texto completo en el pdf
Anuncio

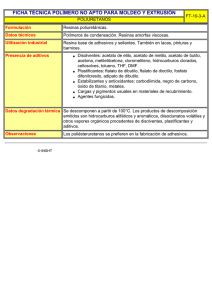
JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores Acerca de la JCI Número actual Suscribir Archivo RSS y alertas Contacto Buscar Herramientas del Publicado en el Volumen 123, Número 4 (1 de abril de 2013) J Clin Invest. 2013; 123 (4) :1605-1614. artículo doi:. 10.1172/JCI65153 Copyright © 2013, Sociedad Americana para la Investigación Clínica Ver PDF Citar este artículo E-mail este artículo Envíe una carta Información sobre la reutilización Abreviaturas convencionales Artículo uso Comparte este artículo Información sobre el autor Encuentra artículos de Jiang, L. en: JCI | PubMed | Google Scholar Encuentra artículos de Mason, GF en: JCI | PubMed | Google Scholar Ir a Superior Artículo de investigación El aumento de la captación de cerebros y la oxidación de acetato en los grandes bebedores Jiang Lihong 1 , Barbara Irene Gulanski Stuart A. Weinzimer Julia Koretski 4 John H. Krystal 3 , Brian Pittman , Susan Harman 4 2 4 2 , Henk M. De Feyter , Elizabeth Guidone , Ismene L. Petrakis y Graeme F. Mason 4 4 1 , , , 1, 4 1 Departamento de Radiología Diagnóstica, 2 Departamento de Medicina Interna, 3 Departamento de Pediatría y 4 Departamento de Psiquiatría de la Universidad de Yale, Escuela de Medicina, New Haven, Connecticut, EE.UU.. Dirección para correspondencia: Lihong Jiang, N-147 TAC-MRRC, Yale University School of Medicine, 300 Cedar Street, PO Box 208043, New Haven, Connecticut 06520, EE.UU.. Teléfono: 203.785.2953 fax: 203.785.6643, e-mail: lihong.jiang @ yale.edu . Publicado por primera vez 08 de marzo 2013 Recibido para su publicación el 01 de junio 2012, y aceptado en forma revisada 17 de enero 2013. Cuando una persona consume etanol, el cuerpo comienza rápidamente para convertirlo en ácido acético, que circula en la sangre y puede servir como una fuente de energía para el Abstracto cerebro y otros órganos. Este estudio utilizó Introducción comprobar si consumo excesivo y crónico se asocia con una mayor captación en el cerebro y Resultados Discusión 13 C espectroscopía de resonancia magnética para la oxidación de ácido acético, proporcionando un beneficio potencial metabólico o efecto adenosinérgico como consecuencia del consumo de alcohol. Siete grandes bebedores, que regularmente consumían al menos 8 vasos por semana y por lo menos 4 bebidas al día por lo Métodos menos una vez por semana, y 7 bebedores ligeros, que consumían menos de dos bebidas por Referencias semana fueron reclutados. Los sujetos se les administró [2 - 13 C] acetato de etilo durante 2 horas y escaneado durante todo ese tiempo con espectroscopia de resonancia magnética del ¿Necesitas ayuda? E-mail de la JCI cerebro para observar natural de de 13 13 abundancia C de N-acetil aspartato (NAA) y la aparición glutamato marcado con C, glutamina , y acetato. Los grandes bebedores tenía aproximadamente 2 veces más acetato relativo del cerebro a la sangre y el glutamato doble etiquetado y glutamina. Los resultados muestran que el transporte y acetato de oxidación son más rápidos en bebedores comparado con que en bebedores de luz. Nuestro hallazgo sugiere que un nuevo enfoque terapéutico para el suministro de acetato durante la desintoxicación de alcohol puede ser beneficioso. Introducción El alcohol es la sustancia más consumida de recreo y una de las drogas que más se abusa en el mundo. El consumo de alcohol se caracteriza por síntomas de intoxicación del sistema nervioso central, la actividad cerebral alterada, mala coordinación motora y cambios de comportamiento. Las alteraciones en las actividades del SNC son debido al efecto del alcohol en la síntesis, liberación, y la señalización de transmisores de neurona, incluyendo glutamato, GABA, y otros transmisores de neurona ( 1 -3 ). El consumo de alcohol también afecta la sensibilidad a la insulina que regula las proteínas, carbohidratos, y grasas (4 ). El abuso crónico de alcohol puede resultar en tolerancia y dependencia física. A pesar de los importantes avances en la comprensión de los efectos del alcohol se han hecho en las últimas décadas, la patogénesis del consumo de alcohol y el abuso no se conoce por completo (5 ). La comprensión de los mecanismos que conducen a la tolerancia y la dependencia pueden dar información valiosa sobre la adicción al alcohol y la vulnerabilidad y, finalmente, dar lugar a una intervención terapéutica eficaz para facilitar la desintoxicación. El alcohol se convierte en acetato en la periferia, en particular en el hígado ( 6 ,7 ), y que se libera a la sangre (8 ). La administración de etanol a los seres humanos eleva acetato de sangre (6 ,9 ,10 ) de <0,1 http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores mM a 1 a 2 mM en cuestión de minutos a partir del comienzo de la administración (11 ,12 ). El consumo de alcohol suficiente para lograr los niveles de alcohol en el aliento de% incluso 50 mg es suficiente para niveles de acetato de plasma para acercarse 1-2 mM, más allá del cual la concentración de acetato de plasma no se eleva (6 ,9 ,10 ,12 ,13 ). Acetato viaja a otros órganos, incluyendo el cerebro, para uso como sustrato de energía (14 ) y en la biosíntesis de ácidos grasos y colesterol (15 ,16 ). La conversión de etanol a acetato comienza con el metabolismo en acetaldehído. En las personas que consumen alcohol a niveles moderados o de vez en cuando, el etanol se metaboliza a acetaldehído en una reacción reversible catalizada por la alcohol deshidrogenasa en el citosol, y posteriormente se oxida a acetaldehído acetato en una reacción irreversible por la aldehído deshidrogenasa en la mitocondria (5 ). En las personas que son consumidores de alcohol crónico y pesada, una segunda vía se vuelve prominente, y que es el etanol microsomal-oxidante sistema, que funciona en el retículo endoplásmico liso de los hepatocitos para convertir etanol a acetaldehído a través del citocromo P450. Una tercera ruta de metabolismo del etanol es a través de la catalasa, que se encuentra en los cuerpos celulares y es capaz de oxidar pequeñas cantidades de etanol en acetaldehído. Acetaldehído deshidrogenasa rápidamente cataliza la conversión de acetaldehído a acetato, y alcohol en personas dependientes muestran acetato elevada de hasta 24 horas después de la última bebida (17 ). Acetato de entra del ácido tricarboxílico (TCA) para la oxidación a través de acetil-CoA sintetasa, y el proceso de oxidación genera adenosina (18 -21 ), que ha sedantes propiedades similares a las de etanol (22 -24 ). Uno puede esperar bebedores de tener largos periodos de tiempo con niveles elevados de adenosina en sus tejidos. En el cerebro, la glucosa es la fuente principal de la oxidación mitocondrial de energía, sin embargo, acetato también se puede utilizar como fuente de energía alternativa, y que se utiliza casi exclusivamente por los astrocitos ( 25 ). Consumo excesivo de alcohol se ha informado a conducir a la hipoglucemia (26 ). Anteriormente, los estudios sobre el metabolismo de acetato de pacientes con diabetes que tenían hipoglucemia recurrente anterior y ratas saludables que se sometieron a 3 días de hipoglucemia recurrente antecedente mostró transporte aumentaron acetato cerebro y la oxidación (27 ,28 ). Aunque el metabolismo acetato se ha caracterizado en situaciones distintas de beber, vínculos entre acetato de metabolismo y el consumo de alcohol no son claras. Datos recientes muestran que el alcohol disminuye la utilización de la glucosa cerebral (29 -31 ) y la absorción aumenta acetato (30 ). Estos hallazgos conducen a nuestra hipótesis: en la ingesta crónica de alcohol, el cerebro puede utilizar más acetato como fuente de energía. La elevación a base de etanol de acetato de sangre persiste durante hasta 24 horas (32 ), así bebedores pesados están expuestos a altos niveles de acetato durante largos períodos de tiempo, y bebedores dependientes probable es que siempre tienen acetato elevada. Si el consumo de acetato de cerebro es mayor, entonces los efectos de adenosina se puede esperar a ser mejorada. Frente a una elevación persistente de la adenosina, el cerebro se adapta probable, y durante la retirada, la pérdida de la adenosina pueden contribuir a los síntomas. Nuestro objetivo en este estudio fue comprobar si consumo excesivo y crónico puede afectar la absorción de acetato cerebro y el metabolismo. Para este fin, se utilizó [2 - 13 C] acetato de etilo como un sustrato metabólico en combinación con en la espectroscopia in vivo por resonancia magnética (ERM) para comparar el consumo cerebro acetato en bebedores y bebedores de luz. Resultados Impacto de consumo excesivo de alcohol en acetato de plasma. En un día de consumo típico, los bebedores consume 8 ± 1 bebidas ( n = 7), y los bebedores de luz consumido 1 o 0 (es decir, algunos bebió muy rara vez). Para los bebedores en exceso, la última copa fue de 3 ± 1 días antes ( n = 5, 2 no responder a esa pregunta), mientras que para los bebedores moderados, uno tenía una bebida 7 días antes, y los demás no consume alcohol durante al menos 20 días y en algunos casos más de 2 meses. Los grandes bebedores probado sobrio, con alcohol en el aliento de 0 en los días de prueba, después de haber bebido no menos de 2 días antes del estudio, y en un caso una semana antes del estudio. El intervalo más largo sin beber promedio para los bebedores pesados fue de 5 ± 1 días. Los grandes bebedores tenían niveles significativamente mayores de acetato de plasma antes de la infusión (0,20 ± 0,13 mm, rango: 0.09-0.48 mM) en comparación con los de los bebedores moderados (0,09 ± 0,01 mm, rango: 0.08-0.11 mM) ( P = 0,05) (Figura 1 A). Las diferencias en acetato antes de la infusión entre los grupos puede reflejar más lentas tasas de eliminación de acetato en los grandes bebedores. La glucosa en plasma no mostró diferencias significativas después de una noche de ayuno, con niveles de antes de la infusión de 5,0 ± 0,5 mm para los grandes bebedores y 4,8 ± 0,4 mM para los bebedores ligeros ( P = 0,6). Durante la infusión de acetato, los sujetos no mostraron cambios significativos en plasma de glucosa (efecto de grupo en general, P = 0,61), con variaciones de menos de 2% (Figura 1 B). Lactato en el plasma y β-hidroxibutirato entrar en el cerebro mediante el transportador de ácido monocarboxílico mismo como acetato, y así las diferencias potencialmente podría afectar la entrada de acetato para el cerebro mediante la inhibición competitiva. β-hidroxibutirato difiere insignificantemente entre los 2 grupos al inicio del estudio (0,17 ± 0,01 mm y 0,21 ± 0,11 mM para los bebedores ligeros y pesados, respectivamente, P = 0,13) y después de 120 minutos (0,09 ± 0,03 mM y 0,61 ± 0,42 mM, respectivamente, P = 0,27). El aumento de la βhidroxibutirato durante la infusión fue significativa en los bebedores pesados ( P = 0,05), si no se aplica la corrección de Bonferroni para dar cuenta de las múltiples medidas en plasma, pero no en los bebedores de luz ( P = 0,28). Sin embargo, el lactato en plasma no mostró diferencias significativas entre los grupos antes y durante la infusión de acetato, con niveles de lactato antes de la infusión de 0,95 ± 0,13 mm y http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores 0,83 ± 0,10 mm para los bebedores ligeros y pesados, respectivamente ( P = 0,46), aumentando ligeramente a 1,03 ± 0,12 mM y 0,84 ± 0,12 mM, respectivamente, al final de la infusión ( P = 0,30). El aumento de lactato fue también insignificante para cada grupo ( P = 0,93 y P = 0,56 para los bebedores pesados y ligeros, respectivamente) o para todos los datos juntos ( P = 0,63). La infusión de [2 - 13 C] acetato aumentó el acetato de plasma desde el valor inicial (~ 0,1 mM) a aproximadamente 1 a 2 mM en 5 minutos (Figura 1 C) entre ambos grupos. Las concentraciones plasmáticas en estado estacionario de acetato entre los grandes bebedores y los bebedores ligeros fueron comparables (1,2 ± 0,3 mM para los grandes bebedores y 1,3 ± 0,2 mM para los bebedores ligeros, P = 0,78; Figura 1 C). Plasma 13 C-acetato de enriquecimientos siguió un patrón similar a concentraciones de acetato de plasma, pasando de 0% a 70% ~ 80% en 5 minutos. No se observaron diferencias significativas entre los grupos en estado de equilibrio (72% ± 5% para los grandes bebedores y 77% ± 5% para los bebedores ligeros, P = 0,5; Figura 1 D). Figura 1 Plasma acetato y las concentraciones de glucosa en [2 - 13 C] acetato de infusión. ( A ), las concentraciones plasmáticas de acetato antes de la infusión. Los símbolos representan las concentraciones individuales; barras horizontales indican la media. ( B ) con un promedio concentraciones de glucosa en plasma durante la infusión de acetato. ( C ) con un promedio concentraciones plasmáticas de acetato durante [2 infusión. ( D ) con un promedio plasmáticas de acetato de 13 13 C] acetato de enriquecimientos C durante la infusión de acetato. Diamantes grises representan los bebedores pesados (HD), y los diamantes blancos representan los bebedores ligeros (LD). Los valores con barras de error representan la media ± SEM. Impacto de consumo excesivo de alcohol en representativa 13 13 etiquetado C en el cerebro. Figura 2 muestra C-MRS espectros durante la parte de estado estable de la bebedores y bebedores ligeros, normalizado a los sujetos natural propio aspartato (NAA) resonancias C3 y C6. Los 1 13 13 C-acetato de infusión en una C abundancia de N-acetil H medidas de MRS no mostró diferencias significativas entre los bebedores y bebedores de luz con respecto a cualquiera de los metabolitos, respectivamente, incluyendo la proporción de NAA a agua ( P = 0,10), que de glutamato a agua ( P = 0,49), que de glutamina al agua ( P = 0,62), y que de GABA al agua ( P = 0,4). El más abundante 13 glutamina posiciones C4. Los grandes bebedores tuvieron mayor etiquetado C se produjo en el glutamato y 13 incorporación etiquetado C a través del curso de tiempo en glutamato C4 ( P = 0,01) y glutamina C4 ( P = 0,021) respecto a la de bebedores de luz, incluso en el punto final ( P = 0,0013 y 0,012, respectivamente) ( Figura 3 , A y B). Glutamato y glutamina C3 también se etiquetan, que se produce como 13 C es procesada a través de varias vueltas del ciclo TCA. Figura 2 El estado de equilibrio 13 C espectros de un bebedor empedernido (espectro superior) y un bebedor de luz (menor espectro). El bebedor pesado notablemente mayor tenía 13 C etiquetado que el bebedor de luz. Los parámetros de adquisición fueron los siguientes: 765 puntos complejos; 5.000 Hz de ancho de banda, tiempo de repetición, 2,5 segundos. Un total de 640 adquisiciones fueron agrupados para cada espectro, cada uno representando los últimos 27 minutos observados mientras que el glutamato y la glutamina etiquetado C4 estaban en un estado estacionario. Los espectros se llena de cero a 16.384 puntos complejos, con ventana -2 Hz Lorentzian y 6 Hz gaussiana ampliación, y transformado de Fourier. Figura 3 Cursos promediados de tiempo del porcentaje de 13 C enriquecimiento de GLU4 y Gln4 para ( A ) los grandes bebedores y ( B ) los bebedores ligeros. bebedores pesados mostraron mayor 13 C etiquetado en ambos GLU4 y Gln4, en consonancia con una mayor utilización de acetato. Gln4 está representada por diamantes negros y GLU4 está representada por cuadrados negros en bebedores. Gln4 está representada por diamantes blancos y GLU4 está representada por cuadrados blancos en bebedores de luz. Los valores con barras de error representan la media ± SEM grupo. Los cursos de tiempo de 13 enriquecimientos C de glutamato y glutamina C4 y los de estado estable 13 C enriquecimientos de glutamato y glutamina C3 se analizaron con un modelo matemático del metabolismo cerebral en acetato de CWave software ( 33 ) para calcular los flujos metabólicos (Tabla 1 y la Figura 4 ). http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores Modelado metabólico de los cursos de tiempo individuales mostró que los grandes bebedores tenían un mayor c erebral m etabolic r comió ac etate (CMR ac ) que los bebedores moderados, con valores de 0,069 ± 0,008 mmol / min / kg y 0,048 ± 0,006 mmol / min / kg, respectivamente ( P = 0,02) (Figura 5 A). 13 resonancias C de GABA, acetato, y otros metabolitos eran pequeñas debido a sus bajas concentraciones globales en el cerebro. 13 C-GABA era indetectable en bebedores de luz pero se detectó a los un nivel de 0,09 ± 0,03 mmol / kg en bebedores, lo que indica que 13 C-GABA etiquetado en bebedores es también mayor que en los bebedores de luz (Figura 2 ). En los bebedores ligeros, 13 C-GABA es necesariamente mucho menor que en los grandes bebedores. Una idea de la límite se puede sacar de la desviación estándar del ruido espectral, ± 0,029 mmol / kg. Para detectar la presencia de la etiqueta GABA en todo el grupo, la relación señal a ruido de al menos 1,5 sería necesario, que tiene un límite de detección de 0,044 mmol / kg. La fracción de glutamato que se encuentra en astroglía (FracGluA) se fijó a 0,10, calculado a partir de datos en la ref. 34 para un voxel similar, pero también fue probado para un valor mucho más bajo (0,01), que se encontró que tienen un impacto insignificante en los resultados. La tasa de glutamato-glutamina ciclismo ( V ciclo ) se calculó con relación al ciclo de TCA neuronal ( V ACNT ), utilizando los enriquecimientos en estado estacionario de glutamato y glutamina C4, como se indica en la Tabla 1 . El valor de V fue de 0,18 ± ciclo 0,03 mmol / kg / min y 0,28 ± 0,02 mmol / kg / min en bebedores ligeros y pesados, respectivamente ( P = 0,008). Otros dos parámetros, la tasa de astroglial de la piruvato deshidrogenasa ( V síntesis de glutamina ( V PdhA gln PdhA ) y la tasa de ), se define a partir de las tasas de otros, tal como se define en la Tabla 1 . V se estimó en 0,08 ± 0,02 mmol / kg / min y 0,04 ± 0,02 mmol / kg / min en bebedores ligeros y pesados ( P = 0,13), y el valor estimado de V gln fue 0,22 ± 0,03 mmol / kg / min y 0,32 ± 0,02 mmol / kg / min en ligera y pesada bebedores ( P = 0,008). Es importante señalar que el lactato de los intercambios de sangre con lactato que se genera en el cerebro, y su efecto se combina con la de la glucosa en la tasa de flujo a través de la piruvato deshidrogenasa. Figura 4 Las vías metabólicas que muestran la captación cerebral de [2 de etilo y la transferencia de la 13 13 C] acetato . etiquetado C a glutamina y glutamato en las neuronas y astroglía Astroglia consumir acetato, mientras que las neuronas y astroglía tanto consumo de glucosa (Glc). El acetato de marcado en el grupo metilo, cuyo carbono está designada 2 (Ac marcado con acetil CoA (Ac 2 2 ), entra en la astroglia y el ciclo del TCA para formar C2 CoA). En el primer turno del ciclo de Krebs, se etiqueta el C4 de astroglial α-cetoglutarato (α-KG ), que intercambia para formar glutamato C4 (Glu A4 convertir el glutamato en glutamina, formando glutamina C4 (Gln 4 A4 ). Astroglia ), que se transfiere a las neuronas, convertidos, y se mezcla con la gran piscina neuronal de glutamato (Glu N4 ). Parte del glutamato se libera como parte de glutamato-glutamina en bicicleta, y algunas bolsas para formar neuronal α-cetoglutarato (α-KG N4 ). En ambos compartimentos, el carbono continúa a través del ciclo y oxaloacetato etiquetas (OAA) y etiquetas de glutamato y glutamina en C3 (datos no presentados), pero no volver a la C4 de glutamato y glutamina. Mientras tanto, la gran mayoría de la glucosa permanece sin marcar y diluye el pool de acetil CoA y los productos intermedios del ciclo de Krebs en las neuronas y astroglia. AcCoA, la acetil-CoA; Lac, lactato; Pyr, piruvato. Figura 5 Tasas metabólicas individuales calculados sobre la base de 13 cursos de tiempo C de GLU4 y Gln4 y el estado de equilibrio de Glu3 y Gln3. El valor de V xA , que es la tasa de intercambio entre astroglial α-cetoglutarato y glutamato, no se ha determinado. La cinética se probó por lo tanto en un rango de valores de V posible es igual a la tasa del ciclo TCA V TCAA xA . Su valor mínimo , y, para valores superiores a 10 × V TCAA , hay una diferencia insignificante en la cinética del impacto en comparación con el infinito ( 70 ), por lo que V xA V = 10 × V xA TCAA = 10 × V era seleccionado como el máximo de la gama. ( A ) CMR TCAA . CMR AC ( B ) astroglial ciclo TCA ( V C ) CMR ac ac se calculó suponiendo fue significativamente mayor en el grupo de consumo alto ( P = 0,02). TCAA ) las tasas no difirieron ( P = 0,58) cuando V se calculó suponiendo V xA =V TCAA grandes bebedores y los bebedores ligeros ( P = 0,01). ( D ) V los grupos y bebedor bebedor de luz cuando V xA = 10 × V xA =V TCAA TCAA no mostraron diferencias entre individuales; barras horizontales indican la media. Tabla 1 Las ecuaciones utilizadas en CWave software para calcular las tasas http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] .( ( P = 0,99). Los valores con barras de error representan la media ± SEM grupo. Los símbolos representan las concentraciones metabólicas TCAA , mostrando diferencias significativas entre los JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores El accesorio metabólicos requerían que la tasa de cambio entre astrocytic α-cetoglutarato y glutamato ( V xA ) tienen un valor asumido (Tabla 1 ). Nos equipados los datos para la Figura 5 , A y B, con un valor del tipo de cambio que era 10-veces mayor que la velocidad de ciclo astrocytic TCA ( V sensibilidad del modelo para el valor de V sensibilidad de V xA , guarnición se repitió con V xA mostró que para el valor mínimo de V xA xA =V , que es igual a V TCAA TCAA TCAA ). Para probar la . La prueba de , CMR ac fue 0,103 ± 0,013 mmol / kg / min y 0,061 ± 0,008 mmol / kg / min para bebedores y bebedores ligeros, respectivamente, mientras que para V xA = 10 × V TCAA , CMR ac fue 0,069 ± 0,008 mmol / kg / min para los bebedores pesados y 0,048 ± 0,006 mmol / kg / min para los bebedores ligeros. En ningún caso encontró el valor de V TCAA , que era 0.08-0.13 mmol / kg / min (Figura 5 , B y D), de manera significativa entre los bebedores y bebedores de luz, aunque en ambos casos bebedores mostraron significativamente mayor CMR ac que la de los bebedores ligeros ( P = 0,02) (Figura 5 , A y C). Impacto del consumo excesivo de alcohol en concentraciones de acetato cerebrales. Cerebro acetato de concentración durante la porción de estado estacionario de la infusión de [2 - 13 13 C- C] acetato fueron 80% más altos en los grandes bebedores (0,071 ± 0,014 mmol / kg) que en la luz bebedores (0,039 ± 0,007 mmol / kg) ( P = 0,06; Figura 6 A). Las proporciones de cerebro / sangre 13 C-acetato de concentraciones en los grandes bebedores fueron 84% mayores (0,049 ± 0,007) que los de los bebedores moderados (0,026 ± 0,006) ( P = 0,02; Figura 6 B). Debido a que los niveles cerebrales de acetato y proporciones cerebro / sangre fueron más altos, mientras que al mismo tiempo el cerebro estaba consumiendo más de acetato, bebedores debe haber tenido elevada hematoencefálica transporte de acetato en comparación con la de bebedores de luz. La figura 6 Las concentraciones cerebrales acetato durante el estado estacionario [2 C] acetato de infusión, que muestra bebedores han aumentado [2 ) en estado estacionario cerebro [2 - 13 13 13 . C] acetato en el cerebro ( A ] C concentraciones de acetato durante la 2 [ - 13 C] acetato de infusión. ( B ) Relación entre las concentraciones de acetato de cerebro / sangre en estado estacionario [2 - 13 C] acetato de infusión. Los valores con barras de error representan el grupo promedio ± SEM. Los símbolos representan las concentraciones individuales; barras horizontales indican la media. Relación entre la absorción de acetato a la historia reciente de beber. estado estacionario glutamato C4 13 enriquecimientos C se correlacionaron significativamente con el número de bebidas consumidas en los últimos 30 días ( P = 0,0005, r = 0,8). Estado estacionario glutamina C4 consumo en el último mes ( P = 0,03, r 2 13 2 = 0.8, Figura 7 A) y pasados días 60 ( P = 0,0006, r = 0.6, Figura 7 B), aunque la última comparación no sobrevivió a una corrección de Bonferroni. La relación sugiere que el aumento en el etiquetado metabolito es una adaptación del cerebro para obtener más energía a partir de acetato durante consumo excesivo y crónico. Figura 7 Las correlaciones entre el glutamato C4 y C4 enriquecimientos glutamina y la historia reciente potable tanto para los grandes bebedores y los bebedores ligeros. ( A ) Correlación con las bebidas en los últimos 30 días para GLU4 ( P = 0,0005) y Gln4 ( P = 0,1). ( B ) Correlación con días de consumo de alcohol en el último mes para GLU4 ( P = 0,098) y Gln4 ( P = 0,03). Diamantes grises representan Gln4 GLU4 13 C enriquecimiento. Discusión http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] 2 enriquecimientos C se correlaciona con el número de días de 13 enriquecimientos C, y los cuadrados blancos representan JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores En este estudio, hemos demostrado que el consumo excesivo y crónico aumenta la utilización de acetato de cerebro y sangre-cerebro transporte de acetato. En la presencia de niveles similares de acetato de plasma, los bebedores fueron capaces de utilizar más acetato de energía como combustible alternativo para apoyar el metabolismo cerebral. Acetato podría promover consumo excesivo continuado con una recompensa en forma de beneficio calórico o adaptación adenosinérgico. Glutamato-glutamina ciclismo y GABA síntesis. Un hallazgo de importancia clínica potencial fue el aumento de la relación de glutamato-glutamina ciclismo ( V neuronal ( V ACNT cambio puede ocurrir si V de elevada V ciclo ciclo ) con respecto a la tasa del ciclo TCA ) en bebedores, aunque en este grupo no dependiente, el hallazgo fue inesperada. El ciclo fue mayor o si V ACNT fue menor o alguna combinación de ambos. Para el caso , una posibilidad es una enfermedad hepática avanzada, en la que la encefalopatía hepática podría aumentar la conversión de glutamato en glutamina ( 35 ), pero estos sujetos tenían pruebas de función hepática normales. Otra explicación para la elevada V ciclo es que después de al menos 2 días sin alcohol, hubo un aumento de tono glutamatérgico que estimuló una mayor absorción astroglial y conversión a glutamina. Sin embargo, otra posibilidad es que el V un más lento V ACNT ciclo /V ACNT relación fue mayor debido a . La mayor parte del consumo de energía del cerebro es neuronal ( 36 ) y suministrado por la glucosa. Captación cerebral de glucosa ha sido informado de que 12% menor en la corteza occipital en recientemente abstinentes dependientes del alcohol sujetos (37 ) o diferente no (38 ), por lo que uno espera que la mayoría menos una reducción del 12% en V valores estimados de V ciclo y CMR ac ACNT y por lo tanto poco impacto sobre los , en comparación con las diferencias entre los grupos. Es de destacar la teoría propuesto recientemente que la relación de glutamina / concentraciones de glutamato podría reflejar glutamato-glutamina ciclismo ( 39 ), pero en este caso, V 12 C+ 13 ciclo diferían sin diferencias en la general ( C) los niveles de glutamato y glutamina. La comprobación de que está potencialmente relacionada con el aumento de la tasa V ciclo fue que 13 C GABA se detectó en los grandes bebedores, pero no en los bebedores ligeros. En este estudio, si los bebedores de luz consumida medio como acetato de tanto como los bebedores, a continuación, los bebedores de luz se espera que tenga una concentración de 13 C-GABA igual a 0,045 mmol / kg, que está justo en el límite más bajo de razonable detección dado el ruido espectral. Por lo tanto, aunque es posible que 13 C-GABA se incrementó con mayores glutamato-glutamina en bicicleta, no se puede diferenciar entre esa posibilidad y simples límites de detectabilidad. La mayor disponibilidad de acetato para el metabolismo cerebral. crónicas bebedores pasar una gran fracción de tiempo con acetato arterial elevada, y el metabolismo cerebral acetato de mayor potencialmente puede ser inducida por la generación habitual de ácido acético en la sangre a partir de alcohol, como se ha observado previamente en los seres humanos y otros animales ( 40 ,41 ) Por otra parte, el consumo crónico elevado sin comer puede provocar episodios de hipoglucemia (42 ), que se ha demostrado que aumentar hematoencefálica transporte ácido monocarboxílico y por lo tanto aumentar la disponibilidad de cerebro de acetato de (28 ). En el presente caso, los niveles de referencia de acetato de plasma en los grandes bebedores eran más del doble de las de los bebedores moderados, a pesar del estudio requerido de 48 horas de abstinencia de alcohol. Los niveles de acetato de cerebro en bebedores ligeros y pesados, respectivamente, fueron 0,039 mmol / kg y 0,071 mmol / kg (Figura 6 ). Dado un espacio de distribución de acetato de 0,32 ml / g (43 ), las respectivas concentraciones de acetato en solución fueron 0.12-0.22 mM, lo suficientemente cerca de la K M de 0,17 mM para la utilización ( 43 ). Debe haber habido un flujo unidireccional casi exclusivo de acetato de sangre al cerebro, y el incremento del transporte podría duplicar la velocidad de oxidación. Por tanto, es posible que la elevación de acetato de cerebro a través de transporte es suficiente para conducir su oxidación. Posibles impactos en el transporte fueron los niveles ligeramente más altos de β-hidroxibutirato en los grandes bebedores, a pesar de que podría competir con acetato de transporte, por lo que cualquier incremento del transporte en los grandes bebedores es lo suficientemente grande como para superar cualquier diferencia en cuerpos cetónicos pudieran existir. Los niveles de 10% -20% más bajos de lactato en los bebedores se espera que aumente ligeramente acetato de transporte a través de una menor competencia para el transporte, pero no es suficiente para explicar el metabolismo mucho más grande visto aquí. Tal impacto de transporte, facilitando una cierta conversión de glucosa a consumo de acetato, sería coherente con los datos recientes que muestran que el cerebro de la rata disminuye la captación y la fosforilación de glucosa cuando los niveles de acetato son más altos en la sangre (31 ). Humanos resultados también muestran disminución de la captación de glucosa y un mayor consumo de etilo en la presencia de alcohol (30 ). Una medida importante pero difícil de hacer en estas poblaciones sería hematoencefálica transporte de acetato. Impacto potencial energético de acetato de beber en exceso. Aunque en este estudio se reclutaron sólo pacientes sanos que no tenían problemas de salud significativos relacionados con consumo excesivo de alcohol, y las infusiones de etilo se realiza bajo euglucemia, el metabolismo del acetato en los grandes bebedores mostró un perfil similar al lo que se ha observado en pacientes con diabetes tipo 1 que han tenido hipoglucemia antecedente recurrente ( 28 ). Beber en exceso promueve una amplia gama de problemas de salud relacionados con la hipoglucemia, tales como el deterioro de la gluconeogénesis, la desnutrición y las condiciones de confusión (como la diabetes44 ). Los atracones de bebida en sí disminuye los niveles de NADH, lo que disminuye los niveles de piruvato y la reducción de la gluconeogénesis (45 ). Para agravar las condiciones de hipoglucemia, hay pruebas de que algunos alcohólicos han deprimido las respuestas contrarreguladores a hipoglucemia (46 ). Alcohol causó una pequeña reducción en la concentración de glucosa en plasma, 5,1 a 4,7 mM, cuando se infunde a alcanzar un nivel de alcohol en http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores sangre de% mg 60 (47 ), lo que demuestra que incluso sin causar toda regla episodios de hipoglucemia, el alcohol tiene la capacidad de reducir los niveles de glucosa, que es el suministro de energía del cerebro primario. De hecho, los mayores factores desencadenantes de la hipoglucemia inducida por alcohol parecen ser beber en exceso y falta de comer. Aunque son pocos los grandes bebedores experimentan hipoglucemia en cualquier momento dado (48 ), nuestros resultados en pacientes con diabetes tipo 1 muestran que la hipoglucemia intermitente es suficiente para duplicar el transporte y el consumo de acetato (28 ). Por lo tanto, la adaptación del transporte de ácidos monocarboxílicos y el metabolismo se ve en los grandes bebedores puede reflejar adaptaciones similares a las observadas en la diabetes tipo 1 con hipoglucemia antecedente recurrente. Debido a acetato se consume exclusivamente en astroglía ( 49 ), tal un suplemento de energía se espera que tenga su impacto principal en la glia. Cuando la glucosa es escaso, el consumo elevado de acetato potencialmente puede soportar una gran parte de las necesidades energéticas astrocíticos y dejar más glucosa disponible para abastecer las neuronas (27 ). En la población de este estudio, ninguna energía adicional que se necesitaba para la función cerebral en bebedores, como se evidencia por el hecho de que V TCAA fue constante entre los bebedores y bebedores de luz y que el aumento de la CMR acompañado por una disminución de V PdhA ac en bebedores fue , como se predice por las observaciones de Pawlosky y colaboradores ( 31 ). Sin embargo, en una población que abusa o depende de que está desnutrido, el combustible adicional que proporcionara una recompensa en forma de beneficio energético. Dada la capacidad del etanol para causar caídas agudas de la glucosa en sangre (26 ,45 ,47 ), el acetato formado a partir de etanol tiene el potencial de proporcionar una recompensa compensatoria en forma de calorías, alentando así la ingestión continua de alcohol. Potencial de impacto adenosinérgico de consumo de acetato. intracelular de adenosina es producido por desfosforilación de AMP ( 50 ) y otros productos químicos, incluyendo cAMP, ADP, ATP y (51 ), que implican la transducción de señales y la detección de metabolismo. La oxidación de acetato genera adenosina (52 ), y el etanol se eleva extracelular de adenosina (42 ), que es sedante, con propiedades similares a las de la intoxicación por alcohol (45 ,46 ). La elevación a base de etanol de acetato de sangre persiste durante hasta 24 horas (53 ), así bebedores pesados están expuestos a altos niveles de acetato durante períodos prolongados de tiempo. Que no era factible con MRS para medir la adenosina extracelular, pero la oxidación de acetato de elevada sugiere que los efectos adenosinérgico de etanol derivado de acetato son susceptibles de ser mejorado en bebedores. Elevación persistente de intracerebral adenosina tiene el potencial para inducir adaptaciones adenosinérgico que contribuyen a seguir bebiendo pesada. Como bebedores acostumbrado a elevaciones crónicas de la adenosina, el cese potable puede llevar a la molestia con la disminución de la adenosina, y la restauración de la adenosina por consumo excesivo de alcohol puede ser gratificante (20 ,54 ). Dificultades y limitaciones. Aunque los pacientes recibieron instrucciones de no beber alcohol durante 48 horas antes del estudio, sólo podían ser probado con una alcoholemia de la mañana de la medición, el cual mostró un valor de 0 en todos los casos. Si alguien bebían menos de 48 horas antes del estudio, podrían haber despejado el alcohol, pero todavía tienen acetato elevada. Eso podría explicar los niveles elevados de acetato de sangre antes de la infusión, pero durante la infusión de los niveles de acetato no fue diferente entre los grupos. Una limitación potencial es la aparente complejidad del modelo metabólico, dada la pequeña población de sujetos. Sin embargo, aunque este modelo contiene muchos elementos, está sujeta a restricciones de equilibrio de masas que reducen enormemente el número de parámetros libres y sigue el escenario generalmente aceptada de la oxidación de acetato de astroglial y glutamato-glutamina bicicleta neurotransmisor y se ha aplicado en animales y seres humanos en una variedad de condiciones metabólicas ( 25 ,55 -58 ). Si 13 C-glucosa infusiones se realizaron para aumentar la sensibilidad de las mediciones con el valor de la velocidad del ciclo TCA neuronal, que disminuiría el número de hipótesis que se hizo. Conclusiones. En resumen, se han identificado los cambios metabólicos cerebrales que están asociados con beber en exceso. Los cambios sugieren que beber en exceso crónico puede inducir la regulación positiva de transporte de sangre-cerebro monocarboxilato y aumentar la capacidad del cerebro para oxidar acetato. Los resultados de aumento en el consumo de etanol-acetato derivada tienen el potencial de aumentar los niveles extracelulares de adenosina, lo que añade un efecto adenosinérgico para el beneficio potencial calórico que ofrece con acetato de consumo excesivo continuo. Nuestros hallazgos en bebedores proporcionar información potencialmente útil en el tratamiento de la dependencia del alcohol sujetos por lo que sugiere la provisión de acetato y / o apoyo adenosinérgico durante la desintoxicación para aliviar los síntomas de abstinencia. Métodos Sujetos . Los sujetos sanos, edad 21-46, sin dependencia del alcohol fueron reclutados de la comunidad a través de publicidad local. Los grandes bebedores y los bebedores ligeros fueron: edad 29,7 ± 9,6 y 28,6 ± 7,7 años, respectivamente ( P = 0,81). Las mujeres embarazadas (evaluados mediante pruebas de embarazo en orina) y las personas con antecedentes de trastornos neurológicos o contraindicaciones para la RM fueron excluidos. Los individuos también fueron excluidos sobre la base de una entrevista de diagnóstico estructurada (SCID-II) que reveló una historia de abuso de sustancias psicoactivas que no sea el tabaquismo o consumo excesivo de alcohol en los últimos 6 meses ( 59 ). Otros criterios de exclusión incluyeron una historia de trastorno de estrés postraumático, trastorno bipolar o la esquizofrenia en los http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores familiares de primer grado o uno mismo-y falta de voluntad para mantenerse libre de alcohol durante las 48 horas antes del día de la prueba. Los hombres que bebían más de 14 bebidas por semana o por las mujeres que bebían más de 8 tragos por semana fueron reclutados como bebedores en exceso, y las personas que bebían menos de 2 tragos por semana fueron reclutados como bebedores ligeros. El consumo de alcohol en el mes anterior a la fecha de la prueba se determinó a través de la línea de tiempo de seguimiento de nuevo método (60 ). Se les pidió que se abstengan de alcohol durante 48 horas y rápidas durante 10 horas antes de la infusión de acetato con el fin de minimizar el efecto agudo de etanol y glucosa en el metabolismo del acetato. Se incluyeron ocho grandes bebedores (2 mujeres, 6 hombres) y 8 bebedores ligeros (2 mujeres, 6 hombres). Para el análisis de la cinética metabólica, 1 bebedor de luz fue excluido debido al ejercicio extremo y las condiciones de la dieta, que tienen el potencial de alterar el transporte y el metabolismo de ácido monocarboxílico (61 ,62 ), y 1 bebedor fue excluido debido al elevado 13 C enriquecimiento de β-hidroxibutirato en la sangre. Para los fines de detección y aclimatación al medio ambiente escáner antes de someterse a la infusión de acetato, que se ofreció a realizar un 1 H MRS exploración de temas antes del día de la infusión. Cinco de los siete grandes bebedores y seis de cada siete bebedores ligeros incluidos en el estudio se sometieron a 1 H MRS. 1 un H MRS. H MRS estudios se realizaron con un imán 4T (Tecnología Oxford magnético) y un espectrómetro Bruker (Bruker Instruments), tal como se describe anteriormente ( 63 ). La cabeza del sujeto fue asegurado cómodamente a una plataforma con la región de interés adosados a un niño de 8 cm bobina de superficie distribuida capacitancia sintonizado a 170 MHz. A un ponderado multicorte MRI se obtuvo para la localización anatómica. De la imagen, un 3 × 1,5 × 3 cm de la región de interés se 13 seleccionó, centrada en la línea media de la corteza occipital, dentro del volumen de la más grande voxel C MRS. Shimming automatizado primero y segundo orden se aplicaba en el volumen de interés ( 64 ). GABA fue adquirida durante 20 minutos usando una secuencia de J de edición de pulso (65 ), ya que esto proporciona una prueba muy sensible y capacitación para el sujeto que mantenga suficiente todavía para MRS. Los parámetros de adquisición espectrales fueron las siguientes: tiempo de repetición, 2,5 segundos, el tiempo de eco, 68 milisegundos; anchura de barrido, 15.000 Hz, y el tiempo de adquisición, 510 milisegundos. Un no suprimida, espectro localizada de agua fue adquirido para su uso como un estándar de concentración interna. El procedimiento de adquisición, con la instalación, duró aproximadamente 45 minutos. Además de GABA, glutamato, glutamina, NAA, y otros metabolitos se detectaron y equipado en el dominio espectral con una base de medición conjunto de metabolitos. Las desintegraciones por inducción libre se llenaron cero a 32 K, procesados con -2 Hz Lorentzian / 6 Hz gaussiana ampliación, y transformada de Fourier. Los resultados de estas mediciones se utilizaron para evaluar si NAA, glutamato, glutamina y diferían entre estos bebedores y bebedores ligeros. [2 - 13 C] acetato de infusión. En el día del estudio, alcohol en el aliento fue verificada como 0 utilizando un Alcotest 6810 alcoholímetro (Draeger Inc.). Un catéter intravenoso se situó en la vena antecubital de cada brazo, uno para infundir 13 C-acetato y el otro para extraer muestras de sangre. Muestras de sangre venosa se obtuvieron cada 10 minutos, comenzando 20 minutos antes de la infusión, y continuó durante toda la infusión. La infusión de 350 mm [2 - 13 C] acetato de etilo (99% enriquecido; Isotec), fue preparado por el Servicio de Investigación de Drogas de Yale-New Haven Hospital. La infusión de acetato se llevó a cabo a una velocidad de 6 mg / kg / min durante los primeros 5 minutos, seguido de una infusión continua de 3 mg / kg / min durante aproximadamente 115 minutos ( 28 ). 13 C MRS. MRS datos se adquirieron en un 4 Tesla de todo el cuerpo del imán conectado a un espectrómetro de imágenes (Bruker Instruments), tal como se describe anteriormente ( 66 ). Los sujetos ponen en posición supina en el imán, con la cabeza apoyada en la parte superior de una sonda de resonancia magnética radiofrecuencia consiste en un diámetro de 8,5 cm circular 13 C-coil y 2 1 H bobinas de cuadratura para la adquisición y desacoplamiento ( 67 ). Después de sintonizar y adquisición de imágenes scout, un voxel de 5 x 4 x 4,5 cm se realizó utilizando FASTERMAP ( 68 ). 13 3 fue seleccionado en la región occipital-parietal. Acuñamiento C-MR espectros fueron adquiridos usando un adiabático 13 C-[ 1 H] secuencia de polarización de transferencia optimizado para la detección de glutamato y glutamina C4, con localización ISIS, la adquisición de 765 puntos complejos con un 5.000 Hz de ancho de banda y un tiempo de repetición de 2,5 segundos. Free-inducción se desintegra se promediaron en grupos de 128 a producir 5,3 minutos de bloques. Después de bloque de línea de base 1, 13 C-MRS espectros fueron adquiridos continuamente a lo largo de la infusión con los bloques de 5,3-minuto durante 2 horas. Los datos espectrales se prepararon para análisis con -2 Hz / 6 Hz Lorentzian-a-Gaussian conversión y 16veces relleno cero, seguido por la transformación de Fourier. Un en-casa LC modelo de tipo enfoque se utilizó para ajustar áreas de pico de 13 C4 marcado con C glutamato y C3, C4 y C3 glutamina, GABA C2 y C3, y NAA C3 y C6. Un análisis de Monte-Carlo se utiliza para estimar las desviaciones estándar de cada metabolito de etiquetado desde el programa de ajuste ( 69 ). Debido NAA C3 y C6 no se enriquecieron mensurable por la infusión de acetato de 2-horas, la natural 13 C abundancia de señales de NAA NAA C3 y C6 se promediaron durante la duración del estudio y se utiliza como un estándar interno para estimar la C- concentraciones marcados de glutamato y glutamina. Para el estado de equilibrio del cerebro 13 13 C- acetato de concentraciones, se nos informa que el sumatorio de los últimos 5 FID. Las concentraciones plasmáticas de acetato y con supresión de 1 H-observó / 13 13 enriquecimientos C se midieron en muestras usando agua C-editado espectroscopía de RMN en 11,7 T Bruker AVANCE espectrómetro de alta resolución RMN mediante la mezcla de plasma de 50 l con 50 l de ácido fórmico 2,5 mM en 100 mM de tampón fosfato (pH 7,4) y 40% de D http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] 2 O. JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores Análisis de modelos metabólico. tasas metabólicas se determinaron ajustando un modelo 2compartimiento de astroglia y el metabolismo neuronal, usando los cursos de tiempo de 13 C enriquecimiento de glutamato y glutamina C4 y los enriquecimientos en estado estacionario de glutamato y glutamina C3. Los cursos a tiempo de las concentraciones plasmáticas de acetato de 13 enriquecimientos C se utilizan como insumos para el análisis de modelos. Debido a que la cinética de transporte de sangre del cerebro para el acetato en los seres humanos no se ha medido, el modelado no incluye parámetros cinéticos para el transporte a través de la BBB o para la utilización de acetato. Por lo tanto, CMR ac refleja tanto en el transporte y utilización. Sin embargo, debido a los niveles plasmáticos de acetato fueron similares en ambos grupos, las diferencias observadas en el metabolismo de acetato de reflejar cambios reales en los parámetros cinéticos para el transporte de acetato y / o la utilización, en lugar de los cambios en la absorción de acetato debido únicamente a cambios en la concentración de acetato de plasma. Flujos de masa y isotópicos de [2 - 13 C] acetato de glutamato del cerebro y la glutamina se expresaron como ecuaciones diferenciales acopladas con CWave 3,0 ( 33 ) que se ejecuta en Matlab (Mathworks). Las ecuaciones (Tabla 1 ) se resuelve utilizando un primer orden de Runge-Kutta, y optimización de mínimos cuadrados se logró utilizando un algoritmo de Levenberg-Marquardt. Estadísticas. multivariado de medidas repetidas ANOVA se utilizó para comparar la evolución temporal de 13 C etiquetado de glutamato y glutamina, con post-hoc pairwise pruebas para evaluar las diferencias entre los grupos. A 2-muestra t test se realizó para evaluar las diferencias en acetato de plasma inicial, el estado de equilibrio de acetato de cerebro, y CMR alterna entre los grandes bebedores y los bebedores ligeros. A 2- tailed P valor de <0,05 se consideró estadísticamente significativo. Todos los datos se presentan como media ± SEM. ANOVA se utilizó para comparar los enriquecimientos de glutamato C4, C4 glutamina y GABA C2 entre los grandes bebedores y los bebedores ligeros. Post-hoc t tests para muestras independientes se realizaron para evaluar qué medidas diferían significativamente entre los grupos. Aprobación del Estudio. Este proyecto fue aprobado por el Programa de Protección de la Universidad de Yale Human Research. Antes de la participación, todos los sujetos dieron su consentimiento informado. Agradecimientos Esta publicación ha sido posible gracias a las subvenciones del NIH R21 AA018210 (a GF Mason), R21 AA019803 (a GF Mason), R01 DA021785 (a GF Mason), y la concesión CTSA UL1 RR024139 del Centro Nacional para Recursos de Investigación y el Centro Nacional para el Avance de Science Translational, los componentes del NIH, y el NIH Roadmap para la investigación médica. Su contenido es de exclusiva responsabilidad de sus autores y no representan necesariamente la opinión oficial de NIH. Notas al pie Conflicto de intereses: John H. Krystal tiene una beca de investigación de Pfizer y recibe una compensación de la Sociedad de Psiquiatría Biológica como su editor. Barbara Irene Gulanski tiene acciones comunes en Pfizer. Citación para este artículo: J Clin Invest. 2013; 123 (4) :1605-1614. doi: 10.1172/JCI65153. Referencias 1. Prosser RA, Mangrum CA, Vidrio JD. Etanol modula los cambios de fase aguda glutamatérgicas y serotoninérgicos del reloj circadiano de ratón in vitro. Neurociencia. 2008; 152 (3) :837-848. Vea este artículo a través de: PubMed CrossRef 2. Wallner M, Hanchar HJ, Olsen RW. Las dosis bajas de alcohol acciones sobre los receptores GABAA alpha4beta3delta se invierte por el antagonista del alcohol conductual Ro15-4513. Proc Natl Acad Sci EE.UU. A. 2006; 103 (22) :8540-8545. Vea este artículo a través de: PubMed CrossRef 3. Wakita M, MC Shin, S Iwata, K Nonaka, Akaike N. Efectos del etanol sobre los receptores GABA en las terminales nerviosas presinápticas GABAérgicas y glutamatérgicas. Exp Ther J Pharmacol. 2012; 341 (3) :809-819. Vea este artículo a través de: PubMed CrossRef 4. Ting JW, Lautt WW. . El efecto de la exposición aguda, crónica de etanol, y prenatal en sensibilidad a la insulina Pharmacol Ther. 2006; 111 (2) :346-373. Vea este artículo a través de: PubMed CrossRef 5. . Manzo Avalos-S, A. Saavedra Molina celular y mitocondrial efectos del consumo de alcohol . Int J Environ Health Res Pública 2010; 7 (12) :4281-4304. Vea este artículo a través de: PubMed CrossRef 6. . Lundquist F, Winkler K, Munckpet S, Tygstrup N, Mellemgaard metabolismo del etanol K. y la producción de acetato libre en el hígado humano, J Clin Invest. 1962; 41:955-961. Vea este artículo a través de: JCI.org PubMed CrossRef http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores 7. Norberg A, AW Jones, RG Hahn, Gabrielsson JL. Papel de la variabilidad en la explicación de la farmacocinética del etanol - aplicaciones de investigación y forenses. Farmacocinética Clínica. 2003; 42 (1) :1-31. Vea este artículo a través de: PubMed CrossRef 8. Jucker BM, Lee JY, RG Shulman. . In vivo C-13 las mediciones de RMN de flujo hepatocelular ciclo del ácido tricarboxílico J Biol Chem. 1998; 273 (20) :12187-12194. Vea este artículo a través de: PubMed CrossRef 9. . Lundquist F, Sestoft L, Damgaard SE, Clausen JP, Trap-Jensen J. Utilización de acetato en el antebrazo humano durante el ejercicio después de la ingestión de etanol J Clin Invest. 1973; 52 (12) :3231-3235. Vea este artículo a través de: JCI.org PubMed CrossRef 10. Davin A, Vion-Dury J, Viout P, Cozzone PJ. Evaluación rápida del contenido de etanol y el metabolismo en el plasma humano usando espectroscopía de resonancia magnética de protón cuantitativo. Alcohol Alcohol. 1994; 29 (5) :479-483. Vea este artículo a través de: PubMed 11. Peng GS, YC Chen, TP Tsao, Wang MF, Yin SJ. Base farmacocinético y farmacodinámico para la protección parcial contra el alcoholismo en los asiáticos, heterocigotos para la variante ALDH2 * 2 alelo del gen. Genómica Pharmacogenet. 2007; 17 (10) :845-855. Vea este artículo a través de: PubMed CrossRef 12. Nuutinen H, K Lindros, Hekali P, Salaspuro acetato M. arterial elevada como indicador rápido de eliminación del etanol en los alcohólicos crónicos. Alcohol. 1985; 2 (4) :623-626. Vea este artículo a través de: PubMed CrossRef 13. Mascord D, Smith J, Starmer GA, Whitfield JB. Efectos del aumento de la tasa de metabolismo del alcohol en la concentración de acetato de plasma. Alcohol Alcohol. 1992; 27 (1) :25-28. Vea este artículo a través de: PubMed 14. Patel AB, de Graaf RA, Rothman DL, Behar KL, Mason GF. Evaluación de acetato de transporte cerebral y las tasas metabólicas en el cerebro de rata in vivo usando 1H-[13C]-RMN. J Cereb Blood Flow Metab. 2010; 30 (6) :1200-1213. Vea este artículo a través de: PubMed CrossRef 15. Hellman L, Rosenfeld RS, Gallagher TF. Colesterol síntesis a partir de C-14-acetato en el hombre. J Clin Invest. 1954; 33 (2) :142-149. Vea este artículo a través de: JCI.org PubMed CrossRef 16. Natali F, Siculella L, S Salvati, Gnoni GV. El ácido oleico es un potente inhibidor de la síntesis de ácidos grasos y colesterol en células de glioma C6. Res J Lipid. 2007; 48 (9) :1966-1975. Vea este artículo a través de: PubMed CrossRef 17. Pronko PS, MG Velichko, AR Moroz, NN Rubanóvich. Bajo peso molecular, los metabolitos pertinentes metabolismo del etanol: correlación con la severidad de abstinencia de alcohol y de utilidad para la identificación de los alcohólicos. Alcohol Alcohol. 1997; 32 (6) :761-768. Vea este artículo a través de: PubMed CrossRef 18. Kiviluoma KT, Peuhkurinen KJ, Hassinen IE. Transporte adenina nucleótidos y la producción de adenosina en el corazón de rata aislado mitocondria durante el metabolismo de acetato. Biochim Biophys Acta. 1989; 974 (3) :274-281. Vea este artículo a través de: PubMed 19. Kiselevski Y, et al. . Metabolismo de acetato en los mecanismos cerebrales de adaptación a etanol Med Sci Monit. 2003; 9 (5) :178-182. Vea este artículo a través de: PubMed 20. Mailliard WS, Diamante I. Recientes avances en la neurobiología del alcoholismo: el papel de la adenosina. Pharmacol Ther. 2004; 101 (1) :39-46. Vea este artículo a través de: PubMed CrossRef 21. Diamond I, L Nagy, Mochly D-Rosen, Gordon A. El papel del transporte de adenosina adenosina en etanol y la tolerancia inducida por celular y la dependencia. Biológico posible y marcadores genéticos de alcoholismo. Ann NY Acad Sci. 1991; 625:473-487. Vea este artículo a través de: PubMed CrossRef 22. Carmichael FJ, et al. Los efectos en el sistema nervioso de acetato: Contribución a los efectos centrales de etanol. J Pharmacol Exp Ther. 1991; 259 (1) :403-408. Vea este artículo a través de: PubMed 23. Carmichael FJ, Orrego H, V Saldivia, Israel Y. Efecto del propiltiouracilo sobre el aumento inducido por etanol en el consumo de oxígeno del hígado en ratas despiertas. Hepatología. 1993; 18 (2) :415421. Vea este artículo a través de: PubMed CrossRef 24. Carmichael FJ, Orrego H, Israel Y. inducidos por acetato de adenosina mediada por los efectos del http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores etanol. Suppl Alcohol Alcohol. 1993; 2:411-418. Vea este artículo a través de: PubMed 25. Muir D, Berl S, Clarke DD. Acetato y fluoroacetato como posibles marcadores de metabolismo glial en vivo. Brain Res. 1986; 380 (2) :336-340. Vea este artículo a través de: PubMed CrossRef 26. Jain H, Beriwal S, Singh S. Alcohol cetoacidosis inducida, la hipoglucemia grave y encefalopatía irreversible. Med Sci Monit. 2002; 8 (11): CS77-CS79. Vea este artículo a través de: PubMed 27. Jiang L, et al. Hipoglucemia antecedente recurrente altera el metabolismo oxidativo neuronal in vivo. Diabetes. 2009; 58 (6) :1266-1274. Vea este artículo a través de: PubMed CrossRef 28. Mason GF, KF Petersen, V Lebon, DL Rothman, GI Shulman. El aumento de ácido monocarboxílico cerebro transporte y utilización en la diabetes tipo 1. Diabetes. 2006; 55 (4) :929-934. Vea este artículo a través de: PubMed CrossRef 29. Volkow ND, et al. Las dosis bajas de alcohol disminuye sustancialmente el metabolismo de la glucosa en el cerebro humano. Neuroimage. 2006; 29 (1) :295-301. Vea este artículo a través de: PubMed CrossRef 30. Volkow ND, et al. Intoxicación alcohólica aguda disminuye el metabolismo de la glucosa, pero aumenta el consumo de acetato en el cerebro humano. Neuroimage. 2013; 64:277-283. Vea este artículo a través de: PubMed CrossRef 31. Pawlosky RJ, et al. Las alteraciones en la utilización de la glucosa cerebral que acompaña a las elevaciones de etanol en sangre y concentraciones de acetato en la rata. Alcohol Clin Exp Res. 2010; 34 (2) :375-381. Vea este artículo a través de: PubMed CrossRef 32. Sarkola T, Iles MR, Kohlenberg-Mueller K, Eriksson CJ. Etanol, acetaldehído, acetato, lactato y niveles después de la ingesta de alcohol en hombres y mujeres blancos: efecto de 4-metilpirazol. Alcohol Clin Exp Res. 2002; 26 (2) :239-245. Vea este artículo a través de: PubMed CrossRef 33. Clubb R, G. Mason bienestar animal cautiverio efectos en una amplia gama de carnívoros. Naturaleza. 2003, 425 (6957) :473-474. Vea este artículo a través de: PubMed CrossRef 34. Lebon V, et al. . Astroglial contribución al metabolismo energético del cerebro en los seres humanos reveladas por 13C espectroscopia de resonancia magnética nuclear: elucidación de la vía predominante para la repleción neurotransmisor glutamato y la medición del metabolismo oxidativo astrocytic J Neurosci. 2002; 22 (5) :1523-1531. Vea este artículo a través de: PubMed 35. Brusilow SW, RC Koehler, RJ Traystman, AJL Cooper. Glutamina sintetasa astrocito: importancia en los síndromes de hiperamonémica y diana potencial para la terapia. Neurotherapeutics. 2010; 7 (4) :452-470. Vea este artículo a través de: PubMed CrossRef 36. RG Shulman, Rothman DL, Behar KL, Hyder F. base energética de la actividad cerebral: implicaciones para la neuroimagen. Tendencias Neurosci. 2004; 27 (8) :489-495. Vea este artículo a través de: PubMed CrossRef 37. Volkow N, et al. . Disminución del metabolismo cerebral en los alcohólicos saludables neurológicamente intactos Am J Psychiatry. 1992; 149 (8) :1016-1022. Vea este artículo a través de: PubMed 38. Hommer D, et al. Efectos de la m-clorofenilpiperazina regional sobre la utilización de la glucosa cerebral: tomografía por emisión de una comparación tomográfico de sujetos alcohólicos y control. J Neurosci. 1997; 17 (8) :2796-2806. Vea este artículo a través de: PubMed 39. Theberge J, et al. El glutamato y glutamina. Medido con 4,0 T protón MRS en pacientes no tratados con voluntarios sanos y esquizofrénicos Am J Psychiatry. 2002; 159 (11) :1944-1946. Vea este artículo a través de: PubMed CrossRef 40. Korri UM, Nuutinen H, Salaspuro M. El aumento de acetato de sangre: un marcador nuevo laboratorio de alcoholismo y consumo excesivo de alcohol. Alcohol Clin Exp Res. 1985; 9 (5) :468-471. Vea este artículo a través de: PubMed CrossRef 41. WJ McBride, Li TK. Los modelos animales de alcoholismo: neurobiología de alto consumo de alcohol en el comportamiento de los roedores. Crit Rev Neurobiol. 1998; 12 (4) :339-369. Vea este artículo a través de: PubMed CrossRef 42. Marks V. La patología clínica de alcohol. Pathol J Clin. 1983; 36 (4) :365-378. http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores Vea este artículo a través de: PubMed CrossRef 43. Patel AB, De Graaf RA, Rothman DL, Behar KL, Mason GF. Evaluación de acetato de transporte cerebral y tasas metabólicas en el cerebro de rata in vivo usando (1) H-(13) C-RMN. J Cereb Blood Flow Metab. 2010; 30 (6) :1200-1213. Vea este artículo a través de: PubMed CrossRef 44. Brecher AS, Lehti MD. Una hipótesis que relaciona la hipoglucemia, acidemia hiperuricemia, láctico, y la gluconeogénesis reducida en alcohólicos a la inactivación de la actividad de glucosa-6-fosfatasa por acetaldehído. Alcohol. 1996; 13 (6) :553-557. Vea este artículo a través de: PubMed CrossRef 45. HA Krebs, RA Freedland, R Hems, Stubbs M. La inhibición de la gluconeogénesis hepática por etanol. Biochem J. 1969; 112 (1) :117-124. Vea este artículo a través de: PubMed 46. J. Wright efectos endocrinos del alcohol. Clin Endocrinol Metab. 1978; 7 (2) :351-367. Vea este artículo a través de: PubMed CrossRef 47. Juhlin-Dannfelt A. Efectos del etanol de la utilización de sustratos por el cerebro humano. Scand J Clin Lab Invest. 1977; 37 (5) :443-449. Vea este artículo a través de: PubMed CrossRef 48. Sporer KA, Ernst AA, Conte R, Nick TG. . La incidencia de la hipoglucemia inducida por etanol Am J Emerg Med. 1992; 10 (5) :403-405. Vea este artículo a través de: PubMed CrossRef 49. Waniewski RA, Martin DL. Los astrocitos y transporte sinaptosomas y metabolizar lactato y acetato de otra manera. Res Neurochem. 2004; 29 (1) :209-217. Vea este artículo a través de: PubMed CrossRef 50. Borowiec A, Lechward K, Tkacz-Stachowska K, Skladanowski AC. La adenosina como regulador metabólico de la función del tejido: la producción de adenosina 5'-citoplasmática nucleotidasas. Acta Biochim Pol. 2006; 53 (2) :269-278. Vea este artículo a través de: PubMed 51. Dunwiddie TV, Diao L, Proctor WR. Nucleótidos de adenina someterse a una conversión rápida, cuantitativa a la adenosina en el espacio extracelular en el hipocampo de rata. J Neurosci. 1997; 17 (20) :7673-7682. Vea este artículo a través de: PubMed 52. Kiviluoma KT, Peuhkurinen KJ, Hassinen IE. Transporte adenina nucleótidos y la producción de adenosina en el corazón de rata aislado mitocondria durante el metabolismo de acetato. Biochim Biophys Acta. 1989; 974 (3) :274-281. Vea este artículo a través de: PubMed 53. Verdy M, Saliou Diallo, G. [hipoglucemia y el alcohol]. Can Med Assoc J. 1968; 98 (17) :827-830. Vea este artículo a través de: PubMed 54. Asatryan L, et al. . Implicación del sistema purinérgico en los trastornos por consumo de alcohol Alcohol Clin Exp Res. 2011; 35 (4) :584-594. Vea este artículo a través de: PubMed CrossRef 55. Badar-Goffer RS, Bachelard HS, Morris PG. Metabolismo cerebral de la glucosa y acetato estudiado por 13 C-NMR. Una técnica para investigar la compartimentación metabólica en el cerebro. Biochem J. 1990; 266 (1) :133-139. Vea este artículo a través de: PubMed 56. Lebon V, et al. Astroglial contribución al metabolismo energético del cerebro en los seres humanos reveladas por 13 . C espectroscopia de resonancia magnética nuclear: elucidación de la vía predominante para la reposición neurotransmisor glutamato y la medición del metabolismo oxidativo astrocytic J Neurosci. 2002; 22 (5) :1523-1531. Vea este artículo a través de: PubMed 57. van den Berg CJ, Garfinkel D. Un estudio de la estimulación de los compartimentos cerebrales. Metabolismo de las sustancias relacionadas con glutamato y en cerebro de ratón. Biochem J. 1971; 123 (2) :211-218. Vea este artículo a través de: PubMed 58. Patel AB, de Graaf RA, Mason GF, Rothman DL, RG Shulman, KL Behar. La contribución de GABA a glutamato / glutamina ciclismo y metabolismo de la energía en la corteza de rata in vivo. Proc Natl Acad Sci EE.UU. A. 2005; 102 (15) :5588-5593. Vea este artículo a través de: PubMed CrossRef 59. Feinstein A, Stergiopoulos V, J Fine, Lang AE. Resultado psiquiátrico de los pacientes con un trastorno del movimiento psicógeno: un estudio prospectivo. Neuropsiquiatría Neuropsychol comportamiento Neurol. 2001; 14 (3) :169-176. Vea este artículo a través de: PubMed http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores 60. Sobell LC, Sobell MB. Línea de tiempo de seguimiento de nuevo: una técnica para la evaluación de auto-reporte de consumo de alcohol. En: Litten RZ, JP Allen, eds. Medición de Consumo de Alcohol: Métodos psicosociales y bioquímicos. Totowa, Nueva Jersey, EE.UU.: Humana Press; 1993; :41-72. 61. Coles L, J Litt, Hatta H, Bonen A. Ejercicio rápidamente aumenta la expresión de los transportadores de monocarboxilato MCT1 y MCT4 en músculo de rata. J Physiol. 2004; 561 (pt 1): 253-261. Vea este artículo a través de: PubMed CrossRef 62. Leino RL, Gerhart DZ, Duelli R, Enerson BE, Drewes LR. Inducida por la dieta cetosis aumenta monocarboxilato transportador (MCT1) los niveles en el cerebro de rata. Int. Neurochem. 2001; 38 (6) :519-527. Vea este artículo a través de: PubMed CrossRef 63. Morgan P, et al. Cortical los niveles de GABA en el insomnio primario. dormir. 2012; 35 (6) :807-814. Vea este artículo a través de: PubMed 64. Shen J, Rycyna RE, Rothman DL. Mejoras en un método in vivo calce automático [FASTERMAP]. Magn Reson Med. 1997; 38 (5) :834-839. Vea este artículo a través de: PubMed CrossRef 65. Rothman DL, Petroff OA, Behar KL, Mattson RH. Localizada 1H RMN mediciones de ácido gammaaminobutírico en el cerebro humano in vivo. Proc Natl Acad Sci EE.UU. A. 1993; 90 (12) :5662-5666. Vea este artículo a través de: PubMed CrossRef 66. Boumezbeur F, et al. . Metabolismo cerebral alterado mitocondrial en el envejecimiento saludable como se evaluó por espectroscopia de resonancia magnética in vivo J Cereb Blood Flow Metab. 2010; 30 (1) :211-221. Vea este artículo a través de: PubMed CrossRef 67. Shen J, et al. Determinación de la tasa del ciclo de glutamato / glutamina en el cerebro humano in vivo por RMN 13C. Proc Natl Acad Sci EE.UU. A. 1999; 96 (14) :8235-8240. Vea este artículo a través de: PubMed CrossRef 68. Shen J, Rycyna RE, Rothman DL. Mejoras en un método in vivo calce automático [FASTERMAP]. Magn Reson Med. 1997; 38 (5) :834-839. Vea este artículo a través de: PubMed CrossRef 69. Valentine GW, et al. El efecto antidepresivo de la ketamina no está asociado con cambios en occipital contenido de amino ácido neurotransmisor, según lo determinado por [(1) H]-MRS. Res Psiquiatría. 2011; 191 (2) :122-127. Vea este artículo a través de: PubMed 70. Mason GF, DL Rothman, KL Behar, RG Shulman. RMN determinación del tipo de ciclo de TCA y tipo de cambio alpha-ketoglutarate/glutamate en el cerebro de rata. J Cereb Blood Flow Metab. 1992; 12 (3) :434-447. Vea este artículo a través de: PubMed CrossRef 71. Patel AB, de Graaf RA, Mason GF, Rothman DL, RG Shulman, KL Behar. La contribución de GABA a glutamato / glutamina ciclismo y metabolismo de la energía en la corteza de rata in vivo. Proc Natl Acad Sci EE.UU. A. 2005; 102 (15) :5588-5593. Vea este artículo a través de: PubMed CrossRef 72. Gjedde A, Diemer NH. Determinación autorradiográfica de contenido regional glucosa cerebral. J Cereb Blood Flow Metab. 1983; 3 (3) :303-310. Vea este artículo a través de: PubMed CrossRef 73. Gruetter R, Ugurbil K, Seaquist ER. Las concentraciones en equilibrio de glucosa cerebral y el transporte en el cerebro humano. J Neurochem. 1998; 70 (1) :397-408. Vea este artículo a través de: PubMed CrossRef 74. Mason GF, KF Petersen, de Graaf RA, GI Shulman, DL Rothman. Las mediciones de la tasa de anaplerótico en la corteza cerebral humana usando 13C espectroscopia de resonancia magnética y [1-13C] y [2-13C] glucosa. J Neurochem. 2007; 100 (1) :73-86. Vea este artículo a través de: PubMed CrossRef 75. Mason GF, R Gruetter, DL Rothman, KL Behar, RG Shulman, EJ Novotny. Determinación simultánea de las tasas del ciclo de Krebs, la utilización de la glucosa, el intercambio alphaketoglutarate/glutamate, y la síntesis de glutamina en el cerebro humano por RMN. J Cereb Blood Flow Metab. 1995; 15 (1) :12-25. Vea este artículo a través de: PubMed CrossRef 76. . Gruetter R, ER Seaquist, K. Ugurbil Un modelo matemático del metabolismo de los neurotransmisores compartimentada en el cerebro humano Am J Physiol Endocrinol Metab. 2001; 281 (1): E100-E112. Vea este artículo a través de: PubMed 77. Gruetter R, et al. Localizada espectroscopía de RMN 13C en el cerebro humano de etiquetado de http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.] JCI - Aumento de la captación en el cerebro y la oxidación de acetato en los grandes bebedores aminoácidos a partir de D-[1-13C] glucosa. J Neurochem. 1994; 63 (4) :1377-1385. Vea este artículo a través de: PubMed CrossRef 78. Lebon V, et al. . Astroglial contribución al metabolismo energético del cerebro en los seres humanos reveladas por 13C espectroscopia de resonancia magnética nuclear: elucidación de la vía predominante para la repleción neurotransmisor glutamato y la medición del metabolismo oxidativo astrocytic J Neurosci. 2002; 22 (5) :1523-1531. Vea este artículo a través de: PubMed Acerca de la JCI Número actual Suscribir Archivo RSS y alertas Contacto Copyright © 2013 American Society for Clinical Investigation . La JCI es la publicación de la ASCI , una sociedad de honor de médico-científicos. copia, redistribución, y otras políticas de uso http://www.jci.org/articles/view/65153[01/04/2013 03:18:49 p.m.]