cinética enzimática
Anuncio

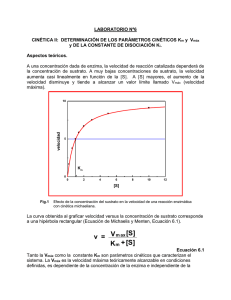
cinética enzimática Cinética química: estudia las velocidades de las reacciones químicas. Cinética enzimática: Parte de la cinética química que estudia la velocidad de las reacciones catalizadas por enzimas. 1.- Velocidad de reacción En una reacción en la que la velocidad del sistema no varía, la velocidad es: v A P t t La velocidad en una reacción espontánea e irreversible v d A d P dt dt mol l La unidad es : mol l 1 s 1 s A lo largo del proceso de la reacción varía [A] y va disminuyendo la velocidad de la reacción, por ello, la velocidad de una reacción se calcula, mediante la ecuación cinética: v K A K : Constanted e proporcion alidad, cte. de velocidad También se puede calcular experimentalmente mediante las curvas de progreso, que indican la aparición de productos o desaparición de reactivos en el tiempo. La pendiente de la tangente a la curva en cada punto es la velocidad de la reacción. La velocidad de la reacción varía hasta llegar al equilibrio, en el que la velocidad de la reacción es cero. [P] v1 t En una reacción en la que interviene más de un sustrato: A B P Los reactivos van a tener que colisionar y la velocidad es proporcional a la concentración de reactivos: v K A B si : 2 A P v K A 2 2.- Orden de las reacciones El orden de una reacción es la suma de los exponentes de los términos de las concentraciones en las ecuaciones de velocidad. Las de orden 1 y 2 son las más comunes, las de 3 son extrañas y de 4 o más no se conocen. La molecularidad de una reacción es el número de moléculas que tienen que colisionar para que se produzca la reacción. Las reacciones pueden ser Elementales: si ambas coinciden (aunque no siempre sea así) En varias etapas: si no coinciden La constante de velocidad tiene unidades diferentes según del orden de la reacción: A P De primer orden o unimolecul v K A u : s ar 1 A B P 2 A P De segundo orden o bimolecula 2 v K A B v K A u : mol 1 L s r 1 Un caso especial es la reacción de orden 0, en la que la velocidad es independiente de la concentración de sustrato y la transformación es lineal: v K u : mol L s 1 [P] t 3.- Reacciones reversibles AB C B En estas, cambia el concepto: Las constantes de velocidad son diferentes en cada sentido y también las velocidades, que sólo se igualan en el equilibrio. v 1 K 1 A B Hacia la derecha v 2 K 2 C D Hacia la izquierda En el equilibrio : v1 v 2 K 1 A B K 2 C D K1 K2 A B C D K eq Ésta es la constante para una reacción determinada, y su valor nos permite saber en qué sentido está desplazada la reacción: si es mayor de uno lo está a la derecha y si es menor de uno, a la izquierda. Todo ello sin olvidar que el equilibrio es un estado dinámico, que las velocidades de formación y desintegración sean iguales no significa que haya parado la interconversión de sustratos en productos y de productos en sustratos. La espontaneidad de la reacción viene dada por la energía libre de Gibbs (Go). 4.- Cinética enzimática Si en un tubo mezclamos todos los componentes necesarios para que tenga lugar una reacción y 1. vamos variando la concentración de sustratos de modo creciente obtenemos que a medida que aumenta la concentración de sustrato aumenta la velocidad hasta que todo el enzima está saturado de sustrato. 2. a una concentración saturada de sustrato aumentamos la concentración de enzima, el aumento de enzima es proporcional al aumento de la velocidad de la reacción, si se duplica la concentración de enzima, duplicaremos la velocidad de reacción. Caso 2 Caso 1: S1> S2> S3 [P] [P] S1 S2 S3 4[E] 2[E] [E] t t Estas son las bases experimentales en las que se asientan las exposiciones de Henri y la cinética de Michaelis-Menten.