TABLA PERIODICA
Anuncio
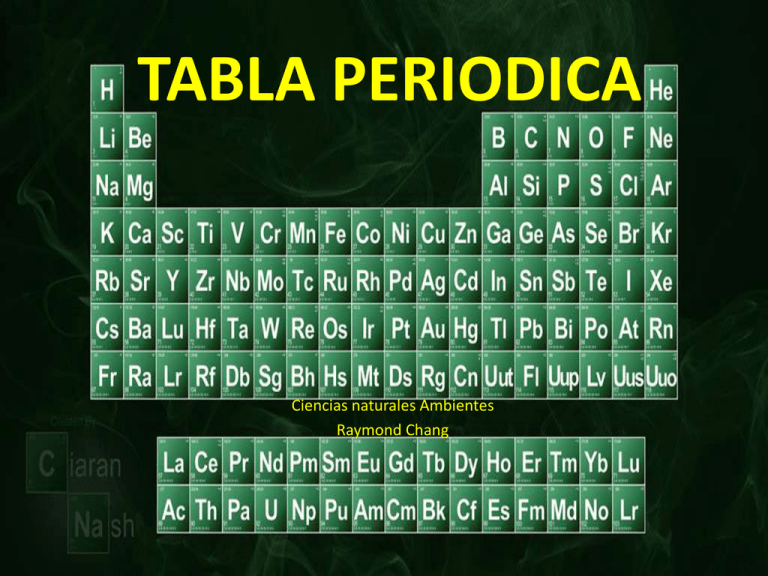
TABLA PERIODICA Ciencias naturales Ambientes Raymond Chang TABLA PERIODICA La organización más satisfactoria de los elementos fue obra de Dmitri Mendeleev, quien señalo que las propiedades, tanto físicas como químicas de los elementos varían periódicamente al aumentar la masa atómica. 2 TABLA PERIODICA 3 PERIODOS Una fila horizontal es un periodo. En la tabla periódica hay 7 periodos de elementos. GRUPOS o FAMILIAS Los grupos corresponden a las columnas y se identifican con números romanos. Las familias se identifican con nombres específicos. I A METALES ALCALINOS II A METALES ALCALINOTERREOS III A FAMILIA DEL BORO IV A FAMILIA DEL CARBONO V A FAMILIA DEL NITROGENO VI A FAMILIA DEL OXIGENO VII A FAMILIA DE LOS HALOGENOS VIII A FAMILIA DE LOS GASES NOBLES 4 CLASIFICACION DE LOS ELEMENTOS METALES: Los metales del Grupo IA son los mas reactivos. NO METALES: Entre los no metales se encuentran dos gases muy conocidos el nitrógeno y el oxigeno. METALOIDES: Los elementos que se encuentran en la región intermedia de la tabla periódica entre metales y no metales. 5 CARACTERISTICAS DE LOS METALES, NO METALES Y METALOIDES • METALES • Se caracterizan por su brillo metálico, ser buenos conductores del calor y electricidad y por ser dúctiles y maleables. La mayoría son sólidos a temperatura ambiente. • NO METALES • Malos conductores del calor y de la electricidad, su ductilidad y maleabilidad son muy bajas y no poseen brillo. Algunos son sólidos como el C otros líquidos como el Br y otros gaseosos como el O y N. METALOIDES • Son elementos • Son semiconductores químicos que tienen de la electricidad, por lo propiedades cual son muy usados en intermedias entre los electrónica. metales y no metales. Ejemplo: • Boro, Silicio, Germanio, Arsénico, Antimonio, Telurio y Polonio. 8 DIATOMICOS: Elementos no metálicos existen como pares de átomos combinados en forma de moléculas diatómicas en condiciones ambientales ordinarias (hidrógeno, nitrógeno, oxigeno, flúor, cloro, bromo, yodo). 9 ELEMENTOS DIATOMICOS HIDROGENO NITROGENO OXIGENO FLOUR CLORO BROMO YODO 10 CLASIFICACION DE LOS ELEMENTOS ELEMENTOS REPRESENTATIVOS Son todos los elementos situados en las primeras dos columnas y en las ultimas seis columnas de la tabla periódica. ELEMENTOS DE TRANSICION Se encuentran en la región central de la tabla periódica. 11 ELEMENTOS DE TRANSICION INTERNA Son los elementos desde el 58 hasta el 71 y desde 90 hasta 103. GASES NOBLES Forman el ultimo grupo de la tabla tienen poca tendencia a reaccionar o combinarse. 12 CLASIFICACIÓN GASES NOBLES NOMBRES NO COMUNES HALOGENOS METALES ALCALINOTERREOS METALES ALCALINEOS ELEMENTOS REPRESENTATIVOS ELEMENTOS DE TRANSCISION 13 Un átomo es eléctricamente neutro. Por esta razón hay igual número de electrones afuera del núcleo que protones adentro del núcleo. 14 NÚMERO ATÓMICO: es igual al número de protones en el núcleo de un átomo, cada elemento tiene su número atómico propio y se usa para identificar a cada elemento NÚMERO DE MASA: Sera el número de protones en un átomo, mas el número de neutrones , el cual es igual a la masa atómica en uma. 15 NUMERO DE MASA = # DE PROTONES + # DE NEUTRONES A= NUMERO DE MASA X= SIMBOLO DEL ELEMENTO Z= NUMERO ATOMICO 16 Ejercicio Cuantos protones, electrones y neutrones hay en cada uno de los siguientes átomos: ATOMO 12 6 C 80 35 Br 206 82 Pb PROTONES ELECTRONES NEUTRONES 6 6 6 17 Ejercicio Nombre del elemento # atómico # de masa # de protones símbolo # de neutrone s # de electrones Complete la siguiente tabla para átomos neutros: N 15 Calcio 42 38 14 56 50 16 138 18 Propiedades • ELECTRONEGATIVIDAD.- Es una medida de la tracción que ejerce un átomo de una molécula sobre los electrones del enlace. En la tabla periódica la electronegatividad en los periodos aumenta hacia la derecha y en los grupos aumenta hacia arriba. ELECTRONEGATIVIDAD ELECTRONEGATIVIDAD Existe una escala de electronegatividad , uno de los usos es la predicción del tipo de enlace químico formado entre átomos. Clasificación del enlace en base a la diferencia de electronegatividad Busque el valor de la electronegatividad en su tabla periódica. Se resta siempre la electronegatividad mayor de la menor, no importando el orden en que se encuentren los átomos en el compuesto. Nunca debe multiplicar la electronegatividad por el número de veces que aparece el átomo en la fórmula. EJERCICIO : Calcular la diferencia de electronegatividad entre cada uno de los pares de átomos siguientes, e indique si es iónico, covalente : a) Cl y Na b) S y O c) K2S d) SeS2 e) SO3 f) P y Cl g) HCl h) P2S3 i) CS PROPIEDADES GENERALES QUE PRESENTAN LOS COMPUESTOS IÓNICOS Y LOS COVALENTES CARÁCTER METALICO • CARÁCTER METÁLICO.- La división entre metales y no metales es clara en la tabla. El carácter metálico se refiere a que tan marcadas son las propiedades metálicos o no metálicos con respecto a otros elementos. El carácter metálico aumenta en los periodos hacia la izquierda y en los grupos hacia abajo. • ENLACE QUIMICO Es la fuerza de atracción que mantiene unidos a los átomos en las moléculas y a los iones en los cristales. A los tipos de enlaces presentes en una substancia se deben las propiedades químicas y físicas de las sustancias. El enlace químico puede ser: Iónico Covalente REGLA DEL OCTETO “Los átomos interaccionan para modificar el número de electrones en sus niveles electrónicos externos en un intento de lograr una estructura electrónica similar a la de un gas noble” La estructura de un gas noble consta de ocho electrones en el nivel mas externo, para todos los elementos excepto en el hidrógeno y el helio, en donde el nivel completo consiste en sólo 2 electrones. Así los niveles electrónicos más externos de la mayoría de los átomos al combinarse tienden a ganar o perder electrones hasta que el número total de electrones es igual a 8. Los átomos alcanzan su estabilidad cuando tienen ocho electrones en su último nivel . Para lograrlo pueden : Perder electrones (metales) Ganar electrones (no metales) Compartir electrones ENLACE IONICO En los enlaces iónicos los electrones de valencia de un METAL se TRANSFIEREN a un NO METAL. Se origina así un ión positivo y uno negativo, los cuales se unen debido a una atracción electrostática. Na + Cl → Na+ + Cl – ENLACE IONICO ENLACE COVALENTE Al par compartido de electrones de la molécula se le llama enlace covalente. Cuando dos o mas átomos comparten electrones forman una molécula. Durante la formación de un enlace covalente se puede imaginar a dos átomos que se acercan el uno a otro entrelazándose sus orbitales, de tal manera que no se pueden separar con facilidad. Ejemplo Cl2, H2 ENLACE COVALENTE ESTRUCTURAS DE LEWIS Es la representación de un elemento o compuesto con sus electrones de valencia. El símbolo de cada elemento se utiliza para representar el núcleo y todos los electrones internos. Los electrones de valencia son luego representados como puntos alrededor del símbolo. Ejemplos: o O O o o Cl Los electrones de valencia para los elementos representativos corresponden al número de grupo







