Guía de Aprendizaje: Teoría Atómica
Anuncio

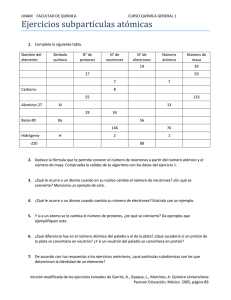
LICEO COEDUCACIONAL LA IGUALDAD Departamento de Ciencias Ciencias Naturales Guía de Aprendizaje: Teoría Atómica Objetivo: Describir la utilidad del modelo atómico y de la teoría atómica para explicar los procesos de transformación fisicoquímica de la materia. La identidad de un átomo y sus propiedades vienen dadas por el número de partículas que contiene. Lo que distingue a unos elementos químicos de otros es el número de protones que tienen sus átomos en el núcleo. Este número se llama Número atómico y se representa con la letra Z. Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente. Por ejemplo, todos los átomos del elemento Hidrógeno tienen 1 protón y su Z = 1, los de helio tienen 2 protones y Z =2, los de litio, 3 protones y Z = 3,… Si el átomo es neutro, el número de electrones coincide con el de protones y nos lo da Z. El Número másico nos indica el número total de partículas que hay en el núcleo, es decir, la suma de protones y neutrones. Se representa con la letra A y se sitúa como superíndice a la izquierda del símbolo del elemento. Representa la masa del átomo medida en uma, ya que la de los electrones es tan pequeña que puede despreciarse. En el ejemplo, tendríamos un átomo del elemento neón, con 10 protones en su núcleo y 10 electrones en su corteza (es neutro). Tendría también: 22-10 = 12 neutrones. Prof. Víctor Zárate T. LICEO COEDUCACIONAL LA IGUALDAD Departamento de Ciencias Ciencias Naturales IONES Un ion se representa mediante el símbolo del elemento del que procede, con un superíndice a la derecha, que indica la carga que posee mediante un número y el signo + o el signo -. Los cationes han perdido electrones en el número que indica la carga positiva. Por ejemplo, +3 indicará que ese átomo ha perdido 3 electrones. Los aniones han ganado electrones, en el número que indica la carga negativa. Por ejemplo, -2 indicará que ese átomo ha ganado 2 electrones. En esta escena puedes determinar las distintas partículas subatómicas de una especie atómica: Este átomo corresponde al elemento Aluminio. Tiene 13 protones y 14 neutrones. Es un catión con carga +3, lo que quiere decir que ha perdido 3 electrones respecto a su estado neutro; por tanto, tiene 13-3 = 10 electrones. ISOTOPOS Todos los átomos de un elemento químico tienen el mismo número de protones, pero pueden diferenciarse en el número de neutrones. Se llaman Isótopos los átomos que tienen el mismo número de protones y se diferencian en el número de neutrones. Por tanto, presentan el mismo número atómico (Z) y diferente número másico (A). Los isótopos tienen masa diferente, ya que tienen distinto número de neutrones. Para nombrarlos se indica su nombre seguido de su número másico; por ejemplo, sodio-23 (Na-23). Prof. Víctor Zárate T. LICEO COEDUCACIONAL LA IGUALDAD Departamento de Ciencias Ciencias Naturales Hidrógeno-1. Este isótopo tiene: 1 protón, 1 electrón y 0 neutrones. Hidrógeno-2. Este isótopo tiene: 1 protón, 1 electrón y 1 neutrón. Hidrógeno-3. Este isótopo tiene: 1 protón, 1 electrón y 2 neutrones. TRABAJOINDIVIDUAL 1. Con ayuda de la tabla periódica, identifico el número atómico y de masa de los siguientes elementos: Calcio, Hierro, Estaño, Azufre, Astato, Manganeso, Oxígeno, Plata, Cloro, Francio. 2. Teniendo en cuenta la información anterior, determino el número de protones, electrones y neutrones de cada uno de los átomos que conforman los elementos. 3. Determino el número de protones, neutrones y electrones para los siguientes iones: a) Mg+2 b) F-1 c) Al+3 d) O-2 5. Doy mi concepto de isótopos y escribo los isótopos del hidrógeno identificando neutrones, electrones y protones de cada uno Prof. Víctor Zárate T.