Guías para la Resucitación Inicial de los pacientes
Anuncio

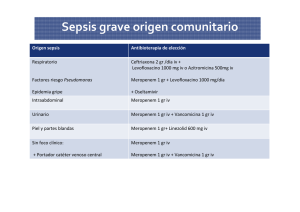
REANIMACIÓN INICIAL DE LOS PACIENTES CON SEPSIS SEVERA/SHOCK SÉPTICO Autores: Dr. Raúl Alejandro Gómez, Dr. Fernando Villarejo, Dr. Miguel Curone, Dr. Ignacio Moine. Avalado por el Comité de Docencia y Comité de Riesgo de Swiss Medical Group. Estas guías constituyen una serie de recomendaciones de tipo general que no reemplazan al buen juicio del médico en el tratamiento de cada caso en particular. Temas: 1. Reanimación temprana de los pacientes con sepsis severa / shock séptico 2. Aspectos infecciosos 3. Soporte hemodinámico 3.1. Reanimación ulterior con fluidos 3.2. Drogas vasopresoras 3.3. Drogas inotrópicas 4. Administración de hemocomponentes 5. Empleo de hidrocortisona Anexo: Tratamiento antimicrobiano empírico de sepsis severa y shock séptico en UCI. Antimicrobianos empíricos según gérmenes y patrones de multirresistencia (organismos multirresistentes - OMR). Factores de riesgo para SAMR. Alergia SEVERA a penicilina (PNC): anafilaxia, síndrome de Stevens Johnson, necrolisis epidérmica tóxica, DRESS, etc. Esquemas antimicrobianos sugeridos Sepsis sin foco aparente de la comunidad Con foco sospechado / identificado RECORDAR: EL “RELOJ SÉPTICO” ESTÁ CONTANDO Glosario ATB: Antibióticos BLEE: Beta-lactamasa de espectro extendido CAP: Catéter en arteria pulmonar CVC: Catéter venoso central dVCI: Distensibilibilidad de vena cava inferior EtCO2: “End tidal” CO2 ETE: Ecocardiograma transesofágico ETT: Ecocardiograma transtorácico EVR: Enterococo resistente a vancomicina FC: Frecuencia cardiaca Fey VI: Fracción de eyección del ventrículo izquierdo FR: Frecuencia respiratoria GC: Gasto cardíaco Gradiente de pCO2 (vc-a): Gradiente de pCO2 de sangre venosa central a arterial IV: Intravenoso KPC: Klebsiella sp. productora de carbapenemasa NPT: Nutrición parenteral total PAD: Presión arterial diastólica PAM: Presión arterial media PAPW: Presión de enclavamiento en arteria pulmonar PiCCO: “Pulse index Continuous Cardiac Ouput” PNC: Penicilina PP: Presión de pulso PVC: Presión venosa central SAMR: Staphylococcus aureus meticilino-resistente SNG: Sonda nasogástrica SvcO2: Saturación de hemoglobina en sangre venosa central VCS: Vena cava superior VM: Ventilación mecánica VO: Vía oral VPP: Variación de presión de pulso VT: Volumen “tidal” (corriente) VTI Ao: “Aortic velocity time integral” 1. Reanimación temprana de los pacientes con sepsis severa / shock séptico SEPSIS SEVERA / SHOCK SÉPTICO (REANIMACIÓN INICIAL < 6 HORAS) Click aquí Click aquí Comenzar inmediatamente con la reanimación si el paciente presenta hipotensión y/o hiperlactatemia (> 4 mmol/l o > 36 mg/dl en sangre arterial). Obtener cultivos e inicio urgente de antibióticos (ATB). NO ESPERAR a la admisión a UTI. Objetivos hemodinámicos iniciales: Reversión de hipovolemia y optimización de condiciones de llenado ventricular. PAM ≥ 65 mmHg y PAD ≥ 40 mmHg (en pacientes con hipertensión no controlada, ajustar el target a valores más elevados, ej. PAM > 75 mmHg). Diuresis ≥ 0,5 ml/kg/h. SvcO2 >70% (saturación de hemoglobina en sangre venosa central-obtenida de un catéter colocada en VCS y con determinación por co-oximetría). NOTA: En pacientes en los cuales no pueda obtenerse SvcO2, como alternativa se puede utilizar el “clearance” de lactato” (reducción ≥ 10% en pacientes con valores elevados al inicio). Cl lactato: (lactato inicial – lactato ulterior) / lactato inicial x 100 (lactato ulterior, luego de al menos 2 hs. de reanimación). 2. Aspectos infecciosos Obtener inmediatamente los cultivos apropiados antes de iniciar antibióticos (ATB) en la medida que esto no atrase innecesariamente el inicio de los mismos (< 45 minutos). Dos o más hemocultivos. Retrocultivos de catéteres centrales > 48 hs. (con ausencia de otro foco sospechado). Otros cultivos según indicación clínica / sospecha de foco infeccioso. NOTA: Realizar estudios de imágenes rápidamente según sospecha de foco infeccioso. Iniciar ATB intravenosos tan pronto como sea posible, dentro de la primera hora del diagnóstico de sepsis severa o shock séptico. Esquema ATB empírico dirigido a la sospecha clínica de infección y gérmenes representativos. En el estudio de Kumar et al (2006): El inicio de ATB efectivos dentro de la primera hora luego del comienzo de la hipotensión se asoció a una sobrevida hospitalaria del 79,9%. Por cada hora adicional a tratamiento ATB efectivo en las primeras 6 horas luego del comienzo de la hipotensión la sobrevida se redujo un promedio de 7,6%. Con un retraso de 5-6 hs. la sobrevida fue del 42% y para las 9-12 hs. del 25,4%. Evaluar al paciente en búsqueda de un foco infeccioso pasible de intervención quirúrgica (ej., evacuación de abscesos, desbridamiento de tejido necrótico) e implementar control del mismo tan pronto como sea posible (< 12 hs.). 3. Soporte hemodinámico Administrar una carga de fluidos inicial de al menos 30 ml/kg de cristaloides -salina 0,9% o Ringer Lactato- en 1 hora (o su equivalente en coloides). Algunos pacientes requerirán mayores volúmenes en tiempos menores. Siempre evaluar la función cardiaca en pacientes con cardiopatía previa. No esperar a la colocación de un catéter venoso central (CVC) intratorácico para expandir con volumen. NO usar hidroxietil almidón (“hidroxietil starch”). Colocar un CVC (acceso de primera opción la vena subclavia, segunda opción la vena yugular interna) de al menos dos luces en vena cava superior para determinación de SvcO 2. En pacientes con sospecha de requerimiento de nutrición parenteral total, de tres luces con un lumen reservado para la NPT: mantenimiento de permeabilidad con solución de dextrosa en agua 5% a 5 ml/h, no usar para transfusión de hemocomponentes, otros fluidos o administración de drogas (rotular como uso exclusivo NPT). Cuando la expansión con fluidos es inefectiva para restablecer la presión arterial y/o la perfusión tisular, iniciar vasopresores (de elección: noradrenalina). El empleo de vasopresores puede también ser requerido para mantener la PAM y perfusión en caso de hipotensión grave con riesgo de muerte, aun cuando la hipovolemia no haya revertido y/o la carga con líquidos no haya finalizado. En aquellos pacientes con reanimación inicial en curso / finalizada, ECOCARDIOGRAMA 2D / DOPPLER CARDIACO TRANSTORÁCICO-ETT(considerar según la condición particular ecocardiograma transesofágico-ETE-) para valorar función ventricular derecha e izquierda, hipocinesia primaria o secundaria, dVCI y determinación de gasto cardiaco por VTI Ao (pero recordando que no existe un “gasto cardiaco” (GC) normal en sepsis, se valorará como adecuado o no a las necesidades tisulares). En pacientes con requerimiento de noradrenalina ≥ 0,1 µg/kg/min (o ante indicación del médico tratante), COLOCACIÓN DE LÍNEA ARTERIAL para monitoreo continuo de presión arterial (eventualmente análisis de morfología de la onda y determinación de variación de presión de pulso –VPP- y componentes delta UP y delta DOWN). Considerar en el paciente individual la DETERMINACIÓN DE GASTO CARDIACO por ecocardiografía, catéter en arteria pulmonar (CAP), PiCCO™, etc. 3.1. Reanimación ulterior con fluidos: La elección del monitoreo hemodinámico a emplear estará definido por la disponibilidad de recursos y juicio del médico tratante. Parámetros estáticos: Valores de presión venosa central (PVC) de 8-12 mmHg (recomendaciones Surviving Sepsis Campaign) o cifras de presión de enclavamiento en arteria pulmonar (PAPW) que aseguren el mejor gasto cardiaco. Parámetros dinámicos: Variación de presión de pulso (VPP): Se considerarán pacientes potencialmente respondedores a fluidos aquellos con una VPP ≥13% y un delta DOWN ≥5 mmHg. Para su correcta valoración, el sujeto debe estar ventilado en condiciones pasivas, sin esfuerzo respiratorio, sin arritmias y con un VT ≥8 ml/Kg. En aquellos pacientes con esfuerzo respiratorio débil, que no logran abrir la válvula inspiratoria durante una pausa tele-espiratoria de 15 segundos, un incremento del 5% de la PP (o del GC) se considerará indicativa de dependencia de precarga (test de oclusión tele-espiratoria). En pacientes con síndrome de dificultad respiratoria aguda (SDRA/ARDS) el empleo de bajos valores de VT (< 8 ml/kg) y/o existencia de baja Cst,rs (≤30 ml/cmH2O) generan menor confiabilidad en los valores de VPP y se recomiendan otros métodos de monitoreo hemodinámico funcional. Asimismo, se ha propuesto que una relación de FC a FR (FC/FR) <3,6 reduce la precisión de la VPP. También disminuye frente a hipertensión intra-abdominal. No utilizar VPP ante la presencia de cor pulmonale. En un 25% de pacientes quirúrgicos ventilados bajo anestesia, la VPP se encuentra en una “zona gris” (9-13%) donde 50% son respondedores y 50% no son respondedores a un desafío con volumen. Si bien es difícil extrapolar estos resultados de pacientes en cirugía al cuadro séptico, la probabilidad pre-test y el juicio clínico sobre la relación riesgo/beneficio de la expansión con fluidos debe prevalecer. Un descenso de la VPP (dVPP) ≥3% en estos sujetos en la sala de operaciones se correlaciona con aumento del gasto cardiaco. Prueba de elevación pasiva de miembros inferiores (“passive leg raising”) y valoración de su impacto sobre el gasto cardiaco (“respondedores”: incremento del gasto cardiaco ≥12% dentro de los 30-90 segundos de la maniobra). Puede emplearse independientemente de arritmias y/o respiración espontánea En pacientes que inicialmente no dispongan de un dispositivo para determinación de gasto cardiaco, un aumento de la EtCO2 ≥5% puede emplearse para definir una positiva respuesta a infusión de fluidos. Distensibilidad de la vena cava inferior (dVCI) por medición ecocardiográfica; un valor >18% apoya una favorable respuesta del gasto cardiaco a un desafío con volumen (máx diámetro en inspiración – mín diámetro en espiración / mín diámetro en espiración) en pacientes ventilados en condiciones pasivas (validado fundamentalmente para pacientes médicos). Mini-desafío con fluidos: un incremento ≥10% del VTI sub Ao por ultrasonidos luego de una expansión con 100 ml de coloides refleja una condición de respuesta a volumen del gasto cardiaco. Recordar: Ningún valor de corte es un “número mágico”. 3.2. Drogas vasopresoras: La noradrenalina es el agente vasopresor de elección. En casos seleccionados, y ante fracaso de noradrenalina, se puede agregar adrenalina. Considerar el empleo de dopamina en pacientes altamente seleccionados (bajo riesgo de taquiarritmias y presencia de bradicardia absoluta o relativa). No usar bajas dosis de dopamina para protección renal. Es discutible el agregado de vasopresina (0,03 u/min) como agregado a la noradrenalina para aumentar pam o reducir la dosis de esta droga. 3.3. Drogas inotrópicas: En aquellos casos en los cuales se mantenga la SvcO 2 < 70% a pesar de la expansión con volumen y/o empleo de vasopresores, iniciar dobutamina a 5 µg/kg/min, máximo 20 mcg/kg/min. En aquellos casos con evidencias de disfunción miocárdica y/o hipoperfusión tisular (ej., ecocardiografía con hipocinesia ventricular -Fey VI <45%-, gradiente de pCO2 (vc-a) > 6 mmHg, aclaramiento inadecuado de lactato o signos de circulación clínica no efectiva livideces, relleno capilar <2 segundos, etc.) iniciar o incrementar dobutamina. Considerar determinación de gasto cardiaco por ecocardiografía, catéter en arteria pulmonar (CAP), PiCCO™, etc. El empleo de milrinona o levosimendan en este colectivo no se recomienda en la actualidad salvo en casos extremadamente particulares. En aquellos pacientes que no requirieron intubación endotraqueal y VM invasiva por su enfermedad aguda, considerar esta intervención ante necesidad de dosis elevadas y/o ascendentes de drogas vasoactivas para liberar el consumo excesivo de O2 por los músculos respiratorios. 4. Administración de hemocomponentes En ausencia de isquemia miocárdica aguda, hemorragia activa o cardiopatía isquémica, no transfundir glóbulos rojos salvo frente a valores de hemoglobina <7g/dl con un objetivo de 7-9 g/dl. No transfundir plasma fresco congelado ante trastornos de coagulación sin evidencias de sangrado o en ausencia de procedimientos invasivos planificados. Transfusión de plaquetas: Con valores <10.000/mm3, transfundir en ausencia de sangrado evidente. Con valores <20.000/mm3, transfundir ante riesgo significativo de sangrado. Mantener valores >50.000/mm3 ante sangrado activo, cirugías o procedimientos invasivos. 5. Empleo de hidrocortisona En pacientes en shock con incapacidad de alcanzar estabilidad circulatoria a pesar de adecuada reanimación con fluidos y vasopresores, puede considerarse el empleo de hidrocortisona endovenosa en dosis de 200 mg/día, preferentemente en infusión. No usar test de ACTH para identificar potenciales beneficiarios del empleo de la misma. Anexo: Tratamiento antimicrobiano empírico de sepsis severa y shock séptico en UCI. Este listado no pretende ser una referencia exhaustiva ni reemplazar la consulta en tiempo y forma con el servicio de Infectología en situaciones críticas. Las recomendaciones están primariamente orientadas a eventos sépticos de la comunidad. La condición del huésped y la epidemiología local de la comunidad (como así de las unidades), que se modifica en el tiempo, deben guiar también la selección del antibiótico más apropiado. Las dosis e intervalos de administración de las drogas son considerados para sujetos adultos con funcionalidad renal y/o hepática normales, y deberán ser ajustados según el grado de compromiso orgánico. Salvo información en contrario, las drogas y dosis están referidas a la vía endovenosa. Antimicrobianos empíricos según gérmenes y patrones de multirresistencia (organismos multirresistentes - OMR). Staphylococcus aureus meticilino-resistente (SAMR): vancomicina, linezolid, daptomicina (no emplear esta última en pulmón en tanto es inactivada por el surfactante). Como alternativas y dependiendo de la sensibilidad y foco infeccioso, tigeciclina, clindamicina, trimetoprima/sulfametoxazol (TMS). Enterococo resistente a vancomicina (EVR): linezolid de primera línea; como alternativas y dependiendo de la sensibilidad, daptomicina y tigeciclina; puede eventualmente ser sensible a penicilina o ampicilina. Bacilos gram-negativos ampC positivos (Enterobacter y Citrobacter sp; también puede observarse en Morganella Morgagni, Providencia, Serratia y Proteus sp. indolpositivo): carbapenemes de primera línea. Como alternativas y dependiendo de la sensibilidad, fluoroquinolonas o tigeciclina. Enterobacterias productoras de beta-lactamasas de espectro extendido – BLEE (E. coli, Klebsiella sp; menos frecuentemente Proteus mirabilis, Enterobacter sp): carbapenemes de primera línea (precaución: en Klebsiella sp puede presentarse considerable resistencia a carbapenemes por un mecanismo diferente). Como alternativas y dependiendo de la sensibilidad, fluoroquinolonas o tigeciclina. Klebsiella sp. productora de carbapenemasa (KPC): colistín de primera línea, como alternativas y dependiendo de la sensibilidad fosfomicina o fluoroquinolonas. En pacientes con factores de riesgo y/o antecedentes de colonización por estos microorganismos, la elección del tratamiento antimicrobiano inicial debe estar dirigida por los mecanismos de resistencia y se sugiere fuertemente la consulta con Infectología para ajustar esquema. Factores de riesgo para SAMR: Presencia de catéter venoso central. Presencia de otros dispositivos intravasculares percutáneos. Colonización conocida por SAMR. Hospitalización reciente (dentro de los 3 meses) o actual (<2 semanas). Paciente en cuidado ambulatorio o institucional subagudo, particularmente con rotura de barrera cutánea. Adicción a drogas endovenosas. Tratamiento dialítico. Alergia SEVERA a penicilina (PNC): anafilaxia, síndrome de Stevens Johnson, necrolisis epidérmica tóxica, DRESS, etc. NOTAS sobre alergias en general a penicilina. El 85-90% de los pacientes que reportan reacciones alérgicas nunca fueron alérgicos o tuvieron un evento temprano que resolvieron. En pacientes con un test cutáneo positivo, aproximadamente 2% reaccionarán a una cefalosporina. En pacientes selectivamente alérgicos a amoxicilina o ampicilina, debería evitarse el empleo de cefalosporinas con idéntica cadena lateral grupo R si tienen un test cutáneo positivo para aminopenicilinas (a diferencia de USA, en las poblaciones del sur de Europa hasta un tercio de sujetos alérgicos a amoxicilina están sensibilizados a cadenas laterales grupo R). En pacientes con un test cutáneo positivo, más de un 99% tolerará un tratamiento con carbapenemes. Meropenem ha sido estudiado con particular interés en este aspecto. Aztreonam es el único monobactamo disponible y no hay evidencias de reacción cruzada entre monobactamos y penicilina. ESQUEMAS ANTIMICROBIANOS SUGERIDOS Sepsis sin foco aparente de la comunidad Sin factores de riesgo para Pseudomonas aeruginosa: empleo de ceftriaxone (1 g cada 12 hs.) con agregado de vancomicina - 1 g cada 12 hs. - ante factores de riesgo para SAMR. Factores de riesgo para SAMR: presencia de catéter venoso central, otros dispositivos intravasculares percutáneos, colonización conocida por SAMR, hospitalización reciente (dentro de los 3 meses) o actual (<2 semanas), paciente en cuidado ambulatorio o institucional subagudo, particularmente con rotura de barrera cutánea, adicción a drogas endovenosas, tratamiento dialítico. Con factores de riesgo para Pseudomonas aeruginosa: empleo de cefepime (2 g cada 8 hs.) en lugar de ceftriaxone (con agregado de vancomicina -1 g cada 12 hs-ante factores de riesgo para SAMR). Factores de riesgo para infección bacteriémica a Pseudomonas aeruginosa: inmunodeficiencia severa (trasplante de órgano sólido o médula ósea, neutropenia, quimioterapia reciente -<30 días-SIDA –CD4 <200 células/ml u otras evidencias de SIDA-, tratamiento con altas dosis de esteroides, azatioprina, ciclosporina), tratamiento antibiótico de amplio espectro en los últimos 30 días, presencia de un catéter venoso central o dispositivo urinario, infección asociada a cuidados de la salud. NOTA: Más allá de las consideraciones clásicas para neumonía (ej., enfermedad pulmonar crónica estructural como fibrosis quística o bronquiectasias). Factores de riesgo para SAMR: presencia de catéter venoso central, otros dispositivos intravasculares percutáneos, colonización conocida por SAMR, hospitalización reciente (dentro de los 3 meses) o actual (<2 semanas), paciente en cuidado ambulatorio o institucional subagudo, particularmente con rotura de barrera cutánea, adicción a drogas endovenosas, tratamiento dialítico. NOTAS: En pacientes con antecedentes de colonización por BGN BLEE+ o infecciones recurrentes urinarias o biliares (≥3 en el último año) y en aquellos con sepsis a pesar de tratamiento antibacteriano actual o reciente (dentro de la última semana) de amplio espectro: imipenem (500 mg cada 6 hs) o meropenem (1 g cada 8hs); en pacientes con antecedentes de colonización por Klebsiella productora de carbapenemasas, agregar colistín (100 mg cada 8 hs). Alergia severa a PNC: Considerar riesgo / beneficio del empleo de MEROPENEM (1g cada 8 hs). Con foco sospechado / identificado Neumonía grave de la comunidad: Sin factores de riesgo para P. aeruginosa: terapéutica combinada con ceftriaxone (1 g cada 12 hs) o ampicilina-sulbactam (1,5 g cada 6 hs)+ claritromicina (500 mg cada 12 hs). Con factores de riesgo para P. aeruginosa: terapéutica combinada con cefepime (2 g cada 8-12 hs) o piperacilina/tazobactam (4,5 g cada 6 hs) + levofloxacina (750 mg cada 24 hs) o ciprofloxacina (400 mg cada 12 hs). NOTAS: Alergia severa a PNC: levofloxacina 750 mg cada 24 hs. + aztreonam 2 g cada 8 hs. Considerar riesgo/beneficio del empleo de MEROPENEM (1g q8 hs). Factores de riesgo para Pseudomonas sp. (neumonía): terapéutica esteroidea (>10 mg prednisona cada 24 hs), enfermedad pulmonar estructural (ej., fibrosis quística, bronquiectasias), empleo reciente de antibióticos de amplio espectro > 7 días, neutropenia. Posible NAC –SAMR (con factores de riesgo, neumonías cavitadas o necrotizantes): agregar vancomicina (como alternativa linezolid según consulta con Infectología). No emplear daptomicina. En condiciones epidemiológicas de circulación viral de influenza, agregar oseltamivir 75 mg cada 12 hs. VO/SNG (en ventilación mecánica 150 mg cada 12 hs). Neumonía aspirativa NO emplear ATB profilácticos; la mayoría de los eventos son químicos. La terapéutica inmediata se recomienda para pacientes con obstrucción de intestino o aquellos bajo tratamiento antiácido en virtud de del riesgo aumentado de colonización gástrica, aquellos con síntomas >48 hs. o en pacientes severamente enfermos. Ampicilina-sulbactam (1,5 gr cada 6 hs.) Alternativa: ceftriaxone (1 gr cada 12 hs.) + metronidazol (500 mg cada 6 hs.) o clindamicina (600 mg cada 6 hs.) Sospecha de infección por P.aeruginosa: piperacilina/tazobactam (4,5 gr cada 6 hs.); cefepime (2 gr cada 8-12 hs.) + metronidazol (500 mg cada 6 hs.) o clindamicina (600 mg cada 6 hs.). Alergia severa a PNC: ciprofloxacina (400 g cada 12 hs.) + clindamicina (600 mg cada 6 hs.). Considerar riesgo / beneficio del empleo de MEROPENEM (1g cada 8 hs.). Infecciones graves de piel y partes blandas Pié diabético con sepsis severa / shock séptico: Ciprofloxacina (400 mg cada 12 hs.) + clindamicina (600 mg cada 6 hs.) Alternativa: piperacilina/tazobactam (4,5 g cada 6 hs.) Con factores de riesgo para SAMR: agregar vancomicina (1 g cada 12 hs.). Fascitis necrotizante: el tratamiento empírico es adyuvante de la cirugía de emergencia. Siempre consultar a Infectología. Vancomicina (1 g cada 12 hs)+ piperacilina/tazobactam (4,5 g cada 6 hs.) o cefepime (2 g cada 8-12 hs.) + clindamicina (600 mg cada 6 hs.). Alergia severa a PNC: vancomicina (1 g cada 12 hs.) + ciprofloxacina (400 g cada 12 hs.) + clindamicina (600 mg cada 6 hs.). Considerar riesgo/beneficio del empleo de MEROPENEM (1g cada 8 hs.). UROSEPSIS (infección del tracto urinario -ITU- más SIRS) Ceftriaxone (1g cada 12 hs) o cefepime (2 g cada 8-12 hs.) Alergia severa a PNC: ciprofloxacina (400 mg cada 12 hs) o aztreonam (2 g cada 8 hs.) + gentamicina (3-5 mg / kg cada 24 hs.). Considerar riesgo / beneficio del empleo de MEROPENEM (1 g cada 8 hs.). Manejo de pacientes con sonda vesical: retirar el catéter siempre que sea posible Infecciones del tracto biliar (colecistitis y/o colangitis) Piperacilina/tazobactam (4,5 g cada 6 hs.) Alternativa: ampicilina-sulbactam (3 g cada 6 hs.) + ciprofloxacina (400 mg cada 12 hs.) Alergia severa a PNC: ciprofloxacina (400 mg cada 12 hs.) o aztreonam (2 g cada 8 hs.) + metronidazol (500 mg cada 6 hs.) +/- vancomicina (1 g cada 12 hs.). Considerar riesgo / beneficio del empleo de MEROPENEM (1g cada 8 hs.). Peritonitis primaria Ceftriaxone (1 g cada 12 hs.); empleo concomitante de albúmina (1,5 g/kg y nueva dosis de 1 g/kg en día 3), de forma mandatoria con bilirrubina > 4 mg/dl o creatinina > 1 g/dl. Alergia severa a PNC: levofloxacina (750 mg cada 24 hs.) o ciprofloxacina (400 mg cada 12 hs.) con consulta inmediata a Infectología para aquellos en fluoroquinolonas para profilaxis primaria. Considerar riesgo / beneficio del empleo de MEROPENEM (1g cada 8 hs.). Peritonitis secundaria/perforación tracto gastrointestinal Ceftriaxone (1 g cada 12 hs.) + metronidazol (500 mg cada 6 hs.). Alternativas: ampicilina-sulbactam (3 g cada 6 hs.) + ciprofloxacina (400 mg cada 12 hs.); piperacilina / tazobactam (4,5 g cada 6 hs.). Alergia severa a PNC: ciprofloxacina (400 mg cada 12 hs.) o aztreonam (2 g cada 8 hs.) + metronidazol + vancomicina. Considerar riesgo/beneficio del empleo de MEROPENEM (1 g cada 8 hs.). El tratamiento antifúngico empírico no está generalmente indicado para perforaciones GI salvo que el paciente presente factores de riesgo: perforación esofágica, inmunosupresión, terapéutica antiácida prolongada, hospitalización prolongada, fístula GI persistente. En pacientes que no han recibido tratamiento previo prolongado con azólicos, sin aislamiento previo de C. glabrata o kruzei, empleo de fluconazol (primera dosis 800 mg IV, luego 400 mg cada 24 hs.). En caso contrario, caspofungin (primera dosis 70 mg IV, luego 50 mg cada 24 hs.) o variantes de anfotericina (anfotericina desoxicolato 0,5-1 mg/kg o anfotericina en dispersión coloidal 3-5 mg/kg o anfotericina liposomal 3-5 mg/kg cada 24 hs.) con consulta con Infectología. Peritonitis terciaria: Según rescates previos, colonizaciones y antibióticos previos. Consulta con Infectología. Infección por Clostridium difficile, complicada severa (hipotensión, íleo, megacolon tóxico o pancolitis en TC, perforación, necesidad de colectomía): Vancomicina 500 mg cada 6 hs. VO/SNG + metronidazol 500 mg cada 8 hs. IV. Imposibilidad de tolerar terapéutica oral o íleo completo: vancomicina 500 mg en 500 ml de solución salina 0,9% como enema de retención por sonda Foley en recto cada 6 hs. + metronidazol 500 mg cada 8 hs. IV. Meningitis en adultos Inmunocompetente: ceftriaxone (2 g cada 12 hs.) Inmunocomprometidos o > 50 años o alcoholismo: ceftriaxone (2 g cada 12 hs.) + ampicilina (2 g cada 4 hs.). Uso de dexametasona adyuvante (ante sospecha de neumococo, condición observada en la mayoría de los pacientes adultos): Dosis: 0,15 mg/kg cada 6 hs. por 2-4 días. La primera dosis debe ser administrada 10-20 minutos antes o concomitante con la primera dosis de ATB. NOTAS: Ante sospecha de neumococo resistente, agregar vancomicina al esquema terapéutico. Alergia severa a PNC: considerar riesgo/beneficio del empleo de MEROPENEM (1 g cada 8 hs.). Encefalitis por virus herpes (vhs, vvz) Aciclovir 10 mg/kg cada 8 hs. Infecciones bacteriémicas asociadas a catéteres venosos centrales (cvc) Vancomicina (1 g cada 12 hs.) + cefepime (2 g cada 8 hs.) o imipenem (500 mg cada 6 hs.) o meropenem (1 g cada 8 hs.). Alergia severa a PNC: vancomicina (1 g cada 12 hs.) + ciprofloxacina (400 mg cada 12 hs.) o aztreonam (2 g cada 8 hs.) +/- amikacina (15 mg/kg cada 24 hs.). Considerar riesgo/beneficio del empleo de MEROPENEM (1g cada 8 hs.). Neutropenia febril: fiebre inicial Cefepime (2 g cada 8 hs.) o piperacilina/tazobactam (4,5 cada 6 hs.) +/- vancomicina (1 g cada 12 hs.) (*) Alergia severa a PNC: vancomicina (1 g cada 12 hs.) + aztreonam (2 g cada 8 hs.) + amikacina (15 mg/kg cada 24 hs.). Consulta urgente con Infectología Y EVALUAR EMPLEO DE MEROPENEM. (*) Indicaciones de vancomicina: bacteriemia asociada a CVC sospechada, infección de piel y partes blandas, neumonía, severa mucositis oral o faríngea, historia de colonización o infección por SAMR. Lecturas sugeridas: Arnold RC, Shapiro NH, Jones AE, Schorr C, Pope J. Multicenter study of early lactate clearance as a determinant of survival in patients with presumed sepsis. Shock 2009; 32: 35-39. Boyd JH, Forbes J, Nakada T, Walley KR, Russell JA. Fluid resuscitation in septic shock: A positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med 2011; 39:259 –265. Cannesson M, Le Manach Y, Hofer CK, Goarin JP, Lehot J-J, et al. Assessing the diagnostic accuracy of pulse pressure variations for the prediction of fluid responsiveness. A “gray zone” approach. Anesthesiology 2011; 115:231–41 Cuschieri J, Rivers EP, Donnino MW, Katilius M, Jacobsen G, Nguyen HB, Pamukov N, Horst M. Central venous-arterial carbon dioxide difference as an indicator of cardiac index. Intensive Care Med 2005; 31:818–822. Jones AE, Shapiro NI, Trzeciak S, Arnold RC, Claremont HA, Kline JA, MD Lactate clearance vs central venous oxygen saturation as goals of early sepsis therapy. A randomized clinical trial. JAMA. 2010; 303: 739-746. Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006; 34:1589–1596. Le Manach Y, Hofer CK, Lehot JJ, Vallet B, Goarin JP, Tavernier B, Cannesson M. Can changes in arterial pressure be used to detect changes in cardiac output during volume expansion in the perioperative period? Anesthesiology. 2012; 117:1165-1174. Marik PM, Baram M, Vahid B. Does central venous pressure predict fluid responsiveness? A systematic review of the literature and the tale of seven mares. CHEST 2008; 134:172–178. Monnet X, Bataille A, Magalhaes E, Barrois J, Le Corre M, Gosset C, Guerin L, Richard C, Teboul JL. End-tidal carbon dioxide is better than arterial pressure for predicting volume responsiveness by the passive leg raising test. Intensive Care Med 2013; 39: 93-100. Monnet X, Teboul J-L. Hemodynamic management of cardiovascular failure by using PCO2 venous-arterial difference. J Clin Monit Comput. 2012; 26: 367-374. Monnet X, Teboul J-L. Passive leg raising. Intensive Care Med 2008; 34:659–663. Monnet X, Teboul J-L. Volume responsiveness. Curr Opin Crit Care 2007; 13: 549–553. Morelli A, De Castro S, Teboul JL, Singer M, Rocco M, Conti G, De Luca L, Di Angelantonio E, Orecchioni A, Pandian NG, Pietropaoli P. Effects of levosimendan on systemic and regional hemodynamics in septic myocardial depression. Intensive Care Med 2005;31: 638-644. Morelli A, Donati A, Ertmer C, Rehberg S, Lange M, Orecchioni A, Cecchini V, Landoni G, Pelaia P, Pietropaoli P, Van Aken H, Teboul JL, Ince C, Westphal M. Levosimendan for resuscitating the microcirculation in patients with septic shock: a randomized controlled study. Crit Care. 2010;14(6):R232. doi: 10.1186/cc9387. Muller L, Toumi M, Bousquet PJ, Riu-Poulenc B, Louart G, Candela D, Zoric L, Suehs. C, de La Coussaye JE, Molinari N, Lefrant JY; AzuRéa Group. An increase in aortic blood flow after an infusion of 100 ml colloid over 1 minute can predict fluid responsiveness: the mini-fluid challenge study. Anesthesiology 2011; 115:541-7. Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, Peterson E, Tomlanovich M. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345:1368-1377. Schmittinger CA, Dünser MW, Haller M, Ulmer H, Luckner G, Torgersen C, Jochberger S, Hasibeder WR. Combined milrinone and enteral metoprolol therapy in patients with septic myocardial depression. Crit Care. 2008; 12(4):R99. doi: 10.1186/cc6976. Surviving Sepsis Campaign website. http://www.survivingsepsis.org. Acceso en mayo 20, 2013. Vallée F, Vallet F, Mathe O, Parraguette J, Mari A, Silva S, Samii K, Fourcade O, Genestal M. Central venous-to-arterial carbon dioxide difference: an additional target for goal-directed therapy in septic shock? Intensive Care Med 2008; 34: 2218-2225. Vieillard-Baron A, Caille V, Charron V, Belliard G, Page B, Jardin F. Actual incidence of global left ventricular hypokinesia in adult septic shock. Crit Care Med 2008; 36:1701– 1706. Vieillard-Baron A, Jardin F. Ultrasonographic examination of the venae cavae. Intensive Care Med 2006; 32: 203–206.