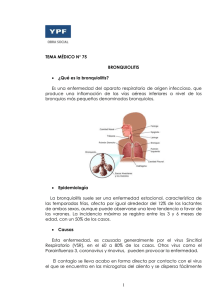
IL-4, IL-5, IL-1β, IL-8, TNF-α EN PACIENTES CON
Anuncio

REPÚBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS DIVISIÓN DE ESTUDIOS PARA GRADUADOS MAESTRÍA EN BIOLOGÍA – MENCIÓN INMUNOLOGÍA BÁSICA IL-4, IL-5, IL-1β, IL-8, TNF-α EN PACIENTES CON INFECCION AGUDA POR VIRUS SINCICIAL RESPIRATORIO TRABAJO DE GRADO PRESENTADO PARA OPTAR AL GRADO DE MAGISTER SCIENTARUM EN BIOLOGÍA-MENCIÓN INMUNOLOGÍA BÁSICA AUTOR: ALIBETH ROSSANNA MAVAREZ MONTES C. I. 14.090.681 TUTORA: Dra. NEREIDA VALERO C. I. 8.491.958 MARACAIBO, SEPTIEMBRE DE 2008 REPÚBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS DIVISIÓN DE ESTUDIOS PARA GRADUADOS MAESTRÍA EN BIOLOGÍA – MENCIÓN INMUNOLOGÍA BÁSICA IL-4, IL-5, IL-1β, IL-8, TNF-α EN PACIENTES CON INFECCIÓN AGUDA POR VIRUS SINCICIAL RESPIRATORIO ………………………………………………………………………………………………… Trabajo de Grado presentado para Optar al Grado de Magíster Scientarum en Biología - Mención Inmunología Básica AUTOR: Alibeth Rossanna Mavárez Montes C. I. 14.090.681 TUTORA: Dra. Nereida Valero C. I. 8.491.958 Maracaibo, Septiembre de 2008 ii IL-4, IL-5, IL-1β, IL-8, TNF-α EN PACIENTES CON INFECCIÓN AGUDA POR VIRUS SINCICIAL RESPIRATORIO ____________________________________ Lcda. Mavárez Montes, Alibeth Rossanna C. I. 14.090.681 Dirección: Residencias Las Islas, casa Nº 17, Av. 18C con calle 106A, Parroquia Cristo de Aranza, Municipio Maracaibo, Estado Zulia. Teléfono: 0261-7697794 Móvil: 0424-6143013 Correo electrónico: [email protected] ___________________________________ Tutora: MgSc. Nereida Valero C. I. 8.491.958 iii VEREDICTO Este Jurado, nombrado por el Consejo Técnico de la División de Estudios para Graduados de la Facultad Experimental de Ciencias de la Universidad del Zulia, aprueba el Trabajo de Grado titulado “IL-4, IL-5, IL-1β, IL-8, TNF-α EN PACIENTES CON INFECCIÓN AGUDA POR VIRUS SINCICIAL RESPIRATORIO”, que la Lcda. Alibeth Rossanna Mavárez Montes C. I. 14.090.681 presenta ante este Consejo para optar al grado de MAGISTER SCIENTIARIUM EN BIOLOGÍA – MENCIÓN INMUNOLOGÍA BÁSICA. Jurado: _________________________ MgSc. Nola Montiel Jurado _________________________ Dr. Héctor Pons Jurado _________________________ MgSc. Jorge Guiñes Jurado Maracaibo, Septiembre 2008 iv DEDICATORIA A ti Dios por dar la oportunidad de vivir, a mis padres Omaira y Aly por estar conmigo en todo momento y uds mi rey y mi reina por ser los mas hermoso que ha llegado a mí vida los amos. v AGRADECIMIENTOS - Principalmente a Dios por ser quien guía mis pasos, aportándome la fuerza, que necesito para poder trazar todas las metas que me he propuesto. - A la Dra. Nereida Valero por brindarme sus conocimientos, orientación e incentivar en mi el espíritu de investigador, así como también por ofrecerme su apoyo en los buenos y malos momento, entregándome su amistad incondicional. - A la Universidad del Zulia, Facultad Experimental de Ciencia, División de Estudios para Graduados por permitirme ingresar a sus aulas, y así poder adquirir nuevos conocimientos. - Al M.C José Hernández por ser un hombre con gran espíritu de superación, mi consejero en los momentos que más lo necesito, y por ser el mejor esposo que puede haber en el mundo. Te amo Rey. - A la Dra. Yraima Larreal por contar con sus consejos en todo momento. - A la MgSc. MeryBell Maldonado por toda su amistad, contribución, y orientación otorgada para la elaboración de este trabajo. - Al personal de la Sección de Virología del Instituto de Investigaciones Clínica por toda su ayuda y colaboración especialmente a la MgSc Luz Marina Espina. - A mi compañera Lcda. Jennifer Gotera por brindarme su amistad y por compartir conmigo todos esos momentos duros, dándome el apoyo que necesario para no desfallecer. vi - A udes papi y mami por darme la vida, amor, confianza y apoyarme en todo momento, los amo. - A mi reina pequeña Emily Sofía por regalar el don de ser madre y haber llegado en el mejor momento de mi vida, para brindarme la sonrisa que día a día alegre mi vida, eres lo más gran que puedo tener. - A Mairaly y Aly Javier por ser los mejores hermanos que se puedan tener. - A mis niños Gilberto y Gilary por llenarme de alegría, ternura y amor, su tía linda los ama. - A mi suegra por se otra madre para mi, apoyándome en esta meta trazada. - A mis amigos los MgSc. Yenddy, Alegría, Ricardo y al futuro MgSc. Jhon por su amistad incondicional y por su ayuda en lo momentos necesarios. - A todos mis compañeros de clases por su cariño y amistad. - A los Dres. Betulio Chacín, Dagoberto Bermúdez y Francisco Arocha, por la colaboración prestada para la toma de los muestras. - Al personal del Hospital General del Sur, Policlínica Maracaibo, Falcón y a los pacientes por permitir la toma de las muestras para la realización de este proyecto. - A FONACIT por depositar su confianza en mi, por otórgame la beca para la realización de mis estudios. - Al CONDES por el financiamiento de este proyecto. vii INDICE DE CONTENIDO pág. PRESENTACION………………………………………………………………….... i FRONTISPICIO……………………………………………………………………... ii VEREDICTO………………………………………………………………………… iii DEDICATORIA……………………………………………………………………… iv AGRADECIMIENTOS……………………………………………………………… v INDICE DE CONTENIDO………………………………………………………….. vii INDICE DE FIGURAS………………………..…………………………………….. ix INDICE DE TABLAS……………………………………………………………….. xi RESUMEN…………………………………………………………………………… xii ABSTRAC……………………………………………………………………………. xiii ABREVIATURAS……………………………………………………………………. xiv I. INTRODUCCION……………………………………………………………… 1 II. OBJETIVOS…………………………………………………………………... 6 III. MATERIALES Y METODOS……………………………………………….. 7 Población estudiada ……………………………………………………………… 7 Toma de Muestra…………………………………………………………………… 7 Recolección de las muestras……………………………………………………… 7 Aislamiento e Identificación del virus por Inmunofluorescencia……………….. 9 Cultivo e Infección de Monocitos………………………………………………….. 10 Determinación de proteínas……………………………………………………….. 11 Cuantificación de IL-4, IL-5, IL-1β, IL-8, TNF-α en muestra de suero, sobrenandantes de cultivo de monocitos infectados y en células Hep-2…….. 11 viii Cuantificación de IgE sérica……………………………………………………….. 12 Cuantificación de IgG anti-VSR por el método de Inmunofluorescencia Indirecta……………………………………………………………………………… 12 Análisis Estadístico…………………………………………………………………. 13 IV. RESULTADOS………………………………………………………………. 14 Estudios séricos.…………………………………………………………. 14 Estudios en cultivos …..…………………………………………………. 23 V. DISCUSIÓN…………………………………………………………………... 27 VI. CONCLUSIONES…………………………………………………………… 32 BIBLIOGRAFÍA……………………………………………………………………... 33 ANEXOS……………………………………………………………………………... 40 ix INDICE DE FIGURAS pág. Fig. 1.- Distribución de la población estudiada con infección respiratoria aguda (IRA) por Virus Sincicial Respiratorio. 14 Fig. 2.- Concentraciones séricas de IL-4 en pacientes con infección respiratoria aguda por VSR. 14 Fig. 3.- Concentraciones séricas de IL-4 en pacientes con Infección Respiratoria Aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad. 15 Fig. 4.- Concentraciones séricas de IL-5 en pacientes con infección respiratoria aguda por VSR. 16 Fig. 5.- Concentraciones séricas de IL-5 en pacientes con Infección Respiratoria Aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad 16 Fig. 6.- Concentraciones séricas de IL-1 β en pacientes con infección respiratoria aguda por VSR. 17 Fig. 7.- Concentraciones séricas de IL-1β en pacientes con Infección Respiratoria Aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad" 18 Fig. 8.- Concentraciones séricas de IL-8 en pacientes con infección respiratoria aguda por VSR. 18 Fig. 9.- Concentraciones séricas de IL-8 en pacientes con Infección Respiratoria Aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad. 19 x 19 Fig.10.- Concentraciones séricas de TNF-α en pacientes con infección respiratoria aguda por VSR. Fig.11.- Concentraciones séricas de TNF-α en pacientes con Infección Respiratoria Aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad. 20 Fig.12.- Concentraciones séricas IgE en pacientes con infección respiratoria aguda por VSR. 21 Fig.13.- Concentraciones séricas de IgE en pacientes con Infección Respiratoria Aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad. 21 Fig.14.- Relación de IL-5 y eosinofilia en sérica de pacientes con infección respiratoria aguda por VSR. 23 Fig.15.- Concentraciones de IL-4 en sobrenadantes de cultivo de monocitos humanos y HEp-2 infectados con VSR. 24 Fig.16.- Concentraciones de IL-5 en sobrenadantes de cultivo de monocitos humanos y HEp-2 infectados con VSR. 24 Fig.17.- Concentraciones de IL-1β en sobrenadantes de cultivo de monocitos humanos y HEp-2 infectados con VSR. 25 Fig.18.- Concentraciones de IL-8 en sobrenadantes de cultivo de monocitos humanos y HEp-2 infectados con VSR. 26 Fig.19.- Concentraciones de TNF-α en sobrenadantes de cultivo de monocitos humanos y HEp-2 infectados con VSR. 26 xi INDICE DE TABLA Tabla I.- Niveles séricos de citocinas y los grupos de estudio con infección 22 respiratoria aguda. xii Mavárez Montes, Alibeth Rossanna. “IL-4, IL-5, IL-1β, IL-8, TNF-α EN PACIENTES CON INFECCION AGUDA POR VIRUS SINCICIAL RESPIRATORIO” Trabajo presentado para optar al grado de Magister Scientarum en Biología, Mención Inmunología Básica. Universidad del Zulia. Facultad Experimental de Ciencias. División de Estudios para Graduados. Maestría en Biología, Mención Inmunología Básica. Maracaibo. Estado Zulia, Venezuela. 2008. 40p. RESUMEN El virus sincicial respiratorio (VSR) es el principal patógeno en niños y la primera causa de enfermedad en lactantes. Dada la importancia de la participación de la inmunidad celular en la limitación de la enfermedad por VSR, se sugiere que es probable que la reducción de células TH1 y TH2 juega un papel importante en la susceptibilidad a bronquiolitis por VSR. Se planteó como objetivo determinar las concentraciones de IL-4, IL-5, IL-1β, IL-8 y TNF-α en pacientes con infección aguda por VSR, y el papel que pueden desempeñar estos factores solubles, así como la IgE total, IgG anti-VSR y la eosinofilia en la severidad de la enfermedad. Se seleccionaron 35 pacientes sin distingo de edad y sexo con diagnóstico clínico de infección respiratoria aguda (IRA) alta o baja. Se recolectaron muestras del tracto respiratorio, sangre con o sin anticoagulante de los pacientes y de 10 individuos sanos como grupo control. Se utilizó cultivo de células Hep-2 para el aislamiento e identificación del VSR por la técnica de Inmunofluorescencia Directa. La determinación de citocinas se realizó por la técnica de ELISA, tanto en suero, cultivo de monocitos y en células HEp-2 a las 24 horas pi. En los niveles séricos se evidenció un aumento marcado (p<0,05) de todos estos factores solubles en los pacientes con infección por VSR al compararlo con el grupo control, pero solo resulto diferente (p<0,05) a los pacientes negativos al virus en la determinación de IL-1β, IL-8 e IgE. Según el grado de severidad de la enfermedad se observó un aumento (p<0,01) en los pacientes infectados por VSR grado moderado y severo con respecto al control y a los no infectados por VSR, sugiriendo una respuesta inmunitaria mas grave debido al proceso inflamatorio generado, mientras que en los cultivos HEp-2 solo se incremento la IL-4. En los cultivos de monocitos no se observaron diferencias en cuanto a las citocinas ensayadas y la presencia del virus. Estos resultados sugieren una acción relevante de IL-8 e IgE implicada en la patogénesis por VSR y así como un aumento importante la citocinas IL-4, IL-5 relacionada a la infección grave causada por este virus. Palabras Claves: VSR, IRA, TH2, citocinas proinflamatorias Correo Electrónico: [email protected] xiii Mavárez Montes, Alibeth Rossanna. “IL-4, IL5, IL-1β, IL-8, TNF-α IN PATIENTS WITH ACUTE INFECTION BY RESPIRATORY SINCYTIAL VIRUS” Trabajo presentado para optar al grado de Magister Scientarum en Biología, Mención Inmunología Básica. Universidad del Zulia. Facultad Experimental de Ciencias. División de Estudios para Graduados. Maestría en Biología, Mención Inmunología Básica. Maracaibo. Estado Zulia, Venezuela. 2008. 40p. ABSTRACT The respiratory sincytial virus (RSV) is the main pathogen in children and the first cause of inferior respiratory tract disease in infants since, cellular immunity plays an important role in the resolution of RSV disease, probability decrease of TH1 and TH2 cells. Could be important in the susceptibility to VSR broncholitis. Therefore, the aim of this study was to determine the serum content of IL-4, IL-5, IL-1β, IL-8, and TNF-α IgE, anti-RSV IgG and eosinophlia in patients with acute infection and to stablish the relation of those parameters with the severity of the disease. Thirty five patients with high or low acute respiratory infection of any age and sex were selected. Ten normal individuals were used as control. Samples from respiratory tract and blood (with and without anticoagulants) were obtained. HEp-2 cell cultures were used to isolated and identified RSV. Identification was performed by direct imnunofluorescence. Cytokines were determined in 24 hours post infection monocyte and HEp-2 and serum ELISA. Increased content of serum factors were increased (p<0.05) in RSV infected patients when compared to control, however, only IL-1β and IL-8. And IgG were significantly increased (p<0,05) when compared to acute infection patients without RSV infection. Mild and severe forms of RSV infection show higher value (p<0.01) when compared to control and acute infection was observed in patients whithour RSV infection, suggesting higher immune response related with the severity of the disease. Only increased content of IL-4 was observed in HEp-2 cultures. There were not significant differences in monocyte cultures related to cytokine and virus content. These results suggest an important role of IL-4, IL.5, IL-8 and IgG in the respiratory infection by RSV. Key Words: RSV, IRA, TH2, proinflammatory cytokines E-MAIL: [email protected] xiv LISTA DE ABREVIATURAS CMN: Células mononucleares ELISA: Ensayo de Inmunoabsorción Enzimática IRA: Infección Respiratória IL-: Interleucina IFD: Inmunofluorescencia Directa IFI: Inmunofluorescencia Indirecta IFN: Interferón GM-CSF: Factor estimulador de colonia granulocítico-macrofágico LBA: Lavado Bronqueoalveolar PI: Post infección TNF: Factor de Necrosis Tumoral TMB: Tetrametilbencidina VSR: Vírus Sincicial Respiratório INTRODUCIÓN Las infecciones respiratorias agudas (IRA) son enfermedades con evolución menor a 15 días, siendo la más grave de ellas, la neumonía. Las IRA constituyen un importante problema de salud pública y entre los agentes etiológicos involucrados principalmente se encuentran los virus, causando morbilidad a cualquier edad; no obstante, los casos más severos se presentan en lactantes y en la población mayor de 60 años y los virus implicados son el Virus Sincicial Respiratorio (VSR), Parainfluenza y Adenovirus (Rosete y col., 2002; Aristizábal, 2008). En Venezuela, las IRA representan un problema de salud pública relevante y son consideradas la principal causa de morbimortalidad en niños menores de 5 años. Según el Ministerio del Poder Popular para la Salud, ocupa la primera causa entre las enfermedades de denuncia obligatoria y es uno de los principales motivos de consulta en atención primaria en salud (Boletín Epidemiológico, 2006) El VSR, pertenece a la familia Paramixoviridae y al género pneumovirus (Fenner, 1976). Éste presenta un tamaño de 80nm-120nm siendo más pequeño que el resto de los paramixovirus. Su nucleocápside mide de 11-15 nm. Su ARN es monocatenario, no segmentado y codifica para 10 proteínas (Cane y col., 1995). Presenta dos subtipos serológicos (A y B) y 2 glicoproteínas de superficie, la G (mediadora de la adherencia del virus a la superficie respiratoria) que estimula una respuesta inmunitaria tipo TH2 y la F (funde las membranas del virus a la célula huésped) y estimula una respuesta tipo TH1 (Tristam y col., 1999, Melnick., 1999; Sullender, 2000; Picazo, 2002; Lemanske, 2003). La población en riesgo de padecer la infección por VSR son los niños que se encuentran en guarderías, hacinamiento y en mayor frecuencia cuando son prematuros, o presentan cardiopatía congénita, hipertensión pulmonar, displasia broncopulmonar, neuropatía crónica, fibrosis quística, inmunodeficiencia y enfermedad metabólica o neurológica (Doménech, 2004). La transmisión del VSR se da fácilmente a través del contacto de persona a persona, por medio de la dispersión de partículas o gotitas al toser, estornudar o hablar, por contacto con el material infeccioso depositado en ropa de cama, cunas y manos contaminadas, ocasionando autoinfecciones vía nasal u ocular. El período de incubación es aproximadamente de 3 a 6 días, la excreción del virus puede durar 2 semanas o más en niños y menos tiempo en adultos (Boletín Epidemiológico del Ministerio de Salud de Nicaragua; Mandell y col., 1999). Al inicio de la enfermedad el virus se replica en nasofaringe, alcanzando títulos VSR altos como 1x106 DI/ml en cultivo de tejidos de secreción nasal. La adherencia del virus a las células del tracto respiratorio superior se produce por la unión de la glicoproteína G con el receptor de la célula huésped, probablemente un glucosaminoglicano tipo heparina, seguido de la fusión de la envoltura viral con la membrana celular (mediada por la glicoproteína F) y de la penetración de la nucleocapside en el citoplasma (Falsey y Walsh., 2000). En condiciones normales, las dos ramas de la inmunidad mantienen un perfecto equilibrio. Existe un balance entre la inmunidad innata, que se caracteriza por su respuesta inmediata en reconocer y eliminar al agente extraño mediante una serie de mediadores no específicos, y la adaptativa caracterizada porque además del reconocimiento inmunitario y eliminación efectiva del patógeno, induce la formación de células específicas de memoria. La respuesta inflamatoria a la infección por VSR se inicia probablemente en las células del epitelio respiratorio. Estas células producen una serie de citocinas y quimiocinas en respuesta a las infecciones virales (Welliver, 2000). La inmunidad adquirida producida por VSR es parcialmente eficaz, por lo que las reinfecciones son comunes, sin embargo después de la primera exposición es poco frecuente la enfermedad grave. La protección y recuperación de la enfermedad son mediadas principalmente por el sistema inmunitario del huésped. Los anticuerpos secretorios, los séricos, los linfocitos T citotóxicos dependientes del complejo mayor de histocompatibilidad clase I, y en los lactantes menores, los anticuerpos maternos, sirven como efectores específicos (Mandell y col., 2002; Domachowske y Rosenberg., 1999). Cuando existe infección por VSR se produce un desequilibrio entre ambas ramas de la inmunidad: la inmunidad innata a través de la producción de mediadores proinflamatorios y el reclutamiento de neutrófilos, eosinófilos y monocitos en la vía respiratoria, y la adaptativa gracias a una respuesta celular excesiva de linfocitos T CD8+ y producción por parte de los linfocitos T CD4+ de citocinas TH1 y TH2 que llevan a la producción de inflamación pulmonar, bronquiolitis y sibilancias recurrentes (Lemanske, 2003; Mejías y col., 2004). Krishnam y col., 2003), realizaron un estudio donde determinaron que la inmunorespuesta que puede darse en niños, cuando son infectados por primera vez por VSR, probablemente el virus este contribuye a la severidad de la enfermedad en tres fases posibles: una inmunorespuesta natural, una respuesta adaptativa escasa, o una respuesta adaptativa polarizada en la dirección TH2. Una vez iniciada la respuesta inmunitaria, los linfocitos T cooperadores son activados generando una respuesta adaptativa de tipo TH1 o TH2. La producción temprana de interferón gamma (IFN-γ) es la clave para que se presente una respuesta predominante TH1, mientras que una baja producción de IFN-γ se asocia con una respuesta TH2 predominante con eosinofilia pulmonar persistente (Openshaw, 2002). Algunos estudios muestran que en pacientes con infección por VSR se produce una activación predominante de linfocitos de tipo TH2 (Roman y col., 1997). En esta respuesta participan una serie de citocinas, las cuales son proteínas que regulan la función de las células que las producen u otros tipos celulares. Son los agentes responsables de la comunicación intercelular, inducen la activación de receptores específicos de membrana, funciones de proliferación y diferenciación celular, quimiotaxis, crecimiento y modulación de la secreción de inmunoglobulinas. Las personas con bronquiolitis por VSR producen citocinas como la interleucina (IL-1), factor de necrosis tumoral alpha (TNF-α), IL-6 e IL-8. En respuesta a las citocinas, se produce una infiltración de células inflamatorias, predominantemente neutrófilos (Openshaw, 2002), también la IL-4 e IL-5 son secretadas en respuesta a la infección del virus. La síntesis de IgE por los linfocitos B depende de la IL-4, y esta se incrementa por la acción de IL-5, IL-6 e IL-13 (Kiniwa y col., 1992; Del Prete y col., 1998; Punnonen y col., 1993). La IL-4 e IL-5 juegan un papel relevante en la eosinofilia que acompaña a la inflamación de las vías aéreas (Clutterbuck y col., 1989 y 1990). Las citocinas proinflamatorias como la IL-1β, IL-6, IL-11, TNF-α y factor estimulador de colonia granulocítico-macrofágico (GM-CSF) son liberados por una gran variedad de células entre las que se encuentran incluidos los macrófagos y células epiteliales y están implicadas en la amplificación de la respuesta inflamatoria, el TNF-α se haya implicado especialmente en las reacciones asmáticas (Lorente, 2001). Por otro lado la infección por VSR activa una serie de quimiocinas como la IL-8 que promueve el reclutamiento de neutrófilos y eosinófilos, responsables en parte del proceso inflamatorio. Estudios con expectoración de pacientes sugieren un papel importante de esta quimiocina en las exacerbaciones de asma (Laham y col., 2004; Gern y col., 2002; Oh y col., 2002), y es producida por células epiteliales de la mucosa nasal en cultivo, donde promueven la supervivencia de los eosinófilos (Mullol y col., 1995 y Noah y col., 2000). En investigaciones sobre la patogénesis de la enfermedad producida por VSR, se ha demostrado una relación entre polimorfismo de nucleótidos en la secuencia del gen de la IL-8. Este polimorfismo se asocia a la producción creciente de IL-8, que es un potente quimioatrayente de neutrófilos, además se ha demostrado que ocurre con mayor frecuencia en niños con bronquiolitis por VSR, en los cuales se han encontrado niveles plasmáticos de IL-8 incrementados asociados a enfermedad severa, y con predominio de neutrófilos (Roche y col., 2003). También se ha demostrado que concentraciones de IL-8 y de RANTES en secreciones respiratorias de infantes con bronquiolitis se correlacionan con el número de leucocitos presentes en las mismas, indicando que estas quimiocinas pueden ser responsables de la infiltración del leucocito en la vía aérea durante la infección por VSR (McNamara y col., 2005; Brandenburg y col., 2001; Hull y col., 2000). La inmunidad natural producida por este virus ha sido demostrada por el incremento de TNF-α, IL-1β, IL-6 e IL-8 en lavados nasales de infantes durante la infección activa (Noah y col., 1995); quizás lo más importante para la clasificación de éste, sea esclarecer la asociación entre la naturaleza temporal y el grado de variabilidad de la inmunidad mediada por células (Van Schaik y col., 1999, De Weerd y col., 1998 así mismo como la desviación o deficiencia de la misma (Brandenburg y col., 2000, Bendelja y col., 2000), que en la vida temprana es transitoria, todos estas alternativas se han ofrecido como sugerencias para explicar la variabilidad en la severidad de la enfermedad (Aberle y col, 1999). Dada la importancia de la participación de la inmunidad celular en la limitación de la enfermedad por VSR en la infección temprana (0penshaw y col., 1992), algunos autores sugieren que es ampliamente probable que la reducción de la células de tipo TH, tanto TH1 como TH2 durante la infancia, juega un papel importante en la susceptibilidad a bronquiolitis después de la infección por VSR. Se ha señalado que el balance en la producción de citocinas/quimiocinas TH1 frente a TH2 podría relacionarse con la gravedad de la infección (Mejías y col., 2004). Las células HEp-2 se obtuvo en 1952 a partir (carcinoma laríngeo humano) son virus-permisivas, corresponde al primer tipo de cultivo, con las que se puede identificar la presencia del VSR al observar un efecto citopático (ECP) que se origina en las células infectadas, este ECP es característico del virus y consiste en la formación de sincicios reconocidos como células gigantes multinucleadas, (Archundia, 2000). Algunas investigaciones realizadas en el modelo múrido como en humanos han evidenciado que la proteína G del VSR estimula la respuesta TH2 (Aberle y col., 1999), mientras que la proteína F estimula la respuesta TH1 (Van Schaik y col., 1999) lo que aparentemente explica la variación de los síntomas producidos por VSR en el trato respiratorio inferior. Sin embargo, ciertos resultados han creado dudas sobre el patrón de citocinas que el virus estimula; así algunos autores sugieren que el patrón de citocinas predominante durante la infección por VSR es TH1, otros que es TH2, o bien que estimula a ambas (Roman y col., 1997; Van Schaik y col., 1999). La razón que ha motivado la realización de la presente investigación responde al hecho de que hasta ahora existen contradicciones relacionadas a la respuesta inmunitaria inducida por el virus, la caracterización de la respuesta inmunitaria frente a VSR en los pacientes con IRA, pudiera ser utilizada como marcador diagnóstico en la severidad de la enfermedad, así como también para el diseño de estrategias de tratamiento para este tipo de afecciones y aportar evidencias en el mecanismo inmunopatogénico del VSR cuando se presente las IRA y así fomentar los esfuerzos para disminuir estas infecciones en nuestro país. OBJETIVOS OBJETIVO GENERAL Determinar IL-4, IL-5, IL-1β, IL-8 y TNF-α en pacientes con infección aguda por Virus Sincicial Respiratorio (VSR). OBJETIVOS ESPECÍFICOS Aislar e identificar el VSR en cultivos de células HEp-2 a partir muestras del tracto respiratorio (lavado nasofaríngeo, exudado faríngeo, hisopado nasal, o lavado bronqueoalveolar) de pacientes con infección respiratoria aguda (IRA). Determinar la concentración sérica de IgE total e IgG anti VSR en muestras de pacientes con infección respiratoria y en individuos controles. Cuantificar citocinas TH2 (IL-4 e IL-5) y proinflamatorias (IL-1β, IL-8 y TNF-α) en sobrenandantes de cultivo (monocitos normales y en células HEp-2), en suero de pacientes con IRA y en controles. Relacionar estos factores con la severidad de las manifestaciones clínicas en los pacientes, según la clasificación del manual del programa IRA. Relacionar la IgE con la eosinofília e IL-5 durante la infección por VSR. MATERIAL Y MÉTODOS Población estudiada De un total de 150 pacientes estudiados se seleccionaron 35 pacientes con IRA, en edades comprendidas de 1 a 77 años (X±DE: 34,41 ± 20,70), sin distingo de sexo, procedentes de diferentes centros asistenciales de la cuidad de Maracaibo (Hospital General del Sur, Policlínica Maracaibo, Clínica Falcón e Instituto de Investigaciones Clínicas “Dr. Américo Negrette”) durante el período comprendido entre enero 2005 a diciembre 2007. A cada paciente se le tomó muestra de lavado nasofaríngeo, exudado faríngeo, hisopado nasal, o lavado bronqueoalveolar, antes de iniciar terapia con fármacos. Al momento de la toma de la muestra los pacientes seleccionados presentaban síntomas de infección respiratoria aguda (fiebre, tos, obstrucción nasal, rinorrea y estornudos) dentro de los primeros siete días de evolución (5,48±2,51días). Como población control se incluyeron 10 individuos aparentemente sanos en edades similares a los pacientes (31,20±21,18 años) sin antecedentes de infección respiratoria, sin asma o enfermedad pulmonar obstructiva, enfermedad cardiovascular, ni tabaquismo para el momento de la toma de la muestra, con resultados negativos a las pruebas virológicas y bacteriológicas. Se excluyeron del estudio todos aquellos pacientes que estaban recibiendo tratamiento con antibiótico, esteroide, antileucotrieno o antialérgico, los que presentaron infecciones respiratorias crónicas y pacientes asmáticas. Recolección de muestras (Anexo 2) Las muestras de sangre fueron recolectadas a través de venopunción con previa asepsia (con alcohol isopropílico al 70%) del pliegue del codo, colocadas en tubos de ensayos con anticoagulante EDTA para la realización de los frotis sanguíneos que fueron coloreados con Wrigth-Giemsa (hemograma) contaje diferencial de células leucocitaria y sin anticoagulante para la obtención del suero, los cuales fueron almacenados a -70º C, hasta su procesamiento. Además, se tomaron muestras del trato respiratorio (lavado nasofaríngeo, exudado faríngeo, hisopado nasal, o lavado bronqueoalveolar), fueron recolectadas por duplicado, una se colocó un tubo estéril que contenía medio de transporte para aislamiento viral (solución de Hank´s suplementada con suero fetal bovino, tratada previamente con antibiótico y antimicótico: 1.000u/ml de penicilina, 500ug/ml de estreptomicina y 4ug/ml de anfotericina B). Las muestras fueron lisadas en un sonicador (Modelo Fisher Scientif. Sonic 300) a 30 decibeles. Posteriormente fueron centrifugadas 300 x g durante 10 min a 4 ºC para obtener sobrenadantes libres de células y moco. El sobrenadante que se obtuvo se utilizó para el cultivo celular (Lahiri y col., 1999 y Noda y col., 1999). La segunda muestra se colocó en un tubo de transporte de Cary & Blair para el estudio bacteriológico, y para lo cual fueron inoculadas en placas de agar McConkey, agar sangre de carnero, sangre de carnero con kanamicina y agar GC. Se incubó por 24-48h a 37ºC en condiciones aerobias, microaerofílicas y anaerobias. Las especies bacterianas fueron identificadas según técnicas bacteriológicas convencionales (Finegold y col., 1998). A cada paciente se le llenó una ficha de recolección de datos diseñada para la investigación de virus respiratorios (Anexo 1), previo consentimiento por escrito, tomando en cuenta las Normas del Código de Bioética y Bioseguridad del FONACIT capítulos 2 y 3 (Briceño y col., 2002) y del Comité de Bioética del Instituto de Investigaciones Clínicas “Dr. Américo Negrette” de la Facultad de Medicina, Universidad del Zulia. Los pacientes con IRA fueron clasificados según grado de severidad de acuerdo a los criterios del manual del programa IRA (1996). Caso Leve: La presencia de uno o más de los siguientes síntomas o signos: Secreción nasal, obstrucción nasal, garganta roja, tos y ronquera. Caso Moderado: La presencia de uno o más de los siguientes síntomas o signos: Dolor y/o secreción de oídos. garganta con puntos o placas de pus, ganglios palpables y dolorosos en el cuello y frecuencia respiratoria de 50 a 70 por minuto. Caso Grave: La presencia de uno o más de los siguientes síntomas o signos: Aleteo nasal, retracción (tiraje) intercostal y/o subesternal, quejido respiratorio. estridor, cianosis, y frecuencia respiratoria mayor de 70 por minuto. Aislamiento viral e identificación por inmunofluorescencia directa en cultivo de células HEp-2. Se seleccionaron las células HEp-2 en este estudio para el aislamiento, replicación e identificación del virus. Se inocularon por duplicado 200μL de sobrenadante de las muestras, obtenidos después de la sonicación, en cultivos de células HEp-2 (Línea celular de carcinoma laríngeo humano) provenientes del Instituto Nacional de Higiene (INH) protocolo -520-I. Luego se colocaron a 37°C en atmósfera de 5% de CO2 en platos cultivo de 24 pozos. Se incubaron por 1 hora a 37ºC y 5% de CO2 para la adherencia viral. Posteriormente se adicionaron 300μL de medio de cultivo MEM (minimum esscential medium) suplementado con 10% de suero fetal bovino y con antibiótico-antimicótico a concentraciones descritas. Se colocaron a 37°C en atmósfera de 5% de CO2. Cuando la formación de células gigantes multinucleadas o sincicios fue evidente (96-120 horas), se retiró el sobrenadante del cultivo y se tomaron las células para la identificación viral y el duplicado se guardó a –70 ºC para pases sucesivos. Se utilizaron controles en cada placa, uno positivo (cepa de VSR conocida) y el negativo que sólo contenía medio de cultivo, para la comparación de los cambios morfológicos. La detección e identificación del VSR se hizo por la técnica de inmunofluorescencia directa (IFD). Simultáneamente se investigó la presencia de otros virus respiratorios como Adenovirus, Parainfluenza tipo 1, 2 y 3, e Influenza A y B, utilizando un anticuerpo monoclonal especifico marcado (Light DiagnosticsTM SimulFluor® Respiratory Screen Kit, Chemicon Internacional Temecula. CA, USA). Este kit contiene dos componentes los cuales se unieron al antígeno vírico apropiado en la muestra. El componente primario conjugado con fluoresceína se unió a las células infectadas por Adenovirus, Influenza A, Influenza B y Parainfluenza 1, 2 y 3 mostrando una fluorescencia color verde manzana brillante y el secundario conjugado con rodamina, se unió al VSR, coloreando las células amarillo oro, permitiendo la discriminación del VSR de otros virus respiratorios. Las células no infectadas se observaron de color rojo pálido debido a la presencia del colorante azul de Evans como contraste. El VSR mostró un patrón de positividad amarillo oro en el citoplasma de la célula, y se observaron los sincicios, característico de este virus. Para el resto de los virus se observó fluorescencia color verde manzana citoplasmática, nuclear o ambas localizaciones. Se determinó una reacción de tinción positiva para cualquiera de los siete virus por la presencia de al menos 2 células intactas que presentaron fluorescencia específica. Un resultado negativo estuvo indicado por la ausencia de fluorescencia en un muestreo mínimo de 20 células epiteliales. Se utilizó para la visualización de las células fluorescentes un microscopio invertido con fluorescencia (Zeiss modelo 872E, Alemania). Cultivo e infección de monocitos. Se realizaron cultivos de células mononucleares (CMN) para evaluar la respuesta inmunitaria frente a una infección producida por VSR, debido a que los monocitos humanos cuando son infectados por virus se activan, producen y liberan una serie de citocinas como IL-1β y TNF-α en lavados nasales (Corne, 1997). Las células mononuclares (CMN) se aislaron de sangre heparinizada de 5 voluntarios sanos, por centrifugación en gradiente de densidad sobre histopaque 1077 (Sigma Chemical Co., St.Louis, MO) (Boyum., 1968). Se verificó la viabilidad celular con la coloración supravital de azul tripán y se ajustó la concentración a 2x106 cel/ml. Las CMN se resuspendieron en medio RPMI 1640, suplementado con 10% de suero fetal bovino y con antibiótico-antimicótico a las concentraciones anteriormente descritas. Las muestras de suspensión celular se sembraron en platos de cultivo de veinticuatro pozos de fondo plano con un diámetro de 16 mm y se incubaron por 3 horas a 37°C en atmósfera de 5% de CO2, para permitir la adherencia de los monocitos al fondo de la placa. Las células no adherentes fueron removidas por lavados con medio de cultivo. Se estimó una población de monocitos de aproximadamente 3x105 cel/pozo, las cuales fueron infectados con 4x104 UFP/ml de VSR aislados en células HEp-2 (Arnold., 2005). Esta fue calculada para producir una multiplicidad de infección de 1 (MOI: 1), asumiendo que todas las células del cultivo podrían ser blanco para el VSR. Los monocitos control se cultivaron con sobrenadantes de células HEp-2 de los individuos controles. Utilizando la técnica de IFD descrita anteriormente se confirmó la infección viral de los monocitos. En los sobrenadantes de estos cultivos se determinaron las concentraciones de IL-4, IL-5, IL-1β, IL-8 y TNF-α a las 24 horas post infección (pi). Los estudios en cultivos celulares fueron realizados por triplicado. Determinación de Proteínas. La determinación de las proteínas se realizó basada en el método de Bradford (Bio-Rad Protein Assay). Las proteínas fueron medidas en los monocitos y en las células HEp-2 que quedaron adheridos en el fondo de la placa, los cuales fueron sometidos a un proceso de sonicación. El cálculo de la concentración se determinó a través de una curva de regresión lineal de densidad óptica vs. concentración que se obtuvo con estándares de concentraciones conocidas y que se incluyeron simultáneamente al procesamiento de las muestras. Los resultados se leyeron a 595 nm fueron expresados en mg. Cuantificación de IL-4, IL-5, IL-1β, IL-8 y TNF-α en muestra de suero y en sobrenandantes de cultivo de monocitos y en células HEp-2. Los niveles de IL-4, IL-5, IL-1β, IL-8, TNF-α se determinaron en forma cuantitativa a través de la técnica de ELISA de fase sólida de alta sensibilidad y especificidad, proporcionada por diferentes casas comerciales: IL-4, IL-5 y TNF-α (DIACLONE, Francia, Fleming), IL-1β (ALPCO Diagnostics, New York, USA) e IL-8 (R & D Systems, Miniapolis, MN, USA). La técnica consistió en un ensayo cuantitativo de ELISA tipo sandwich, en la cual se hizo reaccionar la muestra con un anticuerpo monoclonal de captura específico para la citocina fijado a una fase sólida, sobre la cual se adicionó un anticuerpo monoclonal secundario biotinilado contra al antígeno. Luego de un periodo de incubación y posterior a una fase de lavado, se le agregó un complejo streptavidinaperoxidasa que se unió al anticuerpo biotinilado. Posterior al periodo de incubación y lavado, se agregó el sustrato de tetrametilbencidina (TMB). La reacción enzimasustrato se evidenció por el desarrollo de un color cuya intensidad fue directamente proporcional a la concentración de la citocina presente en la muestra. El cálculo de la concentración se determinó a través de una curva de regresión lineal de densidad óptica vs. concentración que se obtuvo con estándares de concentraciones conocidas y que se incluyeron simultaneo al procesamiento de las muestras. Los resultados se leyeron a 450 nm y fueron expresados en pg/ml para suero y pg de citocina/mg de proteína en los cultivos de monocitos y células HEp-2. Cuantificación de IgE sérica. El método empleado es un ELISA tipo sandwich (CALBIOTECH INC. CBI. Spring Valley, C.A), donde las muestras de suero fueron colocadas en pozos recubiertos con un anticuerpo de captura (anti-IgE). La IgE presente en el suero de los pacientes queda adherida a este anticuerpo. Luego de la incubación a 37ºC, se lavaron, y se añadió el conjugado Anti-IgE HRP. Luego se adicionó el substrato, desarrollándose un color cuya intensidad es proporcional a la concentración de IgE en las muestras. Éstas fueron leídas a 450nm. Por medio de una curva estándar se obtuvo la concentración de IgE en UI/ml. Determinación de IgG anti-VSR por el método de inmunofluorescencia indirecta. Está basada en la reacción de los anticuerpos IgG anti-VSR presentes en la muestra que se unen al antígeno que se encuentra en la superficie del portaobjetos, las inmunoglobulinas no unidas son eliminadas en el proceso de lavado. Luego el complejo antígeno-anticuerpo es revelado mediante una anti-IgG humana marcada con isotiocianato de fluoresceína. La reacción positiva se evidenció mediante un color verde manzana nuclear y citoplasmático de un 20-25% de las células, mientras que en una reacción negativa las células se observaron de color rojo (Pneumoslide IgG, VIRCELL, SL, Granada, España). Análisis Estadístico. Los datos obtenidos fueron ordenados y analizados mediante el programa Graph Pad Prism 5.0 (San Diego, CA. USA). Todas las determinaciones estadísticas fueron realizadas por análisis de varianza (ANOVA) y utilizando como post-test la prueba de Bonferroni. El límite de significancia fue p<0,05. Para establecer la asociación de variables se utilizó el test de correlación de Pearson y el Ji cuadrado. Los resultados son presentados como media ± desviación estándar. RESULTADOS De los 35 pacientes con infección respiratoria aguda, 15 (42,85%) presentaron positividad para VSR: 5 (33,33%) presentaron infección leve, 3 (20%) infección moderada y 7 (46,66%) infección grave; 20 pacientes (57,14%) resultaron negativos para la infección por VSR pero positivos para otros agentes infecciosos: 6 (30%) con infección leve, 4 (20%) moderada y 10 (50%) grave (Fig 1). Leve Moderado Grave VSR- VSR+ 0 5 10 15 20 25 nº de casos Figura 1. Distribución de la población estudiada con infección respiratoria aguda (IRA) por Virus Sincicial Respiratorio (n=15) y sin infección por VSR (n=20) clasificados según el grado de severidad de IRA. Estudios séricos. Al analizar las concentraciones séricas de IL-4 se encontró que éstas fueron similares entre los pacientes con infección por VSR (13,82±2,732 pg/ml) o ausencia del virus (12,32 ±1,478pg/ml), pero incrementadas (p<0,01) con respecto a la población control (9,463±1,392pg/ml) (Fig 2). IL -4(p g /m l) 20 * 15 * 10 5 0 Control VSR+ VSR- Figura 2. Concentraciones séricas de IL-4 en pacientes con infección respiratoria aguda por VSR (n=15), y negativos al virus (n=20). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + post test de Bonferroni. *p<0,01 con respecto al control (n=10). Las concentraciones de IL-4 según el grado de severidad, arrojaron diferencias significativas (p<0,01) entre los grupos de pacientes VSR- con infección leve (12,58±0,2467pg/ml) y grave (12,98±1,448 pg/ml) con respecto al grupo control (9,463±1,392 pg/ml); mientras que en los pacientes VSR+ con infección grave (16,07±2,409 pg/ml) este incremento fue muy marcado (p<0,001) con respecto a los grupos VSR+ con infección leve (11,81±0,7809pg/ml) e infección moderada (11,93± 0,6123pg/ml), VSR- y el control (Fig 3). * ** IL-4(pg/m l) 20 15 * 10 * Control Leve Moderada Grave 5 0 VSR+ VSR- Figura 3. Concentraciones séricas de IL-4 en pacientes con Infección Respiratoria Aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad: VSR+ con infección leve (n=5), moderada (n=3) y grave (n=7) y VSR- leve (n=6), moderada (n=4), grave (n=10) y un grupo control (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + post test de Bonferroni. *p<0,01 con respecto al grupo control, **p<0,001 con respecto a los grupos VSR+ con infección leve y moderada y VSR- con infección grave. En relación a las concentraciones séricas de IL-5 se observó una elevación significativa (p<0,001) entre los pacientes que se en encontraban o no infectados por VSR (74,41±31,23 pg/ml y 61,59±7,273 pg/ml) con respecto al control (31,88±10,46 pg/ml) (Fig 4). No se observaron cambios importantes con respecto al tipo de infección (VSR+ vs VSR-). IL-5(pg/ml) 150 * 100 * 50 0 Control VSR+ VSR- Figura 4. Concentraciones séricas de IL-5 en pacientes con infección respiratoria aguda por VSR (n=15), negativos al virus (n=20) y controles (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + post test de Bonferroni. *p<0,01 con respecto al control . Al hacer la clasificación de las concentraciones séricas de IL-5 según el grado de severidad se encontraron elevadas (p<0,05) en aquellos pacientes con infección por VSR en los distintos grados de severidad de la enfermedad: leve (76,25± 38,25 pg/ml); moderado: (74,99±34,73 pg/ml) y grave (72,85± 29,880 pg/ml) y los no infectados por VSR de manera grave (66,94±3,817 pg/ml) con respecto al grupo control, es decir los niveles de IL-5 fueron similares en todos los grados de severidad (Fig 5). IL-5 (pg/m l) 150 100 * * * * 50 0 VSRVSR+ Figura 5. Concentraciones séricas de IL-5 en pacientes con infección respiratoria aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad: VSR+ con infección leve (n=5), moderada (n=3) y grave (n=7) y VSR- leve (n=6), moderada (n=4), grave (n=10) y un grupo control (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DS y analizados con ANOVA + post test de Bonferroni. *p<0,05 con respecto al grupo control. Control Leve Moderada Grave En cuanto a las concentraciones séricas de IL-1β, estas estuvieron incrementadas (p<0,001) en los pacientes con infección por VSR (19,89±3,545 pg/ml) y los VSR(15,95±3,450pg/ml) con respecto al grupo control (9,514±7141 pg/ml), a su vez en los VSR+ resultaron mayores a los que no estaban infectados por este virus (Fig 6). IL-1β(pg/m l) 25 * ** 20 * 15 10 5 0 Control VSR+ VSR- Figura 6. Concentraciones séricas IL-1 β en pacientes con infección respiratoria aguda por VSR (n=15), y negativos al virus (n=20) y controles (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + post test de Bonferroni. *p<0,001 con respecto al control. **p<0,01 con respecto a los pacientes sin infección por VSR. Al relacionar la IL-1β con el grado de severidad se encontró elevación de las concentraciones (p<0,05) en el grupo VSR- grave (21,25±3,219 pg/ml) con respecto a VSR- leve (12,94±1,387), mientras que en los pacientes con infección por VSR no se evidenciaron cambios en los niveles de IL-1β relacionados a la severidad de la infección (Fig 7). IL -1 β (p g /m l) 30 20 * * * * ** * * Control Leve Moderado Grave 10 0 VSR+ VSR- Figura 7. Concentraciones séricas de IL-1β en pacientes con Infección Respiratoria Aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad: VSR+ con infección leve (n=5), moderada (n=3) y severa (n=7) y VSR- leve (n=6), moderada (n=4) severa (n=10) y un grupo contrl (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DS y analizados con ANOVA + post test de Bonferroni. *p<0,05 con respecto al grupo control. **p<0,05 con respecto al grupo VSR- con infección leve. Con respecto a las concentraciones de IL-8 en el suero de pacientes con IRA se observó un aumento marcado (p<0,01) entre el grupo con infección por VSR (114,1±90,93 pg/ml) al compararlo con el control (29,55±5,808 pg/ml) y el negativo al virus (33,40±20,26 pg/ml) (Fig 8). 250 * IL-8(pg/m l) 200 150 100 50 0 Control VSR+ VSR- Figura 8. Concentraciones séricas IL-8 en pacientes con infección respiratoria aguda por VSR (n=15), y negativos al virus (n=20) y un grupo control (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + post test de Bonferroni. *p<0,01 con respecto al control y a VSR-. Así mismo, al observar las concentraciones de IL-8 en suero de pacientes con IRA producidas por VSR según el grado de severidad, se evidenció elevación (p<0,001) en el grupo de infección grave (195,1±62,84 pg/ml) con respecto al control (29,55±5,808 pg/ml), VSR+leve (61,65±5,183 pg/ml); VSR+moderado (112,5±1,614 pg/ml) y VSR- grave (49,321±16,09 pg/ml). Mientras que el grupo con infección por VSR moderada arrojó valores incrementados (p<0,01) con respecto al grupo control y VSR-moderada (24,98 ±1,769 pg/ml), es decir que los niveles de IL-8 se asocian directamente al grado de severidad de las IRA producidas por VSR (Fig 9). 300 Control Leve Moderada Grave IL-8 (pg/ml) * 200 ** 100 0 VSR+ VSR- Figura 9. Concentraciones séricas de IL-8 en pacientes con infección respiratoria aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad: VSR con infección leve (n=5), moderada (n=3) y grave (n=7) y VSR-leve (n=6), moderada (n=4) y grave (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + Bonferroni. *p<0,001 con respecto al grupo control, infección por VSR leve, moderada y sin VSR grave. **p<0,01 con respecto al grupo control y sin infección por VSR moderada. Al analizar las concentraciones de TNF-α en suero de pacientes con IRA de acuerdo al tipo de infección se evidenciaron niveles elevados (p<0,001) en los grupos VSR+ (80,80±27,54 pg/ml) y VSR- (94,31±20,92 pg/ml) con respecto al grupo control (26,26±3,009 pg/ml), no así entre ellos (Fig 10). TNF-α (pg/ml) 150 100 * * VSR+ VSR- 50 0 Control Figura 10. Concentraciones séricas de TNF-α en pacientes con infección respiratoria aguda por VSR (n=15), y negativos al virus (n=20) y un grupo control (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + post test de Bonferroni. *p<0,01 con respecto al control. En cuanto a las concentraciones de TNF-α obtenidas en el suero de pacientes con infección por VSR (leve: 54,21±17,66 pg/ml; moderado: 67,04±2,47 pg/ml y grave: 105,7±12,36 pg/ml) y entre los pacientes que resultaron negativos a la infección viral en todos los grados de severidad (leve: 85,55±26,93 pg/ml, moderado: 98,50±19,47pg/ml y grave: 99,12±20,52 pg/ml) se observó una elevación (p<0,001) al ser comparados con el grupo control (26,26±3,00 pg/ml). Los pacientes infectados por VSR grave presentaron un aumento (p<0,001) de sus niveles con respecto a los grados inferiores de la enfermedad, es decir existe relación entre los niveles de TNF-α con el grado de severidad en la infección por VSR (Fig 11). T N F - α ( p g /m l) 150 * ** 100 * * * * * Control Leve Moderada Grave 50 0 VSR+ VSR- Figura 11. Concentraciones séricas de TNF-α en pacientes con infección respiratoria aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad: VSR+ con infección leve (n=5), moderada (n=3) y grave (n=7) y VSR- leve (n=6), moderada (n=4) y grave (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DS y analizados con ANOVA + Bonferroni. *p<0,05 con respecto al grupo control y una **p<0,05 con respecto al grupo con infección por VSR leve y moderada. En cuanto a las concentraciones de IgE sérica se evidenció un incremento significativo (p<0,05) en los pacientes con infección respiratoria por VSR (61,05±31,27Ul/ml) con respecto al resto de los grupos: control (18,49± 5,513 Ul/ml) y VSR- (26,24±15,42 Ul/ml) (Fig 12). 100 * Ig EU L /m l 80 60 40 20 0 Control VSR+ VSR- Figura 12. Concentraciones séricas IgE en pacientes con infección respiratoria aguda por VSR (n=15), y negativos al virus (n=20) y un grupo control (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA +post test de Bonferroni. *p<0,01 con respecto al control y sin infección por VSR. Al comparar equivalentes en individuos con infección fue evidente el incremento (p<0,01) de las concentraciones séricas de IgE en las infecciones moderadas (76,92±3,536 Ul/ml) y graves (79,89±17,47 Ul/ml) con respecto al control (18,49± 5,513 Ul/ml) y a las obtenidas en los pacientes VSR- moderada (25,39±9,898 Ul/ml) y VSR- grave (21,41±8,555 Ul /ml). La producción sérica de IgE se asoció a una mayor severidad de la infección por VSR (Fig 13). 150 * 100 I g E ( U l / m l) Control Leve Moderada Grave ** 50 0 VSR+ VSR- Figura 13. Concentraciones séricas de IgE en pacientes con infección respiratoria aguda por Virus Sincicial Respiratorio clasificados de acuerdo a la severidad de la enfermedad, VSR con infección Leve (n=5), moderada (n=3) y grave (n=7) y VSR- leve (n=6), moderada (n=4), grave (n=10) y grupo control (n=10). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DS y analizados con ANOVA + post test de Bonferroni. *p<0,001 con respecto al grupo control, con infección por VSR leve y sin infección por VSR grave. **p<0,01 con respecto a control, VSR+leve y VSRmoderado . Al determinar las concentraciones séricas de las citocinas ensayadas (IL-4, IL-5, IL-1β, TNF-α e IL-8), se evidenció un aumento marcado (p<0,01) de todos estos factores solubles en los pacientes con infección por VSR al compararlo con el grupo control, pero sólo resultó diferente a los pacientes negativos al virus en la determinación de IL-1β, IL-8 e IgE (Tabla I). TABLA I.- NIVELES SERICOS DE CITOCINAS E IgE EN PACIENTES CON INFECCIÓN RESPIRATORIA AGUDA Y CONTROLES. Control VSR+ VSR- n=10 n=15 n=20 IL-4(pg/ml) 9,463±1,3 13,82±2,7a 12,32±1,4a IL-5(pg/ml) 31,88±10,4 74,41±31,2a 61,59±7,2a IL-1β(pg/ml) 9,514±2,7 19,89±3,5a,b 15,95±3,4a TNF-α(pg/ml) 26,26±3,0 80,80±27,5a 94,31±20,9a IL-8(pg/ml) 29,55±5,808 114,1±90,43a,b 33,40±20,26 IgE (UI/ml) 18,49± 5,513 61,05±31,27 a,b 26,24±15,42 a b p<0,05 con respecto al control. p<0,05 con respecto a VSR- Se encontró una correlación positiva (r=0,8796, p<0,01) entre la IL-5 sérica con el número de eosinófilos presente en los pacientes con infección respiratoria producida por VSR (Fig14). Mientras que en los pacientes sin infección por VSR no se obtuvo tal asociación (Datos no mostrados). Eosinofilo % 15 10 5 0 0 50 100 150 200 IL-5 (pg/ml) Figura 14. Correlación de IL-5 (pg/ml) sérica y eosinofilia en pacientes con infección respiratoria aguda por VSR (n=8). Las concentraciones fueron determinadas por ELISA. Analizados con Test de correlación de Pearson (r=0,8796, p<0,01). En cuanto a la determinación sérica de IgG anti-VSR, el 100% de los pacientes seleccionados y de la población control arrojaron inmunidad al virus. A pesar de que el paciente está enfermo en el momento de la toma de la muestra, no se realizó títulación de anticuerpos IgG anti-VSR. Estudios en cultivos Aun cuando se evidenció un incremento (p<0,01) de las concentraciones de IL-4 en sobrenadantes de cultivo de monocitos a la 24 horas pi, en infectado por VSR (85,13±7,584 pg/mg de proteína) y sin infección (VSR-:78,44±11,08 pg/mg de proteína) con respecto al control (35,17±10,55 pg/mg de proteína), la diferencia existente (p<0,01) entre las concentraciones de IL-4 en los cultivos de HEp-2 infectados con VSR y en monocitos, parece indicar que no hubo producción de esta citocina en los monocitos. Mientras que en las concentraciones de IL-4 en sobrenadantes de HEp-2 se evidenció un aumento significativo (p<0,001) en los cultivos infectados por VSR+ (129,7±30,88 pg/mg de proteína) con respecto al control (59,35±15,89 pg/mg de proteína) y negativos al virus (81,32±19,61 pg/mg de proteína) (Fig 15). IL-4(pg/mgdeproteína) 200 ** 150 100 * Control Monocitos VSR+ VSR- * 50 0 Monocitos HEp-2 Figura 15. Concentraciones de IL-4 en sobrenadantes de cultivo de monocitos humanos y HEp-2 infectados con VSR (n=9) y sin infección por VSR (n=9). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + Bonferroni. *p<0,01 con respecto al control (n=4) y **p<0,001 con respecto al resto de los cultivos. Al analizar las concentraciones de IL-5 obtenidas de sobrenadantes de monocitos, se observa que los cultivos no infectados por VSR (1095±559,0 pg/mg de proteína) presentaron niveles elevados (p<0,05) con respecto a los controles (426,4±122,8 pg/mg de proteína) y a los infectados por VSR (645,4 ±142,6 pg/mg de proteína); mientras que en los sobrenadantes de células HEp-2 no se observaron diferencias (VSR+:364,0±79,75 pg/mg de proteína; VSR-: 418,7± 245,7 pg/mg de proteína y Co: 363,2±30,22 pg/mg de proteína), por lo que la producción de IL-5 no estuvo IL-5 (pg/mg de proteína) relacionada a la presencia de VSR (Fig 16). 2000 Controles VSR+ VSR- * 1500 1000 500 0 Monocitos HEp-2 Figura 16. Concentraciones de IL- 5 en sobrenadantes de cultivo de monocitos humanos y HEp-2 infectados con VSR (n=9) y sin infección por VSR (n=9). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + post test de Bonferroni. *p<0,01 con respecto al control y a VSR+. En las concentraciones de IL-1β obtenida de los sobrenadantes de monocitos cultivados que no tenían infección por VSR (2368±494,4 pg/mg de proteína) se evidenció un incremento (p<0,001) con respecto a los grupos control (344,9±102,58 pg/mg de proteína) y VSR+ (876,0±189,8 pg/mg de proteína) en cultivo. Mientras que en las células HEp-2 los cultivos sin infección por VSR (992,1± 298,0 pg/mg de proteína) arrojaron concentraciones mayores (p<0,05) que las observadas en los IL-1β (pg/mg de proteína) controles (346,6±36,76 pg/mg de proteína) (Fig 17). 4000 3000 Control VSR+ VSR- * 2000 ** 1000 0 Monocitos HEp-2 Figura 17. Concentraciones de IL 1 β en sobrenadantes de cultivo de monocitos humanos y HEp-2 infectados con VSR (n=9) sin infección por VSR (n=9). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + post test de Bonferroni. *p<0,01 con respecto al control y VSR+. **p<0,01 con respecto al control. Similar respuesta se obtuvo en las concentraciones de IL-8 en monocitos, donde se evidenció que los cultivos no infectados por VSR (1130±335,6 pg/mg de proteína) arrojaron las mayores concentraciones (p<0,05) con respecto al control (648,1±164,4 pg/mg de proteína) y a los infectados por VSR (876,4±117,6 pg/mg de proteína). En los sobrenadantes de células HEp-2 no se observaron diferencias (VSR+: 429,7± 87,64 pg/mg de proteína; VSR-: 410,3± 155,6 pg/mg de proteína y Co: 452,0± 103,0 pg/mg de proteína) (Fig 18). IL-8 (pg/mg de proteína) 2000 Controles VSR+ VSR- * 1500 1000 500 0 Monocitos HEp-2 Figura 18. Concentraciones de IL-8 en sobrenadantes de cultivo de monocitos humanos y HEp-2 infectados con VSR, (n=9) sin infección por VSR (n=9). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + post test de Bonferroni. *p<0,05 con respecto al grupo control y los infectados por VSR. Las concentraciones de TNF-α en los sobrenadantes de cultivo de monocitos no infectados por VSR (2570± 908,7 pg/mg de proteína) se elevaron significativamente (p<0,05) con respecto al control (711,9 ± 56,16 pg/mg de proteína) y VSR+ (1523± 908,9 pg/mg. Con respecto a los sobrenadantes de células HEp-2 no se observaron diferencias (VSR+: 745,7± 256,2 pg/mg de proteína; VSR-: 903,1± 658,9 pg/mg de TNF-α(pg/mg de proteína) proteína y Co: 639,3± 57,66 pg/mg de proteína) (Fig 19). 4000 Control VSR+ VSR- * 3000 2000 1000 0 Monocitos HEp-2 Figura 19. Concentraciones de TNF-α en sobrenadantes de cultivo de monocitos humanos y HEp-2 infectados con VSR (n=9) y sin infección por VSR(n=9). Las concentraciones fueron determinadas por ELISA. Los datos representan el X±DE y analizados con ANOVA + post test de Bonferroni. *p<0,01 con respecto al control e infectado por VSR. DISCUSIÓN En este estudio se analizaron las concentraciones séricas de IL-4, IL-5, IL-1β, IL8 y TNF-α, dado que estas citocinas juegan un papel relevante en la inflamación de las vías aéreas (Rodríguez y col., 1999). A pesar de que se observó una elevación de IL-4 tanto en el suero de los pacientes infectados como en los no infectados por VSR, al clasificarlos por grados de severidad es evidente un marcado aumento relacionado a la infección grave causada por VSR. Este hallazgo es indicativo de activación de linfocitos TH2, que junto a los efectos de esta citocina sobre la síntesis incrementada de IL-5 e IgE (elevada en los casos severos), sugieren regulación de la expresión de los receptores de IgE en los macrófagos y eosinófilos, haciendo que estas células interaccionen con cualquier tipo de alergeno, lo que conllevaría a un aumento de la gravedad de la enfermedad, tal como lo reportan Rodríguez y col., (1999) y Liu y col., (2007). Además, Legg y col., en el 2003, en un estudio realizado en lavados nasales de niños que padecían infección respiratoria, observaron que la IL-4 se encontró elevada en los niños con bronquiolitis por VSR, así como la IL-10 e IL-12 los días 1-2 y 5-7 de la enfermedad, datos que sugieren que en estos pacientes se produce un exceso de respuesta Tipo TH2 o una respuesta inmunitaria deficiente de tipo TH1. En células de epitelio respiratorio como las HEp-2 las concentraciones de IL-4 fueron marcadamente incrementadas en los cultivos infectados por VSR, mientras que en monocitos no se determinaron cambios importantes asociados a la presencia de este agente, lo que sugiere que probablemente las concentraciones de IL-4 favorezcan un micro ambiente bronquial o broncoalveolar caracterizado por altos niveles de esta citocina, la cual representa el factor determinante mas importante en la expansión de los linfocitos TH2, o en la diferenciación de linfocitos B hacia células productoras de IgE (Pala y col., 2002). Además, la IL-4 favorece la producción de mucosidad a través de la activación de los neutrófilos y de la estimulación de los receptores del factor de crecimiento epidermal (EGF) (Lorente y col., 2001) También se encontraron elevados los niveles séricos de IL-5 en pacientes con IRA por VSR causando infección leve, moderada o grave, y sólo en aquellos pacientes con IRA grave causada por otros agentes. Sanmugalingham y col., (2000) en su estudio demuestran el papel selectivo de la IL-5 en la mediación de la adherencia dependiente de integrina del eosinófilo al epitelio de la vía aérea y reafirma una vez mas la importancia de esta citocina en el control de la activación del eosinófilo en enfermedades tales como asma. La correlación positiva encontrada entre la IL-5 y la cantidad de eosinófilos en los pacientes infectados por VSR, sugieren que haya mayor posibilidad de que a nivel de la vía aérea esto ocurra, una vez conocido que los eosinófilos se producen en la médula a partir de células pluripotenciales del progenitor CD34+, que son comunes a los eosinófilos y basófilos, que bajo la influencia de factores de crecimiento, incluyendo IL-3, el factor estimulador de colonia granulocítico-macrofágico (GM-CSF) e IL-5regulando la activación de los eosinófilos. La IL-3 y GM-CSF son activos como precursores tempranos, mientras que la IL-5 actúa mas tardíamente para la diferenciación de los eosinófilos y su liberación a la circulación sanguínea (Denburg, 1998). A pesar de que la logística en la recolección de las muestras sanguíneas no fue del todo eficiente, dado que permitió determinar eosinófilos en sólo 8 de los 15 pacientes con IRA por VSR, en el presente estudio la eosinofilia fue evidente en estos pacientes y no en los no infectados por VSR sugiriendo que los eosinófilos activados por virus se reclutan probablemente en las vías respiratorias causando daño y provocando una reacción de hiperreactividad tardía (Balfour, 1996, Phipps y col, 2007), asociado a un cuadro clínico más severo. Chang y col., (2003), realizaron un estudio en LBA, donde determinaron los niveles de IL-5 e IFNγ, los cuales fueron aumentados significativamente en el grupo de pacientes asmáticos sin infección identificada por VSR y con bronquiolitis inducida por VSR, comparado con valores del grupo control. Cuando dividieron a los niños del grupo con bronquiolitis, en subgrupos eosinófilo-positivos y eosinófilonegativos, el subgrupo eosinófilo-positivo había aumentado perceptiblemente los niveles IL-5. El porcentaje de los eosinófilos en el LBA, correlacionó significativamente con los niveles de IL-5 en ambos grupos. Estos autores sugieren una predisposición a una respuesta inmunitaria tipo TH2, tal como se sugiere en este y en otros estudios realizados en ratones que han demostrado que la infección por VSR puede inducir una alteración en el equilibrio TH1/TH2 a favor de una respuesta TH2 con producción creciente de IL-5 (Welliver y col., 1981). En cuanto a la concentración sérica de IL-1β, ésta fue marcadamente alta en los pacientes con y sin infección por VSR con cuadro clínico desde leve a grave, lo que nos sugiere liberación de esta citocina en la IRA no relacionada a VSR. Mientras que los niveles de TNF-α también estuvieron incrementados en los pacientes con y sin infección por VSR y en los diferentes grados de severidad. Resultados que concuerdan con lo descrito por Noah (1995) en un estudio realizado en niños en un hogar de cuidado diario, donde determinaron en lavados nasales la expresión de IL1β, IL-8, IL-6 y TNF-α, los cuales estuvieron muy elevados al ser comparados con el control, y todos menos el TNF-α disminuyeron sus concentraciones de 2-4 semanas sin evidenciar diferencias significativas con respecto a los no infectados por VSR. Beutler (2000) y Tian (2001) en otros estudios encontraron niveles elevados de TNFα en los primeros días, al ser estos relacionados con la carga del virus, lo cual confirma claramente que es una citocina que se encuentra involucrada en la mediación de los procesos inflamatorios producidos por la infección con VSR. La IL-1 promueve la liberación de mediadores procedentes de los mastocitos del pulmón humano, de modo dependiente de la IgE (Salaxi y col., 1989 y Bischoff y col., 1992); estas citocinas producen la liberación de histamina de los mastocitos de adenoides y epidermis, respectivamente (Subramanian., 1987 y Van Overdeld y col., 1991). Las células TH2 producen IL-5, citocina que promueve la síntesis y secreción de IgE por células B, siendo ésta crucial en el desarrollo y superviviencia de eosinófilos en los sitios de inflamación. Esto puede explicar la eosinofilia frecuentemente asociada con reacciones alérgicas mediadas por IgE (Herrero, 2006). Los niveles séricos de IgE en pacientes con infección por VSR estuvieron muy elevados y este aumento fue más evidente en las infecciones moderadas y graves. Welliver (2000) en varios estudios en niños con IRA, encontró que los niveles de IgE específicas para este virus, estaban incrementados en células epiteliales y secreciones nasofaringeas, asociando este hecho con las sibilancias y obstrucción de vías respiratorias, y postularon que se produce una sensibilización de las células cebadas, que al ocurrir una subsecuente infección, el VSR interactúa con las IgE específicas y activa la liberación de mediadores que consecuentemente agravan el cuadro clínico. Llama la atención que en modelos in vitro, las concentraciones de IL-1β y TNF-α no mostraron diferencias importantes en los sobrenadantes de cultivos infectados por VSR al ser comparados con los controles. Algunos autores sugieren que el TNFα tiene un papel crítico en la inflamación, pero la función de esta citocina en enfermedades causadas por VSR no esta totalmente clara, dado que algunos mencionan que tiene un papel protector en las infecciones por VSR (Henderson, 1995), mientras que Mejías y col., (2004) realizaron un estudio en ratones, los cuales recibieron un anticuerpo monoclonal neutralizante antiVSR e infectados intranasalmente con VSR A2, a las 24 horas tenían las concentraciones más altas de TNF-α en muestras del LBA pero sin presentar sintomatología durante el curso de la infección. Estos autores concluyeron que la replicación reducida de VSR está asociada significativamente a la producción de TNF-α aumentada que podría explicar, por lo menos en parte, la regulación de marcadores clínicos e inflamatorios en la severidad de la enfermedad aguda y la mejoría de las anormalidades pulmonares. La IL-8 es una quimiocina potente que promueve el reclutamiento de neutrófilos y eosinófilos, responsables en gran parte del proceso inflamatorio. Estudios previos sugieren un papel importante de esta citocina en las exacerbaciones de asma (Baggiolini y col., 1994). En un trabajo realizado por O´Sullivan en 2005 observó aumento de las concentraciones de IL-8 en muestras de secreción respiratoria de niños con broquiolitis y al correlacionarlas con el número de leucocitos en las mismas secreciones, indicaron que probablemente esta quimiocina puede ser responsable de la infiltración del leucocito de la vía aérea durante la infección de VSR. En otro estudio realizado por Hasan (2002), determinó que las concentraciones séricas de IL-8 el día 1 de evolución se encontraban aumentadas, para luego disminuir durante el período de cinco días de estudio. Una declinación similar en concentraciones del quimiocinas fue observada en secreciones nasofaríngeas. Sin embargo, cuando la concentración de IL-8 en secreciones respiratorias fue comparada con las de suero, diversas tendencias eran observadas. En el presente estudio los niveles séricos de IL-8 estuvieron incrementados en los pacientes infectados por VSR, y particularmente con infección grave, hallazgos que concuerdan con estudios previos. Sin embargo, al observar las concentraciones en sobrenadantes de HEp-2 y monocitos humanos no se evidencio relación alguna de esta citocina y la infección por VSR, contrario a lo reportado por Kurt-Jones y col., (2000) quienes describen en monocitos humanos estimulados in vitro con la proteína F del VSR A2 purificada, la activación de receptores tipo Toll 4 (TLR 4) involucrados en la liberación de IL- 8, IL-6 e IL-1. Con respecto a la detección de lnmunoglobulinas G específicas al virus (IgG antiVSR), en el presente estudio se demuestra que todos los pacientes y sanos (controles) presentaron inmunidad al virus; estos datos indican una alta seroprevalencia de VSR y refuerzan el concepto de que la mayoría de la población tiene contacto con el virus probablemente desde la infancia. Hallazgo que concuerda con lo descrito por Lérida y col., (2000) en un estudio epidemiológico en pacientes con y sin criterio serológico de infección aguda por VSR, en los cuales encontraron 97% de inmunidad al virus con sólo un 6,8% de seroconversión. No se observaron variaciones significativas al relacionar la inmunidad con la severidad de la IRA en los pacientes, sin embargo los mayores porcentajes de IgG anti VSR se encontraron en la población que presentó IRA grave, a pesar que algunos autores describen que después de la primera exposición al virus es poco frecuente la enfermedad grave y que la inmunidad producida por VSR es parcialmente eficaz y hasta el momento no existe una medida de profilaxis efectiva solo la administración mensual de un anticuerpo monoclonal humanizado anti VSR (Palivizumab) representa una alternativa de protección a la infección (Skaricic y col., 2008). Tomando en cuenta todos los parámetros evaluados es importante recalcar la posible y relevante acción de la IL-8 como principal citocina implicada en la patogénesis de la infección causada por el VSR, sin dejar de mencionar el incremento de citocinas proinflamatorias como la IL-1 β y el TNF-α, que aun cuando no estuvieron relacionadas directamente a la infección por VSR, se sugiere su participación in vivo, en el agravamiento del cuadro clínico. La determinación de IL-4 e IL-5 pudieran indicar la generación de una respuesta inmunitaria tipo TH2 en los pacientes con IRA infectados por VSR, mientras que se evidenció un alto porcentaje de inmunidad en la población no relacionada a la severidad de la IRA en los pacientes analizados. CONCLUSIONES En base a los resultados obtenidos en el presente estudio, se concluye: 9 Durante la infección respiratoria aguda se incrementan los niveles séricos de citocinas proinflamatorias IL-1 β y TNF-α, no solo relacionados a la presencia del VSR. 9 Se sugiere una relevante acción de la IL-8 como principal citocina implicada en la patogénesis de la infección causada por el VSR, asociada posiblemente al reclutamiento de neutrófilos y eosinófilos, responsables en gran parte del proceso inflamatorio en la vía aérea de estos pacientes. 9 El incremento en las concentraciones de IL-4 e IL-5 en los pacientes infectados por VSR sugieren una respuesta inmunitaria tipo TH2 relacionada a la infección grave causada por VSR. 9 La producción incrementada de IL-4 en células HEp-2 infectadas por VSR sugieren la participación de esta citocina en la regulación de la síntesis de otros factores como la IL-5 e IgE. 9 El alto porcentaje de IgG anti VSR encontrado en los pacientes y controles indican una seroprevalencia a VSR. REFERENCIA BIBLIOGRAFICAS • Aberle, JH., Aberle, SW., Dworzak, MN. 1999. “Reduced interferon-gamma expression in peripheral blood mononuclear cells of infants with severe respiratory syncytial virus disease”. Am J Respir Crit Care Med; 160: 1263–1268. • Aristizábal G. 2000. Infección Respiratoria Aguda (IRA) viral y sibilancias recurrentes en lactantes. Revista Colombiana de neumología. 12(4). • Archundia, FJ., Alejandre, JE., Cabello, C., Rosete, DP., Manjares, ME. 2000. Incorporación de la técnica de RT-PCR para la detección del virus sincitial respiratorio. Revista del Instituto Nacional de Enfermedades Respiratorias. 13(3): 145-152. • Arnold R., Ko¨nig W. 2005. Respiratory Syncytial Virus Infection of Human Lung Endothelial Cells Enhances Selectively Intercellular Adhesion Molecule-1 Expression. The Journal of Immunology. 174: 7359–7367. • Baggiolini, M., Dewald, B., Moser B. 1994. Interleukin-8 and related chemotactic cytokines-CXC and CC chemokines. Advances in Immunology. 55: 97-179. • Brandenburg, AH., Kleinjan, A., Van Het., Land B. 2000. “Type 1–like immune response is found in children with respiratory syncytial virus infection regardless of clinical severity”. J Med Virol; 62:267–277. • Brandenburg, AH., Neijens, HJ., Osterhaus, AD. 2001. “Pathogenesis of RSV lower respiratory tract infection: implications for vaccine development”. Vaccine; 19: 2769-2782. • Balfour-Lynn, L. 1996. ¿Por qué los virus provocan sibilancias en los niños? Br Med J. (4): 11-19. • Bendelja, K., Gagro, A., Bace, A. 2000. “Predominant type-2 response in infants with respiratory syncytial virus infection demonstrated by cytokine flow cytometry”. Clin Exp Immunol; 121:332–338. • Beutler, B. 2000. Endotoxin, toll-like receptor 4, and the afferent limb of innate immunity. Current Opinion in Microbiology. 3(1): 23–28. • Bischoff, SC., Dahniden, CA. 1992. C-kit ligand: a unique potentiator of mediator release by human lung mast cells. Journal of Experimental Medicine, 175: 237-244. • Broide, DH; Lotz, M; Cuomo, AJ; Coburn, DA; Federman, EC; Wasserman, SI. 1992. Cytokines in symptomatic asthma airways. The Journal of Allergy and Clinical Immunology. 89(5): 958-967. • Böyum, A. 1968. Separation of leukocytes from blood and bone marrow. Scandinavian Journal of Clinical and Laboratori Investigation. Supplementum. 97:7. • Briceño, E., Suarez, E., Michelangi, C., Feliciangeli, D., Otaiza, E., Mendible, J., Villalon, M., Ceballo H., Godoy, J. 2002. Código de Bioética y Bioseguridad, Capítulos 2 y 3. Ministerio de Ciencia y Tecnología (FONACIT). 2da Edición. Venezuela. • Cane, P., Pringle, C. 1995 Molecular epidemiology of human Respiratory Sincytial Virus. Seminars in Virology. 6: 371-378. • Chang, K; Sang, W; Choon, S; Beyon, G; Kang, H; Young, Yull. 2003. Bronchoalveolar lavage cytokine profiles in acute asthma and acute bronchiolitis. Journal of allergy and clinical immunology. 112(1): 64-71. • Clutterbuck, EJ., Sanderson, CL. 1990. Regulation of human eosinophil precursor production by cytokines. A comparison of recombinanthuman interleukin-1 (rhIL-1), rhIL-3, rhIL5, rhIL-6 and granulocyte-macrophage colony-stimulating factor. Blood; 75: 1774-1779. • Comité Nacional de Neumonología, Subcomisión de Epidemiología, Comité Nacional de Infectología, Comité Nacional de Medicina Interna. 2006. Recomendaciones para el diagnóstico y tratamiento de las infecciones respiratorias agudas bajas en menores de 2 años. Archivos Argentinos de Pediatría. 104(2): 159-176. • Corne, JM., Holgate, ST. 1997. Mechanisms of virus induced exacerbations of asthma. Thorax. 52: 380-389. • Del Prete G. F., Maggi ., Parronchi P., Chrétien J., Tiri A., Macchia, D. 1988. IL-4 is an essential factor for the IgE synthesis induced in vitro by human T cell clones and their supematants. J Inmunol. 140: 4193-4198. • Denburg, JA. 1998. The origins of basophils and eosinophils in allergic inflammation. The Journal of Allergy and Clinical Immunology. 102(5): S73– S106. • Domachowske, J., Rosenberg, H. 1999. Respiratory Syncytial Virus Infection: Immune Response, Immunopathogenesis, and Treatment. Clinical Microbiology Reviews. 12(2): 298–309. • Efectividad del programa infecciones respiratorias (IRA) y la incidencia de niños con enfermedades respiratorias. Municipio Zamora. Villa de Cura. Estado Aragua. 2.000. Disponible en:http.www.Efectividad del programa infecciones respiratorias (IRA) y la incidencia de niños con enfermedades respiratorias - Monografias_com.htm • Falsey AR., Walsh EE. 2.000. Respiratory Syncytial Virus Infection in Adults. Clinical Microbiology Reviews, 13(3): 371-384. • Fenner F. 1975. The classification and nomenclatura of viruses. Summary of results of internacional committee on taxonomy of viruses in Madrid, J Gen Virol. 31: 463-470. • Finegold S., Sheperd W., Spaulding E. 1988. Manual de Diagnóstico Microbiológico. 12a ed. Manual Moderno. México. Pp. 1243-1254. • Galvis, V., Bustamente, M., Sarmiento, C. Guía de atención de la Infección Respiratoria Aguda. Disponible en: www2.valledelcauca.gov.co/.../normas • Gern, JE., Martin, MS., Anklam, KA., Shen, K., Roberg, KT., Carlson-Dakes, K., Adler, S., Gilbertson-White, R., Hamilton, PA., Shult, CJ., Kirkk, DF., Da Silva, SA., Sund, MR., Kosorok, RF., Lemanske, Jr. “Relationships among specific viral pathogens, virus-induced interleukin-8, and respiratory symptoms in infancy”. Pediatr. Allergy Immunol. 13: 386-393. • González V., Ramiro. 2004. Nuevos conocimientos sobre el virus respiratorio sincicial (VRS): a propósito de una gran epidemia / New knowledge on the respiratory syncytial virus (RSV): apropos of a great epidemia. Revista Medica Clínica las Condes. 15(4): 127-130. • Hall, CB., Powell, KR., MacDonald, NE., Gala, CL., Menegus, ME., Suffin, SC. 1986. Respiratory syncytial viral infection in children with compromised immune function. New England Journal of Medicine. 315(2):77-81. • Hasan, J., Chavez, S., Mejías, A., Goméz, A, Ríos, A., Nassi, S., Yusuf,M., Kapur, P., Hardy, R., Hatfield, J., Rogers, B., Krisher, K., Ramilo, O. 2004. Respiratory Syncytial Virus Induces Pneumonia, Cytokine Response, Airway Obstruction, and Chronic Inflammatory Infiltrates Associated with Long-Term Airway Hyperresponsiveness in Mice. The Journal of Infectious Diseases. 189:1856–65 • Herrero, T. Manual de Alergia. I Parte. Consultado el día 01/02/06. Disponible en: www.cofa.org.ar/Cursos/archivos/alergia.doc. • Hull, J., Thomson, A., Kwiatkowski, D. 2000. “Association of respiratory syncytial virus bronchiolitis with interleukin 8 gene region in UK families”. Thorax; 55: 1023-1027. • Hussell, T., Pennycook, A., Openshaw, PJ. 2001. Inhibition of tumor necrosis factor reduces the severity of virus-specific lung immunopathology. European Journal of Immunology. 31(9): 2566-2573. • Jafri, HS. 2002. Role of chemokines in respiratory Syncytial virus disease. Pediatric Infectious Disease Journal. 21(5): 454–456. • Krishnan, S., Craven, M., Welliver, R., Ahmad, N., Halonen, M. 2003. Differences in Participation of Innate and Adaptive Immunity to Respiratory Syncytial Virus in Adults and Neonatos. Journal of Infectious Diseases. 188(3): 433-439. • Kiniwa, M., Gateley, M., Chizzonite, R., Fargeas, C., Delepesse, G. 1992. Recombinant interleukin-12 suppresses the synthesis of immunoglobulin E by interleukin 4-stimulated human lymphocytes. J Clin Invest. 90(1): 262-266. • Kurt-Jones, E.A., Popova, L., Kwinn, L., Haynes, L., Jones, L., Tripp, R., Walsh, E., Freeman, M., Golenbock, D., Anderson, L., Finberg, R. 2000. Pattern recognition receptor TLR4 and CD14 mediate response to respiratory syncytial virus. Nat. Immunol (1): 398-401. • Laham FR., Isaraele V., Casellas JM. 2004. inflammatory cytokines between “Differential production of primary infection with human metapneumovirus and other common respiratory viruses of infancy”. J infect. Dis. 189: 1199-1206 • Lahiri, D., Ghosh C. 1999. Interactions between melatonin, reactive oxygen species, and nitric oxide. Annals of the New York Academy of Science. 893: 325-330. • Legg, J., Hussain, I., Warner, JA., Johnston, SL., Warner, Q. 2003. Type 1 and Type 2 Cytokine Imbalance in Acute Respiratory Syncytial Virus Bronchiolitis. American Journal of Respiratory and Critical Care Medicine 168: 633-639. • Lemanske, RF. 2003 Does respiratory sincitial viral-induced broncholitis result from helper T cell type 1/type 2 cytokine imbalance. American Journal of Respiratory and Critical Care Medicine. 168: 625-627. • Lérida, A., Marrón, A., Casanova, A., Rosón B., Carratalá, Gudiol. 2000. Infección por virus respiratorio sincitial en adultos ingresados por neumonía adquirida en la comunidad. Enf. Infec. Microb. Clin. 18 (4) 177181. • Liu, B., Kimura, Y. 2007. Respiratory syncytial virus protects againts the subsequent development of Japanese cedar pollen-induced allegic responses. J Med Virol. 79(10): 1600-5. • Lorente. F., Laffond. E., Moreno. E., Dávila. I. 2001. Infección vírica y asma: mecanismos inmunológicos. Allergologia et Immunopathologia 29(3): 126 – 132. • Mandell G; Dolin R; Bennet J. 1999. Mandell Enfermedades Infecciosas Principios y Practica. 4ta Edición Editorial Médica Panamericana. • McNamara PS, Smyth RL. 2005. “The pathogenesis of respiratory syncytial virus disease in childhood”. Br Med Bull; 61: 13-28. • Mejías, A; Chávez, S; Ríos, AM; Fonseca, M; Gómez, AM; Jafri, HS; Ramilo, O. 2004. Asma y virus respiratorio sincicial. Nuevas oportunidades de intervención terapéutica. Anales de Pediatria 61 (3): 252-260. • Melnick JC. Taxonomy and classification of viruses. 1999. En: Murray PR. Manual of Clinical Microbiology, 7ªed. Washington: Am Society Micobiol. • Ministerio de Salud de Nicaragua. 2003. Virus Sincitial Respiratorio (VSR). Boletín Epidemiológico de Nicaragua. Semana 44. • Ministerio Para el Poder Popular para la Salud. Venezuela. 2006. Boletín Epidemiológico. Semana N° 50. p 18. Morier, L; Pérez, L; Cancio, R; Savón, CL; González, Z; Goyenechea, A. 1996. Comparación de la línea NCI-H292 con otras líneas continúas para la multiplicación de virus respiratorios. Revista Cubana de Medicina Tropical. 48(3). • Mullol, J; Xaubet, A; Gaya, A; Roca-Ferrer, I; López, E; Fernández, JC. 1995. “Cytokine gene expression and release from epithelial cells”. A comparison study between healthy nasal mucosa and nasal polyps. Clin Exp Allergy; 25: 607-615. • Noah, TL; Henderson, FW; Henry, MM; Peden, DB; Devlin, RB. 1995. Nasal lavage cytokines in normal, allergic, and asthmatic school-age children. American journal of respiratory and critical care medicine. 152(4): 1290-1296. • Noah, TL; Henderson, FW; Wortman, TA; Devlin, RB; Handy, J; Koren, HG; Becker, S. 1995. Nasal cytokine production in viral acute upper respiratory infection of childhood. Journal of Infectious Diseases. 171(3): 584-592. • Noah, T; Becker, S. 2000. Chemokines in nasal secretions of normal adult experimentally infected with respiratory syncytial virus. Clin. Immunol. 97: 43-49. • Noda, Y; Mori, A; Liburdy, R; Packer, L. 1999. “Melatonin and its precursors scavenge nitric oxide”. J Pineal Res. 27: 159-163. • Oh, JW; Lee, HB; Park, IK; Kang, JO. 2002. “Interleulin-6, interleukin-8, interlukin-11 and interferon-gamma levels in nasopharyngeal aspirates from wheezing children with respiratory syncitial virus or influenza A virus infection”. Pediatr. Allergy immunol. 13: 350-356. • Openshaw P. 2002. Potential therapeutic implications of new insights into respiratory syncytial virus disease. Respir Res. 3(1): S15-S20. • O’Sullivan, S. 2005. Asthma Death, CD8+ T Cells, and Viruses. The Proceedings of the American Thoracic Society. 2: 162-165. • Pala, P., Bjarnason, R., Singurbergsson, F., Metacalfe, C., Sigurs, N,. Openshaw, PJM. 2002. Enhenced IL-4 responses in childred with a history of respiratory syncytial virus bronchiolitis in infancy. Eur Respir J. 20: 376-82. • Picazo, J. J. 2002. Desarrollo de vacunas frente al Virus Sincitial Respiratorio. Vacunas. 3 (2): 12-15. • Phipps, S., Lam, CE., Mahalingam, S., Newhouse, M., Ramirez, R., Rosenberg, HF., Foster, PS., Matthaei, KI. 2007. Eosinophils contribute to innate antiviral immunity and promote clearance of respiratory syncytial virus. Blood. 110(5): 1578-86. • Punnoen J, Aversa G, Cocks BG, Mckenzie ANJ, Menon S, Zurawski G.1993. Interleukin 13 induces interleukin-1 independent IgG4 and IgE synthesis and CD23 expression by human B cells. Proc Natl Acad Sci USA. 90: 37303734. • Recomendaciones para el diagnóstico y tratamiento de las infecciones respiratorias agudas bajas en menores de 2 años. 2006. Arch. Argent. Pediatr.104:2. • Roche P, Lambert S, Spencer J. 2003. Surveillance of viral pathogens in Australia. Communicable Diseases Intelligence. 27(1): 117-122. • Rodríguez, M; Gómez, F, Sánchez J. 1999. Las Citocinas y su papel en el Asma Bronquial y la Rinitis. Revista de la Asociación de Neumonologos del Sur. 11(2):52-67. • Roman N, Calhoun W, Hinton K et al. 1997. Respiratory syncytial virus infection in infants is associated with predominant Th-2- like response. Am J Respir Crit Care Med. 156:190-195. • Rosete, D; Archuandia, J; Cabello, C; Manajarrez, ME. 2002. “Patogenia de las infecciones respiratorias por virus” Rev. Inst. Nal. Enf. Resp. Méx. Vol. 15(4):239-254. • Skaricic, D., traube, C., De B, J., Boyer, J., Cristal, RG., Worgall, S. 2008. Genetic delivery of an anti-RSV antibody to protect againt pulmonary infection with RSV. Virology. 378(1): 79-85. • Salaxi, H; Chan-Yeung, M. 1989. Interleukin-1 potentiates antigen-mediated arachidonic acid metabolite formation in mast cells. Clinical & Experimental Allergy. 19(6): 637-642. • Sanmugalingham, D; De Vries, E; Gauntlett, R; Symon, F; Bradding, P; Wardlaw, A. 2000. Interleukin-5 enhances eosinophil adhesion to bronchial epithelial cells Clinical and Experimental Allergy. 30(2): 255-263. • Simoes EA. 1999. Respiratory syncytial virus infection. Lancet. 354: 847852. • Subramaniann, BRAY MA. 1987. “Interleukin-1 releases histamine from human basophi1s and mast cells in vitro”. J Immunol 1987; 138: 271-275. • Sullender, WM. 2000. Respiratory Sincytial Virus and antigenic diversity. Clin Microbiol Rev. 13 (1):1-15, table of contents. • Tian, B; Zhang, Y; Luzón, BA. 2002. Identification of NF-kB–dependent gene networks in respiratory syncytial virus-infected cells. Journal of Virology. 76(13): 6800–6814. • Tristam DA., Welliver RC. 1999. Respiratory Sincytial Virus. En: Murray PR. Manual of Clinical Microbiology, 7ªed. Washington: Am Society Micobiol. • Van Schaik, SM; Tristam, DA; Nagpal, IS; Hintz, KM; Welliver, RC; Welliver, RC. 1999. “Increased production of interferon-gamma and cysteinyl leukotrienes in virus-induced wheezing”. J Allergy Clin Immunol; 103:630– 636. • Van Overveld, FJ., Jorens, PHG., Rapampart, M., De Backer, W., Vermeire, PA. 1991. “Tumour necrosis factor stimulates human skin mast cells to release histamine and untase”. Clin Exp Allergy. 21: 711-714. • Welliver, RC., Wong, DT., Sun, M., Middleton, E Jr., Vaughan, RS., Ogra, PL. 1981. The development of respiratory syncytial virus-specific IgE and the release of histamine in nasopharyngeal secretions after infection. The New England Journal of Medicine. 305(15): 841-846. • Whimbey, E; Couch, RB; Englund, JA; et al. 1995. Respiratory syncytial virus pneumonia in hospitalized adult patients with leukemia. Clinical Infectious Diseases. 21(2): 376-379. • Welliver R. 2000. Immune response. Weisman LE, Groothuis JR, editors. Contemporary diagnosis and management of respiratory syncytial virus. Handbooks in Health Care. Newtown, p: 94-121. ANEXOS