LAS SUSTANCIAS Y SU IDENTIFICACIÓN
Anuncio
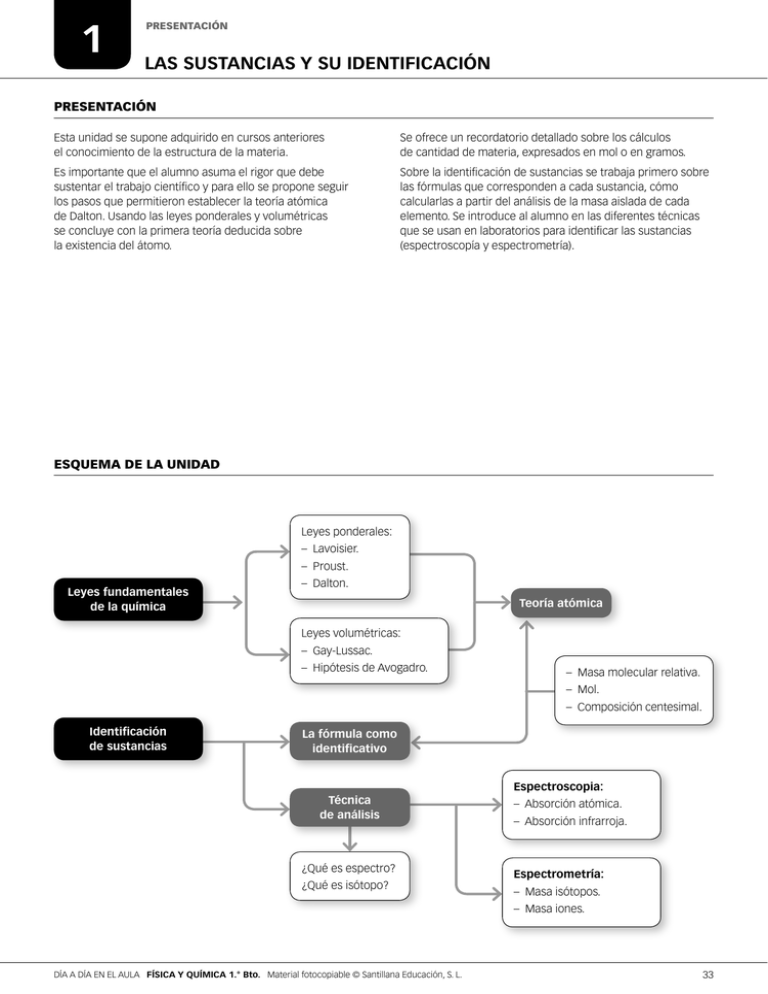
1 PRESENTACIÓN LAS SUSTANCIAS Y SU IDENTIFICACIÓN PRESENTACIÓN Esta unidad se supone adquirido en cursos anteriores el conocimiento de la estructura de la materia. Se ofrece un recordatorio detallado sobre los cálculos de cantidad de materia, expresados en mol o en gramos. Es importante que el alumno asuma el rigor que debe sustentar el trabajo científico y para ello se propone seguir los pasos que permitieron establecer la teoría atómica de Dalton. Usando las leyes ponderales y volumétricas se concluye con la primera teoría deducida sobre la existencia del átomo. Sobre la identificación de sustancias se trabaja primero sobre las fórmulas que corresponden a cada sustancia, cómo calcularlas a partir del análisis de la masa aislada de cada elemento. Se introduce al alumno en las diferentes técnicas que se usan en laboratorios para identificar las sustancias (espectroscopía y espectrometría). ESQUEMA DE LA UNIDAD Leyes ponderales: – Lavoisier. – Proust. Leyes fundamentales de la química – Dalton. Teoría atómica Leyes volumétricas: – Gay‑Lussac. – Hipótesis de Avogadro. – Masa molecular relativa. – Mol. – Composición centesimal. Identificación de sustancias La fórmula como identificativo Espectroscopia: Técnica de análisis ¿Qué es espectro? ¿Qué es isótopo? – Absorción atómica. – Absorción infrarroja. Espectrometría: – Masa isótopos. – Masa iones. DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 33 1 PROBLEMAS RESUELTOS LEYES PONDERALES PROBLEMA RESUELTO 1 El hierro y el oxígeno forman un compuesto. Se realizan una serie de experiencias en las que se combinan determinadas cantidades de los dos elementos; en cada caso se mide la cantidad de óxido que se forma y las cantidades de hierro y oxígeno que sobran. Completa los huecos que faltan en la tabla siguiente: Experiencia Hierro (g) A 5,58 B 7,44 C 12 D Oxígeno (g) Óxido de hierro (g) Hierro que sobra (g) Oxígeno que sobra (g) 7,98 0 2,64 0 0 2,24 0 1,42 6,1 3,2 8,5 La información que obtenemos de cada experiencia es: • En la experiencia B se indican las cantidades de oxígeno y hierro que se combinan sin que sobre de ninguno de los elementos. Estas cantidades indican la proporción en que se combinan el oxígeno y el hierro. De acuerdo con la ley de conservación de la masa, la cantidad de óxido de hierro que se forma es la suma de las cantidades de los elementos que se combinan: 7,44 + 3,2 = 10,64 g • En la experiencia A se indica la cantidad de hierro que se combina, sin que sobre nada, y la cantidad de óxido de hierro que se forma. Por diferencia entre estas dos cantidades calculamos la cantidad de oxígeno que se combina. 7,98 g de óxido - 5,58 g hierro = 2,4 g de oxígeno se combinó Como nos dice que sobran 2,64 g de oxígeno, la cantidad que había inicialmente será la que se combinó más la que sobró: 2,4 g de oxígeno se combina + 2,64 g de oxígeno sobra = 5,04 g oxígeno había inicialmente • En la experiencia C la cantidad de hierro inicial y la que sobra nos permite conocer la cantidad de hierro que se combina: 12 g de hierro inicial - 2,24 g hierro sobra = 9,76 g de hierro se combinan Utilizando las proporciones que deducimos de la experiencia B podremos calcular la cantidad de oxigeno que reacciona y de óxido que se obtiene. 9,76 g de hierro ? 10,64 g óxido de hierro = 13,96 g óxido de hierro 7,4 g de hierro Como no sobra nada de oxígeno, la cantidad de este elemento que reacciona es la que había inicialmente: 13,96 g óxido de hierro - 9,76 g hierro = 4,2 g de oxígeno • En la experiencia D sabemos la cantidad de oxígeno que había inicialmente y la que sobra; por diferencia, podremos calcular la que reaccionó: 8,5 g de oxígeno inicial - 6,1 g óxígeno sobra = 2,4 g de oxígeno se combinan Utilizando las proporciones que deducimos de la experiencia B podremos calcular la cantidad e hierro que reacciona y de óxido que se obtiene. 2,4 g de oxígeno ? 10,64 g óxido de hierro = 3,43 g óxido de hierro 7,44 g de oxígeno 7,98 g óxido de hierro - 2,4 g oxígeno se combinan = 1,03 g de hierro se combinan La cantidad de hierro que se combina sumada a la que sobra nos dirá la cantidad de hierro que había inicialmente: 1,03 g de hierro se combinan + 1,42 g hierro sobra = 2,45 g de hierro inicial 34 DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 1 PROBLEMAS RESUELTOS LEYES PONDERALES Resumen Experiencia Hierro (g) Oxígeno (g) Óxido de hierro (g) Hierro que sobra (g) Oxígeno que sobra (g) A 5,58 5,04 7,98 0 2,64 B 7,44 3,2 10,64 0 0 C 12 4,2 13,96 2,24 0 D 2,45 8,5 3,43 1,42 6,1 ACTIVIDADES 1 El hierro y el oxígeno pueden formar dos óxidos diferentes. Se analizó la composición de una serie de experiencias y se encontraron los siguientes resultados: Muestra Oxígeno (g) Hierro (g) A 3,2 7,44 con la formación de lluvia ácida. Experiencias realizadas en el laboratorio determinan que cuando se hacen reaccionar 4 L de gas nitrógeno con 8 L de gas oxígeno, se forman 8 L de ese gas, estando todos los gases en idénticas condiciones de presión y temperatura. Sabiendo que el oxígeno y el nitrógeno forman moléculas diatómicas, justifica la molécula del gas que se forma. B 1,6 5,58 Sol.: NO2 C 3,2 3,2 D 0,8 2,79 3 Entre las muestras anteriores localiza: a) Dos que se refieran al mismo compuesto. b) Dos que se refieran a compuestos diferentes que cumplan la ley de las proporciones múltiples. Sol.: N2: sobran 4 L, O2: se consume todo; NO2: se forman 4 L e) Una muestra cuyo análisis revela un compuesto imposible. d) Si la fórmula de uno de los óxidos es FeO, ¿Cuál es la del otro? Sol.: a) B y D; b) A y B, A y D; c) C; d) Fe203 2 Cuando el nitrógeno reacciona con el oxígeno forma una serie de óxidos, uno de los cuales está relacionado En una experiencia de laboratorio se pusieron en condiciones de reaccionar 8 L de gas nitrógeno y 8 L de gas oxígeno. Determina la cantidad del óxido de nitrógeno del que se hablaba en el ejercicio anterior se podrá obtener si todos los gases se encuentran en las mismas condiciones de presión y temperatura. 4 El cloro y el cobre forman dos compuestos, el CuCI y el CuCI2. Analizada una muestra de CuCl se han encontrado 5 g de cobre y 2,8 g de cloro. Si la muestra fuese de CuCI2 y tuviese 10 g de cobre. ¿Cuál sería la masa de cloro? Sol.: 11,2 g DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 35 1 PROBLEMAS RESUELTOS LA TEORÍA ATÓMICO-MOLECULAR DE LA MATERIA PROBLEMA RESUELTO 2 El sulfato de amonio (NH4)2SO4, es una sustancia que se utiliza como abono. Para abonar un terreno se han sintetizado 2 kg de esta sustancia. Calcula: a) Los moles de oxígeno que se han utilizado. b)Los gramos de azufre que se añaden al terreno. c)Los átomos de hidrógeno que contienen. d)La masa de abono que deberíamos utilizar si queremos añadir al terreno un billón de billones (1024) átomos de nitrógeno. e)La composición centesimal del sulfato de amonio Datos: M(N) = 14,01 g/mol; M(H) = 1,008 g/mol; M(O) = 16,00 g/mol; M(S) = 32,06 g/mol Inicialmente tenemos que determinar la masa molar del sulfato de amonio, La estequiometría del compuesto nos permitirá establecer el resto de las relaciones. También tenemos que conocer que en 1 mol hay 6,022 ? 1023 partículas. M((NH4)2SO4) = (14,01 +1,008 ? 4) ? 2 + 32,06 + 16,00 ? 4 = 132,1 g/mol 1 mol 2 ? 103 g de (NH4)2SO4 ? = 15,14 mol (NH4)2SO4 132,1 g a) 15,14 mol de (NH 4) 2 SO 4 ? 4 mol O = 60,5 mol de O 1 mol de (NH 4) 2 SO 4 b) 15,14 mol de (NH 4) 2 SO 4 ? 32,06 g de S = 484,2 g de S 1 mol de (NH 4) 2 SO 4 c) 15,14 mol de (NH 4) 2 SO 4 ? 8 mol H 6,022 ? 10 23 átomos ? = 7,3 ? 10 25 átomos de H 1 mol de (NH 4) 2 SO 4 1 mol d) 10 24 átomos de H ? 1 mol de (NH4) 2 SO 4 132,1 1 g de (NH 4) 2 SO 4 1 mol de H ? ? = 27,4 g de (NH 4) 2 SO 4 6,022 ? 10 23 24 átomos de H 1 mol de H 1 mol de (NH 4) 2 SO 4 e) Se trata ele determinar los gramos de cada elemento que hay cada 100 g de compuesto: 2 ? 14,01 g de N ? 100 = 21,2 % de N 132,1 g de (NH 4) 2 SO 4 8 ? 1,008 g de H ? 100 = 6,1% de H 132,1 g de (NH 4) 2 SO 4 32,06 g de S ? 100 = 24,3 % de S 132,1 g de (NH 4) 2 SO 4 4 ? 16,06 g de O ? 100 = 48,4 % de O 132,1 g de (NH 4) 2 SO 4 ACTIVIDADES 1 Una de las características a tener en cuenta en un abono es su riqueza en nitrógeno. Determina si es más rico el nitrato de potasio, KNO3, o el cloruro de amonio, NH4CI. 3 Sol.: 69,92 % de Fe en Fe203; 77,72 % de Fe en FeO Sol.: r iqueza del KN03, 13,85 %; riqueza del NH4Cl: 26,77 % 4 2 En una bombona tenemos 10 g de gas oxígeno, O2. Calcula cuántas moléculas y cuántos átomos de oxígeno tenemos. ¿Y si el gas fuese Argón? Sol.: m oléculas O2: 1,88 ? 1023; átomos O: 3,76 ? 1023; átomos de Ar: 1,51 ? 1023 36 Cuando el hierro se combina con oxígeno forma dos óxidos, de fórmula Fe2O3 y FeO. Calcula el porcentaje en hierro de cada uno de ellos. Para hacer una preparación necesitamos 1,23 g de nitrógeno que los vamos a obtener del nitrato de calcio, Ca(NO3)2. ¿Cuántos gramos de ese compuesto debemos utilizar? Sol.: 5,1 g DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 1 PROBLEMAS RESUELTOS FÓRMULA DE LAS SUSTANCIAS PROBLEMA RESUELTO 3 El potasio forma una oxisal con cloro y oxígeno. Al calentar 5 g de la oxisal se desprende oxígeno dejando un residuo de 3 g de otra sal de cloro y potasio. Se disuelve en agua esta segunda sal y se le añade nitrato de plata, AgNO3, en exceso obteniéndose 5,77 g un sólido que resulta ser AgCI. Determina la fórmula química de las dos sales que forma el potasio. Nota: el potasio no forma compuesto insoluble con el ion nitrato. Datos: Las masas atómicas relativas se encuentran en la tabla periódica. Siguiendo la serie de las reacciones podremos determinar la cantidad de K, O y CI que hay en cada una de las dos sales de potasio. KxClyOz " KwClp O2 + 5g De esta reacción deducimos que en la muestra de la oxisal hay 2 g de O. 3g Si determinamos la cantidad de CI que hay en el AgCI que se formó, podremos conocer la cantidad de CI que había en la sal KwClp y en KxClyOz. Por diferencia, podremos conocer la cantidad de K que hay en cada una de esas sales. MAgCl = 107,9 + 35,45= 143,4 g/mol KxClyOz KwClp 35,45 g Cl 5,77 g Ag Cl ? = 1,43 g Cl 143,4 g Ag Cl 5g 3g 1,57 g K 1,43 g Cl 2gO 1,57 g K 1,43 g Cl 3 g de KwClp - 1,43 g Cl = 1,57 g de K Conocida la proporción en masa en que se combinan los elementos en cada uno de los compuestos, obtendremos la proporción en moles para llegar a determinar su fórmula. La fórmula de la oxisal será del tipo: KxClyOz. x = 1,57 g de K ? 1 mol de K 1 mol de Cl = 0,04 mol de K ; y = 1,43 g de Cl ? = 0,04 mol de Cl ; 39,1 g de K 35,45 g de Cl 1 mol de O z = 2 g de O ? = 0,125 mol de O 16 g de O La fórmula del compuesto es del tipo: K0,04CI0,04O0,125. Los subíndices deben ser números enteros sencillos que mantengan esta proporción. Para encontrarlos dividimos ambos números por el más pequeño: K 0,04 Cl 0,04 O 0,125 & K1Cl1O 3,1 & KClO3 0,04 0,04 0,04 La fórmula de la otra sal es del tipo: KwClp 1 mol de K 1 mol de Cl w = 1,57 g de K ? = 0,04 mol de K ; p = 1,43 g de Cl ? = 0,04 mol de Cl 39,1 g de K 35,45 g de Cl la fórmula del compuesto es del tipo, K0,04Cl0,04 & KCl. ACTIVIDADES 1 El nitrato de cadmio cristaliza en forma de hidrato. Cuando se calientan 3 g de la sal hidratada a 110 °C hasta peso constante se obtiene un residuo de 2,36 g. Determina la fórmula del hidrato. 2 Un óxido de cromo tiene un 68 % de cromo. Determina su fórmula. Sol.: Cr2O3 Sol.: Cd(NO3)2 ? 4H2O DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 37 1 MÁS PROBLEMAS FICHA 1 LEYES FUNDAMENTALES DE LA QUÍMICA Nombre: Curso: Fecha: EJEMPLO Tenemos dos muestras de compuestos diferentes formados por los mismos elementos. Un análisis del primero revela que nuestra muestra contiene 95,85 gramos de cloro y 129,6 gramos de oxígeno. El análisis de la segunda muestra da como resultado 127,8 gramos de cloro y 57,6 gramos de oxígeno. Comprueba que se cumple la ley de las proporciones múltiples (o de Dalton). En el primer compuesto por cada gramo de oxígeno hay x gramos de cloro: 95,85 g de Cl x g de Cl = 129,6 g de O 1 g de O & x = 0,74 g de Cl g de O En el segundo compuesto, por cada gramo de oxígeno hay y gramos de cloro: 127,8 g de Cl y g de Cl = 57,6 g de O 1 g de O & y = 2,22 g de Cl g de O Las cantidades de cloro que reaccionan con un gramo de oxígeno en cada compuesto están en relación: g de Cl 1 g de O = 3 g de Cl 2,22 g de O 0,74 Una relación sencilla de enteros. Se cumple, por tanto, la ley de proporciones múltiples (o de Dalton). PROBLEMAS PROPUESTOS 1 Existen tres óxidos de azufre en los que los porcentajes de azufre son 66,67 %, 57,14 % y 40 %, respectivamente. Comprueba si se cumple la ley de las proporciones múltiples. 2 La formación de 2 L de vapor de agua exige la participación de 2 L de hidrógeno y 1 L de oxígeno (todos los gases en las mismas condiciones de presión y temperatura). Razona si las siguientes afirmaciones son verdaderas o falsas. a) De las proporciones anteriores se deduce que en este caso no se cumple la ley de conservación de la masa de Lavoisier. b) De las proporciones anteriores se deduce que se cumple la ley de los volúmenes de combinación de Gay‑Lussac. c) De las proporciones anteriores se deduce que en una reacción química el número de moléculas puede variar. d) En los 2 L de vapor de agua hay el mismo número de moléculas que en los 2 litros iniciales de hidrógeno. 38 DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 1 MÁS PROBLEMAS FICHA 2 LEYES FUNDAMENTALES DE LA QUÍMICA Nombre: Curso: Fecha: PROBLEMAS PROPUESTOS 3 Un químico ha obtenido en su laboratorio un compuesto y al analizar su composición ha comprobado que contiene 45,77 g de cinc y 22,45 g de azufre. Otro químico ha obtenido el mismo compuesto mediante un procedimiento diferente, y en su caso el compuesto está formado por 71,92 g de cinc y 35,28 g de azufre. Comprueba si se cumple la ley de las proporciones definidas. 4 El dióxido de cloro, ClO2, es un gas que se utiliza en la industria del papel como agente blanqueante; tiene también una acción germicida, por lo que se emplea en la potabilización del agua. Se puede obtener en el laboratorio haciendo reaccionar los gases cloro y oxígeno. (La formulación de este compuesto es una excepción a las normas IUPAC). En la tabla siguiente se muestran los datos correspondientes a algunas experiencias de su fabricación en el laboratorio. Completa los datos que faltan teniendo en cuenta que en todos los casos, tanto los gases que reaccionan como los que se obtienen se encuentran en las mismas condiciones de presión y temperatura. Experiencia cloro (L) oxígeno (L) dióxido de cloro (L) cloro que sobra (L) oxígeno que sobra (L) A 3 6 6 0 0 0 0 B 5 C 3 D 3 3 2 DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 1 39 1 MÁS PROBLEMAS FICHA 3 MEDIDA DE LA CANTIDAD DE SUSTANCIA Nombre: Curso: Fecha: EJEMPLO El dióxido de nitrógeno es un gas tóxico que se produce en combustiones a temperaturas elevadas como las que tienen lugar en los motores de los coches. Debido a los problemas pulmonares que produce, la Unión Europea establece un máximo de 40 microgramos por metro cúbico en el aire. Calcula el número de moléculas de dióxido de nitrógeno que habrá en el aire por metro cúbico cuando se alcance dicho máximo. La masa molecular del dióxido de nitrógeno es: M(NO2) = 14,01 + 16,00 ? 2 = 46,01 u Un mol de dióxido de nitrógeno tiene una masa de 46,01 g. Como en el máximo de contaminación permitida hay 40 mg/m3, hay: g de NO 2 mol m3 = 8,69 ? 10-7 3 m g de NO 2 46,01 mol 40 ? 10-6 Cada mol tiene el número de Avogadro de moléculas, NA = 6,022 · 1023. Por tanto el número de moléculas de dióxido de nitrógeno por metro cúbico que hay en el aire es: 8,69 ? 10-7 moléculas mol moléculas ? 6,022 ? 10 23 = 5,23 ? 017 3 m m3 mol PROBLEMAS PROPUESTOS 5 Considera un cubo vaso de agua lleno hasta el borde. Si suponemos que el volumen es de 300 cm3, calcula: a) El número de moléculas de agua que hay en el vaso. b) El número de átomos de hidrógeno y de oxígeno que hay en el vaso. Datos: M (H) = 1,008 g/mol; M (O) = 16,00 g/mol; dH O = 1 g/cm3. 2 6 Calcula, en gramos, la masa de una molécula de ácido sulfúrico. Datos: M (H) = 1,008 g/mol; M (O) = 16,00 g/mol; M (S) = 32,06 g/mol; NA = 6,022 ? 1023 partículas/mol. 40 DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 1 MÁS PROBLEMAS FICHA 4 MEDIDA DE LA CANTIDAD DE SUSTANCIA ‑ FÓRMULA DE LAS SUSTANCIAS Nombre: Curso: Fecha: PROBLEMAS PROPUESTOS 7 Ordena de mayor a menor masa las siguientes cantidades: a) 50 mol de ácido nítrico. c) 1027 átomos de helio. b) 1026 moléculas de dióxido de carbono. d) 5 kg de hierro. Datos: M(H) = 1,008 g/mol; M(He) = 4,003 g/mol; M(C) = 12,00 g/mol; M(N) = 14,01 g/mol; M(O) = 16,00 g/mol; M(Fe) = 55,85 g/mol; NA = 6,022 ? 1023 partículas/mol. 8 La fórmula molecular de la cafeína es C8H10N4O2. Calcula a) La masa molecular de la cafeína. b) La masa de un mol de cafeína. c) El número de moléculas de cafeína que hay en 100 g de esta sustancia. d) Los átomos de hidrógeno que hay en 100 g de cafeína. Datos: M(H) = 1,008 g/mol; M(C) = 12,00 g/mol; M(N) = 14,01 g/mol; M(O) = 16,00 g/mol; NA = 6,022 ? 1023 partículas/mol. DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 41 1 MÁS PROBLEMAS FICHA 5 FÓRMULA DE LAS SUSTANCIAS Nombre: Curso: Fecha: EJEMPLO El análisis de un compuesto ha ofrecido los siguientes resultados: 168 gramos de carbono, 28,2 g de hidrógeno y 224 g de oxígeno. Sabiendo que su masa molecular es de 60,032 unidades de masa atómica, calcula su fórmula empírica y molecular. Datos: M(H) = 1,008 g/mol; M(C) = 12,00 g/mol; M(O) = 16,00 g/mol. Sabemos que la masa de un mol de átomos de carbono es 12,00 g, la de un mol de átomos de hidrógeno es 1,008 g y la de un mol de átomos de oxígeno es de 16,00 g. Así que en el análisis de ese compuesto se tiene: 168 g de C = 14 mol de átomos de C g de C 12,00 mol 28,2 g de H = 27,98 mol de átomos de H g de H 1,008 mol 224 g de O = 14 mol de átomos de O g de O 16,00 mol En la fórmula los átomos están en la proporción 14 : 28 : 14. Simplificando: 1 : 2 : 1. Y la fórmula empírica es CH2O. Para continuar hasta encontrar la fórmula molecular necesitamos la masa molecular del compuesto: M(CnH2nOn) = 12,00 ? n + 1,008 ? 2n + 16,00 ? n = 30,016 n = 60,03 u & n = 60,032 =2 30,016 Luego la fórmula molecular del compuesto es C2H4O2. PROBLEMAS PROPUESTOS 9 La glicerina se utiliza en la industria de los cosméticos y también en la farmacéutica. Tenemos una muestra de glicerina que contiene 576 g de carbono, 128 mol de átomos de hidrógeno y 2,89 ? 1025 átomos de oxígeno. Sabiendo que un mol de glicerina tiene una masa de 92,06 g, calcula su fórmula molecular. Datos: M(H) = 1,008 g/mol; M(C) = 12,00 g/mol; M(O) = 16,00 g/mol; NA = 6,022 ? 1023 partículas/mol. 42 DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 1 MÁS PROBLEMAS FICHA 6 LEYES PONDERALES ‑ MEDIDAS DE CANTIDAD ‑ FÓRMULAS Nombre: Curso: Fecha: PROBLEMAS PROPUESTOS 10 En un determinado óxido de azufre el porcentaje de azufre corresponde al 40% de la masa total del óxido. Calcula su fórmula empírica. Datos: M(O) = 16,00 g/mol; M(S) = 32,06 g/mol. 11 Al calentar una masa de 3,971 g de cobre se observa que reacciona exactamente con 1,000 g de oxígeno. Al cambiar las condiciones experimentales, 1,000 g de oxígeno reacciona totalmente en este caso con 7,942 g de cobre. a) ¿Qué cantidad de óxido de cobre se formará en cada ensayo? b) ¿Se cumple la ley de proporciones múltiples? c) Calcula la composición centesimal en cada caso. d) Escribe la fórmula empírica de cada uno de los óxidos. Datos: M(O) = 16,00 g/mol; M(Cu) = 63,55 g/mol. DÍA A DÍA EN EL AULA FÍSICA Y QUÍMICA 1.° Bto. Material fotocopiable © Santillana Educación, S. L. 43









