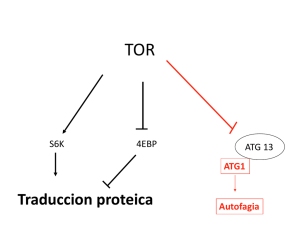
"la autofagia en la degradacion de antigenos" trabajo recepcional
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE BIOANALISIS REGION XALAPA "LA AUTOFAGIA EN LA DEGRADACION DE ANTIGENOS" TRABAJO RECEPCIONAL MODALIDAD MONOGRAFIA PRESENTA: KARIS CRISTINA LLERA GUEVARA DIRECTOR: DR. H&CTOR VIVANCO CID ASESOR TECNICO: DR. ENRIQUE JUAREZ AGUILAR XALAPA, VER. ENERO DE 2008 INDICE PAGINA RESUMEN 1 INTR0DUCCI6N 2 OBJETIVO GENERAL Y OBJETIVOS ESPECIFICOS 3 CAPI'TULO I SISTEMAINMUNEINNATO Y ADQUIRIDO. 1.1 Inmunidad Innata 1.2 Inmunidad Adquirida 1.3 Internalizaci6n y procesamiento de antfgenos para su presentaci6n a trav6s de MHC Clase II. 1.4 Procesamiento de antfgenos para su presentacidn a trav6s de MHC Clase I. 1.5 Procesamiento de antfgenos para su presentaci6n a trav£s de Mol6culas CD1. 9 10 14 CAPfTULO II ASPECTOS GENERALES DEL FEN&MENO DE AUTOFAGIA 2.1 Definici6n de Autofagia. 2.2 Importancia biol6gica en diferentes tipos celulares. 2.3 Tipos de Autofagia. 23 23 24 24 CAPiTULO III LA AUTOFAGIA Y SU IMPORTANCIA EN LA GENERACI6N DE RESPUESTA INMUNE 3.1 Papel de la Autofagia en la Inmunidad Innata. 3.1.1 Autofagia en la defensa inmune innata a virus y del mecanismo de Autofagia. 3.2 Papel de la Autofagia en la Inmunidad Especffica. 3.2.1 Entendiendo el principio de compartimentalizacibn durante el procesamiento y presentacidn de antfgenos. 3.2.2 Autofagia como mecanismo celular que provee antfgenos citosdlicos para su presentacidn no ctesica por mol6culas del MHC clase II. 3.2.3 Mecanismos de seftalizaci6n que regulan el mecanismo de Autofagia. 4 4 6 32 32 36 38 38 40 42 CONCLUSIONES 44 GLOSARIO 45 REFERENCES BIBLIOGRAFICAS 50 RESUMEN El termino "Autofagia" define al proceso celular que se lieva a cabo en diferentes pobtaciones celulares y en donde componentes citos6licos son degradados hasta sus constituyentes primarios mediante enzimas lisosomales. La Autofagia incluye la degradaci6n de las protefnas solubles en el citosol, pero tambi6n de organelos tales como mitocondrias o peroxisomas. La Autofagia tambi6n se relaciona como una funcidn protectora. Cuando hay un dafio celular, se activa este proceso eliminando la c6lula dafiada del tejido o los componentes celulares defectuosos. En la actualidad se ha resaltado el rol que desempefta la Autofagia y su relacibn con la defensa inmunol6gica ya que participa en la defensa contra los patdgenos intra y extracelulares llevando a cabo el secuestro, la degradaci6n y eliminaci6n de patbgenos bacterianos y protozoarios. En algunos casos, el mecanismo de Autofagia es utilizado por patdgenos para infectar y crecer dentro de las c6lulas hu6sped, pero en otros casos la Autofagia puede funcionar como mecanismo de protecci6n contra la infecci6n. En el caso particular de las infecciones virales, se ha comenzado a conocer mds acerca de c6mo el mecanismo de autofagia contribuye a potenciar la respuesta inmune a este particular grupo de agentes pat6genos ya que el mecanismo de autofagia, es responsable de preparar el compartimento citos6lico y de esta forma componentes virales, tales como RNA de cadena sencilla o cadena dobie, DNA viral o proteinas virales, son atrapados y dirigidos hacia compartimentos endociticos de la cglula hu6sped. Oiversos estudios han demostrado que la Autofagia potencia la inmunidad innata y las respuestas adaptativas, en paralelo, algunas mol6culas efectoras del sistema inmune tales como citocinas, receptores y f us ligandos celulares que participan en la inmunidad innata y adaptativa, tambten regulan el proceso de autofagia en un mecanismo de retroalimentacidn. En general, existe una correlacidn entre la activaci6n de autofagia por mediadores inmunol6gicos y el control de la infieccton con pat6genos intracelulares. INTR0DUCCI6N La Autofagia o autofagocitosis es un proceso celular natural que tiene lugar en el interior de las c£lulas de manera normal. Consiste en la digestibn y degradacibn de aquellas partes de la c6lula que ya estdn envejecidas, y que han de ser sustituidas por otras nuevas. La Autofagia tiene lugar en las c6lulas de cualquier organismo vivo, cuando la c6lula carece de nutrientes o bien es sujeta a condiciones de "estrGs" celular, aumenta la tasa de Autofagia y la c6lula obtiene energia de si misma. La Autofagia es un mecanismo involucrado en diferentes tipos celulares en eucariontes. El estudio de este proceso celular ha cobrado gran interns en los Oltimos aftos, al demostrarse que su participaci6n o bien la carencia de esta, impacta en la homeostasis celular, incluyendo otros procesos tales como muerte celular programada, en el desarrollo y la diferenciacidn celular, as! como en la senectud celular. Oe la misma forma, se ha estudiado y caracterizado la participaci6n del fendmeno de autofagia en patologlas severas como el cancer, enfermedades neurodegenerativas y miopatfas. Una de las areas que esten siendo exploradas en la actualidad con gran auge, es la participaci6n de la Autofagia en el contexto de defensa inmunoi6gica. En el presente trabajo se abordan los aspectos mds relevantes del fen6meno de autofagia, incluyendo aspectos generales del fendmeno y enfocando la participacidn de este proceso celular dentro del sistema inmunoldgico de un hospedero, principalmente en el procesamiento y la presentaci6n de antlgenos. OBJETIVO GENERAL El presente trabajo tiene como finalidad exponer la importancia sobre el fendmeno de Autofagia y su relaci6n especifica con el sistema inmunoldgico. OBJETIVOS ESPECiFICOS • Resaltar el papel que desempefla la autofagia en la defensa de un hospedero. • Resumir la relaci6n de este proceso celular con el procesamiento y presentacidn de antfgenos que llevan a cabo c6iulas del sistema inmunol6gico. • Abordar los mecanismos de supresi6n de la Autofagia que emplean ciertos microorganismos para favorecer la infecci6n viral o la supervivencia bacteriana en eventos de infeccidn. • Aportar material bibiiogrdfico de consulta sobre el tema para la actualizaci6n de profesionales relacionados al campo de la salud, asf como catedr£ticos relacionados con las materias de Inmunologfa, biologfa celular y molecular. CAPlTULO I SISTEMA INMUNE INNATO Y ADQUIRIDO 1.1 INMUNIDAD INNATA El sistema inmune innato participa de manera relevante durante los primeros momentos de exposici6n a un antfgeno, a trav6s de la inducci6n de una respuesta inflamatoria, proceso que se genera principalmente a trav6s de la participaci6n coordinada de los siguientes componentes: 1) Barreras ffsicas y qufmicas, (epitelios) y las sustancias antimicrobianas sintetizadas en estas superficies. 2) C6lulas fagocfticas como Neutr6filos y Macr6fagos. 3) C6lulas no fagocfticas como c6lulas asesinas naturales (C6lulas NK), C6lulas cebadas (o mastocitos) y eosinbfilos. 4) Protefnas presentes en la sangre, que incluyen componentes del sistema del Complemento y otros mediadores de la inflamaci6n que son producidos al inicio de un evento de infecci6n (protefnas de fase aguda). 5) Protefnas que son producidas por c£lulas del sistema innato que reciben el nombre gen£rico de citocinas, las cuales regulan y coordinan numerosas actividades de las c6lulas de la inmunidad innata e influyen de manera determinante sobre c6lulas del sistema inmune adquirido. La visidn modema, considera a este sistema no s6lo como un conjunto de mecanismos inespecfficos de defensa, sino como el elemento crftico para el inicio de una respuesta inmune especflica e incluso como elemento clave que influencfa el tipo de respuesta adquirida que se general durante una infecci6n o bien durante la exposici6n a un antfgeno de naturaleza no infecciosa. 1,2 El primer reto del sistema inmune innato es discriminar entre un gran numero de molgculas presentes en patbgenos potenciales y componentes propios del hospedero, usando para este fin, receptores celulares o protefnas solubles denominados receptores de reconocimiento de patrones (PRRs). Existen protefnas con caracterfsticas de PRRs, involucradas en diferentes procesos tales como endocitosis mediada por receptor, fagocitosis, activacibn y sfntesis de mediadores inflamatorios, como lo son: Lectinas tipo C (tales como lectina que une manosa o MBL, DEC-205, receptor de manosa), receptores para detritus celulares o "scavenger", Pentrexinas (protefna C reactiva y protefna s&ica amiloide, tambi6n conocidas como protefnas de fase aguda), tranferasas de Ifpidos: como la protelna que une al lipopolisacdrido (LBP), protefna bactericida potenciadora de la permeabilidad (BPIP), integrinas (CD11b, CD11c, CD18), CD14 y una de las familias de receptores m£s estudiada y de mayor importancia en los ultimos afios: la familia de los receptores hom6logos a Toll (TLRs). Estos receptores se localizan en la superficie de las c6lulas del sistema inmune del hospedero y reconocen en los microorganismos patdgenos, una serie de mol6culas de naturaleza piincipalmente lipopolisacarfdica o protefca las cuales se denominan "Patrones Moleculares Asociados a Pat6genos" (PAMPs). Estos PAMPs son estructuras sujetas a poca variabilidad y ser diferentes a los componentes propios, con lo cual se constituyen como excelentes blancos de la respuesta inmune, como lo son el lipopolisaccirido (LPS) de las bacterias Gram-negativas, los gcidos lipoteicoicos (LT) y peptidoglicana (PGN) de bacterias Gram-positivas, lipoarabinomananas de Mycobacterias (LAM), Lipopeptidofosfoglicana (LPG) de Entamoeba histolytica entre otros. Los PAMPs al ser reconocidos por los PRRs expresados en las c6lulas efectoras, inducer) mecanismos que llevan a la respuesta inmune innata a poner en alerta al hospedero con respecto a la presencia de agentes pat6genos, induciendo la expresi6n de una serie de citocinas de tipo proinflamatorio, como lnterleucina-1J3 (IL-1(3), Interleucina 6 (IL-6), Factor Estimulante de Colonias de Granulocitos-Macr6fagos (GM-CSF), Factor de Necrosis Tumoral-a (TNF-a)(11) e lnterleucina-12 (IL-12), asf como quimiocinas tales como IL-8, Rantes, MIP-1a y MIPip y mol6culas de adhesi6n celular. La producci6n de estos mediadores inflamatorios es de vital importancia para el reclutamiento de m&s c6lulas al sitio de infecci6n (piincipalmente neutrdfilos y macr6fagos), asf como para dar inicio a una respuesta inmune de tipo especffico.1,2 Interrelacidn de la respuesta inmune innata y especffica ante un evento de infeccidn Muchos microorganismos pat6genos han evolucionado de tal forma que logran resistir los mecanismos de la inmunidad innata, de modo que su eliminacidn requiere los potentes mecanismos de la inmunidad adquirida. Las respuestas inmunitarias adquiridas utilizan muchos de los mecanismos efectores de la inmunidad innata para eliminar los microorganismos y suelen actuar aumentando la actividad antimicrobiana de los mecanismos de defensa de la inmunidad innata. El inicio y desarrollo de las respuestas inmunitarias adquiridas requieren que los antfgenos sean capturados, degradados (procesados) y expuestos a linfocitos especfficos, siendo este proceso conocido como P R O C E S A M I E N T O Y P R E S E N T A C I O N D E ANTLGENOS. ES aquf en donde el presente trabajo pretende enfocarse a mayor detalle y ligar este concepto con el proceso de AUTOFAGIA. Las c6lulas especializadas que desempeftan la funci6n de procesar y presentar antfgenos, reciben el nombre de C6lulas Presentadoras de Antfgenos (CPAs que son C6lulas Dendrfticas, macr6fagos y linfocitos B). Las C6lulas Dendriticas, resultan ser las mds eficientes CPAs que capturan los antfgenos microbianos y los transportan a los 6rganos linfeticos, en donde los presentan a los linfocitos T. Ademds de que son la unica poblaci6n celular capaz de estimular la respuesta de linfocitos T que nunca han visto el antfgeno para el cual son especfficos, es decir a los linfocitos T vfrgenes (del t6rmino en ingl6s Naive).SA 1.2 INMUNIDAD ADQUIRIDA El sistema inmune adquirido es capaz de reconocer y reaccionar frente a un gran numero de sustancias microbianas y no microbianas. Ademds tiene una extraordinaria capacidad para distinguir entre moteculas y microorganismos diferentes, incluso muy relacionados y, por esta raz6n, tambi£n se denomina inmunidad especffica. Existen dos tipos de respuestas inmunitarias adquiridas, denominadas inmunidad humoral e inmunidad celular, cuya funcibn es eliminar distintos tipos de antfgenos. Tipo celular C6lulas Dendrfticas (CD) Macrbfagos Linfocitos B Mol6culas de clase I de MHC Expresi6n constitutiva. Aumenta en forma marcada en CD maduras. Moteculas coestimulatorias Expresi6n constitutiva (baja). Aumenta en forma marcada en CD maduras. Expresidn constitutiva (baja). Aumenta en macr6fagos activados. Expresi6n constitutiva (baja). Aumenta en linfocitos B activados. Expresidn constitutiva (muy baja). Aumenta en macrdfagos activados. Expresidn constitutiva (baja). Aumenta en linfocitos B activados. Funcibn como CPA Activaci6n de c£lulas T Naive e inicio de la respuesta inmune primaria. Activaci6n de c6luias T efectoras y de memoria e induccibn de la respuesta inmune secundaria. Activaci6n de c^lulas T efectoras y de memoria e induccibn de la respuesta inmune secundaria. Activaci6n de c£lulas T efectoras y de memoria e induccibn de la respuesta inmune secundaria. Tabla N° 1: Propiedades de las CPAs profesionales. (Reguelro-Gonzdlez, 2004) Inmunidad Humoral Estd mediada por anticuerpos presentes en la sangre y las secreciones mucosas, que son producidas por linfocitos B, los cuales, reconocen los antfgenos extracelulares (incluidos los de la superficie celular) y se diferencian en c£lulas productoras de anticuerpos denominadas c6lulas plasmdticas.4,6 Inmunidad Celular Este mediada por los linfocitos T, favorece la destrucci6n de los microorganismos que residen y proliferan en los fagocitos o de las c6lulas infectadas con el fin de eliminar los reservorios de la infeccidn. Los linfocitos T se dividen en linfocitos T cooperadores (CD4) y linfocitos T citot6xicos (CD8). En respuesta a la estimulacidn antigGnica, los linfocitos T cooperadores sintetizan protefnas denominadas citocinas, cuya funci6n es estimular la proliferacidn, activacidn y la diferenciaci6n de los linfocitos T y de otras c6lulas. Los Linfocitos T citot6xicos destruyen las c6lulas que producen antfgenos extrafios, (como virus y otros microorganismos intracelulares), asf como c6lulas tumorales. Los linfocitos T s6lo reconocen antfgenos que se unen a protefnas del hu6sped que est£n codificadas por genes del Complejo Principal de Histocompatibilidad (MHC por sus siglas en ingles), que se expresan en la superficie de las CPAs iniciando una respuesta celular. En la actualidad, ademds de conocer los mecanismos para la presentacibn y generaci6n de respuestas a pgptidos, conocemos tambten la participaci6n de un tercer sistema de presentacidn antig6nica, el cual permite la respuesta de linfocitos T y de otras poblaciones tales como c6lulas NKT y c6lulas T y8 (los cuales reconocen y lisan c6lulas infectadas por virus de manera adaptativa) no s6lo para antlgenos de naturaleza proteica, sino tambidn para el reconocimiento especlfico de Ifpidos y glucolfpidos en el contexto de molgculas CD1 (Cluster o grupo de diferenciacibn 1). Las molGculas del MHC clase II son capaces de unir y presenter antfgenos de naturaleza polisacarfdica para la inducci6n de respuestas celulares a este tipo de mol6culas; descubrimiento que rompi6 con el dogma de que sdlo fragmentos de protefnas (p6ptidos) pueden ser presentados a trav6s de moteculas del MHC clase II. 4'6 En lo que se refiere al sistema de presentaci6n a trav6s de C01, actualmente se conoce que constituye en si una familia de mol6culas cuyos genes esten localizados fuera de la regi6n que codifica para las mol6culas del MHC. En el humano existen 5 genes que codifican para diferentes isoformas de CD1. Estos genes, se iocalizan en el cromosoma 1 y no presentan gran polimorfismo. De los 5 genes CD1 en el humano, cuatro de ellos se expresan como protefnas funcionales y son designados como CD1a, CD1b, CD1c y CD1d. En el caso de CD1 existen mOltiples formas alternativas que se generan por un mecanismo de "splicing" alternativo del RNA y que se Iocalizan intracelularmente. Este grupo de genes surgi6 de la duplicacibn de un locus ancestral que dio oiigen ademds de esta familia, a las mol6culas del MHC clase I. 1.3 INTERNALIZACI6N Y PROCESAMIENTO DE ANTfGENOS PARA SU PRESENTACI6N A TRAVltS DEL MHC CLASE II Existen protefnas que son parte de un microorganismo o de algun antfgeno de naturaleza no infecciosa que pueden ser engullidas mediante un mecanismo de internalizaci6n celular, esto sucede con veslculas endosomales membranosas, donde posteriormente serdn degradadas gradualmente al ser expuestas a un pH dcido y enzfmas proteollticas celulares. Aun cuando la estructura completa de cada protefna finalmente se destruye, se producen muchos pSptidos cuyas longitudes y secuencias varfan de acuerdo con la secuencia de la protelna original, la especificidad de la rotura de los enlaces determinada por las proteinasas que actuan sobre ellos, su conformati6n plegada y su accesibilidad para ser degradados, entre otros factores. La gran mayorfa de las moteculas de clase II se asocia en el retfculo endopldsmico con una tercera protefna conocida como cadena invariante (no presenta polimorfismo), la cual acompaffard a las moteculas de clase II con una doble misi6n: bloquear el sitio de uni6n del p6ptido y retener el complejo dentro de la c6lula, desviSndolo hacia la ruta endocftica.6 A continuaci6n en la figura ntimero 1, se ilustra las diferentes regiones de la mol6cula del MHC clase II. Figura N° 1: Las mol6culas de clase II estdn compuestas de una cadena alfa polimorfa y una cadena (3. (Abbas ,2004). En la ruta endocftica las moteculas de clase II aparecen en compartimentos celulares especiales denominados MIIC (compartment peptide loading o compartimento de carga de p6ptido) los cuales contienen protefnas extracelulares y presenta un pH dcido con alta actividad proteolftica. En estos compartimentos la mayoria de la cadena invariante esta ya degradada y solamente permanece unido a las mol6culas de clase II un segmento de cadena invariante, un pequefto p£ptido denominado CLIP (por p6ptido de cadena invariable relacionado con la clase II) y que ocupa precisamente la hendidura de uni6n del pgptido. Este p6ptido es extraldo de esa hendidura para ser reemplazado por los distintos p6ptidos endosomales que serdn transportados por las moteculas del MHC de clase II al exterior de la c£lula. Para este intercambio de CLIP por otros p6ptidos se requiere la acci6n de la motecula HLA-DM, un heterodfmero formado por dos cadenas a y p. Su funcidn es la Iiberaci6n de CLIP de las mol6culas MHC de clase II cuando 6stas se Iocalizan en el endosoma actuando como una enzima que cataliza esta reacci6n. Los complejos de clase II forman entonces agregados y estdn listos para recibir pgptidos. Algunos p6ptidos generados en el citoplasma pueden unirse a las moteculas de dase II en el CPL. El mecanismo por el cual estos pgptidos llegan hasta el compartimento MHC II es desconocido, aunque y a la inversa: de manera excepcional (y s6lo en macr6fagos y c6lulas dendrfticas) los endosomas dejan escapar pgptidos al citoplasma, desde donde pueden llegar a la ruta de MHC clase I. A esta presentacidn por la ruta de clase I de pGptidos adquiridos extracelularmente se le llama presentacidn cruzada.6,7 1.3 PROCESAMIENTO DE ANTfGENOS PARA SU PRESENTACI6N A TRAVIS DE MHC CLASE I Las protefnas antig6nicas tambi6n pueden derivar de patdgenos intracelulares como los virus, y algunas bacterias (Chlamydia, Shigella, Rickettsia y Listeria) y par&sitos (Toxoplasma). Los antfgenos provenientes de 6stos se procesan mediante una secuencia de eventos que participan en el metabolismo normal de las protefnas. La degradaci6n protefnica es en el citosol dentro de grandes complejos de multisubunidades enzimdticas (proteasomas) los cuales llevan a cabo la degradaci6n de protefnas citos6licas que se encuentran dafiadas, que fueron plegadas de manera incorrecta, o bien, marcadas para su destruccibn o reciclaje rdpido POR UBIQUITINAClON y tambidn protefnas derivadas de pat6genos intracelulares. Algunos de 6stos pgptidos despu6s se relacionan con protefnas del MHC clase I y son liberados a la superficie celular para presentarse ante los linfocitos T CD8. Caracterfstlca Vfa endocftica Vfa citosdlica Protefnas extracelulares sometidas a endocitosis (del hospedero y extraftas). Protefnas de membrana (del hospedero y extraftas). Protefnas citos6licas del hospedero o de pat6genos intracelulares (virales, bacterianas, parasitarias). P6ptidos de seftal (del hospedero y extrafios). Maquinaria para procesamiento Enzimas lisosomales. Proteasomas (incluyendo protefnas de bajo peso molecular). Tipos celulares donde se activa. CPA profesionales. Todas las c£lulas nucleadas. Sitio de unidn antigenoMHC. Vesfculas, lisosomas COMPARTIMENTOS endocfticos TARDfOS. Retfculo endopldsmico rugoso. MHC utilizado. Clase II Clase 1 Presenta a C6lulas T CD4 (cooperadoras) C6lulas T CD 8 (citotdxicas). Fuentes principales de antfgenos. Tabla N° 2: Resumen de las Vfas de procesamiento de antigenos. (Goldsby RA, 2006). Aunque las vlas de degradaci6n citos6lica y endocftica son independientes, algunos pat6genos se procesan a trav6s de ambas; por ejemplo, el contenido de las vesfculas endocfticas pocas veces se libera hacia el citosol (quizes por medio de la lisis de la membrana de las veslculas) en un fen6meno denominado presentacidn cruzada del termino "Cross Priming", el cual transfiere antfgenos potenciales de la vfa endocftica a la citos6lica. Por el contrario, las protefnas codificadas a partir del genoma viral que se integran a membranas celulares (por ejemplo; las glucoprotelnas de superficie de virus con envoltura) son canalizadas a las membranas de las veslculas endocfticas y consignadas a la vfa endocftica. En el presents trabajo se aborda a profundidad el mecanismo de autofagia, en el cual material citos6lico puede ser dirigido a la via endocftica, para la generacidn de respuestas mediadas a trav6s del MHC clase II. Esta via se describird a detalle en el capitulo 3. Las moldculas de clase I son "cargadas" con pgptidos en el retlculo endopl£smico, justo despubs de su biosfntesis. Para introducirse en el retlculo endoptesmico necesitan de las protefnas TAP (transportadores asociados con el procesamiento de antfgenos). Estas son codificadas por dos genes localizados dentro de la regidn del MHC de clase II (TAP 1 y TAP 2), son miembros de la familia de protefnas transportadoras, las cuales son capaces de transportar activamente mol6culas, incluidos pequeflos p6ptidos, a trav6s de las membranas del retfculo endoptesmico. TAP 1 y TAP 2 se asocian para formar dimeros cuya funci6n consiste en transportar los pgptidos generados en el citosol hacia el interior del retfculo endoplasmic*). Tapasina es una tercera motecula que actua de puente uniendo el heterodfmero TAP a las moteculas de clase I, para facilitar la carga de pgptidos. Cuando el p6ptido entra en el retfculo endopldsmico los dfmeros de clase I "vacfos" reci6n formados permanecen unidos al complejo TAP, el p6ptido se fija a los sitios de la mol6cula de clase I. A continuaci6n el complejo P6ptido-clase I se libera de la tapasina y puede salir del retfculo endopldsmico y transportarse a la superficie celular. Los genes LMP2 y LMP7 (large multifunctional proteasome o gran proteasoma multifuncional), que estan tambten localizados en la regi6n de clase II, codifican sendas protefnas que, a su vez, forman parte de un gran complejo polipeptldico denominado proteasoma. Este complejo es el responsable de llevar a cabo la mayor parte de toda la actividad proteolftica que se detecta en el citoplasma. Se cree que gran parte de los p6ptidos que mets tarde se unirdn a las molbculas de dase I, son generados predsamente por la actividad de este proteasoma.6,7 Como se observa en la figura numero dos las mol6culas de clase I constan de dos cadenas polipeptfdicas unidas de forma no covalente: una cadena alfa codificada por el MHC de 44 kD y una subunidad no codificada la p-2 microglobulina para fijarse a p6ptidos de 8-11 aminodddos con conformaddn extendida y flexible. Las molGculas de clase I que no se plieguen adecuadamente, que no sean capaces de interaccionar de forma correcta con 0-2microglobulina o que no lleven su cargamento correspondiente de pdptido, son retenidas dentro del retlculo endoptesmico por la acci6n de la calnexina, y, posteriormente, degradadas. Estos procesos de degradaci6n, transporte y carga de p6ptidos en las moteculas de clase I se estdn produciendo de forma constante durante la vida de una c6lula. La funci6n de las mol6culas del MHC de clase I es pues mostrar o sacar hasta la membrana celular una seleccidn suficientemente amplia de p6ptidos de todas las protefnas que estcin siendo sintetizadas por una determinada celula para que los linfocitos T puedan detectar antfgenos de patdgenos o antfgenos tumorales que se generan en forma intracelular. **10 i i 1.5 PROCESAMIENTO DE ANTFGENOS PARA SU PRESENTACI6N A TRAVIS DE MOL£CULAS CD1 En el humano las isoformas de CD1 se dividen en 2 grupos en base a su homologla a nivel de amino£cidos. El grupo I incluye a CD1a, CD1b, CD1c; el grupo II incluye a CD1d, mientras que CD1e no ha sido clasificado a la fecha. Especies tales como el rat6n y rata, carecen de los genes del grupo I y presentan dos genes CD1 con una homologla entre si del 90 al 95%, siendo clasificados como homdlogos de CD1D humano y reciben el nombre de CD1.1 y CD1.2 11'14. Estudios de estructura cristalogr£fica han sido reportados para las mol£culas CD1d del ratdn, as! como las isoformas CD1a y CD1b en el humano.16"18 Estas mol6culas, son en general, glucoprotelnas transmembranales tipo I y esten constituidas por una cadena alfa, que se divide en tres dominios extracetulares (a1, a2 y a3), asociada a (3-2 microglobulina de manera no covalente, presentando gran similitud con las molGculas de clase I del MHC. La asociaci6n de la cadena a, con p-2 microglobulina es necesaria para la expresi6n en superficie de CD1, influyendo en su correcto plegamiento y por lo tanto estabilizando la estructura para su adecuada funcidn. Los dominios a1 y a2 forman un surco en donde se aloja el antlgeno; este surco es mds estrecho y m^s profundo que el presente en las molgculas de clase I. El surco este constitui'do principalmente por amino£cidos no cargados, de naturaleza altamente hidrofdbica. CD1d en el rat6n y CD 1a en el humano, presentan dos sitios de uni6n (pockets) denominados A' y F', mientras que la isoforma CD1b humana, presenta 4 (figura numero 3) (pockets A', C', F' y T'). El sitio de uni6n para antlgeno es incapaz de formar puentes de hidrdgeno con su ligando (como en el caso de moteculas del MHC clase I), debido a la naturaleza del mismo, que s6lo permite interacciones de tipo hidrof6bico. La presencia de cadenas de dcidos grasos en antlgenos de naturaleza glucolipldica favorece su uni6n al surco altamente hidrof6bico de las moteculas CD1, especlficamente a los sitios de uni6n A' y F', en tanto que la porcidn hidrofflica del antlgeno se proyecta hacia el exterior, para ser reconocida por el receptor de la c£lula T. CDld (RAT6N) CDla (HUMANO) «1 tt 2 V A i CDlb (HUMANO) Figura N° 3: Estructura de las isoformas: CD1d (murino). (Zeng Z, et al.1997). CD1a ( Z a j o n c et al. 2003). y CD1 b humanas(Batuwangala T et al, 2004). Distribuci6n celular e intracelular de las isoformas de CD1 Las mol6culas CD1a y CD1b, se expresan en C6lulas Dendrfticas, asi como en timocitos corticales19'20. CD1c se expresa en c6lulas de Langerhans, asi como en un subgrupo de linfocitos B. CD1d se expresa en c6lulas epiteliales, timocitos corticales, hepatocitos, Celulas Dendrfticas, macrofagos y c^lulas B, CD1e se expresa en c6lulas dendrfticas inmaduras, aunque su localizaci6n es intracelular y no se ha detectado asociada a membrana. La estimulacibn de monocitos humanos con GM-CSF e IL-4 induce la expresi6n de las diferentes isoformas de CD1 al diferenciarse a dendrfticas con fenotipo inmaduro21-24 Las isoformas de CD1 en humano, se distribuyen de manera heteroggnea en diferentes compartimentos del interior celular, sitios donde cargan antfgenos. CD1a presenta un patr6n de distribucidn parecido a las mol6culas clase I del MHC, es decir, se localiza en superficie celular, asf como en vesfculas endosomales. CD1b y c se Iocalizan principalmente en membrana plasm£tica asf como en endosomas tardfos y lisosomas, siendo menos evidente su presencia en endosomas tempranos. CD1d se localiza, al igual que CD1b, en endosomas tardfos principalmente. CD1e se localiza intracelularmente en aparato de Golgi y retfculo endopldsmico en cgiulas dendrfticas inmaduras, mientras que en cdlulas dendrfticas maduras sufre una redistribuci6n, localizSndose en endosomas tardfos. La heterogeneidad en la localizaci6n y el tr&fico intracelular de las mol6culas CD1 se explica por la presencia de una secuencia de localizacidn endosomal YXXZ presente en la porcidn citopldsmica, donde Y es tirosina, X cualquier aminodcido y Z un aminodcido con cadena lateral hidrofdbica tal como valina o isoleucina. Esta secuencia permite la asociaci6n de moteculas de CD1 con protefnas adaptadoras (AP) para su correcto tr^fico intracelular hacia endosomas tardfos y compartimento MHC. Dicha secuencia esta presente en CD1b, CD1c y CD1d, pero no en CD1a lo cual explica la exclusi6n de esta ultima de endosomas tardfos 2M®. La eliminacidn de esta secuencia de localizacidn en CD1b en modelos experimentales, resulta en la redistribucibn de la motecula en superficie celular y en la ausencia de presentacidn de antfgenos restringidos por esta isoforma de CD1. Asf pues, para la presentaci6n de llpidos y glucollpidos por moldculas CD1b y CD1d se requiere de transpose del antfgeno hacia endosomas tardfos, mientras que para CD1a no se requiere.27 y I '•'•>• i COA I AV 1 cote ^icrgod CO TB C OD ' MM Figura N° 4: Tr£fico y distribuci6n intracelular de isoformas de CD1 de humano. (Sugita M et at,1999). Mecanismos de internalizacidn para antfgenos que son presentados A traves de CD1 Los principales mecanismos que contribuyen a la captaci6n de antfgenos en las CPAs, lo constituyen la endocitosis mediada por receptor, la fagocitosis y la macropinocitosis. Los macr6fagos y las C6lulas Dendriticas capturan antlgeno vfa vesfculas cubiertas de clatrina, a travbs de los receptores para Fc, complemento o receptores para ligandos especfficos. Existe evidencia de la participaci6n de receptores de superficie celular que favorecen la captura y la internalizacibn de glucolfpidos hacia compartimentos especiales en donde pueden ser cargados por moteculas CD1. Hasta el momenta, s6lo para la motecula LAM se tiene bien caracterizado como ocurre la captura, transporte y presentacibn de este antfgeno. 28'29 El receptor de manosa (RM) presente en la superficie de CPAs, es el responsable de la captura de LAM, asi como de su internalizaci6n y transporte hacia la vfa endosomal. Empleando estudios de microscopia confocal y microscopia electrbnica, se ha demostrado la presencia del RM en compartimentos intracelulares, de manera abundante en endosomas tempranos, en menor proporci6n en endosomas tardfos, en donde colocaliza con C063, marcador especffico de este tipo de endosomas y en ei interior del compartimento MIIC. El RM colocaliza con la motecula de CD1b en endosomas tardfos. La LAM internalizada a trav6s del RM es llevada a endosomas tempranos en donde puede ser liberada debido al pH gcido, para posteriormente transportarse a endosomas tardfos, donde es cargada por CD1b y es presentada a linfocitos T especfficos. Antagonistas como las a-mananas, las cuales se unen al receptor y compiten con la LAM, inhiben la intemalizaci6n y la presentaci6n de este glucolfpido a c6lulas T reactivas, lo cual resalta la importancia de este receptor en la captura del antfgeno. Inhibidores de la acidificacidn endosomal tales como concanamicina A, inhiben la presentaci6n de LAM, lo cual demuestra que la captaci6n de antfgenos por CD1b requiere de acidificaci6n endosomal30 Otro receptor tipo PRR involucrado en la captura de glucolfpidos, es CD14, el cual participa en la captaci6n e internalizacidn de LPS de bacterias Gram negativas, aun cuando no se ha demostrado que la internalizaci6n finalice con la presentacibn de este glucolfpido. Otros mecanismos descritos para la internalizaci6n de glucollpidos, es la integraci6n directa de este tipo de antfgenos en la membrana celular de algunas poblaciones del hospedero, proceso facilitado por la presencia de anclas de glucosilfosfatidilinositol (GPI) y su migraci6n hacia diferentes compartimentos, como lo ejemplifica el caso de LAM y de LPS 31,32. Recientemente se ha descrito que las propiedades intrfnsecas de las mol6culas lipfdicas, tales como la longitud y el grado de saturacidn de las cadenas de gcidos grasos determinan su tr£fico intracelular. Lfpidos con cadenas de £cidos grasos de cadena larga y saturadas, son dirigidos hacfa endosomas tardfos y lisosomas, mientras que llpidos de cadena corta y no saturados, son reciclados a la membrana plasmdtica33. Procesamiento de antfgenos que son presentados a trav6s de CD1 En lo que se refiere a procesamiento antiggnico, se ha sugerido el requerimiento de procesamiento enzimdtico para algunos glucolfpidos mientras que para otros no se ha demostrado. El antfgeno de Mycobacterium tuberculosis denominado trealosa dimicolato es procesado a glucosa monomicolato, siendo necesario dicho procesamiento para lograr la activacidn de ceiulas T especfficas para este Oltimo antfgeno. De la misma forma la mol6cula a-Digalactosil ceramida, tiene que ser procesada con la ayuda de una alfa-galactosidasa lisosomal para generar a-Galactosil ceramida, para ser reconocida y llevar a la activacidn a cdlulas NKT en el contexto de la isoforma CD1d. 38,36 Estos antecedentes refuerzan la idea de que la modificaci6n enzimStica de los motivos de carbohidratos puede producir diferentes determinantes antig6nicos a cdlulas T y diferentes especificidades, igual a lo que ocurre con los peptidos que son generados como producto del procesamiento de protefnas. El procesamiento a nivel de los dcidos grasos puede ser necesario para el correcto acomodo del glucolfpido en el surco de las moldculas CD1. Recientemente se ha descrito la participacidn de protefnas activadoras de esfingolfpidos denominadas saposinas, como mol6culas que intervienen durante el proceso de carga antigdnica para las isoformas CD1b y CD1d humanas. En particular la moldcula SAP-C favorece el acomodo de moteculas llpicas derivadas de mycobacterias en la isorforma CDtb, proceso que realiza en el interior de compartimentos lisosomales. Para la presentacidn del antfgeno alfa-galactosil ceramida, se requiere de la actividad de saposinas, las cuales favorecen la presentacidn de este antfgeno en el contexto de CD1d. La participacidn de estas moteculas ha comenzado un nuevo campo en la investigacidn de protefnas chaperonas que facilitan la presentaci6n de antfgenos de naturaleza glucolpfdica en el contexto de CD1 37,38 Antfgenos presentados por isoformas de CD1 y respuesta celular La primera evidencia que involucr6 a moteculas CD1 como mol6culas presentadoras de antfgenos derivados de pat6genos, foe cuando se demostrd y aisl6 una Ifnea de cglulas T CD4" CD8\ que prolifera en respuesta a antfgenos purificados de Mycobacterium tuberculosis. La posterior caracterizaci6n de ia naturaleza del antfgeno revel6 que 6ste correspondfa a Scido mic6lico, el cual es cargado y presentado en el contexto de CD1b.39,40 La isoforma CDlb presenta adem£s de dcidos micdlicos, LAM, glucosa monomicolato (GMM), ceramidas end6genas asf como gangli6sidos propios del hospedero. La caracterfstica estructural que comparten estos ligandos es la presencia de una regidn hidrofflica y dos cadenas de dcidos grasos. Un requisite para que estos antfgenos puedan cargarse en CD 1b es que se requiere de acidificaci6n endosomal. CD1c presenta el antfgeno aislado de mycobacterias denominado Hexosa-1-fosfoisoprenoide, asf como el antfgeno sintetico Manosilfosfodolicol.41,42 Para moteculas del grupo II de CD1, el antfgeno mejor caracterizado y estudiado es una galactosilceramida derivada de una esponja marina (Agelas mauritanius), la cual es presentada a trav6s de CD1d tanto en humano, como en rat6n, favoreciendo la activacitin de cglulas NKT, especfficas para este antfgeno y restringidas por CD1d, ejerciendo de esta manera una potente funcibn efectora y reguladora.43-48 El principal grupo de cglulas restringidas por CD1 lo constituyen el subgrupo denominado c6lulas NKT el cual expresa un TCR particular e invariante que en el rat6n es Va14-Ja281 asociado con la cadena V(38 principalmente y en el humano es Va24-J aQ asociado con la cadena Vpi1. 8 0 Estas c6lulas NKT son restringidas especfficamente por la molecula CD1d en humano y su homdlogo en el rat6n. Esta poblaci6n expresa marcadores en superficie celular asociados a cblulas NK como: NKR-P1 (NK1.1), CD16, y receptores inhibidores que se unen a las moteculas de clase I como Ly49C (en rat6n) y CD94 (en humano). Todas las c6lulas NKT tanto de ratdn, como de humano, reconocen al antfgeno a-Galactosilceramida en el contexto de CD1d. Estas c6lulas pueden reconocer tambi6n antfgenos de naturaleza lipldica propios del hospedero tales como fosfatidilinositol y fosfatidilglicerol.61 La activaci6n de cblulas NKT induce una serie de eventos que lleva a la producci6n de IL-4 e INF-7. Mediante la sfntesis y liberacibn de estas citocinas las cglulas NKT participan tambi6n en la inmunidad antimicrobiana influenciando la polarizaci6n de respuestas hacia un perfil TH1 o TH2. De manera relevante, el perfil de citocinas secretado por esta poblaci6n ha sido implicado en la regulaci6n de diferentes tipos de respuesta inmune, incluyendo la respuesta a Mycobacterium bovis y Plasmodium falciparum.***6 En pacientes con tuberculosis, la participaci6n de linfocitos T citotdxicos (CD8+) y linfocitos T dobles negativos (CD4"y CDS') con capacidad citolftica que reconocen glucolfpidos tales como dcidos micblicos y LAM de Mycobacterium tuberculosis en el contexto de CD1b. En lesiones de piel de pacientes con lepra que siguen un curso benigno de la enfermedad (lepra tuberculoide), se han identificado c6lulas T restringidas por CD1b, especificas contra Mycobacterium leprae capaces de producir gran cantidad de INF-y, asf como c6lulas dendrfticas que expresan gran densidad de mol6culas CD1. 66,67 Otro subgrupo importante de c6lulas que reconocen isoformas de CD1 lo constituye las cblulas yS citollticas presentes en intestino, que expresan un TCR caracterfstico V51. Este subgrupo en particular reconoce a la motecula CD1c. Aun cuando mucho se ha avanzado en el entendimiento de la naturaleza de los antfgenos que son presentados por CD1, la mayorfa de los trabajos se han enfocado sobre mol6culas presentes en miembros del genero Mycobacterium.M Respuesta inmune a pardsitos a trav6s de la presentacidn de CD1 En lo que se refiere a molbculas presentes en pardsitos que son presentadas a traves del sistema CD1, se conoce que glicoconjugados (glicollpidos y glucoprotefnas) del helminto Schistosoma mansoni presentes durante la fase de eclosi6n del pardsito (durante la deposici6n de huevos de helmintos en hlgado), son capaces de inducir una respuesta inmune celular polarizada al perfil de citocinas TH2 al ser presentados a trav6s de la isoforma CD1d en un modelo de estudio murino. La enfermedad inicialmente genera un perfil de respuesta de citocinas TH1, pero el pardsito al invadir hfgado y depositar los huevecillos en este sitio, genera una potente activacidn de c6lulas NKT, ya que antfgenos presentes en la superficie de esta fase parasitaria, pueden a trav6s de su presentacidn en el contexto de CD1d, lleva a la activacidn de esta poblaci6n celular. ANTIGENO Mrcoljtas ORIGEN RESTRICCION OH OCHs A frVVNAAAAAAAAA^NAAA^AA/SAAA/ ov/s^^^^/vs/vvvyv acidos micolicos OH Mycobacterium Glucosa monomicolato GDI T CC'lt, GlyrcKpfliKiolpas Gal —GaMftc Cvl — Gcl s iW'j ^ ^ ^ ^ s a ^ ^ v ^ ^ / Gangliosido GM1 (ii-iai alfa-galactosilceramida antfgeno propio Esponja Marina COH CD1fl Pnwptioipias ManV myeiieltci-O ^ r.fai"' o ° O fosfatidilinositolmanosidos 9" (30-32) u „p fi hesoxil-l-fosfoisoprenoides Mycobacterium CDU Mycobacterium coic Mycobacterium COIc f»-55) Manosil-l-Fosfodolicol NH, OMS„ O- B — M a n — Man-C4rM»c-nric«ic=<lo»-0 - f - O 0> Fig. N 0 M&n O Glicosilfosfatidilinositol (GPI) antfgeno propio/microbiano CD1<1 5: Estructura de los principales antfgenos que son presentados por las diferentes isoformas de C01 para la inducci6n de una respuesta celular especffica. (Matsuda JL and Kronenberg M, 2001). CAPfTULO II ASPECTOS GENERALES DEL FEN6MENO DE AUTOFAGIA 2.1 DEFINICI6N DE AUTOFAGIA La homeostasis celular es mantenida por la regulation exacta del equilibrio entre la slntesis y la degradaci6n de componentes celulares. Las cOlulas pueden detectar cambios en el microambiente y responder a estos mediante una variedad de respuestas anabOlicas o catabOlicas. Dos son las principales vias implicadas en la degradation de macromolOculas en cblulas eucariotas: la via de ubiquitina / proteasoma y la via de autofagia. La primera participa en la degradation de protelnas de vida corta, manteniendo un volumen controlado de protelnas en la cOlula. Por otra parte autofagia es un proceso celular involucrado en la degradation y en la elimination de proteinas de larga vida y organelos, el cual puede ser objeto de represiOn o induction en respuesta a diferentes estlmulos. Autofagia, literalmente significa "comerse a si mismo", y se define como un proceso mediante el cual, una cOlula es capaz de consumir componentes propios en su interior con diversos fines. Este proceso celular involucra la participation de enzimas lisosomales, proteinas solubles en el citosol, mitocondrias y peroxisomas, las cuales en conjunto llevan a cabo la degradation y la conversion de componentes citosOlicos.60 Este fenOmeno celular puede llevarse a cabo en las siguientes dos etapas: la primera en la cual una cOlula secuestra componentes de su citoplasma en veslculas llamadas autofagosomas. En una segunda etapa, estas vesiculas llegan a fusionarse con compartimentos celulares que son sitios de degradation, conotidos como lisosomas. La vacuola autofdgica es un organelo generable que posee el ambiente apropiado para la actividad catalltica con la cooperation de enzimas hidrollticas, esta caracterlstica la hace capaz de degradar casi cualquier clase de componente celular incluyendo organelos enteros. La autofagia se caracteriza por una morfologla esencialmente id6ntica en piantas, cbluias de ievaduras y en mamiferos. La estructura de una vesicula autotegica consta de una doble membrana y cuando se fusiona con el lisosoma, tanto la membrana interna del autofagosoma, como sus protelnas y el contenido del organelo es degradado por enzimas hidroliticas, pudiendo los productos de degradation ser reticlados. 61 2.2 IMPORTANCIA BIOL6GICA EN DIFERENTES TIPOS CELULARES Autofagia se ha relacionado con proliferation, diferentiaciOn, cdncer, apoptosis y recientemente se ha propuesto como una herramienta que permite a la cOlula obtener energla, £cidos grasos y aminodcidos permitiendo su supervivencia en condiciones adversas. Un mecanismo de autofagia defitiente es tambiOn causante de distintas enfermedades. De acuerdo con su papel esencial en la homeostasis celular, el mecanismo de autofagia ha sido implicado en varias patologias tales como el cdncer, enfermedades neurodegeneratives y miopatlas.92 2.3 TIPOS DE AUTOFAGIA Existen tres tipos de autofagia: la microautofagia, la macroautofagia (referida a partir de aqul como autofagia) y la autofagia mediada por protelnas chaperonas (AMC). A continuaciOn se describen a detalle cada una de estas: MACROAUTOFAGIA La macroautofagia es el proceso donde algunos componentes del citosol son secuestrados primariamente en una estructura denominada preautofagosoma, para conformar despuOs un autofagosoma. El autofagosoma se fusiona entonces con un lisosoma, cuyo contenido rico en enzimas proteollticas e hidrolasas puede tener acceso a la vesicula interior, el llamado cuerpo autotegico. El compartimento que se ha generado y su contenido se llama autofagolisosoma o autolisosoma (Figura ntimero 6). Tras la degradation del contenido, el resultado son macromolgculas que son liberadas de regreso hacia el citosol a trav6s de permeasas para su reutilizaci6n en procesos metab6licos. Alternativamente, la carga puede ser inactivada o digerida cuando la macroautofagia actua como parte de la respuesta inmune para eliminar pat6genos microbianos, punto que sera abordado con mds detalle en el capltulo 3. Figura N° 6: Figura esquemdtica de la generaci6n de macroautofagia. (Rubinsztein DC et al., 2007) La macroautofagia es un proceso altamente regulado principalmente en los pasos de secuestro del contenido citos6lico y progresi6n. La privaci6n de nutrientes es el estlmulo m£s comun para la induccidn del fen6meno de macroautofagia, pero la disminucibn de amino£cidos especlficos reguladores y el aumento de los niveles de glucocorticoesteroides y hormona tiroidea tambign la estimulan. La activaci6n independiente de nutrientes de este tipo de autofagia, es tambign inducida durante un estlmulo apopt6tico. Algunos de los inhibidores fisiol6gicos reconocidos son: la insulina, algunos factores de crecimiento, AMPc y GMPc y condiciones que llevan a la disminucidn de niveles intracelulares de ATP debido a que los pasos de secuestro, fusidn del fagosoma con lisosomas y degradaci6n durante la macroautofagia, son mecanismos dependientes de energla. El efecto de algunos reguladores ftsiol6gicos tambign depende del tejido analizado, por ejemplo, el glucag6n y los agonistas beta-adrengrgicos, que m£s que estimular la macroautofagia, la inhiben en el musculo cardiaco y esquelgtico, mientras que el cldsico efecto inhibitorio de algunos aminodcidos no es visto en cOlulas pancre&ticas. A nivel molecular, las vias de serialization que conectan los diferentes reguladores con el proceso macroautof&gico aun no son tiaras. Las senates intracelulares para esta via incluyen inflamaciOn celular, la movilizatidn de reservas de caltio y la fosforilaciOn de protelnas e hidrOlisis de GTP. Algunas protelnas altamente especializadas denominadas GTPasas participan en el proceso autof&gico. Otras familias de protelna-tinasas teles como la PI3K tambiOn han sido involucradas durante este proceso. Un evento crltico para la induction de macroautofagia, es la activation de una protefna conocida como TOR, la cual es una protelna-tinasa que actOa como un sensor celular. Esta protefna TOR actua como un regulador negativo de la macroautofagia. Cuando TOR no es estimulada por nutrientes o cuando inhibidores especlficos teles como la Rapamicina, la inhiben, por lo tanto la induction de macroautofagia es favoretida. La inactivaciOn de la via TOR aumenta los niveles de la protelna autof&gica Atg8 y la actividad de tinasa de ATG1; estos son puntos clave para initiar la autofagia.62,63 En la figura ntimero 7 se puede observar un esquema de la compleja regulation del fenOmeno de macroautofagia, incluyendo la participation de la protefna TOR como sensor maestro de esta vfa, as! como las protelnas que han sido descritas, y su participation en los dos primeros pasos de macroautofagia: autofagosoma. formation del pre-autofagosoma, y la formation del Figura N° 7: Papel de la protefna Tor como sensor celular y regulador del proceso de macroautofagia. El ensamblaje en la fase de pre-autofagosoma de dos cascadas de conjugaci6n y los dos sistemas de fbsfbrilaci6n permiten la nucleaci6n/ek>ngaci6n de la membrana de aislamiento. La progresi6n de esta membrana de aislamiento hacia la fbrmaci6n de vesfculas que llevan hidrolasas (cvt del ingles hydrolase carrying vesicle) o un autofagosoma es regulado a trav6s de la cascada de seflalizaci6n de la protefna Tor. Abreviaturas: PEA (fosfatidil-etanolamina); Tor (del ingtes: Target of Rapamycine)YCuervo AM et al. 2004). Gracias al gran esfuerzo de diferentes grupos cientfficos hoy en dfa se sabe que existe un complejo grupo de genes implicados en el proceso autofdgico, para los cuales se ha adoptado una nomenclatura en la cual cada gen es designado con la abreviatura ATG (en mayusculas) para referirse a un gen y a sus protelnas como Atg (minusculas). Cada una de las protefnas que son codificadas por genes relacionados con autofagia ademds de denominarse con las siglas Atg llevan un numero progresivo (Atg es la abreviatura para el t6rmino en ingl6s: autophagy-related genes). Dicho numero sirve para diferenciar entre diferentes genes y sus productos. Muchos de los estudios y descubrimientos de genes y protefnas se han realizado empleando sistemas experimentales que hacen uso del estudio molecular en levaduras. La mayorfa de los genes identificados en levaduras son conservados tambign en mamfferos e incluso en plantas. A continuacidn se describen los genes identificados a la fecha en la tabla numero 3. Gen ATG1, ULK ATG3 ATG4 ATG5 ATG6, Beclin 1 ATG7 ATG8, MAPI LC3 ATG9 ATG10 ATG12 ATG16 Funcidn de la protefna Atg1 es una serfna-treonina protefna-cinasa involucrada en la regulacton y la formaci6n de la vesfcula autofdgica. Atg3 funciona como una enzima de conjugaci6n similar a ubiquitina que covalentemente ataca a Atg/LC3 Atg4 es una cistefna-proteasa que actCia sobre la porci6n carboxi-terminal de Atg8/LC3 para exponer residuos de glicina para una conjugaci6n subsecuente. Atg5 es atacada covalentemente por Atg12 y se liga a Atg16 como parte de un complejo tetramgrico de funcidn desconocida. Atg6 es un componente del complejo fosfatidilinositol-3-clnasa (PIK-3) III que es requerido para autofagia. Atg7 es un homblogo de la enzima activadora de ubiquitina; ambas son activadas por Atg8/LC3 y Atg12 antes de la conjugacidn. Atg8/LC3 tiene estructura similar a ubiquitina, es conjugada a fosfatidiletanolamina y es parte del autofagosoma, pero su funclbn no se conoce. Atg9 es una protefna transmembrane que quizd este involucrada liberando la membrana durante la fbrmacidn del autofagosoma. Atg10 funciona como una enzima conjugadora de ubiquitina que ataca covalentemente a Atg12 y Atg5. Atg12 tiene una estructura similar a ubiquitina; se conjuga a una lisina interna de Atg5 por medio de una glicina C- Terminal. Atg16 liga a Atg5 y homo-oligomeriza para formar un complejo tetramgrico. Tabla N° 3: Se describen los genes que participan en el proceso de autofagia, as! como la funci6n de la protefna para la cual codifican en mamlferos. (Rubinsztein DC etal. 2007). MICROAUTOFAGIA La Microautofagia esta involucrada en la captura y degradacidn de regiones completas del citosol por el sistema lisosomal, pero la principal diferencia en comparaci6n con macroautofagia, es que la membrana de captura en este caso es la membrana lisosomal por si misma. La formaci6n de vesfculas intermedias (como por ejemplo el autofagosoma) no es requerida en esta vfa. Como en la macroautofagia, la carga pueden ser protefnas solubles, asl como organelos completes. La microautofagia fue morfol6gicamente descrita en cOlulas de mamlferos como la presencia de organelos similares a lisosomas con multiples veslculas atrapadas en su lumen (cuerpos multivesiculares). Estos cuerpos multivesiculares difieren de los generados en endocitosis, en el sentido de que contienen un lumen acldico y proteasas activas. Recientes estudios han demostrado que la captura del citosol por lisosomas/vacuolas puede adopter formas muy diferentes, desde invaginaciones, formas tubulares, a otras estructuras intermedias. El aislamiento de vacuolas de levaduras ha hecho posible el estudio In Vitro de estas. Esto ha puesto de manifiesto que la vacuola microautof&gica genera estructuras tubulares con multiples ramificaciones que rodean los materiales intemalizados. Este proceso requiere un potencial de membrana intacta y la participation de GTPasas, pero sorprendentemente, es independiente del titoesqueleto y no requiere la presencia de protelnas que normalmente regulan la fusi6n homotlpica de las membranas.63,64 RegulaciOn de Microautofagia La microautofagia es un mecanismo constitutivo de continua degradation de protelnas de larga vida dentro de muchos tipos de cOlulas. Este forma de proteOlisis lisosomal es indiferente de los estlmulos cldsicos que activan la macroautofagia teles como la privation de nutrientes, la regulation por hormonas teles como el glucagon o bien por aminodcidos regulatorios. Recientemente, una forma de microautofagia conocida como pexofagia que conduce a la degradation preferential de peroxisomas mediante la absortiOn directa por la vacuola microautofagica; esta se ha identificado en levaduras. AUTOFAGIA MEDIADA POR PROTEfNAS CHAPERONAS (AMC) La caracterlstica principal de la AMC, en comparaciOn con la macro y microautofagia, es que las protefnas sustrato son dirigidas directamente hacia el lumen de lisosomas sin previa formation de veslculas intermedias. Este tipo de autofagia, es una via lisosomal de proteOlisis que es responsable de la degradation del 30% de las proteinas citosOlicas en conditiones de privacidn prolongada de nutrientes. Protefnas chaperonas molecufares en el citosol y en el lumen de lisosomas son responsables de estimular esta via proteolltica. Las protefnas chaperonas en citosol desdoblan protefnas sustrato antes de su traslado a travgs de la membrana lisosomal. Un componente fundamental de la autofagia mediada por chaperonas es un receptor en la membrana lisosomal, conocido como protefna de membrana asociada a lisosomas tipo 2a (lamp-2a). Recientes resultados muestran que la autofagia mediada por chaperonas es tambign activada por el estrgs oxidativo, y en este caso la expresidn de lamp- 2a se incrementa debido a regulaci6n transcripcional. AMC puede reducirse mediante inhibidores de la glucosa 6fosfato deshidrogenasa y de la protefna de choque tgrmico de 90 kDa (hsc90) La reducci6n de los niveles de lamp-2a utilizando estrategias de RNA interferente, reducen la actividad de AMC. AMC se activa en la mayorfa de las cglulas, pero se ha estudiado mds en fibroblastos, hfgado y riftdn. AMC es activada durante la privacidn de nutrientes por tiempos prolongados, como en el hambre o la eliminacidn de factores de crecimiento en suero en cglulas en cultivo.64,86 El motivo KFERQ en las protefnas sustrato La mayorfa de los sustratos conocidos para autofagia mediada por chaperonas contienen una secuencia de aminogcidos (motivo) relacionada con el pentapgptido KFERQ. Esa secuencia esta presente en el 30% de las protefnas citos6licas y es determinante en el reconocimiento de las protefnas que ser£n degradadas mediante este mecanismo. Es posible que secuencias similares a KFERQ puedan ser generadas en algunas protefnas por modificaci6n post-traduccional. Este motivo es reconocido en el citosol por la protefna de choque tgrmico de 73kDa (hsc73), un miembro de la familia de chaperonas hsp70. La interacci6n entre el sustrato y hsc73 estg regulada por nucle6tidos, y por otras co-chaperonas (figura ntimero 8). El complejo sustrato/chaperdn es dirigido a la membrana lisosomal, donde se une a la protefna-receptor, lamp-2a. El sustrato interactda directamente Con lamp-2a a travgs de una regi6n diferente al motivo KFERQ, ocupada por la chaperona. El desdoble del sustrato es necesario para su transporte hacia los lisosomas. La multimerizacibn de lamp-2a es necesaria para la translocation del sustrato por lo tanto, es posible que la asociacibn de multiples moteculas lamp-2a pueda ser suficiente para crear una discontinuidad en la membrana lisosomal, necesaria para el transporte de los sustratos.66-68 Figura N° 8: Modelo Hipotetico para el transporte de proteinas citos6licas hacia lisosomas mediada por autofagia mediada por protefnas chaperonas. En condiciones de estr6s, el motivo KFERQ en la secuencia de aminodcidos de las protefnas citosdlicas, es reconocida por un chaperbn citos6lico y sus co-chaperones. Ei complejo sustrato/chaperdn se une a una proteina de membrana lisosomal (lamp-2a) y el sustrato junto con el receptor de membrana, son translocados hacia el lumen del lisosoma mediante la ayuda de un chaper6n lisosomal. Mediante un mecanismo aun desconocido se disocian el chaper6n y el receptor del sustrato, el cual es rdpidamente degradado por proteasas lisosomales. Abreviaturas: hsc73 (proteina de choque termico de 73 kDa); lamp-2a (protefna de membrana asociada a lisosomas 2a); Lyshsc73 (hsc73 lisosomal).(Cuervo AM et al. 2004). CAPlTULO III LA AUTOFAGIA Y SU IMPORTANCE EN LA GENERACI6N DE RESPUESTA INMUNE La importancia de la autofagia en la defensa contra los patdgenos intra y extracelulares ha sido reconocida por varios estudios recientes. En especial la macroautofagia participa activamente en el secuestro, la degradaci6n y eliminacibn de patdgenos bacterianos y protozoarios. En el presente capftufo se sintetiza la informaci6n mas reciente en relaci6n al proceso de autofagia, como mecanismo de defensa inmune innata y especffica. 3.1 PAPEL DE AUTOFAGIA EN LA INMUNIDAD INNATA El rol de la autofagia en el hospedero en la eliminaci6n de patdgenos intracelulares, ha recibido considerable atenci6n en alios recientes. Se reconoce ahora que la autofagia participa como mecanismo de defensa innata, al restringir algunas de las infecciones virales y la replicacidn de bacterias y pardsitos intracelulares. Uno de estos ejempios es la infeccibn por L monocytogenes, la cual es una bacteria intracelular facultativa que puede sobrevivir en macrdfagos e invadir cglulas no fagocfticas como las cglulas epiteliales, hepatocitos y cglulas endoteliales. Durante la infecci6n por este patggeno, las cglulas fagocfticas internalizan esta bacteria. En el interior de un fagosoma, la bacteria prepara un ambiente hostil con pH dcido. Este microambiente, permite que la bacteria secrete una exotoxina (listeriolisina O) que es capaz de lisar la membrana del fagosoma, mucho antes de que gste complete la fusi6n con los lisosomas, organelos ricos en proteasas bactericidas. Lo anterior permite a la bacteria escapar al citoplasma, su nicho intracelular. En el citoplasma, la bacteria prolifera y se disemina a las cglulas adyacentes por un mecanismo de contacto cglula a cglula sin exponerse al ambiente extracelular y evadiendo la respuesta inmune de esta forma. Para contrarrestar este mecanismo de evasi6n de la respuesta inmune, macr6fagos infectados utilizan el mecanismo de autofagia para engullir la bacteria que ha escapado hacia el citoplasma y regresarla al ambiente hostil que representan los lisosomas donde la bacteria es degradada eficientemente y la infeccidn es controlada parcialmente.69 Otro ejemplo de la participation de autofagia en la defensa inmune innata a patOgenos, lo constituye la bacteria Staphylococcus aureus, la cual es eliminada por degradation autof&gica. Esta bacteria es eficazmente secuestrada y degradada en compartimentos lisosomales.70 En experimentos in vitro, usando Hneas celulares deficientes en la proteina Atg5 -/-, las cuales son deficientes en la maquinaria autotegica, la bacteria se multiplica sin control. Curiosamente, entre las distintas cepas de S. aureus. Algunas cepas viruientas incluidas las cepas que son resistentes a fdrmacos tales como meticilina, han puesto de manifiesto una marcada resistentia a la elimination por autofagia.71 El patOgeno Gram-negativo, Salmonella typhlmurium reside y se replica en compartimentos vinculados a las membranas. Un subconjunto de las bacterias que son internalizadas en cOlulas presentadoras de antlgeno, daAan la membrana y escapan de compartimentos fagosomales. Se ha demostrado recientemente que estas bacterias que han escapado colocalizan con la proteina autotegica LC3. Otro ejemplo de patOgeno que es controlado a travOs de autofagia, lo es Francisella tularensis, la cual es una bacteria que escapa al citoplasma, sitio donde se replica, tras replicarse, esta bacteria se reintroduce al compartimento endocltico por medio de un proceso mediado por la autofagia, a pesar de que no se observa degradation bacterial.72,73 En el caso de la infection por micobacterias se ha comprobado que estas pueden interferir con la fusiOn entre fagosomas y lisosomas (impiden la maduratiOn que resultarla en la biogenesis de fagolisosomas). Otro mecanismo que recientemente se ha descrito es que M. tuberculosis puede accesar al citoplasma y de esta forma evadir el ambiente hostil de fagolisosomas. La activation de la autofagia ya sea fisiolOgicamente (es detir, por inanition) o farmacolOgicamente (tratamiento con rapamitina) incrementa la colocalisaciOn de la Micobacteria con constituyentes lisosOmicos y tambiOn con las protelnas autOfagas Beclin-1 y LC3. A nivel estructural, se ha observado que las vacuolas contenlan bacilos y membranas intemas caracteristicas de los autofagolisosomas. La activation de macrOfagos con el IFNy estimula la autofagia y reduce la carga bacteriana. La estimulatiOn de la via autofdgica re-direcciona a las bacterias a un compartimento en el que los patOgenos son eliminados.72,73 Evasi6n de la respuesta Inmune innata y del mecanismo de autofagia. Atgunas bacterias y virus utiiizan la maquinaria del proceso de autofagia para invadir los tejidos de un hospedero. Por ejemplo, Porphyromonas gingivalis y Brucella abortus se Iocalizan en autofagosomas y su virulencia o la capacidad replicativa est£n asociadas con este evento. Ourante la infecci6n, estos patdgenos son secuestrados en fagosomas e inducen autofagia, promoviendo asf la fusidn del fagosoma con vacuolas autofagicas en lugar de endosomas. Este hecho impide la degradacidn del agente patdgeno por hidrolasas lisosomales. La maduracidn de autofagosomas se ve afectada en las cglulas infectadas con P. gingivalis y cepas de B. Abortus. Las vacuolas autofagicas tambign proporcionan a estos agentes patdgenos los nutrientes que facilitan su crecimiento en compartimento autofggico. 73 La inhibicidn de la autofagia, reduce la persistencia de P. gingivalis en las cglulas infectadas. Legionella pneumophila y Coxiella burnetii, que son capaces de crecer en lisosomas, pueden utilizar las vacuolas autofggicas para invadir nuevas vesfculas. M£s recientemente, se ha descrito que Salmonella induce la muerte celular de macrdfagos mediante la activacidn de macrdfagos. Esta bacteria entdrica induce la formacidn de vesfculas multimembranosas similares a autofagosomas, estructuras que contienen tanto marcadores de mitocondrias y retfculo endoplgsmico. Asi mismo la maquinaria de autofagia es utilizada por ciertos virus para completar su replicacidn dentro de la cglula. Otros patdgenos, secretan factores que evitan la autofagia. Un ejemplo notable es el caso de la Shigella flexneri. Shigella trastoma la membrana fagosomal y de esa forma escapa hacia el citoplasma, en donde evade el mecanismo de autofagia al secretar un factor de virulencia denominado como IcsB por medio de un sistema de secrecidn tipo II, que interfere con el reclutamiento de la protefna autofggica Atg5 y con la formacidn del autofagosoma.74,76 En la figura numero 9 se ilustra el mecanismo por el cual dos bacterias intracelulares diferentes, son susceptibles o resistentes a los mecanismos de Autofagia. Figura N° 9: Accion y evasion del mecanismo de autofagia durante infeccion bacteriana. Las bacterias pueden ser internalizadas por fagocitosis y el consiguiente fagosoma puede fusionarse con endosomas y posteriormente con lisosomas; la gran mayorfa de pat6genos bacterianos son susceptibles de ser degradados en fagolisosomas. Sin embargo algunos agentes pat6genos, como L. monocytogenes, son capaces de lisar la membrana del fagosoma y escapar al citoplasma. En este sitio, las bacterias pueden posteriormente convertirse en bianco del mecanismo de autofagia en un intento por regresar a este pat6geno a compartimentos de degradacibn. En el caso de L. pneumophila, P. gingivalis, y B. Abortus, inhiben la maduraci6n de autofagosomas o retrasan la fusi6n con lisosomas, permitiendo a las bacterias replicarse dentro del autofagosoma. Tornado de (Takahiro S. etal, 2004). En conjunto, estas observaciones sugieren que en algunos casos, el mecanismo de autofagia es utilizado por pat6genos para infectar y crecer dentro de las cblulas hu6sped, pero en otros casos la autofagia puede funcionar como mecanismo de protecci6n contra la infeccion. El esclarecimiento de las estrategias moleculares utilizadas por los virus y bacterias para controlar el mecanismo de autofagia podrla ayudar a entender los complejos mecanismos moleculares que regulan la autofagia en celulas de mamiferos, y tambign podria contribuir a desarrollar nuevas estrategias para el tratamiento y la prevenci6n de enfermedades infecciosas. En la figura numero 10 se muestran los principales patdgenos que se han estudiado en su resistencia o susceptibilidad al mecanismo de autofagia.74-77 Phagocytic I endocytic degradation Most bacteria are killed | Some bacteria escape Autophagic \ degradation Streptococcus pyogenes Staphylococcus aureus Mycobacterium sp, Bacterial evolution for escape Evade f r o m autophagic degradation Shigella dysenteriae I isteria monocytogene'1, Legionella pneumophila Brucella abortus Figura N° 10: Diferente susceptibilidad/resistencia de patbgenos a la maquinaria autofegica celular. (Amano A et al. 2006) 3.1.1 AUTOFAGIA EN LA DEFENSA INMUNE INNATA A VIRUS Evasidn de la autofagia en Virus Como ya se habla senalado al principio de este capltulo, durante un evento infeccioso, sobre todo por patogenos intracelulares que escapan a los mecanismos de degradacidn fagocltica, la autofagia representa un importante mecanismo para regresar componentes constituyentes de patdgenos hacia lisosomas para su completa degradacidn. En el caso particular de las infecciones virales, en los Qltimos afios se ha comenzado a conocer m£s acerca de cdmo el mecanismo de autofagia contribuye a potenciar la respuesta inmune a este particular grupo de agentes patdgenos. Los virus, pardsitos intracelulares obligados, se replican en el espacio citosdlico de la cdlula hudsped, empleando la propia maquinaria celular para la sfntesis de su material gendtico, as! como para la produccidn de protelnas constitutivas. Una de las incdgnitas de cdmo las cdlulas infectadas eran capaces de responder a dichos patdgenos, mediante la generacidn de mediadores solubles tales como citocinas, en particular mediante la produccidn de IFN tipo I (incluyendo a INF-a e IFN-P) fue despejada recientemente, e increlblemente involucra la partidpacidn del mecanismo de autofagia.78,79 Al ser el espacio citosdlico el sitio en donde los virus se replican y ensamblan, resultaba un misterio en como los componentes virales que permanecen en el citosol y no son secretados al espado extracelular, eran reconocidos por el sistema inmune, pues hasta la fecha, en el dtosol, pocos receptores inmunoldgicos han sido descritos por partidpar del reconodmiento, activacidn y produccidn de citocinas tales como la familia de interferones. De esta forma el concepto ampliamente aceptado para explicar la respuesta de citocinas a componentes virales, contemplaba como un paso obligado, la secrecidn de componentes virales (protelnas de envoltura o cdpsides o material gendtico desnudo) al espacio extracelular para su reconodmiento y para la producddn de citodnas antivirales. Sin embargo en los ultimos afios se ha demostrado que el mecanismo de autofagia, es responsable de sensar el compartimento citosdlico y de esta forma componentes virales, tales como RNA de cadena sencilla o cadena doble, DNA viral o protelnas virales, son atrapados y dirigidos hada compartimentos endocfticos de la cdlula hudsped. En estos endosomas la presencia de una familia de receptores conodda como receptores similares a Toll (del inglds Toll like Receptors o TLRs) es crftica para el reconodmiento de moldculas que son degradadas ahi. Los receptores tipo Toll o TLRs, son una de las principales familias de receptores que partidpan en la respuesta inmune innata a travds del reconodmiento de moldculas presentes en patdgenos. Los TLRs al reconocer a sus ligandos, inducen la produccidn de citocinas tales como TNF-a, IL-12, IL-18, e importantemente la production de interferones, asl como la expresiOn de molOculas coestimuladoras sobre la superficie de las cOlulas presentadoras de antlgenos, participando de esta manera en la interacci6n que se establece entre el sistema inmune innato y el adquirido. Se han descrito a la fecha 13 diferentes TLRs. Cada uno de estos receptores reconoce de forma "especifica" a diferentes molOculas presentes en bacterias, hongos, virus o bien a molOculas propias del hospedero generadas en estados de estrOs celular. 79>8° Un miembro de esta familia, que es TLR7, detecta RNA de cadena sencilla. En estudios de los casos de la infection por el Virus de la Estomatitis Vesicular (VSV) y el Virus Sendai (SV), la activation dependiente de TLR7 de COIulas Dendrlticas Plasmocitoides (CDPs) y su secreciOn de IFN tipo I parece depender en la autofagia pues se ha demostrado que las dendrlticas deficientes de Atg5 no son capaces de Secretar IFNa en respuesta a la infection de SV y VSV.81"84 3.2 PAPEL DE AUTOFAGIA EN LA INMUNIDAD ESPECIFICA. 3.2.1 ENTENDIENDO EL PRINCIPIO DE COMPARTAMENTALIZACI6N DURANTE EL PROCESAMIENTO Y PRESENTACI6N DE ANTiGENOS. Como se ha abordado en el capitulo I, las molOculas del MHC de clase I esten especializadas en la presentation de pOptidos derivados de protelnas citosOlicas, degradadas por el proteasoma. Estas proteinas tambiOn pueden tener un origen nuclear o bien provenir del retfculo endoptesmico o mitocondria. Los productos de degradation de estas protelnas (pOptidos) son translocados desde el citosol hacia el retlculo endopl£smico, en donde se encuentran en espera las molOculas del MHC de clase I. En el retlculo endopldsmico entonces se ensamblan los complejos pOptido-MHC clase I, para su posterior transporte a la membrana plasmdtica. En contraste, las molOculas del MHC clase II son diferentes, ya que evitan tomar pOptidos en el interior del retlculo endoplasmics al ser protegidas por la cadena invariante, la cual actda como un pseudopOptido que protege el sitio de uniOn, ademSs de dirigir el transporte de las molOculas del MHC clase II hacia compartimentos endocfticos tardfos. En este sitio la cadena invariante es degradada e intercambiada por fragmentos de protefna que provienen del exterior celular (llamados protefnas o antfgenos exdgenos).85,88 Estas son definidas como las rutas "cldsicas" de presentacidn de antfgenos para clase I y clase II. Sin embargo actualmente se sabe que este patr6n de compartamentalizaci6n no es rfgido al 100 % y las cglulas presentadoras de antfgeno, pueden mediante algunos mecanismos, intercambiar estas rutas de presentacidn. Lo anterior significa que antfgenos exdgenos que son internalizados por una CPA pueden llegar a acceder al citoplasma, y ahf pueden ser degradados via proteasoma en pdptidos y estos ser dirigidos a retlculo endopldsmico para su asociacidn "atfpica" con moldculas del MHC clase I. La ventaja de este tipo de presentacidn cruzada (del tdrmino en ingles "Cross Presentation") es que un antfgeno exdgeno, puede inducir respuestas tanto de linfocitos CD4 (a travds de pdptidos que son cargados y presentados por MHC clase II), asf como inducir respuesta de linfocitos CD8 (a travds de pdptidos que son cargados y presentados por MHC clase I) al mismo tiempo.88,88 Otro ejemplo de presentacidn de antfgenos mediante una ruta "no cldsica", que en los ultimos afios mds se ha explorado, lo constituye el hecho de que protefnas de origen citopldsmico (que tendrfan que ser procesadas y presentadas en el contexto de moldculas del MHC clase I), bajo determinadas circunstancias, pueden ser transportadas y ganar acceso hacia endosomas-lisosomas, en donde son degradadas en pdptidos que pueden ser cargados por moldculas del MHC clase II, y presentados a linfocitos T CD4. Este ultimo ejemplo de presentacidn atfpica es expiicado a travds del mecanismo de autofagia. 87,88 3.2.2 AUTOFAGIA COMO MECANISMO CELULAR QUE PROVEE ANTfGENOS CITOS6LICOS PARA SU PRESENTACI6N NO CLASICA POR MOLDCULAS DEL MHC CLASE II. El papel de autofagia en la inmunidad no se limita a la directa eliminaci6n de pat6genos intracelulares o a la estimulaci6n de la produccidn de IFN tipo I. Por lo menos en ciertos contextos, la autofagia prOmueve la presentaci6n de antlgenos citosdiicos a travds de moldculas del MHC clase II, lo que permite asociar este fen6meno con la inmunidad adaptativa. Schmid y colaboradores han reportado la presencia de autofagosomas constitutivos en cdlulas B, cdlulas dendrfticas y cglulas epiteliales. En estas cdlulas, por lo menos la mitad de todos los autofagosomas se entrecruzan o fusionan con compartimentos de carga ricos en moldculas del MHC de clase II. Esta via de trdfico puede ser de gran importancia para la presentacidn de antfgenos. La forma "individualizada" de autofagia denominada autofagia mediada por moldculas chaperonas tambidn tiene un papel en la presentacidn de antfgenos enddgenos a travds del MHC de clase II. Esta forma de autofagia permite la importacidn de protefnas individuates citosdlicas que contengan la secuencia o motivo de reconodmiento detectada por lamp-2a. La protefna de choque tdrmico HSC70 participa de manera relevante en este mecanismo al transportar proteinas citosdlicas hada el interior de fagolisosomas.8M1 (a) Endocytosis (b) Microautophagy • ^ r ' X b A MIIC r V V < I v v V Late endosome (d) Chapcrone-mcdiatcd autophagy (c) Macroautophagy **v Hsp — V Autophagasome M ^Cytopa lsmci 1 prduoylssi Hsp Figura N° 11: Diagrama de las posibles vias para la generacidn y presentation de epitopes por mol6culas MHC de clase II. (A) En la via endocitica, las proteinas exdgenas son internalizadas y sometidas a procesamiento proteolitico. (B) Microautofagia se caracteriza por la invaginacidn lisosomal, que secuestra componentes citos6licos. (C) En macroautofagia, una doble estructura membranosa encierra y aisla componentes citos6licos, y eventualmente se fusiona con lisosomas. (0) En la autofagia mediada por mol6culas chaperonas, proteasas citos6licas generan p6ptidos que se transportan hacia lisosomas mediante la actividad de mol6culas hsp y/o hsc y lamp-2a. Los ultimos tres procesos probablemente liberan antfgenos citoptesmicos o p6ptidos a compartimentos endosomales para su asociacibn a MHC de clase II. Los p6ptidos resultantes entonces se entrecruzan con las mol6culas MHC de clase II en sitios ricos en estas mol6culas (compartimento MIIC) antes de transportarse y presentarse en la superficie celular para la activacibn de C6lulas T CD4+. (Strawbridge AB, etal. 2007). 3.2.3 MECANISMOS DE SENALIZAClbN QUE REGULAN EL MECANISMO DE AUTOFAGIA La relaci6n entre autofagia e inmunidad es bidireccionai. No s6lo ia autofagia potencia ia inmunidad innata y las respuestas adaptativas, en paralelo, algunas moldculas efectoras del sistema inmune tales como citocinas, receptores y sus ligandos celulares que participan en la inmunidad innata y adaptativa, tambidn regulan el proceso de autofagia en un mecanismo de retroalimentacidn. Algunas moldculas del sistema inmunoldgico que regulan positivamente el proceso de autofagia, incluyen IFN-y y miembros de la familia de TNF-a (TNF-a, TRAIL) y el receptor CD40L. En contraste, la autofagia es regulada negativamente por citocinas del perfil TH2, tales como la interleucina4 (IL-4) e IL-13, aunque esto ultimo se ha demostrado hasta la fecha sdlo en lineas celulares. En general, existe una correlacidn entre la activacidn de autofagia por mediadores inmunoldgicos y el control de la infeccidn con patdgenos intracelulares. Linfocitos CD4+ pueden cooperar con Cdlulas Presentadoras de Antlgenos para inducir autofagia en dstas ultimas a travds de la interaccidn entre CD40 y su ligando (CD40L), estimulacidn que protege a las CPAs en contra del pardsito Toxoplasma gondii. IFN-y y TNF-a son cruciales para la proteccidn contra la infeccidn por micobacterias y otros patdgenos intracelulares que pueden replicarse en macrdfagos, y estas citocinas se ha demostrado son potentes inductores de autofagia tanto en los macrdfagos, como en otras cdlulas.92-98 A continuacidn se muestra en la figura ntimero 12, un modelo hipotdtico de cdmo se lleva a cabo este tipo de presentacidn a travds de dstas vlas autofdgicas, en conjunto con las moldculas de seftalizacidn implicadas. Figura N° 12: Regulacidn del proceso de autofagia a traves de sefiales moleculares que se establecen entre cdlulas presentadoras de antigeno y Linfocitos T CD4. A travds de la autofagia los antigenos citopldsmicos pueden ser transportados para su presentacidn hacia compartimentos abundantes en moldculas de clase II del MHC. En estos compartimentos, el antfgeno es procesado en pdptidos que son cargados en las moldculas de clase II para la estimulacidn de cdlulas T CD4+. Las cdlulas T CD4+ a su vez, una vez activadas a travds de la interaccidn MHC-TCR, regulan positivamente el proceso de autofagia a travds de la secrecidn de IFN-y y miembros de la familia de TNF-a (TNF, TRAIL) y el receptor CD40L. Las Cdlulas T CD4+ polarizadas a Th2 son susceptibles a muerte celular por macroautofagia. Tornado de: (Schmid D. et al, 2007). CONCLUSIONES • De acuerdo a la evidencia revisada, se puede concluir que la Autofagia es un proceso biol6gico relacionado directamente con la adaptation y con la supervivencia celular ya que permite a la cOlula obtener energla en condiciones adversas. • La Autofagia esta Intimamente relationada con numerosos procesos fisiolOgicos celulares tales como proliferation, diferenciaciOn y apoptosis y de igual manera en el contexto de inmunidad innata y adaptativa. Cabe destacar que falta mucho por saber y que numerosas investigationes en curso podran aportar nuevos datos sobre la relation con el proceso saludenfermedad. • La Autofagia participa como defensa innata, al restringir algunas infecciones virales y la replication de bacterias y pardsitos intracelulares. • Las CPAs utilizan el mecanismo de la Autofagia para engullir los agentes infecciosos y regresarios a los autofagolisosomas donde son finalmente degradados. • Aditionalmente, dado que los patOgenos utilizan armas moleculares diferentes para modular la Autofagia, entre mas information se tenga sobre las estrategias utilizadas por estos para inhibir a la autofagia, se ganara mucho mas conotimiento acerca de la ruta autofagica misma. • Por medio de la Autofagia se lleva a cabo la presentation de antlgenos citosOlicos hacia compartimentos abundantes en molOculas de clase II del MHC. • Los mecanismos de la Autofagia estan estrechamente vinculados a la defensa contra agentes infecciosos y dado que Ostos pueden de alguna manera verse involucrados en la modulation de la Autofagia e incluso inhibiria, es fundamental conocer estas interacciones y con respecto a esto, determinar en que casos, es factible ya sea estimular o suprimir a la autofagia para poder evaluar la respuesta inmune que se desencadene en el hospedero, y as! desarrollar nuevas estrategias para el tratamiento y/o prevention de enfermedades infecciosas. 6LOSARIO Agonista Parcial: Variedad de ligando peptfdico de un RCT que s6lo induce un subgrupo de las respuestas funcionales de los linfocitos T o que induce respuestas totalmente distintas de las que produce el pdptido intacto (original). AP: Protefnas adaptadoras. Intervienen en las vias de transducci6n de sefiales en los linfocitos, actuando como moldculas puente o "andamiaje" para el reclutamiento de otras moldculas de seftalizacidn. ATG: Siglas que sirven para nombrar a la familia descubierta de los Genes Relacionados o Involucrados con la Autofagia. Autofagia: Proceso celular mediante el cual una membrana envuelve protefnas u organelos y se dirije al lisosoma, donde se fusiona con su membrana y libera en su interior el contenido para ser degradado. AMC: Autofagia mediada por protefnas chaperonas. Proceso por el cual las protefnas citosolicas son reconocidas por protefnas chaperonas del citosol y forman un complejo que es reconocido por un receptor de la membrana del lisosoma que a travds de este se internaliza la protefna en el lisosoma, para ser degradada por proteasas. BPIP: Protefna bactericida potenciadora de la permeabilidad. Catepsinas: Son las proteasas mds abundantes de los endosomas de las CPAs y probablemente tienen una participacidn importante en la generacidn de los fragmentos peptldicos de antlgenos extraftos proteicos que se unen al MHC de clase II. CD: Cdlulas dendrfticas. Cdlulas accesorias procedentes de la mddula dsea que se encuentran en los tejidos epiteliales y linfdticos y que se caracterizan morfoldgicamente por poseer finas proyecciones membranosas. Actdan como CPA para los linfocitos T vfrgenes y son importantes para la iniciacidn de las respuestas inmunitarias adquiridas frente a antfgenos protefcos. Cdlula Plasm&tica: Linfocito B totalmente diferenciado secretor de anticuerpos que muestra un aspecto histoldgico caracterfstico, con forma ovalada, nucleo excdntrico y un halo perinuclear. Cdlulas de Langerhans: Cdlulas dendrfticas inmaduras que forman una trama contfnua en la capa epiddrmica de la piel y cuya funcidn consiste en atrapar y transportar los antfgenos proteicos hacia los ganglios linfdticos de drenaje. Durante su migracidn hacia los ganglios linfdticos, maduran a cdlulas dendrfticas que pueden presenter de manera eficaz los antfgenos a los linfocitos T vfrgenes. C6lulas efectoras: C&ulas que realizan funciones efectoras durante la respuesta inmunitaria, tales como secreci6n de citocinas (por ejemplo linfocitos T cooperadores), elimination de los microorganismos (macrdfagos) secreti6n de anticuerpos (linfocitos B diferenciados). Citocinas: Protelnas sintetizadas por muchos tipos de c£lulas distintas que intervienen en las reacciones inflamatorias e inmunitarias. Son los principales mediadores de la comunicati6n entre las c£lulas del sistema inmunitario. CLIP: P6ptido de la cadena invariable asociado a la clase II. Resto peptidico de la cadena invariable que se acopla en la hendidura de uni6n a los p6ptidos que tiene el MHC de clase II y que se elimina por la accidn de la motecula HLA-DM antes de que la hendidura sea accesible a los p&ptidos producidos a partir de antlgenos proteicos extraftos. CPAs: Cglulas presentadoras de Antlgenos, especializadas en mostrar fragmentos peptldicos o antlgenos proteicos, asotiados a mol6culas de su MHC, sobre su superficie, con el fin de activar a los linfocitos T especlficos de estos antlgenos. Tambten expresan mol6culas coestimuladoras para que la activaci6n de los linfocitos T sea 6ptima. "Cross Priming": Presentatidn Cruzada. Mecanismo por el que una CPA activa o prepara a un LTC CD8+ vlrgen especlfico del antlgeno de una tercera c6lula (c6lula tumoral o infectada por un virus). Ocurre cuando una CPA ingiere una c6lula infectada (a menudo apopt6sica) y los antlgenos microbianos se presentan asotiados al MHC de clase I, exactamente igual que cualquier otro antlgeno fagocitado. DAG: Diacilglicerol. Mol6cula de seflalizaci6n unida a la membrana y generada mediante la hidrdlisis del fosfatidilinositol, durante la activaci6n de los linfocitos por los antlgenos. Su funtidn consiste en activar una enzima denominada protefna cinasa C que participa en la generaci6n de factores de transcripcidn activos. Defensinas: P6ptidos ricos en cistefna que se encuentran en los grdnulos de los neutr6filos y que actuan como antibi6ticos de amplio espectro, eliminando una amplia variedad de bacterias y hongos. La slntesis de defensinas aumenta en respuesta a citocinas inflamatorias como IL-1 y TNF. Fc: Fragmento cristalino. Se de una motecula intacta de unirse a receptores de la Complemento. Reciben este encuentran en soluci6n. utiliza para referirse a la regi6n conrespondiente Ig que interviene en las funciones efectoras al superficie celular o a la proteina C1q del nombre porque tienden a cristalizar cuando se GM-CSF: Factor estimulador de las colonias de granulocitos-macr6fagos. Citosina sintetizada por los linfocitos T activados, los macrdfagos, las c£lulas endoteliales y los fibroblastos del estroma y que actua en la m6dula 6sea, en la que incrementa la produccibn de neutrdfilos y monocitos. Es un factor de activacidn de macrdfagos y estimula la diferenciacidn de las cdlulas de Langerhans en cdlulas dendrfticas maduras. GPI: Glucosilfosfatidilinositol. HLA-DM: Moldcula de pdptidos de intercambio que tiene una funcidn esencial en la via del MHC de clase II de la presentacidn de antigenos. Se encuentra en el compartimento endosdmico especializado MHC y facilita la eliminacidn del pdptido CLIP, derivado de la cadena invariable, asf como la unidn de las moldculas de clase II del MHC a otros pdptidos. Esta codificado por un gen del MHC y su estructura es similar a la de las moldculas del MHC de clase II, aunque no es polimorfa. Hsc70: Protefna de choque tdrmico de 70 kOa. Hsc73: Protefna de choque tdrmico de 73 kDa. li: Cadena invariable. Protefna no polimorfa que se une a moldculas del MHC clase II recidn sintetizadas en el retfculo endopl&smico. Evita que las hendiduras de unidn a los pdptidos de las moldculas de clase II del MHC se ocupen con pdptidos existentes en el retlculo endopldsmico, de modo que dstos pdptidos puedan asociarse a moldculas de clase I. Facilita el plegamiento y ensamblaje de las moldculas de clase II y conduce a las moldculas de clase II recidn formadas hacia el compartimento MIIC endosdmico especializado, donde tiene lugar la carga de pdptidos. LAM: Lipoarabinomananas de micobacterias. LAMP-2A: Protefna de membrana asociada a lisosomas tipo 2A. LBP: Protefna que une al lipopolisacdrido. Ligando de Fas: Protefna de membrana que pertenece a la familia de protelnas TNF y se expresa en los linfocitos T activados. Se une a Fas y estimula una via se seftalizacidn que conduce a la muerte celular por apoptdsis de las cdlulas que expresan Fas. LPA: Ligandos peptfdicos alterados. Pdptidos con residuos de contacto con el RCT alterados que inducen respuestas distintas de las que provocan los ligandos peptfdicos originates. LMP2 Y LMP7: Del inglds Large Multifunctional Proteasome o Gran Proteasoma Multifuncional. Dos subunidades catalfticas del proteasoma, una organela que degrada las protefnas citosolicas a pdptidos en la vfa del MHC clase I. Estdn codificadas por genes del MHC. IFN-y estimula su sfntesis y amabas son especialmente importantes en la generacidn de pdptidos de unidn al MHC de clase I. LPPG: Lipopdptidofosfoglicana de Entamoeba histolytica. LPS: LipopolisacSrido. Sin6nimo de eridotoxina. LT: Lipoteicoicos. Microautofagia: Proceso mediante ei cual se degradan componentes pequeftos y suele generarse a trav6s de invaginaciones del propio lisosoma que internalizan componentes que van a ser degradados. MBL: Lectina que une manosa. MHC: Complejo Principal de Histocompatibilidad. MIIC: Compartimento del MHC clase II. Subgrupo de endosomas presentes en los macrbfagos y en linfocitos B y que son importantes en la via del MHC de clase II de presentaci6n de antlgenos. El MIIC tiene todos los componentes necesarios para la formaci6n de complejos entre las mol6culas de clase II y los pgptidos, incluidas las enzimas que degradan los antlgenos proteicos, las mol6culas de clase II, la cadena invariable y el HLA-DM. Motfvos: Secuencias de amino&cidos. PAMPs: Patrones moleculares asociados a pat6genos. PAS: Estructura Preautofagosomal. PEA: Fosfatidiletanolamina. Pentraxinas: Familia de protelnas plasmdticas formadas por cinco subunidades globulares id6nticas; una de ellas es la proteina C reactiva, un reactante de fase aguda. P6N: Peptidoglicana. PI3K. Fosfatidilinositol-3-cinasa. Proteasas: Enzimas que rompen los enlaces peptldicos y que por lo tanto, degrada las protelnas a peptidos. Distintos tipos de proteasas tienen especificidades diferentes por enlaces entre aminodcidos especlficos. Las proteasas de los fagocitos son importantes en la eliminacidn de los micoorganismos ingeridos durante las respuestas inmunitarias innatas y las proteasas liberadas por los fagocitos en los focos de inflamaci6n pueden provocar lesiones mlsticas. Las proteasas de las CPAs son esenciales para la generaci6n de los fragmentos peptldicos de los antlgenos proteicos que se unen a las moteculas del MHC durante las respuestas inmunitarias celulares. PRPs: Receptores de reconocimiento de patrones. Rapamicina: Inmunosupresor, cuyo efecto principal consiste en inhibir la proliferaci6n de linfocitos T. TCR: Receptores de las Cdlulas T. Receptores "Scavenger": Familia de receptores de la superficie celular expresados en los macrdfagos y definidos originalmente como receptores involucrados en la endocitosis de partlculas de Lipoprotefnas de baja densidad oxidadas o acetiladas, pero que tambidn se unen y participan en la fagocitosis de distintos microorganismos. RM: Receptor de manosa. TAP: Transportadores asociados con el procesamiento de antlgenos. TLRs: Receptores Homdlogos a Toll. TNF: Factor de Necrosis Tumoral. Citocina producida principalmente por los fagocitos mononucleares activados y que actCia estimulando la atraccidn de neutrdfilos y monolitos hacia los focos de infeccidn y activando a las cdlulas que llegan para que erradiquen los microorganismos. Estimula a las cdlulas de los endotelios vasculares para que expresen nuevas moldculas de adhesidn, induce la secrecidn de quimiocinas en los macrdfagos y cdlulas endoteliales y favorece la apoptosis de las cdlulas diana. En las infecciones graves se sintetizan cantidades importantes de TNF que ejercen efectos sistdmicos, tales como induccidn de fiebre, slntesis de protelnas de fase aguda en el hlgado. TOR: Target of Rapamycin. Protefna del bianco de rapamicina. REFERENCIAS BIBLIOGRAFICAS 1. Abbas Abut K., Lichtman Andrew H. Inmunologia celular y molecular. Edici6n: Quinta. Editorial: Elsevier, Espafia S. A. 2004 Pdginas: 65-105. 2. Fainboim Leonardo, Geffner Jorge. lntroducci6n a la inmunologia humana. Edicidn: Quinta. Editorial: M6dica Panamericana S. A. Buenos Aires, Argentina 2005. Pdginas: 93-103. 3. Regueiro-Gonzdlez JR, L6pez Larrea C, Gonzalez Rodriguez S. Inmunologia y patologla del sistema inmune. Edici6n: Tercera. Editorial: M6dica Panamericana S. A. Madrid, Espafia 2004. Pdginas: 65-85. 4. Goldsby Richard, Kindt Thomas, Osborne Barbara. Inmunologia. Edici6n: Quinta. Editorial: Mc Graw-Hill Interamericana. Mexico, DF. 2006. Pdginas: 171-209. 5. Tristam G. Parslow, D. Inmunologia bisica y cllnica. Edicibn D6cima. Editorial: El Manual Moderno S. A. de C. V. Mexico DF. 2004. Pdginas: 93-109,110-131. 6. Roitt Ivan, Delves Meter. Inmunologia Fundamentos. Edici6n: D6cima. Editorial: Mddica Panamericana S. A. Buenos Aires, Argentina 2004. PSginas: 78-89. 7. P6rez Tamayo Ruy, L6pez Corella Eduardo. Principios de Patologla. Edici6n: Cuarta. Editorial: M6dica Panamericana. Mexico DF. 2007. PSginas: 37-83. 8. Vinay Kumar, CotrSn Stanley. Patologla Humana. Edicidn: S6ptima. Editorial: Elsevier. Madrid Espafia 2004. Pdginas: 14-15, 104-107, 201205. 9. Gonzalez Sastre Francesc, Guinovart Joan. Patologla Edici6n: S6ptima. Editorial: Masson, Paris Francia 2004. Molecular. 10. Rubin Emmanuel, Gorstein Ferd, Strayer David. Patologla Estructural fundamentos clinicopatoldgieos en medicina. Edici6n: Cuarta. Editorial: Mc Graw Hill Interamericana. Madrid Espafia, 2005. Pdginas: 110-120. ARTiCULOS DE REVISI6N H.Calabi F, Jarvis JM, Martin L, Milstein C. 1989. Two classes of CD1 genes. Eur. J. Immunol. 19:285-92. 12. Bradbury A, Belt KT, Neri TM, Milstein C, Calabi F. 1988. Mouse CD1 is distinct from and co-exists with TL in the same thymus. EMBO J. 7:3081-86. 13. Bradbury A, Calabi F, Milstein C. 1990. Expression of CD1 in the mouse thymus. Eur. J. Immunol. 20:1831-36. 14. Balk SP, Bleicher PA, Tertiorst C. 1991. Isolation and expression of cDNA encoding the murine homologues of CD1.146(2):768-74. 15.Zeng Z, Castano AR, Segelke BW, Stura EA, Peterson PA, Wilson I A. 1997. Crystal structure of mouse CD1: an MHC-like fold with a large hydrophobic binding groove. Science. 277:339-45. 16.Zajonc DM, Elsliger MA, Teyton L, Wilson IA. 2003. Crystal structure of CD1a in complex with a sulfatide self antigen at a resolution of 2.15 A. Nat Immunol. 4(8):808-15. 17.Gadola SD, Zaccai NR, Harlos K, Shepherd D, Castro-Palomino JC, Ritter G, Schmidt RR, Jones EY, Cerundolo V. 2002. Structure of human CD1b with bound ligands at 2.3 A, a maze for alkyl chains. Nat. Immunol. 3(8):721-6. 18.Batuwangala T, Shepherd D, Gadola SD, Gibson KJ, Zaccai NR, Fersht AR, Besra GS, Cerundolo V, Jones EY. 2004. The crystal structure of human CD1b with a bound bacterial glycolipid. J. Immunol. 172(4):2382-8. 19. Martin LH, Calabi F, Lefebvre F-A, Bilsland CAG, Milstein C. 1987. Structure and expression of the human thymocyte antigens CD1a, CD1b, and CD1c. Proc.Natl. Acad. Sci. USA 84:9189-93. 20.Porcelli S. 1995. The CD1 family: a third lineage of antigen presenting molecules. Adv. Immunol. 59:1-98. 21.Sugita M, van der Wei N, Rogers RA, Peters PJ, Brenner MB. 2000. CD1c molecules broadly survey the endocytic system. Proc. Natl. Acad. Sci. USA. 97: 8445-84450. 22.Brossay L, Jullien D, Cardell S, Sydora BC, Burdin N, Modlin RL, Kronenberg M. 1997. Mouse CD1 is mainly expressed on hemopoietic-derived cells. J. Immunol. 159:1216-24. 23.Mandal M„ Chen X.R., Alegre M.L. 1998. Tissue distribution, regulation and intracellular localization of murine CD1 molecules, Mol. Immunol. 35:525-536. 24.Kasinrerk W, Baumruker T, Majdic O, Knapp W, Stockinger H. 1993. C01 molecule expression on human monocytes induced by granulocyte-macrophage colony-stimulating factor. J. Immunol. 150:579-84. 25.Sugita, M. 1999. Separate pathways for antigen presentation by CD1 molecules. Immunity. 11, 743-752. 26.Sugita M, Jackman RM, van Donselaar E, Behar SM, Rogers RA, Peters PJ, Brenner MB, Porcelli SA. 1996. Cytoplasmic tail-dependent localization of CD1b antigen-presenting molecules to MIICs. Science. 273:349-52. 27. Jackman RM, Stenger S, Lee A, Moody DB, Rogers RA, Niazi KR, Sugita M, Modlin RL, Peters PJ, Porcelli SA. 1998. The tyrosinecontaining cytoplasmic tail of CD1b is essential for its efficient presentation of bacterial lipid antigens. Immunity. 8:341-5. 28.Sallusto F, Cella M, Danieli C, Lanzavecchia A. 1995. Dendritic cells use Macropinocytosis and the Mannose Receptor to Concentrate macromolecules in the major histocompatibility complex class II Compartment: Downregulation by Cytokines and Bacterial Products. J. Exp. Med.182: 389-400. 29.Steinman R, Swanson J. 1995. The Endocytic Activity of Dendritic Cells. J. Exp. Med.182: 283-288. 30.Prigozy Tl, Sieling PA, Clemens D, Stewart PL, Behar SM, Porcelli SA Brenner MB, Modlin RL, Kronenberg M. 1997. The mannose receptor delivers llpoglycan antigens to endosomes for presentation to T cells by CD1b molecules. Immunity. 6:187-97. 31. Kitchens R, Wang P, Munford R. 1998. Bacterial lipopolisaccharide can enter monocytes via two CD14 dependent pathways. J. Immunol. 161:5534-5545. 32.Llangumaran S. 1995. Integration of mycobacterial lipoarabinomannans into glycosylphosphatidylinositol-rich domains of lymphomonocytic cell plasma membranes. J. Immunol. 155,1334-1342. 33. Branch D, Briken V, Cheng TY, Roura-Mir C, Guy M, Geho H, Tykocinski L, Besra G.S. Porcelli S. 2001. Lipid length controls antigen entry into endosomal and nonendosomal pathways for CD1b presentation. Nature Immunology. 2(8):676. 34.Tailleux L, Schwartz O, Herrmann JL, Pivert E, Jackson M, Amara A, Legres L, Dreher D, Nicod LP, Gluckman JC, Lagrange PH, Gicquel B, Neyrolles O. 2003. DC-SIGN is the major Mycobacterium tuberculosis receptor on human Dendritic Cells. J. Exp. Med. 197(1):121-7. 35.Moody DB, Reinhold BB, Reinhold VN, Besra GS, Porcelli SA. 1999. Uptake and processing of glycosylated mycolates for presentation to CD1b-restricted T Cells. Immunol. Lett. 65(1-2):85-91. 36.Prigozy Tl, Naidenko O, Qasba P, Elewaut D, Brossay L, Khurana A, Natori T, Koezuka Y, Kulkami A, and Kronenberg M. 2001. Glycolipid Antigen Processing for Presentation by CD1d Molecules. Science. 291:664-667. 37.Zhou D, Cantu C 3rd, Sagiv Y, Schrantz N, Kulkarni AB, Qi X, Mahuran DJ, Morales CR, Grabowski GA, Benlagha K, Savage P, Bendelac A, Teyton L. 2004. Editing of CD1d-bound lipid antigens by endosomal lipid transfer proteins. Science. 303(5657):523-7. 38.Winau F, Schwierzeck V, Hurwitz R, Remmel N, Sieling PA, Modlin RL, Porcelli SA, Brinkmann V, Sugita M, Sandhoff K, Kaufmann SH, Schaible UE. 2004. Saposin C is required for lipid presentation by human CD1b. Nat. Immunol. 5(2): 169-74. 39. Porcelli S, Morita CT, Brenner MB. 1992. CD1b restricts the response of human CD4-8- T lymphocytes to a microbial antigen. Nature. 360:593-97. 40.Beckman EM, Porcelli SA, Morita CT, Behar SM, Furlong ST, Brenner MB. 1994. Recognition of a lipid antigen by CD1-restricted a0+ T cells. Nature. 372,691-694. 41.Sieling PA, Chatterjee D, Porcelli SA, Prigozy Tl, Mazzaccaro RJ, Soriano T, Bloom BR, Brenner MB, Kronenberg M, Brennan PJ. 1995. CD1-restricted T cell recognition of microbial lipoglycan antigens. Science. 269, 227-230. 42.Shamshiev A, Donda A, Carena I. 1999. Self glycolipids as T cells autoantigens. Eur. J. Immunol. 29:1667-1675. 43.Beckman, Melian A, Behar SM, Sieling PA, Chatterjee D, Furlong ST, Matsumoto R, Rosat JP, Modlin RL, Porcelli SA. 1996. CD1c restricts responses of mycobacteria specific T cells: evidence for antigen presentation by a second member of the human CD1 family. J. Immunol.157: 2795-2803. 44. Moody DB. 2000. CD1c-mediated T-cell recognition of isoprenoid glycolipids in Mycobacterium tuberculosis infection. Nature. 404: 884-888. 45.Kawano Cui J, Koezuka Y, Toura I, Kaneko Y, Motoki K, Ueno H, Nakagawa R, Sato H, Kondo E, Koseki H, Taniguchi M. 1997. CD1drestricted and TCR-mediated activation of Va14 NK T cells by glycosylceramides. Science. 278,1626-1629. 46.Burdin N, Brossay L, Koezuka Y, Smiley ST, Grusby MJ, Gui M, Taniguchi M, Hayakawa K, Kronenberg M. 1998. Selective ability of mouse CD1 to present glycolipids: alpha-galactosylceramide specifically stimulates Valpha 14C NKT lymphocytes. J. Immunol. 161:3271-81. 47.Spada F, Koezuka Y, Porcelli SA. 1998. CD1d-restricted recognition of synthetic glycolipid antigens by human NK T cells. J. Exp. Med. 188:1529-34. 48. Brossay L, Chioda MC, Burdin N, Koezuka Y, Casorati G, Dellabona P, Kronenberg M. 1998. CD1d mediated recognition of a alphagalactosylceramide by Nk T cells is highly conserved through mammalian evolution. J. Exp. Med. 188:1521-28. 49.Castaflo AR, Tangri S, Miller JE, Holcombe HR, Jackson MR, Huse WD, Kronenberg M, Peterson PA. 1995. Peptide binding and presentation by mouse CD1. Science. 269:223-26. 50. McDonald H. 1995. NK1.1 T cell receptor-alpha/beta cells:new clues to their origin, specificity, and function. J. Exp. Med. 180:699-704. 51.Gumperz J. 2000. CD1d-restricted T cells recognition of cellular lipids. Immunity. 12: 211:221. 52. Park S. Bendelac A. 2000. CD1 restricted T cell responses and microbial infection. Nature. 406:768-792. 53.Ulrichs T, Moody DB, Grant E, Kaufmann SH, Porcelli SA. 2003. T-cell responses to CD1-presented lipid antigens in humans with Mycobacterium tuberculosis infection. Infect. lmmun.6:3076-87. 54.Schofield L, McConville M, Hansen D. Campbell, Fraser R, Tachado S. 1999. CD1d restricted immunoglobulin G formation to GPI anchored antigens mediated by NKT cells. Science. 283:225-229. 55. Kumar H, Belperron A.g, Barthold S, Bockenstedt L. 2000. Cutting Edge: CD1d Deficiency Impairs Murine Host Defense Against the Spirochete, Borrelia burgdorferi. J. Immunol. 165:4797-4801. 56.Stenger S, Mazaccaro R, Uyemura K, Sette A, Porcelli S, Brenner MB, Bloom B, Modlin R. 1997. Differential effects of Cytololytic T cells Subsets on Intracelular Infection. Science. 276:1684-1687. 57.Sieling PA, Jullien D, Dahlem M, Tedder TF, Rea TH, Modlin RL, Porcelli SA. 1999. CD1 expression by Dendritic Ceils in human leprosy lesions: Correlation with effective host immunity. J. Immunol. 162:1851-1858. 58.Spada F, Grant E, Peters P, Sugita M, Melian A, Lesli D, Krensky A. 2000. Self recognition of CD1 by gamma/delta T cells: implication for innate immunity. J. Exp. Med. 191.937-948. 59.Matsuda JL and Kronenberg M. 2001. Presentation of self and microbial lipids by CD1 molecules. Current Opinion in Immunol. 13: 19-25. 60.Chao-Wen W., Klionsky D., 2003. The Molecular Mechanism of Autophagy. Molecular Medicine. 9:65-76. 61.Marifto G, L6pez-Oti'n C, 2004. Autophagy: Molecular mechanisms, physiological functions and relevante In human pathology. Cellular and Molecular Sciences. 6:1439-1454. 62.Amano A, Nakagama I, Yoshimori T. 2006. Membrane Traffic in Physiology and Pathology. Journal Biochemistry. 140:161-166. 63.Yorimitsu T„ Klionsky D, 2007. Eating the endoplasmic reticulum, quality control by autophagy. Elsevier. 17:279-285. 64. Cuervo AM, 2004. Autophagy: Many paths to the same end. Molecular and Cellular Biochemistry. 263:55-72. 65. Huang J, Klionsky DJ. 2007. Autophagy and Human Disease. Autophagy. 15:1837-1849. 66.Reis C, Sousa, 2007. Eating In to Avoid infection. Perspectives Immunology. 315:1376-1377. 67.Rubinsztein DC., Gestwicki JE., Leon OM, Klionsky DJ.2007. Potential therapeutic applications of autophagy. Nature Reviews Drug Discovery. 6: 304-312. 68. Fred Dice J.2007. Chaperone Mediated Autophagy. Autophagy. 3:1-5. 69.Swanson MS. 2006. Autophagy: Eating for Good Health. The Journal of Immunology. 177:4945-4951. 70.Schnaith A, Kashkar H, Leggio S. 2006. Staphylococcus aureus subvert Autophagy for induction of caspase-independent Host Cell Death. Journal of Biological Chemistry. 282: 2695-2706. 71.Schmid D, Munz C. 2005. Inmune Surveillance of intracellular pathogens via autophagy. Nature. 12:1519-1527. 72. Palmer GE. 2007. Autophagy in the Invading Pathogen. Autophagy. 3: 251-253. 73.Colombo Ml. 2007. Autophagy: A Pathogen Driven Process. IUBMB Life. 59: 238-242. 74. Palmer GE, Michelle NK, Sturtevant JE. 2007. Autophagy In the pathogen Candida albicans. Journal of Microbiology. 153: 51-58. 75.Amer AO, Byrne BG, Swanson MS. 2005. Macrophages Rapidly Transfer Pathogens from Lipid Raft Vacuoles to Autophagosomes. Autophagy. 1: 53-58. 76. Py B, Lipinsky M, Yuan J. 2007. Autophagy limits Listeria monocytogenes intracellular Growth in the Early Phase of primary infection. Autophagy. 3:117-125. 77.Schmid D, Munz C. 2007. Innate and Adaptive Immunity through Autophagy. Immunity. 27:11-21. 78.Espert L, Codogno P, Biard-Piechaczyk M, 2007. Involvement of autophagy in viral infections: antiviral function and subversion by viruses. Journal Molecular Medicine. 10.1007: 0173-0186. 79. Akiko I. 2007. Role of Autophagy in innate Viral Recognition. Autophagy. 3:1-3. 80. Kyu Lee H. Lund JM, Ramanathan B, Mizushima N, Iwasaki A. Autophagy-Dependent Viral Recognition by Plasmacytoid Dendritic Cells. Science. 315:1398-1401. 81.Levine B, Deretic V. 2007. Unveiling the roles of autophagy in innate and adaptative immunity. Nature Immunology. 7:767-777. 82. Deretic V. 2006. Autophagy as an immune defense mechanism. Current Opinion in immunology. 18: 375-382. 83.Espert L, Denizot M, Grimaldi M. 2007. Autophagy and CD4+ T Lymphocyte destruction by HIV-1. Autophagy. 3:32-34. 84.Men6ndez-Benito V, Neefjes J. 2007. Autophagy in MHC class II Presentation: Sampling from within. Immunity. 26:1-3. 85.Dengjet J, Schoor O, Fisher R. 2005. Autophagy promotes MHC Class II presentation of peptides from intracellular source proteins. PNAS. 102: 7922-7927. 86.lnaba K, Turley S, lyoda T. 2007. The formation of immunogenic MHC Class II peptide ligans in Lysosomal Comparments of Dendritic