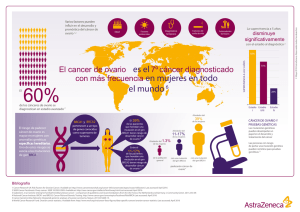
oo - Gencat.cat
Anuncio

g Guías de Práctica Clínica en Cáncer en Cataluña o OncoGuía de ovario OG01/2004 Noviembre 2004 g o ÍNDICE PARTE I. PROCESO Y METODOLOGÍA DE LAS GUÍAS DE PRÁCTICA CLÍNICA EN CÁNCER-ONCOGUÍAS 5 . Proceso 5 . Metodología 6 . Fuentes e información consultadas 8 PARTE II. ONCOGUÍA DE OVARIO 9 . Algoritmos 9 15 . Estadificación quirúrgica del cáncer epitelial de ovario 16 . Concepto e indicaciones de la citorreducción “óptima” en el tratamiento del cáncer de ovario 18 . Cirugía de reevaluación - second look 20 . Propuesta de protocolo para el tratamiento de los tumores ováricos serosos borderline 20 . Quimioterapia 21 . Seguimiento 22 . Tratamiento de la recidiva 22 g o . Actitud ante una tumoración ovárica . Bibliografía 23 . Anexo. Recomendaciones generales para la redacción de un informe de anatomía patológica de cáncer de ovario 27 Para citar este documento hay que hacerlo de la manera siguiente: OncoGuía de ovario. Barcelona: Agencia d’Avaluació de Tecnologia i Recerca Mediques. CatSalut. Departament de Sanitat i Seguretat Social. Generalitat de Catalunya. Noviembre 2004 (OG01/2004) EDICIÓN Y DISTRIBUCIÓN AATRM TRADUCCIÓN LinguaCom y AATRM DISEÑO J. López Corduente IMPRESIÓN AATRM © Agència d’Avaluació de Tecnologia i Recerca Mèdiques Dipòsit legal: B-9.241-2006 La Agència d’Avaluació de Tecnologia i Recerca Mèdiques es una empresa pública, sin ánimo de lucro, creada en mayo de 1994. Tiene como objetivos promover que la introducción, la adopción, la difusión y la utilización de tecnologías médicas se haga de acuerdo con criterios de eficacia, seguridad, efectividad y eficiencia demostradas, y también promover la investigación orientada a las necesidades de salud de la población y a las de conocimiento del sistema sanitario. © Agència d’Avaluació de Tecnologia i Recerca Mèdiques La Agència tiene la propiedad intelectual de este documento. Ningún fragmento de esta edición puede ser reproducido, almacenado o transmitido de ninguna forma ni por ningún procedimiento, sin el previo permiso expreso del titular del copyright. Las personas interesada en recibir ejemplares de este documento pueden dirigirse a: Agència d'Avaluació de Tecnologia i Recerca Mèdiques Esteve Terradas, 30 Recinte Parc Sanitari Pere Virgili Edifici Mestral, 1a planta 08023 Barcelona T. 93 259 42 00 F. 93 259 42 01 e-mail: [email protected] http://www.aatrm.net Comité organizador y de metodología de las OncoGuías ¬ Dr. Joan Vidal-Jové Coordinador del Programa, Agència d’Avaluació de Tecnologia i Recerca Mèdiques - Instituto Catalán de Oncología ¬ Dr. Josep M. Arnau de Bolós Jefe de sección de farmacología clínica, Fundación Instituto Catalán de Farmacología ¬ Dra. Marta Aymerich Martínez Directora de la CIRIT, Departamento de Universidades, Investigación y Sociedad de la Información ¬ Dr. Josep M. Borràs Andrés Director, Instituto Catalán de Oncología ¬ Dr. Josep R. Germà Lluch Director de Desarrollo Oncológico, Instituto Catalán de Oncología ¬ Dr. Roger Pla Farnos Director del Plan Director de Oncología en Cataluña ¬ Sr. Antoni Parada Martínez Documentalista, Agència d’Avaluació de Tecnologia i Recerca Mèdiques ¬ Sra. Isabel Parada Martínez Edición, Agència d’Avaluació de Tecnologia i Recerca Mèdiques ¬ Sra. Elisa Rius Umpiérrez Edición, Agència d’Avaluació de Tecnologia i Recerca Mèdiques ¬ Dr. Joan MV Pons i Rafols Director, Agència d’Avaluació de Tecnologia i Recerca Mèdiques o Expertos en cáncer de ovario g ¬ Dr. Antonio Arellano Tolivar Servicio de oncología médica, Hospital Universitario Germans Trias i Pujol ¬ Dr. Vicenç Artigas Raventós Jefe de sección de cirugía HBP-oncológica Servicio de cirugía general y digestiva, Hospital de la Santa Creu i Sant Pau ¬ Dra. Carme Balaña Quintero Servicio de oncología médica, Hospital Universitario Germans Trias i Pujol ¬ Dra. Anna Balil Gilart Servicio de oncología médica, Hospital Universitario Arnau de Vilanova de Lleida ¬ Dra. Sònia del Barco Berrón Servicio de oncología médica, Hospital Universitario de Sant Joan de Reus ¬ Dr. Pedro Barrios Sánchez Servicio de cirugía oncológica, Consorcio Sanitario Integral-Creu Roja l’Hospitalet ¬ Dr. Miquel Beltran Fabregat Servicio de oncología médica, ICO, Hospital Universitario Dr. Josep Trueta de Girona ¬ Dr. Isidre Boguñà Zubiaur Servicio de ginecología y obstetricia, Hospital de la Santa Creu i Sant Pau ¬ Dr. Albert Cabero Roura Servicio de ginecología, Hospital Universitario Arnau de Vilanova de Lleida ¬ Dr. Luis Camacho Consorcio Sanitario Integral-Creu Roja l’Hospitalet ¬ Dr. José A. Carceller Vidal Jefe de servicio de oncología radioterápica, Hospital Universitario Arnau de Vilanova de Lleida ¬ Dr. Josep Castellví Vives Servicio de anatomía patológica, Hospital Universitario de la Vall d’Hebron ¬ Dr. Enric Delgado Latre Jefe clínico del servicio de oncología y obstetricia, Hospital de la Santa Creu i Sant Pau ¬ Dra. Montserrat Estorch Cabrera Servicio de medicina nuclear, Hospital de la Santa Creu i Sant Pau ¬ Dr. Xavier Fabregat Mayol Servicio de oncología, Hospital del Mar ¬ Dr. Pere Fuster Brull Servicio de ginecología y obstetricia, Hospital del Mar ¬ Dra. Mª Jose Fuentes Raspall Servicio de oncología radioterápica, Hospital de la Santa Creu i Sant Pau ¬ Dra. Mª José Lafuente Pascual Hospital de la Santa Creu i Sant Pau ¬ Dra. Montse Llobera Serentill Servicio de oncología, Hospital de Tortosa Verge de la Cinta ¬ Dra. Gemma Mancebo Moreno Servicio de ginecología y obstetricia, Hospital del Mar ¬ Dra. Susanna Marín Borràs Servicio de oncología radioterápica, ICO Hospital Duran i Reynals ¬ Dra. Teresa Maristany Daunert Servicio de radiología, Hospital de Mar ¬ Dra. Lola Martí Cardona Servicio de ginecología, Ciudad Sanitaria y Universitaria de Bellvitge 3 ¬ Dra. Carmen Mateo Corbalán Jefe de sección de ginecología, Hospital de Tortosa Verge de la Cinta ¬ Dr. Ramon Miralles Pi Jefe de servicio de obstetricia y ginecología, Hospital Universitario Joan XXIII de Tarragona ¬ Dra. Belén Ojeda González Jefe clínico del servicio de oncología médica, Hospital de la Santa Creu i Sant Pau ¬ Dr. Jaume Pahisa Fábregas Jefe de sección de ginecología oncológica, Instituto Clínico de Obstetricia, Ginecología y Neonatología, Hospital Clínic i Provincial de Barcelona ¬ Dra. Beatriz Pardo Búrdalo Servicio de oncología médica, ICO Hospital Duran i Reynals ¬ Dra. Mª Assumpció Pérez Benavente Servicio de ginecología, Hospital Materno-infantil de la Vall d’Hebron ¬ Dr. Antoni Pessarrodona Isern Jefe de servicio de obstetricia y ginecología, Hospital Mútua de Terrassa ¬ Dr. Jordi Ponce Sebastià Hospital Universitario Arnau de Vilanova de Lleida ¬ Dr. Jaime de Prat Diaz de Losada Director del servicio de anatomía patológica, Hospital de la Santa Creu i Sant Pau ¬ Dra. Isabel Roca Bielsa Servicio de medicina nuclear, Hospital Universitario de la Vall d’Hebron ¬ Dra. Àngels Rovirosa Casino Servicio de oncología radioterápica, Hospital Clínic i Provincial de Barcelona ¬ Dr. Melcior Sentís Crivellé Responsable de radiología de la mama y ginecológica, Corporación Sanitaria Parc Taulí ¬ Dr. Josep M. Solé Monne Servicio de radioterapia, Hospital General de Catalunya ¬ Dr. Antoni Tarrats Oliva Servicio de ginecología, Hospital Universitario Germans Trias i Pujol ¬ Dr. Agust Vidal Bel Servicio de anatomía patológica, Ciudad Sanitaria y Universitaria de Bellvitge Asesores externos de la OncoGuía de ovario g o ¬ Dr. Matías Jurado Clínica Universitaria de Navarra ¬ Dr. Javier Magriña Clínica Mayo Scottsdale, EEUU ¬ Dr. Francisco Nogales Hospital Universitario San Cecilio, Granada ¬ Dra. Esther Oliva Massachussets General Hospital, EEUU ¬ Dr. Andrés Poveda Instituto Valenciano de Oncología PARTE I. PROCESO Y METODOLOGÍA DE LAS GUÍAS DE PRÁCTICA CLÍNICA EN CÁNCER-ONCOGUÍAS PROCESO Introducción Las OncoGuías son la herramienta que utiliza el Plan Director de Oncología para lograr la equidad terapéutica. El Departamento de Sanidad y Seguridad Social de la Generalitat de Cataluña ha instaurado el Plan Director de Oncología de Cataluña que, entre otros objetivos, establece que hay que desarrollar medidas de mejora de la atención oncológica basadas en la mejor evidencia científica posible. La gestión de este Plan Director ha sido encomendada al Instituto Catalán de Oncología (ICO), empresa pública que tiene entre sus misiones asesorar al CatSalut - Servicio Catalán de la Salud en la prevención y control del cáncer en Cataluña así como en la mejora de la atención oncológica de la población. Por otro lado, l’Agència d’Avaluació de Tecnologia i Recerca Mèdiques (AATRM) de Cataluña, también empresa pública del CatSalut, tiene entre sus objetivos generar información procedente del análisis riguroso y sistemático de la evidencia científica, para que aquellos que tienen que tomar decisiones dentro del sistema sanitario lo hagan fundamentándose en la mejor información disponible. En este sentido, la AATRM tiene una amplia experiencia en la realización y evaluación de guías de práctica clínica. Estos objetivos y misiones cristalizaron en la firma de un acuerdo ICO-AATRM para crear un programa conjunto denominado Programa de Guías de Práctica Clínica en Cáncer-OncoGuías, que presenta como atributos fundamentales la calidad, la eficiencia y la transparencia. Actores El uso de una OncoGuía tiene que garantizar que se reciba el tratamiento recomendado por los estudios científicos y los expertos de todo el mundo involucrados en este tipo de enfermedad. Para lograr este propósito, se decidió que la administración sanitaria ejercería un papel dinamizador, y que los actores fundamentales y responsables del desarrollo de las mencionadas OncoGuías serían los profesionales de la atención sanitaria, apoyados metodológicamente por la AATRM. Las Comisiones de Tumores y los departamentos de Oncología Médica, Hematología, Oncología Radioterápica, y Cirugía; especialidades médicas y quirúrgicas como Digestivo, Endoscopia, Neumología, Ginecología, Cirugía Plástica, Cirugía Torácica; así como los especialistas en Servicios Centrales, Anatomía Patológica, Radiología y Medicina Nuclear de los hospitales de la Red Hospitalaria de Utilización Pública de Cataluña son los participantes. Todos ellos aportan la experiencia clínica plasmada en los protocolos existentes de los principales tipos de tumores y, en la fase correspondiente del proceso, revisan y discuten la elaboración de los algoritmos y el redactado del texto de las OncoGuías hasta lograr el documento definitivo, y se constituyen en Comité de Expertos que velará por la actualización continuada de las mencionadas OncoGuías. Esta parte del proceso es fundamental para establecer la dinámica de participación y consenso que hace que el documento final sea producto de todos y propiedad tanto de los expertos como de las agencias encargadas de producirlo. La AATRM ha compilado y revisado sistemáticamente, evaluando su calidad, las guías de práctica clínica disponibles, nacionales e internacionales, sobre los tipos de cáncer que nos ocupan. También ha evaluado la calidad de los protocolos asistenciales vigentes en Cataluña con respecto al grado de evidencia que los sustenta y al grado de acuerdo con la experiencia revisada. Posteriormente, ha redactado las correspondientes guías, que fueron discutidas en diferentes jornadas de trabajo organizadas a tal efecto, tanto con profesionales de las diferentes instituciones catalanas como con expertos del ámbito internacional. Las principales guías internacionales evaluadas han sido las de la National Comprehensive Cancer Network, las de la Fédération Française de Centres de Lutte Contre le Cancer, las del Cancer Care Ontario y las del National Institute for Clinical Excellence. Por otra parte, la Academia de Ciencias Médicas de Cataluña y de Baleares da su apoyo científico al tiempo que coordina la elaboración de las recomendaciones generales para la redacción de los informes patológicos mediante la Sociedad Catalana de Anatomía Patológica. 5 Las OncoGuías están basadas en el estado del conocimiento científico, la revisión de la experiencia internacional y las aportaciones de expertos de nuestro contexto, perfilando y estableciendo su aplicabilidad en nuestro entorno sanitario. Por lo tanto, permitirán dar garantía de recibir el mejor tratamiento demostrado, independientemente del lugar de residencia. Hay que destacar que, en este caso, la innovación consiste en la estandarización de estos tratamientos. Los atributos de equidad, protección y consenso son los que reflejan más fidedignamente la utilidad de las OncoGuías. Contenido La cualidad principal es el hecho de ser básicas y claras. La guía tipo dispone de la composición siguiente: ¬ Comité de expertos involucrados ¬ Proceso y metodología de elaboración ¬ Algoritmos de diagnóstico, tratamiento y seguimiento ¬ Texto explicativo ¬ Bibliografía Está previsto incorporar una base de datos de resultados con indicadores de atención oncológica (supervivencia libre de enfermedad, supervivencia global, número de ganglios analizados, y otros específicos del tipo de tumor). Esta base de datos será una incorporación diferencial e innovadora con respecto al resto de guías de práctica clínica internacionales vigentes hoy en día. Actuará tanto de control de calidad como de testigo de la necesidad de actualización de las OncoGuías. El objetivo cualitativo es hacer unas OncoGuías fiables e integradoras, que puedan competir en calidad y universalidad con cualquiera de las consideradas de referencia en los diferentes entornos sociosanitarios. METODOLOGÍA Vínculo de las recomendaciones con la evidencia científica disponible En los algoritmos de las OncoGuías se proponen una serie de intervenciones diagnósticas, preventivas o terapéuticas para diferentes tipos de tumores. Para decidir las recomendaciones para cada uno de los casos se han tenido en cuenta los protocolos existentes y la práctica clínica actual en los diferentes hospitales catalanes, así como las opiniones y argumentos de los miembros de los diferentes grupos de trabajo expresados en una serie de reuniones abiertas y programadas dentro de un plan de trabajo estructurado. El método de trabajo básico ha sido la elaboración de unos documentos preliminares que se han ido debatiendo y no se han dado por definitivos hasta llegar a un consenso por parte del grupo de expertos. Los miembros de los grupos de trabajo han hecho distintas consideraciones a los diferentes borradores (por escrito o en las mismas reuniones) que se han discutido en todos los casos en las reuniones programadas. Para una serie de recomendaciones seleccionadas por cada grupo de trabajo, en función de su relevancia, se han añadido dos tareas adicionales. En primer lugar, se ha comprobado el grado de acuerdo que sobre la recomendación ha existido dentro del grupo de trabajo y también 6 se le ha asignado una categoría dentro de una clasificación del grado de consenso. En segundo lugar, se ha realizado una breve síntesis de la evidencia científica disponible que apoya la intervención, con la asignación de una categoría dentro de una clasificación según su calidad. Así, cada una de estas recomendaciones seleccionadas se menciona en los algoritmos con dos valores: uno referido al grado de consenso dentro del grupo de trabajo y otro referido a la calidad de la evidencia científica que la apoya; habitualmente, se añade una llamada a un texto en que se sintetiza brevemente la evidencia. A continuación, se describen el proceso y las categorías de ambas clasificaciones. Las clasificaciones se han elaborado teniendo en cuenta las propuestas actuales del National Cancer Institute (www.cancer.gov/cancerinfo/pdq/), la National Comprehensive Cancer NetworkNCCN (www.nccn.org/), www.nccn.org/), el NHS Scotland (www. www.nccn.org/ show.scot.nhs.uk/sign/guidelines), el Institute for Clinical Systems Improvement-ICSI (www. icsi.org), la Fédération Nationale des Centres de Lutte Contre le Cancer (www.fnclcc.fr/) www.fnclcc.fr/ y la www.fnclcc.fr/) AATRM (www.aatrm.net). Clasificación de la evidencia científica disponible Habitualmente, la mayoría de clasificaciones vigentes hoy día utilizan como elemento básico la susceptibilidad al sesgo del diseño de los estudios que apoyan la eficacia de la intervención que se plantea. Por lo general, conceden el nivel más alto de la clasificación a los estudios en que la asignación de los pacientes a los diferentes grupos ha sido aleatoria (habitualmente, ensayos clínicos controlados aleatorizados o metaanálisis de ensayos clínicos de estas características) y el nivel mínimo a la opinión de expertos en ausencia de evidencia de nivel superior. En categorías intermedias, se sitúan los estudios epidemiológicos observacionales analíticos con un grupo control (por ejemplo, estudios de cohortes o de casos y controles) y los estudios observacionales sin un grupo control (por ejemplo, series de casos). Como se acaba de comentar, la mayoría de clasificaciones valoran fundamentalmente la evidencia sobre la eficacia de la intervención que se plantea y no valoran formalmente cuestiones relacionadas con el riesgo de yatrogenia, ni la conveniencia de la intervención ni sus costes. Aceptando como planteamiento inicial que la eficacia es lo primero que se tiene que tener en cuenta, en el caso concreto de la oncología se ha valorado que era fundamental reflejar en la clasificación cuál era la variable de medida de eficacia empleada en los estudios que apoyan la intervención planteada, puesto que se considera superior una medida que ha demostrado mejorar la supervivencia que otra que sólo ha demostrado mejorar la tasa de respuestas tumorales. Clasificación del grado de consenso Categoría E Estándar. Cuando todo el grupo de trabajo está de acuerdo en considerar recomendable la intervención que se plantea en el contexto concreto del algoritmo. Categoría OC Opción de consenso. Cuando la mayoría (90%) del grupo de trabajo considera recomendable la intervención que se plantea en el contexto concreto del algoritmo. Categoría O Opción. Cuando hay discrepancias mayores sobre si la intervención es recomendable y no se ha llegado a un consenso por parte de la mayoría del grupo de trabajo. Hay que tener en cuenta que, con cierta frecuencia, para una misma población pueden estar disponibles diferentes intervenciones sobre las cuales haya habido, en el seno del grupo de trabajo, grados de consenso que pueden haber sido diferentes. Clasificación de la evidencia disponible Categoría 1 Estudios experimentales con asignación aleatoria (ensayos clínicos aleatorizados o metaanálisis de estos ensayos clínicos) Categoría 2 Estudios observacionales con grupo control (estudios de cohortes, estudios de casos y controles) Categoría 3 Estudios observacionales sin grupo control (series de casos) Categoría 4 Opinión de expertos A estas categorías, se añade una letra en función de la variable principal de medida empleada en los estudios que apoyan la eficacia de la intervención: A Mortalidad total B Mortalidad por cáncer C Calidad de vida D Medidas indirectas (intervalo libre de enfermedad, intervalo libre de progresión de la enfermedad, tasa de respuesta tumoral) Así pues, cada una de las recomendaciones seleccionadas se ha clasificado en una serie de niveles que van desde un máximo de 1A hasta un mínimo de 3D; cuando la recomendación se basaba únicamente en la opinión de expertos no tenía sentido asignar la letra correspondiente a la variable principal de medida. Hay que tener en cuenta que, con cierta frecuencia, para una misma población pueden estar disponibles diferentes intervenciones apoyadas por una evidencia científica que puede ser de calidad diferente y clasificarse, por lo tanto, en niveles diferentes. Limitaciones del método utilizado Clasificación del grado de consenso No se han hecho votaciones formales en el seno de los grupos de trabajo y el grado de consenso ha sido estimado por el coordinador del grupo, encargado de ir incorporando la clasificación de la evidencia científica disponible y el grado de consenso para cada una de las intervenciones seleccionadas. 7 Posteriormente, la clasificación provisional del grado de consenso para cada intervención era confirmada, o modificada si se daba el caso, en las reuniones del grupo de trabajo. No se ha definido un método concreto para pasar de la clasificación de la evidencia científica disponible a la recomendación para cada intervención seleccionada; no se han definido criterios explícitos para considerar los aspectos mencionados en el apartado anterior (por ejemplo, magnitud de los beneficios, riesgo de yatrogenia, etc.) ni tampoco los costes ni aspectos relacionados con la conveniencia de las intervenciones (por ejemplo, complejidad o necesidad de una monitorización especial). A menudo, algunos de estos aspectos se han discutido en el seno de los grupos de trabajo sobre la base de la evidencia, en ocasiones contradictoria, hecho que ha influido en el grado de consenso al que se ha llegado. En el futuro se valorará si hace falta modificar el método para pasar de la clasificación de la evidencia disponible a hacer las recomendaciones y establecer el grado de consenso. Clasificación de la evidencia disponible La clasificación ha utilizado como criterio básico la susceptibilidad al sesgo del diseño de los estudios que apoyan la intervención, pero no ha empleado ninguna escala concreta para medir con más detalle la calidad específica de cada uno de los diferentes tipos de estudio ni la heterogeneidad de los resultados entre diferentes estudios. Por otro lado, se ha centrado en la eficacia y en la variable principal de medida, pero no ha tenido en cuenta de manera formal ni la magnitud de los beneficios ni la incertidumbre sobre la estimación de la eficacia (precisión de la medida). Tampoco se ha incorporado en la valoración formal el riesgo de yatrogenia o toxicidad de la intervención. Muchas de estas cuestiones adicionales se han planteado en algunas de las discusiones en el seno de los grupos de trabajo y han tenido su peso en el momento de llegar a un mayor o menor grado de consenso sobre la recomendación de cada una de las intervenciones. En el futuro, se valorará si vale la pena incorporar formalmente alguna o todas estas cuestiones para clasificar la evidencia o graduar la fuerza de las recomendaciones. Otra limitación ha sido que no se han definido unos criterios explícitos para la identificación y selección de la evidencia científica disponible para cada intervención seleccionada. Para cada una de ellas, miembros concretos de los grupos de expertos han hecho una propuesta de síntesis de la evidencia científica, con las referencias bibliográficas correspondientes, y una propuesta de clasificación inicial; ambas propuestas eran sometidas a discusión, y modificación si se daba el caso, en el seno del grupo. En algunos casos, se ha tenido en cuenta la evidencia científica recogida en otras recomendaciones o guías de práctica clínica ya publicadas. En el futuro, está pensado mantener un grupo reducido de expertos para cada guía que, entre otras tareas, haga una identificación y selección de nueva evidencia científica en función de su relevancia para confirmar o cambiar las recomendaciones hechas en esta primera edición. Se valorará si vale la pena incorporar formalmente unos criterios explícitos para la identificación y selección de la evidencia científica. Finalmente, hay que mencionar que la clasificación empleada es especialmente adecuada para las intervenciones preventivas y terapéuticas, pero probablemente haría falta ajustarla para las intervenciones diagnósticas o pronósticas. Pese a esta limitación, teniendo en cuenta que se empezaba un proyecto de notable complejidad y que la mayoría de intervenciones seleccionadas para vincular con la evidencia científica disponible son terapéuticas, se decidió utilizar una sola clasificación para todas las intervenciones seleccionadas. En el futuro, se valorará si hace falta ajustar esta clasificación para algún tipo concreto de intervención y cómo hacerlo. FUENTES DE INFORMACIÓN CONSULTADAS ¬ ¬ ¬ ¬ ¬ ¬ 8 Fédération Nationale des Centres de Lutte Contre le Cancer (www.fnclcc.fr/) www.fnclcc.fr/ www.fnclcc.fr/) Institute for Clinical Systems Improvement ICSI (www.icsi.org) National Cancer Institute NCI (www.cancer.gov/cancerinfo/pdq/) www.cancer.gov/cancerinfo/pdq/ www.cancer.gov/cancerinfo/pdq/) National Comprehensive Cancer Network NCCN (www.nccn.org/) www.nccn.org/ www.nccn.org/) National Health Service NHS Scotland (www.show.scot.nhs.uk/sign/guidelines) National Institute for Clinical Excellence NICE (www.nice.org.uk/) PARTE II. ONCOGUÍA DE OVARIO ALGORITMO 1. Diagnóstico y tratamiento primario del cáncer de ovario epitelial Sospecha/diagnóstico enfermedad de ovario Sospecha de cáncer de ovario epitelial por masa pelviana y/o ascitis, distensión abdominal o síntomas sin otra causa clara de malignidad1 Cáncer de ovario con cirugía previa y/o estadificación incompletas con: útero intacto y/o anejos intactos y/o epiplón no resecado y/o documentación de la estadificación inadecuada - Eco o TC abdominopelviana si está clínicamente indicada - Ca 125 / Ca 19.92 - Hemograma completo - Bioquímica completa - Rx de tórax PA/L - Enema opaco / Colonoscopia si está clínicamente indicada - Citología en caso de derrame pleural Completar procedimiento quirúrgico (estadificación y/o resección) Confirmación patológica de cáncer de ovario epitelial3 Tumor de ovario borderline seroso por masa pelviana borderline o diagnóstico en revisión patológica En pacientes con estadios III/IV irresecables,7 considerar: Histerectomía total abdominal y salpingooforectomía bilateral con estadificación completa4,5 + Cirugía citorreductora óptima para estadios I-IV6 [E-1A] Tratamiento tumor borderline seroso (Algoritmo 5) Quimioterapia neoadyuvante8 con citorreducción de intervalo Tratamiento quimioterápico (Algoritmo 2) 1 Ver texto con criterios de sospecha y criterios ecográficos de masa anexial 2 Ante la eventualidad de carcinomas mucinosos 3 Histológica o citológica 4 Ver criterios de estadificación completa 5 Si la paciente desea mantener fertilidad, debe considerarse salpingooforectomía unilateral o bilateral en estadios IA y IB bien diferenciados siempre y cuando se haya hecho estadificación completa 6 Criterios de cirugía citorreductora óptima: ver texto 7 Criterios de irresecabilidad: - Metástasis hepáticas parenquimatosas masivas - Adenopatías paraaórticas por encima de la vena renal - Afectación de la raíz del mesenterio - Afectación diseminada de la serosa peritoneal 8 Número mínimo de ciclos: 3 9 ALGORITMO 2. Tratamiento quimioterápico de cáncer de ovario epitelial Estadificación patológica Estadios IA o IB1 Grado 1 Observación Grado 2 Estadios III y IV Estadios IC y II Grado 3 y tumores de células claras Quimioterapia2 con paclitaxel/ carboplatino 6 ciclos3 [E-1A] Quimioterapia2 adyuvante con paclitaxel/ carboplatino 4-6 ciclos [E-2B] Remisión completa4 Seguimiento cáncer de ovario (Algoritmo 3) Remisión parcial Progresión Observación o ensayo clínico Tratamiento de rescate (Algoritmo 4) 1 La clasificación por grados se aplica a los tumores endometrioides 2 Considerar dosis de fármacos AUC5 3 En los casos de estadio III, bajo volumen y con óptima citorreducción (T<0,5cm), se puede administrar quimioterapia intraperitoneal por grupos experimentados 3 Ver texto 10 ALGORITMO 3. Seguimiento del cáncer de ovario Seguimiento Estadios I, II, II y IV en remisión completa - Visitas cada 4-6 meses durante 2 años y cada 6 meses durante los 3 años siguientes con marcadores tumorales + exploración física que incluya examen pelviano - Eco opcional - TC abdominopelviana según indicación clínica - Rx tórax PA y L según indicación clínica [OC-4] Si Ca 125 aumentado (o Ca 19.9 si aumentado al inicio) u otras alteraciones Continuar seguimiento Reevaluación1 Recidiva y tratamiento de rescate (Algoritmo 4) 1 No recomendar tratamiento con marcadores aumentados solos 11 ALGORITMO 4. Recidiva y tratamiento de rescate en el cáncer de ovario Recidiva1 <6 meses después de quimioterapia > 6 meses después de quimioterapia En casos seleccionados: Masa resecable de bajo volumen o recidiva >18 meses CONSIDERAR Cirugía de citorreducción secundaria2 Ensayo clínico Quimioterapia de 2ª línea3 Quimioteràpia basada en platino3 1 Debe considerarse la posibilidad de un 2º primario 2 Ver texto de cirugía 3 Ver texto de quimioterapia 12 ALGORITMO 5. Tumor de ovario borderline seroso Tumor borderline seroso Diagnóstico en revisión patológica1 Masa pelviana borderline SÍ cirugía previa incompleta2 Si previamente cirugía estándar con estadificación completa4 Sospecha de enfermedad residual3 No sospecha de enfermedad residual Paciente que SÍ desea fertilidad Paciente que NO desea fertilidad Cirugía conservadora de la fertilidad con estadificación completa4 Cirugía estándar con estadificaicón completa4 Estadio I o implantes no invasivos Implantes invasivos Observación [OC-3] 1 Ver texto de laparoscopia 2 Se aconseja contactar con el centro donde se hizo la cirugía previa, contar con la opinión de la paciente y la valoración anatomopatológica Ensayo clínico Seguimiento del tumor borderline (Algoritmo 6) Considerar tratamiento adyuvante como cáncer de ovario epitelial [OC-3] Tratamiento adyuvante (Algoritmo 2) 3 Criterios que deben considerarse, entre otros: crecimiento exofítico, nódulos peritoneales no biopsiados 4 Ver texto de tumores borderline 13 ALGORITMO 6. Seguimiento del tumor borderline seroso Seguimiento - Visitas cada 4-6 meses durante 2 años y posteriormente anuales - Ca 125 cada visita - Ecografía en el caso de cirugía conservadora [OC-4] Si recidiva clínica Evaluación quirúrgica y citorreducción si apropiado Implantes no invasivos Implantes invasivos Considerar tratamiento como cáncer de ovario epitelial Observación 14 Tratamiento adyuvante (Algoritmo 2) ACTITUD ANTE UNA TUMORACIÓN OVÁRICA El cáncer de ovario se presenta en la mayoría de casos como una masa anexial unilateral o bilateral descubierta en una exploración clínica o ecográfica. La actitud ante una tumoración ovárica (después de descartar quistes funcionales) tiene que enfocarse desde el lado oncológico, aunque la mayoría de masas ováricas son benignas. Anamnesis Se consideran pacientes de alto riesgo a las postmenopáusicas, a las que tengan antecedentes familiares de cáncer de ovario, antecedentes de otras neoplasias (mama, endometrio, colon), y a las nuligestas y/o infértiles. Exploración Física general, abdominal y pelviana. Altamente sospechosas de malignidad: masa anexial palpable, dura e irregular, especialmente si es bilateral. Douglas ocupado por nódulos duros, fijos e irregulares. Hepatomegalia y ascitis, en casos avanzados. Eco-Doppler vaginoabdominal Signos de sospecha de malignidad: coexistencia de formaciones sólidas y líquidas en el interior del tumor. ¬ Irregularidad de los bordes ¬ Ecos internos ¬ Vegetaciones internas ¬ Septos limitantes ¬ Ascitis ¬ Neovascularización intratumoral, con vasos de trayecto tortuoso ¬ Flujos de baja resistencia Las enfermas con bajo grado de sospecha de neoplasia maligna serán sometidas a la laparoscopia. Las enfermas de alta sospecha de neoplasia maligna serán sometidas a cirugía reglada con criterios oncológicos. Laparoscopia Antes de proceder al tratamiento quirúrgico de la masa ovárica supuestamente benigna, hay que explorar exhaustivamente la cavidad abdominal para descartar implantes sospechosos; si se encuentran, hay que biopsiar. Se realizará lavado peritoneal para estudio citológico. La punción y aspiración para citología del líquido intraquístico tiene un alto índice de falsos negativos, por lo que no se recomienda. Debe examinarse la superficie ovárica externa para descartar la presencia de vegetaciones. Si se encuentran signos sospechosos de malignidad, se realizará cirugía reglada con criterios oncológicos, con eventual biopsia preoperatoria. Si no se encuentran signos de malignidad, se procederá al tratamiento quirúrgico laparoscópico según los siguientes criterios: ¬ Mujeres postmenopáusicas: ovariectomía/ anexectomía unilateral o bilateral. ¬ Mujeres premenopáusicas: quistectomía siempre que se pueda y, de no ser así, ovariectomía/anexectomía. Anamnesis Examen pelviano Eco-Doppler vaginal Ca12.5; Ca 19.9 LDH α-Fetoproteína y β-HCG (< 30 años) Marcadores tumorales Se solicitará a todas las pacientes el Ca 125 y Ca 19.9. En mujeres premenopáusicas, el Ca 125 puede estar elevado en patología benigna, llegando a cifras de 65-200 UI/ml, frecuentemente endometriosis. El nivel de corte es de 35 UI/ ml en la postmenopausia y de 65 UI/ml en la premenopausia. En mujeres menores de 30 años, se solicitará α-Fetoproteína, β-HCG y LDH para descartar tumores germinales. No sospecha de malignidad Sospecha de malignidad Laparoscopia diagnóstica No sospechosa Laparoscopia quirúrgica Cirugía reglada Sospechosa Cirugía reglada 15 En resumen: 1. Ante toda masa ovárica se tendrán en cuenta todos los criterios expuestos para evitar en lo posible manipular inadecuadamente un cáncer de ovario. 2. Si en el transcurso de una intervención sobre una masa ovárica se descubre que se trata de un cáncer de ovario y la paciente o el equipo no está en condiciones de conseguir el tratamiento óptimo, se suspenderá la intervención para practicarla en condiciones óptimas dentro de los 15 días inmediatos. ............................................... ESTADIFICACIÓN QUIRÚRGICA DEL CÁNCER EPITELIAL DE OVARIO TNM Ovario (ICD-O C56) NORMAS PARA LA CLASIFICACIÓN La clasificación se aplica a los tumores estromales malignos de la superficie epitelial, incluyendo los borderline o los de bajo potencial de malignidad. Debe existir confirmación histológica de la enfermedad. Los procedimientos para valorar la clasificación T, N y M son: exploración física, técnicas de imagen, laparoscopia, y/o exploración quirúrgica. T: Tumor primario N: Ganglios linfáticos regionales M: Metástasis a distancia Tx No se puede evaluar el tumor primario Nx No se pueden evaluar los ganglios linfáticos regionales N0 No se demuestran metástasis ganglionares regionales Mx No se pueden evaluar las metástasis a distancia M0 No hay metástasis a distancia T0 No hay evidencia de tumor primario T1 N1 Tumor limitado a los ovarios, uno o ambos (FIGO I) Metástasis ganglios linfáticos T1a regionales (FIGO IIIC) Tumor limitado a un ovario; cápsula intacta, sin tumor en la superficie ovárica. Sin células malignas en la ascitis o lavados peritoneales (FIGO IA)) T1b Tumor limitado a ambos ovarios; cápsulas intactas, sin tumor en la superficie ovárica. Sin células malignas en la ascitis o lavados peritoneales (FIGO IB) T1c Tumor limitado a uno o ambos ovarios con cualquiera de lo siguiente: cápsula rota, tumor en la superficie ovárica, células malignas en la ascitis o lavados peritoneales (FIGO IC) T2 Tumor que afecta a uno o ambos ovarios con extensión pelviana y/o implantes (FIGO II) T2a Extensión y/o implantes en útero y/o trompa(s). Sin células malignas en la ascitis o lavados peritoneales (FIGO IIA) T2b Extensión y/o implantes en otros tejidos pelvianos. Sin células malignas en la ascitis o lavados peritoneales (FIGO IIB) T2c Extensión y/o implantes (T2a o T2b) con células malignas en la ascitis o lavados peritoneales (FIGO IIC) T3 Tumor que afecta a uno o ambos ovarios con metástasis peritoneales fuera de la pelvis confirmadas microscópicamente (FIGO III) T3a Metástasis peritoneales fuera de la pelvis microscópicas (sin tumor macroscópico) (FIGO IIIA) T3b Metástasis peritoneales fuera de la pelvis macroscópicas de 2 cm o menos en su diámetro mayor (FIGO IIIB) T3c Metástasis peritoneales fuera de la pelvis mayores de 2 cm en su diámetro mayor y/o metástasis en los ganglios linfáticos regionales (FIGO IIIC) 16 M1 Metástasis a distancia (se excluyen las metástasis peritoneales) (FIGO IV) CLASIFICACIÓN ANATOMOPATOLÓGICA PTNM Las categorías pT, pN y pM se corresponden con las categorías T, N y M Estadios I IA IB IC II IIA IIB T1 T1a T1b T1c T2 T2a T2b N0 M0 N0 M0 N0 M0 N0 M0 N0 M0 N0 M0 N0 M0 IIC III IIIA IIIB IIIC IV T2c N0 M0 T3 N0 M0 T3a N0 M0 T3b N0 M0 T3c N0 M0 Cualquier T N1 M0 Cualquier T Cualquier N M1 Sobin LH, Wittekind CH, editors. TNM Classification of Malignant Tumours. 6th edition. New York: John Wiley & Sons; 2002. Junto al objetivo fundamental de exéresis adecuada del tumor, la cirugía en el cáncer de ovario posee un papel trascendental en la estadificación de la enfermedad. Es necesaria una estadificación correcta en el cáncer epitelial de ovario para establecer el pronóstico y la necesidad de tratamientos complementarios. Las diferencias en la supervivencia de los estadios iniciales de esta enfermedad (FIGO I-II) y los estadios avanzados (FIGO III-IV) es muy significativa. 1-3 de un amplio muestreo abdominal y retroperitoneal. 10 Actualmente, la exploración quirúrgica es el método más apropiado para estadificar esta enfermedad. A pesar de este consenso generalizado, para el 30 o el 46% de las pacientes intervenidas inicialmente por esta enfermedad, no se dispone de información suficiente para realizar adecuadamente la estadificación. 2 De estas pacientes, el 77% han sido infraestadificadas y pasan directamente a un estadio III al ser reevaluadas posteriormente. 4 Dentro de las diversas maniobras quirúrgicas necesarias y utilizadas para reestadificar a estas pacientes, la citología peritoneal fue la exploración quirúrgica que más influyó en la modificación del estadio, siendo positiva en el 33 % de los casos. 2,5,6 ¬ Lavado peritoneal para evaluación citológica. Preferiblemente por compartimentos anatómicos El diagnóstico de los estadios iniciales sólo es posible tras la exclusión de metástasis abdominales y/o retroperitoneales mediante una exploración quirúrgica que ha de ser extensa y rigurosa. 7-10 La metodología de esta revisión quirúrgica, basada en las vías naturales de diseminación y extensión del cáncer epitelial de ovario, ha sido recomendada por el Gynecologic Oncology Group (GOG), y por la European Guidelines for Staging of Ovarian Cancer del grupo ginecológico de la EORTC. 3,10 Los resultados obtenidos con la aplicación de cualquiera de los dos criterios de estadificación fueron muy similares. Ambos sistemas confirmaron el alto índice de enfermedad microscópica, demostrándose la necesidad La metodología quirúrgica recomendada para estadificar a una paciente diagnosticada de cáncer de ovario incluye los siguientes pasos y procedimientos: ¬ Cuidadosa inspección intraabdominal y palpación de todas las superficies peritoneales y mesentéricas: hígado, estómago, vesícula, bazo y riñones ¬ Omentectomía completa ¬ Apendicectomía (sospecha o confirmación de histología mucinosa) ¬ Histerectomía total abdominal ¬ Anexectomía bilateral ¬ Evaluación y biopsia de ambas superficies diafragmáticas (> 2 muestras) ¬ Liberación y biopsias de las adherencias adyacentes al tumor primario ¬ Además, biopsias del peritoneo vesical, fondo de saco, ambos parietocólicos y de la fosa ovárica del lado afecto (> 2) ¬ Biopsia de cualquier lesión sospechosa ¬ Muestreo biópsico de ganglios linfáticos/ linfadenectomía a lo largo de vasos ilíacos, aorta y cava entre arteria mesentérica inferior y vena renal izquierda o linfadenectomía pelviana y paraaórtica. 11 Algunos grupos de ginecólogos especializados han demostrado que técnicamente es posible realizar por vía laparoscópica el estudio de extensión del cáncer de ovario en estadio inicial. Actualmente, no existen resultados de estudios prospectivos y aleatorios que determinen aisladamente la variable vía de abordaje. 12-15 17 CONCEPTO E INDICACIONES DE LA CITORREDUCCIÓN “ÓPTIMA” EN EL TRATAMIENTO DEL CÁNCER DE OVARIO Citorreduccion “óptima” primaria En el tratamiento inicial del cáncer epitelial de ovario los únicos factores independientes relacionados con la supervivencia que mantienen relevancia estadística son el tratamiento quimioterápico con cisplatino y el tamaño del tumor residual tras la cirugía, es decir, la citorreducción “óptima” primaria. 16 Definición Se denomina cirugía citorreductora o cirugía debulking al concepto de exéresis tumoral sin intención curativa. Sólo se ha demostrado beneficio clínico con esta cirugía en un tipo muy limitado de tumores. El linfoma de Burkitt y el carcinoma de ovario son los más significativos. Principios 1. Efecto directo sobre el metabolismo y el estado general de las pacientes motivado por la reducción del volumen tumoral, la eliminación de zonas de necrosis y de las consecuencias adversas sobre la función digestiva. 7,8 2. Mejora en la respuesta al tratamiento complementario debido a la disminución sustancial del número de células tumorales. Según el crecimiento gompertziano propuesto por Norton y Simpson, se acepta la hipótesis de que cuanto mayor es el número de células o el tiempo de tumorneogénesis y de tratamiento con quimioterapia, más probable es la formación de clones celulares quimioerresistentes que disponen de un menor riego sanguíneo y peor acceso de los fármacos hasta las células tumorales. 7,17,18 3. La eliminación de una población determinada de células con la cirugía incrementa la sensibilidad a los fármacos y ayuda a disminuir el número de ciclos de quimioterapia. 19 También se han referido efectos beneficiosos de la reducción de volumen tumoral sobre el sistema inmunitario de estas pacientes. 20 Los beneficios de la citorreducción quirúrgica están claros durante el tratamiento inicial del cáncer de ovario: citorreducción primaria. Los criterios para definir la citorreducción “óptima” han ido evolucionando desde el concepto inicial de cirugía con residuo 18 tumoral igual o inferior a 2 cm de diámetro mayor, hasta la propuesta actual de algunos autores de cirugía “completa”, equivalente a la ausencia de enfermedad residual macroscópica. Heintz 21 observó en su serie que los factores que influyen en la posibilidad de una citorreducción “óptima” son los mismos que están relacionados con el periodo libre de enfermedad y la supervivencia (edad joven, bajo grado, metástasis pequeñas, ausencia de ascitis o carcinomatosis peritoneal). A estos hechos, hay que añadir la dificultad de determinar con exactitud el tamaño del residuo tumoral en la cirugía, en ocasiones compleja. Pero a pesar de persistir estos puntos controvertidos, actualmente se dispone de evidencia que recomienda mayores esfuerzos quirúrgicos que persigan reducir el tumor residual a restos mínimos (por debajo de 0,5 cm), o incluso, en algunas circunstancias, lograr la ausencia de tumor macroscópico. 22-25,25-41 El único estudio prospectivo aleatorizado realizado sobre citorreducción es el de citorreducción de intervalo de la European Organization for Research and Treatment of Cancer (EORTC), que mostró que la supervivencia media y global era mayor en el grupo de pacientes sujetas a cirugía de intervalo después de 3 ciclos de quimioterapia. El análisis multivariante confirmó que la cirugía fue un factor pronóstico independiente para los resultados. 42 Se han descrito abordajes quirúrgicos extrafasciales que facilitan la exéresis centrípeta completa de las grandes masas tumorales abdomino-pelvianas. 43-46 Sugarbaker 47 ha publicado técnicas quirúrgicas que permiten la citorreducción fiable y segura de cualquiera de los compartimentos anatómicos abdominales y/o retroperitoneales que puedan estar afectados por la diseminación celómica del cáncer de ovario y ayudar a efectuar la cirugía (procedimientos de peritonectomías). Para tratar con seguridad el cáncer de ovario es necesario que: ¬ El cirujano conozca la evolución natural de esta enfermedad, los fundamentos de la cinética tumoral y las técnicas quirúrgicas que le permitan abordar cualquier compartimento anatómico. ¬ Debe estar habituado a la práctica de resecciones viscerales e intestinales, en ocasiones múltiples y radicales. En algunas pacientes es necesario efectuar una cirugía oncológica muy extensa para poder realizar el grado de citorreducción “óptima” exigido. La experiencia y el conocimiento del cirujano en el comportamiento de este tipo de tumores y sus características especiales de diseminación son básicos para determinar la necesidad y la idoneidad de estas cirugías radicales. ¬ El cirujano no ha de sobreestimar la invasión de estos implantes y debe procurar eliminar sin asociar a exéresis o resecciones aquellos implantes que no profundizan en la serosa visceral, pero también debe determinar con seguridad si existe infiltración extensa que obligue a cirugías más amplias que incluyan territorios ganglionares extraováricos. ¬ La exéresis en bloque y de forma extrafascial de todas las estructuras de la pelvis mayor, incluido el colon sigmoideo, el recto superior y el mesorrecto (pelviperitonectomía), es un procedimiento necesario en un índice alto de pacientes con cáncer avanzado de ovario o de los carcinomas serosos de la superficie peritoneal. 48,49 ¬ La esplenectomía, algunas resecciones viscerales o del peritoneo parietal, diafragmático o de la cápsula de Gleason pueden ser necesarias. 50 Estas medidas, junto a otros procedimientos radicales, sólo están justificadas si forman parte de un esfuerzo citorreductor “óptimo”. Ante la imposibilidad de extirpar todo tumor que mida, como mínimo, 2 cm, es difícil justificar estos procedimientos. Aunque el objetivo quirúrgico ideal debería ser conseguir la citorreducción completa. ¬ La linfadenectomía radical retroperitoneal sólo estaría justificada en ausencia de enfermedad peritoneal. Los altos índices descritos de estadificación incompleta y de cirugías citorreductoras “subóptimas” en este tipo de tumores orientan hacia una necesaria especialización en el tratamiento del cáncer de ovario, y son numerosas las opiniones que definen el cáncer de ovario como un tumor de tratamiento con resultados “equipodependientes” o “cirujanodependientes”. 51-53 Citorreduccion secundaria Mientras que el papel de la cirugía citorreductora primaria “óptima” está plenamente aceptado en el tratamiento del cáncer de ovario, el lugar de la cirugía citorreductora secundaria en el tratamiento del cáncer de ovario persistente o recurrente no está del todo definido. Tampoco está del todo establecido si la mejor respuesta al tratamiento quirúrgico y la mayor supervivencia, descrita en algunas series, dependen de la cirugía citorreductora per se o de la biología tumoral que permitió realizar correctamente la citorreducción secundaria. 54-56 Técnicamente es posible realizar la citorreducción secundaria “óptima” aproximadamente en el 60% de las pacientes, si es asumida por cirujanos expertos. 57 Éstos deben intentarla ante pacientes con periodos libre de enfermedad largos, ante la posibilidad técnica de practicar citorreducciones completas de la enfermedad residual o recurrente con morbilidad aceptable, respuestas a una quimioterapia de inducción, pacientes jóvenes y en buen estado general. 58-60 En estas situaciones y condiciones clínicas, como no se ha demostrado que los medios por la imagen otorguen una seguridad absoluta con los hallazgos operatorios, el equipo quirúrgico debe conocer con exactitud los motivos para contraindicar o abortar preoperatoriamente la citorreducción secundaria. Éstos serían una afectación hepática parenquimatosa importante, la afectación ganglionar portal y/o por encima de los vasos renales, la retracción masiva mesentérica (mesenterio en “coliflor”) o carcinomatosis serosa grosera de gran parte del tramo digestivo y, finalmente, la presencia de nódulos diafragmáticos superiores a 5 cm y que penetren el tórax. 61,62 La citorreducción secundaria en la enfermedad recurrente (enfermedad detectada tras más de 6 meses después de la remisión completa del tratamiento primario) sólo produjo beneficios en la supervivencia media cuando la citorreducción consiguió residuo tumoral menor de 2 cm. 56 Las posibilidades de respuesta al segundo abordaje quirúrgico citorreductor pueden ser muy altas cuando el periodo libre de enfermedad es superior a los 24 meses. 63 19 CIRUGÍA DE REEVALUACIÓN - SECOND LOOK Se considera cirugía de reevaluación la que se practica en una paciente correctamente estadificada después de la quimioterapia de primera línea y que presenta remisión completa de la enfermedad (clínica, biológica y por exploraciones complementarias). No se recomienda practicarla de manera sistemática, ya que no está demostrado que aporte ningún beneficio a las pacientes. Se puede valorar su realización para evaluar ensayos terapéuticos y en centros experimentados en algunos casos seleccionados en que se piense que su realización cambiará el enfoque terapéutico. ............................................... PROPUESTA DE PROTOCOLO PARA EL TRATAMIENTO DE LOS TUMORES OVÁRICOS SEROSOS BORDERLINE Introducción Estadificación Cada vez parece más claro que los tumores ováricos serosos borderline (TOSBL) se comportan biológicamente como una entidad nosológica separada del cáncer epitelial de ovario, por su historia natural, factores pronósticos y respuesta a la quimioterapia. 64 ¬ Citología por lavado Parece, pues, necesario considerar a los TOSBL como una enfermedad completamente diferente de la de los tumores epiteliales de ovario y, por lo tanto, se ha de establecer un protocolo diferenciado de estadificación y tratamiento. 65-68 Rasgos diferenciales ¬ Los TOSBL tienen una supervivencia global del 80%, mucho mejor que la de los tumores epiteliales. ¬ Las mujeres afectadas de TOSBL suelen ser más jóvenes que las afectadas por tumores epiteliales y, por lo tanto, tienen todavía deseo reproductivo. ¬ El factor pronóstico que parece más importante para establecer las tasas de supervivencia es la existencia de implantes invasivos en los estadios avanzados. ¬ Parece que la quimioterapia postquirúrgica no modifica la historia natural de la enfermedad ni su pronóstico. ¬ La afectación de los ganglios retroperitoneales no es un factor de mal pronóstico respecto a la evolución. 20 ¬ Biopsias peritoneales múltiples ¬ Omentectomía infracólica ¬ Considerar linfadenectomía y apendicectomía en los mucinosos Propuesta de protocolo Pacientes con deseo de gestación • Sin implantes invasivos Se puede practicar un tratamiento conservador, incluso en estadios avanzados, salpingooforectomía unilateral con quistectomía contralateral o quistectomía bilateral con resección de los implantes peritoneales. • Con implantes invasivos Cirugía radical, histerectomía con salpingooforectomía bilateral, omentectomía infracólica, biopsias peritoneales, exéresis de los implantes peritoneales, resección de las adenomegalias. Pacientes sin deseo de gestación Cirugía radical, histerectomía con salpingooforectomía bilateral, omentectomía infracólica, biopsias peritoneales, exéresis de los implantes peritoneales, resección de las adenomegalias. QUIMIOTERAPIA Quimioterapia adyuvante estadios I y II La mayoría de pacientes con cáncer epitelial de ovario en estadios precoces recibirán quimioterapia adyuvante. De los estudios publicados, se desprende que las pacientes de bajo riesgo, estadios Ia-Ib grado I y una correcta laparotomía de estadificación, no requieren tratamiento adyuvante, ya que la supervivencia a largo plazo en estos casos es superior al 90%.3,69,70 Sin embargo, existe aún bastante discordancia respecto a estos mismos estadios IA-IB con moderado grado de diferenciación, grado II para los que no hay un claro acuerdo sobre la necesidad de tratar; por tanto, se puede recomendar observación o quimioterapia adyuvante. Para el grupo de alto riesgo: estadios IA-IB mal diferenciados, estadios IC y II o cualquier estadio con histología de células claras, el alto riesgo de recidiva (20-30%) y el resultado de algunos estudios justifican el tratamiento con quimioterapia adyuvante.3,4,71-74 Las pautas recomendadas son las mismas que se utilizan en la enfermedad avanzada, la asociación de platino (cisplatino o carboplatino) y paclitaxel. Quimioterapia en estadios avanzados El tratamiento sistémico primario recomendado para el cáncer de ovario avanzado es la asociación de paclitaxel más carboplatino (nivel de evidencia 1). Se prefiere esta combinación a la de paclitaxel-cisplatino por su menor toxicidad; sin embargo, debe considerarse como un régimen alternativo.75-80 Datos recientes permiten incluir también la asociación de carboplatino-docetaxel como una alternativa en el caso de riesgo de toxicidad a paclitaxel.81,82 El esquema de tratamiento aceptado y recomendado es carboplatino, dosis AUC de 5 a 7,5, más paclitaxel 175 mg/m2 en 3 horas. Los regímenes alternativos incluyen: cisplatino 75 mg/m2 más paclitaxel 175 mg/m2 en 3 horas o carboplatino AUC de 5 a 6 más docetaxel 75 mg/m2. El número de ciclos de quimioterapia recomendado es de seis. No hay evidencia de que más de seis ciclos, como parte del tratamiento de inducción, mejoren los resultados. Aunque un importante número de estudios no aleatorizados sugería que continuar con quimioterapia con platino como tratamiento de consolidación podía prolongar la supervivencia, ningún estudio aleatorizado ha podido confirmar este hecho.83,84 Los resultados preliminares del estudio de los grupos Southwest Oncology Group (SWOG) y Gynecologic Oncology Group (GOG), que comparaban 3 versus 12 ciclos de monoterapia con paclitaxel, administrados mensualmente en pacientes con cáncer de ovario avanzado y en remisión clínica completa, demuestran que 12 ciclos de tratamiento de consolidación mejoran significativamente el intervalo libre de progresión, pero por el momento no hay diferencias en la supervivencia global. Por todo ello, por el momento no es un tratamiento recomendado. Las pacientes en remisión clínica completa pasarán a efectuar controles de seguimiento.83 Quimioterapia intraperitoneal El papel de la quimioterapia intraperitoneal (IP) sigue siendo un tema controvertido. Sin embargo, existen estudios aleatorizados que demuestran que el tratamiento con platino IP aumenta la eficacia y disminuye la toxicidad en pacientes con cirugía optima y tumor residual < 0,5 cm. El primer estudio publicado por Aberts en 1996 85 demostraba que la combinación de cisplatino IP y ciclofosfamida IV era superior en términos de supervivencia y toxicidad a la misma combinación administrada por vía endovenosa. Estudios posteriores con paclitaxel siguen poniendo de manifiesto la superioridad de la rama de tratamiento IP en ese mismo grupo de pacientes. 86 Por todo ello y a pesar de las dificultades de la administración, la quimioterapia IP puede considerarse como una opción de tratamiento para las pacientes con cirugía óptima y mínimo tumor residual. 21 SEGUIMIENTO Seguimiento de los estadios I y II Seguimiento de los estadios III y IV Una vez completado el tratamiento quirúrgico y de quimioterapia adyuvante en los estadios de alto riesgo, el seguimiento recomendado en estas pacientes, pasan a efectuar seguimiento con marcadores tumorales Ca 12.5 y Ca 19.9 si estaba elevado de inicio y exploración física con examen pelviano. Opcionalmente se puede efectuar ECO abdomino-pelviana. En cambio, otras exploraciones, como TC abdominopelviana y /o Rx tórax, sólo se realizarán si hay indicación clínica. Las pacientes con cáncer de ovario avanzado que progresen durante el tratamiento inicial con quimioterapia deberían ser tratadas con una segunda línea de quimioterapia (tratamiento de la recidiva). Los controles se realizarán cada 4-6 meses durante los 2 primeros años, cada 6 meses los 3 años siguientes y después anualmente. En el caso de remisión clínica completa, como se ha comentado previamente, no hay evidencia de que una quimioterapia de consolidación adicional prolongue la supervivencia. Por tanto, en estos casos la recomendación es la observación mediante controles de seguimiento como en los estadios I y II. El papel de la laparotomía o laparoscopia second look sigue siendo un tema controvertido y no se recomienda como parte de tratamiento estándar del cáncer de ovario. ............................................... TRATAMIENTO DE LA RECIDIVA El tratamiento de la recidiva del cáncer epitelial de ovario y el pronóstico de la enfermedad en ese momento dependen de varios factores. Los más importantes son: la respuesta al tratamiento de quimioterapia inicial y el intervalo transcurrido desde que finalizó dicho tratamiento hasta la aparición de la recidiva. La probabilidad de respuesta a una segunda línea de tratamiento en la recidiva depende fundamentalmente de la respuesta al tratamiento inicial con platino y del intervalo libre de recidiva o progresión desde que finaliza ese tratamiento. Ambos factores determinan la potencial platino-sensibilidad que, en definitiva, es el reflejo de la quimiorresistencia o quimiosensibilidad de la enfermedad. Las pacientes que progresan durante el tratamiento o en los 6 primeros meses después de finalizado se consideran “platinorresistentes”. En este caso no se recomienda tratar con compuestos de platino ni paclitaxel dada la escasa probabilidad de respuesta (10%) a los mismos esquemas. Lo más recomendable es participar en ensayos clínicos o utilizar alguno de los diferentes agentes que han demostrado su eficacia en esta situación. Tienen una actividad similar en pacientes “platinorresistentes” el topotecan (20%), la adriamicina liposomal (26%), la gemcitabina 22 (19%), el etoposido oral (27%), la altetramina (14%) y la ifosfamida (12%).87-92 Por tanto, se puede utilizar cualquiera de estos agentes, si bien ninguno de ellos se puede considerar el de elección como tratamiento de la recidiva. Las pacientes que responden al tratamiento inicial con platino y tienen un intervalo libre de progresión superior a 6 meses tienen una mayor probabilidad de responder nuevamente al platino, considerándose “platinosensibles”. Cuanto mayor sea el intervalo mayor es la probabilidad de respuesta, así, las pacientes que tienen un intervalo ≥18 meses pueden alcanzar una tasa de respuesta de 60-80%.63 Las pacientes “platinosensibles” tienen más posibilidades de tratamiento de segunda línea. La recomendación es tratar con la misma combinación que produjo la respuesta inicial, ya que, aunque no hay una clara demostración de que la combinación sea superior a la monoterapia en esta situación, algunos estudios reportados recientemente sugieren que la combinación es superior.93 Para pacientes con un intervalo libre de progresión de ≥18 meses y las que tienen una recidiva localizada o de pequeño volumen con un intervalo como mínimo de >6 meses, debe considerarse la cirugía citorreductora secundaria.94-96 BIBLIOGRAFÍA 1. Pecorelli S, Odicino F, Maisonneuve P, Creasman W, Sheperd J, Sideri M et al. Carcinoma on the ovary. J Epidemiol Biostat. 1998;3:75-102. 2. Soper JT. Management of early-stage epithelial ovarian cancer. Clin Obstet Gynecol. 1994;37(2):423-38. 3. Young RC, Walton LA, Ellenberg SS, Homesley HD, Wilbanks GD, Decker DG et al. Adjuvant therapy in stage I and stage II epithelial ovarian cancer. Results of two prospective randomized trials. N Engl J Med. 1990;322(15):1021-7. with median survival and overall survival (measured with the log (relative risk] as main objectives. Eur J Cancer Clin Oncol. 1989;25(4):711-20. 17. Goldie JH, Coldman AJ. A mathematic model for relating the drug sensitivity of tumors to their spontaneous mutation rate. Cancer Treat Rep. 1979;63(1112):1727-33. 18. Norton L, Simon R. Tumor size, sensitivity to therapy, and design of treatment schedules. Cancer Treat Rep. 1977;61(7):1307-17. 19. Griswold DP, Jr., Schabel FM, Jr., Wilcox WS, Simpson-Herren L, Skipper HE. Success and failure in the treatment of solid tumors. I. Effects of cyclophosphamide (NSC-26271) on primary and metastatic plasmacytoma in the hamster. Cancer Chemother Rep. 1968;52(3):345-87. 20. Heintz AP, Bereck JS. Cytoreductive surgery for ovarian cancer. En: Piver MS, editor. Ovarian Malignancies: Diagnostic & Therapeutic Advances. Edinburgh: Churchill Livingstone; 1987. p.129-43. 4. Trimbos JB, Parmar M, Vergote I, Guthrie D, Bolis G, Colombo N et al. International Collaborative Ovarian Neoplasm trial 1 and Adjuvant ChemoTherapy In Ovarian Neoplasm trial: two parallel randomized phase III trials of adjuvant chemotherapy in patients with early-stage ovarian carcinoma. J Natl Cancer Inst. 2003;95(2):105-12. 5. Piver MS, Barlow JJ, Lele SB. Incidence of subclinical metastasis in stage I and II ovarian carcinoma. Obstet Gynecol. 1978;52(1):100-4. 6. Young RC, Decker DG, Wharton JT, Piver MS, Sindelar WF, Edwards BK et al. Staging laparotomy in early ovarian cancer. JAMA. 1983;250(22):3072-6. 21. Peter A, Heintz M. Surgery in ovarian cancer: the concept of cytoreductive surgery. Curr Opin Obstet Gynecol. 1996;8(1):8-11. 7. Clarke-Pearson DL, Kohler MF, Hurteau JA, Elbendary A. Surgery for advanced ovarian cancer. Clin Obstet Gynecol. 1994;37(2):439-60. 22. Meigs JV. Tumors of the female pelvic organs.New York:The Macmillan Company; 1934. 8. Hoskins WJ. Surgical staging and cytoreductive surgery of epithelial ovarian cancer. Cancer. 1993;71(4 Suppl):1534-40. 23. Munnell EW. The changing prognosis and treatment in cancer of the ovary. A report of 235 patients with primary ovarian carcinoma 1952-1961. Am J Obstet Gynecol. 1968;100(6):790-805. 9. McGowan L, Lesher LP, Norris HJ, Barnett M. Misstaging of ovarian cancer. Obstet Gynecol. 1985;65(4):568-72. 24. Griffiths CT. Surgical resection of tumor bulk in the primary treatment of ovarian carcinoma. Natl Cancer Inst Monogr. 1975;42:101-4. 10. Trimbos JB. Surgical staging; surgical guidelines and the importance of lymphadenectomy vs lymphnode sampling in early ovarian cancer. Advanced ovarian cancer: optimal therapy. Update. Valencia: International Symposium; 1999. 25. Hoskins WJ, Lawton FG. Primary cytoreductive surgery for advanced-stage disease. En: Gershenson DM, McGuire W, editors. Ovarian Cancer: Controversies in Management. Oxford, New York: Churchill Livingston; 1998. p.65-84. 11. Changes in definitions of clinical staging for carcinoma of the cervix and ovary: International Federation of Gynecology and Obstetrics. Am J Obstet Gynecol. 1987;156(1):263-4. 26. Eisenkop SM, Friedman RL, Wang HJ. Complete cytoreductive surgery is feasible and maximizes survival in patients with advanced epithelial ovarian cancer: a prospective study. Gynecol Oncol. 1998;69(2):103-8. 12. Soper JT, Johnson P, Johnson V, Berchuck A, ClarkePearson DL. Comprehensive restaging laparotomy in women with apparent early ovarian carcinoma. Obstet Gynecol. 1992;80(6):949-53. 27. Wharton JT, Herson J. Surgery for common epithelial tumors of the ovary. Cancer. 1981;48(2 Suppl): 582-9. 13. Amara DP, Nezhat C, Teng NN, Nezhat F, Nezhat C, Rosati M. Operative laparoscopy in the management of ovarian cancer. Surg Laparosc Endosc. 1996;6(1): 38-45. 28. Hacker NF, Berek JS, Lagasse LD, Nieberg RK, Elashoff RM. Primary cytoreductive surgery for epithelial ovarian cancer. Obstet Gynecol. 1983;61(4):413-20. 29. 14. Childers JM, Lang J, Surwit EA, Hatch KD. Laparoscopic surgical staging of ovarian cancer. Gynecol Oncol. 1995;59(1):25-33. Hoskins WJ. Epithelial ovarian carcinoma: principles of primary surgery. Gynecol Oncol. 1994;55(3 Pt 2): S91-S96. 30. 15. Possover M, Mader M, Zielinski J, Pietrzak K, Hettenbach A. Is laparotomy for staging early ovarian cancer an absolute necessity? J Am Assoc Gynecol Laparosc. 1995;2(3):285-8. Omura GA, Bundy BN, Berek JS, Curry S, Delgado G, Mortel R. Randomized trial of cyclophosphamide plus cisplatin with or without doxorubicin in ovarian carcinoma: a Gynecologic Oncology Group Study. J Clin Oncol. 1989;7(4):457-65. 16. Voest EE, van Houwelingen JC, Neijt JP. A meta-analysis of prognostic factors in advanced ovarian cancer 31. Hoskins WJ, Bundy BN, Thigpen JT, Omura GA. The influence of cytoreductive surgery on recurrence-free 23 interval and survival in small-volume stage III epithelial ovarian cancer: a Gynecologic Oncology Group study. Gynecol Oncol. 1992;47(2):159-66. 32. 33. Bristow RE, Tomacruz RS, Armstrong DK, Trimble EL, Montz FJ. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta-analysis. J Clin Oncol. 2002;20(5):1248-59. Delgado G, Oram DH, Petrilli ES. Stage III epithelial ovarian cancer: the role of maximal surgical reduction. Gynecol Oncol. 1984;18(3):293-8. 34. Pohl R, Dallenbach-Hellweg G, Plugge T, Czernobilsky B. Prognostic parameters in patients with advanced ovarian malignant tumors. Eur J Gynaecol Oncol. 1984;5(3):160-9. 35. Seifer DB, Kennedy AW, Webster KD, Vanderbrug MS, Isakson DG. Outcome of primary cytoreduction surgery for advanced epithelial ovarian carcinoma. Cleve Clin J Med. 1988;55(6):555-60. 36. Sutton GP, Stehman FB, Einhorn LH, Roth LM, Blessing JA, Ehrlich CE. Ten-year follow-up of patients receiving cisplatin, doxorubicin, and cyclophosphamide chemotherapy for advanced epithelial ovarian carcinoma. J Clin Oncol. 1989;7(2):223-9. 37. Conte PF, Sertoli MR, Bruzzone M, Rubagotti A, Rosso R, Bentivoglio G et al. Cisplatin, methotrexate, and 5fluorouracil combination chemotherapy for advanced ovarian cancer. Gynecol Oncol. 1985;20(3):290-7. 38. Vogl SE, Pagano M, Kaplan BH, Greenwald E, Arseneau J, Bennett B. Cis-platin based combination chemotherapy for advanced ovarian cancer. High overall response rate with curative potential only in women with small tumor burdens. Cancer. 1983;51(11):2024-30. 39. Hogberg T, Carstensen J, Simonsen E. Treatment results and prognostic factors in a population-based study of epithelial ovarian cancer. Gynecol Oncol. 1993;48(1):38-49. 40. Lund B, Williamson P. Prognostic factors for overall survival in patients with advanced ovarian carcinoma. Ann Oncol. 1991;2(4):281-7. 41. Makar AP, Baekelandt M, Trope CG, Kristensen GB. The prognostic significance of residual disease, FIGO substage, tumor histology, and grade in patients with FIGO stage III ovarian cancer. Gynecol Oncol. 1995;56(2):175-80. 42. van der Burg ME, van Lent M, Buyse M, Kobierska A, Colombo N, Favalli G et al. The effect of debulking surgery after induction chemotherapy on the prognosis in advanced epithelial ovarian cancer. Gynecological Cancer Cooperative Group of the European Organization for Research and Treatment of Cancer. N Engl J Med. 1995;332(10):629-34. 45. Sugarbaker PH. Complete parietal and visceral peritonectomy of the pelvis for advanced primary and recurrent ovarian cancer. Cancer Treat Res. 1996;81:75-87. 46. Eisenkop SM, Spirtos NM. What are the current surgical objectives, strategies, and technical capabilities of gynecologic oncologists treating advanced epithelial ovarian cancer? Gynecol Oncol. 2001;82(3):48997. 47. Sugarbaker PH. Peritonectomy procedures. Ann Surg. 1995;221(1):29-42. 48. Scarabelli C, Gallo A, Franceschi S, Campagnutta E, De G, Giorda G et al. Primary cytoreductive surgery with rectosigmoid colon resection for patients with advanced epithelial ovarian carcinoma. Cancer. 2000;88(2):389-97. 49. Gillette-Cloven N, Burger RA, Monk BJ, McMeekin DS, Vasilev S, Disaia PJ et al. Bowel resection at the time of primary cytoreduction for epithelial ovarian cancer. J Am Coll Surg. 2001;193(6):626-32. 50. Scarabelli C, Gallo A, Campagnutta E, Carbone A. Splenectomy during primary and secondary cytoreductive surgery for epithelial ovarian carcinoma. Int J Gynecol Cancer. 1998;8(3):215-21. 51. Junor EJ, Hole DJ, Gillis CR. Management of ovarian cancer: referral to a multidisciplinary team matters. Br J Cancer. 1994;70(2):363-70. 52. Eisenkop SM, Spirtos NM, Montag TW, Nalick RH, Wang HJ. The impact of subspecialty training on the management of advanced ovarian cancer. Gynecol Oncol. 1992;47(2):203-9. 53. Boente MP, Chi DS, Hoskins WJ. The role of surgery in the management of ovarian cancer: primary and interval cytoreductive surgery. Semin Oncol. 1998;25(3):326-34. 54. Vogl SE, Seltzer V, Calanog A, Moukhtar M, Camacho F, Kaplan BH et al. “Second-effort” surgical resection for bulky ovarian cancer. Cancer. 1984;54(10):22205. 55. Bertelsen K. Tumor reduction surgery and long-term survival in advanced ovarian cancer: a DACOVA study. Gynecol Oncol. 1990;38(2):203-9. 56. Morris M, Gershenson DM, Wharton JT, Copeland LJ, Edwards CL, Stringer CA. Secondary cytoreductive surgery for recurrent epithelial ovarian cancer. Gynecol Oncol. 1989;34(3):334-8. 57. Naik R, Nordin A, Cross PA, Hemming D, de Barros LA, Monaghan JM. Optimal cytoreductive surgery is an independent prognostic indicator in stage IV epithelial ovarian cancer with hepatic metastases. Gynecol Oncol. 2000;78(2):171-5. 43. Jacquet P, Vidal-Jové J, Zhu B, Sugarbaker P. Peritoneal carcinomatosis from gastrointestinal malignancy: natural history and new prospects for management. Acta Chir Belg. 1994;94(4):191-7. 58. Zylberberg B, Dormont D, Janklewicz S, Darai E, Madelenat P, Antoine JM. Cytoreductions secondaires dans le traitement des cancers de l’ovaire. Gynecol Obstet Fertil. 2000;28(2):127-36. 44. Benedetti-Panici P, Maneschi F, Scambia G, Cutillo G, Greggi S, Mancuso S. The pelvic retroperitoneal approach in the treatment of advanced ovarian carcinoma. Obstet Gynecol. 1996;87(4):532-8. 59. Zang RY, Zhang ZY, Li ZT, Cai SM, Tang MQ, Chen J et al. Impact of secondary cytoreductive surgery on survival of patients with advanced epithelial ovarian cancer. Eur J Surg Oncol. 2000;26(8):798-804. 24 60. Kikkawa F, Ino K, Nomura S, Ishikawa H, Kuzuya K, Yamamuro O et al. Prognostic factors of secondary ovarian carcinoma. Oncology. 2002;63(2):124-9. 61. Rubin SC, Benjamin I, Berek JS. Cytoreductive surgery. En: Gershenson DM, McGuire WP, editors. Ovarian Cancer: Controversies in Management. New York: Churchill Livingstone; 1998. p.101-13. 62. Kapnick SJ, Griffiths CT, Finkler NJ. Occult pleural involvement in stage III ovarian carcinoma: role of diaphragm resection. Gynecol Oncol. 1990;39(2):1358. 63. Markman M, Rothman R, Hakes T, Reichman B, Hoskins W, Rubin S et al. Second-line platinum therapy in patients with ovarian cancer previously treated with cisplatin. J Clin Oncol. 1991;9(3):389-93. 64. Prat J, De Nictolis M. Serous borderline tumors of the ovary: a long-term follow-up study of 137 cases, including 18 with a micropapillary pattern and 20 with microinvasion. Am J Surg Pathol. 2002;26(9):111128. 74. Vergote I, Trimbos JB, Guthrie D, Parmar M, Bolis G, Mangioni C et al. Results of a Randomized Trial in 923 Patients with High-Risk Early Ovarian Cancer, Comparing Adjuvant Chemotherapy with No Further Treatment Following Surgery [abstract 802]. Presentado en el Meeting Annual of the American Society of Clinical Oncology (ASCO); 2001. 75. McGuire WP, Hoskins WJ, Brady MF, Kucera PR, Partridge EE, Look KY et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer. N Engl J Med. 1996;334(1):1-6. 76. Piccart MJ, Bertelsen K, James K, Cassidy J, Mangioni C, Simonsen E et al. Randomized intergroup trial of cisplatin-paclitaxel versus cisplatin-cyclophosphamide in women with advanced epithelial ovarian cancer: three-year results. J Natl Cancer Inst. 2000;92(9):699708. 77. McGuire WP. Confirmation of the “old” standard of care for ovarian cancer and a challenge. J Natl Cancer Inst. 2000;92(9):674-5. 65. Querleu D, Papageorgiou T, Lambaudie E, Sonoda Y, Narducci F, LeBlanc E. Laparoscopic restaging of borderline ovarian tumours: results of 30 cases initially presumed as stage IA borderline ovarian tumours. BJOG. 2003;110(2):201-4. 78. Bookman MA, Greer BE, Ozols RF. Optimal therapy of advanced ovarian cancer: carboplatin and paclitaxel versus cisplatin and paclitaxel (GOG158) and an update on GOG0182-ICON5. Int J Gynecol Cancer. 2003;13 (Suppl 2):149-55. 66. Camatte S, Morice P, Pautier P, Atallah D, Duvillard P, Castaigne D. Fertility results after conservative treatment of advanced stage serous borderline tumour of the ovary. BJOG. 2002;109(4):376-80. 79. 67. Buttin BM, Herzog TJ, Powell MA, Rader JS, Mutch DG. Epithelial ovarian tumors of low malignant potential: the role of microinvasion. Obstet Gynecol. 2002;99(1):11-7. de Bois A, Lueck HJ, Meier W, Moebus V, Costa SD, Bauknecht T et al. Cisplatin/Paclitaxel Vs Carboplatin/ Paclitaxel in Ovarian Cancer: Update of an Arbeitsgemeinschaft Gynaekologische Onkologie (AGO) Study Group Trial[abstract 1374]. Presentado en el Meeting Annual of the American Society of Clinical Oncology (ASCO); 1999. 80. Neijt JP, Hansen M, Hansen SW, Sorensen PG, Sessa C, Witteveen PO et al. Randomized phase III study in previously untreated epithelial ovarian cancer FIGO stage IIB, IIC, III, IV, comparing paclitaxel-cisplatin and paclitaxel-carboplatin [abstract 1259]. Presentado en el Meeting Annual of the American Society of Clinical Oncology (ASCO); 1997. 81. Vasey PA, Atkinson R, Coleman R, Crawford M, Cruickshank M, Eggleton P et al. Docetaxel-carboplatin as first line chemotherapy for epithelial ovarian cancer. Br J Cancer. 2001;84(2):170-8. 82. Vasey PA. Survival and longer-term toxicity results of the SCOTROC study: docetaxel-carboplatin (DC) vs. paclitaxel-carboplatin (PC) in epithelial ovarian cancer (EOC) [abstract 804]. Presentado en el Meeting Annual of the American Society of Clinical Oncology (ASCO); 2004. 83. Markman M. Consolidation therapy revisited: intravenous chemotherapy. Int J Gynecol Cancer. 2003;13(Suppl 2):204-7. 84. Piccart MJ, Floquet A, Scarfone G, Willemse PH, Emerich J, Vergote I et al. Intraperitoneal cisplatin versus no further treatment: 8-year results of EORTC 55875, a randomized phase III study in ovarian cancer patients with a pathologically complete remission after platinum-based intravenous chemotherapy. Int J Gynecol Cancer. 2003;13(Suppl 2):196-203. 85. Alberts DS, Liu PY, Hannigan EV, O’Toole R, Williams SD, Young JA et al. Intraperitoneal cisplatin plus intravenous cyclophosphamide versus intravenous 68. Leake JF, Rader JS, Woodruff JD, Rosenshein NB. Retroperitoneal lymphatic involvement with epithelial ovarian tumors of low malignant potential. Gynecol Oncol. 1991;42(2):124-30. 69. Dembo AJ, Davy M, Stenwig AE, Berle EJ, Bush RS, Kjorstad K. Prognostic factors in patients with stage I epithelial ovarian cancer. Obstet Gynecol. 1990;75(2):263-73. 70. 71. Vergote I, De Brabanter J, Fyles A, Bertelsen K, Einhorn N, Sevelda P et al. Prognostic importance of degree of differentiation and cyst rupture in stage I invasive epithelial ovarian carcinoma. Lancet. 2001;357(9251):176-82. Bolis G, Colombo N, Pecorelli S, Torri V, Marsoni S, Bonazzi C et al. Adjuvant treatment for early epithelial ovarian cancer: results of two randomised clinical trials comparing cisplatin to no further treatment or chromic phosphate (32P). G.I.C.O.G.: Gruppo Interregionale Collaborativo in Ginecologia Oncologica. Ann Oncol. 1995;6(9):887-93. 72. Young RC, Brady MF, Nieberg RM, Long HJ, Mayer A, Lentz SS et al. Randomized clinical trial of adjuvant treatment of women with early (FIGO I-IIa high risk) ovarian cancer [abstract 1376]. Presentado en el Meeting Annual of the American Society of Clinical Oncology (ASCO); 1999. 73. Young RC, Pecorelli S. Management of early ovarian cancer. Semin Oncol. 1998;25(3):335-9. 25 cisplatin plus intravenous cyclophosphamide for stage III ovarian cancer. N Engl J Med. 1996;335(26):1950-5. 91. Manetta A, Tewari K, Podczaski ES. Hexamethylmelamine as a single second-line agent in ovarian cancer: follow-up report and review of the literature. Gynecol Oncol. 1997;66(1):20-6. 92. Sorensen P, Pfeiffer P, Bertelsen K. A phase 2 trial of ifosfamide/mesna as salvage therapy in patients with ovarian cancer refractory to or relapsing after prior platinum-containing chemotherapy. Gynecol Oncol. 1995;56(1):75-8. 93. ten Bokkel HW, Gore M, Carmichael J, Gordon A, Malfetano J, Hudson I et al. Topotecan versus paclitaxel for the treatment of recurrent epithelial ovarian cancer. J Clin Oncol. 1997;15(6):2183-93. González-Martín A. Is combination chemotherapy superior to single-agent chemotherapy in second-line treatment? Int J Gynecol Cancer. 2003;13(Suppl 2): 185-91. 94. Muggia FM, Hainsworth JD, Jeffers S, Miller P, Groshen S, Tan M et al. Phase II study of liposomal doxorubicin in refractory ovarian cancer: antitumor activity and toxicity modification by liposomal encapsulation. J Clin Oncol. 1997;15(3):987-93. Barrios P, Losa F, Camacho L, Fernandez-Trigo V, Mas J, Alberola M, Buqueras C. Procedimientos de peritonectomia en el tratamiento del carcinoma de ovario en los estadios III-IV. Técnica idónea para conseguir una cirugía óptima. Oncologia 23 (s1) 20-25.2000. 95. 89. Lund B, Hansen OP, Theilade K, Hansen M, Neijt JP. Phase II study of gemcitabine (2’,2’-difluorodeoxycytidine) in previously treated ovarian cancer patients. J Natl Cancer Inst. 1994;86(20):1530-3. Barrios P, Mas J, Fernandez-Trigo V, Arias JC, Gonzalez JA. Técnicas de peritonectomia en la citorreducción óptima del cancer epitelial avanzado de ovario. Perspectives in Surgery. Ed. Española. 2003. 96. 90. Hoskins PJ, Swenerton KD. Oral etoposide is active against platinum-resistant epithelial ovarian cancer. J Clin Oncol. 1994;12(1):60-3. Barrios P, Dexeus D, Camacho L, Losa F, Ramos I, Bachs E. Secondary ovarian tumors: pseudomyxoma peritonei and primary peritoneal carcinoma. CME Journal of Gynecologic Oncology 2004;9:168-188. 86. 87. 88. Markman M, Bundy BN, Alberts DS, Fowler JM, ClarkPearson DL, Carson LF et al. Phase III trial of standarddose intravenous cisplatin plus paclitaxel versus moderately high-dose carboplatin followed by intravenous paclitaxel and intraperitoneal cisplatin in small-volume stage III ovarian carcinoma: an intergroup study of the Gynecologic Oncology Group, Southwestern Oncology Group, and Eastern Cooperative Oncology Group. J Clin Oncol. 2001;19(4):1001-7. ............................................... 26 ANEXO. RECOMENDACIONES GENERALES PARA LA REDACCIÓN DE UN INFORME DE ANATOMÍA PATOLÓGICA DE CÁNCER DE OVARIO TIPO DE MUESTRA DIAGNÓSTICO 1. Medidas del tumor 7. Invasión vascular 2. Estado de la cápsula 8. Lesiones acompañantes 3. Crecimiento superficial 9. Lavado peritoneal 4. Necrosis 10. Extensión aparato genital 5. Hemorragia 11. Extensión extragenital 6. Porcentaje de tumor sólido 12. Ganglios linfáticos De manera opcional se puede incluir el pTNM en el informe. PROTOCOLO SUGERIDO. TUMORES DEL OVARIO TIPO DE MUESTRA DIAGNÓSTICO TUMORES DEL EPITELIO DE SUPERFICIE/ESTROMA SEROSOS TUMOR SEROSO BORDERLINE M84601 CISTADENOCARCINOMA SEROSO, ADENOCARCINOMA SEROSO M84603 CISTADENOCARCINOMA SEROSO PAPILAR M84603 ADENOFIBROMA, CISTADENOFIBROMA SEROSO MALIGNO_______ MUCINOSOS TUMOR MUCINOSO BORDERLINE M84711 CARCINOMA MUCINOSO INTRAEPITELIAL _______ ADENOCARCINOMA, CISTADENOCARCINOMA MUCINOSO M84703 ADENOFIBROMA CISTADENOFIBROMA MALIGNO_______ ENDOMETRIOIDES TUMOR ENDOMETRIOIDE BORDERLINE M83801 CARCINOMA ENDOMETRIOIDE M83803 ADENOCARCINOMA M81403 CON DIFERENCIACIÓN ESCAMOSA_______ ADENOFIBROMA M83810, CISTADENOFIBROMA MALIGNO M83813 SARCOMA DEL ESTROMA ENDOMETRIAL M88003 TUMOR MÜLLERIANO MIXTO MALIGNO M89503 HOMÓLOGO _______ HETERÓLOGO _______ DE CÉLULAS CLARAS M83100 TUMOR BORDERLINE_______ 27 ADENOCARCINOMA M83103 ADENOFIBROMA M83130 Y CISTADENOFIBROMA _______ DE CÉLULAS TRANSICIONALES M90000 TUMOR DE BRENNER BORDERLINE M90001 CARCINOMA DE CÉLULAS TRANSICIONALES M90003 CARCINOMA ESCAMOSO M80703 CARCINOMA INDIFERENCIADO CARCINOMA INDIFERENCIADO DE CÉLULA PEQUEÑA M80413 CARCINOMA NEUROENDOCRINO (MALIGNANT CARCINOID) M82403 TUMORES MIXTOS PROLIFERANTES, ESPECIFICAR _______ MALIGNOS, ESPECIFICAR M89403 TUMOR DE CORDONES SEXUALES, ESPECIFICAR TUMORES DE CÉLULAS GERMINALES DISGERMINOMA M90603 TUMOR DEL SENO ENDODÉRMICO, ESPECIFICAR VARIANTES M90713 CARCINOMA EMBRIONARIO M90703 CORIOCARCINOMA M91013 POLIEMBRIOMA M90723 TERATOMA, ESPECIFICAR VARIANTES (MALIGNANT TERATOMA) M90803 TUMORES MIXTOS, ESPECIFICAR TUMOR MIXTO DE CÉLULAS GERMINALES Y DE CORDONES SEXUALES M90731 MESOTELIOMA M90503 TUMOR DE PROBABLE ORIGEN WOLFFIANO _______ CARCINOMA DE CÉLULA PEQUEÑA, CON HIPERCALCEMIA M80413 CARCINOMA HEPATOIDE _______ ENFERMEDAD TROFOBLÁSTICA, ESPECIFICAR MOLA H. M91000; MOLA INVASORA: M91001 CORIOCARCINOMA: M91013 TUMOR DE TEJIDOS BLANDOS, ESPECIFICAR LINFOMA, LEUCEMIA, ESPECIFICAR TUMORES METASTÁSICOS, ESPECIFICAR MEDIDAS DEL TUMOR ________ x ________ x __________ mm LOCALIZACIÓN � OVARIO DERECHO � OVARIO IZQUIERDO ESTADO DE LA CÁPSULA � ROTA � INVADIDA � ESPONTÁNEA � NO � SÍ CRECIMIENTO SUPERFICIAL � NO 28 � SÍ � ACCIDENTAL � SOBREPASADA NECROSIS � NO � SÍ � MÍNIMA � EXTENSA HEMORRAGIA � NO � SÍ PORCENTAJE DE TUMOR � SÓLIDO ___________ � QUÍSTICO _________ � PAPILAR ________ INVASIÓN VASCULAR � NO IDENTIFICADA � PRESENTE INVASIÓN PERINEURAL � AUSENTE � PRESENTE LESIONES ACOMPAÑANTES � NO � ENDOMETRIOSIS � LUTEINIZACIÓN ESTROMAL � INCLUSIONES MÜLLERIANAS � OTRAS ESPECIFICAR ___________________________________________________ LAVADO PERITONEAL � NEGATIVO � POSITIVO EXTENSIÓN � OVARIO CONTRALATERAL � TROMPAS � CÉRVIX � VAGINA � ÚTERO � SEROSA � MIOMETRIO � ENDOMETRIO � PARAMETRIOS � TUMOR ENDOMETRIAL SINCRÓNICO EXTENSIÓN EXTRAGENITAL � PERITONEO � NO IMPLANTES � SUPERFICIALES � EPIPLÓN � NO IMPLANTES � SUPERFICIALES � SÍ � INVASIVOS � INVASIVOS � SÍ � APÉNDICE � METÁSTASIS � OTROS, ESPECIFICAR ___________________________________________________ 29 GANGLIOS LINFÁTICOS ESPECIFICAR CADENA, LADO, NÚMERO DE GANGLIOS TOTALES Y NÚMERO DE GANGLIOS METASTÁSICOS. ESPECIFICAR DIÁMETRO MÁXIMO DEL MAYOR DE ELLOS EN CADA CADENA ESTADIFICACIÓN DE LA FIGO. CORRELACIÓN CON TNM FIGO TNM I CRECIMIENTO LIMITADO A LOS OVARIOS IA CRECIMIENTO LIMITADO A UN OVARIO. NO ASCITIS NEOPLÁSTICA. CÁPSULA INTACTA. NO CRECIMIENTO SUPERFICIAL IB IC T1 T1a CRECIMIENTO LIMITADO A AMBOS OVARIOS. NO ASCITIS NEOPLÁSTICA. CÁPSULA INTACTA. NO CRECIMIENTO SUPERFICIAL IA O IB CON T1b - TUMOR EN LA SUPERFICIE DE UNO O CON OVARIOS, O - ROTURA DE LA CÁPSULA, O - ASCITIS MALIGNA, O - LAVADOS PERITONEALES POSITIVOS T1c II CRECIMIENTO QUE AFECTA A UNO O AMBOS OVARIOS, CON EXTENSIÓN PELVIANA T2 IIA EXTENSIÓN O METÁSTASIS AL ÚTERO O A LAS TROMPAS T2a IIB EXTENSIÓN A OTROS TEJIDOS PELVIANOS T2b IIC IIA O IIB CON: III - TUMOR EN LA SUPERFICIE DE UNO O AMBOS OVARIOS, O - ROTURA DE LA CÁPSULA, O - ASCITIS MALIGNA, O - LAVADOS PERITONEALES POSITIVOS AFECTACIÓN DE UNO O AMBOS OVARIOS, CON IMPLANTES PERITONEALES EXTRAPELVIANOS (INCLUYE SEROSA DE INTESTINO DELGADO O EPIPLÓN) CONFIRMADOS HISTOLÓGICAMENTE I/O GANGLIOS RETROPERITONEALES O INGUINALES POSITIVOS. LAS METÁSTASIS A CÁPSULA HEPÁTICA SUPERFICIALES. CORRESPONDEN AL ESTADIO III T3 y/o N1 IIIA TUMOR MACROSCÓPICAMENTE LIMITADO A PELVIS VERDADERA CON GANGLIOS NEGATIVOS PERO CON AFECTACIÓN DE SUPERFICIE PERITONEAL HISTOLÓGICAMENTE CONFIRMADA, O AFECTACIÓN DE MESENTERIO O DE INTESTINO DELGADO HISTOLÓGICAMENTE CONFIRMADA IIIB TUMOR QUE AFECTA A UNO O AMBOS OVARIOS CON IMPLANTES HISTOLÓGICAMENTE CONFIRMADOS, A SUPERFICIE PERITONEAL, NO MÁS GRANDES DE 2 CM GANGLIOS LINFÁTICOS NEGATIVOS IIIC METÁSTASIS PERITONEALES MAYORES DE 2 CM DE DIÁMETRO Y/O GANGLIOS LINFÁTICOS RETROPERITONEALES POSITIVOS IV 30 T2c METÁSTASIS A DISTANCIA (AFECTACIÓN PLEURAL, METÁSTASIS HEPÁTICAS, POR EJEMPLO) T3a T3b T3c y/o N1 M1 AGRUPACIÓN DE ESTADIOS FIGO T N M IA T1a N0 M0 IB T1b N0 M0 IC T1c N0 M0 IIA T2a N0 M0 IIB T2b N0 M0 IIC T2c N0 M0 IIIA T3a N0 M0 IIIB T3b N0 M0 IIIC T3c N0 M0 Cualquier T N1 M0 Cualquier T Cualquier N M1 IV 31 El Programa OncoGuías ha sido posible también gracias a la colaboración de las siguientes compañías: Amgen Oncology AstraZeneca Oncology Aventis Oncology Bristol Myers Squibb, S.L. Laboratoris Dr. Esteve, S.A. Lilly Merck Farma y Química, S.A. Pfizer Productos Roche Oncology Sanofi - Synthelabo