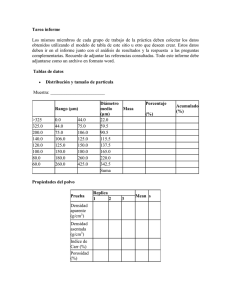
“Determinación de la contaminación por plaguicidas en agua, suelo
Anuncio

PROYECTO UCA FIAES “Determinación de la contaminación por plaguicidas en agua, suelo, sedimentos y camarones en los Cantones Salinas del Potrero y Sisiguayo de la Bahía de Jiquilisco” INFORME FINAL ABRIL 2007- DICIEMBRE 2008 1 Índice Presentación ........................................................................................................... 5 1. Definición del problema.................................................................................. 10 2. Delimitación del Problema.............................................................................. 15 3. 4. 2.1 Delimitación Geográfica .......................................................................... 15 2.2 Delimitación de contaminantes a analizar............................................... 16 Objetivos de la Investigación.......................................................................... 23 3.1 Objetivo General ..................................................................................... 23 3.2 Objetivos Específicos.............................................................................. 23 Metodología ................................................................................................... 24 4.1 Revisión Bibliográfica.............................................................................. 24 4.2 Trabajo de Campo .................................................................................. 24 4.3 Trabajo Experimental .............................................................................. 27 4.3.1 Montaje de Laboratorio ......................................................................... 27 4.3.2 Análisis.................................................................................................. 28 4.3.3 Control de calidad ................................................................................. 30 5. Resultados ..................................................................................................... 31 5.1 Plan de muestreo .................................................................................... 31 5.2 Medición de parámetros en puntos de muestreo .................................... 34 5.3 Trabajo Experimental .............................................................................. 39 5.3.1 Tiempos de retención............................................................................ 39 5.3.2 Curvas de Calibración ........................................................................... 40 5.3.3 Marchas analíticas ................................................................................ 43 5.4 Resultado de análisis de pesticidas ........................................................ 54 5.5 Análisis de Resultados............................................................................ 67 6. Conclusiones.................................................................................................. 72 7. Recomendaciones ......................................................................................... 74 Bibliografía ............................................................................................................ 76 2 Índice de tablas Tabla 1 Resultados de las encuestas sobre pesticidas utilizados por la comunidad ......... 17 Tabla 2 Plaguicidas utilizados en el cultivo de caña de azúcar (consulta a experto)......... 18 Tabla 3. Pesticidas organofosforados utilizados en el cultivo de caña de azúcar y en las comunidades para sus labores agrícolas ............................................................................ 19 Tabla 4. Pesticidas organoclorados utilizados históricamente............................................ 22 Tabla 5. Pesticidas seleccionados para el estudio.............................................................. 22 Tabla 6 Manejo y Preservación de muestras compuestos orgánicos semi-volátiles.......... 26 Tabla 7. Plan de muestro ..................................................................................................... 32 Tabla 8 Parámetros medidos en puntos de muestreo de agua en época seca ................. 34 Tabla 9 Parámetros medidos en puntos de muestreo de agua en época lluviosa ............. 36 Tabla 10 Parámetros medidos en puntos de muestreo de sedimentos en época seca..... 37 Tabla 11 Parámetros medidos en puntos de muestreo de sedimentos en época lluviosa 38 Tabla 12. Tiempo promedio de pesticidas organoclorados................................................. 39 Tabla 13. Tiempos de retención promedio de pesticidas fosforados.................................. 40 Tabla 14. Resultados de curvas de calibración estandar interno para pesticidas organoclorados y organofosforados .................................................................................... 41 Tabla 15. Resultados de curvas de calibración estándar externo para pesticidas organoclorados y organofosforados .................................................................................... 42 Tabla 16 Resultados relevantes de la validación ................................................................ 43 Tabla 17 Porcentajes de recuperación de extracción de sedimentos con diferentes lavados.................................................................................................................................. 45 Tabla 18. Porcentajes de recuperación para análisis de organoclorados en camarones .. 53 Tabla 19. Resultados de análisis de pesticidas organoclorados y organofosforados en muestreo I y II de aguas, concentración en ppb.................................................................. 55 Tabla 20 Resultados de análisis de pesticidas organoclorados y organofosforados en muestreo I y II de sedimentos, concentración en ppb ......................................................... 59 Tabla 21 Resultados de análisis de pesticidas organoclorados y organofosforados en muestreo de sedimentos y suelo dentro de los estanques de cultivo de camarón (Penaeus sp), concentración en ppb .................................................................................................... 61 Tabla 22 Resultados de análisis de pesticidas organoclorados y organofosforados en de camarones, concentración en ppb ....................................................................................... 63 3 Índice de figuras Figura 1. Ocho Zonas dedicadas al Cultivo de camarón en la Bahía de Jiquilisco 12 Figura 2. Sitios seleccionados para realizar la investigación ................................ 15 Figura 3. Estanques seleccionados para llevar a cabo la investigación................ 16 Figura 4. Ubicación de Cultivos de Algodón y Caña de Azúcar en el período 20052006 en el departamento de Usulután (Fuente MAG)........................................... 18 Figura 5. Mapa de áreas epidemiológicas de Malaria y cultivo de algodón en los años 70 (mapa elaborado en el Laboratorio de SIG de la UCA con información de Rodríguez, M., 2001)............................................................................................. 20 Figura 6. Mapa de puntos de muestreo................................................................. 31 Figura 7. Cromatograma de extracción con 3 lavados .......................................... 45 Figura 8 Columnas de limpieza rellenas con gel SEPHADEX .............................. 48 Figura 9 Cromatograma muestreo II, punto 12...................................................... 49 Figura 10 Cromatograma muestro III, punto 10..................................................... 49 Figura 11 Muestra de sedimento sometida a limpieza con Florisil ........................ 50 Figura 12. Cromatograma de análisis de camarones luego de pasar por la columna de limpieza ............................................................................................................ 52 Figura 13. Extracción de camarón (Peaneus sp) sin caparazón y utilizando solvente Acetona:Hexano 1:1................................................................................ 52 Figura 14. Camarones silvestres muestreados en un brazo de la Bahía de Jiquilisco................................................................................................................ 53 Figura 15 Resultados relevantes muestreo de Agua época lluviosa ..................... 64 Figura 16 Resultados relevantes muestreo sedimentos época seca .................... 65 Figura 17 Resultados relevantes muestreo sedimentos época lluviosa ................ 66 Figura 18 Estaciones de muestreo, Bahía de Jiquilisco (Pachecho, 1995)........... 68 Figura 19 Evolución de concentración de pesticidas en punto de muestreo 5...... 68 Figura 20 Evolución de concentración de pesticidas en punto de muestreo 5...... 69 4 Presentación En este documento se presentan los resultados del proyecto UCA-FIAES “Determinación de la contaminación por plaguicidas en agua, suelo, sedimentos y camarones en los Cantones Salinas del Potrero y Sisiguayo de la Bahía de Jiquilisco” ejecutado entre abril de 2007 y Diciembre de 2008. El objetivo principal del proyecto fue la determinación de los niveles actuales de contaminación por pesticidas en una zona de cultivo de camarón (Penaeus vannamei) en la Bahía de Jiquilisco. La motivación a desarrollar este trabajo estaba dirigida a investigar sobre posibles causas que afectan a las especies de la bahía de Jiquilisco, particularmente a las de interés comercial como el camarón (Penaeus sp). Además generar información actualizada que pudiese ser utilizada en futuras investigaciones y que sirva de base sólida para toma de decisiones en la regulación del uso de pesticidas a lo largo de la cuenca de los ríos, para reducir su efecto en el ecosistema estuarino. El proyecto contempló como primera actividad fundamental el montaje y adecuación de un laboratorio, en la Universidad Centroamericana “José Simeón Cañas”, para el análisis de pesticidas organoclorados y organofosforados en diferentes matrices. En el país existen pocos laboratorios con la capacidad para analizar este tipo de sustancias por lo que el laboratorio, además de ser la herramienta fundamental para la ejecución de los objetivos del proyecto, es importante también para aumentar la capacidad investigativa de la universidad, lo cual traerá beneficios al país. En abril 2007 inició el proceso para el montaje del laboratorio que recibió el nombre de Laboratorio de Calidad Ambiental, con una capacitación sobre la técnica cromatográfica impartida por un experto en el área y con la cotización y compra del mobiliario, equipos y reactivos necesarios para la implementación de 5 los análisis. El laboratorio terminó su montaje en noviembre del 2007 quedando totalmente equipado para la extracción, concentración y detección de muestras. Por otra parte, para seleccionar los contaminantes a ser analizados se realizó un estudio de los pesticidas utilizados en la zona, tanto actualmente como históricamente, para lo que se diseñó una encuesta (Anexo 1), se levantó la información en campo y luego se realizó la tabulación y análisis de los datos. Dicho estudio identificó las familias de agroquímicos y las cantidades que las personas de las comunidades de San Hilario y Sisiguayo utilizan en sus actividades agrícolas, el detalle de los resultados de dicho estudio se presenta en la sección 2.2. Para esta selección también se tomó en cuenta que en la parte norte de la Bahía existen extensas plantaciones, principalmente de caña de azúcar, donde también se utilizan grandes cantidades de estas sustancias y además que en la Bahía de Jiquilisco históricamente se utilizaron muchos pesticidas organoclorados en el cultivo de algodón y el combate de la Malaria. En base a lo anterior los pesticidas seleccionados para ser analizados fueron los siguientes: • Lindano, Isómero gamma del Hexaclorociclohexano (γ-HCH) • 4,4´DDT, Diclorodifeniltricloroetano • 4,4´DDE, Diclorodifenildicloroetileno • 4,4´DDD, Diclorodifenildicloroetano • Endrin, 1,2,3,4,10,10-hexacloro-6,7-epoxi-1,4,4A,5,6,7,8,8A-octahidro1, 4, 5,8-dimetanonaftaleno • Heptacloro, 1,4,5,6,7,8,8-Heptacloro-3a,4,7,7a-tetrahidro-4,7metanoindeno • Paratión, p-Nitrofeniltiofosfato de o, o-dietilo • Metil Paratión, o,o-dimetil o-4-nitrofenil fosforotioato • Etroprofos, o-etil S,S-dipropil fosforoditioato Posteriormente se diseñó un plan de muestreo, en donde se detalló el número de muestras a tomar de cada matriz y los puntos en que dichas muestras serían recolectadas. Los mapas de muestreo se elaboraron con el apoyo del Laboratorio 6 de Sistema de Información Geográfica de la UCA y posteriormente fueron validados con los miembros de la comunidad. El detalle de dicho plan de muestreo se incluye en la sección 5.1. Una vez seleccionados los puntos de muestreo se redactaron protocolos basándose en una revisión bibliográfica, definiéndose los tipos de recipientes a utilizar, el tipo de muestra a obtener, el equipo, el procedimiento a seguir y las formas de preservación de las muestras antes de su ingreso al laboratorio. Los protocolos se muestran en el Anexo 2 de este informe. Los resultados del estudio de uso de pesticidas en la zona y el plan de muestreo fueron presentados y discutidos en una reunión con personal del FIAES, personal técnico del Ministerio de Medio Ambiente y Recursos Naturales (MARN) y con representantes de algunos actores locales como: Asociación MANGLE y Movimiento Salvadoreño de Mujeres (MSM). Los participantes hicieron observaciones que fueron tomadas en cuenta para la ejecución del muestreo. Una vez montado el laboratorio se inició con la optimización de los métodos de análisis. Para ello en primer lugar, se realizaron ensayos para determinar los tiempos de retención de los plaguicidas organoclorados y organofosforados con el fin de evaluar si los pesticidas eran detectados por el equipo y además evaluar si cada uno se identifica en un tiempo diferente, para esto se prepararon soluciones con patrones de cada pesticida y se inyectaron al cromatógrafo 5 veces, se verificó que todos los pesticidas daban señal y que cada uno se identificaba en un tiempo diferente. Una vez verificado lo anterior se realizaron curvas de calibración para cada pesticida, para lo cual se prepararon mezclas de todos los pesticidas, a 5 niveles de concentración utilizando estándares certificados, las cuales se inyectaron al cromatógrafo para evaluar la intensidad de la respuesta. Para cada curva se hizo la evaluación de la linealidad, todas ellas presentaron coeficiente de correlación Pearson (r2) mayor de 0.98, el resultado de las curvas de calibración se muestra en Anexo 10. 7 Posteriormente se llevó a cabo la validación del método de determinación de pesticidas organoclorados y organofosforados en aguas para evaluar si las condiciones del análisis eran adecuadas, se determinaron los niveles de recuperación y los límites de detección y cuantificación para cada pesticida. Para lograr lo anterior se prepararon muestras y blancos fortificados con las mezclas de pesticidas a analizar, los cuales se sometieron a todo el proceso de análisis. La recuperación para los pesticidas organoclorados se mantiene en el intervalo 6085%. Para los pesticidas organofosforados los resultados fueron los siguientes: para los pesticidas phoxim, metamidofos y terbufos, no se obtuvo respuesta de área, posiblemente porque el límite de detección del equipo es muy alto. En cuanto al etroprofos, metil paratión y paratión sí se obtuvieron respuestas y los porcentajes de recuperación se encuentran dentro del intervalo 70%-125%. Adicionalmente se definieron los límites de detección (LD) y de cuantificación (LCM) para los organoclorados y organofosforados. El detalle de todos los cálculos y resultados de la validación se muestran en el Anexo 10. El primer muestreo inició en diciembre de 2007 y finalizó en marzo 2008 cubriendo el muestreo en época seca. Se tomaron muestras de agua, sedimentos y se realizaron las extracciones y la detección de todas ellas. Los resultados de aguas se cuantificaron y se presentan en la sección 5.4. Sin embargo en los cromatogramas correspondientes al análisis de sedimentos se observaron interferencias que impedían la cuantificación. Debido a esto se modificó la marcha de sedimentos para eliminar dichas interferencias, determinando que es necesario hacer pasar los extractos por una columna de limpieza y realizar la cuantificación por la técnica de estándar externo, todas las pruebas realizadas para eliminar dichas interferencias se presentan en la sección 5.3.3, los resultados de los análisis de sedimentos se muestran en la sección 5.4. El segundo muestreo se realizó entre junio y agosto de 2008, recolectándose muestras de agua, sedimento y suelo para luego extraerlas y concentrarlas. Los resultados se presentan en la sección 5.4. 8 Finalmente las muestras de camarón (Penaeus sp.) se recolectaron en el mes de octubre de 2008 cuando estos habían alcanzado la talla comercial en los estanques seleccionados, los resultados del análisis de esta matriz se muestra en la sección 5.4. 9 1. Definición del problema El estuario de la Bahía de Jiquilisco es el primero en importancia en El Salvador dada su extensión, su intensa actividad pesquera y por ser un área de desarrollo de estadios larvarios y juveniles de numerosas especies. Por otra parte, es el área con mayor extensión de bosque salado, entre 14,267 ha. y 22,912 ha. cuya especie dominante es el mangle rojo. El complejo incluye las áreas protegidas de bosque aluvial costero: Normandía, Chaguantique y el Tercio, así como la punta San Juan del Gozo (MARN 2003). En la Bahía de Jiquilisco drenan tres cuencas hidrográficas: la del río Lempa, la comprendida entre el río Lempa y el Grande de San Miguel y la del río Grande de San Miguel. Los ríos de dichas cuencas contienen contaminación por vertidos de aguas negras domésticas y por vertidos de las diferentes actividades industriales y agrícolas. En la zona nor-occidental de la bahía existe una actividad agrícola enfocada en el cultivo de maíz, arroz, frijoles, maicillo, ajonjolí, musáceas, algodón y caña de azúcar. Actualmente, esta última actividad agrícola es la que en mayor medida utiliza fertilizantes y pesticidas que eventualmente se trasladan a las aguas costeras a través de los ríos. Por otra parte, según López, citado por Pacheco (1995), en la década de los 70 en el departamento de Usulután se sembraron cerca de 30,000 hectáreas de algodón, algunas de estas plantaciones se ubicaron en la parte nor occidental de la Bahía de Jiquilisco, aunque para el año de 1992 las hectáreas cultivadas de algodón se habían reducido a 1400. El cultivo del algodón se ha caracterizado por el uso intensivo de agroquímicos para el control de plagas. Muchos de estos plaguicidas son compuestos organoclorados altamente tóxicos y de lento proceso de descomposición en el 10 medio natural, tales como Aldrín, Endrín, Dieldrín, DDT y otros similares. Estudios realizados por López (1975-1976) detectaron la presencia de residuos de plaguicidas organoclorados y organofosforados en 5 sitios de la Bahía de Jiquilisco, así como residuos en peces, moluscos, crustáceos y equinodermos. Rubio et al. (1984) reporta además la presencia de Metil Paratión, Etil Paratión y Lindano en Jiquilisco. Por su parte, Pacheco (1995) realizó análisis en 5 sitios de muestreo de la Bahía de Jiquilisco en agua, sedimento y especies pesqueras e hizo una comparación con los datos de López (1976), encontrando una reducción en aguas estearinas en las concentraciones de DDT, Metil paratión y Endrín y un aumento en las concentraciones de Dieldrín; en el caso de los sedimentos se observó un aumento de Dieldrín y Endrin entre 1976 y 1995 en algunas de las estaciones de monitoreo en la época lluviosa y una reducción en la época seca, se observaron disminuciones en esta matriz de DDT y Metil Paratión en todas las estaciones de monitoreo tanto en época seca como en época lluviosa. Se observó además que las concentraciones más altas en sedimento se encontraron en las estaciones más alejadas de la bocana. Se observó un incremento en la concentración de Dieldrín y Endrín en camarón (Penaeus sp) y curiles aunque una reducción de DDT en los mismos. Los valores encontrados de pesticida no sobrepasaron los niveles reportados en dicho estudio como permisibles para la vida acuática. Adicionalmente, el documento “Línea Base de las Condiciones Biofísicas y Socioeconómicas del área de Conservación Jiquilisco-Jaltepeque” manifiesta que el ecosistema estuarino de la Bahía de Jiquilisco presenta una considerable contaminación antropogénica debido a cultivos agrícolas en tierras aledañas al estero y que los residuos detectados sobrepasan los límites establecidos para solubilidad en aguas y toxicidad, por lo tanto constituyen un peligro potencial para la fauna y la flora marina. Además se sugiere que esto podría ser una de las causas de la extinción y degeneración de especies marinas, como la disminución de tamaño de conchas (Anadara sp.) y la falta de engrosamiento de la cutícula del camarón (Penaeus sp.). 11 Por otra parte, el cultivo del camarón marino (Penaeus vannamei y P. stylirostris) en El Salvador, se concentra principalmente en la zona del margen oriental del bajo Lempa y de la Bahía de Jiquilisco, estimándose que en 1995 se dedicaban entre 580 y 780 has. permanente o temporalmente al cultivo. La mayoría de esa extensión (≈ 97%) corresponde a salineras reconvertidas al cultivo del camarón (Penaeus sp), incluidas en el programa CEE-GOES ALA 92/18 dirigido a la reintegración de ex-combatientes de la guerra civil (Hernández et al, 2005). En la Figura 1 se muestran las ocho zonas o sectores dedicados al cultivo de camarón marino en esta región. En la jurisdicción de Jiquilisco se ubican cuatro zonas: La Canoa-Las Mesitas; Salinas de Sisiguayo, El Zompopero y El PotreroCuche de Monte, mientras que en la jurisdicción de Puerto El Triunfo: El Jobal en la Isla El Espíritu Santo y Salinas El Mapachín (Hacienda. La Carrera) y en la jurisdicción de San Dionisio: Puerto Parada y Puerto El Flor. Finalmente se incluyen los núcleos de La Ringlera e Isla Arco del Espino, en la jurisdicción de Jucuarán. En esas ocho zonas existen 33 núcleos productores de camarón (Penaeus sp), de los que 28 pertenecen a asociaciones cooperativas y cinco son de propietarios individuales (Hernández et al, 2005). Figura 1. Ocho Zonas dedicadas al Cultivo de camarón en la Bahía de Jiquilisco (Adaptado de Hernández et al, 2005) 12 La Asociación de Desarrollo Campesino, ASDEC, que agrupa a cooperativas del área, declara problemas en el crecimiento de especies de camarón (Penaeus sp) en sus lagunas de crianza. Una de las áreas donde se ha observado este problema es el cantón Salinas el Potrero, donde está ubicado el núcleo camaronero El Zompopero y donde habitan aproximadamente 500 familias que subsisten del cultivo del camarón. Los suelos aledaños a dichos estanques, que actualmente son utilizados para cultivos de granos básicos, fueron utilizados anteriormente para el cultivo intensivo de algodón, por lo que podrían estar aún contaminados con residuos de plaguicidas, y probablemente continúan contribuyendo a la contaminación de la Bahía. De igual forma, la Asociación Movimiento Salvadoreño de Mujeres, MSM, manifiesta la misma problemática de crecimiento en un estanque de cultivo de camarón manejado sólo por mujeres (“Estanque de las mujeres”) ubicado en la Cooperativa 31 de Diciembre del cantón Salinas de Sisiguayo, donde esta asociación brinda apoyo. Los niveles actuales de contaminación en los suelos, el agua y los sedimentos de la Bahía de Jiquilisco se desconocen, los últimos datos reportados datan de 1995, haciendo notar que el monitoreo de los niveles de contaminación en la Bahía es importante porque en ella desembocan muchos ríos que a su paso arrastran pesticidas que pueden afectar el medio natural de las especies y el desarrollo del cultivo en los estanques camaroneros. Por otro lado, también se desconoce si estos contaminantes siguen bioacumulándose en especies marinas, afectando el desarrollo normal de éstas e ingresando de esta forma a la cadena alimenticia del ser humano. El presente trabajo pretende establecer los niveles actuales de contaminación de 10 plaguicidas en suelo, sedimento, agua y camarones de 3 estanques de crianza; y en suelo y agua circundante a éstos, en la Bahía de Jiquilisco. La motivación a desarrollar este trabajo está dirigida a investigar sobre posibles causas que afectan a las especies de la bahía de Jiquilisco, en este caso el 13 camarón (Penaeus sp), no se pretende en ningún momento dar una respuesta directa al problema del crecimiento de éste; sino, generar información actualizada que pueda ser utilizada para investigaciones más concretas encaminadas a resolver este tipo de problemas. Por otro lado, también se pretende generar registros que contribuyan a las decisiones respecto a las acciones a seguir para regular el uso de pesticidas a lo largo de la cuenca de los ríos, para reducir su efecto en el ecosistema estuarino. 14 2. Delimitación del Problema 2.1 Delimitación Geográfica Para la realización del estudio se ha seleccionado trabajar en las áreas circundantes a dos estanques donde se han detectado problemas con las especies y uno donde no se han manifestado dificultades en el crecimiento. La Figura 2 muestra la ubicación de los núcleos camaroneros seleccionados y la Figura 3 muestra los estanques seleccionados: Estanque Los Mancornados (Cantón Salinas Sisiguayo), el estanque manejado por mujeres de la cooperativa 31 de Diciembre (Cantón Salinas Sisiguayo) y La Carranza (Cantón Salinas el Potrero). Sin embargo en el momento de iniciar el muestreo el estanque La Carranza no estaba en cultivo por lo que se tomó la decisión de monitorear el estanque contiguo El Torno que presenta similares características de manejo y eficiencia al seleccionado originalmente. Figura 2. Sitios seleccionados para realizar la investigación 15 Figura 3. Estanques seleccionados para llevar a cabo la investigación 2.2 Delimitación de contaminantes a analizar Con el fin de seleccionar los plaguicidas que se analizarán como posibles contaminantes del suelo, agua, sedimentos y camarones de los cantones Salinas El Potrero y Salinas de Sisiguayo se realizó una encuesta a personas de las comunidades de San Hilario y Sisiguayo para conocer sus hábitos de uso y manejo de plaguicidas. El cuestionario utilizado en la encuesta, incluidos en el Anexo 1, constaba de 4 partes: una primera sobre datos generales del encuestado, la segunda sobre información referente a las formas de seleccionar y, comprar plaguicidas, así como sobre los tipos de plaguicidas utilizados en la zona, la tercera orientada a comprender cuales son las prácticas en el uso y manejo de los agroquímicos y la última parte para definir a las personas que están 16 involucradas en el trabajo con plaguicidas. El resultado de la encuesta se muestra en forma resumida en la Tabla 1. Tabla 1 Resultados de las encuestas sobre pesticidas utilizados por la comunidad Pesticidas Utilizados Nombre genérico Componente Gramoxone Paraquat Derivado bipiridilo Folidol metil-paratión Organofosforado Marshal carbosulfan Carbamato Ranger Glifosato Aminoácidos fosforados Paraquat Paraquat Derivado del bipiridilo Hedonal 2,4 D Derivado fenoxiacético Batalla Glifosato Aminoácidos fosforados Gesaprim Atrazina Triazina Root Out Amino ácidos fosforados Semevin Thiodicarb Carbamato Camarón Methamidophos Organofosforado Glufosinato de Basta amonio Volaton Phoxim Karate Lannate Organofosforado Cihalotrina labmda Methomyl Carbamato En cuanto a la extensión de las tierras cultivadas por los miembros de las comunidades se pudo constatar que su extensión comparada con las parcelas agroindustriales ubicadas al norte de la bahía, es relativamente pequeña como se muestra en la Figura 4. Aunque por lo anterior, la cantidad de agroquímicos utilizados por los miembros de la comunidad en comparación con las cantidades utilizadas en dichas parcelas puede considerarse pequeña, por su cercanía a los estanques de cultivo, se tomaron en cuenta tanto los agroquímicos utilizados por 17 la comunidad como los agroquímicos utilizados por las plantaciones agroindustriales principalmente caña de azúcar que se muestran en la Tabla 2. Figura 4. Ubicación de Cultivos de Algodón y Caña de Azúcar en el período 2005-2006 en el departamento de Usulután (Fuente MAG) Tabla 2 Plaguicidas utilizados en el cultivo de caña de azúcar (consulta a experto) Nombre genérico Componente Terbutrina Triazina Diuron Derivado de la Urea Ametrina Triazina Glifosato Derivado del ácido fosfónico Glufosinato de Amonio Derivado del ácido fosfónico Terbufos Organofosforado Etroprofos Organofosforado Carbofurano Carbamato Para seleccionar entre los pesticidas utilizados, el primer filtro utilizado fue la técnica de detección, únicamente los organofosforados tienen posibilidad de ser detectados por cromatografía gaseosa por detector de captura de electrones por lo 18 tanto se seleccionaron los pesticidas mostrados en la Tabla 3, por ser detectables a la técnica analítica disponible en le laboratorio. Tabla 3. Pesticidas organofosforados utilizados en el cultivo de caña de azúcar y en las comunidades para sus labores agrícolas Pesticidas Organofosforados Nombre-genérico Tipo de Componente Parcelas en Comunidades Folidol Metil paratión Ranger Batalla Organofosforado Aminoácidos fosforados Glifosato Root Out Aminoácidos fosforados Aminoácidos fosforados Tamaron Methamidophos Organofosforado Volaron Phoxim Organofosforado Plantaciones de caña de azúcar Terbufos 10 GR Terbufos Organofosforado Counter 10 G Terbufos Organofosforado Mocap 10 GR Etroprofos Organofosforado Roundup 35.6 SL Glifosato Aminoácido fosforado Entre los mostrados en la Tabla 3, se seleccionaron para monitorear la presencia de contaminación por plaguicidas, los siguientes: - Terbufos - Metil Paratión - Etroprofos Sin embargo al desarrollar las marchas analíticas y evaluar las recuperaciones para cada pesticida el límite de detección del Terbufos fue demasiado alto, por lo que no se podrán reportar resultados dadas las bajas concentraciones que se esperan encontrar en muestras ambientales. Debido a ello se reportará en su lugar resultados de Paratión para el cual el límite de detección es bajo. Además de las fuentes de contaminación actual, el área de la Bahía de Jiquilisco ha sido contaminada con pesticidas persistentes utilizados en el pasado. Entre los 19 cultivos que históricamente han marcado el uso de plaguicidas clorados está el cultivo del algodón. Este cultivo tiene una alta incidencia de plagas por lo que el uso de plaguicidas fue incrementándose cada año siendo los años 1964/1965 cuando se logra la máxima área de siembra de algodón, (86,001 hectáreas), y se adoptó el uso intensivo de maquinaría y agroquímicos. Entre los plaguicidas más utilizados en las décadas de los 60 y 70 se encuentran compuestos organoclorados tales como: BHC (Lindano), DDT (Diclorodifeniltricloroetano), Toxafeno, Dieldrín, Aldrín, Endrín, Heptacloro y Endosulfan. Todos ellos son compuestos muy persistentes es decir que su vida media en el medio ambiente es muy alta. Además del uso de compuestos clorado para el control de plagas, también hubo uso de estos compuestos para el control de enfermedades como la Malaria. Antes de 1950 esta enfermedad estaba considerada como la principal causa de morbilidad en El Salvador, siendo en 1931 la tasa de morbilidad de 270 personas por 10,000 habitantes, mientras que en 1981 dicha tasa ya se había reducido a 1.8 y actualmente la malaria ya no es causa de morbilidad. Figura 5. Mapa de áreas epidemiológicas de Malaria y cultivo de algodón en los años 70 (mapa elaborado en el Laboratorio de SIG de la UCA con información de Rodríguez, M., 2001) 20 La Gerencia de Atención Integral de la Salud Ambiental del Ministerio de Salud Pública y Asistencia Social (MSPAS), en el documento “ Diagnóstico situacional de DDT en los programas de control de vectores en El Salvador” reporta que a pesar de que no existen registros donde se especifique que cantidad de DDT fue utilizado, se estima que desde 1946-1959 se utilizaron 1,690,000 Kg. de DDT, y en base a la información de fichas técnicas del MSPAS, desde 1960-1973 reporta que se rociaron 5,161,260 casas con 2,580,630 Kg. de DDT, habiendo un total de 1,316,486 personas expuestas por año. En la Figura 5 muestra el mapa de la zona hiperendémica, la más afectada por la enfermedad y por lo tanto la más expuesta a rocío de DDT, esta zona se ubica como muestra la figura, en la zona costera e incluye el territorio de la Bahía de Jiquilisco en Usulután. Adicionalmente, desde los años 70 diversas instituciones han realizado estudios en El Salvador que demuestran la presencia de pesticidas clorados en productos lácteos, hortalizas, suelos, aguas subterráneas y superficiales. Entre estos pesticidas utilizados históricamente se encuentran los que se muestran en la Tabla 4. El DDE (Diclorodifenildicloroetileno) y el DDD (Diclorodifenildicloroetano) son compuestos de degradación del DDT. Por ejemplo en suelo el DDT se degrada a estos metabolitos por la acción de microorganismos. Es importante incluirlos en sitios donde ha habido contaminación por DDT, ya que son compuestos de degradación del mismo y son tóxicos. 21 Tabla 4. Pesticidas organoclorados utilizados históricamente Nombre genérico Componente DDT Organoclorado DDE Organoclorado DDD Organoclorado Endrín Organoclorado Dieldrín Organoclorado Lindano Organoclorado Heptacloro Organoclorado En base a lo anteriormente descrito, la lista de plaguicidas seleccionados para ser identificados en este proyecto, tanto en agua, suelo, sedimento y tejido de camarón (Penaeus sp.) son los que se muestran en la Tabla 5, pese a que se propusieron 4 plaguicidas se identificaran 10 en las distintas matrices. Tabla 5. Pesticidas seleccionados para el estudio Naturaleza Química del componente Nombre del pesticida Activo Paration Organofosforados Metil paratión Etroprofos DDT DDE DDD Organoclorados Endrín Dieldrín Lindano Heptacloro 22 3. Objetivos de la Investigación 3.1 Objetivo General Cuantificar, en una primera fase, el contenido de 4 plaguicidas en suelos, sedimentos, agua y camarones, en época lluviosa y época seca, en estanques de camarones y zonas circundantes, en la Bahía de Jiquilisco. 3.2 Objetivos Específicos • Acondicionamiento del laboratorio, sistematización y consolidación de la investigación, socialización de la información. • Determinar niveles actuales de 4 plaguicidas, en suelos y agua circundante a estanques de cultivo de camarón (Penaeus sp.), en la Bahía de Jiquilisco • Determinar niveles actuales de 4 plaguicidas en el sedimento, suelo, agua y camarones, en estanques de cultivo de camarón (Penaeus sp.) 23 4. Metodología 4.1 Revisión Bibliográfica Antes de iniciar el trabajo de campo y de laboratorio se realizó una búsqueda bibliográfica de estudios previos en la zona, así como de estudios similares realizados en otras zonas. La información encontrada se tomó en cuenta para la selección de las metodologías a utilizar en el presente estudio. Las matrices de interés son: agua, suelo, sedimento y camarones, y se trabajará con analitos orgánicos, particularmente pesticidas organoclorados y organofosforados. Basándose en esta información se realizó una revisión bibliográfica para definir los métodos estándares de muestreo para estas diferentes matrices, tomándose la decisión de utilizar los métodos estándares de la Agencia de Protección Ambiental de Estados Unidos (EPA). 4.2 Trabajo de Campo El primer paso para la realización del trabajo de campo fue la definición de los puntos de muestreo. Como se muestra en el capítulo 2, en la sección referente a la delimitación geográfica del problema, se trabajará en las áreas circundantes a dos estanques donde se han detectado problemas de crecimiento de camarón y uno donde no se han manifestado dificultades en el crecimiento. Para la determinación de los puntos de muestreo se realizaron mapas de las zonas de interés a gran escala, apoyándose en el Laboratorio del Sistema de Información Geográfica de la UCA. Luego se definieron como criterios para la selección de puntos de muestreo, los siguientes: - Se tomarán muestras dentro de los estanques, tanto de suelo, sedimentos, agua y camarones. 24 - Se tomaron muestras de agua en todo su recorrido hasta los estanques, comenzando en la Bahía, luego en los brazos de agua que se internan en el manglar y finalmente en los puntos de toma de agua de los estanques. Intentando de esta forma monitorear todo el recorrido del agua que se utiliza en el cultivo de camarón. Además para la definición de los puntos se tomaron en cuenta las zonas donde hay desembocadura de ríos, ya que en estas zonas puede darse el ingreso de contaminantes a la Bahía. - En algunos de los puntos seleccionados para toma de agua, se tomaron también muestras de sedimentos y se determinaron parámetros como pH, Temperatura y Oxígeno disuelto. Por otra parte, en el Anexo 2 se detallan los siguientes procedimientos de muestreo: - Protocolo para muestreo de aguas de bahía y/o estanque para la determinación de pesticidas organoclorados y organofosforados. - Protocolo para muestreo de sedimentos de bahía para la determinación de pesticidas organoclorados y organofosforados. - Protocolo para muestreo de suelos para la determinación de pesticidas organoclorados y organofosforados. Los contenedores utilizados para la recolección de las muestras fueron lavados previamente al muestreo con agua y jabón libre de fosfatos y luego enjuagados con acetona, en el Anexo 3 se presenta el procedimiento para el lavado de toda la cristalería en el laboratorio. El material de los contenedores para agua y sedimento es de vidrio color ámbar con capacidad de 2.5 litros ya que no puede utilizarse recipientes de plástico, por la posibilidad de contaminar las muestras de ésteres ftalatos y otros hidrocarburos. Para camarones se utilizan bolsas plásticas con cierre hermético pero en su 25 interior se recubren con papel aluminio para evitar contaminación de la muestra con el plástico. Las muestras, una vez adquiridas se enfrían a 4°C con hielo y luego se guardan a esta temperatura en el laboratorio. El tiempo máximo para realizar la extracción es de una semana, así como indican los procedimientos de la EPA que se muestran en la Tabla 6 . Tabla 6 Manejo y Preservación de muestras compuestos orgánicos semi-volátiles [SW-846, EPA] ORGANICOS SEMIVOLATILES PESTICIDAS ORGANOCLORADOS/PCBSY HERBICIDAS Matriz de la Contenedor Preservativo Tiempo máximo de muestra almacenamiento Muestras de Contenedor de 125 mL residuos de boca ancha con concentradas tapadera de teflón Contenedores color Muestra acuosas ámbar de 1 galón, dos sin residuos de de 0.5 galones o 4 de cloruro un litro con tapadera Ninguno Muestras 14 días Enfriar a 4 ºC Muestras 7 días de teflón Contenedores color Añadir 3 mL de ámbar de 1 galón, dos tíosulfato de sodio al Muestra acuosas de 0.5 galones o 4 de 10% con residuos de un litro con tapadera adición cloruro de teflón puede ser hecha en el por galón. del laboratorio La tíosulfato antes Muestras 7 días de salir al campo. Contenedor de 125 mL Muestras Sólidas de boca ancha con Enfriar a 4 ºC Muestras 14 días tapadera de teflón El muestreo se realizó en dos épocas en los puntos de muestreo seleccionados, un muestreo en la época seca y otro en la época lluviosa para evaluar si el cambio de estación afecta la movilidad y presencia de los contaminantes. 26 4.3 Trabajo Experimental 4.3.1 Montaje de Laboratorio Entre las primeras actividades programadas en el proyecto estaba el montaje y adecuación de un laboratorio para el análisis de pesticidas organoclorados. Para esto se realizó la adquisición de mobiliario, de una cámara de extracción, se realizaron las instalaciones de gas, aire acondicionado y ductos de succión. Finalmente se adquirió el equipo y reactivos que se detallan a continuación (en el Anexo 8 pueden observarse fotos del laboratorio). El laboratorio recibió el nombre de Laboratorio de Calidad Ambiental. • Equipo - Cromatógrafo, Detector y Auto inyector El cromatógrafo utilizado para el análisis es un Shimadzu GC-2014 con un Detector de Captura de Electrones Shimadzu ECD-2014 y un Autoinyector AOC20. - Columna Cromatográfica de Detección Marca: Alltech Numero de serie: 706120203 Fase: ECTM-5 Diámetro Interno: 0.32 mm Grosor del Film: 0.25 μm Temperatura máxima: 350 ºC - Equipo de concentración RapidVap Vaccum, Marca: LABCONCO - Bomba de vacío para concentrador , Marca: LABCONCO 195 litros / minuto 27 115 VAC 50/60 Hz fase única 7.2 amperios - Shaker Forma Scientific • Reactivos CLORURO DE METILENO - Fisher Scientific D143-4 Calidad HPLC - Fisher Scientific D154-4 Calidad GC Resolv HEXANO - Fisher Scientific Clase 1B H302-4 Calidad HPLC grade ACETONA - Fisher Scientific Clase 1B H929-4 Calidad Optima - Mallinckrodt Chemicals Calidad AR SULFATO DE SODIO ANHIDRO - Fisher Scientific Calidad ACS - Mallinckrodt Chemicals Calidad ACS 4.3.2 Análisis La técnica estándar para detección de los pesticidas organofosforados y organoclorados es a través de la cromatografía gaseosa. En cromatografía 28 gaseosa la muestra debe ser sometida a una serie de preparaciones previas a la inyección en el cromatógrafo, estas son: extracción y limpieza. La extracción depende de la matriz en la cual se encuentran las muestras, para muestras acuosas en particular la extracción de compuestos orgánicos semivolátiles se realiza por extracción líquido-líquido (método EPA 3510) por embudos de separación. En el Anexo 4 se muestra la marcha de extracción realizada en el Laboratorio de Calidad Ambiental. Para las muestras sólidas el proceso de extracción que puede ser utilizado es la extracción Soxhlet (método EPA 3540). Debido a ciertas limitaciones de equipo fue necesario modificar dicho método, y con el fin de comprobar que la modificación hecha produciría resultados equivalentes al procedimiento original, se realizaron experimentos una vez modificado el método, los resultados se muestran en el apartado 5.2.1 Pruebas preliminares. El procedimiento para la extracción de muestras sólidas se muestra en el Anexo 5. La detección de organoclorados se realizó en el laboratorio de Calidad Ambiental de la UCA, utilizando el método denominado organoclorados 4 el cual tiene las siguientes especificaciones: - Horno: 80°C (1 min.), 20°C/min. hasta 140°C (2 min.), 4°C/min. hasta 250 (10 min.). - Detector: ECD, 325 °C, 1 nA - Gas portador: N2 ultra alta pureza, flujo de columna 2 mL/min - Inyección: 2 μL, 10:1 split. La detección de organofosforados no pudo realizarse en el laboratorio de la UCA ya que los pesticidas no fueron detectados por el detector ECD, por lo tanto se determinaron en el Laboratorio de Calidad Integral de FUSADES, bajo las siguientes condiciones. 29 - Horno: 85° C/0.00 min, 30.0°C/min 195° C/0.0 min, 5° C/min, 250° C/8.33 min. Tiempo de corrida 23 min. - Gas de Arrastre: Nitrógeno de Alta Pureza - Inyector: 250° C. Inicialmente en modo Splitless, flujo total: 64.2 mL/min., flujo de purga: 60.0 mL/min., 0.75 min. (Modo Split). - Detector: FPD, 250° C, Make up 58.1 mL/min., Flujo de Hidrógeno: 75.0 mL/min.; Flujo de Aire: 100 mL/min. 4.3.3 Control de calidad Antes de realizar los análisis se elaboró una curva de calibración utilizando la técnica de estándar interno, utilizando 5 puntos de la mezcla de pesticidas organoclorados y organofosforados a 5 concentraciones diferentes. Los estándares sustitutos utilizados son: - Para compuestos organoclorados: pentacloronitrobenceno - Para compuestos organofosforados: Mezcla de tributil fosfato y trifenil fosfato. Como medida de control de calidad el análisis de las muestras se realiza en duplicado y se inyecta cada muestra dos veces al cromatógrafo. Además se analizan junto a las muestras un blanco de laboratorio para verificar que no haya contaminación cruzada y una muestra fortificada para evaluar la recuperación. La técnica de estándar interno se utilizó para cuantificar las muestras de agua y camarones, las muestras de sedimentos no pudieron ser cuantificadas con esta técnica ya que al ser la matriz más compleja algunas sustancias extraídas no permitían leer el estándar interno. Es por esto que para las muestras de sedimentos se utilizó para su cuantificación la técnica de estándar externo. 30 5. Resultados 5.1 Plan de muestreo Tomando en cuenta los criterios explicados anteriormente en la sección 4.2 Trabajo de campo, se realizó el mapa de muestreo que se muestra en la Figura 6 y se definió el plan de muestreo que se muestra en la Tabla 7 , en el Anexo 8 pueden verse fotos de la ejecución de dicho plan. Figura 6. Mapa de puntos de muestreo 31 Tabla 7. Plan de muestro Nombre estanque Cantón 31 de Diciembre Tipo de muestra Numero de muestras Ubicación del punto de muestreo mapa Agua bahía 3 muestras en época seca y lluviosa 5 Agua brazos 2 muestras a lo largo de la bahía en época seca y lluviosa 1 muestra justo a la entrada de la piscina en época seca y lluviosa Sedimento Muestras en sitios circundantes a los estanques de cultivo de camarón Agua bahía Los Mancornados San Hilario Agua de brazos Sedimento Agua 31 de Diciembre Penaeus sp. Suelo Sedimento Muestras en los estanques de cultivo de camarón Agua Los Mancornados Penaeus sp. Suelo Sedimento 4 muestras en época seca y época lluviosa 3 muestras sobre el punto en época seca y lluviosa 2 muestras a lo largo en época seca y lluviosa 1 muestra justo a la entrada de la piscina en época seca y lluviosa 4 en época seca y 4 en época lluviosa 3 muestras en época seca y en época lluviosa 2 muestras en época seca y dos en época lluviosa 3 muestras en vaciado de estanque 3 muestras en vaciado de estanque 3 en época seca y 3 en época lluviosa 2 muestras en época seca y dos en época lluviosa 3 muestras en vaciado de estanque 3 muestras en vaciado de estanque 6y7 8 6y7 2 3 4 3 9 1 32 Nombre estanque Cantón Tipo de muestra Numero de muestras Ubicación del punto de muestreo mapa Agua bahía 3 muestras en época seca y en época lluviosa 10 1 muestra en la desembocadura del Río San Lázaro en época seca y época lluviosa. Muestras en sitios circundantes a los estanques de cultivo de camarón La Carranza Agua brazos Sisiguayo Sedimento Agua Muestras en los estanques de cultivo de camarón 12 1 muestra justo a la entrada donde se toma agua para la piscina en época seca y lluviosa 13 4 muestras en época seca y 4 en época lluviosa 11 y 12 Suelo 3 en época seca y 3 en época lluviosa 2 muestras en época seca y dos en época lluviosa 3 muestras en vaciado de estanque Sedimento 3 muestras en vaciado de estanque Penaeus sp. La Carranza 1 muestras en la desembocadura del río El Espino en época seca y lluviosa 11 14 33 5.2 Medición de parámetros en puntos de muestreo Durante la toma de muestra en los puntos seleccionados se midieron diferentes parámetros en el sitio con equipo portátil, tales como: pH, Oxígeno Disuelto, conductividad, los datos obtenidos en cada punto se muestran en la Tabla 8, Tabla 9, Tabla 10 y Tabla 11. A continuación se detalla las especificaciones técnicas del equipo de medición utilizado. - Medidor de oxigeno portátil Marca OAKTON DO 300 Con compensación de temperatura y de salinidad - Medidor de conductivita portátil Marca WTW Con compensación de temperatura. - Tiras de papel Marca Hydrion pH 1-12 Tabla 8 Parámetros medidos en puntos de muestreo de agua en época seca Tipo de Muestra Agua Identificación del punto 1 18-12-07 Lugar Estanque Coop. Parámetros de medición Hora pH Oxigeno Disuelto Conductivi dad 10:56 a.m. 8.0 0.45 mg/L 4.9 µS/cm 27.9 47 días de sembrado 8:30 a.m. 7:0 0.09 mg/L Interferencias 29.5 Bajamar 8:15 a.m. 7.0 0.14 mg/L 53.4 mS/cm 29.4 Bajamar T˚C Observaciones Los Mancor nados Agua 28-03-08 2 Agua 28-03-08 3 Bahía Coop. Los Mancorna dos Brazo Bahía Coop. Los Mancorna 34 Agua 28-03-08 4 Agua 5 26-02-08 Agua 6 29-03-08 Agua 7 3-12-07 Agua 8 3-12-07 Agua 9 18-12-07 Agua 10 26-02-08 Agua 11 12-12-07 Agua 12 12-12-07 Agua 13 12-12-07 Agua 12-12-07 14 dos Brazo Bahía Coop. Los Mancorna dos Bahía 31 de Diciembre Sisiguayo Brazo Bahia Coop. 31 Diciembre Sisiguayo Brazo de Bahía Coop. 31 Diciembre Sisiguayo Entrada al estanque brazo de Bahía Coop. 31 Diciembre Sisiguayo Estanque Coop. Las Mujeres Bahía La Carranza San Hilario Brazo Bahia San Hilario Brazo Bahia San Hilario Justo entrada de estanque Brazo Bahia San Hilario Estanque El Torno San Hilario 8:00 a.m. 7.0 0.10 mg/L 53.7 mS/cm 29.0 Bajamar 9:15 a.m. 8.0 0.10 mg/L 9.36 µS/cm 29.2 Bajamar 2.00 p.m. 7.0 Interferencias 50.2 mS/cm 30.6 Pleamar 9.40 a.m. 7.0 No se llevo el equipo No se llevo el equipo No se llevo el equipo Bajamar No se llevo el equipo No se llevo el equipo No se llevo el equipo Bajamar 9:30 a.m. 7.0 Viento fuerte Viento fuerte 9.00 a.m. 8.0 1,86 mg/L 4.4 µS/cm 24.8 A una semana de siembra de camarón 9:25 a.m. 8.0 0,09 mg/L Interferencias 29.0 Bajamar El conductivímetro falló 11:07 a.m. 8.0 0,20 mg/L 4.9 µS/cm 29 Bajamar 10:35 a.m. 8.0 0,28 mg/L 4.9 µS/cm 27.7 Bajamar 11:20 a.m. 8.0 0,11 mg/L 3.6 µS/cm 26.7 Bajamar 2:00 p.m. 8.0 0,86 mg/L 27.5 Los camarones estaban en fase de cosecha Interferencias 35 Tabla 9 Parámetros medidos en puntos de muestreo de agua en época lluviosa Parámetros de medición Tipo de Muestra Agua Identificación del punto 1 23-07-08 Lugar Oxigeno Disuelto Conductivi dad Hora pH 9:20 a.m. 7.0 5.93 mg/L 7.44 mS/cm 29.4 Bahía Coop. Los Mancorna dos Brazo Bahía Coop. Los Mancorna dos Brazo Bahía Coop. Los Mancorna dos Bahía 31 de Diciembre Sisiguayo Brazo Bahia Sisiguayo Brazo de Bahía Coop. 31 Diciembre Sisiguayo Entrada al estanque brazo de Bahía Coop. 31 Diciembre Sisiguayo Estanque Coop. Las Mujeres Bahía La Carranza San Hilario Brazo Bahia San Hilario 8:12 a.m. 7:0 6.14 mg/L 35.4 mS/cm 29.4 8:31 a.m. 7.0 4.89 mg/L 34.7 mS/cm 29.2 7:45 a.m. 7.0 5.52 mg/L 34.9 mS/cm 29.4 11:37 a.m. 7.0 5.73 mg/L 36.9 mS/cm 31.5 11:21 a.m. 7.0 2.99 mg/L 34 mS/cm 31.4 Pleamar 10:57 a.m. 7.0 1.51 mg/L 28.3 µS/cm 31.0 Pleamar 10:34 a.m. 7.0 0.95 mg/L 13.81 mS/cm 29.4 Pleamar 11.73 mg/L 21.8 mS/cm 34.5°C Brazo Estanque Coop. T˚C Observaciones Los Mancor nados Agua 23-07-08 2 Agua 23-07-08 3 Agua 23-07-08 4 Agua 5 20-06-08 Agua 6 20-06-08 Agua 7 20-06-08 Agua 8 20-06-08 Agua 9 18-12-07 Agua 10 20-06-08 Agua 11 20-06-08 Agua 12 10:55 a.m. 11:50 a.m. 7.0 3.76 mg/L 36 mS/cm 31.3 12:07 a.m. 8.0 3.28 mg/L 33.2 mS/cm 31.9 Justo entrada río San Lázaro 11:30 8.0 3.64 20.1 32.1 Justo en la 36 15-08-08 Agua 13 20-06-08 Agua 14 30-06-08 Bahia San Hilario Justo entrada de estanque Brazo Bahia San Hilario Estanque El Torno San Hilario a.m. mg/L mS/cm 12:29 a.m. 8.0 3.51 mg/L 19.5 mS/cm 4:40 p.m. 8.0 14.68 mg/L 40.6 mS/cm desembocadura del río El Calabozo 26.7 32.2 Bajamar Los camarones estaban en fase de cosecha, acaban de hacer recambio de agua, la noche anterior llovió fuertemente Tabla 10 Parámetros medidos en puntos de muestreo de sedimentos en época seca Tipo de Muestra Identificación del punto Sed 18-1207 1 Sed 28-0308 3 Sed 29-0308 6 Sed 3-12-07 7 Sed 18-1207 9 Sed 12-1207 11 Sed 12-1207 12 Lugar Estanque Coop. Los Mancor nados Brazo Bahía Coop. Los Mancorna dos Brazo Bahia Coop. 31 Diciembre Sisiguayo Brazo de Bahía Coop. 31 Diciembre Sisiguayo Estanque Coop. Las Mujeres Brazo Bahia San Hilario Brazo Bahia San Hilario Parámetros de medición Conductivi Oxigeno dad T˚C Disuelto Hora pH 10:56 a.m. 8.0 0,45 mg/L 4.9 µS/cm 27.9 47 días de sembrado 8:15 a.m. 7.0 0.14 mg/L 53.4 mS/cm 29.4 Bajamar 2.00 p.m. 7.0 Interfe -rencias 50.2 mS/cm 30.6 Pleamar 9.40 a.m. 7.0 No se llevo el equipo No se llevo el equipo No se llevo el equipo Bajamar Estaba haciendo viento fuerte 9.00 a.m. 8.0 0,61 mg/L 4.4 µS/cm 24.8 A una semana de siembra de camarón 11:07 a.m. 8.0 0,21 mg/L 4.9 µS/cm 10:35 a.m. 8.0 0,28 mg/L 4.9 µS/cm Observaciones Bajamar 27.7 Bajamar 37 Sed 12-1207 14 Estanque El Torno San Hilario 2:00 p.m. 8.0 0,87 mg/L Interferencias 27.5 Los camarones estaban en fase de cosecha Tabla 11 Parámetros medidos en puntos de muestreo de sedimentos en época lluviosa Identificació n del punto Lugar Sed 23-0708 1 Sed 23-0708 3 Sed 22-0908 Sed 22-0908 6 Sed 22-0908 11 Sed 22-0908 12 Sed 20-0608 14 Estanque Coop. Los Mancor nados Brazo Bahía Coop. Los Mancorna dos Brazo Bahia Sisiguayo Brazo de Bahía Coop. 31 Diciembre Sisiguayo Brazo Bahia San Hilario Brazo Bahia San Hilario Estanque El Torno Tipo de Muestra 7 Parámetros de medición Oxigeno Conducti T˚C Disuelto vidad Hora pH Observaciones 9:20 a.m. 7.0 5.93 mg/L 7.44 mS/cm 29.4 8:31 a.m. 7.0 4.89 mg/L 34.7 mS/cm 29.2 9:20 a.m. 6.5 3,56 mg/L 32.8 mS/cm 29.9 9:45 a.m. 6.5 7,32 mg/L 44.3 mS/cm 29.4 Pleamar 10:05 a.m. 6.0 5,68 mg/L 40.3 mS/cm 29 Justo entrada río San Lázaro 11:45 6.0 5,6 mg/L 20.8 mS/cm 27.5 4:42 p.m. 7-8 14.6 mg/L 40.6 mS/cm 32.2 La noche anterior hubo lluvia fuerte, se acababa de hacer un recambio de agua al estanque. 38 5.3 Trabajo Experimental 5.3.1 Tiempos de retención Para poder determinar la especificidad del método, primero se determinaron los tiempos de retención de cada pesticida, inyectando los estándares individuales de cada pesticida cinco veces. Luego se calculó el coeficiente de variación de los tiempos de retención para crear una ventana o intervalo de tiempo de retención, los resultados se muestran en Tabla 12 y Tabla 13. Estos tiempos de retención se introdujeron al programa del cromatógrafo y luego se realizaron pruebas con mezclas de pesticidas a diferentes concentraciones para verificar que fueran identificados estando mezclados entre sí. • Pesticidas organoclorados Tabla 12. Tiempo promedio de pesticidas organoclorados Pesticida Tiempo de retención Ventana* Lindano 15.202 0.03356 Estándar sustituto 15.436 0.04487 Heptacloro 18.440 0.1375 Dieldrín 24.644 0.132 DDE 24.773 0.1237 Endrín 25.584 0.1325 DDD 26.627 0.1191 DDT 28.286 0.124 *ventana está definida como +/- 3 Coeficientes de Variación (CV) 39 • Pesticidas organofosforados Tabla 13. Tiempos de retención promedio de pesticidas fosforados Tiempo de Ventana* Pesticida retención (min.) Etroprofos Estándar sustituto 10,119 0,028 9,826 0,025 Paration 16,219 0,032 Metil Paration 14,518 0,026 Terbufos 12,396 0,075 Phoxim 4,619 0,172 *ventana está definida como +/- 3 Coeficientes de Variación (CV) 5.3.2 Curvas de Calibración • Cuantificación Estándar Interno Para construir la curva de calibración de los compuestos organoclorados se prepararon soluciones de mezclas de los siguientes pesticidas: Hexaclorobenceno, Lindano, Endrin, Dieldrín, DDD, DDE, DDT, Heptacloro y Estándar Sustituto. Las soluciones se prepararon a 25 ppb, 50 ppb, 100 ppb, 150 ppb, 250 ppb y 400 ppb. Para elaborar la curva de calibración de los compuestos organofosforados se prepararon soluciones de mezclas de los siguientes pesticidas: Phoxim, Metamidofos, Etroprofos, Terbufos, Metil Paratión, Paratión y Estándar Sustituto. Se prepararon soluciones de las siguientes concentraciones 50 ppb, 100 ppb, 200ppb, 250 ppb y 300 ppb. Para cada pesticida se realizó el análisis de regresión lineal para determinar la linealidad del método, así como para generar la ecuación de la curva de calibración: y= mx + b, 40 En donde: y: relación de áreas analito-estándar sustituto x: relación de masas analito-estándar sustituto m: pendiente b: intercepto Los resultados obtenidos del análisis de regresión lineal para los pesticidas organoclorados y organofosforados se presentan en la Tabla 14, el análisis se realizó por medio del programa Excel y el procedimiento se detalla en Anexo 10. Tabla 14. Resultados de curvas de calibración estándar interno para pesticidas organoclorados y organofosforados Coeficiente de Pesticida Curva de Calibración Correlación Pearson (r2) Lindano Y= 1.045x + 0.092 0.938 Heptacloro Y= 0.877x + 0.132 0.931 Dieldrín Y= 0.815x + 0.102 0.987 DDE Y= 0.974x + 0.070 0.992 Endrín Y= 0.768x + 0.092 0.987 DDD Y= 0.641x + 0.063 0.991 DDT Y= 0.731x + 0.067 0.990 Etroprofos Y= 1.305x -0.087 0.995 Metil paratión Y= 0.812x-0.081 0.995 Paration Y= 0.935x -0.062 0.997 La cuantificación con estándar interno no fue posible con todas las muestras. Las muestras de suelo y sedimento presentaban interferencias cuyo principal problema fue que una de ellas coincidía en tiempo con el estándar interno lo que imposibilitaba su cuantificación. La eliminación de las interferencias no fue posible así que se optó por cuantificar dichas muestras por la técnica de estándar externo. Por lo tanto se procedió a calcular las curvas de calibración para esta técnica. 41 • Cuantificación con estándar externo Para construir la curva de calibración de los compuestos organoclorados se prepararon soluciones de mezclas de los siguientes pesticidas: Hexaclorobenceno, Lindano, Endrin, Dieldrín, DDD, DDE, DDT, Heptacloro. Las soluciones se prepararon a 25 ppb, 50 ppb, 100 ppb, 150 ppb, 250 ppb y 400 ppb. Para cada pesticida se realizó el análisis de regresión lineal para determinar la linealidad del método, así como para generar la ecuación de la curva de calibración: y= mx + b, En donde: y: Área analito x: Concentración analito m: pendiente b: intercepto Los resultados obtenidos del análisis de regresión lineal para los pesticidas organoclorados y organofosforados se presentan en la Tabla 15, el análisis se realizó por medio del programa Excel. Tabla 15. Resultados de curvas de calibración estándar externo para pesticidas organoclorados y organofosforados Coeficiente de Pesticida Curva de Calibración Correlación Pearson (r2) Lindano Y= 1983.6x - 1160.3 0.997 Heptacloro Y= 1637.8x + 19309 0.990 Dieldrín Y= 1567.8 + 9921.3 0.999 DDE Y= 1865.5x - 7424 0.997 Y= 1475.7x + 7895.9 0.998 DDD Y= 1229x + 1799.8 0.998 DDT Y= 1400x – 224.6 0.997 Endrín 42 5.3.3 Marchas analíticas • Análisis de Aguas Para el análisis de aguas se realizó la validación del método detallado en el Anexo 9, en dicho anexo se presenta el protocolo de validación y los resultados de la validación se muestran en el Anexo 10. Los resultados más significativos de la validación se resumen en la Tabla 16: Tabla 16 Resultados relevantes de la validación Prueba Pesticidas organoclorados Pesticidas organofosforados 0,016 ppb 0,016 ppb Porcentaje de recuperación 60-85% 70-125% Linealidad de analitos >0.98 >0.98 Límite de detección del método • Análisis de suelos y sedimentos Como se explicó en el apartado 4.3.2 Análisis fue necesario modificar el método de extracción de sedimentos y suelos. A continuación se presenta la modificación realizada al método y las pruebas hechas para verificar que funcionase. El procedimiento de la EPA para extracción de suelos es el siguiente: − Agregar 10 g de muestra de sedimentos en un recipiente de vidrio. − Añadir Estándar sustituto a la muestra. − Añadir sulfato de sodio granulado. − Transferir muestra a dedal de extracción y colocar en equipo de extracción Sohxlet. − En el recipiente de recolección de solvente colocar cobre granular con el fin de eliminar sulfuros. 43 En el laboratorio de calidad ambiental no se cuentan con suficientes equipos de extracción Sohxlet por tanto este equipo fue sustituido por un “Shaker”. El método modificado es el siguiente: − En un erlenmeyer de 250 mL se agregan 10 g de muestra − Añadir sulfato de sodio anhidro − Añadir cobre granular − Mezclar bien − Añadir 100 mL de cloruro de metileno − Se coloca el erlenmeyer en el shaker − Se hace funcionar el shaker a una velocidad de 125 rpm por cuatro horas − Una vez cumplidas las cuatro horas se remueve el solvente del erlenmeyer, a este solvente se le llama primer lavado, añadir 100 mL de cloruro de metileno al erlenmeyer. Colocar erlenmeyer en shaker y hacerlo funcionar por 4 horas más − Repetir el paso anterior, hasta obtener tres lavados. Es evidente que el grado de extracción de los pesticidas dependerá de cuanto tiempo la muestra permanezca en contacto con el solvente y de cuantos lavados sean aplicados a la muestra. El tiempo de cada lavado se predeterminó en cuatro horas. Para evaluar el número de lavados óptimos se realizaron las siguientes pruebas. Se tomaron seis muestras del punto 3 y se prepararon según el método modificado, agregándose 750 μL de mezcla de pesticidas organoclorados de 400 ppb. Las muestras se sometieron a 1, 2 y 3 lavados, obteniéndose los cromatogramas que se muestran en el Anexo 7 y los porcentajes de recuperación que se muestran en la Tabla 17. 44 Tabla 17 Porcentajes de recuperación de extracción de sedimentos con diferentes lavados Recuperación de Pesticidas en Sedimentos Muestra Lindano Heptacloro 86% Prueba Shaker 2 lavados Prueba Shaker 3 lavados Prueba Shaker 1 DDE Endrin Dieldrín DDD DDT 38,8% 43,5% 30,9% 31,8% 37,0% 50,2% 74,2% 67,9% 69,7% 69,3% 64,8% 74,2% 71,9% 88,8% 78,6% 79,3% 70,4% 77,6% 81,7% 89,2% Lavados Como se pueden observar en la Tabla 17 al aumentar la cantidad de lavados se extrae más de cada uno de los pesticidas. En el cromatograma de 3 lavados que se muestra en la Figura 7, se observa además que se obtienen tres picos de gran intensidad en los minutos 9.9, 15.6 y 21.4. 9.7 min 20.027 298262 DDE 24.787 29.953 39.757 195882 20 21.383 (Estandar Sustituto) 5773151 15.620 10 75426046 377516 10 40 30 3434643 1.557 9.630 20 50 177158 Figura 6. Extracción con 3 lavados. (Hexaclorobenceno) 30 156388 27.980 132705 DDT 28.290 24.667 (Dieldrin) 187938 21.883 221440 228048 22.963 213269 23675523.487 23.663 346452 16.347 272051 Lindano 15.260 267362 Heptaclor 18.487 60 101657 40 70 167525 Endrin 25.607 171312 26.040 154443 DDD 26.640 139223 26.913 11.233 mVolts 50 14.993 182525 12.033 60 80 134589 70 184995 12.853 189922 13.153 593123 262536 2.443 13.797 A re a Nam e R e te n ti o n T i m e 80 21.4 min 90 EC D Psh aker3L R 2 243687 90 15.6 min 0 0 0 5 10 15 20 25 30 35 40 45 M in u t e s Figura 7. Cromatograma de extracción con 3 lavados 45 Para determinar el origen de estos picos se realizaron tres lavados de cuatro horas para cada etapa del análisis, para poder identificar el origen de las interferencias, para evaluar cada etapa se analizó lo siguiente: • Cobre con solvente • Solvente pasado por lana de vidrio • Solvente pasado por filtro de fibra de vidrio • Muestra sin fortificar Los cromatogramas obtenidos de las pruebas se muestran en el Anexo 7. Únicamente en el cromatograma de la muestra sin fortificar que se muestra en la Figura 8 aparecen los 3 picos, por lo tanto se concluye que estas sustancias pertenecen a la muestra de sedimentos y no son interferencias incorporadas durante el análisis. Area Name Retention T ime 9000 9000 8000 8000 7000 7000 6000 6000 5000 5000 4000 4000 3000 2000 (DDT) 1000 (DDD) (Dieldrin) (DDE) (Endrin) 21.430 20.007 15.623 21.4 111430418 (Heptaclor) 1000 15.6 i 318266 2000 (Lindano) (Estandar Sustituto) 10118976 6154825 3000 min (Hexaclorobenceno) 9.627 9.7 693806 2.443 426344 3.077 mVolts 10000 ECD prueba punto7 1lavado 0 0 0 5 10 15 20 25 30 35 40 45 Minutes Figura 8. Cromatograma de extracción de muestra sin fortificar 46 mVolts 10000 Los picos que aparecen cerca de los tiempos 9.7 y 21.4 min. no interfieren con los pesticidas a analizar, sin embargo la interferencia que aparece a los 15.6 min. está muy cerca del estándar sustituto e imposibilita la cuantificación de las muestras. Además al hacer el análisis de fosforados en el cromatógrafo de gases con detector PFD, la señal de estas sustancias extraídas de la matriz son mucho más intensas y imposibilitan la cuantificación, ya que como puedo observarse en la Figura 9, distorsionan la línea base y cubren gran parte del cromatograma, interfiriendo con las señales de los pesticidas de interés. Interferencia Figura 9 Cromatograma de análisis de pesticidas organofosforados en sedimentos. 47 Debido a esta interferencia se consideró necesario agregar un paso de limpieza al protocolo de determinación de pesticidas organoclorados y organofosforados en sedimentos. La técnica seleccionada para la limpieza de los extractos de sedimento y suelo fue la técnica de exclusión por tamaño a través de un gel de nombre comercial SEPHADEX, las columnas utilizadas se muestran en la Figura 8. El protocolo para la implementación de esta técnica se muestra en el Anexo 11 y el protocolo de limpieza en el Anexo 12. Figura 8 Columnas de limpieza rellenas con gel SEPHADEX Sin embargo al pasar las muestras por la fase de limpieza no se eliminaron las interferencias en los cromatogramas de organoclorados, sin embargo esta etapa permitía la cuantificación de organofosforados. Para eliminar las interferencias se muestreó una tercera vez los sedimentos recolectando únicamente la parte superficial del sedimento, de esta forma no se extraería la parte anóxica del mismo que es la que se sospechaba podía introducir las interferencias en el análisis. En las Figura 9 y Figura 10 se muestran cromatogramas de los muestreos 2 y 3. 48 21.313 50 -50 0.0 2.5 5.0 7.5 10.0 150 12.5 15.0 17.5 20.0 22.5 mVolts 25.0 Name Retention Time ECD Punto 10 S R1 MIII Sepha 25.0 27.5 27.5 38.210 22.5 30.0 30.0 32.317 20.0 30.483 17.5 29.023 1.687 32.287 30.490 31.110 DDT 28.323 DDD 26.723 (Endrin) (Dieldrin) (DDE) 21.553 (Heptaclor) Hexaclorobenceno 14.143 14.507 15.093 (Lindano) (Estandar Sustituto) 16.087 16.337 12.073 12.230 12.393 12.577 12.847 13.127 10.360 120 120 100 100 mVolts 15.790 9.663 15.627 Name Retention Time DDT 28.313 28.497 15.0 (Endrin) 26.057 (DDD) 27.300 12.5 (Dieldrin) DDE 24.797 0 21.303 1.533 2.017 2.193 80 17.720 18.143 Heptaclor 18.510 19.177 19.263 300 15.630 10.0 Hexaclorobenceno 14.140 14.337 14.500 15.063 (Lindano) (Estandar Sustituto) 15.797 16.097 16.350 16.560 7.5 11.210 100 5.0 12.220 12.383 12.837 13.113 250 250 200 200 9.677 400 2.5 10.337 -20 0.0 2.420 2.633 2.757 2.910 3.113 3.060 3.360 3.547 3.623 3.760 4.093 4.463 4.627 4.980 5.100 5.243 5.400 5.530 5.997 6.380 6.680 6.860 7.060 7.300 7.473 7.883 8.547 8.667 8.853 20 9.447 3.060 40 3.233 3.5503.363 3.763 3.827 3.623 3.897 4.093 4.223 4.463 4.617 4.983 5.237 5.397 5.527 5.650 5.793 6.003 6.187 6.380 6.683 6.860 7.087 7.263 7.477 7.643 8.040 8.553 8.667 8.850 2.753 60 2.633 2.870 2.930 mVolts 180 1.537 1.693 2.197 mVolts 200 ECD Punto 1.2 S R1 MII 200 Interferencias 32.5 32.5 180 160 160 140 140 80 60 40 20 0 Minutes 35.0 35.0 37.5 40.0 37.5 40.0 42.5 Interferencias 350 0 42.5 -20 45.0 Figura 9 Cromatograma muestreo II, punto 12 400 350 300 150 100 50 0 Minutes -50 45.0 Figura 10 Cromatograma muestro III, punto 10 49 Como puede observarse las interferencias están presentes aún en los sedimentos más superficiales (capa superior de 3 cm.) por lo tanto muestrear únicamente la parte superficial del sedimento no resolvió el problema, la interferencia es además de un tamaño similar a las moléculas de pesticida y por lo tanto la técnica de limpieza que se basa en separación por tamaños no es efectiva. El principal problema de las interferencias es como se ha explicado anteriormente que una de ellas coincide en tiempo con el estándar interno lo que imposibilita la cuantificación de las muestras. Se intentó utilizar otra técnica de limpieza basada en otro principio que no fuese la separación de tamaños, se solicitó la colaboración del laboratorio MAG-OIRSA ya que ellos utilizan una técnica basada en la separación por adsorción utilizando columnas empacadas con el adsorbente de nombre comercial Florisil. Se llevó una muestra de sedimento al laboratorio donde se extrajo y limpió, los resultados obtenidos se muestran en la Figura 11. 100 100 ECD Punto14SHexAcetFlorisil 80 70 70 60 60 50 50 40 40 30 30 DDT (DDD) (Dieldrin) (DDE) (Endrin) 10 20 (Heptaclor) 20 10 0 0.0 0 2.5 5.0 7.5 10.0 12.5 15.0 17.5 20.0 22.5 25.0 27.5 30.0 32.5 35.0 37.5 40.0 42.5 45.0 Minutes Figura 11 Muestra de sedimento sometida a limpieza con Florisil 50 mVolts 80 Lindano Sustituto) (Estandar 90 Hexaclorobenceno mVolts Name 90 Como puede observarse en la Figura 11 las interferencias no son removidas por el Florisil, de lo que podemos concluir que las interferencias encontradas en la matriz sedimentos y suelos son de tamaño y polaridad similar a los pesticidas organoclorados y por esta razón es difícil removerlos. Para determinar la naturaleza de dichas interferencias se seleccionaron 9 muestras de sedimento, cuyos extractos fueron enviados el Laboratorio de Cromatografía del Instituto Químico de Sarria en Barcelona, España. Las muestras fueron analizadas por Cromatografía de Gases con Espectrometría de Masas (GC-MSD), los resultados de estos análisis se muestran en el Anexo 13. Como alternativa a la cuantificación se utilizará la técnica de estándar externo que no requiere el estándar sustituto o interno para la cuantificación. • Análisis de camarones El análisis de camarones se realizó con el método de extracción que se presenta en el Anexo 6 y el método de limpieza que se muestra en el Anexo 12. En las primeras pruebas se realizó la calibración de la columna de limpieza el procedimiento se presenta en el Anexo 11. Los resultados del análisis de camarones se muestran en la Figura 12, donde se puede observar que al extraer los pesticidas se extraen otras sustancias, como grasa y que al pasar el extracto por la columna de cromatografía de exclusión los pesticidas viajan al mismo tiempo que dichas interferencias, por lo que es imposible su cuantificación. 51 Figura 12. Cromatograma de análisis de camarones luego de pasar por la columna de limpieza Se realizaron pruebas de extracción de camarones sin caparazón, ya que los pesticidas se acumulan en el tejido, para evaluar si de esta forma se eliminan dichas interferencias. Además se cambió el solvente de Cloruro de Metileno a una mezcla Acetona:Hexano 1:1, al extraer bajo estas condiciones se obtuvo el cromatograma que se muestra en la Figura 13. Figura 13. Extracción de camarón (Penaeus sp) sin caparazón y utilizando solvente Acetona: Hexano 1:1 Como puede observarse en la Figura 13 las interferencias se han eliminado por lo que los análisis se realizaron sin caparazón y utilizando el solvente Acetona: 52 Hexano 1:1. Los porcentajes de recuperación se muestran en la Tabla 18 y se encuentran dentro del rango aceptable para este tipo de análisis. Tabla 18. Porcentajes de recuperación para análisis de organoclorados en camarones Porcentajes de recuperación Promedio Lindano Heptacloro Dieldrín DDE Endrin DDD DDT 65.3% 84.9% 56.6% 60% 62% 72.7% 33% A parte de las muestras de camarón (Penaeus sp) recolectadas en los estanques se muestrearon camarones en el brazo de la Bahía donde está ubicados lo puntos de muestreo 5, 6 y 7. Se obtuvieron muestras de camarones silvestres de este sitio, se pesaron y se analizaron 2 muestras de pesos similares. Se pudo observar que el tamaño de los camarones silvestres es mucho más grande que el se logra en los estanques de cultivo, los camarones recolectados tenían pesos entre 14 g hasta los 35 gramos (Figura 14). Figura 14. Camarones silvestres muestreados en un brazo de la Bahía de Jiquilisco 53 5.4 Resultado de análisis de pesticidas Los resultados de los análisis de agua para época seca (muestreo I) y para época lluviosa (muestreo II) se muestran en la Tabla 19 para organoclorados y organofosforados. Los resultados más relevantes de la matriz agua se resumen en la Figura 15. En la Tabla 20 se muestran los resultados del muestreo de sedimentos en época seca y época lluviosa, en la Tabla 21 los resultados del muestreo de sedimentos y suelos dentro de los estanques y finalmente en la Tabla 22 se muestran los resultados del muestreo de camarones. Los resultados más relevantes para sedimentos se resumen en la Figura 16 y Figura 17. 54 Tabla 19. Resultados de análisis de pesticidas organoclorados y organofosforados en muestreo I y II de aguas, concentración en ppb ND: No detectado Concentraciones de Pesticidas encontradas en muestras de Agua durante Muestreo I ppb (ng/ml) Muestra Lindano Estanques El Torno Punto 14,1 Replica 1 ND Punto 14,1 Replica 2 ND Punto 14,2 Replica 1 ND Punto 14,2 Replica 2 ND Punto 14,3 Replica 1 ND Punto 14,3 Replica 2 ND Las Mujeres Punto 9,1 Replica 1 ND Punto 9,1 Replica 2 ND Punto 9,2 Replica 1 ND Punto 9,2 Replica 2 ND Punto 9,3 Replica 1 ND Punto 9,3 Replica 2 ND Los Mancornados Punto 1,1 Replica 1 ND Punto 1,1 Replica 2 ND Punto 1,2 Replica 1 ND Punto 1,2 Replica 2 ND Punto 1,3 Replica 1 ND Punto 1,3 Replica 2 ND Agua de los Brazos y la Bahia Punto 2 Replica 1 ND Punto 2 Replica 2 ND Punto 3 Replica 1 ND Punto 3 Replica 2 ND Punto 4 Replica 1 ND Heptaclor DDE Endrin Dieldrín DDD DDT Metil Paration Paration Etroprofos ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND 55 Punto 4 Replica 2 Punto 5,1 Replica 1 Punto 5,1 Replica 2 Punto 5,2 Replica 1 Punto 5,2 Replica 2 Punto 5,3 Replica 1 Punto 5,3 Replica 2 Punto 6 Replica 1 Punto 6 Replica 2 Punto 7 Replica 1 Punto 7 Replica 2 Punto 8 Replica 1 Punto 8 Replica 2 Punto 10,1 Replica 1 Punto 10,1 Replica 2 Punto 10,2 Replica 1 Punto 10,2 Replica 2 Punto 10,3 Replica 1 Punto 10,3 Replica 2 Punto 11 Replica 1 Punto 11 Replica 2 Punto 13 Replica 1 Punto 13 Replica 2 ND ND ND ND ND ND ND ND ND ND ND ND ND ND 0,085 ND ND ND ND ND ND ND ND ND 0,089 ND ND ND ND ND ND ND ND ND <LCM 0,086 ND ND ND ND ND ND ND ND <LCM <LCM ND ND ND ND ND ND ND ND 0,088 ND ND ND ND ND ND ND ND ND <LCM ND ND ND ND ND ND ND ND ND <LCM ND ND ND ND ND ND ND ND ND <LCM ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND <LCM ND ND ND ND ND ND ND ND ND <LCM ND ND ND ND ND ND ND ND ND <LCM ND ND ND ND ND ND ND ND ND <LCM ND ND ND ND ND ND ND ND ND 0,182 ND ND ND ND ND ND ND ND ND <LCM ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND Resultados corregidos por el sesgo ND: NO DETECTADO LCM: límite de cuantificación <LCM El valor detectado en la muestra en mayor que el limite de detección del método 0,016 ppb pero inferior al Limite de cuantificación 0,083 ppb 56 Concentraciones de Pesticidas encontradas en muestras de agua durante Muestreo II ppb (ng/ml) Muestra Estanques El Torno Punto 14,1 Replica 1 Punto 14,1 Replica 2 Punto 14,2 Replica 1 Punto 14,2 Replica 2 Punto 14,3 Replica 1 Punto 14,3 Replica 2 Las Mujeres Punto 9,1 Replica 1 Punto 9,1 Replica 2 Punto 9,2 Replica 1 Punto 9,2 Replica 2 Punto 9,3 Replica 1 Punto 9,3 Replica 2 Los Mancornados Punto 1,1 Replica 1 Punto 1,1 Replica 2 Punto 1,2 Replica 1 Punto 1,2 Replica 2 Punto 1,3 Replica 1 Punto 1,3 Replica 2 Agua de los Brazos y la Bahia Punto 2,1 Replica 1 Punto 2,1 Replica 2 Punto 2,2 Replica 1 Punto 2,2 Replica 2 Punto 3,1 Replica 1 Punto 3,1 Replica 2 Punto 3,2 Replica 1 Lindano Heptaclor DDE Endrin Dieldrin DDD DDT Metil Paration Paration Etroprofos ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND 57 Punto 3,2 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 4 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 4 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 5,1 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 5,1 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 5,2 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 5,2 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 5,3 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 5,3 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 6,1 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 6,1 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 6,2 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 6,2 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 7,1 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 7,1 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 7,2 Replica 1 ND ND ND ND ND ND <LCM ND ND ND Punto 7,2 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 8 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 8 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 10,1 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 10,1 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 10,2 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 10,2 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 10,3 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 10,3 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 11 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 11 Replica 2 ND ND ND ND ND ND ND ND ND ND Punto 13 Replica 1 ND ND ND ND ND ND ND ND ND ND Punto 13 Replica 2 ND ND ND ND ND ND ND ND ND ND Resultados corregidos por el sesgo ND: NO DETECTADO LCM: límite de cuantificación <LCM El valor detectado en la muestra en mayor que el limite de detección del método 0,016 ppb pero inferior al Limite de cuantificación para DDT 0,116 ppb 58 Tabla 20 Resultados de análisis de pesticidas organoclorados y organofosforados en muestreo I y II de sedimentos, concentración en ppb ND: No detectado Resultados Muestreo I sedimentos ppb (ng/g) Muestra Lindano Heptaclor DDE Endrin Dieldrin DDD DDT Metil Paratión Paration Punto 3,1 Replica 1 ND ND ND ND ND ND ND ND ND Punto 3,1 Replica 2 ND ND ND ND ND ND ND ND ND Punto 3,2 Replica 1 ND ND 3,93 ND ND ND ND ND ND Punto 3,2 Replica 2 ND ND 14,19 ND ND ND ND ND ND Punto 6,1 Replica 1 ND ND 5,24 ND ND ND ND ND ND Punto 6,2 Replica 1 ND ND ND ND ND ND ND ND ND Punto 6,2 Replica 2 <LCM ND 3,97 ND ND ND ND ND ND Punto 7,1 Replica 1 ND ND ND ND ND ND ND ND ND Punto 7,1 Replica 2 ND <LCM 4,99 ND ND ND ND ND ND Punto 7,2 Replica 1 <LCM ND ND ND ND ND ND ND ND Punto 7,2 Replica 2 ND ND 6,95 ND ND ND ND ND ND Punto 11,1 Replica 1 ND ND 20,82 ND ND ND ND ND ND Punto 11,1 Replica 2 ND ND ND ND ND ND ND ND ND Punto 11,2 Replica 1 ND ND ND ND ND ND ND ND ND Punto 11,2 Replica 2 ND ND 6,40 ND ND ND ND ND ND Punto 12,1 Replica 1 ND ND 13,61 ND ND ND ND ND ND Punto 12,1 Replica 2 ND ND 7,48 ND ND ND ND ND ND Punto 12,2 Replica 1 ND ND 30,97 ND ND ND ND ND ND Punto 12,2 Replica 2 ND ND ND ND ND ND ND ND ND Resultados corregidos por el sesgo ND: NO DETECTADO LCM: límite de cuantificación <LCM El valor detectado en la muestra en mayor que el limite de detección del método 3,75 ppb pero inferior al Limite de cuantificación LCM Lindano 30 ppb LCM Heptaclor 46 ppb Etroprofos ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND 2,59 ND 59 Resultados Muestreo II sedimentos ppb (ng/g) Muestra Lindano Heptaclor DDE Endrin Dieldrin DDD DDT Metil Paratión Paration Punto 3,1 Replica 1 ND ND ND ND ND ND ND ND ND Punto 3,1 Replica 2 ND ND ND ND ND ND ND ND ND Punto 3,2 Replica 1 ND ND ND ND ND ND ND ND ND Punto 3,2 Replica 2 ND ND ND ND ND ND ND ND ND Punto 6,1 Replica 1 ND ND ND ND ND ND ND ND ND Punto 6,1 Replica 2 ND ND 4,81 ND ND ND ND ND ND Punto 6,2 Replica 1 ND <LCM 3,75 ND ND ND ND ND ND Punto 6,2 Replica 2 ND <LCM 6,33 ND ND ND ND ND ND Punto 7,1 Replica 1 ND ND ND ND ND ND ND ND ND Punto 7,1 Replica 2 ND ND 4,10 ND ND ND ND ND ND Punto 7,2 Replica 1 ND ND ND ND ND ND ND ND ND Punto 7,2 Replica 2 ND <LCM ND ND ND ND ND ND ND Punto 11,1 Replica 2 ND ND 10,27 ND ND 188,76 <LCM ND ND Punto 11,2 Replica 1 ND <LCM 9,34 ND ND ND <LCM ND ND Punto 11,2 Replica 2 ND <LCM 10,53 ND ND ND ND ND ND Punto 12,1 Replica 1 ND <LCM 16,97 ND ND ND <LCM ND ND Punto 12,1 Replica 2 ND <LCM 10,69 ND ND ND ND ND ND Punto 12,2 Replica 1 ND ND 21,32 ND ND ND <LCM ND ND Punto 12,2 Replica 2 ND ND 10,31 ND ND ND ND ND ND Punto 10 Replica 1 ND ND ND ND ND ND ND ND ND Punto 10 Replica 2 ND ND ND ND ND ND ND ND ND Punto 5 Replica 1 ND ND 5,51 <LCM ND ND ND ND ND Punto 5 Replica 2 ND ND 3,81 ND ND ND ND ND ND ND: NO DETECTADO Resultados corregidos por el sesgo LCM: límite de cuantificación <LCM El valor detectado en la muestra en mayor que el limite de detección del método 3,75 ppb pero inferior al Limite de cuantificación LCM Heptaclor 46.6 ppb LCM Endrin 19,8 ppb LCM DDT 30 ppb Etroprofos ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND 60 Tabla 21 Resultados de análisis de pesticidas organoclorados y organofosforados en muestreo de sedimentos y suelo dentro de los estanques de cultivo de camarón (Penaeus sp), concentración en ppb ND: No detectado Muestra El Torno Punto 14,1 Replica 1 Punto 14,1 Replica 2 Punto 14,2 Replica 1 Punto 14,2 Replica 2 Punto 14,3 Replica 1 Punto 14,3 Replica 2 Punto 14,1 Replica 1 Punto 14,1 Replica 2 Punto 14,2 Replica 1 Punto 14,2 Replica 2 Punto 14,3 Replica 1 Punto 14,3 Replica 2 Las Mujeres Punto 9,1 Replica 1 Punto 9,1 Replica 2 Punto 9,2 Replica 1 Punto 9,2 Replica 2 Punto 9,3 Replica 1 Punto 9,3 Replica 2 Punto 9,1 Replica 1 Lindano ND ND ND ND ND ND ND ND ND ND 11,69 ND ND ND ND ND ND ND ND Muestreo de suelo y sedimentos en estanques de cultivo de camarón Heptaclor DDE Endrin Dieldrin DDD DDT Metil Paratión Sedimento (5 cm ) ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND Suelo (20 cm) ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND 6,10 ND ND ND <LCM ND Sedimento (5 cm ) ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND Suelo (20 cm) ND ND ND ND ND ND ND Paration Etroprofos ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND 41,71 ND ND ND ND ND ND ND ND ND ND ND ND ND ND 61 Punto 9,1 Replica 2 ND ND 5,05 ND ND ND ND ND ND Punto 9,2 Replica 1 ND ND 9,28 ND ND ND <LCM ND ND Punto 9,2 Replica 2 <LCM <LCM 7,98 <LCM <LCM <LCM <LCM ND ND Punto 9,3 Replica 1 ND ND ND ND ND ND ND ND ND Punto 9,3 Replica 2 <LCM <LCM 13,59 <LCM <LCM <LCM <LCM ND ND Los Mancornados Sedimento (5 cm) Punto 1,1 Replica 1 ND ND ND ND ND ND ND ND ND Punto 1,1 Replica 2 ND ND ND ND ND ND ND ND ND Punto 1,2 Replica 1 ND ND ND ND ND ND ND ND ND Punto 1,2 Replica 2 ND ND ND ND ND ND ND ND ND Punto 1,3 Replica 1 ND ND ND ND ND ND ND ND ND Punto 1,3 Replica 2 ND <LCM 4,86 ND ND ND <LCM 8,25 12,68 Suelo (20 cm) Punto 1,1 Replica 1 ND ND 3,85 ND ND ND ND ND ND Punto 1,1 Replica 2 ND <LCM 5,09 ND ND ND ND ND ND Punto 1,2 Replica 1 ND <LCM 19,61 <LCM <LCM <LCM <LCM ND ND Punto 1,2 Replica 2 ND <LCM 9,01 <LCM <LCM <LCM <LCM ND ND Punto 1,3 Replica 1 <LCM <LCM 11,11 <LCM <LCM <LCM <LCM ND ND Punto 1,3 Replica 2 <LCM <LCM 12,13 <LCM <LCM <LCM <LCM ND ND Resultados corregidos por el sesgo ND: NO DETECTADO LCM límite de cuantificación <LCM El valor detectado en la muestra en mayor que el limite de detección del método (3,75 ppb) pero inferior al Limite de cuantificación LCM Heptaclor 46.6ppb LCM Endrin 19,8 ppb LCM DDT 30 ppb LCM Lindano 30 ppb LCM Dieldrin 18.7 ppb ND ND ND ND ND ND ND ND ND ND 10,98 ND ND ND ND ND ND 62 Tabla 22 Resultados de análisis de pesticidas organoclorados y organofosforados en de camarones, concentración en ppb ND: No detectado Cuantificación Camarones ng/g (ppb) Muestras Lindano Estanque El Torno M2R1ElTorno ND M2R2ElTorno ND M1R1ElTorno ND M1R2ElTorno ND Estanque Los Mancornados M1R1LM ND M1R2LM ND M2R1LM ND M2R2LM ND Estanque 31 de Diciembre M1R131Dic ND M1R231Dic ND M2R131Dic ND M2R231Dic ND Muestras brazo San Hilario M1 (15 gramos) ND M2 (15 gramos) ND M3 (30 gramos) ND M4 (30 gramos) ND ND: NO DETECTADO Resultados corregidos por el sesgo Heptaclor DDE Endrin Dieldrin DDD DDT Metil Etroprofos Paration ND ND ND ND ND ND ND ND Paration ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND ND 21,27 ND ND ND ND ND ND ND 10,97 ND ND 63 Figura 15 Resultados relevantes muestreo de Agua época lluviosa 64 Figura 16 Resultados relevantes muestreo sedimentos época seca 65 Figura 17 Resultados relevantes muestreo sedimentos época lluviosa 66 5.5 Análisis de Resultados Agua En el muestreo de aguas no se detecta presencia de pesticidas organoclorados y organofosforados en las aguas de los estanques de cultivo de camarón (Penaeus sp.), tanto en la época seca como en la lluviosa. En el muestreo de aguas circundantes a los estanques se observaron en el agua concentraciones de Dieldrín en todas las replicas de los puntos de muestreo 5, 6 y 10, la concentración oscila entre 0,085 ng/ml (ppb) a 0,182 ng/ml (ppb). Este hallazgo se dio únicamente en el muestreo de época seca ya que en el muestreo de época lluviosa no se detectaron residuos de pesticidas en ninguna de las muestras. El Dieldrín fue uno de los pesticidas utilizados en el cultivo de algodón, el Aldrín, otro pesticida utilizado en el cultivo de algodón, se degrada rápidamente a Dieldrín en el ambiente, se adhiere al suelo y se degrada muy lentamente. Según el Ambient Water Quality Criteria for Aquatic Organism de la Agencia de protección ambiental EPA, la máxima concentración de Dieldrín en agua superficial salada para la cual una comunidad acuática puede estar expuesta indefinidamente sin que resulte en efectos inaceptables es 0,1194 ng/ml (Se excede únicamente en una muestra del punto 10). Al comparar con los estudios hechos en el 76 (López) y en el 95 (Pacheco), un punto de muestreo definido por ellos coincide con los puntos 5 y 10 de muestreo de este estudio como muestra la Figura 15. 67 Punto 1 La Llanta coincide con puntos 5 y 10 del estudio Figura 18 Estaciones de muestreo, Bahía de Jiquilisco (Pacheco, 1995) En el estudio de 1995 se observó la presencia de Dieldrín en el punto 1 y además se observó un aumento del mismo con respecto a 1976. Esto posiblemente se deba a que el DDT se prohibió en 1980 y el Dieldrín en 1986 por lo tanto puede ser que una vez prohibido el DDT, este fuera sustituido por el Dieldrín. Si se grafica las concentraciones de pesticidas encontradas en el punto 1 en los años 76 y 95 y las de los puntos 5 y 10 encontradas en este estudio se observa en época seca como muestra la Figura 19 una reducción en el tiempo de la concentración DDT y Metil Paratión, una aumento del Dieldrín entre 1975 y 1993 y además se observa que las concentraciones de Dieldrín encontradas en la zona Concentración ppb en el estudio de 2007 son equivalentes a las encontradas en 1993. 0,25 0,2 Dieldrin 0,15 DDT 0,1 Metil Paration 0,05 0 Nov. 1975 Nov. 1993 Dic.2007 Fechas de muestreo Figura 19 Evolución de concentración de pesticidas en punto de muestreo 5 68 En época lluviosa se observa (Figura 20) al comparar los 3 muestreos una disminución del DDT en el tiempo, un aumento de Dieldrín y Endrín entre 1976 y 1994, sin embargo en el 2007 en esta época no se detectaron pesticidas en Concentración ppb la zona. 0,035 0,03 0,025 0,02 0,015 0,01 0,005 0 Dieldrin Endrin DDT Mayo. 1976 Mayo. 1994 Junio.2008 Fechas muestreo Figura 20 Evolución de concentración de pesticidas en punto de muestreo 5 Por otra parte, se detectó 4-4´DDD en una muestra del punto 5, el 4-4´DDD se utilizó como plaguicida pero además es uno de los metabolitos del DDT cuando este se degrada en el ambiente. Sedimentos Se muestrearon los sedimentos de las áreas circundantes de los estanques camarones encontrando en época seca que en el 60% de las muestras (puntos 3, 6, 11, 12) hay presencia de DDE, en concentraciones que oscilan entre 3,93 ppb hasta 30,97 ppb. El DDE es el principal metabolito del DDT y es muy persistente en el medio ambiente y se adhiere muy fuertemente en el suelo. Durante el muestreo en época lluviosa se agregaron 2 puntos más al muestreo de sedimentos, el 5 y el 10, ya que los resultados de agua mostraban contaminación del agua en esa zona. Los resultados de los análisis de estas muestras de 69 sedimentos revelan presencia de DDE en el punto 5, en concentraciones de 3,815,51 ppb. Al igual que en la época seca en el 60% de las muestras (puntos 3, 6, 11, 12) hay presencia de DDE en concentraciones que oscilan entre 3,75-21,32 ppb. Además en época lluviosa se observó en los puntos 6, 11 y 12 presencia de Heptacloro en los sedimentos en concentraciones inferiores al límite de cuantificación establecido por el método. El 17% de las muestras, en puntos 11 y 12, mostraron presencia de residuos de DDT en concentraciones por debajo del límite de cuantificación establecido por el método. Sedimentos y suelos de los estanques El muestreo del fondo de los estanques de cultivo de camarón se hizo a dos niveles, los sedimentos constituidos por los 5 cm. de la capa superior del fondo del estanque y los suelos que son capas más profundas, aproximadamente 20 cm. por debajo del sedimento. Los sedimentos de los estanques (5 cm. de profundidad) no reflejaron presencia de los plaguicidas organoclorados y organofosforados evaluados para ninguno de los dos periodos establecidos en el muestreo. Sin embargo, en los suelos de los estanques (20 cm. de profundidad) se identificaron Heptacloro, Endrín, Dieldrín, DDD y DDT, en concentraciones inferiores al límite de cuantificación respectivo por lo cual no se puede asegurar la cantidad en que se encuentran pero sí se puede confirmar su presencia. Pero sí se encontró DDE en los suelos en valores cuantificables: 3,85-19,61 ng/g. 70 En cerca del 95% de las muestras de sedimento de los estanques y de la bahía al extraer y limpiar los pesticidas se arrastraron junto a estos 3 interferencias, al enviar 9 muestras al Instituto Químico de Sarriá en Barcelona donde se analizaron con cromatografía de gases con espectrofotometría de masas, se reveló que dichas sustancias son: cyclic octaatomic sulfur (23.1 min.); un compuesto que tiene una masa molecular de 292 (32.3 min.) y una sustancia de masa molecular 275.1 (33.5 min.) Estas dos últimas no pudieron ser identificadas sus moléculas ya que no se encontraban en la librería de moléculas del equipo. Como los pesos moleculares de las sustancias son próximos a los pesos moleculares de los pesticidas la técnica de separación por exclusión de tamaño no es efectiva. Camarones Se analizaron 4 muestras de camarones de cada estanque y no se detectó presencia de pesticidas organoclorados ni organofosforados en el tejido del mismo. 71 6. Conclusiones El agua de los estanques no reflejó presencia de ninguno de los pesticidas, sin embargo en el agua circundante a los estanques se detectó presencia de Dieldrín en concentraciones de 0,085 a 0,182 ppb. El Dieldrín fue uno de los pesticidas utilizados en el cultivo de algodón y su uso en la agricultura fue prohibido en 1986. En el sedimento procedente de los estanques no se encontró ninguno de los diez plaguicidas analizados. En el sedimento tomado en las zonas circundantes a los estanques fueron encontrados tres de los diez plaguicidas, específicamente DDE, Heptacloro y DDT, sin embargo los dos últimos en concentraciones abajo de los límites de cuantificación respectivos. No se encontraron parámetro de comparación respecto a los valores aceptables de dichas sustancias en sedimentos. Esta nueva información quedaría como referencia para futuras evaluaciones en la zona. En el suelo de los estanques (capa a 20 cm. de profundidad) se detectaron seis de los diez plaguicidas evaluados, Heptacloro, DDE, Endrín, Dieldrín, DDD y DDT, prácticamente todos en concentraciones inferiores al límite de cuantificación. El estanque Los Mancornados fue el que presentó más presencia de pesticidas organoclorados, seguido del estanque de Las Mujeres y finalmente del Torno. En el tejido de camarón (Penaeus sp.) de las muestras obtenidas en los estanques objetos de estudio no se detectó presencia de pesticidas organoclorados y organofosforados. Según la información que proporcionan los espectros de masas, se observó que las sustancias interferentes más repetidas en las muestras de sedimentos son: cyclic octaatomic sulfur (23.1 min.) observado prácticamente en todas las muestras; el compuesto que tiene una masa molecular de 292 (32.3 min.) y la sustancia de masa molecular 275.1 (33.5 min.). Estas dos últimas no pudieron ser 72 identificadas sus moléculas, debido a que la base de datos del equipo no las ubico con ninguna de las referencias que tiene en su memoria. Estas tres sustancias fueron arrastradas junto a los pesticidas en los procesos de extracción y limpieza, según los métodos aplicados y la técnica de limpieza por exclusión de tamaños no es eficiente pues los pesos moleculares son muy próximos. En conclusión, principalmente en los sedimentos de la zona se encuentran aún evidencia de los compuestos organoclorados objeto de este estudio, aunque en cantidades relativamente pequeñas 73 7. Recomendaciones Extender esta investigación a otras áreas de producción de camarón (Penaeus sp.) en la Bahía de Jiquilisco, es muy importante caracterizar el contenido de plaguicidas en torno a las zonas de cultivo de camarón debido que éste es un producto de consumo humano y además un producto con potencial de exportación. Ampliar la investigación a otras familias de plaguicidas utilizados en la actualidad como carbamatos y piretroides para completar el estudio sobre el impacto de los cultivos aledaños a la Bahía de Jiquilisco sobre el ecosistema de la misma. Así mismo se recomienda investigar el efecto, sobre el ecosistema estuarino, de los maduradores de caña de azúcar utilizados en grandes cantidades en la zona. Para dar seguimiento a los resultados de este estudio, realizar una evaluación del contenido de plaguicidas en bivalvos, en los puntos donde se ha detectado presencia de pesticidas organoclorados en sedimentos (puntos 5, 6, 11 y 12), ya que estos organismos son buenos indicadores para evaluar la penetración de estas sustancias en el medio ambiente. Se recomienda en este tipo de estudios siempre incluir el análisis de los sedimentos dado que representan una matriz estable en el tiempo a diferencia del agua cuya constante movimiento dificulta su análisis en el tiempo. Sin embargo esta matriz es muy compleja y como se ha mostrado en el estudio en la zona de la Bahía de Jiquilisco existen algunas sustancias difíciles de remover que interfieren con la cuantificación de pesticidas organoclorados y organofosforados por lo tanto se recomienda en esta matriz realizar cuantificación por estándar externo. En la ejecución de este proyecto se enfrentó la dificultad de las pocas condiciones que ofrece el país para la investigación, por ejemplo la adquisición de insumos y 74 equipo puede tardar entre 3 a 6 meses por lo que se recomienda tomar en cuenta dicha dificultad en los cronogramas de las investigaciones. 75 Bibliografía 1. Pacheco, R. Residuos de Plaguicidas en agua, sedimento y organismos acuáticos en la bahía de Jiquilisco. Universidad de El Salvador.1995. 2. Rodríguez, M. “Diagnóstico situacional del uso de DDT en los Programas de Control de Vectores en El Salvador”. Ministerio de Salud Pública y Asistencia social, Programa de Acción Integral (PAI).2001 3. MARN; Plan de Manejo del Área Natural Bahía de Jiquilisco; San Salvador; El Salvador; 2004 4. MARN/AECI; Complejo Bahía de Jiquilisco. Propuesta de sitio Ramsar; San Salvador; El Salvador; 2004 5. MARN; Diagnóstico Línea Base de condiciones biofísicas y socioeconómicas del Área de Conservación Jiquilisco y Jaltepeque. Proyecto ECOSERVICIOS. Documento sin publicar. Disponible MARN; 2003 6. Hernández-Rauda R., W.A. López & M.Vásquez-Jandres; El cultivo del camarón marino en la Bahía de Jiquilisco, Usulután, El Salvador; Instituto de Ciencias del Mar y Limnología, Facultad de Ciencias Naturales y Matemática, Universidad de El Salvador, 2006. 7. Hamilton D.J. et al; Regulatory limits for pesticide residues in water (IUPAC Technical Report); Pure Appl.Chem.; Vol 75 N°8; p.1123-1155; 2003 8. EPA; Waste-Hazard Waste-Test Methods, SW-846 On Line disponible en: http://www.epa.gov/epawaste/hazard/testmethods/sw846/online/index.htm 76