RESÚMENES
Anuncio

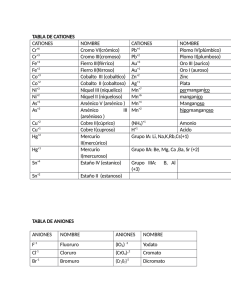
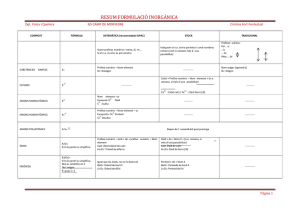
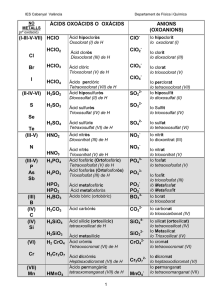
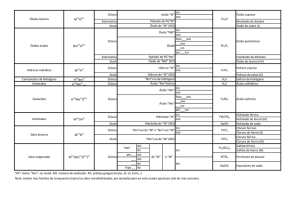
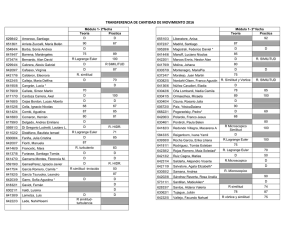
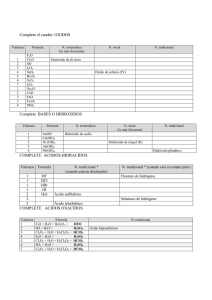
I E S IA E MA R RO DPTO. DE FÍSICA Y QUÍMICA NO BAQU RESÚMENES Índice general 3 1. Conceptos básicos 5 1. CONCEPTOS BÁSICOS 5 IES “MARIANO BAQUERO GOYANES” Curso académico 2015-16 Dpto. de Física y Química Unidad 1.- Conceptos básicos Resúmenes de Química 2º Bach. Formulación inorgánica: Elementos y nombres propios Hoja 1-1 ELEMENTOS Metales No metales – "Moléculas" Fórmula: Símbolo del elemento. Nombre: Nombre del elemento. Li Cu Tl Ag Y ... litio cobre talio plata itrio Cs Co Ta Pt Ce ... H2 N2 P4 O2 O3 S8 S F2 Cl2 cesio cobalto tántalo platino cerio hidrógeno / dihidrógeno nitrógeno / dinitrógeno fósforo blanco / tetrafósforo oxígeno / dioxígeno ozono / trioxígeno azufre / ciclooctoazufre azufre flúor / diflúor cloro / dicloro Br2 I2 He Ne Ar Kr Xe Rn bromo / dibromo yodo / diyodo helio neón argón kriptón xenón radón No metales – Redes atómicas Fórmula: Símbolo del elemento. Nombre: Nombre del elemento. B C Si boro carbono (grafito, diamante) silicio P As Sb fósforo arsénico antimonio ALGUNOS COMPUESTOS CON NOMBRE PROPIO Otros hidruros BH3 AlH3 B2 H6 NH3 N 2 H4 PH3 AsH3 SbH3 BiH3 borano / trihidruro de boro alumano / trihidruro de aluminio diborano / hexahidruro de diboro amoníaco / azano / trihidruro de nitrógeno hidracina / tetrahidruro de dinitrógeno fosfano / trihidruro de fósforo arsano / trihidruro de arsénico estibano / trihidruro de antimonio bismutano / trihidruro de bismuto Hidrácidos H2 S H2 Se H2 Te HF HCl HBr HI HCN ácido sulfhídrico / sulfuro de hidrógeno / sulfano ácido selenhídrico / seleniuro de hidrógeno / selenano ácido telurhídrico / telururo de hidrógeno / telurano ácido fluorhídrico / fluoruro de hidrógeno / fluorano ácido clorhídrico / cloruro de hidrógeno / clorano ácido bromhídrico / bromuro de hidrógeno / bromano ácido yodhídrico / yoduro de hidrógeno / yodano ácido cianhídrico / cianuro de dinitrógeno Óxidos / Peróxidos / Hidróxidos H2 O H2 O2 CaO NaOH KOH Ca(OH)2 agua / oxidano “agua oxigenada” / dioxidano “cal viva” / óxido de calcio “sosa cáustica” / hidróxido de sodio “potasa cáustica” / hidróxido de potasio “cal apagada” / hidróxido de calcio IES “MARIANO BAQUERO GOYANES” Curso académico 2015-16 Dpto. de Física y Química Unidad 1.- Conceptos básicos Resúmenes de Química 2º Bach. Formulación inorgánica: Oxoácidos Hoja 1-2 ÓXIDO + H2 O −−→ OXOÁCIDO OXOÁCIDOS MONOHIDRATADOS Representativos 17: Cl, Br, I Transición −−→ +1 +3 +5 +7 oso oso ico ico +4 +6 oso ico +1 +3 hipo 16: 15: S, Se, Te −−→ −−→ N hipo oso 14: −−→ C oso 4: Ti, Zr, Hf per −−→ +4 ico 6: 7: +5 Cr, Mo, W Mn, Tc, Re −−→ −−→ ico +3 +6 oso ico +6 +7 ico ico per +4 ico OXOÁCIDOS POLIHIDRATADOS metaorto- par orto- impar di- (P, As, Sb, V) di- −−→ 15: P, As, Sb 14: −−→ −−→ −−→ −−→ + 1 H2 O + 2 H2 O + 3 H2 O + 2 H2 O 2 (orto)ácido - H2 O −−→ −−→ Si +3 +5 oso ico +4 ico 13: −−→ B +3 ico 5: V, Nb, Ta −−→ +5 ico OTROS OXOÁCIDOS H5 IO6 H6 TeO6 HCNO ácido paraperyódico ácido ortotelúrico ácido ciánico ÓXIDO + nH2 O −−→ OXOÁCIDO metadi- par tetraortodi- impar −−→ −−→ −−→ −−→ −−→ superar número de oxidación superar número de oxidación superar número de oxidación +1 oxígeno más +1 oxígeno más IES “MARIANO BAQUERO GOYANES” Curso académico 2015-16 Dpto. de Física y Química Unidad 1.- Conceptos básicos Resúmenes de Química 2º Bach. Formulación inorgánica: Compuestos Hoja 1-3 (Positivo)m (Negativo)n COMPUESTOS Positivo -> Átomo o grupo de átomos con número de oxidación positivo. Negativo -> Átomo o grupo de átomos con número de oxidación negativo. NOMENCLATURA DE STOCK STOCK La valencia no se especifica en los casos: Nombre negativo de Nombre positivo (valencia) La valencia se debe especificar entre paréntesis y en números romanos. Grupo 1, Ag Grupo 2, Zn, Cd Grupo 3, B, Al, Ga −−→ −−→ −−→ +1 +2 +3 Positivos / Cationes ELEMENTOS CON UN NÚMERO DE OXIDACIÓN Nombre: Nombre del elemento. H Li Na K Rb Cs Fr Ag +1 +1 +1 +1 +1 +1 +1 +1 hidrógeno litio sodio potasio rubidio cesio francio plata Be Mg Ca Sr Ba Ra Zn Cd +2 +2 +2 +2 +2 +2 +2 +2 berilio magnesio calcio estroncio bario radio cinc cadmio Sc Y La Ac B Al Ga +3 +3 +3 +3 +3 +3 +3 escandio itrio lantano actinio boro aluminio galio ELEMENTOS CON VARIOS NÚMEROS DE OXIDACIÓN Nombre: Nombre del elemento (número de oxidación) In −−→ + 1 In −−→ + 3 Tl −−→ + 1 Tl −−→ + 3 Cu −−→ + 1 Cu −−→ + 2 Au −−→ + 1 Au −−→ + 3 Pt −−→ + 2 Pt −−→ + 4 ... indio(I) indio(III) talio(I) talio(III) cobre(I) cobre(II) oro(I) oro(III) platino(II) platino(IV) Pb −−→ + 2 Pb −−→ + 4 Sn −−→ + 2 Sn −−→ + 4 Bi −−→ + 3 Bi −−→ + 5 Mn −−→ + 2 Mn −−→ + 3 Mn −−→ + 4 Mn −−→ + 6 ... GRUPOS DE ELEMENTOS NH4+ amonio plomo(II) plomo(IV) estaño(II) estaño(IV) bismuto(III) bismuto(V) manganeso(II) manganeso(III) manganeso(IV) manganeso(VI) Fe −−→ + 2 Fe −−→ + 3 Co −−→ + 2 Co −−→ + 3 Ni −−→ + 2 Ni −−→ + 3 Hg −−→ + 1 Hg −−→ + 2 Cr −−→ + 2 Cr −−→ + 3 ... hierro(II) hierro(III) cobalto(II) cobalto(III) níquel(II) níquel(III) mercurio(I) mercurio(II) cromo(II) cromo(III) N −−→ + 1 N −−→ + 2 N −−→ + 3 N −−→ + 4 N −−→ + 5 Cl −−→ + 1 Cl −−→ + 3 Cl −−→ + 4 Cl −−→ + 5 Cl −−→ + 7 ... nitrógeno(I) nitrógeno(II) nitrógeno(III) nitrógeno(IV) nitrógeno(V) cloro(I) cloro(III) cloro(IV) cloro(V) cloro(VII) IES “MARIANO BAQUERO GOYANES” Curso académico 2015-16 Dpto. de Física y Química Unidad 1.- Conceptos básicos Resúmenes de Química 2º Bach. Formulación inorgánica: Compuestos II Hoja 1-4 Negativos / Aniones SENCILLOS Nombre: Raíz del elemento + -uro (el oxígeno se nombra óxido). H −−→ −1 F −−→ −1 Cl −−→ −1 Br −−→ −1 I −−→ −1 OH −−→ −1 CN −−→ −1 hidruro fluoruro cloruro bromuro yoduro hidróxido cianuro O −−→ −2 S −−→ −2 Se −−→ −2 Te −−→ −2 O2 −−→ −2 S2 −−→ −2 óxido sulfuro seleniuro telururo peróxido disulfuro B −−→ −3 N −−→ −3 P −−→ −3 As −−→ −3 Sb −−→ −3 boruro nitruro fosfuro arseniuro antimoniuro C −−→ −4 Si −−→ −4 carburo siliciuro DERIVADOS DE OXOÁCIDOS +1 +3 +5 +7 +1 +3 +5 +7 +1 +3 +5 +7 +4 +4 +6 +6 +4 +6 +1 +3 +5 +4 +3 +6 +6 +6 +6 +6 +7 +6 +7 +6 +7 HClO HClO2 HClO3 HClO4 HBrO HBrO2 HBrO3 HBrO4 HIO HIO2 HIO3 HIO4 H2 SO3 H2 S2 O5 H2 SO4 H2 S2 O7 H2 SeO3 H2 SeO4 HNO HNO2 HNO3 H2 CO3 HCrO2 H2 CrO4 H2 Cr2 O7 H2 MoO4 H2 WO4 H2 MnO4 HMnO4 H2 TcO4 HTcO4 H2 ReO4 HReO4 ác. hipocloroso ác. cloroso ác. clórico ác. perclórico ác. hipobromoso ác. bromoso ác. brómico ác. perbrómico ác. hipoyodoso ác. yodoso ác. yódico ác. peryódico ác. sulfuroso ác. disulfuroso ác. sulfúrico ác. disulfúrico ác. selenioso ác. selénico ác. hiponitroso ác. nitroso ác. nítrico ác. carbónico ác. cromoso ác. crómico ác. dicrómico ác. molíbdico ác. wolfrámico ác. mangánico ác. permangánico ác. tecnécico ác. pertecnécico ác. rénico ác. perrénico ClO– ClO2– ClO3– ClO4– BrO– BrO2– BrO3– BrO4– IO– IO2– IO3– IO4– SO32– S2 O52– SO42– S2 O72– SeO32– SeO42– NO– NO2– NO3– CO32– CrO2– CrO42– Cr2 O72– MoO42– WO42– MnO42– MnO4– TcO42– TcO4– ReO42– ReO4– hipoclorito clorito clorato perclorato hipobromito bromito bromato perbromato hipoyodito yodito yodato peryodato sulfito disulfito sulfato disulfato selenito seleniato hiponitrito nitrito nitrato carbonato cromito cromato dicromato molibdato wolframato manganato permanganato tecneciato pertecneciato renato perrenato HSO3– HS2 O5– HSO4– HS2 O7– HSeO3– HSeO4– hidrogenosulfito hidrogenodisulfito hidrogenosulfato hidrogenodisulfato hidrogenoselenito hidrogenoseleniato HCO3– hidrogenocarbonato HCrO4– HCr2 O7– HMoO4– HWO4– HMnO4– hidrogenocromato hidrogenodicromato hidrogenomolibdato hidrogenowolframato hidrogenomanganato HTcO4– hidrogenotecneciato HReO4– hidrogenorenato IES “MARIANO BAQUERO GOYANES” Curso académico 2015-16 Dpto. de Física y Química Unidad 1.- Conceptos básicos Resúmenes de Química 2º Bach. Formulación inorgánica: Compuestos III Hoja 1-5 OTROS DERIVADOS DE OXOÁCIDOS +3 +3 +3 +5 +5 +5 +3 +3 +3 +5 +5 +5 +3 +3 +3 +5 +5 +5 +4 +4 +3 +3 +5 +5 +5 HPO2 H4 P2 O5 H3 PO3 HPO3 H4 P2 O7 H3 PO4 HAsO2 H4 As2 O5 H3 AsO3 HAsO3 H4 As2 O7 H3 AsO4 HSbO2 H4 Sb2 O5 H3 SbO3 HSbO3 H4 Sb2 O7 H3 SbO4 H2 SiO3 H4 SiO4 HBO2 H3 BO3 HVO3 H4 V2 O7 H3 VO4 ác. metafosforoso ác. difosforoso ác. (orto)fosforoso ác. metafosfórico ác. difosfórico ác. (orto)fosfórico ác. metaarsenioso ác. diarsenioso ác. (orto)arsenioso ác. metaarsénico ác. diarsénico ác. (orto)arsénico ác. metaantimonioso ác. diantimonioso ác. (orto)antimonioso ác. metaantimónico ác. diantimónico ác. (orto)antimoniato ác. metasilícico ác. (orto)silícico ác. metabórico ác. (orto)bórico ác. metavanádico ác. divanádico ác. (orto)vanádico PO2– P2 O54– PO33– PO3– P2 O74– PO43– AsO2– As2 O54– AsO33– AsO3– As2 O74– AsO43– SbO2– Sb2 O54– AsO33– SbO3– Sb2 O74– SbO43– SiO32– SiO44– BO2– BO33– VO3– V2 O74– VO43– metafosfito difosfito (orto)fosfito metafosfato difosfato (orto)fosfato metaarsenito diarsenito (orto)arsenito metaarseniato diarseniato (orto)arseniato metaantimonioso diantimonito (orto)antimonito metaantimónico diantimoniato (orto)antimoniato metasilicato (orto)silicato metaborato (orto)borato metavanadato divanadato (orto)vanadato HP2 O53– HPO32– hidr... hidr... H2 P2 O52– H2 PO3– di... di... ... HP2 O73– HPO42– hidr... hidr... H2 P2 O72– H2 PO4– di... di... ... HAs2 O53– HAsO32– hidr... hidr... H2 As2 O52– H2 AsO3– di.. di... ... HAs2 O73– HAsO42– hidr... hidr... H2 As2 O72– H2 AsO4– di... di... ... HSb2 O53– HSbO32– hidr... hidr... H2 Sb2 O52– H2 SbO3– di.. di... ... HSb2 O73– HSbO42– HSiO3– HSiO43– hidr... hidr... hidr... hidr... H2 Sb2 O72– H2 SbO4– di... di... ... H2 SiO42– di... ... HBO32– hidr... H2 BO3– di... HV2 O73– HVO42– hidr... hidr... H2 V2 O72– H2 VO4– di... di... ...