solucionario
Anuncio
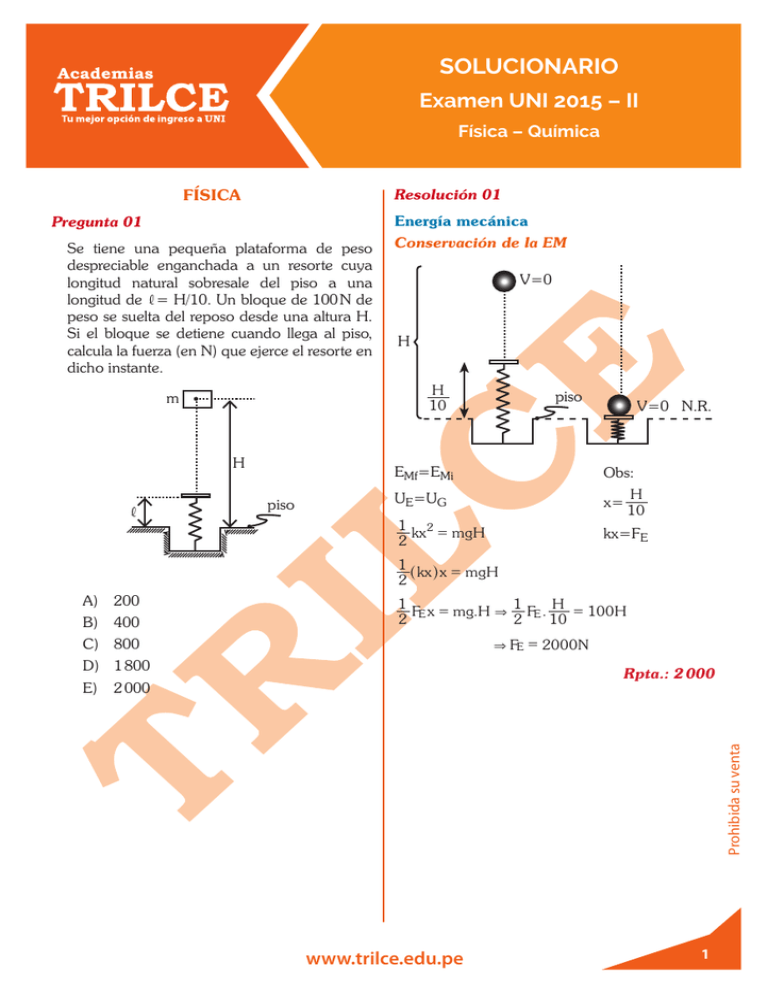
SOLUCIONARIO Examen UNI 2015 – II Física – Química FÍSICA Resolución 01 Energía mecánica Pregunta 01 Se tiene una pequeña plataforma de peso despreciable enganchada a un resorte cuya longitud natural sobresale del piso a una longitud de , = H/10. Un bloque de 100 N de peso se suelta del reposo desde una altura H. Si el bloque se detiene cuando llega al piso, calcula la fuerza (en N) que ejerce el resorte en dicho instante. V=0 H H 10 m H , Conservación de la EM piso piso V=0 N.R. EMf=EMi Obs: UE=UG x= 1 2= kx mgH 2 kx=FE H 10 1^ h = kx x mgH 2 A) 200 B) 400 1 1 H = = F x mg .H & FE . 100H 2 E 2 10 & FE = 2000N C) 800 D) 1 800 Rpta.: 2 000 Prohibida su venta E) 2 000 www.trilce.edu.pe 1 SOLUCIONARIO Examen UNI 2015 – II Física – Química Pregunta 02 Pregunta 03 Una bola de 180 g de masa, que se mueve con una rapidez de 10 m/s, choca frontal y elásticamente con otra bola que está en reposo. Después del choque, la bola que llega rebota hacia atrás con una rapidez de 4 m/s. La rapidez en m/s que adquiere la bola que estaba en reposo, y su masa en g son respectivamente: En una estación espacial, orbitando a poco más de 600 km de altura, llevaron un reloj de péndulo; pero encontraron que se estaba atrasando. ¿Qué deberían hacer para evitar el atraso? I. Reducir la masa del péndulo. II. Reducir la longitud del brazo del péndulo. A) 4; 380 III. Aumentar la altura de la órbita de la estación. B) 5; 400 C) 5; 420 D) 6; 400 A) F V F E) 6; 420 B) F F F Resolución 02 C) F V V Cantidad de movimiento D) V F V Conservación de la cantidad de movimiento 4m/s 10m/s V Reposo E) F F V Resolución 03 Gravitación Después Por conservación de la cantidad de movimiento Pi= Pf Variación de la gravedad I. La masa de la lenteja no influye en el periodo.…(F) II. Al reducir la longitud del péndulo, disminuye el periodo. El reloj del péndulo tiende a adelantarse y compensa el atrazo. … (V) 180.10= 180(–4)+mV 14(180)= mV ....... (1) III. Al aumentar la altura, disminuye la gravedad; el reloj del péndulo tiende más a atrazarse.… (F) Pero e= 1 V+4 1= ( V = 6 m/s 10 − 0 Reemplazando en (1) Rpta.: F V F 14(180)= m (6) m= 420 g Rpta.: 6; 420 Pregunta 04 Para generar ondas armónicas en una cuerda se requiere una potencia media de 4 000 W. Si se reducen la amplitud y la longitud de onda a la mitad, manteniendo la velocidad constante, calcula la potencia media, en W, que se necesita. www.trilce.edu.pe 2 Prohibida su venta Antes SOLUCIONARIO Examen UNI 2015 – II Física – Química A) 500 Pero se sabe: B) 1 000 Paparente = Preal - E C) 2 000 Reemp. D) 3 000 90% Preal = Preal - E E) 4 000 ⇒ E = 10% Preal Resolución 04 Potencia media P =`mj 1 v 10 P =t H2O 1 n v (2rf2) A2 2 1 A2 2º Acto : P = nv (4rf2) 2 4 1º Acto: 4000 = P= g$v = H2O Ondas mecánicas H2O ⇒ 10 = 1 nv (2rf2) A2 2 mg 10 P anillo c 1 m 10 tanillo tH O 2 Rpta.: 10 4000 P = 4000 W Rpta.: 4000 Pregunta 05 Al sumergirse en agua un anillo de cierto material, este tiene el 90 % del peso que tiene en el aire. Calcula la razón de la densidad del anillo con respecto a la del agua. Densidad del agua= 103 kg/m3 A) 1 Pregunta 06 Para los siguientes vectores mostrados en la figura, determina M= A + B + 3C Si A = 16u. circunferencia B 53º 37º C Prohibida su venta B) 10 C) 20 D) 25 A E) 30 Resolución 05 A) 30 u Estática de fluidos B) 40 u Principio de Arquímedes C) 60 u Dato D) 80 u Paparente = 90% Preal E) 100 u 3 www.trilce.edu.pe SOLUCIONARIO Examen UNI 2015 – II Física – Química Resolución 06 Resolución 07 Análisis vectorial Características físicas del movimiento Método del paralelogramo Rapidez media 36km/h=10m/s B = d vt= & d 50m 53º 37º 50m t 18km/h=5m/s 50m d 50 = = t = &t 10s v 5 A → A+B = C reemplazando en: A + B + 3C = C + 3C A + B + 3C = 4C ∴ A + B + 3C = 4C A + B + 3C = 80u Rpta.: 80 u Pregunta 07 Un atleta corre a lo largo de un camino recto con una rapidez de 36 km/h durante 5 s y después retorna con una rapidez de 18 km/h a su posición original. d V = total t total 100 V= m/s 5 + 10 100 c 18 m V= 15 5 V = 24 km/h Rpta.: 24 Pregunta 08 Un avión que se mueve con velocidad constante v = ^80 ti + 50tjh m/s , suelta un paquete cuando se encuentra a una altura y= 2 000 m. Determina aproximadamente la distancia entre el avión y el paquete 8 s después de haberse soltado, en metros. (g= 9, 81 m/s2) Prohibida su venta Calcula su rapidez media (en km/h). A) 24 5s B) 25 C) 26 A) 230 D) 27 B) 280 E) 28 C) 300 D) 314 E) 399 www.trilce.edu.pe 4 SOLUCIONARIO Examen UNI 2015 – II Física – Química Resolución 08 A) 7,2 Mov. en dos dimensiones B) 10,8 C) 12,0 Mov. parabólico D) 18,0 vx=80m/s E) 27,0 vy=50m/s Resolución 09 avión ∆y paquete Dinámica de una partícula 2° Ley de Newton Analizando “m3” m e N1 ∆y = 1 2 gt 2 ∆y = 1 (9,81) (8)2 = 313,92 m 2 8g aMAX N1 FR=ma ∆y ≅ 314 m Rpta.: 314 meN1=8a me8g=8a →a=0,6g Pregunta 09 Analizando al sistema Se tienen tres cuerpos dispuestos tal como se muestra en la figura. Las masas de los cuerpos m1 y m3 son 10 kg y 8 kg , y los coeficientes de fricción entre las masas m1 y m3 son ue= 0,6, uc= 0,4, no existiendo fricción entre m1 y la mesa. Determina el máximo valor de m2 (en kg) para que m1 y m3 se muevan juntas sin resbalar (g= 9,81 m/s2). m3 a m1+m3 N2 (m1+m3)g a m2 m2g m g a = m + m2 + m 1 2 3 m1 m g 0, 6g = 18 +2 m Prohibida su venta 8kg m2 2 →m2=27kg Rpta.: 27,0 5 www.trilce.edu.pe SOLUCIONARIO Examen UNI 2015 – II Física – Química Pregunta 10 Pregunta 11 Un satélite de 5 500 kg de masa gira en torno a la tierra con un período de 6,2×103 s. Calcula a qué altitud (en km) se encuentra el satélite sobre la superficie terrestre. MT= 6×1024 kg; G= 6,67×10–11 N.m2/kg2; RT= 6,4×106 m En relación a las ondas electromagnéticas, se dan las siguientes proposiciones: I. La luz y las ondas de radio se propagan con la misma velocidad en el vacío. II. El índice de refracción del agua es el mismo para todas las longitudes de onda del espectro visible. Considera (0,39)1/3= 0,73 III. El ángulo de refracción de la luz es siempre menor que el ángulo de incidencia. A) 700 B) 750 C) 800 Son correctas: D) 850 E) 900 A) solo I Resolución 10 B) solo II Gravitación universal C) solo III Fuerza gravitatoria D) I y II P E) II y III m Resolución 11 F6 n OEM Fenómenos ondulatorios MT O I. II. El índice de refracción de una sustancia transparente depende de la longitud de onda de la radiación electromagnética. F6=ma Y =m De donde: GMm Y w2(R+h) 3 (R + h) ⇒w2= En el vacío, todas las ondas electromagnéticas se propagan con la misma rapidez. III. La relación de ángulos de incidencia y refracción depende de los medios donde se propaga la luz. GM = 2r 2 3 ` T j (R + h) Rpta.: Solo I reemplazando: 6, 67.10 −11 .6.1024 4r 2 = 6+ 3 (6, 4.10 h) (6, 2.103) 2 ` h = 900km Pregunta 12 Sobre el eje de simetría de un espejo esférico convexo cuyo radio de curvatura es 1 m, se coloca un objeto a 1,5 m de su vértice. Calcula el aumento del espejo. Rpta.: 900 www.trilce.edu.pe 6 Prohibida su venta R SOLUCIONARIO Examen UNI 2015 – II Física – Química D) 1,04×1015 A) 1 4 E) 2,04×1016 B) 1 3 Resolución 13 C) 1 2 Física moderna D) 3 4 h fo = f E) Efecto fotoeléctrico 4,14x10-15 fo = 4,3 4 3 fo = 1,04x1015 Resolución 12 Rpta.: 1,04x1015 Óptica Espejos Pregunta 14 q 150 I 50 F 50 C I = 50 i 200 A= I. 1 4 1 Rpta.: 4 Pregunta 13 Prohibida su venta Se hacen incidir fotones sobre una superficie de aluminio cuya función trabajo es de 4,3 eV. Calcula la frecuencia mínima del fotón incidente, en Hz, de modo que el aluminio emita fotoelectrones. (1 eV= 1,6×10–19 J, c= 3×108 m/s) La figura muestra una espira conductora en el plano xy. Un imán se encuentra frente a la espira, sobre el eje de la espira. Señala verdadero (V) o falso (F) según corresponda en las siguientes proposiciones, para un observador que está al lado del imán. h= Si el polo norte del imán se acerca a la espira, la corriente inducida en la espira es de sentido horario. II. Si el polo norte del imán se aleja de la espira, la corriente inducida en la espira es de sentido horario. III. Si ahora invertimos el imán, de modo que el polo sur del imán se acerca a la espira, la corriente inducida en la espira es de sentido horario. 6,62×10–34 J.s, y A) 0,74×1012 B) 0,84×1013 C) 0,94×1014 7 x www.trilce.edu.pe SOLUCIONARIO Examen UNI 2015 – II Física – Química A) V F V A) 100 B) F V V B) 200 C) F V F C) 250 D) V F F D) 300 E) F F V E) 350 Resolución 14 Resolución 15 Electromagnetismo Movimiento armónico simple Ley de Lenz Energía en el M.A.S. Graficando el movimiento oscilatorio V N Bex Bind x "V I x I) Antihorario... F V=0 P S Ek; U y I A P.E V=0 Bind Bex y x A V N A: amplitud II) Horario... V Ek: energía cinética U: energía potencial V En el M.A.S la energía S se conserva: Bind 1 (1) 102 + U 2 ( EM = 50 + U... 1 & EM = Ek + U = y x I Por dato: U=4Ek=4(50) & U = 200J III) Horario... V Rpta.: F V V Reemplazo en 1 ` EM = 250J Pregunta 15 Rpta.: 250 Un bloque de masa m= 1 kg oscila sin fricción sobre una mesa horizontal. En el instante en que la energía potencial del bloque es cuatro veces su energía cinética, su rapidez es v= 10 m/s. Calcula la energía mecánica total, en joules, del bloque durante su oscilación. Pregunta 16 En relación a la dilatación de los sólidos, se dan las siguientes proposiciones: I. La relación de variación de volumen V= Vo(1+γ∆T) es válida para cualquier intervalo de temperatura. www.trilce.edu.pe 8 Prohibida su venta Bex SOLUCIONARIO Examen UNI 2015 – II Física – Química II. El coeficiente de dilatación volumétrica γ es aproximadamente dos veces que el coeficiente de dilatación lineal. III. Si el cambio de temperatura está dado en ° C, entonces el cambio de longitud puede estar dado en metros. Resolución 17 Termodinámica Ciclo de Carnot K Son correctas: T1 = 327 + 273 = 600K T2 = 127 + 273 = 400K A) I B) II C) III T1=600K D) I y II Wx E) I y III K T2=400K Resolución 16 Fenómenos térmicos De donde Dilatación térmica Wx: trabajo realizado por el gas en un proceso adiabático I. Para intervalos de temperaturas grandes, el coeficiente de dilatación cúbica (γ) varía con la temperatura. II. γ ≅ 3a. III. La variación de longitud puede estar en cualquier unidad de longitud. Rpta.: Solo III Pregunta 17 Prohibida su venta Dos moles de gas helio monoatómico desarrollan el ciclo de Carnot entre dos focos térmicos, uno de 327° C y el otro a 127° C. Calcula (en joules) el trabajo que el gas realiza durante la expansión adiabática. R= 8,31 J/mol.K P2 V2 − P, V, ..... (1) 1−c donde c : coeficiente adiabático Wx = Cp ... (2) Cv como el gas es monoatómico c= 3 5 = & Cv = R y Cp R 2 2 5 En 2 c = 3 Wx = n.RT2 − nRT1 nR9T En 1 = 1−c 1-c 2 (8, 31) (− 200) Wx = 5 1− 3 ` Wx = 4986, 00J A) 24,93 Rpta.: 4986,00 B) 41,55 C) 342,62 D) 784,13 E) 4 986,00 9 www.trilce.edu.pe SOLUCIONARIO Examen UNI 2015 – II Física – Química Pregunta 18 Caso 2 Q Cuatro partículas cargadas idénticamente se colocan en los vértices de un cuadrado de lado igual a 2 m, tal que en el centro el potencial eléctrico es Vo. Calcula el potencial eléctrico en el punto medio de uno de los lados del cuadrado. 2m Q 5 m 1m P 5 m 1m A) Vo(1+2 5 )/ 2 Q B) Vo(2+ 5 )/ 10 Q 2m C) Vo(1+ 5 )/ 2 5 de donde nos piden Vp: potencial eléctrico en “P” D) Vo(1+ 5 )/ 5 2 ( Vp = E) Vo(1+ 5 )/ 10 2KQ + 2KQ 1 5 ∴ Vp = Vo (1 + 5 ) / 10 Resolución 18 Rpta.: Vo (1 + 5 ) / 10 Electrostática Potencial eléctrico Pregunta 19 Caso 1 Q 2m 2 m En el circuito que se muestra, calcula la potencia en la batería de 3 V (en W). Q 2W 2 m O 2 m 6V 2 m 4V 3V Q Q Vo : potencial eléctrico en el centro del cuadrado 4KQ 2 V ( o = KQ ........ (1) 2 2 Prohibida su venta 4W En la figura Luego: Vo = 2W A) 0,30 B) 0,38 C) 4,80 D) 5,20 E) 9,90 www.trilce.edu.pe 10 SOLUCIONARIO Examen UNI 2015 – II Física – Química Resolución 19 A) 0 ti + 0 tj +0 kt B) ti + tj +0 kt Electrodinámica C) ti + tj + kt D) –6 ti +6 tj –2 kt Circuitos eléctricos 2W 2W + 6V - + - I1 I2 3V E) 0 ti + 0 tj –2 kt 4V + Resolución 20 Electromagnetismo Fuerza magnética 4W y Aplicamos SVMALLA= 0 I. 6–2I1–2(I1–I2)–3= 0 3= 4I1-2I2... 1 B = _ i + j iT II. 4–4I2+3-2(I2–I1)= 0 x 7=6I2-2I1... 2 I=2A Resolviendo 1 y 2 ⇒I1= 1,6A y I2= 1,7A z ⇒Px= VI= 3(I2–I1) ∴Px= 0,3 w Rpta.: 0,30 Como la espira es cerrada ∴ FM = 0 i + 0 j + 0k Rpta.: 0 ti + 0tj + 0kt Pregunta 20 Por la espira de la figura circula una corriente de 2 A y está ubicada en una región de campo magnético constante B= ( ti + tj )T. Calcula la fuerza magnética total sobre la espira, en N. y 2m Prohibida su venta B = _ti + tji T QUÍMICA Pregunta 21 Se han planteado varias definiciones de ácidos y bases. Al respecto, señala la alternativa que presenta la secuencia correcta, luego de determinar si la proposición es verdadera (V) o falsa (F). Números atómicos: H= 1; B= 5; N= 7; F= 9 1m z 11 3m I=2A x I. El ión NH4+ es un ácido de BronstedLowry. II. El BF3 es una base de Lewis. III. De acuerdo a la definición de Arrhenius, el agua se comporta como ácido o como base. www.trilce.edu.pe SOLUCIONARIO Examen UNI 2015 – II Física – Química A) F F V A) 0,9 B) F V F B) 1,7 C) V F F C) 3,4 D) V F V D) 4,3 E) V V V E) 5,1 Resolución 21 Resolución 22 Ácido - Base Estequiometría Teorías ácido base Brousted Estequiometría de soluciones I. Hallando moles de NaOH: Según la teoría Bromsted-Lowry nNaOH + = 6 = ( n 0, 3 mol NH3 + H2 O ? NH4 + OH − 0, 05 ácido base base ácido 1Cl2 + 2NaOH ⇒ NaClO + NaCl + H2O conjugado conjugado 1 mol ⇒ 2 mol II. Teoría Lewis F c H base H F x = 0,15 mol a C.N B F "H N " B F F ácido H F 1 mol ⇒ 22,4 L 0,15 mol ⇒ x III. La teoría de Amhenius está sustentada en el estudio de la conductividad de las soluciones acuosas, por lo tanto no asignaba un carácter de ácido o base al agua. Rpta.: V F F Pregunta 22 Numerosos blanqueadores de lavandería utilizan el hipoclorito de sodio como ingrediente activo. Para prepararlo, se agregan al reactor 50 mL de hidróxido de sodio 6 M y luego se hace burbujear cloro gaseoso por un espacio de 10 minutos, obteniéndose todo el NaC , O posible. ¿Qué volumen (en L) de gas cloro, medido a condiciones normales, se consumió? C, 2(g)+2NaOH(ac) → NaC, O(ac)+NaC, (ac)+H2O( , ) ∴ x = 3,36 litros Rpta.: 3,4 Litros Pregunta 23 Dos líquidos, X e Y, se dejan caer a través del mismo tipo de gotero y con la misma inclinación. ¿Cuáles de los siguientes casos, independientes entre sí, explican las formas diferentes de las gotas? X I. Y El líquido X tiene mayor tensión superficial que el líquido Y. II. El líquido Y tiene una mayor viscosidad que el líquido X. www.trilce.edu.pe 12 Prohibida su venta H H N x ⇒ 0,3 mol SOLUCIONARIO Examen UNI 2015 – II Física – Química III. El líquido X podría ser agua (H2O) mientras que el líquido Y podría ser hexano (CH3CH2CH2CH2CH2CH3) A) solo II B) solo III C) I y II D) I y III A) Solo I E) II y III B) Solo II C) Solo III Resolución 24 D) I y III Ácidos y bases E) II y III Equilibrio iónico A2(g) + B2 2AB Resolución 23 Enlace químico I. (F) Keq no varía Fuerzas intermoleculares I. El líquido “x” muestra mayor intensidad de fuerzas intermoleculares, por lo cual presenta mayor tensión superficial. II. Según la forma de la gota del líquido “y”, las fuerzas intermoleculares son menos intensas. III. Por la forma de la gota del líquido “x”, podemos inferir que es una sustancia más polar, como el agua por ejemplo. ∆n=(2)-(1+1)=0 II. (F) A2 + B2 2AB Kc=4 o Como: Kp=Kc(RT)∆n 0,5Co 0,5Co Co Kp=4(RT)o 0,5Co 0,5Co Co Kp=4 Co ∆H<0 Co III. (V)Como es exotérmica al aumentar la temperatura, la reacción se desplaza en forma inversa. Rpta.: solo III Rpta.: I y III Pregunta 25 Pregunta 24 La siguiente reacción en equilibrio ocurre en un recipiente cerrado de volumen V a una temperatura T: Prohibida su venta A2(g)+B2(g) E 2AB(g) ∆H<0 Indica cuáles de las siguientes proposiciones son correctas: I. Si se duplica el volumen del recipiente, la constante Kc también se duplica. II. Si el grado de reacción es 0,5 y las concentraciones iniciales de A2 y B2 son Co, entonces Kp= 2. Se tienen 200 g de un mineral que contiene FeS. Para conocer su contenido de FeS, se hace reaccionar con HC , (ac) según: FeS(s)+2HC , (ac) → FeC , 2(ac)+H2S(g) Si la reacción tuvo una eficiencia del 80% y se obtuvieron 18,6 litros de H2S a las condiciones de 2 atm y 40° C, ¿cuál es el contenido de FeS en el mineral (en %)? Masa atómica del Fe= 56, S= 32 R = 0, 082 III. Si se duplica la temperatura, el equilibrio se desplaza a la izquierda. 13 www.trilce.edu.pe atm L mol K SOLUCIONARIO Examen UNI 2015 – II Física – Química A) 18,1 Se observó que las celdas obedecen esencialmente las mismas leyes que las celdas galvánicas formales. Además: B) 32,6 C) 63,8 D) 79,7 i. E) 83,8 Cuando se usan electrodos de Zn y Cu, el Zn se oxida. Resolución 25 ii. Cuando se usan electrodos de Zn y Pb, el Pb se reduce, Estequiometría iii. Cuando se usan electrodos de Pb y Cu, el Pb se oxida. Pureza Al respecto, ¿cuáles de proposiciones son correctas? Muestra 200 g (mineral): FeS(s)+2HC, (ac) → FeC, 2(ac)+H2S(g) 1,8mol 1,81mol I. 159gFeS las siguientes El líquido en el interior de los productos usados actúa como solución electrolítica. II. Solo pueden determinarse los potenciales de reducción de 2 metales. Hallando moles de H2S: 2×18,6= 0,082×313×n De la eficiencia: III. El potencial de oxidación de la serie de metales usados es Zn > Pb > Cu 80 n = 1, 44ml x 100 1 4 44 2 444 3 A) Solo I Sacando el porcentaje: C) Solo III 200 g → 100% D) I y II 159 g → x E) I, II y III B) Solo II 1, 81mol H2 S ∴ x= 79,7% Rpta.: 79,7 Resolución 26 Electroquímica Celdas galváneas Un habilidoso joven logra construir una pila galvánica usando naranjas, tomates o papas, logrando medir los potenciales obtenidos de acuerdo al siguiente esquema: vegetal I. electrodo 1 electrodo 2 electrodo 1 (V) Sirve de medio de conducción eléctrica. II. (V) A partir de un potencial, se puede determinar los otros dos. electrodo 2 vegetal III. (V) Por las características mencionadas voltímetro Zn > Pb > Cu www.trilce.edu.pe Rpta.: I, II y III 14 Prohibida su venta Pregunta 26 SOLUCIONARIO Examen UNI 2015 – II Física – Química Pregunta 27 proposiciones corresponden a métodos para una debida protección del hierro para su uso industrial? El plomo en el cuerpo causa graves transtornos conocidos como saturnismo. ¿Cuánto plomo (en mg) es ingerido por una persona que bebe 1 000 mL de agua diariamente durante 5 años, si el agua proviene de un depósito artesanal de cerámica decorada con pigmentos de “amarillo de cromo” (PbCrO4) que ha saturado el agua contenida en él? I. II. Cubrirlo con una delgada capa de otro metal, como el cobre, para evitar la formación del óxido. 1 año= 365 días. III. Conectándolo adecuadamente a una pieza de cinc o magnesio, que se oxida más fácilmente y convierta al hierro en “zona catódica”. Solubilidad de PbCrO4 en agua a temperatura ambiental= 1,34×10–7 mol L Masa molar del Pb= 207,2 g/mol 2 B) 30,40 A) Solo I C) 40,54 B) Solo II D) 50,67 C) Solo III E) 60,80 D) I y III Resolución 27 E) I, II y III Unidades químicas de masa Resolución 28 Mol 1000 mL 1L 5 años × 365 días × agua × × 1 año 1 día 1000 mL Prohibida su venta × 2 E°: Fe +/Fe = − 0, 44V ; Zn +/Zn = − 0, 76V ; 2 2 Cu +/Cu = + 0, 34V ; Mg +/Mg = − 2, 37V A) 20,27 1,34 × Alearlo con determinados metales como el cromo y níquel, para convertirlo en un material muy resistente a la corrosión. 10-7mol 207,2 g PbCrO4 Pb 1mg × × 1 mol 10-3g 1L PbCrO4 = 50,67 mg de Pb Rpta.: 50,67 Electroquímica Celdas galvánicas I. (V)El cromo, níquel y manganeso sirven en aleación para formar mezclas anticorrosivas. II. (F)Como: Fe/Fe+2 Cu/Cu+2 eº=+0,44V eº=-0,34V y foox > foox , entonces Fe se oxida Fe Cu III. (V)Como: foox > foox y Eoox > foox zn Pregunta 28 El hierro es el metal de mayor uso industrial, pero también es uno que se corroe muy fácilmente. Por ello, debe protegerse de la corrosión. ¿Cuáles de las siguientes 15 www.trilce.edu.pe Fe Mg Fe Rpta.: I y III SOLUCIONARIO Examen UNI 2015 – II Física – Química Pregunta 29 Pregunta 30 Tomando en cuenta el concepto de isomería y con respecto a los siguientes compuestos: En relación a los principales problemas ambientales globales, ¿cuáles de las siguientes proposiciones son correctas? 1. C2H5 COOH I. 2. CH3CH2OH 3. H2C = CHCl ¿Cuáles de las siguientes proposiciones son correctas? I. Los clorofluorocarbonos son los principales responsables de la contaminación ambiental por smog fotoquímico. II. La lluvia ácida es un fenómeno que se produce principalmente por la emisión de gases de efecto invernadero provenientes de los vehículos automotores y su reacción con el agua del ambiente. El compuesto 1 presenta isomería geométrica. II. El CH3 — O — CH3 y el compuesto 2 son isómeros de función. III. El compuesto 3 presenta isomería geométrica III. Los desperdicios industriales calientes, descargados a las corrientes de agua, producen contaminación térmica. A) Solo I B) Solo II A) Solo I C) Solo III B) Solo II D) I y II C) Solo III E) II y III D) I y II E) I y III Resolución 29 Resolución 30 Química orgánica Contaminación ambiental Isomería Lluvia ácida y efecto invernadero (F)I. CH3 — CH2 — C I. (V)II. CH3 — CH2 — OH (ALCOHOL) II. (F)Los gases de invernadero no son responsables de la lluvia ácida. OH No tiene isomería geométrica. y CH3 — O — CH3 (F)Los CFC son responsables destrucción de la capa de ozono. de la III. (V)La alteración de la temperatura produce contaminación térmica. (ETER) Son isómeros de función. Rpta.: Solo III H H (F)III. C C H Cl No tiene isomería geométrica. Rpta.: Solo II www.trilce.edu.pe 16 Prohibida su venta O SOLUCIONARIO Examen UNI 2015 – II Física – Química Pregunta 31 C) solo III D) I y III Dados los siguientes fenómenos, ¿cuáles de ellos son físicos? I. El ciclo del agua en la naturaleza. E) II y III Resolución 32 II. Transformación de energía mecánica en energía eléctrica. Átomo III. Aumento de la acidez de las aguas de un río por efecto de la lluvia ácida. 25 12 X Especies atómicas I. A) Solo I 26 y 12 W (V) poseen igual Z y diferente A. Son isótopos B) Solo II II. (F) suma de A= 25+26= 51 C) Solo III III. (V) son átomos neutros p+= e–= Z Rpta.: I y III D) I y II E) I, II y III Pregunta 33 Resolución 31 Materia Fenómenos I. El ciclo del agua en la naturaleza es físico, todo cambio de estado es físico. II. Transformación de energía mecánica en energía eléctrica, es fenómeno físico. III. Aumento de la acidez de las aguas de un río por efecto de la lluvia ácida, es fenómeno químico. Rpta.: I y II Prohibida su venta Dadas las siguientes proposiciones formuladas en base a lo ocurrido, ¿cuáles son correctas? Relación de densidades= 26 Dados los núclidos siguientes, 25 12 X y 12 W , ¿cuáles de las siguientes proposiciones son correctas? Son isótopos entre sí. II. La suma de sus números de masa es 50. III. Los átomos neutros, en ambos casos, tendrán 12 electrones. 4 PH 2O = 1,59 Números atómicos: H= 1; C= 6; O= 8; Cl= 17 I. El tetracloruro de carbono es apolar. III. Las fuerzas intermoleculares en la fase líquida inferior son del tipo dispersión de London. A) Solo I B) Solo II C) I y II D) II y III E) I y III A) solo I B) I y II 17 PCC, II. Las fuerzas intermoleculares en la fase líquida superior son del tipo dipolo instantáneo-dipolo inducido. Pregunta 32 I. Al agregar cuidadosamente 5 mL de CC , 4 a 20 mL de agua colocada en un tubo de ensayo, se observan dos fases líquidas. www.trilce.edu.pe SOLUCIONARIO Examen UNI 2015 – II Física – Química Resolución 33 Resolución 34 Enlace químico Unidades químicas de masa Fuerzas intermoleculares Pureza de una muestra En el recipiente: Muestra de montroidita mtotal= 13,5g H2O HgO Impureza CCl4 DATO: 80% CCl4 apolar 20% Por tanto: masaHgO= 0,8×13,5g= 10,8 g II. Fase líquida superior: H2O→Enlace puente de hidrógeno III. Fase líquida inferior: Cálculo de la masa de mercurio (Hg): 10, 8gHgO # CCl4→Dispersión de London 200, 6gHg = 10gHg 216, 6gHgO Rpta.: 10,0 Rpta.: I y III Pregunta 35 Pregunta 34 Joseph Priestley descubrió el oxígeno en 1772 al someter a calentamiento una muestra de montroidita, un mineral que contiene óxido de mercurio (II). Este óxido se descompone en oxígeno gaseoso y mercurio metálico. A partir de 13,5 g de montroidita, que contiene 80 % de óxido de mercurio (II), ¿qué masa de mercurio metálico (en g) puede obtenerse? Masas atómicas: Hg= 200,6; O= 16 A) 4,0 B) 5,5 C) 7,0 D) 8,5 E) 10,0 Se tienen 10,50 g de una muestra que contiene CaCO3 e impurezas inertes. La muestra se calienta y se descompone todo el carbonato de calcio presente, de acuerdo a la siguiente ecuación: CaCO3(s) —› CaO(s) + CO2(g) Después del calentamiento se obtuvo un residuo sólido de masa final 7,64 g. ¿Qué porcentaje (%) de la muestra original es CaCO3? Masa molar (g/mol): CO2= 44; CaO= 56; CaCO3= 100 A) 50,5 B) 57,2 C) 61,9 D) 72,8 E) 83,7 www.trilce.edu.pe 18 Prohibida su venta I. SOLUCIONARIO Examen UNI 2015 – II Física – Química Resolución 35 A) F V V Estequiometría B) V F V C) V F F Pureza de reactivos D) F V F mTotal= 10,5 g= mCaCO3–mImp E) F F V Impureza Resolución 36 CaCO3 inerte Equilibrio Químico En la reacción: CaCO3(s) 1mol<>100 g Dato: (10,5 g-mI) Hibridación → CaO(s)+CO2(g) 1mol<>56 g (7,64 g–mI) Cianuro de Hidrógeno: H–CN I. Ángulo 180º (molécula Lineal) II. Molécula polar III. Hibridación para el nitrógeno: Por estequiometría (Ley de Proust) 10, 5g − mI 7, 64g − mI = 56g 100g H–C ∴mimpureza= 4 g Rpta.: F V V mCaCO3= 6,5 g → %CaCO3 = 6, 5g # 10, 5g 100 Rpta.: 61,9 Si la disposición de átomos en el cianuro de hidrógeno es H C N, señala la alternativa que presenta la secuencia correcta, después de determinar si la proposición es verdadera (V) o falsa (F). Prohibida su venta Pregunta 37 Una sal de ácido orgánico NaA es totalmente soluble en agua. El anión A–, en contacto con el agua, reacciona según: Pregunta 36 I. % El ángulo de enlace HCN es 120°, aproximadamente. II. La molécula es polar. III. El nitrógeno tiene hibridación sp. Números atómicos: H= 1; C= 6; N= 7 Electronegatividades: H= 2,1; C= 2,5; N= 3,0 A–(ac)+H2O( , ) E HA(ac)+–OH(ac) ¿Cuál es el pH de una solución 0,1 M de NaA? Ten en cuenta que: AH(ac) E H+(ac)+ A–(ac)Ka= 2,5×10–6 H2O( , ) E H+(ac)+–OH(ac)Kw= 1,0×10–14 log 2= 0,31 A) 4,69 B) 6,69 C) 7,31 D) 9,31 E) 10,00 19 N SP www.trilce.edu.pe SOLUCIONARIO Examen UNI 2015 – II Física – Química Resolución 37 Resolución 38 Ácido-base Electroquímica Equilibrio-iónico AH E H+A– Electrólisis Ka= 2,510–6 1 -14 10 OH–+H+ E H2O ______________ K= AH+OH– E A–+H2O K’= 2.5.108 Se invierte A–+H2OE AH+OH– K’’= 4.10–9 0,1 2 -x x x → x = 4.10–9 0, 1 - x x x 0 , 1 - x # eq - g Mg2+= # Faraday masa de Mg = # Faraday meq 1, 2 g = # Faraday= 0,1F 12 eq − g/g 0,1 F× 96500C = 9 650C 1F Rpta.: 9 650 x= 2,10–5 ⇒ pOH= –LOG210–5 pOH= 4,69 ∴pH= 9,31 Rpta.: 9,31 Pregunta 38 El magnesio metálico se produce industrialmente por electrólisis de sus sales fundidas. ¿Cuántos coulombs se requieren para obtener 1,2 g de magnesio metálico a partir de MgC , 2( , )? Masa molar Mg = 24 g/mol A) 1 930 B) 4 825 Prohibida su venta C) 9 650 D) 19 300 E) 96 500 www.trilce.edu.pe 20 SOLUCIONARIO Examen UNI 2015 – II Física – Química Pregunta 39 Pregunta 40 Con respecto al compuesto FeSO4, indica la alternativa que presenta la secuencia correcta luego de determinar si la proposición es verdadera (V) o falsa (F): I. Es una sal oxisal. La Tabla Periódica es un esquema gráfico que ordena los elementos y nos permite predecir algunas regularidades. Al respecto, ordena los elementos de números atómicos 8; 11; 15 y 19, según sus radios atómicos crecientes. II. El estado de oxidación del azufre es +6. A) 8; 15; 11; 19 III. Es el sulfato férrico. B) 8; 15; 19; 11 C) 19; 15; 11; 8 A) V V V D) 8; 11; 19; 15 B) V V F E) 19; 8; 11;15 C) V F F D) F V V Resolución 40 E) F F F Tabla periódica Propiedades periódicas Resolución 39 Nomenclatura inorgánica Sales I. (V) El FeSO4 es una sal oxisal 15P II. (V) El SO42– ion sulfato x -2 x–8= –2 (SO4 )2- 11Na x= +6 (E. O. del azufre) III. (F) El Fe2+ es el ion ferroso, por lo cual la sal es sulfato ferroso. Rpta.: V V F 19K R.A. 8O radio atómico ∴ Según los radios atómicos crecientes: 8; 15; 11; 19 Prohibida su venta Rpta.: 8; 15; 11; 19 21 www.trilce.edu.pe



