academia interescolar de química guía de estudio para química i
Anuncio
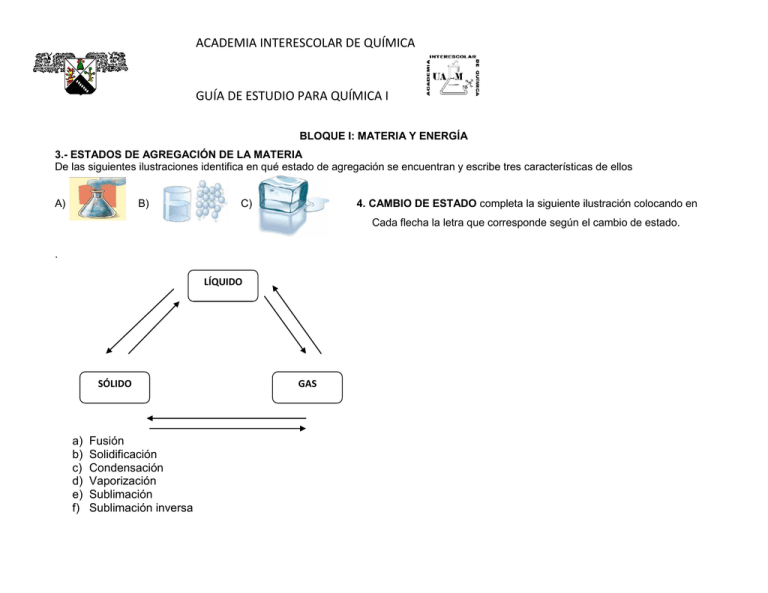
ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I BLOQUE I: MATERIA Y ENERGÍA 3.- ESTADOS DE AGREGACIÓN DE LA MATERIA De las siguientes ilustraciones identifica en qué estado de agregación se encuentran y escribe tres características de ellos A) B) C) 4. CAMBIO DE ESTADO completa la siguiente ilustración colocando en Cada flecha la letra que corresponde según el cambio de estado. . LÍQUIDO SÓLIDO a) b) c) d) e) f) Fusión Solidificación Condensación Vaporización Sublimación Sublimación inversa GAS ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I a) d) 6.- TIPOS DE ENERGÍA: Identifica en las siguientes ilustraciones, el tipo de energía que se presenta: b) c) e) f) 7.- PROPIEDADES DE LA MATERIA (GENERALES Y ESPECÍFICAS) Generales: Son aquellas que presenta todo cuerpo material sin excepción y al margen de su estado físico, entre ellas son: masa, volumen, peso, extensión, impenetrabilidad, inercia, divisibilidad y elasticidad. Actividad: Desarrolla en qué consiste cada una de ellas. ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I Especificas: Son las propiedades peculiares que caracterizan a cada tipo de materia permiten su diferencia con otras y su identificación; algunas de ellas son: maleabilidad, densidad, viscosidad, explosividad, dureza, ductibilidad, color, brillo, olor, tenacidad. Actividad: Menciona en qué consiste cada una de ellas. 8.- FENOMENOS FÍSICOS Y QUÍMICOS Fenómeno físico: Ocurre cuando la sustancia realiza un proceso o cambio sin perder sus propiedades y características, es decir, sin modificar su naturaleza. Por ejemplo: ruptura de un vaso de vidrio, doblado de un clavo, congelamiento del agua, formación de las nubes, rotación de la tierra, la lluvia, la formación del arcoíris, estiramiento de una liga, movimiento de las aspas de un ventilador. Fenómeno químico: Ocurre cuando la sustancia se transforma en otra nueva, de distinta naturaleza y no puede regresar a su estado natural. Por ejemplo: la oxidación del hierro, la respiración, encender un cerillo, el proceso de digestión, la cocción de alimentos, la descomposición de los alimentos, quema de basura, combustión de hidrocarburos. 9. CLASIFICACIÓN DE LA MATERIA: Elemento: Sustancia simple de sustitución definida, todos los átomos del mismo elemento tienen el mismo número de protones, actualmente existen 118 elementos químicos. Compuesto: Sustancia de composición definida, formada por dos o más elementos. Ejemplos: cloruro de sodio (sal), agua, sacarosa. Mezcla: Sistema material formado por dos o más componentes reunidos pero no combinados químicamente. En una mezcla no ocurre una reacción química y cada uno de sus componentes mantiene su identidad y propiedades. Existen dos tipos de mezclas Homogénea: Sustancia uniforme en todas sus partes, físicamente no se notan los elementos y compuestos que la integran. Ejemplos: aire, productos de limpieza, jabones líquidos, shampo, refrescos, licores, leche, pinturas vinílicas, etc. Heterogénea: Sustancia de constitución variable, físicamente se detectan sus componentes. 10. MÉTODOS DE SEPARACIÓN DE MEZCLAS: Relaciona las columnas anotando la letra que corresponda a cada descripción del método señalado: A) Consiste en separar materiales con distinta densidad. Se fundamenta que el material ( ) Evaporación y destilación más denso, al tener mayor masa por unidad de volumen, permanecerá en la parte inferior del envase. ( ) Cristalización B) Consiste en calentar la mezcla hasta el punto de ebullición de uno de los componentes, y dejarlos hervir hasta que se evapore totalmente. Los otros componentes quedan en el ( ) Filtración envase. Posteriormente condensar el vapor. C) Este método se fundamenta en que algunos de los componentes de la mezcla no es ( ) Decantación soluble en el otro. Se pasa la mezcla través de una placa porosa o un filtro, el sólido se queda en la superficie del filtro mientras que el líquido atraviesa.. D) Método que se inicia con la preparación de una solución saturada a cierta temperatura, con la mezcla se desea separar los componentes a partir de formación de cristales en un baño de hielo ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I BLOQUE II. ESTRUCTURA DE LA MATERIA ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I Gracias a los estudios realizados con descargas eléctricas en gases contenidos en tubos, se descubrió que el átomo está constituido esencialmente por tres partículas subatómicas: electrón, protón y neutrón, que presentan características diferentes. Escribe las características de cada una e indica con qué parámetros se relaciona. (Número atómico y número de masa). PARTÍCULA LOCALIZACIÓN CARGA PARÁMETRO PROPIEDAD CON LA QUE SE RELACIONA Descubierto por… Protón Neutrón Electrón 2.5 NUMEROS CUANTICOS Los números cuánticos aparecen en las soluciones de la ecuación de Schrödinger. Cada electrón posee 4 números cuánticos en virtud de su posición, por tanto según el principio de exclusión de Pauli no puede haber 2 electrones con los cuatro números cuánticos iguales dentro del átomo, estos son: n, l, m, s. Número cuántico n. El número cuántico principal determina el tamaño de las órbitas, por tanto, la distancia al núcleo de un electrón vendrá determinada por este número cuántico. Su valor puede ser cualquier número natural mayor que 0 (1, 2, 3...) Para calcular el número máximo de electrones que acepta cada nivel se calcula con la fórmula 2n donde "n" es el nivel. El valor de "n" determina el volumen efectivo. Nivel 1 21=2 Nivel 2 Nivel 3 23=8 Nivel 4 24=32 22=4 Numero cuántico l. El número cuántico azimutal determina el subnivel y se relaciona con la forma del orbital. Cada nivel energético ( n ) tiene "n" subniveles. Se designa con números que van de cero a n-1, los cuales se identifican con las letras s, p, d, f. SUBNIVEL (NÚMERO ASIGNADO) LETRA 1 l=0 s 2 l=0 l=1 s p 3 l=0 l=1 l=2 s p d NIVEL NIVEL 4 SUBNIVEL LETRA l=0 l=1 l=2 l=3 s p d f ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I Número cuántico m. El número cuántico magnético determina la orientación espacial de las órbitas. Se designa con números que van de -l a + l pasando por cero. Representa el número de orbitales presentes en un subnivel Cada orbital acepta un máximo de 2 electrones. Número de orbitales Número de Valor de l Valores de m electrones 0 s 1 2 0 1 p 3 6 -1, 0, +1 2 d 5 10 -2, -1, 0, +1, +2 3 f 7 14 -3, -2, -1, 0, +1, +2, +3 Número cuántico spin (ms) Cada electrón, en un orbital, gira sobre sí mismo. Este giro puede ser en el mismo sentido que el de su movimiento orbital o en sentido contrario. Se relaciona con el giro del electrón sobre su propio eje. Al estar juntos en un mismo orbital, un electrón gira hacia la derecha y otro hacia la izquierda. Se le asignan números fraccionarios: -1/2 y +1/2. 2.6 CONFIGURACIÓN ELECTRONICA Cada uno de los subniveles con su respectivo nivel principal de energía, tiene diferente energía. Los subniveles están ordenados de acuerdo con su incremento de energía en la siguiente lista (el símbolo < se lee "menor que".) 1s < 2s < 2p < 3s < 3p < 4s < 3d <4p < 5s < 4d < 5p < 6s < 4f < 5d… ejemplo. 30 Zn: 1s , 2s , 2p ,3s , 3p , 4s , 3d ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I A partir de la configuración electrónica condensada, nosotros podemos obtener los siguientes datos: a) Nivel de energía más externo: Es el último nivel, por tanto está representado por el coeficiente más alto. (Periodo de la tabla periódica) b) Último subnivel que se forma: Es el subnivel en el cual termina la configuración. (Bloque de la tabla periódica) c) Electrones de valencia: Número de electrones presentes en el último nivel. Para elementos que terminan en s o p indica la familia. Ejemplo: 14 Si: 1s , 2s , 2p ,3s , 3p a) Nivel de energía más externo: 3, el elemento se encuentra en el tercer periodo de la tabla periódica b) Último subnivel que se forma: p, se localiza en el bloque “p” de la tabla c) Electrones de valencia: 2 + 2 = 4, pertenece a la familia IV A o 14. Completa la siguiente tabla indicando el periodo, bloque y familia para los siguientes elementos. Periodo Bloque Realiza las siguientes configuraciones electrónicas y completa la tabla 33 As 56 Ba Familia ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I 1 2 3 4 5 6 7 8 9 Grupo IA II A III B IV B VB VI B VII B VIII B IX B Familia Metales alcalinos Metales alcalinotérreos Del Escandio Del Titanio Del Vanadio Del Cromo Del Manganeso Del Hierro Del Cobalto Grupo 10 11 12 13 14 15 16 17 18 XB IB II B III A IV A VA VI A VII A VIII A Familia Del Níquel Del Cobre Del Zinc Térreos Carbonoides o del Carbono Nitrogenoides o del Nitrógeno Anfígenos o Calcógenos o del Oxígeno Halógenos Gases nobles ó raros ó inertes Las Clases son elementos que por sus propiedades se agrupan en 4 en la tabla periódica y son las siguientes: a) Metales ligeros: Que están formados por el grupo I y II A b) Metales de Transición: Elementos del grupo B (I, II, III, IV, V, VI, VII y VIII) c) No metales Incluye a los grupos IIIA, IVA, VA, VIA, VIIA y gases nobles d) Metales de transición interna: Serie de lantánidos y actínidos De acuerdo con el comportamiento común que presentan entre si algunos elementos, se clasifican en metales, no metales y semimetales presentando las siguientes características: METALES *Conducir con facilidad el calor y la electricidad *Son dúctiles (se pueden formar alambres con ellos) y maleables, (pueden laminarse para formar placas). NO METALES *No conducir la electricidad (a excepción del carbono, bajo la forma de grafito). *Buenos aislantes térmicos, excepto el carbono en forma de diamante. *No tienen brillo metálico, son quebradizos; SEMI - METALES *Las propiedades que manifiestan tanto los metales como los no metales, no hay una clara diferenciación entre ellos, pues algunos no metales como él silicio (Si) y arsénico(As) y algunos metales como el ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I *Tienen brillo metálico o gris plateado, excepto cobre y oro *La mayoría son sólidos, a excepción del Mercurio, Galio, Cesio y Francio, que se funden en la mano con protección *El estado sólido se caracteriza por enlace metálico *Presentan tendencia a ser electropositivos y al reaccionar con el oxígeno forman óxidos. *Forman cationes perdiendo electrones *Forman compuestos iónicos con los no metales *Energías de ionización bajas *Los metales alcalinos y/o ligeros (a excepción de H y He). Debido a su gran actividad química, no se encentran libres en la naturaleza sino formando sales; pierden con facilidad sus electrones y, por lo tanto, se oxidan fácilmente y son buenos reductores, tienden a formar iones positivos. Se les puede obtener por electrólisis. Presentan alta tendencia a unirse por electrovalencia. no presentan ductibilidad ni maleabilidad, al reaccionar con el oxígeno forman anhídridos. En general tienden a ganar electrones. *Presentan estados sólidos, líquidos y gaseosos. *Energías de ionización altas. *Afinidades electronegativas muy negativas *Forman aniones ganando electrones. *Los no metales de los grupos III, V, VI y VII (exceptuando al Hidrógeno y el Helio) presentan una configuración electrónica ns2, np1-6, ubicándoseles en el bloque “p”. * Los no metales que se encuentran en la tabla más próximos a los gases nobles presentan mayor tendencia a ganar electrones; son buenos oxidantes; tienden a ser ion negativo; al unirse entre ellos lo hacen por enlaces covalentes y con los metales por enlaces iónicos. germanio (Ge) y antimonio (Sb) conducen la electricidad en menor grado que los metales, pero mucho más que los no metales, por lo cual se les llama semimetales (se usan en la fabricación de semiconductores). * No se encuentran libres en la naturaleza sino bajo la forma de compuestos. PESO ATÓMICO. El peso atómico es una cantidad física adimensional definida como la razón de las masas promedio de los átomos de un elemento a 1/12 de la masa de un átomo de carbono, el concepto se utiliza generalmente para referirse al peso atómico. ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I La masa atómica es igual a la suma de los protones y los neutrones que están en el núcleo. Se representa con una letra A y es la cantidad de materia que contiene un átomo. Por tratarse de cantidades infinitamente pequeñas, este parámetro se estima en unidades relativas, denominada unidades de masa atómica (uma). Se basa en un valor arbitrario de exactamente 12 unidades de masa atómica para el 12C. Ejemplos: No. de masa El Z determina el número de protones o de electrones en un átomo neutro 1 H 26 Fe 79 Au MA = 1.00797 = 1 MA = 55.847 = 56 MA = 196.996 = 197 Ejemplo: 23 Na A=23 Z=11 p+=11 e-=11 nº=12 11 . NÚMERO ATOMICO Se representa por Z. Se define como el total de cargas positivas que tiene un átomo en el núcleo. El número atómico es igual a la cantidad de protones que están en el núcleo, que es igual al número de electrones del elemento que están en los orbitales. Se indica con un subíndice que precede al símbolo del elemento: Ejemplo: 2He Subíndice = Z Indica Z = 2 ACTIVIDAD: Llena los espacios vacios. Existen una gran cantidad de sustancias que empleamos diariamente, en ocasiones es importante conocer algunas de sus características, escribe en la línea el número atómico del elemento, así como el nombre del mismo, que corresponda a la pregunta en cuestión. 1.- Este elemento es el más abundante en el universo _______________________ 2.- Este metal noble es uno de los más preciados, su color es amarillo __________ 3.- Para la elaboración de algunos antiácidos se emplea el hidróxido de este elemento, también se ha empleado para la fabricación de utensilios de cocina y latas de refresco ______________________ 4.- Este metal se utiliza en el recubrimiento de piezas metálicas, haciéndolas más resistentes a la corrosión y dándoles un brillo argentino, con él se elabora el acero inoxidable _________________ 5.- La molécula de ácido nítrico, además de hidrógeno y nitrógeno contiene ___________________ 6.- Este metal se utiliza como aditivo en las gasolinas, con él se fabrican diversos pigmentos, su uso se ha reducido debido a su carácter tóxico __________________ 7.- La pólvora se elabora con la participación de este elemento, algunos de sus compuestos huelen muy feo. Se puede recolector, como elemento, en los volcanes ____________________________ ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I 8.- Este elemento forma parte del principio activo del Alka Seltzer, su nitrato se conoce como nitro de Chile. Es muy reactivo y explota cuando le agregas agua, el color de su flama es amarillo. ________ 9.- Es el único no metal líquido a la temperatura ambiente ____________________ 10.- La emisión de radiactividad es una característica de este elemento, se emplea en la generación de energía eléctrica. Se encuentra en el mineral pechblenda ______________________________ VALENCIA Y NÚMERO DE OXIDACIÓN. Valencia es la capacidad que tiene un átomo de un elemento para combinarse con los átomos de otros elementos y formar compuestos. En la tabla periódica se muestran las valencias más comunes de los elementos (observa que hay elementos que presentan una o más valencias). Número de oxidación: de acuerdo con la valencia que cada elemento presenta, el número de oxidación se considera como “la carga positiva o negativa, aparente o real, que adquiere un elemento al combinarse con otro”. Las principales reglas para establecer el número de oxidación de los elementos son: a. El número de oxidación del oxígeno es casi siempre 2 – b. El número de oxidación del hidrógeno, generalmente es igual a 1+. Excepto en los hidruros. c. Los metales siempre presentan números de oxidación positivos de acuerdo a su grupo en la T. P. d. Los no metales pueden tener números de oxidación positivos y negativos de acuerdo al elemento con que se combinan y al grupo que ocupa el elemento en la tabla periódica. Los números de oxidación que pueden tener algunos metales de transición son ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I Radio atómico: Es la medida de la mitad del diámetro de un átomo. Comportamiento: Aumenta al incrementarse el núm. atómico en un grupo de la tabla periódica y aumenta al disminuir el núm. atómico en un periodo. Afinidad electrónica: Es la energía que se libera cuando un átomo gaseoso capta un electrón, entre mayor energía se libere, mayor será la afinidad electrónica. Comportamiento: Aumenta de izquierda a derecha y de abajo hacia arriba. Ordena o contesta lo que se te indica: Energía de ionización: Es la energía necesaria que hay que suministrarle a un átomo (neutro) en estado gaseoso para arrancarle un electrón. Comportamiento: Aumenta de izquierda a derecha y de abajo hacia arriba. PROPIEDADES PERIÓDICAS Electronegatividad: Es la capacidad de un átomo para atraer los electrones de valencia de un enlace. Comportamiento: Aumenta de izquierda a derecha y de abajo hacia arriba. Número de oxidación: Es el número de electrones que gana o pierde un elemento cuando se combina para adquirir la configuración de un gas noble inmediato. Comportamiento: De arriba hacia abajo y de derecha a izquierda se pierden electrones. De abajo hacia arriba y de izquierda a derecha se ganan electrones. Punto de fusión: Es la temperatura necesaria para cambiar de sólido a líquido. Punto de ebullición: Es la temperatura necesaria para cambiar de líquido a gaseoso. Comportamiento: en los metales aumentan en un grupo de abajo hacia arriba, pero en los no metales aumentan de arriba hacia abajo. ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I Anota una (M) si las propiedades señaladas a continuación, pertenecen a un elemento metálico; o bien, una (NM) si se trata de la propiedad de un No metal. Relaciona la siguiente sopa de letras con los conceptos que se te preguntan, sombrea la palabra en el cuadro y además anota la respuesta sobre la línea. ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I ENLACE QUÍMICO Definición: Unión de dos o más átomos para formar moléculas Clasificación 1. Enlaces intramoleculares o interatómicos: forma en que se 2. Enlaces intermoleculares: forma de cómo interactúan las unen los átomos para formar moléculas moléculas a) Enlace iónico a) Puentes de Hidrógeno b) Enlace covalente b) Fuerzas de Van der Waals Son de naturaleza No polar electrostática, es decir que implican atracciones entre especies + y – Polar Ión-dipolo Coordinado Dipolo-dipolo c) Metálico Fuerzas de dispersión de London ENLACES INTRAMOLECULARES (completa la tabla) Tipo enlace de Descripción Iónico Covalente No polar Covalente Polar Covalente Puro Covalente Coordinado Metálico Presenta una transferencia de electrones (un átomo cede y otro acepta) Se comparte un par de electrones Se comparte un par de electrones Se comparte un par de electrones Uno de los átomos aporta el par de electrones, que se comparten, para la unión Se considera como un arreglo de iones positivos inmersos en un mar de electrones Propiedades de Elementos las sustancias que une relacionadas al enlace Metal y No Metal Diferencia de electronegatividad de los elementos que participan en el enlace Por lo general > 2.0 Ejemplos No metal y No Metal No metal y No Metal No metal y No Metal No metal y No Metal = 0 < 0.5 CH4, CHCl3, CCl4 1.0 a 2.0 H2O y HF =0 H2, O2, N2, Cl2 No aplica H2SO4, PClO2 Metal con metal No aplica Aleaciones como: Acero Inoxidable, Bronce, Latón KCl, MgBr2 CaO ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I ENLACES INTERMOLECULARES Tipo de enlace Puentes de Hidrógeno Ión-Dipolo Descripción Unión de dos átomos muy electronegativos (F. O y N) por medio de un átomo de hidrógeno que sirve de puente entre ambos Fuerza de atracción entre el ión y uno de los dipolos de la molécula polar Ejemplos Dipolo-Dipolo Fuerzas de Dispersión de London Son fuerzas de atracción que actúan en moléculas polares La fuerza de atracción se genera cuando los electrones en un átomo influyen en el núcleo del átomo cercano, creando un momento dipolar instantáneo H2O, NH3, HF En disoluciones de sustancias iónicas en agua como el NaCl en H2O Moléculas polares como: HF, HCl, H2O Sustancias no polares como He, Propano, Butano BLOQUE IV CLASIFICACIÓN DE LOS COMPUESTOS INORGÁNICOS Compuestos inorgánicos Binarios No metal + No metal Óxido No Metálico SO2 Ácido Hidrácido HCl Ternarios Metal + Ión poliatomico Metal + No metal Óxido Metálico Na2O Hidruro NaH Sal Binaria ó Sencilla NaCl Hidróxido Oxisal NaOH NaClO3 Hidrógeno + Ión poliatomico Ácido Oxiácido HClO3 ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I Nomenclatura sistemática También llamada racional o estequiométrica. Se basa en nombrar a las sustancias usando prefijos numéricos que indican el número de átomos de cada uno de los elemento presentes en cada molécula. La forma de nombrar los compuestos en este sistema es: de Prefijo Nombre genérico o función química Prefijo Nombre específico Óxido Metal o No metal de acuerdo a Anhídrido la función química mono- 1 mono1 Hidruro di2 di2 Hidróxido etc. tri3 tetra- 4 tri- 3 penta- 5 tetra- 4 hexa- 6 penta- 5 hepta- 7 hexa- 6 hepta- 7 Sistema Stock o IUPAC Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento con “nombre específico”. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: de Nombre genérico o función química Óxido Anhídrido Hidruro Hidróxido etc. Nombre específico Metal o No metal de acuerdo a la función química No. de Valencia del Metal o No metal con números romanos Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como superíndices del elemento en una fórmula molecular. ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I Casos especiales de cambios de sufijos Para la nomenclatura de los OXIÁCIDOS Acido Número de oxidación +1, +2 +3, +4 +5, +6, único +7 prefijo Hipo- Para la nomenclatura de las OXISALES -oso -oso -ico -ico No metal Per- Para la nomenclatura de los HIDRACIDO Acido Número de oxidación +1, +2 +3, +4 +5, +6, único +7 sufijo prefijo Hipo- sufijo No metal Per- -ito -ito -ato -ato + Número de oxidación +1, +2 +3, +4 +5, +6, único +7 Para la nomenclatura de las SALES BINARIAS O SENCILLAS hidrico Nombre del ion de la serie de los haluros uro de metal Nombre del ion de la serie de los haluros ACTIVIDAD: COMPLETA EL SIGUIENTE CUADRO COLOCANDO EN EL PARENTESIS EL NÚMERO QUE LE CORRESPONDA: FAMILIA OXIDOS BÁSICOS ( ) HIDRUROS FORMADO POR ( ) ( Metal e hidrogeno ) Hidrógeno y no metal ( ) Metal y no metal ( ) OXISALES NOMBRE ( ) CO oxido de carbono II ) ( HIDROXIDO EJEMPLO SnO ( ) ( ) HBr ( ) ( ) ( ) Al(OH)3 ( ) HIO ( ) ( ) Cloruro de potasio ( ) Ácido hipoiodoso Nitrato de plata prefijo Hipo- Per- sufijo Metal -oso -oso -ico -ico ACADEMIA INTERESCOLAR DE QUÍMICA GUÍA DE ESTUDIO PARA QUÍMICA I 1)Óxidos ácidos 2) hidruros 3)óxidos básicos 4)hidrácidos 5)hidróxidos 6)sales sencillas 7)oxisales 8)oxiácidos 9)óxido de zinc 10)óxido de estaño 11)hidruro de potasio 12)ácido bromhídrico 13)hidróxido de potasio 14)hidruro de estroncio 15)ácido sulfhídrico 16)hidróxido de aluminio 17)NaOH 18)KOH 20)SrH 2 21) AuNO3 22)AgNO3 23)AgNO2 24)metal, no metal y oxígeno 25) metal y oxígeno 26)H2S 27) hidrógeno, no metal y oxígeno 28)hidrógeno y no metal 29)KCl 30)metal, oxígeno e hidrógeno (OH) 31)no metal y oxígeno 32)PCl3 EL MOL Un mol se define como la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos hay en 12 gramos de 12C. Se ha demostrado que este número es: 6.023 x 1023 partículas, y se conoce como número de Avogadro (NA). 1 mol de átomos = 6.023 x 1023 átomos = masa atómica en gramos 1 mol de moléculas = 6.023 x 1023 moléculas = masa molar en gramos PESOS ATÓMICOS Y MOLECULARES El peso fórmula de una sustancia es la suma de los pesos atómicos de cada átomo en su fórmula química La fórmula del H2O, por ejemplo, indica que una molécula de agua está compuesta exactamente por dos átomos de hidrógeno y uno de oxígeno. el agua (H2O) tiene el peso fórmula de: [2 x (1,0079 uma)] + [1 x (15,9994 uma)] = 18,01528 uma Si una sustancia existe como moléculas aisladas (con los átomos que la componen unidos entre sí) entonces la fórmula química es la fórmula molecular y el peso fórmula es el peso molecular. COMPLETA EL SIGUIENTE CUADRO: Compuesto Al(NO3)3 Al2 (SO4)3 NaHCO3 Peso molecular Gramos 21.45g Moles No. de moléculas 0.78 1.45 x 10 24



