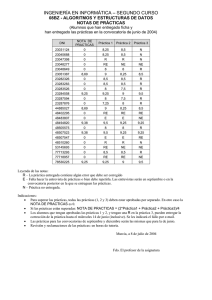
manual de practicas de laboratorio de ciencias morfologicas y
Anuncio

U n iv e rs id a d V e ra c ru z a n a <3c-/ FACULTAD DE BIOANALISIS ■ A - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS C oncepcion Conde de Gregoris. MANUAL DE PRACTICAS DE LABO RATO RIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS UNIVERSIDAD VERACRUZANA FACULTAD DE BIOANALISIS MANUAL DE PRACTICAS DE LABORATORY DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS. Que para obtener el tftulo de licenciado en Qufmica Clfnica. PRESENTA: Concepcion Conde de Gregoris. ASESOR: Dr. Francisco Malpica Ramon. - 2 - MANUAL DE PRACTICAS DE LABO RATO RIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS AGRADECIMIENTOS A Dios: Te doy gracias senor por que nunca me has abandonado y siempre has permanecido a mi lado en cada dfa de mi vida. A mis padres: Por su gran esfuerzo en darme estudios y gracias a ellos soy una profesioncita. A mis hermanos: Ma. Luisa, Daniel, Jose Marfa, Pablo y Pedro que siempre me apoyaron de una u otra manera. A: Doha Rosi, Eli, Daniela y Gil por que nunca dudaron en cuidarme a mis hijos y eso lo valoro demasiado. Agradecimiento especial a: Carlos Arturo Gallardo Hernandez, que me apoyo en la realizacion de este trabajo, agradezco su valiosa ayuda , ademas sabe perfectamente cuanto lo quiero. MANUAL DE PRACTICAS DE LABORATORY DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS AGRADECIMIENTOS A mi jurado: Agradezco infinitamente al DR. Francisco Malpica Ramon una gran persona y amigo por que fue quien me alento para titularme, mi respeto y admiracion por siempre. A: La M. en C. Ma. Del Carmen Martinez Zurnaya, una gran amiga y una persona muy especial a la que quiero mucho. A: El Q. C. Francisco Solis Paez, director de la facultad de bioanalisis por las facilidades otorgadas para la realization de este proyecto. MANUAL DE PRACTICAS DE LABORATORIO DE Cl ENG) AS MORFOLOGICAS Y FISIOLOGICAS DEDICATORIA A mis hijos: Samantha Aleida y Emiliano, porque comprendieron siempre que mama estaba estudiando y contentos me apoyaron para seguir adelante, los amo. A un gran hombre: Mi esposo Lie. Zinue S. Hernandez Gutierrez, por ser quien me hace crecer como persona y saca lo mejor de mi, que sin su apoyo nunca hubiera empezado este proyecto, ayudandome en cada etapa y desvelandose conmigo para el termino del mismo. MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS INDICE Introduction.................................................................................... 5 Practica NQ1 Estuche de diseccion y manejo del instrumental........................................................6 Practica NQ2 Conocimiento del anfiteatro y manejo de modelo anatomico natural..................... 10 Practica NQ3 Diseccion y sutura............................................................... 13 Practica NQ4 Signos vitales....................................................................................................... .20 Practica NQ5 Identification de las venas cefalica, media y basilica en un cadaver....... ...........34 Practica NQ6 Obtencion de muestras sangumeas......................................................................... 39 Practica NQ7 Elaboracion de frotis sangumeo........................................... 44 Practica NQ8 Determinacion de hematocrito........................................................ 52 Practica NQ9 Recuento de globulos rojos....................................................................................... 58 -3 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS Practica NQ10 Liquido cefalorraquideo...................... ............................................................ ..... 64 Practica NQ11 Diseccion de una rata............ .............................. ......................... ...........................73 Bibliograffa.......... ,............................................................................ ........... ............ 79 4- MANUAL DE PRACTICAS DE LABORATORIO DE CIENC1AS MORFOLOGICAS Y FISIOLOGICAS INTRODUCCION El conocimiento del cuerpo humano es por medio de las disciplinas de la morfologia y la fisiologfa humana, esto se basa en la aplicacion de los conocimientos teoricos principalmente, pero al reforzarlo mediante la practica, el conocimiento y la experiencia del docente, se transforma en aprendizaje por parte del alumno y se hace mas firme al conjuntarlos y sobretodo que le encuentra una aplicacion clinica y verdadera al conocimiento adquirido durante el semestre y que ademas usara durante todo el tiempo de vida profesional. Dentro de la Experiencia Educativa no existe un manual de practicas de laboratorio, aunque estas se realizan, pero no se encuentran registradas, lo anterior fue lo que motivo al diseno del presente manual que representa las diferentes practicas de laboratorio que se realizan durante el transcurso del curso. El manual de practicas de laboratorio dentro de la Experiencia Educativa de Ciencias Morfologicas y Fisiologicas, tiene como objetivo que el alumno relacione la utilidad que tienen los diferentes analisis clfnicos con la morfologia y fisiologfa del cuerpo humano, para poder comparar con los diferentes estados de enfermedad que atacan al cuerpo humano, y a su vez aprenda y domine diversas tecnicas que le seran de gran utilidad a lo largo de toda la carrera de Qufmica Clinica. A continuacion se presentan varias practicas enfocadas a la utilidad qufmica clinica que tiene cada aparato y sistema humano, asf mismo con la realizacion de este manual se busca dejar una gufa de apoyo para todos los estudiantes que conforman la facultad de Bioanalisis. -5 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS p r A c t ic a NO. 1 ESTUCHE DE DISECCION Y MANEJO DEL INSTRUMENTAL. OBJETIVO Al finalizar la practica, el alumno sera capaz de identificar cada una de los instrumentos que conforman al estuche de diseccion, asf como su adecuado y correcto uso. SUSTENTO TEORICO El estuche de diseccion es el conjunto de instrumentos disenados especialmente para realizar practicas de diseccion por estudiantes de la camera del area de Ciencias de la Salud, siendo una herramienta que permite realizar maniobras de 'manipulation de tejidos. Las variaciones del instrumental son muy numerosas pero adecuados para el desempeno de la practica y de diferentes materiales como son el titanio, bario u otros metales, la gran mayoria de este tipo de instrumentos, son fabricados de acero inoxidable, las aleaciones que se utilizan deben tener propiedades especificas para hacerlos resistentes a la corrosion, cuando se exponen a sangre, Ifquidos antisepticos o diferentes Ifquidos corporales, y a los elementos naturales. Los instrumentos segun su funcion pueden variar en forma y tamano, algunos pueden ser pequenos o grandes, cortos o largos, rectos o curvos y filosos o romos. El estuche de diseccion es usado por los estudiantes, bajo una supervision directa del maestro al realizar las practicas de diseccion en cadaver o cirugias en animales de laboratorio, por lo que durante el tiempo que duren estas practicas, es indispensable para la clase. El estuche de diseccion varia en numero de piezas, el mas comun utilizado es el de 12 piezas que a continuacion analizaremos. - 6 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENC1AS MORFOLOGICAS Y FISIQLOGICAS PARTES DEL ESTUCHE DE DISECCION. 1. Pinzas de diseccion con dientes. Se usa para sostener y manipulas tejidos firmemente como la piel. 2. Pinza lisa (pinzas de diseccion sin dientes). Se utiliza para la manipulacion de tejidos grasos o delicados. 3. Pinza punta roma. Se utiliza para ir separando tejidos. 4. Pinzas de Kelly. Ayuda a separar tejidos, son pinzas hemostaticas, rectas o curvas, tiene ranura en sus dos ramas y presenta un sistema de cremallera para dejarla fija una vez pinzado el vaso sangufneo. 5. Tijeras curvas. Son utilizadas para cortar tejido (solo cirujano). 6. Tijeras rectas. Utilizadas para realizar codes sencillos como el hilo en la sutura (solo ayudante). 7. Porta agujas. Se usa para tomar y sostener agujas quirurgicas curvas, son muy parecidas a las pinzas. 8. Estilete. Utilizado para explorar heridas. 9. Canula. Se utiliza para la exploration de heridas y para realizar codes rectos. 10. Separadores. Se utilizan para separar tejido. 11. Serinas. Son ganchos que solo se ocupan en diseccion para la observation y manipulacion de tejidos profundos, actuan como separadores. 12. Bisturf. Se divide en dos pades, mango y hoja, esta se fija al mango resbalando la hendidura dentro de las muescas del mango, al fijar o sacar la hoja del mango, nunca se utilizan los dedos, todo por medio de pinzas; las hojas son de diferente forma y tamano, las mas comunes las del numero 3 y 4. -7 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS 6 5 1 2 3 12 4 7 11 8 9 DESCRIPCION DE LA PRACTICA. Se identificara el estuche de diseccion y cada una de sus piezas, el cual es el material principal utilizado dentro del mismo, asf como la manipulacion de este. TECNICA: 1,-ldentificar cada pieza del estuche de diseccion y su uso practico. 2. -Ensamblar el bisturf con su hoja, se deslizando suavemente la hoja con ayuda de unas pinzas (no hacerlo con los dedos). 3. - Tomar con el porta agujas la aguja e insertar el material de sutura, jalando el hilo hasta escuchar un “clic”. MATERIAL Y EQUIPO. 1.-Bata. 2. - Guantes de latex. 3. - Estuche de diseccion -8 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS CUESTIONARIO. 1 i Par a que se utiliza el estuche de diseccion en el anfiteatro? Para hacer disecciones, codes y suturas en el cadaver. 2.- i,De que material esta echo las piezas del estuche de diseccion? De titanio, balio u otros metales, pero la gran mayona de instrumentos quirurgicos estan fabricados de acero inoxidable. -9 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y F1SIOLOGICAS PRACTICA NO. 2 CONOCIMIENTO DEL ANFITEATRO Y MANEJO DE MODELO ANATOMICO NATURAL REGLAMENTO DEL ANFITEATRO. 1. El acceso al anfiteatro queda restringido a los alumnos de anatomfa y sus maestros. 2. Cada grupo tiene horarios establecidos, los cuales deben ser respetados. 3. Los alumnos solo podran asistir a diseccion cuando se encuentre un maestro cOmo responsable, y deberan dejar suturada la region trabajada. 4. Los cadaveres se asignan por medio de un oficio con copia al jefe de grupo y al maestro responsable, estando obligados a manipular su cadaver lo mejor posible con la finalidad de conservarlo util un mayor tiempo. 5. Es requisito indispensable que para hacer disecciones, los alumnos se vistan con la ropa especffica para tal fin. 6. Cada grupo esta obligado a separar adecuadamente los residuos resultantes, conforme lo marca la ley general para la prevention y gestion integral de los residuos. 7. En el anfiteatro, hay un modelos, almacen de huesos y piezas anatomicas y que los alumnos pueden solicitar para prestamo a domicilio mediante la entrega de su credencial. 8. Por razones sanitarias, los alumnos no pueden ingerir alimento ni fumar en el anfiteatro. 9. Como el anfiteatro es compartido con otros grupos, es indispensable mantener el orden, para no interrumpir el trabajo de los compaheros. - 10 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOG1CAS Y FISIOLOGICAS OBJETIVO Al finalizar la practica el alumno debe ser capaz de reconocer cada una de las areas que conforman el anfiteatro, mostrar un buen comportamiento dentro del mismo y el respeto al modelo anatomico natural, asf como su correcta manipulacion. SUSTENTO TEORICO La palabra anfiteatro proviene del griego ver), el anfiteatro fue una creacion amphi (ambos lados) theatron (lugar para romana, se caracterizaba por una construccion circular ascendente en forma de embudo, en la cual la periferia era el espacio de mayor diametro y el centro que era el escenario donde se desarrollaba las matanzas de los cristianos era mucho menor. Con este tipo de construccion el publico tenia una amplia vision de lo que se realizaba en el escenario desde cualquier lugar de las graderfas en que estuvieres ubicado. Los anfiteatros anatomicos se disenaron para disecar y ensenar la anatomfa mediante demostraciones publicas del cuerpo humano y de animales. Es donde se realizaban las necropsias o necrocirugfas (cirugia en personas muertas). El primer anfiteatro anatomico se construyo en 1594 en la universidad de Padua. Actualmente se cuenta con un anfiteatro para Ciencias de la Salud Xalapa, con unas dimensiones y construccion diferente a la mencionada, sin embargo es en donde los alumnos junto con los maestros acuden a las diferentes practicas de diseccion pertenecientes a las materias relacionadas con la anatomfa humana. DESCRIPCION DE LA PRACTICA. Se visitara el anfiteatro para conocer como se encuentra conformado y se identificara el modelo anatomico asignado, el cual es el material de la practica utilizado dentro del mismo, asf como la manipulacion de este. - 11 - MANUAL DE PRACTICAS DE LABORATORY DE CIENCIAS MORFOLQGICAS Y FISIOLOGICAS TECNICA: 1 Conocer la distribution del anfiteatro. 2. - Manejo correcto del modelo anatomico. 3. - Respetar el reglamento del anfiteatro. — gk iis ■■■■■ MATERIAL Y EQUIPO. 1. - Bata. 2. - Guantes de latex. 3. - Cubre bocas. 4. - Estuche de diseccion CUESTIONARIO 1.- ^Para que se disenaron los anfiteatros anatomicos? Para disecar y ensenar la anatomfa mediante demostraciones publicas del cuerpo humano y de animates. - 12 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS PRACTICA NO. 3 DISECCION Y SUTURA SUSTENTO TEORICO Se le llama diseccion al corte realizado en algun tejido con el material adecuado. La sutura es una union quirurgica de tejidos, separados por una herida, o por una incision quirurgica, mediante el ligado con hilos metalicos, seda, catgut, nylon, etc., con la ayuda de una aguja. Y de este modo proteger la herida de agresiones externas. A continuacion se describe algunos tipos de suturas, las cuales son las mas utilizadas: • Modo sim ple de Ciruiano. Es el nudo mas frecuentemente utilizado en AP. Para realizar el nudo se enrolla el extremo largo de la sutura (unido a la aguja) alrededor del porta agujas con dos vueltas (doble lazada sobre porta, con hilo proximal). Con la punta del porta se sujeta el cabo suelto, y se estiran los extremos para tensar el nudo. Se repite la operation en el sentido contrario, para fijar el nudo y Se estiran ambos cabos para cortar el hilo y dejar dos extremos cortos. - 13 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS • Sutura continua. Se realiza un primer punto de sutura, pero sin recortar los cabos, de modo que se continua introduciendo el hilo de forma constante a lo largo de toda la incision. Usar las pinzas para separar el tejido. Cruzar de forma subcutanea formando un angulo de 455 con el eje de la herida, y salir por la dermis del lado opuesto (en la forma intradermica, tanto la entrada como la salida se hacen por la hipodermis) manteniendo estos angulos, la vision del recorrido hace que parezca perpendicular en la zona superficial mientras que es inclinado en la parte profunda. Volver a introducir el hilo por la zona enfrentada al punto de salida anterior, y de nuevo 45s subcutanea, atravesando toda la herida. Para terminar, cortar el cabo unido a la aguja de forma que sobresalga un poco para fijarlo a la piel con un esparadrapo quirurgico, o realizando un nudo sobre el propio cabo. - 14- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS • Punto de colchonero. Para diseccion vertical: Se pasa la aguja por la herida, de un extremo al otro a unos 0,5 cm. del borde. A otros 0,5 cm. del punto de salida, se vuelve a introducir la aguja para pasar de nuevo a traves de toda la herida hasta el punto origen, pero de forma mas profunda, saliendo a unos 0,5 cm. del primero. Se mantiene la misma direccion en los cuatro puntos. Se anuda el hilo, con ambos cabos saliendo del mismo lado, con el nudo habitual. Para diseccion horizontal: De igual modo, se pasa la aguja de un extremo al otro, pero se aproxima trasladando el punto a 0,5 cm. al lateral del origen, quedando en la misma Ifnea paralela a la herida y se introduce a la misma profundidad. - 15- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS El hilo utilizado en cada una de ellas, puede variar, segun la zona anatomica, las caracteristicas de la herida y del paciente que se trate al igual que el tiempo que el hilo permanecera en la zona suturada. La sutura de hilo proporciona un cierre seguro y garantiza la mayor fuerza de soporte de la herida, en comparacion con otros tipos de cierre. Las desventajas que presenta es que requiere la utilizacion de anestesia, el tiempo de intervencion es mayor, traumatiza el tejido y aumenta el riesgo de transmision de enfermedades por inoculacion accidental. La alternativa a las suturas convencionales, esta en la sutura mecanica y en las cintas adhesivas que proporcionan menor reactividad y menos incidencia de infecciones que las de hilo. Los pegamentos tisulares o adhesivos surgen en este contexto como una alternativa a los procedimientos de sutura habituales, aunque actualmente la mayona de los centros de salud, disponen solo de los materiales de sutura mas clasicos como la seda. Las agujas de sutura estan disehadas para llevar el hilo de sutura a traves de los tejidos, proporcionando el minimo dano, su eleccion viene dada por el tipo de tejido a suturar, la accesibilidad de la zona a intervenir y el grosor del hilo empleado. Existen agujas rectas que se manejan con los dedos, no con el porta agujas; que se emplean para cierres cutaneos de incisiones largas. - 16 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLQGICAS Y FISIOLQGICAS Las agujas curvas se manejan con el porta agujas, la aguja es tomada por una zona entre el tercio medio y posterior de esta, permitiendo una mayor precision, las cuales cuentan con distintos arcos y circunferencias. Las de tres octavos o un medio son las mas utilizadas en cirugias menores. OBJETIVO El alumno conocera y practicara la diseccion y algunos de los diferentes tipos de sutura, asf como el manejo del instrumental necesario. DESCRIPCION DE LA PRACTICA Se practicara la diseccion y algunos tipos de sutura en un cadaver y en un pedazo de polio o cerdo. TECNICA 1. Se ensambla el bisturf con su hoja mediante el uso de las pinzas adecuadas, nunca con los dedos. 2. Se hace una incision en la pieza de polio, cerdo o en la pierna del cadaver, segun se requiera. 3. Se coloca la aguja en el porta agujas tomando la aguja no en medio, si no a tres cuartas partes y se inserta el hilo jalando hasta que se escuche un “clic”. 4. Se inserta la aguja en la piel jalando la aguja con la pinza de diseccion y al mismo tiempo se trata de unir con la pinza dentada los bordes de la herida para facilitar el paso de la aguja. 5. Se procede a realizar el nudo simple, enrollando el extremo largo de la sutura (unido a la aguja) alrededor del porta agujas con dos vueltas (doble lazada sobre el porta agujas). Con la punta del porta agujas se sujeta el cabo suelto y se estiran los extremos para tensar el nudo. - 17- MANUAL DE PRACTICAS DE LABORATORY DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS 6. Se repite la operation en sentido contrario para fijar el nudo. 7. Otro tipo de sutura es la sutura continua, la cual se realiza con un primer punto de sutura, pero sin recortar los cabos, de modo que se continua introduciendo el hilo en forma constante a lo largo de toda la incision, se utilizan para separar el tejido. 8. Se cruza de forma subcutanea formando un angulo de 45Qcon el eje de la herida, y salir por la dermis del lado opuesto, manteniendo estos angulos. 9. Volver a introducir el hilo por la zona enfrentada al punto de salido anterior, y de nuevo a 45s subcutanea atravesando toda la herida. MATERIAL Y EQUIPO. • Estuche de diseccion. • Guantes • Cubre bocas • Bata MATERIAL BIOLOGICO. • Polio. • Pata de cerdo. • Cadaver. CUESTIONARIO: ^Que pinzas se utilizan para detener un sangrado? Pinza de hemostasia o mosquito. - 18- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLQGICAS Y FISIOLOGICAS iC om o se debe tomar la aguja para coser una herida? Se toma con las pinzas de diseccion no de la parte central, si no a tres cuartas partes. - 19 MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS P R A C T IC A L SIGNOS VITALES. SUSTENTO TEORICO. Los signos vitales son mediciones de las funciones mas basicas del cuerpo. Los signos vitales comprenden el ritmo cardfaco, la frecuencia respiratoria, la temperatura y la presion arterial. Estos signos se pueden observar, medir y vigilar para evaluar el nivel de funcionamiento ffsico de un individuo. Los signos vitales normales cambian con la edad, el sexo, el peso, la tolerancia al ejercicio y la enfermedad. Los rangos normales para los signos vitales de un adulto sano promedio son: ■ Presion arterial: 120/80 mm/Hg ■ Respiracion: 12-18 respiraciones por minuto. ■ Pulso: 60-80 latidos por minuto (en reposo) ■ Temperatura: 36.5-37.29 C (97.8-99.1 9 F)/promedio de 379 C (98.6 9 F) FRECUENCIA RESPIRATORIA. La frecuencia respiratoria es el numero de veces que una persona respira por minuto. Se suele medir cuando la persona esta en reposo, y consiste simplemente en contar el numero de respiraciones durante un minuto contando las veces que se eleva su pecho. La frecuencia respiratoria puede aumentar con la fiebre, las enfermedades y otras condiciones medicas. Cuando se miden las respiraciones tambien es importante tener en cuenta si la persona tiene dificultad para respirar. La frecuencia respiratoria normal de un adulto que este en reposo oscila entre 15 y 20 respiraciones por minuto. Cuando la frecuencia es mayor de 25 respiraciones por minuto o menor de 12 (en reposo) se podrfa considerar anormal. - 20 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS FRECUENCIA CARDIACA: La frecuencia cardiaca (FC) es el numero de veces que el corazon se contrae en un minuto, y es importante conocer su comportamiento entre otras razones por su Utilidad practica como un indice de intensidad para dosificar el ejercicio ffsico. Tanto las personas sedentarias como los deportistas deben de conocer su frecuencia cardiaca para realizar un ejercicio ffsico o plan de entrenamiento de manera controlada, preservando con ello su integridad ffsica y optimizando sus esfuerzos. Valores medios de la FCR en funcion de la edad y del sexo HOMBRES EDAD MAL NORMAL BIEN EXCELENTE 86+70 -84 62 60 O MENOS 30-39 86+72 -84 64 62 O MENOS 40-49 90+74 -88 66 64 O MENOS 50-90 90+76 68 -74 66 O MENOS 20-29 MUJERES EDAD MAL NORMAL BIEN EXCELENTE 96+78 -94 72 70 O MENOS 30-39 98+80 -96 72 70 O MENOS 40-49 100+80 -98 74 72 O MENOS 50-90 104+84 -86 74 74 0 MENOS 20-29 -21 MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS La frecuencia cardiaca al igual que la presion arterial, en reposo pueden ser afectada por varios factores, tales como: temperatura, humedad, actividad ffsica realizada antes de la medicion, emociones (estres), la ingestion de alimentos, el fumar, fatiga, infeccion y otros. La frecuencia cardiaca es un indicativo del nivel de la aptitud cardiorrespiratoria (aerobica); ya que, se sabe que el ejercicio cronico (a largo plazo) de tipo aerobico reduce las palpitaciones del corazon en reposo. PULSO: El ritmo del pulso es la medida de la frecuencia cardiaca, es decir, del numero de veces que el corazon late por minuto. Cuando el corazon impulsa la sangre a traves de las arterias, las arterias se expanden y se contraen con el flujo de la sangre. Al tomar el pulso no solo se mide la frecuencia cardiaca, sino que tambien puede indicar: ■ El ritmo del corazon. ■ La fuerza de los latidos. -22 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS El pulso normal de los adultos sanos oscila entre 60 y 100 latidos por minuto. El pulso puede fluctuar y aumentar con el ejercicio, las enfermedades, las lesiones y las emociones. Las ninas de 12 anos de edad y las mujeres en general, suelen tener el pulso mas rapido que los hombres. Los deportistas, como los corredores, que hacen mucho ejercicio cardiovascular, pueden tener ritmos cardiacos de hasta 40 latidos por minuto sin tener ningun problema. Uno mismo puede “tomarse el pulso”. El pulso se puede palpar en la muneca, el cuello, la sien, la ingle, detras de las rodillas o en la parte alta del pie, areas en las cuales la arteria pasa cerca de la piel. Para medir el pulso en el cuello (arteria carotida), se colocan los dedos fndice y medio al lado de la manzana de Adan (nuez), en una ligera depresion que se encuentra alii y se presiona suavemente con los dedos firmes hasta que se localiza el pulso. Una vez que se encuentra el pulso, se cuentan los latidos durante un minuto o durante 30 segundos y se multiplica por dos para obtener la suma total de latidos por minuto (tambien hablamos de pulsaciones por minuto = PPm). PROCEDIMIENTO PARA EL PULSO Como tomarse el pulso: Cuando el corazon impulse la sangre a traves de las arterias notara sus latidos presionando con firmeza en las arterias, que estan localizadas cerca de la superficie de la piel en ciertos lugares del cuerpo. El pulso se puede encontrar en la parte baja del cuello hacia el lado, en la parte interior del codo o en la muneca. Cuando se tome el pulso: ■ Utilizando las yemas de los dedos indices y corazon, presione suavemente pero con firmeza sobre las arterias hasta que sienta el pulso. ■ Empiece a contar las pulsaciones cuando el segundero del reloj marque las 12. -2 3 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS ■ Cuente su pulso durante 60 segundos (o durante 15 segundos y despues multipliquelo por cuatro para calcular los latidos por minuto). ■ Mientras este contando, no mire al reloj continuamente, mas bien concentrese en las pulsaciones. ■ Si no esta seguro de los resultados, pidale a otra persona que cuente por usted. ■ Si su medico le ha pedido que se tome el pulso y le resulta diffcil encontrarlo, consulte con el medico para que le de mas instrucciones. DILATACION PUPILAR optico optico -2 4 MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS El orificio que posee el iris en el centra que tiene forma circular, es la pupila. Las pupilas en hendiduras se pueden cerrar totalmente, por el contrario las circulares siempre dejan un pequeno orificio. Este orificio hace de obturador y diafragma, regulador de la luz precisa que debe entrar en la camara oscura del globo ocular e impresionar la pelfcula sensible de la retina, sin quemarla por un exceso de luz. Estimulando el iris por exceso de luz puede contraerse, dejando este orificio convertido en un diminuto punto negro, y por el contrario, en lugares de poca iluminacion pueden dilatarse hasta formar un gran cfrculo que puede medir hasta ocho milfmetros de diametro, sobre todo en los jovenes, pues en los ancianos y en los ninos es mas limitada esta abertura. El proceso de dilatacion de la pupila sucede con total automatismo, independiente de la voluntad del sujeto, condicionada por el cambio de brillo o la intensidad de iluminacion. Volviendo a la comparacion fotografica, tenemos las modernas camaras con sus grandes lentes de gran abertura y corta distancia focal, que pueden captar imagenes con escasa iluminacion, pero esa gran abertura de la lente, consigue poca nitidez y poca profundidad de foco. Pasa igual con la pupila muy abierta, en escenas poco iluminadas: se dilata hasta conseguir un gran orificio, pero capta menos detalles. No solo reaccionan las pupilas por efecto de la luz, pues esta demostrado que acciones de otra naturaleza, como pueda ser la ira, el deseo y otros estados animicos pueden influir y modificar el tamano de este singular orificio; tambien puede ser modificado con el esfuerzo de mirar objetos cercanos para aumentar asi la profundidad de enfoque, aunque estas funciones no son las de su normal funcionamiento. PRESION ARTERIAL La presion arterial es la fuerza que ejerce la sangre contra las parades de las arterias. Cada vez que el corazon late, bombea sangre hacia las arterias. Su -25- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS presion arterial estara al nivel mas elevado al latir el corazon bombeando la sangre. A esto se le llama presion sistolica. Cuando el corazon esta en reposo, entre un latido y otro, la presion sanguinea disminuye. A esto se le llama la presion diastolica. En la lectura de la presion arterial se utilizan estos dos valores, las presiones sistolica y diastolica. Generalmente, se escriben uno arriba del otro o uno antes del otro. La lectura con valores de: ■ 120/80 o menos son normales ■ 140/90 o mas indican hipertension arterial ■ Entre 120 y 139 para el numero mas elevado, o entre 80 y 89 para el numero mas bajo es prehipertension -26- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS COMO MEDIR LA PRESION ARTERIAL Metodo Auscultatorio: Para proceder a la medicion de la tension arterial, siente tranquilamente al paciente por 5 minutos previos, cerciorandose que no haya fumado ni ingerido cafe y que se halla con la vejiga vacfa (luego de haber orinado). ■ Coloque el brazo izquierdo si es diestro y viceversa a la altura del corazon, apoyandolo en una mesa o el brazo del sillon. ■ Ponga el manguito alrededor del brazo desnudo, entre el hombro y el codo. ■ Identifique y palpe el latido del “pulso braquial” producido por la arteria del brazo (se localiza a dos centfmetros por encima del pliegue del codo, en la cara interna del brazo). ■ Sobre este latido, apoye la campana del estetoscopio. ■ Identifique y palpe el latido del pulso radial (pulso localizado a la altura de la muneca cercano al borde correspondiente al dedo pulgar) en el mismo brazo que realizara la medicion. ■ Bombee la pera con rapidez hasta que la presion alcance 30 mm Hg mas de la maxima esperada o bien lo que es mas certero, 30 mm Hg por encima del momento en que desaparecio el pulso radial que estabamos palpando (esto ocurre porque al comprimirse el brazo, se comprime la arteria y desaparece el pulso. ■ Desinfle el manguito lentamente observando la escala del tensiometro, haciendo que la presion disminuya 2 a 3 mm Hg por segundo. ■ En el momento que escuche (ausculte) el primer latido, debera observar el nivel que registra la aguja (o el menisco en el caso del tensiometro de mercurio). Ese valor registrado corresponded a la Presion Arterial Maxima (o Sistolica) cuyo valor no debera ser mayor a 139 mm de Mercurio (mmHg). -27- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS A partir de ese momento seguiremos desinflando el manguito e iremos escuchando los latidos que primero crecen en intensidad y luego decrecen. ■ En el determinado momento en que dejamos de oir los latidos, realizaremos una nueva lectura sobre la escala del tensiometro y en ese momento estableceremos la Presion Arterial Minima, la que no debera superar los 89 mmHg. ■ Repita el proceso en el brazo opuesto para corroborar que los registros sean simetricos en ambos brazos. ■ De todas maneras es recomendable que las primeras mediciones las realice con su supervisor. -28- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y F1SIOLOGICAS Metodo palpatorio: ■ Este metodo es mas rustico, de menor precision y prescinde del estetoscopio (por lo tanto carece de la auscultacion de los ruidos). ■ Coloque el brazo izquierdo si es diestro y viceversa a la altura del corazon, apoyandolo en una mesa o el brazo del sillon. ■ Ponga el manguito alrededor del brazo desnudo, entre el hombro y el codo. ■ Identifique y palpe el latido del pulso radial (pulso localizado a la altura de la muneca cercano al borde correspondiente al dedo pulgar) en el mismo brazo que realizara la medicion. « Bombee la pera con rapidez hasta que la presion alcance 30 mm Hg mas de la maxima esperada o bien lo que es mas certero, 30 mm Hg por encima del momento en que desaparecio el pulso radial que estabamos palpando (esto ocurre porque al comprimirse el brazo, se comprime la arteria y desaparece el pulso. « Desinfle el manguito lentamente observando la escala del tensiometro, haciendo que la presion disminuya 2 a 3 mm Hg por segundo. ■ En el momento que aparezca (se vuelva a palpar) el primer latido del pulso radial, debera observar el nivel que registra la aguja (o el menisco en el caso del tensiometro de mercurio). Ese valor registrado correspondera a la Presion Arterial ■ En el momento que aparezca (se vuelva a palpar) el primer latido del pulso radial, debera observar el nivel que registra la aguja (o el menisco en el caso del tensiometro de mercurio). Ese valor registrado correspondera a la Presion Arterial Maxima(o Sistolica) cuyo valor no debera ser mayor a 139 mm de Mercurio (mmHg). ■ En el momento que aparezca (se vuelva a palpar) el primer latido del pulso radial, debera observar el nivel que registra la aguja (o el menisco en el caso del tensiometro de mercurio). Ese valor registrado correspondera a la Presion Arterial Maxima(o Sistolica) cuyo valor no debera ser mayor a 139 mm de Mercurio (mmHg). - 29 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS « Repita el proceso en el brazo opuesto para corroborar que los registros sean simetricos en ambos brazos. Como es de observar rapidamente, el metodo palpatorio obvia el registro de la presion arterial minima, con lo cual se pierde un dato de gran valor. Sin embargo en casos particulars, (ruidos ambientales intensos que impiden un adecuado registro por el metodo auscultatorio), este metodo aporta una eficaz y rapida informacion acerca del estado de la presion arterial. OBJETIVO. Aprender a medir los signos vitales del paciente como la frecuencia respiratoria, cardfaca, el pulso, la dilatacion de las pupilas y la toma de presion arterial. DESCRIPCION DE LA PRACTICA. Se trabajara en equipo de cuatro personas. Se escogeran dos integrantes del equipo para que sean pacientes. Despues tomaran los signos vitales en estado de reposo, despues de realizar ejercicio, y al estar sometidos a estres. PROCEDIMIENTO Presion arterial: 1. Sentar al paciente comodamente. 2. Tomarla en el brazo, y empezar a ubicar palpatoriamente los latidos. 3. Con ayuda de un estetoscopio y un tensiometro, registrar los latidos. Normal 120 80 ALTA 130 85 -30- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS Pulso: Se puede tomar en todos los lugares en los que pasen las arterias: munecas (arteria radial o cubital) cuello (arteria carotida), pie (arteria pedial). Frecuencia (normal: 60-100 pulsaciones por minuto) 1. Sentar al paciente comodamente. 2. Tomar el pulso de cualquier zona antes mencionada, con el dedo rndice y medio, evitando tomar el pulso con el pulgar. 3. Registrar el numero de pulsaciones durante 1 minuto. Respiracion. Esta se toma por simple observation, se observa cuantas veces se mueve el torax en un minuto. Frecuencia respiratoria: 12-18 resp/min. Reflejo pupilar: 1. Con una lampara pequena, se alumbra el ojo y se observa como se contrae la pupila. 2. En caso de no tener lampara, se abre rapidamente el parpado superior y se observa la misma reaction. Esta maniobra no es recomendable si hay senales de heridas u objetos extranos dentro de los ojos. 3. Si no hay contraccion de una o de ninguna de las dos pupilas, pudiera haber dafio neurologico serio. 4. Normalmente las pupilas se contraen al estimulo de la luz. 5. Si ambas pupilas estan mas pequenas de lo normal (contrafdas), la causa puede ser una insolacion o el uso de drogas. Si las pupilas no son de igual tamano, puede indicar la presencia de una herida en la cabeza o una paralisis. -3 1 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS Temperatura: 1. Se coloca al paciente en una posicion comoda. 2. Colocar el termometro abajo del brazo, en la axila y dejarlo ahf por un lapso de tiempo de 5 minutos. 3. Retirar el termometro. 4. Para leer el termometro, tomar el extremo opuesto al bulbo, de forma que los numeros queden de frente a usted. 5. Hacer rodar el termometro entre los dedos, hacia atras y hacia adelante, hasta que se vea un reflejo rojo o plateado en la columna. 6. Comparar el extremo de la columna con el grado que se marca en las Ifneas sobre el termometro. RESULTADOS. Se sometio a los alumnos a diversos estados ffsicos y emocionales para observar como cambiaban sus signos vitales. Fueron sometidos a estres al decides que habrfa examen sorpresa y se les puso a corner con el fin de ver como cambiaban los signos vitales despues de una actividad ffsica. A continuacion se muestra el resultado de los signos vitales de un alumno: Nombre: Judith Zamora Vivanco. Sianos vitales en estado de reposo: Pulso: 65 pulsaciones por minuto. Presion arterial: 1 2 0 - 8 0 mm/HG Frecuencia respiratoria: 13 respiraciones por minuto. Sianos vitales desoues de examen sorpresa: Pulso: 78 pulsaciones por minuto. -32- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS Presion arterial: 130- 85 mm/HG. Frecuencia respiratoria: 17 respiraciones por minuto. Sianos vitales desoues de actividad ffsica: Pulso: 140 pulsaciones por minuto. Presion arterial: 150 - 90 mm/HG. Frecuencia respiratoria: 35 respiraciones por minuto. MATERIAL Y EQUIPO. ■ Estetoscopio. ■ Baumanometro. ■ Cronometro. ■ Lampara. ■ Tensiometro. ■ Termometro de vidrio. CUESTIONARIO. 1 i,Cuales son los valores normales de la presion arterial? 80/120 mmHg 2.- <j,Cuales son las frecuencias en las que se mide la presion arterial? Sfstole y diastole. -3 3 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS PRACTICA N9 5 IDENTIFICACION DE LAS VENAS CEFALICA, MEDIA Y BASILICA EN UN CADAVER SUSTENTOTEORICO Como todos sabemos el corazon es el encargado de bombear la sangre a todo nuestro organismo, las arterias son las encargadas de llevar la sangre oxigenada y las venas, las encargadas de regresar la sangre al corazon para ser nuevamente oxigenada. (Las arterias llevan y las venas regresan). ARTERIAS: Las arterias son tubos huecos de paredes resistentes y gruesas. Las arterias principales son: la aorta y la pulmonar, y su tamano va disminuyendo a arteriolas y sistema capilar. ARTERIAS DEL CUERPO vena auricular posterior arteria occipital arteria tem poral superficial arteria m axilar arteria facial arteria lingual arteria tiroidea superior arteria carotida com un derecha arteria vertebral derecha arteria su bd avia derecha arteria axilar arteria profunda d el brazo arteria carotida externa arteria carotida interna arteria carotida com un izquierda arteria braquiocefalica arteria subclavia izquierda arteria coronaria derecha aorta toracica arteria braquial vena radial vena gonadica interoseo arteria cubital arteria coliaca arteria renai vena m esenterica superior aorta abdom inal arco palm ar superficial vena m esenterica inferior arteria iliaca com un vena femoral arteria iliaca interna vena poplitea arteria iliaca externa vena femoral profunda arteria tibiale posterior arteria tibial anterior vena peronea arteria plantar media arteria plantar lateral arco plantar arteria dorsal de pie -3 4 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS VENAS: Las venas a diferencia de las arterias, son menos elasticas y tienen unas valvulas que impiden que la sangre descienda o se regrese por su peso. Su grosor tambien varia desde las minusculas venulas, hasta las de mayor grosor llamadas venas cavas que entran por el lado derecho del corazon. Las principales venas son y vienen de: « Cava superior: de la cabeza ■ Subclavias: miembros superiores ■ Cava inferior: piernas, rinones, hfgado. • La vena coronaria rodea al corazon ■$**no foncjj-tudh no£ su p e rio r long ifudxnn^ in fc rii Sena recto Angular P o rc ia n tra n s v e r s a l d e i»r»o la le r a lFcscicd a n te rio r 1 Ple K O Y u g v la r CM'rvical- extern t* T ron co Y u flw lo r inlern-O' fr a n c a b r a q u lo r e f a lc o Vena cover b r a q u io c e fa iic a izcjw ierco Su-bcia v ia d «r« i Ce^diico su p e rio r. A x ilo r 1 ■ Fulm onac m in fw rip r- m m Corario-ri-qi derecha.^ V hho cover C o ro n c in ^ ic q u ie r d a K Jr j -€ sp la n ic v m JA >C%| M e d ia n a M ^ s e n te ric a s u p e r io r basilic*; T o fd e k a e x te rn a C m a m o r ia if ia c o p iim ifjv A * 1e>rna M e s o n t « r jc a In fe rio r llio c o in te rn a »;h*pogdjir»caJ lU a co e x te rn a internet- C o ia te ra le s p a lm a re s de lo t dodos Distribution de venas del cuerpo humano. -35- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISiOLOGICAS Entre venas y arterias podemos sumar aproximadamente una longitud de 50,000 Km, aproximadamente. La sangre esta presente en todo el organismo, pero puede variar la cantidad de concentracion dependiendo de varios factores por ejemplo: Durante el ejercicio la concentracion de sangre en los musculos es mayor, asi como durante la digestion la cantidad de sangre aumenta en los intestinos, el calor y el trio tambien modifican la distribution de la sangre. OBJETIVO. Conocer la localization de forma exacta de las arterias y venas del antebrazo. Especialmente las de interes para la venopuncion. DESCRIPCION DE LA PRACTICA. Esta practica se realizara en el anfiteatro utilizando un cadaver para identificar las principales venas que se utilizan para tomar muestras de sangre, identificando la vena basilica, cefalica y mediana. TECNICA. 1. - En primer lugar cuidadosamente utilizando el bisturf del estuche de diseccion se realizara una incision en'el antebrazo del cadaver. 2. -Enseguida se penetrara entre los musculos que se encuentran en esa zona para poder observar la vena cefalica y basilica, tomando en cuenta que la vena basilica se encuentra a mayor profundidad que la cefalica. 3. - Se observara donde se unen la vena cefalica y basilica, que da origen a la vena mediana. -36- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS Nota: La vena basilica es una larga vena de largo recorrido del miembro superior, que ayuda a drenar la sangre de parte de la mano y el antebrazo. La mayor parte de su trayecto es superficial; generalmente discurre por la grasa subcutanea y otras fascias que descansan sobre los musculos del miembro superior. Se origina en la parte cubital de la red venosa dorsal de la mano. Tras un pequeno recorrido por la mano, se hace anterior y sube por el antebrazo, pasando a llamarse vena basilica del antebrazo. Cerca de la region de la fosa cubital, en la curvatura de la articulacion del codo, la vena basilica normalmente se conecta con otra gran vena superficial del miembro superior, la vena cefalica, por medio de la vena mediana cubital. 4.- Despues de identificar las venas de interes, se procede a suturar la region en donde se hizo la diseccion. VENAS CEFALICA, BASILICA Y MEDIA. MATERIAL. « Estuche de diseccion. ■ Bata. ■ Cubre bocas. -37- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLQGICAS Y FISIOLOGICAS ■ Guantes de latex. MATERIAL BIOLOGICO. • Cadaver. CUESTIONARIO. iQ u e caracteristicas presenta la vena basilica? R= Es una vena que se origina en el lado cubital de la red dorsal de la mano, pasa hacia arriba por el antebrazo y se une con las venas humerales para formar la venaaxilar. ^Que caracteristicas presenta la vena cefalica? R= Nace junto con la vena basilica, del arco venoso dorsal y tambien se hace anterior (vena cefalica del antebrazo). Asciende por el canal externo del codo, continua subiendo por el brazo y llega hasta el surco deltopectoral perforandolo y desembocando en la vena axilar. iC om o se llama la vena que resulta de la union de las venas basilica y cefalica? R= Vena mediana. -3 8 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLQGICAS Y FISIOLOG1CAS PRACTICA N2 6 OBTENCION DE MUESTRA SANGUINEA SUSTENTO TEORICO A la accion de realizar un corte en la vena se le conoce con el nombre de flebotomfa; que deriva del griego flebas (venas) tomas (corte), por consiguiente la persona que efectua las sangrias es un flebotomista, esta debera tener ciertas caracteristicas: • Buena presentation • Buena etica profesional • Experiencia • Agilidad mental • Capacidad y disponibilidad para seguir instrucciones • Caracter agradable y amable. Mediante esta tecnica de extraction, con los cuidados necesarios se obtendra sangre venosa para la realizacion de diferentes analisis. OBJETIVO El alumno conocera y dominara la tecnica de obtencion de sangre, que empleara durante todo el curso para realizar diversas practicas que requieran de una muestra para obtener su resultado. DESCRIPCION DE LA PRACTICA Con esta practica se pretende que los alumnos aprendan a tomar una muestra sangufnea venosa, con previa explicacion teorica con ayuda de un brazo electronico didactico para toma de muestra y visualizacion de las principales venas de puncion en un cadaver. -39- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS TECNICA 1. Se hace una ocultacion previa a la puncion, ligando con la finalidad de observar y palpar el curso que siguen las venas, desligar. 2. Se limpia con una torunda la zona de dicha puncion, esperando que evapore el alcohol. 3. Ligar nuevamente e introducir la aguja formando un angulo de 45°, o segun lo amerite previo chequeo correcto de la jeringa, esta se tomara de la parte cercana a la aguja con el dedo indice y con el bisel hacia arriba, con la mano derecha y los dedos de la otra nos servira para evitar el juego de la misma. 4. Cuando se esta en vena, la sangre fluira hacia la jeringa con el rmnimo de aspiracion, la cual se continuara haciendo lentamente hasta obtener el volumen deseado. 5. Retirar la ligadura y decir al paciente que abra la mano y poner la torunda simultaneamente al sacar la aguja del sitio de donde se hizo la puncion. 6. El paciente debera permanecer con el brazo doblado por un lapso de 3 a 5 minutos, para evitar hemolisis. 7. El vaciado de la sangre se hara inmediatamente en los tubos correspondientes deslizando la sangre por las paredes para evitar hemolisis. -40- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS V e n a c e f£ lic a V e n a b a s ilic a A rte ria h u m e ra l V e n a m e d ia n a del codo A rte ria c u b ita l A rte ria ra d ia l A rc o p a lm a r p ro f u n d o VENAS PARA OBTENCION DE MUESTRA BRAZO ELECTRONICO DIDACTICO PARA TOMA DE MUESTRA -4 1 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS TOMA DE MUESTRA CON METODO VACUTAINER. MATERIAL • Ligadura • Alcohol al 70% • Algodon • Jeringas desechables • Agujas de calibre 19, 20 y 21 de bisel largo • Tubo con anticoagulante • Cojfn. -4 2 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS CUESTIONARIO. 1. que se le conoce como venopuncion? R= A la accion de realizar un code en las venas. 2. ^Cuales son las principales venas para la puncion? Vena cefalica, basilica y media. 3. ^Cuantos tipos de tecnicas de extraccion sanguinea se utiliza? R= Comunmente se utilizan dos, con jeringa o Vacutainer. -4 3 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS P R A C T IC A L 7 ELABORACION DE FROTIS SANGUINEO SUSTENTO TEORICO. Es un examen de sangre que brinda information acerca del numero y forma de las celulas sangumeas y es de gran ayuda en la determination de enfermedades: • Parasitarias. • Hematologicas. • Inmunologicas. Los eritrocitos son las celulas sangumeas mas numerosas que hay en este componente y su color se debe a la hemoglobina que contienen y que por cierto es la que transporta el oxfgeno. Su lugar de production y desarrollo se encuentra en la medula osea, donde tambien nacen los leucocitos, pero algunos de estos ultimos terminan su desarrollo en los tejidos linfaticos. Estos leucocitos no trabajan en el sistema inmunologico, algunos llegan al lugar de la infection en mayor numero, pero otros lo acaban con mayor eficacia. Las plaquetas son celulas que tambien se forman en la medula osea, sirven para el retardo de hemorragias y favorece a la coagulacion. El plasma forma el 55% de la sangre, el primero contiene como agua, despues protefnas, electrolitos, sales, etc. La mayorfa de los elementos formes que constituyen a la sangre son los eritrocitos, y casi nada de neutrofilos, linfocitos, monocitos, eusinofilos y por ultimo basofilos. Todos excepto los eritrocitos son leucocitos y de esos los neutrofilos, monocitos, eusinofilos, y basofilos terminan su desarrollo en la medula osea. -44- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS Para la identification de forma visual de los leucocitos, los eusinofilos, basofilos y neutrofilos parecen tener una estructura interna de granos, por esta razon se les clasifica como granulocitos, en cambio los linfocitos y monocitos se les llama agranulocitos. Los globulos rojos tienen forma de una dona, son flexibles para que al pasar por los capilares mas angostos no se rompan, la razon de que tienen el centro hueco, es que han perdido su nucleo y producen oxfgeno de forma anaerobica, es decir que no gastan el oxfgeno que contienen. El fierro que contiene cada eritrocito se encuentra en la molecula de hemoglobina, este elemento se intercambia en los pulmones por una de oxfgeno, y se realiza el proceso inverso en cada uno de los tejidos. FORMA DE REALIZAR EL EXTENDIDO: f DEJAR QUE SE EXTIENDA LA SANGRE' ' -45- DESUZAR EL PORTA EXTENSOR’ MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS CARACTERISTICAS DE UNA BUENA EXTENSION: • La cabeza ha de estar cerca de uno de los extremos del porta. • La cola debe estar cercana al otro extremo del porta, pero sin llegar a el. • El borde de la cola tiene que estar finamente deshilachado. Ese fino deshilachamiento recibe el nombre de "barbas". • Toda la extension ha de ser fina y homogenea. • Los bordes laterales de la extension deben estar separados de los bordes del porta por 1 mm aproximadamente. • Una extension normal ha de tener una longitud de las % partes del portaobjetos. • El uso de tenidores automaticos exige la realizacion de extensiones mas cortas que las consideradas normalmente como correctas (con una longitud de la mitad del portaobjetos). f MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS DEFECTOS DE EXTENSION: • Excesiva longitud y escaso grosor o escasa longitud y excesivo grosor. Esto se debe a un inadecuado tamano de la gota de sangre o/y a un error en la velocidad o/y a un fallo en el angulo de extension de la misma. • Presencia de escalones o estrfas. Esto esta ocasionado por una falta de uniformidad en el deslizamiento de la gota. • Existencia de abundantes zonas redondeadas que carecen de sangre. Esto se produce por la presencia de restos de grasa o de suciedad en el porta. • Extremo final excesivamente dentado. EXTENSION LARGA Y MUY FINA EXTENSION CORTA Y GRUESA m — EXTENSION CON ESTRlAS TRANSVERSALES EXTENSION CON ESTRlAS LONGITUDINAIES EXTENSION CON ZONAS SIN SANGRE EXTENSION CON EXTREMO FINAL MUY DESFLECAOO OBJETIVO. El alumno sera capaz de realizar y dominar la tecnica para realizar un frotis sanguineo, permitiendole distinguir los diferentes componentes celulares y determinar si el paciente presenta alguna alteracion en sus celulas sangufneas. -47- MANUAL DE PRACTICAS DE LABORATORY DE CIENCIAS MORFOLOGICAS Y F1SIOLOGICAS DESCRIPCION DE LA PRACTICA. Se tomara una muestra sanguinea con anticoagulante. Previa explication de las caractensticas que un frotis sanguineo debe reunir, el alumno procedera a realizarlo y tenirlo, para despues observa en el microscopio y conocer las diferentes caractensticas de las celulas sanguineas. TECNICA: 1. Haga un extendido de sangre recientemente extrafda y mezclada. 2. Dejar secar a temperatura ambiente. 3. Cubra con el;colorante de writght por un lapso de cinco minutos, segun sea la calidad del colorante. 4. Pasado el tiempo, anada solucion amortiguadora, (solucion buffer), y deja actuar al mezclar por 10 minutos. 5. Pasado este tiempo lave por decantacion y deje secar el frotis a temperatura ambiente, teniendo cuidado de limpiar perfectamente la parte inferior de la preparacion para eliminar el maximo excedente del colorante. 6. Ya seca la preparacion, anadir entre las partes del cuerpo y la cola una pequena gota de aceite de immersion. 7. Observar al microscopio en 10X y100X. Observacion de neutrofilos, linfocitos y eritrocitos. -4 8 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS VALORES NORMALES: NEUTROFILOS (54 a 72%): Es normal encontrar neutrofilos inmaduros, como mielocito y metamielocito. En el nacimiento desciende a un 30% de cuatro a seis meses, a los cuatro anos aumenta hasta alcanzar los valores de los adultos. EOSINOFILOS: Se encuentran de 1 a 3%, y no presentan variaciones con la edad. BASOFILOS: Celulas poco abundantes en la sangre, y su % es de 0-1%. MONOCITOS: Oscilan entre 4 y 10%, y no se encuentran variaciones con la edad. UNFOCITOS: Al nacimiento, se encuentran aproximadamente 30%, de los 3 a los 6 meses de edad aumentan al 60%, y permanecen asi hasta los cuatro anos. Luego ocurre una declinacion hasta alcanzar valores del 30% a los ocho anos, encontrandose en los adultos concentraciones de 20 a 40%, y permanece asi hasta los 65 anos, y de ahf bajan gradualmente. ENFERMEDADES QUE CAUSAN AUMENTO INDICES DE LEUCOCITOS: -49- O DISMINUCION EN LOS MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS NEUTROFILIA f : > Inmediata: puede ser causada por tension, convulsiones, personas que han recibido algun tipo de anestesia, ansiedad, administracion de adrenalina. > Aguda: puede ser por algun tipo de infeccion, necrosis tisular (infarto), anemia hemolftica, intoxicacion por medicamentos, o pacientes que esten tomando corticoesteroides. > Cronica: pacientes con inflamacion cronica, glomerunolefritis y neoplasias. NEUTROPE > Production deficiente: en trastornos de celulas precursoras, en deficiencia de vitamina B12 o acido folico, quimioterapia, radioterapia, en enfermedades congenitas o pancreaticas. > Incremento en la destruccion celular: en infecciones graves, en hiperesplenismo y reacciones inmunitarias muy fuertes. EOSINOFILIAf : > Infestacion parasitaria, en reacciones alergicas, en infecciones tipo lepra, brucelosis, tuberculosis, o enfermedades micoticas, asma, reacciones medicamentosas, dermatitis, neoplasias y trastornos intestinales. EOSINOPENIA > Es muy raro, principalmente en situaciones muy fuertes de tension, en reacciones inflamatorias, en administracion de glucocorticoides, adrenalina o prostaglandinas. BASOFILIA | : > En trastornos mieloproliferativos cronicos, enfermedades inflamatorias y despues de la exposicion de radiaciones. -50- intestinales, MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLQGICAS Y FISIOLOGICAS M ONOCITOSISf: > Sfndromes mielodisplacicos, leucemias agudas, tumores linfocitarios, en anemia hemdlftica, en neutropenia cronica. LINFOCITOSIsf : > En mononucleosis infecciosa, en infecciones por burdetella pertusis, en infecciones por citomegalovirus, en toxoplasmosis, en infecciones virales como varicela y hepatitis, en sffilis, en periodos de convalecencia, en linfocemia aguda, en leucemia linfocitica cronica y en linfoma. LINFOPENIA j : > En neoplasias diseminadas, en enfermedades de tejido conectivO, con lupus eritematoso sistematica, en pacientes con quimioterapia, radioterapia, administracion de corticoesteroides, enfermedades inmunodeficientes casos de congenitas o tuberculosis, en adquiridas, en enfermedades agudas, cronicas y en casos de tension y esfuerzos. CUESTIONARIO. 1 ^Cual es la utilidad de un frotis sangufneo? R= El frotis sangufneo sirve para observar las celulas sangufneas (eritrocitos, leucocitos y plaquetas) y evaluar su morfologfa y cantidad en la sangre periferica, para asf ayudar a confirmar el diagnostico de diferentes afecciones de la sangre. 2.- iC om o se tine un frotis sangufneo? R= Despues de realizar el extendido, se deja secar, y se Neva a tenir con colorante de Writght durante 5 minutos, posteriormente, anadir solucion buffer durante 10 minutos, enjuagar con agua corriente y dejar secar al aire. -5 1 - MANUAL DE PRACTI'CAS DE LABORATORIO DE CIENCIAS MORFOLQGICAS Y FISIOLOG1CAS PRACTICA Ns 8 DETERMINACION DE HEMATOCRITO SUSTENTO TEORICO. El hematocrito es el porcentaje del volumen de la sangre que ocupa la fraccion de los globulos rojos. Las cifras normales de hematocrito en personas oscilan entre: hombres, de 36,0% a 45,0%; mujeres, de 36,1% a 44,3%, dependiendo de diversos factores fisiologicos, como la edad y la condicion fisica del sujeto. Su determination se basa en la separation de los eritrocitos y el plasma mediante una centrifugation capaz de empacar a los hematfes en el menor volumen posible; este sera llevado al 100% con el total de la sangre, por lo que el resultado sera expresado en porcentaje. El volumen del plasma que queda atrapado entre las celulas debe ser el menor posible para evitar mediciones erroneas. Es obvio, que el anticoagulante utilizado para realizar esta determinacion sea capaz de mantener inalterado el volumen eritrocitario. La determinacion de hematocrito es un examen de sangre que mide el tarnaho y numero de globulos rojos, al igual que suministra un porcentaje de estos globulos que se encuentran ,en toda la sangre. Este examen casi siempre se ordena como parte de un conteo sanguineo completo. El examen visual del plasma sobrenadante en el tubo de hematocrito puede aportar information valiosa relativa a la causa de anemia. Los niveles elevados de bilirrubina serica, caracterfsticos de pacientes con anemia hemolitica o megaloblastica, se detectan por el color amarillo (icterico) del plasma. En las deficiencias de hierro y en los procesos inflamatorios, el plasma se observa mas palido de lo normal. Los aumentos en el numero de leucocitos y plaquetas pueden apreciarse, como una delgada capa de celulas grises, situada por encima de los eritrocitos empacados. -52- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS Es importante enfatizar que el hematocrito refleja la concentration de los eritrocitos pero no la masa total de estos. Es asf como el hematocrito esta bajo en la hiperhidremia del embarazo sin que la masa total de eritrocitos circulante este reducida; y puede estar normal o elevado en los casos de shock hipovolemico acompahado de hemoconcentracion aunque la masa total de eritrocitos pueda estar disminuida en forma importante debido a la perdida de sangre caracterfstica de esta situation clfnica. OBJETIVO. Realizar y aprender la tecnica de la determinacion de hematocrito, en base a los valores de referencia, tanto en hombres como en mujeres. Asf como identificar la importancia y utilidad clfnica de la determinacion de hematocrito, ejecutando correctamente el macro y micrometodo. DESCRIPCION DE LA PRACTICA. En esta practica se busca realizar de manera correcta la determinacion de hematocrito, mediante el macro y micrometodo. TECNICA (MICROHEMATOCRITO). 1. Mezclar la sangre por inmersion, por lo menos durante 5 min, no agitarla. 2. Llenar las dos terceras partes de un tubo capilar por el lado no marcado. 3. Sellar el extremo opuesto (marcado por una banda azul) con la flama del mechero. 4. Centrifugar a 12, 000 rpm de 5 a 8 min, se lee usando una regia, las alturas del volumen y del volumen total de la muestra. 5. Se mide toda la muestra, ese sera el 100%, posteriormente se mide solo la parte roja (eritrocitos), hasta antes de la parte blanca (leucocitos). 6. La determinacion se hace mediante una regia de tres, multiplicando el valor de lo eritrocitos por 100 y dividiendolo entre el volumen total de la muestra. -53- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS HEMATOCRITO= ALTURA DE ERITROCITOS (mm) X100 ALTURA DEL VOLUMEN TOTAL (mm) 1. El valor resultante, sera expresado en porcentaje. 2. Tambien se puede obtener el resultado, utilizando un lector de microhematocrito, en el cual se coloca el capilar y se mide el total tanto del paquete globular, como de los demas componentes sangufneos. Solamente se mide el paquete globular. VOLUMEN TOTAL DE LA MUESTRA: 5.1 cm Ulifatttes rojos VOLUMEN DE ERITROCITOS: 2.4 cm TUBO DESPUES DE HABERSE CENTRIFUGADO CALC ULOS: (2.4cm) (100%) 5.1CM- -►100% 2.4CM- -► x = (47.06% 5.1cm -54- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIQLQGICAS VENTAJAS: • El plasma que queda atrapado entre las celulas es mmimo (1%) • Resultados muy predecibles. DESVENTAJAS: • Relativamente mas diffcil de realizar, sobre todo el sellado y dominar la lectura. LECTOR DE MICROHEMATOCRITO TECNICA (MACROHEMATOCRITO). 1. Mezclar la sangre por inmersion por lo menos durante 5 minutos. NO AGITARLA. 2. Llenar el tubo de Wintrobe hasta la marca de “0-10” usando una jeringa con canula larga o una pipeta Pasteur. Es importante vigilar que no se formen burbujas en la columna de sangre o en el fondo del tubo al llenarlo. Esto se logra haciendo resbalar la sangre por las paredes del tubo, iniciando en el fondo y sacando la canula a medida que se va llenando. 3. Centrifugar el tubo a 3000 rpm durante 30 minutos. La velocidad de centrifugacion se debera ajustar al radio de la centrifuga, considerando que siempre se debera tener una fuerza centrifuga relativa mayor a 2000 G. -5 5 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS 4. Leer el Ifmite superior de la columna de eritrocitos, inmediatamente por debajo de la capa gris de leucocitos, en la columna de la derecha (escala ascendente de 0 a 10 cm). 5. El resultado se informa en milfmetros por ciento. VENTAJAS: • • Es un metodo estandarizado. i Sencillo de realizar y de facil lectura. DESVENTAJAS: I • El plasma atrapado entre celulas es alrededor del 3% del volumen. i i • Puede dar resultados inconstantes debido a que existen alteraciones morfologicas, el plasma que queda atrapado entre celulas se incrementa. VALORES DE REFERENCIA: Al igual que con la hemoglobina y los eritrocitos, se modifican con la edad, sexo y altura sobre el nivel del mar. En la CD. De Xalapa, Ver. a 1400 m sobre el nivel del mar, son los siguientes: HOMBRES 40.7 A 50.3% MUJERES 36.1 A 44.6% NINOS DE 3 MESES A 10 ANOS 37% NINOS DE 10 A 15 ANOS 39% EQUIPO REQUERIDO. • Microcentrifuga para tubos capilares. Centrifuga -56- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS MATERIAL. Tubos capilares Mechero Regia Vacutainer o material para extraction. Tubos de Wintrobe Pipeta Pasteur con bulbo Mechero de Bunsen Gradilla MATERIAL BIOLOGICO. • Sangre obtenida con EDTA CUESTIONARIO. 1. iQ ue es el hematocrito? R= El hematocrito es el porcentaje del volumen de la sangre que ocupa la fraction de los globulos rojos. 2. ^Que importancia cllnica tiene el hematocrito? R= Sirve para el diagnostico de la anemia, en conjunto con la determination de hemoglobina. -57- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOG1CAS Y FISIOLQGICAS PRACTICA Ns 9 RECUENTO DE GLOBULOS ROJOS SUSTENTO TEORICO. La muestra de sangre se diluye lo suficiente para contar cifras legibles utilizando un liquido de dilucion isotonico que permita ademas identificarlos adecuadamente, impidiendo la aglutinacion y la hemolisis y destruya otros elementos que pudieran interferir en el recuento, que se realiza en la camara de Neubauer, cuya capacidad es conocida. El recuento de eritrocitos consiste en la cuenta del numero de celulas sangufneas rojas por volumen de unidad en una muestra de sangre venosa. Se obtiene mediante medicion directa y como tal no define ninguna patologfa; es indispensable para obtener el volumen corpuscular medio VCM, de todas maneras este parametro es obtenido directamente por el equipo para obtener el tamano promedio de los eritrocitos y la hemoglobina corpuscular media que si es un parametro calculado a partir de la hemoglobina y el recuento de globulos rojos. OBJETIVO. Identificar la importancia y utilidad clfnica del recuento de eritrocitos, asf mismo ejecutar correctamente el recuento de globulos rojos en muestras de sangre. DESCRIPCION DE LA PRACTICA. A partir de una muestra de sangre con EDTA, se procedera a realizar un conteo de celulas rojas, siguiendo la tecnica estandarizada, y los calculos establecidos. -58- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS TECNICA. 1. Mezclar la sangre por lo menos durante 5 minutos. 2. Llenar la pipeta de toma hasta la marca 0.5. 3. Diluir con liquido de Hayen, llenando hasta la marca 101; se debe evitar la formacion de burbujas, que alterarfan la dilucion. Para ello, se recomienda rotar la pipeta al aspirar y mantenerla en posicion vertical. El exceso en la punta se elimina con papel secante. Con esto obtenemos una dilucion de 1 :200 . 4. Agitar durante un minuto. 5. Inmediatamente, eliminar las cuatro primeras gotas y cargar la camara de Neubauer en sus dos cuadriculas. Dejar reposar un minuto a temperatura ambiente para permitir la sedimentacion de las celulas. 6. Contar al microscopio con el objetivo seco debil o fuerte, verificando primero que la distribution de las celulas sea homogenea; en caso contrario, se debera repetir la prueba. La cuenta se realiza en 80 cuadros pequenos del area central de la camara, seleccionando para ello un cuadro mediano central y cuatro angulares. 7. Multiplicar el numero de eritrocitos contados por 10,000 para obtener el total de globulos rojos por mm3 de sangre. 8. La formula para realizar los calculos es la siguiente: NX200X10X400 = NX 10,000 80 DONDE: N: es el numero de eritrocitos contados. 200: es el titulo de dilucion. 10: correction de la profundidad de la camara para ajustar el volumen a 1 mm3 -59- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS 400: total de cuadros pequenos del cuadro central de la camara. 80: total de cuadros pequenos contados. PIPETA DE TOMA PARA GLOBULOS ROJOS Y LEUCOCITOS L: CUADROS PARA LEUCOCITOS E: CUADROS PARA ERITROCITOS. -6 0 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS areas en donde se cuentan globulos blancos | areas en donde se cuentan eritrocitos CAMARA DE NEUBAUER VALORES DE REFERENCIA: Al igual que con la hemoglobina, se modifican con la edad, el sexo y la altura sobre el nivel del mar. En la Cd. de Xalapa Veracruz, a 1400 m sobre el nivel del mar, son los siguientes: -6 1 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS ERITROCITOS VALORES DE REFERENCIA EDAD SEXO VALORES (X105/mm3) RECIEN NACIDO M ASC0 FEM 4.5 a 6.5 1 MES A 2 ANOS M ASC0 FEM 3.5 a 4.0 3 A 10 ANOS MASC 0 FEM 4.1 a 5.0 11 A 60 ANOS FEM 4.0 a 5.2 11 A 60 ANOS MASC 4.6 a 5.8 MAS DE 60 ANOS MASC 0 FEM 4.1 a 5.0 En la siguiente tabla, se muestran los valores promedio de eritrocitos a diferentes alturas sobre el nivel del mar: ERITROCITOS VALORES DE REFERENCIA A DIFERENTES ALTITUDES MUJERES NIVEL DEL HOMBRES MEDIA RANGO MEDIA RANGO 4.65 3.88 a 5.42 5.15 4.39 a 5.91 1000 4.69 4.17 a 5.21 5.28 4.63 a 5.93 1860 4.92 4.33 a 5.51 5.76 4.94 a 6.58 2220 4.99 4.27 a 5.71 5.69 5.10 a 6.28 2670 4.95 4.31 a 5.59 5.63 4.95 a 6.31 MAR NIVEL DEL MAR EQUIPOY MATERIAL • Microscopio. • Pipetas de thoma para globulos rojos con boquilla. • Camara de Neubauer. -6 2 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS • Gradilla. • Tubos de ensaye de 13X100 mm. • Pipeta serologica de 5 ml. MATERIAL BIOLOGICO. • Sangre con E.D.T.A REACTIVOS. • Liquido diluyente de Hayen. CUESTIONARIO. 1 i En que consiste el recuento de globulos rojos? R= El recuento de eritrocitos consiste en la cuenta del numero de celulas sangumeas rojas por volumen de unidad en una muestra de sangre venosa. 2.- ^Por que es diluida la muestra? R= La muestra de sangre se diluye lo suficiente para contar cifras legibles utilizando un liquido de dilucion isotonico que permita ademas identificarlos adecuadamente, impidiendo la aglutinacion y la hemolisis y destruya otros elementos que pudieran interferir en el recuento, que se realiza en la camara de Neubauer, cuya capacidad es conocida. -6 3 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS PRACTICA N9 10 LIQUIDO CEFALORRAQUIDEO. SUSTENTO TEORICO. Aproximadamente el 70% del Ifquido cefalorraqufdeo se forma en los plexos coroideos ventriculares a traves de un proceso combinado de secrecion activa y ultrafiltracion a partir del plasma. Alrededor del 30% de LCR se forma como Ifquido intersticial, elaborado dentro los espacios intracelulares del cerebro y de la medula espinal. La reabsorcion de LCR se produce a traves de las vellosidades aracnoideas de los senos durales. EL LIQUIDOCEFALORRAQUIDEO ES: • Un Ifquido transparente e incoloro que se produce dentro de las cavidades o ventrfculos del cerebro, por el plexo coroides y el plasma sangufneo que se derrama. • Bana al cerebro, la medula espinal y las meninges. La acumulacion excesiva de Ifquido cerebroespinal resulta en la dilatacion anormal de los espacios en el cerebro llamados ventrfculos. Esta dilatacion ocasiona una presion potencialmente perjudicial en los tejidos del cerebro y es causante de la hidrocefalia. Su production es aproximadamente 500 ml diarios, aunque el sistema solo cuente con 120 a 150 ml. El LCR es sustituido en su totalidad tres veces diarias, cada 6 a 7 horas es renovado completamente. La funcion principal del LCR es mantener flotando al encefalo, actuando como amortiguador. Del mismo modo sirve de vehfculo para eliminar los desechos y fluir entre el craneo y al espina dorsal para compensar los cambios en el volumen de sangre intracraneal y en menor grado, desechos y nutrir al cerebro. -64- sirve como vehfculo para eliminar MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS COMPOSIClbN. • Sodio. • Cloro. • Magnesio. • Potasio. • Bicarbonato y fosfatos. • Glucosa. • Protemas. OBTENCION DE LIQUIDO CEFALORRAQUIDEO MEDIANTE TECNICA DE PUNCION LUMBAR: 1. -Se selecciona el sitio de puncion, generalmente en la L-4 Y L-5 o mas abajo, en el espacio L-5 se observa una pequena saliente osea que ayuda localizar el sitio de puncion, en este sitio se limpia con alguna solucion antiseptica y el area circundante se cubre con una sabana esteril de manera que no obstruya el campo visual. 2. A continuation se inyecta un anestesico local lentamente en la dermis alrededor del sitio elegido para la puncion. 3. Posteriormente se introduce una aguja especial con estilete en la linea media entre ambas apofisis del espacio lumbar hasta que penetre en el espacio subracnoideo. 4. Con la aguja adentro del espacio, se extrae el estilete y se coloca en su lugar un manometro para medir la presion LCR. 5. Se extraen de 10-20 ML de LCR que se dividen en 3 muestras de 2 a 3ml cada una en tubos distintos esteriles y con rotulos secuenciales: -65- MANUAL DE PRACTICAS DE LABO RATO RIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS • El tubo 1 se utiliza para pruebas bioquimicas y serologicas. • El tubo 2 para microbiologia. • El tubo 3 para pruebas citologicas. 6. Al retirar la aguja se mide nuevamente la presion, en caso de encontrar hipertension intracraneanal se extrae muy poco Ifquido por el riesgo de que el tallo cerebral quede fuera de lugar. 7. Se coloca una gasa esteril en el sitio de puncion. 8. Los tubos.se rotulan con el # secuencial 1, 2, 3, el nombre del paciente y la fecha enviandose inmediatamente al laboratorio. Existen otros metodos alternatives que se utilizan en casos especiales, como la puncion sisternal o suboxipital, que implica ser una puncion debajo del hueco occipital. Esto resulta peligroso, porque esta muy cerca del tronco encefalico, siempre es realizado con fluoroscopia (rayos X especiales). La puncion ventricular, es menos comun, se realiza en el quirofano, en la cual se hace un orificio en el craneo y se inserta una aguja directamente en uno de los ventriculos del cerebro. Se recotecta el .liquido. cefalorraquideo IMPORTANCE CLINICA: Las infecciones del SNC se dividen en varias categorfas que pueden ser diferenciadas facilmente entre si mediante el examen del LCR. -66- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLQGICAS La meningitis es una inflamacion caracterizada por la inflamacion de las meninges. La causa mas frecuente de este tipo de inflamacion es a causa de bacterias (Neisseria meningitidis, Haemophilius influenza, Streptococus pneumonae) las cuales progresan de una manera muy rapida llevando a un fatal desenlace. Estos agentes Ilegan por medio de la nariz o la boca, alojandose en las meninges y Ifquido cerebroespinal. Las meningitis causadas por hongos, intoxicaciones, medicamentos o virus, son menos frecuentes, y por lo regular siguiendo un tratamiento adecuado pueden curarse mas facilmente, a diferencia de las meningitis bacterianas. Aunque cualquier persona puede contraer meningitis, es una enfermedad especialmente frecuente en ninos y personas inmunosuprimidas. Los sfntomas mas frecuentes son dolor de cabeza y rigidez de la nuca que tiende a asociarse con fiebre, intolerancia anormal a la luz o a los sonidos y trastornos de la conciencia. A menudo, especialmente en ninos pequenos, solo se presentan sfntomas inespecfficos, tales como irritabilidad y somnolencia. Si se presentan erupciones en la piel, puede indicar una forma particular de meningitis, como la meningococcemia. Existen diferentes maneras de prevenir la meningitis. Algunas vacunas existentes contra la meningitis en el mercado solo protegen un solo tipo de bacteria determinada. Existen vacunas contra el meningococo C, otra que protege contra el Haemophilus influenza tipo B (Hib) y, tambien, la del neumococo. Es por ello que cuando uno recibe una vacuna contra la meningitis (actualmente referida a la del meningococo C), solo quedara inmune frente al tipo de germen pero no frente al resto de las multiples posibilidades. Es decir, que aunque recibamos muchas vacunas contra la meningitis, siempre es posible contraer meningitis por otros germenes o causantes externos. -67- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLQGICAS Y FISIOLOGICAS PRUEBAS DE LABORATORIO: -Examen ffsico del LCR: • Aspecto: en condiciones normales, el LCR es cristalino, con un aspecto y viscosidad comparables al agua. Los leucocitos o eritrocitos pueden producir un LCR opaco o turbio. La turbidez a su vez, puede estar causada por microorganismos (bacterias u hongos). • Color: el LCR es totalmente incoloro, patologicamente adquiere coloracion amarillenta o rojiza. • Densidad: 1.oo6- 1.008. -Examen quimico de LCR: • Glucosa: 50 a 75 mg/100ml en adultos, y en ninos de 70 a 90 mg/100ml. • Protefnas: de 15 a 40 mg/100 ml. • Cloruros: 700 a 750 mg/100 ml. -Examen citologico: • Cuenta celular total en adultos 0-10/mm3 y en ninos de 0-20/mm3. • Observacion de celulas epiteliales. • En condiciones normales, el LCR no presenta celularidad. -Examen microbiologico: • Tincion de Gram. • Tincion con tinta china. • Cultivo. -68- : MANUAL DE PRACTiCAS DE LABORATORIO DE CIENCIAS MORFOLQGICAS Y FISIOLQG1CAS OBJETIVO. Conocer la importancia clfnica que tiene el Ifquido cefalorraqufdeo (LCR), asf como las pruebas qufmicas, citologicas y microbiologicas que se le realizan; del mismo modo aprender a evaluar el aspecto ffsico y conocer la manera de extraction de LCR. DESCRIPCION DE LA PRACTICA. En esta practica se busca llevar a cabo las diferentes pruebas que se le realizan al LCR, como son el examen ffsico, qufmico y microbiologico. TECNICA. > EXAMEN FISICO: 1. Observar el aspecto y color del Ifquido cefalorraqufdeo. 2. Medir el volumen del LCR. 3. Medir la densidad del LCR, colocando una gota en el refractometro, y se observa a contra luz la medida que marca la densidad. 4. Medir el pH del LCR colocando una gota sobre la tira reactiva indicadora de pH. TIRA REACTIVA INDICADORA DE pH -69- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS SE OBSERVA LA DENSIDAD EN EL REFRACTOMETRO. > EXAMEN CITOLOGICO: 1. Con la ayuda de una pipeta Pasteur, se coloca una pequena gota de liquido cefalorraquideo en la camara de neubauer. 2. Se le coloca el cubreobjetos a la camara de neubauer. 3. Se enfoca la camara de neubauer en el microscopio, en el objetivo de 40X y se observa si existe celularidad. -70- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS > EXAMEN MICROBIOLOGICO: 1. Se realiza un frotis de LCR y se fija con calor, cuidando no quemar la muestra. 2. Posteriormente, se tine mediante la tecnica de Gram: 1 minuto de cristal violeta, se enjuaga con agua corriente, 1 minuto de lugol y se enjuaga con agua corriente, se decolora con alcohol acetona hasta que deje de salir hilos del colorante y por ultimo se tine con safranina durante 30 s, se enjuaga con agua corriente y se deja secar al aire. 3. Se observa al microscopio en 100X con aceite de inmersion para ver si existe la presencia de bacterias. MATERIAL DE LABORATORIO. • Pipeta Pasteur. • Camara de Neubauer. • Lampara de alcohol. • Portaobtejos: • Cubreobjetos. • Refractometro. • Microscopio. REACTIVOS. • Colorante cristal violeta. • Yodo lugol • Alcohol acetona. -7 1 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLQGICAS • Safranina. MATERIAL BIOLOGICO. • Muestra de LCR. CUESTIONARIO. 1. <i,Que es el LCR y cual es su funcion? R= Un llquido de transporte e incoloro que se produce dentro de las cavidades o ventrfculos del cerebro por el plexo coroides y el plasma sangumeo que se derrama. Su principal funcion es mantener al encefalo flotando. ; 2. ^Que estudios se llevan a cabo en el LCR? R= Se realiza un examen ffsico, qufmico, citologico y microbiologico. 3. iQ ue afeccion es la responsable de la inflamacion de las meninges? R= La meningitis, que puede ser causada por virus, bacterias u hongos, y afecta principalmente a ninos y personas inmunodeprimidas. - 72 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS PRACTICA N9 11 DISECCION DE UNA RATA SUSTENTOTEORICO. Muchas investigaciones cientfficas son realizadas en animates de experimentacion, dentro de los cuales se incluyen primates no humanos como el mono Rhesus, ungulados como las cabras y los borregos. Sin embargo, en la mayoria de los experimentos se emplean especies pequenas de mamiferos como los roedores; entre estos estan los conejos, los cobayos, los hamsteres y principalmente las ratas de laboratorio. Los aparatos y sistemas que conforman al organismo de los mamiferos son los siguientes: Xavidad nasal Fosa nasal Laringe Pulmon derecho Pulmon I izquierdo APARATO RESPIRATORIO: El aparato respiratorio es el encargado de captar oxigeno y eliminar dioxido de carbono procedente del metabolismo celular. El aparato respiratorio generalmente incluye tubos, como los bronquios, usados para cargar aire en los pulmones, donde ocurre el intercambio gaseoso. El diafragma, como todo musculo puede contraerse y relajarse. En la inhalacion, el diafragma se contrae y se allana y la cavidad toracica se amplfa. Esta contraccion crea un vacfo que succiona el aire hacia los pulmones. En la exhalacion, el -7 3 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS diafragma se relaja y retoma su forma de domo y el aire es expulsado de los pulmones. En humanos y otros mamiferos, el sistema respiratorio consiste en vfas aereas, pulmones y musculos respiratorios que median en el movimiento del aire tanto dentro como fuera del cuerpo. APARATO CIRCULATORIO: Es la estructura anatomica que comprende conjuntamente tanto al sistema cardiovascular que conduce y hace circular la sangre, como al sistema linfatico, que conduce la linfa. Esta conformado por arterias, venas, sangre, capilares y el corazon, el cual consiste en un haz de tejido especializado que genera una corriente electrica. Este marcapasos natural produce una contraccion muscular que impulsa la sangre a todo el organismo. -74- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS Intestine __Intestino grueso Ap6ndice detgado IPW SISTEMA DIGESTIVO: Es el conjunto de organos (boca, faringe, esofago, estomago, intestino delgado e intestino grueso) encargados del proceso de la digestion, es decir, la transformation de los alimentos para que puedan ser absorbidos y utilizados por las celulas del organismo. La funcion que realiza es la de transporte (alimentos), secrecion (jugos digestivos), absorcion (nutrientes) y excrecion (mediante el proceso de defecacion). El proceso de la digestion es el mismo en todos los animales monogastricos: transformar los glucidos, lipidos y protefnas en unidades mas sencillas, gracias a las enzimas digestivas, para que puedan ser absorbidas y transportadas por la sangre. OBJETIVO. El objetivo de esta practica es que el alumno conozca como estan constituidos anatomicamente los diferentes aparatos y sistemas de un marmfero, tomando como modelo una rata de laboratorio. -75- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLQGICAS DESCRIPCION DE LA PRACTICA. Se anestesiara a una rata de laboratorio y se va a diseccionar para observar los aparatos y sistemas que la conforman. TECNICA. 1. Se anestesia a la rata haciendo unos calculos en donde por cada 250 g se va a inyectar .10 ml de anestesia. 2. Se deja que la anestesia haga efecto, y una vez dormida la rata, se va a amarrar de las cuatro patas, boca arriba, a los extremos de la tabla. -76- MANUAL DE PRACTICAS DE LABORATORY DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS 3. Antes de hacer el code abdominal, se rectifica que la rata este completamente dormida, pellizcando con las pinzas la piel del abdomen, y verificando que no chille o se mueva. 4. Si la rata ya esta completamente dormida, se va a diseccionar la cavidad abdominal, cuidando de no cortar algun organo. Se observara el aparato digestivo utilizando los separadores del estuche de diseccion. 5. Posteriormente, se va a diseccionar la cavidad toracica, cortando las costillas con las tijeras. Se podra observar el corazon y los pulmones. 6. Una vez estudiado todo el organismo de la rata, se va a inyectar anestesia directamente en su corazon para provocarle la muerte. 7. Finalmente, se cierra la rata y se Neva a los desechos biologicos. -7 7 - MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIQLOGICAS MATERIAL. • Estuche de diseccion. • Tabla con sujetadores. • Ligas. • Guantes. • Cubre bocas • Bata MATERIAL BIOLOGICO: • Rata de laboratorio. CUESTIONARIO: 1. iQ ue calculos se hacen para anestesiar a una rata de laboratorio? R= Se va inyectar por cada 250 g, .10 ml de anestesia. 2. iQ ue aparatos y sistemas se observaran? R= Sistema digestivo, aparato circulatorio y respiratorio. -78- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS BIBLIOGRAFIA s Anatomfa Humana W. J. Hamilton. Publicaciones culturales, S.A. s Histologfa 3- edicion. C. Roland Leeson. Editorial Interamericana. S Anatomfa humana. Ruth Ashgey. Editorial Limusa. s Fundamentos de anatomfa y fisiologfa humanas. Shirley R. Burke. Editorial Limusa. s Histopatologfa. Dr. Robertson F. Ogilvie. Editorial Interamericana, S.A. s Fisiopatologfa clfnica 5a edicion. William A. Sodeman, Jr. William A. Sodeman. Editorial Interamericana. s Fisiologfa humana 4- edicion. Arthur C. Guyton. Editorial Interamericana. s Manual de la enfermerfa moderna. Margaret A. Tracy. Union topografica editorial Hispano-Americana. s Qufmica Clfnica, principios y procedimientos. -79- MANUAL DE PRACTICAS DE LABORATORIO DE CIENCIAS MORFOLOGICAS Y FISIOLOGICAS Viguer J. M. Editorial Interamericana de Espana S.A.U. s La clfnica y el laboratorio 21a edicion. J. M. Prieto Valtuena. J. R. Yuste Ara. s Tecnicas y metodos de laboratorio clfnico 3- edicion. Jose Manuel Gonzalez de Buitrago. Editorial Masson. PAGINAS WEB: s http://quimicoclinico.wordpress.com Y http://www.ugr.es/~jhuertas/FH-FE/fh_fisiologia.html s http://es.scribd.com/doc/8705123/Liquido-cefalorraquideo ^ http://www.auxilio.net/General-Manual/anatomia-y-fisiologia-basica.html s http://primeros-auxilios.idoneos.com/ s http://www.zubizarreta.org.ar/docs/MUESTRAS2.pdf -80-