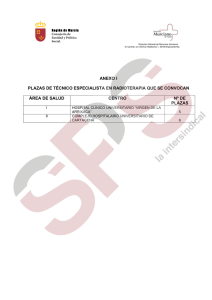
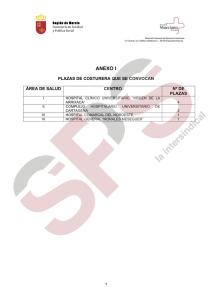
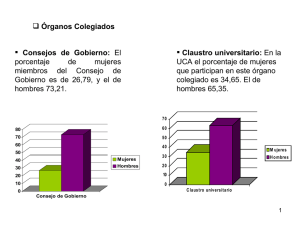
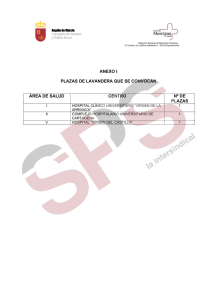
Cubiertas boletin 2.qxd
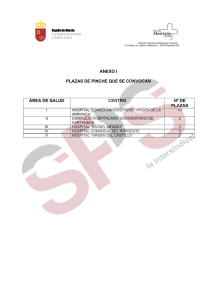
Anuncio

BOLETÍN TRIMESTRAL DEL GRUPO ESPAÑOL DE INVESTIGACIÓN EN CÁNCER DE MAMA Boletín GEICAM del Nº 6 – JUNIO DE 2003 El próximo mes de Junio se va a celebrar en Santander el 4º Simposio Internacional del GEICAM. En el interior de este número podrán encontrar el programa definitivo del mismo. Grupo Español de Investigación en Cáncer de Mama Interior boletin 2.qxd 19/06/03 18:48 Página 3 CONTENIDOS Pág. Carta del Presidente 4 Temas de revisión 6 Quimioprevención del cancer de mama: en la encrucijada (Dr. José Enrique Alés Martínez). Desde pGEICAM 12 Tumor filodes mamario. Una neoplasia de comportamiento biológico variable (Dra. María Francisca Garijo Ayensa) Aportaciones científicas del GEICAM 17 Ensayos clínicos del GEICAM 21 Desde el otro lado del espejo 39 La mujer protagonista en su proceso de cáncer de mama (Mª José Aybar) Desde la sede 42 Todo lo que siempre quiso saber de un gestor de datos y nunca se atrevió a preguntar (César García Serrano) Noticias y convocatorias 44 Programa del IV Simposio Internacional de GEICAM 45 Animamos a los lectores para que participen en la sección Tribuna abierta, en la que podrán expresar su opinión sobre los temas que deseen. Envíe su contribución para esta sección por correo a la dirección: GEICAM, Paseo de la Castellana 181, 16 dcha, 28046 Madrid, o por correo electrónico a la dirección [email protected] 3 Nº 6 – JUNIO DE 2003 Interior boletin 2.qxd 19/06/03 18:48 Página 4 Carta del presidente No me queda más remedio que iniciar esta carta refiriéndome al mismo asunto al que dediqué la carta del anterior Boletín: la investigación clínica en Europa. De aprobarse la Directiva Europea de buenas prácticas clínicas en la realización de ensayos clínicos de uso humano en su redacción actual, la Investigación Clínica promovida por grupos cooperativos se verá seriamente amenazada en Europa, ante la imposibilidad de que dichos grupos aporten la medicación en estudio (aun en el supuesto de que esté comercializada para la indicación estudiada). Es obvio que esta legislación parece pensada casi exclusivamente para regular la investigación clínica promovida por la Industria Farmacéutica con fines de registro de fármacos, a la vez que trata de terminar con la proliferación de pseudoensayos clínicos con fármacos comercializados que tiene como finalidad fundamental promover el consumo de los mismos. No obstante, los efectos colaterales de esta Directiva serán terribles y es de esperar que en muy pocos meses nos encontraremos ante un panorama desolador, en el que sólo los ensayos clínicos promovidos por la Industria Farmacéutica estén presentes. De haber estado vigente esta normativa hace 10 años, por ejemplo, el estudio GEICAM 9401, promovido exclusivamente por nuestro grupo, seleccionado para presentación oral en ASCO 2002 y pendiente de publicación en una prestigiosa revista oncológica, no se hubiera podido llevar nunca a cabo. Este ensayo intentó estudiar la mejor forma de administración (secuencial frente a concomitante) de quimioterapia y tamoxifeno adyuvantes en mujeres postmenopáusicas con cáncer de mama y ganglios positivos. El estudio encontró que la administración concomitante de ambas terapias era deletérea, reduciendo la supervivencia libre de enfermedad en aproximadamente un 5% a 5 años frente a la administración secuencial. Este resultado es coincidente con el de un estudio americano (Intergroup 0100) y ambos van a cambiar la práctica clínica en muchos hospitales del mundo. Por ejemplo, los hos- pitales miembros del grupo cooperativo norteamericano NSABP tradicionalmente utilizaban el tamoxifeno concomitantemente con la quimioterapia y han cambiado su política a raíz de la comunicación de estos dos estudios. El ensayo GEICAM 9401 es un ejemplo de estudio que no vamos a poder repetir más si se aplica la Directiva Europea antes mencionada. El propietario del tamoxifeno, por razones obvias, nunca tendrá el más mínimo interés en gastarse el dinero en promover un estudio de tal índole que, sin embargo, va a beneficiar a muchas mujeres futuras con cáncer de mama en el mundo. Lamentablemente, el beneficio que los futuros pacientes obtienen de la investigación clínica independiente parece no ser relevante para las personas que redactaron la futura normativa europea. Por fortuna, empiezan ya a percibirse algunas voces críticas en la Academia y aun en las asociaciones de mujeres que critican la ceguera de las autoridades europeas que redactaron en sus actuales términos esta directiva. La EORTC, el grupo BIG y GEICAM están siendo pioneros en la lucha contra esta desafortunada normativa. Recientemente se ha establecido un grupo de trabajo que engloba a estas tres instituciones y que ha iniciado una serie de actividades reivindicativas. Entre ellas, podemos mencionar la redacción de una Carta al Director de la revista Lancet alertando a los médicos europeos de la trascendencia práctica de esta normativa, que convertirá a Europa en el pariente pobre de la investigación clínica independiente mundial. Asimismo, se han iniciado contactos con eurodiputados (incluidos españoles) para sensibilizarlos sobre el grave problema que se avecina. Desde esta tribuna quiero solicitaros de nuevo una actitud activa y beligerante a favor de la investigación clínica independiente, en todos aquellos foros en los que tengáis la oportunidad de participar. En otro orden de cosas, el pasado mes de Mayo se firmó el contrato NSABP-GEICAM para realiza4 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 18:48 Página 5 ción conjunta del estudio NSABP B-33 (exemestano versus placebo como terapia adyuvante en mujeres que han recibido 5 años de tamoxifeno adyuvante). Este estudio constituye un hito histórico para nuestro grupo y una prueba de fuego para su prestigio internacional, y también, su futuro a medio plazo, ya de que de resultar la experiencia positiva no se descartan futuras colaboraciones entre ambos grupos. Estoy convencido de que los miembros de GEICAM han percibido sobradamente la importancia de un reclutamiento rápido y entusiasta, por lo que no insistiré más en resaltar la necesidad de una actitud activa en la búsqueda de pacientes para el ensayo. Uno de los estudios de GEICAM, el TARGET 0, que compara FAC con TAC como terapia adyuvante de pacientes con cáncer de mama y ganglios negativos, ha sido objeto de atención en los últimos meses. El estudio, cuyos resultados de tolerancia con o sin filgrastim se presentaron en la última reunión de la American Society of Breast Diseases celebrada en abril en Dallas, ha merecido la atención tanto de Aventis internacional como de las autoridades españolas. Hace un par de meses, recibimos la visita del Dr Antoine Yver, Senior Director of Oncology de Aventis internacional, quien nos comunicó el interés de su compañía en incluir los datos de seguridad del estudio TARGET 0 en el dossier de solicitud de registro ante la FDA de Taxotere como terapia adyuvante del cáncer de mama. Para garantizar la solidez de nuestros datos, se han realizado auditorías a Aventis España, GEICAM y Pivotal (la CRO del Dr. Ibrahim Fahr que se encarga de la monitorización del estudio), con un resultado satisfactorio, por lo que dichos datos serán finalmente incorporados al citado dossier. Por otro lado, el estudio TARGET 0 está teniendo el honor de ser el primer estudio español auditado por la Agencia Española del Medicamento en su nueva etapa de aplicación de la Directiva Europea 2001/20/CE. Diversas auditorías se han realizado ya en Córdoba, Jaén y Cuenca y otras están programadas en otras ciudades. Os aseguro que esta elección no ha sido una casualidad, 5 sino que refleja el interés de la Agencia por iniciar sus actividades auditoras con los menores problemas posibles. Quiero también anunciaros que dos nuevos estudios adyuvantes se encuentran actualmente en fase de implementación y discusión, respectivamente. El primero de ellos, en mujeres con ganglios axilares negativos, será un estudio de GEICAM en colaboración con Bristol Myers-Squibb España, y su diseño fue decidido y aprobado en la última reunión de la Junta Directiva de nuestro grupo. En los próximos días recibiréis el borrador del protocolo, al que espero se adhieran al menos tantos centros como al TARGET 0. El segundo estudio, en mujeres con ganglios axilares positivos, es un estudio BCIRG que substituirá al fallido BCIRG 008, que ha debido anularse ante la decisión de Roche de retirar su colaboración. El nuevo diseño, aun sometido a discusión, probablemente comparará TAC con la pauta de densidad de dosis de AC-paclitaxel del CALGB. Os mantendré informados de la propuesta final para que todos podamos hacer las sugerencias oportunas. Por último, cuando recibáis este Boletín, muchos de vosotros os encontraréis asistiendo al Congreso de GEICAM. Os deseo que disfrutéis al máximo con el programa científico y social que de forma tan entusiasta ha organizado el Dr. José Manuel López Vega, a quien quiero agradecer desde aquí en nombre del grupo todos sus desvelos y esfuerzos. Miguel Martin PRESIDENTE DE GEICAM Nº 6 – JUNIO DE 2003 Interior boletin 2.qxd 19/06/03 18:48 Página 6 Temas de revisión DR. JOSÉ ENRIQUE ALÉS MARTÍNEZ, Unidad de Oncología Médica,Hospital Ruber Internacional, Madrid Quimioprevención del cáncer de mama: en la encrucijada La pertenencia al sexo femenino es el principal, aunque no exclusivo, factor de riesgo para la aparición del cáncer de mama y su desarrollo está íntimamente ligado a la exposición a estrógenos por parte del tejido glandular mamario. Este vínculo hormonal se ha detectado en numerosos estudios epidemiológicos (1) y se recoge de forma indirecta en varios componentes del principal algoritmo validado para predecir el riesgo de desarrollar cáncer de mama (2-4), de ahí el atractivo de utilizar la manipulación del ambiente hormonal con fines preventivos. Demostración de la hipótesis Además de los hallazgos epidemiológicos, los datos en modelos animales (5) y la constatación de que el tratamiento con tamoxifeno adyuvante en pacientes con cáncer de mama operable disminuía la incidencia de cáncer de mama contralateral (6) justificaron el diseño y lanzamiento de varios ensayos de prevención del cáncer de mama con tamoxifeno a principios de la década de los noventa (7-9). Estos ensayos tenían diferencias significativas en cuanto a los criterios de selección y el tamaño muestral, aunque compartían un diseño aleatorizado y una rama control con placebo. El primer resultado positivo fue comunicado por el NSABP en su estudio P-1 que demostró una reducción del 50% del riesgo de aparición de cáncer de mama en una población de riesgo elevado seleccionada mediante el algoritmo de base epidemiológica de Gail (7). Los ensayos realizados por el Royal Marsden y el grupo italiano se publicaron inicialmente como estudios negativos, esto es, sin demostración de superioridad de tamoxifeno sobre placebo (8,9). Sin embargo, un análisis cuidadoso de los criterios de selección de las pacientes, del desarrollo de estos ensayos en cuanto a cumplimiento de los tratamientos y su menor tamaño muestral, explican que los resultados fueran aparentemente opuestos a los del estudio P-1 (Tabla 1). Son estudios, no obstante, que ayudan a comprender y definir los límites de la eficacia del tamoxifeno como agente preventivo del cáncer de mama. Más tarde, el ensayo IBIS-1 encontró resultados similares al estudio P-1 aunque el efecto preventivo fue algo menor. 6 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 18:48 Página 7 Ensayo Inclusión Exclusión Edad (mediana) THS (%) % con familia 1er grado Antecedentes mama THS actual, Modelo Gail EP o TVP, > 1,66 riesgo 5 THS o contraaños cep. orales 3 o LCIS 52 Exclusión uso de THS 75 7% LCIS; 10% ADH Énfasis en ant. Cáncer previo, EP o TVP familiares 51 40 96 5% con LCIS o ADH Aumento riesgo, Cáncer previo, Royal EP o TVP familiar Mardsen 1er grado 47 42 100 51 19 21 11 DCIS (excluidos); ninguno LCIS o ADH Ninguno LCIS o ADH NSABP P1 meses, Hª de DCIS IBIS-1 Italiano Histerectomía, No necesario riesgo CM EP o TVP Adaptado de Chlebowski et al. (J Clin Oncol 2002;20:3328) Tabla 1. Ensayos aleatorizados con tamoxifeno Los límites del tamoxifeno A pesar de su probada eficacia el uso general de tamoxifeno como agente preventivo se ha visto limitado por varias razones. En primer lugar, tamoxifeno se ha asociado con varios efectos secundarios potencialmente graves, destacando el cáncer de endometrio y los fenómenos de tromboembolismo venoso. Por ello, se han explorado diversos escenarios para averiguar que personas pueden tener un perfil de riesgo/beneficio que les permita obtener un beneficio más claro de la quimioprevención con tamoxifeno (12,13). La conclusión general es que el nivel de riesgo aconsejable para usar tamoxifeno en el contexto de la práctica clínica debe estar bastante por encima del riesgo quinquenal del 1,66% utilizado para la inclusión de pacientes en los estudios P-1 y STAR. Es interesante que tamoxifeno reduce la incidencia de cáncer de mama cuando el riesgo es superior al "normal", pero no disminuye el riesgo de fondo de la población según se deduce de un reanálisis reciente del estudio italiano (14) y del análisis de la reducción del riesgo de cáncer de mama en función del nivel de estradiol basal en las participantes en el estudio MORE (15) (Figura 1). Un segundo aspecto a tener en cuenta es el gran número de sujetos sanos que deben tratarse para prevenir un caso de cáncer, o más aun, para salvar una vida. Además, tamoxifeno no sólo aumenta la frecuencia de los acontecimientos adversos graves de riesgo vital mencionados, sino que produce una serie de efectos perturbadores de la calidad de vida que deben estar plenamente justificados si se usara sobre una gran base poblacional. El grupo de trabajo al respecto de los Servicios de Prevención estadounidenses ("U.S. Preventive Services Task Force") ha concluido que "los daños potenciales de la quimioprevención pueden superar los beneficios potenciales en mujeres que no tienen un riesgo alto de cáncer de mama". En el caso de las mujeres con riesgo alto el informe declara que "el balance entre beneficios y perjuicios puede ser favorable en algunas mujeres de alto riesgo pero depen- 7 Nº 6 – JUNIO DE 2003 Quimioprevención del cancer de mama Finalmente, una revisión reciente que analiza en conjunto los datos actualizados de los estudios anteriores prueba definitivamente que el tamoxifeno puede reducir el riesgo de aparición de cáncer de mama en mujeres con un riesgo superior al "normal" (10). En el ensayo MORE, cuyo objetivo principal era demostrar la eficacia del tratamiento de la osteoporosis con raloxifeno (otro modulador selectivo de los receptores de estrógenos), la incidencia de tumores de mama se redujo drásticamente en las mujeres tratadas con raloxifeno en comparación con las tratadas con placebo (11). En resumen, ha quedado plenamente objetivado que la manipulación del ambiente hormonal en la mujer mediante bloqueo estrogénico puede prevenir de forma significativa la aparición de cáncer de mama. 19/06/03 18:48 Página 8 derá del riesgo de cáncer de mama, el riesgo potencial de efectos secundarios y las preferencias individuales de las pacientes" (16). Reducción del 76% 3 % de cáncer a los 4 años TEMAS DE REVISIÓN Interior boletin 2.qxd 2,5 Placebo 2 1,5 Raloxifeno 1 0,5 0 0-0 0-5 0-10 >10 Nivel de estradiol basal (pmol/L) Figura 1. En el estudio MORE las pacientes del grupo placebo tenían mayor riesgo de desarrollar cáncer de mama en función de los niveles basales de estradiol. Raloxifeno abolía las diferencias. Líneas actuales de investigación Entonces, ¿que opciones tenemos si tamoxifeno no puede aplicarse de forma generalizada? Hay varios agentes y aproximaciones en activa investigación para tratar de obtener una respuesta. Por ejemplo, los resultados de raloxifeno en el estudio MORE son extraordinariamente prometedores y el estudio STAR (tamoxifeno frente a raloxifeno en mujeres posmenopáusicas con los mismos criterios de inclusión que el estudio P-1) dirá si el balance riesgo/beneficio puede empujarse hacia el lado de los beneficios gracias a una menor incidencia de nuevos casos de cáncer de endometrio. Sin embargo, no es probable que los problemas de tipo tromboembólico sean menores con raloxifeno que con tamoxifeno (10, 11). Se ha especulado que una pequeña dosis de antiagregantes plaquetarios puede contrarrestar este efecto protrombótico de los SERMS. Es posible que los resultados del estudio RUTH (17), que compara raloxifeno con placebo en mujeres con riesgo cardiovascular elevado, ayuden a despejar esta incógnita ya que el 50% de las pacientes incluidas tomaban aspirina a dosis bajas. Estos datos estarán disponibles en 2005. También los inhibidores de la aromatasa han comenzado a investigarse como agentes preventivos debido, sobre todo, a los primeros resultados del estudio ATAC, demostrando la superioridad de anastrozol sobre tamoxifeno en términos de eficacia y un perfil de seguridad generalmente mejor que el de tamoxifeno, incluyendo menos tumores de endometrio y menos episodios vasculares (18). Además, la incidencia de nuevo cáncer de mama contralateral fue menor en las pacientes tratadas con anastrozol respecto a las tratadas con tamoxifeno, pro- 8 Boletín del GEICAM 19/06/03 18:48 Página 9 porcionando el mismo tipo de evidencia que justificó los ensayos de quimioprevención con tamoxifeno. Por todo ello se han puesto en marcha varios ensayos clínicos para comprobar si anastrozol mejora los resultados de tamoxifeno en mujeres con antecedentes de carcinoma de mama intraductal (NSABP B35, IBIS-II DCIS) o mujeres con riesgo elevado de cáncer de mama (IBIS-II). Desafortunadamente, anastrozol no está exento de efectos indeseables. Su potente efecto antiestrogénico se ha asociado con un aumento de fracturas óseas en el ensayo ATAC. Este efecto secundario es especialmente preocupante considerando que las mujeres posmenopáusicas ya tienen un riesgo mayor de fracturas osteoporóticas y el gran número de mujeres que se verían expuestas al fármaco en cualquier iniciativa poblacional de quimioprevención. Esto ha llevado a preconizar por algunos el uso simultáneo y profiláctico de inhibidores de la aromatasa y bifosfonatos para impedir la pérdida de masa ósea. Esta posible solución parece plausible aunque faltan datos que confirme su utilidad en el contexto de la quimioprevención. En cualquier caso ello supone mayor complejidad de manejo y un gasto añadidos que deben medirse con precaución en este contexto. Otro inhibidor de la aromatasa, el exemestano, tiene un potencial prometedor como agente preventivo del cáncer de mama y protector, al mismo tiempo, de la masa ósea. La razón parece residir en uno de sus metabolitos, el 17-hidroxiexemestano, que tiene una débil acción androgénica. En modelos animales exemestano protege frente a la pérdida ósea causada por la extirpación quirúrgica de los ovarios (19). En mujeres posmenopáusicas sanas tratadas con exemestano no se aprecia un aumento de los marcadores de recambio óseo que indiquen pérdida ósea (20). La utilidad potencial de exemestano para la prevención se ha comenzado a explorar en varios estudios piloto que utilizan criterios intermedios de valoración de la eficacia y la seguridad como la densidad mamaria, parámetros de resonancia magnética y marcadores de recambio óseo en varias poblaciones de pacientes. El ensayo Apres, explorará el potencial de exemestano como agente preventivo en mujeres portadoras de mutaciones BRCA1 y 2. Igualmente los resultados de los ensayos que comparan tamoxifeno con exemestano en el tratamiento adyuvante de mujeres con cáncer de mama operable ayudarán a definir la eficacia de exemestano y su perfil de seguridad, pero sólo la realización de ensayos específicamente diseñados para quimioprevención podrá definir el papel exacto de exemestano en la prevención del cáncer de mama. El proyecto GEICAM de quimioprevención En la asamblea general de GEICAM de abril de 2002 se propuso un proyecto de quimioprevención que con algunas modificaciones se presentó para obtener financiación del FIS dentro del programa de redes. Básicamente consistía en un doble ensayo clínico, uno en mujeres con antecedentes de carcinoma intraductal y otro en una población de riesgo elevado semejante a la de los estudios P-1, STAR o IBIS-I. En ambos casos se eligió exemestano como el agente más prometedor y rama experimental de los ensayos. Sobre la base de estos ensayos se incluían subestudios de seguridad respecto a la evolución de la masa ósea, imágenes obtenidas por resonancia magnética y otros atractivos proyectos de investigación traslacional. Desafortunadamente el proyecto no ha obtenido la financiación deseada a pesar de obtener la calificación de "excelente" por parte de un jurado evaluador internacional. Es el momento de retomar el proyecto y adaptarlo a las posibilidades reales del grupo en el momento actual, eligiendo como base de partida uno de los ensayos propuestos inicialmente. Cualquiera de los dos ensayos, carcinoma intraductal o población de riesgo elevado, exigirá un gran esfuerzo de selección de candidatas, colaboración con otras entidades y un número elevado de sujetos. En mi opinión, sin embargo, el modelo que mejor se adecua a las características de GEICAM como grupo de investigación oncológica es el proyecto en mujeres con antecedentes de carcinoma intraductal. En primer lugar se trata de pacientes ya identificadas en cuanto a su patología y por tanto no sería necesario utilizar procedimientos de cribado 9 Nº 6 – JUNIO DE 2003 Quimioprevención del cancer de mama Interior boletin 2.qxd TEMAS DE REVISIÓN Interior boletin 2.qxd 19/06/03 18:48 Página 10 poblacional para su selección. Además este modelo homogeneiza la población en cuanto al riesgo esperable de desarrollo de cáncer de mama infiltrante o nuevo cáncer intraductal y facilita la extensión (exportación) del ensayo a otros países/grupos cooperativos con muy diferentes incidencias de cáncer de mama en la población general. No olvidemos que uno de los escollos teóricos que se plantean en un ensayo de prevención de base poblacional es la distinta incidencia de cáncer de mama en distintas áreas geográficas y la necesidad de validar cualquier herramienta de estimación del riesgo. Desde el punto de vista de la aplicación del ensayo como base para proyectos de investigación traslacional, el modelo "in situ" presenta un enorme atractivo. Por ejemplo, acaba de demostrarse que existen importantes similitudes en cuanto al perfil de expresión genético en los estadios preinvasivo e invasivo del cáncer de mama (21). Por tanto, se podrán formular preguntas de enorme interés y crear un banco de muestras de carcinoma in situ originado prospectivamente cuya utilidad trasciende la propia del ensayo. El modelo que se propone se refiere a mujeres posmenopáusicas diagnosticadas de carcinoma intraductal y candidatas a tratamiento con cirugía conservadora, radioterapia y terapia hormonal. Se compararía exemestano frente a una rama control de tamoxifeno o bien anastrozol, por su papel de tratamiento emergente en los estudios de quimioprevención ya iniciados. Una segunda aleatorización muy interesante investigaría el papel de los inhibidores de la enzima cox-2 en la iniciación y mantenimiento del proceso neoplásico (Figura 2). Criterios de inclusión exemestano x 5 años Postmenopausicas exemestano x 5 años + celecoxib DCIS tratadas focalmente (LCIS, ADH) tamoxifeno x 5 años n=3000 tamoxifeno x 5 años + celacoxib Figura 2. Proyecto de quimioprevención en pacientes con carcinoma in situ Conclusiones La quimioprevención del cáncer de mama mediante la manipulación hormonal estrogénica es un hecho demostrado de forma definitiva. Aunque los efectos secundarios impiden su uso indiscriminado, existen grupos de mujeres que pueden beneficiarse ya hoy día del uso de tamoxifeno y disminuir así de forma considerable sus posibilidades de desarrollar cáncer de mama: mujeres premenopáusicas con riesgo alto, mujeres posmenopáusicas sin útero, no fumadoras y sin predisposición elevada para trombosis venosa y mujeres con antecedentes de carcinoma intraductal o hiperplasia ductal atípica son ejemplos a tener en cuenta. En Estados Unidos se estima que más de 2 millones de mujeres podrían beneficiarse de la quimioprevención con tamoxifeno, tomando sólo en consideración aquellas con un beneficio neto estimado claro (22). En la actualidad existen diversos proyectos internacionales de investigación con la inclusión ya finalizada o en curso que a partir de 2005 comenzarán a arrojar luz sobre si es posible mejorar el balance riesgo/beneficio de tamoxifeno. Sin embargo quedan lagunas considerables en 10 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 18:48 Página 11 las que no hay iniciativas visibles a corto plazo como son la prevención en mujeres premenopáusicas no elegibles para tamoxifeno, la prevención del cáncer de mama con receptores negativos y la disminución del riesgo "normal" en mujeres sin factores de riesgo sobreañadidos. Bibliografia 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. Kelsey, J. L. and Bernstein, L. Epidemiology and prevention of breast cancer. Annu Rev Public Health 1996;17:47-67. Gail MH, Brinton LA, Byar DP, Corle DK, Green SB, Schairer C, et al. Projecting individualized probabilities of developing breast cancer for white females who are being examined annually. J Natl Cancer Inst 1989;81:1879-86. Costantino JP, Gail MH, Pee D, Anderson S, Redmond CK, Benichou J, et al. Validation studies for models projecting the risk of invasive and total breast cancer incidence. J Natl Cancer Inst 1999;91:1541-8. Anderson SJ, Ahnn S, Duff K. NSABP breast cancer prevention trial risk assessment program, Version 2. NSABP Biostatistical Center Technical Report. Pittsburgh (PA): Department of Biostatistics, University of Pittsburgh; August 14, 1992. Jordan VC. Effect of tamoxifen (ICI 46,474) on initiation and growth of DMBA-induced rat mammary carcinomata. Eur J Cancer 1976;12:419-24. Fisher B, Redmond C. New perspective on cancer of the contralateral breast: a marker for assessing tamoxifen as a preventive agent . J Natl Cancer Inst 1991;83:1278-80. Fisher, B et al. Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P-1 Study. J Natl Cancer Inst 1998;90:1371-88. Powles, T et al.. Interim analysis of the incidence of breast cancer in the Royal Marsden Hospital tamoxifen randomised chemoprevention trial. Lancet 1998;352:98-101. Veronesi, U. et al. Prevention of breast cancer with tamoxifen: preliminary findings from the Italian randomised trial among hysterectomised women. Italian Tamoxifen Prevention Study. Lancet 1998;352:93-7. Cuzick, J.et al. Overview of the main outcomes in breast-cancer prevention trials. Lancet 2003;361:296-300. Cauley, J. A. et al. Continued breast cancer risk reduction in postmenopausal women treated with raloxifene: 4-year results from the MORE trial. Multiple outcomes of raloxifene evaluation. Breast Cancer Res Treat 2001;65:125-34. Gail, MH et al. Weighing the risks and benefits of tamoxifen treatment for preventing breast cancer. J Natl Cancer Inst 1999;91:1829-46. Hershman, D. et al. Outcomes of tamoxifen chemoprevention for breast cancer in very high-risk women: a cost-effectiveness analysis. J Clin Oncol 2002;20:9-16. Veronesi U, et al. Italian randomized trial among women with hysterectomy: tamoxifen and hormonedependent breast cancer in high-risk women. J Natl Cancer Inst 2003;95:160-5 Cummings SR, et al. Serum estradiol level and risk of breast cancer during treatment with raloxifene. JAMA 2002;287:216-20. U.S. Preventive Services Task Force. Chemoprevention of Breast Cancer: Recommendations and Rationale. Ann Intern Med 2002;137:56-8. Mosca L, et al. Design and methods of the Raloxifene Use for The Heart (RUTH) study. Am J Cardiol 2001;88:392-5. Buzdar A, on behalf of the ATAC Trialists' Group. The ATAC ('Arimidex', Tamoxifen, Alone or in Combination) trial in post-menopausal women with early breast cancer - updated efficacy results based on a median follow-up of 47 months. San Antonio Breast Cancer Symposium 2002. Abstract 13. Goss PE, Cheung AM, Lowery C, Hu H, Qi S. Comparison of the effects of exemestane, 17-hydroexemestane and letrozole on bone and lipid metabolism in the ovariectomized rat. San Antonio Breast Cancer Symposium 2002, abstract 415 Goss P, et al. A randomized, placebo-controlled, explorative study to investigate the effect of low estrogen plasma levels on markers of bone turnover in healthy postmenopausal women during the 12-week treatment with exemestane or letrozole. San Antonio Breast Cancer Symposium 2002, abstract 267 Ma XJ, et al. Gene expression profiles of human breast cancer progresión. Proc Natl Acad Sci USA 2003;100:5974-9 Freedman AN, et al. Estimates of the number of US women who could benefit from tamoxifen for breast cancer chemoprevention. J Natl Cancer Inst 2003;95:526-32. Freedman AN, et al. Estimates of the number of US women who could benefit from tamoxifen for breast cancer chemoprevention. J Natl Cancer Inst 2003;95:526-32. 11 Nº 6 – JUNIO DE 2003 Quimioprevención del cancer de mama GEICAM puede contribuir de una forma decisiva a la investigación de la prevención del cáncer de mama en mujeres posmenopáusicas recién diagnosticadas de carcinoma intraductal, incorporando atractivos proyectos de investigación traslacional y desarrollando esquemas de cooperación interdisciplinaria y con otros grupos que faciliten su ejecución. La búsqueda de nuevos sistemas de financiación será decisiva para el desarrollo de este y otros proyectos de similar envergadura. Interior boletin 2.qxd 19/06/03 18:48 Página 12 Desde pGeicam DRA. MARÍA FRANCISCA GARIJO AYENSA Departamento de Anatomía Patológica, Hospital Universitario "Marqués de Valdecilla", Facultad de Medicina de la Universidad de Cantabria.Santander Tumor filodes mamario. Una neoplasia de comportamiento biológico variable El tumor filodes mamario es una neoplasia bifásica constituida por elementos epiteliales maduros y un componente mesenquimal celular de elementos fusiformes. La incidencia del tumor es baja. Constituye el 0,3% de todos los tumores mamarios y el 2,5% de las neoplasias fibroepiteliales (1). Caracteres clínicos La neoplasia aparece más frecuentemente entre mujeres de 45 a 50 años de edad. Sin embargo existe un amplio rango de edades desde la adolescencia a la mujer de edad avanzada. En general las mujeres con tumor filodes son 15 a 20 años mayores que las que presentan un fibroadenoma. Las pacientes muestran a la exploración una tumoración mamaria. Algunas relatan una pequeña masa palpable durante años que ha crecido rápidamente en poco tiempo. Los tumores de gran diámetro pueden abombar la superficie cutánea con aumento de la trama vascular; incluso pueden complicarse con ulceración cutánea sin que sea signo de malignidad. Generalmente el tumor es multilobular, no adherido a la piel y libre a la movilización. Raramente son bilaterales o multicéntricos. Radiología y ecografía Los tumores filodes generalmente aparecen bien circunscritos, a veces con densidad lobulada en las mamografías. Las calcificaciones son poco frecuentes. Ecográficamente se presentan como masas sólidas, bien definidas, con ecos internos de bajo nivel. 12 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 20:54 Página 13 Caracteres macroscópicos La mayoría de estos tumores tienen un aspecto sólido, carnoso, con hendiduras que le confieren un patrón foliáceo. Pueden observarse áreas quísticas. El contorno suele ser lobulado, con límite bien definido. El tamaño es variable oscilando entre tumores pequeños y gigantes. El diámetro medio aproximado es de 5 cm (2). Diámetros de 40 cm observados en el pasado raramente se ven en la actualidad. Los focos de hemorragia y necrosis suelen aparecer en los tumores grandes. El tumor filodes se compone de dos elementos dominantes: hendiduras o espacios quísticos tapizados por células epiteliales y tejido mesenquimal hipercelular. Este se proyecta en la hendiduras ocasionando un patrón foliáceo. El elemento epitelial consta habitualmente de dos capas: las células epiteliales secretoras y las mioepiteliales. Se pueden observar cambios metaplásicos del tipo de epitelio escamoso y epitelio apocrino. Frecuentemente se observa hiperplasia epitelial, que en ocasiones es de carácter florido. La transformación maligna epitelial es muy rara. El componente mesenquimal muestra celularidad variable. Algunas lesiones son muy difíciles de diferenciar del fibroadenoma celular y otras son claramente sarcomatosas, sobre todo si se observa pleomorfismo. Existe un espectro tumoral que progresa desde lesiones de aspecto inocente a claramente malignas. En la gran mayoría de los casos el patrón bifásico sugiere un proceso benigno, con un componente mesenquimal de mayor celularidad que el del fibroadenoma, pero sin pleomorfismo y escaso número de mitosis. Pueden presentar zonas mixoides y áreas hialinizadas. Aunque la lesión es circunscrita no existe cápsula verdadera. La ocasional presencia de células gigantes grotescas no debe tomarse como indicativo de malignidad. En el otro extremo del espectro, representado por una minoría de los tumores, se sitúan los francamente sarcomatosos. Estos tumores francamente malignos tienen bordes infiltrativos, hipercelularidad del componente mesenquimal con sobrecrecimiento respecto al componente epitelial, atipia nuclear marcada del componente fusocelular e incremento en el contaje mitótico. Pueden aparecer patrones específicos de tipo liposarcoma, condrosarcoma, osteosarcoma, rabdomiosarcoma y otros incluyendo hemangiopericitoma e histiocitoma fibroso maligno, como datos evidentes de malignidad. En ocasiones próximos al tumor pueden evidenciarse nódulos satélites. Existe un grupo de tumores con caracteres intermedios que plantean problemas para el patólogo en orden a predecir el riesgo de recidiva local y el potencial metastásico. Los estudios dirigidos a resolver este grupo problemático no han establecido un patrón coherente que permita predecir con seguridad la evolución de estos tumores. Las razones de esta inseguridad se basan en el número relativamente bajo de casos en las series publicadas y la división variable que hacen los diferente autores en dos grupos (benignos y malignos) o en tres grupos (benignos, en el límite de la malignidad o "borderline" y malignos). Clasificación conductista No existe ningún carácter único que sirva para predecir la evolución clínica. Debido a la inconsistencia de los datos publicados Tavassoli (1) propuso que se abandonase la designación de tumor filodes benigno y se clasificasen estos tumores en "bajo grado" y "alto 13 Nº 6 – JUNIO DE 2003 Tumor filoides mamario. Una neoplasia de comportamiento biológico variable Caracteres microscópicos DESDE pGEICAM Interior boletin 2.qxd 19/06/03 20:54 Página 14 grado". Sin embargo esta clasificación es inadecuada puesto que da la impresión de que todos los tumores filodes son malignos, lo que no es cierto puesto que la mayoría se comportan como benignos. Los tumores filodes se han intentado clasificar en tres grupos: Benignos, en el límite de la malignidad y malignos. Los tumores filodes benignos presentan las siguientes características (3): 1. 2. 3. Márgenes expansivos Ausencia de atipia o atipia mínima en el componente mesenquimal Número de mitosis de 0 a 4 x 10 campos de gran aumento. Los tumores filodes malignos se caracterizan por (4): 1. 2. 3. 4. 5. 6. Márgenes infiltrantes Atipia marcada o moderada del componente mesenquimal Sobrecrecimiento de los elementos mesenquimales en relación con los elementos epiteliales Presencia de necrosis Existencia de más de un elemento mesenquimal 10 ó más mitosis x 10 campos de gran aumento. No obstante en un análisis multivariante los factores pronósticos independientes predictivos fueron la necrosis tumoral y la existencia de elementos mesenquimales heterólogos malignos. En las figuras 1 y 2 se ilustra un tumor filodes maligno. Los tumores filodes en el límite de la malignidad ("borderline") muestran (4): 1. 2. 3. Márgenes expansivos o infiltrantes Atipia moderada del componente mesenquimal Las mitosis oscilan de 5 a 9 x 10 campos de gran aumento. Los tumores "borderline" tratados con escisión completa no recidivaron ni metastatizaron en la serie de Moffat y cols (2). La mayoría de los autores designan los tumores filodes como benignos o malignos basándose en la evaluación histopatológica del tipo de crecimiento de los márgenes, sobrecrecimiento del componente mesenquimal, pleomorfismo y contaje mitótico. La categoría "borderline" es útil para prevenir el sobrediagnóstico de malignidad y su excesivo tratamiento (4). Figura 1. Tumor filodes maligno. Hipercelularidad del componente mesenquimal con predominio alrededor de los ductos. Atipia celular marcada. Figura 2. Tumor filodes maligno. Aspecto foliáceo de la arquitectura tumoral. Borde de crecimiento sin encapsulación. Obsérvese la hipercelularidad de la neoplasia comparádola con la del tejido circundante. 14 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 20:55 Página 15 Estudio inmunohistoquímico y de citometría de flujo El porcentaje de células tumorales del componente mesenquimal que se tiñen con Ki67 (MIB1) expresa la actividad proliferativa del tumor filodes y se correlaciona con la capacidad de recidiva (5). La progresión hacia un fenotipo de mayor malignidad en el tumor recidivante se acompaña de un mayor índice de positividad con el Ki67 (5). Esto sugiere una continuidad entre las formas benignas, "borderline" y malignas (5). En la figura 3 se ilustra la tinción inmunohistoquímica para Ki67 en un tumor filodes maligno. La expresión del receptor estrogénico y de progesterona es muy heterogénea y no es concluyente en lo referente al pronóstico y a la histogénesis. El estudio de la ploidía DNA y de la fracción en fase S para evaluar la evolución del tumor filodes ha dado resultados contradictorios. Figura 3. Tumor filodes maligno. Inmunohistoquímica para Ki-67. Obsérvese el incremento del número de células mesenquimales que aparecen en fase proliferativa. Indice proliferativo alto. Recidivas y metástasis La frecuencia de recidivas en varias publicaciones ha variado de 7% a 70% dependiendo del número de casos en estudio y de la proporción de lesiones agresivas (1). En general, aproximadamente el 30% de los tumores filodes desarrolla recidivas, la mayoría dentro de los dos años después del tratamiento. Estas recidivas pueden mostrar un fenotipo más agresivo con incremento de la celularidad y aumento de la atipia y del contaje mitótico. La escisión incompleta se correlaciona estrechamente con la recidiva. Las recidivas locales aparecen aproximadamente en el 50% de los tumores filodes metastatizante. Las metástasis aparecen en menos del 10% de los tumores filodes en general. Los tumores filodes malignos presentan metástasis hematógenas en aproximadamente el 22% de los casos (2). Las metástasis se desarrollan por vía hemática. Los ganglios linfáticos suelen estar libres. Sin embargo se han observado metástasis ganglionares en el 15% de los tumores metastatizantes. La mayoría de los tumores (66%) metastatizan en los pulmones. Otras localizaciones incluyen los huesos (28%), el corazón (9,4%) y el hígado (5,6%), aunque casi cualquier órgano puede afectarse. Generalmente las metástasis se hacen evidentes dentro de los dos años del tratamiento inicial (1). Carcinoma asociado al tumor filodes Se han descrito en el seno de un tumor filodes la presencia de carcinoma intraductal o carcinoma lobulillar in situ. Esta última neoplasia es más frecuente y a menudo se observa también en el tejido mamario adyacente. El carcinoma infiltrante se asocia con mucha menos frecuencia que los anteriores al tumor filodes. 15 Nº 6 – JUNIO DE 2003 Tumor filoides mamario. Una neoplasia de comportamiento biológico variable La inmunoexpresión de p53 se ha detectado en la mayoría de los tumores filodes malignos y está ausente en los benignos. DESDE pGEICAM Interior boletin 2.qxd 19/06/03 20:52 Página 16 Diagnóstico diferencial El tumor filodes debe diferenciarse del fibroadenoma, del sarcoma de estroma periductal y de los sarcomas mamarios. El fibroadenoma celular carece de un patrón claro foliáceo. El tumor filodes además de un patrón foliáceo bien desarrollado presenta un mayor grado de hipercelularidad del estroma, especialmente en la porción del estroma adyacente al epitelio. La actividad mitótica puede ayudar en este diagnóstico diferencial pues según Fechner los fibroadenomas no sobrepasan el contaje mitótico de 3 mitosis x 10 campos de gran aumento (6). El sarcoma de estroma periductal es un tumor específico, bifásico, raro, distinto del tumor filodes. Se caracteriza por una proliferación de células fusiformes, de elevada densidad celular, sarcomatosa que se dispone alrededor de túbulos redondeados que retienen sus luces abiertas, sin patrón foliáceo. Los nódulos de proliferación fusocelular puede estar separada por agregados de tejido adiposo (7). Sin embargo este tumor puede transformarse en un tumor filodes con el tiempo. En los casos en los que el sobrecrecimiento mesenquimal es extenso la distinción de un sarcoma puro puede ser difícil, sobre todo en los cilindros. El adecuado muestreo del tumor es imprescindible para detectar elementos epiteliales que pueden estar muy reducidos. Puesto que algunos tumores filodes pueden recidivar como sarcomas puros es importante obtener una adecuada historia de la paciente y examinar la o las biopsias previas. Manejo anatomopatológico del tumor filodes Es imprescindible el muestreo adecuado de este tipo de tumor. Al menos debería de incluirse un bloque por cada 1cm tumoral. Además debería examinarse la periferia de la neoplasia marcando con tinta china la totalidad de los bordes quirúrgicos con el fin de comprobar que la extirpación ha sido completa. Se recomienda que estos tumores deben extirparse con un margen de 10 mm de tejido sano. Conclusión y propuesta La elección de este tema se debe a la problemática general que plantea. Debido a la poca frecuencia del tumor es poco probable que un solo centro reúna suficiente casuística para establecer conclusiones firmes. Se propone un estudio multicéntrico con agrupación de todos los casos de tumor filodes en un único registro, con datos adecuados, que permita conocer mejor esta neoplasia. Bibliografía 1. 2. 3. 4. 5. 6. 7. Tavassoli FA. Pathology of the breast. Second edition, Stamford: Appleton & Lange, 1999;598-614. Moffat CJC, Pinder SE, Dixon AR, Elston CW, Blamey RW, Ellis IO. Phyllodes tumours of the breast: a clinicopathologic review of thirty-two cases. Histopathology 1995;27:205-18. Pietruska M, Barnes L. Cystosarconma phyllodes. A clinico-pathologic analysis of 42 cases. Cancer 1978;41:1974-83. Elston CW, Ellis IO. The breast. Third edition. En Symmers W St C. Systemic pathology, Volume 13. Edinburgh: Churchill Livingstone, 1999;168-83. Shpitz B, Bomstein Y, Sternberg A, Klein E, Tiomkin V, Kaufman A, Groisman G, Bernheim J. Immunoreactivity of p53, Ki67, and c-erbB-2 in phyllodes tumors of the breast in correlation with clinical and morphologic features. J Surg Oncol 2002;79:86-92. Fechner RE. Fibroadenomas in patients receiving oral contraceptives. Am J Clin Pathol 1970;53:857-64. Burga AM, Tavassoli FA. Periductal stromal tumor. A rare lesion with low-grade sarcomatous behavior. Am J Surg Pathol 2003;27:343-48. 16 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 20:52 Página 17 Aportaciones científicas del GEICAM “Estudio fase III de quimioterapia adyuvante en mujeres con cáncer de mama en estadios operables: FAC versus CMF adyuvante” Código: GEICAM/8701 Coordinador del estudio: Dr. Miguel Martín, Hospital Clínico Universitario San Carlos de Madrid • Presentado como póster en el 37th ASCO Annual Meeting celebrado en el año 2001. • Presentación oral en el VIII Congreso Nacional de la Sociedad Española de Oncología Médica que se celebró en octubre de 2001, donde obtuvo el primer premio a la mejor comunicación oral presentada. • Artículo aceptado para publicación en la revista Annals of Oncology (en prensa). "Hormonoterapia simultánea versus secuencial en el tratamiento adyuvante de pacientes postmenopáusicas con cáncer de mama operable y ganglios positivos" Código: GEICAM/9401 Coordinador del estudio: Dr. César Picó • Presentación oral en el 38th ASCO Annual Meeting celebrado en mayo del año 2002. • Enviado para publicación a la revista Journal of Clinical Oncology. "Estudio randomizado de quimioterapia intensiva de consolidación DICEP frente a observación en enfermas con cáncer de mama metastásico de baja carga tumoral sensibles a la quimioterapia de inducción con taxol y epirrubicina" Código: GEICAM/9601 Coordinador del estudio: Dr. Miguel Martín, Hospital Clínico San Carlos, Madrid • Artículo aceptado para publicación en Revista de Oncología (en prensa). "Ensayo fase II de vinorelbina en infusión contínua de 96 horas en pacientes con neoplasia de mama metastásica refractaria a antraciclinas" Código: GEICAM/9702 Coordinador del estudio: Dr. Carlos Jara, Fundación Hospital de Alcorcón, Madrid • Artículo publicado: Jara-Sanchez C, Martin M, Garcia-Saenz JA, Barnadas A, Fernandez- Aramburo A, Lopez- Vega JM, Pelegri A, Alba E, Casado A. Vinorelbine as a 96-Hour Continuous Infusion in Heavily Pretreated Patients with Metastatic Breast Cancer: A Cooperative Study by the GEICAM Group. Clinical Breast Cancer 2003; 3(6): 399-404. 17 Nº 6 – JUNIO DE 2003 APORTACIONES CIENTÍFICAS DEL GEICAM Interior boletin 2.qxd 19/06/03 20:53 Página 18 "Ensayo fase II de gemcitabina en combinación con vinorelbina en pacientes con carcinoma de mama metastásico resistente a antraciclinas" Código: GEICAM/9704 Coordinador del estudio: Dr. Francisco Lobo, Fundación Jiménez Díaz, Madrid • Aceptado como Proceedings en el 38th ASCO Annual Meeting celebrado en mayo del año 2002. • Artículo aceptado para publicación: Lobo F, Virizuela JA, Dorta FJ, Florián J, Lomas M, Jiménez E, López P, Casado V, León A, Estévez LG, Dómine M, and the Spanish Group for Research in Breast Cancer (GEICAM). Gemcitabine plus Vinorelbine in Metastatic Breast Cancer Patients Previously Treated with Anthracyclines: Results of a Phase II Study. Clinical Breast Cancer 2003; 4(1): 46-50. "Ensayo fase II de Adriamicina y Taxotere secuenciales en primera línea de cáncer de mama metastásico" Código: GEICAM/9801 Coordinador del estudio: Dr. Emilio alba, Hospital Clínico Universitario Virgen de la Victoria de Málaga • Presentado como póster en el Congreso de la Federación de Sociedades Españolas de Oncología (FESEO) del año 2000. • Presentado como póster en el XIX Congreso de Senología y Patología Mamaria en octubre del año 2000. • Presentado como póster en el 36th ASCO Annual Meeting celebrado el año 2000. • Presentación oral en el IV Congreso Europeo de Cáncer de Mama celebrado en Barcelona en marzo de 2002 • Artículo publicado: E. Alba, N. Ribelles, A. Antón, R. Pérez-Carrión, J.M. López-Vega, M. Llanos, A. Pelegrí, J.Florián, M. Menéndez, M.J. Godes. Sequential doxorubicin and docetaxel as first-line treatment in metastatic breast cancer: a GEICAM-9801 phase II study. Cancer Research and Treatment 2003; 77: 1-8. "Ensayo fase III multicéntrico randomizado comparativo de docetaxel en combinación con doxorubicina y ciclofosfamida (TAC) frente a 5-fluorouracilo, en combinación con doxorubicina y ciclofosfamida (FAC) como tratamiento adyuvante en pacientes con cáncer de mama operable con ganglios negativos (N0) y criterios de alto riesgo" ESTUDIO "TARGET 0" Código: GEICAM/9805 Coordinadores del estudio: Dr. Miguel Martín, Hospital Clínico San Carlos, Madrid Dra. Ana Lluch, Hospital Clínico Universitario de Valencia Dr. Agustí Barnadas, Hospital Germans Trias i Pujol, Badalona • Estudio intermedio de toxicidad hematológica presentado como póster en el 27th Annual Symposium of the American Society of Breast Disease (ABSD) que se celebró en abril de 2003. 18 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 20:44 Página 19 "Estudio fase III, multicéntrico y randomizado de la administración secuencial de Adriamicina y Docetaxel frente a la administración concomitante de ambos fármacos en el tratamiento de primera línea de cáncer de mama metastásico" Código: GEICAM/9903 Coordinador del estudio: Dr. Emilio Alba, Hospital Clínico Universitario Virgen de la Victoria de Málaga • Aceptado como Proceedings en el 38th ASCO Annual Meeting celebrado en mayo del año 2002. • Aceptado como comunicación oral en el 39th ASCO Annual Meeting que se celebrará entre los dias 31 de mayo hasta 3 de junio de 2003. • Aceptado como comunicación oral en el Congreso de la Sociedad Española de Oncología Médica del año 2003. Ensayo fase II de la asociación de Gemcitabina y Docetaxel bisemanal en el tratamiento de primera línea del cáncer de mama diseminado" Código: GEICAM/9904 Coordinador del estudio: Dr. Amadeu Pelegrí, Hospital Sant Joan de Reus • Presentado como póster en el 24th Annual San Antonio Breast Cancer Symposium del año 2001 • Presentado como póster en el 38th ASCO Annual Meeting celebrado en mayo del año 2002. • Presentado en el 8th International Oncology Conference celebrado en Saint Gallen entre los días 12 al 15 de marzo de 2003 • Aceptado como Proceedings en el 39th ASCO Annual Meeting del año 2003. "Estudio de docetaxel en administración semanal como tratamiento neoadyuvante de pacientes con cáncer de mama operable" Código: GEICAM/9905 Coordinadora del estudio: Dra. Laura García Estévez, Fundación Jiménez Díaz de Madrid • Presentado como póster en el 23th Annual San Antonio Breast Cancer Symposium del año 2000. • Admitido como Proceedings en el 37th ASCO Annual Meeting del año 2001. • Presentación oral en el IV Congreso Europeo de Cáncer de Mama celebrado en Barcelona en marzo de 2002 • Artículo publicado: Laura G. Estévez, José Miguel Cuevas, Antonio Antón, Jesús Florián, José Manuel LópezVega, Amalia Velasco, Francisco Lobo, Ana Herrero and José Fortes. Weekly Docetaxel as Neoadjuvant Chemotherapy for Stage II and III Breast Cancer. Efficacy and Correlation with Biological Markers in a Phase II, Multicenter Study. Clinical Cancer Research 2003; 9: 686-692. 19 Nº 6 – JUNIO DE 2003 APORTACIONES CIENTÍFICAS DEL GEICAM Interior boletin 2.qxd 19/06/03 20:44 Página 20 "Ensayo clínico multicéntrico fase III, randomizado comparando 6 ciclos de régimen FEC (fluorouracilo, 4-epirubicina y ciclofosfamida) con 4 ciclos de régimen FEC seguido de 8 administraciones de taxol semanal en régimen secuencial, como tratamiento adyuvante de pacientes con cáncer de mama operado y afectación axilar" Código: GEICAM/9906 Coordinadores del estudio: Dr. José Manuel López Vega, Hospital Universitario Marqués de Valdecilla, Santander Dr. Enrique Aranda, Complejo Hospitalario Reina Sofía, Córdoba Dr. Álvaro Rodríguez Lescure, Hospital General Universitario de Elche • Estudio intermedio de toxicidad aceptado como comunicación oral en el Congreso de la Sociedad Española de Oncología Médica del año 2003. "Validación de las categorias de riesgo de St.Gallen 2001 para pacientes con cáncer de mama y ganglios negativos: un estudio ALAMO-GEICAM" Código: GEICALAMO/9093-02 Coordinador del estudio: Dr. Ramón Colomer, Institut Català d'Oncologia, Girona • Aceptado como comunicación oral en el Congreso de la Sociedad Española de Oncología Médica del año 2003. 20 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 20:44 Página 21 Ensayos clínicos del GEICAM Estudios con tratamientos neoadyuvantes Pacientes Teorico Estudios con tratamientos neoadyuvantes "Ensayo fase II de la combinación gemcitabina-adriamicina-paclitaxel (GAT) administrada como tratamiento neoadyuvante en el tratamiento de pacientes con carcinoma de mama estadio III" Código: GEICAM/2002-01 • Participación prevista: 43 pacientes • Número de pacientes reclutadas (Mayo de 2003): 8 Real 40 30 Meses 20 10 0 Meses Curva de reclutamiento CENTROS INVESTIGADOR Hospital Universitario de la Princesa (Madrid) Dra. Amalia Velasco 4 Hospital Germans Trias i Pujol (Badalona) Dr. Agustín Barnadas 2 Complejo Hospitalario Ciudad de Jaén (Jaén) Dr. Pedro Sánchez Rovira 1 Hospital Miguel Servet (Zaragoza) Dr. Antonio Antón 1 Clínica Corachán S.A. (Barcelona) Dr. Alfonso Modollel 0 Fundación Hospital de Alcorcón (Alcorcón) Dr. Carlos Jara 0 Hospital Universitario Marqués de Valdecilla (Santander) Dr. José M. López Vega 0 Hospital Universitario Infanta Cristina (Badajoz) Dra. Lomas Garrido 0 Hospital Ramón y Cajal (Madrid) Dra. Carmen Crespo 0 Hospital General Universitario de Valencia (Valencia) Dra. Mª José Godes – Complejo Hospitalario Juan Canalejo-Marítimo de Oza (A Coruña) Dra. Lourdes Calvo – Complejo Hospitalario Virgen de la Victoria (Málaga) Dr. Emilio Alba – 21 Nº 6 – JUNIO DE 2003 Nº PACIENTES 19/06/03 ENSAYOS CLÍNICOS DEL GEICAM Interior boletin 2.qxd 20:44 Página 22 "Estudio fase II multicéntrico de doxorubicina en combinación con ciclofosfamida (AC) seguido de docetaxel (T) en administración semanal como tratamiento neoadyuvante de pacientes con cáncer de mama operable estadios II y IIIa" Código: GEICAM 2002/03 • Participación prevista: 61 pacientes • Número de pacientes reclutadas (Mayo de 2003): 6 Pacientes 60 Te o r i c o Real 50 40 30 20 10 0 Meses Curva de reclutamiento: CENTROS INVESTIGADOR Hospital De la Ribera (Alcira) Dr. José Miguel Cuevas 3 Hospital Germans Trias i Pujol (Badalona) Dr. Agustín Barnadas 2 Fundación Jiménez Díaz (Madrid) Dra. Laura García Estévez 1 Complejo Hospitalario Juan Canalejo-Marítimo de Oza (A Coruña) Dra. Lourdes Calvo 0 Hospital General Universitario de Alicante (Alicante) Dra. Encarna Adrover 0 Hospital General Universitario de Valencia (Valencia) Dra. Mª José Godes – Hospital Universitario Marqués de Valdecilla (Santander) Dr. José M. López Vega – Corporació Sanitaria Parc Taulí (Sabadell) Dr. Miguel Angel Seguí – 22 Boletín del GEICAM Nº PACIENTES Interior boletin 2.qxd 19/06/03 18:51 Página 23 Estudios con tratamientos adyuvantes "Ensayo Randomizado con taxotere secuencial o simultáneo en pacientes con cáncer de mama operable y ganglios positivos" Código: GEICAM /9803 -V315 12 Nº PACIENTES 212 Nº EVENTOS MESES DE SEGUIMIENTO 25 53 "Ensayo fase III multicéntrico randomizado comparativo de docetaxel en combinación con doxorubicina y ciclofosfamida (TAC) frente a 5-fluorouracilo, en combinación con doxorubicina y ciclofosfamida (FAC) como tratamiento adyuvante en pacientes con cáncer de mama operable con ganglios negativos (N0) y criterios de alto riesgo" ESTUDIO "TARGET 0" Código: GEICAM/9805 Nº DE CENTROS 59 Nº PACIENTES Nº EVENTOS MESES DE SEGUIMIENTO 1064 Pendiente de recogida 41 "Ensayo multicéntrico fase III, randomizado comparando 6 ciclos de FEC con 4 ciclos de FEC seguidos de 8 ciclos de Taxol semanal en régimen secuencial, como tratamiento adyuvante en pacientes con cáncer de mama operable y afectación axilar" Código: GEICAM/9906 Nº DE CENTROS 62 Nº PACIENTES Nº EVENTOS MESES DE SEGUIMIENTO 1250 88 39 23 Nº 6 – JUNIO DE 2003 Estudios con tratamientos adyuvantes Nº DE CENTROS Interior boletin 2.qxd 19/06/03 18:51 Página 24 Pacientes "HERA: Estudio multicéntrico randomizado, de tres brazos, comparando la administración de Herceptin® durante uno y durante dos años versus la noadministración de Herceptin® en mujeres con cáncer de mama primario HER2positivo que han completado la quimioterapia adyuvante." Código: GEICAM/2001-02 • Número de pacientes reclutadas en centros de GEICAM (Mayo de 2003): 43 • Número de pacientes registradas (muestras enviadas): 166 CENTROS PARTICIPANTES INVESTIGADOR/A Nº DE MUESTRAS ENVIADAS Nº PACIENTES Complejo Hospitalario Ciudad de Jaén (Jaén) Pedro Sánchez Rovira 29 10 Instituto Oncológico Regional de Galicia (A Coruña) Manuel Ramos Vázquez 10 6 Hospital Miguel Servet (Zaragoza) Antonio Antón Torres 37 5 Hospital Universitario Virgen del Rocío (Sevilla) Luís Iglesias Pérez 30 4 Hospital Xeral-Cies (Vigo) Javier Castellanos Díez 11 4 Complejo Hospitalario de Pontevedra (Pontevedra) Manuel Constenla Figueiras 6 3 Hospital Universitario de Canarias (Santa Cruz de Tenerife) Norberto Batista López 5 2 2 2 Hospital General y Universitario de Guadalajara (Guadalajara) Javier Cassinello Espinosa Hospital Universitario de la Princesa (Madrid) Amalia Velasco Ortíz de Taranco 6 1 Complejo Hospitalario Juan Ramón Jiménez (Huelva) Juan Bayo Calero 6 1 Complejo Hospitalario de Orense (Orense) Jesús García Mata 4 1 Hospital General Universitario (Valencia) María José Godes Sanz de Bremond 2 1 Complejo Hospitalario Ntra. Sra. De La Candelaria-Ofra (Santa Cruz de Tenerife) José Manuel Rodríguez García 2 1 Corporació Sanitaria Parc Taulí (Sabadell) Miguel Ángel Seguí Palmer 4 1 Hospital de Gran Canaria Dr. Negrín (Las Palmas de Gran Canaria) José Aguiar Morales 0 1 Hospital Insular (Las Palmas de Gran Canaria) Adolfo Murias Rosales 12 0 Complejo Hospitalario Arquitecto Marcide-Novoa Santos (El Ferrol) Laura De Paz Arias 0 0 Hospital de la Ribera (Alcira) José Miguel Cuevas Sanz 0 0 Hospital Del Mar (Barcelona) Ignacio Tusquets Trias De Bes 0 0 24 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 18:51 Página 25 "Ensayo clínico fase III multicéntrico y randomizado que compara docetaxel en combinación con doxorubicina y ciclofosfamida (TAC) frente a la combinación de T), como tratamiento doxorubicina y ciclofosfamida seguida de docetaxel (AC adyuvante de pacientes con cáncer de mama operable, con HER2NEU negativo y ganglios axilares positivos" Código: BCIRG/005 Nº DE CENTROS Nº PACIENTES Nº EVENTOS MESES DE SEGUIMIENTO 67 En periodo de rcogida 5 41 Pacientes Estudios con tratamientos adyuvantes "Ensayo clínico fase III, multicéntrico, randomizado, para la comparación de la administración de doxorubicina y ciclofosfamida seguido de docetaxel (AC T), con doxorubicina y ciclofosfamida seguido de docetaxel y trastuzumab (AC TH), y con docetaxel, platino y trastuzumab en el tratamiento adyuvante de pacientes con cáncer de mama operable y ganglios positivos o ganglios negativos y criterios de alto riesgo, que contengan la alteración HER2neu" ESTUDIO BCIRG 006 Código: GEICAM/2001-06 • Nº de pacientes incluidos en centros de GEICAM (Mayo de 2003): 47 • Número de pacientes registradas (muestras enviadas): 83 Meses Curva de reclutamiento CENTROS PARTICIPANTES INVESTIGADOR Nº DE MUESTRAS ENVIADAS Hospital Universitario San Carlos (Madrid) Dr. Miguel Martín Jiménez Complejo Hospitalario Juan Canalejo-Marítimo de Oza (A Coruña) Dra. Lourdes Calvo Martínez Nº PACIENTES 21 13 8 5 Complejo Hospitalario Virgen de la Victoria (Málaga) Dr. Emilio Alba Conejo 7 5 Hospital Donostia (San Sebastián) Dra. Isabel Álvarez López 7 5 Fundación Hospital de Alcorcón (Alcorcón) Dr. Carlos Jara Sánchez 4 3 Hospital General Universitario de Alicante (Alicante) Dra. Encarna Adrover Cebrián 3 3 Hospital Ruber Internacional (Madrid) Dr. José Enrique Alés Martínez 3 2 Hospital Ramón y Cajal (Madrid) Dra. Carmen Crespo Massieu 3 2 25 Nº 6 – JUNIO DE 2003 Interior boletin 2.qxd 19/06/03 18:51 Página 26 Fundación Jiménez Díaz (Madrid) Dra. Laura García Estevez 3 2 Complejo Hospitalario Xeral Calde (Lugo) Dr. José Ramón Mel Lorenzo 5 1 Hospital de Barbastro (Barbastro) Dr. Jesús Florián Gericó 5 1 Hospital Universitario Puerta del Mar (Cádiz) Dr. José María Baena Cañada 4 1 Consorci Sanitari de Terrasa (Terrasa) Dra. Angels Arcusa Lanza 2 1 Hospital Germans Trias i Pujol (Badalona) Dr. Agustí Barnadas y Molins 2 1 Hospital Txagorritxu (Vitoria) Dra. Severina Domínguez 1 1 Hospital Universitario Sant Joan de Reus (Reus) Dr. Amadeu Pelegrí Sarle 1 1 Complejo Hospitalario Reina Sofía (Córdoba) Dr. Enrique Aranda Aguilar 1 0 Clínica Sagrado Corazón S.A. (Sevilla) Dr. Pedro Valero Jiménez 1 0 Hospital de Espíritu Santo (Santa Coloma de Gramanet) Dra. Cristina Martín 1 0 Hospital Universitario Infanta Cristina (Badajoz) Dr. José María Puerto Pica 0 0 Hospital Provincial Rodríguez Chamorro (Zamora) Dr. José Valero Álvarez Gallego 0 0 Hospital General Universitario de Elche (Elche) Dr. Álvaro Rodríguez Lescure 0 0 Hospital Universitario Puerto Real (Puerto Real) Dr. Antonio Lorenzo Peñuelas 0 0 Hospital Universitario Marqués de Valdecilla (Santander) Dr. José Manuel López Vega 0 0 Hospital Universitario Virgen de la Arrixaca (Murcia) Dr. Alonso Romero/Dr. Juan José Valverde Iniesta 0 0 Complejo Hospitalario de Albacete (Albacete) Dr. Antonio Fernández Aramburo 0 0 Hospital Virgen de los Lirios Dra. Amparo Oltra 0 0 "Ensayo clínico aleatorio, multicéntrico e internacional, de quimioterapia adyuvante tras recidiva loco-regional de cáncer de mama tratada con resección radical. Quimioterapia vs. Observación" BIG Trial 1-02 IBCSG Trial 27-02 Código: GEICAM/2002-04 • Número de pacientes previstos: 977 (en todos los países participantes) • Participación en España: 100 pacientes • Investigadores participantes en España: CENTROS INVESTIGADOR Hospital Ramón y Cajal (Madrid) Dra. Carmen Crespo Complejo Hospitalario Ciudad de Jaén (Jaén) Dr. Sánchez Rovira Hopital Universitario Puerta del Mar (Cádiz) Dr. Baena Cañada Hospital Universitario San Carlos (Madrid) Dr. Martín Jiménez Complejo Hospitalario Virgen de la Victoria (Málaga) Dr. Emilio Alba Fundación Hospital Alcorcón (Alcorcón) Dr. Carlos Jara Hospital Ntra. Sra. De Aranzazu (San Sebastián) Dra. Isabel Alvarez Hospital General Universitario de Alicante (Alicante) Dra. Encarna Adrover Hospital Clínico Unviversitario de Valencia (Valencia) Dra. Ana Lluch Complejo Hospitalario de Pontevedra (Pontevedra) Dr. Manuel Constenla Dra. Amaparo Ruíz Instituto Valenciano de Oncología (Valencia) 26 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 18:51 Página 27 "Estudio aleatorizado, doble-ciego, controlado con placebo que evalúa el efecto del exemestano en pacientes postmenopáusicas con cáncer de mama en estadio clínico T1-3, N0-1, M0, que hayan completado la terapia con tamoxifeno durante un mínimo de 5 años" Estudio NSABP B33 Código: GEICAM/2002-05. CENTRO INVESTIGADOR Hospital Xer al Cíes (Vigo) Javier Castellanos 0 Complejo Hospitalario de Pontevedra (Pontevedra) Manuel Constenla 0 Complejo Hospitalario de Orense (Orense) Jesús García Mata 0 Complejo Hospitalario Xeral Calde (Lugo) José Ramón Mel Lorenzo 0 Centro Oncológico Regional de Galicia (A Coruña) Manuel Ramos 0 Complejo Hospitalario Juan Canalejo-Marítimo de Oza (A Coruña) Lourdes Calvo 0 Hospital Policlínico de Vigo S.A. POVISA (Vigo) Concepción Almanza Madera 0 Hospital De Cabueñes (Gijón) José Manuel Gracia Marco 0 Consorci Sanitari de Terrassa (Terrassa) Angels Arcusa Lanza 0 Hospital Germans Trias i Pujol (Badalona) Agustin Barnadas 0 Hospital Mutua de Terrassa (Terrassa) Luis Cirera 0 Hospital Municipal de Badalona (Badalona) Isabel Moreno Solorzano 0 Instituto Catalán de Oncología (L'Hospitalet de Llobregat) Miguel Gil 0 Hospital Clinic i Provincial (Barcelona) Montserrat Muñoz 0 Hospital Universitari Sant Joan de Reus (Reus) Sonia del Barco 0 Hospital Sant Camil (Sant Pere de Ribes) Montserrat Boleda 0 Complejo Hospitalario de Albacete (Albacete) Antonio Fernández Aramburo 0 Hospital General Virgen de la Luz (Cuenca) Eduardo Martinez de Dueñas 0 Hospital General Universitario de Guadalajara (Guadalajara) Javier Cassinello Espinosa 0 Hospital General Universitario de Alicante (Alicante) Encarna Adrover 0 Hospital de Sagunto (Sagunto) Antonio Galán Brotons 0 Hospital Provincial de Castellón (Castellón) Adolfo Frau Llopis 0 Hospital Son Dureta (Palma de Mallorca) Antoni Avellá 0 Hospital de Barbastro (Barbastro) Jesús Florián Jericó 0 Hospital Gregorio Marañón (Madrid) Gumersindo Pérez Manga 0 Hospital Universitario San Carlos (Madrid) Miguel Martin Jimenez 0 Clínica Puerta de Hierro (Madrid) Ricardo Cubedo 0 Hospital General de Móstoles (Móstoles) Miguel Méndez Ureña 0 Hospital Universitario "Doce de Octubre" (Madrid) César Mendiola Fernández 0 Hospital Ruber Internacional (Madrid) José Enrique Alés Martínez 0 Fundación Hospital Alcorcón (Alcorcón) Carlos Jara Sánchez 0 Complejo Hospitalario Ciudad de Jaén (Jaén) Pedro Sánchez Rovira 0 Hospital Universitario Virgen de Rocio (Sevilla) Manuel Ruiz /Rosario González 0 27 Nº 6 – JUNIO DE 2003 Nº PACIENTES Estudios con tratamientos adyuvantes • Número de pacientes previsto para centros de GEICAM: 600 • Se prevé comenzar el reclutamiento en Junio de 2003. • Investigadores participantes: Interior boletin 2.qxd 19/06/03 18:51 Página 28 Hospital Universitario Puerta del Mar (Cádiz) José Mª BaenaCañada 0 Hospital Universitario Puerto Real (Puerto Real) Antonio Lorenzo Peñuelas 0 Complejo Hospitalario Reina Sofía (Córdoba) Enrique Aranda Aguilar 0 Complejo Hopitalario Virgen de la Victoria (Málaga) Emilio Alba Conejo 0 Complejo Hospitalario Juan Ramón Jiménez (Huelva) Juan Lucas Bayo Calero 0 Clínica Sagrado Corazón S.A. (Sevilla) Pedro Valero Jimenez 0 Hospital Punta de Europa (Algeciras) Rafael Trujillo Vilchez 0 Hospital Clínico Universitario de Valladolid (Valladolid) Alvaro Sanz Rubiales 0 Hospital Clínico Universitario de Salamanca (Salamanca) Cesar A. Rodríguez 0 Hospital Provincial Rodriguez Chamorro (Zamora) José Valero Alvarez 0 Instituto Oncológico (San Sebastián) Arrate Plazaola Alcibar 0 Hospital Ntra. Sra. De Aranzazu (San Sebastián) Isabel Alvarez López 0 Hospital Universitario Marques de Valdecilla (Santander) José Manuel López Vega 0 Complejo Hospitalario San Millan-San Pedro (Logroño) Edelmira Velez de Mendizabal 0 Corporació Sanitaria Parc Taulí (Sabadell) Miguel Angel Segui – Complejo Hospitalario de Ciudad Real (Ciudad Real) Mª José García López – Hospital Santa Creu I Sant Pau (Barcelona) Belén Ojeda – Hospital del Mar (Barcelona) Ignacio Tusquets – Hospital Universitari de Lleida Arnau de Vilanova (Lleida) Ana Balil i Gilart – Hospital Virgen de la Salud (Toledo) Miguel Ángel de la Cruz Mora – Hospital Provincial de Toledo (Toledo) Pedro Puñal – Hospital General Universitario de Valencia (Valencia) Mª José Godes Sanz Bremond – Instituto Valenciano de Oncología (Valencia) Amparo Ruiz Simón – Hospital General Universitario de Elche (Elche) Alvaro Rodriguez Lescure – Hospital Insular (Las Palmas de Gran Canaria) Adolfo Murias Rosales – Hospital Clinico Universitario Lozano Blesa (Zaragoza) José Ignacio Mayordomo – Hospital Miguel Servet (Zaragoza) Antonio Antón Torres – Hospital Rio Carrión (Palencia) Alberto Arizcum – Hospital General de León (León) García Palomo – Hospital de Basurto (Basurto) Purificación Martinez Prado – Hospital Universitario Virgen de la Arrixaca (Murcia) José Luis Alonso Romero – Hospital General Universitario J.M. Morales Meseguer (Murcia) Francisco Ayala de la Peña – "Ensayo fase III multicéntrico randomizado comparativo de Femara (letrozol) frente a epirubicina en combinación con ciclofosfamida (EC) seguido de Femara (letrozol) como tratamiento adyuvante en pacientes añosas con cáncer de mama operable y ganglios linfáticos axilares positivos" Código: GEICAM/2002-06. • Número de pacientes previsto: 570 • Se prevé comenzar el reclutamiento en Junio de 2003 • Investigadores participantes: 28 Boletín del GEICAM 19/06/03 18:51 Página 29 CENTRO INVESTIGADOR Nº PACIENTES Complejo Hospitalario de Pontevedra (Pontevedra) Manuel Constenla Complejo Hospitalario Xeral Calde (Lugo) José Ramón Mel Lorenzo 0 Centro Oncológico Regional de Galicia (A Coruña) Manuel Ramos 0 Complejo Hospitalario Juan Canalejo-Marítimo de Oza (A Coruña) Lourdes Calvo 0 Consorci Sanitari de Terrassa (Terrassa) Angels Arcusa Lanza 0 Hospital Germans Trias i Pujol (Badalona) Agustin Barnadas 0 Hospital Municipal de Badalona (Badalona) Isabel Moreno Solorzano 0 Corporació Sanitaria Parc Taulí (Sabadell) Miguel Angel Segui 0 Hospital Clínic i Provincial (Barcelona) Montserrat Muñoz 0 Clínica Corachán S.A. (Barcelona) Alfonso Modolell 0 Hospital Universitari Sant Joan de Reus (Reus) Sonia del Barco Cerrón 0 Complejo Hospitalario de Albacete (Albacete) Antonio Fernández Aramburo 0 Hospital Virgen de la Salud (Toledo) Miguel Ángel de la Cruz Mora 0 Hospital General Virgen de la Luz (Cuenca) Eduardo Martinez de Dueñas 0 Hospital de Sagunto (Sagunto) Antonio Galán Brotons 0 Hospital General Universitario de Elche (Elche) Alvaro Rodriguez Lescure 0 Hospital General de Elda (Elda) Cristina Llorcas Ferrandiz 0 Hospital Universitario Infanta Cristina (Badajoz) Mª Lomas Garrido 0 Hospital de Barbastro (Barbastro) Jesús Florián Jericó 0 Complejo Hospitalario Ciudad de Jaén (Jaén) Pedro Sánchez Rovira 0 Hospital Universitario Virgen de Rocio (Sevilla) Manuel Ruiz Borrego/Rosario González Mancha 0 0 Hospital Universitario Puerto Real (Cádiz) Antonio Lorenzo Peñuelas 0 Complejo Hospitalario Virgen de la Victoria (Málaga) Emilio Alba Conejo 0 Hospital Punta de Europa (Algeciras) Rafael Trujillo Vilchez 0 Hospital Rio Carrión (Palencia) Alberto Arizcum 0 Hospital Ntra. Sra. De Aranzazu (San Sebastián) Isabel Alvarez López 0 Hospital Universitario de la Princesa (Madrid) Amalia Velasco Ortiz de Taranco – Hospital Santa Creu I Sant Pau (Barcelona) Belén Ojeda – Hospital Josep Trueta (Girona) Ramón Colomer Bosch – Hospital Universitari de Lleida Arnau de Vilanova (Lleida) Ana Balil i Gilart – Hospital Nuestra Senora del Prado (Talavera de la Reina) Florestán Juarez – Hospital General Universitario de Alicante (Alicante) Encarna Adrover – Hospital General Universitario de Valencia (Valencia) Mª José Godes Sanz Bremond – Hospital Clínico Universitario de Valencia (Valencia) José Manuel Sastre Albiach – Hospital de la Ribera (Alcira) José Miguel Cuevas – Hospital Universitario de Canarias (Santa Cruz de Tenerife) Marta Llanos Muñoz – Hospital Insular (Las Palmas de Gran Canaria) Adolfo Murias Rosales – Hospital Clinico Universitario Lozano Blesa (Zaragoza) José Ignacio Mayordomo – Hospital Universitario San Carlos (Madrid) Miguel Martin Jimenez – Clínica Puerta de Hierro (Madrid) Ricardo Cubedo – Hospital General de Móstoles (Móstoles) Miguel Méndez Ureña – Hospital Universitario "Doce de Octubre" (Madrid) César Mendiola Fernández – Fundación Hospital Alcorcón (Alcorcón) Carlos Jara Sánchez – Fundación Jimenez Díaz (Madrid) Francisco Lobo Samper – Hospital Clínico Universitario de Valladolid (Valladolid) Alvaro Sanz Rubiales – Hospital General de León (León) García Palomo – Hospital de Basurto (Basurto) Purificación Martinez Prado – Hospital Universitario Virgen de la Arrixaca (Murcia) José Luis Alonso Romero – Hospital General Universitario J.M. Morales Meseguer (Murcia) Francisco Ayala de la Peña – 29 Nº 6 – JUNIO DE 2003 Estudios con tratamientos adyuvantes Interior boletin 2.qxd Interior boletin 2.qxd 19/06/03 18:51 Página 30 Estudios en cáncer de mama metastásico "Ensayo clínico multicéntrico, fase IV, abierto, aleatorizado para la administración de Pamidronato en pacientes afectas de cáncer de mama con metástasis óseas" Código: GEICAM/2000-01 Nº DE CENTROS 27 Nº PACIENTES Nº EVENTOS MESES DE SEGUIMIENTO 150 67 42 "Protocolo de tratamiento con Vinorelbina y UFT en pacientes con cáncer de mama metastásico" Código: GEICAM/2000-02 • Número de pacientes reclutadas (Mayo de 2003): 36 Pacientes 60 Teorico Real 50 40 30 20 10 0 Meses Curva de reclutamiento CENTROS INVESTIGADOR Hospital Miguel Servet (Zaragoza) Centro Oncológico Regional de Galicia (A Coruña) Hospital Germans Trias i Pujol (Badalona) Complejo Hospitalario Virgen de la Victoria (Málaga) Hospital de Barbastro (Barbastro) Hospital Universitario Infanta Cristina (Badajoz) Hospital de la Ribera (Alcira) Hospital Clínico Universitario San Cecilio (Granada) Hospital Universitario Virgen de la Arrixaca (Murcia) Hospital de Mérida (Mérida) Dr. Antonio Antón Dr. Ramos Vázquez Dr. Agustí Barnadas Dra. Nuria Ribelles Dr. Jesús Florián Dra. Lomas Garrido Dr. José Miguel Cuevas Dr. García Puche Dr. Juan José Valverde Dra Aranda Bellido 30 Boletín del GEICAM Nº PACIENTES 15 11 7 1 1 1 0 0 0 0 Interior boletin 2.qxd 19/06/03 18:51 Página 31 Meses Curva de reclutamiento CENTROS INVESTIGADOR Hospital Universitario San Carlos (Madrid) Dr. Miguel Martín 18 Hospital Clinic i Provincial (Barcelona) Dra. Montserrat Muñoz 16 Complejo Hospitalario de Orense (Orense) Dr. García Mata 13 Instituto Valenciano de Oncología (Valencia) Dra. Amparo Ruíz 12 Hospital Universitari de Lleida Arnau de Vilanova (Lérida) Dra. Balil 10 Fundación Hospital de Alcorcón (Alcorcón) Dr. Jara 8 Complejo Hospitalario Juan Canalejo-Marítimo de Oza (A Coruña) Dra. Calvo 7 Hospital Puerta de Hierro (Madrid) Dr. Provencio 5 Hospital General Virgen de la Luz (Cuenca) Dr. Mártinez de Dueñas 4 Hospital Clínico Universitario de Salamanca (Salamanca) Dr. Rodríquez 4 Hospital Municipal de Badalona (Badalona) Dra. Moreno 3 Hospital Universitario Marqués de Valdecilla (Santander) Dr. López Vega 3 Hospital General Universitario de Elche (Elche) Dr. Rodríguez Lescure 2 Consorci Sanitari de Terrasa (Terrasa) Dra. Arcusa 2 Hospital Universitari Sant Joan de Reus (Reus) Dr. Pelegrí 2 Instituto Oncológico (San Sebastián) Dra. Plazaola 2 Hospital Universitario de Canarias (Santa Cruz de Tenerife) Dra. Marta Llanos 2 Hospital General Universitario de Alicante (Alicante) Dra. Adrover 2 Hospital Universitario Virgen del Rocío (Sevilla) Dr. Iglesias 1 Hospital Clínico Universitario Virgen de la Victoria (Málaga) Dr. Emilio Alba 1 Hospital General Universitario (Valencia) Dra. Godes 1 Complejo Hospitalario Xeral Calde (Lugo) Dr. Mel 1 Hospital de Gran Canaria Dr. Negrín (Las Palmas de Gran Canaria) Dr. Aguiar 0 Hospital de Mérida (Mérida) Dra. Aranda Bellido 0 Hospital de Barbastro (Barbastro) Dr. Florián 0 Hospital Mutua de Terrassa (Terrasa) Dr. Luís Cirera 0 Consorci Sanitari Integral Hospital de L'Hospitalet (L'Hospitalet de Llobregat) Dr. Joan Janariz 0 31 Nº 6 – JUNIO DE 2003 Nº PACIENTES Estudios con tratamientos adyuvantes Pacientes "Ensayo randomizado en fase III comparativo de vinorelbina frente a la asociación de gemcitabina y vinorelbina en pacientes con carcinoma de mama avanzado previamente tratadas con antraciclinas y taxanos" Código: GEICAM/2000-04 • Número de pacientes reclutadas (Mayo de 2003): 119 19/06/03 18:51 Página 32 "Estudio fase IV.III de mantenimiento con Caelyx® frente a observación tras la quimioterapia de inducción para cáncer de mama metastásico" Código: GEICAM/2001-01 • Número de pacientes reclutadas (Mayo de 2003): 29 • Número de pacientes registradas: 75 Pacientes ENSAYOS CLÍNICOS DEL GEICAM Interior boletin 2.qxd Curva de reclutamiento CENTROS ospital Universitario Virgen del Rocío (Sevilla) INVESTIGADOR Manuel Ruíz Borrego Nº Nº PACIENTES PACIENTES REGISTRADAS INCLUÍDAS 21 7 Hospital Universitario San Carlos (Madrid) Miguel Martín Jiménez 13 6 Complejo Hospitalario Xeral-Calde (Lugo) Mel Lorenzo 8 6 Complejo Hospitalario Juan Canalejo-Marítimo de Oza (A Coruña) Lourdes Calvo 4 3 Centro Oncológico Regional de Galicia (A Coruña) Ramos Vazquez 9 2 Complejo Hospitalario Virgen de la Victoria (Málaga) Emilio Alba Conejo 9 2 Hospital Germans Trias i Pujol (Badalona) Agustí Barnadas 3 2 Hospital Municipal de Badalona (Badalona) Isabel Moreno Solórzano 1 1 Complejo Hospitalario de Albacete (Albacete) Antonio Fernández Aramburo 4 0 Hospital Universitario "Doce de Octubre" (Madrid) César Mendiola 2 0 Hospital General de Elche (Elche) Álvaro Rodríguez Lescure 2 0 Hospital Universitario Marqués de Valdecilla (Santander) José Manuel López Vega 1 0 Hospital General Universitario de Guadalajara (Guadalajara) Javier Cassinello Espinosa 0 0 Hospital Puerta de Hierro (Madrid) Ricardo Cubedo 0 0 Hospital Universitario Puerta del Mar (Cádiz) José Manuel Baena Cañada 0 0 Hospital de Barbastro (Barbastro) Jesús Florián Gericó 0 0 Hospital Miguel Servet (Zaragoza) Antonio Antón Torres 0 0 Hospital de Sagunto (Sagunto) Antonio Galans Brotons 0 0 Complejo Hospitalario Universitario de Santiago (Santiago de Compostela) Menéndez Prieto 0 0 Fundación Hospital de Alcorcón (Alcorcón) Carlos Jara 0 0 Complejo Hospitalario San Millán-San Pedro (Logroño) Edelmira Vélez Mendizabal 0 0 32 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 18:54 Página 33 "Ensayo en cáncer de mama avanzado en primera línea hormonal con exemestano vs anastrozol en mujeres postmenopaúsicas y receptores hormonales positivos. Estudio randomizado, cruzado, multicéntrico" Código: GEICAM/2001-03 • Número de pacientes incluidos (Mayo de 2003): 59 Te o r i c o Real 60 Estudios en cáncer de mama metastásico Pacientes 70 50 40 30 20 10 0 Meses Curva de reclutamiento CENTROS INVESTIGADOR Instituto Valenciano de Oncología (Valencia) Dr. Antonio Llombart 19 Hospital Universitario San Carlos (Madrid) Dr. Miguel Martín 16 Hospital Miguel Servet (Zaragoza) Dr. Antonio Antón 8 Hospital Clínico Universitario Lozano Blesa (Zaragoza) Dr. José Ignacio Mayordomo 7 Hospital Ntra. Sra. De Aranzazu (San Sebastián) Dra. Isabel Álvarez 2 Instituto Oncológico (San Sebastián) Dra. Arrate Plazaola 1 Hospital de Sagunto (Sagunto) Dr. Antonio Galán 1 Hospital Sant Camil (Sant Pere de Ribes) Dra. Monserrat Boleda 1 Hospital Ruber Internacional (Madrid) Dr. José Enrique Ales 1 Hospital Germans Trias i Pujol (Badalona) Dr. Agustí Barnadas 1 Hospital de Barbastro (Barbastro) Dr. Jesús Florián 1 Hospital Puerta De Hierro (Madrid) Dr. Ricardo Cubedo 1 Hospital Municipal de Badalona (Badalona) Dra. Isabel Moreno 0 Hospital General y Universitario de Guadalajara (Guadalajara) Dr. Javier Cassinello 0 Complejo Hospitalario Xeral-Calde (Lugo) Dr. Mel Lorenzo 0 Complejo Hospitalario de Pontevedra (Pontevedra) Dr. Manuel Constenla 0 Complejo Hospitalario Ciudad de Jaén (Jaén) Dr. Sánchez Rovira 0 Complejo Hospitalario Juan Canalejo-Marítimo de Oza (A Coruña) Dra. Silvia Antolín 0 33 Nº 6 – JUNIO DE 2003 Nº PACIENTES 19/06/03 ENSAYOS CLÍNICOS DEL GEICAM Interior boletin 2.qxd 18:54 Página 34 "Ensayo fase II de quimioterapia con Trastuzumab, Paclitaxel y Cisplatino administrados semanalmente en primera línea en cáncer de mama metastásico" Código: GEICAM/2001-04 • Número de pacientes incluidos (Mayo de 2003): 12 Teorico R eal Pacientes 70 60 50 40 30 20 10 0 Meses Curva de reclutamiento CENTROS INVESTIGADOR Nº PACIENTES Complejo Hospitalario Reina Sofía (Córdoba) Dr. Enrique Aranda 3 Complejo Hospitalario Virgen de la Victoria (Málaga) Dra. Nuria Ribelles 3 Fundación Hospital de Alcorcón (Alcorcón) Dr. Jara 2 Hospital de Barbastro (Barbastro) Dr. Florián 1 Hospital de la Ribera (Alcira) Dr. Cuevas 1 Hospital General de Jeréz de la Frontera (Jerez de la Frontera) Dra. Encarna Orozco 1 Hospital Clínic i Provincial (Barcelona) Dra. Muñoz 1 Clínica Puerta de Hierro (Madrid) Dr. Cubedo 0 Hospital Torrecárdenas (Almeria) Dra. Antonia Martínez 0 Hospital General Universitario de Guadalajara (Guadalajara) Dr. Cassinello 0 Hospital Universitario Infanta Cristina (Badajoz) Dra. Mª Lomas Garrido 0 Hospital Txagorritxu (Vitoria) Dra. Severina Domínguez 0 Hospital Universitario Puerta del Mar (Cádiz) Dr. Baena Cañada 0 Complejo Hospitalario Juan Ramón Jiménez (Huelva) Dr. Bayo Calero 0 Complejo Hospitalario de Orense (Orense) Dr. García Mata 0 "Ensayo clínico multicéntrico, fase III, abierto, aleatorizado para la administración de zoledronato en pacientes afectas de cáncer de mama con metastásis óseas asintomáticas" Código: GEICAM/2001-05 • Número de pacientes incluidos (Mayo de 2003): 30 34 Boletín del GEICAM 19/06/03 18:54 Página 35 Meses Curva de reclutamiento CENTROS INVESTIGADOR/A Hospital Clínico Universitario (Valencia) Ana Lluch Hernández Nº PACIENTES 7 Centro Oncológico de Galicia "José Antonio Quiroga y Piñeiro" Manuel Ramos Vázquez 6 Hospital Puerta de Hierro (Madrid) Ricardo Cubedo 4 Hospital Universitario Virgen del Rocio (Sevilla) Manuel Ruiz Borrego 3 Complejo Hospitalario de Pontevedra (Pontevedra) Manuel Constenla 2 Hospital Germans Trias i Pujol (Badalona) Agustí Barnadas y Molins 2 Complejo Hospitalario Juan Canalejo-Marítimo de Oza (A Coruña) Silvia Antolín Novoa 2 Hospital Universitario "Doce de Octubre" César Mendiola 2 Hospital Clinic i Provincial (Barcelona) Montserrat Muñoz 1 Hospital Virgen de los Lirios (Alcoy) Amparo Oltra Ferrando 1 Complejo Hospitalario Virgen de la Victoria (Málaga) Emilio Alba Conejo 0 Hospital Arnau de Vilanova (Valencia) Vicente Alberola Candel 0 Hospital Universitari de Lleida Arnau de Vilanova (Lérida) Ana Balil i Gilart 0 Hospital General Universitario de Elche (Elche) Álvaro Rodríguez Lescure Hospital Xeral-Cies (Vigo) Javier Castellanos Díez 0 0 Complejo Hospitalario Ntra. Sra. de la Candelaria-Ofra (Sta. Cruz de Tenerife) Mª del Pilar López 0 Hospital Militar Central Gómez Ulla (Madrid) Santos Enrech Francés 0 Hospital General de Vic (Vic) Rosa María Franquesa Grané 0 Hospital General Yagüe (Burgos) García Girón 0 Hospital de Madrid (Madrid) Eduardo García Rico 0 Hospital Clínico Universitario San Cecilio (Granada) Jose Luis García Puche 0 Complejo Hospitalario de Orense (Orense) Jesús García Mata 0 Fundación Hospital de Alcorcón (Madrid) Carlos Jara Sánchez 0 Hospital Universitario Infanta Cristina (Badajoz) María Lomas Garrido 0 Hospital General Universitario de Guadalajara (Guadalajara) Arcediano del Amo 0 Complejo Hospitalario Ciudad de Jaén (Jaén) Margarita Fernández Morales 0 Hospital Universitario San Carlos (Madrid) Miguel Martín Jiménez 0 Hospital del Espíritu Santo (Barcelona) Cristina Martín Lorente 0 Hospital Municipal de Badalona (Badalona) Isabel Moreno Solórzano 0 Hospital de Mérida (Mérida) Fuensanta Aranda Bellido 0 Complejo Hospitalario Arquitecto Marcide-Novoa Santos (El Ferrol) Laura de Paz Arias 0 Hospital del Mar (Barcelona) Meritxell Bellet 0 Hospital Universitario Juan Ramón Jiménez (Huelva) Juan Bayo Calero 0 Hospital Clínico Universitario San Juan (Alicante) José Lizón Giner 0 Hospital Sant Camil (Sant Pere de Ribes) Montserrat Boleda 0 Complejo Hospitalario Xeral Calde (Lugo) José Ramón Mel Lorenzo 0 Hospital Universitario de La Fe (Valencia) Miguel Pastor Borgoñón 0 35 Nº 6 – JUNIO DE 2003 Estudios en cáncer de mama metastásico Pacientes Interior boletin 2.qxd 19/06/03 ENSAYOS CLÍNICOS DEL GEICAM Interior boletin 2.qxd 18:54 Página 36 "Ensayo clínico fase III, multicéntrico, randomizado para la comparación de docetaxel (Taxotere®) y trastuzumab (Herceptin®) frente a docetaxel (Taxotere®), sal de platino (cisplatino o carboplatino) y trastuzumab (Herceptin®) como quimioterapia de primera línea para pacientes con cáncer de mama avanzado que contenga la amplificación del gen HER2" Estudio BCIRG-007 Código: GEICAM/2001-07 • Pacientes reclutadas (Mayo de 2003): 7 • Participan en el estudio (GEICAM): Pacientes Te o r i c o Real 20 15 10 5 0 Meses Curva de reclutamiento CENTROS INVESTIGADOR Hospital Universitario San Carlos (Madrid) Miguel Martín Jiménez 4 Hospital General Universitario de Alicante (Alicante) Encarna Adrover Cebrián 2 Hospital Germans Trias i Pujol (Badalona) Agustí Barnadas y Molins 1 Hospital General Universitario de Elche (Elche) Álvaro Rodríguez Lescure 0 Hospital Universitario La Fe (Valencia) Blanca Munárriz Gandia 0 Hospital Ruber Internacional (Madrid) José Enrique Alés Martínez 0 Hospital Clínico Universitario San Juan (Alicante) José Lizón Giner 0 Hospital Virgen de los Lirios (Alcoy) Amparo Oltra 0 Hospital Universitario "Doce de Octubre" (Madrid) César Mendiola 0 Instituto Valenciano de Oncología (Valencia) Amparo Ruiz 0 36 Boletín del GEICAM Nº PACIENTES Interior boletin 2.qxd 19/06/03 18:54 Página 37 Estudios epidemiológicos CENTRO INVESTIGADOR Instituto Valenciano de Oncología (Valencia) Dr. Antonio Llombart/Dra. Amparo Ruiz 1064 Complejo Hospitalario Virgen de la Victoria (Málaga) Dr. Emilio Alba Conejo 515 Complejo Hospitalario de Albacete (Albacete) Dr. Antonio Fernández Aramburo 506 Instituto Oncológico de Guipúzcoa (San Sebastián) Dra. Arrate Plazaola Alcíbar 474 Hospital Clínico Universitario Lozano Blesa (Zaragoza) Dr. José Ignacio Mayordomo 451 Hospital General Universitario Miguel Servet (Zaragoza) Dr. Antonio Antón 378 Hospital Clínico Universitario San Juan (Alicante) Dr. José Lizón Giner 361 Hospital Universitario San Carlos (Madrid) Dr. Miguel Martín/Dr. Antonio Casado 352 Complejo Hospitalario Reina Sofía (Córdoba) Dr. Juan R. De la Haba Rodríguez / Dr. Enrique Aranda 347 Hospital Germans Trias i Pujol (Badalona) Dr. Agustí Barnadas i Molins 298 Centro Oncológico Regional de Galicia (A Coruña) Dr. Manuel Ramos Vázquez 287 Hospital Universitari de Lleida Arnau de Vilanova (Lérida) Dra. Anna Balil i Girart 207 Hospital Universitario Infanta Cristina (Badajoz) Dr. José María Puerto Pica/Dra.MaríaLomas Garrido 189 Hospital de Basurto (Bilbao) Dra. Purificación Martínez del Prado 181 Hospital Ntra. Sra. de Aránzazu (San Sebastián) Dra. Isabel Álvarez López 175 Hospital Provincial de Zamora (Zamora) Dr. José Valero Álvarez Gallego 168 Hospital Virgen de los Lirios (Alcoy) Dra. Amparo Oltra Ferrando 130 Hospital de Barbastro (Barbastro) Dr. Jesús Florián Jericó 124 Hospital Rúber Internacional (Madrid) Dr. José Enrique Alés Martínez 104 Hospital de Especialidades de Jaen Dr. Pedro Sánchez Rovira 100 Hospital Ramón y Cajal (Madrid) Dra. Carmen Crespo Massieu 98 Hospital General de Vic (Vic) Dra. Rosa María Franquesa 94 Hospital Universitario de Canarias (Sta. Cruz de Tenerife) Dra. Beatriz Alonso Álvarez/Dr. Norberto Batista 85 Consorci Sanitari de Terrassa (Terrassa) Dra. Angels Arcusa Lanza 80 Hospital General Universitario de Alicante (Alicante) Dr. Álvaro Rodriguez Lescure 71 Complejo Hospitalario Ntra. Sra. de la Candelaria-Ofra (Sta. Cruz de Tenerife) Dr. José Manuel Rodríguez García / Dr. Javier Dorta Delgado 70 Hospital General de Elda (Elda) Dra. Cristina Llorca Ferrándiz 67 Clínica Corachan S.A. (Barcelona) Dra. Teresa Checa Ruiz/Dr. Alfonso Modolell Roig 50 Hospital Universitario La Princesa (Madrid) Dra. Amalia Velasco 23 Hospital Universitari Sant Joan de Reus (Reus) Dr. Amadeu Pelegrí Sarle/Dra. Sonia del Barco 15 Hospital Insular (Las Palmas de Gran Canaria) Dr. Adolfo Murias 9 Hospital Rio Carrión (Palencia) Dr. Arizcun/Dr. Arranz 5 Hospital de Sagunto (Sagunto) Dr. Antonio Galán Brotons 0 Hospital del Mar (Barcelona) Dra. Meritxell Bellet/Dr. Ignacio Tusquets 0 Hospital General Universitario de Alicante (Alicante) Dra. Encarnación Adrover 0 Complejo Hospitalario Juan Canalejo-Marítimo de Oza (A Coruña) Dra. Lourdes Calvo Martínez 0 Hospital Municipal de Badalona (Badalona) Dra. Isabel Moreno Solorzano 0 Hospital Clínico Universitario (Valencia) Dra. Ana Lluch Hernández 0 Hospital Universitario La Fe (Valencia) Dra. Blanca Munárriz/Dr. Miguel Pastor 0 Complejo Hospitalario Xeral Calde (Lugo) Dr. Guillermo Quintero Aldana 0 Hospital Universitario Virgen del Rocío (Sevilla) Dr. Manuel Ruiz / Dr. Luis Iglesias / Dra. Rosario González 0 Clínica UniversitariA de Navarra (Pamplona) Dr. Martín Algarra 0 37 Nº 6 – JUNIO Nº PACIENTES DE 2003 Estudios epidemiológicos "Encuesta de evolución de pacientes con cáncer de mama en hospitales del grupo GEICAM (1994-1997)" Código: EL ÁLAMO 2. • Recordamos a los investigadores participantes que en el mes de Abril de 2003 concluyó el plazo para la inclusión de pacientes. Rogamos que los investigadores que no hayan enviado los casos de su centro todavía, lo hagan a la mayor brevedad posible. • Número de pacientes incluidos (Mayo de 2003): 7078 • OBJETIVO: 12.000 pacientes ENSAYOS CLÍNICOS DEL GEICAM Interior boletin 2.qxd 19/06/03 20:58 Página 38 Hospital Policlínico de Vigo S.A. POVISA (Vigo) Dra. Concepción Almanza Madera 0 Hospital Xeral Cies (Vigo) Dr. Javier Castellanos Díez 0 Hospital Universitario "Doce de Octubre" (Madrid) Dr. Ramón Colomer Bosch 0 Hospital Clínico Universitario de Salamanca (Salamanca) Dr. Juan Jesús Cruz Hernández 0 Sanatorio San Francisco de Asís - Clínica Ntra. Sra. De América (Madrid) Dra. Isabel de la Gándara 0 Complejo Hospitalario de Orense (Orense) Dr. José Luis Firvida Pérez / Dr. Jesús García Mata 0 Corporació Sanitaria Parc Taulí (Sabadell) Dr. Miguel Angel Seguí 0 Hospital Txagorritxu (Vitoria) Dra. Severina Domínguez 0 Hospital Mutua de Terrassa (Terrassa) Dr. Luis Cirera 0 Hospital Universitario Dr. Peset (Valencia) Dr. Daniel Almenar Cubells 0 Hospital San Pedro de Alcantara (Cáceres) Dr. Borrega 0 Hospital Universitario Puerta del Mar (Cádiz) Dr. José María Baena Cañada 0 Hospital General Universitario de Valencia (Valencia) Dra. Blasco 0 Fundación Tejerina (Madrid) Dr. José Schneider / Dr. Cerrato 0 Complejo Hospitalario Montecelo (Pontevedra) Dr. Manuel Constenla 0 Hospital SAS San Cecilio (Granada) Dr. Diego Márquez 0 Hospital Universitario Marqués de Valdecilla (Santander) Dr. José Manuel López Vega 0 38 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 20:58 Página 39 MARÍA JOSÉ AYBAR, Vice-Presidenta de FECMA Presidenta de AMAC-GEMA (Asociación de Mujeres Aragonesas de Cáncer Genital y de Mama) La mujer protagonista en su proceso de cáncer de mama Durante miles de años la Medicina se ha basado casi exclusivamente en la ciencia médica, proyectando los médicos su saber hacia la sociedad. Más adelante se creó el equipo, a través de la incorporación de enfermería, biólogos, psicólogos, etc. Pero quedaba pendiente algo fundamental, puesto que, fuera del equipo, estaban los máximos protagonistas: el enfermo y el individuo sano, la persona susceptible de enfermar. Todos ellos recibían el esfuerzo del equipo médico, pero participaban poco en las decisiones. Hoy en día hay un cambio, si observamos lo que sucede en Estados Unidos y en el Norte de Europa, hay un vendaval de activismo positivo, en el sentido de que el protagonista, sea persona sana, persona que sufre o ha sufrido una enfermedad, quiere participar, quiere tener su voz en el proceso preventivo, en el proceso diagnóstico, en el terapéutico, en la investigación. Después de este preámbulo y como representante de una Asociación de Mujeres de Cáncer de Mama y desde mi propia experiencia voy a entrar en el tema de cómo una mujer puede participar a lo largo de todo el proceso. La participación viene de la mano de la información. Por una parte, se debe entrar en el tema de la información desde el punto de vista psicológico, diagnóstico, pronóstico, soporte, etc. Pero no basta con esto: la información, no sólo debe atender a la problemática psicológica que pueda generar, sino también a la información real, objetiva de cada momento de la enfermedad. Todavía bastantes mujeres se operan de cáncer de mama dejándose en manos del médico: "mira, te anestesiaremos y veremos lo que es mejor para ti". Creo que debe ser la mujer, siempre sobre la base de la información médica, quién decida cuando hay más de una opción terapéutica con los mismos resultados, el tratamiento que prefiere. En resumen, destacar que hay dos tipos de información: la que corresponde a la problemática de la enfermedad tabú, que es el cáncer, y la información exacta, razonada, justificada en cifras, de lo que es la enfermedad y de cuáles son las opciones que se presentan a la enferma. 39 Nº 6 – JUNIO DE 2003 La mujer protagonista en su proceso de cáncer de mama Desde el otro lado del espejo Interior boletin 2.qxd 19/06/03 20:58 Página 40 Si como he dicho, la información es básica para la participación, no es menos la relación paciente-médico. Tiene que ser una relación de confianza, una relación cuidada hasta los más mínimos detalles para que una pueda mantener la esperanza, para que tanto la intervención como los tratamientos, resulten lo menos agresivos posible. Por lo tanto, el médico habrá de valorar a la enferma en sus problemas familiares y sociales, así como los emanados de su propio carácter. También se precisa la confianza y seguridad de la existencia del colectivo de profesionales que te van a atender, que te van a cuidar a ti como a tu familia. Considero preciso que éstos mantengan una labor de equipo, un tabajo coordinado en pro de la salud de la afectada, que piensen que cualquier malestar humano no puede quedar relegado a lo estrictamente coroporal, pués el cuerpo que padece, expresa también sus vínculos y sus carencias psicológicas y sociales. ¿Cómo se puede facilitar la relación paciente-médico? Yo la basaría en cuatro puntos: 1. INFORMACIÓN.- Hay que enseñar a la paciente cómo debe asimilar la información de manera eficiente durante sus consultas con el médico y proponerle que vaya preparada, escribiendo de antemano las preguntas que quiera realizar e incluso tomar notas durante la consulta, hacerse acompañar por alguien de su entorno. Algunas dudas que a la mayoría se nos presentan son: ¿Qué me sucede? ¿Qué me prescribe y por qué? ¿Hay métodos alternativos, y cuáles son los beneficios y los riesgos? ¿Hay efectos secundarios? 2. CONFIANZA.- Es vital que la paciente confíe en el médico. Para ella esto supone plantear qué expectativas tiene, durante el tratamiento, respecto al médico. Es importante en esta relación de colaboración, que la enferma se responsabilice de su propia salud y se haga cargo de lo que de ella depende. Se ha de sentir segura expresandosus sentimientos y ha de saber que se la escucha. Su médico debe: Explicarlo todo escogiendo cuidadosamente las palabras. Permitir que la visita dure todo lo necesario. Comprender lo que es especial en su enfermedad. Trabajar con los miembros de su familia. 3. INTERACCIÓN.- Se debe animar a la paciente a que interactúe con el médico de una manera firme y participativa. Hay que ayudarla a ensayar cómo comunicar con eficacia su enfado, su miedo y sus preguntas. 4. RESPONSABILIDAD.- Hay que posibilitar que la paciente tenga clara su responsabilidad en el enfoque y las alternativas de tratamiento. Se la ha de ayudar a que vea qué opciones y posibilidades existen, incluso cuando éstas apenas difieren entre sí o cuando son inapelables. Es preciso alentarla para que asuma el control de las decisones que le corresponden tomar durante el tratamiento. Esta relación médico-paciente la define una frase de Unamuno: "Hay que estar con el enfermo sin ser el enfermo". Como resumen a todo lo anterior me gustaría que avanzando en el milenio fuésemos capaces de conseguir lo siguiente: • Educación y responsabilización de nuestra propia salud, de tal forma que cada uno obtuviésemos la capacidad de tomar nuestras decisiones con autonomía. • Desmitificación y uso correcto de la palabra CÁNCER. Que este sustantivo cuya definición es una enfermedad con tratamiento, no sea usado para apelar a situaciones generalizadas de crisis. Ejemplo: hace poco escuché en un medio de comunicación que despedían a un entrenador de futbol porque era "el cáncer del equipo". 40 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 19:03 Página 41 • Debida información y apoyo de un equipo para que la persona dentro de un proceso de cáncer, pueda participar y tomar las decisiones que más le convengan. NADIE DEBERÍA ESTAR AUTORIZADO A ROBARLE ESTE DERECHO. Voy a terminar con una frase de una paciente con cáncer de mama (Shirley Glass): La mujer protagonista en su proceso de cáncer de mama "Cuando mi médico me dijo que era una enferma exigente, le contesté que una paciente de cáncer dócil, es una paciente de cáncer muerta". 41 Nº 6 – JUNIO DE 2003 Interior boletin 2.qxd 19/06/03 19:03 Página 42 Desde la sede CÉSAR GARCÍA SERRANO GESTOR DE DATOS - SEDE DE GEICAM Todo lo que siempre quiso saber de un gestor de datos y nunca se atrevió a preguntar El Ensayo Clínico no existiría sin datos, aunque no hay que olvidar que los datos no existirían sin pacientes. Partiendo de esta premisa se puede entender que es necesario la figura del Gestor de Datos debido al papel fundamental que los datos tienen en todo el proceso de elaboración de un ensayo clínico. Y Vd. se preguntará: ¿Qué es un Gestor de Datos? No se puede responder a esta pregunta sin antes hacer una breve exposición de dicho proceso. El protocolo nos marca las directrices de qué datos deben reflejarse en el Ensayo Clínico. Siguiendo las pautas indicadas en éste, los investigadores médicos recogen en los cuadernos de recogida de datos (CRDs) la información de las pacientes participantes. Los monitores contrastan la información que aparecen en los CRDs con la que está reflejada en la historia clínica y otros documentos fuente. Esta información es entregada al Departamento de Gestión de Datos. A partir de aquí es cuando el Gestor de Datos participa más activamente. Se confeccionarán las Bases de Randomización y de Entrada de Datos que habrán sido diseñadas previamente por el Departamento de Gestión de Datos ajustándose a las pautas marcadas en el protocolo y validadas con sus correspondientes procedimientos. Toda la información de los CRDs es introducida en la Base de Datos correspondiente y todos los registros de los cuadernos quedarán almacenados. Una vez grabados los datos se procede a su verificación contrastando la información recogida en los CRDs con la introducida en la Base de Datos. El gestor de datos editará las queries pertinentes tras la identificación de los datos omitidos, erróneos, dudosos, correcciones, discrepancias y clarificaciones. Éstas serán resueltas posteriormente, dependiendo del nivel, por el propio gestor de datos, el monitor o el investigador. Una vez resueltas las queries se vuelve a validar la Base de Datos tras las modificaciones pertinentes. Este proceso se repetirá tantas veces como sea necesario hasta la 42 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 19:03 Página 43 obtención de una Base de Datos "limpia", es decir, que todos sus datos sean coherentes y se ajusten al protocolo. Una vez que todos los datos del Ensayo Clínico están completados se "sella la Base de Datos" (lo que supone que nadie puede hacer modificaciones sobre los datos o una manipulación de éstos) y se entrega al Departamento de Bioestadística para su posterior análisis. Por todo lo expuesto podemos llegar a la conclusión de que un Gestor de Datos es una parte fundamental del engranaje del Ensayo Clínico para conseguir un trabajo de calidad. Espero haber contestado, si no a todas, a algunas de vuestras preguntas. Un saludo. 43 Nº 6 – JUNIO DE 2003 NOTICIAS Y CONVOCATORIAS Interior boletin 2.qxd 19/06/03 19:03 Página 44 Noticias y convocatorias Noticias TRASLADO DE HOSPITAL DE LOS DRES. AMADEU PELEGRÍ Y EDUARDO MARTÍNEZ DE DUEÑAS El Dr. Amadeu Pelegrí, que venía desarrollando su labor profesional en el Hospital Sant Joan de Reus, se ha trasladado al Hospital Arnau de Vilanova de Lleida. El Dr. Amadeu Pelegrí será sustituido en el Hospital Sant Joan de Reus por la Dra. Sonia del Barco. Por su parte, el Dr. Eduardo Martínez de Dueñas, que estaba trabajando en el Hospital Virgen de la Luz de Cuenca, se ha trasladado al Hospital Provincial de Castellón y será sustituido por las Dras. María del Mar Muñoz Sánchez e Isabel Fernández-Rañada Shaw. Desde la sede de GEICAM queremos desear a ambos mucha suerte en sus nuevos lugares de trabajo. Convocatorias 39th ASCO Annual Meeting Lugar de celebración: Chicago, Illinois, 31 de mayo-3 de junio de 2003 IV Congreso Internacional de GEICAM Lugar de celebración: Palacio de la Magdalena, Santander 6, 7 y 8 de Junio de 2003 Coordinador: Dr. José Manuel López Vega, Hospital Universitario Marqués de Valdecilla, Santander IX Congreso de la SEOM Lugar de celebración: Santa Cruz de Tenerife, 21 a 24 de Junio de 2003 44 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 19:03 Página 45 IV SIMPOSIO INTERNACIONAL DE GEICAM Palacio de la Magdalena, Santander; 6-8 Junio 2003 Dr. José Luis Fernández Luna Unidad de Biología Molecular. Hospital Universitario Marqués de Valdecilla (Santander) Ponencia: Mecanismos moleculares de quimiorresistencia Dr. Félix Bonilla Velasco Servicio de Oncología Médica. Hospital Universitario Puerta de Hierro (Madrid) Ponencia: Cambios moleculares genéticos y epigenéticos en cáncer de mama: Identificación, expresión y perspectivas clínicas Dr. Jaume Piulats Laboratorio de Bioinvestigación. Merck Farma y Química, S.A. (Barcelona) Ponencia: Inhibición de la angiogénesis: Mecanismos y perspectivas clínicas Dr. Francisco J. Esteva Breast Medical Oncology. M.D. Anderson Cancer Center. (Houston, EEUU) Ponencia: Basic developments on HER2 biology and its clinical prospects Prof. Mitch Dowsett Royal Marsden Hospital (Gran Bretaña) Ponencia: Mechanisms of resistance to tamoxifen and oestrogen deprivation Dr. Álvaro Rodríguez Lescure Hospital General de Elche (Alicante) Ponencia: Taxanos en quimioterapia adyuvante del cáncer de mama Prof. Robert Paridaens Universidad de Lovaina (Bélgica) Ponencia: New options in adjuvant hormonal therapy Dr. Terry Mamounas Aultman Cancer Center. (Ohio, EEUU) Ponencia: Recent experience from NSABP in adjuvant and neoadjuvant treatments Prof. Dennis Slamon Universidad de California (Los Angeles, EEUU) Ponencia: Clinical trials on adjuvant trastuzumab (Herceptin) 45 Nº 6 – JUNIO DE 2003 IV Simposio Internacional de GEICAM Lista de ponentes PROGRAMA Interior boletin 2.qxd 19/06/03 20:47 Página 46 Programa VIERNES, 6 DE JUNIO DE 2003 09:00 h 13:00 h 16:00 h 16:05 h 16:15 h 16:55 h 17:35 h 18:15 h 18:55 h 19:35 h 21:45 h Reunión de la Junta Directiva de GEICAM Comedor de Infantes, Palacio de la Magdalena Almuerzo, Palacio de la Magdalena Comienzo del IV Simposio Internacional. Paraninfo de la Magdalena Presentación: Dr. José Manuel López Vega, Hospital Universitario Marqués de Valdecilla (Santander) 1ª Mesa Científica INVESTIGACIÓN BÁSICA APLICADA AL CÁNCER DE MAMA Moderadoras: Dra. Ana Lluch, Hospital Clínico de Valencia Dra. Laura García Estévez, Fundación Jiménez Díaz (Madrid) Título: Mecanismos moleculares de quimiorresistencia Dr. José Luis Fernández Luna, Hospital Universitario Marqués de Valdecilla (Santander) Título: Cambios moleculares genéticos y epigenéticos en cáncer de mama: Identificación, expresión y perspectivas clínicas Dr.Félix Bonilla Velasco, Hospital Universitario Puerta de Hierro (Madrid) Título: Inhibición de la angiogénesis: Mecanismos y perspectivas clínicas Dr. Jaume Piulats, Laboratorio de Bioinvestigación. Merck Farma y Química, S.A. (Barcelona) Título: Basic developments on HER2 biology and its clinical prospects Dr. Francisco J. Esteva, M.D. Anderson Cancer Center. (Houston, EEUU) Título: Mechanisms of resistance to tamoxifen and oestrogen deprivation Prof. Mitch Dowsett, Royal Marsden Hospital (Gran Bretaña) Debate Cena de Ponentes (Restaurante La Cúpula, Santander) SÁBADO, 7 DE JUNIO DE 2003 09:00 h 14:00 h 17:00 h 17:30 h 17:40 h 18:10 h 18:50 h 19:20 h 20:00 h 20:45 h 21:45 h Reunión Asamblea General de GEICAM Paraninfo de la Magdalena Salida hacia el embarcadero de la bahía de Santander Almuerzo a bordo durante una circunnavegación de la bahía REVISIÓN Y COMENTARIO DE COMUNICACIONES AL SIMPOSIO Dra. Amparo Ruiz, Instituto Valenciano de Oncología Dr. Agustí Barnadas, Hospital Germans Trias i Pujol (Barcelona) 2ª Mesa Científica AVANCES EN TRATAMIENTO ADYUVANTE Moderadores: Dr. Amadeu Pelegrí, Hospital Universitario Sant Joan de Reus (Tarragona), Dr. Emilio Alba, Hospital Universitario Virgen de la Victoria (Málaga) Título: Taxanos en quimioterapia adyuvante del cáncer de mama Dr. Álvaro Rodríguez Lescure, Hospital General de Elche (Alicante) Título: New options in adjuvant hormonal therapy Prof. Robert Paridaens, Universidad de Lovaina (Bélgica) Título: Recent experience from NSABP in adjuvant and neoadjuvant treatments Dr. Terry Mamounas, Aultman Cancer Center. (Ohio, EEUU) Título: Clinical trials on adjuvant trastuzumab (Herceptin) Prof. Dennis Slamon, Universidad de California (Los Angeles, EEUU) Debate Conclusiones y clausura Dr. Miguel Martín, Presidente de GEICAM Cena Oficial de Simposio (Gran Casino de Santander) 46 Boletín del GEICAM Interior boletin 2.qxd 19/06/03 20:47 Página 47 Solicitud de admisión a GEICAM (Grupo Español de Investigación en Cáncer de Mama) Por favor, recorte el formulario, rellénelo y envíelo por fax al número 91 571 01 01, ó por correo a la dirección: GEICAM, Paseo de la Castellana 181, 16 Derecha, 28046 Madrid Datos del solicitante: Nombre y apellidos: Título de Especialidad: Año: Centro donde trabaja: Tel.: Dirección Centro: Fax: Dirección particular: Tel.: Solicito ser miembro de GEICAM, aceptando sus estatutos. En ................................................................................. a .......... de ........................................ de ........................................ Firmado: Miembros de GEICAM que le avalan: Nombre y apellidos: Centro donde trabaja: En ................................................................................. a .......... de ........................................ de ........................................ Firmado: Nombre y apellidos: Centro donde trabaja: En ................................................................................. a .......... de ........................................ de ........................................ Firmado: 47 Nº 6 – JUNIO DE 2003 Interior boletin 2.qxd 19/06/03 20:48 Página 49 Formulario de Inscripción como Miembro Colaborador Recorte el formulario, complételo y envíelo por fax al número 91 571 0101, o por correo postal a la siguiente dirección: Grupo Español de Investigación en Cáncer de Mama Paseo de la Castellana 181, 16 Dcha 28046 Madrid Nombre o entidad: NIF: Domicilio: Localidad: País: C.P. Teléfono: Correo electrónico : Aportación periódica: Anual Mensual Cuantía de la aportación: Aportación única Formas de pago Domiciliación bancaria Tarjeta de crédito Transferencia bancaria Talón nominativo Domiciliación bancaria Consigne los siguientes datos: (Los encontrará en su libreta, talonario o extracto del banco) Nº de Entidad (4 dígitos) Nº de Oficina (4 dígitos) D.C. (2 dígitos) Nº de Cuenta (10 dígitos) Tarjetas de crédito válidas: Visa, Mastercard Consigne los siguientes datos: Nombre de la tarjeta: VISA Número de la tarjeta (16 dígitos): MASTERCARD OTRAS _________________________________ Fecha de caducidad: Titular de la tarjeta: Transferencias Bancarias: Caixa Laietana: 2042 0160 42 3300000146 Talón nominativo: Expedirlo a favor del Grupo Español de Investigación en Cáncer de Mama y remitirlo a la dirección: Grupo Español de Investigación en Cáncer de Mama Paseo de la Castellana 181, 16 Derecha 28046 Madrid 49 Nº 6 – JUNIO DE 2003