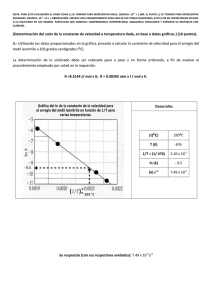
Etapa I
Anuncio

0 UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE AGRONOMIA DEPARTAMENTO DE QUÍMICA Y TECNOLOGÍA CÁTEDRA QUÍMICA III GUIA DE CÁLCULOS Maracay, enero 2010 1 Personal de la Cátedra Activo Ing. Agro. Dra. Alejandra Ramírez Ing. Agro. MSc. Francisca Sosa Ing. Agro. MSc. Yasmin Román Ing. Agro. Audrey Suárez Ing. Agro. Dra. Nora Techeira Ing. Agro. MSc. Palmira Zambrano Ing. Agro. MSc. Fanny Molina Jubilado Ing. Agro. Dr. Ekcbert Schulz Ch. Lic. Qca. MSc. Ligia Ortiz Lic. Qca. Gladys Quijada Fca. Carmen Sofía Bravo Ing. Agro. Dra. Carmen Rivero Lic. Biol. Dra. Emperatriz Pacheco Lic. Qca. MSc. Feliciano R. Anzola Ing. Qco. MSc. Lucia Graciani 2 PROLOGO Los objetivos fundamentales de la asignatura QUÍMICA III, radican en capacitar al estudiante en la planificación, ejecución de diferentes tipos de análisis químicos así como la de interpretar sus resultados. Como una contribución al logro de este objetivo, los Profesores de la Cátedra prepararon la presente Guía de Cálculos, producto de la experiencia acumulada en el transcurso de varios años de trabajo docente. La Guía comprende prácticas de cálculos que permiten el manejo de resultados, y además, incluye los correspondientes problemarios. La información suministrada es indispensable para el estudio y comprensión del ANÁLISIS QUÍMICO CUANTITATIVO. Sin duda este material, donde se presentan métodos gravimétricos, volumétricos y espectrofotométricos, todos de gran utilidad práctica, será una valiosa ayuda para los estudiantes tanto desde el punto de vista formativo como informativo. 3 ÍNDICE Contenido PROLOGO ……………………………………………………………………… Pag. 2 Práctica Nº 1: Resolución de problemas. pH de ácidos y bases fuertes y débiles. Acidez total, actual y potencial ……………………………………… 6 Cálculo de la concentración iónica de soluciones de ácidos fuertes y débiles ………………………………………………………………… 7 Cálculo de pH y del pOH de soluciones de ácido y bases, fuertes y débiles ………………………………………………………………… 8 Cálculo de las concentraciones iónicas conocidos el pH o el pOH.. 9 Acidez actual, acidez total y acidez potencial .……………………… 10 Problemas propuestos ………………………………………………… 12 Práctica Nº 2: Cálculo del pH de soluciones reguladoras…………………. 15 Sistema regulador ácido débil y su sal: ácido acético – acetato de sodio …………………………………………………………………….. 15 Sistema regulador base débil y su sal: hidróxido de amonio– cloruro de amonio …………………………………………………...… 19 Mecanismo de acción reguladora ………………………………….… 21 Problemas propuestos ……………………………………………...… 23 Práctica Nº 3: Cálculo del pH de sales que hidrolizan ……………………. 27 Ejercicios ……………………………………………………………...… 27 Problemas propuestos…………………………………………………. 32 Práctica Nº 4: Cálculo de la solubilidad y el Kps de compuestos pocos solubles………………………………………………………………………….. 33 Cálculo de Kps ………………………………………………………… 34 4 Cálculo de la solubilidad a partir del Kps …………………………… 35 Efecto del ión común ………………………………………………….. 37 Aplicaciones del Kps …………………………………………………... 40 Problemas propuestos ………………………………………………… 42 Práctica Nº 5: Manejo de resultados en el análisis Gravimétrico, cálculos de humedad y muestra seca …………………………………….… 45 Factor gravimétrico o factor de conversión ……….……………….… 46 Relación de millonésima parte: mg.kg-1 …………………………….. 50 Milimoles de carga en Solución ……………………….……………… 50 Cálculos referidos a muestra y muestra seca ……………………... 51 Problemario de gravimetría …………………………………………… 53 Práctica No 6: Aplicación de criterios estadísticos al Manejo de datos obtenidos en el laboratorio ………………………………………………….… 57 Cálculo de la Media Aritmética ……………………………………….. 58 Estimación de la precisión …………………………………………….. 60 La desviación Media Absoluta ………………………...……………… 60 La desviación Media Relativa ………………………………………… 60 Estimación de la exactitud ……………………………………..……… 62 Error Absoluto …………………………………………………….…… 62 Error relativo ……………………………………………………….…… 62 Limites de precisión y exactitud aceptados en el análisis químico .. 63 Problemas propuestos ………………………………………………… 64 Práctica Nº 7: Mezclas alcalinas …………………………………………..… 67 Manejo del concepto de milimolc …………………………………..…. 67 Cálculos aplicados a los métodos volumétricos ………………….… 71 Composición cualitativa de una mezcla alcalina ………………….... 73 Mezcla de hidróxido y carbonato ……………………………………. . 74 Mezcla de carbonato y bicarbonato …………………………………. 76 5 Problemas propuestos ………………………………………………… 78 Práctica No 8: Cálculos relacionados con la quelometría ………………… 82 Determinaciones con el uso de EDTA …………………………….… 85 Problemas propuestos ………………………………………………… 89 Práctica N° 9: Cálculos en el análisis espectrofométrico ………………… 93 Problemas propuestos ………………………………………………… 94 Apéndices …………………………………………………………………..…… 97 6 INTRODUCCIÓN AL EQUILIBRIO QUÍMICO PRACTICA Nº 1. RESOLUCIÓN DE PROBLEMAS. pH DE ÁCIDOS Y BASES FUERTES Y DÉBILES. ACIDEZ TOTAL, ACTUAL Y POTENCIAL. OBJETIVOS Que el alumno obtenga la destreza necesaria para: Calcular la concentración iónica en soluciones de ácidos y bases fuertes y débiles. Calcular el pH y el pOH de soluciones de ácidos y bases fuertes y débiles. Calcular la acidez total, actual y potencial de soluciones de ácidos fuertes y débiles. INTRODUCCIÓN Tal vez no existe en Química otra clase de equilibrio tan importante como aquel en que intervienen los ácidos y las bases. El ión hidronio, H3O+, participa en muchas reacciones químicas donde puede ser: uno de los reaccionantes, un producto, un catalizador o estar involucrado de alguna otra forma. La concentración de hidronio, H3O+, podría determinar en qué extensión se realiza la reacción, la velocidad de la misma o el mecanismo según el cual dicha reacción tiene lugar. Los ácidos y las bases son comúnmente clasificados como fuertes y débiles, según la magnitud del valor de la constante de ionización, Ki. Se asume que los ácidos y bases fuertes son aquellos que en soluciones acuosas diluidas están 100% ionizados, por ello basta conocer su concentración molar para calcular el pH de dichas soluciones. Por su parte, los ácidos y bases débiles presentes en soluciones acuosas están sólo parcialmente ionizados. Para calcular el pH de estas soluciones es necesario 7 conocer además de la concentración molar, la constante de ionización del ácido (Ka) o de la base (Kb) en cuestión. 1. Cálculo de la concentración iónica de soluciones de ácidos fuertes y débiles. Uno de los problemas más frecuentes es averiguar cuál es la concentración de las especies iónicas presentes en una solución, a partir de una constante de ionización conocida, para la cual se toma como base la expresión del cálculo de Ki. Ejercicio 1 ¿Cuál será la concentración de los iones presentes en una solución que es 0,0100 M en ácido acético (CH3COOH) si Ka = 1,8 10-5? a.- Se establece la reacción de equilibrio: CH COOH 3 H CH COO 3 b.- Al deducir la expresión de Ka; se tiene: Ka [H ][CH 3 COO ] [CH 3 COOH] c.- Como se desconocen las concentraciones: [H ] [CH 3 COO ] [CH 3 COOH] X 0,0100 X d.- Se sustituyen estos valores en la expresión de Ka: Ka X* X 0,0100 X . Como se está en presencia de un ácido débil cuyo valor de Ka es muy pequeño, Ka = 1,8 x 10-5, es decir menor a 1,0 10-4, es posible suponer que la porción de ácido disociado (X) es también muy pequeña y puede ser despreciada cuando actua como sumando o como sustraendo. Nota 1: El valor de K de 1 10-4 ha sido propuesto como el valor límite para considerar si la fracción ionizada debe ser considerada o no. 8 e.- La validez de la suposición hecha puede ser comprobada 0,01 – 4,2 10-4 = 0,00957 0,01 Nota 2: Para las bases se procede de idéntica forma, aplicando el valor Kb. 2. Cálculo de pH y del pOH de soluciones de ácido y bases, fuertes y débiles. El pH de una solución está dado, según la definición propuesta por Sórensen, por el logaritmo negativo de la concentración de iones hidrógeno presente en dicha solución. Matemáticamente la expresión sería la siguiente: pH log[H 1 ] log[H ] También es posible, por analogía, el cálculo del pOH en una solución. Éste es igual, matemáticamente, al logaritmo negativo de la [OH : pOH log[OH ] 1 log[OH ] Ahora bien, el conocimiento de uno u otro valor (pH, pOH) implica el conocimiento automático del desconocido, por cuanto al aplicar las definiciones anteriores a la expresión del producto iónico del agua se obtiene que: pH + pOH = 14 Ejercicio 2 Se tiene una solución cuya [H+ es 4,8 10-13. ¿Cuál será su pH? pH = - log [H- = - log (4,8 10-13) pH = 12,32 Ejercicio 3 ¿Cuál es el pH de una solución cuya [OH- es 2,5 10-3 M? El producto iónico del agua es: Kw = [OH- [H+ = 1 10-14 1,00 10-14 = (2,5 * 10-3) [H+ 9 H 1,00 * 10 14 2,5 * 10 3 4 * 10 12 pH = - log [H+ = - log4*10-12 pH = 11,40 Ejercicio 4 ¿Cuál es el pOH de una solución cuya [OH- es 4,5 10-11 M? Calcule además el pH pOH = - log [OH+ = - log4,510-11 pOH = 10,35 pH = 14 – 10,35 pH = 3,65 3. Cálculo de las concentraciones iónicas conocidos el pH o el pOH Ejercicio 5 ¿Cuál será la concentración de ión H+ presente en una solución cuyo pH es 3,6? pH = - log [H+ = 3,6 log [H+ = - 3,6 No existen tablas con valores para antilogaritmos negativos, por esta razón para calcular la [H+ es necesario valerse de un artificio matemático: -3,6 = - 4+0,4 Sustituyendo en la expresión [H+ = antilog. (- 4 + 0,4) [H+ = (antilog. – 4) (antilog. 0,4) [H+ = 10-4 2,51 [H+ = 2,51 10-4 mol L-1 Ejercicio 6 ¿Cuál es la concentración de OH- en una solución cuyo pH es 12,68? pH = - log [H+ = 12,68 10 log [H+ = -12,68 a. Cálculo de la [H+ por aplicación del mismo artificio del problema anterior: [H+ = (antilog – 13)* (antilog 0,32) [H+ = 2,1 10-13 mol L-1 b. Cálculo de la [OH- , a través del Kw: 1,00 10-14 = [H+ [OH[OH ] 1,00 * 10 14 [H ] [OH ] 1,00 * 10 14 2,1 * 10 13 [OH ] 4,76 *10 2 molL 1 4. Acidez actual, acidez total y acidez potencial. Si se compara el comportamiento de soluciones equimolares (igual concentración) de los ácidos HCl y CH3COOH, ambos monopróticos (es decir, que ceden un ión hidronio por cada mol de ácido) se encuentra la siguiente situación: Solución 0,1000M HCl: HCl H es decir que: H Cl 0,1000 molL 1 pH = 1,0 Solución 0,1000M CH3COOH: CH 3 COOH H CH 3 COO [CH3COOH = 0,1 - X [H+ = 1,34 10-3 M pH = 2,87 11 A pesar de tener ambas soluciones la misma potencialidad en iones hidronio, es decir, 0,1000 mol L-1, en el caso del electrolito débil su concentración de iones H+ será muy pequeña comparada con la primera. Con base a este comportamiento diferente para originar iones hidronio en solución, surgen los conceptos de: Acidez Total, Acidez Actual y Acidez Potencial. Acidez Total: Viene dada por la concentración de iones H+ que puede originar el ácido (átomos de hidrógeno combinados en enlace covalente polar). Se mide por titulación y se expresa en moles L-1. Acidez Actual: Viene dada por la concentración de iones hidronio en solución. Se expresa en moles L-1 y se mide indirectamente por el pH. Acidez Potencial: Es la concentración de iones hidrógeno que aún permanece sin ionizar, unidos en el ácido por enlace covalente polar. Esta acidez se calcula por la diferencia entre la acidez total y acidez actual. Si ha comprendido bien estos términos. Indique para las soluciones de HCl y CH3COOH 0,1000 M los valores correspondientes a la acidez actual, total y potencial, Ka para el ácido acético es 1,810-5. ÁCIDO Acidez Total Acidez Actual Acidez Potencial HCl CH3COOH En el campo agronómico estos conceptos son de gran importancia para manejar los criterios de acidez en los suelos. En este campo de estudio, a la acidez 12 potencial se le da el nombre de “acidez de reserva” y a la acidez actual se le llama “acidez activa”. Problemas propuestos. 1. Determinar la [H+ y la [CH3COO- para una solución 7,1 10-3 M de ácido acético (CH3COOH) si Ka = 1,8 10-5 R: 3,57 10-4 mol L-1 2. Determinar la concentración molar de OH- en una solución 0,12 M en amoníaco si Kb = 1,8 10-5 R: 1,47 10-3 moles L-1. 3. ¿Cuál será la molaridad de una disolución de ácido acético (CH 3COOH) que genera una [H+ de 2,510-4 moles L-1, si la constante de ionización de este ácido es 1,810-5? R: 3,72 10-3 M 4. Se tiene una solución de HCNO (ácido ciánico) 0,013 M. ¿Cuál es la concentración de H+, CNO- y HCNO de esta solución? La constante de disociación del HCNO es 1,2 10-4. R: 1,25 10-3 M (H+); 1,25 10-3 M (CNO -) y 0,0118 M HCNO 5. ¿Cuál es la [H+ presente en una solución 1,34 10-4 M de ácido propiónico? Ka = 1,34 10-5 R: 4,24 10-5 M 6. ¿Cuál es el pH de una solución de ácido acético cuya [OH - es 4,5 10-11 M? R: 3,65 7. ¿Cuál es el pH de una solución de NH4OH 0,025 M si Kb = 1,8 10-5? R: 10,83 8. ¿Cuál será [H+], [OH-], pH y pOH de una solución de ácido acético 0,25 M, si Ka = 1,8 10-5? R: [H+] = 2,12 10-3, [OH-] = 4,68 10-12, pH = 2,67 y pOH = 11,33 13 9. En cada caso calcule el pH de una solución 0,1 M. a.- Anilina (C6H5NH2), Kb = 4,2 10-10 b.- Piridina (C5C5N), Kb = 1,5 10-9 c.- Fenol(C6H5OH), Ka = 1,3 10-10 d.- Ácido benzoico(C6H5COOH), Ka = 6,30 10-5 R: a. pH = 8,81; b. 9,09; c. 5,44; d. 2,60 10. Calcule el pH de una solución de ácido hipocloroso 0,05 M. Ka = 3,2 10-8 R: 4,40 11. Una solución tiene concentración de ión hidrógeno de 4,0 10-12 M. ¿Cuál será el pOH? R: 2,60 12. ¿Cuál será el pOH de una disolución de Ba(OH)2 que contiene 0,6614 g L-1 suponiendo que la disolución es completa? Calcule además el pH de esa solución. Ba(OH)2 = 171,36 g mol-1. R: 2,11 y 11,89 13. ¿Cuál será el pH de una disolución de NaOH que contiene 0,04 g de soluto L-1 de disolución? NaOH = 40 g mol-1. R: 11 14. Se tiene un suelo cuyo pH es 5.5 ¿Cuál será la concentración de hidrógeno en R: 3,16 10-6 mol L-1 dicho suelo? 15. La sangre suele tener un pH de 7,4. ¿Cuál es la concentración de [OH- ? R: 0,25 10-6 mol L-1 16. Construya un cuadro con la acidez total, actual y potencial para los siguientes pares de electrolitos: 16.1 HClO 0,1 M HI 0,1 M Ka = 3,0 10-8 14 16.2 HNO3 0,20 M Ka = 1,8 10-5 CH3COOH 0,2 M 16.3 HCl 0,05 M Ka = 6,3 10-5 C6H5COOH 0,05 M 16.4 HClO4 0,01 M Ka = 1,3 10-10 C6H5OH 0,10 M 17.- Clasifique los siguientes electrolitos como: 17.1. Äcido: Fuerte y Débil 17.2. Base: Fuerte y Débil 1. HNO3 8. HBr 2. KOH 9. H2S 3. H3PO4 10. NaOH 4. Ba (OH)2 11. HClO4 5. HI 12. NH4OH 6. HCN 13. H2CO3 7. Ca(OH)2 14. NH3 15 PRÁCTICA Nº 2. CÁLCULO DEL pH DE SOLUCIONES REGULADORAS OBJETIVOS Que el alumno obtenga la destreza necesaria para: Calcular el pH de diferentes mezclas reguladoras. Comprender, basado en cálculos, el mecanismo de acción reguladora. INTRODUCCIÓN Una solución amortiguadora o reguladora es aquella que cambia sólo ligeramente la concentración de iones hidrógeno cuando se le añaden pequeñas cantidades de un ácido fuerte o de una base fuerte o cuando son diluidas. En consecuencia, su pH varía muy poco. En general dichas soluciones estan formadas por un ácido débil y su sal y/o por una base débil y su sal. Ahora bien, mantener la reacción de un sistema, dentro de ciertos niveles, constituye uno de los aspectos de mayor relevancia en los campos de la química analítica y la agronomía. En el primer caso porque existe un número muy importante de reacciones, usadas como base de métodos analíticos, que solo proceden en el sentido deseado a un determinado nivel de pH. Para comprender la importancia en el campo agronómico basta recordar que la producción agrícola depende de seres vivos y que todas las funciones de éstos son posibles en rangos estrechos de acidez o bacisidad. 1. Sistema regulador ácido débil y su sal: ácido acético – acetato de sodio. Ejercicio 1. ¿Cuál es el pH de una solución reguladora preparada por disolución de 0,525 mol de ácido acético y 0,525 mol de acetato de sodio, en agua suficiente para obtener 0,5 L de solución? 16 Ka = 1,8 10-5 a. El sistema regulador planteado sería: CH 3 COOH CH 3 COO CH COONa 3 H CH COO 3 Na b. Se calcula la Molaridad del ácido acético y del acetato de sodio: Ca = 0,525 mol / 0,5 L = 1,05 mol L-1 Cs = 0,525 mol / 0,5 L = 1,05 mol L-1 c. El ácido acético es un electrolito débil por lo que su Ka debe plantearse con base a su equilibrio de disociación: CH 3 COOH Ka CH 3 COO H [CH 3 COO ][H ] [CH 3 COOH] d. El acetato de sodio es un electrolito fuerte CH COONa 3 CH COO 3 Na Cs = [CH3COONa = [CH3COO- = [Na+ Por lo tanto en una solución reguladora formada por un ácido débil y su correspondiente sal, [H+ [CH3COO- , debido a que la CH3COO- proviene tanto de la disociación del ácido como la de la sal. e.- Se despeja la concentración molar de iones hidrógeno a partir de Ka: [H ] Ka [CH 3 COOH] [CH 3 COO ] 17 f.- Se calculan las concentraciones de las entidades iónicas y moleculares presentes en el equilibrio: El acetato de sodio ioniza completamente, y da origen a 1,05 mol L-1 de ión acetato. 1,05 0 CH COONa 3 0 0 CH COO 3 Na 1,05 1,05 El ácido acético, como electrolito débil, se ioniza sólo en pequeña extensión, dando origen a X mol L-1 de ión hidrógeno y X mol L-1 de ión acetato, quedando sin ionizar (1,50 – X) mol L-1 del ácido. En el equilibrio, por estar presente la sal (acetato de sodio): Inicialmente 1,05 1,05 + 0 CH 3 COOH En el equilibrio CH 3 COO 1,05 – X 0 H 1,05 + X X El valor de X, en este caso, es menor que el obtenido en la disociación del ácido puro, porque en la solución amortiguadora, la alta concentración del ión común (CH3COO-) presente, disminuye el grado de ionización. En este caso será válido considerar: [H+] = X [CH3COO-] = 1,05 + X = Cs + X [CH3COOH] = 1,05 – X = Ca – X 1,05 Ca = 1,05 f.- Sustituyendo en la expresión obtenida en el punto e: [H ] Ka Ca Cs 1,05 1,8 * 10 5 1,05 [H+] = 1,8 10-5 mol L-1 18 pH = log [H+] = - log (1,8 10-5) pH = 4,74 Observación Cuando una solución reguladora ha sido preparada a partir de cantidades equimoleculares de un ácido débil y de su correspondiente sal, el pH de la solución es el logaritmo negativo de la constante del ácido. Ejercicio 2. ¿Cuál será el pH de una solución reguladora que contiene 0,175 mol de CH3COOH y 20,5 g de CH3COONa en 0,5 L de solución? CH3COONa = 82 g mol-1 a. Se calculan las molaridades del ácido y de la sal: Ca = 0,175 mol / 0,5 L = 0,350 mol L-1 mol de la sal = 20,5 g / 82 g mol-1 = 0,25 mol Cs = 0,25 mol/0,5 L = 0,500 mol L-1 b. Según se dedujo en el problema anterior [H ] Ka [CH 3 COOH] [CH 3 COO ] Ka* Ca Cs c.- Se calculan las concentraciones de las especies iónicas y moleculares presentes en el equilibrio: [H ] X [CH COO ] 0,500 3 X Cs X Cs 0,500mol L 1 [CH COOH] 3 X Ca X Ca 0,350mol L 1 0,350 d.- Se sustituyen los valores: [H+] = 1,8 10-5 0,350/0,500 19 [H+] = 1,26 10-5 mol L-1 pH = - log [H+] = - log (1,26 10-5) = 4,90 pH = 4,90 Observación Los dos problemas precedentes demuestran que el pH de una solución buffer depende de la constante de disociación del ácido débil y de las concentraciones del ácido y de su sal. 2. Sistema regulador base débil y su sal: hidróxido de amonio–cloruro de amonio. Ejercicio 1 ¿Cuál será el pH de una solución buffer que contiene concentraciones molares iguales de NH4OH y NH4Cl? a. El sistema regulador en consideración sería: NH 4 OH NH Cl 4 NH 4 OH NH Cl 4 b. El hidróxido de amonio es un electrolito débil por lo que su Kb debe plantearse con base a su equilibrio de disociación: NH 4 OH Kb NH 4 OH [NH 4 ][OH ] [NH 4 OH] c. El cloruro de amonio es un electrolito fuerte: NH Cl 4 NH 4 Cl Cs = [NH4Cl] = [NH4+] = [Cl-] 20 Por lo tanto en una solución reguladora formada por una base débil y su correspondiente sal, [OH-] [NH4+], debido a que la [NH4+] proviene tanto de la disociación de la base como la de la sal. d. A partir de Kb se despeja la concentración molar de iones hidróxilo: [OH ] Kb* [NH 4 OH] [NH 4 ] e. Se calculan las concentraciones de las especies iónicas y moleculares presentes en el equilibrio como se hizo en el sistema regulador ácido acético – acetato de sodio. Inicialmente Cb Cs NH 4 OH En el equilibrio Donde: Cb – X NH 4 OH Cs + X X Cb = concentración molar de la base Cs = concentración molar de la sal [OH ] Kb Cb X Cs X Kb* Cb Cs Como: Cb = Cs [OH-] = Kb = 1,8 10-5 mol L-1 f. Cálculo del pH. Kw = [H+] [OH-] [H ] Kw [OH ] 1 * 10 14 1,8 * 10 5 [H+] = 0,555 10-9 mol L-1 pH = - log (5,55 10-10) = 9,25 21 3. Mecanismo de acción reguladora. Ejercicio 1. Suponga que dispone de una solución que contiene 0,250 mol L-1 de CH3COOH y 0,250 mol L-1 de CH3COONa. ¿Cuál será la variación de pH si a 0,250 L de esta solución se le agregan 30 mL de HCl 0,10 M? Ka = 1,8 x 10-5 a. Se plantea el sistema regulador: CH 3 COOH CH 3 COO CH COONa 3 H CH COO 3 Na b. Se calcula el pH inicial de la solución: [H ] Ka [CH 3 COOH] [CH 3 COO ] Ka* Ca Cs [H+] = 1,8 10-5 * 0,250 / 0,250 pH inicial = 4,74 c. Se calcula el pH luego de añadir el HCl: mol de HCl añadidos: 0,030 L x 0,10 mol L-1 = 0,0030 mol mol de CH3COOH iniciales: 0,250 L 0,250 mol L-1 = 0,0625 mol mol de CH3COONa iniciales: 0,250 L 0,250 mol L-1 = 0,0625 mol Volumen final = 0,250 L + 0,030 L = 0,280 L. Los 0,0030 mol de HCl reaccionan con 0,0030 mol del anión acetato para formar 0,0030 mol de ácido acético, según la siguiente reacción: Inicialmente 0,0030 HCl 0,0625 CH3COO 0,0625 – 0,0030 0,0625 CH3COOH 0,0625+0,0030 22 La concentración del CH3COO- se verá disminuida en una cantidad (Y= 0,003) y la concentración del ácido aumentada en esa misma cantidad, de tal manera que: Ca Cs (0,0625 (0,0625 0,0030) mol 0,280 L 0,0 655 0,280 0,2 339 molL 1 0,0030) mol 0,280 L 0,0 595 0,280 0,2 125 molL 1 La concentración final de iones hidrógeno será: [H ] Ka Ca Cs 0,2339 [H ] 1,8 * 10 5 0,2125 [H+] = 1,98 10-5 mol L-1 pH = - log (1,98 10-5) pH final = 4,70 c. Cálculo de la variación de pH: pH = pHf – pHi pH = 4,70 – 4,74 = - 0,04 Ejercicio 2 Suponga que a 0,250 L de la solución reguladora del ejercicio 1 le añade 30 mL de NaOH 0,10 M. ¿Cuál será la variación de pH? pH inicial: 4,74 mol inicial de CH3COOH = 0,0625 mol inicial de CH3COONa = 0,0625 b. Cálculo del pH final: mol de NaOH añadidos = mol OH- = 0,030 0,10 = 0,0030 mol. Los 0,0030 mol de OH- añadidos se combinan con 0,0030 mol de ácido acético y forman 0,0030 mol de Ac- 23 Inicialmente 0,0625 0,0030 0,0625 CH3COOH OH CH3COO 0,0625 – 0,0030 Ca Cs H2O 0,0625+0,0030 (0,0625 0,0030) mol 0,280 L 0,0595 0,280 0,2125 molL 1 0,0625 0,0030 mol 0,280 L 0,0655 0,280 0,2339 molL 1 [H ] Ka Ca Cs 0,2125 [H ] 1,8 * 10 5 0,2339 [H+] = 1,63 x 10-5 mol L-1 pH = - log (1,63 10-5) pH final = 4,79 c. Cálculo de la variación de pH: pH = pHf – pHi pH final = 4,79 – 4,74 = 0,05 Problemas propuestos Problema 1. Suponga que dispone de una solución amortiguadora que contiene un mol de NH4Cl y un mol de NH4OH por litro. Kb = 1,8 10-5. a. Calcule el pH de esta disolución. b. Calcule el pH de la misma disolución después de haberle añadido a un litro de ella 10,0 mL de NaOH 1 M. c. Calcule el pH de esta disolución después de añadirle a un litro de ella, 10,0 mL de HCl 1M. d. Calcule el pH de una disolución preparada por adición de 10,0 mL de NaOH 1M a un litro de agua. 24 e. Calcule el pH de una disolución preparada por adición de 10,0 mL de HCl 1 M a un litro de agua. Compare las respuestas, y establezca conclusiones. R: a.: 9,26 b.: 9,26 c.:9,25 d.: 12,0 e.: 2,0 Problema 2. A 100 mL de NH4OH 0,1 M se añaden 5 g de NH4NO3. Se pregunta: a.- ¿Cuál es el pH de la disolución amortiguadora resultante? b.- Si esta solución se diluye a 0,50 L, ¿Cuál es el pH de la disolución reguladora diluída? ¿Por qué? (PM NH4NO3=80 g mol-1) R: a.: 8,46 b.: 8,46 Problema 3. a. Se disuelven 5 g de ácido benzoico en agua hasta completar 0,5 litros. ¿Cuál será el pH de la disolución? (PM C6H5COOH=122 g mol-1) Ka = 6,310-5 b. Si a la disolución anterior se añaden 5 g de benzoato de sodio, ¿Cuál será el pH ahora? ¿A qué se debe la variación del pH? (PM C6H5COONa=144 g mol-1) R: a.: 2,64 b.: 4,13 Problema 4. ¿Cuál es el pH de las siguientes soluciones? (Ka = 1.8 10-5) a. 200 mL de ácido acético 0,124 M más 50 mL de NaOH 0,110 Mc. b. 200 mL de ácido acético 0,124 M más 100 mL de NaOH 0,110 Mc. R: a.: 4,20 b.: 4,65 Problema 5. Demuestre que pOH = pKb en la semineutralización de una base débil (NH 4OH) con un ácido fuerte. 25 Problema 6. ¿Cuál es el pH de una solución formada mezclando 300 mL de solución 0,240 M en NH4OH y 0,120 M en NH4Cl, con 200 mL de HCl 0,150 Mc. (Kb = 1,8 10-5) R: 9,06 Problema 7. Se mezclan 100 mL de solución 0,50 Mc de ácido benzoico con 100 mL de solución 0,20 Mc de KOH. (Ka = 6,3 10-5) a.- ¿Cuál es el pH de la solución resultante? b.- ¿Cuál será la variación de pH si al sistema anterior se le añaden 0,006 moles de NaOH? Asuma que no hay cambio de volumen R: 4,02; 0,22 Problema 8. Se preparó una solución reguladora disolviendo 0,200 mol de ácido propiónico y 0,015 mol de propionato de sodio en agua suficiente para hacer un litro de disolución. (Ka = 1,34 10-5) a. ¿Cuál será el pH de la disolución? b. ¿Cuál será la variación de pH si se añadieran 0,010 milimol de HCl a 10,0 mL de esa solución reguladora? c. ¿Cuál será la variación de pH si a 10,0 mL de la solución reguladora se agregan 1 10-5 mol de NaOH? R: a.: 3,75 b.: - 0,03 c.: +0,03 Problema 9. Calcule la variación de pH que se producirá al agregar 0,01 mol de NaOH a un litro de solución reguladora 0,1000 M de NH4OH y 0,1000 M de NH4Cl (Kb = 1,8 105 ) R: 0,08 26 Problema 10. ¿Cuál será el pH de una solución reguladora que contiene 0,175 moles de ácido acético y 20,5 gramos de acetato de sodio en 0,5 L de solución? ¿Cuál será la variación de pH si al sistema anterior se le agregan 30 mL de HCl 0,1000 M? Ka = 1,8 10-5; CH3COONa = 82 g mol-1 R: 4,90; -0,31 27 PRÁCTICA Nº 3. CÁLCULO DEL pH DE SALES QUE HIDROLIZAN OBJETIVOS: Que el alumno obtenga la destreza necesaria para: Calcular el pH de soluciones acuosas de sales que hidrolizan. Identificar las sales de reacción neutra, ácida y alcalina INTRODUCCIÓN La influencia de una sal sobre el pH del agua depende de qué efecto tengan los iones producidos por la disociación de la sal, sobre el equilibrio iónico del agua. H 2O H OH Kw = [H+] [OH-] = 1 x 10-14 Así los cationes que provienen de bases fuertes no tienen tendencia a asociarse con los iones OH-, ni los aniones que provienen de ácidos fuertes reaccionan con los iones H+. Por ende, el equilibrio iónico del agua en soluciones de sales provenientes de reacciones de neutralización ácido fuerte – base fuerte no es afectado, por lo tanto el pH de esas soluciones será el del agua pura: 7,00 y las sales son llamadas sales neutras. Los cationes que provienen de la reacción de bases débiles con ácidos fuertes si influyen sobre el equilibrio iónico del agua, debido a que dichos cationes reaccionan con algunos iones OH-. Por tal motivo, la [H+] [OH-] y el pH de estas soluciones es ácido. Igualmente, los aniones que provienen de la reacción de ácidos débiles con bases fuertes perturban el equilibrio iónico del agua, al asociarse con parte de los iones H+. Como resultado de esto la [H+] de las soluciones es básico. [OH-] y el pH 28 Ejercicio 1. ¿Cuál es el pH de una solución 0,30 M de KNO3? El KNO3 es una sal que proviene de un ácido fuerte y una base fuerte, por lo tanto ni su catión (K+), ni su anión ( ) tienen tendencia a asociarse con los iones del H2O, es decir no hidroliza. Kw = [H+] [OH-] [H+] = [OH-] 1 x 10 14 [H ] 1 x 10 7 molL 1 pH = 7 Ejercicio 2 Calcule el pH de una solución 0,5 M de acetato de sodio. (Ka = 1,8 10-5) a. El acetato de sodio es un electrolito fuerte que se disocia totalmente: CH COONa 3 CH COO 3 Na Cs= [CH3COONa]= [CH3COO-]=[Na+] b.- El ión acetato proviene de un ácido débil (acético), por consiguiente hidroliza: inicialmente 0,5 CH 3 COO En el equilibrio H 2O 0 0 CH 3 COOH OH X X 0,5 – X Kh [CH 3 COOH][OH ] [CH 3 COO ] [CH 3 COOH] Kh [H ] [OH ]2 [CH 3 COO ] [OH ]2 X Kw Ka Kw [CH 3 COO ] Ka 29 [OH ] Kw * Cs Ka Si se sustituyen los valores correspondientes: 1 * 10 14 * (0,5 1,8 * 10 5 [OH ] X) X = mol L-1 de ión CH3COO- hidrolizado, valor despreciable con relación al aportado por la disociación completa de la sal. 2,80 x 10 10 [OH ] 1,67 x 10 5 molL 1 pOH = 4,78 y pH= 9,22 o bien se calcula la [H+]: [H ] 1*10 14 1,67 *10 5 Kw [OH ] 5,99 *10 10 molL 1 [H+] = 5,99 x 10-10 mol L-1 pH = - log (5,99 x 10-10) pH = 9,22 Ejercicio 3 Calcule el pH de una solución 0,05 M de acetato de sodio. Reacciones que se producen: CH COONa CH COO- Na 3 3 CH 3 COO - H 2 O CH 3 COOH OH - Si se hacen las mismas consideraciones que en el caso anterior se tiene: [OH [OH ] ] Kw * Cs Ka 1 x 10 14 * 5 *10 2 1,8 x 10 5 30 2,78 x 10 11 [OH -] 5,27 x 10 6 molL 1 pOH = 5,28 pH = 14 – pOH = 14 – 5,28 pH= 8,72 Nota: Compare los resultados de los ejercicios 2 y 3. ¿Qué conclusión puede establecer? Ejercicio 4 Calcule el pH de una solución de NH4Cl que contiene 2,675 g de la sal en 200 mL de solución. Kb = 1,8 10-5 PM NH4Cl = 53,5 g mol-1 a. Molaridad de la solución: número de mol de la sal = g . sal PMg . mol número de mol de la sal = 2,675 g 53,5 g . mol 1 1 número de mol de la sal = 0,05 M= nº mol vol 0,05 mol 0,200 L M = Cs = 0,2500 El NH4Cl es un electrolito fuerte que se disocia totalmente: NH Cl 4 NH 4 Cl 31 b. El ión amonio proviene de una base débil, por tanto hidroliza: Inicialmente Cs 0 NH 4 H 2O NH 4 OH Cs –X En el equilibrio X Kh H X [NH 4 OH][H ] [NH 4 ] [NH4OH] = [H+] = X Kh Kw Kb [H ] 2 [NH 4 ] Kw (Cs Kb [H ] X) X = mol L-1 de anión NH4+ hidrolizado, valor muy pequeño con relación a la concentración total de NH4+ aportado por la disociación total del NH4Cl. Entonces: [H ] [H ] Kw Cs Kb 1 * 10 14 0,25 1,8 * 10 5 1,39 * 10 10 [H+] = 1,1810-5 mol L-1 pH = 4,93 32 Problemas propuestos 1.- ¿Cuál es el pH de una solución 0,003 M de KNO3? R: 7,00 2.- Calcule el pH de una solución 0,025 M de NH4Cl.(Kb=1.8 10-5) R: 5,43 3.- Se añade 0,1 mol de NaOH sólido a 1 litro de una solución también 0,1 M de HCN, hasta que el ácido ha sido exactamente neutralizado.¿Cuál es la concentración de iones hidrógeno de la solución resultante? (Ka HCN = 4,9 1010 ) R: 7,0 x 10-12 M 4.- ¿Cuál es el pH de la solución que resulta cuando se mezclan 50 mL de ácido benzóico 0,20 M con 50 mL de NaOH 0,20 M? (Ka = 6,3 10-5) R: 8,60 5.- ¿Cuál es el pH de la solución que resulta de la mezcla de 200 mL de ácido acético 0,124 M con 100 mL de NaOH 0,248 Mc? R: 8,83 6.- Cuando 0,10 moles de NH4OH se neutralizan con 0,10 mol de HCl en 0,50 L de agua, la solución resultante tiene un pH de 4,98. Explique cuantitativamente la razón de esta acidez. Kb = 1,8 10-5 33 PRÁCTICA Nº 4. CÁLCULO DE LA SOLUBILIDAD Y EL Kps DE COMPUESTOS POCOS SOLUBLES. OBJETIVOS Que el alumno obtenga la destreza necesaria para: Calcular la constante del producto de solubilidad (Kps). Calcular la solubilidad de compuestos poco solubles en función del Kps. Determinar cuantitativamente la influencia que tiene la presencia de un ión común en la solubilidad de un compuesto electrolito poco soluble. Relacionar el Kps con la formación de un precipitado. INTRODUCCIÓN La aplicación de la Ley de Acción de Masas a una solución saturada de una sal poco soluble y completamente ionizada da lugar a una constante de mucha importancia en el análisis químico. Por ejemplo, en el caso de una solución saturada de cloruro de plata que se halla en equilibrio con la sal que no se ha disuelto, la pequeña porción de cloruro de plata que se encuentra en solución está completamente ionizada y el equilibrio que se establece con el sólido se puede representar por la ecuación: AgCl (s) Ag Cl - La constante de equilibrio para esta reacción se representa por: Ke [Ag ][Cl ] [AgCl (s) ] Como la actividad de [AgCl(s)] que es un sólido es la unidad, el producto Ke por AgCl(s) es otra constante que recibe el nombre de constante del producto de solubilidad, Kps, en este caso: Kps = [Ag+] [Cl-] 34 Cuando un mol del electrolito origina más de un ión de la misma clase, en la expresión del Kps, la concentración de dicho ión debe figurar con un exponente igual al número de iones formados a partir de una molécula. Por ejemplo: Ca3(PO4)2 3Ca2+ + 2PO43- Kps = [Ca2+]3 [PO43-]2 Al generalizar se establece que en una solución saturada de un electrolito poco soluble, la expresión matemática de la constante del producto de solubilidad Kps, es el producto de las concentraciones molares de los iones elevada cada una de ellas a un exponente que coincide con el número de iones que origina una molécula del compuesto. El Kps varía con la temperatura, puesto que la solubilidad varía con ese factor, por lo cual el valor de esta constante es referido a una temperatura dada, generalmente 25ºC. 1. Cálculo de Kps. Ejercicio 1 La solubilidad del AgCl a 25º C es 0,000193 g/100 mL, calcule su Kps. (PM AgCl = 143,5 g mol-1) a. Se escribe el equilibrio para la solución saturada: AgCl (s) Ag Cl - b. Se escribe la expresión para el Kps: Kps = [Ag+] [Cl-] c. Se calcula la concentración molar de los iones: Solubilidad AgCl = 0,000193 g/100 mL = 0,00193 g L-1 Solubilidad molar = 0,00193 g L-1/143,5 g/mol S = 1,34 10-5 mol L-1 35 Cada mol de AgCl que se disuelve genera un ión Ag+ y un ión Cl- por lo tanto: [Cl-] = [Ag+] = 1,34 10-5 mol L-1 d. Se sustituyen estos valores en la expresión Kps: Kps = (1,34 10-5) (1,34 10-5 ) = 1,8 10-10 Kps = 1,8 10-10 Ejercicio 2 ¿Cuál es el producto de solubilidad del Ag3PO4, si la solubilidad de la sal es 2,010-3 g L-1? No tome en cuenta los efectos de la hidrólisis. (PM Ag3PO4 = 419 g mol-1) a. Ag3PO4(s) b. Kps = [Ag+]3 [PO43-] 3Ag+ + PO43- c. Solubilidad molar = 2,0 * 10 -3 g . L 1 419 g . mol 1 S = 4,810-6 mol L-1 Por cada ión PO43- hay 3 iones Ag+ [Ag+] = 3 4,8 x 10-6 = 1,44 10-5 mol L-1 [PO43-] = 4,8 10-6 mol L-1 d. Al sustituir en la expresión del Kps: Kps = (1,44 10-5)3 (4,8 10-6) Kps = 1,43 10-20 2. Cálculo de la solubilidad a partir del Kps. Ejercicio 3 El Kps del Ag2CrO4 es 1,2 10-12. Calcule la concentración molar de los iones presentes en la solución saturada. a. El equilibrio para la solución saturada es: Ag2CrO4 2Ag+ + CrO42- b. Kps [Ag+]2 [CrO42-] = 1,2 10-12 c. Solubilidad molar del Ag2CrO4 = S mol L-1 [Ag+] = 2 S 36 [CrO4=] = S Al disolver Ag2CrO4 en agua se forman 2Ag+ por cada CrO42d. Al sustituir en la expresión del Kps: Kps = (2S)2 x S = 1,2 10-12 Kps = 4S3 = 1,2 10-12 1,2 x 10 12 4 S3 S 3 1,2 x 10 4 12 6,7 x 10 5 mol. L 1 Ejercicio 4 Si el Kps del Ca(IO3)2 es 6,4 10-9.¿Cuántos miligramos de la sal se disolverán en 500 mL de agua? PM Ca(IO3)2=390 g mol-1 a. Ca(IO3 ) 2 Ca 2 2IO3 - b. Kps = [Ca2] [IO3-]2 c. Solubilidad molar del Ca(IO3)2 = S [Ca2+] = S [IO3-] = 2S d. Kps = S(2S)2 = 4S3 = 6,4 10-9 S3 S 6,4 x 10 9 4 3 6,4 x 10 4 9 S= 1,17 x 10-3 mol L-1 = 1,17 x 10-3 milimol mL-1 e. Cálculo de los miligramos de sal disueltos en un mililitro: 1,17 10-3 mMol mL-1 390 mg/mMol = 0,46 mg/mL Miligramos de sal disueltos en 500 mL 0,46 mg mL-1 500 mL = 230 mg 37 3. Efecto del ión común Ejercicio 5 Calcule la solubilidad en mol L-1 del AgCl, en una disolución 0,0050 M de NaCl. Kps AgCl = 1,8 10-10. Compare el resultado obtenido con la solubilidad de la sal en agua pura. a. AgCl (s) Ag Cl - b. Kps = [Ag+] [Cl-] = 1,8 10-10 c. Concentración de los iones en la solución: [Ag+] = S En el caso del ión Cl- se tienen dos fuentes: S= proveniente del AgCl y 0,005 mol L-1 proveniente del NaCl por lo que: [Cl-] = 0,005 + S Como S es mucho menor que 5 10-3, debido a que el Kps es del orden de 10 -10 se puede depreciar el valor de S. Luego: [Cl-] = 0,0050 moles.L-1 d. Si se sustituye en la expresión del Kps: Kps = S (5 10-3) 1,8 10-10 = S 5 10-3 S 1,8 * 10 -10 5 * 10 -3 = 3,6 10-8 mol L-1 Solubilidad del AgCl en agua pura: 1,34 10-5 mol L-1, en tanto que la solubilidad del AgCl en la solución 5 10-3 M de NaCl = 3,6 x 10-8 mol L-1. Es decir que la solubilidad disminuye aproximadamente 400 veces. Ejercicio 6 Cuál será la solubilidad, en mol L-1 del MgCO3 en una solución 5 10-3 M de Na2CO3 No tome en cuenta los efectos de la hidrólisis. Kps del MgCO3 = 3 x 10-5. a. MgCO3 Mg2+ + CO32- b. Kps = [Mg+2] [CO3-2] = 3 10-5 c.- Concentración de los iones: 38 [Mg2+] = S [CO3-2] = 5 10-3 + S 3 x 10-5 = S. (5 10-3 + S) En este caso no se debe despreciar S frente a 5 10-3 debido a que el Kps del MgCO3 es apenas del orden de 10-5. Por lo tanto, es necesario calcular la solubilidad del MgCO3 por medio de una ecuación de segundo grado. 3 10-5 = 5 10-3S + S2 S2 + (5 10-3) S – 3 10-5 = 0 Solubilidad en Na2CO3 (5 10-3 M) = 3,5 x 10-3 mol L-1 Solubilidad en H2O = 5,47 10-3 mol L-1 NOTA: Si se hubiera despreciado el valor de S frente a 5 x 10 -3 la solubilidad obtenida sería 610-3 mol L-1, cantidad que es apreciablemente mayor que 3,5 10-3. 39 Ejercicio 7 Una porción de 50,0 mL de AgNO3 0,100 M es mezclada con 25,0 mL de una solución de K2CrO4 0,156 M. Calcular: 3.1. La cantidad de Ag2CrO4 que precipita. 3.2. La composición de la solución en el equilibrio. 3.3. El porcentaje de plata que queda en solución. PM Ag2CrO4 = 332 g mol-1 Kps Ag2CrO4 = 1,2 10-12 a. Después de mezclar, pero antes de la reacción, hay presentes en 75,0 mL de solución. mol de AgNO3 = 0,1000 mol L-1 0,05 L = 0,0050 mol Moles de K2CrO4 = 0,156 mol L-1 0,025 L = 0,00390 mol La reacción de formación del Ag2CrO4 es la siguiente: 2 Ag CrO 4 Ag 2 CrO 4(s) Es decir, que se requieren dos iones plata por cada ión cromato. Ahora bien, como hay un exceso de K2CrO4 se puede asumir que la precipitación de Ag+ es completa. mol de Ag2CrO4(s) = ½ (0,0050) = 0,00250 mol Gramos de Ag2CrO4 = 0,00250 mol x 332 g mol-1 La cantidad de Ag2CrO4 que precipitó fue 0,83 g b. Composición de la solución en el equilibrio AgCrO 4 2Ag CrO 4 -2 Kps = [Ag+]2 [CrO4-2] = 1,210-12 Como en la solución hay un exceso de K2CrO4 0,0039 – 0,0025 = 0,0014 mol en 75 mL [K2CrO4] = 0,0187 M en la solución las concentraciones iónicas son: [CrO4-2] = 0,0187 + S 40 [Ag+] = 2S Al sustituir los valores: Kps = 1,210-12 = [2S]2(0,0187 + S) Como S << 0,0187, se puede despreciar, por lo tanto S= 4,010-6 M [Ag+] = 8,010-6 M y por lo tanto: [Ag2CrO4] = 4,010-6 M [CrO4-2] = 0,0187 M [K2CrO4]inicial = 25 x 0,156 / 75 = 0,0520 M [K+] = 2 [K2CrO4] = 20,052 = 0,1040 M [AgNO3]inicial = 500,1 / 75 = 0,0667 M [NO3-] = [AgNO3]inicial = 0,0667 M c. Porcentaje de Plata en solución: [Ag+] = 8,010-6 mol Ag+ en 75 mL = 8,010-6 mol L-10,075 L = 610-7 mol Ag+ g de Ag = 610-6mol108 g mol-1=6,4810-5 g por lo que el % de Ag en peso/volumen será 6,48 x 10 5 g % Ag = x 100 75 mL % Ag = 0,000086 4. Aplicaciones del Kps. Ejercicio 8 El Kps del BaSO4 es 1,110-10. ¿Se formará precipitado al mezclar 10,0 mL de BaCl2 0,010 M con 30,0 mL de Na2SO4 0,0050 M? a. BaSO 4 (s) Ba 2 b. Kps = [Ba2+] [SO4=] SO4 41 c. Cuando [Ba2+] [SO4=] > 1,110-10, precipitará BaSO4 para reducir las concentraciones de los iones a los valores en el equilibrio. d. Concentración molar de los iones Ba2+ y SO4= en la nueva solución: 10,0 mL0,010 M = 0,10 mMol BaCl2 = 0,10 mMol Ba2+ 30,0 mL0,0050 M = 0,15 mMol Na2SO4 = 0,15 mMol SO4= Ahora bien, como el volumen total son 40 mL, las nuevas concentraciones serán: [Ba2+] = 0,10 mMol/ 40 mL = 2,510-3 mol L-1 [SO4=] = 0,15 mMol / 40,0 mL = 3,810-3 mol L-1 e. El producto iónico (PI): PI = (2,510-3) x (3,810-3) = 9,510-6 9,510-6 > 1,110-10 PI > Kps Luego, habrá precipitación de BaSO4 Ejercicio 9 Luego de disolver 5,1 g de AgNO3 y 2,9 g de K2CrO4 en agua suficiente para completar 225 mL de solución, ¿se formará precipitado de Ag2CrO4? ¿Cuál será la [Ag+] y [CrO4=] en la solución final? Kps del Ag2CrO4 es 1,210-12 PMAgNO3 = 170 g mol-1 PMK2CrO4 = 194 g mol-1 a. Ag 2 CrO 4 (s) 2Ag CrO 4 b. Kps = [Ag+]2[CrO4=] c. Concentración de los iones Ag+ y CrO4= [AgNO3 ] 5,1g 170 g . mol 1* 0,225L 0,133 M [Ag+] = 0,133 M [K2 CrO 4 ] 2,9 g 194 g . mol 1 * 0,225 L 0,066 M 42 [CrO4=] = 0,066 M d. [Ag+]2 [CrO4=] = (0,133)2 x 0,066 PI = 0,0180,066 = 1,210-3 1,210-3 > Kps, por lo tanto hay precipitación de Ag2CrO4 e. La solución final será una solución saturada de Ag2CrO4; como tal la concentración de sus iones será: [Ag+] = 1,34 x 10-4 M [CrO4=] = 6,7 x 10-5 M Problemas propuestos: 1. Una solución saturada de BaF2 es 7,510-3 M. ¿Cuál es el producto de solubilidad del BaF2? R: 1,710-6 2. Si 0,1329 mg de AgBr se disuelven en un litro de agua, ¿Cuál es el producto de solubilidad del AgBr? PMAgBr = 188 g mol-1 R: 510-13 3. Una solución saturada de MgF2 es 1,1810-3 M. ¿Cuál es el producto de solubilidad del MgF2? R: 6,610-9 4. En 694 mL de agua se disuelven 0,0017 g de BaSO 4 ¿Cuál es el Kps de BaSO4? PMBaSO4 = 233,40 g mol-1 R: 1,110-10 5. A partir de los valores de Kps y pesos moleculares que se indican, calcular en cada caso la Solubilidad Molar y la Solubilidad en mg/100mL. 43 a. Fe(OH)2 Kps= 4,1 x 10-15 PMFe(OH)2=90 g mol-1 b. Fe(OH)3 Kps= 1,6 x 10-39 PMFe(OH)3=107 g mol-1 c. AgI Kps= 8,3 x 10-17 PMAgI = 235 g mol-1 d. Pb3(PO4)2 Kps= 8,0 x 10-43 PMPb3(PO4)2=811 g mol-1 e. Pb(IO3)2 Kps= 3,0 x 10-13 PMPb(IO3)2= 557 g mol-1 R: a. 110-5 y 910-2 b. 8,7710-11 y 9,3810-7 c. 9,1110-9 y 2,1410-4 d. 1,4910-9 y 1,2110-4 e. 4,2210-5 y 2,35 6. Dado que el Kps del Ioduro Talioso (TlI), es 8,910-8, calcular los gramos de TlI que se disuelven en 1,26 L de agua. PM TlI = 331 g mol-1 R: 0,1243 g 7. Si la concentración de ión bario en una solución es 110-8 M, ¿Se formará precipitado si la concentración de ión sulfato se hace 110-3? Kps BaSO4 = 1,1 x 10-10 R: no hay precipitación. 8. La concentración de ión plata de una solución es 510-4 M. ¿Cuál debe ser la concentración de ión cloruro, para causar la precipitación de AgCl? Kps = 1,81010 R: [Cl-] > 3,6 x 10-7 9. Si el Kps del sulfato de estroncio (SrSO4) es 7,610-7. ¿Cuántos gramos de SrSO4 se disolverán en 2 litros de Sr(NO3)2 0,10 M. PM SrSO4 = 183,7 g mol-1 R: 2,810-3 g 10. Calcular la concentración molar de ión sulfuro necesaria para iniciar la precipitación del sulfuro metálico en las disoluciones siguientes: 44 a. Solución acuosa saturada de AgCl Kps AgCl = 1,8 10-10, Kps Ag2S=3,3*10-52 b. Solución que contiene 50 mg Cd2+/100 mL Cd=112,4 g mol-1, Kps CdS= 7,110-27 R: a. 1,84 10-42 y b. 1,6 10-24 11. Dado que el Kps del MgF2, es 6,610-9, calcular cuántos gramos de MgF2 pueden disolverse en 0,25 L de una solución de Mg(NO3)2 0,1000 M. PM MgF2 = 62 g mol-1 R: 1,98*10-3 g 12. Al mezclar 2 L de SrCl2 0,10 M con 0,25 L de Na2SO4 0,80 M. ¿Cuáles serán las concentraciones de Sr2+ y SO4= en la disolución final? Kps SrSO4= 7,6 10-7 R: 8,7 10-4 M de Sr2+ y 8,7 10-4 M de SO4= 13. A partir del valor del Kps del Ag2CrO4 (1,2 10-12), calcule la solubilidad molar del Ag2CrO4 en solución de K2CrO4, en las concentraciones que se indican a continuación: M K2CrO4 0,002 0,004 0,006 0,008 0,010 S del Ag2CrO4 45 INTRODUCCIÓN AL ANÁLISIS CUANTITATIVO PRÁCTICA Nº 5. MANEJO DE RESULTADOS EN EL ANÁLISIS GRAVIMÉTRICO CÁLCULOS DE HUMEDAD Y MUESTRA SECA OBJETIVOS. Que el alumno obtenga la destreza necesaria para: Emplear el factor gravimétrico en la conversión de una cantidad en peso de una sustancia en otra equivalente. Manejar correctamente unidades de concentración habituales en el análisis cuantitativo (%, mg.kg-1 y milimoles de carga en solución). Convertir los resultados obtenidos al analizar una muestra húmeda en su equivalente en base seca. INTRODUCCIÓN El análisis gravimétrico envuelve la preparación y pesada de una sustancia estable, de composición conocida, que contiene el constituyente que se determina. Está basado en la Ley de las Proporciones Definidas, la cual establece que, “en cualquier compuesto puro, las proporciones en peso de los elementos constituyentes son siempre las mismas”. Esto permite establecer, por estequiometría, las relaciones cuantitativas que se obtienen en el análisis gravimétrico. En el análisis cuantitativo, la aplicación de la estequiometría, medida de las relaciones en peso entre las sustancias reaccionantes y los productos de la reacción, es fundamental y relativamente simple. En este tipo de análisis, la forma química final bajo la cual se determina el analito es, pocas veces, la forma usada para informar sobre el resultado del análisis; de ahí la necesidad de establecer relaciones estequiométricas que permitan convertir el peso de la sustancia determinada en el peso correspondiente de otra sustancia química. Veamos los ejemplos: 46 Ejemplo 1 Se pesan 1,5000 g de una muestra que contiene cloruro, se disuelve en agua y se le añade un ligero exceso de Nitrato de Plata, lo que produce 0,9214 g de AgCl. Se pregunta, ¿Cuál será el peso de ión cloruro presente en la muestra?. Primero, se debe establecer la reacción química base del proceso: Cl - Ag AgCl Segundo, como la reacción está balanceada atómica y molecularmente, sirve de base para efectuar el siguiente cálculo estequiométrico: 35,46 g Cl- + 107,88 g Ag+ = 143,34 g AgCl Es decir, que si en 143,34 g de AgCl hay 35,46 g de Cl -, en 0,9214 g de AgCl habrá una cantidad de Cl- equivalente: 35,46 * 0,9214 143 ,34 0,2279 g de cloruro en la muestra Frecuentemente se expresan los resultados de los análisis como porcentaje del componente analizado presente en la muestra. Para el ejemplo 1, el cálculo es: %Cloruro gdeCloruro * 100 gdeMuestra 0,2279 * 100 1,5000 15,19 % Factor gravimétrico o factor de conversión Si se examinan una serie de análisis gravimétricos clásicos, tales como: determinación de hierro en un mineral, determinación de fósforo en abonos y en rocas fosfatadas, determinación de la pureza de una muestra de piedra caliza, etc., se observa que el constituyente buscado no puede ser pesado directamente, sino que éste se precipita y se pesa combinado con otras especies: Así en el análisis de hierro, éste se pesa como Fe2O3; en el de fósforo como P2O5 y en el de calcio como CaCO3. Por lo tanto, es necesario establecer relaciones estequiométricas para convertir la sustancia pesada en el compuesto o elemento que interesa, para informar el resultado del análisis. Esta conversión se realiza empleando una razón de pesos atómicos o moleculares, derivada de las relaciones estequiométricas de la reacción fundamental. 47 Así en el ejemplo 1, para convertir el peso de AgCl, determinado experimentalmente, en un peso equivalente de cloruro, se multiplicó dicho peso por la relación 35,46/143,34; porque se sabe que 35,46 g de cloruro están combinados con plata para dar 143,34 de cloruro de plata, la relación de pesos atómicos y moleculares planteada: 35,46/143,34 ó Cl-/AgCl se denomina: “Factor Químico”, “Factor Gravimétrico” o “Factor de Conversión” y se define como “el peso de una sustancia que se determina, equivalente a la unidad de peso de una sustancia dada”. Esto significa, en el ejemplo que se utiliza en este momento, a una unidad de peso de cloruro de plata (sustancia dada). El empleo del factor gravimétrico permite calcular, a partir del peso de cualquier elemento o compuesto, la cantidad equivalente del constituyente que se analiza. Si se regresa al ejemplo 1: Cl- / AgCl = 35,46 / 143,36 = F (Factor gravimétrico) g de Cl- = g de AgCl x f = 0,9214 x 0,2474 = 0,2279 El factor gravimétrico se establece colocando siempre el peso atómico o molecular de la sustancia buscada en el numerador y el peso molecular o atómico de la sustancia conocida o pesada en el denominador. Los coeficientes se ajustan de acuerdo a las reacciones que están involucradas en el cambio. Por ejemplo, si se desea determinar el cloruro presente en una solución de FeCl 3, mediante la aplicación del método de precipitación con AgNO3, es necesario establecer el factor gravimétrico y se debe plantear la reacción correspondiente: FeCl 3 3AgNO 3 3AgCl Fe (NO 3 ) 3 El factor vendrá dado por la siguiente expresión: F FeCl 3 3 AgCl Ejemplo 2 El hierro presente en una muestra de FeCO3 se determina por el método gravimétrico. Para ello el hierro contenido en la muestra, una vez disuelta en medio ácido, se oxida al estado férrico y se procede a su precipitación con una solución de amoníaco. Después de calcinado el precipitado se pesa y el resultado se informa como Fe2O3. 48 Reacciones: FeCO 3 2H Fe 2 Fe 2 ½Br 2 Fe3 3NH 4 OH 2Fe(OH) 3 H 2O Fe 3 CO 2 Br - Fe(OH)3 Fe 2 O 3 3NH 4 3H 2 O Estas reacciones permiten establecer las siguientes relaciones: 1 Mol FeCO3 equivale a 1 Mol Fe(OH)3 2 Mol Fe(OH)3 equivale a 1 Mol Fe2O3 equivale a 1 Mol Fe2O3 Por lo tanto: 2 Mol FeCO3 En general, es innecesario considerar los pesos de los productos intermedios en una reacción que tiene lugar por etapas, y solo se tienen en cuenta las sustancias inicial y final. En consecuencia se puede escribir la ecuación hipotética: 2 FeCO3 equivale a 1 Mol de Fe2O3 231,72 g FeCO3 equivale a 159,70 g Fe2O3 En algunos casos ocurre que no figuran átomos comunes en el numerador y en el denominador del factor, debido a que la determinación del analito no se realiza a través de una reacción directa. Por ejemplo: Ejemplo 3 Es posible determinar arsénico mediante su conversión en arseniato de plata, y éste a su vez, por otra reacción química, es convertido en cloruro de plata, que es el compuesto que finalmente se pesa. En este caso el factor gravimétrico para convertir cualquier peso de AgCl que resulte del cambio químico, en arsénico, será: 1 Mol As produce 1 Mol Ag3AsO4 F As 3 AgCl produce 3 Mol AgCl 49 Como se observa, no se han tomado en consideración los compuestos intermedios formados. El único requisito que se debe cumplir es el que establece que el constituyente bajo consideración debe estar relacionado cuantitativamente con el producto final a través de cada una de las etapas que forman el proceso. Por último, en algunos casos, el número de átomos del elemento involucrado en el cambio no es el mismo en el numerador y en el denominador. Ejemplo 4 Observe la siguiente reacción: 2 CuCl CuCl 2 Cu Si se pesa el Cobre producido (Cu) y se quiere convertido en su equivalente CuCl el factor sería: F Cu 2CuCl De lo antes expuesto se concluye que: a. El cálculo del factor gravimétrico está basado en el balanceo molar. b. Siempre, en relaciones matemáticas referentes a cálculos estequimétricos, las fórmulas representan el peso de 1 mol. c. En la expresión del factor gravimétrico, siempre la sustancia pesada o conocida está en el denominador y la sustancia buscada en el numerador. Factor Gravimétrico = aMolBuscado bMolConocido Donde a y b son los coeficientes estequiométricos producto del balanceo molar. En términos generales: g Sustancia Buscada g Sustancia ConocidaX aMol Sustancia Buscada bMol Sustancia Conocida g Sustancia Buscada g Sustancia Conocida * FG 50 Relación de millonésima parte: mg.kg-1 Es una expresión de una concentración relativa muy usada para informar los resultados de microelementos en análisis de suelos, agua, seres vivos, etc. Para el uso de esta expresión se diferencian las unidades cuando se trata de muestras sólidas o líquidas. Así cuando la cantidad de un analito dado que se informa se expresa en mg se tendran dos casos: si la muestra es sólida la concentración se refiere a kilogramos de la muestra, en tanto que para muestras líquidas se refiere a litros. Es posible aca usar cualquier par de unidades que conserven entre si una relación de 1 millón, lo que generaría expresiones equivalentes tales como: g / g ó g / Tn Ejemplo: Se analizó hierro en muestra de suelo y se determinó que contenía 4 mg.kg-1 de Fe. ¿Cuántos kg de suelo se requerirán para obtener 1 kg de hierro? 4 mg de Fe en 1 kg de muestra 410-6 kg de Fe en 1 kg de muestra Es decir, 1 4 *10 6 = 0,25106 = 2,5 x 105 kg de suelo tienen 1 kg de Fe Milimoles de carga en Solución Es otra forma utilizada, a menudo para expresar la concentración de un determinado componente de una solución, en este caso se toma como base el concepto de mol de carga (Molc) la expresión usada es: Molc.L-1. Para obtener esta unidad de concentración se requiere conocer el peso del Mol c del componente que se estudia. Ahora bien, el Molc de una especie química en particular depende de la reacción química en que se encuentre involucrada dicha especie. Para esta unidad se manejan multiplos y submultiplos de acuerdo al sistema internacional de medidas, las mas usadas son el miliMolc (m Molc) y el centiMolc (cMolc) 51 Cálculos referidos a muestra húmeda y muestra seca Para las muestras que pueden ganar o perder humedad con facilidad, como son: materiales biológicos, muestras de suelos, abonos, etc., los análisis generalmente se informan con base a la “muestra seca” lo que permite tener un valor de referencia constante. Para ello tal como se determinó en la práctica correspondiente es necesario conocer el contenido de humedad en la muestra original (% H2O). Ejemplos: 1. Una muestra de cereales contiene 1,96% N y 15% de humedad. ¿Cuál es el % N en la muestra seca? m.h. = muestra húmeda m.s. = muestra seca 1,96 g N 100 g m.h. 15 g H2O (100 – 15) = 85 g m.s. también contienen 1,96 g N, es decir: 100 g m. h. 1,96 g N 85 g m.s. El % N en la muestra seca será: 85 g m.s. 100 g m.s. X= % N(m.s.) = 1,96 g N 1,96 g N X 100 85 % N(m.s.) = 2,31 2. Una muestra de 10 gramos de suelo que contiene 2,0% humedad, produce, al analizarla un precipitado de 0,4800 g de Fe2O3. ¿Cuál es el % Fe en la muestra húmeda y seca? PMFe = 56; PMFe2O3 = 160 52 g.Fe = g.Fe2O3.f = g.Fe2O3 X 0,4800 X 2 Fe Fe 2 O 3 2(56) = 0,4800 x 0,70 = 0,3360 g Fe (m.h.) 160 % Fe (m.h.) = 0,3360 g X 100 = 3,36 % 10 g Ahora bien como la muestra contiene 2% de humedad es possible escribir que: 100 g m.h. 3,36 g Fe (100 – 2) = 98 g m.s. Entonces, el % Fe (m.s.) será: % Fe (m.s.) = 3,36% X 100 = 3,43 % 98 3. Un material orgánico contine 5% P2O5 en la muestra húmeda y 20% P2O5 en la muestra seca. Se pregunta. ¿Cuál es el % de humedad del material? 20 g P2O5 100 g m.s. 5 g P2O5 100 g m.h. Se calcula en cuántos gramos de m.s. están los 5 g P2O5 20 g P2O5 5 g P2O5 100 g m.s. X g de m.s. X = 5 x 100/20 = 25 g m.s. 100g m.h. O sea que 5 g P2O5 están en Luego, el % H2O será: % H2O = 100 – 25 = 75 25g m.s. 53 Problemario de gravimetría 1. Calcule los factores gravimétricos para convertir (Sustancia pesada) (Sustancia buscada) a. BaSO4 H2SO4 b. Mg2P2O7 MgO c. KClO4 K2O d. Fe2O3 Fe3O4 e. P2O5 NaH2PO4 f. NaH2PO4 Ca (H2PO4)2 g. K2O KCl h. MgO Mg(HCO3)2 R: a= 0,42; b= 0,36; c= 0,34; d= 0,97; e= 1,69; f= 0,98; g= 1,59; h= 3,65 2. Calcule los factores gravimétricos para convertir el precipitado (a) en la sustancia analizada (b), siguiendo la secuencia de reacciones involucradas en los correspondientes análisis: Ag 2 CrO 4 NaNO 3 a. AgNO 3 Na 2 CrO 4 (b) Ag 2 CrO 4 HCl AgCl H 2 Cr 2 O 7 NaNO 3 (a) AgBr NaNO 3 b. NaBr AgNO 3 (b) AgBr Cl 2 AgCl Br2 (a) Hg 2 Cl 2 H 3 PO 4 HCl c. H 3 PO 3 HgCl 2 H 2 O (b) (a) R: a: 1,19 b: 0,72 c: 0,17 3. Calcule los factores gravimétricos para convertir: a. Ácido sulfúrico (H2SO4), anhídrido sulfúrico (SO3) y tiosulfato de sodio(Na2S2O3) en azufre (S) R: 0,33; 0,40; 0,41 54 b. Anhídrido fosfórico (P2O5) en: Ortofosfato ácido de calcio (CaHPO4), Ortofosfato diácido de sodio (Na(H2PO4)2), Ortofosfato de calcio (Ca3(PO4)2. R: 1,92; 1,69; 2,18 4. Para determinar el contenido de fósforo en un fertilizante, se analizó una muestra de 20 g por gravimetría y se obtuvo un residuo de Mg2P2O7 que una vez calcinado pesó 6,4000g. Indique: a. Peso de P2O5 en la muestra b. % de P2O5 y % de P PM Mg2P2O7=222,59 g.mol-1; R: a: 4,081; PM P2O5=141,95 g.mol-1 b: 20,41 y 8,91 5. Una muestra de piedra caliza pesa1,2430g y produce 0,0228g de Fe2O3; 1,3101g de CaSO4 y 0,0551 de Mg2P2O7. Exprese estos resultados como porcentaje de: a. Fe b. CaO R: a: 1,28% b. 43,40% 6. c. MgO c. 1,60% Sobre 5 gramos de una roca se preparo un extracto con HCI al 10% completando el volumen a 500 mL. En una alicuota de 100 mL se determinó el magnesio por gravimetria, y se obtuvo un residuo de pirofosfato de magnesio que pesó 20mg. Calcule la composición de la roca en: a) % oxido de magnesio; b) mg.kg-1 de bicarbonato de magnesio; c) mMolc de magnesio en 100g de roca. R: a:0,72 b:26289,3 c:36 7. Una muestra contiene 38,95% de cloruro. Calcule el peso de precipitado de AgCI que se obtiene con 1,0000 g de muestra. R: 1,5745 g 55 8. Para analizar el contenido de hierro en un suelo, 2 gramos de muestra se extraen con HCI completando hasta 500 mL de solucion; 50 mL de ese extracto producen por gravimetria un residuo que después de calcinado pesó 0,0349 de Fe2O3. Exprese el resultado del analisis en: a) mg.kg-1 de Fe y b) mg.kg-1 Fe3(P04)2.8H20. R: a: 122150 b: 364996 9. Cuántos g de sulfato de potasio se pueden obtener a partir de 10 litros de una solucion que contiene 20,0 mg.L-1 de K? K = 39 g.mol-1; K2S04 = 174 g.mol-1 R: 0,4462g 10. Una solucion se prepara por la mezcla de: 100 mL de Na2S04 (142 mg.L-1 Na2S04) 50 mL de K2S04 (30 mMolc de K+.L-1) 20 mL de NaCI (58,5 mg.L-1 NaCI) El volumen es completado a 500 mL con agua destilada. Calcular los mMol c.L-1 de los cationes y aniones presentes en esa solucion. 11. Cuántos mg.L-1de sodio aporta un agua de riego que contiene: 15 mg.L-1 Na2SO4.1OH2O 2,0 mMolc en 1 L solución de Na3PO4 0,30 mMolc Na2CO3 en 25 mL R: 324,14 12. Por cuestiones de calldad se permite un contenido máximo de 5 mg.kg-1 de cloruro en las hojas secas de tabaco. Para analizarlo se preparó un extracto de 100 mL correspondiente a 2 kg de hojas secas. ¿Cuál será el peso máximo de AgCI que deberia formarse a partir de 50 mL del extracto para que la concentraclón de cloruro este dentro del límite permitido? AgCI = 143,34 g.mol-1; Cl = 35,46 g.mol-1 56 R: 20,2 mg 13. Un suelo contiene 16% H2O y 0,02% FeSO4. Calcule el porcentaje y los mg.kg-1 de Fe en la muestra seca. R: 0,0088; 88. 14. SI una roca fosfatada contlene 60% ortofosfato de calcio (Ca 3(PO4)2) y 15% humedad, ¿Cuál es el % P2O5 en la roca seca? R: 32,33 15. Después de secada una muestra tiene 35% P2O5. SI el contenido de agua es 17%, ¿Cuál es el % de P2O5 en la mueatra humeda? R: 29,05 16. ¿Cuántos gramos de MgCI2, de 10% humedad, deben pesarse para preparar 2,5 litros de solución de 10 mg.L-1 Mg? R: 0,1089 g 17. Para preparar 1000 kg de un fertilizante que contenga 8% de NH3 ¿Cuántos kg de sulfato de amonio ((NH4)2SO4) de 10% de humedad deben usarse R: 345,1kg 18. Una muestra de harina que contiene 20% de humedad, después de secarse presenta un contenido de 0,19% de calcio. ¿En que peso de harina húmeda hay 4,282g de CaO? R: 2012,2g 57 PRÁCTICA 6. APLICACIÓN DE CRITERIOS ESTADÍSTICOS AL MANEJO DE DATOS OBTENIDOS EN EL LABORATORIO OBJETIVOS Que el alumno obtenga la destreza necesaria para: Calcular la media aritmetica (X) de una serie de datos. Calcular la desviacion media, absoluta y relativa, y la desviacion estándar como medidas de la precision. Calcular el error, absoluto y relativo, como medida de la exactitud. Aplicar los límites de precision y exactitud aceptados en el analisis químico para enjuiciar los resultados obtenidos en el mismo. INTRODUCCIÓN. El último objetivo de un analisis quimico cuantitativo es determinar la cantidad de una clerta especie presente en la muestra. Si se prescinde de la forma como se logra ese objetivo, es inherente a cada determinacion la medida final de alguna propiedad fisica a partir de la cual se deduce la cantidad de la especie en cuestion. Desafortunadamente, la medida de cualquier cantidad fisica (masa, volumen, etc.) esta sujeta a un grado de incertidumbre y el analista solo puede intentar alcanzar una aproximacion al valor verdadero. Para mayor seguridad, el quimico siempre hace repeticiones de las medidas, de esta manera, demuestra su reproducibilidad y aurnenta la confianza que puedan tener sus resultados. Finalmente, aun cuando es dificil, en la mayoria de los casos es necesario hacer en el trabajo experimental la estimacion de las incertidumbres que afectan a las medidas. En el trabajo que realiza un estudiante en el Laboratorio de Química III, se le provee de muestras homogeneas y de métodos establecidos para su análisis, por consiguiente se espera que obtenga la mejor serie posible de resultados. A pesar de ello, sus datos experimentales podrían presentar serias incertidumbres. 58 Se enfrenta entonces el problema de evaluar dichos resultados y decidir cuales deben ser descartados o incluidos en el informe final. A medida que el estudiante progresa, se encontrará con muestras más complejas y/o con métodos cuya adecuación a la muestra o analito no ha sido totalmente establecida. Esto hace más evidente la necesidad de conocer y manejar la terminología y los métodos estadísticos inherentes a la evaluación de la precisión y la exactitud de los resultados de cualquier trabajo experimental. Cálculo de la Media Aritmética Ahora Bien, para una serie de valores, obtenidos a partir de una misma muestra y en condiciones analíticas idénticas, se considera que el valor con mayor representatividad es la media aritmética. X1 Media aritmética = X X2 ... X n n n Xi X Donde: i 1 n Xi = Valor medido o determinado n = número de observaciones Se debe tener presente que la media sólo representará el mejor valor de la serie cuando los valores provengan de una muestra representativa y sólo estén afectados por errores indeterminados o accidentales. Ejercicio 1 Se desea expresar el resultado final de un análisis de un mineral de hierro, luego de analizar 10 muestras de dicho material se obtuvieron los valores (Xi) que se indican a continuación: % Fe = 50,7; 50,3; 50,4; 50,6; 51,4; 50,4; 49,3; 50,9; 50,5 y 51,7. 59 Tal como se indicó el mejor valor de la serie corresponderá al promedio, por lo tanto: 10 Xi X i 1 10 50 ,6% Fe Ejercicio 2 Para indicar el contenido de cloruro de sodio en un alimento concentrado para animales, se analizaron varias muestras de dicho alimento, los resultados obtenidos fueron los siguientes: Análisis Nº Peso de Muestra NaCl 1 10,000 g 0,2000 g 2 20,000 g 0,4050 g 3 10,000 g 0,2030 g 4 15,000 g 0,3000 g Como los resultados del análisis, peso de NaCl, provienen de diferentes pesos de muestra, antes de calcular la media, hay que llevarlos a una misma base de comparación que puede ser porcentaje. De esta manera se expresan los resultados de cada análisis como % de NaCl. Análisis Nº Muestra NaCl %NaCl 1 10,000 g 0,2000 g 2,00 2 20,000 g 0,4050 g 2,03 3 10,000 g 0,2030 g 2,03 4 15,000 g 0,3000 g 2,00 Si se toma como ejemplo el análisis nº 1 para calcular el % de NaCl se procederá de la siguiente manera: %NaCl = 0,2000 X 100 = 2,000% 10 ,000 Idéntico procedimiento se aplicará a cada uno de los demás análisis los valores de % NaCl, permitirán calcular el resultado de ese análisis: 60 X %NaCl = 2,000 2,03 2,03 2,00 = 2,02 4 R: 2,02 % NaCl Estimación de la precisión La precisión evalúa el grado de concordancia de los valores de una serie de datos entre sí. La desviación media y la desviación estándar son parámetros que permiten concluir acerca de la precisión de una serie de resultados determinados en idénticas condiciones analíticas. La desviación Media Absoluta ( d ): de un conjunto de observaciones es el promedio de las desviaciones individuales, sin considerar el signo que las preceda, es decir se considera el valor absoluto matemáticamente se expresa por: n Xi d donde: Xi X X i 1 n desviación de cada resultado n = número de observaciones Las unidades de la desviación media son las mismas de los resultados para los cuales se calcula. La desviación Media Relativa: se calcula referida a la media (X) de la serie de resultados en consideración generalmente se expresa como porcentaje (%) o partes por mil (‰). d rel d X 61 d rel (%) d rel * 100 d rel (% o) d rel * 1000 d * 100 X d * 1000 X Si la precisión lograda en el análisis es alta, los resultados de la desviación (media o estándar), serán bajos, es decir, los resultados se encuentran agrupados muy cerca de la media aritmética. Ejercicio 3 Se desea calcular d y d% para los resultados de porcentaje de hierro que se indican: 25,1; 25,6; 25,2 y 24,9. Para resolver el problema se deben calcular: la media aritmética ( X ) y las desviaciones individuales ( Xi X ), así: Análisis Nº n= Xi= %Fe2O3 d= Xi X 1 25,1 0,1 2 25,6 0,4 3 25,2 0,0 4 24,9 0,3 4 Xi = 100,8 a. Cálculo de la media aritmética ( X ). 4 Xi X i 1 4 100,8 4 25,2% Fe 2 O 3 R: X = 25,2% Fe2O3 /d/ = 0,8 62 b. Cálculo de la desviación media ( d ). d d 0,8 4 n R: d = 0,2% Fe 2 O3 0,2% Fe2O3 c. Cálculo de la desviación media relativa (d%). d d * 100 X 0,2 * 100 25 ,2 0,79 % Estimación de la exactitud La exactitud de un análisis es estimada en función del error, absoluto y relativo, que se comete en el mismo. En este caso, por lo tanto, la comparación será contra el valor verdadero real ( ). Para obtener cuantitativamente estos parámetros para una serie de datos, es imprescindible conocer el valor real, más probable o verdadero. Error Absoluto: el correspondiente a un resultado individual, viene dado por la expresión: E = valor medido – valor real = Xi Ahora bien, el cálculo de errores individuales es poco usado y se prefiere la comparación del mejor valor de la serie, es decir, el promedio con el valor real, por lo que se usa generalmente la siguiente expresión: E = media aritmética – valor real = X Error relativo: representa la relación entre el valor absoluto y el valor real, generalmente se expresa como porcentaje (%) o partes por mil (‰). Las expresiones de cálculo serían las siguientes: E rel E 63 Erel (%) Erel (% o) Erel *100 Erel *1000 E E *100 *1000 Ejercicio 4 Calcule la exactitud del análisis del ejercicio anterior ( X = 25,2% Fe2O3), si el valor real es de 25,6% Fe2O3. E= X - = 25,2% Fe2O3 – 25,6% Fe2O3 = - 0,4% Fe2O3 R: E = -0,4% Fe2O3 Erel (%) E *100 0,4 *100 25,6 1,6% R: E% = -1,6% Si, X el error tiene signo negativo. Es decir se cometen errores por defecto. Si, X el error tiene signo positivo. Es decir se cometen errores por exceso. El cálculo del error relativo tiene gran importancia al comparar el error cometido en medidas de magnitudes apreciablemente diferentes. Limites de precisión y exactitud aceptados en el análisis químico La exactitud y precisión alcanzadas en un análisis dependen esencialmente del método y del acceso a materiales y reactivos de alta calidad. Generalmente la simplicidad y rapidez en el análisis químico no son compatibles con la más alta precisión. En cuanto a la naturaleza de la muestra, la mayoría de las sustancias puras no ofrecen dificultades al análisis y se prestan para obtener una elevada exactitud, en cambio es de esperar mayores errores al analizar materiales naturales o artificiales cuya composición es compleja. 64 Otro factor que influye en la exactitud es la proporción en que se encuentra el constituyente que se analiza. En atención a esto, es difícil establecer límites precisos de exactitud, sin embargo, puede decirse que es permisible: Contenido del constituyente Exactitud Aceptada 10% ó mayor 0,1 – 1,0% 0,1% -10% 0,01 – 0,1% 0,01% - 0,1% 0,001 – 0,01% Para concentraciones pequeñas, es decir menores de 0,01%, no se pueden usar métodos gravimétricos (sensibilidad de la balanza analítica 0,0001g. En estos casos se aplican métodos colorimétricos o volumétricos. En cuanto a los límites de precisión, si la proporción del constituyente no es muy pequeña, la desviación en el análisis no debe ser mayor de tres partes por mil (3‰). Indudablemente, si las repeticiones para una muestra generan diferencias considerables, no puede confiarse en el resultado, deben hacerse nuevos análisis hasta obtener una precisión satisfactoria. Si dos o más resultados concuerdan perfectamente, de ningún modo se justifica la conclusión de que el valor obtenido es correcto. Buena concordancia significa simplemente que los errores accidentales o las variaciones en los errores determinados de todas las determinaciones son los mismos. Puede haber, no obstante, un error muy grande asociado al resultado. Cuando no hay concordancia se evidencia que se han cometido errores operativos o equivocaciones. Problemas propuestos 1. En las determinaciones repetidas del contenido de Cloruro (expresado en porcentaje) en una muestra se obtuvieron los resultados siguientes; 59,83; 60, 45; 59,88; 60,24; 60,28 y 59,77. Calcule la media aritmética ( X ), la desviación media ( d ) y la desviación relativa en %. R: 60,08; 0,25 y 0,42 65 2. Si en la muestra del problema anterior el % real de cloruro es 60,68, calcule los errores absoluto y relativo ( en %) R: - 0,58; 0,96% 3. En el análisis gravimétrico de un mineral se obtienen los siguientes resultados: Análisis Nº Gramos muestra Gramos Fe2O3 1 1,0000 0,2000 g 2 2,0000 0,4050 g 3 1,0000 0,2030 g 4 1,5000 0,3000 g Calcule: a. La precisión b. La exactitud, si en la muestra el % real de h Fe2O3 es 21,02 R: 0,70% - 4,19% 4. En el análisis de una calcita, se obtienen los siguientes resultados del % CaO; 20,03; 20,74; 20,75; 20,65. Calcule la desviación media ( d ) y el error relativo en %, si el valor real es 21,00% CaO. R: 0,26; - 2,19% 5. A partir de los datos que abajo se señalan, calcule para cada análisis la media y el error relativo en %. Análisis A: %S encontrados: 15,15; 15,00; 15,27; 15,21; 15,30 Valor real= 15,25% S Análisis B; %SO3 encontrados: 30,44; 30,30; 30,60; 30,37 Valor real= 30,60% SO3 R: Análisis A: 15,19; -0,39% Análisis B: 30,43; -0,56% 66 6. En un análisis gravimétrico se obtuvieron en las repeticiones de una muestra los siguientes resultados: 0,660; 0,630; 0,680; 0,670 gramos AgCl a partir de 1,000 gramos de muestra. Calcule el valor real ( ) si E% fue igual a – 2,95. R: 0,68 g 7. Un analista encontró valores de 39,17; 39,99; 39,21 y 38,22 por ciento para el contenido de hierro en una muestra de mineral. Si el % real de hierro es 39,33, calcule el error absoluto y el relativo en partes por mil. R: -0,15; -3,82 8. Un técnico encontró, en mediciones repetidas de la molaridad de una solución, los siguientes valores; 0,0971; 0,0968; 0,0976 y 0,0984. Exprese correctamente el valor de la molaridad. R: 0,0975 0,0005 M, n= 4 9. Se analizó el contenido de NaCl en una muestra mediante el uso de dos métodos diferentes, los resultados obtenidos fueron los siguientes: Método “A” Método “B” g muestra g NaCl g muestra g NaCl 1,0000 0,130 2,0000 0,280 2,0000 0,208 4,0000 0,570 1,0000 0,120 2,0000 0,290 Si el valor real es 11,75% NaCl, examine los dos métodos mediante la aplicación de los criterios sobre límites de precisión y exactitud aceptados en el análisis químico y seleccione el método más adecuado para este caso. R: Ninguno de los dos métodos es adecuado. 67 ANÁLISIS VOLUMÉTRICO PRÁCTICA Nº 7. MEZCLAS ALCALINAS OBJETIVOS Que el alumno obtenga la destreza necesaria para : Interpretar los resultados de una valoración de ácidos o bases. Interpretar los resultados del análisis de una mezcla alcalina, mediante el uso de dos indicadores, para establecer su composición cualitativa y cuantitativa. INTRODUCCIÓN Una vez completado el proceso de ejecución de un análisis volumétrico, se requiere realizar los cálculos necesarios para interpretar dicho análisis, se debe tener claro que en el punto de equivalencia: mMolesc de sustancia valorante= mMolesc sustancia valorada En el caso de una volumetría de neutralización Nº mMolesc ácido = Nº mMolesc Base Un manejo eficiente de esta relación, requiere la revisión de algunos conceptos importantes. Por lo que es conveniente hacer las siguientes consideraciones: 1. Manejo del concepto de milimolc. a. Relación entre Molaridad de carga, Volumen y milimolc. Una de las formas más adecuada de expresar la concentración de las soluciones en el análisis volumétrico es mediante la Molaridad de carga (Mc). Una solución uno Mc contiene un molc-gramo de soluto por litro de solución o un milimolc-gramo por mililitro de solución. Se deduce de esto que el producto del número de mililitros de una solución y la molaridad de carga de la misma debe dar el número de milimolesc. V Mc = Nº de milimolesc 68 Esta sencilla expresión es el fundamento de la mayoría de los cálculos en que intervienen relaciones de volúmenes entre soluciones. b. Relación entre el volumen y la molaridadc de soluciones reaccionantes. Como un mMolc de un ácido se neutraliza exactamente con un mMolc de una base, y dado que el número de mmolc en cada caso se halla mediante la multiplicación del volumen, en mililitros, de solución por su Mc, se puede establecer una relación sencilla entre las dos soluciones reaccionantes en el punto de equivalencia. Nº mmolc A = Nº mmolc B Nº mMolc = V Mc VA MCA = VB MCB De aquí se deduce la Mc de una solución, mediante la determinación del volumen que reacciona exactamente con un volumen dado de otra solución de M c conocida. Las molaridades de carga de dos soluciones guardan una relación inversa con sus respectivos volúmenes. Ejemplo. ¿Cuál es la Mc de una solución de H2SO4, si se requieren 27,8 mL de ácido para neutralizar 25,0 mL de un álcali 0,4820 Mc? a. En el punto de equivalencia: Nº mmolc H2SO4 = Nº mmolc álcali V1 Mc1 = V2 Mc2 27,8 mL Mc1 = 25,0 mL 0,4820 Mc b. Mc1 = 25,0 mL* 0,4820 M c 27,8 mL Mc = 0,4335 c. Conversión de datos a milimolesc Al resolver problemas de Química Analítica se comprobará la gran utilidad que tiene convertir desde un primer momento las cantidades de las sustancias 69 reaccionantes en los milimoles de carga correspondientes. Los procedimientos siguientes son de aplicación general: 1. Si se tiene una solución “S” de Mc conocida: V Mc = Nº de molesc de soluto. Ejemplo. ¿Cuántos mmolesc hay en 100 mL de una solución de NaOH 0,1 Mc? V Mc = Nº de mmolesc de NaOH = mmolesc Na+ = mmolc OH100mL0,1=10 mmolc de NaOH=10 mmolc Na+ = 10 mmolcOH-. Si se conoce el peso del sólido Nº mmolc=g/(g/mmolc) ó Nº mmolc =mg/(mg/mmolc) Ejemplo. ¿Cuántos mmolc hay en 40 g de NaOH? g/Molc = 40; g/ mmolc = 0,040 mg/mmolc = 40 40 g /0,040 g.mmolc-1 = 1000 mmolc NaOH ó también: 40.000 mg / 40 mg.mmolc-1 = 1000 mmolc 2. Si se tiene una solución “S” de peso específico o densidad (d) y composición porcentual (%) conocidas: Ejemplo. ¿Cuántos mmolc hay en 5 mL de solución de HCl de 37,23% de pureza y 1,19 g/mL de densidad? V= 5 mL g/molc = 36,5 d = 1,19 g/mL g/mmolc = 0,0365 % = 37,23 mg/ mmolc = 36,5 a. V d = m 5 mL1,19 g.mL-1 = 5,95g de solución HCl b. g x % de pureza/100 = g puros 5,95 37,23/100 = 2,22 g HCl puros c. Nº de mmolc = 2,22 g/0,0365 g.mmolc-1 = 60,8 mMolc de HCl o bien: Nº de mmolc = 2220 mg/36,5 mg. mmolc-1 = 60,8 mmolc de HCl 70 d. Determinación de la molaridadc de una solución. La molaridadc se puede determinar de diversas maneras: 1. En una solución estándar primaria se determina a partir del peso del soluto y del volumen en el cual ese soluto está disuelto. Ejemplo. Calcular la Mc de una solución preparada, al disolver 10,6 g de Na 2CO3 en agua destilada hasta completar 100 mL. g.Molc-1 Na2CO3 = 53; g. mmolc-1 Na2CO3 = 0,053 mg.mmolc-1 = 53 Nº mmolc = 10,6 g/ 0,053 g.mmolc-1 = 200 mmolc en 100 mL = 200 mMolc/100 mL solución o bien: Nº mMolc = 10.600 = 200 mmolc/100 mL solución 53mg/mMol c V Mc = Nº mmolc Mc = 200 mmolc/ 100 mL = 2,00 mmolc/mL Mc = 2,00 2. En soluciones de concentación aproximada se puede determinar: a. A partir del volumen exacto de solución de concentración aproximada, requerido para que reaccione con un peso conocido de sustancia tipo (valoración primaria). Ejemplo. Una muestra de ácido oxálico puro (H2C2O4.2H2O) que pesó 0,2000g, requiere 30,12 mL de KOH para su completa neutralización. ¿Cuál es la molaridad de carga del KOH? Molc-g del H2C2O4.2H2O = Mol/2 = 63,00gmolc-1 Nº de mmolc = g/ g-mmolc = mg / mg-mmolc Nº de mmolc = V Mc En el punto de equivalencia: mmolc H2C2O4.2H2O = mmolc KOH, 3,17 = VMc es decir que: McKOH = 3,17 mmol/ 30,12 mL McKOH = 0,1054 71 b. A partir del volumen exacto de solución de concentración aproximada requerido para que reaccione con un volumen exactamente conocido de solución estándar (valoración secundaria). Ejemplo. ¿Cuál es la molaridadc de una solución de HCl, si se requieren 25,8 mL de ácido para neutralizar 24,0 mL de un álcali 0,4750 Mc? V Mc = V1 Mc1 25,8 mL Mc = 24,0 ml 0,4750 mMolc.mL-1 Mc = 24,0 0,4750 / 25,8 = 0,4419 Cálculos aplicados a los métodos volumétricos. Los métodos volumétricos (valorimétricos) se clasifican, generalmente, de acuerdo al tipo de reacción que ocurre entre el componente buscado y la solución estándar, en: Métodos volumétricos de neutralización. Métodos volumétricos de precipitación. Métodos volumétricos de formación de complejos. Métodos volumétricos de oxidación–reducción (redox). En esta práctica se discuten los cálculos aplicados a los métodos volumétricos de neutralización. La reacción entre un ácido (donador de protones) y una base (aceptor de protones) se denomina neutralización. Entre los principales métodos que se fundamentan en este tipo de reacción se cuentan: I. Valoración de un ácido o una base: la reacción fundamental en estas volumetrías puede escribirse así: H OH - H 2O Ejemplo. ¿Cuál es la molaridadc de una solución de ácido fórmico, si una alícuota de 25,00 mL de ese ácido requiere para su completa neutralización 12,00 mL de solución 0,2000 Mc de NaOH? 72 a. En el punto de equivalencia: NaOH H 2 O HCOO - Na HCOOH H OH - H 2O Nº mmolc HCOOH = Nº mmolc NaOH V1 Mc1 = V2 Mc2 b. Si se sustituyen los valores en la igualdad anterior: 25 mL Mc = 12 mL 0,20 mmolc.mL-1 c. Cálculo de la Mc del ácido: 2,4 mmolc/ 25,00 mL = 0,0960 = Mc (HCOOH) II. Valoración de mezclas alcalinas: en las mezclas compatibles de NaOH, NaHCO3 y Na2CO3, los constituyentes presentes pueden determinarse (cualitativa y cuantitativamente) por valoraciones que implican el uso de dos indicadores, generalmente fenolftaleína y anaranjado de metilo, los principios de partida vienen dados por las posibles reacciones producidas cuando se valoran soluciones alcalinas con una solución estándar ácida, las cuales son los siguientes: Pto. Equivalencia Hidróxidos: H OH - Carbonatos: CO 3 Bicarbonatos: HCO 3 H 2O H HCO 3 H pH= 7 - pH = 8,3 H 2 CO 3 Intervalo de viraje de los indicadores usados: Fenolftaleina Anaranjado de Metilo pH 9 incolora pH 9 rosa violeta pH 4 rojo pH 4 amarillo pH = 3 73 Las mezclas alcalinas compatibles en solución son: OH- + CO3= (Por ejemplo: NaOH + Na2CO3) HCO3¯ + CO3= (Por ejemplo: Na2CO3 + NaHCO3) Se debe tener presente que estas sustancias pueden también existir aisladas y en cualquier caso, con ellas pueden coexistir sustancias inertes. Se pregunta: ¿Por qué en solución acuosa no coexiste la mezcla de NaOH y NaHCO3? 1. Composición cualitativa de una mezcla alcalina: Con los resultados de la valoración con dos indicadores es posible determinar la composición cualitativa de una mezcla alcalina, para ello se comparan los milimoles de carga de ácido correspondientes a las titulaciones en presencia de fenolftalína y en presencia de anaranjado de metilo. Si se llama mmolc AF a los mmolesc de H+ gastados en presencia de fenolftaleína y m molc AM a los mmolesc de H+ gastados en presencia anaranjado de metilo, cuando la valoración se efectúa en una sola alícuota, se pueden deducir las mezclas presentes en una muestra. Esto es posible si se toma en cuenta que: En presencia del indicador fenolftaleína se titulan: OH- y ½ CO3= H OH - CO 3 H 2O H HCO 3 (es decir ½ de los CO=3 presentes) En presencia de anaranjado de metilo se titulan: ½ CO3= y HCO3- HCO 3 H H 2 CO 3 H 2 O CO 2 74 Esto permite construir el siguiente cuadro para la toma de las decisiones: Relación entre mmolc AF y mmolc AM Componentes presentes mmolc AF > m molc AM OH- y CO3= mmolc AF < mmolc AM CO3= y HCO3¯ mmolc AF = N y mmolc AM = 0 OH- mmolc AF = 0 y mmolc AM = N HCO3¯ mmolc AF = mmolc AM CO3= Ejemplo. Para analizar los constituyentes alcalinos en cierta agua de riego, se titularon 50 mL de muestra. Se gastaron 5,0 mL de HCl 0,1200 Mc en presencia de fenolftaleína y 10,0 mL de HCl 0,2400 Mc en presencia de anaranjado de metilo. Se pregunta: ¿Cuáles son los componentes de la mezcla alcalina? Cálculo de mmolc HCl correspondiente a cada indicador Nº mmolc AF = VAF Mc = 5,0 0,1200 = 0,60 mmolc Nº mmolc AM = VAM Mc = 10,0 0,2400 = 2,40 mmolc Análisis cualitativo de la mezcla: Como mmolc AF < mmol AM los constituyentes son: CO3= y HCO3¯ Mezcla de hidróxido y carbonato. Ejemplo. Una muestra contiene Na2CO3, NaOH e impurezas inertes. Se pesan 1,200 g de dicha muestra y se requieren 30,00 mL de solución 0,5000 Mc de HCl para alcanzar el punto final en presencia de fenolftaleína (V AF) y 5,00 mL adicionales del mismo ácido para hacer virar el anaranjado de metilo (VAM). ¿Cuáles son los porcentajes de Na2CO3 y NaOH? a. Titulación en presencia de fenolftaleína: el ácido agregado neutraliza las bases fuertes, según las siguientes reacciones: H OH- H 2O pH = 7.0 75 y el carbonato pasa a bicarbonato (semivaloración) según: CO 3 H HCO 3 - pH = 8.3 En este momento la fenolftaleína vira de rosa a incolora y se han añadido 30,00 mL de ácido (VAF). En este caso: VAF Mc = mmolc OH- + ½ mmolc CO3= Al sustituir los valores obtenidos: VAFMc = 30,000,5000 = 15,00 = mmolc OH- + ½ mmolc CO3= b. Titulación en presencia de anaranjado: HCO 3 H H CO 2 3 H O CO 2 2 pH = 3.0 Al continuar la valoración se gastan 5,00 mL de ácido para hacer virar el indicador, (recordar que a pH < 4,0 el anaranjado de metilo es rojo), con lo cual se completa la neutralización. Por consiguiente, en este caso: VAMMc = ½ mmolc CO3= Al sustituir los valores: 5,00 x 0,5000 = 2,50 = ½ mmolc CO3= c. Cálculo del número de mmolesc que corresponde a cada componente de la mezcla alcalina analizada: Según lo calculado en (a) y (b): mmolc OH- + ½ mmolc CO3= = VAFMc = 15,00 ½ mmolc CO3= = VAMMc = 2,50 Luego mmolc CO=3 en la muestra = 22,50 = 5,00 mmolc OH- en la muestra = 15,00 – 2,50 = 12,50 d. Cálculo de los porcentajes: % NaOH Nº mmolc OH- = Nº mmolc NaOH g/ mmolc NaOH = 0,040 Nº mmolc NaOH = 12,5 g NaOH = Nº mmolc NaOH g/ mmolc de NaOH g NaOH = 12,5 0,040 = 0,5000 76 % NaOH = 0,5000g 1,2000g * 100 41,67 % Na2CO3 Nº mmolc CO3= = Nº mmolc Na2CO3 g/mmolc Na2CO3 = 0,053 Nº m molc Na2CO3 = 5,00 g Na2CO3 = Nº m molc Na2CO3 g/mmolc de Na2CO3 g Na2CO3 = 5,00 0,053 = 0,2650 % Na2CO3 = 0,2650g 1,2000g * 100 22,08 Mezcla de carbonato y bicarbonato. Ejemplo. Una muestra contiene Na2CO3 y NaHCO3 e impurezas inertes. Se pesan 1,1000 g de dicha muestra, se disuelven y se valoran. Se gastan 26,40 mL de solución 0,2500 Mc de HCl para alcanzar el punto final en presencia de fenolftaleína (V AF) y 40,70 mL adicionales para hacer virar el anaranjado de metilo (VAM). ¿Cuáles son los porcentajes de Na2CO3 y NaHCO3? a. Titulación en presencia de fenolftaleína. El volumen de ácido agregado para hacer virar la fenolftaleína corresponde a la conversión del carbonato en bicarbonato, es decir, a su semineutralización: CO 3 H HCO 3 - pH = 8,3 En este punto se han añadido 26,40 mililitros (VAF). En este caso: VAF Mc = ½ mmolc CO3= La sustitución de los valores lleva: VAF Mc = 26,40 0,2500 = 6,60 = ½ mmolesc CO3= b.- Titulación en presencia de anaranjado. Se continuó la valoración y se gastaron 40,70 mL (VAM) con lo cual se completó la neutralización del carbonato y se valoró el bicarbonato: HCO 3 H H CO 2 3 pH = 3.0 77 En este caso: VAM Mc = ½ mmolc CO3= + mmolc HCO3¯ Al sustituir: VAM Mc = 40,70 0,2500 = 10,18 = ½ mmolc CO3= + mmolc HCO3¯ c. Cálculo del número de mmolc presentes en la muestra analizada: Según lo calculado en (a) y (b): VAF Mc = ½ mmolc CO3- = 6,60 VAM Mc = ½ mmolc CO3= + mmolc HCO3¯= 10,18 Luego: mmolc CO3= en la muestra = 2 x 6,60 = 13,20 mmolc HCO3¯ en la muestra = 10,18 – 6,60 = 3,58 d. Cálculo de los porcentajes: % Na2CO3 Nº mmolc CO3= = Nº mmolcNa2CO3 g.mmolc-1 de Na2CO3 = 0,053 Nº mmolcNa2CO3 = 13,20 gNa2CO3 = mmolc Na2CO3g.mmolc-1 Na2CO3 = 13,200,053 = 0,6996 g % Na2CO3 = 0,6996g 1,1000g * 100 63,60 % NaHCO3 Nº mmolc HCO3- = Nº mmolc NaHCO3 g.mmolc-1 de NaHCO3 = 0,084 Nº mmolc NaHCO3 = 3,58 gNaHCO3 = mmolc NaHCO3 g mmolc NaHCO3 = 3,58 0,084 = 0,3007 g % NaHCO3 = 0,3007 g * 100 1,1000 g 27 ,34 78 Problemas Propuestos 1. ¿Cuál es la molaridadc de una solución alcalina preparada disolviendo en agua 6,73 g de NaOH de 99,5% de pureza y 9,42 g de Ba(OH)2.8H2O puro, el volumen final fue de 850 mL? PM NaOH = 40 g.mol-1; PM Ba(OH)2.82O = 315,5 g.mol-1 R: 0,267 Mc 2. ¿Cuál será la molaridad de carga aproximada de una solución ácida preparada por mezcla de las siguientes (A + B + C) soluciones de ácido sulfúrico? A: 160 mL de solución 0,3050 Mc B: 300 mL de solución 0,4163 M C: 250 mL de solución cuyo peso específico es 1,12 g/mL y su concentración 17% (p/p). PM H2SO4 = 98 g.mol-1 R: 1,79 Mc 3. ¿Qué volumen de agua hay que añadir a 760 mL de Ba(OH) 2 0,2500 M para preparar una solución 0,1000 Mc? R: 3040 mL 4.. ¿Cuántos gramos de Ba(OH)2.8H2O son necesarios para preparar 400 mL de solución 0,0833 Mc? ¿Cuántos moles/litro y cuántos molc-gramo/litro contiente esta última solución? PM Ba(OH)2 = 171, 5 g.mol-1 PM Ba(OH)2.8H2O= 315,5 g.mol-1 R: 5,26 g; 0,0417 mol/L y 0,0833 Mc – g/L 5. Una muestra de 4,0000 g ftalato ácido de potasio (KHC3H4O4) es equivalente a 48,37 mL de una solución de NaOH. ¿Cuál es la molaridad de carga del hidróxido de sodio? PM KHC8H4O4 = 204,2 g.mol-1 R: 0,4050 79 6.- ¿Cuántos mililitros de H2SO4 0,300 Mc se requieren para: Neutralizar 30 mL de KOH 0,500 Mc Neutralizar 300 mL de Mg(OH)2 0,025 M Neutralizar 20 mL de una solución que contiene 10,02 g de KHCO 3 por 100 mL (PM KHCO3 = 100 g.mol-1) R: 50,0 mL; 50,0 mL; 66,8 mL 7.- Se prepara una solución ácida mediante la disolución de 10,0000 g de H2C2O4.2H2O impuro en agua, a 800,0 mL; si 50,0 mL de esa solución requieren para su neutralización completa 35,0 mL de KOH 0,1000 Mc. ¿Cuál es el % de ácido oxálico en la muestra? PM H2C2O4.2H2O = 126 g.mol-1 R: 35,28% 8. Se pesan 1,500 g de una muestra que contiene 45% de una base XOH, cuyo Molc–g = 40 se disuelven en agua hasta un volumen de 100 mL. Si posteriormente se valoran 25,0 mL de esta solución con HCl 0,2000 Mc. ¿Cuál será el volumen de ácido consumido en dicha valoración? R: 21,1 mL 9.- Se añaden 50,0 mL de una solución 1,0870 Mc de HCl a 28,0 mL de una solución alcalina y se sobrepasa el punto de neutralización. Si para hacer que la solución sea exactamente neutra es necesario agregarle ahora 10,0 mL de un álcali 0,1021 Mc se pregunta. ¿Cuántos mmolc de base contenía la solución original y cuál sería su Mc? R: 53,33 mmolc; 1,9046 Mc 10.- ¿Cuál es el peso máximo de ácido oxálico dihidratado puro que debe tomarse para que al valorarlo con un álcali 0,1050 Mc no sea necesario volver a llenar la bureta de 50 mL? PM C2H2O42H2O = 126 g.mol-1 R: 0,3308 g 80 11.- Un agua de riego contiene 20 mmolc.L-1 de NaOH y 30 mmolc.L-1 de Na2CO3. ¿Qué volumen de HCl 0,1000 Mc se necesita para titular una alícuota de 50 mL de dicha agua cuando se usa: a) fenolftaleína como indicador y b) anaranjado de metilo? R: 17,5 mL; 7,5 mL 12.- Una solución contiene 38,0000 g de NaOH y 2,0000 g de Na 2CO3 por litro. Se pregunta: a. ¿Cuál es la Mc de la solución? b. ¿Cuál es su Mc efectiva en una valoración en frío en la que se emplea fenolftaleína? R: a. 0,9877 Mc; b. 0,9689 Mc 13.- ¿Qué volumen de HCl 0,2000 Mc será necesario para neutralizar 1,0000 g de muestra que contiene 40% de NaHCO3 y 30% de Na2CO3, en presencia de los indicadores: Fenolftaleína y b) Anaranjado de metilo. R: a: 14,15 mL; b: 37,95 mL 14. Una muestra contiene como componentes activos NaOH, Na2CO3, NaHCO3 o mezclas compatibles de estos compuestos. Se disuelve en agua una porción que pesa 1,0000 g y al valorarla con HCI 1,0380 Mc se gastan 17,96 mL en presencia de fenolftaleina y 3,21 mL del mismo ácido en presencia de anaranjado de metilo. Determine: a. ¿Qué álcalis están presentes? b. ¿Cuál es el % de cada uno en la muestra original? PM NaOH = 40 g.mol-1; R: OH-/CO3=; PM Na2CO3 = 106 g.mol-1 61,24% NaOH; 35,31% Na2CO3 81 15. Para determinar mezclas alcalinas en un agua de riego, se titularon 50,0 mL de agua con HCI 0,1200 M y se gastaron 5,0 mL del ácido en presencia de fenolftaleina y 20 mL en presencia de anaranjado de metilo. Se pregunta: a. ¿Qué álcalis estan presentes? b. mmolesc/50 mL de agua de riego de los álcalis presentes c. mg L-1 de los álcalis presentes, expresados como sales sódicas. PM Na2CO3 = 106 g.mol-1; R: PM NaHCO3 = 84 g.mol-1 a: CO3= /HC03-; b: 1,2 mmolesc CO3=/50 mL ; 1,8 mmolesc HCO3-/50 mL; c: 1272 mg L-1 Na2CO3; 3024 mg L-1 NaHCO3 16. Se sabe que una muestra contiene NaOH, NaHCO 3, Na2CO3 o mezclas compatibles de estas sustancias con materia inerte. Al neutralizar 1,2000 g de este material se requieren 5,90 mL de HCI 0,5000 Mc al utilizar fenolftaleina como indicador y 22,56 mL del mismo ácido al usar anaranjado de metilo. Calcule el % de impurezas inertes en la muestra. R: 15,63%. 82 PRÁCTICA No 8. CÁLCULOS RELACIONADOS CON LA QUELOMETRÍA OBJETIVOS Que el alumno obtenga la destreza necesaria para: Interpretar un análisis quelométrico con el uso de EDTA como agente valorante. Aplicar el concepto de milimol. Expresar los resultados del analisis quelométrico INTRODUCCIÓN Los métodos volumétricos por formación de complejos se fundamentan en el uso de una reacción química en la cual, el constituyente que se determina forma un ión complejo soluble con involucre la formación de un un reactivo adecuado. No toda reacción que ión complejo puede ser utilizada en el análisis químico; para ello la reacción debe llenar algunos requisitos, a saber: Que sea una reacción definida. Que la reacción proceda cuantitativamente. Que sea rápida y Que permita el uso de un indicador para poner de manifiesto en forma nítida el punto final de la reacción. Las determinaciones analíticas basadas en la formación de complejos reciben el nombre general de Complejometrías. Dentro de los reactivos formadores de complejos, hay un grupo, cuyo principal representante es el ácido etilendiaminotetracético (EDTA), éste tiene la propiedad de formar complejos muy estables con la mayoría de los iones metálicos. Estos compuestos orgánicos fijan el ión metálico internamente, y éste queda inmovilizado, y se forman así los llamados quelatos. A las volumetrías que usan estos reactivos se les denomina Quelometrías. El ácido etilendiaminotetracético, se representa abreviadamente como H 4Y; el ión Y4- representa el anión etilendiaminotetracetato. El EDTA es poco soluble 83 en agua, por lo que se prefiere conocida comercialmente usar como su sal disódica (Na 2H2Y.2H20) verseno, complexona o titriplex, para preparación de soluciones estándares. Esto es posible debido a que la tanto el EDTA como su sal disódica son sustancias tipo primario. Los ligandos del tipo del EDTA pueden coordinarse en varias o en todas las posiciones en torno a un ión metálico; el complejo metal-ligando formado es muy estable. La estequiometría de la reacción entre el catión que se determina y el EDTA es 1:1, es decir, que se combinan un mol del ión metálico y un mol de EDTA, no importa cual sea el estado de oxidación del catión, razón por la cual en este tipo de volumetrías se utilizan soluciones patrones Molares del ligando. En el punto de equivalencia, el número de moles (o mMol) de EDTA agregados, es igual al número de moles (o mMol) del catión que se determina. Cuando se forma un quelato hay un equilibrio entre dicho quelato y los iones que lo constituyen. La reacción general de formación de quelatos metal-EDTA y su correspondiente Keq vendrán dados por: M n Y Keq 4- MY (n - 4) [MY(n 4) ] [M n ][Y 4 ] Esta constante corresponde a la llamada “Constante de formación del complejo” y sirve para definir la estabilidad del mismo (observe que el valor reciproco de esta constante de equilibrio correspondería a la constante de disociación del complejo). Ahora bien, si la constante de estabilidad del quelato es alta indica un quelato muy estable; esto en principio permitiría su aplicación en el análisis químico. No obstante, es preciso que la reacción llene los demás requisitos ya mencionados. A los requisitos señalados anteriormente, para una reacción a ser usada en una determinación quelométrica, se añade el que la entalpía libre debe ser suficientemente grande al formarse el complejo metálico. En otras palabras, la reacción de titulación debe ser exotérmica, en la cual se llegue a un nivel de energía bastante inferior al mostrado por los compuestos reaccionantes. 84 En las quelometrías al alcanzar el punto de equivalencia, en el cual han reaccionado cantidades equimolares del metal con el ligando, se establece el equilibrio y la reacción se hace prácticamente irreversible, esto se demuestra al visualizar las correspondientes constantes de estabilidad del quelato. la Por ejemplo, constante de estabilidad Fe-EDTA = demuestra una estabilidad elevada causada por la entalpía I1025, libre y no por la naturaleza del enlace mismo (metal-EDTA). Cuando el efecto de entalpía es suficientemente grande, es posible encontrar también un indicador para tal reacción y se registra en el punto final de la titulación el conocido efecto del ascenso rápido del logaritmo negativo de la concentración molar del ión metálico (pM) o un incremento correspondiente de la concentración del ligando libre. La siguiente figura muestra la estructura característica del quelato Metal-EDTA. Estructura del Quelato Metal-EDTA 85 I. Determinaciones con el uso de EDTA Ionización del EDTA En las titulaclones quelométricas es Indispensable trabajar a un pH definido para que la reacció sea cuantitativa, por eso dichas titulaciones se efectúan en presencia de una solución buffer. Este hecho ea una consecuencia del comportamiento del H4Y como ácido débil. El H4Y es un ácido tetraprótico; por consiguiente tiene cuatro constantes de ionización: H4 Y H 3 Y- H 3 Y- H H K1 1,00 * 10 -2 H 2 Y2- K2 2,16 * 10 -3 H 2 Y 2- H HY3- K3 6,92 * 10 -7 HY 3- H Y4 - K4 5,50 * 10 -11 El predominio de una u otra de estas formas ionizadas depende del pH, de esta manera: Especie predominante H4Y pH Menor de 2 H3Y- 2-3 H2Y2- 3-6 3- HY Y4- 6 - 10 Mayor de 10 Por otra parte, la selección del pH al cual se efectuará la titulación depende de: a. El Indicador usado: Por ejempIo, en la titulación de calcio en presencia del Indicador MUREXIDE, se obtiene un cambio neto de color únicamente a pH 12; a un pH inferior no es posible determinar el punto final con este indicador. b. La solubilidad de los hidróxidos metálicos que se formen en la titulación: Por ejempIo en la titulación del calcio a pH 12; se debe estudiar la solubilidad del ión a partir del Kps de su hidróxido (Kps del Ca(OH)2 = 5,510-6). Es decir que, la solubilidad del Ca(OH)2 es lo suficientemente grande para que los iones calcio 86 sean secuestrados por el EDTA, para la formación del quelato de calcio el cual a su vez genera menos iones de calcio libres que el Ca(OH)2. En cambio el magnesio no se puede titular a pH 12, porque se formaría Mg(OH) 2 insoluble en la titulación, el cual no se disolvería para formar Mg-EDTA, que tiene una constante de estabilidad relativamente de magneslo baja. En consecuencia, la titulación se efectúa a un pH máximo de 10 (buffer cloruro de amonio- hidróxido de amonio) y se usa como indicador negro de eriocromo T. 1. Fundamento del cálculo Cuando se analiza un material para determinar la concentración de un ión metálico presente, con el uso de una solución patrón (EDTA), se dispondrá al final de los siguientes datos experimentales: a. Peso o volumen de muestra analizada. b. Volumen de solución patrón de EDTA, gastado en la valoración de la muestra. Con esta información experimental se procede luego a calcular el resultado del análisis. Recordar la premisa fundamental, en función de lo que ocurre en el punto de equivalencia: Moles del Metal = Moles de EDTA mmoles del Metal = mmoles de EDTA Ejercicio 1. Para ser utilizada en un análisis quelométrico se preparó medio litro de solución que contiene 5,0000g de Na2H2Y.2H20. ¿Cuál es la molaridad de esta solución? El peso molecular de la sal disódica es 372 g.mol-1. Número de Moles Na2H2Y.2H2O = M 13,4 mMol 500 mL 5,0000 g 0,372 g . mMol 1 0,0269 mMol . mL 1 13,4 mMol 87 No olvide que la molaridad, representa los moles presentes en un litro de solucion o los milimoles (mmol) en un mililitro. Ejercicio 2. Para determinar la pureza de una muestra de Sal de Epson (MgS04.7H2O) se pesan 0,2495g de la misma, se disuelven adecuadamente, se tamponan y se hacen reaccionar con una solución patrón preparada según el problema 1, y se gastan 32,55 mL en la valoración. Exprese la pureza de la muestra en tanto por ciento. El peso molecular del MgSO4.7H2O es de 246 g.mol-1. Mg 2 H 2 Y2- MgY2- 2H a. En el punto de equivalencia Número de mmoles de Mg2+ = Número de mmoles EDTA b. Número de mmoles de EDTA mmoles de EDTA = VEDTA. MEDTA mmol= 32,55 mL0,0269 mmol.mL-1 = 0,88 mmolMg = 0,88 c. Moles de Sulfato de magnesio 0,88 mmol de Mg equivalen a igual número de mmol de sulfato de magnesio heptahidratado, entonces; mmol MgS04.7H2O = 0,88 d. Peso de la sal Se convierten los mmol de la sal a peso de la misma, dado que se conoce lo que pesa un mmol. PM MgS04.7H2O = 246 g.mol-1 mmol MgS04.7H20 = 0,246 g.mmol-1 g MgS04.7H2O = 0,88 mmol0,246 g.mmol-1 g MgSO4.7H2O en la muestra analizada: 0,22 g 88 e. Pureza de la muestra La pureza de la muestra de Sal de Epson expresada en tanto por ciento será: g muestra analizada: 0,2495 0,2200 g *100 0,2495 % MgS04.2H20 = 88,18 % pureza = 88,18 Ejercicio 3 A una solución que contiene 0,8 mMol de MgO se le agregan 6,85 mL de solución 0,1000M de verseno, en presencia de negro de eriocromo T como indicador. ¿Cuál será el color de la solución? a. El indicador negro de eriocromo T que es de color azul forma con el ión Mg 2+ un complejo de color rojo vino. Mg 2 HIn 2- MgIn - Azul b. A Rojo vino medida que se añade la solución patrón de magnesio-indicador (Kest = 107) H se verseno, el complejo transforma en un nuevo complejo MgEDTA2- (Kest = 108,7) que es más estable. MgInn- HEDTA 3 - Rojo vino MgEDTA Incoloro HIn - Azul c. Una vez convertido todo el complejo MgIn- en MgEDTA2-, reaparece el color del indicador libre, o sea que la solución se colorea de azul. En nuestro ejercicio la solución contiene: 0,8 mmol MgO = 0,8 mmol Mg = 0,8 mmol MgYnmmol EDTA = VEDTAHEDTA mmol EDTA = 6,65 mL0,100 mmol.mL-1 mmol EDTA = 0,685 = 0,69 d) La situación en la solución es la siguiente: 0,8 mmol MgIn- > 0,69 mmol EDTA 89 Como la estequiometría de la reaccion entre el MgIn- y el verseno es 1:1 hasta el momento se han transformado 0,69 mmol del complejo MgIn - y quedan todavía en solución: 0,80 - 0,69 = 0,11 mmol MgIn-, Esto es un exceso del complejo MgIn-, por consiguiente la solución seguirá de color rojo vino. Ejercicio 4 Calcule los mg.L-1 de CaCO3 presentes en un agua de riego si 50 mL de dicha agua requieren 8,30 mL de EDTA para su titulación. Cada mililitro de EDTA es equivalente a 1 mg de CaCO3. a. Se calculan los mg de CaCO3 correspondientes al volumen de EDTA gastados en la valoración de los 50 mL. mg CaCO3 = 8,30 mL * 1 mg/mL = 8,30 mg b. Se calculan los mg.L-1 de CaCO3 mg L-1 CaCO3 = 8,30 mg /0,05 L = 166 mg L-1 CaCO3 = 166 Problemas Propuestos. 1. Se prepara una solución estándar de EDTA que contiene 20 mg de Na2H2C10H12O8N2.2H20 (sal disódica del ácido etilendiaminotetracético) por cada mililitro de solución. Calcule la concentración molar de la solución. PM sal = 372 g mol-1 R: 0,0538 M 2. Calcule el porcentaje de CaCO3 presente en una muestra si 0,2500g de CaCO3 impuro requieren 40,0 mL de la soluclón estándar de EDTA preparada en (1). PM CaCOa = 100 g mol-1 R: 86,08% 90 3. ¿Cuántos mililitros de la solución de EDTA preparada en (1) se necesitan para que reaccionen con 0,152Og de CaO puro? CaO = 56 g mol-1 R: 50,45 mL 4. De un extracto acuoso de un suelo que contiene: 475 mg L-1 de cloruro de magneslo 240 mg L-1 de sulfato de magnesio 1036 mg L-1 de nitrato de magnesio Se toma una alicuota de 10 mL y se le añaden 5 mL de EDTA 0,0250 M. Indique: a. ¿EI volumen de EDTA fue suficiente para alcanzar el punto final? b. En caso negativo, ¿Cuál es el volumen que debería emplearse? c. ¿Qué color presentará la solución en a y en b? MgCI2= 95 g mol-1 MgS04= 120 g mol-1 R: a. Fue menor; b. 5,6 mL Mg(N03)2= 148 g mol-1 c. Color rojo vino en a y Color azul en b. 5. Si a 10,0 mL de una solución que contiene 240 mg.L -1 de Mg se le añaden 9,50 mL de solucion 0,0100M de ácido etilendiaminotetracético, en presencia de negro de Eriocromo T como indicador, ¿Cuál será el color de la solución resultante? Razone su respuesta. Mg = 24 g mol-1 R: Color rojo-vino 6. Si en el problema (5) en lugar de la solucion de Mg mencionada se utiliza otra solución que contiene 400 mg.L-1 de MgO, ¿Cuál será el color de la solución resultante? Razone su respuesta. MgO = 40 g mol-1 R: Rojo vino 7. Y si en el problema (5) en lugar de 9,50 mL de solución 0,0100 M de EDTA se añaden 10,50 mL, ¿Cuál sera el resultado? Razone su respuesta. R: Azul. 91 8. Para analizar una muestra de MgCOa impuro que contiene 7% de humedad se pesa 0,2500g de la misma, se disuelven adecuadamente, se tampona y se hace reaccionar con una solución patrón de EDTA (1,0 mL de solución contiene 0,0250g de EDTA disódico, dihidratado) para lo cual se gastan 25,0 mL. Exprese la pureza de la muestra en tanto por ciento en base humeda y seca. EDTA disódico, dihidratado = 372 g mol-1, MgCOa = 81 g mol-1 R: 54,44% mh y 58,49% ms. 9. Si usted analiza un material constituido por 8% de humedad, 20% de impurezas inertes y óxido de magnesio, Indique: a. ¿Qué volumen de EDTA 0,0850M será necesario para valorar 0,0950g de dicho material? b. ¿Cuántos milimoles de magnesio hay presentes en 1 gramo de ese material? MgO: 40 g mol-1 R: a. 20,12 mL; b. 18 mMol 10. Se prepara una solución de concentración conocida de EDTA y se confirma que cada mL de la misma forma complejo con el Mg presente en 10,00 mL de una solución que contiene 0,30g de MgCl2/L. Por otra parte, se comprueba que 100 mL de un agua de pozo requieren 8,60 mL de la solución de EDTA valorada anteriormente. Si se conoce que la forma clásica de expresar la dureza del agua es en mg.L-1 de CaCO3, independientemente de la naturaleza de los aniones y cationes que realmente esten presentes. ¿Cuál es la dureza del agua analizada? MgCI2 = 95,23 g mol-1. CaCO3 = 100 g mol-1 Mg = 24,32 g mol-1 R: 271 mg L-1 11. Para determinar la pureza de una muestra que contiene 0,5000g de MgSO4.7H2O, ésta se hace reacclonar con una solución de EDTA que contiene 10,0000g de EDTA en 500 mL de solución, para lo cual se gastan 30,0 mL. Exprese la pureza de MgS04.7H20 = 246 g mol-1 la muestra en porcentaje. EDTA = 372 g mol -1 92 R: 79,35% 12. Una alícuota de 10,00 mL de solución de MgCI 2 se titula con 35,0 mL de solución de EDTA 0,0200 M. Calcule: a. Molaridad de la solución b. El pMg en la solución Mg = 24 g mol-1 Cl = 35,5 g mol-1 R: a. 0,0700 mmol.mL-1; b. 1,15. 13. Mediante cálculos, complete el siguiente cuadro: Kest Mg = 4,9108 Soluciones Mg+2 + mL NET pMg Color de la solución 50 mL Sol. Mg2+ 0,0100M 50 mL Sol. Mg2+ 0,0100M 10 mL Sol. EDTA 0,0100M 50 mL Sol. Mg2+ 0,0100M 50 mL Sol. EDTA 0,0100M R: pMg Color de la solución 2 Rojo vino 2,18 Rojo vino 5,50 Azul 14. Con base en las constantes de estabilidad que se indican complete las ecuaciones que se muestran a continuación y razone su respuesta, en cada caso. Pb 2 Ca EDTA 2- Mg 2 Ca EDTA 2- Ca 2 Pb EDTA 2- Ke Mg EDTA = 1108,7 Ke Ca EDTA = 11010,7 Ke Pb EDTA = 11018 93 PRÁCTICA 9. CÁLCULOS EN EL ANÁLISIS ESPECTROFOTOMÉTRICO. Ejercicio 1 ¿Cuál es la absorbancia de una solución que presenta 40% de transmitancia? T% = 40 log 40 = 1,602060 A = 2- log T% A = 2 - 1,602060 = 0,39794 A = 0,3979 Ejercicio 2 ¿Cuál es la transmitancia de una solución que presenta una absorbancia de 0,3980? A = 0,3980 A = 2- log T% 0.398 = 2 - log T% log T% = 2 - 0,398 = 1,602 T% = antilog 1.602 = 40 T% = 40 Ejercicio 3 Una solución de 8 mg.L-1 de Mn en forma de KMn04 tiene una absorbancia de 0,37. ¿Cuál es su absortividad molar? (b = 1 cm). c=8 mg.L-1 A = 0,37 8 mg.L-1 = 8 x 10-3 g.L-1 de Mn M 8 * 10 -3 g . L-1 55 gMol -1 A = . c. b ε 1,455 x 10 -4 Mol . L-1 A c.b b =1 cm 94 0,37 1,455 * 10 -4 M * 1 cm ε 2543 L . mol -1 . cm -1 = 2543 L.Mol-1.cm-1 Ejercicio 4 Una solución de KMn04 tiene = 2543 y una absorbancia de 0,18 a 545 nm. ¿Cuál es su concentración en Mol.L-1 y en mg.L-1 de Mn? (b = 1 cm). = 2543 L.Mol-1.cm-1 A = 0,18 = 545 nm b = 1 cm Mn = 55 g.Mol-1 A = .c.b c c A ε* b 0,18 2543 x 1 7,078 *10 -5 Mol . L-1 g.L-1 Mn = 7,07810-5 x 55 = 3,8910-3 3,8910-3 g.L-1= 3,89 mg.L-1 Entonces c = 7,07810-5 Mol.L-1 y 3,9 mg.L-1 Mn Problemas propuestos 1. Una disolución que contiene 10 mg.L -1 de cierto material coloreado, medida con un espesor óptico de 1,00 cm, presenta la absorbancia y el porcentaje de tansmitancia que se muestran en la primera línea del cuadro anexo. Calcule los valores que faltan en dicho cuadro. Se supone que el sistema sigue la Ley de Beer. 95 Concentración Espesor (mg.L-1) (cm) Dado 10,0 1,00 a 4,2 1,00 b 12,7 1,00 c 18,0 2,00 d 1,00 e 5,00 f %T Absorbancia 38,9 0,410 0,861 22,1 10,0 19,2 2. Una disolución de KMnO4 que contiene 1,00 mg de Mn por 100 mL tiene una transmitancia de 12,9% cuando se mide con una celda de espesor de 2,00 cm. a. Calcular la absorbancia de la disolución. b. Calcular el %T cuando se mide con un espesor de 1,00 cm. c. Se disuelve una muestra de 0,2000g de oxida a permanganato y se diluye a 500,0 mL, la acero al manganeso, se absorbancia de la dilución, medida con un espesor de 1,00 cm es 0,600. Calcular el % de Mn en el acero. R: 0,889; 35.9%; 3,4% Mn 3. Una disolución de KMnO4 que contiene 1,00 mg.L-1 de Mn tiene una transmitancia de 90,4% con un espesor de 1,00 cm a 526 nm. Calcule: a. %T en una solución que contiene 2,00 mg.L -1 de Mn, cuando se mide con un espesor de 10,0 cm. b. La absortividad molar de Mn (medido como permanganato) a 526 nm. R: 13,28%: 2409 L.Mol-1.cm- 1 4. A 565 nm la absortividad molar de KMnO4 es 1430. Calcular la absorbancia y el %T de una solución de KMn04 al 0,002% cuando se mide en cubetas de 2,00 cm de espesor. R: 0.362; 43,45% 96 5. Los siguientes datos se han obtenido por medida de cierta disolución en cubetas de 2.00 cm de espesor: Concentración (g.L-1) Transmitancia (%) 0,0105 0,0210 0,0280 44,8 20,0 11,7 Indique: a. ¿Sigue el sistema la Ley de Beer? b. ¿Cuál es el valor medio de la absortividad, en (mg.L-1).cm-1 c. ¿Cuál es la concentración de una disolución que tiene un %T de 28,7 medido en cubetas de 2,00 cm. d. ¿Cuál es la concentración de una disolución que tiene un % T de 54,4 medido en cubetas de 1,00 cm. 6. Se encontró que la sustancia coloreada M tiene un pico de absorción a 405 nm y que una disolución de 3,0 mg.L -1 de dicho compuesto, cuando se medió en una cubeta de 2,5 cm, presentaba una absorbancia de 0,842. El peso fórmula de M es 150 g.Mol-1. Señale: a. ¿Cuál es la absortividad de M a 405 nm? b. ¿Cuál es la absortividad molar de M a 405 nm? c. ¿Qué peso de M esta contenido en 100 mL de una disolución que tiene una absorbancia de 0,760 a 405 nm, cuando es medida en una cubeta de 1 cm. R: 0,1123 L.cm-1.mg-1; 1,684104 L .Mol-1.cm-1; y 0,677 mg en 100 mL. 7. Un reactivo forma un complejo coloreado 1:1 con plomo (II) en solución. El complejo a la longitud de onda de máxima absorbancia, tiene una absortividad molar de 4200 L.Mol-1.cm-1 Calcule la concentración mínima de Pb en moles.L-1 y en mg.L-1 que puede medirse en una celda de 1 cm, si se supone que una absorbancia de 0,100, es el valor mínimo para que la medición resulte exacta. Pb: 207,2 g.Mol-1 R: 4.93 mg.L-1. 97 Apéndice 1 Constantes de disociación de algunos ácidos Nombre del ácido Fórmula Ka1 Ka2 Acético CH3COOH 1,8010-5 Acetilsalicílico C9H8O4 3,0010-4 Ascórbico C6H8O6 8,0010-5 Etanolamina HOCH2CH2NH 3,1810-10 Arsenioso H3AsO3 5,1010-10 Benzoico C6H5COOH 6,3010-5 Bórico H3BO3 5,8110-10 Butanoico CH3CH2CH2COOH 1,5210-5 Carbónico H2CO3 4,3010-7 Cianídrico HCN 4,9010-10 Cítrico C6H8O7 7,1010-4 Fórmico HCOOH 1,8010-4 Fluorídrico HF 3,5010-4 Fenol C6H5OH 1,3010-10 Glutárico HOOCCH2CH2 CH2COOH 4,6010-5 Hipobromoso HBrO 2,0010-9 Hipocloroso HClO 3,2010-8 Hipoiodoso HIO 2,3010-11 Pentanoico CH3CH2CH2 CH2COOH 1,4410-5 Peróxido H2O2 2,4010-12 Propanoico CH3CH2COOH 1,3410-5 Sulfídrico H2S 1,0010-7 1,0010-19 Sulfuroso H2SO3 1,5010-2 6,3010-8 5,610-11 1,710-5 3,7010-6 98 Apéndice 2 Constantes de disociación de algunas bases Nombre de la base Fórmula Kb Amoníaco NH3 1,8010-5 Anilina C6H5NH2 4,2010-10 Codeína C18H21NO3 1,6010-6 Dimetilamina (CH3)2NH 5,4010-4 Etilamina C2H 5NH2 6,4010-4 Hidrazina N2H4 8,9010-7 Hidroxilamina NH2OH 9,1010-9 Piridina C5H 5N 1,5010-9 Trimetilamina (CH3)3 N 6,5010-5 99 Apéndice 3 Constantes del Producto de solubilidad (Kps) a 25ºC de algunos compuestos Compuesto Fórmula Kps Bromuro de Plata AgBr 5,0010-13 Carbonato de Bario BaCO3 5,0010-9 Carbonato de Calcio CaCO3 4,5010-9 Carbonato de Estroncio SrCO3 9,3010-10 Carbonato de Plata Ag2CO3 8,1010-12 Carbonato de Zinc ZnCO3 1,0010-10 Cloruro de Cuproso CuCl 1,9010-7 Cloruro Mercurioso Hg2Cl2 1,2010-18 Cloruro de Plata AgCl 1,8010-10 Cromato de Plomo PbCrO4 3,0010-13 Cromato de Plata Ag2CrO4 1,2010-12 Fluoruro de Bario BaF2 1,7010-6 Fluoruro de Calcio CaF2 3,9010-11 Fluoruro de Magnesio MgF2 6,6010-9 Fosfato de Calcio Ca3(PO4)2 2,1010-33 Hidróxido de Aluminio Al(OH)3 3,0010-34 Hidróxido Cúprico Cu(OH)2 4,8010-20 Hidróxido de Férrico Fe(OH)3 1,6010-39 Hidróxido Ferroso Fe(OH)2 4,1010-15 Hidróxido de Magnesio Mg(OH)2 7,1510-12 Hidróxido de Zinc Zn(OH)2 3,0010-16 Sulfato de Bario BaSO4 1,1010-10 Sulfato de Plata Ag2SO4 1,5010-5 Yoduro de Plomo PbI2 7,9010-9 Yoduro de Plata AgI 8,3010-17 Tomado del Skoog (2008) y Harvey (2002) 100 Apéndice 4 Poténciales estándar de reducción para algunas reacciones Eo Reacción Co 3 e H 2O 2 Co 2 2H 1,81 2e 1,78 2 H 2O MnO 4 4H 3e MnO 2 2 H 2O 1,68 MnO 4 8H 5e Mn 2 4 H 2O 1,51 Cl 2 2 e Cr2 O 7 O2 14 H 4H NO 3 1,36 2 Cl 6e 4e 4H 2 Cr 3 2 H 2O 3e NO 2 H 2 O 7 H 2O 1,33 1,23 0,96 Ag e Ag 0,80 Fe 3 e Fe 2 0,77 Cu Cu 2 e 0,52 Cu 2e 0,34 Cu Hg 2 Cl 2 2 e 2 Hg 2 Cl 0,28 0,22 AgCl e Ag Cl 2H 2e H2 0,00 Fe 3 3e Fe - 0,04 Pb 2 2e Pb - 0,13 2 CO 2 2 H 2e Zn 2 Zn 2e H 2C2O 4 - 0,49 - 0,76 101 Eo Reacción 2 H 2O 2 2 e Mn 2 2e Al 3 e Ca 2 - 1,66 Al 2e Na - 1,18 Mn 3e Mg 2 - 0,83 H 2 OH - 2,87 Mg - 2,71 Na 2e - 2,87 Ca K e K - 2,93 Li e Li - 3,04 Apéndice 5 Pesos atómicos NOMBRE SÍMBOLO Actinio Aluminio Americio Antimonio Argón Arsénico Astatine Azufre Bario Berilio Berkelio Bismuto Borium Boro Bromo Cadmio Calcio Californio Carbono Cerio Cesio Cloro Ac Al Am Sb Ar As At S Ba Be Bk Bi Bh B Br Cd Ca Cf C Ce Cs Cl PESO ATÓMICO 227,028 26,982 (243) 121,757 39,948 74,922 (210) 32,066 137,33 9,011 (247) 208,941 (262) 10,810 79,904 112,41 40,078 (251) 12,011 140,12 132,905 35,453 NOMBRE Lutecio Magnesio Manganeso Meitnerium Mendelevio Mercurio Molibdeno Neodimio Neón Neptunio Niobio Níquel Nitrógeno Nobelio Oro Osmio Oxígeno Paladio Plata Platino Plomo Plutonio SÍMBOLO Lu Mg Mn Mt Md Hg Mo Nd Ne Np Nb Ni N No Au Os O Pd Ag Pt Pb Pu PESO ATÓMICO 174,967 24,305 54,938 (266) (258) 200,590 95,940 144,240 20,179 237,048 92,906 58,690 14,007 (259) 196,967 190,200 15,999 106,420 107,868 195,080 207,200 (244) 102 Cobalto Cobre Criptón Cromo Curio Disprosio Dubnium Einstenio Erbio Escandio Estaño Estroncio Europio Fermio Flúor Fósforo Francio Gadolinio Galio Germanio Hafnio Hassium Helio Hidrógeno Hierro Holmio Indio Iridio Iterbio Itrio Lantano Laurencio Litio Co Cu Kr Cr Cm Dy Db Es Er Sc Sn Sr Eu Fm F P Fr Gd Ga Ge Hf Hs He H Fe Ho In Ir Yb Y La Lr Li 58,939 63,546 83,800 51,996 (247) 162,500 (262) (252) 167,260 44,956 118,710 87,620 151,960 (257) 18,998 30,974 (223) 157,250 69,720 72,610 178,490 (265) 4,003 1,008 55,847 164,930 114,820 192,220 173,040 88,906 138,905 (260) 6,941 Polonio Potasio Praseodimio Prometio Protactinio Radio Radón Renio Rodio Rubidio Rutenio Rutherfordio Samario Seaborgium Selenio Silicio Sodio Talio Tantalio Tecnecio Telurio Terbio Titanio Torio Tulio Tungsteno Uranio Vanadio Xenón Yodo Zinc Zirconio Po K Pr Pm Pa Ra Rn Re Rh Rb Ru Rf Sm Sg Se Si Na Tl Ta Tc Te Tb Ti Th Tm W U V Xe I Zn Zr (209) 39,098 140,908 (145) 231,036 226,025 (222) 186,207 102,906 85,468 101,070 (261) 150,360 (263) 78,960 28,086 22,989 204,383 180,948 (98) 127,600 158,925 47,880 232,038 168,934 183,85 283,029 50,942 131,29 126,905 65,39 91,224