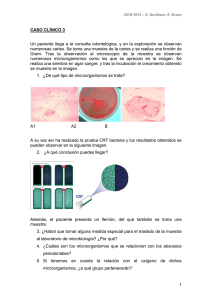
Microbiología
Anuncio

Microbiología Manual de Prácticas Nombre del alumno: ___________________________________ Nombre del laboratorista:_______________________________ Nombre del profesor:___________________________________ Grado & Grupo: ________________ UNIVERSIDAD DE COLIMA DIRECCIÓN GENERAL DE EDUCACIÓN MEDIA SUPERIOR MANUAL DE PRÁCTICAS DE MICROBIOLOGÍA Elaborado por: Q.F.B. Mónica Alcaraz Munguía Aprobado por la Academia Estatal de Microbiología: M.V.Z. Eduardo Aguilar Torres M.V.Z. Gustavo Valpuesta Vega QFB. María Mercedes Suárez Bravo QFB. Patricia Edwigis Valladares Celis Supervisado por: Licda. Laura Araceli Jiménez Cobián A G OSTO DE L 2009 2 JUSTIFICACIÓN El presente trabajo se elaboró con la finalidad de proporcionar un material ordenado y de fácil acceso al trabajo académico el cual se complementa con la actividad científica en el laboratorio. Actualmente no se encuentra un manual de prácticas de microbiología en el nivel medio superior dentro de la página de la Universidad de Colima ni en bachilleratos que tengan el área Químico Biólogo o un área en común en donde se contemple la asignatura de microbiología general en el nivel medio superior. La intención de este manual es satisfacer las necesidades del docente en los aspectos teóricos llevados en el aula con la actividad científica desarrollada en el laboratorio de tal forma que se nos facilite el trabajo ordenado y uniforme en todos los bachilleratos. El manual consta de quince prácticas y fue elaborado tomando en cuenta las referencias bibliográficas que marca el programa de educación media superior de la Universidad de colima para la asignatura de Microbiología. La elaboración del manual se realizó en varias etapas mediante la recopilación de prácticas. Cada práctica inicia con el título en la parte central el cual se seleccionó de acuerdo a la dosificación del programa por semana. El objetivo hace referencia al aspecto significativo que se pretende que los alumnos logren al final del experimento. La introducción es la parte teórica de cada una de las prácticas, fue tomada de diversas referencias bibliográficas. En la parte experimental el procedimiento se tomó de diversos manuales de otras Universidades y de la misma Universidad de Colima. El cuestionario en el que el alumno demuestra su aprovechamiento logrado al final de la secuencia de aprendizaje se elaboró basado en el aspecto introductorio y resultados experimentales que se esperan de cada práctica. Así mismo se complementa con observaciones que el alumno realizará mediante dibujos o esquemas y finalizará con conclusiones personales del mismo. 2 3 INDICE DE PRÁCTICAS Página Práctica No 1 Empacado del material y esterilización por calor seco.............................................................................. Práctica no 2 Esterilización por calor húmedo Práctica No 3 Preparación de medios de cultivo Sólidos........................................................................................ Práctica No 4 32 Aislamiento de bacterias mediante el método sembrado en placa por estrías........................................ Práctica No 8 28 Aislamiento de Hongos mediante el método extensión en placa.......................................................... Práctica No 7 21 Sembrado en placa de microorganismos del medio ambiente..................................................................... Práctica No 6 21 Preparación de medios de cultivo Líquidos....................................................................................... Práctica No 5 7 35 Manejo y uso del microscopio óptico Compuesto…………………………………………………… Práctica No 9 Tinción de la cápsula bacteriana.................................................. 40 Práctica No 10 Tinciones selectivas..................................................................... 42 Práctica No 11 Tinción de Gram........................................................................ 46 Práctica No 12 Tinción ácido-Alcohol resistente................................................. 49 Práctica No 13 Efecto de la presión osmótica sobre la viabilidad y el crecimiento de los microorganismos.................................. Práctica No 14 Determinación del tiempo y punto térmico mortal en microorganismos....................................................... Práctica No 15 51 Inhibidores bacterianos.............................................................. 54 58 3 4 RECOMENDACIONES GENERALES 1.-La hora de entrada tendrá 10 minutos de tolerancia, después de este tiempo, no se permitirá al acceso al laboratorio 2.-Al entrar al laboratorio, el alumno deberá ponerse la bata y abotonarla completamente, sólo podrá quitársela al salir de éste. 3.- Las mesas deberán estar siempre limpias y desocupadas, las mochilas deberán ser colocadas en los cajones de las mesas de trabajo. 4.- No comer ni fumar en el laboratorio, no introducirse ningún objeto a la boca. 5.- Recogerse el pelo para efectuar el trabajo de laboratorio. 6.- Limpiar y desinfectar el área de trabajo antes y después de usarla. 7.- No pasear entre las mesas del laboratorio, el trabajo deberá efectuarse sentado y en su equipo de trabajo. 8.-Hablar sólo lo necesario con los compañeros. 9.- Días antes de iniciar la práctica lea cuidadosamente que es lo que se va a realizar, si no entiende pregunte al profesor. 10.- Si hay necesidad de llevar material biológico para la realización de la práctica, es necesario conseguirlo de lo contrario la práctica se suspenderá para todo el equipo. 11.- El asa utilizada para el cultivo de microorganismos deberá esterilizarse en la flama del mechero, antes y después de su uso. 12.-Informe al profesor de cualquier accidente que ocurra. 13.-En caso de derramar material que contenga microorganismos, cúbralo con fenol o benzal y deje actuar diez minutos y de aviso al profesor. 14.- Todo el material que se va a incubar o desechar, debe colocarse en el sitio 4 5 indicado por el profesor. 15.-Etiquete todo el material que va a incubar con los siguientes datos: equipo, grupo, fecha, nombre del material e iniciales del nombre del alumno. 16.- Después de la incubación es necesario la esterilización del material para eliminar microorganismos que pudieran hacernos daño a nuestra salud. 17.- Lávese las manos con agua y jabón antes de salir del laboratorio. 18.- Es obligación de cada equipo entregar todo el material limpio. 5 6 FÓRMULA Y PREPARACIÓN DE REACTIVOS USADOS EN LAS DIFERENTES PRÁCTICAS DE ESTE CURSO 1.- SOLUCIÓN DE AGUA OXIGENADA AL 10% PREPARACIÓN Preparar antes de usarse. Colocar 1 ml de agua oxigenada en 9 ml de agua destilada 2.- COLORANTE DE AZUL DE METILENO AL 5% PREPARACIÓN Azul de metileno Agua destilada 3.- REACTIVOS DE LA TÉCNICA DE GRAM A) COLORANTE CRISTAL VIOLETA FÓRMULA: Cristal violeta Etanol al 95% Oxalato de amonio Agua destilada PREPARACIÓN: 1.- Disolver el cristal violeta en el etanol 2.- Disolver el oxalato en el agua 3.- Mezclar las dos soluciones B) SOLUCION DE LUGOL FORMULA Yoduro de potasio Agua destilada Yodo metálico Etanol, aforar a PREPARACIÓN: 1.- Disolver el yoduro de potasio en el agua 2.- Agregar el yodo metálico y disolver 3. Aforar a 100 ml con etanol C) SOLUCIÓN DE ALCOHOL ACETONA FORMULA Acetona volumen Etanol al 95% volúmenes D) COLORANTE SAFRANINA FORMULA Safranina 5.0 gr 100 ml 2.0 gr 20 ml 0.8 gr 80 ml 10.0 gr 20.0 ml 5.0 gr 100.0ml 1 2 0.5 gr 6 7 Agua destilada 100.0 ml PREPARACIÓN Disolver la safranina en aproximadamente 20 ml de agua, después aforara a 100 ml con más agua. 4.- REACTIVOS DE LA TÉCNICA DE ZIEHL- NEELSEN A) COLORANTE FUCSINA FENICADA FORMULA: Fucsina básica 5.0 gr Fenol 25.0 grs Etanol al 95% 50 ml Agua destilada aforar a 500 ml PREPARACIÓN 1.- Colocar el fenol en 100 ml de agua destilada y calentar en baño a ebullición 2.- Añadir la fucsina básica y disolver 3.- Añadir el etanol y mezclar 4.- Aforar la solución a 500 ml con agua destilada B) SOLUCIÓN DE ALCOHOL ÁCIDO FORMULA Ácido clorhídrico 3.0 ml Etanol al 95 100.0 ml PREPARACIÓN Adicionar el ácido clorhídrico al etanol, lentamente y agitando C) COLORANTE AZUL DE METILENO FORMULA Azul de metileno 5.0 gr Agua destilada 100.0 ml 5.- MEZCLA CRÓMICA Dicromato de potasio 20.0 gr Ácido sulfúrico concentrado 20.0 ml. Agua destilada 250.0 ml. 7 8 EMPACADO DEL MATERIAL Y ESTERILIZACIÓN POR CALOR SECO Práctica No 1 Nombre Del Alumno:__________________________________Semestre______ Grupo______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio__________________________________ Calif:__________ OBJETIVO: El alumno aprenderá el procedimiento para empacar diversos materiales de uso en microbiología así como el procedimiento de la esterilización por calor seco de estos. SUSTANCIAS QUIMICAS Detergente Extran Agua destilada Horno a 170·C Termómetro MATERIAL Matraces Tubos de ensaye Pipetas Cajas de petri Papel estraza Algodón Escobillones INTRODUCCION. EMPACADO DEL MATERIAL Antes de iniciar un empaque del material que se desea esterilizar, es necesario que todas las prácticas que se realicen estén en condiciones de esterilidad y se debe, en primer lugar, limpiar el área de trabajo con alguna sustancia desinfectante y encender el mechero. Se emplearán distintos agentes germicidas y desinfectantes (soluciones de hipoclorito de sodio, cloroxilenol, formaldehído, etc.) para desinfectar superficies. El material a esterilizar se deberá de empacar correctamente con papel estraza Una de las razones de la importancia del papel en nuestra vida cotidiana es la enorme cantidad de usos que se le pueden dar a este producto. De la misma manera, el papel puede adaptarse a las diferentes utilidades que se vayan a realizar llegando a contabilizarse hasta 457 variedades diferentes de papel. Las variedades dependen de una serie de características físicas que hacen que el papel se pueda adaptar a diferentes usos como: Impedir el ingreso de microorganismos al interior, Sellar en forma completa para evitar contaminación, Soportar la tracción y manipulación habitual sin sufrir deterioro y hacer permeable al método de esterilización seleccionado. Todo esto se logra Empacando en primer lugar en campo de algodón, y posteriormente en empaque mixto o en polipropileno de acuerdo con el tamaño del material. 8 9 ESTERILIZACIÓN POR CALOR SECO La muerte microbiana se produce por una esterilización, ya sea como consecuencia de mecanismos de transferencia de energía, además de la oxidación. En la esterilización por Calor seco existe una destrucción de los microorganismos oxidando sus constituyentes químicos, desnaturalizando las proteínas y los ácidos nucleicos de las células así como fragmentando las membranas celulares. Para materiales que deben permanecer secos como ciertos instrumentos de vidrio de laboratorio tales como: cajas de petri, pipetas, así como aceites, polvos ( por ser impermeables al vapor), los materiales que no se pueden esterilizar por calor seco son: Material textil (algodón, sedas, lino, etc.), Gomas y Materiales sintéticos Todo material que se altere a la temperatura de trabajo se dispone de hornos eléctricos por los que circula aire caliente, en vista ¡de que el calor es menos eficaz en materiales secos, se acostumbra a aplicar una temperatura de 160·C a 170·C durante una hora o más. Para materiales de vidrio de laboratorio es suficiente una exposición de dos horas de duración a 160·C ( 320 ·F) para que quede esterilizado. Otras formas útiles de calor seco incluyen incineración para objetos que deben ser destruidos y flameados por pasaje de agujas o pequeños instrumentos a través de la llama de un mechero bunsen PROCEDIMIENTO I) EMPACADO DEL MATERIAL l.- Lava el material de laboratorio, principalmente la cristalería con detergente Extran o Alkox (Fácilmente se contamina con esporas difíciles de eliminar) enjuaga con abundante agua de la llave y en seguida con agua destilada. 2.- Secar el material utilizando papel absorbente para acelerar el secado 3.-Empaca el material correctamente A) CAJAS DE PETRI Corta el papel estraza, en forma de rectángulos adecuados para la cantidad de 2 a 3 cajas. Colócalas en la parte central y Envuélvelas según te indique tu profesor.:Se toman los extremos de Papel y se unen , Se hace un nuevo doblez recargando ligeramente en la caja para marcarlo, Los extremos se doblan en forma triangular .Ya en forma triangular se doblan hacia atrás quedando listas para esterilizar. B) PIPETAS Introduce una pequeña porción de algodón en el cuello de la pipeta, procurando que quede lo suficientemente apretada. Con tiras de papel de 3 cm de ancho envuélvelas, comenzando por la punta y en forma de espiral gira hacia arriba hasta el final de la pipeta. C) TUBOS DE ENSAYE. Se toma el tubo con la mano izquierda y con la derecha el tapón de algodón. Coloca algodón en la boca del tubo a 1/5 parte de la longitud del mismo procurando que quede bien apretado, deposítalos en recipientes adecuados, tápalos con papel estraza y átalos. 9 10 D) MATRACES. Tapa el cuello del matraz con algodón, lo suficientemente apretado para evitar que se destape ( se tapa en la misma forma que el tubo). Como protección coloca un gorrito de papel estraza y átalo con cinta. E) MATERIAL METÁLICO El asa de platino, tijeras, bisturí, material quirúrgico no es necesario empacarlo para su esterilización. II) ESTERILIZACIÓN POR CALOR SECO 1.-Las normas de Procedimiento de la Institución establecerán las condiciones de trabajo según la carga, volumen, peso, resistencia térmica del material. Es imprescindible respetar los parámetros obtenidos en la validación del procedimiento. La temperatura de esterilización por Calor Seco deberá estar entre 160·C a 170 °C. y el tiempo de aplicación será de una hora o más. 2.- El material a esterilizar se deberá cargar con el esterilizador frío, teniendo en cuenta las siguientes recomendaciones: Cada unidad deberá quedar separada de las vecinas Los materiales no deberán estar en contacto con las paredes, piso y techo del esterilizador La carga del esterilizador será homogénea y no deberá superar el 80% de la capacidad total de la cámara 3.-Colocar el material dentro del Esterilizador. Encender el Esterilizador, Verificar que los instrumentos de control de ciclo, tiempo ( l hora) y temperatura( 170·C) se encuentren en la posición correcta. Esperar hasta que los instrumentos de medición alcancen la temperatura seleccionada para el ciclo 4.- Cuando se alcance la temperatura seleccionada, se comenzará a descontar el tiempo de esterilización. Cumplido el tiempo de exposición se apagará el Esterilizador La descarga del Esterilizador se efectuará una vez que el material se haya enfriado. 5.-Durante el ciclo de Esterilización no deberá abrirse la puerta del Esterilizador porque ello implicaría abortar el ciclo, debiendo en este caso recomenzarlo, además de que el cambio de temperatura rompería la cristalería 6.- una vez alcanzada la temperatura de 160ºC en el horno con aire caliente coloca todo el material que se empacó y toma el tiempo de 2 horas para su esterilización CUESTIONARIO: 1.- Porqué antes de una esterilización es necesario lavar y desinfectar el material?________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 10 11 2.- ¿Es necesario un secado del material en el horno antes del empacado con papel estraza? ¿Porque?________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 3.- Qué finalidad tiene el empacado antes de la esterilización?____________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 4.- Puede ser utilizado otro tipo de papel que el de estraza? ¿Por qué?____________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 5.- Qué finalidad tienen los tapones de algodón que se colocan en los extremos de las pipetas y de los Matraces Erlen Meyer__________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 6.- Qué desventaja tiene el utilizar la esterilización por calor seco en este laboratorio?_____________________________________________________________________ ________________________________________________________________________________ 7.- Cómo actúa la esterilización por calor seco en los microorganismos?________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 8.- A qué temperatura y cuánto tiempo tendrás que emplear para esterilizar por calor seco el material de laboratorio para asegurar la destrucción de microorganismos patógenos y esporas?_________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ OBSERVACIONES Realiza los dibujos correspondientes del procedimiento de empacado que realizaste para cada tipo de material de laboratorio. Así mismo dibuja el horno en donde realizaste la esterilización por calor seco. 11 12 CONCLUSIONES ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 12 13 ESTERILIZACIÓN POR CALOR HÚMEDO Práctica No 2 Nombre Del Alumno:_________________________________Semestre______ Grupo______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio_______________________________ Calif:_____________ OBJETIVO: El alumno conocerá y aplicará el procedimiento de esterilización por calor húmedo, así como las ventajas del procedimiento. MATERIAL Reloj Autoclave u olla de presión 3 Soporte universal 2 mechero fischer Material de cristalería limpio, seco y empacado Asa de platino SUSTANCIAS Agua de la llave Extran Alkox INTRODUCCIÓN AGENTES FÍSICOS ANTIMICROBIANOS. A) CALOR HÚMEDO.- La temperatura elevada, combinada con una humedad elevada, es uno de los métodos más efectivos para matar microorganismos. El calor húmedo mata a los microorganismos coagulando sus proteínas. Es mucho más rápido y efectivo que el calor seco. El vapor a presión proporciona temperaturas por encima de las que se pueden obtener al hervir. Tiene la ventaja de un calentamiento rápido, así como penetración rápida y abundante humedad.. El aparato a esterilizar que utiliza vapor de agua a presión regulada se denomina autoclave. Consta de una cámara de doble pared que se llena de vapor saturado libre de aire y se mantiene a la temperatura indicada y a la presión establecida durante un periodo de tiempo determinado. Generalmente el autoclave funciona a una presión de 15 libras/ pulgada cuadrada a 121·C ( 249·F). El tiempo de funcionamiento para lograr la esterilidad depende de la naturaleza del material que se va a esterilizar, del tipo de envase y del volumen del material. Una temperatura de l00·C es la suficiente para matar a todas las formas bacterianas en 2 o 3 minutos, excepto a las esporas, para matar a estas se requiere una temperatura de 121·C durante 15 minutos y a una presión de 15 libras. 13 14 Este método es adecuado para esterilizar aparatos que tienen hule, jeringas que contienen metal, para medios de cultivo que contienen un azúcar especial dextrosa. El autoclave se puede sustituir por la olla de presión. B) CALOR SECO. - En este tipo de esterilización existe una destrucción de los microorganismos oxidando sus constituyentes químicos, desnaturalizando las proteínas y los ácidos nucleicos de las células así como fragmentando las membranas celulares. Para materiales que deben permanecer secos como ciertos instrumentos de vidrio de laboratorio tales como: cajas de petri, pipetas, así como aceites, polvos ( por ser impermeables al vapor), los materiales que no se pueden esterilizar por calor seco son: Material textil (algodón, sedas, lino, etc.), Gomas y Materiales sintéticos Todo material que se altere a la temperatura de trabajo se dispone de hornos eléctricos por los que circula aire caliente, en vista ¡de que el calor es menos eficaz en materiales secos, se acostumbra a aplicar una temperatura de 160·C a 170·C durante una hora o más. Para materiales de vidrio de laboratorio es suficiente una exposición de dos horas de duración a 160·C ( 320 ·F) para que quede esterilizado. Otras formas útiles de calor seco incluyen incineración para objetos que deben ser destruidos y flameados por pasaje de agujas o pequeños instrumentos a través de la llama de un mechero bunsen PROCEDIMIENTO C) ESTERILIZACIÓN POR CALOR HÚMEDO (vapor a presión) 1.- Lava el material que te proporcione tu profesor con mezclas adecuadas como Extran, mezcla Crómica con concentraciones adecuadas tomando en cuenta lo sucio del material, seca en estufa o en forma manual con papel absorbente y empácalo. Tenlo listo para su esterilización. 2.- Coloca el agua necesaria en la autoclave u olla de presión hasta la marca e introduce unas gradillas metálicas que servirán de base al material a esterilizar. Coloca el material a esterilizar dentro de la autoclave u olla de presión, evitando que el material toque las paredes. 3.- Cierra la autoclave u olla de presión, cuidando de dejar abierta la válvula de salida de vapor que ayudará a expulsar el aire contenido dentro y que éste es desplazado por el vapor que se produce. .- si el aire no fue eliminado totalmente de la autoclave, el manómetro aumentará a 15 libras. Pero la temperatura no habrá alcanzado los 12l·C. Por esto se debe medir el tiempo cuando la temperatura llegue a l12·C 4.- Cierra la válvula cuando el vapor sea continuo. La temperatura de l05·C indica que está libre de aire. Vigila el termómetro. Cuando vaya en 120·C, mantenla durante 15 minutos para que se efectúe la esterilización (15 libras de presión). Transcurrido este tiempo se corta la fuente de calor. 5.-Deja enfriar hasta que el manómetro marque cero. Abre la válvula de salida de vapor, para expulsar el vapor restante. Abre el autoclave y retira el material 14 15 6.- Si el material no está en estado líquido la válvula se puede abrir rápido a la salida de vapor, pero si está en estado líquido la rápida pérdida de presión las hace hervir o bien saltar los tapones. Por lo tanto se espera unos minutos a que se enfríe perfectamente CUESTIONARIO. 1.- Cuál material se puede esterilizar por calor seco y cuál no. ¿Porqué? _______________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 2.- Qué tipo de material se puede esterilizar por calor húmedo?________________________________________________________________________ ________________________________________________________________________________ 3.- A qué condiciones de temperatura y presión se destruyen todas las formas vegetativas? ________________________________________________________________________________ ________________________________________________________________________________ 4.- A qué condiciones de temperatura y presión se destruyen las esporas? ________________________________________________________________________________ ________________________________________________________________________________ 5.- Cuáles son las condiciones necesarias de tiempo y temperatura para esterilizar por calor seco?___________________________________________________________________________ ________________________________________________________________________________ 6.- Cuáles son las condiciones necesarias de tiempo y temperatura para esterilizar por calor húmedo?________________________________________________________________________ ________________________________________________________________________________ 7.-Cómo actúa la esterilización por calor seco en los microorganismos? ________________________________________________________________________________ ________________________________________________________________________________ 8.- Cómo actúa la esterilización por calor húmedo en los microorganismos? ________________________________________________________________________________ ________________________________________________________________________________ 9.- Qué tipo de esterilización es más recomendable y por qué? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ OBSERVACIONES: Realiza esquemas y dibujos correspondientes a la esterilización por calor húmedo que realizaste en la práctica 15 16 CONCLUSIONES: ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 16 17 PREPARACIÓN DE MEDIOS DE CULTIVO SÓLIDOS Práctica No 3 Nombre Del Alumno:_________________________________Semestre______ Grupo______ Nombre del titular_____________________________________Fecha____________________ Nombre del Prof. de Laboratorio_________________________________ Calif:___________ OBJETIVO: Adiestrar al alumno en la preparación de diferentes medios de cultivo MATERIAL 4 Matraz Erlen Meyer de 250 ml 1 Baño maría 3 Tripies 2 Mecheros Fisher 3 Telas de asbesto Agitador 4 Vaso de precipitado de 250 ml 1 Espátula 1 Vidrio de reloj Cajas de petri Tapones de algodón Autoclave u olla de presión Papel estraza Tubos de ensayo 16X150 SUSTANCIAS Agar nutritivo Miuller Hinton Agar base sangre Agar Macconkey Agar- Manitol- Sal- Agar INTRODUCCIÓN Uno de los sistemas más importantes para la identificación de microorganismos es observar su crecimiento en sustancias alimenticias artificiales preparadas en el laboratorio. El material alimenticio en el que crecen los microorganismos es el Medio de Cultivo y el crecimiento de los microorganismos es el Cultivo.. Para que las bacterias crezcan adecuadamente en un medio de cultivo artificial debe reunir una serie de condiciones como son: temperatura, grado de humedad y presión de oxígeno adecuado, así como un grado correcto de acidez o alcalinidad. Un medio de cultivo debe contener los nutrientes y factores de crecimiento necesarios y debe estar exento de todo microorganismo contaminante. La mayoría de las bacterias patógenas requieren nutrientes complejos similares en composición a los líquidos orgánicos del cuerpo humano. Por eso, la base de muchos medios de cultivo es una infusión de extractos de carne y Peptona a la que se añadirán otros ingredientes. El Agar es un elemento solidificante muy empleado para la preparación de medios de cultivo. En los diferentes medios de cultivo se encuentran 17 18 numerosos materiales de enriquecimiento como hidratos de carbono, suero, sangre completa, bilis, etc. Los hidratos de Carbono se adicionan por dos motivos fundamentales: para incrementar el valor nutritivo del medio y para detectar reacciones de fermentación de los microorganismos que ayuden a identificarlos. El suero y la sangre completa se añaden para promover el crecimiento de los microorganismos menos resistentes. Por su aspecto físico. Los medios de cultivo preparados pueden ser clasificados por su aspecto en: : Líquidos, Semisólidos, Sólidos. Y por su uso en: I.- Medios de cultivos básicos II:_ Medios de cultivos especiales como: mejorados, selectivos, diferenciales, de transporte. PROCEDIMIENTO: 1- Primeramente se desinfecta el área de trabajo con fenol al 5% o alcohol y se enciende el mechero PREPARACIÓN DE MEDIOS DE CULTIVO SÓLIDOS 1.- Leer las instrucciones del fabricante para cada medio de cultivo y pesar la cantidad necesaria según el volumen requerido. 2.- Colocar el medio en un vaso de precipitado que contenga el agua destilada en el volumen requerido, agitar y calentar a ebullición para disolver el Agar. En el último paso se debe tener cuidado ya que el recipiente se calienta en exceso y el producto tiende a hervir y proyectarse, lo cual puede producir serias quemaduras. El Agar disuelto hace transparente al medio que originalmente estaba turbio. Puede utilizarse un baño maría para aumentar la solubilidad. 3.- Si se va a envasar en cajas de petri, es necesario conservar el medio en un matraz y esterilizarlo a 121·C durante 15 minutos. Al terminar, es conveniente mantener el mecher o encendido para formar un área de esterilidad al momento del vaciado en las cajas de petri aproximadamente de 15 ml. A 20 ml De Agar por caja procurando que no se forman burbujas. Tapar la caja inmediatamente 4.- Si se desea que el Agar quede en tubos, entonces se esterilizará el Agar directamente en ellos a 121·C durante 15 minutos tapados con algodón, gasa y papel estraza. Si desea que solidifiquen inclinados, colocarlos en una superficie lisa inclinándolos en un ángulo de 20 a 30 · sobre una varilla de vidrio. 5.- . Para preparar el Agar base Sangre es necesario Adicionar e n condiciones d e asepsia sangre desfibrinada estéril en concentración final de 15%. Después de la e sterilización d el Agar base Mezclar cuidadosamente y poner en cajas petri estériles. 18 19 A) VACIADO EN CAJAS DE PETRI 3.- No destapar las cajas de petri, sino hasta el momento que vayan a ser utilizadas. Es conveniente colocarse un cubre bocas la persona que va a realizar el vaciado y evitar hablar en todo momento para no contaminar el medio de cultivo. 4.- Es conveniente mantener el mechero encendido y trabajar cerca del área estéril al momento del vaciado en las cajas de petri. Levantar la tapadera de la caja petri con la mano izquierda , sin soltarla y sin retirarla demasiado de la base de la misma caja mientras que con la mano derecha tomar el matraz que contiene el medio de cultivo y realizar el vaciado de aproximadamente 15 ml. A 20 ml de Agar por caja procurando que no se forman burbujas, se procede a tapar la caja inmediatamente 5.- Si se forman burbujas, tomar el mechero, flamear el medio de cultivo sobre la superficie de la caja de petri y de manera rápida. Se procede a tapar la caja. 6.- Esperar a que el medio solidifique, Se rotulan los medios de cultivo, anotando la fecha y con iniciales el tipo de medio de cultivo. Si las placas no se van a utilizar el mismo día se sujetan con cinta y se colocan en el refrigerador de manera invertida para evitar que el vapor condensado caiga sobre el medio de cultivo y lo pueda contaminar 7.- Cuando se vayan a utilizar los medios de cultivo preparados, será necesario secar las placas invertidas en estufa a 37 °C. Antes de realizar el sembrado de microorganismos. CUESTIONARIO 1.- ¿Qué es un medio de cultivo? ________________________________________________________________________________ 2.- Qué es un cultivo de microorganismo? ________________________________________________________________________________ ________________________________________________________________________________ 3.- Qué finalidad tiene utilizar medios de cultivo sólidos? ________________________________________________________________________________ ________________________________________________________________________________ 4.- Escribe el nombre de 5 medios de cultivo que pueden ser empleados en el laboratorio de microbiología. ________________________________________________________________________________ ________________________________________________________________________________ 19 20 5.- De dónde es obtenido el extracto Agar- Agar para la preparación de medios de cultivos?________________________________________________________________________ 6.- Por qué es necesario esterilizar la mesa entes de realizar el vaciado del medio de cultivo en las cajas de petri? ________________________________________________________________________________ ________________________________________________________________________________ 7.-Por qué la base de muchos medios de cultivo es una infusión de extractos de carne y Peptona?________________________________________________________________________ ________________________________________________________________________________ 8.- Escribe la composición química para cada medio de cultivo que utilizaste. Agar nutritivo Hinton Agar base sangre Miuller Agar Macconkey Agar- Manitol- Sal- Agar OBSERVACIONES. Dibuja todos los pasos realizados en la preparación de los medios de cultivo. CONCLUSIONES: ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 20 21 PREPARACIÓN DE MEDIOS DE CULTIVO LÍQUIDOS Práctica No 4 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Prof. de Laboratorio_________________________________ Calif:___________ OBJETIVO: El alumno aprenderá la técnica del vaciado en placa del medio de cultivo preparado en la sesión anterior en cajas de petri ya esterilizadas además preparará medios de cultivo líquido estéril. MATERIAL 3 Telas de asbesto 3 Tripies o soportes Universales 2 Mecheros Fisher 2 Agitadores 2 Vasos de precipitado de 250 ml 2 Espátulas 2 Vidrio de reloj Tubos de ensaye 20 X 200 mm Tapones de algodón Autoclave u olla de presión Papel estraza Equipo para Baño María SUSTANCIAS Medio de cultivo para caldo nutritivo Medio de cultivo para caldo triptona Fenol al 5% INTRODUCCIÓN CLASIFICACIÓN DE LOS MEDIOS DE CULTIVO: Para el aislamiento, estudio y clasificación de los microorganismos, es necesario utilizar un medio de cultivo en el que dispongan de las sustancias orgánicas e inorgánicas necesarias indispensables para el normal desarrollo de su metabolismo. En estos medios, los microorganismos además de poder multiplicarse, pueden manifestar características de crecimiento y propiedades bioquímicas; aspectos de gran importancia para su clasificación. Estos preparados estériles que poseen los elementos necesarios para el desarrollo de un microorganismo, se denominan medios de cultivos y pueden dividirse por su: A) ASPECTO: Medios líquidos. Se emplean fundamentalmente para:- Cultivar los microorganismos y obtener grandes cantidades de los mismos o bien la producción de metabolitos específicos 21 22 La multiplicación bacteriana en los medios de cultivos líquidos se manifiesta generalmente por el enturbiamiento de éste;.- Estimular y promover la selección de algún o algunos microorganismos e impedir que otros se multipliquen.- Identificar al microorganismo estudiado mediante pruebas bioquímicas. Medios semisólidos.- Se utilizan para identificaciones bioquímicas y averiguar si el germen estudiado es móvil. Los medios semisólidos tienen una consistencia blanda. Medios sólidos.Se utilizan para obtener colonias aisladas de microorganismos. Los medios sólidos constituyen la mayor parte de los medios de cultivo que se emplean en Microbiología. , En los medios de cultivos sólidos la multiplicación bacteriana se manifiesta por una formación macroscópica denominada colonia bacteriana, que es el resultado de la multiplicación de una sola célula bacteriana. B) USO I.- Medios de cultivos básicos. Se caracterizan por ser pobres en material nutritivo, de manera que su uso es muy restringido, constituyen la base para la preparación de otros medios. Como ejemplo pueden citarse el caldo peptonado y el Agar-Agar corriente. II:_ Medios de cultivos especiales. Entre estos se encuentran: a) Medios mejorados. En general son los mismos medios básicos a los que se les agrega una sustancia enriquecedora como sangre, suero, etc. El uso de estos medios es universal y está orientado especialmente a obtener buen desarrollo de cualquier tipo de bacteria, se utilizan en primera instancia en el aislamiento bacteriano, ya sea a partir de otros cultivos o de productos patológicos.Los medios de este tipo de uso más frecuente son: Agar tripticasasangre, caldo tripticasa, Agar chocolate, medio de Mueller-Hinton. b) Medios selectivos . Son medios que contienen sustancias que impiden o limitan el crecimiento de algunas especies microbianas y permiten el desarrollo de otras. consiste en aislar un microorganismo de un sustrato que contiene numerosas otras especies.Se incluyen en este grupo el agar cristal violeta para el aislamiento de bacterias Gram(-) y el agar telurito de potasio para el aislamiento de bacterias Gram(+). c) Medios de cultivos diferenciales . Se emplean para demostrar alguna propiedad bioquímica de la bacteria como degradación de hidratos de carbono, proteínas, hidrólisis de la urea, etc., contienen indicadores de ácido base, redox o sustancias que detectan cambios en el medio o en las características típicas de las colonias el estudio en estos medios debe realizarse empleando cepas bacterianas puras. Existen numerosos medios de este tipo, de uso preferencial en la bioidentificación de bacilos Gram(-) ya que ellos no tienen características muy distintivas en las colonias o cultivos en general. Entre los de uso más corriente se encuentran: Agar fierro-triple-azúcar (TSI agar Medio de SIM, Caldo glucosado fosfatado, Voges-Proskauer o del rojo de metilo, Medio agar-citrato de sodio (Medio de Simmons- Medio caldo urea, d) Medios de transporte. Sirven para transportar los especimenes que contienen a los microorganismos, del sitio de la toma del producto hasta el laboratorio donde va a 22 23 efectuarse el estudio. Estos medios impiden que se altere la proporción original de la flora microbiana en los especimenes. PROCEDIMIENTO: B) PREPARACIÓN DE MEDIOS DE CULTIVO LÍQUIDOS * Preparar caldo nutritivo y caldo triptona 1.- Leer las instrucciones del fabricante y pesar la cantidad necesaria según el volumen de medio de cultivo requerido. 2.- Disolver el medio en agua destilada agitando el recipiente 3.- Envasar el volumen necesario en matraces, tubos u otros recipientes. Procurar que el volumen del medio no rebase la mitad de la capacidad del recipiente, pues de otra manera el medio se puede regar 4.- Tapar el recipiente con algodón, gasa y papel estraza. 5.- Esterilizar en autoclave a 121·C durante 15 minutos, a menos que se indique otra cosa. 6.- antes de usar el medio de cultivo, se debe someter a una prueba de esterilidad, para lo cual se debe meter a una estufa a 37·C durante 24 horas. El medio debe permanecer libre de crecimiento. CUESTIONARIO 1.- Qué es un medio de cultivo? ________________________________________________________________________________ ________________________________________________________________________________ 2.- Qué tipo de nutrientes requieren los microorganismos para poder crecer en un medio de cultivo? ________________________________________________________________________________ ________________________________________________________________________________ 3.- ¿ Cómo nos podemos dar cuenta que existió crecimiento de microorganismos en un medio líquido? 4.-¿Cómo se manifiesta el crecimiento de los microorganismos en un medio de cultivo sólido? ________________________________________________________________________________ ________________________________________________________________________________ 5.-¿Cuál es el elemento principal del medio de cultivo que favorece su solidificación? ________________________________________________________________________________ ________________________________________________________________________________ 23 24 6.- De acuerdo a su uso ¿ Qué tipo de medios de cultivos podemos encontrar en el mercado? ________________________________________________________________________________ ________________________________________________________________________________ 7.- Escribe dos ejemplos de medios selectivos encontrados en el laboratorio en donde puedan desarrollarse los microorganismos ________________________________________________________________________________ ________________________________________________________________________________ 8,. Qué finalidad tiene guardar invertidos los medios de cultivo ya preparados en las cajas de petri en el refrigerador o en la estufa de incubación? ________________________________________________________________________________ ________________________________________________________________________________ 9.- Escribe dos medios de cultivos que nos permiten determinar alguna prueba bioquímica______________________________________________________________________ ________________________________________________________________________________ OBSERVACIONES: Dibuja todos los pasos del proceso de vaciado del Agar en cajas de petri esterilizadas CONCLUSIONES:________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ _______________________________________________________________________________ 24 25 SEMBRADO EN PLACA DE MICROORGANISMOS DEL MEDIO AMBIENTE Práctica No 5 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio_________________________________ Calif:___________ OBJETIVOS - Observar la gran variedad de microorganismos presentes en el medio ambiente, determinando las diferentes morfologías de colonias que se obtienen. Los efectos de un desinfectante por medio del crecimiento de colonias de bacterias en un medio de cultivo en cajas de Petri. MATERIAL 3 cajas de Petri estériles preparadas con Agar nutritivo Caja de hisopos estériles sin abrir toallas de papel 3 cajas de petri estériles preparadas con Agar sangre. Cinta pegante Marcador permanente o lápiz de cera Un desinfectante con 70% de solución de alcohol, 10% de una solución blanqueadora , jabón líquido Extran o alkox. INTRODUCCIÓN La población microbiana existente en nuestro entorno es grande y compleja. Cientos de especies microbianas habitan normalmente en distintas partes de nuestro cuerpo, incluidas la boca, el tracto intestinal y la piel. Al nacer, los microbios inmediatamente empiezan a colonizar nuestros cuerpos, así como a casi todos los objetos del mundo. Ellos flotan alrededor hasta que entran en contacto con una superficie que ofrezca comida y resguardo. Se encuentran más frecuentemente en la oscuridad, en objetos húmedos que a menudo entran en contacto con la comida, la suciedad o la vegetación. Las superficies del baño, los cepillos para el cabello, los refrigeradores, los lavaplatos y las tablas de cocina tienen a menudo muchos microbios. Las manijas y las paredes tienen menos porque son pobres en nutrientes y secos. Un estudio adecuado de microorganismos que hay en estos hábitat requiere técnicas que permitan conocer y ordenar la compleja población mixta o cultivo mixto, separándole en sus distintas especies como cultivos puros. Un cultivo puro consta de una población de células derivadas todas ellas de una célula parental. Los microorganismos se cultivan en el laboratorio sobre materiales nutritivos denominados medios. Se dispone de una gran cantidad de medios y la clase que se debe de utilizar depende de muchos factores, uno de los cuales es la clase de microorganismos que se va a cultivar. El material que se inocula 25 26 sobre el medio se denomina inóculo mediante alguna técnica (siembra por estría en placa o siembra en masa en placa). Durante la incubación a 37:C , las células microbianas individuales se reproducen tan rápidamente que en un lapso de 18 a 24 horas producen masas visibles de células denominadas colonias. Una colonia es visible a simple vista. Cada colonia diferente es presumiblemente un cultivo puro de una sola clase de microorganismo. Si dos células microbianas procedentes del inóculo original quedan muy cerca una de otra sobre el medio de Agar, la masa de células observables no será un cultivo puro. La mayoría de los microbios en nuestro cuerpo y otras superficies son inofensivas, pero algunos son patógenos o causan enfermedad. Por esta razón, queremos controlar el número de microbios que nos rodea. La posibilidad de infectarnos aumenta con el número de microbios en los objetos circundantes. Pero ¿qué podemos hacer para reducir el número de microbios en las superficies que nos rodean? PROCEDIMIENTO En esta actividad escogerás un fomite (cualquier objeto inanimado que pueda causar enfermedad en los organismos por contener microorganismos como: la manija, el marco, el control remoto de la televisión, una moneda). Este fomite ayudará a confirmar la presencia de microbios y los efectos de un desinfectante por medio del crecimiento de colonias de bacterias en un medio de cultivo en cajas de Petri. 1. Si tienes el cabello largo, recógetelo para mantenerlo lejos de las cajas de Petri cuando estés trabajando. Lava tus manos. Limpia tú área de trabajo frotando suavemente, con la solución desinfectante en una toalla de papel. Saca tus cajas de Petri pero no abras las cajas hasta que se te indique. 2. Escoge un objeto del salón de laboratorio (la manija, el marco, el control remoto de la televisión, una moneda, etc.). Toma una caja de Petri sin abrir y con tú lápiz de cera o marcador, divide la base de la caja en cuatro secciones iguales. Escribe el nombre del objeto al otro lado y designa las secciones de 1 hasta 4. Abre la caja de hisopos de algodón y escoge uno con cuidado para no tocar la punta. Limpia tú objeto escogido con todos los lados de la punta del hisopo volteándolo y retorciendo el hisopo a medida que lo mueves por la superficie del objeto. 3. Ahora abre la tapa de la caja y suavemente haz cuatro siembras sobre la superficie de la caja como se muestra en la ilustración, empezando en la sección designada "1" y continuando en el orden de las secciones, de manera que la última siembra esté en la sección 4. Presiona firme pero suavemente y no retiñas las siembras anteriores. Tus siembras sólo deben dejar una impresión muy ligera en el Agar. Cierra la caja y séllala con dos pedazos de cinta. No cubras la caja con cinta o no podrás verla bien. 26 27 4. Divide una segunda caja de Petri en 4 secciones numeradas de 1 hasta 4 y desígnala “Control.” Limpia la mitad del objeto que escogiste anteriormente con una toalla de papel humedecida con agua-solo frótala un par de veces; no la restriegues. Con un nuevo hisopo estéril, toma muestra del área limpiada. Abre la tapa de la segunda caja y haz SUAVEMENTE 4 siembras en la superficie de la caja, siguiendo el orden de las secciones numeradas como lo hiciste previamente. Cierra la caja y séllala. 5. Divide la tercera caja de Petri en 4 secciones numeradas y desígnalas con el nombre del desinfectante que escogiste (por ejemplo "blanqueador"). Usa el desinfectante escogido para limpiar la otra mitad del objeto que trabajaste antes. Con un nuevo hisopo estéril, toma muestra del área. Repite el proceso de sembrar la caja. Ciérrala y séllala. 6. Esteriliza los hisopos usados con desinfectante y descártalos. Pon las cajas en un lugar apartado y déjalas incubar a la temperatura de 37·C durante 24 a 48 horas. Limpia tu área de trabajo con la solución desinfectante y lava tus manos. 7.- Repite todo el experimento utilizando Cajas de cultivo con Agar sangre sólo que ahora selecciona otro Fomite que no hayas empleado 7. Después de que hayan pasado dos días, mira las cajas de Petri iniciales. No la abras. A la vez examina las otras cajas de Petri sin abrirlas. Crea una tabla que compare las cajas sembradas antes y después de limpiar el objeto (mira la tabla de ejemplo). Asegúrate de indicar si los microbios crecieron en cada siembra. 8. Nota: un adulto supervisor debe hacer este paso preferiblemente. Cuidadosamente abre las cajas de Petri en un lavaplatos e inúndalas con blanqueador o alcohol sin diluir. Déjalas por una hora y enjuágalas completamente; colócalas en una bolsa plástica, amárrala y descártala. Asegúrate de no tocar la superficie de las cajas cuando las abras y lava tus manos cuidadosamente después de manipularlas. Limpia tú área de trabajo con la solución desinfectante. CUESTIONARIO 1.- Qué es un cultivo puro de microorganismos? ________________________________________________________________________________ ________________________________________________________________________________ 2.- Qué es in inóculo? ________________________________________________________________________________ ________________________________________________________________________________ 3.- Físicamente en un medio de cultivo de microorganismos cuando se dice que no forma un cultivopuro? ________________________________________________________________________________ ________________________________________________________________________________ 4.- Qué tipo de técnica empleaste para la siembra de microorganismos? ________________________________________________________________________________ 27 28 5.- ¿En cuál caja crecieron más y más grandes las colonias? ¿Por qué piensas eso? ________________________________________________________________________________ ________________________________________________________________________________ 6.-¿Cómo es el patrón que observas en el tamaño y cantidad de colonias en cada caja? ________________________________________________________________________________ ________________________________________________________________________________ 7.- ¿Cómo podemos controlar la contaminación microbiana? ________________________________________________________________________________ ________________________________________________________________________________ 8.- Completa en la siguiente tabla anotando X en los espacios correspondientes a las divisiones realizadas en donde hayan crecido los microorganismos A) MEDIOS DE CULTIVO CON AGAR NUTRITIVO Caja 1 Siembra 1 2 Caja 2 3 4 1 2 Caja 3 3 4 1 2 3 4 3 4 Crecimiento B)MEDIOS DE CULTIVO CON AGAR SANGRE Caja 1 Siembra 1 2 Caja 2 3 4 1 2 Caja 3 3 4 1 2 Crecimiento OBSERVACIONES: Dibuja todos los pasos empleados en el sembrado de las cajas de petri con Agar nutritivo. Y los resultados de las colonias bacterianas que crecieron. CONCLUSIONES______________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ _______________________________________________________________________________ 28 29 AISLAMIENTO DE HONGOS MEDIANTE EL METODO EXTENSIÓN EN PLACA Práctica No 6 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio_________________________________ Calif:___________ OBJETIVO: El alumno aislará actinomiceto del suelo mediante el método extensión en placa utilizando una varilla angular de vidrio MATERIAL MATERIAL BIOLÓGICO 1 varilla de vidrio doblada Muestra de suelo 2 pipetas de 1 ml 2 caja con medio de cultivo estéril Czapeck 5 tubos de ensayo 2 caja con medio estéril de Gelosa glicerol extracto de levadura (GGL) Asa bacteriológico 2 caja con medio estéril Gelosa peptona Dextrosa extracto de levadura (GPDL) Alcohol al 70% INTRODUCCION Uno de los problemas más frecuentes en Microbiología es el aislamiento de un cultivo puro de una especie bacteriana dada. A pesar de que es muy difícil aislar una sola célula, existen técnicas capaces de aproximar este ideal En Microbiología, todas las manipulaciones deben ser llevadas a cabo de modo que se impida cualquier tipo de contaminación en el área de trabajo. Los procedimientos utilizados par conseguirlo se conocen con el nombre de técnica aséptica, y se citan a continuación: -Las asas deben esterilizarse antes de utilizarlas y enfriarse sobre el agar o el material de vidrio (en zonas estériles) antes de tomar la muestra de microorganismos, con objeto de no destruirlos por calor. -Después de utilizarlas, las asas se vuelven a esterilizar. -Las bocas de los tubos y matraces de vidrio se flamean ligeramente una vez destapadas, y después de la inoculación. -Durante la inoculación, los tapones se mantienen en la mano sujetándolos por la parte que no entra en contacto con tubos y matraces. -Los tubos abiertos deben mantenerse en posición inclinada para que el riesgo de contaminación sea mínimo. -Las tapas de las placas Petri no deben colocarse nunca sobre la mesa de trabajo. Técnicas de siembra La siembra de microorganismos puede realizarse en medios líquidos o en medios sólidos. En el primer caso, para la inoculación se utilizará asa estéril si el medio de partida es sólido, o pipeta estéril (Pasteur o graduada) si es líquido. 29 30 En el segundo caso, cuando se parte de otro medio sólido, se utiliza el asa de platino normal para siembra en placa o tubo inclinado y el asa recta para siembra en picadura en tubos rectos o, en general, cuando se quiere introducir el microorganismo en el seno del medio de cultivo sólido; cuando el medio de partida es líquido, se puede pasar al medio sólido con un asa de platino calibrada, con la que se extiende la muestra directamente, o con pipeta (Pasteur o graduada), depositando la muestra que luego se extenderá sobre la placa con un asa de Digralsky. O con una varilla doblada. En general, en Microbiología se trabaja con cultivos puros de microorganismos. Un cultivo puro es aquél en que todas las células provienen de una sola célula inicial. Una colonia de cualquier microorganismo es un cultivo puro, ya que todas sus células proceden de una inicial; por lo tanto, cuando se desea aislar un microorganismo de una muestra cualquiera, es preciso ver colonias del mismo, lo que implica que el aislamiento ha de realizarse en medio sólido en placa. Los pasos de un proceso de aislamiento de una especie microbiana se pueden resumir en los siguientes: -Siembra en placa de la muestra de partida. -Tomar una colonia de la placa una vez incubada, resuspenderla en agua estéril y sembrar una segunda placa, en la que todas las colonias que crezcan deben ser idénticas. -A partir de la segunda placa se puede resuspender una de las colonias en medio líquido, consiguiéndose ya un cultivo puro. -Para la conservación de los cultivos puros de un microorganismo existen diversos métodos, el más simple es la resiembra en tubos inclinados que se mantienen, normalmente refrigerados, durante 3-6 meses. PROCEDIMIENTO 1.- Hacer diluciones decimales a partir de la muestra de suelo hasta 10 -5 2.- Sólo vas a necesitar las últimas dos diluciones es decir: 10 -4 , 10 –5 las demás se desecharán. 3.- Rotula dos cajas de petri con el nombre del medio de cultivo Czapeck en una anota la dilución 10-4, y en la otra anota la dilución 10-5 4.- Rotula dos cajas de petri con el nombre del medio de cultivo (GGL) en una anota la dilución 10-4, y en la otra anota la dilución 10-5 5.- Rotula dos cajas de petri con el nombre del medio de cultivo (GPDL) en una anota la dilución 10-4, y en la otra anota la dilución 10-5 6.- Esteriliza el asa bacteriológica en el mechero, espera que se enfríe cerca del área estéril e introdúcela en la dilución 10-4 7.- Coloca una gota de esta dilución 10-4 en el centro de la superficie del Agar en el primer medio de cultivo Czapeck., tapa la caja de petri 8.- Vuelve a introducir en la misma dilución 10-4 y coloca una gota en el siguiente medio (GGL), repite lo mismo y coloca una gota en el tercer medio de cultivo (GPDL) . No olvides tapar las cajas para evitar que se contamine. 9.-Esteriliza el asa bacteriológica y ahora introdúcela en la dilución 10 -5 repite los pasos anteriores, pero ahora para todas las cajas que están rotuladas con la dilución 10 -5 No olvides tapar los medios de cultivo. 30 31 10.- Vierte una o dos gotas de alcohol al 70% sobre el brazo más corto de la varilla de vidrio y con el mechero enciende el alcohol que se encuentra en la varilla . Permite que arda hasta que se queme todo el alcohol. Deja que la varilla de vidrio se enfríe por un minuto 11.- Utiliza el brazo corto de la varilla para dispersar uniformemente la gota de cada dilución sobre toda la superficie de cada placa de Agar inicia con las diluciones 10 -5 12.- Invierte la caja de petri, incúbala a temperatura de 37ºC por 24 horas. CUESTIONARIO 1.- A qué grupo de microorganismos pertenecen los actinomicetos? _______________________________________________________________________________ 2.- ¿Para qué son utilizados en el área médica los actinomicetos? ________________________________________________________________________________ ________________________________________________________________________________ 3.-Qué tipo de técnica utilizaste para sembrar a estos microorganismos? ________________________________________________________________________________ 4.- Menciona otra técnica para aislar cultivos puros de microorganismos? ________________________________________________________________________________ 5.- ¿Cuál fue la finalidad de quemar el alcohol sobre la varilla de vidrio? ________________________________________________________________________________ ________________________________________________________________________________ 6.- ¿Por qué iniciaste a distribuir con la varilla en forma uniforme las diluciones l0 -5 que contenían a los microorganismos y no con las diluciones de l04? ________________________________________________________________________________ ________________________________________________________________________________ 7.-¿Qué apariencia presentaron las colonias después del tiempo de incubación? ________________________________________________________________________________ ________________________________________________________________________________ 8.- Esquematiza el proceso de dilución para la muestra de tierra que realizaste 31 32 OBSERVACIONES Dibuja todo el proceso llevado a cabo para el aislamiento del cultivo puro de microorganismo por extensión en placa, así como los resultados obtenidos al cabo de 24 horas. CONCLUSIONES ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 32 33 AISLAMIENTO DE BACTERIAS MEDIANTE EL METODO SIEMBRA EN PLACA POR ESTRÍAS Práctica No 7 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio_________________________________ Calif:___________ OBJETIVO: Demostración de los medios de defensa del huésped en la piel y garganta mediante el método de siembra en placa por estría. MATERIAL Cajas de petri con Agar- Sangre (GS) Cajas de petri con Manitol sal Agar (MSA) Cajas de petri con Agar vogel y Jonson (AVJ) Cajas de petri con Agar Estafilococo S110 Mechero Fisher Asa de platino Hisopos estériles MATERIAL BIOLÓGICO Exudado faringeo Solución salina estéril Raspado de piel INTRODUCCIÓN La piel (en condiciones normales) es una barrera que impide la penetración de los gérmenes, por ello actúa como mecanismo de defensa. Los mamíferos son frecuentemente infectados por algunas de las bacterias preexistentes en su medio ambiente, aunque en general viven en equilibrio con estos microorganismos, manteniéndoles limitados a zonas relativamente superficiales de su organismo. Sin embargo las bacterias infecciosas producen enfermedades al invadir tejidos más profundos. Por lo tanto para mantener la salud, el huésped debe defenderse constantemente frente a la invasión por parte de las bacterias. Los factores mecánicos, químicos y microbianos desempeñan un papel importante al restringir la colonización de las bacterias a las superficies corporales. Factores mecánicos: Las superficies epiteliales de la piel y de las mucosas constituyen barreras que resultan más o menos impermeables a las bacterias. La impermeabilidad de la piel es mayor que en la mayoría de las mucosas. Cuando se altera la integridad de la superficie epitelial, pueden desarrollarse infecciones subcutáneas. Las bacterias que causan más frecuentemente estas infecciones son las que existen habitualmente en la superficie cutánea, folículos pilosos y glándulas sudoríparas en la piel, es decir los estafilococos. Factores químicos: La acidez de las secreciones gástricas mantienen sin duda la esterilidad habitual del estómago. El Ph bajo de la piel (3-5), debido en gran parte a los productos ácidos del metabolismo bacteriano, frena sin duda el crecimiento de muchos microorganismos que toman contacto con sus superficie 33 34 Factores microbianos: El antagonismo microbiano inhibe el crecimiento de muchas bacterias y hongos potencial mente patógenos en lugares superficiales donde de no ser así, podrían producirse enfermedades. La flora de la región faríngea presenta problemas peculiares para el aislamiento e identificación de microorganismos, por lo tanto se refiere a los componentes de la flora normal como a microorganismos con acción patógena. Es importante recordar que algunos microorganismos tienen capacidad patógena definida y su presencia es un indicio claro de enfermedades, en tanto que otros, llamados oportunistas, guardan una posición ambigua y pueden encontrarse tanto como componentes de la flora normal, como asociados a procesos patológicos, causados por otros microorganismos que son verdaderos responsables (por ejemplo los virus) Los estafilococos están entre las primeras bacterias que se reconocieron como patógenas, y se descubrieron por primera vez a principios de la década de1880. Se encuentran ampliamente distribuidos por la naturaleza, y a menudo forman parte de la flora bacteriana de la piel y el tracto respiratorio superior; muchas de las especies que se encuentran en el hombre son comensales. La especie predominante patógena para el hombre es el staphylococcus aureus, constituye la causa más común de las infecciones supurativas para el hombre. El aislamiento de S. aureus a partir del exudado faríngeo y exudado de piel, no tiene importancia diagnóstica, ya que se considera parte de la flora normal de la faringe y nasofaringe, por lo que no tiene significado clínico. PROCEDIMIENTO: 1.- Limpiar y esterilizar el área a trabajar con fenol al 5% 2.- Prender el mechero fischer cerca de donde se va a trabajar, si es posible colocar otro 3.- Humedecer el hisopo en solución salina estéril, pasarlo sobre la superficie de la piel (con o sin pelo) 4.- Descargar el hisopo en dos cajas de petri con el medio ya preparado. (Es recomendable que para cada dos cajas se utilice un solo hisopo con muestra). No retires completamente las tapas de los medios de cultivo para evitar que se contaminen 5.- quemar el hisopo y tirarlo. 6.- Esteriliza el Asa de platino hasta el rojo vivo, enfríalo introduciéndolo en un extremo del Agar 7.- Realiza el sembrado de los microorganismos por el método de estría utilizando el asa y como se muestra en la figura. Evita destapar completamente la tapa de los medios de cultivo. 8- Repetir el mismo proceso con otro hisopo estéril y con solución salina para otras dos cajas . siembra por estría utilizando el Asa de platino y así hasta que se terminen se sembrar todos los medios preparados. 9.- Incubar a 37ºC por 24-48 horas y observar resultados. 10.- Repite el mismo procedimiento pero ahora toma muestra de la faringe con hisopos estériles en las zonas afectadas como: amígdalas, pared posterior de la faringe, en general cualquier área que manifiesta signos de inflamación, exudados y úlceras, procurando no tocar con el hisopo la lengua. 34 35 INTERPRETACIÓN DE RESULTADOS: A) REACCIONES POSITIVAS EN DISTINTOS MEDIOS GELOSA SANGRE Para el aislamiento, cultivo y detección de actividad hemolítica de Staphylococcus, Streptococcus y otros microorganismos fastidiosos. Se observan colonias blancas casi grises, Grandes, convexas de consistencia butirácea, Presentan bordes regulares. Se observa que Presenta hemólisis. Las colonias en medio sólido son redondeadas, uniformes, Estos crecen rápidamente a 37 C pero tienden a formar pigmentos mejor a temperatura ambiente (20 C). MANITOL SAL AGAR (MSA) Se utiliza como medio selectivo, para cultivar y enumerar especies clínicas de estafilococos El manitol cuando es utilizado por los microorganismos, vira de su color original rojo a amarillo. Se observan colonias chicas, blancas, convexas, de consistencia butirácea , presentan bordes irregulares. S. aureus Manitol sal Colonia amarilla S. epidermidis Manitol sal Colonia incolora AGAR VOGEL Y JONSON (AVJ) Para la detección de Staphylococcus aureus coagulasa-positivo, se observan colonias negras Pequeñas. bordes irregulares con halo amarillo. Para S. epidermidis y otros Pequeñas, negro-grisáceos, sin halo, El medio presenta un vire de rojo pálido a amarillo. ESTAFILOCOCO S110 S110 Colonias blancas un poco amarillentas, Se observan colonias chicas, convexas, De consistencia butirácea y bordes Regulares. 35 36 B) DESCRIPCIÓN DEL TIPO DE COLONIAS OBTENIDAS Observar las colonias obtenidas y describirlas teniendo en cuenta las siguientes características: .FORMA: puntiforme, circular, rizoide, irregular, filamentosa. .TAMAÑO: grande (más de 3 Mm.), mediana (2-3 Mm.), pequeña (1-2 Mm.) .COLOR. Reportar el color final después de la incubación .BORDE: entero, ondulado, lobulado, filamentoso, ondeado .ELEVACIÓN: plano, elevado, convexo, pulvinado, umbonado .SUPERFICIE: suave, brillante, rugosa, plegada, seca, polvorienta CUESTIONARIO: 1.- ¿Cuándo los microorganismos pueden causar daño en nuestro organismo? _____________________________________________________________________________ _____________________________________________________________________________ 2.- Qué tipo de bacterias son encontradas con mayor frecuencia en nuestra piel y que pretenden aislarse en esta práctica? _____________________________________________________________________________ 3.-¿ Qué finalidad tiene humedecer el hisopo con solución salina estéril? _____________________________________________________________________________ _____________________________________________________________________________ 4.- ¿Por qué no es recomendable utilizar el mismo hisopo para descargar en las cinco cajas de petri con los medios ya preparados? _____________________________________________________________________________ _____________________________________________________________________________ 5.- ¿Por qué se recomienda enfriar el asa de platino en el medio de cultivo ya preparado antes de realiza el sembrado por estrías de los microorganismos? 36 37 _____________________________________________________________________________ _____________________________________________________________________________ 6 ¿En qué cosiste el aislamiento por estrías? _____________________________________________________________________________ _____________________________________________________________________________ 7.- Después de haber incubado a 25·C por 48 horas describe las colonias obtenidas en cada medio de cultivo utilizado GELOSA SANGRE .FORMA: .TAMAÑO: .COLOR. .BORDE: .ELEVACIÓN: AGAR VOGEL Y JONSON (AVJ) .FORMA: .TAMAÑO: .COLOR. .BORDE: .ELEVACIÓN: MANITOL SAL AGAR (MSA) FORMA: TAMAÑO: COLOR: BORDE: ELEVACIÓN: ESTAFILOCOCO S110 FORMA: TAMAÑO: COLOR: BORDE: ELEVACIÓN: OBSERVACIONES:. Dibuja y colorea todos los resultados obtenidos después de las 48 horas de haber sido incubados. CONCLUSIONES: ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 37 38 MANEJO Y USO DEL MICROSCOPIO ÓPTICO COMPUESTO Práctica No 8 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio__________________________________ Calif:__________ OBJETIVO El alumno reconocerá el microscopio compuesto, identificará cada una de sus partes y lo manejará correctamente observando la Presencia de microorganismos en muestras biológicas MATERIAL. Microscopio compuesto Porta y cubre objetos Palillo Hisopo MATERIAL BILÓGICO Sarro dental Muestra de orina Muestra de Excremento SUSTANCIAS Sol. Salina. NaCl al 0.85% Sol. de yodo-lugol INTRODUCCION. El microscopio es el instrumento más frecuentemente utilizado y el más útil en un laboratorio de microbiología, proporciona la amplificación o agrandamiento que nos permite ver organismos y estructuras invisibles a simple vista. Los microscopios permiten una amplia gama de amplificaciones, desde cien veces a cientos miles de veces. Las dos categorías de microscopios disponibles son los microscopios ópticos y los microscopios electrónicos. Los microscopios ópticos utilizan un sistema de lentes ópticas y comprenden los microscopios de campo claro, campo oscuro, fluorescencia y contraste de fases. Los microscopios electrónicos emplean haces de electrones en lugar de ondas de luz para producir una imagen ampliada. MANEJO Y USO DEL MICROSCOPIO ÓPTICO 1. Colocar el objetivo de menor aumento en posición de empleo y bajar la platina completamente. Si el microscopio se recogió correctamente en el uso anterior, ya debería estar en esas condiciones. 2. Colocar la preparación sobre la platina sujetándola con las pinzas metálicas. 3. Comenzar la observación con el objetivo de 4x (ya está en posición) o colocar el de 10 aumentos (10x) si la preparación es de bacterias. 4. Para realizar el enfoque: a. Acercar al máximo la lente del objetivo a la preparación, empleando el tornillo macrométrico. Esto debe hacerse mirando directamente y no a través 38 39 del ocular, ya que se corre el riesgo de incrustar el objetivo en la preparación pudiéndose dañar alguno de ellos o ambos. b. Mirando, ahora sí, a través de los oculares, ir separando lentamente el objetivo de la preparación con el macrométrico y, cuando se observe algo nítida la muestra, girar el micrométrico hasta obtener un enfoque fino. 5.- Pasar al siguiente objetivo. La imagen debería estar ya casi enfocada y suele ser suficiente con mover un poco el micrométrico para lograr el enfoque fino. Si al cambiar de objetivo se perdió por completo la imagen, es preferible volver a enfocar con el objetivo anterior y repetir la operación desde el paso 3. El objetivo de 40x enfoca a muy poca distancia de la preparación y por ello es fácil que ocurran dos tipos de percances: incrustarlo en la preparación si se descuidan las precauciones anteriores y mancharlo con aceite de inmersión si se observa una preparación que ya se enfocó con el objetivo de inmersión. PROCEDIMIENTO TECNICAS DE MONTAJE HÚMEDO La gota pendiente o las preparaciones húmedas permiten examinar organismos vivos suspendidos en un fluido. Las preparaciones húmedas se hacen colocando una gota del fluido que contiene el organismo sobre una lámina de vidrio y cubriéndola con una fina pieza de vidrio (cubreobjetos): para reducir la tasa de evaporación y eliminar corrientes de aire, generalmente se rodea la gota con vaselina. Cuando se examinan las preparaciones húmedas por microscopía de campo claro, es importante ajustar la fuente de luz de forma adecuada. Es posible disminuir la intensidad de la luz mediante la utilización de filtros especiales. MONTAJE EN SOLUCION SALINA FISIOLÓGICA (NaCl 0.85%) O AGUA Utilizada para estudiar la movilidad de las bacterias A) 1.- En el centro de un portaobjetos coloca una gota de solución salina 2.- Con un hisopo toma muestra de sarro dental de un compañero que no se haya lavado los dientes y colócala en la solución salina mezclando cuidadosamente 3.- . Examinar con objetivos de 40X y 60 X. B) 1.- Centrífuga aproximadamente 10 ml de orina a 2,500 rpm durante 5 minutos. 2.- Desecha el líquido sobrenadante y procede a mezclar el sedimento urinario 3.- Coloca una gota del sedimento mezclado en el centro de un portaobjetos limpio y seco 4.- Sobre el sedimento pon un cubreobjetos y observa con el objetivo de 40X y 60X C) 1.- En un tubo de 13 X 100mm coloca las tres cuartas partes de solución salina fisiológica 2.- Con un aplicador de madera toma muestra de excremento de varias partes de la muestra y deposítalo dentro del tubo con la solución salina, agita uniformemente. 39 40 3.- En un portaobjetos limpio y seco, coloca una gota de muestra preparada en los pasos anteriores 4.-Coloca un cubreobjeto sobre la preparación y observa en el microscopio con objetivo 40X y 60X MONTAJE EN SOLUCIÓN YODO LUGOL Utilizada para identificar en heces fecales Protozoos intestinales con sus organelos citoplasmáticos 1.- En un portaobjetos limpio y seco, coloca una gota de solución de yodo lugol 2.- Con un palillo de madera toma una pequeña cantidad de muestra fecal y deposítala en el portaobjetos mediante movimientos de rotación y extendiendo la muestra por toda la gota En el paso No 2 Puedes utilizar la muestra salina preparada en el inciso C e n l ugar de la muestra de excremento en forma directa 3.-Coloca un cubreobjeto sobre la preparación y observa en el microscopio CUESTIONARIO: 1.- ¿Que es poder de resolución? 2.- ¿Qué finalidad te proporciona el utilizar microscopio compuesto: ________________________-_______________________________________________________ ________________________________________________________________________________ 3.- ¿Cuál es la importancia que tiene el diafragma en el microscopio? ________________________________________________________________________________ ________________________________________________________________________________ 4.- ¿Qué tipo de bacterias pudiste observar en las muestras que se estudiaron ________________________________________________________________________________ ________________________________________________________________________________ 5.- ¿Qué importancia tiene el estudiar y observar los microorganismos en muestras biológicas? ________________________________________________________________________________ ________________________________________________________________________________ 6.- Escribe el nombre de cada una de las partes del microscopio compuesto 40 41 OBSERVACIONES. Dibuja lo observado en los diferentes objetivos para cada muestra que preparaste durante el experimento. CONCLUSIONES ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 41 42 TINCIÓN DE LA CÁPSULA BACTERIANA Práctica No 9 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio_________________________________ Calif:___________ OBJETIVO El alumno aprenderá diversas técnicas para la tinción de la cápsula bacteriana en distintos cultivos bacteriológicos. MATERIAL Cultivo de 24 horas de Klebsiella Rhinoscleromatis en Macconkey o citrato de simmons (puede aislarse del excremento seco de palomas) Cultivo de 24 horas de Staphylococcus aureus en manitol sal Agar (msa) Cepa de 24 horas en Agar Saboraud Cryptococcus neoformans. Tinta china ( recientemente filtrada) Frasco con mordente de Knaysi Frasco con rojo congo Frasco con mordente de cápsula INTRODUCCION La cápsula bacteriana es una capa de material viscoso o mucoide. El tamaño de estas cápsulas está influenciado por el medio en el que crece la bacteria. En algunos casos el grosor de la cápsula es sólo una fracción del diámetro de la célula, en otros casos la cápsula es mucho mayor que la célula. Las cápsulas bacterianas son importantes tanto para la bacteria como para otros organismos. A las bacterias les proporcionan una cubierta protectora y además sirven de reservorio de alimento almacenado. Tienen Propiedad Antifagocitaria : Dificulta o impide la fagocitosis, lo cual potencia su virulencia ya que favorece la multiplicación y facilita la invasión. Brinda Protección frente a Fagos.: Dificulta la fijación de bacteriófagos e impide el pasaje su pasaje que puedan afectar a la bacteria Las cápsulas de ciertas bacterias productoras de enfermedades aumentan la capacidad infectiva de las bacterias. Si la bacteria pierde totalmente su cápsula, puede perder su virulencia y por lo tanto su capacidad de producir enfermedad Algunos ejemplos de bacterias productoras de cápsulas son: neumococos, Klebsiella., aunque también puede estar presente en bacterias gram positivas y Gram. negativas Sin embargo las cápsulas tiene diversas propiedades como: Induce la producción de anticuerpos protectores (esto es útil en la producción de algunas vacunas) y Permite la diferenciación de tipos serológicos dentro de la misma especie ya sea por aglutinación con sueros 42 43 PROCEDIMIENTO TINCION DE CÁPSULA A) METODO DE DUGUID 1.- Poner con el asa una gota pequeña de tinta china en el centro de un portaobjetos limpio. 2.-Poner una gota de agua del mismo tamaño junto a la gota de tinta china 3.- Tomar con el Asa bacteriológica un pequeño fragmento del cultivo de bacterias 4.- Hacer una suspensión ( sin extenderla) en la gota de agua 5.- Mezclarla con la tinta china 6.- Colocar un cubreobjetos sobre la suspensión, evitando que queden burbujas 7.- Observar la preparación al microscopio con el objetivo seco fuerte y de inmersión. La cápsula se observa como una zona brillante alrededor de la bacteria en un campo oscuro. B) METODO DEL ROJO CONGO 1.- Poner una gota pequeña de rojo congo en el centro de un portaobjetos limpio 2.-Tomar con el asa bacteriológica un pequeño fragmento de crecimiento de colonia bacteriana 3.- Suspender la muestra en la gota de rojo congo y hacer un frotis 4.- cubrir el frotis ( SIN FIJARLO A LA FLAMA DEL MECHERO) con una gotas del mordente de cápsula y dejarlo actuar durante un minuto. 5.-Lavar el frotis con agua destilada y dejarlo secar al aire 6.- Observar la preparación al microscopio con el objetivo de inmersión La cápsula se observa como una zona brillante alrededor de la bacteria de color rojo en un campo de azul oscuro. CUESTIONARIO 1.- ¿Qué importancia médica tiene la cápsula bacteriana? ________________________________________________________________________________ ________________________________________________________________________________ 2.-¿Qué características presenta la cápsula en las bacterias? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 3.- ¿Qué importancia tiene la presencia de la cápsula en las bacterias? ________________________________________________________________________________ ________________________________________________________________________________ 4.- ¿Qué sucede con las bacterias cuando estas llegan a perder la cápsula? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 43 44 5.- Investiga de qué está compuesta la capa de material mucosa que forma la cápsula ________________________________________________________________________________ ________________________________________________________________________________ OBSERVACIONES Dibuja lo que observaste en ambos objetivos indicados en la práctica con el microscopio compuesto CONCLUSIONES: ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 44 45 TINCIONES SELECTIVAS Práctica No 10 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio_________________________________ Calif:___________ OBJETIVO El alumno aplicará la técnica de tinción específica para lograr observar en el microscopio la pared celular y endoesporas en distintas muestras bacteriológicas MATERIAL Cultivo de 12 a 18 horas de Bacillus Suptillus ( lacto bacilos) en Agar nutritivo y Agar sangre Cultivo de Bacillus cereus ( tierra contaminada y tratada a 80·C por 10 minutos) en Agar nutritivo y Agar sangre Cultivo de 24 horas de Staphylococcus aureus en manitol sal Agar (msa) Solución de ácido fosfomolíbdico ( 1%) Solución acuosa de verde de metilo ( 1%) Verde malaquita ( solución acuosa al 5%) Safranina ( solución acuosa al 5% ) Portaobjetos Cubreobjetos Microscopio compuesto Asa bacteriológica Mechero Bunsen INTRODUCCIÓN PARED CELULAR Debajo de las sustancias extracelulares tales como las cápsulas o capas mucosas y externas a la membrana citoplasmática está la pared celular que es una estructura muy rígida y que da forma a la célula. El espesor de la pared celular oscila entre 10 y 35 nm, sin embargo algunas paredes celulares son considerablemente más gruesas. Las paredes celulares bacterianas son esenciales para el crecimiento y la división. Todas las bacterias poseen paredes celulares rígidas que protegen a la célula de explotar en medios de baja presión osmótica. Composición química de las paredes celulares.- Los peptidoglicanos proporcionan a la pared celular una estructura rígida. Estos grandes polímeros, están compuestos de tres clases de bloques estructurales: N- Acetil-Glucosamina, Ácido N- Acetil-Murámico y un péptido que consta de cuatro o cinco aminoácidos que son: L- alanina, D-Alanina, _DÁcido Glutámico y Lisina. Además contiene proteínas con polisacáridos, lipoproteínas y lipopolisacáridos 45 46 Propiedades y Funciones: 1= Brinda protección y resistencia a la bacteria frente a los posibles cambios de presión osmótica del medio en el que se encuentra y a la acción de ciertos agentes externos.2= Presenta Poros que actúan como filtros, permitiendo el pasaje de agua y metabolitos esenciales.3= Presenta antígenos de tipo y grupo específicos.4= Participa en la división (multiplicación) bacteriana (se invagina junto con la membrana plasmática)5= En las bacterias Gram .negativas tiene poder patógeno debido a que presenta endotoxinas (Lípido A).6= Es el sustrato donde actúan los - Lactámicos y otros antimicrobianos. La tinción para la pared celular se aprovecha del hecho de que los contenidos citoplasmáticos se pueden hidrolizar diferencialmente con ácido fosfomolíbdico, dejando la pared sin afectar. Después de teñir se puede observar la pared celular con citoplasma como ahuecado ESPORAS Son elementos de reproducción y/o de resistencia a un medio adverso que presentan algunas bacterias , especialmente del género bacilar. Su forma, tamaño y ubicación varía según la especie. Estos cuerpos son producidos en el último estadío del crecimiento celular, que bajo condiciones apropiadas, germinan y producen la clase original de célula en crecimiento o vegetativa. Las esporas son resistentes a muchos agentes químicos y físicos. Hesiten dos tipos de esporas: Endosporas : espora presente en el interior de la bacteria. Destinada a germinar originando la forma vegetativa de la que deriva. Es un cuerpo de pared gruesa muy refringente y sumamente resistente. Son producidas por especies Bacillus, clostridium y Sporosarcina. Las endoesporas resisten las condiciones ambientales adversas de desecación, calor y mal suministro de nutrientes ( agentes químicos como desinfectantes) Exosporas : esporo que permanece libre en el ambiente, constituyendo la forma de resistencia bacteriana ante condiciones adversas o desfavorables (nutrición, desecación, temperatura, presencia de agentes químicos, presiones, etc.) PROCEDIMIENTO A) TINCIÓN DE LA PARED CELULAR 1.- Prepara un frotis húmedo relativamente concentrado de Bacillus Suptillus sobre un portaobjetos limpio . NO LO FIJES A LA FLAMA. Prepara otro con B. cereus 2.-Antes de que la suspensión bacteriana se seque sobre el portaobjetos, adiciónale la solución del ácido fosfomolíbdico cubriéndola por completo. 3.- Déjalo reaccionar 4 minutos. 4.- Inclina completamente el portaobjetos sobre el fregadero para eliminar totalmente el ácido fosfomolíbdico 5.-Agrega el verde de metilo directamente sobre el frotis húmedo y déjalo reaccionar 5 minutos. 6.- Lava suavemente en la llave. Es inevitable que al lavar en la llave, algo del material se desprenda del frotis, trata de minimizar el desprendimiento pero al mismo tiempo lava bien, hasta que el agua ya no arrastre colorante. 7.- Seca al aire y después examina con aceite de inmersión 46 47 8.- Si se tiñó correctamente, las paredes celulares aparecerán de verde oscuro o azul, mientras que el citoplasma se verá de un verde claro o incoloro. TINCIÓN DE LA PARED CELULAR (TÉCNICA DE KNAYSI) 1.- Hacer un frotis de Bacillus subtilis en la forma usual y fijarlo con calor. Prepara otro con Bacillus cereus 2.- Cubrir el frotis con mordente de Knaysi y dejarlo actuar durante 10 minutos. 3.- Lavar la preparación con agua 4.- Colocar con el asa bacteriológica una gota de fuscina fenicada sobre la preparación. 5.- Poner un cubreobjetos sobre la preparación y observar al microscopio con el objetivo de inmersión. La pared celular se observa de color rojo intenso alrededor de la bacteria, cuyo citoplasma se ve de un color rosa o rojo tenue. A) TINCIÓN DE ESPORAS ( TÉCNICA DE SHEAFFER Y FULTON) 1-Prepare un dos extendidos del microorganismo aislado del cultivo de microorganismo uno de Bacillus Suptillus y otro de Bacillus cereus 2-Fijar por calor y cubrir todo el portaobjeto con una solución de verde de Malaquita. 3-Calentar hasta emisión de vapores y seguir dicho calentamiento durante 3 minutos (no permitir que se seque el colorante. Si esto ocurriera, agregar colorante, sobre el preexistente y no sobre la parte seca, hasta cubrirlo nuevamente.) 4-Lavar con agua y cubrir con solución de Safranina. Dejar actuar 30 segundos. Lavar con agua, secar y observar con objetivo de inmersión. 5-Informar: morfología, color y tipo de espora. El colorante Verde malaquita: capaz de teñir las esporas en caliente.. La Safranina: colorante de contraste que tiñe las formas vegetativas. Las endosporas, t ras l a p rimera t inción, no perderán el colorante en el lavado con agua, y sí lo h arán l as formas vegetat ivas, q ue quedarán teñidas con el segundo colorante TINCIÓN DE ESPORAS ( TÉCNICA DE COLORACIÓN DE GRAM) 1.- Hacer un frotis de B.suptilis de la forma usual y otra de B. cereus 2.- Teñir con la coloración de Gram 3.-Observar al microscopio con el objetivo de inmersión las esporas se pueden observar sin teñir o si se encuentra dentro del bacilo, la espora n o se tiñe y el citoplasma se ve de color morado Localización y morfología de las esporas en Bacillus 47 48 CUESTIONARIO 1.- Menciona dos funciones que tiene la pared celular en las bacterias ________________________________________________________________________________ ________________________________________________________________________________ 2.-¿Cuáles son los principales compuestos orgánicos de las paredes celulares? _______________________________________________________________________________ 3. ¿Qué característica y que color tiñeron las paredes celulares de las bacterias que lograste observar? _______________________________________________________________________________ 4.- Investiga las diferencias de la pared celular de las bacterias Gram positivas y Gram negativas _______________________________________________________________________________ _______________________________________________________________________________ 5.- Describe dos diferencias para distinguir a una endospora de una exospora _______________________________________________________________________________ 6. ¿Qué característica y que color tiñeron las esporas observadas en las distintas muestras microbiológicas?______________________________________________________________ ________________________________________________________________________________ 7.- Menciona algunos microorganismos capaces de producir esporas ________________________________________________________________________________ OBSERVACIONES Dibuja las estructuras celulares que lograste observar con el objetivo de inmersión CONCLUSIONES ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 48 49 TINCIÓN DE GRAM Práctica No 11 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio_________________________________ Calif:___________ OBJETIVO El alumno aplicará una técnica de coloración diferencial para la identificación de bacterias Gram positivas y Gram negativas.. MATERIAL Asa de platino Microscopio Porta objetos Aceite de inmersión Cultivos de Escherichia coli Cultivo de Staphylococcus aureus Cultivo de Cándida albicans Esputo de tuberculoso procesado en autoclave SUSTACIAS COLORANTES Colorante violeta cristal de Gram Solución decolorante alcohol acetona Safranina de Gram Yodo de Gram o lugol para gram INTRODUCCIÓN TINCION DE GRAM. Tinción empleada en microbiología para la visualización de bacterias en muestras clínicas. También se emplea como primer paso en la diferenciación bacteriana. El examen con microscopio óptico de preparación con tinción de Gram se emplea de rutina para determinar la forma de las bacterias. Las formas comunes son cocos ( esféricas), bacilos (alargadas) y formas espiraladas Las bacterias pueden diferenciarse con esta tinción en dos grupos. Los microorganismos Gram. positivos se tiñen de azul , mientras que aproximadamente un tercio de los cocos, la mitad de los bacilos y todos los organismos espira lados se tiñen de rojo y se dice que son gramnegativos. Las aplicaciones más comunes de la coloración de Gram son las siguientes: La presencia de cocos grampositivos agrupados sugiere estafilococos; en cadenas sugiere estreptococos; en forma de lanceta a los diplococos La presencia de diplococos gramnegativos son características de especies de Neisseria 49 50 Los bacilos Gram. positivos grandes sugieren especies de Bacillus o clostridium, los bacilos Gram. positivos pequeños sugieren especies de Listeria o una de las corineiformes ( difteroides) Los bacilos Gram. negativos son las bacterias mas comunes halladas en los laboratorios clínicos e incluyen a Enterobacteriaceae, bacilos no fermentados y especies de Haemophilus. El valor diagnóstico de esta tinción es variable; normalmente permite una buena orientación al microbiólogo para seleccionar las técnicas de cultivo más adecuadas y también tiene valor en orientar hacia un diagnóstico etiológico, en especial para instaurar un tratamiento inicial. PROCEDIMIENTO REALIZACIÓN DEL FROTIS 1. Colocar una pequeña gota de agua en el centro de un portaobjetos limpio. Es necesaria muy poca cantidad de agua, por lo que se puede usar el asa de siembra, ya que en el extremo curvo de su filamento queda retenida una mínima gota de agua, que resulta suficiente. 2. Flamear el asa de siembra, tomar, en condiciones asépticas, una pequeña cantidad del cultivo bacteriano en medio sólido y transferirlo a la gota de agua. Remover la mezcla con el asa de siembra hasta formar una suspensión homogénea que quede bastante extendida para facilitar su secado. Si la muestra se toma de un cultivo en medio líquido, no es necesario realizar los dos primeros pasos ya que basta con colocar y extender una gota de la suspensión bacteriana, que se toma con el asa de siembra, directamente sobre el portaobjetos. 3. Esperar hasta que el líquido se evapore o acelerar su evaporación acercando el porta a la llama del mechero. En este caso hay que tener mucha precaución de no calentar demasiado el porta pues las células pueden deformarse o romperse. A) TINCIÓN DE GRAM 1. 2. 3. 4. 5. 6. Realiza la preparación del frotis bacteriano como se explicó en el paso anterior Teñir con cristal violeta 1min. Lavar con abundante agua el exceso de colorante. Cubrir con Lugol 1min. Lavar con agua el exceso de Lugol. Decolorar con alcohol-acetona o simplemente con alcohol hasta que la preparación deje de perder color (30seg) 7. Lavar con abundante agua para eliminar el resto de disolvente. 8. Teñir con safranina 1min. 9. Lavar con agua para eliminar el colorante de contraste. 10. Secar la preparación. 11. Examinar al microscopio con aceite de inmersión y fijándose sobre todo en el color de cada preparación. 50 51 CUESTIONARIO 1.- ¿Qué es un frotis? ________________________________________________________________________________ ________________________________________________________________________________ 2.- ¿Con qué finalidad se fija la muestra de microorganismos en el porta objetos? ________________________________________________________________________________ ________________________________________________________________________________ 3.-¿Qué importancia tiene teñir las muestras bacterianas? ________________________________________________________________________________ ________________________________________________________________________________ 4.- ¿Por qué es necesario emplear aceite de inmersión para la observación de los microorganismos? ________________________________________________________________________________ ________________________________________________________________________________ 5.-De los reactivos que utilizaste para la tinción de Gram, ¿cuál es el que funciona como colorante primario? ________________________________________________________________________________ ________________________________________________________________________________ 6.-¿Qué función tiene el Yodo en la tinción de Gram? ________________________________________________________________________________ ________________________________________________________________________________ 7.-¿Qué coloración tiñen las bacterias Gram positivas? ________________________________________________________________________________ ________________________________________________________________________________ 8.- ¿Qué coloración tiñen las bacterias Gram. negativas? 9.- Menciona tres bacterias que tiñen Gram positivas y escribe la enfermedad que causa cada una de ellas ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 51 52 10.- Menciona tres bacterias que tiñen Gram negativas y escribe la enfermedad que causa cada una de ellas. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ OBSERVACIONES: Realiza los dibujos y esquemas correspondientes a las tinciones realizadas CONCLUSIONES: ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 52 53 TINCIÓN ÁCIDO-ALCOHOL RESISTENTE Práctica No 12 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio_________________________________ Calif:___________ OBJETIVO: El alumno aplicará las técnicas de coloración de microorganismos ácido-resistentes para diferenciarlos e identificarlos, en base a sus propiedades morfológicas MATERIAL: *Un cultivo de 72 horas de mycobacterium. Si es posible se les facilitará un esputo de tuberculoso procesado en autoclave. * Un cultivo de 24 horas de streptococcus REACTIVOS * Fucsina de Ziehl- Neelsen * Azul de metileno * Alcohol acidulado INTRODUCCIÓN Los microorganismos pertenecientes al género Mycobacterium se caracterizan por tener una pared celular completamente diferente a las restantes bacterias. La pared de las Mycobacterias posee un alto contenido de lípidos que la hace impermeable a los agentes hidrofílicos, por lo tanto estos microorganismos no se tiñen adecuadamente con los reactivos utilizados en la coloración de Gram y no pueden ser clasificados como Gram positivos o negativos. Las Mycobacterias son teñidas adecuadamente por el método de Ziehl-Neelsen (Tinción Ácido -Rápida o Acid-Fast Stain) que utiliza como solución decolorante una mezcla de etanol y ácido clorhídrico. Son bacilos ácido-alcohol resistentes por lo que la tinción de Zieh1Neelsen es útil para la coloración de estos microorganismos obtenidos de muestras clínicas o de cultivo. Con esta tinción, los bacilos aparecen de color rojo brillante sobre un fondo azul. Los bacilos tuberculosos son difíciles de teñir con la tinción de Gram, y se observan como bacilos gram positivos con tinción irregular. Estos microorganismos una vez coloreados son resistentes a la decoloración ácido-alcohólica y por eso se denominan Bacilos Ácido Alcohol Resistentes (BAAR) . El género Mycobacterium incluye más de 100 especies que pueden clasificarse en seis grupos desde el punto de vista bacteriológico, pero con fines didácticos se dividen en tres apartados: Complejo tuberculosis. Incluye las especies M. tuberculosis, Mycobacterium bovis (incluida la cepa BCG) y Mycobacterium africanum , productoras todas ellas de tuberculosis. Se incluye también Mycobacterium microti, productor de tuberculosis en rata Complejo lep ra. En el que se incluyen las especies M. leprae, productor de la lepra humana, y Mycobacterium lepraemurium , que produce lepra en roedoresel. El Mycobacterium leprae 53 54 que es un parásito intracelular obligado que se multiplica lentamente en células fagocitarias mononucleares como los histiocitos de la piel y en las células de Shwan de los nervios Otra s Micobacterias. Micobacterias no comprendidas en los dos grupos anteriores. Sólo algunas de ellas suelen ser patógenas, otras pueden ser patógenas oportunistas y finalmente otras suelen ser saprofitas. Producen las denominadas micobacteriosis las infecciones producidas por M. avium , M. kansakii, M. fortuitum y M. chelonei son consideradas oportunistas y no tuberculosas PROCEDIMIENTO 1. Prepara un frotis bacteriano. Haciendo un delgado extendido del material para su estudio y permitir que se seque al aire. 2. Fijar el frotis con calor, evitar que hierva 3. Cubrir la preparación con carbofucsina. o fuscina fenicada 4. Calentar la preparación en un mechero Bunsen durante 5 min. No debe hervir. Si se evapora, se añade más carbofucsina para que no se seque en ningún momento. 5. Lavar con agua el resto de colorante. 6. Decolorar con la mezcla ácido-alcohol. Hasta que solo permanezca un tenue color rosa. 7. Lavar con agua para que no prosiga la decoloración. 8. Teñir con azul de metileno 1 min. 9. Lavar con agua el resto de colorante. 10. Secar la preparación. 11. Examinar al microscopio. Con objetivo de inmersión por 100 X ( aceite) La tinción es positiva para bacilos rojos contra un fondo azul claro CUESTIONARIO 1.- ¿Qué Clasificación de bacterias pueden ser encontradas en este tipo de tinción? ________________________________________________________________________________ ________________________________________________________________________________ 2.- ¿Qué otro nombre recibe la tinción ácido- alcohol- resistente? ________________________________________________________________________________ 3.- ¿Qué coloración se tiñen las bacterias bacilares en la tinción ácido- alcohol- resistente que da como resultado la reacción positiva? ________________________________________________________________________________ ________________________________________________________________________________ 4.-¿Qué función tiene el alcohol en la técnica de tinción? ________________________________________________________________________________ ________________________________________________________________________________ 5.-¿Qué especies de Mycobacterium son los causantes de la tuberculosis? ________________________________________________________________________________ ________________________________________________________________________________ 54 55 6.- ¿Qué especie de Mycobacterium es el responsable de la lepra? ________________________________________________________________________________ ________________________________________________________________________________ OBSERVACIONES: Haz un esquema de los pasos que realizaste durante la realización de la práctica, así como el dibujo de las bacterias bacilares observadas en el microscopio. CONCLUSIONES: ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 55 56 EFECTO DE LA PRESIÓN OSMÓTICA SOBRE LA VIABILIDAD Y EL CRECIMIENTO DE LOS MICROORGANISMOS Práctica No 13 Nombre Del Alumno:_________________________________Semestre______ Grupo______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio_________________________________ Calif:___________ OBJETIVO: El alumno manejará las técnicas para observar el efecto de la presión osmótica que ejerce el Cloruro de sodio y la Sacarosa sobre el crecimiento microbiano MATERIAL: 3 Tubos de 16X 150 . En cada uno 10 ml de caldo nutritivo adicionado con: 2ml de cloruro de sodio al 1%, 2ml de cloruro de sodio al 10%, 2ml de cloruro de sodio al 20% 3 Tubos de 16X 150. En cada tubo 10 ml de caldo nutritivo adicionado con: 2ml de Sacarosa al 1%, 2 ml de Sacarosa al 10%, 2 ml de Sacarosa al 20% Nefelómetro de Mac Farland Pipetas de 5 ml , y de 1 ml estériles Agua destilada estéril CEPAS: Escherichia Coli Staphylococcus aureus Klebsiella pneumoniae AGARES * Agar sangre * Agar Nutritivo * Caldo nutritivo INTRODUCCIÓN: A) PRESIÓN: La osmosis es la difusión a través de una membrana semipermeable que separa a dos soluciones con distintas concentraciones de sustrato. El proceso tiende a igualar la concentración de soluto a ambos lados de la memoran. Cuando a ciertas células bacterianas se les suspende en una solución que contiene una concentración elevada de cloruro de sodio (20%), el agua pasará desde la región de menor concentración de sustancia disuelta ( el interior de la célula tiene una baja concentración salina) a través de la membrana citoplasmática que es semipermeable a la solución que rodea a la célula. Así la célula se deshidrata produciéndose plasmólisis. Si las bacterias se colocan en una solución que contiene menos del 1% de cloruro de sodio, el flujo de agua se invertirá, es decir ocurrirá la difusión, ya que fluirá el agua desde la solución externa al interior de la célula y originará la plasmotipsis. Dentro de la célula se establece una presión osmótica a causa de la gran cantidad de agua que se acumula allí, esta presión hará que se hinchen e incluso las 56 57 células pueden reventar. El mecanismo de inhibición microbiana es la plasmólisis: las células se deshidratan y por lo tanto Son incapaces de metabolizar o crecer, pueden morir o permanecer vivas pero en condiciones durmientes. Sin embargo también existen microorganismos que requieren altas concentraciones salinas y son denominadas halófilos, y los que requieren presiones osmóticas elevadas se les conoce como osmófilos. La mayor parte de las bacterias pueden tolerar una amplia gama de presiones osmóticas externas y fuerzas iónicas debido a su capacidad de regular la osmolaridad interna y la concentración iónica. La osmolaridad está regulada por el transporte activo de iones potasio al interior de la célula A) En medios hipotónicos (con una aw>aw del citoplasma) es la pared celular la que ejerce todo el papel: su rigidez se opone a la entrada de agua, y por lo tanto, evita que la membrana citoplásmica tienda a sufrir una presión de turgor excesiva. B) En medios hipertónicos (cuando la aw del exterior es menor que la del citoplasma). Las bacterias poseen mecanismos compensatorios por los que tienden a aumentar la osmolaridad interior por encima de la del medio (para garantizar la entrada de agua del ambiente y mantener su metabolismo). Ello se logra esencialmente aumentando la concentración de un soluto muy soluble en agua en el interior celular, soluto llamado genéricamente soluto compatible, lo cual se puede lograr por varios posibles mecanismos: bombeando iones al interior; sintetizando una molécula orgánica osmóticamente activa; bombeando sustancias osmoprotectoras. PROCEDIMIENTO: PREPARACIÓN DE LA CEPA A ESTUDIAR Suspender la cepa bacteriana en agua destilada logrado obtener una turbiedad del No 10 del nefelómetro de Mac- Farland. En caso de no tener el nefelómetro solo cuidar la turbiedad a manera de suspensión. A) EFECTO DEL CLORURO DE SODIO 1.- Colocar en una gradilla en orden creciente de concentración una serie de 3 tubos con 10 ml cada uno con caldo nutritivo y adiciona 2 ml de cloruro de sodio con las distintas concentraciones ( al 1%, 10% y 20 º% de NaCl) 2.-Rotularlas de acuerdo a la concentración y nombre de la cepa que se va a inocular en ellos 3.- Inocular en cada tubo 0.l ml de la suspensión bacteriana correspondiente 4.- repetir los pasos del 1 al 4 para cada cepa proporcionada 5.- Incubar los tubos a 37·C durante 24- 48·C6.- Homogenizar el cultivo y leer el resultado de cada tubo en base a su turbiedad, comparándola con las ampolletas del nefelómetro de Mac- Farland 57 58 B) EFECTO DE LA SACAROSA 1.- Colocar en una gradilla en orden creciente de concentración una serie de 3 tubos con 10 ml cada uno con caldo nutritivo y adiciona 2 ml de sacarosa con las distintas concentraciones ( al 1%, 10% y20% de Sacarosa) 2.-Rotularlas de acuerdo a la concentración y nombre de la cepa que se va a inocular en ellos 3.- Inocular en cada tubo 0.l ml de la suspensión bacteriana correspondiente. 4.- repetir los pasos del 1 al 4 para cada cepa proporcionada. 5.- Incubar los tubos a 37·C durante 24- 48·C. 6.- Homogenizar el cultivo y leer el resultado de cada tubo en base a su turbiedad, comparándola con las ampolletas del nefelómetro de Mac- Farland. CUESTIONARIO: 1.- ¿Cómo se define la ósmosis? ________________________________________________________________________________ ________________________________________________________________________________ 2.- ¿Qué es plasmólisis y cuando ocurre? ________________________________________________________________________________ ________________________________________________________________________________ 3.- ¿Qué sucedió con las bacterias al incrementar la concentración del NaCl y sacarosa en los distintos caldos nutritivos? ________________________________________________________________________________ ________________________________________________________________________________ 4.- ¿Qué nombre reciben las bacterias que soportan grandes presiones osmóticas? ________________________________________________________________________________ 5.- ¿Quién es el responsable en la célula bacteriana controlar la presión en medios hipotónicos? ________________________________________________________________________________ 6.- ¿Cuándo se establece un medio hipotónico? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 7.- ¿Cuándo se establece un medio hipertónico? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 58 59 RESULTADOS: Anota los resultados del efecto del cloruro de sodio y de la sacarosa sobre el crecimiento, indicando el número de ampolleta del nefelómetro a que corresponda dicho crecimiento. En caso de no contar con el Nefelómetro registra a manera de cruces dicho crecimiento bacteriano CEPAS EFECTO DE LA PRESIÓN OSMÓTICA 1% NaCl 10% NaCl 20% NaCl E.COLI S.AUREUS K.PNEUMONIAE CEPAS EFECTO DE LA PRESIÓN OSMÓTICA 1% Sacarosa 10% sacarosa 20% Sacarosa E.COLI S.AUREUS K.PNEUMONIAE OBSERVACIONES Dibuja a manera de esquema los pasos realizados en la elaboración de la práctica, así como los resultados obtenidos después del tiempo de incubación. CONCLUSIONES: ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 59 60 DETERMINACIÓN DEL TIEMPO Y PUNTO TÉRMICO MORTAL EN MICROORGANISMOS Práctica No 14 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio__________________________________ Calif:__________ OBJETIVO El alumno aplicará un método que le permitirá conocer la temperatura y el tiempo mínimos necesarios para esterilizar una suspensión, así como el efecto que tienen diferentes diluyentes sobre dichas determinaciones. MATERIAL Tubos de 13 X 100 estériles Pipetas de 5 ml estériles Pipetas de l ml estériles Cajas de Agar Nutritivo o Agar sangre Baños maría a 37·C, 70·C, y ebullición Tubos de ensaye con 1 ml de puré de tomate, jugo de naranja y agua destilada CEPAS Escherichia coli Staphylococcus aureus Klebsiella Pneumoniae INTRODUCCIÓN: Diferentes especies microbianas varían ampliamente en sus fluctuaciones de temperatura óptima para su desarrollo: Las llamadas psicrófilas crecen mejor a temperaturas bajas (15 a 20·C), las formas mesófilas lo hacen mejor de 30 a 37·C, la mayor parte de la termófilas entre 50·C y 60·C. La mayor parte de los microorganismos son mesófilos, 30·C es la temperatura óptima para muchas de las formas de vida libre y la temperatura del huésped es óptima para los simbiontes de los animales de sangre caliente. El límite superior de temperatura tolerada por cualquier especie se correlaciona bien con la estabilidad térmica general de las proteínas de dicha especie. Los microorganismos comparten con los vegetales y los animales la respuesta al choque por calor, una síntesis de proteínas por el calor cuando son expuestos a una elevación súbdita en la temperatura por arriba de la óptima para el crecimiento. Al parecer estas proteínas son resistentes al calor y estabilizan a las proteínas de la célula sensible al calor. Las bacterias también exhiben fenómeno denominado choque por frío, ósea la 60 61 muerte de las células por un enfriamiento rápido, en oposición a uno lento. Por ejemplo, el enfriamiento rápido de la escherichia coli desde 37·C a 5·C puede matar al 90% de las células EFECTO LETAL DEL CALOR. Al subir la temperatura por encima de la temperatura máxima de crecimiento, se dejan sentir los efectos sobre la viabilidad: la pérdida de viabilidad significa que las bacterias dejan de ser capaces de crecer y dividirse. La muerte se debe a la destrucción o inactivación irreversible de una molécula o estructura esencial (como p. ej. el ADN cromosómico o por creación de un daño irreparable en la membrana). ¿Cómo podemos caracterizar o medir en la práctica la inactivación por calor de una suspensión bacteriana? He aquí algunos parámetros utilizados: tiempo térmico mortal: es el tiempo mínimo requerido para que mueran todas las bacterias de una determinada suspensión a una determinada temperatura; tiempo de reducción decimal: es el tiempo requerido para reducir al 10% la densidad de la suspensión, a una determinada temperatura (también llamado valor D); punto térmico mortal: es la temperatura mínima que mata a todas las bacterias en un tiempo determinado (normalmente el tiempo de referencia empleado es de 10 min). PROCEDIMIENTO A) PREPARACIÓN DE LAS SUSPENSIONES MICROBIANAS 1.- Adicionar agua destilada a cada cepa que se va a estudiar cuidado de que quede turbia a manera de suspensión. 2.- Colocar 1 ml de jugo de naranja en un tubo de 13 X 100, 1 ml de Agua destilada en otro tubo de 13X100 y 1 ml de puré de tomate en otro tubo de 13 X 100. Será necesario rotularlos. 3.- transferir 1 ml de la suspensión bacteriana preparada a cada tubo B) DETERMINACIÓN DEL PUNTO TERMICO MORTAL (PTM) 1.- Colocar en una gradilla una serie de 4 tubos de 13 X 100 para cada tipo de bacteria a estudiar 3.- Marcar cada tubo con el nombre de la cepa que se va a estudiar. 4.- Anotar en cada tubo las temperaturas siguientes testigo, 37·C, 70·C, y ebullición 5.- Colocar en cada tubo 0.5 ml de la suspensión bacteriana que preparaste con agua, jugo de naranja y puré de tomate a tratar 6.- Calentar la suspensión a la temperatura indicada en un baño maría durante 10 minutos ( el tubo testigo NO SERA CALENTADO) 7.- Vaciar el contenido de cada tubo en la superficie de una placa de Agar nutritivo y Homogeneizar por rotación sobre la mesa o mediante extensión con varilla de vidrio doblada a 90 grados 8.- Incubar a 39:C durante 24- 48 horas 9.- Observar si hay crecimiento. 61 62 C) DETERMINACIÓN DEL TIEMPO TÉRMICO LETAL(TTL) 1.- Colocar en una gradilla una serie de 4 tubos de 13 X 100 para cada tipo de bacteria a estudiar 2.- Marcar cada tubo con el nombre de la cepa que se va a estudiar 3.- Anotar en cada tubo los tiempos que se indican a continuación: Testigo, 5 minutos, 1 5 minutos, 30 minutos 4.- colocar en cada tubo 0.5 ml de la suspensión bacteriana que preparaste con agua, jugo de naranja y puré de tomate a estudiar 5.- Calentar en baño maría a 70·C para todos los tubos y respetando los tiempos indicados ( el tubo testigo NO SE CALIENTA) 6.- Vaciar el contenido de cada tubo sobre la superficie de una placa de Agar nutritivo y homogeneizar por rotación sobre la mesa o extensión con varilla de vidrio doblado a 90 grados 7.- Incubar las placas a 37·C durante 24- 48 horas 8.- Observar si presenta o no crecimiento CUESTIONARIO: 1: ¿Qué características presentan las bacterias llamadas psicrófilas? ________________________________________________________________________________ ________________________________________________________________________________ 2.- ¿A qué temperatura crecen las bacterias mesófilas? ________________________________________________________________________________ 3.- ¿Qué sucede con las proteínas en la célula bacteriana cuando se aplica un cambio brusco en la temperatura ________________________________________________________________________________ ________________________________________________________________________________ 4.- ¿En qué consiste el tiempo térmico letal? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 5.- ¿En qué consiste el punto térmico mortal? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 6.- ¿A qué temperatura se reporta el punto térmico mortal para las bacterias estudiadas en los distintos diluyentes? ________________________________________________________________________________ ________________________________________________________________________________ 7.- ¿Qué muestras después de la incubación reporta el tiempo óptimo para la destrucción 62 63 de las bacterias en los distintos diluyentes? ________________________________________________________________________________ ________________________________________________________________________________ _______________________________________________________________________________ RESULTADOS: Completa las siguientes tablas después del tiempo adecuado y temperatura de incubación para los distintos medios. A) PUNTO TERMICO MORTAL (PTM) Cepas Diluyente E. coli Crecimiento calentar Testigo 37 ºC después de 70ºC Ebullic. Testigo 37 ºC 70ºC Ebullic. Testigo 37 ºC 70ºC Ebullic. Agua Jugo de Naranja Puré de tomate S. aureus Agua Jugo de Naranja Puré de tomate K.pneumoniae Agua Jugo de Naranja Puré de tomate B) TIEMPO TÉRMICO LETAL(TTL) Cepas Diluyente E. coli Agua Crecimiento después de calentar Testigo 5 min 15min 30 min. 63 64 Jugo de Naranja Puré de tomate S. aureus K.pneumoniae Agua Jugo de Naranja Puré de tomate Agua Jugo de Naranja Puré de tomate Testigo 37 ºC 70ºC Ebullic. Testigo 37 ºC 70ºC Ebullic. OBSERVACIONES: Dibuja los pasos que seguiste para la realización de la práctica CONCLUSIONES: ____________________________________________________________________ ____________________________________________________________________ ____________________________________________________________________ ___________________________________________________________________ 64 65 INHIBIDORES BACTERIANOS Práctica No 15 Nombre Del Alumno:_________________________________Semestre______ Grupo_______ Nombre del titular_____________________________________Fecha____________________ Nombre del Profr. de Laboratorio_________________________________ Calif:___________ OBJETIVO: El alumno manejará algunas técnicas para poner de manifiesto la actividad de los antibióticos sobre el crecimiento microbiano. MATERIAL: Cajas de petri con medios de cultivo Muller-Hinton, o Agar nutritivo Asa bacteriológica Mechero Fisher Sensidiscos ( antibiogramas) Fenol al 5% SUSTANCIAS BIOLÓGICAS Cultivo de en caldo nutritivo de 24 horas de Bacillus subtilis ( lactó bacilos) Cultivo de 24 horas Staphylococcus aureus en manitol sal Agar (msa) Cultivo de 24 horas de Escherichia Coli en medio Macconkey INTRODUCCIÓN: ANTIBIÓTICOS Son sustancias capaces de destruir y eliminar los microorganismos causantes de una infección producida por bacterias (faringitis, bronquitis, otitis, neumonía, amigdalitis, etc). No son eficaces cuando la infección es producida por virus (gripe). Cada tipo de antibiótico será efectivo para destruir una clase de microorganismos en función de su modo de actuación..Se les llama antibióticos de amplio espectro a los que son efectivos frente a un gran número de agentes microbianos: los microorganismos causantes de la infección son capaces de desarrollar resistencias al antibiótico de manera que este no será eficaz para eliminarlos. Cada año se investiga creando nuevos antibióticos eficaces para las formas microbianas resistentes a sus anteriores tratamientos. Se deben usar siempre bajo prescripción médica. Existen pruebas (antibiogramas) que determinan el antibiótico más eficaz para cada infección, pero normalmente se sigue un protocolo de actuación de los antibióticos de elección para cada tipo de infección. Es el médico el profesional que juzga la infección existente y el antibiótico eficaz para su tratamiento. Los antibióticos siempre se deben tomar bajo prescripción médica y cumplir el tratamiento completo. El incumplimiento del tratamiento puede dar lugar a recaídas que precisarán el tratamiento con otro tipo de antibiótico por haber desarrollado resistencia al primero . 65 66 MODO DE ACCION DE LOS ANTIBIÓTICOS 1.- Inhibición de la síntesis de la pared celular. 2.- Alteración sobre la membrana citoplásmica. 3.- Inhibición de la síntesis proteica.4.- Bloqueo de la síntesis de los ácidos nucleicos. ANTIBIOGRAMAS Para estudiar la sensibilidad de un microorganismo por técnicas de difusión se dispone de dos sistemas, el de discos de papel impregnados con el antibiótico y las tabletas, consistentes en una suspensión del antibiótico liofilizada y comprimida en material inerte. Los fabricantes recomiendan conservar los discos a –20 °C para largos periodos o entre 2 y 8 °C si se utilizan en el plazo de una semana. Por el contrario, las tabletas se han considerado más estables, pudiéndose almacenar a temperatura ambiente y manteniendo su actividad más tiempo que los discos .Por lo que respecta a la temperatura de conservación, al comparar para cada antibiótico los diámetros de los halos de inhibición de los discos conservados entre 4 y 6 °C con los conservados a temperatura ambiente no se encontraron diferencias significativas a lo largo de todo el estudio; tampoco se encontraron diferencias al comparar los halos de las pastillas conservadas entre 4 y 6 °C con las conservadas a temperatura ambiente, de modo que tanto los antibióticos que permanecieron estables durante el tiempo del estudio como los que disminuyeron su actividad lo hicieron de modo paralelo a ambas temperaturas PROCEDIMIENTO: A) PREPARACIÓN DE LAS SUSPENSIONES MICROBIANAS Suspender la cepa bacteriana en agua destilada logrado obtener una turbiedad del No 10 del nefelómetro de Mac- Farland. En caso de no tener el nefelómetro solo cuidar la turbiedad a manera de suspensión. B) ACTIVIDAD DE LOS ANTIBIÓTICOS EN DISCO 1.- Marcar 2 placas Muller-Hinton, o Agar nutritivo con el nombre de la cepa S.aureus y otra con el nombre de K.pneumoniae. 2.- Tomar con un hisopo diferente las muestras que fueron preparadas en el inciso A de este procedimiento y sembrar las placas rotuladas 3.- Quemar el hisopo y desecharlo. 4. Colocar un multidisco o discos individuales sobre las placas y presionar ligeramente los discos contra la gelosa 5.-Incubar las placas a 37ºC durante 24 horas 6.- Medir el diámetro de los halos de inhibición del crecimiento producidos por cada antibiótico y notar los resultaos C) DETERMINACIÓN DE INHIBIDORES EN LA LECHE 1.- Preparar el medio de cultivo de la siguiente forma: -Preparar medio de cultivo Muller-Hinton, o Agar nutritivo, esterilizarlo y enfriarlo a 40ºC 66 67 - Añadir 0.5 ml de B. Subtilis obtenido de un cultivo de 24 horas en caldo nutritivo en una caja de petri esterilizada - Vaciar 15 ml del medio de cultivo ya enfriado a 40ºC. Distribuir en forma homogénea - Dejarlo que solidifique. 2.- Tomar una muestra de leche y calentar a baño María a 80ºC durante 3 minutos exactamente, enfriar bruscamente la leche en un baño con hielo 3.- Impregnar un disco de papel filtro con la leche fría, secarlo ligeramente y con unas pinzas esterilizadas depositarlos en el centro de una caja de petri preparada anteriormente 4.- Incubar la placa de 18 a 20 horas a 37ºC y observar las zonas de inhibición causadas por los antibióticos sobre el B. Subtilis. 5.- Si la muestra de leche contiene antibióticos, alrededor del disco se formará un halo, el cual indica la inhibición de microorganismos y presencia de antibióticos en concentraciones superiores a las permitidas CUESTIONARIO 1.- Qué función tiene lo antibióticos? ________________________________________________________________________________ ________________________________________________________________________________ 2.-Qué son los antibiogramas y cuál es su función? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 3.-Menciona dos causas del porque los microorganismos pueden llegar a hacerse resistentes a los antibióticos? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 4.-En caso de no tener Sensidiscos en el laboratorio: ¿cómo puedes fabricarlos? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 5.-Escribe dos Fuentes naturales de donde se puedan obtener los antibióticos ________________________________________________________________________________ 6.-Según los resultados de tu práctica . ¿Qué medicamentos puedes utilizar para destruir y eliminar a los microorganismos como: Staphylococcus y Escherichia Coli? ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 7.- Investiga qué tipo de enfermedades pueden ocasionar los microorganismos estudiados en la práctica ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 67 68 8.-Existió inhibición de microorganismos y presencia de antibióticos superiores a las permitidas en la leche que estudiaste?________por qué? ________________________________________________________________________________ ________________________________________________________________________________ OBSERVACIONES Realiza los dibujos de los resultados obtenidos a las 24 horas de incubación CONCLUSIONES ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 68 69 BIBLIOGRAFÍA 1) Dr Martínez Ramos, Manual de Prácticas de Microbiología General, Centro de Graduados e investigación, Instituto Tecnológico de Veracruz, l993. 2) M.C Gaitán Hinojosa Mario Alberto, Manual de prácticas de Bacteriología General, Facultad e ciencias Químicas , Universidad de Colima. 3) Manual de Laboratorio Manual de prácticas de Microbiología. Cualquiera de estas prácticas se puede hacer perfectamente en un laboratorio de instituto ... http://www.joseacortes.com/practicas/ Última modificación: 17-03-2005 © 2001 por José A. Cortés 4) El Microscopio óptico compuesto Práctica de laboratorio: Manejo y uso del microscopio optico compuesto. ... Mantener seca y limpia la platina del microscopio. Si se derrama sobre ella ... www.joseacortes.com/practicas/microscopio.htm - 23k - En caché 5) http://html.rincondelvago.com/biologia_41.html 6) http://html.rincondelvago.com/tincion-de-gram.html 7) gráficos obtenidos de: http://www.uphs.upenn.edu/bugdrug/antibiotic_manual/gram.htm 8) Las tinciones - Monografias.com Tinción Simple: utiliza un solo colorante. Tinción de Gram: ... En la muestra de la práctica anterior 3 eran gran positivo por su coloración morada. Tinción ... www.monografias.com/trabajos15/ tinciones/tinciones.shtml - 28k - En caché Páginas similares 9) Pelczar, Michael, et.al, Elementos de Microbiología, McGraw-Hill, Mexico 10) Zinsser, Joklik Willett Amos, Microbiología, Editorial médica panamericana, 18º edición, México. 11) Koheman Elmer w., et.al. Diagnóstico Microbiológico, Panamericana, quinta edición, México. 69