Unidad 3 NOMENCLATURA Y REACCIONES QUÍMICAS DE
Anuncio

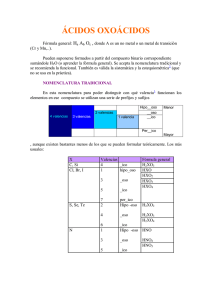
Instituto Tecnológico de Ciudad Valles Unidad 3 3.1 NOMENCLATURA Y REACCIONES QUÍMICAS DE COMPUESTOS INORGÁNICOS Clasificación y nomenclatura de los compuestos inorgánicos. Tomando en consideración que según Brandwein (1988), existen más de |50,000| compuestos químicos inorgánicos en los que no interviene el carbono, se ha buscado un sistema para agruparlos de acuerdo con sus propiedades químicas, para darles nombre y reconocerlos. Se ha dado el nombre de función inorgánica al grupo de compuestos similares que presentan un conjunto de propiedades comunes. Las principales funciones químicas inorgánicas son: Óxidos Hidróxidos Ácidos Sales Hidruros Química. M.C. María Guadalupe Rivera Morales. 2008 86 Instituto Tecnológico de Ciudad Valles La nomenclatura química es el conjunto de reglas que se emiten para dar nombre a cada una de las sustancias químicas. El objeto de la nomenclatura química es identificar a una sustancia química. La nomenclatura química contiene reglas que se han modificado con el tiempo y se seguirán modificando a medida que se obtengan nuevos compuestos o se establezcan acuerdos internacionales para designar a los ya existentes. Las reglas de nomenclatura actuales provienen de los acuerdos internacionales tomados en una asociación mundial de químicos, denominada International Union of Pure and Applied Chemistry, conocida como IUPAC, por sus siglas en inglés (Unión Internacional de Química Pura Aplicada). Para nombrar a los compuestos químicos inorgánicos se siguen normas de la IUPAC. Se aceptan tres tipos de nomenclaturas para los compuestos inorgánicos: la nomenclatura sistemática, la nomenclatura de Stock y la nomenclatura tradicional. Nomenclatura sistemática Para nombrar compuestos químicos según esta nomenclatura se utilizan los prefijos: mono__, di__, tri__, tetra__, penta__, hexa__, hepta__.... Nomenclatura de Stock Este tipo de nomenclatura, cuando el elemento que forma el compuesto tiene más de una valencia, ésta se indica al final, en números romanos y entre paréntesis. Nomenclatura tradicional En esta nomenclatura para poder distinguir con qué valencia funcionan los elementos en ese compuesto se utilizan una serie de prefijos y sufijos. Número de valencias Valencia menor Valencia mayor 1 _ICO 2 _OSO 3 HIPO_OSO _OSO 4 HIPO_OSO _OSO 3.1.1 _ICO _ICO _ICO PER_ICO Óxidos Son compuestos binarios formados por la combinación de un elemento y oxígeno. Hay dos clases de óxidos que son los óxidos básicos y los óxidos ácidos (anhídridos). Química. M.C. María Guadalupe Rivera Morales. 2008 87 Instituto Tecnológico de Ciudad Valles Óxidos básicos. Son compuestos binarios formados por la combinación de un metal y el oxígeno. Su fórmula general es: M2OX Donde M es un metal y X la valencia del metal (el 2 corresponde a la valencia del oxígeno). Las valencias de los elementos se intercambian entre ellos y se ponen como subíndices. (Si la valencia es par se simplifica). Para formular los compuestos se escribe el símbolo del elemento M (metal) y a continuación el del oxígeno (O). Como subíndice del elemento M se coloca la valencia del oxígeno y al oxígeno la valencia del elemento M, simplificando si es posible. A continuación se ejemplifican algunos casos de estos compuestos: Na + O 2 Na2O El sodio es un metal que trabaja con valencia 1 y el oxígeno con valencia 2. Al intercambiar las valencias y colocarlas como subíndices queda: Na 2O Ca + O2 CaO Al combinar el calcio que trabaja con valencia 2 y el oxígeno con valencia 2. Como ambos tienen valencias par se simplifican y queda: CaO Pb + O2 PbO2 En este ejemplo el plomo con valencia 4 y el oxígeno con valencia 2. Como ambos tienen valencia par se simplifican y al intercambiar las valencias y colocarlas como subíndices, queda: PbO2 Fe + O2 Fe2O3 En este caso el hierro con valencia 3 y el oxígeno con valencia 2. Al intercambiar las valencias y colocarlas como subíndices, queda: Fe2O3 Óxidos ácidos o anhídridos. Son compuestos binarios formados por un no metal y oxígeno. Su fórmula general es: N2OX Donde N es un no metal y la X la valencia del no metal (el 2 corresponde a la valencia del oxígeno). Las valencias de los elementos se intercambian entre ellos y se ponen como subíndices. (Si la valencia es par se simplifica). Química. M.C. María Guadalupe Rivera Morales. 2008 88 Instituto Tecnológico de Ciudad Valles Para formular los compuestos se escribe el símbolo del elemento NM (no metal) y a continuación el del oxígeno (O). Como subíndice del elemento NM se coloca la valencia del oxígeno y al oxígeno la valencia del elemento NM, simplificando si es posible. A continuación se ejemplifican algunos casos de estos compuestos: S + O2 SO2 En este caso el azufre con valencia 4 y el oxígeno con valencia 2. Para fórmulas primero se escribe el azufre y luego el oxígeno, al intercambiar las valencias estas se simplifican por ser número par, así que los subíndices son 1 y 2, al intercambiar y colocarlos como subíndices queda: SO2 Cl2 + O2 Cl2O7 En este ejemplo el cloro con valencia 7 se combina con el oxígeno con valencia 2. Para formular se escribe primero el cloro seguida del oxígeno, posteriormente se intercambian las valencias y se escriben como subíndices, quedando de la siguiente manera: Cl2O7 Nomenclatura de los óxidos básicos. Para nombrarlos de acuerdo a las tres reglas de nomenclatura: a) Nomenclatura sistemática: Se escribe primeramente los prefijos mono, di, tri, tetra, penta, etc..., (según los átomos de oxígeno) con la palabra óxido, la preposición de y posteriormente los prefijos di, tri, tetra, etc. (para indicar el número de átomos del metal) seguido del nombre del metal. Prefijo numeral-óxido de prefijo numeral-nombre del metal b) Nomenclatura de Stock: se escribe la palabra óxido, la preposición de, el nombre del metal (se indica la valencia con números romanos entre paréntesis, sí su valencia es única esta no se indica). Óxido de nombre del metal (valencia del metal) c) Nomenclatura tradicional: se escribe la palabra óxido, seguida del nombre del metal con el sufijo oso o ico. Si el metal tiene más de 2 valencias se utiliza terminología. Número de valencias Valencia menor Valencia mayor 1 _ICO 2 _OSO _ICO 3 HIPO _ OSO _OSO 4 HIPO _ OSO _OSO _ICO _ICO PER _ICO Óxido nombre del metal-sufijo Química. M.C. María Guadalupe Rivera Morales. 2008 89 Instituto Tecnológico de Ciudad Valles A continuación se presentan algunos ejemplos utilizando las tres reglas de nomenclatura: Compuesto Nombre sistemático Nomenclatura de Stock Nombre tradicional Ag2O Monóxido de diplata Óxido de plata Óxido argéntico PbO2 Dióxido de plomo Óxido de plomo ( IV ) Óxido plúmbico Na2O Óxido de disodio Óxido de sodio Óxido sódico Au2O3 Trióxido de dioro Óxido de oro (III) Óxido aúrico Fe2O3 Trióxido de dihierro Óxido de hierro (III) Óxido férrico Ejemplo 1 Escribir el nombre de los compuestos NiO y Ni2O3, utilizando las tres reglas de nomenclatura. RESPUESTA Sistemática Stock Tradicional NiO Monóxido de níquel óxido de níquel (II) óxido niqueloso Ni2O3 Trióxido de diníquel óxido de níquel ( III) óxido niquélico Nomenclatura de los óxidos ácidos (anhídridos) Para nombrarlos de acuerdo a las tres reglas de nomenclatura: a) Nomenclatura sistemática: Se escribe primeramente los prefijos mono, di, tri, tetra, penta, etc..., (según los átomos de oxígeno) con la palabra óxido, seguida de la preposición de y posteriormente los prefijos di, tri, tetra, etc. (para indicar el número de átomos del no metal) seguido del nombre del no metal. Prefijo numeral-óxido de prefijo numeral-nombre del no metal b) Nomenclatura de Stock: se escribe la palabra óxido, la preposición de, el nombre del no metal (se indica la valencia con números romanos entre paréntesis, sí su valencia es única esta no se indica). Óxido de nombre del no metal (valencia del no metal) Química. M.C. María Guadalupe Rivera Morales. 2008 90 Instituto Tecnológico de Ciudad Valles c) Nomenclatura tradicional: se escribe la palabra anhídrido, seguido del nombre del no metal con la terminación oso o ico. Si el metal tiene más de dos valencias se utiliza la siguiente terminología. Número de valencias Valencia menor Valencia mayor 1 _ICO 2 _OSO _ICO 3 HIPO _OSO _OSO 4 HIPO _OSO _OSO _ICO _ICO PER _ICO Anhídrido nombre del no metal-sufijo A continuación se presentan algunos ejemplos utilizando las tres reglas de nomenclatura: Compuesto Nombre sistemático Nomenclatura de Stock Nombre tradicional I2O3 Trióxido de diyodo Óxido de yodo (III) Anhídrido yodoso B2O3 Trióxido de diboro Óxido de boro Anhídrido bórico CO2 Dióxido de carbono Óxido de carbono (IV) Anhídrido carbónico Ejemplo 2 Escribir el nombre del compuesto Cl2O, utilizando las tres reglas de nomenclatura. RESPUESTA Sistemática Cl2O monóxido de dicloro Stock óxido de cloro (I) Química. M.C. María Guadalupe Rivera Morales. 2008 Tradicional anhídrido hipocloroso 91 Instituto Tecnológico de Ciudad Valles 3.1.2 Hidróxidos Los hidróxidos, también conocidos como bases son compuestos formados por un metal y el grupo hidroxilo (OH). Su fórmula general es: M(OH)X Donde M es un metal y la X la valencia del metal El grupo OH siempre tiene valencia 1. Estos se obtienen cuando se combina un óxido con agua. Óxido + agua hidróxido Los hidróxidos se formulan escribiendo el metal seguido del radical hidróxido; éste va entre paréntesis si el subíndice es mayor de uno. A continuación se dan ejemplos de algunos hidróxidos: NaO + H2O NaOH El sodio trabaja con valencia 1 y el radical hidróxido tiene valencia 1. Para formular se escribe el metal seguida del OH y como tienen igual valencia no se escribe. CaO + H2O Ca(OH)2 El calcio tiene valencia 2, al formular el compuesto se debe de encerrar entre paréntesis el OH y poner como subíndice el 2. En forma simplificada se pueden formar los hidróxidos combinando directamente el metal con el radical OH-. Si el metal tiene varias valencias, se escribe entre paréntesis el OH y fuera de él, con número romano la valencia con que actuó dicho metal. El plomo tiene dos valencias de 2 y 4, por lo que se tiene al cruzar las valencias: Pb+2 + OH- Pb(OH)2 Pb+4 + OH- Pb(OH)4 Propiedades de las bases a) Tienen sabor a lejía (jabón). b) Reaccionan con los ácidos produciendo sal y agua con desprendimiento de energía y a la reacción se denomina neutralización. c) Causan escozor al contacto con la piel - la sosa cáustica que se usa en la cocina NaOH o la cal. d) Son untuosos y resbalosos al tacto. Para nombrarlos de acuerdo a las tres reglas de nomenclatura: Química. M.C. María Guadalupe Rivera Morales. 2008 92 Instituto Tecnológico de Ciudad Valles a) Nomenclatura sistemática: Se escribe primeramente los prefijos mono, di, tri, tetra, penta, etc..., (según la cantidad de hidroxilos) con la palabra hidróxido, seguida de la preposición de y posteriormente del nombre del metal. Prefijo numeral-hidróxido de nombre del metal b) Nomenclatura de Stock: se escribe la palabra hidróxido, la preposición de, el nombre del metal (se indica la valencia con números romanos entre paréntesis, sí su valencia es única esta no se indica). Hidróxido de nombre del metal (valencia del metal) c) Nomenclatura tradicional: Se escribe la palabra hidróxido, seguido del nombre del metal con la terminación oso (menor valencia) o ico (mayor valencia). Hidróxido nombre del metal-sufijo A continuación se presentan algunos ejemplos utilizando las tres reglas de nomenclatura: Compuesto Nombre sistemático Nomenclatura de Stock Nombre tradicional Ca(OH)2 Dihidróxido de calcio Hidróxido de calcio Hidróxido cálcico Al(OH)3 Trihidróxido de aluminio Hidróxido de aluminio Hidróxido alumínico Pb(OH)4 Tetrahidróxido de plomo Hidróxido de plomo (IV) Hidróxido plúmbico Ejemplo 3 Escribir el nombre de los compuestos Ni(OH)2 y Ni(OH)3, utilizando las tres reglas de nomenclatura. RESPUESTA Sistemática Stock Tradicional Ni(OH)2 dihidróxido de níquel hidróxido de níquel (II) hidróxido niqueloso Ni(OH)2 tetrahidróxido de níquel hidróxido de níquel (III) hidróxido niquélico Química. M.C. María Guadalupe Rivera Morales. 2008 93 Instituto Tecnológico de Ciudad Valles 3.1.3 Ácidos Son compuestos que se caracterizan por poseer en el interior de su molécula, átomos de hidrógeno, que reciben el nombre de iones hidrogeniosos de allí que reciben el nombre de sustancias protonadoras. Existen dos tipos de ácidos. Oxiácidos Hidrácidos Oxiácidos Son compuestos ternarios formados por un no metal, oxígeno e hidrógeno. Se obtienen a partir del óxido ácido o anhídrido correspondiente sumándole una molécula de agua (H2O). Su fórmula general es: H2O + N2Ox = HaNbOc Donde H es el hidrógeno, N el no metal y O el oxígeno. Estos se obtienen cuando se combina un anhídrido (óxido no metálico) con agua. Anhídrido + agua ácido (oxácido) Para escribir la fórmula de un ácido se escribe primero el número total de hidrógenos, el total de elementos no metálicos y por último el total de oxígenos. Si todos los subíndices del compuesto tienen mitad o tercera parte se les saca y se anota la fórmula simplificada: Cl2O + H2O H2Cl2O2 Cl2O + H2O HClO En forma simplificada se pueden formar los oxácidos es combinando directamente el H con el radical. Para formular se escribe el H seguida del radical. Como subíndice del hidrógeno se escribe la valencia del radical. El hidrógeno con el radical PO4 que tiene valencia 3. H+ + PO4-3 H3PO4 El hidrógeno con el radical SO3 que tiene valencia de 2. H+ + SO3-2 Química. M.C. María Guadalupe Rivera Morales. 2008 H2SO3 94 Instituto Tecnológico de Ciudad Valles Lista de aniones más comunes y su carga. No. de oxidación -1 No. de oxidación -2 No. de oxidación -3 ClO Hipocloroso SO3 Sulfuroso AsO3 Arsenioso ClO2 Cloroso SO4 Sulfúrico AsO4 Arsénico ClO3 Clórico CO3 Carbónico PO3 Fosforoso ClO4 Perclórico SiO3 Silícico PO4 Fosfórico BrO Hipobromoso CrO4 Crómico BO3 Bórico BrO2 Bromoso Cr2O7 Dicrómico BrO3 Brómico MnO4 Mánganico BrO4 Perbrómico TeO3 Teluroso IO Hipoyodoso TeO4 Telúrico IO2 Yodoso SeO3 Selenioso IO3 Yódico SeO4 Selénico IO4 Peryódico NO2 Nitroso NO3 Nítrico MnO4 Permangánico CrO4 Percrómico Propiedades de los ácidos a) Tienen sabor agrio. b) Reaccionan con las bases o hidróxidos produciendo sal y agua (Neutralización). c) Tienen olor picante intenso. d) Al contacto con la piel causan ardor. e) Son muy corrosivos, es decir, degradan los metales formando sales y liberando oxígeno. Para nombrarlos se emplea la nomenclatura sistemática y la nomenclatura tradicional. a) Nomenclatura sistemática: se nombran como compuestos binarios. Se escribe primeramente el prefijo numeral mono, di, tri, etc. dependiendo de la cantidad de oxígeno presente con la palabra oxo el nombre del anión con el sufijo –ato, se especifica la valencia del elemento central mediante números romanos entre paréntesis, la preposición de, seguida de la palabra "hidrógeno" Prefijo numeral-oxo-anión-ato (valencia del no metal) de hidrógeno Química. M.C. María Guadalupe Rivera Morales. 2008 95 Instituto Tecnológico de Ciudad Valles b) Nomenclatura de Stock: se escribe la palabra ácido, seguido del prefijo numeral mono, di, tri, etc. Según la cantidad de oxígeno presente con la palabra oxo el nombre del anión con el sufijo ico y por último se especifica la valencia del elemento central mediante números romanos entre paréntesis. Ácido prefijo numeral-oxo-anión-ico (valencia del no metal) c) Nomenclatura tradicional: se escribe la palabra ácido, seguido del nombre del no metal con la terminación oso (menor valencia) e ico (mayor valencia). Si el metal tiene más de dos valencias lleva la siguiente terminología: Número de valencias Valencia menor Valencia mayor 1 _ICO 2 _OSO _ICO 3 HIPO _OSO _OSO 4 HIPO _OSO _OSO _ICO _ICO PER _ICO Ácido no metal-sufijo A continuación se presentan algunos ejemplos utilizando las dos reglas de nomenclatura: Compuesto Nomenclatura sistemática Nomenclatura de Stock Nombre tradicional HClO Monoxoclorato (I) de hidrógeno Ácido Monoxoclórico (I) H2 SO4 Tetraoxosulfato (VI) de hidrógeno Ácido Tetraoxosulfúrico (VI) Ácido sulfúrico H2 CO3 Trioxocarbonato (IV) de hidrógeno Ácido Trioxocarbónico (IV) Ácido carbónico H2 SeO3 Trioxoseleniato (IV) de hidrógeno Ácido Trioxoselenico (IV) Ácido selenioso HBrO4 Tetraoxobromato (VII) de hidrógeno Ácido Tetraoxobrómico (VII) Ácido perbrómico Química. M.C. María Guadalupe Rivera Morales. 2008 Ácido hipocloroso 96 Instituto Tecnológico de Ciudad Valles El fósforo, arsénico y antimonio forman ácidos especiales: Si a los óxidos correspondientes se les suma una molécula de agua se tienen los ácidos META. P2O 3 + H2O = H2P2O4 = HPO2 Ácido metafosforoso P2O 5 + H2O = H2P2O6 = HPO3 Ácido metafosfórico Si a los óxidos correspondientes se les suma dos moléculas de agua se tienen los ácidos PIRO. P2O 5 + 2H2O = H4P2O7 Si a los óxidos correspondientes se les suma tres moléculas de agua se tienen los ácidos ORTO. P2O 3 + 3H2O = H6P2O6 = H3PO3 Ácido ortofosforoso o Ácido fosforoso P2O 5 + 3H2O = H6P2O8 = H3PO4 Ácido ortofosfórico o Ácido fosfórico Hay algunos metales como el cromo y el manganeso que también forman ácidos: H2CrO4 Ácido crómico H2Cr2 O7 Ácido dicrómico H2MnO4 Ácido mangánico HMnO4 Ácido permangánico Ejemplo 4 Escribir el nombre del compuesto HClO, utilizando las reglas de nomenclatura permitidas por la IUPAC. RESPUESTA Sistemática HClO oxoclorato (I) de hidrógeno de Stock ácido oxoclórico (I) Tradicional ácido hipocloroso Hidrácidos Son compuestos binarios que resultan de la combinación del hidrógeno con los no metales de los grupos VI y VII. Los no metales que forman estos ácidos son los siguientes: * Flúor, cloro, bromo, iodo, (todos ellos funcionan con valencia 1). * Azufre, selenio, teluro (funcionan con valencia 2). Su fórmula general es: HxN Química. M.C. María Guadalupe Rivera Morales. 2008 97 Instituto Tecnológico de Ciudad Valles Donde N es el no metal y x la valencia del no metal. El número de oxidación del hidrógeno es +1, por lo que estos se formulan: Se escribe el H seguida del no metal (del grupo VIIA), quedando: HCl Con los elementos del grupo VIA se escribe el símbolo H con el subíndice 2 seguida del no metal, este se escribe: H2S Estos compuestos pueden estar en estado puro y en solución, para nombrarlos solo se utiliza la nomenclatura tradicional. a) Nomenclatura tradicional: En estado puro: se indica el nombre del no metal con la terminación uro, la preposición de, la palabra hidrógeno. En solución: se pone la palabra ácido, seguido del nombre del no metal con la terminación hídrico. A continuación se presentan algunos ejemplos de la nomenclatura tradicional: Compuesto Nombre tradicional Nombre tradicional (en estado puro) (en solución) HBr Bromuro de hidrógeno Ácido Bromhídrico H2S Sulfuro de hidrógeno Ácido Sulfhídrico H2Se Selenuro de hidrógeno Ácido Selenhídrico HI Yoduro de hidrógeno Ácido Yodhídrico Ejemplo 5 Escribir el nombre del HCl (ac) y del HCl (g), utilizando la regla de nomenclatura permitida por la IUPAC. RESPUESTA Tradicional HCl(ac) ácido clorhídrico HCl(g) cloruro de hidrógeno Química. M.C. María Guadalupe Rivera Morales. 2008 98 Instituto Tecnológico de Ciudad Valles 3.1.4 Sales Son compuestos que resultan de sustituir a los átomos de hidrógeno de un ácido por elementos o radicales metálicos y de sustituir los OH- de las bases por aniones o iones poliatómicos negativos. Hay dos clases: Oxisales Sales Haloideas. La reacción química por medio de la cual obtenemos las sales se denomina neutralización (reacción entre ácido e hidróxido) Ácido + hidróxido sal + agua Como ejemplos de estas reacciones tenemos: HNO3 + NaOH NaNO3 + H2O HCl + NaOH NaCl + H2O Oxisales Son compuestos ternarios formados por un metal, un no metal y el oxígeno. Por lo que se puede decir que son derivados de la unión de cationes y aniones. Se obtienen a partir de los ácidos oxácidos sustituyendo los hidrógenos de éstos por un metal. Existen tres tipos de oxisales: neutras, ácidas y básicas. Las sales neutras son aquellas que contienen un metal y un ión poliatómico (radical). Las sales ácidas, contienen aparte de los dos elementos anteriores uno o dos átomos de hidrógeno y las sales básicas, contiene en su molécula unos o dos átomos de OH. Sales neutras Se obtienen sustituyendo todos los hidrógenos de un ácido oxácido por un metal. Para su formulación se escribe el símbolo del metal seguido del radical (ion poliatómico). La valencia radical se le pone como subíndice al metal y la valencia del metal se le pone como subíndice al radical ( sí el subíndice es mayor de uno se encierra entre paréntesis) Cu+1 + NO3-1 Fe+2 + NO3- CuNO3 Fe(NO3)2 Sales ácidas Son compuestos que se obtienen sustituyendo parte de los hidrógenos de un ácido oxácido por un metal. Para su formulación se escribe el símbolo del metal seguido del radical (ión poliatómico). Química. M.C. María Guadalupe Rivera Morales. 2008 99 Instituto Tecnológico de Ciudad Valles La valencia radical se le pone como subíndice al metal y la valencia del metal se le pone como subíndice al radical (sí el subíndice es mayor de uno se encierra entre paréntesis). Na+ + HCO3- NaHCO3 Sales básicas Se originan cuando en una reacción de neutralización hay un exceso de hidróxido respecto del ácido. Son compuestos que poseen algún grupo OH-. Mg(OH)NO3 Radicales para formar sales ácidas No. de oxidación -1 No. de oxidación -2 No. de oxidación -3 ClO Hipoclorito SO3 Sulfito AsO3 Arsenito ClO2 Clorito SO4 Sulfato AsO4 Arseniato ClO3 Clorato CO3 Carbonato PO3 Fosfito ClO4 Perclorato SiO3 Silicato PO4 Fosfato BrO Hipobromito CrO4 Cromato BO3 Borato BrO2 Bromito Cr2O7 Dicromato BrO3 Bromato MnO4 Manganato BrO4 Perbromato HPO3 Fosfito ácido IO Hipoyodito HPO4 Fosfato ácido IO2 Yodito IO3 Yodato IO4 Peryodato NO2 Nitrito NO3 Nitrato MnO4 Permanganato CrO4 Percromato HSO3 Sulfito ácido o bisulfito HSO4 Sulfato ácido o bisulfato HCO3 Carbonato ácido ó bicarbonato H2PO3 Fosfito de ácido H2PO4 Fosfato de ácido Química. M.C. María Guadalupe Rivera Morales. 2008 100 Instituto Tecnológico de Ciudad Valles Las oxisales se nombran de acuerdo a las siguientes reglas de nomenclatura de la I.U.P.A.C. a) Nomenclatura de stock; Se escribe el nombre del no metal con los prefijos (hipo o per) si es que el no metal tiene más de dos valencias con los sufijos (ito o ato), la preposición de, el nombre del metal (indicando entre paréntesis y con número romano la valencia, sí tiene una sola valencia esta no se indica). Número de valencias Valencia menor Valencia mayor 1 _ICO 2 _OSO _ICO 3 HIPO _OSO _OSO 4 HIPO _OSO _OSO _ICO _ICO PER _ICO Nombre anión-sufijo de nombre del metal c) Nomenclatura tradicional: se escribe el nombre del no metal con los prefijos (hipo o per) si es que el no metal tiene más de dos valencias con los sufijos (ito o ato), seguido del nombre del metal con el sufijo oso o ico. A continuación se presentan algunos ejemplos utilizando las dos reglas de nomenclatura: Compuesto Nomenclatura de Stock Nombre tradicional Ca(ClO 2)2 Clorito de calcio Clorito cálcico Na2 SO4 Sulfato de sodio Sulfato sódico Carbonato de hierro (III) Carbonato férrico Sulfato de calcio Sulfato cálcico Clorato de estaño (IV) Clorato estánnico Fe2 (CO3)3 CaSO 4 Sn(ClO 3)4 Las sales ácidas se nombran igual que las neutras. a) Nomenclatura de Stock: se escribe el nombre del no metal con el sufijo ito (menor valencia) o ato (mayor valencia) precedida de la palabra ácido si tiene un hidrógeno o diácido si tiene dos hidrógeno, la preposición de, seguido del nombre del metal (indicando entre paréntesis y con número romano la valencia del metal). Química. M.C. María Guadalupe Rivera Morales. 2008 101 Instituto Tecnológico de Ciudad Valles Pb(HSO3) 4 Sulfito ácido de plomo (IV) NaHCO3 Carbonato ácido de sodio K2HPO 4 Fosfato ácido de potasio NaH2PO 4 Sulfato diácido de sodio b) Nomenclatura de tradicional: se escribe el nombre del no metal con el sufijo ito (menor valencia) o ato (mayor valencia) precedida de la palabra ácido si tiene un hidrógeno o diácido si tiene dos hidrógeno, la preposición de, seguido del nombre del metal con el sufijo oso o ico. En las sales básicas Zn(OH)Cl Cloruro de hidroxicinc [Ca(OH)2SO 4 Sulfato bis-hidroxicalcio Sales binarias o haloideas Son compuestos binarios que resultan de sustituir el hidrógeno de los hidrácidos por no metales es decir resultar de reaccionar un hidrácido con un hidróxido. Se forman por un metal y un no metal. HF + NaOH NaF + H2O Su fórmula es: Mx(N)x Donde M es un metal, N el no metal y x la valencia de ambos. Para su formulación se escribe primero el símbolo del metal seguido el símbolo del no metal. Las valencias de los elementos se cruzan colocándolas como subíndices. NaCl Na2S FeBr2 Iones negativos para formar sales binarias e hidrácidos No. de Oxidación -1 No. de oxidación -2 F Fluoruro S Sulfuro Cl Cloruro Se Seleniuro Br Bromuro I Yoduro CN Cianuro Química. M.C. María Guadalupe Rivera Morales. 2008 102 Instituto Tecnológico de Ciudad Valles Para nombrarlos de acuerdo a las tres reglas de nomenclatura: a) Nomenclatura sistemática: Se escribe primeramente los prefijos mono, di, tri, tetra, penta, etc..., (de acuerdo al número del anión) con el nombre del no metal con la terminación uro y posteriormente del nombre del metal. b) Nomenclatura de Stock: se escribe el nombre del no metal con la terminación uro, la preposición de, el nombre del metal (se indica la valencia con números romanos entre paréntesis, sí su valencia es única esta no se indica). c) Nomenclatura tradicional: se escribe el nombre del no metal con la terminación uro, la preposición de, el nombre del metal con la terminación: Número de valencias Valencia menor Valencia mayor 1 _ICO 2 _OSO _ICO 3 HIPO _OSO _OSO 4 HIPO _OSO _OSO _ICO _ICO PER _ICO A continuación se presentan algunos ejemplos utilizando las tres reglas de nomenclatura: Compuesto Nombre sistemático Nomenclatura de Stock Nombre tradicional KBr Monobromuro de potasio Bromuro de potasio Bromuro de potásico Fe2S3 Trisulfuro de dihierro Sulfuro de hierro(III) Sulfuro férrico ZnSe Monoseleniuro de cinc Seleniuro de cinc Seleniuro cíncico Au2Te Monotelururo de dioro Telururo de oro (I) Telururo auroso Diyoduro de mercurio Yoduro de mercurio (II) Yoduro mercúrico HgI2 Química. M.C. María Guadalupe Rivera Morales. 2008 103 Instituto Tecnológico de Ciudad Valles Ejemplo 6 Escribir el nombre del compuesto FeCl2, utilizando las reglas de la IUPAC. RESPUESTA Sistemática FeCl2 dicloruro de hierro 3.1.5 Stock Tradicional cloruro de hierro (II) cloruro ferroso Hidruros Son compuestos binarios formados por un metal o no metal e Hidrógeno. Hay dos clases de hidruros: Hidruros metálicos Hidruros no metálicos. Hidruro metálico Es la combinación de un metal con el hidrógeno. Su fórmula general es: MHX Donde M es un metal y la X la valencia del metal. El hidrógeno siempre tiene su número de oxidación de -1. Para formular los compuestos se escribe el símbolo del elemento M (metal) y a continuación el del hidrógeno (H). Como subíndice del elemento M se coloca la valencia del Hidrógeno, pero como esta es 1 no se escribe y al hidrógeno (H) la valencia del elemento M. Na + H2 NaH En este caso el sodio y el hidrógeno tienen valencia 1. Al formular se escribe primero el Na seguida del H. Como tienen igual valencia (1), estas no se escriben. NaH Ca + H2 CaH2 En este compuesto el calcio con valencia 2 se combina con el hidrógeno con valencia 1. Para formular los compuestos se escribe primero el símbolo del calcio seguida del hidrógeno. Colocando al hidrógeno la valencia del calcio como subíndice, nos queda: CaH2 Química. M.C. María Guadalupe Rivera Morales. 2008 104 Instituto Tecnológico de Ciudad Valles Para nombrarlos de acuerdo a las tres reglas de nomenclatura: a) Nomenclatura sistemática: Se escribe primeramente los prefijos mono, di, tri, tetra, penta, etc..., (según los átomos de hidrógeno) con la palabra hidruro, seguida de la preposición de y posteriormente los prefijos di, tri, tetra, etc. (para indicar el número de átomos del metal) seguido del nombre del metal. b) Nomenclatura de Stock: se escribe la palabra hidruro, la preposición de, el nombre del metal (se indica la valencia con números romanos entre paréntesis, sí su valencia es única esta no se indica). c) Nomenclatura tradicional: Se escribe la palabra hidruro, seguido del nombre del metal con la terminación oso (menor valencia) o ico (mayor valencia). A continuación se presentan algunos ejemplos utilizando las tres reglas de nomenclatura: Compuesto Nombre sistemático Nomenclatura de Stock Nombre tradicional CaH2 Dihidruro de calcio Hidruro de calcio Hidruro cálcico NaH Monohidruro de sodio Hidruro de sodio Hidruro sódico FeH2 Dihidruro de hierro Hidruro de hierro (II) Hidruro ferroso FeH3 Trihidruro de hierro Hidruro de hierro (III) Hidruro férrico NiH2 Dihidruro de níquel Hidruro de níquel (II) Hidruro niqueloso Ejemplo 7 Escribir la fórmula de los siguientes compuestos: trihidruro de aluminio, hidruro estannoso e hidruro de magnesio. RESPUESTA Trihidruro de aluminio, AlH3; hidruro de estannoso, SnH2; hidruro de magnesio MgH2 Hidruros no metálicos Son compuestos binarios formados por la combinación de un no metal con el Hidrógeno. Química. M.C. María Guadalupe Rivera Morales. 2008 105 Instituto Tecnológico de Ciudad Valles Con los no metales de los grupos VI y VII, forman hidrácidos. Los no metales como el nitrógeno, fósforo, arsénico, antimonio, carbono, silicio y boro forman compuestos con el hidrógeno y reciben nombres especiales. Estos se formulan de acuerdo a la posición que ocupe el elemento en la siguiente lista: Rn, Xe, Kr, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, Y, Br, Cl, O, F. Si el elemento esta antes del hidrógeno de la lista anterior este se formula como: Se escribe el símbolo del no metal seguida del hidrógeno, colocando a éste la valencia del no metal como subíndice, queda: NH3 Para nombrarlos de acuerdo a las tres reglas de nomenclatura: a) Nomenclatura sistemática: Se escribe primeramente los prefijos mono, di, tri, tetra, penta, etc..., (según los átomos de hidrógeno) con la palabra hidruro, seguida de la preposición de y posteriormente los prefijos di, tri, tetra, etc. (para indicar el número de átomos del no metal) seguido del nombre del no metal. b) Nomenclatura de Stock: se escribe la palabra hidruro, seguido del nombre del metal (se indica la valencia con números romanos entre paréntesis, sí la valencia es única esta no se indica). c) Nomenclatura tradicional: Recibe nombres especiales. A continuación se presentan algunos ejemplos utilizando las tres reglas de nomenclatura: Compuesto Nombre sistemático Nomenclatura de Stock Nombre tradicional SiH4 Tetrahidruro de silicio Hidruro de silicio Silano CH4 Tetrahidruro de carbono Hidruro de carbono Metano BH3 Trihidruro de boro Hidruro de boro Borano Ejemplo 8 Escribir el nombre del siguiente compuesto SbH3, utilizando la nomenclatura sistemática. RESPUESTA SbH3 Trihidruro de antimonio Química. M.C. María Guadalupe Rivera Morales. 2008 106 Instituto Tecnológico de Ciudad Valles Ejemplo 9 Escribir la fórmula de los siguientes compuestos: Amoníaco y Fosfina(también conocida como fosfamina) RESPUESTA Amoníaco NH3 3.2 Fosfina PH3 Compuestos químicos de importancia económica, industrial y ambiental . Importancia socioeconómica de los elementos: NaCl o Sal. También llamado cloruro de sodio, compuesto químico de fórmula NaCl. El término sal también se aplica a las sustancias producidas en la reacción de un ácido con una base, llamada reacción de neutralización. Las sales se caracterizan por sus enlaces iónicos, lo que da lugar a puntos de fusión relativamente altos, conductividad eléctrica en disolución o fundidas y estructura cristalina en estado sólido. El uso más común de la sal es la salazón. La sal es un componente esencial de la dieta de los seres humanos y de otros animales de sangre caliente. Algunas personas restringen su consumo directo de sal, pero obtienen las cantidades necesarias comiendo carne y pescados que la contienen. La sal de mesa común destinada al consumo en zonas continentales alejadas del mar suele contener pequeñas cantidades de yodo para prevenir el bocio. Los animales salvajes a menudo se congregan en torno a corrientes saladas o en superficies con incrustaciones de sal para lamer los depósitos de sal. Industrialmente la sal es la fuente de obtención del cloro y del sodio, así como de sus respectivos compuestos. Entre los compuestos del cloro de relevancia comercial se encuentran el ácido clorhídrico, el cloroformo, el tetracloruro de carbono y el polvo de blanquear. Entre los compuestos de sodio más importantes se encuentra el carbonato de sodio, el sulfato de sodio, el bicarbonato de sodio, el fosfato de sodio y el hidróxido de sodio. La sal se emplea también para preservar carnes y pescados, y en ciertos métodos de refrigeración para preparar mezclas frigoríficas, así como en los procesos de teñido y para fabricar jabón y vidrio. Al ser transparentes a los rayos infrarrojos, los cristales de sal se utilizan para hacer los prismas y lentes de instrumentos empleados en el estudio de estos rayos. H2SO4 o Ácido sulfúrico. Es un líquido corrosivo, de gran viscosidad, incoloro y con una densidad relativa de 1.85. Tiene un punto de fusión de 10.36 °C, un punto de ebullición de 340 °C y es soluble en agua en cualquier proporción. Al mezclar ácido sulfúrico con agua se libera una considerable cantidad de calor. El ácido sulfúrico concentrado, llamado antiguamente aceite de vitriolo, es un importante agente desecante. Actúa tan vigorosamente en este aspecto que extrae el agua, y por lo tanto carboniza, la madera, el algodón, el azúcar y el papel. Debido a estas propiedades desecantes, se usa para fabricar éter, nitroglicerina y tintes. Cuando se calienta, el ácido sulfúrico concentrado se comporta como un Química. M.C. María Guadalupe Rivera Morales. 2008 107 Instituto Tecnológico de Ciudad Valles agente oxidante capaz, por ejemplo, de disolver metales tan poco reactivos como el cobre, el mercurio y el plomo, produciendo el sulfato del metal, dióxido de azufre y agua. Los usos del ácido sulfúrico son tan variados que el volumen de su producción proporciona un índice aproximado de la actividad general industrial. Por ejemplo, a principios de la década de 1970, la producción anual de ácido sulfúrico en Estados Unidos, el mayor productor, sobrepasaba los 29 millones de toneladas, que corresponden a una producción diaria de 1/3 kg por persona al año. El ácido sulfúrico se utiliza principalmente para hacer fertilizantes, tanto superfosfato como sulfato de amonio. También se usa para fabricar productos orgánicos, pinturas y pigmentos, y rayón, así como para refinar petróleo y procesar metales. Uno de los pocos productos de consumo que contienen ácido sulfúrico como tal, es la batería de plomo, que se utiliza en los automóviles. NH3 o Amoníaco. Gas de olor picante, incoloro, muy soluble en agua. Una disolución acuosa saturada contiene un 45% en peso de amoníaco a 0 °C, y un 30% a temperatura ambiente. Disuelto en agua, el amoníaco se convierte en hidróxido de amonio, NH4OH, de marcado carácter básico y similar en su comportamiento químico a los hidróxidos de los metales alcalinos. En el siglo XIX, la principal fuente de amoníaco fue la destilación de la hulla; era un derivado importante en la fabricación de los combustibles gaseosos. Hoy, la mayoría del amoníaco se produce sintéticamente a partir de hidrógeno y nitrógeno por el proceso de Haber-Bosch. El amoníaco es un refrigerante importante y se usa mucho en la industria química, especialmente en la fabricación de fertilizantes, ácido nítrico y explosivos. Importancia ecológica de los compuestos: Óxidos de Carbono: CO2 o Dióxido de carbono. Gas incoloro, inodoro y con un ligero sabor ácido, cuya molécula consiste en un átomo de carbono unido a dos átomos de oxígeno. El dióxido de carbono se produce por diversos procesos: por combustión u oxidación de materiales que contienen carbono, como el carbón, la madera, el aceite o algunos alimentos; por la fermentación de azúcares, y por la descomposición de los carbonatos bajo la acción del calor o los ácidos. Comercialmente el dióxido de carbono se recupera de los gases de hornos de calcinación, de los procesos de fermentación, de la reacción de los carbonatos con los ácidos, y de la reacción del vapor con el gas natural, una fase de la producción comercial de amoníaco. El dióxido de carbono se purifica disolviéndolo en una solución concentrada de carbonato alcalino y luego calentando la disolución con vapor. El gas se recoge y se comprime en cilindros de acero. El dióxido de carbono se usa para fabricar carbonato de sodio, Na2CO3 · 1OH2O (sosa para lavar), e hidrogenocarbonato de sodio, NaHCO3 (bicarbonato de sodio). Disuelto bajo una presión de 2 a 5 atmósferas, el dióxido de carbono produce la efervescencia de las bebidas gaseosas. No arde ni sufre combustión, por lo que se emplea en extintores de fuego. El extintor de CO2 es un cilindro de acero lleno de dióxido de carbono líquido que, cuando se libera, se expande repentinamente y produce una bajada de temperatura tan enorme que se solidifica en "nieve" en polvo. Esta nieve se volatiliza (se evapora) al contacto con la sustancia en combustión, produciendo una capa de gas que enfría y Química. M.C. María Guadalupe Rivera Morales. 2008 108 Instituto Tecnológico de Ciudad Valles mitiga la llama. El dióxido de carbono sólido, conocido como hielo seco, se usa mucho como refrigerante. Su capacidad para enfriar es casi el doble que la del hielo del agua; sus ventajas son que no pasa a líquido sino que se convierte en un gas, produciendo una atmósfera inerte que reduce el crecimiento de las bacterias. CO o Monóxido de carbono. Compuesto químico de carbono y oxígeno. Es un gas incoloro e inodoro, un 3% más ligero que el aire, que resulta venenoso para los animales de sangre caliente y muchas otras formas de vida. El monóxido de carbono es un importante combustible industrial y un componente del gas pobre, del gas de altos hornos y del gas de hulla. En la metalurgia del acero fundido, el monóxido de carbono formado a partir del coque, actúa como agente reductor, extrayendo el oxígeno del mineral. El monóxido de carbono se combina activamente con el cloro para formar cloruro de carbonilo o fosgeno, y calentado en presencia de un catalizador se combina con el hidrógeno formando metanol. La combinación directa del monóxido de carbono con ciertos metales, forma compuestos gaseosos, y se emplea para el refinado de dichos metales, especialmente el níquel. Óxidos de Nitrógeno: De estos ya se conocen varios efectos sobre la salud, sobre todo del sistema respiratorio, se produce cuando se queman combustibles fósiles de automotores, plantas de poder, hornos y turbinas. Además debido a que la gente lleva a cabo la mayoría de sus actividades domesticas en interiores, esta fuertemente expuesta a este contaminante, donde la combustión por tabaco y gas LP son la principal fuente de contaminación. Los óxidos de nitrógeno (NOx) son importantes contribuyentes potenciales de fenómenos nocivos como la lluvia ácida y la eutroficación en las zonas costeras. La eutroficación ocurre cuando un cuerpo de agua sufre un notable incremento de nutrientes como los nitratos reduciendo la cantidad de oxígeno disuelto, transformando el ambiente en un medio no viable para los seres vivientes. Óxidos de Azufre: El desarrollo industrial, principalmente la metalurgia y el incremento continuo en la fabricación de automóviles de combustión interna generan contaminantes peligrosos para la vida como: óxidos de azufre que mediante otras reacciones químicas se trasforman en ácido sulfúrico, óxidos de nitrógeno que se transforma en ácido nítrico, además de aldehídos, ácido sulfhídrico, ácido fluorhídrico, arsénico y algunos derivados de metales como el plomo, el zinc, el mercurio, el cadmio y el cobre. El SO2 es un gas que pertenece a la familia de los gases de óxidos de azufre (SOx), que se producen principalmente de la combustión de compuestos que contienen azufre -carbón y aceite- y durante ciertos procesos industriales y en la producción de acero. Este gas incoloro y con sabor ácido picante, es percibido por el olfato en concentraciones hasta de 3 ppm (0.003%) a 5 ppm (0.005%). Cuando se encuentra en niveles de 1 a 10 ppm induce al aumento de la frecuencia respiratoria y el pulso. Cuando alcanza las 20 ppm produce una fuerte irritación en ojos, nariz, garganta, incrementa la crisis asmática y recrucede las alergias respiratorias. Si la concentración y el tiempo de exposición aumentan, se producen afecciones respiratorias severas. Una exposición a 400 - 500 ppm, aunque Química. M.C. María Guadalupe Rivera Morales. 2008 109 Instituto Tecnológico de Ciudad Valles sea corta, puede resultar fatal para el organismo al producir y agravar ciertos padecimientos cardiovasculares. SO2 o Dióxido de Azufre. Son causa directa de la lluvia ácida cuyos efectos son muy importantes tanto en las grandes ciudades acelerando la corrosión de edificios y monumentos, reduciendo significativamente la visibilidad como en el campo, produciendo la acidez de lagos, ríos y suelos. SO3 o Trióxido de Azufre. Es un agente deshidratante poderosísimo, se obtiene por oxidación del anhídrido sulfuroso, SO2. Por calentamiento de ácido sulfúrico se desprende SO3. Cromato: Los iones de cromato disueltos en agua constituyen un grave problema para la salud de los seres vivientes pues causa la muerte por envenenamiento. Arsenato de Potasio: Son compuesto que están en: cemento, asbesto, estos compuestos causan problemas en vías respiratorias Arsenato de Sodio: Son los principales contaminantes de lagos y ríos, estos compuestos provienen de los detergentes en especial. 3.3 Clasificación de las reacciones químicas de los compuestos inorgánicos Las reacciones químicas son cambios químicos que presentan las sustancias al combinarse. Es la transformación que experimenta una sustancia en su estructura molecular por acción de otra sustancia o de algún agente energético para dar origen a una nueva sustancia química. Así por ejemplo, el ácido clorhídrico reacciona con el zinc metálico para producir cloruro de zinc con desprendimiento de gas hidrógeno. Evidencias del desarrollo de una reacción química: * Formación de precipitados (sólidos). * Desprendimiento de especies gaseosas con cambio de temperatura. * Formación de un gas. * Desprendimiento de Luz y Energía. Una ecuación química es la representación matemática de una reacción química (cambio químico) y consiste en relacionar cualitativa y cuantitativamente la combinación de las fórmulas para efectuar un cambio químico de acuerdo a la ley de la conservación de la materia. “En todo reacción química la suma de las masas de los reactivos, es igual a la suma de las masas de los productos”. Química. M.C. María Guadalupe Rivera Morales. 2008 110 Instituto Tecnológico de Ciudad Valles Como por el ejemplo: 2HCl + Zn ZnCl2 + H2 73 g 65 g = 136 g 2 g 138 g = 138 g Partes de una Ecuación Química: 1. El sistema inicial (antes de efectuarse el cambio químico) lo forman las sustancias que van a reaccionar y se llaman reactantes o reactivos, HCl y Zn. 2. El sistema final lo constituyen las sustancias formadas o productos después de reaccionar, ZnCl2 y H2. 3. Estos dos sistemas se separan mediante una flecha horizontal que indica el sentido de la reacción y quiere decir se forma o se produce, . Simbología que se emplea en las ecuaciones químicas y reglas que deben seguirse: 1. Escribir correctamente las fórmulas de reactivos y productos. 2. Separar reactivos y productos por medio de la flecha que indica el sentido de la reacción. 3. Balancear la ecuación colocando los coeficientes adecuados en reactivos y productos. 4. No debe inventarse; las reacciones deben ser reales. Reactividad Química y Uso de la Tabla Periódica: A menudo podemos predecir el comportamiento químico de una sustancia, si hemos visto o sabemos como se comporta una sustancia similar. Por ejemplo, el sodio (Na) reacciona con agua (H2O) para formar hidróxido de sodio (NaOH) y H2 gaseoso: Na + H2O NaOH + H2 Como el Potasio (K) está en la misma familia (columna) que el sodio en la tabla periódica, es posible predecir que la reacción del K con el H2O será similar a la del Na: K + H2O KOH + H2 No solo eso, de hecho podemos predecir que todos los metales alcalinos reaccionan con el agua para formar sus hidróxidos e hidrógeno. De la misma manera podemos utilizar la tabla periódica para predecir la reactividad de otros elementos químicos. Química. M.C. María Guadalupe Rivera Morales. 2008 111 Instituto Tecnológico de Ciudad Valles Clasificación de las reacciones químicas: Tipos Adición Desplazamiento Descomposición Iónicas Metatesis Precipitación Redox Dismutación Substitución 3.3.1 3.3.1.1 Ejemplo CH2=CH2 + Br2 BrCH2CH2Br H3O+ + OH- 2H2O 2H2O2 2H2O + O2 H+ + Cl - + Na+ + OH - H2O + Na+ + Cl2HCl + Na2S H2S(g) + 2NaCl AgNO3 + NaCl AgCl(s) + NaNO3 SO2 + H2O H2SO3 12OH- + 6Br2 BrO3 - + 10Br- + 6H2O CH4 + Cl2 CH3Cl + HCl Con base en cambios químicos Reacciones de combinación, síntesis o adición En la cual dos o más reactantes se combinan para dar un solo producto más complejo. A + B AB A continuación, se mencionan algunos ejemplos: O2 + Al Al2O3 S + O2 SO3 K + O2 K2O Fe2O3 + H2O Fe (OH)3 3.3.1.2 Reacciones de descomposición En este tipo de reacciones, un compuesto se descompone para formar dos o mas sustancias nuevas, las sustancias formadas pueden ser elementos o compuestos más sencillos, por lo general es necesario la acción del calor o la corriente eléctrica. AB A + B A continuación, se mencionan algunos ejemplos: KClO3 + calor KCl + O2 CaCO3 + calor CaO + CO2 Química. M.C. María Guadalupe Rivera Morales. 2008 112 Instituto Tecnológico de Ciudad Valles H2O + electricidad H2 + O2 NaCl + electricidad Na + Cl2 3.3.1.3 Reacciones de desplazamiento (sustitución simple) En éste tipo de reacciones un elemento más activo sustituye a otro menos activo o cuando los ácidos fuertes atacan a los metales. A + BC B + AC A continuación, se mencionan algunos ejemplos: Fe + CuSO4 FeSO4 + Cu Zn + HCl ZnCl + H2 Para este tipo de reacciones es muy útil la serie electromotriz de los metales, la que está ordenada de acuerdo al potencial de “H”, y por convenio se le da el valor de cero. Los metales que se encuentran a la izquierda desplazaran a los metales que se encuentren a la derecha de él, en una reacción de desplazamiento. Como los ejemplos anteriores. Li>K>Na>Ba>Sr>Mg>Be>Al>Mn>Zn>Cr>Fe>Co>Ni>Sn>Pb>H>Cu>Ag>Hg>Pt>Au 3.3.1.4 Reacciones de doble desplazamiento o metátesis En este tipo de reacciones hay intercambio de iones. Los nuevos compuestos se forman combinándose un ión positivo de un compuesto con el ión negativo del otro compuesto de los reactantes. AB + CD CB + AD A continuación, se mencionan algunos ejemplos: AgNO3 + HCl AgCl + HNO3 NaOH + HCl NaCl + H2O 3.3.1.5 Reacciones de neutralización Son reacciones de doble desplazamiento, donde los reactantes son un ácido más una base y como producto se obtiene una sal mas agua. Química. M.C. María Guadalupe Rivera Morales. 2008 113 Instituto Tecnológico de Ciudad Valles Ácido + Base Sal + Agua Como ejemplo, tenemos: HNO3 + NaOH NaNO3 + H2O 3.3.1.6 Reacción de Oxidación - Reducción (REDOX) Son aquellas reacciones donde se verifican simultáneamente una oxidación y una reducción, llamadas también reacciones de transferencia de electrones, existiendo cambios en los estados de oxidación. Oxidación.- Cuando un reactante pierde electrones o se da un aumento en el estado de oxidación, se le llama agente reductor. Na0 Na+ + e Reducción.- Cuando un reactante gana electrones o se da una disminución en el estado de oxidación, se le llamada agente oxidante. Cl20 + 2e- 2ClA estas ecuaciones se les llama semireacciones y siempre van en pares. Juntas hacen una reacción completa al sumarse (el Na le dio electrones al Cl): 2Na0 2Na+ + 2e Cl20 + 2e - 2Cl2Na + Cl2 2NaCl 3.3.2 3.3.2.1 Con base en aspectos energéticos Reacciones exotérmicas Son aquellas reacciones que al efectuarse el sistema desprende calor, donde la energía total de los reactantes es mayor que la energía total de los productos. Por ejemplo al verter ácido sulfúrico sobre agua, de inmediato aumenta la temperatura de 18ºC a 69ºC aproximadamente. A + B C + calor A continuación, se mencionan algunos ejemplos: Zn + H2SO4 ZnSO4 + H2 + calor Na + H2O NaOH + H2 + calor Química. M.C. María Guadalupe Rivera Morales. 2008 114 Instituto Tecnológico de Ciudad Valles 3.3.2.2 Reacciones endodérmicas Son aquellas reacciones donde hay absorción de calor al efectuarse, la energía total de los productos es mayor que la energía total del reactante. A + B + calor C A continuación, se mencionan algunos ejemplos: Fe + S + calor FeS CaCO3 + calor CaO + CO2 Ejemplo 10 La siguiente reacción: 2NaHCO3 Na2CO3 + H2O + CO2, a que clase de reacción química pertenece. RESPUESTA Descomposición Ejemplo 11 La siguiente ecuación química es de: N2 + H2 NH3 + 46.5 KJ/mol RESPUESTA Exotérmica 3.4 Balanceo de reacciones químicas Una ecuación química debe estar correctamente balanceada, o sea, cumplir con la Ley de la conservación de la materia o masa de Lavoisier. La ley aplicada a una ecuación química indica que el número de átomos o moles de átomos de cada elemento deberá ser la misma en ambos lados de la ecuación, esto es, balanceada. Las ecuaciones sencillas se pueden resolver fácilmente al balancear o equilibrar por medio del método de tanteo, es decir, colocar coeficientes a los reactivos y a los productos de reacción de Química. M.C. María Guadalupe Rivera Morales. 2008 115 Instituto Tecnológico de Ciudad Valles manera que el número de átomos que haya en los reactivos sea igual a los existentes en los productos de la reacción. Para la realización práctica de este método se sugieren los siguientes pasos: 1. Escribir las fórmulas de los compuestos de forma correcta tanto en los reactivos como en los productos; una vez hecho esto, no se debe cambiar ninguna de ellas durante la siguiente operación de equilibrio. 2. Elegir el compuesto que contiene el mayor número de átomos de un elemento ya sea un reactivo o un producto. Este elemento no debe ser oxígeno o hidrógeno, y se equilibrará por medio de coeficientes que se irán calculando por el método de tanteo. Es importante resaltar en este punto que los subíndices de las fórmulas químicas jamás se deben alterar cuando se equilibre la ecuación. Equilibrar los hidrógenos, ya que por lo general se balancea primero el de agua, luego los de oxígeno. Verificar que todos los coeficientes sean números enteros y que se encuentren en la menor proporción posible. 3.4.1 Por el método redox Las reacciones químicas de oxidación-reducción, conocidas también como reacciones redox, son aquellas en las que se transfieren electrones y este intercambio de electrones modifica los números de oxidación de los elementos participantes; es decir, unos ganan electrones y otros los pierden. Para balancear por este método es necesario conocer los estados de oxidación. Principales estados de oxidación. Todos los elementos en estado neutro tienen estados de oxidación de cero. Por ejemplo el O2, Cl2, Cu, Zn; P4 El oxígeno (O) en compuestos como óxidos, ácidos y sales oxácidas tiene estados de oxidación de –2. El hidrógeno (H) en diferentes compuestos tiene Estado de Oxidación de –1 en los hidruros metálicos y +1 en el resto de los casos que son la mayoría. Los metales formando parte de moléculas tienen estados de oxidación positivos. Como ejemplo, se menciona la molécula de bióxido de carbono, CO2: el átomo de C forma dos enlaces covalentes con dos átomos de O más electronegativo que él. Comparte los 4 electrones, pero para saber cuales son los estados de oxidación, hay que suponer que el C los pierde, y que el O los gana, con lo cual la carga que tendría el C sería “+4” y la del O “–2”, por lo que el estados de oxidación del carbono es +4 y la del oxígeno –2. En el caso de compuestos que contienen S, como Química. M.C. María Guadalupe Rivera Morales. 2008 116 Instituto Tecnológico de Ciudad Valles el H2SO4, El S tiene estados de oxidación +2, +4 y +6 según comparta 2, 4 o los 6 electrones de valencia con un elemento más electronegativo (por ejemplo O), en este compuesto el S comparte 6 electrones su carga es +6, el oxígeno es -2 y el Hidrógeno +1. También el S, tiene el estado de oxidación de -2, esto sucede cuando se combina con elementos menos electronegativos que él (es decir, no este presente el oxígeno), como en el caso del H2S, el S su estado de oxidación es -2 y del H, +1. Cálculo de estado de oxidación (E.O.). La suma de los estados de oxidación de una molécula es siempre 0 y de un ión es igual a su carga eléctrica. Ejemplo 12 Calcular los estados de oxidación (E.O.) de los elementos en el compuesto de sulfato de zinc (ZnSO4) RESPUESTA El metal Zn, se encuentra ubicado en el grupo IIB en la tabla periódica por lo que su estado de oxidación es +2. El Oxígeno, es el más electronegativo y su estado de oxidación es -2. Para igual su carga: +2 + E.O.(S) + 4 (–2) = 0 por lo tanto el estado de oxidación del S es +6. Definición de oxidación y reducción. El término oxidación comenzó a usarse para indicar que un compuesto incrementaba la proporción de átomos de Oxígeno. Igualmente, se utilizó el término de reducción para indicar una disminución en la proporción de oxígeno. Actualmente, ambos conceptos no van ligados a la mayor o menor presencia de Oxígeno. Se utilizan las siguientes definiciones: OXIDACIÓN: Fenómeno química por medio del cual un átomo pierde electrones (o aumento en el número de oxidación). Química. M.C. María Guadalupe Rivera Morales. 2008 117 Instituto Tecnológico de Ciudad Valles REDUCCIÓN: Fenómeno química por medio del cual un átomo gana electrones (o disminución en el número de oxidación). AGENTE OXIDANTE: Es una sustancia que causa que otra sustancia se oxide, al hacer esto, ella se reduce. AGENTE REDUCTOR: Es una sustancia que causa que otra sustancia se reduzca, al hacer esto, ella se oxida. Ejemplo 13 Comprobar que la reacción de formación de hierro: Fe2O3 + 3 CO 2 Fe + 3 CO2 es una reacción redox. Indicar los E.O. de todos los elementos antes y después de la reacción. RESPUESTA E.O.: Fe2O3 + 3 CO 2 Fe + 3 CO2 +3 –2 +2 –2 0 +4 –2 Reducción: El Fe disminuye su E.O. de “+3” a “0” luego se reduce (cada átomo de Fe captura 3 electrones). Oxidación: El C aumenta su E.O. de “+2” a “+4” luego se oxida (en este caso pasa de compartir 2e– con el O a compartir los 4 electrones). Procedimiento para balancear por REDOX. Como su nombre lo indica, este método de balanceo se basa en los cambios de los números de oxidación de las especies que reaccionan. A continuación se describen los pasos de este método de balanceo. Balancear por el método del cambio del número de oxidación la reacción química siguiente: KMnO4 + FeSO4 + H2SO4 Química. M.C. María Guadalupe Rivera Morales. 2008 MnSO4 + Fe2(SO4)3 + K2SO4 + H2O 118 Instituto Tecnológico de Ciudad Valles Paso 1. Cálculo de los números de oxidación. +1 +7 -2 KMnO4 +2 +6 -2 +1 +6 -2 + FeSO4 + H2SO4 +2 +6 -2 MnSO4 +3 +6 -2 +1 +6 -2 +1 -2 + Fe2 (SO4)3 + K2SO4+ H2O Paso 2. Identificación de los elementos que cambian su estado de oxidación. Se identifican los elementos que cambian su estado de oxidación o carga y se escriben como semireacciones de oxidación y de reducción (no importa el orden de escritura de las semirreacciones) +7 +2 Mn Mn +2 Fe +3 Fe Paso 3. Balance de masa. Se efectúa el balance de masa. Debe haber el mismo número de especies químicas en ambos lados de la flecha de reacción. En el caso del manganeso, no es necesario efectuar el balance de masa pues hay un número igual de átomos en ambos miembros de la semirreacción. Sin embargo, en el caso del hierro, hay un coeficiente de 2 en el Fe+3 que también debe aparecer del mismo modo en el Fe+2. +7 +2 Mn Mn +2 2Fe +3 2Fe Paso 4. Balance de carga. Se efectúa el balance de carga. Debe haber igual número de cargas en ambos lados de las flechas de reacción. Lo único que puede utilizarse para el balance de carga son los electrones que se pierden o se ganan en el proceso redox. ¡Atención! El balance de carga siempre debe hacerse después del balance de masa, nunca antes. El planteamiento de una desigualdad matemática puede servir para realizar el balance de carga. Al mismo tiempo se pueden identificar los procesos de oxidación y de reducción, dependiendo del lado de donde se agreguen los electrones. +7 Mn +2 Mn Química. M.C. María Guadalupe Rivera Morales. 2008 119 Instituto Tecnológico de Ciudad Valles La desigualdad se plantea utilizando los números de oxidación de las especies que cambian en el proceso redox. En el caso del manganeso el procedimiento es: +7 ≥ +2 Para comprobar esto el Mn +7 a +2 se reduce, es decir gana 5 electrones 5e- + (+7) = +2 +2 = +2 La semirreacción es : 5e- + Mn+7 Mn+2 (El número de oxidación del Mn disminuye de +7 a +2. Por tanto, es la semirreacción de reducción). Para el hierro el procedimiento es: +2 +3 2Fe 2Fe +4 ≤ +6, el hierro se oxida al perder dos electrones cuando cambia de +4 a +2, por lo tanto: +4 = +6 + 2e+ 4= +4 La semirreacción del hierro es: 2Fe+2 2Fe+3 + 2e- (Hay pérdida de electrones y el número de oxidación del Fe aumenta de +2 a +3. Por tanto, es la semirreacción de oxidación) Con lo anterior quedan balanceadas las semirreacciones redox por masa y carga. Paso 5. Balance de los electrones intercambiados (perdidos y ganados) en las semirreacciones redox balanceadas. El número de electrones que se intercambian en las semirreacciones redox debe ser el mismo. Este se obtiene al multiplicar de manera cruzada los electrones perdidos y ganados. Se simplifica la ecuación. [ 5e- + Mn+7 Mn+2 ] 2 [ 2Fe+2 2Fe+3 + 2e- ] 5 10e- + 2Mn+7 + 10Fe+2 2Mn+2 + 10Fe+3 + 10eEl proceso redox total queda como sigue: 2Mn+7 + 10Fe+2 2Mn+2 + 10Fe+3 Química. M.C. María Guadalupe Rivera Morales. 2008 120 Instituto Tecnológico de Ciudad Valles Paso 6. Introducción de los coeficientes obtenidos, en el proceso redox, en la reacción global. a) Los coeficientes que se obtienen hasta este paso corresponden únicamente a las especies químicas que intervinieron en el proceso redox y se colocan como coeficientes de los compuestos correspondientes en la reacción completa: 2KMnO4 +10FeSO4 + H2SO4 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + H2O b) Ajuste de los coeficientes de las especies que no cambiaron en el proceso redox. En esta reacción, no cambiaron su estado de oxidación el H+1, S+6 K+1y O–2 de modo que debe haber igual número de estas especies en ambos miembros de la ecuación para que ésta quede balanceada. 2KMnO4 +10FeSO4 + 8H2SO4 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O En este paso la reacción ya quedó balanceada pues ya se cumple con la ley de la conservación de la masa. 3.4.2 Por el método de ión electrón Otra manera de igual reacciones REDOX, muchas de las reacciones químicas ocurren en soluciones acuosas en medios ácido o básico, las cuales solo señalan los reactivos que sufren cambios en su número de oxidación, es decir que solamente poseen la parte iónica de toda la ecuación química. Este método de balanceo de reacciones REDOX resulta más adecuado porque en el proceso se emplean las especies químicas que tienen existencia real. Por ejemplo. El KMnO4 se compone de los iones K+1 y MnO4 -1 dos especies que tienen existencia real. En el ejemplo de balanceo que se describirá en seguida, el ión MnO4-1 se usa como tal, ya que en el medio acuoso donde ocurre esta reacción el Mn+7 sólo puede encontrarse como ión permanganato, MnO4 -1. Procedimiento para balancear reacciones por el ión-electrón I. Reacciones que ocurren en medio ácido Balancear la reacción química siguiente: CaC2O4 + KMnO4 + H2SO4 CaSO4 + MnSO4 + K2SO4 + CO2 + H2O Paso 1. Los compuestos iónicos se separan en sus iones componentes, señalando con toda claridad sus cargas correspondientes. Los óxidos y los compuestos covalentes no se separan en iones. Ca+2+C2O4 -2+K+1+MnO4-1+H+1+SO4-2 Ca+2+SO4-2+Mn+2+SO4-2+K+1+SO4-2 + CO2 + H2O Química. M.C. María Guadalupe Rivera Morales. 2008 121 Instituto Tecnológico de Ciudad Valles Paso 2. Se simplifica la reacción eliminando de ella todas aquellas especies químicas que no tienen cambios durante el proceso. Ca+2+C2O4 -2+K+1+MnO4-1+H+1+SO4-2 Ca+2+SO4-2+Mn+2+SO4-2+K+1+SO4-2 + CO2 + H2O Las especies que permanecen después de esta simplificación son las que toman parte en el proceso redox. El resultado de este proceso recibe el nombre de reacción iónica. En ésta, puede advertirse que aparece el ion H+, lo cual indica que el proceso redox ocurre en medio ácido. C2O4-2 + MnO41- + H+1 Mn+2 + CO2 + H2O Paso 3. Se escriben las semirreacciones de oxidación y de reducción en cualquier orden: C2O4-2 CO2 MnO4-1 Mn+2 Paso 4. Balance de masa: a) Primero se balancean todos los elementos que no sean oxígeno ni hidrógeno Hay dos átomos de carbono en el primer miembro de la primera semirreacción y sólo uno en el segundo miembro. Esto se ajusta mediante el coeficiente adecuado. La segunda semirreacción queda igual. Sólo hay un átomo de manganeso en ambos miembros. C2O4-2 MnO4-1 2CO2 Mn+2 b) Ahora se balancea el oxígeno. En medio ácido, el exceso de oxígeno se balancea con agua en el miembro contrario de la semirreacción En la primera semirreacción el oxígeno está balanceado, no así en la segunda. En ésta hay 4 átomos de oxígeno en el MnO4- y, por tanto, se balancea con agua como se indicó: MnO4-1 Mn+2 + 4H2O Por último se balancea el hidrógeno con iones H+ en el miembro contrario: 8H+1 + MnO4- 1 Mn+2 + 4H2O Con esto concluye el proceso de balance de masa. El resultado es: C2O4-2 2CO2 8H+1 + MnO4-1 Mn+2 + 4H2O Paso 5. Balance de carga. Este paso sólo debe realizarse después del balance de masa. Nunca antes. Este paso puede efectuarse utilizando desigualdades, las cuales se resuelven agregando electrones (e-) para igualar las cargas iónicas: Química. M.C. María Guadalupe Rivera Morales. 2008 122 Instituto Tecnológico de Ciudad Valles a. C2O4- 2 2[CO2]0 -2 ≤ 0 -2 ≤ 0 + 2e-2 ≤ -2 C2O4-2 2CO2 + 2e- (oxidación) En este caso el carbono del C2O4 trabaja con +3 debido a que el oxígeno es -2 y como son 4 oxígenos es -8 y para igualar la carga del carbono se le resta la carga del radical -2 nos quedan +6 para igualar la carga. En el CO2 el carbono trabaja con +4. El carbono cambia de +3 a +4 y como son dos carbonos pierde 2 electrones b. 8H+1 + MnO4-1 Mn+2 + 4[H2O]0 +8 + (-1) = +7 ≥ +2 5e- + (+7) ≥ +2 +2= +2 5e- + 8H+1 + MnO4-1 Mn+ 2+ 4H2O (reducción) En el MnO4 el oxígeno es -2 y como son 4 oxígenos es -8 y para igualar la carga del Mn se le resta la carga del radical que es -1 y nos quedan +7 para igual la carga. Entonces el Mn cambia de +7 a +2 por lo que gana 5 electrones: El resultado del Paso 5 es: C2O4-2 5e- + 8H+1 + MnO4-1 2CO2 + 2eMn+2 + 4H2O Paso 6. Balance del número de electrones perdidos y ganados. El número de electrones perdidos y ganados debe ser el mismo en todo proceso redox. Esto se logra multiplicando por el factor adecuado las semirreacciones redox balanceadas por masa y carga: [C2O4-2 [5e- + 8H+1+ MnO4-1 2CO2 + 2e-] 5 Mn+2 + 4H2O] 2 5C2O4-2 + 10e- + 16H+1 + 2MnO4-1 10CO2 + 10e- + 2Mn+2+ 8H2O Simplificando, se llega a la ecuación iónica: 5C2O4-2 +16H+1 + 2MnO4-1 10CO2 + 2Mn+2+ 8H2O Química. M.C. María Guadalupe Rivera Morales. 2008 123 Instituto Tecnológico de Ciudad Valles Paso 7. Los coeficientes que se obtienen en la ecuación iónica se trasladan a la reacción general, pero sólo quedaran balanceadas las especies que intervinieron en el proceso redox: 5CaC2O4 + 2KMnO4 + 8H2SO4 CaSO4 + 2MnSO4 + K2SO4 + 10CO2 + 8H2O Paso 8. Por último se ajustan las especies que permanecieron sin cambios en el proceso redox: 5CaC2O4 + 2KMnO4 + 8H2SO4 5 CaSO4 + 2MnSO4 + K2SO4 +10CO2 + 8H2O Con lo cual se llega al final de este método de balanceo. II. Reacciones que ocurren en medio básico Balancear la reacción química siguiente: Na2ZnO2 + NH3 + H2O Zn + NaNO3 + NaOH Paso 1. Los compuestos iónicos se separan en sus iones componentes, señalando con toda claridad sus cargas correspondientes. Los óxidos y los compuestos covalentes no se separan en iones. Los elementos tienen carga cero. Zn + Na+1 + NO3-1 + Na+1 + OH-1 Na+1 + ZnO2-2 + NH3 + H2O Paso 2. Se simplifica la reacción eliminando de ella todas aquellas especies químicas que no tienen cambios durante el proceso. Zn + Na+1 + NO3-1 + Na+1 + OH-1 Na+1 + ZnO2-2 + NH3 + H2O Las especies que permanecen después de esta simplificación son las que toman parte en el proceso redox. El resultado de este proceso recibe el nombre de reacción iónica. En ésta, puede advertirse que aparece el ion OH–1, lo cual indica que el proceso redox ocurre en medio básico. Zn + NO3-1 + OH-1 ZnO2-2 + NH3 + H2O Paso 3. Se escriben las semirreacciones de oxidación y de reducción en cualquier orden ZnO2-2 Zn0 -1 NO3 [NH3]0 Paso 4. Balance de masa: a) Primero se balancean todos los elementos que no sean oxígeno ni hidrógeno. b) En este caso sólo hay oxígeno e hidrógeno en exceso. Química. M.C. María Guadalupe Rivera Morales. 2008 124 Instituto Tecnológico de Ciudad Valles c) Balanceo del oxígeno. El oxígeno se balancea agregando moléculas de agua del mismo lado de la reacción donde hay exceso de éste. Zn0 ZnO2-2 + 2H2O 6H2O + NO3-1 [NH3]0 d) El hidrógeno se balancea en el miembro contrario por iones OH4 OH-1 + Zn0 ZnO2-2 + 2H2O 6H2O + NO3-1 [NH3]0 + 9OH-1 Paso 5. Balance de carga. Este paso sólo debe realizarse después del balance de masa. Nunca antes. Este paso puede efectuarse utilizando desigualdades, las cuales se resuelven agregando electrones (e-) para igualar las cargas iónicas: 4OH-1 + Zn0 ZnO2- 2+ 2[H2O]0 -4 ≤ -2 -4 ≤ -2 + 2e-4 = -4 4OH-1 + Zn0 ZnO2- 2+ 2[H2O]0 + 2e- (oxidación) -1 ≥ -9 8e- + (-1) ≥ -9 -9 = -9 8e- + 6H2O + NO3-1 [NH3]0 + 9OH-1 (reducción) El resultado del Paso 5 es: 4OH-1 + Zn0 ZnO2-2 + 2[H2O]0 + 2e8e- + 6H2O + NO3-1 [NH3]0 + 9OH-1 Paso 6. Balance del número de electrones perdidos y ganados. De nuevo, el número de electrones perdidos y ganados en el proceso redox debe ser el mismo. Por tanto, las semirreacciones redox se multiplican por el factor adecuado para lograr este propósito. [4OH-1 + Zn0 ZnO2-2 + 2[H2O]0 + 2e-] 4 [8e- + 6H2O + NO3-1 [NH3]0 + 9OH-1] 1 ________________________________________________________________ 16OH-1+ 4Zn0+ 8e- + 6H2O + NO3-1 4ZnO2-2 + 8[H2O]0 + 8e-+ [NH3]0 + 9OH-1 Química. M.C. María Guadalupe Rivera Morales. 2008 125 Instituto Tecnológico de Ciudad Valles Simplificando, se llega a la ecuación iónica: 7OH-1 + 4Zn0 + NO3-1 4ZnO2-2 + 2[H2O]0 + [NH3]0 Paso 7. Los coeficientes que se obtienen en la ecuación iónica se trasladan a la reacción general, pero sólo quedarán balanceadas las especies que intervinieron en el proceso redox: 4 Zn + NaNO3 + NaOH 4Na2ZnO2 + NH3 + H2O Paso 8. Por último se ajustan las especies que permanecieron sin cambios en el proceso redox: 4 Zn + NaNO3 + 7NaOH 4Na2ZnO2 + NH3 + 2H2O Química. M.C. María Guadalupe Rivera Morales. 2008 126