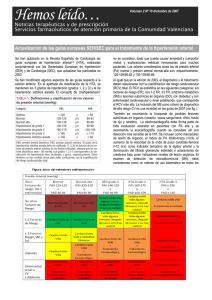
hipertensión arterial - Médicos de El Salvador
Anuncio

HIPERTENSIÓN ARTERIAL UN MANUAL PARA MÉDICOS DE ATENCIÓN PRIMARIA Dr. Hugo Villarroel Ábrego 1 2 HIPERTENSIÓN ARTERIAL. UN MANUAL PARA MÉDICOS DE ATENCIÓN PRIMARIA. Dr. Hugo Villarroel Abrego Internista — Cardiólogo — Ecocardiografista Professional Member of the American Heart Association Member of the American Society of Echocardiography Member of the Heart Failure Association of the European Society of Cardiology [email protected] 3 ©2007 Del Autor, Hugo Villarroel Ábrego Todos los derechos reservados. Primera Edición: 2007 Prohibida la reproducción parcial o total de esta obra, sin la autorización escrita del autor. Hecho el depósito que manda la ley. Impreso en El Salvador por Impresos Litográficos San Salvador 2007. 4 "…la ciencia, al llegar al término de sus paradojas, deja de proponer y se detiene para contemplar y dibujar el paisaje siempre virgen de los fenómenos… Ahora se comprende el lugar que ocupa la obra de arte…" Albert Camus El Mito de Sísifo 5 Para Yani, Eduardo y Mónica De un esposo y padre agradecido 6 Del autor. El doctor Hugo Villarroel Ábrego nació en San Salvador en 1964. Internista, cardiólogo y ecocardiografista, cursó estudios en la Universidad Salvadoreña "Alberto Masferrer", los Hospitales del Instituto Salvadoreño del Seguro Social (ISSS) en San Salvador y el Instituto Nacional de Cardiología "Ignacio Chávez", en México, D.F. Fue cardiólogo de staff del ISSS hasta 1998. Se desempeñó como Director Médico de la empresa de telemedicina "Cardiotel de C.A." desde 1997 hasta el año 2005. Es miembro del Colegio Médico de El Salvador, de la Asociación Salvadoreña de Medicina Interna, del la Asociación Salvadoreña de Cardiología, Professional Member of The American Heart Association, Member of the American Society of Echocardiography y Member of the Heart Failure Association of the European Society of Cardiology. Es profesor invitado de las facultades de medicina de las Universidades de El Salvador, Evangélica, "Alberto Masferrer" y "Matías Delgado". Ha participado como investigador en estudios clínicos multicéntricos (GOALLS, INVEST, DISCOVERY-ALPHA, JUPITER, LUNAR Y EVAS). Frecuentemente realiza giras por Centroamérica y el Caribe (incluyendo Puerto Rico) impartiendo conferencias sobre temas cardiológicos. Obtuvo el Premio Nacional de Cardiología en 1994. Tiene 26 estudios de investigación inéditos, publicados, pendientes de publicación y en proceso. En el año 2006 publicó su primer texto médico, "Arritmias cardíacas: Un manual para médicos de atención primaria y estudiantes de medicina". Escribe ficción y su primera novela, "En el Nombre de David, fue publicada en el año 2003. Actualmente prepara una segunda novela y trabaja intensamente en la constitución legal de "PROSERES" una fundación sin fines de lucro dedicada a la educación para la salud y de la que es actualmente secretario. 7 INDICE 9 PREFACIO SECCIÓN I. DEFINICIÓN, CLASIFICACIÓN, ETIOLOGÍA, FISIOPATOLOGÍA Y ANATOMOPATOLOGÍA. 1. Definición de hipertensión arterial 2. Clasificación de la hipertensión arterial 3. Generalidades sobre la etiología y la fisiopatología de la hipertensión arterial. 4. Anatomopatología de la hipertensión arterial crónica y sus complicaciones. 11 13 14 17 SECCIÓN II. VALORACIÓN CLÍNICA DE LA HIPERTENSIÓN ARTERIAL. HISTORIA CLÍNICA, LABORATORIO Y GABINETE. 1. Anamnesis. 2. Procedimientos para la medición correcta de la presión arterial. 3. Exploración física. 4. Exámenes de laboratorio. 5. Estudios de gabinete. SECCIÓN III. TRATAMIENTO DE LA HIPERTENSIÓN ARTERIAL. 1. Metas del tratamiento de la hipertensión arterial. 2. Toma de decisiones para inicio de tratamiento. Pasos en el proceso de decisión. 3. Tratamiento no farmacológico. 4. Tratamiento farmacológico. 5. Indicaciones mandatorias en el tratamiento de la hipertensión arterial. 6. Fármacos antihipertensivos. 7. Estrategias iniciales. Selección inicial de fármaco(s). 8. Ajustes de dosificación y control clínico del paciente hipertenso. 24 25 27 28 29 36 37 38 41 52 59 70 71 SECCIÓN IV. SITUACIONES CLÍNICAS ESPECIALES. 1. Crisis hipertensivas. 2. Hipertensión arterial refractaria. 3. Hipertensión arterial secundaria. 4. Hipertensión arterial asociada al embarazo. 5. Hipertensión arterial crónica en niños y adolescentes. 77 89 91 100 106 BIBLIOGRAFÍA 109 8 PREFACIO. Este libro es un proyecto acariciado durante los últimos diez años. Siempre a la espera de la última evidencia, de los lineamientos definitivos, se trabajó en él con parsimonia, quizás demasiado despacio. Pero ya que el ritmo frenético que va marcando la investigación clínica vuelve casi obsoleto cualquier intento de imprimir textos de estudio, he decidido publicar este manual —orientado para la práctica de la medicina general y como apoyo para estudiantes de medicina— con la esperanza de que nuevas ediciones vayan viendo la luz a medida que los conceptos emergentes sobre el tema así lo exijan. La idea fundamental era preparar un material de consulta rápida, pero no tan básico que descuidara el marco teórico que sustenta a cada una de las conductas aquí sugeridas. Un saludable principio de economía justifica el que no se conceda más espacio del estrictamente indispensable a cada sección. El uso de cuadros sinópticos ayudó a resolver el problema del exceso de datos por explicar y la relativa escasez de espacio, que es propia de este tipo de publicaciones. Debo reconocer crédito y tributar agradecimiento a los siguientes profesionales, todos ellos íntimamente involucrados en la lucha de todos los días contra el monstruo llamado "riesgo cardiovascular global": Doctor José Ricardo Suárez Arana (internista, cardiólogo general y pediátrico, maestro de maestros) quien ha contribuido con la revisión total del texto. Su experiencia, sus ideas y muchos de los conceptos que él ha enseñado a generaciones de médicos —y que siguen vigentes— se han incorporado en todas las secciones. Licenciada Silvia Yanira Martínez de Villarroel (nutricionista y dietóloga), quien ha participado activamente en la redacción de las estrategias no farmacológicas de reducción de la presión arterial, parte de lo que llamamos "cambios terapéuticos de estilo de vida". Su paciente e incondicional apoyo como compañera de trabajo y esposa ha sido clave para la realización de este trabajo. Doctor Jaime Ávila Guerra, oftalmólogo y retinólogo. Colaboró con material gráfico para este libro. Estoy muy agradecido por su disposición para ayudar. Doctora Lya Mylene Villarroel Ábrego (ginecóloga, perinatóloga y ultrasonografista ginecoobstétrica). Colaboró de modo entusiasta con la redacción del capítulo de hipertensión asociada al embarazo. Se le agradecen de corazón su capacidad de síntesis y su facilidad para enfatizar lo realmente relevante de las cosas. San Salvador, julio del 2007. 9 SECCIÓN I. DEFINICIÓN, CLASIFICACIÓN, ETIOLOGÍA, FISIOPATOLOGÍA Y ANATOMOPATOLOGÍA. 10 1. DEFINICIÓN DE HIPERTENSIÓN ARTERIAL. Desde el punto de vista fisiopatológico, la hipertensión arterial (HTA) crónica es un síndrome caracterizado por incremento de las cifras de presión arterial (PA), ello como consecuencia de cambios hemodinámicos, macro y microvasculares. Estos cambios son causados, a su vez, por disfunción del endotelio vascular y remodelado de la pared de las arteriolas de resistencia, responsables de mantener el tono vascular periférico. Dichos cambios, que anteceden en el tiempo a la elevación de la PA, producen lesiones orgánicas específicas y muy bien definidas clínicamente. Franz Messerli propone definir la HTA como el nivel de PA que sea capaz de producir lesión cardiovascular en un paciente determinado1. Esto implicaría la obligatoriedad de hacer una valoración global de riesgo para cada persona, “enferma” o no, para calcular las cifras de presión que deberían considerarse “seguras” para ella. Este punto de vista contrasta con el uso rutinario y muy generalizado de cifras límite como punto de corte para diagnóstico, por lo general 140/90 milímetros de mercurio (mmHg), cifras que podrían considerarse hasta cierto punto arbitrarias, si no se consideran las comorbilidades y los factores de riesgo de cada individuo en particular. En síntesis, para cada paciente existiría una cifra umbral para diagnosticar “hipertensión”. Dicho nivel estará dado por la evidencia científica disponible con relación a su perfil individual. Esta evidencia provendría de los resultados de estudios observacionales, epidemiológicos o de experimentos clínicos controlados. En las Tablas 1, 2 y 3 se presentan, respectivamente, las clasificaciones de cifras de PA propuestas por el Joint Nacional Committe on Prevention, Detection, Evaluation and Treatment of High Blood Pressure2 (Séptimo Reporte); por T. D. Giles (American Society of Hypertension)3 y las Sociedades Europea de Hipertensión y Cardiología4. El Consenso Latinoamericano sobre Hipertensión Arterial, publicado el año 20015 —y que también ha sido considerado para la redacción del presente manual— sugiere una clasificación que es esencialmente idéntica a la europea. 11 TABLA 1: Clasificación JNC 7 de la hipertensión arterial. CLASIFICACIÓN HTA PAS (mm Hg) PAD (mm Hg) Normal < 120 < 80 Prehipertensión 120 - 139 80 - 89 HTA estadio 1 140 - 159 90 - 99 HTA estadio 2 > 160 > 100 JNC 7: Joint National Committee Seventh Report PAS: Presión arterial sistólica PAD: Presión arterial diastólica El Séptimo Informe del NHLBI sobre la prevención, detección, evaluación y tratamiento de la hipertensión arterial (JNC 7). JAMA, 21 de mayo, 2003. TABLA 2: Clasificación de Giles de la hipertensión arterial. Clase ↑ PA Normal Nunca o rara vez Enfermedad CV FR CV Marcadores tempranos Lesión órganos blanco No No/pocos No No HIPERTENSIÓN ARTERIAL Estadío 1 Estadío 2 Estadío 3 Ocasional o intermitente Temprana Algunos Sostenida Progresiva Muchos Marcada y sostenida Avanzada Muchos Usualmente presentes Francamente presentes Francamente presentes con progresión No Signos tempranos Sí, con o sin eventos cardiovasculares CV: cardiovascular; FR: factores de riesgo Giles TD. Traducido al español de The new definition of hypertension. Program and abstracts of the 20th Annual Scientific Meeting of the American Society of Hypertension; May 14-18, 2005; San Francisco, California. TABLA 3: Clasificación de la European Society of Cardiology y la European Society of Hypertension de los niveles de presión arterial. CATEGORÍA PAS (mm Hg) PAD (mm Hg) Óptima < 120 < 80 Normal 120-129 80-84 Normal alta 130-139 85-89 HTA grado 1 140 - 159 90 - 99 HTA grado 2 160-179 100-109 HTA grado 3 >180 >110 HTA sistólica aislada > 140 <90 PAS: Presión arterial sistólica PAD: Presión arterial diastólica Journal of Hypertension, 2007, 25: 1105-1187 12 2. CLASIFICACIÓN DE LA HIPERTENSIÓN ARTERIAL. • La HTA puede ser, según su evolución temporal, aguda o crónica. En los estados crónicos, la elevación podría ser intermitente o transitoria (hipertensión “reactiva” o de “bata blanca”, feocromocitoma, enfermedad hipertensiva del embarazo) o bien sostenida y continua (por ejemplo, aunque no exclusivamente, las formas esenciales de enfermedad). • Puede ser secundaria a adaptación fisiológica (ejercicio, dolor, estrés) o el resultado de alguna condición fisiopatológica (disfunción endotelial, hipertensión renovascular, síndrome metabólico, toxicidad). • La HTA puede ser exclusivamente sistólica (hipertensión del adulto joven hiperadrenérgico, hipertensión sistólica aislada del adulto mayor, hipertiroidismo, estados de alto gasto cardíaco), o sístolo-diastólica. Se discute la existencia de formas diastólicas aisladas de HTA, pero no parece ser una condición frecuente, por lo menos de manera sostenida. • Otro criterio se basa en la presencia de una causa identificable, genética o adquirida, que explique el estado hipertensivo. Así, se habla de HTA primaria (esencial, idiopática) o secundaria. • El nivel de las cifras de PA da base a otro criterio de clasificación: HTA leve, moderada o severa, esquema cómodo pero de valor operativo limitado. Podría considerarse, por ejemplo, más a riesgo a un hipertenso joven —sin otros factores de riesgo— con PA de 180/100 mmHg que un paciente diabético que convalece de un infarto miocárdico con cifras presoras de 150/90 mmHg. La calificación de “gravedad” con base en niveles de PA ha sido complementada con el concepto de “estadios”. De los tres estadios propuestos originalmente en el Sexto Reporte del Comité Nacional Conjunto para el diagnóstico y tratamiento de la HTA (JNC VI, 1997)6, se ha consensuado dejar solo dos para el Séptimo Reporte (JNC 7, 2003)2 y agregar una categoría de riesgo, la llamada prehipertensión, término que ha desatado controversias aún no resueltas a la fecha (ver Tabla 1) y que incluiría a las categorías "normal" y "normal alta" de la propuesta europea 4. • Resulta atractiva la propuesta de T. D. Giles y el Internacional Society of Hypertension Working Group, (The New Definition of Hypertension, San Francisco, 2005)3, en que los criterios definitorios están dados por el perfil temporal de la PA, factores de riesgo, presencia o ausencia de marcadores tempranos de enfermedad, grado de lesión de órganos blanco y comorbilidades cardiovasculares asociadas (ver Tabla 2). 13 3. GENERALIDADES SOBRE LA ETIOLOGÍA FISIOPATOLOGÍA DE LA HIPERTENSIÓN ARTERIAL. Y LA Para efectos prácticos, el presente manual estará enfocado al estudio de la hipertensión arterial crónica. Ciertas circunstancias clínicas especiales en que puede aparecer un abrupto incremento de las cifras de presión recibirán atención en la Sección IV. En la mayor parte de casos de HTA crónica no puede detectarse una “causa” puntual que, para cada sujeto, explique la aparición del incremento sostenido de cifras presoras. Se llamará esencial a este tipo de HTA, aunque muchos pacientes incluidos en esta categoría, podrían, en realidad, sufrir de una forma secundaria de HTA que pasaría desapercibida si no se les estudiase sistemática y exhaustivamente. Así, en términos estrictos, la HTA esencial debería ser un diagnóstico de exclusión. Se detallan los porcentajes para los diferentes tipos de causas más frecuentes. a) Hipertensión primaria o esencial: 90-95% de los adultos con edades de 18-65 años no tendrá una causa identificable de hipertensión. b) Hipertensión secundaria: • • • • Enfermedad parenquimatosa renal: 3 - 4% Enfermedad vascular renal: 0.5 -1% Hiperfunción adrenal: 0.1 - 0.3% Todas las demás causas: menos del 5% La HTA asociada al síndrome de resistencia a la insulina con obesidad central y que conduce a diabetes mellitus tipo II (síndrome metabólico, SM) podría ser un tipo secundario de enfermedad hipertensiva, pues ya se ha demostrado qué defectos genéticos o adquiridos de la señalización intracelular postreceptor de insulina estarían involucrados en su causalidad. Este punto es debatible y merece ulterior estudio y discusión, más allá de los alcances del presente manual. A continuación se presenta un inventario de las causas de HTA crónica que, sin pretender ser exhaustivo, abarcaría la gran mayoría de situaciones clínicas posibles: a) HTA esencial. b) HTA esencial asociada al síndrome metabólico. c) HTA sistólica aislada (HSA). d) HTA secundaria a enfermedad renal. • Glomerulonefritis aguda o crónica • Glomeruloesclerosis focal o difusa 14 • • • • Colagenopatías Nefritis intersticial Enfermedad poliquística renal Síndrome de Liddle e) HTA secundaria a enfermedad vascular renal. • Estenosis de arteria renal unilateral o bilateral • Esclerodermia • Enfermedad de Takayasu – Onichi f) HTA secundaria a coartación aórtica. g) HTA secundaria a endocrinopatías. • Enfermedad de Cushing • Acromegalia • Hipertiroidismo • Feocromocitoma • Hipercalcemia • Adenoma corticosuprarrenal • Deficiencia de 11-hidroxilasa • Deficiencia de 17-hidroxilasa • Hiperplasia suprarrenal • Síndrome de Geller • Exceso aparente de mineralocorticoides • Hiperaldosteronismo supresible por glucocorticoides h) HTA asociada al embarazo. i) HTA asociada a enfermedades del sistema nervioso central. • Trauma craneoencefálico o de médula espinal • Hipertensión intracraneal • Tumores encefálicos • Apnea del sueño • Porfiria aguda • Disautonomía • Síndrome de Guillain-Barré j) HTA secundaria al uso de fármacos (ver la Tabla 4, drogas con acción pro-hipertensiva). 15 TABLA 4. Principales drogas con acción pro-hipertensiva. Grupo farmacológico Principios activos Anestésicos y antagonistas narcóticos Ketamina, desflurano, naloxona Fentermina, sibutramina, mazindol, ma-huang Fluoxetina, sertralina, paroxetina, citalopram, escitalopram, venlafaxina Metoclopramida, proclorperazina, alizapride Ibuprofén, ketoprofén, naproxén, indometacina, diclofenac, piroxicam, tenoxicam, meloxicam, rofecoxib, celecoxib, etoricoxib, valdecoxib Cafeína, cafedrina, teodrenalina, etilefrina, oxifedrina, fenilefrina, fenilpropanolamina, efedrina, pseudoefedrina, adrenalina, noradrenalina, dopamina, dobutamina, nafazolina, oximetazolina Cocaína Hidrocortisona, dexametasona, prednisona, metilprednisolona, betametasona Anorexígenos Antidepresivos Antieméticos Antiinflamatorios no esteroidales Cardiotónicos y catecolaminas Cocaína Corticosteroides Derivados ácido glicirretínico Orozuz o regaliz (licorice) Eritropoyetina - Ergotamina y derivados Ergotamina, dehidroergotamina, metisergida, ergometrina Hormonas sexuales Estrógenos, progestágenos, testosterona, esteroides anabólicos Hormonas tiroideas Levotiroxina, liotironina, Inmunosupresores Ciclosporina Soluciones parenterales Solución salina normal 16 Mecanismos ↑ Actividad simpatoadrenal ↑ Actividad simpatoadrenal Inhibición de recaptación de serotonina y noradrenalina Acción antidopaminérgica central Retención hidrosalina Inhibición de prostaciclina ↑ Actividad simpatoadrenal ↑ Actividad simpatoadrenal Efecto agonista mineralocorticoide ↑ Actividad mineralocorticoide ↑ Resistencias vasculares periféricas Vasoconstricción periférica ↑ Actividad mineralocorticoide ↑ Actividad del sistema renina-angiotensina ↑ Actividad simpatoadrenal ↑ Actividad simpatoadrenal ↑ Actividad simpatoadrenal Nefroesclerosis ↑ Volemia y resistencias vasculares periféricas por sobrecarga de sodio 4. ANATOMOPATOLOGÍA DE LA HIPERTENSIÓN ARTERIAL CRÓNICA Y SUS COMPLICACIONES. Se presenta a continuación un inventario básico de las lesiones estructurales atribuidas a la hipertensión arterial sobre órganos específicos (los llamados “órganos blanco”) y de la repercusión funcional que este daño orgánico pueda provocar. Los órganos blanco de la HTA son las arterias periféricas, el sistema nervioso central (incluyendo retina del ojo), el corazón y los riñones (ver Fig. 1). La historia clínica, la exploración física y las pruebas de laboratorio y gabinete estarán encaminadas a la investigación del impacto de la HTA sobre dichos órganos, tanto a nivel clínico como subclínico. FIGURA 1. Hipertensión arterial y lesión estructural-funcional de órgano blanco. 17 4.1. SISTEMA NERVIOSO CENTRAL. a) Retinopatía hipertensiva (ver Fig. 2): Vasoespasmo, aumento del brillo arterial, cruces arterio-venosos patológicos (signo de Gunn), hemorragias redondas y en flama, exudados, papiledema. b) Trombosis retinianas venosas y arteriales. c) Leucaraiosis: Lesiones microvasculares discretas a nivel periventricular cerebral (valorables por tomografia axial o resonancia magnética, ver Fig. 3, recuadro amarillo). d) Isquemia cerebral transitoria (ICT): Déficit neurológico isquémico con recuperación ad integrum antes de 24 horas. e) Accidente cerebrovascular (ACV) trombótico o embólico: lesión isquémica no reversible después de una semana de inicio del déficit. Los infartos lacunares por lo general son silentes. f) ACV hemorrágico con hematoma intracerebral, con o sin invasión del espacio subaracnoideo (ver Fig. 3, recuadro rojo). g) Encefalopatía hipertensiva, deterioro de la alerta y cognición sin focalización neurológica durante el curso de una urgencia hipertensiva. h) Demencia de origen vascular: Como consecuencia de múltiples infartos del sistema nervioso central. FIGURA 2. Examen fondoscópico retiniano de un paciente hipertenso crónico. Obsérvense el severo estrechamiento arteriolar, la presencia de exudados y hemorragias redondas y en flama. Esta fotografía es cortesía del Dr. Jaime Ávila Guerra, oftalmólogo y retinólogo. 18 FIGURA 3: Leucaraiosis y ACV hemorrágico. Lesiones microvasculares discretas a nivel periventricular cerebral (recuadro amarillo) en un hipertenso crónico con déficit neurológico agudo (hemianopsia homónima). En esta imagen de resonancia magnética nuclear hay, además, un hematoma intraparenquimatoso parietooccipital derecho, con edema perilesional que afecta la región calcarina (recuadro rojo). De la colección de casos clínicos del Dr. Hugo Villarroel Ábrego. 4.2. ARTERIAS PERIFÉRICAS. a) Disfunción endotelial crónica, con liberación de especies reactivas de oxígeno, vasoconstricción inapropiada, inflamación, aumento de actividad protrombótica y reducción de la fibrinólisis. b) Remodelado parietal con estrechamiento luminal, a expensas de la redistribución del músculo liso de la túnica media arterial (ver Fig. 4). c) Arterioloesclerosis, con engrosamiento de la túnica media (de Monckeberg). d) Ateroesclerosis progresiva de grandes vasos, en especial de vasos cerebrales, aorta, coronarias y arterias de los miembros inferiores, generando hipoperfusión crónica subclínica o sintomática. e) Aneurismas, complicados eventualmente con disección y/o ruptura, especialmente a nivel de aorta torácica (ver Fig. 5). 19 FIGURA 4: REMODELADO ENDOTELIAL. Reducción del calibre luminal del vaso y aumento del grosor parietal relativo, todo ello secundario a una redistribución del músculo liso de la túnica media. La disminución del área de corte seccional vascular conduce a un marcado aumento de la resistencia vascular periférica. FIGURA 5: ANEURISMA AÓRTICO CON DISECCIÓN Y TROMBOSIS. Ecocardiograma 2D, eje largo paraesternal modificado. Dilatación extrema de segmento ascendente de la aorta en una paciente hipertensa de edad avanzada. Hay calcificación de anillo aórtico (flecha blanca) y un aneurisma de 73 mm. La imagen intravascular heterogénea señalada con la letra “T” corresponde a un trombo gigante. De la colección de casos clínicos del Dr. Hugo Villarroel Ábrego. 20 4.3. CORAZÓN. a) Hipertrofia ventricular izquierda: En inicio hay engrosamiento parietal sin incremento de la masa ventricular total (remodelado concéntrico); luego se desarrolla franca hipertrofia concéntrica (figura 6), que podría llegar a fase dilatada (hipertrofia excéntrica). FIGURA 6: HIPERTROFIA VENTRICULAR IZQUIERDA (HVI). En caso de HTA no tratada o no controlada, el ventrículo izquierdo normal (A) hipertrofia sus paredes a expensas de una disminución del volumen de la cavidad, el llamado patrón de HVI concéntrica (B), en que la relación grosor de pared/radio de cavidad (h/r) es menor a la normal (0.45–0.5). Esto reduce el estrés sistólico de la pared ventricular, por lo que constituye un mecanismo adaptativo. En fases más avanzadas, la cavidad ventricular se dilata y el h/r se normaliza, pero a expensas de un gran incremento de la masa total del ventrículo izquierdo, aumento de estrés de la pared, isquemia subendocárdica, fibrosis y pérdida de distensibilidad y viscoelasticidad miocárdicas; hay aumento de las presiones de fin de diástole y signos y síntomas congestivos. En estos casos se habla de HVI excéntrica (C), que conlleva un mal pronóstico a largo plazo. b) Fibrosis miocárdica, como parte del proceso de hipertrofia, con deterioro de la distensibilidad parietal y de las propiedades viscoelásticas del miocardio contráctil. c) Isquemia microvascular coronaria, principalmente por rarefacción de la red capilar y disfunción endotelial de los vasos remanentes. d) Síndromes coronarios agudos: Angina inestable o infarto sin onda Q (también conocido como infarto sin elevación de segmento S-T). e) Infarto agudo miocárdico. f) Disfunción diastólica ventricular izquierda, a consecuencia de isquemia, hipertrofia y fibrosis ventricular, que conducen a 21 anomalías regionales y globales de la relajación y, en fases más avanzadas, de la distensibilidad. g) Disfunción sistólica ventricular izquierda, con caída de la fracción de eyección ventricular izquierda (FE, el porcentaje de toda la sangre que, habiendo llenado el ventrículo en diástole, es bombeada de manera efectiva fuera de la cavidad). h) Insuficiencia cardíaca congestiva (ICC) global; como consecuencia de la falla ventricular izquierda hay además compromiso secundario del hemicardio derecho, con dilatación de cámaras e hipertensión arterial pulmonar secundaria. i) Valvulopatías calcíficas degenerativas de hemicardio izquierdo, en especial de las válvulas mitral (insuficiencia) y aórtica (estenosis y/o insuficiencia). j) Arritmias ventriculares, como consecuencia de micro-reentrada por fibrosis, lesión o isquemia. 4.4. RIÑÓN. a) Microalbuminuria, marcador temprano de nefropatía y factor independiente de riesgo de morbimortalidad cardiovascular. b) Fibrosis tubulointersticial del parénquima renal. c) Glomeruloesclerosis focal y difusa con pérdida de nefronas, como consecuencia de hipertensión intraglomerular crónica. d) Isquemia renal crónica debida a ateroesclerosis acelerada de las arterias renales. e) Infarto renal, por ateromatosis de arterias renales o embolia. f) Reducción de la tasa de filtrado glomerular, por la pérdida de masa de nefronas funcionales, proceso progresivo que se ve acelerado en hipertensos y más aún en presencia de diabetes. g) Insuficiencia renal crónica (IRC) como evento terminal. 22 SECCIÓN II. VALORACIÓN CLÍNICA DE LA HIPERTENSIÓN ARTERIAL. HISTORIA CLÍNICA, LABORATORIO Y GABINETE. 23 1. ANAMNESIS. La historia clínica del paciente hipertenso debe ser recolectada al detalle y enriquecerse con información provista por parientes cercanos, o por otros médicos o personal paramédico que lo hayan atendido en el pasado, si aplica. La HTA es una enfermedad asintomática por excelencia, tanto así que se le ha llamado the silent killer (“el asesino silencioso”), por lo que no resultaría extraño que no se recolecten muchos síntomas en la historia, o que estos síntomas sean poco específicos (cefalea, mareo, trastornos visuales, por ejemplo). Una vez bien definido el motivo de consulta y habiéndose documentado los datos relevantes de la presente enfermedad, debe hacerse énfasis desde la primera consulta sobre los siguientes datos: • Factores de riesgo, tradicionales y no tradicionales (ver Tabla 5); • Antecedentes familiares de enfermedad, en especialidad si ha habido muerte de causa cardíaca en consanguíneos menores de 50 años; • Condición socioeconómica, cultural y laboral, estatus familiar, acceso a sistemas de salud, nivel de educación, factores ambientales y/o situacionales causantes de estrés; • Listado exhaustivo de comorbilidades (generalmente interrogando antecedentes por sistemas); • Hábitos higiénico-dietéticos: café, té, bebidas carbonatadas, alcohol, tabaco, sodio, alimentación, actividad física; • Exposición a fármacos que puedan causar HTA (Tabla 4); • Alergias e intolerancias; • Síntomas, cardiovasculares (disnea, ortopnea, disnea paroxística nocturna, precordialgia, palpitaciones, síncope, edemas, claudicación intermitente) o inespecíficos (cefalea, mareo, acúfenos, trastornos visuales, deterioro cognitivo, fatiga, cambios del estado de ánimo, disfunción eréctil, por ejemplo); • Eventos previos cardiovasculares: isquemia cerebral transitoria, accidentes cerebrovasculares, angina de pecho, infarto miocárdico, insuficiencia cardíaca congestiva, insuficiencia renal crónica entre otros; • Procedimientos quirúrgicos previos o planeados. Esta información es vital para la valoración global de riesgo cardiovascular de cada paciente hipertenso. Cada elemento de 24 riesgo o diagnóstico clínico, resuelto o no (tratado o no tratado), cada síntoma, cada antecedente debería ser incluido en una lista de problemas. Esto ayudará a planear el tratamiento global sin olvidar puntos importantes. 2. PROCEDIMIENTOS PARA LA MEDICIÓN CORRECTA DE LA PRESIÓN ARTERIAL. • Pedir al paciente que tome asiento (para consulta institucional resulta ideal colocar una silla sin brazos pero con respaldo al lado del escritorio). La espalda deberá estar recostada contra el respaldo y el miembro superior deberá reposar sobre la superficie del escritorio, el antebrazo en pronación, a la altura del corazón; las plantas de los pies deben estar apoyadas sobre el piso, no se permitirá al paciente cruzar las piernas. • Después de algunos minutos de reposo (de preferencia 5 minutos, quizás durante o al final del interrogatorio) se coloca un manguito de tamaño apropiado (que cubra 2/3 de la longitud del brazo) y en buenas condiciones en la parte media del brazo del paciente; no debe haber ropa entre la piel y el manguito, que deberá estar bien ajustado, pero no tanto que impida la introducción del dedo meñique entre el mismo y la piel. Si al arremangar la camisa o la blusa la tela comprime el miembro, deberá mejor retirarse la ropa y pedir al paciente que se vista con una bata para examen físico. Precaución: en algunos pacientes no puede emplearse alguno de los brazos para la toma de PA: historia de cirugía radical en axila, o presencia de una fístula arteriovenosa, por ejemplo). • De preferencia emplear un tensiómetro de columna de mercurio, que deberá ser revisado y calibrado periódicamente. La base del tensiómetro y el centro del manguito deberán estar a la altura del corazón del paciente) para evitar errores de la medición. Si se dispone solo de esfigmomanómetros debe de verificarse que estén bien calibrados. Debe disponerse de por lo menos tres tallas de manguitos, incluyendo uno para pacientes obesos y otro pediátrico, que podría ser útil en personas muy ancianas con gran atrofia muscular y/o escaso panículo adiposo. • Debe decirse al paciente que el procedimiento puede ser un tanto incómodo o doloroso. Inflar el manguito por lo menos 30 mmHg más arriba de la presión necesaria para que desaparezca el pulso radial, o hasta que se haya superado una presión de 220 mmHg. Luego, aplicando el estetoscopio sobre la arteria braquial, debe desinflarse con lentitud hasta que sean audibles por primera vez los ruidos de Korotkoff (PA sistólica). La desaparición precoz de los 25 ruidos y su ulterior reaparición, el llamado gap o brecha auscultatorio(a) es frecuente en personas de edad avanzada, por lo que se deberá seguir desinflando el manguito con lentitud hasta que no haya duda del cese definitivo de los ruidos (fase V de Korotkoff, PA diastólica). En algunos pacientes los ruidos nunca desaparecen, por lo que se medirá la PA diastólica cuando cambien de intensidad (Fase IV). En todo momento los ojos del observador deberán estar al nivel de la columna de mercurio, para evitar errores de apreciación. • Al desinflar el manguito es de crítica importancia que el miembro del paciente se encuentre inmóvil. • En la primera consulta sería ideal tomar la PA en ambos brazos y dejar definido en cuál de ellos se encuentra más elevada, haciéndolo constar en el expediente, pues las mediciones deberían seguirse realizando en ese mismo brazo. La medición de la PA con el paciente de pie es muy aconsejable en el adulto mayor, deberá dejarse al paciente de pie por lo menos durante 1 minuto antes de hacer la medición. • Si se hacen tomas sucesivas, como es aconsejable (incluso se puede hacer una medición final, antes que el paciente abandone el consultorio), deberá dejarse un intervalo de por lo menos un minuto entre medida y medida. • Las cifras de PA no deberán redondearse. Con buena técnica puede registrarse la PA con un nivel de exactitud de 2 mm Hg. • Todos los conceptos arriba explicados aplican también para los tensiómetros electrónicos disponibles en el mercado. Se buscarán marcas certificadas por Food and Drugs Administration de los Estados Unidos de América (FDA), de preferencia con manguito braquial. El médico debe enseñar personalmente a sus pacientes el uso de estos aparatos y la secuencia correcta de procedimientos para que las mediciones domiciliarias sean confiables. Se estima que las cifras de PA en el hogar son en promedio 5 mm Hg menores que en el consultorio, tanto para la PA sistólica como para la diastólica. 3. EXPLORACIÓN FÍSICA. Cada médico hará un examen físico completo, que deberá incluir la siguiente información: 26 • Inspección del aspecto general, en especial de la facies, color de tegumentos, hábito corporal, estado anímico, nivel de conciencia y orientación; • Antropometría: peso, talla, índice de masa corporal (IMC), perímetro de cintura (PC, medir a la altura de las crestas ilíacas) y relación cintura/cadera (RCC); • Medición del pulso y de la PA, en posición sentada y después de 5 minutos de reposo, por lo menos en tres ocasiones en la primera consulta. Se considera a la media aritmética o a la mediana de dichas cifras como el valor representativo para la visita. Es necesario medir la PA en ambos brazos, registrar el valor más elevado y anotar en el expediente a qué brazo corresponde, para medirla en ese miembro a futuro. Los procedimientos para la medición correcta de la PA se discutieron en el inciso 2. Se recomienda la toma de PA en posición de pie si se trata de pacientes adultos mayores para descartar ortostatismo, o en caso que se sospeche disautonomía (diabéticos crónicos, por ejemplo). • Fondo de ojo: tener en cuenta la clasificación de Keith-Wagener de retinopatía hipertensiva, si aplica, aunque los oftalmólogos no la aplican; se buscarán aumento del brillo arterial, cruces arteriovenosos patológicos (signo de Gunn), pérdida de la relación venoarterial, exudados, hemorragias y anomalías de disco óptico y retina periférica (ver figura 2). Debe recordarse que los signos de la retinopatía hipertensiva incipiente (cambios en la relación arteriovenosa, por ejemplo) son inespecíficos, a excepción de las hemorragias y exudados. Cada vez es menos frecuente ver papiledema en clínica. • Cuello: Inspección de venas yugulares, palpación y auscultación de arterias carótidas, valoración de la glándula tiroides; • Exploración cardiopulmonar exhaustiva, describiendo aspecto y expansión del tórax, ventilación pulmonar, punto de máximo impulso (PMI) del corazón, frémitos y ruidos cardíacos, tanto los normales como los accesorios o patológicos; • Abdomen: panículo adiposo, presencia de pulsaciones visibles, circulación venosa complementaria, visceromegalias, tumores; • Exploración de los pulsos periféricos (amplitud, onda de pulso, simetría), del llenado capilar, temperatura de zonas acrales, redes venosas periféricas; • Exploración neurológica básica, que debería ser exhaustiva en caso de lesión previa o actual del sistema nervioso central o periférico): pupilas, movimientos oculares, simetría facial, audición, 27 equilibrio, coordinación, lengua y paladar blando, fuerza de los miembros, sensibilidad, reflejos osteotendinosos y músculocutáneos, normales o patológicos. 4. EXAMENES DE LABORATORIO. Se recomiendan los siguientes estudios de laboratorio básicos para todo paciente hipertenso: • Hematócrito (Hct) y/o hemoglobina (Hb): No es necesario tomar un hemograma completo si solo se estudia la HTA; • Creatinina sérica (nitrógeno ureico en sangre es opcional, pero es necesario en caso de ICC aguda); • Potasio sérico (algunos expertos piden también sodio sérico, para la detección de hiponatremia, si la clínica la sugiere); • Glicemia en ayunas y 2 horas postprandial. Un test de tolerancia oral a la glucosa (TTG) podría ser necesario; • Perfil lipídico: Colesterol total/HDL y triglicéridos (ayuno de 12-14 horas), el colesterol LDL puede calcularse por la fórmula de Friedewald si los triglicéridos son inferiores a 400 mg%: [(CT - CHDL) – TG/5]; • Ácido úrico en especial si se trata de paciente varón o mujeres embarazadas; • Examen general de orina (la "biopsia renal del pobre", según un viejo aforismo); • Microalbúmina en orina si el examen general de orina no muestra proteinuria y se sospecha lesión renal por la cantidad y el tipo de factores de riesgo presentes (diabetes mellitus, por ejemplo). Otras pruebas de laboratorio deberán indicarse en situaciones especiales, que se discutirán en los apartados correspondientes del presente manual. 5. ESTUDIOS DE GABINETE. A continuación los procedimientos de diagnóstico de gabinete que se consideran útiles para el estudio de todo hipertenso. Se busca confirmar el 28 diagnóstico de HTA, descartar causas secundarias y determinar la presencia (o hacer seguimiento) de lesiones de órgano blanco y de su grado de severidad. a) Electrocardiograma (ECG). Fundamental para el diagnóstico de hipertrofia ventricular izquierda (HVI, ver figura 7), evaluación de arritmias, presencia de zonas de necrosis, corrientes de isquemia y/o lesión, diagnóstico de trastornos electrolíticos; b) Radiografía (RX) posteroanterior del tórax; podrán indicarse RX laterales en caso necesario. Se valoran silueta cardíaca, aorta, hilios pulmonares, mediastino, tórax óseo y el parénquima pulmonar (ver figura 8); c) Ergometría o test de ECG de esfuerzo. Ayuda a valorar la condición física, la respuesta presora al ejercicio en pacientes ya tratados y la presencia o ausencia de isquemia o arritmias inducibles. No es un estudio de primer nivel de atención pero tiene aplicación en ciertos pacientes y debe ser tenido en cuenta si hay un elevado riesgo coronario o en presencia de angina de pecho con ejercicio. d) Monitoreo ambulatorio de presión arterial de 24 horas (MAPA, ver figura 9). Es un recurso a menudo subutilizado. Si no se ha llegado a considerar al MAPA como estudio de primera línea quizás sea por su costo relativamente elevado y la poca disponibilidad de monitores (software y equipo costoso, aparatos con vida útil relativamente breve), pero probablemente el estudio vaya ganando popularidad en el futuro cercano. Utilidades: • • • • Valorar el comportamiento circadiano de la PA, en especial la presencia (o ausencia) de descenso fisiológico nocturno de la PA; Medir las cargas presoras porcentuales de PA sistólica y diastólica (número de mediciones con PA elevada entre el total de mediciones válidas, multiplicado este cociente x 100), tanto pre como post-tratamiento; Respuesta presora al estrés, diagnóstico de la hipertensión reactiva y de “bata blanca”; Monitoreo de los efectos de las drogas antihipertensivas para garantizar control total de la hipertensión a lo largo de las 24 horas. e) Ecocardiograma (ECO)/Doppler-color (figura 10). Estudio no invasivo de altísimo rendimiento diagnóstico. No es un estudio de primer nivel porque requiere de equipo sofisticado y personal altamente entrenado, por lo que su costo es relativamente elevado. No se recomienda la ecocardiografía de rutina en pacientes con HTA sin síntomas o evidencia clínica de daño orgánico cardíaco. El ECO permite valorar: • • Masa ventricular izquierda y patrón geométrico ventricular; Movilidad global y segmentaria parietal, grosor y ecogenicidad de paredes, presencia o no de tejido hibernante o cicatricial; 29 • • • • Funciones sistólica y diastólica de ambos ventrículos; Anatomía y funcionamiento valvulares; Anatomía de anillo aórtico, raíz de aorta y aorta ascendente; Estudio hemodinámica global no invasivo, incluyendo medición de presiones venosa central, atrial izquierda y venocapilar pulmonar; cálculo de presiones de llenado ventriculares y presión sistólica de la arteria pulmonar. Se pueden medir volumen sistólico, gasto e índice cardíacos. Además se pueden medir gradientes subvalvulares o intracardíacos en caso de cardiomiopatía hipertrófica. Otros procedimientos (doppler de arterias renales, monitoreo de Holter, estudios de función autonómica, pruebas de mecánica vascular y/o función endotelial, estudios de medicina nuclear, tomografía axial computarizada, resonancia magnética nuclear) podrían ser necesarios en ciertos pacientes, pero no se consideran mandatarios para los niveles básicos de atención. Se deberá valorar, al indicarlos, la relación costo/beneficio para cada individuo en particular, independientemente de los recursos disponibles. 30 FIGURA 7. Signos electrocardiográficos de hipertrofia ventricular izquierda (considerando criterios de Romhilt-Estes). 1: Voltaje de R en precordiales izquierdas. 2: Polaridad de ST opuesta a la de R (patrón de sobrecarga sistólica). 3: Deflexión intrinsecoide de QRS. 4: Eje eléctrico de QRS en el plano frontal. 5: Presencia de signos de crecimiento atrial izquierdo. FIGURA 8. Radiografía de tórax. Cardiomegalia en un paciente hipertenso crónico. Paciente de pie, proyección posteroanterior. 31 FIGURA 9. Monitoreo ambulatorio de presión arterial de 24 horas. Obsérvese el comportamiento circadiano y la elevación matinal de la presión arterial, responsable de que la mayoría de eventos cardiovasculares mayores se registren entre las 4 AM y las 10 AM. FIGURA 10. Ecocardiograma 2D. Proyección de eje largo paraesternal en un paciente con cardiopatía hipertensiva. Nótense los grosores parietales de 19.9 y 21.5 mm (valor máximo normal hasta 11 mm). Se trata de una típica hipertrofia concéntrica del ventrículo izquierdo, pues la cavidad ventricular (medición DVId) es menor de lo normal y la relación h/r (radio cavidad/grosor pared posterior) es de 0.66 (valor máximo 0.45-0.5). Tomado de la colección de casos clínicos del Dr. Hugo Villarroel Ábrego. 32 Tabla 5. FACTORES DE RIESGO CARDIOVASCULAR*. FACTOR DE RIESGO Sexo masculino COMENTARIOS Factor no modificable. Si parientes consanguíneos padecieron de un problema cardiocirculatorio antes de los 55 años, hay un mayor riesgo cardiovascular comparado al de quien que no tiene esos antecedentes. A mayor edad, mayor riesgo de eventos cardiovasculares: mujeres mayores de 65 años y varones mayores de 55 años. Pérdida de la protección que las hormonas endógenas proporcionan al endotelio. El estrés produce sobreactivación simpática e hipotálamo-hipofisiaria-adrenal, coadyuvando al aceleramiento del desarrollo de lesiones cardiovasculares estructurales; podría haber tendencia también a trombosis. ↑ Riesgo relativo de eventos desde cuando la PA sistólica es mayor de 115 mm Hg. Factor de riesgo mayor independiente, quizá el de mayor impacto de todos los conocidos. Exceso de eventos en comparación con población general. Predictor independiente de eventos. Factor de riesgo independiente, relacionado con aumento del tono simpatoadrenal. Factor promotor de lesiones macro y microangiopáticas, en gran parte por ateroesclerosis acelerada. La diabetes tipo II es la etapa evolutiva final del síndrome metabólico. Se considera que la diabetes confiere un riesgo cardiovascular a siete años idéntico al de haber sufrido un infarto miocárdico anteroseptal agudo. Factor de riesgo mayor para enfermedad cardiovascular, cerebrovascular, neumopatía y diversos tipos de cáncer; incrementa marcadamente la actividad simpatoadrenal y expone a arritmias e isquemia. El abuso de alcohol (>3 onzas de etanol al día) causa vasoconstricción e incremento de las cifras de presión arterial, también estimula la liberación de vasopresina y expone a retención de agua libre e hyponatremia. Uno de los marcadores de riesgo tradicional de mayor prevalencia e impacto aterógeno, identificado como tal por primera vez en el estudio de Framingham. Subgrupo de partículas de LDL con mayor aterogenicidad que el LDL de mayor volumen y densidad, tienden a aumentar su proporción cuando existe hipertrigliceridemia. Subtipo de LDL con mayor aterogenicidad y promotora de trombosis, su importancia como factor de riesgo está en debate. Historia familiar de cardiopatía Edad avanzada Postmenopausia Estrés Prehipertensión Hipertensión arterial crónica Hipertensión arterial “reactiva” Ausencia de descenso nocturno de PA Taquicardia en reposo Diabetes mellitus/ Intolerancia a carbohidratos Tabaquismo Etilismo Hipercolesterolemia total/LDL ↑ % partículas pequeñas y densas de C-LDL Lp (a) 33 FACTOR DE RIESGO COMENTARIOS Marcador de riesgo independiente que tiende a coexistir con LDL pequeñas y densas y niveles bajos de C-HDL. Cada decremento de 1 mg% de C-HDL conlleva un 3% de incremento de riesgo de eventos cardiovasculares. Condiciones clave para el desarrollo de hiperinsulinismo, HTA, síndrome metabólico, y diabetes. Factor de riesgo independiente para ateroesclerosis y eventos trombóticos. El impacto real de su tratamiento está sujeto a discusión. Promueve balance calórico positivo y obesidad. Claramente asociado a mayor riesgo de eventos cardiovasculares. Marcador de adiposidad abdominal y obesidad central, de alto valor predictivo para el diagnóstico del síndrome metabólico. Marcador de obesidad central, tiene valor predictivo para diagnóstico del síndrome metabólico, menor valor diagnóstico que el perímetro de cintura. Independientemente de las cifras de HTA, la hipertrofia ventricular multiplica el riesgo de muerte por un factor de 3-5 veces. El ácido úrico elevado es agente inductor de disfunción endotelial y su prevalencia en hipertensos es cercana al 50%. Marcador específico y agente inductor de inflamación vascular, prerrequisito para el desarrollo de ateromatosis vascular e inestabilización de placas ateromatosas ya existentes; se considera de riesgo una elevación de más de 2.0 mg% La presencia de microalbuminuria es el más precoz marcador de nefropatía y multiplica exponencialmente el riesgo de eventos cardiovasculares. Hipertrigliceridemia Bajos niveles de colesterol-HDL Obesidad, sobrepeso Hiperhomocisteinemia Sedentarismo ↑ Perímetro de cintura Relación cintura/cadera anormal Hipertrofia ventricular izquierda Hiperuricemia ↑ PCR de alta sensibilidad (cardíaca) Microalbuminuria * No se trata de una lista exhaustiva, pero se revisan los factores de riesgo más importantes. 34 SECCIÓN III. TRATAMIENTO DE LA HIPERTENSIÓN ARTERIAL. 35 1. METAS DEL TRATAMIENTO DE LA HIPERTENSIÓN ARTERIAL. Es difícil tratar con éxito a largo plazo (en especial con fármacos) una condición crónica asintomática u oligosintomática. El tratamiento de la HTA es muy eficaz en la prevención de lesión orgánica subclínica, eventos cardiovasculares mayores y mortalidad, pero las tasas de abandono o falta de cumplimiento son muy elevadas, entre otras cosas por falta de disciplina personal, déficit de educación en salud (tanto entre pacientes como en tratantes), acceso limitado (geográfica y culturalmente) a servicios institucionales de salud eficientes y bien equipados, y muy elevados costos de atención médica privada. El manejo del hipertenso, para ser considerado exitoso, debe buscar cumplir ciertos objetivos, independientemente de los recursos económicos o técnicos de los que se disponga en un lugar y momento determinados. En todo caso, el objetivo fundamental es reducir al máximo el riesgo cardiovascular global. Para lograrlo es necesario: • Tratar todas las comorbilidades concomitantes. • Reducir las cifras de presión arterial y mantenerlas bajas de modo sostenido, en un rango seguro, según el perfil de riesgo individual; • Prevenir las complicaciones de la enfermedad hipertensiva; • Conservar la calidad de vida; • Obtener una relación costo-beneficio óptima. 36 2. TOMA DE DECISIONES PARA INICIO DE TRATAMIENTO. PASOS EN EL PROCESO DE DECISIÓN. Deben considerarse algunos conceptos fundamentales antes de proponer a un paciente el inicio de cualquier terapia antihipertensiva, farmacológica o no farmacológica: • Es juicioso basar la terapia en evidencia sólida, derivada de ensayos clínicos controlados, pero sin perder de vista al paciente, entidad única e irrepetible; debe individualizarse cada caso, recordando, además de las comorbilidades y del perfil clínico, su acervo cultural y la condición socioeconómica personal y familiar; • Es mandatario instaurar terapia no farmacológica en 100% de casos de HTA, los llamados cambios terapéuticos del estilo de vida. Esto aplica aún a sujetos que no son hipertensos pero que están a riesgo de desarrollar HTA: obesos, diabéticos, hijos de hipertensos, por ejemplo. Es probable que de este modo, comenzando desde la infancia con un estilo de vida saludable, pueda llegar a prevenirse la aparición misma de la HTA, aún en presencia de una importante carga genética. • Si no hay lesión demostrable de los órganos blanco y el paciente se encuentra en fase prehipertensiva, el paso inicial que nadie discute es precisamente iniciar cambios terapéuticos del estilo de vida, por lo menos hasta que se tenga evidencia experimental que confirme que tratar a estos individuos con drogas sea provechoso en términos de reducción de morbimortalidad cardiovascular. Los recientes resultados del estudio TROPHY (Candesartan Cilexetil Long-Term Hypertension Prevention Trial) sugieren esa posibilidad7. • Introducir terapias farmacológicas implica riesgo de interacciones con otras drogas y/o efectos adversos. la selección de medicamentos debe ser cuidadosa, tomando en cuenta estos factores para garantizar la seguridad del paciente. 37 3. TRATAMIENTO NO FARMACOLÓGICO. Los pilares del tratamiento no farmacológico de la HTA son la dieta saludable, el ejercicio físico, el manejo del estrés y evitar el uso o consumo de sustancias potencialmente tóxicas para la salud. 3.1. ALIMENTACIÓN SALUDABLE. Las metas principales de una dieta saludable incluyen, además del consumo de todos los nutrientes necesarios, las reducciones del índice de masa corporal (IMC), perímetro de cintura y porcentaje de la grasa corporal total, variables que deberán ser medidas de base y reevaluadas periódicamente. Una dieta variada, que incluya varias porciones diarias de vegetales y frutas, lácteos descremados, rica en fibra, calcio, potasio y magnesio ha demostrado ser efectiva para la reducción de la presión arterial en pacientes hipertensos: Ver Tabla 6, dieta DASH (Dietary Approaches to Stop Hypertension), por el estudio homónimo8. • Los cambios de la alimentación deberían ser establecidos de manera gradual, para evitar la frustración del paciente y garantizar así la adhesión al régimen. Gustos y preferencias personales así como algunas conductas alimentarias culturalmente condicionadas deben ser tomadas en cuanta a la hora de diseñar la dieta, trabajo que, por lo general, debería ser delegado a profesionales en el área de nutrición. • Se estima que la ingesta calórica promedio estará cerca de 2000 kilocalorías (Kcal) al día en una persona adulta y activa, aunque estos requerimientos podrán variar al considerar la situación específica de cada paciente. En caso de que se requiera restricción calórica, una recorte de 600 kilocalorías (Kcal) al día podría ser apropiado. • Debe moderarse el consumo, en todo caso, de carbohidratos simples (harinas y azúcar refinada, por excelencia), sodio (no más de 2 gramos al día), colesterol y grasas saturadas, en especial las de origen animal. Las proteínas de la dieta podrían ser reducidas en caso de hepatopatía o enfermedad renal crónica. • La cafeína puede permitirse (excepto en caso de angina inestable o arritmias) de manera moderada (no más de 2 o tres tazas pequeñas al día, no muy cargadas), o podría optarse por café descafeinado en bebedores compulsivos. 38 • Se estimulará el consumo de carbohidratos complejos con abundante fibra (no menos de 30 gr/día de fibra) y alimentos ricos en calcio, potasio y magnesio: vegetales, legumbres y frutas. • En general, en la dieta del hipertenso deben estar presentes todos los grupos de alimentos, en las cantidades adecuadas para cada grupo y preparados teniendo en cuenta los principios de la alimentación saludable arriba expuestos. Algunas restricciones aplican según casos individuales (intolerancias, alergias, uso de anticoagulantes orales, enfermedades metabólicas, etc.). 3.2. CONSUMO MODERADO DE ALCOHOL. Se aconseja que el alcohol no sea consumido en una cantidad superior a 3 onzas de etanol al día, lo que correspondería gruesamente a 3 bebidas sencillas de licor destilado, tres botellas de cerveza o tres copas medianas de vino. Ingestas superiores producen incremento de las cifras de PA. Algunos individuos están más propensos al daño hepático causado por etanol (mujeres, por ejemplo) o ya sufren de algún grado de disfunción hepática o están en tratamiento con fármacos potencialmente hepatotóxicos. Si se emplean drogas depresoras del sistema nervioso central debería evitarse el alcohol. Sujetos propensos a las adicciones deberían abstenerse de su consumo. No se recomienda que personas que nunca han bebido alcohol comiencen a hacerlo con la idea de hacer prevención de enfermedad cardiovascular. 3.3. NO AL TABAQUISMO. Cualquier uso de cualquier tipo o presentación de tabaco es altamente perjudicial para la población general, y muy en particular para la persona que sufre de HTA, por lo que no deberá tolerarse el tabaquismo en ninguna de sus formas. Las personas no fumadoras que conviven con tabaquistas por períodos largos de tiempo están expuestas a los mismos riesgos a los que se expone el fumador (tabaquismo pasivo). En áreas rurales de países con bajo índice de desarrollo humano debe recordarse que es común el uso intradomiciliario de combustibles sólidos, como la leña y el carbón, que también son nocivos para la salud cardiopulmonar. 3.4. MANTENER UN PLAN DE EJERCICIO REGULAR. El ejercicio aeróbico diario es recomendable para mejorar el control de la presión arterial. Un plan de ejercicio para hipertensos no 39 deberá ser puesto en marcha hasta que se haya consultado al médico, pues pueden existir contraindicaciones para grados intensos de actividad: HTA no controlada, valvulopatía aórtica, arritmias inducidas por ejercicio, enfermedad coronaria significativa, angina inestable, infarto miocárdico reciente. Una prueba de esfuerzo podría llegar a ser necesaria antes de someter a algunos pacientes a estrés físico, en especial bajo condiciones climáticas extremas. Entre los beneficios de un plan de no menos de 20 minutos diarios y continuos de actividad aeróbica (caminar, trote, natación y ciclismo no competitivos) se tienen la pérdida calórica, la reducción ponderal a expensas de tejido adiposo, disminución de la resistencia a la insulina, mejoría de la función endotelial, inhibición del tono simpatoadrenal, la reducción de la masa ventricular izquierda y una mejoría concomitante del rendimiento cardíaco global. Se puede y debe estimular a los hipertensos a seguir un programa de hasta 5 horas semanales de ejercicio, si es necesario en breves pero más frecuentes períodos de actividad o combinación de actividades que resulten de mayor agrado. Merecen atención aparte los pacientes con algún grado de falla cardíaca, los individuos con minusvalía física o problemas ortopédicos, los neumópatas crónicos y los pacientes con edad avanzada. Los ejercicios intensos y muy espaciados en el tiempo, los deportes de competencia y los de contacto podrían ser perjudiciales para el corazón y predisponer a accidentes. Tres mensajes clave para los que planean hacer ejercicio: un poco de ejercicio es mejor que nada; volverse sedentario es tan malo como haberlo sido toda la vida; nunca es tarde para empezar. 3.5. MANEJO DEL ESTRÉS. El estrés (físico, psíquico o ambiental) es difícil de definir. Aunque es una reacción adaptativa común (“lucha o huída”) ante los problemas de la vida, es percibido como una “tensión”, por lo general, desagradable. A nivel fisiológico, desencadena respuestas inmediatas simpatoadrenales y, de modo mediato, del eje hipotálamo-hipófisis-suprarrenal, con liberación de hormona adrenocorticotrópica (ACTH) e hipercortisolismo. El estrés crónico (sobre todo el traslape de eventos estresantes sucesivos sin dejar tiempo para la recuperación del equilibrio afectivo y emocional) genera reacciones psicofísicas que han sido descritas por psicólogos y psiquiatras: irritabilidad, actitud hostil, trastornos de ansiedad; manifestaciones somatomorfas, muchas de ellas síntomas relacionados con el aparato cardiovascular: palpitaciones, disnea “suspirosa”, dolor torácico opresivo y sensación de desvanecimiento. Casi todas estas manifestaciones están mediadas por hiperventilación psicógena con hipocarbia y alcalosis respiratoria. No hay duda que el estrés agudo puede provocar reacciones hipertensivas transitorias y aún eventos cardiovasculares; el estrés 40 crónico puede agravar la HTA, en especial en pacientes con personalidad tipo A, con baja tolerancia a la frustración o propensos a la ira. El estrés psicosocial crónico es un predictor independiente de infarto miocárdico, como lo ha demostrado claramente el estudio INTERHEART9. Por lo anterior, las técnicas de relajación, el ejercicio aeróbico, los masajes, la práctica de disciplinas como el tai-chi y el yoga podrían contribuir, junto con la psicoterapia cuando sea necesario, a mejorar el manejo del estrés y reducir así su inevitable impacto neurohormonal y cardiovascular. 4. TRATAMIENTO FARMACOLÓGICO. Si se confirma, después de una exhaustiva valoración global de riesgo, que las cifras de PA de un individuo determinado son constantemente superiores al límite que se considera seguro, lo más probable es que llegue a emplearse farmacoterapia en algún momento. No existe aún evidencia que los medicamentos antihipertensivos reduzcan morbimortalidad en pacientes con prehipertensión (actualmente tratados solo con cambios de estilo de vida), pero si hay historia familiar positiva de eventos cardiovasculares tempranos o presencia de muchos factores de riesgo pero con PA aún normal, podrían ser candidatos para farmacoterapia temprana. También sujetos que, sin ser hipertensos, han sufrido ACV, IM o disfunción ventricular, deberían considerarse para tratamiento con drogas. Estas conclusiones se desprenden de los resultados de estudios como HOPE (Heart Outcomes Prevention Evaluation Study) 10, PROGRESS (Perindopril Protection Against Recurrent Stroke Study) 11 y EUROPA (European Trial on Reduction Of Cardiac Events With Perindopril In Stable Coronary Artery Disease) 12. Los grandes estudios de investigación clínica son considerados clave para el diseño de estrategias de tratamiento de hipertensión arterial. Por supuesto, la mejor evidencia disponible es la que se ha obtenido a partir de experimentos clínicos controlados, con protocolos doble ciego y una distribución aleatoria de gran número de pacientes. Por supuesto, también se han recolectado datos que provienen de estudios transversales, de revisiones, posturas de diferentes grupos de expertos, análisis retrospectivos de casos y controles, todas estas fuentes aportando información de menor peso específico. 4.1. MEDICAMENTOS ANTIHIPERTENSIVOS. Las drogas antihipertensivas se clasifican, según su mecanismo de acción principal y en orden de antigüedad histórica, en las siguientes categorías: 4.1.1. Drogas de acción central. Interfieren con el tráfico adrenérgico a nivel del sistema nervioso central, reduciendo, por tanto, el eflujo de catecolaminas hacia el corazón y la 41 vasculatura periférica, generando vasodilatación y reducción de la PA. Se trata de fármacos antiguos y de bajo costo, pero por desgracia, con un importante número de efectos adversos que limitan, hasta cierto punto pero no en todos los pacientes, su uso a largo plazo. 4.1.2. Diuréticos. Después de cinco décadas de experiencia con diuréticos en el tratamiento de la HTA, se considera que estos medicamentos ya han superado la prueba del tiempo. Los diuréticos que se emplean para el tratamiento de la hipertensión arterial son las tiazidas a dosis bajas (y similares) y los diuréticos ahorradores de potasio; los diuréticos de asa o plafond alto se emplean para el manejo de la ICC y la IRC. 4.1.3. Vasodilatadores directos. Su principal indicación es en las crisis hipertensivas, administrados por la vía parenteral (nitroglicerina, nitroprusiato de sodio). El uso crónico de hidralazina o minoxidil, las drogas más representativas del grupo, es poco menos que excepcional. 4.1.4. Bloqueadores alfa-adrenérgicos (α-B). Por el momento se les considera medicamentos de tercera línea. En el estudio ALLHAT13, en que su uso crónico (doxazosina) aumentó el riesgo relativo de infarto miocárdico. Tienen efectos metabólicos benéficos, pero se restringen casi siempre para pacientes hipertensos (o no hipertensos) con hipertrofia prostática. 4.1.5. Bloqueadores beta-adrenérgicos (β-B). Son medicamentos fundamentales para el manejo de la hipertensión arterial, sobre todo en presencia de cardiopatía isquémica, ICC o arritmias. Se subclasifican según su acción más o menos selectiva sobre los subtipos de receptores β, su hidrofilia/lipofilia y según sean capaces o no de ejercer actividad simpatomimética intrínseca (ASI). Recientemente se ha postulado que en ausencia de indicaciones mandatorias para su uso, estos fármacos serían drogas de tercera o cuarta línea, principalmente por el aumento de casos nuevos de diabetes y la poca eficacia en la prevención de eventos mayores, en especial con atenolol14, 15, 16. Exceptuando a éste y al metoprolol, no hay estudios de reducción de morbimortalidad en HTA con otros miembros de la familia. Sin embargo han sido ensayados con mucho éxito en enfermedad isquémica e ICC. 4.1.6. Bloqueadores de canales de calcio (BCC). Los antihipertensivos con más intenso efecto hipotensor pertenecen a este muy heterogéneo grupo de medicamentos, cuyas drogas prototipo son la nifedipina, el verapamil y el diltiazem. Son especialmente eficaces en HTA con “renina 42 baja”, adultos mayores, cardiopatía isquémica estable y en la prevención de ACV. 4.1.7. Inhibidores de la enzima convertasa de angiotensina (IECA). Disponibles en terapéutica desde 1979, estas drogas han demostrado ejercer un efecto protector sobre órganos blanco, más allá de la reducción de las cifras de PA. Sus beneficios se han documentado tanto en la prevención primaria en pacientes con alto riesgo como en personas con condiciones clínicas graves y de mal pronóstico, tales como ICC, infarto miocárdico con falla cardíaca e IRC. 4.1.8. Antagonistas de los receptores de angiotensina II (ARAII). Después de más de 10 años de experiencia con ARA-II ha quedado claro que estos fármacos presentan una tolerabilidad prácticamente comparable con placebo, compartiendo con los IECA’s muchas de sus virtudes terapéuticas. No se ha demostrado a la fecha superioridad de los ARA-II’s sobre los IECA’s, pero tienen ventajas farmacocinéticas y farmacodinámicas innegables, así como un mejor perfil de tolerabilidad, comparable al placebo. Para un listado parcial de las más importantes drogas disponibles en el mercado para cada uno de los grupos de fármacos antihipertensivos deberá consultarse la Tabla 7. En la Tabla 8 se describen farmacocinética y pautas de dosificación. Los efectos adversos, interacciones y precauciones más relevantes se detallan en la Tabla 9. Las tres tablas se encuentran al final de esta sección. Existen otras categorías de fármacos antihipertensivos, pero al momento están en fase de investigación o no están siendo aún comercializados. Se podría mencionar a los antagonistas de renina (aliskiren), a los antagonistas de receptores de endotelina (bosentán) y a los inhibidores de vasopeptidasa neutra. Estas drogas no serán estudiadas en detalle en el presente manual por razones de tipo práctico. Tampoco se estudiaran los bloqueadores ganglionares, ya en desuso para el manejo de la HTA crónica. Los requisitos ideales que debería cumplir cualquier droga empleada en el tratamiento de la HTA crónica son los siguientes: a) Alta eficacia antihipertensiva. Las reducciones de cifras de PA deben ser significativamente superiores a las producidas por placebo, de manera uniforme y consistente; b) Evidencia clínica que confirme impacto en reducción de morbimortalidad; este es uno de los criterios de mayor relevancia y se discutirá a fondo en la sección relacionada con indicaciones mandatorias para el tratamiento de la HTA (inciso 5 de la presente sección); 43 c) Beneficios clínicos más allá de la simple reducción de las cifras de PA; esto implicaría, de preferencia, beneficios sobre la función endotelial y sobre el remodelado de la pared vascular, propiedades antioxidantes u otros efectos favorables sobre el metabolismo; d) Elevado índice terapéutico (seguridad); la dosis que resulte tóxica debe estar muy alejada de las dosis que se consideran terapéuticas; e) Índices pico/valle (I P/V) y de uniformidad (IU) elevados, que garanticen eficacia clínica con una sola dosis diaria; la medición de estos índices puede arrojar resultados variables según los autores revisados, los procedimientos de cálculo, las dosis de las drogas y el tipo de pacientes involucrados en el estudio. Mientras más elevados sean los I P/V e IU, mayor garantía de un efecto prolongado (ver Tabla 9); f) Inicio de efecto gradual y descenso lento de acción; esto implica, por lo general, una vida media (t½) prolongada. Las drogas que provocan cambios bruscos de PA generan respuestas reflejas del sistema nervioso simpático y del sistema renina-angiotensina, lo que está asociado a lesión orgánica, aumento de eventos y de mortalidad. Por ello se ha abandonado el uso de drogas de acción rápida, en especial de bloqueadores de canales de calcio de primera generación (nifedipina, verapamil o diltiazem de acción corta); g) Efecto metabólico neutro o benéfico: se espera que los medicamentos ideales no resulten diabetógenos ni deterioren el perfil lipídico de los pacientes, ni que ejerzan efectos proinflamatorios o protrombóticos; h) Tolerabilidad comparable a placebo, fundamental para garantizar calidad de vida y adhesión a largo plazo al tratamiento; i) Bajo costo. Podría ser difícil mantener tratamientos combinados a largo plazo en poblaciones de escasos recursos económicos que no tengan cobertura institucional para su atención en salud. Es sabido también que las instituciones sanitarias se inclinan a menudo por las opciones menos costosas del mercado a la hora de configurar sus cuadros básicos de medicamentos. Podría haber, además, presión de parte de servicios privados de prepago para que el médico tratante se incline a seleccionar genéricos en vez de drogas originales (lo cual no es problema si se trata de verdaderos genéricos y no de copias. 44 TABLA 7. Medicamentos antihipertensivos. DROGAS (Nombre comercial*) EVIDENCIA GRUPO Drogas de acción central α-Metildopa (Aldomet) Clonidina (Catapresan) ¶ Minoxidina Tiazidas y similares Diuréticos Hidroclorotiazida (HCTZ) Clortalidona Metolazona (Zaroxolyn) Indapamida (Natrilix) Indapamida SR (Natrilix SR) Xipamida (Aquaphoril) ALLHAT ASCOT INSIGHT MRC PROGRESS SHEP STOP-HTA Ahorradores de potasio † Vasodilatadores directos Amilorida Espironolactona (Aldactone) ¶ Eplerenona † Triamtereno ¶ Fenoldopam Hidralazina (Apresoline) Nitroglicerina (Tridil) Nitroprusiato de sodio (Nipride) Selectivos β-B Atenolol (Tenormín) Bisoprolol (Concor) Metoprolol (Lopresor) Metoprolol XL (Betaloc ZOC) Nebivolol (Nebilet) 4E EPHESUS RALES A-HeFT V-HeFT ASCOT CIBIS CIBIS II CIBIS III CONVINCE INVEST MERIT-HF MRC SHEP STOP-HTA SENIORS No selectivos α-B α/β-B Esmolol (Brevibloc) Propranolol (Inderal) Propranolol LA (Inderal LA) Prazosín (Minipres) Doxazosina (Cardura) Terazosina (Hytrin) ALLHAT Verapamil SR (Isoptin Retard/SR) US Carvedilol COPERNICUS CAPRICORN CARMEN AASK ACTION ALLHAT HOT INSIGHT INTACT STONE STOP-2 Syst-Eur VALUE V-HeFT III CONVINCE INVEST Benzotiazepinas NORDIL Carvedilol (Coreg) ¶ Labetalol (Trandate) Dihidropiridinas (DHP) BCC BHAT Amlodipina (Norvasc) Felodipina ER (Plendil) Isradipino SR (Dynacirc SR) Lacidipino (Lacipil) Lecarnidipina (Carbimen) Nifedipina (Adalat Retard/OROS) ¶ Nisoldipina retard (Syscor) ¶ Nitrendipina (Baypress) Fenilalquilaminas Diltiazem (Tilazem Retard) 45 Benazepril (Lotensin) Captopril (Capoten) Cilazapril (Inhibace) Enalapril (Renitec) Enalaprilat (uso intravenoso) Fosinopril (Monopril) Lisinopril (Zestril) Perindopril (Coversyl) Quinapril (Accupril) Ramipril (Tritace) † Trandolapril Zofenopril (Zofenil) AASK AIRE ALLHAT ASCOT CAPP CONSENSUS DREAM EUROPA GISSI-3 HOPE/MICROHOPE ISIS-4 PROGRESS PEACE TRACE TREND V-HeFT II SAVE SMILE Candesartán (Atacand, Blopress) ¶ Eprosartán (Teveten) Irbesartan (Aprovel) Losartán (Cozaar) Olmesartán (Olmetec) Telmisartán (Micardis) Valsartán (Diován) CHARM DETAIL DREAM ELITE II LIFE OPTIMAAL PRIME RENAAL SCOPE VALUE VALIANT VAL-HeFT † IECA ARA-II Diurético + Diurético HCTZ + triamtereno ¶ Espironolactona + furosemida Diurético + β-B Atenolol + clortalidona (Tenoretic) Bisoprolol + HCTZ (Ziac) Diurético + IECA Combinaciones fijas Captopril + HCTZ (Capozide) Enalapril + HCTZ (Co-Renitec) Lisinopril + HCTZ (Zestoretic) Perindopril + Indapamida (Preterax, Bipreterax) Quinapril + HCTZ (Accuretic) Ramipril + HCTZ (Tritace HCT) Diurético + ARA II Candesartán + HCTZ (Atacand/Blopress Plus) Irbesartán + HCTZ (Co-Aprovel) Losartán + HCTZ (Hyzaar, Hyzaar Forte) Telmisartán + HCTZ (Micardis Plus) Valsartán + HCTZ (Co-Diován) β-B + BCC Atenolol + nifedipina retard (Tenif) BCC + IECA Amlodipina + benazepril Verapamil SR + trandolapril (Tarka) Antihipertensivo + otros Amlodipina + atorvastatina (Caduet) *: Nombre del producto original ¶: Medicamento no disponible en Centroamérica. †: Droga no disponible en Centroamérica fuera de combinaciones fijas. 46 INSIGHT INVEST TABLA 8. Farmacocinética y esquemas de dosificación de las drogas antihipertensivas. DROGA DOSIS ESTÁNDAR t/2 (h) DURACIÓN ACCIÓN (h) ÍNDICE V/P METABOLISMO EXCRECIÓN Drogas acción central α-Metildopa 250-1000 mg bid 1.7 12-24 <0.5 SNC/Hepático Fecal/Renal Clonidina 50-150 µg bid-tid 12-16 8 <0.5 Hepático Renal Diuréticos Hidroclorotiazida Clortalidona Metolazona Indapamida SR Xipamida Espironolactona 6.25-25 mg qd 6-15 6-12 12.5-25 mg qd 35-50 48-72 >0.5 1.5 mg qd 14 12-24 >0.5 10-20 mg qd 14-18 >24 0.9 2.5-10 mg qd - - >0.5 12.5-200 mg qd 13-24 48-72 - >0.5 5% Hepático >0.5 Hepático Hepático Renal Renal Renal Renal/Fecal Renal/Fecal Bloqueadores beta-adrenérgicos Propranolol Propranolol LA 10-160 tid 3-5 6 80-160 bid - 12 Atenolol 25-200 mg qd 6-7# 24 Metoprolol 25-100 mg bid 3-7# Según dosis Metoprolol XL 25-200 mg qd - 24 Carvedilol 3.125-25 mg qd-bid 7-10 24 Bisoprolol 1.25-10 mg qd 7-15 24 Nebivolol 2.5-5 mg qd 10 >24 <0.5 - <0.5 - <0.5 - <0.5 >0.5 Hepático - 0.65 Fecal/Renal >0.5 - 0.9 Fecal/Renal Bloqueadores alfa-adrenérgicos Prazosín 1-2 mg bid-tid 2-4 10 <0.5 Doxazosina 1-8 mg qd 19-22 24 0.55-0.7 Terazosina 2.5-10 mg qd 12 24 >0.5 Hepático Fecal/Renal Hepático Fecal/Renal Bloqueadores de canales de calcio Nifedipina OROS Amlodipina Lacidipino Isradipino SR Felodipina ER Lercanidipino Isoptin SR Diltiazem Retard 30-60 mg qd - >24 0.6-0.94 2.5-10 mg qd 30-50 >24 0.63 2.5-10 mg qd 13-19 >24 0.62 5-10 mg bid 8 8 0.1-0.8 2.5-10 mg qd 11-16 <24 0.3-0.45 2.5-20 mg qd 6-8 >24 0.6-0.8 120-480 mg qd 14-16 24 0.82 90-360 mg qd - 24 0.51 47 Inhibidores de la enzima convertidora de angiotensina Captopril 6.25-50 mg tid <3 6-12 0.25 Renal Enalapril 2.5-40 mg qd-bid 11 24 0.4-0.64 Renal Benazepril 5-40 mg qd-bid 10-11 <24 0.4 Renal Cilazapril 10-40 mg qd 7-11 24 0.1-0.8 Renal Fosinopril 10-40 mg qd 11.5-12 24 0.64 Lisinopril 10-40 mg qd 12 >24 0.3-0.7 Perindopril 2-8 mg qd 12.6 24 0.75-1.0 Renal Quinapril 10-40 mg qd 1-3 12-24 0.3-0.4 Renal Ramipril 2.5-10 mg qd 13-17 24 0.5-63 Renal Zofenopril 10-20 mg qd 5.5 24 0.55-0.75 Renal Hepático Renal/Fecal Renal Bloqueadores de receptores de angiotensina II Losartán 25-100 mg qd 1.5-2 18-24 0.5-0.75 Hepático Fecal/Renal Valsartán 40-320 mg qd 6 24 0.66 Hepático Fecal/Renal Irbesartán 150-300 mg qd 11-15 24 0.58-0.74 Hepático Fecal/Renal Candesartán 4-32 mg qd 5-10.5 >24 0.8 Hepático Fecal/Renal Telmisartán 40-160 mg qd 24 >24 0.95-1.0 Hepático (mín.) Fecal Olmesartán 20-40 mg qd 13 24 0.5-0.8 Hepático Fecal/Renal Solo se incluyen medicamentos disponibles en Centroamérica. t1/2: Vida media. qd: Una dosis diaria. bid: Dos dosis diarias. tid: Tres dosis diarias. #: Puede prolongarse hasta 144 horas en IRC terminal. +: Depende de la galénica del producto. 48 TABLA 9. Efectos adversos, contraindicaciones, interacciones precauciones relacionadas con el uso de drogas antihipertensivas. DROGA EFECTOS ADVERSOS INTERACCIONES CONTRAINDICACIONES PRECAUCIONES Drogas acción central alfa-Metildopa Clonidina Astenia Bradicardia Cefalea Congestión nasal Depresión Estreñimiento Disfunción eréctil Fatiga Fiebre Ginecomastia Hemólisis Hepatitis Hiporexia Lupus Mareo Ortostatismo Pancreatitis Parestesias Parkinsonismo Rash Somnolencia Trastornos GI Xerostomía AINE’s Alcohol Anestésicos Antidepresivos TC Anorexígenos Depresores del SNC Haloperidol IMAO Levodopa Litio Simpatomiméticos Hepatopatía activa Depresión Alergia previa Falla hepática previa Bloqueos AV Depresión Parkinson Feocromocitoma HTA rebote Disfunción sinusal Raynaud Trastornos del sensorio Alergia previa Alergia a sulfas (indapamida) Anuria Coma hepático Desequilibrio electrolítico+ Embarazo Lactancia Litio QTc prolongado Cardiomiopatía obstructiva Diabetes/Intolerancia CHO Embarazo Estenosis valvulares Hiperuricemia/Gota IAM Insuficiencia hepática Oliguria Pancreatitis Diuréticos Hidroclorotiazida Clortalidona Metolazona Indapamida SR Xipamida Espironolactona Agranulocitosis Calambres Cefalea Confusión Disfunción eréctil Dislipidemia Fatiga Fiebre Fotosensibilidad Gota Hematuria Hepatopatía Hiperuricemia Hipocalcemia Hipokalemia Hipomagnesemia Hiponatremia Hiporexia Intolerancia CHO Leucopenia Mareo Nefritis Ototoxicidad Rash Trastornos GI Trombocitopenia Xantopsia Alcalosis Azotemia Cefalea Confusión Disfunción eréctil Fatiga Ginecomastia Hiperkalemia Hipocloremia Hiponatremia Hirsutismo Mastodinia Rash AINE’s Aminoglicósidos Anfotericina B Corticosteroides Digoxina Hipoglicemiantes IECA’s Litio Teofilina Warfarina ACTH AINE’s Alopurinol Aspirina Digoxina Esteroides Estrógenos Hipoglicemiantes Laxantes IECA’s Simpatomiméticos Sustitutos de sal 49 Anuria Hiperkalemia IRC Anuria/Oliguria Deshidratación Hepatopatia Hiperkalemia IRC Litiasis renal y DROGA EFECTOS ADVERSOS INTERACCIONES CONTRAINDICACIONES PRECAUCIONES Bloqueadores beta-adrenérgicos Propranolol Propranolol LA Atenolol Metoprolol Metoprolol XL Carvedilol Bisoprolol Nevibolol Bradicardia Broncoespasmo Depresión Disfunción eréctil Dislipemia Disnea Fatiga fácil Frialdad distal Intolerancia CHO Pesadillas Púrpura Rash cutáneo Reducción libido Somnolencia Trastornos GI Trombocitopenia Xeroftalmía AINE’s Anestésicos Antiarrítmicos Clonidina Depresores SNC Digoxina Diltiazem Hipoglicemiantes Simpatomiméticos Verapamil Asma Bloqueos AV Bradicardia severa EPOC* ICC no controlada Síndrome de seno enfermo Diabetes mellitus HTA rebote ICC Infarto miocárdico IRC Feocromocitoma Raynaud Rinitis alérgica Bloqueadores alfa-adrenérgicos Prazosín Doxazosina Terazosina Alucinaciones Artralgia Astenia/fatiga Cefalea Congestión nasal Depresión Diaforesis Disfunción eréctil Edemas Fiebre Mareo Mialgia Ortostatismo Palpitaciones Pancreatitis Parestesias Polaquiuria Priapismo Síncope Somnolencia Tinnitus Trastornos GI Trastornos visuales Xerostomía AINE’s Simpatomiméticos Antihipertensivos Estrógenos Hipersensibilidad a los efectos hipotensores Hipotensión de primera dosis Precaución en ICC Precaución en angina Bloqueadores de canales de calcio Nifedipina OROS Amlodipina Lacidipino Isradipino SRO Felodipina ER Lecarnidipino Alergia Angina Cefalea Diaforesis Disnea Edemas ↑ PFH Fatiga Hepatopatía Insomnio Lumbalgia Palpitaciones Parestesias Polaquiuria Prurito Trastornos GI Retención azoada Sialorrea Taquicardia Tinnitus Xerostomía Anticonvulsivantes Antidepresivos TC Ciclosporina Cimetidina Digoxina Litio Rifampicina 50 Alergia previa Angina inestable Embarazo Estenosis aórtica severa IAM ICC Lactancia QT prolongado Taquiarritmia Angina Enfermedad CV HTA de rebote ICC Bradicardia Bloqueo AV Cefalea Edemas Estreñimiento Fatiga Hepatopatía ICC Mareo Isoptin SR Bradicardia Bloqueo AV Cefalea Edemas Estreñimiento Fatiga Hepatopatía ICC Mareo Diltiazem Retard AINE’s Anestésicos Antiarrítmicos Anticonvulsivantes Ciclosporina β-bloqueadores Cimetidina Calcio Digoxina Estrógenos Litio Rifampicina Teofilina Simpatomiméticos AINE’s Anestésicos Antiarrítmicos Anticoagulantes Anticonvulsivantes Ciclosporina β-bloqueadores Cimetidina Calcio Digoxina Estrógenos Litio Rifampicina Teofilina Simpatomiméticos Bradicardia severa Bloqueo AV Estenosis aórtica severa IAM + bradicardia ICC Síndrome seno enfermo Síndrome de WPW Uso de β-bloqueadores Bloqueo AV G I Bradicardia ICC Bradicardia severa Bloqueo AV Estenosis aórtica severa IAM + bradicardia ICC Síndrome seno enfermo Síndrome de WPW Uso de β-bloqueadores Bloqueo AV G I Bradicardia ICC Inhibidores de la enzima convertidora de angiotensina Captopril Enalapril Benazepril Cilazapril Fosinopril Lisinopril Perindopril Quinapril Ramipril Zofenopril Agranulocitosis Alergia previa Anemia Angioedema Cefalea Colestasis Disgeusia Eosinofilia Fatiga Fiebre Glositis Hepatitis Hiperkalemia Hipotensión Infecciones TRS Leucocitosis Leucopenia Mareo Parestesias Proteinuria Rash cutáneo Retención azoada Síncope Trombocitopenia Tos Trastornos GI Ahorradores K+ AINE’s Alopurinol Anestésicos Antiácidos Clonidina Diuréticos Estrógenos Inmunosupresores Litio Suplementos K+ Alergia previa Estenosis aórtica severa Embarazo Historia de angioedema Lactancia Anestesia general Deshidratación Estenosis arteria renal Hemodiálisis Hiperkalemia previa HTA renovascular Bloqueadores de receptores de angiotensina II Losartán Valsartán Irbesartán Candesartán Telmisartán Olmesartán Alergia previa Angioedema Hiperkalemia Infecciones TRS Mareo Retención azoada Ahorradores K+ AINE’s Alopurinol Anestésicos Antiácidos Clonidina Diuréticos Estrógenos Inmunosupresores Litio Suplementos K+ Alergia previa Estenosis aórtica severa Embarazo Historia de angioedema Lactancia Anestesia general Deshidratación Estenosis arteria renal Hemodiálisis Hiperkalemia previa HTA renovascular IAM Solo se incluyen medicamentos disponibles en Centroamérica. 51 5. INDICACIONES MANDATORIAS EN ELTRATAMIENTO DE LA HIPERTENSIÓN ARTERIAL. Al seleccionar opciones de terapia farmacológica, de las llamadas de “primera línea”, debe tomarse la decisión escogiendo, de entre una muy amplia variedad de fármacos, a aquellos que tienen una indicación mandatoria, valorando las comorbilidades de cada paciente de manera individual. Es decir, se dará preferencia a los medicamentos que hayan demostrado poseer un efecto protector orgánico para cada situación específica. El ejemplo más claro de una indicación mandatoria se tiene en los pacientes diabéticos hipertensos, pues no hay duda que en tales casos se requiere de una intervención con drogas anti-angiotensina, ya sea un inhibidor de enzima convertasa de angiotensina II (IECA) o de un antagonista de receptores de angiotensina II (ARA-II). Las condiciones clínicas asociadas a la HTA que conllevan a indicaciones mandatorias para alguna droga en particular son: a) b) c) d) e) Insuficiencia cardíaca congestiva (ICC); Post infarto de miocardio; Riesgo coronario excesivo (más de un 20% de riesgo a 10 años); Diabetes mellitus (DM); Insuficiencia renal crónica (IRC). ¿Podrían ser todos los antihipertensivos considerados drogas de primera línea cuando no existan indicaciones mandatarias de tratamiento? En tales casos existe libertad para la selección de drogas para iniciar terapia y podríamos emplear cualquier producto respaldado por evidencia, pero se ha sugerido (JNC 7)2, a la luz de los resultados del estudio ALLHAT (The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial) colocar al tope de la lista de opciones a los diuréticos tiazídicos, lo cual no ha dejado de generar gran controversia13. ALLHAT es el estudio más extenso y de seguimiento más prolongado en HTA. Se han comparado varias ramas de tratamiento: lisinopril, amlodipina, clortalidona y doxazosina en una población de más de 42,000 pacientes. En las conclusiones se ha concedido supremacía a las tiazidas a pesar que no fueron superiores en la prevención de morbimortalidad, pero sí en función de su bajo costo, pagando el precio de un aumento significativo de casos nuevos de diabetes. Un estudio australiano, en cambio, el (ANBP-2, The Second Australian National Blood Pressure Study) 14, publicado a principios del año 2003, evalúa muerte o evento cardiovascular mayor como objetivo combinado, comparando IECA’s contra diuréticos, lográndose iguales reducciones tensionales en ambos grupos. En todos los análisis de subgrupos se obtuvo beneficios a favor de IECA’s con una diferencia del 11% de manera global y en hombres del 17%. En pacientes con eventos no fatales también se logró una reducción del 14% y el riesgo se redujo hasta en un 32% a favor del empleo de IECA’s en pacientes con infarto miocárdico no fatal. Todos estos porcentajes fueron significativos excepto en 52 mujeres, pero es una evidencia de calidad que se opone en firme a los datos de ALLHAT. Por otra parte, hasta hace pocos años no había podido demostrarse que algún grupo de fármacos fuese superior a otro en términos de reducción de muerte y eventos cardiovasculares mayores. El primer estudio que demostró alguna distancia entre las terapias llamadas “convencionales” (β-bloqueadores y diuréticos) contra opciones más “novedosas” (bloqueadores de canales de calcio, IECA’s y ARA-II’s) es el LIFE (Losartan Intervention For Endpoint Reduction In Hypertension) 15: hubo una reducción del 13% de riesgo del objetivo combinado primario. El mismo estudio demostró una importante diferencia en cuanto a la incidencia de casos nuevos de diabetes y accidente cerebrovascular, (reducción del 25% del riesgo relativo). ASCOT (Anglo Scandinavian Cardiac Outcomes Trial) 16 ha logrado resultados aún más significativos en una población numéricamente mucho mayor de enfermos coronarios, confirmando la superioridad de la asociación libre de amlodipina y perindopril sobre la de atenolol y tiazidas. Lo de que ya nadie parece dudar es que, para el hipertenso crónico, a largo plazo, en la inmensa mayoría de casos —considerando las metas cada vez más exigentes— se va a necesitar de un tratamiento con dos o más drogas en asociación libre o combinación fija. Tanto así, que el JNC 7 recomienda la terapia combinada como estrategia inicial en pacientes cuya meta de reducción de cifras de PA está a más de 20 mmHg de las cifras obtenidas en condición basal2. En síntesis, la polifarmacia parece ser la regla en el manejo del paciente hipertenso si queremos alcanzar los objetivos que los consensos de expertos están proponiendo. ¿Cómo ir desde las arenas movedizas de la inseguridad hasta un terreno firme, en donde podamos asentar nuestros pies con confianza? ¿Hasta dónde podemos aplicar estos conceptos, generados en el marco artificial de los estudios de investigación, y que no siempre reflejan nuestro modo de pensar en la “vida real”? Los datos experimentales son, una vez más, la mejor evidencia disponible, en especial en cuanto a estrategias de prevención de lesiones tisulares específicas en pacientes con comorbilidades también específicas, lo que constituye la base teórica de las ya mencionadas “indicaciones mandatorias”. En conclusión, cualquier esfuerzo por reducir las cifras de PA hasta las metas que la evidencia Clase I disponible nos sugiere, es deseable y debe perseguirse con empeño, tomando en cuenta la necesidad de individualizar a cada paciente y considerando la presencia de ciertas comorbilidades que demandan manejo específico, con preferencia de algunos fármacos sobre otros, siempre dando prioridad al agudo juicio clínico por encima de cualquier esquema rígido de tratamiento. Situaciones clínicas específicas, como las crisis hipertensivas, el manejo de la HTA secundaria y los trastornos hipertensivos del embarazo serán discutidos en partes subsecuentes de esta sección del manual. 53 5.1. Insuficiencia cardíaca. Uno de los escenarios clínicos más importantes es el del paciente hipertenso con disfunción ventricular izquierda (independientemente de si hay o no cardiopatía isquémica). En esta área destaca el papel de los IECA, pues se dispone de estudios importantes en ésta área: CCS-1 (Chinese Cardiac Study) 17 , AIRE (The Acute Infarction Ramipril Efficacy) 18, SAVE (Survival And Ventricular Enlargement Trial) 19, TRACE (Trandolapril Cardiac Evaluation Study) 20, CONSENSUS (Cooperative North Scandinavian Enalapril Survival Study) 21, SOLVD (Studies Of Left Ventricular Dysfunction) 22 Y SMILE (Survival of Myocardial Infarction Long-term Evaluation) 23. La evidencia que se ha logrado obtener gracias a estos ensayos clínicos controlados es muy poderosa: el uso de IECA’s en el paciente con disfunción ventricular es mandatorio. De hecho, los resultados son especialmente buenos en los pacientes que tienen mayor deterioro ventricular y síntomas más avanzados. El estudio PEP-CHF (Perindopril For Elderly People With Chronic Heart Failure) 24 conducido en mayores de 70 años con disfunción exclusivamente diastólica, no encontró diferencias entre perindopril y placebo en cuanto a mortalidad y hospitalizaciones por ICC se refiere, pero la alta tasa de abandono de tratamiento en ambos grupos dificulta el arribar a conclusiones definitivas al respecto. El papel de los bloqueadores β-adrenérgicos en ICC se empieza a evaluar con más seriedad a mediados de los años noventa del siglo pasado y a estas alturas el paciente hipertenso con falla ventricular constituye también una indicación mandatoria para bloqueo β-adrenérgico, todo ello por los resultados obtenidos en estudios como el US Carvedilol (The Effect of Carvedilol on Morbidity and Mortality in Patients with Chronic Heart Failure) 25 y COPERNICUS (Carvedilol Prospective Randomized Cumulative Survival Trial) 26. Otros estudios exitosos con bloqueadores βadrenérgicos en insuficiencia cardíaca son CIBIS II (The Cardiac Insufficiency Bisoprolol Study II, empleando bisoprolol) 27, CIBIS III (The Cardiac Insufficiency Bisoprolol Study III) 28, MERIT-HF (Metoprolol CR/XL Randomized International Trial in congestive heart failure) 29 y SENIORS (Study of Effects of Nebivolol Intervention on Outcomes and Rehospitalisation in Seniors with Heart Failure) 30. Una droga que no la usamos tanto con la idea de reducir cifras de PA, sino tradicionalmente como agente retenedor de potasio es la espironolactona, cuyos efectos antiproliferativos y cardioreparadores llevan a una reducción de mortalidad en pacientes con ICC muy sintomática ya tratados con IECA’s, documentada en el estudio RALES (Randomized Aldactone Evaluation Study)31. Por razones no siempre muy claras, la adición de espironolactona puede ser exitosa en controlar casos de 54 genuina HTA refractaria. Parece ser que la recientemente desarrollada epleronona comparte, con una acción más selectiva, los mismos beneficios clínicos. ¿Cuál es la evidencia de los ARA-II en pacientes hipertensos con ICC asociada? Después del fracaso del ELITE-II (Effect Of Losartan Compared With Captopril On Mortality In Patients With Symptomatic Heart Failure: Randomized Trial - the Losartan Heart Failure Survival Study II)32 el estudio Val-HeFT (Valsartan Heart Failure Trial)33 es el primero con algún resultado positivo con este grupo terapéutico en pacientes con falla cardíaca, empleando valsartán para alcanzar una significativa reducción de riesgo en cuanto al objetivo combinado final, que incluía muerte por todas las causas, muerte súbita con resucitación, hospitalización por deterioro de insuficiencia cardiaca y requerimientos de inotrópicos; de hecho, esta evidencia se ha venido a confirmar con la publicación del CHARM (Candesartan In Heart failure Assessment Of Reduction In Mortality And Morbidity)34, que ha confirmado, una vez más, la factibilidad de combinar un IECA con un ARA-II en ICC. No se han demostrado los mismos beneficios en pacientes con formas leves de disfunción ventricular. No se tiene aún la evidencia del estudio en proceso I-PRESERVE (Irbesartan In Heart Failure With Preserved Systolic Function) 35. 5.2. Post-infarto miocárdico. Se ha evaluado extensamente la importancia del tratamiento con IECA’s en el post-infarto y los beneficios se observan más que todo en la reducción de mortalidad y no tanto en la prevención del reinfarto, quizá con la excepción del estudio TRACE, ya previamente citado20. Los comentarios expuestos en la sección de insuficiencia cardíaca aplican plenamente para este capítulo, pues casi la totalidad de estudios postinfarto se han realizado en el subgrupo de pacientes con algún grado de disfunción ventricular. En cuanto a ARA-II en postinfarto miocárdico, los resultados negativos del estudio OPTIMAAL (Optimal Therapy In Myocardial Infarction With The Angiotensin II Antagonist Losartan) 36 han frenado las expectativas para una indicación de primera línea para estos fármacos, pues no se logró ningún beneficio adicional sobre el proporcionado por captopril, y de hecho hubo tendencia al deterioro clínico. VALIANT (Valsartan In Acute Myocardial Infarction) 37 demostró que valsartán es tan efectivo como captopril en esta instancia, pero la asociación de ambos podría llevar a un exceso de casos de hipotensión arterial, situación especialmente peligrosa si existe enfermedad obstructiva coronaria. 5.3. Pacientes con alto riesgo coronario. En los pacientes en estadio 1 y con bajo perfil de riesgo, sostener por diez años una reducción de 12 mmHg de PAS podría prevenir una muerte por cada once pacientes tratados2. Pero si el 55 paciente tiene un riesgo todavía más elevado, el NNT (número necesario de pacientes a tratar) para salvar una vida sería solamente nueve2, lo cual enfatiza que tenemos una importante oportunidad de obtener éxito en salvar vidas tratando la hipertensión de manera eficaz, aun en estadios iniciales, especialmente en pacientes de alto riesgo. Los inhibidores de IECA tienen fuerte evidencia a favor de su empleo crónico en pacientes de alto riesgo coronario o con enfermedad coronaria estable. El estudio HOPE incluyó pacientes con alto riesgo cardiovascular pero no necesariamente hipertensos, lográndose beneficios de ramipril contra placebo; el 47% de pacientes que sí era hipertenso logró un beneficio significativo con una reducción muy discreta de PAS: apenas alrededor de 3 mm Hg, con una diferencia en sobrevida sin eventos contra placebo muy favorable10. Los únicos estudios en su estilo que han superado al HOPE en número de pacientes reclutados son dos, en que ha participado el IECA perindopril: EUROPA12 y ASCOT, —este último asociando amlodipina— comparado contra bloqueo β-adrenérgico (atenolol) más tiazida16. Ambos experimentos clínicos demostraron un beneficio especialmente bueno en términos de reducción de riesgos relativos de eventos cardiovasculares. El estudio PEACE (Prevention of Events with Angiotensin Converting Enzyme Inhibition) 38, de reciente publicación, no pudo reproducir, empleando el IECA trandolapril, el éxito de los estudios arriba mencionados. En ACTION (A Coronary Disease Trial Investigating Outcome with Nifedipine GITS),39 nifedipina con mecanismo de liberación osmótica no fue superior a placebo para reducir un objetivo combinado de muerte, IAM, angina refractaria, ICC, ACV o procedimiento de revascularización periférica, en una población de pacientes con cardiopatía isquémica sin falla cardíaca. Se logró, sin embargo, entre los objetivos secundarios, una reducción del 29% de casos nuevos de ICC. En el subgrupo de pacientes hipertensos, en contraste, la reducción del objetivo primario fue de apenas un 12% con un descenso de 6 mmHg de PAS y 3 mmHg en PAD. 5.4. Diabetes mellitus e insuficiencia renal crónica. Se comentan juntas ambas morbilidades por estar íntimamente vinculadas, conociendo la historia natural de la diabetes, principal causa de IRC. En el estudio HOT (Hypertension Optimal Treatment) 40 se sentaron las bases que definieron las metas de tratamiento vigentes para el paciente diabético: PA menor de 130/80 mmHg. Alcanzar estas cifras conlleva una reducción del 51% de eventos cardiovasculares. 56 Diversos estudios han demostrado que el uso de algunos fármacos, especialmente (IECA y ARA II) podrían tener efecto protector en la prevención de casos nuevos de diabetes cuando se comparan contra atenolol: ARIC (Atheroesclerosis Risk In Communities, a favor de IECA) 41, LIFE15, SCOPE (Study of Cognition and Prognosis in the Elderly) 42, INVEST (International Verapamil SR and Trandolapril Study for CAD and Hypertension) 43, ALLHAT13, VALUE (Valsartan Antihypertensive Long-term Use Evaluation)44 y ASCOT16. En pacientes con intolerancia a la glucosa, sin embargo, el uso de ramipril en dosis de hasta 15 mg diarios no fue superior a placebo en la prevención de diabetes mellitus (DREAM: Diabetes Reduction Assessment with Ramipril and Rosiglitazone Medication 45). Está demostrado que el atenolol aumenta la resistencia a la insulina e incrementen el riesgo relativo de desarrollar diabetes tipo 2, aunque el aumento de riesgo absoluto es francamente modesto. Al comparar directamente el bloqueador de canales de calcio amlodipina contra ramipril en pacientes afroamericanos con enfermedad renal (AASK, The African American Study of Kidney Disease and Hypertension), 46 se observó un beneficio tan notable a favor de ramipril después de tres años de seguimiento que fue necesario suspender el estudio por razones éticas. Esto implica que los IECA’s representan una opción mucho más basada en evidencia, que los BCC en la reducción del proceso de deterioro renal: menos casos de nefropatía terminal, menos incidencia de muerte, mayor freno a la declinación de la tasa de filtrado glomerular. En diabéticos afectos de diversos grados de nefropatía, la evidencia que se tiene con ARA-II proveniente de los estudios RENAAL (Reduction of Endpoints in NIDDM with the AII Antagonist Losartan)47 y PRIME (Program For Irbesartan Mortality And Morbidity Evaluation), que incluye los subestudios IDNT (Irbesartan Diabetic Nephropathy Trial)48 e IRMA-2 (Irbesartan Microalbuminuria Type 2 Diabetes Mellitus in Hypertensive Patients)49 permite que se les considere drogas de primera línea en esta instancia clínica. En estudio BENEDICT (Bergamo Nephrologic Diabetes Complications Trial) 50 quedaron ampliamente demostrados los beneficios de trandolapril solo y de la asociación verapamil-trandolapril en la prevención de microalbuminuria en sujetos hipertensos; verapamil de liberación lenta (SR), en cambio, no fue superior a placebo. Al comparar telmisartán contra enalapril en pacientes con nefropatía diabética (DETAIL (Diabetics Exposed to Telmisartan and Enalapril Study) 51 no hubo superioridad de ninguna droga sobre la otra, pero se ha señalado que en los dos grupos de tratamiento las cifras meta de PA eran inaceptablemente altas. 5.5. Enfermedad cerebrovascular. En los experimentos clínicos HOPE10 y PROGRESS11 se obtuvo una reducción significativa de todos los diferentes tipos de 57 enfermedad cerebrovascular, con un descenso global para ambos estudios de cerca del 25% de eventos recurrentes (excepto en caso de indicación necesaria de endarterectomía carotídea en HOPE). Recientemente publicado, el estudio ACCESS (Acute Candesartan Cilexetil Evaluation in Stroke Survivors)52, desarrollado en Alemania, extiende la indicación de un ARA-II (candesartan) para el manejo de emergencia del ACV con PA muy elevada, con una reducción espectacular de mortalidad a un año de aproximadamente un 50%. Se está evaluando el papel de diferentes drogas antihipertensivas en la prevención de la demencia de tipo vascular. Estudios como Syst-Eur (Systolic Hypertension in Europe Trial) 53, PROGRESS11 y SCOPE42 se han enfocado en este objetivo, pero al momento no existe una evidencia sólida que confirme las ventajas de algún fármaco sobre otro, aunque resulta promisorio el papel de los IECA’s y ARA-II’s en tal sentido. 58 6. FÁRMACOS ANTIHIPERTENSIVOS. 6.1. DROGAS DE ACCIÓN CENTRAL. 6.1.1. Generalidades. Los medicamentos con acción simpaticolítica central están disponibles para uso como antihipertensivos desde hace poco más de medio siglo. Debido a los efectos sedantes y depresivos su uso ha venido en descenso, a pesar de su bajo precio. Los fármacos más conocidos de este grupo son, con mucho, el alfa-metildopa y la clonidina. El guanabenz y la guanfacina comparten el mismo mecanismo de acción, pero nunca han estado disponibles en Centroamérica Hay un agente nuevo, la minoxidina, que por su acción más selectiva es mejor tolerada, pero tampoco está disponible en la región. 6.1.2. Mecanismo de acción. Estas drogas estimulan los receptores α2-adrenérgicos postsinápticos a nivel del centro vasomotor del bulbo raquídeo, lo cual lleva a una reducción del eflujo simpático cerebral. La α-metildopa, por su parte, es metabolizada a α-metilnoradrenalina, que funciona como un falso neurotransmisor a nivel periférico, lo cual explicaría en parte sus efectos antihipertensivos. 6.1.3. Efectos clínicos y hemodinámicos. Perfil de eficacia. • Buena efectividad antihipertensiva independientemente de la edad y de la raza. Estos medicamentos provocan vasodilatación, con descenso de las resistencias vasculares periféricas (RVP), sin efectos nocivos sobre la hemodinamia renal. • Está confirmado que su uso crónico reduce la hipertrofia ventricular izquierda y podría mejorar el gasto cardíaco (GC), en especial en el caso de la clonidina. El discreto efecto bradicardizante de la αmetildopa tiende a cancelar dicho efecto. • Puede haber ortostatismo con α-metildopa, especialmente en adultos mayores. • No hay efectos negativos sobre el metabolismo de lípidos ni de carbohidratos. Pueden usarse durante el embarazo. • Su suspensión brusca podría producir efecto de “rebote” (incremento abrupto de la PA). 6.1.4. Efectos adversos, interacciones, contraindicaciones. Ver Tabla 9. 59 6.2. DIURÉTICOS. 6.2.1. Generalidades. Los diuréticos se usan desde hace varias décadas para el tratamiento de la HTA y de los estados edematosos en pacientes con insuficiencias cardíaca y renal. Aunque pueden emplearse como monoterapia, en la mayor parte de esquemas terapéuticos los diuréticos se usan para potenciar los efectos de otras drogas, de preferencia betabloqueadores, IECA’s o ARA-II’s. En caso de HTA severa o refractaria la indicación de un diurético es mandatoria. Se les clasifica en tiazidas y similares, diuréticos de asa (o plafond alto) y diuréticos ahorradores de potasio. Ni los diuréticos mercuriales ni los inhibidores de la anhidrasa carbónica han tenido uso en HTA. No debería emplearse diuréticos de asa con fines únicamente antihipertensivos. 6.2.2. Mecanismo de acción. Su mecanismo de acción no está restringido a sus efectos sobre la reabsorción de sodio (y de otros electrolitos) a nivel tubular renal, sino que se les ha encontrado un efecto reductor de resistencias periféricas con acción relativamente prolongada, que permite su administración en dosis única diaria, efecto quizás sea secundario a una disminución del sodio corporal total. Su efectividad antihipertensiva es dosis dependiente, aunque por desgracia lo son también los eventos adversos asociados. • • • Las tiazidas y similares (incluyendo a los derivados del indol) actúan sobre el transporte de sodio y cloro a nivel del túbulo distal, reduciendo la reabsorción tubular de fluidos y el volumen de diuresis. Un balance total negativo de sodio podría explicar el efecto vasodilatador previamente mencionado. La amilorida y el triamtereno inhiben directamente la función del canal epitelial de sodio (ENaC) en el túbulo distal, reteniendo así potasio a expensas de pérdida de sodio. La espironolactona y la epleronona compiten contra la aldosterona a nivel de su sitio de fijación en el receptor para mineralocorticoides. Esto lleva a natriuresis y retención de potasio e hidrogeniones en el túbulo distal y túmulos colectores. 6.2.3. Efectos clínicos y hemodinámicos. Perfil de eficacia. Hay acuerdo general en que deben usarse los diuréticos a dosis bajas (menores de 25 mg de hidroclorotiazida al día, por ejemplo) para sacar máximo provecho a sus propiedades antihipertensivas y minimizar a la vez sus 60 efectos adversos. En general, los diuréticos reducen el volumen intravascular sin causar respuesta refleja del sistema simpatoadrenal, pero sí generando un incremento secundario de la renina plasmática y de la actividad de angiotensina y aldosterona. Se ha confirmado una reducción de la hipertrofia ventricular izquierda con estas drogas, en especial con la indapamida, en comparación con enalapril54. El efecto diurético de las drogas ahorradoras de potasio es mínimo, pero, para los antagonistas de mineralocorticoides, los beneficios obtenidos van más allá de la simple retención de potasio: hay efectos sobre el remodelado vascular, reducción de fibrosis intersticial tisular y reducción de morbimortalidad en caso de ICC. Se ha confirmado frecuentemente que la adición de espironolactona a pacientes con HTA refractaria puede ser decisiva para el control de estos casos de difícil manejo. 6.2.4. Efectos adversos, interacciones, contraindicaciones. Ver Tabla 9. 61 6.3. BLOQUEADORES α-ADRENÉRGICOS (BAA). 6.3.1. Generalidades. Las quinazolinas fueron los primeros bloqueadores α1-selectivos empleados en el tratamiento de la hipertensión arterial: prazosín, doxazosina y terazosina. Actualmente se les considera medicamentos de tercera línea, tanto por su relativamente baja eficacia en monoterapia como por sus efectos adversos, especialmente ortostatismo y el síncope relacionado con las primeras dosis. Resultados desalentadores con doxazosina en el estudio ALLHAT (aumento de casos de infarto agudo miocárdico) 13 han contribuido a que su uso disminuya, con la excepción del hipertenso que adolece de hipertrofia prostática o como coadyuvante en pacientes con resistencia a la insulina que no tienen enfermedad isquémica. 6.3.2. Mecanismo de acción. Bloqueo selectivo de los receptores α1 adrenérgicos. Los bloqueadores no selectivos son ineficaces para el tratamiento crónico porque generan taquicardia refleja (fentolamina, por ejemplo), estimulando la liberación de norepinefrina de las terminales neuronales simpáticas (efecto mediado por receptores α2). 6.3.3. Efectos clínicos y hemodinámicos. Perfil de eficacia. La reducción de la PA es sostenida con las drogas menos liposolubles, doxazosina y terazosina, que pueden administrarse en dosis única diaria. Prazosín debe administrarse como mínimo 2 ó 3 veces diarias. Todos reducen las resistencias vasculares periféricas al provocar dilatación en los vasos de no capacitancia (de resistencia), lo cual en teoría ayudaría a aumentar el gasto cardíaco. Puede haber activación subsecuente del sistema RAA y del sistema nervioso simpático. Una potencial ventaja de estos fármacos es que no afectan de manera adversa el perfil lipídico. De hecho, pueden aumentar la actividad de la lipoproteinlipasa y elevar las concentraciones plasmáticas de HDL. Se ha reconocido también que la vasodilatación sostenida de las arteriolas del tejido muscular aumenta la sensibilidad a la insulina. 6.3.4. Efectos adversos, interacciones, contraindicaciones. Ver Tabla 9. 62 6.4. BLOQUEADORES β-ADRENÉRGICOS (BBA). 6.4.1. Generalidades. Las drogas bloqueadoras de los receptores beta-adrenérgicos impiden la unión de dichos receptores con sus agonistas, la adrenalina y la noradrenalina. Se tiene aproximadamente cuarenta años de experiencia con estos fármacos en el tratamiento de la hipertensión arterial, la angina de pecho y, desde mediados de los años noventa, la insuficiencia cardíaca. Son drogas heterogéneas y se subclasifican con base a los criterios siguientes: • • • • • Selectividad preferente para los receptores β; Lipo o hidrosolubilidad; Presencia o ausencia de actividad simpatomimética intrínseca: es decir, que puedan tener cierto efecto agonista adrenérgico; Presencia o ausencia de efecto estabilizador de membrana (genera efectos antiarrítmicos); Efectos asociados sobre receptores α-adrenérgicos. 6.4.2. Mecanismo de acción. Las catecolaminas que se liberan —como respuesta a diversidad de estímulos— en las terminaciones del sistema nervioso simpático, provocan una respuesta que, a nivel cardiovascular, genera aumento de la frecuencia cardíaca (efecto cronotrópico positivo), aumento de la fuerza contráctil de las fibras miocárdicas (efecto inotrópico positivo), incremento en la velocidad de conducción a nivel de los tejidos excitables del corazón (efecto dromotrópico positivo). Todo ello es secundario a la estimulación de receptores adrenérgicos tipo β1 y un incremento en las resistencias vasculares periféricas por aumento del tono del músculo liso vascular de las arteriolas (receptores α1 periféricos). Los betabloqueadores son inhibidores competitivos de los receptores adrenérgicos tipo β, y la mayoría son mezclas racémicas en las que el efecto betabloqueador depende del isómero L (levo). 6.4.3. Efectos clínicos y hemodinámicos. Perfil de eficacia. Con diferentes niveles de potencia, solubilidad, cardioselectividad o farmacocinética, el efecto global de estas drogas es el opuesto al de las catecolaminas: bradicardia, reducción de la velocidad de conducción, menor fuerza de contracción miocárdica, mejoría de la relajación de las fibras miocárdicas (efecto lusotrópico negativo) y descenso de la PA por caída del volumen sistólico y gasto cardíaco. Si hay un efecto vasodilatador asociado (por liberación endotelial de óxido nítrico o 63 bloqueo α1 periférico) habrá también disminución de resistencias periféricas y de PA diastólica. La reducción del gasto cardíaco puede precipitar ICC en pacientes con disfunción sistólica ventricular izquierda si las dosis iniciales de betabloqueadores son muy elevadas o si hay congestión hídrica no resuelta, porque suben las presiones ventriculares de fin de diástole y la presión en cuña capilar pulmonar y puede producirse edema agudo pulmonar. Los betabloqueadores en ICC o en post-infarto miocárdico deberían ser indicados por subespecialistas con experiencia. Recientemente se ha cuestionado la seguridad y la eficacia del atenolol, el más empleado de los β-bloqueadores en HTA. Dos metaanálisis recientes55, 56 señalan que, a pesar de ser agentes hipotensores eficaces, no proveen adecuada órgano protección, en especial al sistema nervioso central. Además, está fuera de toda duda que el atenolol aumenta la probabilidad de que se presente diabetes mellitus tipo II (entre un 25-30% de aumento de riesgo relativo), con las implicaciones clínicas que esto representa para una población de hipertensos mayormente afectada por el síndrome metabólico. 6.4.4. Efectos adversos, interacciones, contraindicaciones. Ver Tabla 9. 64 6.5. BLOQUEADORES DE CANALES DE CALCIO (BCC). 6.5.1. Generalidades. Son drogas química y clínicamente heterogéneas, quizás los hipotensores más efectivos de los que se dispone. Se clasifican en tres familias: dihidropiridinas (DHP, prototipo nifedipina, la familia más numerosa), fenilalquilaminas (prototipo verapamil) y benzotiazepinas (prototipo diltiazem). Se utilizan también en angina de pecho (aunque están específicamente contraindicados en caso de infarto miocárdico agudo); las DHP de acción prolongada son coadyuvantes de segunda línea en el manejo de la insuficiencia cardíaca. El verapamil y el diltiazem tienen efectos antiarrítmicos y sobre el crono e inotropismo cardíacos. Todos son relativamente bien tolerados y tienen un perfil metabólico neutro. Sólo deben emplearse preparados de acción prolongada o drogas del grupo con vida media larga y alto índice P/V intrínseco. A las drogas con mecanismo de liberación retardada se les ha llamado bloqueadores de canales de calcio de segunda generación; los de tercera generación serían los de vida media intrínsecamente prolongada (amlodipina, lacidipino, lecarnidipino), pues no se requiere de manipulaciones galénicas para que su efecto antihipertensivo con dosis única al día sea igual o superior a 24 horas. 6.5.2. Mecanismo de acción. Bloqueo selectivo de los canales lentos (L) de calcio, generando así una disminución de las concentraciones citosólicas de calcio (y subsecuentemente de sodio) en células endoteliales y del músculo liso vascular. Esto genera vasodilatación intensa, con reducción consecuente de las resistencias vasculares periféricas. Los efectos sobre el sistema venoso son mínimos. 6.5.3. Efectos clínicos y hemodinámicos. Perfil de eficacia. • Dihidropiridinas. Tienen un efecto predominantemente vascular y discretos efectos miocárdicos. Los preparados de acción corta producen taquicardia refleja, por lo que debe evitarse su uso. El gasto cardíaco se mantiene inalterado o puede haber un discreto aumento del mismo a medida que descienden las resistencias vasculares periféricas. Hay un incremento del flujo coronario por el mismo mecanismo, excepto si la PA diastólica reduce de manera brusca y marcada. A nivel de vasculatura renal hay aumento del flujo de la arteriola aferente del glomérulo, pero no hay cambios 65 en el tono vascular de la arteriola eferente, por lo que se genera un incremento de la presión hidrostática intraglomerular; por ello es que no reducen ni previenen proteinuria, aunque pueden tener efecto antiisquémico renal. De todos los antihipertensivos son las drogas más eficientes (junto con algunos inhibidores de ECA) para la prevención de accidentes vasculares cerebrales y se dispone de mucha evidencia favorable a reducción de eventos mayores en pacientes de edad avanzada. Se les ha descrito efectos antiateroescleróticos, pero aunque la reducción del volumen de las placas ateromatosas en los estudios clínicos ha sido más bien modesta, hay una concomitante reducción de eventos clínicos 57,58. Los efectos relajantes de músculo liso pueden también ser útiles para el manejo de patologías no cardiovasculares como la acalasia, el espasmo esofágico difuso, el esófago nutcracker, vasoespasmo cerebral y amenaza de parto prematuro. • No dihidropiridinas. Los miembros no dihidropiridínicos de la familia tienen, además de sus efectos vasodilatadores periféricos, un efecto relajante sobre el miocardio de trabajo ventricular (efecto inotrópico negativo, principalmente el verapamil), lo cual lleva a la reducción del gasto cardíaco, el otro gran determinante de la PA. La reducción de la frecuencia cardíaca (efecto cronotrópico negativo) y el enlentecimiento de la velocidad de conducción cardíaca (efecto dromotrópico negativo) solo se evidencian con los bloqueadores de calcio no dihidropiridínicos, por lo que se emplean frecuentemente en el manejo de arritmias supraventriculares. Un efecto antifibrótico en intersticio renal ha sido descrito para las drogas no-DHP. 6.5.4. Efectos adversos, interacciones, contraindicaciones. Ver Tabla 9. 66 6.6. INHIBIDORES DE LA ENZIMA CONVERTASA DE ANGIOTENSINA (IECA's). 6.6.1. Generalidades. Las indicaciones para el uso de IECA’s han venido ampliándose de manera progresiva con el paso del tiempo. Son medicamentos mandatorios para el manejo de HTA, hipertrofia ventricular izquierda, insuficiencia cardíaca congestiva, infarto miocárdico agudo, nefropatía diabética, proteinuria, prevención del accidente cerebrovascular recurrente y tratamiento de los pacientes con alto riesgo cardiovascular. Los beneficios logrados con estas drogas en cuanto a órgano-protección se observan tanto en hipertensos como en no hipertensos. Su eficacia vasodilatadora, la escasez de efectos adversos significativos y el amplio respaldo de la evidencia disponible explican la popularidad de esta categoría de fármacos. 6.6.2. Mecanismo de acción. Los IECA bloquean selectivamente la enzima ECA (convertasa de angiotensina) que cataliza la conversión de la angiotensina I a angiotensina II (AG-II) y la degradación de la bradikinina (BK) hasta fragmentos inactivos. Las concentraciones plasmáticas y tisulares de AG-II se reducen, por lo que hay menos moléculas disponibles para ligarse a los receptores de subtipo 1 para la angiotensina II (R-AT1). Simultáneamente aumentan los niveles plasmáticos y titulares de bradikinina, un potente vasodilatador, y en consecuencia, de óxido nítrico (ON). Como la síntesis de endotelina-1 (ET-1) y PAI-1 (inhibidor tipo 1 de la actividad de plasminógeno) dependen de la activación de R-AT1, los efectos vasoconstrictores, proliferativos y protrombóticos de estas moléculas se ven marcadamente atenuados. 6.6.3. Efectos clínicos y hemodinámicos. Perfil de eficacia. Todos los IECA parecen ser homogéneos en cuanto a sus efectos clínicos (efecto de clase). Reducen la PA en todo tipo de hipertensos, aunque sus efectos son más intensos en los casos en que la actividad plasmática de renina (APR) es elevada (pacientes “renina alta” o situaciones clínicas que aumenten la APR, como la deshidratación o la terapia con diuréticos). Se ha reconocido en estos fármacos un efecto anti-remodelado vascular, una acción relajante en la musculatura lisa, y —no menos importante— un efecto protector de órganos blanco en diabetes y HTA. No reducen el flujo vascular cerebral. Hay un impacto benéfico para la función diastólica a nivel del miocardio de trabajo, reducción de la postcarga ventricular 67 izquierda, reducción del estrés parietal vascular y descenso de la presión intraglomerular renal. No tienen efecto sobre la actividad eléctrica del corazón, por lo menos de manera directa, ni estimulan de manera refleja al sistema simpato-adrenal. Pueden combinarse prácticamente con todas las demás categorías de antihipertensivos, para obtener un efecto sinérgico. 6.6.4. Efectos adversos, interacciones, contraindicaciones. Ver Tabla 9. 68 6.7. ANTAGONISTAS DE LOS RECEPTORES DE LA ANGIOTENSINA II (ARA- II). 6.7.1. Generalidades. Cuando se lanza al mercado esta categoría de fármacos —a mediados de la década de los años noventa— se pretendía obtener un efecto antiangiotensina II más completo. Se sabía que en el humano gran parte de la síntesis de AG-II no depende de la acción de la enzima ECA y que, al usar IECA’s, la importancia de esas vías alternas (como la de las quimasas) se incrementa significativamente (“escape” de AG-II). Al momento se sabe que estos medicamentos son eficaces hipotensores con un perfil de seguridad similar al de placebo y efectos órgano-protectores similares a los de IECA's, aunque su costo es significativamente más elevado y en estudios clínicos no han demostrado superioridad sobre aquellos. En insuficiencia cardíaca y nefropatía diabética podría haber beneficios al asociar estas dos categorías de drogas antiangiotensina. Algunos de estos medicamentos (en especial telmisartán) podrían tener un efecto modulador sobre los receptores PPAR-γ, por lo que su candidatura a ser drogas de primera línea en pacientes con síndrome metabólico parece cada día más firme. 6.7.2. Mecanismo de acción. Al bloquear los R-AT1 se impide (competitiva o no competitivamente, según el fármaco) la formación del complejo receptor/AG-II. Las concentraciones de AG-II a nivel plasmático y tisular se incrementan y más moléculas de AG-II están disponibles para asociarse con el subtipo 2 de receptor de AG II (RAT2). La estimulación selectiva y preferente de R-AT2 (efecto de contrabalanceo) estimula la síntesis tisular de BK, aumenta la producción de ON y tendría efectos similares a los de los IECA’s a nivel tisular, sin aumentar los niveles plasmáticos de BK, supuestos responsables de la tos seca asociada a los IECA’s. 6.7.3. Efectos clínicos y hemodinámicos. Perfil de eficacia. En general, los efectos clínicos son similares a los descritos para los IECA’s. El inicio de acción es lento y no alcanzará un máximo antes de 4-6 semanas. 6.7.4. Efectos adversos, interacciones, contraindicaciones. Ver Tabla 9. 69 7. ESQUEMAS TERAPÉUTICOS PARA EL MANEJO A LARGO PLAZO DE LA HIPERTENSIÓN ARTERIAL. Como ya se ha comentado en este manual, la mayoría de pacientes que sufren de HTA crónica requerirá —a mediano o largo plazo— de asociaciones de drogas para poder alcanzar las metas terapéuticas que los comités de expertos exigen. A mayor daño orgánico asociado a HTA, más exigentes serán las metas, y tanto más difícil resultará alcanzarlas. Los cambios terapéuticos del estilo de vida (que empiezan a rendir frutos al cabo de aproximadamente seis semanas) deberán implementarse en todos los pacientes, pero en presencia de lesión y/o disfunción de órgano(s) blanco, los fármacos deberían introducirse lo antes posible. El no tratar de manera eficiente y oportuna a los pacientes genera exceso de morbimortalidad. 7.1. ESTRATEGIAS INICIALES. SELECCIÓN INICIAL DE FÁRMACO(S). Si se ha confirmado en repetidas ocasiones (de preferencia por el mismo médico, en el mismo consultorio), que la PA es superior a 140/90 mmHg (ó superior a 130/80 mmHg en caso de diabetes, nefropatía o cardiopatía isquémica), podrá hacerse el diagnóstico de HTA y deberá plantearse al paciente una estrategia terapéutica. Debe discutirse cada caso con franca apertura e individualizar para cada persona un “combo” de medidas terapéuticas que incluya, más allá del control de la presión arterial, medidas específicas para una efectiva reducción global de riesgo. La selección de fármaco(s) depende de las siguientes variables: • • • • • • • • Presencia o ausencia de indicaciones mandatorias para fármacos específicos, según el nivel de riesgo inicial (ver Sección III, inciso 5); Edad; Raza; Severidad de HTA; Comorbilidades; Síntomas asociados a la HTA, si los hay; Alergias, intolerancias o contraindicaciones para diferentes drogas; Costo. Conviene en principio clasificar a los pacientes según la primera variable, lo cual depende totalmente de si existen o no factores de riesgo y anomalías estructurales y/o disfunción de órganos blanco. 70 1.1. Pacientes sin indicaciones mandatorias. Cualquier droga de cualquiera de los siete grupos terapéuticos puede ser empleada como monoterapia inicial en estos pacientes, en especial si nunca han recibido medicación antihipertensiva. Debe recordarse que la presencia de síndrome metabólico desaconseja el uso de atenolol, pero no de otros BBA con acción vasodilatadora periférica (nebivolol, carvedilol) o metabólicamente neutros (bisoprolol). Otra salvedad sería el poco entusiasmo de muchos especialistas para el empleo de bloqueadores alfa-adrenérgicos en inicio, pero si se trata de una hipertensión leve en un individuo con hipertrofia prostática sintomática debería tenerse en cuenta esta opción. Más importante que la droga a seleccionar, es necesario que el paciente haya comprendido las razones para el inicio de la terapia, valorar su nivel de compromiso y advertirle acerca de los riesgos y beneficios de la(s) droga(s) a prescribir. Es adecuado apegarse a los esquemas de dosificación recomendados (ver Tabla 8). Deberán programarse controles razonablemente cercanos (según cada caso) y en algunas situaciones de muy alto riesgo hospitalizar al paciente, para verificar la eficacia del tratamiento. Si se asocian drogas desde el inicio, las combinaciones sugeridas con mejor sinergia se enlistan a continuación: • • • • • • • • • • • • Bloqueador beta-adrenérgico + diurético; Bloqueador beta adrenérgico + vasodilatador; Bloqueador beta adrenérgico + BCC (dihidropiridínico); BCC + IECA; BCC + ARA-II; IECA + diurético; ARA-II + diurético; ARA-II + BCC; Diurético + droga ahorradora de potasio; Cualquier permutación se puede hacer con las drogas de acción central, pero se aconseja evitar la combinación con bloqueadores beta-adrenérgicos por la sumación de efectos adversos sobre el SNC. La combinación de un BCC con un diurético es también eficaz especialmente en los pacientes con hipertensión sistólica aislada del adulto mayor (HSA). Exceptuando los casos en que haya ICC, la asociación de un IECA y un ARA-II no se recomienda en principio. En un estudio comparativo sin objetivos "duros", la combinación de candesartán y lisinopril fue ventajosa a la de cualquiera de las drogas por separado en el manejo de microalbuminuria (CALM: The Candesartan And Lisinopril Microalbuminuria Study) 59. El estudio ONTARGET (Ongoing Telmisartan Alone And In Combination With Ramipril Global Endpoint Trial) 60 ayudará a definer si esta 71 combinación ofrece ventajas en términos de reducción de morbimortalidad. 1.2. Pacientes con indicaciones mandatorias. Las condiciones de lesión estructural-funcional de órgano blanco en que hay evidencia sólida de reducción de morbimortalidad están bien definidas. En estos casos la prioridad no solo es reducir la PA sino también proteger a los órganos de lesiones ulteriores. La regla es comenzar con asociaciones libres o fijas de fármacos. A veces la sinergia de estas combinaciones no parece ser la ideal en términos de reducción de cifras presoras. Un ejemplo claro de esto es el uso de un IECA (o ARA-II) y un bloqueador beta-adrenérgico en pacientes con ICC, post IM o con enfermedad coronaria crónica estable. Es claro que en estos casos es ideal que el manejo de la HTA esté a cargo de un médico especialista. 8. AJUSTES DE DOSIFICACIÓN Y CONTROL CLÍNICO DEL PACIENTE HIPERTENSO. Independientemente de la(s) droga(s) usada(s) es casi seguro que habrá, tarde o temprano, necesidad de hacer ajustes a la dosificación inicial. Si un mecanismo pro-hipertensivo es bloqueado artificialmente, otros mecanismos aumentan su importancia relativa para tratar de aumentar otra vez las cifras de PA, como si el organismo estuviese “engañado”, creyendo que la PA alta es en realidad la "normal". Es por ello (y considerando la escasez de síntomas de la HTA) que debe hacerse seguimiento periódico a todos los pacientes. Se necesita de un tiempo razonable para normalizar o llevar a metas a los hipertensos. Es probable que el máximo nivel de eficacia de cualquier terapia crónica se alcance al cabo de 4 a 6 semanas, pues no solo se debe considerar parámetros de tipo farmacocinético (número de vidas medias para que las drogas alcancen su concentración "meseta"), sino también el tiempo necesario para una reversión de la disfunción endotelial y del remodelado de las paredes arteriales. La eficacia no solo se debe medir con basen en las cifras de PA: es necesario evaluar el impacto de la terapia en la calidad de vida, sobre los síntomas preexistentes y la aparición de alergias, intolerancias y anormalidades de laboratorio. La frecuencia de controles dependerá exclusivamente del juicio clínico individualizado para cada caso. No se sugiere hacer modificaciones del esquema inicial —salvo emergencias— antes de que se hayan cumplido 15 días de tratamiento. Si después de ese período no se han alcanzado las metas de PA, pueden seguirse las siguientes instrucciones: • Comprobar que prescripción; el paciente 72 haya acatado con exactitud la • • • Verificar que no haya situaciones clínicas o terapias nuevas que puedan afectar la eficacia del tratamiento prescrito; Valorar la posibilidad de un efecto de "bata blanca". Podrían aconsejarse mediciones domiciliarias de la PA o un estudio de MAPA de 24 horas. Caso contrario, si hay reducción excesiva de la PA o signos de hipoperfusión arterial, debe investigarse sobredosificación, condiciones clínicas o farmacológicas asociadas y suspender la medicación de manera temporal o permanente. Si se concluye que el esquema terapéutico inicial es insuficiente y que debe reforzarse la terapia, los pasos a seguir son los siguientes (descritos como algoritmo en la Figura 11): • Excepto en caso de alergia, toxicidad o intolerancia, no se recomienda suspender una monoterapia para iniciar otra monoterapia, aunque algunos consensos de especialistas todavía lo autoricen4. Recomenzar implica pérdidas de tiempo, dinero y, peor aún, de la confianza del paciente en su médico y del médico en sí mismo. • Alternativa 1: Aumentar dosis de la monoterapia inicial o de la combinación usual. Si se usan las dosis estándar de drogas desde un principio, esta estrategia no dará resultados espectaculares en cuanto a reducción adicional de milímetros de mercurio. Lo único seguro es que dosis dobles de las mismas drogas también incrementan el costo diario de tratamiento y los efectos adversos, pero no duplicarán la eficacia. Es obvio que en pacientes con mucha morbilidad de órganos blanco si se necesitan "dosis tope", pero con la finalidad de proveer de un máximo de órgano-protección. • Alternativa 2: Agregar un segundo o tercer fármaco. Esto es lo que será necesario en aproximadamente el 70% de pacientes si los terapeutas se apegan a las normativas vigentes. Se deben agregar medicamentos sinérgicos con el tratamiento inicial si éste es algún tipo de monoterapia; si se comenzó con una combinación, la tercera droga deberá ser un diurético si no se ha empleado todavía. Si después de un mes adicional de terapia combinada con tres fármacos a dosis adecuadas (incluyendo un diurético) y habiéndose verificado que no hay problemas de cumplimiento ni patologías o condiciones clínicas prohipertensoras, si la PA persiste por arriba de las metas, se deberá hacer el diagnóstico de HTA refractaria (ver Sección IV, inciso 2 del presente manual) y deberá ser referido para manejo por médico especialista. Además del interrogatorio clínico y de la discusión de los síntomas y calidad de vida de cada paciente, se recomienda en las consultas de control: 73 • • • • • • • • Tomar el peso y medir el perímetro de cintura; Medir frecuencia cardíaca; Hacer examen físico cardiovascular incluyendo los pulsos periféricos en cuello y extremidades; Palpar hígado, bazo y buscar pulsaciones anormales en el abdomen; Fondoscopía por lo menos cada año; Electrocardiograma a juicio del clínico, pero mínimo una vez al año; RX de tórax PA, mínimo cada 2 años; Laboratorio básico, por lo menos una vez al año. Estas periodicidades están basadas más en empirismo que en evidencia, pero resultan apropiadas y prácticas para el seguimiento a mediano y largo plazo. Cualquier otra prueba de diagnóstico o procedimiento de gabinete estarán justificados si a juicio del médico la relación costo/beneficio es favorable. En la tabla 9 se resumen los efectos adversos más relevantes de las drogas antihipertensivas disponibles en la región centroamericana. Debe recordarse que a menudo los eventos adversos serios y no serios a menudo están subregistrados en los expedientes médicos. Es recomendable interrogar al paciente directamente sobre los efectos probables con relación a la(s) droga(s) que reciba(n) de forma crónica. 74 FIGURA 11. Algoritmo de manejo de pacientes hipertensos. Las asociaciones libres como terapia inicial están recomendadas si se necesita una reducción de presión arterial sistólica mayor de 20 mmHg. Se desaconsejan las monoterapias a dosis máximas como estrategia para llevar a los pacientes a metas. No se hablará de hipertensión refractaria a menos que una triple terapia (incluyendo diurético) no haya sido ensayada por un tiempo razonable. Debe verificarse el cumplimiento de los esquemas terapéuticos por parte del paciente. 75 SECCIÓN IV. SITUACIONES CLÍNICAS ESPECIALES. 76 1. CRISIS HIPERTENSIVAS. 1.1. DEFINICIÓN. Se definen como elevaciones agudas de la presión arterial asociadas a sintomatología o alteraciones de estructura o función de órganos blanco, también de evolución reciente61. Se les subclasifica en urgencias hipertensivas (hay síntomas pero no lesión aguda de órgano blanco) o emergencias hipertensivas (lesión o disfunción aguda de órganos blanco). Los niveles de PA no definen el tipo de crisis, aunque por lo general las cifras de PAD son superiores a 120 mm Hg. Menos del 1% de todos los hipertensos llegará alguna vez a sufrir de una emergencia hipertensiva, que tienden a presentarse cerca de la quinta década de la vida. Si no son tratadas, conllevan un alto riesgo de mortalidad a corto plazo. 1.2. VALORACIÓN. Si se diagnostica una crisis hipertensiva deberán considerarse los siguientes factores: a) Evaluar adecuadamente a los pacientes con PA elevada. b) Recordar que la causa principal de crisis hipertensivas es el abandono de la terapia por parte del paciente o errores en la prescripción de parte del médico tratante (cambios inapropiados de dosis o suspensión brusca de tratamientos previamente indicados por otros colegas). c) Clasificar correctamente la hipertensión en cualquiera de las siguientes cuatro categorías (basándose en la presentación y en concordancia con el grado de agresividad terapéutica requerida): • Hipertensión severa no complicada: Sin evidencia de daño a órgano blanco, no debe ser tratada agudamente pero requiere de seguimiento. Los casos de HTA sistólica aislada severa no deberían clasificarse, sólo con base en las cifras tensionales, como “crisis”, aunque sea necesario iniciar terapia farmacológica de manera inmediata. No debe basarse el diagnóstico de HTA en tomas aisladas de la PA en Servicios de Urgencias. • Hipertensión severa transitoria: como en pacientes que acuden por otra causa a Urgencias y a quienes se le detecta HTA incidentalmente. Ansiedad, pancreatitis, ACV, deshidratación, supresión de alcohol, epistaxis, drogas; todas estas circunstancias pueden generar HTA aguda y 77 transitoria. Se debe tratar el padecimiento que le hizo llegar a urgencias y vigilar de cerca el comportamiento de la PA. • Urgencia hipertensiva: Elevación de la PA a un nivel potencialmente dañino, pero sin evidencia de disfunción aguda de órgano blanco. • Emergencia hipertensiva: PA elevada agudamente, con evidencia de daño a órgano(s) blanco: cerebro, corazón, aorta, riñones, retina. d) Determinar la agresividad y secuencia en el tiempo de las intervenciones terapéuticas (según el diagnóstico previo). e) Tomar decisiones apropiadas sobre la disposición del paciente (manejo ambulatorio u hospitalario, observación en emergencia, servicios de encamados, unidad de cuidados intensivos). Se sugiere seguir el algoritmo de la Figura 12 para la toma de decisiones acertadas y oportunas en el manejo de estos pacientes, aunque la mejor sugerencia posible es que se debe “tratar al paciente, no al tensiómetro”. El médico de Urgencias se enfrenta a menudo con crisis hipertensivas y tiende a actuar de manera agresiva ante cifras elevadas de PA debido a las ya conocidas y potenciales complicaciones orgánicas. El problema principal radica en que por lo general no es difícil reducir las cifras de PA de manera rápida, pero no se sabe con certeza cuáles son las metas “seguras” a alcanzar para prevenir hipoperfusión orgánica y efectos adversos o complicaciones. A menudo se invoca que una reducción de un 20 25% de las cifras de base sería una meta razonable, pero estos datos están basados tan solo en opiniones de expertos60. La selección de drogas se fundamenta, a menudo, más en la experiencia empírica individual que en evidencia de estudios controlados, los cuales son, a su vez, escasos, con casuísticas relativamente pobres y con poco poder estadístico para definir diferencias en cuanto a efectividad e incidencia de efectos adversos. El factor seguridad es de importancia crítica mientras es mayor el número de comorbilidades detectadas en la historia clínica y mientras sea más grave el deterioro orgánico ya establecido o recientemente instaurado. Los protocolos rígidos, aunque cómodos para el terapeuta, podrían no ser apropiados para permitir una individualización de cada caso. El arsenal terapéutico antihipertensivo ha incrementado notoriamente en los últimos años y esto obliga a actualizar conocimientos sobre fármacos que puedan acercarse al concepto de “droga de escoge” en Urgencias: administración sencilla, reducción efectiva y gradual de la PAS y PAD, alto perfil de seguridad, bajo costo. 78 FIGURA 12. Abordaje de las crisis hipertensivas. Ver texto para los detalles. 79 1.3. URGENCIAS HIPERTENSIVAS. TRATAMIENTO. 1.3.1. OBJETIVOS. Si se ha descartado lesión aguda de órgano blanco y se ha hecho el diagnóstico de urgencia hipertensiva, el objetivo terapéutico es llevar las cifras de PA a un rango seguro para el paciente en el plazo de 24 a 48 horas. El uso precipitado de altas dosis de antihipertensivos no solo resulta innecesario, sino peligroso. 1.3.2. OPCIONES DE TRATAMIENTO. a) Un primer paso terapéutico consiste en tranquilizar al paciente, explicándole en detalle su estatus clínico. Es ideal ofrecerle entonces reposo físico en un sitio cómodo y bien ventilado, apagar la luz del cubículo o consultorio y, si el juicio clínico lo sugiere y en ausencia de contraindicaciones, administrar un sedante por la vía oral. No es sorprendente que al ser revalorado el paciente, estas simples medidas generales hayan sido suficientes para resolver la crisis. b) Caso contrario, se dispone de opciones medicamentosas para reducir la PA de manera gradual y satisfactoria, a diferencia de antiguos regímenes agresivos de altas dosis de vasodilatadores de acción rápida, como la nifedipina. Un resumen de los fármacos útiles en urgencias hipertensivas y sus esquemas de dosificación se sumariza en la Tabla 10. Es muy probable que no se requiera de hospitalización, pero sí se recomiendan citas tempranas de seguimiento. c) No deben emplearse diuréticos, en especial diuréticos de asa, en el manejo de las crisis hipertensivas, a menos que haya franca retención hídrica con congestión pulmonar o sistémica. Esto es porque en la fisiopatología de las crisis es muy frecuente que haya reducción de la volemia y la diuresis podría promover hipoperfusión tisular y respuestas reflejas del sistema simpático y del sistema renina-angiotensina-aldosterona. d) Nifedipina. Desde su introducción en terapéutica pronto fue evidente que la nifedipina en forma de cápsulas de liberación rápida es un potente vasodilatador arterial que lleva a reducciones marcadas -y también rápidas- de la PAS y la PAD, ya sea con la administración sublingual (SL) o al masticar y deglutir los comprimidos previamente puncionados. También se han empleado preparados en gotas, aerosol, enema e inyección intravenosa, pero 80 ninguna de esas opciones ha sido estudiada lo suficiente como para merecer discusión adicional en este manual. Con un inicio de acción entre 10 y 15 minutos y un efecto pico al cabo de 30 minutos, el uso de dosis repetidas podría generar profunda hipotensión, taquicardia refleja, fenómeno de "robo" en diversos lechos vasculares y aumento del consumo miocárdico de oxígeno. Por lo anterior está contraindicado el manejo con nifedipina de acción rápida en hipertensos en crisis con angina inestable e infarto agudo miocárdico. Se ha argumentado que aunque en circunstancias especiales una reducción de PA intensa y rápida podría ser deseable, las crisis con daño de órgano blanco (emergencias hipertensivas, que por definición exigen control de cifras presoras en plazo muy corto) deberían manejarse con drogas parenterales en infusión continua, permitiéndose un ajuste fino minuto a minuto de las dosis con base a la respuesta hemodinámica y clínica bajo monitoreo cardíaco. Han sido reportados eventos cerebrovasculares agudos en pacientes con crisis hipertensiva tratados con nifedipina, así como agravamiento de angina de pecho e infarto miocárdico agudo, bloqueo aurículo-ventricular completo y muerte. Por todo lo anterior y por falta de evidencia en cuanto a seguridad y eficacia, el uso de nifedipina SL en crisis hipertensiva ha sido desaprobado por la FDA (Food and Drug Administration). Lo que parece ser universalmente reconocido es que opciones alternativas (como el captopril, la clonidina y el dinitrato de isosorbide) presentan menor incidencia de eventos adversos, sin ser necesariamente más eficaces como hipotensores. e) Captopril. Se sabe que las dihidropiridinas tienen una eficacia hipotensora superior a la de los IECA's, siendo estos últimos especialmente (pero no exclusivamente) efectivos en pacientes con actividad plasmática de renina elevada. Hay consenso que el captopril (con un inicio rápido de acción y la vida media más corta de su grupo) es una opción más segura que la nifedipina, por lo que se da amplia preferencia al captopril para uso en unidades de Urgencias. Se considera que tan solo el antecedente de angioedema provocado por IECA's y la presencia de enfermedad renovascular bilateral o la afección de arteria renal en riñón único serían, afortunadamente, las únicas contraindicaciones absolutas para su uso. La tableta machacada tiene un fuerte y desagradable sabor a sulfuro y el efecto adverso más común es la disgeusia. 81 f) Clonidina. Los efectos centrales simpaticolíticos de la clonidina se deben a estimulación de receptores agonistas alfa-2, lo cual produce reducciones significativas y relativamente rápidas tanto de la PAS como de la PAD, sin producir taquicardia refleja. Es, además, un potente inhibidor de la actividad del sistema renina-angiotensina-aldosterona (SRAA). Se dispone de un esquema de dosificación escalonado con dosis alícuotas vía oral a intervalos de una hora después de una carga inicial de 0.1-0.2 mg hasta una dosis total máxima de 0.8 mg. Más que una desventaja, sus efectos depresores del sistema nervioso central pueden ser capitalizados favorablemente en pacientes con carga intensa de ansiedad asociada a la crisis hipertensiva (aunque pueden ser indeseables cuando se requiera de un máximo grado de alerta en el paciente). Frecuentemente hay reducciones de la frecuencia cardíaca, lo cual obliga a usar el fármaco con cautela o prescindir de él en caso de trastornos avanzados de la conducción aurículo-ventricular, disfunción sinusal o disfunción binodal. No produce depresión contráctil del miocardio, por lo que se puede emplear en caso de insuficiencia cardíaca. Algunas otras indicaciones potenciales para el manejo de crisis hipertensiva con clonidina incluyen hipertensión inducida por trauma cráneo-encefálico y las crisis hipertensivas recurrentes asociadas a hipotensión ortostática debidas al síndrome de insuficiencia barorrefleja, condición rara pero de difícil manejo. Al emplear clonidina siempre debe tenerse en cuenta la posibilidad de una respuesta hipertensiva de rebote al cesar la administración de la droga de manera abrupta. g) Nitratos. Se han reportado beneficios en el manejo de crisis hipertensivas empleando nitratos como la nitroglicerina (NTG) y el dinitrato de isosorbide (DNIS). Los nitratos por vía parenteral están claramente indicados en el tratamiento de emergencias que involucren edema agudo pulmonar, síndromes coronarios agudos e infarto miocárdico agudo y, aunque son drogas principalmente coronariotrópicas y venodilatadoras, sus efectos sobre la presión arterial sistémica son significativos. En urgencias hipertensivas se han utilizado tabletas para administración sublingual (SL) y aerosoles bucales para evitar el intenso metabolismo hepático de primer paso después de la administración oral. Poca evidencia hay respecto a si existe un vehículo de elección para los nitratos, tabletas o aerosol. El uso de tabletas SL genera una respuesta 82 más lenta, menor reducción de cifras de PA y más casos de cefalea que el aerosol. h) Labetalol. Pocos médicos de emergencia se sienten cómodos tratando urgencias hipertensivas con betabloqueadores. El labetalol posee propiedades alfa y beta-bloqueadoras y ha sido empleado por ello en pacientes con feocromocitoma. También se ha ensayado en ginecoobstetricia, pero hay ciertas dudas sobre su potencial embriotóxico y hay casos de insuficiencia cardíaca perinatal en hijos de madres que tomaban el producto. No se discutirán aquí las indicaciones para su uso por no estar disponible en presentación oral al momento en Centroamérica. i) Prazosín. No hay ningún estudio que haya demostrado que el prazosín (hasta en dosis única de 2 mg) sea una opción siquiera comparable con las previamente descritas en cuanto a eficacia. Cabe destacar que sus efectos adversos en administración aguda son muy similares a los de la nifedipina. Su uso estaría justificado solo en situaciones excepcionales. j) Urapidil. Este fármaco (lanzado al mercado a finales de la década de los ochenta) posee un efecto de bloqueo periférico postsináptico alfa-1 asociado a una acción agonista central sobre receptores serotoninérgicos 5HT1A, lo cual reduce las resistencias vasculares periféricas. Goza de mucha popularidad fuera de los Estados Unidos de Norteamérica en virtud de su inicio rápido de acción al administrarse por la vía endovenosa. No está disponible en Centroamérica. 1.3.3. CONCLUSIONES: • • • • • No existe un medicamento ideal para tratar todos los tipos de urgencias hipertensivas. No se tiene evidencia de peso que permita fijar con certeza las metas terapéuticas a corto plazo en el paciente con urgencia hipertensiva. Es necesario individualizar cada caso en cuanto a severidad de la hipertensión, cuadro clínico y comorbilidades existentes. Ningún estudio al momento tiene el poder de discriminar entre drogas "eficaces y recomendables" contra drogas "peligrosas e inapropiadas". Por lo anterior hay una tendencia a manejar empíricamente las crisis hipertensivas, con base en la experiencia estrictamente personal. 83 Tabla 10. Manejo urgencias hipertensivas. DROGA Nifedipina RANGO DOSIS (mg) 5-20 Captopril 6.25-50 Clonidina 0.1 mg alícuotas horarias (máximo 0.7 mg) Labetalol 100-200 Nitroglicerina 0.4 Isosorbide 5-10 Prazosín 1-2 VÍA ADMÓN . SL, VO SL, VO SL, VO INICIO ACCIÓN EFECTO MÁXIMO 0.5-1 2h 1-1.5 h 1h 0.5-1 3-5 DURACCIÓN ACCIÓN OBSERVACIONES 6-8 Se menciona tan solo para desaprobar rotundamente su empleo sistemático. Podría emplearse solo de manera excepcional en pacientes sin jóvenes sin lesiones vasculares. 8-12 Probablemente la droga de elección, precaución si se sospecha HTA de causa renovascular o en caso de historia de angioedema por IECA’s. 8 Buena alternativa, ideal si hay hiperactividad simpática o historia de uso de drogas recreacionales; precaución especial en caso de asma, bradicardia o trastornos de la conducción cardíaca. Puede haber depresión del SNC. VO 1 2-4 8-12 SL 1-3 min 2 min 0.5-1 VO 1-2 1-3 10 SL: Sublingual, VO: Vía oral, min: minuto, h: hora, mg: miligramos 84 Perfil de utilidad, ventajas y desventajas prácticamente muy similar a los de la clonidina, su es efecto un tanto más prolongado. Ideal en caso de infarto o síndrome coronario agudo mientras se preparan las infusiones intravenosas de nitratos; preguntar siempre por el uso reciente de sildenafil o drogas similares. No se dispone de evidencia sólida que respalde su uso, deben preferirse otras opciones. 1.4. EMERGENCIAS HIPERTENSIVAS: TRATAMIENTO. 1.4.1. OBJETIVOS. • Si se confirma disfunción aguda de órgano(s) blanco, se deberá disminuir cifras de PA a niveles seguros en plazo no mayor de 1 hora; por lo general se buscan reducciones cercanas al 30% de las cifras basales de PA. Si no se dispone de los recursos materiales o humanos adecuados para el manejo de estos pacientes, deberá trasladarse al paciente a un centro de atención de tercer nivel, acompañado de un médico, una o dos enfermeras y un terapista respiratorio si es posible. Se podrá emplear nitroglicerina o isosorbide sublingual mientras se prepara a los pacientes para la administración de drogas por la vía intravenosa. • Prevenir ulterior deterioro de órganos blancos afectados, dando además un adecuado manejo de sostén. Esto implica, por lo general, que una vez instalado en la unidad de cuidados intensivos (UCI), el manejo quede a cargo de especialistas y/o subespecialistas (internista, intensivista, cardiólogo o nefrólogo). • No se hará en este manual una revisión profunda del tema porque el manejo de estos casos compete siempre al nivel terciario de atención. 1.4.2. OPCIONES DE TRATAMIENTO. • • • • Hospitalización inmediata en unidad de cuidados intensivos (UCI). Terapia vasodilatadora intravenosa inmediata. Monitoreo cardíaco y hemodinámico constante. No esperar resultados de pruebas de laboratorio y/o de gabinete para la toma de decisiones. 1.4.3. ESQUEMAS DE MEDICAMENTOS. Las pautas específicas de dosificación de las drogas están detalladas en la Tabla 11. No existe una droga ideal para todos los pacientes. a) Nitroprusiato de sodio. Es un vaso y venodilatador con acción inmediata. Mejora el gasto cardíaco al 85 aumentar la precarga y reducir las resistencias periféricas. Debe administrarse por bomba de infusión, bajo monitoreo estricto y a través de jeringas y descartables opacos (es sensible a la luz). Sufre metabolismo hepático y sus metabolitos son potencialmente tóxicos (tiocianato) especialmente en caso de falla renal. No debería mantenerse en infusión por períodos superiores a 24-48 horas y desde un inicio deben buscarse drogas candidatas para un traslape rápido a medicación oral. b) Nitroglicerina. Su efecto es principalmente dilatador venoso y coronario, pero a medida que se incrementan las dosis reduce también las resistencias vasculares periféricas. Produce menos “robo” coronario que el nitroprusiato y no tiene su toxicidad, por lo que puede emplearse por períodos más prolongados de tiempo. Amerita infusión continua por bomba y monitoreo cardíaco y hemodinámico. c) Esmolol. Bloqueador beta adrenérgico β1 selectivo para uso exclusivamente parenteral. Posee una vida media ultracorta (aproximadamente 9 minutos) y la consecuentemente rápida desaparición de sus efectos exige que se administre en infusión continua. Ideal en caso de taquiarritmias (efecto cronotrópico positivo) o para antagonizar los efectos pro-hipertensores de la dopamina o dobutamina. Atractivo para casos de disección aórtica, asociado a nitroprusiato, por sus efectos cardiodepresores. d) Hidralazina. Sus principales usos en la actualidad son la hipertensión asociada al embarazo y la HTA peri o transoperatoria. La rápida vasodilatación arterial estimula respuestas simpáticas reflejas, por lo que podría generar taquicardia. No se aconseja en enfermedad oclusiva de los lechos arteriales, IAM o angina inestable (aumenta el consumo miocárdico de oxígeno), insuficiencia cardíaca congestiva y edema agudo pulmonar. e) Enalaprilat. Alternativa para pacientes a los que no se puede administrar drogas en forma continua por falta de equipos de infusión. Se administra en bolus endovenosos cada 6 horas y la hora siguiente a cada dosis debe ser cuidadosamente monitorizada pues puede producir marcada hipotensión. Se 86 desaconseja en la fase hiperaguda del IAM y en la enfermedad renovascular bilateral. f) Otras drogas como la nicardipina, el labetalol, el fenoldopam y la fentolamina tienen interés tan solo académico para este manual (no están por lo regular disponibles en Centroamérica) y por no tratarse de medicamentos para atención primaria no serán discutidos aquí. Otras drogas como el diazóxido han caído en desuso por la dificultad de su administración y los riesgos de hipoperfusión tisular secundaria a caídas abruptas y poco controlables de la PA. 1.4.4. CONCLUSIONES: • • Las emergencias hipertensivas exigen manejo inmediato y agresivo en el tercer nivel de atención. Existen pautas de manejo agresivo, por lo general con fármacos por la vía intravenosa. Su objetivo es salvar la vida y preservar en lo posible la integridad de los órganos blanco. 87 Tabla 11. Manejo emergencias hipertensivas. DROGA RANGO DOSIS INICIO ACCIÓN DURACCIÓN ACCIÓN Nitroprusiato de sodio 0.5-10 µg/Kg/min Infusión continua <1 min 1-10 min Nitroglicerina Bolus 5-10 µg 10-400 µg/min Infusión continua <1 min 1-10 min Esmolol Bolus 500 µg 25-300 µg/Kg/min infusión continua 5 min 20-30 min (después de bolus IV) Hidralazina 5-10 mg bolus c/20 min Dosis máxima: 20 mg 10-30 min 3-8 h Enalaprilat 1.25-5 mg EV c/6 h <1 h 6h EV: endovenoso; min: minuto; h: hora; mg: miligramos. 88 OBSERVACIONES Potente efecto vasodilatador arterial y venoso, dosis dependiente, ideal en IAM, ICC, disección aórtica; uso por más de 24 h relacionado con toxicidad por tiocianato. Debe protegerse de la luz y administrarse en infusión Indicaciones similares a las del nitroprusiato, más efecto venoso que arterial. Ideal en IAM, SCA, edema agudo de pulmón. Mucho más seguro, no induce toxicidad. Betabloqueador β-1 selectivo de acción rápida y vida media ultracorta. Su empleo se ha orientado más al manejo de taquiarritmias supraventriculares que a emergencias hipertensivas. Útil en preeclampsia-eclampsia. Está contraindicado en edema agudo pulmonar o en post IAM reciente por sus efectos hiperdinámicos, precaución en enfermedad cerebrovascular o coronaria oclusivas. Ideal en caso de infarto o síndrome coronario agudo mientras se preparan las infusiones intravenosas de nitratos, preguntar siempre por uso reciente de sildenafil o similares. 2. HIPERTENSIÓN ARTERIAL REFRACTARIA. Se define como aquella HTA que no puede ser controlada a pesar de una terapia farmacológica a dosis plenas con tres medicamentos, siendo uno de ellos un diurético. A pesar de la eficacia hipotensora de las drogas modernas, un porcentaje de pacientes no alcanzará las metas recomendadas por los comités de expertos. Las metas, por su parte, ya difíciles de alcanzar, podrían ser todavía más exigentes en un futuro temprano, especialmente en los pacientes con mayor deterioro orgánico. Causas reales o aparentes de HTA refractaria: a) Incumplimiento terapéutico. Es el factor individual causal más frecuente de HTA refractaria. En pacientes con diabetes, cardiopatía isquémica, IRC o ICC la polifarmacia es la regla, y se sabe que a mayor cantidad de medicamentos prescritos, mayor probabilidad de abandono parcial o total de la terapia. b) Esquemas terapéuticos inapropiados. Si la prescripción es insuficiente por el uso de dosis subóptimas o combinaciones inadecuadas, se hablaría de una HTA mal tratada y no de refractariedad. c) Presencia de fenómeno de la “bata blanca”. En estos casos el MAPA resolverá el dilema diagnóstico y terapéutico. d) Uso concomitante de drogas. Ya sea por el empleo concomitante de fármacos pro-hipertensores o por medicamentos que, al interactuar, inactiven o reduzcan la eficacia de los medicamentos antihipertensivos. e) Hipertensión arterial secundaria de causa no identificada. En pacientes estenosis de arteria renal, coartación aórtica, feocromocitoma o hiperaldosteronismo primario (por ejemplo) el control de la HTA puede ser imposible si no se da tratamiento específico a las patologías de base. f) Insuficiencia renal crónica. g) Hipertensión sistólica severa asociada a angioesclerosis o insuficiencia valvular aórtica. El marcado aumento de la presión de pulso (PAS menos la PAD) es causado por la pérdida de la distensibilidad vascular, un cambio degenerativo senil generalmente asociado a extensa calcificación. Este aumento de la presión de pulso es un factor de riesgo independiente para el desarrollo de lesión estructural de órganos blanco. h) Pseudohipertensión. En casos extremos de esclerosis calcífica vascular las arterias periféricas están endurecidas y son irregulares a la palpación (arterias en “tráquea de pollo”) y puede resultar imposible 89 comprimirlas hasta el punto de oclusión con el manguito del tensiómetro. Por ello, puede simularse una hipertensión sistólica extrema, pues por mucha presión externa que se genere, siempre se escucha la primera fase de los ruidos de Korotkoff al aplicar el estetoscopio en la fosa antecubital. Si se palpa el pulso radial simultáneamente, será evidente que éste no desaparece, por lo que la medición exacta de la presión será poco menos que imposible. En casos extremos será necesaria una medición intraarterial directa con la ayuda de un catéter. En caso que se haya confirmado la verdadera refractariedad de un caso de HTA, procede hacer una pesquisa profunda para determinar si el paciente adolece de algún tipo de HTA secundaria. Para este estudio debe consultarse el inciso 3 de esta misma sección. 90 3. HIPERTENSIÓN ARTERIAL SECUNDARIA. Como ya se ha explicado, en caso de hipertensión refractaria se debe sospechar una etiología secundaria. Esto no es una regla absoluta, pues muchos pacientes con HTA secundaria cursan con formas moderadas de enfermedad, que pueden mantenerse bajo control con asociaciones de fármacos; por otra parte, a menudo pacientes con HTA esencial tienen comportamiento refractario. También se ha explicado que las llamadas causas secundarias pueden identificarse en alrededor de un 5-10% de todos los casos de HTA en adultos, pero en la práctica general es raro que se diagnostiquen. Esto podría explicarse por escasez de recursos a nivel primario o falta de conocimientos especializados en el abordaje de estos casos. Debe sospecharse HTA secundaria en las siguientes circunstancias: a) Hipertensión con inicio en edades extremas de la vida (menos de 20 ó más de 50 años); b) Hipertensión de difícil control o refractaria (ver inciso 2 de esta misma sección); c) Hipertensión severa palpitaciones; intermitente, asociada a cefalea y/o d) Fenotipo anormal: aspecto cushingoide, facies acromegálica, anomalías del desarrollo sexual (hipogonadismo), gigantismo, por ejemplo; e) Anomalías cutáneas: palidez, rash, edemas, manchas café con leche, calcinosis cutis, vasculitis, eritema nodoso, pilosidad anormal; f) Hiperactividad simpatoadrenal (temblor, piel tibia y húmeda, taquicardia, hiperdefecación, xerostomía); g) Ausencia de pulsos o presencia de soplos vasculares periféricos (carótidas, abdomen, miembros); h) Evidencia de múltiples y/o severas lesiones de órgano blanco; i) Anomalías de laboratorio, especialmente (considerando los estudios básicos): • • • • Hipokalemia con kaliuresis (en ausencia de terapia diurética); Anemia crónica; Hipercalcemia; Proteinuria, hematuria, cilindruria. 91 En caso de sospecha razonable de hipertensión secundaria se recomienda un abordaje escalonado de "niveles de valoración", en que diferentes estrategias de diagnóstico son implementadas, en orden de menor a mayor complejidad y costo. 3.1. PRIMER NIVEL DE VALORACIÓN. En este nivel se hará un escrutinio básico para detectar, dentro de las patologías generadoras de HTA secundaria, a algunas de las de diagnóstico más fácil o accesible con técnicas valorativas relativamente simples. 3.1.1. Historia y exploración. • Hacer una historia clínica lo más detallada posible, valorando los elementos recién descritos en la introducción de este capítulo (1-9). Preguntar por todos los medicamentos en uso actual o reciente, incluyendo corticosteroides, anorexígenos, catecolaminas, drogas "recreacionales", anovulatorios, antiinflamatorios no esferoidales, suplementos alimenticios o golosinas con regaliz (orozuz) (ver Tabla 3). En mujeres preguntar por anomalías menstruales y/o infertilidad. • Tomar la presión en ambos miembros superiores. Si hay hipertensión en el brazo derecho con presión normal o baja en el miembro contralateral, podría haber coartación aórtica. El diagnóstico es aún más probable si hay un soplo interescapular y anormalidades radiológicas (signo del número "3" invertido). • Buscar ortostatismo (hipertensión en decúbito, normalización con la posición de pie, para descartar disautonomía. • Revisar pulsos carotídeos, axilares, humerales, radiales, cubitales, femorales, poplíteos, pedios y tibiales posteriores. La ausencia de pulso en un vaso o una marcada asimetría en la amplitud de la onda de pulso sugeriría vasculopatía oclusiva periférica, que se aprecia en pacientes con esclerodermia (arterias renales), tromboangeítis obliterante o en el síndrome de Takayasu-Onishi (en especial en mujeres jóvenes, "enfermedad sin pulso"). • Auscultar flancos y epigastrio en busca de soplos. Su presencia sugiere estenosis de arteria(s) renal(es), su ausencia no descarta tal posibilidad. • Buscar estigmas de nefropatía crónica: edemas, abotagamiento facial, palidez y color terroso de la piel, edemas periféricos. 92 3.1.2. Laboratorio básico. • Hemograma. • Velocidad de sedimentación eritrocitaria (VSE, ERS) si se sospecha alguna patología inflamatoria sistémica, como enfermedad autoinmune. • Nitrógeno ureico y creatinina. • Depuración de creatinina en orina de 24 horas si la creatinina sérica es anormal. • Potasio sérico. • Ácido úrico, excreción de uratos en orina de 24 horas. • Si el potasio es repetidamente menor de 4.0 mEq/L debería medirse también potasio en orina de 24 horas (no debe haber medicación diurética) siempre y cuando no haya evidencia de pérdidas extrarrenales de potasio (diarrea y vómitos, por ejemplo). • Calcio sérico. Podría ser adecuado medir también albúmina plasmática si hay hipocalcemia, pues el valor de calcio debe corregirse para el nivel de albúmina. • Examen microscópico (hematuria, cilindruria). • TSH (hormona estimulante de tiroides), si hay sospecha de hipertiroidismo. del sedimento urinario 3.1.3. Gabinete básico. • Rayos X de tórax. Buscar anomalías aórticas y establecer severidad de cardiomegalia si la hay. • Ultrasonografía abdominal con doppler/color (duplex) de arterias renales. Se solicitará un rastreo completo, con énfasis en aorta abdominal y riñones (tamaño, simetría, relación corticosuprarrenal). Deben buscarse quistes parenquimatosos (poliquistosis). Se estudian el flujo y los índices de resistencia de los vasos renales. Con este primer nivel de investigación, accesible para todo médico general o de atención primaria, pueden descartarse razonablemente la coartación 93 aórtica, el hipertiroidismo, las glomerulopatías o tubulopatías, la enfermedad renal poliquística, el hiperparatiroidismo y la disautonomía. Resultados anormales podrían sugerir la presencia de endocrinopatías, estenosis de arteria renal y neoplasias generadoras de HTA (enfermedad de Conn [ver figura 13], feocromocitoma) o enfermedades genéticas. Si hay mérito en seguir investigando, podrá entonces implementarse el siguiente nivel de investigación, probablemente ejecutado por un médico especialista o subespecialista. 94 FIGURA 13. Hiperaldosteronismo primario en una mujer hipertensa en sexta década de la vida, con hiperkalemia leve crónica. A. Vista macroscópica de la glándula extirpada y abierta longitudinalmente. B. Corte histológico que muestra neoplasia adenomatosa. Tras la extirpación del adenoma la HTA y la hiperkalemia desaparecieron en forma definitiva (Cortesía Dr. Hugo Villarroel Ábrego). FIGURA 14. Estenosis bilateral de arterias renales en una paciente octogenaria con HTA refractaria a pesar del uso de varias drogas antihipertensivas a dosis plenas (Cortesía Dr. Hugo Villarroel Ábrego). 95 3.2. Segundo nivel de valoración. Los estudios diagnósticos se orientarán con base en los datos clínicos ya recabados. No procede hacer estudios especializados si no persiste una alta sospecha clínica de hipertensión secundaria después de haberse ejecutado el primer nivel de valoración. 3.2.1. Laboratorio especializado. • Actividad plasmática de renina (APR). Ayuda a establecer si se trata de HTA renina alta, baja o normal, lo cual orienta hacia patologías específicas cuando se tienen valores extremos. Por lo general debe estudiarse simultáneamente con los niveles plasmáticos de aldosterona, para establecer la relación aldosterona/APR, herramienta de gran valor clínico. • Aldosterona plasmática. • Cortisol plasmático, en horas de la mañana (8:00 AM) y de la tarde (4:00 PM). Si se demuestra hipercortisolismo deberá también medirse excreción de cortisol en orina de 24 horas. • Catecolaminas plasmáticas (probable feocromocitoma). • Metanefrinas en orina de 24 horas, exclusivamente si se sospecha feocromocitoma. Estudios como el ácido vanilmandélico en orina de 24 horas son menos específicos. • Catecolaminas en orina al azar, inmediatamente después de una crisis de HTA, si se sospecha feocromocitoma. • Gasometría arterial, si se sospechan alcalosis metabólica (pacientes hipokalémicos persistentes) o acidosis tubular renal. • Hormona del crecimiento (para descartar acromegalia). 3.2.2. Gabinete especializado. • Angiotomografía o angiorresonancia con contraste de arterias renales y glándulas suprarrenales. Este estudio es clave para el diagnóstico de estenosis de arterias renales o anomalías estructurales de la corteza y médula suprarrenales. En un solo estudio de imágenes se pueden también descartar las hiperplasias y adenomas suprarrenales. En caso que haya arterias renales normales, 96 no se requerirá de estudios invasivos. Si se detectan lesiones estenóticas arteriales deberá hacerse un cateterismo selectivo de las arterias renales porque puede haber estudios falsos positivos. • Cinearteriografía renal selectiva, de preferencia con sustracción digital, considerado el estudio "patrón oro" ("gold standard"). • Gammagrafía con metayodobencilguanidina (MIBG), específico para el diagnóstico de feocromocitoma, con altos niveles de sensibilidad y especificidad. • Estudios de esteroides urinarios, para el diagnóstico diferencial de los casos de deficiencia de 11 y 17 hidroxilasas y del hiperaldosteronismo supresible por glucocorticoides (HASG). 3.2.3. Procedimientos y pruebas terapéuticas. • Test de captopril, auxiliado con gammagrafía renal y/o con mediciones de APR, a veces complementado con medición directa de renina y aldosterona en venas suprarrenales. Esta técnica tiende a caer en desuso por lo complicada y su relativamente mediocre valor predictivo, por una pobre especificidad. • Test de clonidina, para diagnóstico diferencial feocromocitoma versus HTA esencial hiperadrenérgica. • Test de glucagon, valorando catecolaminas plasmáticas antes y 2 minutos después de una dosis de 2 mg de glucagon intravenoso. Para evaluar feocromocitoma en fase normotensiva. • Test de espironolactona. Ayuda al diagnóstico diferencial de las HTA hipokalémicas. Se determina si la HTA y la hipokalemia son dependientes o independientes de actividad mineralocorticoide. Después de cinco días de terapia con 200 mg/d de espironolactona, si hay deterioro clínico se sospecha síndrome de Geller; si hay respuesta positiva se confirma el hiperaldosteronismo. Una respuesta negativa (no descenso de la PA) sugiere síndrome de Liddle. • Test de triamtereno/amilorida. Se usa para confirmar el síndrome de Liddle. Si después de administrar una de estas 97 de • drogas ahorradoras de potasio se normaliza la hipokalemia y se resuelve la HTA, el diagnóstico queda confirmado. Test de supresión con dexametasona. Específicamente orientado para la confirmación del raro síndrome genético de hiperaldosteronismo supresible por glucocorticoides (HASG). Si después de la administración de dexametasona oral (2 mg/d, 2 semanas) se normalizan la hipokalemia y la HTA, el diagnóstico queda confirmado. Para la aplicación práctica de los conceptos relacionados con el estudio de las hipertensiones hipokalémicas que no son hiperaldosteronismo primario, se sugiere aplicar el algoritmo de la figura 15. 98 FIGURA 15. Abordaje de la hipertensión crónica asociada a hipokalemia, en ausencia de adenoma suprarrenal. Ver texto para los detalles. + K U: Potasio urinario. TX: tratamiento. SEMA: Síndrome de exceso aparente de mineralocorticoides. HASG: hiperaldosteronismo supresible con glucocorticoides. 99 4. HIPERTENSIÓN ARTERIAL ASOCIADA AL EMBARAZO. Los estados hipertensivos del embarazo constituyen una de las complicaciones médicas más frecuentes y severas de la gestación, y son una de las principales causas de prematuridad, morbilidad perinatal y mortalidad materna, a escala mundial. De ahí la extrema importancia de tener unificados los criterios de diagnóstico, clasificación y tratamiento. La preeclampsia, la presentación clínica más común, constituye la más grave de las complicaciones hipertensivas del embarazo y puede resultar catastrófica si pasa inadvertida, sin tratamiento o si evoluciona hacia una eclampsia. Esta situación es más común de lo que podría esperarse y muchas veces no es reconocida a tiempo por los médicos de primer nivel hasta que se presentan las complicaciones maternas y fetales. Otras veces se diagnostica pero sorprendentemente se pospone la intervención adecuada por limitaciones institucionales, sociales y laborales. Durante el embarazo existe una tendencia hacia la hipotensión, por lo que no se pueden aplicar los límites habituales de normalidad. Hay dos formas de definir la HTA en el embarazo: a) Aumento absoluto de PA: Se considera hipertensa a toda paciente embarazada con PA mayor de 140/ 90 mm Hg, obtenida en reposo, en por lo menos dos oportunidades, con un intervalo mínimo de 4-6 horas62. Si la PAD se encuentra muy elevada en la primera toma (mayor de 110 mm Hg) no se aconseja esperar tanto tiempo para confirmar las cifras e iniciar manejo. b) Aumento relativo de PA: Se considera hipertensa a toda paciente que muestre un aumento mayor de 30 mm Hg. de PA sistólica y/o mayor de 15 mm Hg. de la PA diastólica, respecto de la PA que tenía en la primera mitad del embarazo. Se recomienda tomar la PA en posición sentada y no en decúbito supino, porque puede haber lecturas falsamente bajas. Es aconsejable, en cambio, hacer mediciones periódicas de PA en decúbito lateral. La PAD se medirá en el momento de la fase IV de los ruidos de Korotkoff, y no en la fase V, como se acostumbra en los demás pacientes en la práctica general, porque esto proporciona un margen adicional de seguridad. Una buena estrategia para el diagnóstico precoz de la preeclampsia (semanas 28 a 32 de la gestación) es el test de Gant, que consiste en la toma de PA en decúbito supino y en decúbito lateral, el test es positivo si existe una diferencia de presiones superior a 20 mm Hg. A pesar de los recientes avances en la comprensión de la fisiopatología y control de los desórdenes hipertensivos del embarazo, existe confusión en la literatura médica acerca de la definición y clasificación de dichos desórdenes. Términos como “preeclampsia”, "hipertensión gestacional", "toxemia del embarazo", "hipertensión proteinúrica", "toxemia preeclámptica", "hipertensión inducida por el embarazo", "hipertensión orgánica", "preeclampsia verdadera”, 100 “hipertensión esencial latente en el embarazo," "hipertensión crónica" e "hipertensión transitoria" han sido utilizados de manera inadecuada e intercambiados entre sí. Se precisa de una clasificación estándar que permita establecer un algoritmo de tratamiento sin pérdida de tiempo. 4.1. HIPERTENSIÓN ARTERIAL CRÓNICA EN EMBARAZO. La HTA crónica representa un trastorno asociado al embarazo, pero no generado por éste, mientras que las restantes categorías representan trastornos hipertensivos inducidos por el embarazo. Se la detecta antes de la semana 20 de gestación, se detecta en aproximadamente el 5% de los embarazos y puede ser de grado leve o severo. Hay un mayor riesgo de desarrollar preeclampsia y abruptio placentae. La presencia de tensiones elevadas antes de las 20 semanas de gestación nos orienta a pensar en la preexistencia antes de la concepción. 4.1.1. Tratamientos farmacológicos aceptados en embarazo: • Alfametildopa: Riesgo de hipotensión fetal. • Bloqueadores β-adrenérgicos (atenolol, metoprolol, labetalol): retardo del crecimiento, hipoglicemia y bradicardia fetales periparto. • Hidralazina. • Prazosín. • Bloqueadores de los canales de calcio (BCC), en especial nifedipina. 4.1.2. Tratamientos contraindicados en embarazo: • • Inhibidores de la enzima convertasa de angiotensina (IECA's): retardo del crecimiento fetal, oligohidramnios, malformaciones congénitas, fallo renal neonatal, y muerte neonatal. Bloqueadores de receptores de angiotensina II (ARA-II's). En teoría ídem a los IECA’s. No deben emplearse. 4.2. HIPERTENSIÓN GESTACIONAL. Se habla de HTA gestacional cuando las cifras de presión se encuentran elevadas pero sin la presencia de edemas anormales o proteinuria. En estos casos, suele tratarse de enfermas con hipertensiones previas que han pasado desapercibidas y que, en el primer trimestre, están pseudonormalizadas de su PA por los cambios fisiológicos del embarazo. Es común que haya recurrencias 101 en embarazos subsecuentes, evolucionando los casos a HTA crónica y sostenida. 4.3. PREECLAMPSIA/ECLAMPSIA. Se define como HTA edema y proteinuria o hiperuricemia después de la semana 20 de gestación en mujeres previamente normotensas63. Las principales complicaciones son coma, convulsiones (que definen a la eclampsia), hemorragia cerebral, abruptio placentae con coagulación intravascular diseminada (CID), edema pulmonar, fallo renal, hemorragia hepática y muerte. El riesgo fetal incluye retardo severo del crecimiento, hipoxemia, acidosis, prematuridad, y muerte. Se puede presentar preparto y hasta en las cuatro semanas siguientes al parto. A pesar de múltiples estudios realizados, la causa precisa del origen de la preeclampsia aun no está esclarecida. Existe, sin embargo, una serie de hechos confirmados, entre los que se destacan como agentes patogénicos una falla en la migración del trofoblasto y un defecto en la placentación, que originarían diferentes alteraciones inmunogenéticas e isquemia útero-placentaria. Con base en lo anterior y en el contexto de determinados factores genéticos, étnicos, nutricionales, sobrepeso, dislipidemia e incremento de la homocisteína, se establece un cuadro de hipoperfusión placentaria con liberación de elementos tóxicos circulantes, aumento del estrés oxidativo y aparición de disfunción endotelial, lo que precipita un cuadro de vasospasmo generalizado. A consecuencia sobrevienen lesión glomerular con proteinuria, hipertensión arterial, isquemia hepática, trombocitopenia, hemólisis e isquemia del sistema nervioso central con convulsiones (eclampsia). En resumen, la preeclampsia obedece a una vasculopatía sistémica desencadenada por alteración placentaria, con daño del endotelio vascular e isquemia de múltiples órganos (sobre todo riñón, hígado y cerebro) con exceso de sustancias vasoconstrictoras (tromboxano A2, angiotensina II y endotelina I) y déficit de vasodilatadores (óxido nítrico), intervención de citoquinas y déficit de antioxidantes. La preeclampsia puede ser leve o grave, según los siguientes criterios: 4.3.1. PREECLAMPSIA LEVE: • Hipertensión arterial (según lo ya descrito). • Proteinuria patológica, mayor a 300 mg en orina de 24 horas. Si se utilizan tiras reactivas, es aconsejable considerar dos cruces (++) como valor patológico, para 102 evitar los resultados falsos positivos. La no existencia de proteinuria no descarta la enfermedad ya que puede aparecer posteriormente a la evaluación inicial. • Edemas patológicos. El edema es un fenómeno normal en el embarazo, de causa mecánica (compresión uterina sobre las venas pélvicas), generalmente limitado a los tobillos o región pretibial y cede con el reposo nocturno. Es de magnitud variable para cada paciente. El edema patológico se caracteriza por extenderse también a las manos y la cara y no cede con el reposo nocturno, siendo a veces el primer signo de alerta. En algunas pacientes el edema no se hace ostensible con el clásico signo de Godet (edema oculto). En estos casos, la retención de líquido se evidencia por un aumento ponderal anormal (500 gr por semana ó 2000 gr en un mes). • Hiperuricemia patológica. Descartado el origen metabólico (gota) o por fármacos, la hiperuricemia es índice de disfunción renal y suele ser más precoz que la proteinuria. En el embarazo se considera como normal un nivel sérico de ácido úrico hasta de 4.5 mg%. 4.3.2. PREECLAMPSIA GRAVE: • • • • • • • • • • • • • PA igual o superior 160/110 mm Hg. Proteinuria igual o superior a 5 gr en orina de 24 horas. Oliguria (<400 ml/24 h). Alteraciones cerebrales o visuales. Edema pulmonar o cianosis. Plaquetas en número inferior a 100,000 ó tendencia descendente. Hiperreflexia. Dolor en epigastrio. Hemoconcentración e hipovolemia. Retardo del crecimiento intrauterino. Óbito fetal. Síndrome HELLP (hemólisis liver diseases and low platelet). Una complicación de pronóstico sombrío que puede ocurrir siempre que exista preeclampsia. Cursa con hemólisis, aumento de las transaminasas por hemorragia hepática periportal y trombocitopenia. Muerte materna. 103 4.3.3. ECLAMPSIA: Es la situación hipertensiva del embarazo de peor pronóstico materno y fetal. El síndrome de eclampsia inminente es un cuadro clínico que presagia el desencadenamiento de una eclampsia. Clínicamente puede manifestarse con deterioro del estado general, hiperreflexía, excitación psicomotriz u obnubilación, cefaleas, epigastralgia o dolor en hipocondrio derecho, acúfenos y trastornos visuales como centelleos y diplopía. Diagnóstico diferencial: epilepsia, hemorragia o tumores cerebrales, intoxicación acuosa, encefalopatía hipertensiva, meningitis, encefalitis. Características de la preeclampsia con convulsiones y/o coma: • Convulsiva: Presencia de convulsiones tónico clónicas acompañadas de brote hipertensivo (habitualmente). • Comatosa: Aparición de pérdida de conciencia inicial o post convulsión tónico clónica. 4.4. PREECLAMPSIA O ECLAMPSIA SUPERPUESTA. Se da en aquellas pacientes con hipertensión crónica a las que se asocia edemas, proteinuria o ambos. 4.5. TRATAMIENTO. El tratamiento adecuado requiere tener presente los cambios normales de la PA y volumen intravascular que tienen lugar durante el embarazo. El desafío mayor es enfrentar el tratamiento por el hecho de estar en riesgo dos (o más) vidas y porque no existen estudios de vigilancia prolongada con los diferentes fármacos antihipertensivos en uso: α-metildopa, la hidralazina, los βbloqueadores y los bloqueadores de los canales de calcio. Se ha intentado hacer prevención de la preeclampsia con restricción de sodio, diuréticos, bajas dosis de aspirina (60-150 mg/día) y suplementos de calcio en la dieta, pero ninguna de estas estrategias está sustentada en evidencia fuerte que recomiende su uso de forma rutinaria. El manejo de la paciente con pre-eclampsia-eclampsia es competencia del segundo o tercer nivel de atención y solamente se incluirán en este manual algunas de las medidas generales a considerar. 104 • El médico del primer nivel de atención hará historia clínica, realizará el diagnóstico y referirá a la paciente a un segundo nivel. • En estos casos el traslado de las pacientes se debe de realizar con carácter de urgencia en ambulancia, acompañadas por personal capacitado. Deberá mantenerse a las pacientes en decúbito lateral izquierdo, monitorizándose la frecuencia cardíaca fetal. Venoclisis con solución glucosada al 5% es mandatoria. • No administrar vasodilatadores y diuréticos sin reponer previamente el volumen o en presencia de sufrimiento fetal. • No usar IECA’s ni ARA-II. • Preeclampsia leve: Vigilar estrechamente. Si el embarazo se encuentra a término con un cérvix favorable se debería inducir el parto para evitar complicaciones materno-fetales. En estadios más tempranos se debe indicar reposo en cama, terapia antihipertensiva y profilaxis anticonvulsiva con sulfato de magnesio: 6 g en 100 mL de solución glucosada o lactato de Ringer, EV directo durante 15 minutos y seguido de una infusión continua de 2 g por hora, bajo vigilancia de reflejos osteotendinosos, frecuencia respiratoria, frecuencia cardiaca y diuresis (para prevenir o detectar tempranamente toxicidad por magnesio). • Preeclampsia severa: Finalizar rápidamente la gestación sin tener en cuenta la edad gestacional. Cuando la edad gestacional es menor a 34 semanas se podría intentar tratamiento conservador con monitoreo estricto, con el objetivo de mejorar la sobrevida neonatal. Solo se debe considerar esta alternativa en centros de atención perinatales terciarios. • Eclampsia: Terapia antihipertensiva EV como la descrita para las emergencias hipertensivas. Tratamiento anticonvulsivante con sulfato de magnesio. Esta condición debería ser manejada en centros de tercer nivel. 105 5. HIPERTENSIÓN ARTERIAL CRÓNICA EN NIÑOS Y ADOLESCENTES. El aumento de la presión arterial varía según la edad. Durante el primer mes de vida la PAS aumenta de forma rápida, enlenteciéndose posteriormente hasta la edad de 5 años64. Entre esta edad y el inicio de la pubertad, la PAS aumenta a un ritmo de 1-2 mmHg, y la PAD a 0,5-1 mmHg por año, sin mayor diferencia de género65. Entre 13 y 18 años hay un notable incremento de los valores de PA, más evidente en los varones. Estos cambios se deben al crecimiento y desarrollo, y los valores de normalidad deben valorarse además de con la edad y el sexo, con el tamaño corporal, en especial con la talla (ver Tabla 12)64, 65, 66. La hipertensión arterial es poco frecuente en la niñez. Se presenta en el 12% de los pacientes que consultan con pediatras. En la adolescencia la prevalencia puede acercarse al 10%, sobre todo si hay obesidad, y en la mayor parte de casos es de tipo esencial. Casi siempre que las elevaciones son leves se trata de casos de HTA esencial, pero cifras muy elevadas en niños pequeños casi siempre están vinculadas a causas secundarias. Entre las causas secundarias más importantes están: a) Neonatos y lactantes: • Trombosis de arteria renal tras canalización de la arteria umbilical; • Coartación de aorta; • Lesión renal congénita; • Estenosis de arteria renal; • Displasia broncopulmonar. b) Niños menores de 10 años: • Enfermedad renal; • Coartación de aorta; • Estenosis de arteria renal; • Hipercalcemia; • Hipertiroidismo; • Neurofibromatosis; • Tumores neurogénicos; • Feocromocitoma; • Aumento de actividad mineralocorticoide; • Transitoria transcirugía urológica; • Transitoria por tracción ortopédica. c) Adolescencia: • Nefropatías; • Ídem a niños menores de 10 años. Se recomienda la medición rutinaria de la PA desde los 3 años de edad. Se debe comenzar a monitorizar la PA antes de esa edad en caso de: 106 a) Prematurez; b) Bajo peso al nacer; c) Período neonatal mórbido con estancia en Unidad de Cuidados Intensivos; d) Patología cardíaca congénita renal o cardíaca. En general, la técnica de medición para tomar la PA en niños y adolescentes es similar a la de valoración de adultos. Algunas observaciones, sin embargo, deben agregarse: • Los aparatos de medición y los manguitos o brazaletes deben ser los apropiados para que la valoración de la PA sea correcta. • Debe descartarse específicamente coartación de aorta midiendo PA en miembros superiores e inferiores. • A diferencia que en el adulto o en el escolar, en que puede haber una diferencia de 10 y hasta 20 mmHg entre la PA medida en la arteria braquial y la arteria femoral, esta diferencia es prácticamente inexistente en menores de 2 años. • Es crucial la búsqueda de estigmas cutáneos, anomalías genitales, signos sugestivos de síndromes específicos hereditarias que pueden cursar on HTA o enfermedades Los valores de la PA en edad pediátrica y adolescencia deben mantenerse en su percentil usual a lo largo de todo el proceso de crecimiento y desarrollo. Considerando los lineamientos del Cuarto Reporte (año 2004) del Grupo de Trabajo a cargo del Control de la Presión Arterial en Pediatría (Programa Nacional de Educación en Hipertensión, USA)66, se define como HTA en estas edades a una PAS o PAD que se encuentra por arriba del percentil 95 (P95) para la edad, sexo y talla, en tres tomas diferentes, en reposo, separadas por algunos minutos, Si las cifras están entre los percentiles 90 y 95(PA90-95) se considerará al niño como “prehipertenso”, abandonándose el concepto de PA “normal alta”. Se distinguen estadios 1 (PA>P95 pero menos de 5 mmHg por arriba del P99) y 2 (PA> en más de 5 mmHg del P99) en la clasificación de la HTA infantil. Todo adolescente con PA igual o mayor de 120/80 mmHg será considerado prehipertenso independientemente de su percentil de PA. Se deberán hacer todos los esfuerzos posibles para definir si la HTA en un niño o adolescente tiene causa secundaria, para un tratamiento exitoso y a menudo curativo de su enfermedad. El tratamiento de la HTA en niños y adolescentes es esencialmente idéntico al de los adultos. Se da gran importancia a las medidas no farmacológicas, en especial a la restricción de sodio y al aumento de la actividad física. Todos los grupos farmacéuticos de antihipertensivos pueden ser empleados, pero el manejo de estos casos deberá estar siempre en manos de un pediatra. 107 TABLA 12. Importancia de la talla en los valores de PA en menores de 18 años de ambos sexos. PA (mm Hg) PA Sistólica PA Diastólica EDAD (años) 3 6 10 13 16 3 6 10 13 16 PERCENTIL TALLA SEXO MASCULINO P5 P95 104 113 109 117 114 123 121 130 129 138 63 67 72 76 77 82 79 84 83 87 PERCENTIL TALLA SEXO FEMENINO P5 P95 104 110 108 114 116 122 121 128 125 132 65 68 71 75 77 80 80 84 83 86 El objetivo final del tratamiento farmacológico de la HTA significativa y severa en niños y adolescentes es reducir la morbilidad renal y cardiovascular, para lo cual es necesario: a) Conseguir una reducción gradual de la PA hasta alcanzar valores inferiores al P90; b) Cobertura mantenida durante las 24 horas del día; c) Evitar efectos secundarios. Es fundamental que todo ello se logre sin limitar la actividad habitual. 108 BIBLIOGRAFÍA. 1. Messerli FH: Clinician’s Manual on Treatment of Hypertension. First Edition. Science Press, Hoboken, NJ, 2004 2. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure (JNC 7 Express). JAMA 2003;289:2560-2572 3. Giles TD: The new definition of hypertension. Program and abstracts of the 20th Annual Scientific Meeting of the American Society of Hypertension; May 14-18, 2005; San Francisco, California. Late-Breaking Clinical Trials. 4. 2007 Guidelines for the Management of Arterial Hypertension. The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Journal of Hypertension, 2007, 25: 11051187. 5. Consenso Latinoamericano sobre Hipertensión Arterial. Journal of Hypertension 2001, Vol. 6, No. 2. 6. The Sixth Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure (JNC-VI). Arch Inter Med 1997;157:2413-46 7. Julius S, Nesbitt SD, Egan BM, Weber MA, Michelson EL, Kaciroti N, Black HR, Grimm RH Jr, Messerli FH, Oparil S, Schork MA; Trial of Preventing Hypertension (TROPHY) Study Investigators. N Engl J Med. 2006 Apr 20; 354(16):1685-97. 8. Appel LJ, Moore TJ, Obarzanek E, Vollmer WM, Svetkey LP, Sacks FM, Bray GA, Vogt TM, Cutler JA, Windhauser MM, Lin PH, Karanja N. A clinical trial of the effects of dietary patterns on blood pressure. DASH Collaborative Research Group. N Engl J Med. 1997 Apr 17; 336(16):1117-24. 9. Yusuf S, Hawken S, Ounpuu S, on behalf of the INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 2004; 364:937-952. 10. The HOPE study investigators: Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med 2000; 342:145-53 11. PROGRESS Collaborative Group: Randomised trial of a perindopril-based blood-pressurelowering regimen among 6105 individuals with previous stroke or transient ischemic attack. Lancet 2001; 358:1033–41. 12. Fox KM: EURopean trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Lancet. 2003 Sep 6; 362(9386):782-8. 13. The ALLHAT Collaborative Research Group: The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT). JAMA. 2002; 288:2981-2997. 14. Lindon M.H. Wing, M.B., B.S., Christopher M. Reid, Ph.D., Philip Ryan, M.B., B.S., Lawrence J. Beilin, M.D. ,Mark A. Brown, M.B., B.S., M.D., Garry L.R. Jennings, M.D., Colin I. Johnston, M.B., B.S., John J. McNeil, M.B., B.S.,Graham J. Macdonald, M.D., John E. Marley, M.D., M.B., Ch.B., Trefor O. Morgan, M.B., B.S. ,and Malcolm J. West, M.B., B.S., for the Second Australian National Blood Pressure Study Group: A Comparison of Outcomes with Angiotensin-Converting–Enzyme Inhibitors and Diuretics for Hypertension in the Elderly. N Engl J Med 348; 7. 15. Dahlöf B, Devereux RB, Kjeldsen S, et al, for the LIFE study group. Cardiovascular morbidity and mortality in the Losartan Intervention for Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol. Lancet 2002; 359: 995–1003. 16. Dahlof B, Sever PS, Poulter NR, Wedel H, Beevers DG, Caulfield M, Collins R, Kjeldsen SE, Kristinsson A, McInnes GT, Mehlsen J, Nieminen M, O'Brien E, Ostergren J; ASCOT Investigators.Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet. 2005 Sep 10-16; 366(9489):895-906. 17. Chinese Cardiac Study Collaborative Group: Oral captopril versus placebo among 13 634 patients with suspected acute myocardial infarction: interim report from the Chinese Cardiac Study (CCS-1). Lancet 1995; 345:686-7. 109 18. Cleland JGF, Erhardt L, Murray G, Hall AS, Ball SG: death among survivors of acute myocardial infarction with clinical evidence of heart failure. A report from the AIRE study investigators. Eur Heart J 1997; 18:41-51. 19. Rutherford JD, Pfeffer MA, Moyé LA, Davis BR, Flaker GC, Kowey PR, Lamas GA, Miller HS, Packer M, Rouleau JL, Braunwald E: Effects of captopril on ischemic events after myocardial infarction. Results of the Survival and Ventricular Enlargement Trial. Circulation 1994; 90:1731-8. 20. Torp-Pedersen C, Køber L, Carlsen J: Angiotensin-converting enzyme inhibition after myocardial infarction: the Trandolapril Cardiac Evaluation study. Am Heart J 1996; 132:235-43. 21. The CONSENSUS trial study group: Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987; 316:1429-35. 22. The SOLVD investigators: Studies of left ventricular dysfunction (SOLVD) - rationale, design and methods: two trials that evaluate the effect of enalapril in patients with reduced ejection fraction. Am J Cardiol 1990; 66:315-22. 23. Ambrosioni E, Borghi C, Magnani B: The effect of the angiotensin-converting-enzyme inhibitor zofenopril on mortality and morbidity after anterior myocardial infarction. N Engl J Med 1995; 332:80-5. 24. PEP-CHF results presented by J.G.F. Cleland, in the European Society of Cardiology Scientific Congress, September 2006. 25. Packer M, Bristow MR, Cohn JN, Colucci WS, Fowler MB, Gilbert EM, Shusterman NH: The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. N Engl J Med. 1996 May 23;334(21):1349-55 26. Packer M, Coats AJS, Fowler MB, Katus HA, Krum H, Mohacsi P, Rouleau JL, Tendera M, Castaigne A, Roecker EB, Schultz MK, DeMets DL: Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med 2001; 344:1651 – 8. 27. CIBIS-II Investigators and Committees: The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Circulation 1999; 100 Suppl I:I-297. 28. Willenheimer R, van Veldhuisen DJ, Silke B et al. Effect on survival and hospitalization of initiating treatment for chronic heart failure with bisoprolol followed by enalapril, as compared with the opposite sequence. Results of the Randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation 2005; 112:2426-35. 29. Hjalmarson Å, Goldstein S, Fagerberg B, Wedel H, Waagstein F, Kjekshus J, Wikstrand J, Allaf DE, Víctovec J, Aldershvile J, Halinen M, Dietz R, Neuhaus KL, Jánosi A, Thorgeirsson C, Dunselman PHJM, Gullestad L, Kuch J, Herlitz J, Rickenbacher P, Ball S, Gottlieb S, Deedwania P: Effects of controlled-release metoprolol on total mortality, hospitalizations, and well-being in patients with heart failure. The Metoprolol CR/XL Randomized International Trial in congestive heart failure (MERIT-HF). JAMA 2000; 283:1295–302. 30. Flather M, Shibata M, Coats A, Van Veldhuisen D, Parkhomenko A, Borbola J, Cohen-Solal A, Dumitrascu D, Ferrari R, Lechat P, Soler-Soler J, Tavazzi L, Spinarova L, Toman J, Böhm M, Anker S, Thompson S, Poole-Wilson P. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005; 26:215–225. 31. Pitt B: ACE inhibitor co-therapy in patients with heart failure: rationale for the Randomized Aldactone Evaluation Study (RALES). Rev Med Liege 1999; 54:770-2. 32. Pitt B, Poole-Wilson P, Segal R, Martinez FA, Dickstein K, Camm AJ, Konstam MA, Riegger G, Klinger GH, Neaton J, Sharma D, Thiyagarajan B: Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomised trial - the Losartan Heart Failure Survival Study ELITE II. Lancet 2000; 355:1582-7. 33. Cohn JN, Tognoni G: A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med 2001; 345:1667–75. 34. McMurray JJ, Pfeffer MA, Swedberg K, Granger CB, Yusuf S: The CHARM programme. Lancet. 2003 Nov 15; 362(9396):1679. 35. Carson P, Massie BM, McKelvie R, et al; for the I-PRESERVE Investigators. The irbesartan in heart failure with preserved systolic function (I-PRESERVE) trial: rationale and design. J Card Fail. 2005; 11:576-585. 36. Kenneth Dickstein, John Kjekshus and the OPTIMAAL Steering Committee, for the OPTIMAAL Study Group: Effects of losartan and captopril on mortality and morbidity in 110 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. 47. 48. 49. 50. 51. 52. 53. 54. high-risk patients after acute myocardial infarction: the OPTIMAAL randomised trial. Lancet, Published online September 1, 2002. N Engl J Med. 2003 Nov 13; 349(20):1893-906. Braunwald E, Domanski MJ, Fowler SE, Geller NL, Gersh BJ, Hsia J, Pfeffer MA, Rice MM, Rosenberg YD, Rouleau JL; PEACE Trial Investigators. Angiotensin-converting-enzyme inhibition in stable coronary artery disease. N Engl J Med. 2004 Nov 11; 351(20):2058-68. Poole-Wilson PA, Lubsen J, Kirwan B-A, et al, on behalf of the ACTION (A Coronary disease Trial Investigating Outcome with Nifedipine gastrointestinal therapeutic system) investigators. Effect of long-acting nifedipine on mortality and cardiovascular morbidity in patients with stable angina requiring treatment (ACTION trial): randomised controlled trial. Lancet. 2004; 364:849-857. Hansson L, Zanchetti A, Carruthers SG, Dahlöf B, Elmfeldt D, Julius S, Ménard J, Rahn KH, Wedel H, Westerling S: Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. Lancet 1998; 351:1755-62. The Atherosclerosis Risk in Communities (ARIC) Study: design and objectives. The ARIC investigators. Am J Epidemiol. 1989 Apr; 129(4):687-702. Lithell H, Hansson L, Skoog I, Elmfeldt D, Hofman A, Olofsson B, Trenkwalder P, Zanchetti A; SCOPE Study Group. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial. J Hypertens. 2003 May; 21(5):875-86. Carl J. Pepine, MD; Eileen M. Handberg, PhD; Rhonda M. Cooper-DeHoff, PharmD; Ronald G. Marks, PhD; Peter Kowey, MD; Franz H. Messerli, MD; Giuseppe Mancia, MD; José L. Cangiano, MD; David Garcia-Barreto, MD; Matyas Keltai, MD; Serap Erdine, MD; Heather A. Bristol, MS; H. Robert Kolb, RN; George L. Bakris, MD; Jerome D. Cohen, MD; William W. Parmley, MD; for the INVEST Investigators: The International VerapamilTrandolapril Study (INVEST): A Randomized Controlled Trial. JAMA. 2003; 290:2805-2816. Lancet. 2004; 363:2010-2011, 2022-2031. DREAM investigators. Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomised controlled trial. Lancet 2006; DOI: 10.1016/S0140-6736(06)69420-8. Agodoa LY et al. The African American Study of Kidney Disease and Hypertension (AASK). JAMA 2001; 285:2719-2728. Brenner B, Cooper M, de Zeeuw D, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345: 861– 69. Lewis EJ, Hunsicker LG, Clark WR et al: Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345:851-60. Parving H-H, Lehnert H, Bröchner-Mortensen J, et al: The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med 2001; 345: 870-878. Ruggenenti P, et al. The BErgamo NEphrologic DIabetic Complications Trial (BENEDICT). N Engl J Med 2004; 351: 1941-51. Barnett A, et al. Comparison of Angiotensin-II receptor blocker and angiotensin-converting enzyme inhibition in subjects with type 2 diabetes and nephropathy. N Engl J Med 2004; 351: 12-20. Schrader J, Luders S, Kulschewski A, Berger J, Zidek W, Treib J, Einhaupl K, Diener HC, Dominiak P; Acute Candesartan Cilexetil Therapy in Stroke Survivors Study Group. Stroke. 2003 Jul; 34(7):1699-703. Staessen JA, Fagard R, Thijs L, Celis H, Arabidze G, Birkenhäger WH, Bulpitt CJ, de Leeuw PW, Dollery CT, Fletcher AE, Forette F, Leonetti G, Nachev C, O'Brien ET, Rosenfeld J, Rodicio JL, Tuomilehto J, Zanchetti A, for the Systolic Hypertension in Europe (Syst-Eur) Trial Investigators: Randomised double-blind comparison of placebo and active treatment for older patients with isolated systolic hypertension. Lancet 1997, 350:757-764. Gosse P, Sheridan DJ, Zannad F, et al. Regression of Left ventricular hypertrophy in hypertensive patients treated with Indapamide SR 1.5 mg Versus Enalapril 20 mg: the LIVE study. J Hypertens. 2000; 18:1465-1475. 111 55. Lindholm LH, Carlberg B, and Samuelsson O. Should blockers remain first choice in the treatment of primary hypertension? A meta-analysis. Lancet 2005; 366(9496):1545-1553. 56. Messerli FH, Grossman E, Goldbourt U. Are -blockers efficacious as first-line therapy for hypertension in the elderly? JAMA 1998; 279:1903-1907. 57. Pitt B, Byington RP, Rurberg CD, et al. Effect of amlodipine on the progression of atherosclerosis and occurrence of clinical events. Circulation 2000; 102:1503-10. 58. Nissen SE, Tuzcu EM, Libby P, et al. Effect of antihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure. The CAMELOT study: a randomized controlled trial. JAMA 2004; 292: 2217-2226. 59. Mogensen CE, Neldam S, Tikkanen I, Oren S, Viskoper R, Watts RW, and Cooper ME, for the CALM study group. BMJ. 2000 December 9; 321(7274): 1440–1444. 60. Am Heart J 2004; 148:52–61. 61. Villarroel, H: Urgencias hipertensivas: Empirismo contra evidencia en la práctica general”. RASC 2003; 1; 1:11-16. 62. Witlin AG, Sibai BM. Hypertensive diseases in pregnancy. En: Reece EA, Hobbins JC. Medicine of the fetus and mother. Second edition. Filadelfia: Lippincott-Raven Publishers; 1999.p.997-1020. 63. Dekker J, Sibai BM. Primary, secundary and tertiary prevention of preeclamsia. Lancet. 2001;357:209-15 64. Kumazawa MR: Hipertensión arterial en el niño. En Hipertensión Arterial en la Clínica, Capítulo 11. Universidad de Guadalajara. Centro Universitario de Ciencias de la Salud. 65. Lemos KE et al: Hipertensión arterial esencial en niños y adolescentes: factores de riesgo y características. Revista de Postgrado de la VIa Cátedra de Medicina - N° 164 – Diciembre 2006. Págs. 20-22. 66. The Fourth Report on the Diagnosis, Evaluation and Treatment of High Blood Pressure In Children and Adolescents. U.S. DEPARTMENT OF HEALTH AND HUMAN SERVICES. National Institutes of Health National Heart, Lung, and Blood Institute. NIH Publication No. 05-5267. Originally printed September 1996 (96-3790). Revised May 2005 112 Este libro se terminó de imprimir en Impresos Litográficos, San Salvador, El Salvador. El tiraje consta de 1,000 ejemplares. 113