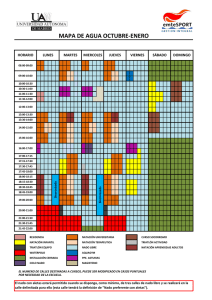
UNIVERSIDAD VERACRUZANA FACULTAD DE QUÍMICA
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE QUÍMICA FARMACÉUTICA BIOLÓGICA CAMPUS XALAPA Efecto del extracto acuoso de Montanoa grandiflora sobre la desesperanza conductual en la rata Wistar forzada a nadar: Comparación con fluoxetina TESIS Que para acreditar la Experiencia Recepcional de la Carrera de Químico Farmacéutico Biólogo PRESENTA: Gilberto Uriel Rosas Sánchez DIRECTOR DE TESIS: Dr. Juan Francisco Rodríguez-Landa Instituto de Neuroetología y Facultad de Química Farmacéutica Biológica Universidad Veracruzana. CODIRECTOR: Dr. Jonathan Cueto Escobedo Instituto de Neuroetología, Universidad Veracruzana. Xalapa, Veracruz Enero, 2015 2 El presente trabajo se realizó bajo la dirección del Dr. Juan Francisco Rodríguez Landa y la co-dirección del Dr. Jonathan Cueto Escobedo en el Instituto de Neuroetología y la Facultad de Química Farmacéutica Biológica de la Universidad Veracruzana, en la Ciudad de Xalapa, Veracruz. México. 3 AGRADECIMIENTOS A Dios Por darme la oportunidad de vivir todas estas experiencias, por darme fuerza, guiarme y bendecirme en todo momento, rodeándome de las personas que quiero y confían en mí. A mis padres Por apoyarme incondicionalmente en todos los proyectos que a lo largo de mi vida he realizado, pero sobre todo por darme su amor y comprensión. Esto es el fruto de su esfuerzo pero tengan por seguro que es el inicio de mucho más. Gracias mamá por ser mi confidente, compañera y la mejor de las amigas; Gracias papá por brindarme tu apoyo, fuerza y perseverancia. Los amo. A mis maestros Especialmente al Dr. Juan Francisco Rodríguez Landa y el Dr. Jonathan Cueto Escobedo por permitirme trabajar a su lado; por todo el apoyo académico recibido a lo largo de mi carrera profesional, por enseñarme a madurar y afianzar la confianza en mí, pero sobre todo por brindarme su amistad incondicional. A mis hermanos Por apoyarme en todo momento, por confiar en mí y hacerme especial dentro de nuestra familia. A mis amigos Por estar siempre presentes en todo momento, demostrarme su cariño y comprensión, además de ser parte de mi familia y brindarme su apoyo en los momentos más difíciles. 4 ÍNDICE Resumen .............................................................................................................. 6 Introducción.......................................................................................................... 7 Antecedentes ...................................................................................................... 10 Generalidades de Cihuapatli ................................................................................................. 10 El estrés como desencadenante de alteraciones emocionales .............................................. 12 El estudio experimental del estrés ......................................................................................... 13 Neurobiología de la depresión ............................................................................................... 15 Tratamientos farmacológicos de la depresión........................................................................ 17 Fitoterapia en la depresión .................................................................................................... 18 El nado forzado para el estudio de la “depresión experimental”............................................. 19 Otros modelos experimentales de depresión ......................................................................... 21 Planteamiento del problema .................................................................................. 23 Hipótesis ............................................................................................................ 24 Objetivo general .................................................................................................. 24 Objetivos específicos ........................................................................................... 24 Material y Métodos ............................................................................................... 25 Ética ...................................................................................................................................... 25 Sujetos .................................................................................................................................. 25 Grupos experimentales ......................................................................................................... 25 Preparación del extracto acuoso de Montanoa grandiflora .................................................... 26 Prueba de campo abierto ...................................................................................................... 27 Prueba de nado forzado ........................................................................................................ 28 Análisis estadístico ................................................................................................................ 29 Diagrama de trabajo .............................................................................................................. 30 Resultados.......................................................................................................... 31 Campo abierto ....................................................................................................................... 31 Prueba de nado forzado ........................................................................................................ 37 Discusión ........................................................................................................... 41 Conclusión ......................................................................................................... 49 Prospectivas ....................................................................................................... 49 Referencias ......................................................................................................... 50 5 Resumen Introducción: El extracto acuoso de Montanoa grandiflora (Familia: Asterácea) y de otras especies del mismo género, se ha usado por siglos en la medicina tradicional mexicana como remedio para diversas enfermedades, incluyendo las del estado de ánimo y emocional. M. grandiflora produce efectos tipo ansiolíticos en ratas evaluadas en el laberinto de brazos elevados mediante acciones que se establecen sobre el receptor GABAA. Algunos compuestos GABAérgicos, además de producir efectos ansiolíticos, también producen efectos anti-desesperanza en la prueba de nado forzado. No obstante, se desconoce si el extracto de esta planta también ejerce efectos antidesesperanza a nivel experimental. El objetivo del presente trabajo fue determinar si el extracto acuoso de M. grandiflora produce efectos anti-desesperanza en la prueba de nado forzado, lo cual fue comparado con el antidepresivo fluoxetina, como control positivo de actividad anti-desesperanza en la rata. Material y métodos: Se utilizaron 40 ratas macho Wistar, distribuidas en cuatro grupos: Control, que recibió el vehículo (1 ml/Kg); dos grupos M. grandiflora, que recibieron 25 y 50 mg/kg del extracto acuoso, respectivamente, y un último grupo Fluoxetina, que recibió 1 mg/kg del fármaco. Los tratamientos fueron administrados por vía oral durante 28 días consecutivos, el efecto fue evaluado en los días 0, 1, 7, 14, 21 y 28 de tratamiento en las prueba de campo abierto y nado forzado. Adicionalmente, se evaluó el efecto del post-tratamiento 24 y 48 horas después de la última administración. Los datos fueron analizados mediante ANOVA de dos vías y la prueba post hoc de Stdent Newman Keuls. Resultados: El extracto de M. grandiflora (50 mg/kg) disminuyó significativamente (p<0.05) la inmovilidad desde el día 1 y se mantuvo así hasta el día 28 de tratamiento, respecto al grupo control; efecto que desapareció al suspender el tratamiento. La administración de fluoxetina redujo significativamente la inmovilidad a partir del día 14 y se mantuvo hasta el día 28 de tratamiento y aún hasta las 48 horas post-tratamiento. En cuanto a la latencia a la primera inmovilidad sólo fluoxetina aumentó significativamente (p< 0.05) esta variable durante el tratamiento y permaneció hasta las 48 horas post-tratamiento. En campo abierto, independientemente del tratamiento, hubo una reducción de la locomoción a partir del día 14; mientras que el acicalamiento disminuyó a partir del día 7 en el grupo control, pero se mantuvo en los grupos M. grandiflora (50 mg/kg) y fluoxetina a lo largo del tratamiento. En cuanto a la conducta vertical no se encontraron diferencias significativas a lo largo del estudio. El extracto de M. grandiflora de 25 mg/kg careció de efectos en las variables evaluadas. Conclusión: El extracto acuoso de M. grandiflora (50 mg/kg) no ejerce un efecto anti-desesperanza a nivel experimental, como lo produjo el antidepresivo fluoxetina; sino que parece ejercer un efecto protector contra el estrés generado por el nado forzado. Lo anterior apoya los efectos ansiolíticos de M. grandiflora descritos previamente, pero bajo nuestras condiciones experimentales no soportan un efecto antidepresivo como se le ha atribuido popularmente en la medicina tradicional mexicana. 6 Introducción El estrés es una respuesta adaptativa del organismo que le permite mantener el equilibrio homeostático y asegurar su supervivencia con base en experiencias previas, predisposición biológica y el estado funcional previo del organismo (McEwen, 2005). Por lo tanto, el estrés es necesario para que se produzcan reacciones normales y adaptativas en el organismo; sin embargo, el estrés puede producir efectos perjudiciales cuando la exposición al agente estresante es excesiva, repetitiva y constante en el tiempo. La permanencia de los mecanismos adaptativos ante un estresor, produce un desgaste fisiológico en el organismo que transforma el mecanismo protector de ajuste transitorio en otro con un alto poder patogénico que con frecuencia se asocia con el inicio de trastornos emocionales como la ansiedad y afectivos como la depresión, separados o en comorbilidad (Contreras et al., 2003). La depresión es un trastorno afectivo que fue identificado por diferentes culturas desde tiempos remotos, incluyendo a los primeros pobladores del altiplano mexicano (Marván et al., 1988; Rodríguez-Landa et al., 2007). Actualmente, se considera una enfermedad psiquiátrica descrita en el Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-IV-R) como un trastorno del estado de ánimo (American Psychiatric Association, 2000). Su prevalencia e incidencia tiene un marcado dimorfismo sexual, se estima que en la población general se observa del 10 al 25 % en mujeres y entre el 5 y 12% en hombres, este dimorfismo parece estar asociado con los efectos de hormonas gonadales femeninas como la progesterona y su metabolito alopregnanolona (Majewska, 1992; Estrada-Camarena et al., 2003; Rodríguez-Landa et al., 2007; Uriarte-Bonilla, 2009). La depresión tiene como síntoma central a la anhedonia o incapacidad para experimentar placer, pero también se desarrollan alteraciones del apetito, del peso corporal, trastornos del sueño y de la eficiencia psicomotriz. Todo ello acompañado de la disminución de la autoestima, sentimientos de culpa e ideas de muerte que conllevan el riesgo de suicidio (American Psychiatric Association, 2000; Gutiérrez-García et al., 2006). Para el estudio de la depresión a nivel preclínico (desesperanza animal), se han desarrollado los modelos que se basan en la inducción de desesperanza, entendida como aquella pauta conductual en la que los animales abandonan cualquier intento de 7 lucha y escape para resolver una situación que les resulta aversiva. El nado forzado es una de las pruebas inductoras de desesperanza más utilizada, la cual consiste en colocar a una rata o ratón en un estanque con agua donde no tiene la posibilidad de escapar (Porsolt et al., 1977, 1978). Esta prueba ha permitido evaluar el efecto de sustancias con potencial antidepresivo, los cuales aumentan la latencia a la primera inmovilidad y reducen el tiempo total de inmovilidad en la prueba de nado forzado. Estos efectos antidesesperanza se relacionan con el incremento de diferentes aminas circulantes en el Sistema Nervioso Central (SNC), de manera semejante a como ocurre en la clínica con el tratamiento antidepresivo (Schatzberg y Nemeroff, 2006). A pesar del amplio espectro de fármacos antidepresivos y sus beneficios, todos ellos tienen un índice de efectividad cercano al 60 %; además, alcanzar el efecto terapéutico requiere varios días de tratamiento. Aunado a esto, durante el tratamiento se presentan múltiples efectos secundarios, que ocasionan que los pacientes lo abandonen (Gourion, 2008 y Vanelli y Coca-Perraillon, 2008). Por esta razón y otras, los pacientes emplean remedios de origen natural como tratamiento alternativo. La organización mundial de la salud reporta que cerca del 75 % de la población mundial utiliza remedios naturales para el cuidado de la salud. Plantas como, Plantago asiática, Passiflora incarnata y Tagetes lucida, se han empleado como remedio para padecimientos nerviosos (Linares et al., 1986), por otro lado, la hierba de San Juan (Hypericum perforatum) ha sido utilizada para tratar los trastornos del estado de ánimo (De la Cruz-Badiano, 1522), y actualmente están disponibles en el mercado algunos fitomedicamentos a base del extracto estandarizado de esta planta (Remotiv® e Hiperikan®), utilizados por la población. Estudios experimentales empleando extractos de Hypericum perforatum, han identificado sus efectos anti-desesperanza, al aumentar la latencia y reducir el tiempo total de inmovilidad en la prueba de nado forzado (Rodríguez-Landa y Contreras, 2000; Lozano-Hernández et al., 2010), lo cual es dependiente del tiempo de tratamiento: se requiere de al menos dos semanas de administración para detectar el efecto esperado. Además de las especies antes mencionadas, Montanoa grandiflora (Familia: Asterácea) y otras especies del mismo género (Montanoa tomentosa y Montanoa frutescens), se han usado por siglos en la medicina tradicional mexicana como remedio para tratar diversos trastornos del sistema nervioso (de la Cruz-Badiano, 1522; Levine 8 et al., 1981; Gallegos, 1985). Los extractos acuosos de M. frutescens y M. grandiflora producen efectos tipo ansiolíticos en la rata por acciones que se establecen sobre los receptores GABAA (Carro-Juárez et al., 2012; Rodríguez-Landa et al., 2014). Sin embargo, el efecto antidesesperanza durante un tratamiento prolongado en la prueba de nado forzado no se ha explorado a fondo. Es por ello que en el presente trabajo se evaluó el extracto acuoso de M. grandiflora sobre los indicadores de desesperanza conductual en la prueba de nado forzado, comparando el efecto con el antidepresivo fluoxetina; ya que como se ha reportado, ciertos compuestos como el valproato de sodio y neuroesteroides como progesterona y su metabolito alopregnanolona, que actúan sobre el receptor GABAA, ejercen efectos parecidos al de los antidepresivos en la prueba de nado forzado (Fernández-Teurel et al., 1989; Rall y Schleifer, 1991; Rodríguez-Landa et al., 2007). De esta manera se podrá apoyar o refutar el efecto antidepresivo atribuido a esta planta en la medicina tradicional mexicana. 9 Antecedentes Generalidades de Cihuapatli Montanoa tomentosa, Montanoa frutescens y Montanoa grandiflora son un grupo de plantas que pertenecen a la familia Asterácea y a las cuales se les conoce con el nombre de origen náhuatl Zoapatle o cihuapatli (Ximenez, 1615). Montanoa grandiflora crece en laderas de los cerros y barrancas como un arbusto de dos o más metros de alto. Sus hojas son grandes de color verde, tiene sus flores dispuestas en cabezuelas parecidas a un racimo, las flores del centro son tubulares y blancas o color crema. Generalmente crecen durante agosto y septiembre. Los frutos son secos de una semilla comprimida (IBUNAM, 2011). La planta es originaria de México, habita en climas semicálidos y templados, entre los 1240 y hasta los 3900 metros sobre el nivel del mar. Es un arbusto asociado a matorral xerófilo, pastizal inducido, bosques de encino, de pino, mixto de encino-pino y bosque de juníperos y es posible localizarla en varios estados del centro del país como: Estado de México, Hidalgo, Michoacán, Morelos, Puebla, Tlaxcala, Distrito Federal y, al sur, en Oaxaca (IBUNAM, 2011). El extracto acuoso de esta planta ha sido utilizado por siglos en la medicina tradicional mexicana como un remedio para problemas reproductivos y trastornos del estado emocional y del ánimo (Ximenez, 1615; Levine et al., 1981; Gallegos, 1985). Las primeras descripciones acerca del uso del extracto de Montanoa como remedio tradicional se mencionan en el Códice Badiano (Libellus de Medicinalibus Indorum Herbis) escrito en 1522, en el cual se describen las características botánicas, recetas tradicionales y prescripciones para su uso (de la Cruz-Badiano, 1522). La medicina tradicional mexicana menciona que el extracto de cihuapatli era usado como un agente anticonceptivo durante las primeras etapas de embarazo (de la Cruz-Badiano, 1522; Ximenez, 1615; Hahn et al., 1981; Levine et al., 1981; Gallegos, 1983; Ponce-Monter et al., 1983) y para inducir contracciones rítmicas uterinas durante el parto. Además, también eran utilizados para el tratamiento de desórdenes del estado de ánimo y el sistema nervioso, donde se menciona que: “cihuapatli resuelve los cambios de humor y los nervios en una forma admirable” (Ximenez, 1615). 10 El extracto crudo acuoso con M. tomentosa es utilizado por la mayoría de las personas con el fin de obtener el efecto medicinal, pero también se pueden preparar extractos con la mezcla de M. frutescens y M. grandiflora (Estrada et al., 1983). Los estudios experimentales han confirmado que el extracto acuoso de M. grandiflora o sus fracciones purificadas poseen efectos anticonceptivos (Hahn et al., 1981), sin influir en el estado endocrino (Gallegos, 1985); al parecer sin modificar parámetros hematológicos, concentración de lípidos en sangre, estado electrolítico o la función del hígado, riñón y glándula tiroides (Hahn et al, 1981); lo cual también ocurre con las otras plantas del mismo género. Los estudios anteriores han corroborado sistemáticamente el uso tradicional de cihuapatli en problemas reproductivos y sexuales, sin embargo, los efectos sobre el estado emocional y del ánimo, aún no han sido ampliamente explorados. En un trabajo previo (Carro-Juárez et al., 2012), se evaluó el efecto ansiolítico de varias dosis (25, 50 y 75 mg/Kg) del extracto de M. frutescens y se comparó con el efecto producido por varias dosis de diazepam (1, 2 y 4 mg/Kg) en el laberinto de brazos elevados, un modelo experimental validado para el estudio de sustancias con potenciales acciones ansiolíticas a nivel clínico y experimental (Griebel et al., 1996; Varty et al., 2002). Por otra parte se observó que el extracto de M. frutescens y M. grandiflora produce efectos afrodisiacos y sobre la eyaculación en ratas (Carro-Juárez et al., 2004), ya que promueve la motivación y el rendimiento sexual mediante acciones similares a las que ejerce la oxitocina (Carro-Juárez et al., 2012). Recientemente, se ha evaluado el efecto de M. frutescens y M. grandiflora sobre la ansiedad durante la fase del ciclo ovárico, los resultados indican que los extractos de M. frutescens y M. grandiflora poseen efectos ansiolíticos que dependen de la fase del ciclo ovárico (Rodríguez-landa et al., 2014), lo que sustenta al menos parcialmente el uso que se le da en la medicina tradicional mexicana como un ansiolítico natural. Adicionalmente y considerando que el receptor GABAA es el sitio de acción de la mayoría de las sustancias con actividad ansiolítica (Trincavelli et al., 2012), se exploró la participación de este receptor en el efecto de las Montanoas y se encontró que el efecto de la planta es modulado por el receptor GABAA (Carro-Juárez et al., 2012). Por lo anterior, es posible que el extracto de estas plantas pueda prevenir los efectos deletéreos del estrés 11 y en consecuencia impida el desarrollo de estados de desesperanza en el nado forzado; una hipótesis que se ha puesto a prueba en el presente estudio. El estrés como desencadenante de alteraciones emocionales Las emociones se generan en respuesta a estímulos biológicamente relevantes para la supervivencia y la salud del individuo, se componen de reacciones de alertamiento, cambios vegetativos, músculo esqueléticos y sensaciones subjetivas (Critcley, 2003). Los procesos emocionales son cruciales para la supervivencia de los individuos, pero cuando la intensidad y relevancia del estímulo rebasa la capacidad del organismo para hacerle frente, producen un desequilibrio emocional que es la principal causa del inicio de una amplia gama de desórdenes psiquiátricos (Dolan, 2002). El estrés se define como una tensión que ocurre en los organismos en respuesta a estímulos provenientes del medio ambiente, dichas fuerzas medioambientales son conocidas como estímulos o factores estresantes (McEwen, 2005). Los efectos del estrés dependen de la percepción que cada individuo tiene sobre los estresores, su capacidad para afrontar al estresor y el uso de estrategias de afrontamiento por parte del individuo. La presencia de un estresor produce inmediatamente la activación del sistema nervioso vegetativo (glándulas suprarrenales, sistema cardiovascular, respiratorio y metabólico) y ciertos procesos iniciados en el SNC a través de las estructuras cerebrales que constituyen el eje hipotálamo-hipófisis-adrenal (Mercier, 2003), con la participación de estructuras cerebrales relacionadas con las emociones como son la amígdala, el hipocampo, el septum, la corteza prefrontal y las porciones altas del tallo cerebral entre otras, que forman el circuito neuronal que es parte del sistema emocional (figura 1). 12 Figura 1. Estructuras cerebrales que conforman el sistema emocional anteriormente llamado sistema límbico (Tomado de Roxo et al., 2011). El estrés es necesario para desencadenar una serie de reacciones en el individuo y principalmente en las estructuras relacionadas con el procesamiento emocional, que en conjunto propician el afrontamiento de una situación que pone en riesgo la vida del individuo; sin embargo, el estrés puede llegar a tener un efecto perjudicial cuando es constante y rebasa la capacidad del individuo para realizar los ajustes de afrontamiento (Ladewig, 2000; McEwen, 2005). Si la exposición al agente estresante es excesiva, repetitiva y prolongada en el tiempo, la permanencia de los mecanismos adaptativos, transforma un mecanismo protector de ajuste transitorio en otro con potencial patogénico que conlleva a trastornos emocionales y afectivos como la ansiedad y la depresión, respectivamente (Contreras, 2003). El estudio experimental del estrés El término estrés fue tomado del latín (stringere: tensar o estirar) y utilizado en el idioma inglés (strain: tensión), para describir la adversidad y la dificultad (Moscoso, 13 1998). A finales del siglo XIX, el fisiólogo francés Claude Bernard observó que los organismos poseen un mecanismo de autorregulación que mantiene estable el medio interno ante las presiones del medio externo (Johnson et al., 1992). Más adelante, el endocrinólogo Hans Selye definió al estrés como una respuesta vegetativa inespecífica a alguna amenaza, englobada en el concepto de Síndrome General de Adaptación ante estímulos nocivos, definido como una compleja respuesta fisiológica caracterizada por tres fases: 1) fase de alarma: reacción inicial del cuerpo ante un estímulo estresante, lo que tiende a restaurar la homeostasis; 2) fase de resistencia, donde la adaptación es sostenida, óptima y permite el desarrollo de una estrategia de supervivencia y 3) fase de agotamiento o cese de la respuesta de adaptación, la cual conduce a la enfermedad y eventualmente a la muerte (Hans Selye, 1936). Entre los desórdenes del síndrome general de adaptación asociados a patologías se encuentran los siguientes: el exceso o deficiencia absoluta en la cantidad de hormonas (por ejemplo los corticoesteroides como la Hormona Adrenocorticotropina (ACTH) y Hormona Estimulante de la Tiroides (TSH) las cuales son producidas durante la respuesta de estrés, además de una desregulación metabólica ocasionada por el estrés que altera la función de diferentes órganos como el hígado, el SNC y el riñón, los cuales pueden responder anormalmente y convertirse en causa de enfermedad durante la adaptación al estrés (Hans Selye, 1955). El estrés incontrolado es un factor que predispone a la aparición de ansiedad y depresión. Para su estudio diversos modelos animales emplean estresores físicos, como los choques eléctricos en las patas o la inmovilización, entre otros, para desencadenar alteraciones conductuales en los animales que semejan alguno de los síntomas de la ansiedad y la depresión en los seres humanos (Seligman, 1967; Funada y Hara, 2001; DeVries et al., 2003; Rygula et al., 2005). Estos modelos son útiles para conocer las bases neurobiológicas que subyacen al estrés, la ansiedad y depresión, sus consecuencias y determinar las acciones de los distintos fármacos empleados en el tratamiento clínico. Las ratas o ratones que son sometidos a estrés físico por largo tiempo, disminuyen la actividad exploratoria, indicando una pérdida de interés hacia nuevas situaciones medioambientales (Katz et al., 1981), aumentan la inmovilidad en la 14 prueba de nado forzado, sugiriendo así una disminución de la motivación por resolver una situación de apremio (Porsolt et al., 1978) y reducen el consumo de agua azucarada, un indicador de anhedonia (incapacidad o desinterés para expresar placer) en roedores (Moreau, 1997); un efecto que es revertido con la administración de antidepresivos tricíclicos como la imipramina (Duncan et al., 1993). Estos hallazgos muestran la utilidad de los modelos animales para el estudio de las respuestas al estrés, la ansiedad y la depresión, así como de sustancias que puedan contrarrestarlas. Neurobiología de la depresión Múltiples estudios en el ser humano y en animales de experimentación han tratado de establecer las causas neurobiológicas de la depresión y el mecanismo de acción de las terapias antidepresivas. Sin embargo, sólo se ha logrado una comprensión parcial de la fisiopatología de la depresión, en la que se involucran alteraciones en el funcionamiento de sistemas neuroanatómicos, bioquímicos, neuroendócrinos (tabla 1) y fisiológicos (Contreras et al., 2002, Páez et al., 2003). En la actualidad, algunas teorías que tratan de explicar la etiología de la depresión, además de incluir las alteraciones en los sistemas de neurotransmisión, también consideran los cambios en las concentraciones de neuroesteroides en el SNC, la disfunción inmunitaria y endocrina, que en conjunto modifican las cascadas de señalización intracelular y la regulación de la expresión génica (Páez et al., 2003). En algunos pacientes con depresión existe una disminución de la concentración de neurotransmisores como serotonina, noradrenalina, dopamina y el ácido γ-amino butírico en el líquido cefalorraquídeo y en plasma, además de algunas hormonas como la progesterona y su metabolito α-reducido alopregnanolona (Contreras et al., 2003). En este sentido, la baja concentración plasmática de hormonas esteroidales que se presenta durante el síndrome premenstrual, el posparto, el climaterio y la menopausia se relaciona con estados de irritabilidad, ansiedad y depresión (Dubrovsky, 2005; Rodríguez-Landa y Contreras, 2006). Desde otro punto de vista, la depresión también puede desencadenarse por factores ambientales y socioculturales que son estresantes 15 para el individuo (Van Praag, 2004). En ambos casos, el uso de terapias farmacológicas ayuda al control de la depresión. Tabla 1. Principales alteraciones neuroquímicas, neuroanatómicas y bioquímicas asociadas a la depresión. Sistema Alteraciones Neuroanatómicos Reducción del número de células gliales en la corteza prefrontal (Ongur et al., 1998). Disminución de la neurogénesis y de la supervivencia de las neuronas del hipocampo, además, una reducción del árbol dendrítico en estructuras cerebrales, principalmente las que conforman el circuito emocional (Stone et al., 2008) Bioquímicos Neuroendócrinos Disminución en la producción de neurotrofinas en el SNC y la síntesis del factor neurotrófico del cerebro, además de alteraciones en la transmisión serotonérgica, noradrenérgica, dopaminérgica y GABAérgica (Duman y Monteggia, 2006). Existe un incremento en la concentración de la hormona adrenocroticotrópica y cortisol en el LCR, además disminuye la síntesis de neurotransmisores y de algunos neuroesteroides como a alopregnanolona (Uzonova et al., 1998). 16 Tratamientos farmacológicos de la depresión El tratamiento farmacológico de la depresión consta de diversos grupos de fármacos como los antidepresivos tricíclicos, los inhibidores selectivos de la recaptura de serotonina (ISRS), los agonistas serotonérgicos y los inhibidores de la monoamino oxidasa (IMAO´s). Estos fármacos tienen diferentes mecanismos de acción pero todos tienen en común que incrementan la concentración de neurotransmisores como serotonina, noradrenalina y dopamina; además de facilitar las acciones GABAérgicas, que en conjunto restablecen la neurotransmisión cerebral produciendo sus efectos terapéuticos (Rodríguez-Landa y Contreras, 1998; Paez et al., 2003); los cuales están asociados a cambios plásticos neuronales que modifican la sensibilidad o densidad de diversos receptores. Uno de los grandes inconvenientes en la farmacoterapia de la depresión, es su larga latencia para ejercer el efecto terapéutico. Generalmente, el efecto terapéutico de los antidepresivos se establece después de tres a cuatro semanas de tratamiento. Además, se ha observado que en las primeras semanas de tratamiento, el paciente puede tener un peor estado anímico que antes de haber iniciado el tratamiento farmacológico (Stassen et al., 1997). La larga latencia, parece ser el resultado del gran número de eventos neuroquímicos y neuroanatómicos que subyacen al tratamiento antidepresivo, los cuales son de lenta instauración debido a que implican procesos metabólicos y genómicos (Horst, 1998; Paez et al., 2003). Los antidepresivos tricíclicos producen efectos antihistamínicos, sedantes, analgésicos y tienen en común que inhiben la recaptura de las monoaminas: acetilcolina, la adrenalina, la serotonina, la noradrenalina y dopamina en mayor o menor grado (Baldessarini, 2007), lo cual se relaciona con su efecto antidepresivo. Los ISRS como su nombre lo indica inhiben la recaptura de serotonina a nivel pre-sináptico, lo que promueve un aumento inicial de 5-HT en la hendidura sináptica, y a largo plazo modificaciones en la sensibilidad y densidad de receptores serotonérgicos, además de cambios estructurales en la neurona, tales como el incremento del árbol dendrítico, del número de espinas dendríticas y en el número de vesículas sinápticas (Horst, 1998; Paez et al., 2003; Guest, 2004). 17 Por otro lado, algunos IMAO´s son inhibidores irreversibles de la enzima monoamino oxidasa, la cual es responsable de la degradación de dopamina, serotonina y noradrenalina, es por ello que su uso incrementa los niveles de dichos neurotransmisores en la sinapsis, contribuyendo al efecto terapéutico (Wimbiscus et al., 2010). En la actualidad se han introducido nuevos fármacos que inhiben selectivamente a la monoamino oxidasa tipo A, tal es el caso de la moclobemida, la cimoxatona y brofaromina (Sacher, 2011). A pesar de esta amplia gama de fármacos con actividad antidepresiva, hay pacientes que no responden favorablemente al tratamiento, lo que ha llevado al estudio sistematizado de posibles alternativas terapéuticas basadas en el conocimiento acumulado por años en la medicina tradicional o folklórica que describen sustancias con potencial antidepresivo; de donde han surgido diversos fitomedicamentos de utilidad en la terapéutica de la depresión. Fitoterapia en la depresión Derivados de la medicina tradicional ancestral basada en el uso de plantas con actividad biológica, han surgido diversos estudios sistematizados con fitomedicamentos para corroborar los efectos, mecanismos de acción y el potencial uso en la terapéutica contra diversas enfermedades, asimismo, se han identificado sus potenciales efectos colaterales e incluso tóxicos. A partir de ellos se han desarrollado algunos fitomedicamentos con potencial antidepresivo. Algunos estudios han evaluado el efecto de extractos estandarizados de plantas como Melissa officinalis, Tilia europea, Pasiflora incarnata e Hypericum perforatum, entre otras. En el caso particular de Hypericum perforatum se ha demostrado que ejerce efectos ansiolíticos y antidepresivos debido a su contenido de principios activos como la hipericina y la hiperforina, los cuales tienen la capacidad de estimular la liberación de algunos neurotransmisores como serotonina, dopamina y noradrenalina (Tian et al., 2014). A la larga estos efectos a nivel cerebral contribuyen a la plasticidad neuronal en estructuras reguladoras del estado emocional. Esta planta ha sido ampliamente estudiada tanto a nivel preclínico como clínico y, con base en los resultados, se han 18 desarrollaron diversos fitomedicamentos como Remotiv® e Hiperikan®. Estos fitomedicamentos, ejercen efectos anti-desesperanza en ratas evaluadas en la prueba de nado forzado, después de 21 días de tratamiento, al igual que la fluoxetina. No obstante, fluoxetina ejerce sus efectos a los 14 días de tratamiento (Lozano-Hernández et al., 2010). Es de llamar la atención que los fitomedicamentos elaborados con Hypericum perforatum compitieron por mucho tiempo en el mercado con el Prozac® (fluoxetina) por su bajo costo y mercadotecnia que sugería que al ser un producto de origen natural, carecía de efectos colaterales. Con el paso de los años se corroboró que tenía múltiples efectos sobre la neuroquímica cerebral, afectando los sistemas de neurotransmisión teniendo como resultado un efecto antidepresivo, pero con múltiples efectos colaterales (Rodríguez-Landa y Contreras, 2003). Con base en lo anterior se debe resaltar que todo producto aunque sea de origen natural ejerce efectos benéficos y perjudiciales dependiendo de la dosis y las condiciones en que se administre. El uso de extractos de plantas y de principios activos de origen vegetal puede ser una alternativa terapéutica para el desarrollo de nuevos medicamentos, sin embargo, esta alternativa debe ser fuertemente estudiada antes de implementarse en la práctica clínica para evitar efectos secundarios que puedan poner en riesgo la vida de quienes lo consumen. Por tal motivo, estas sustancias de origen vegetal deben ser evaluadas en modelos animales adecuados, para respaldar, refutar o en su caso dictar bajo qué condiciones pueden ser de utilidad en la terapéutica de la depresión. El nado forzado para el estudio de la “depresión experimental” Uno de los modelos más utilizado y validado para el estudio de los fármacos y sustancias con efectos antidepresivos es la prueba de nado forzado, la cual fue desarrollada por Porsolt y colaboradores en 1977. En esta prueba se asume que una rata desesperanzada (correlato experimental de la depresión en el ser humano) abandona todo intento por tratar de salir de la situación de apremio cuando es forzada a nadar en un estanque del que no puede escapar (Porsolt et al., 1977; Porsolt et al., 1978). Al inicio de la prueba, las ratas despliegan una serie de movimientos 19 conductuales sugerentes de búsqueda de una salida, ya que se desplazan vigorosamente de un lado a otro del estanque, se sumergen, saltan y tratan desesperadamente de escalar las paredes. Al cabo de minutos se asume que el animal desarrolla un estado de desesperanza reflejado por el incremento de la inmovilidad, es decir, realizan los movimientos mínimos para mantenerse a flote y sin desplazarse (Rodríguez-Landa y Contreras, 2000). En esta prueba los fármacos o sustancias con potencial antidepresivo como la fluoxetina reducen la conducta de inmovilidad y alargan la latencia al primer periodo de inmovilidad (figura 2), lo cual es interpretado como incremento en la motivación del animal por escapar de la situación de apremio que representa el nado forzado (Contreras et al., 2001), un efecto típico de los antidepresivos clínicamente eficaces. Figura 2: Efecto del tratamiento con fluoxetina en ratas forzadas a nadar. Las dosis efectivas de fluoxetina reducen el tiempo total de inmovilidad (a) y aumentan la latencia al primer periodo de inmovilidad (b) en las ratas forzadas a nadar. * p< 0,05 contra el control (Prueba de Dunnett). Ctrl, grupo de control (Tomado y modificado de Contreras et al., 2001). 20 Otros modelos experimentales de depresión Otros modelos frecuentemente utilizados en el estudio de la depresión y de los efectos farmacológicos de los antidepresivos son la prueba de suspensión del rabo en la rata (Castagne et al., 2011), el modelo de desesperanza aprendida (Seligman y Beagley, 1975) y el estrés ligero crónico impredecible (Willner, 2005). Estas pruebas se basan en las respuestas conductuales de los animales ante la aplicación de estresores físicos como pudieran ser choques eléctricos de baja intensidad en las patas, la restricción de espacio, el aislamiento social o situaciones de contingencia como el olor de un predador o la restricción de alimento y agua, que produce alteraciones neuroquímicas, neuroendocrinas y conductuales (Perrot-Sinal et al., 2004 y Herrera-Perez, 2008). En este caso los antidepresivos clínicamente eficaces o las sustancias con potencia antidepresiva revierten los efectos producidos por esos estresores. Los modelos animales de depresión han sido desarrollados con la finalidad de evaluar las acciones de sustancias con potencial antidepresivo, intentando reproducir algunas características clínicas de la depresión en el modelo experimental. En este sentido se han propuesto criterios para validar dichos modelos basándose en las similitudes que existen entre el modelo experimental y el fenómeno clínico, los cuales se basan en: a) la causa inductora del fenómeno, b) el estado conductual inducido en el sujeto, c) los mecanismos subyacentes al cuadro conductual y d) en que las alteraciones inducidas en el sujeto de experimentación deben ser revertidas con los antidepresivos clínicamente eficaces (Mckinney y Bunney, 1969). Estos cuatro criterios son identificados en los modelos anteriormente mencionados, lo que les da validez como modelos de depresión útiles para evaluar las acciones de los antidepresivos y de nuevas sustancias que pudieran ser utilizadas como alternativa farmacológica de este trastorno del estado de ánimo. Finalmente, la medicina tradicional y los estudios experimentales aquí descritos, sugieren que los extractos de M. grandiflora pudieran ejercer efectos antidepresivos en el ser humano, sin embargo, a la fecha se carece de estudios 21 sistematizados que corroboren o refuten esta posibilidad. Considerando que la prueba de nado forzado es un modelo validado para el estudio de las acciones de sustancias con potencia antidepresiva, se abre la posibilidad de evaluar los efectos del extracto de M. grandiflora para identificar si pose un potencial efecto antidepresivo a nivel experimental, y comparar dicho efecto con los producidos por un antidepresivo clínicamente eficaz como la fluoxetina. 22 Planteamiento del problema En la medicina tradicional mexicana se ha reportado que los extractos de M. grandiflora y otras especies del mismo género, ejercen efectos sobre el estado emocional y afectivo, por lo que han sido utilizadas tradicionalmente para el tratamiento de la ansiedad y la depresión (De la Cruz-Badiano, 1522). A nivel experimental se han identificado sus efectos ansiolíticos bajo diferentes esquemas de tratamiento tanto en ratas macho como hembra y se ha establecido que dichas acciones se sitúan sobre los recetores GABAA (Carro-Juárez et al., 2012; Rodríguez-Landa et al., 2014). Sin embargo, a la fecha no se ha explorado, mediante estudios sistematizados y controlados, si el extracto acuoso de M. grandiflora tiene la capacidad de producir efectos tipo antidepresivo, como se le ha atribuido de manera tradicional; este hecho pudiera poner en riesgo a las personas que consumen esta planta para el tratamiento de la depresión, en caso de no poseer dicho efecto terapéutico. Es por ello que en el presente trabajo se identificó mediante un estudio controlado el potencial efecto antidesesperanza del extracto acuoso de M. grandiflora en ratas forzadas a nadar, cuyo efecto fue comparado con un antidepresivo clínicamente efectivo, la fluoxetina. De esta manera se contribuye al estudio sistematizado de las acciones neurofarmacológicas de los extractos de M. grandiflora con la finalidad de apoyar o refutar el uso tradicional de esta planta para el tratamiento de la depresión, lo cual también abrirá la posibilidad para que en estudios posteriores se identifiquen los principios activos responsables del efecto farmacológico aquí identificado. 23 Hipótesis El extracto acuoso de Montanoa grandiflora, administrado a largo plazo, ejerce un efecto tipo anti-desesperanza semejante al antidepresivo fluoxetina en la rata Wistar. Objetivo general Determinar si el tratamiento crónico con el extracto acuoso de Montanoa grandiflora ejerce un efecto anti-desesperanza, semejante a la fluoxetina, en ratas Wistar forzadas a nadar. Objetivos específicos Evaluar el efecto conductual producido por el tratamiento a largo plazo con el extracto acuoso de Montanoa grandiflora (25 y 50 mg/kg) y compararlo con el efecto producido por el antidepresivo fluoxetina en ratas forzadas a nadar. Evaluar el efecto de los tratamientos, a largo plazo, sobre la actividad motora espontanea en la prueba de campo abierto. Evaluar la respuesta conductual de las ratas tratadas durante 28 días con el extracto de Montanoa grandiflora, en nado forzado y campo abierto a las 24 y 48 horas pos-tratamiento. 24 Material y Métodos Ética Todas las manipulaciones experimentales se realizaron siguiendo las recomendaciones del Código Ético del Instituto de Investigaciones Biomédicas de la UNAM (2007). Las manipulaciones y el cuidado de los animales se llevaron a cabo siguiendo estrictamente la Guía para el Cuidado y el Uso de Animales de laboratorio (The National Institute of Health, 1996) y los requerimientos de la ley mexicana (NOM062-ZOO-1999) para el cuidado y uso de animales de laboratorio. El protocolo general del estudio recibió autorización del Comité local de Ética de la Facultad de Medicina Veterinaria y Zootecnia (No. MVZ-189-12) de la Universidad Autónoma de Tlaxcala. Sujetos Se utilizaron 40 ratas macho de la cepa Wistar, con peso promedio entre 250 y 300 g y tres meses de edad al inicio de los tratamientos. Todas las ratas se mantuvieron en cajas de acrílico (44 x 33 base, 20 cm altura) bajo condiciones estándar de bioterio (5-4 ratas por caja), con ciclo de luz/oscuridad de 12/12 horas, la fase de luz inició a las 7:00 am. Las ratas tuvieron acceso ad libitum al agua y al alimento. La viruta de las cajas fue reemplazada por una limpia cada tercer día. Grupos experimentales Se realizó un estudio mixto con cuatro grupos independientes. Cada grupo incluyó un total de diez ratas. Los grupos que se formaron fueron: un grupo control que 25 recibió el vehículo (agua purificada), dos grupos que recibieron diferentes dosis del extracto acuoso de Montanoa grandiflora (25 y 50 mg/Kg, respectivamente) y un grupo que recibió la dosis efectiva de fluoxetina (1 mg/Kg). Los tratamientos fueron administrados por vía oral, e iniciaron después de la sesión basal (día 0) de las pruebas conductuales. El efecto de los tratamientos fue evaluado 1 hora después de la administración en los días 1, 7, 14, 21 y 28 días de tratamiento. Adicionalmente, se evaluó el efecto post-tratamiento a las 24 y 48 horas después de haber suspendido el tratamiento en el día 28. Las dosis de Montanoa grandiflora fueron seleccionadas de acuerdo a estudios en los cuales se ha demostrado que 25 y 50 mg/kg producen efectos ansiolíticos a nivel experimental, mediante acciones que involucran al receptor GABAA (Carro-Juárez et al., 2012; Rodríguez-Landa et al., 2014). La dosis de fluoxetina (Prozac, Ely Lilly Compañía de México, SA de CV México, DF) que se empleó (1 mg/Kg de peso) es la que ejerce el efecto antidesesperanza, a largo plazo, en la rata Wistar y no genera alteraciones en la actividad motriz (Contreras et al, 2001; Hernández-Lozano et al., 2010). Preparación del extracto acuoso de Montanoa grandiflora Montanoa grandiflora (Familia: Asterácea, tribu: Heliantheae), fue recolectada en su hábitat en el estado de Tlaxcala, México, durante Septiembre de 2013 y fue autentificada por un especialista del herbario de la Universidad Autónoma de Tlaxcala (Número de registro: Mf UATX11), donde se conservan y cultivan los especímenes de la planta. El material vegetal fue proporcionado por el Dr. Miguel Carro-Juárez, investigador de la Universidad Autónoma de Tlaxcala. La preparación del extracto se realizó de acuerdo a lo descrito en estudios previos (Carro-Juárez et al., 2012; Rodríguez-Landa et al., 2014). Las hojas frescas de M. grandiflora fueron recogidas en su hábitat natural y preparadas para ser secadas durante veinte días. Una vez secas, las hojas se molieron hasta obtener 1 g de polvo fino, que se mezcló con 20 mL de agua purificada justo antes de la ebullición y se dejó reposar por 10 minutos. La infusión obtenida se filtró y fue secada en horno a una temperatura de 55°C. Con el residuo del 26 extracto se calculó un rendimiento de 80 mg aproximadamente. El residuo seco de la planta se mantuvo a 3°C y luego se utilizó para preparar las soluciones de 25 y 50 mg/mL. En el presente estudio, una solución de 50 mg/mL fue inicialmente preparada y después se diluyó para obtener soluciones equivalentes de 25 mg/mL. Los extractos se prepararon 40 minutos previos a la administración para evitar modificaciones en las propiedades químicas de los extractos. Prueba de campo abierto La prueba consistió en colocar a la rata individualmente, durante 5 minutos en una caja de acrílico opaca (44 x 33 cm base, 20 cm altura), cuya base está dividida en cuadros de 11 x 11 cm (figura 3). En esta prueba se evaluó el número de cuadros cruzados tomando como criterio cuando la rata pasó al menos tres cuartas partes de su cuerpo de un cuadro a otro. Esta prueba se utilizó para descartar que los datos obtenidos en el nado forzado pudieran estar relacionados con cambios en la actividad locomotora generalizada (por ejemplo hiperactividad o hipoactividad motora). Además, se midió el tiempo de acicalamiento, considerado como los periodos de tiempo destinados al auto-aseo y la conducta vertical, considerada como un indicador de exploración. El acicalamiento incluye todas aquellas conductas de aseo autodirigidas como el aseo de la región anogenital, las extremidades anteriores y la emisión de giros elípticos de las extremidades anteriores sobre las orejas, la cabeza, el cuerpo y el rabo del propio animal (Kalueff y Touhimaa, 2004; 2005). La conducta vertical, fue considerada cuando la rata se apoyó en sus extremidades posteriores en una postura vertical con respecto al piso y con la narina orientada en posición de olfateo. Al finalizar cada una de las pruebas la caja fue limpiada cuidadosamente con una solución de alcohol al 15 %. 27 Figura 3. Prueba de campo abierto en la cual se evalúa la actividad motora y la exploración de la rata en un ambiente novedoso. Prueba de nado forzado La prueba de nado forzado consistió en introducir a la rata a un recipiente rectangular (30 X 50 cm base, 60 cm altura) lleno con agua a 25 ± 1°C de temperatura y 23 cm de profundidad, donde no existió ninguna posibilidad de escape (figura 4). En una primera sesión (pre-prueba), se introdujo a la rata durante 15 minutos, donde después de un periodo de vigorosa actividad sólo realizó los movimientos necesarios para mantener la cabeza por arriba del nivel del agua, pero sin desplazarse. En esta sesión el animal desarrolló un estado de desesperanza. 24 horas más tarde la rata fue sometida nuevamente a la prueba durante 5 minutos para evaluar la latencia a la primera inmovilidad, que es un indicador del primer esfuerzo del animal para tratar de escapar de la situación de estrés, y el tiempo total de inmovilidad que nos dice que tan motivada se encuentra la rata ante la situación estresante en la que se encuentra (Porsolt et al., 1977). La inmovilidad corresponde a un indicador de desesperanza o un bajo estado de ánimo. Se asumió como inmovilidad cuando la rata tocó la parte inferior del estanque por lo menos en dos puntos de contacto, es decir, con una o ambas patas traseras o la cola, también se consideró inmovilidad cuando la rata flotó realizando los 28 mínimos movimientos para mantener la cabeza por encima de la superficie del agua, pero sin ningún desplazamiento (Contreras et al., 2001). Figura 4. Prueba de nado forzado, en la cual se evalúa la conducta de inmovilidad. A mayor inmovilidad, mayor desesperanza; interpretada como falta de motivación para buscar una salida a la situación de estrés. Análisis estadístico Los datos fueron analizados por medio de ANOVA de dos vías para muestras repetidas considerando como factores los tratamientos y los días de tratamiento. Cuando se encontraron valores de p≤ 0.05 en el ANOVA, se aplicó la prueba post hoc de Student Newman Keuls. Los resultados se presentan como la media ± el error estándar de cada variable. 29 Diagrama de trabajo 40 ratas macho, cepa Wistar (250-300 g) Vehículo agua purificada 1 ml/Kg (V.O) n=10 M. grandiflora 25 mg/Kg (V.O) n=10 M. grandiflora 50 mg/Kg (V.O) n=10 Fluoxetina 1 mg/Kg (V.O) n=10 Tratamiento por 28 días. Evaluar el efecto a los 1, 7, 14, 21 y 28 días y el post-tratamiento a las 24 y 48 horas Actividad locomotora en campo abierto 5 minutos. Nado Forzado 5 minutos Análisis estadístico ANOVA de dos vías, post-hoc Student Newman Keuls 30 Resultados Campo abierto Número de cuadros cruzados En la prueba de actividad locomotriz en campo abierto no se encontraron diferencias significativas [F(3,252)= 0.369, p= 0.776, NS] en el factor tratamiento (Tabla 2). Sin embargo, en el número de cuadros cruzados considerando el factor días de tratamiento, reveló diferencias significativas [F(7,252)= 271.107, p< 0.001]; la prueba post hoc mostró que a partir del día 14 hay una reducción de la locomoción comparada con la sesión basal (Tabla 3). La interacción entre factores no reveló diferencias significativas [F(21,252)= 1.349, p= 0.145, NS]. No obstante, se observó que hay una reducción en el número de cuadros cruzados, independientemente del tratamiento, a partir del día 14 (Figura 5). Tabla 2. Número de cuadros cruzados de acuerdo al factor tratamiento. Tratamiento Vehículo M. Grandiflora (mg/kg) 25 50 Fluoxetina (mg/kg) 1 Cuadros cruzados (n) 23.00 ± 1.41 24.16 ± 1.63 23.68 ± 1.44 23.61 ± 1.35 El tratamiento no modificó significativamente el número de cuadros cruzados, ANOVA de dos vías para grupos independientes. 31 Tabla 3. Número de cuadros cruzados de acuerdo al factor días de tratamiento. Días de tratamiento Cuadros cruzados (n) Basal 40.08 ± 0.93 1 37.58 ± 1.10 7 36.40 ± 0.98 14 24.78 ± 0.97 * 21 15.73 ± 0.64 * 28 12.53 ± 0.60 * Horas posttratamiento 24 11.28 ± 0.59 * 48 10.55 ± 0.63 * El número de cuadros cruzados se redujo a partir de la evaluación del día de 14. *p< 0,001 vs día basal. ANOVA de dos vías para grupos independientes, post hoc Student Newman Keuls. Figura 5. Número de cuadros cruzados. Independientemente del tratamiento el número de cuadros cruzados disminuyó significativamente a partir del día 14. *p< 0.001 vs sesión basal, ANOVA de dos vías, post hoc Student Newman Keuls. 32 Tiempo de acicalamiento El análisis del tiempo destinado al acicalamiento, mostró diferencias significativa entre tratamientos [F(3,252)= 116.535, p< 0.001], la prueba post hoc reveló que fluoxetina y M. grandiflora (50 mg/kg) aumentaron el tiempo de acicalamiento respecto al vehículo (Tabla 4). El análisis de esta variable considerando los días de tratamiento también arrojó diferencias significativas [F(7,252)= 60.641, p< 0.001], la prueba post hoc mostró que el acicalamiento disminuyó a partir del día 1, respecto a la sesión basal (Tabla 5). Del mismo modo, el análisis de la interacción de factores reveló diferencias significativas [F(21,252)= 10.593, p< 0.001]. La prueba post hoc indica que existe una reducción del acicalamiento a partir del día 1 de tratamiento en el grupo control, 25 mg/kg de Montanoa grandiflora y fluoxetina; pero se mantiene en los grupos M. grandiflora 50 mg/kg, sin embargo, fluoxetina aumenta significativamente el acicalamiento a partir de día 21 y lo mantiene a las 24 y 48 horas de post-tratamiento (Figura 6). Tabla 4. Tiempo de acicalamiento de acuerdo al factor tratamiento. Tratamiento Vehículo Tiempo de acicalamiento 11.33 ± 0.84 M. Grandiflora (mg/Kg) 25 12.87 ± 1.06 50 24.34 ± 1.00 * Fluoxetina (mg/Kg) 1 23.08 ± 1.19 * El tratamiento con fluoxetina o con M. grandiflora (50 mg/Kg) aumentó significativamente el acicalamiento en la prueba de campo abierto. *p< 0.001 vs los demás tratamientos, ANOVA de dos vías para grupos independientes, prueba post hoc Student Newman Keuls. 33 Tabla 5. Tiempo de acicalamiento de acuerdo al factor días de tratamiento. Días de tratamiento Basal 1 7 14 21 28 Horas posttratamiento 24 48 Tiempo de acicalamiento 32.58 ± 1.13 16.38 ± 1.39 * 13.38 ± 1.32 * 14.32 ± 0.97 * 20.58 ± 1.66 * 18.45 ± 1.44 * 16.19 ± 1.74 * 11.36 ± 1.65 * Los días de tratamiento disminuyen significativamente el tiempo empleado en el acicalamiento en la prueba de campo abierto (*p< 0.001) con respecto al día basal, Anova de dos vías para grupos independientes, prueba post hoc Student Newman Keuls. Figura 6. Tiempo de acicalamiento. El acicalamiento fue mantenido por M. grandiflora (50 mg/Kg), sin embargo, fluoxetina aumenta el tiempo de acicalamiento a partir del día 21, dicho efecto se mantiene a las 24 y 48 horas de post-tratamiento. *p< 0.001 vs grupo vehículo y la sesión basal. ANOVA de dos vías para grupos independientes, post hoc Student Newman Keuls. 34 Conducta vertical El análisis del tiempo empleado en la conducta vertical no mostró diferencias significativas [F(3,252)= 0.778, p= 0.514, NS] para el factor tratamiento (Tabla 6), ni para los días de tratamiento [F(7,252)= 0.951, p= 0.468, NS], (Tabla 7) y tampoco para la interacción entre factores [F(21,252= 0.955, p= 0.520, NS], (Tabla 8). Tabla 6. Conducta vertical de acuerdo al factor tratamiento. Tratamiento Vehículo M. Grandiflora (mg/Kg) 25 50 Fluoxetina (mg/Kg) 1 Conducta vertical (S) 15.34 ± 0.58 15.20 ± 0.42 15.17 ± 0.51 14.39 ± 0.43 Los tratamientos no modificaron el tiempo de conducta vertical, a lo largo del estudio. ANOVA de dos vías. Tabla 7. Conducta vertical de acuerdo al factor días de tratamiento. Días de tratamiento Basal 1 7 14 21 28 Horas posttratamiento 24 48 Conducta vertical (S) 15.88 ± 0.62 15.49 ± 0.67 15.17 ± 0.56 14.73 ± 0.76 13.78 ± 0.78 14.43 ± 0.71 15.37 ± 0.69 15.34 ± 0.69 La conducta vertical no se modificó a lo largo del estudio. 35 Tabla 8. Conducta vertical en campo abierto. Tratamiento Vehículo Montanoa Grandiflora fluoxetina Días de tratamiento 1 ml/Kg 25 mg/Kg 50 mg/Kg 1 mg/Kg Basal 15.22 ± 1.57 16.09 ± 1.36 16.42 ± 0.96 15.78 ± 1.19 1 14.73 ± 1.77 15.93 ± 1.19 15.97 ± 1.28 15.33 ± 1.17 7 14.71 ± 1.52 16.66 ± 0.73 14.94 ± 1.12 14.38 ± 1.02 14 16.82 ± 1.61 15.04 ± 1.44 15.11 ± 1.73 11.93 ± 0.95 21 16.57 ± 1.56 13.42 ± 1.20 12.85 ± 1.91 12.29 ± 1.33 28 12.51 ± 1.75 15.19 ± 0.87 15.99 ± 1.53 14.03 ± 1.35 Horas Post-tratamiento 24 16.11 ± 1.44 15.86 ± 1.25 14.04 ± 1.60 15.46 ± 1.33 48 16.03 ± 1.90 13.43 ± 1.30 16.01 ± 1.26 15.89 ± 0.94 El tiempo empleado en la conducta vertical no se ve modificado por los tratamientos ni por los días de tratamiento, ANOVA de dos vías para grupos independientes. 36 Prueba de nado forzado Latencia a la primera inmovilidad El análisis de la latencia a la primera inmovilidad reveló diferencias significativas para el factor tratamientos [F(3,252)= 219.218, p< 0.001], la prueba post hoc indicó que sólo fluoxetina incrementó esta variable con respecto a los demás tratamientos (tabla 9). El análisis de acuerdo al factor días de tratamiento también reveló diferencias significativas [F(7,252)= 11.859, p< 0.001]. La prueba post hoc mostró que hay un aumento de esta variable a partir del día 21 de tratamiento (Tabla 10), respecto a la sesión basal. En la interacción de factores también se observaron diferencias significativas [F(21,252)= 26.648, p <0.001]. La prueba post hoc mostró que sólo las ratas que recibieron la dosis de 1 mg/kg de fluoxetina, desplegaron significativamente un aumento en la latencia a la primera inmovilidad con respecto al vehículo y a las dosis de M. grandiflora a partir del día 14 de tratamiento (Figura 7). Tabla 9. Latencia a la primera inmovilidad de acuerdo al factor tratamiento. Tratamiento Vehículo M. Grandiflora (mg/Kg) 25 50 Fluoxetina (mg/Kg) 1 Latencia a la primera inmovilidad (S) 13.82 ± 0.86 18.92 ± 1.04 19.14 ± 0.97 53.39 ± 3.60 * El tratamiento con fluoxetina incrementó significativamente la latencia a la primera inmovilidad en la prueba de nado forzado. *p< 0.001 vs vehículo y dosis de M. grandiflora, ANOVA de dos vías para grupos independientes, prueba post hoc Student Newman Keuls. 37 Tabla 10. Latencia a la primera inmovilidad de acuerdo al factor días de tratamiento. Días de tratamiento Basal 1 7 14 21 28 Horas posttratamiento 24 48 Latencia a la primera inmovilidad (S) 21.86 ± 1.18 21.76 ± 1.52 21.35 ± 1.31 21.93 ± 2.25 32.37 ± 5.37 * 34.00 ± 5.50 * 32.43 ± 4.64 * 24.84 ± 4.24 La latencia aumentó a partir del día 21 y se mantuvo hasta las 24 y 48 horas de posttratamiento. *p< 0.001 vs basas y días 1 y 7, ANOVA de dos vías para grupos independientes, prueba post hoc Student Newman Keuls. Figura 7. Latencia a la primera inmovilidad. Sólo el tratamiento con fluoxetina aumentó esta variable a partir del día 14 y se mantuvo hasta las 48 horas posttratamiento. *p< 0.001 vs basal y demás grupos de tratamiento. ANOVA de dos vías para grupos independientes, post hoc Student Newman Keuls. 38 Tiempo total de inmovilidad El análisis del tiempo total de inmovilidad, reveló diferencias significativas para el factor tratamiento [F(3,252)= 82.439, p< 0.001], (Tabla 11). La prueba post hoc indicó que fluoxetina y M. grandiflora (50 mg/Kg) disminuyen significativamente esta variable con respecto al vehículo y a la dosis de (25 mg/Kg). El análisis considerando el factor días de tratamiento también reveló diferencias significativas [F(7,252)= 14.080, p< 0.001]. La prueba post hoc mostró que hay una reducción del tiempo total de inmovilidad a partir del día 1 y hasta el día 28 de tratamiento, así como a las 24 y 48 horas de post-tratamiento con respecto al día basal (Tabla 12). En la interacción entre factores también se encontraron diferencias significativas [F(21,252)= 11.769, p< 0.001]. La prueba post hoc mostró que los animales que recibieron M. grandiflora (50 mg/kg) disminuyeron la inmovilidad a partir del día 1 de tratamiento, con respecto al vehículo, pero el efecto se perdió a las 24 y 48 horas post-tratamiento. Fluoxetina redujo el tiempo total de inmovilidad a partir del día 14 de tratamiento con respecto al vehículo y respecto de M. grandiflora, y su efecto permaneció hasta las 48 horas posttratamiento (Figura 8). Tabla 11. Tiempo total de inmovilidad e acuerdo al factor tratamiento. Tratamiento vehículo M. Grandiflora (mg/Kg) 25 50 fluoxetina (mg/Kg) 1 Tiempo total de inmovilidad (S) 71.42 ± 2.72 78.65 ± 1.97 53.01 ± 3.26 * 39.63 ± 3.21 * El tratamiento con fluoxetina y M. grandiflora (50 mg/Kg) disminuyen significativamente el tiempo total de inmovilidad en la prueba de nado forzado. *p< 0.001 vs los demás tratamientos, ANOVA de dos vías para grupos independientes, prueba post hoc Student Newman Keuls. 39 Tabla 12. Tiempo total de inmovilidad de acuerdo al factor días de tratamiento. Días de tratamiento Basal 1 7 14 21 28 Horas posttratamiento 24 48 Tiempo total de inmovilidad (S) 79.86 ± 2.68 67.41 ± 3.94 * 59.57 ± 3.76 * 52.12 ± 4.05 * 32.37 ± 5.37 * 48.50 ± 3.74 * 64.42 ± 5.50 * 64.30 ± 5.35 * Los días de tratamiento disminuyen el tiempo total de inmovilidad. *p< 0.001 vs al día basal, ANOVA de dos vías para grupos independientes, prueba post hoc Student Newman Keuls. Figura 8. Tiempo total de inmovilidad en nado forzado. Esta variable disminuyó en los animales tratados con 50 mg/kg de M. grandiflora desde el día uno de tratamiento, pero dicho efecto se pierde al suspender el tratamiento, mientras que fluoxetina la reduce a partir del día 14 y se mantiene aún 24 y 48 horas después de suspender el tratamiento. *p<0.001 vs grupo vehículo y sesión basal. ANOVA de dos vías, pos hoc Student Newman Keuls. 40 Discusión En el presente estudio fue evaluado el efecto del extracto acuoso de Montanoa grandiflora en un modelo de desesperanza conductual en ratas de la cepa Wistar y se comparó con el efecto producido por fluoxetina, un antidepresivo clínicamente efectivo. Los resultados pueden ser resumidos de la siguiente manera: a) en la prueba de nado forzado las ratas administradas con 50 mg/kg de M. grandiflora disminuyeron la inmovilidad desde el día uno hasta el 28 de tratamiento, efecto que desapareció a las 24 horas post-tratamiento. Mientras que los animales tratados con fluoxetina aumentaron la latencia a la primera inmovilidad y redujeron el tiempo total de inmovilidad a partir del día 14, pero a diferencia de los extractos, la fluoxetina mantuvo el efecto aún hasta después de 48 horas post-tratamiento, y b) en la prueba de campo abierto, el acicalamiento fue reducido en el grupo control a partir del día 1, pero es mantenido por M. grandiflora (50 mg/Kg) a lo largo del tratamiento y por fluoxetina a partir del día 21, incluso a las 24 y 48 horas de post-tratamiento, cuando se somete a la prueba 48 horas pos-tratamiento se reduce significativamente el acicalamiento en los animales tratados con M. grandiflora (50 mg/Kg). Por otro lado, se observó una disminución en el número de cuadros cruzados independiente de los tratamientos. La dosis de 25 mg/kg de M. grandiflora no produjo efectos significativos en ninguna de las variables evaluadas. La conducta vertical no fue modificada por el tratamiento o el tiempo de tratamiento en este estudio. Lo anterior señala que el efecto del extracto de M. grandiflora no puede ser considerado como un efecto tipo antidepresivo, sino como un efecto protector contra el estrés generado por el nado forzado, a diferencia de los efectos de fluoxetina. El nado forzado es un modelo animal empleado para evaluar sustancias con posibles efectos antidepresivos (Porsolt et al., 1977). Este modelo permite medir la conducta de inmovilidad, evalúa fundamentalmente dos variables: a) la latencia a la primera inmovilidad la cual es interpretada como un indicador de la magnitud del primer esfuerzo de la rata por resolver la situación aversiva al ser forzada a nadar (Contreras et al., 1998; Espejo y Miñano, 1999); y b) el tiempo total de inmovilidad, el cual ha sido interpretado como una disminución de la motivación en el individuo que le impide buscar una salida a este problema, a mayor inmovilidad menor motivación (Rodríguez41 Landa y Contreras, 2000). En este estudio se encontró que la fluoxetina, a los 14 días de tratamiento, aumentó significativamente la latencia al primer periodo de inmovilidad, lo que sugiere que este fármaco aumentó el esfuerzo mostrado por las ratas para escapar de la situación estresante que el nado forzado le ocasiona, mientras que ninguna dosis del extracto de M. grandiflora tuvo este efecto motivacional. En cuanto al tiempo total de inmovilidad considerado como un indicador motivacional del animal, en el presente trabajo la fluoxetina redujo el tiempo de inmovilidad, lo cual concuerda con el efecto reportado para los antidepresivos clínicamente efectivos (Contreras et al., 2001). Por otro lado, sólo la dosis de 50 mg de la planta tuvo un efecto semejante a la fluoxetina pero que pudo ser observado desde el inicio del tratamiento, lo que contrasta con la latencia terapéutica de los antidepresivos. La fluoxetina actúa bloqueando los transportadores de serotonina (5-HT), lo que conduce a un aumento de esta monoamina en el espacio sináptico, es decir, la fluoxetina desensibiliza al autorreceptor para que no sea recapturada la serotonina, ya que al inicio de la enfermedad estos autorreceptores se encuentran hipersensibilizados por las bajas concentraciones de este neurotransmisor en la hendidura sináptica (Baldessarini et al., 2005). El problema que se presenta es que en la clínica, la acción antidepresiva no es inmediata, sino que generalmente comienza a apreciarse de 2-6 semanas después de iniciado el tratamiento (Baldessarini, 2007). Como explicación a lo anterior, se sugiere que el aumento inicial de serotonina en la sinapsis conducirá a una hipersensibilización de los autorreceptores presinápticos 5-HT1A, mediante la cual se potenciará la retroalimentación (feedback) negativa sobre la síntesis y liberación de 5HT, debido a este fenómeno se presenta un efecto de Up-regulation, en el cual debido a la baja concentración de serotonina en el espacio sináptico hay un incremento de receptores para 5-HT en la membrana postsináptica posteriormente al tratamiento durante 1 a dos semanas con fluoxetina se producirá una desensibilización o disminución de los autorreceptores de 5-HT, hecho que haría que el funcionamiento serotonérgico se normalizara e incluso se incrementara; este fenómeno es conocido como Down-regulation (Ghaemi et al., 2001). En este sentido se recomienda reducir las dosis de forma progresiva para evitar que se presente el síndrome de interrupción o 42 retirada de los antidepresivos el cual se caracteriza por presentar malestares como alteraciones en el sueño, sensación de desequilibrio, vómito y alteraciones sensoriales, este tipo de síndrome es raro que se produzca en pacientes con menos de 7 semanas de tratamiento, por tal motivo, es recomendable disminuir las dosis hasta retirarla por completo para evitar dependencia al fármaco (Ghaemi et al., 2001). En nuestro estudio es por esta razón que el efecto que alcanza la fluoxetina no es inmediato ya que conlleva una serie de procesos a nivel neuronal que involucran cambios plásticos en el sistema serotonérgico, tal y como se ha reportado en la clínica (Stassen et al., 1997) y se ha reproducido en el comportamiento de las ratas con dosis bajas de antidepresivos, donde sólo se observa después de un tratamiento crónico lo que refleja que hay cambios de adaptación a nivel del receptor neuronal, el cual requiere tiempo suficiente para llegar a ser evidente (Contreras et al., 1990; Decke et al., 1997) mecanismo farmacológico que se reproduce en nuestro estudio para el antidepresivo fluoxetina. Por otro lado, el efecto inmediato del extracto de M. grandiflora en nuestro experimento sugiere un mecanismo diferente al de la fluoxetina en el establecimiento de las acciones en el nado forzado. Estudios experimentales revelan que el tratamiento agudo de antidepresivos tanto de dosis bajas y elevadas no ejercen un efecto antidesperanza en la prueba de nado forzado, comparado con un tratamiento crónico de 21 días en donde el efecto observado si es antidesesperanza; estos datos ponen de manifiesto los cambios neuronales que generan los tratamientos prolongados y por tal motivo el efecto terapéutico no es inmediato (Detke et al., 1997). Por ejemplo, la hierba de San Juan (Hypericum perforatum) se ha estudiado ampliamente a nivel preclínico y clínico del cual ya se han logrado formular fitomedicamentos que en su tiempo llegaron a competir con la fluoxetina ya que tiene la propiedad de disminuir el tiempo total de inmovilidad y aumentar la latencia en la prueba de nado forzado en dosis de Hiperikan® (3.21, 6.43, 12.86 y 25.72 mg/kg) y Remotiv® (1.78, 3.57, 7.14 14.28 mg/kg), pero nuevamente en esos fitomedicamentos, el efecto no es inmediato, si no que se quieren de al menos 21 días de tratamiento para detectar su potencial antidepresivo (Hernández-Lozano et al., 2010). En el presente trabajo, encontramos que el extracto ejerció un efecto parecido al de los antidepresivos desde el primer día de tratamiento, sin embargo, este aparente efecto benéfico en 43 cuanto a la corta latencia de aparición, no es del todo factible, lo cual se discute más adelante. Pocos estudios han reportado la duración del efecto de la fluoxetina al suspender el tratamiento, en el presente trabajo observamos que el efecto de fluoxetina tarda en establecerse de 2 a 3 semanas y persiste hasta 48 horas después del tratamiento mientras que, por otra parte M. grandiflora (50 mg/Kg) no ejerce el mismo efecto que la fluoxetina ya que este actúa de inmediato inhibiendo la respuesta de estrés que genera el nado forzado e impidiendo que se desencadene la desesperanza y su efecto desaparece a las 24 y 48 horas después de que se ha suspendido el tratamiento. Al respecto, diversas investigaciones han demostrado que las hormonas ováricas como la progesterona y la alopregnanolona además de ejercer efectos ansiolíticos, reducen la inmovilidad en la prueba de nado forzado por acciones sobre los receptores membranales o receptores ionotrópicos como el GABAA (Rodríguez Landa et al., 2007), es por ello que los diversos estudios muestran que el efecto de estas hormonas esteroidales son inmediatos, es decir, ejercen un efecto antidesesperanza de breve latencia, no mayor a 24 horas, pero una vez suspendido el tratamiento el efecto regresa a estados basales semejantes al grupo control, debido a que sólo actúan sobre el receptor GABAA (Contreras et al., 2011). El efecto observado en el presente trabajo por M. grandiflora (50 mg/Kg) sobre el tiempo total de inmovilidad en la prueba de nado forzado es similar al de los neuroesteroides antes mencionados, los cuales ejercen sus efectos sobre el estrés, ansiedad y desesperanza por actuar directamente sobre receptores GABAA del hipocampo y septum lateral (Contreras et al., 2011). Por ello la breve duración del efecto de estos compuestos puede deberse a su rápida metabolización y eliminación del cuerpo (Zhu et al., 2001). Por otro lado se debe corroborar que el extracto evaluado no afecte la actividad motora de los animales que reciben el tratamiento y nos generen falsos positivos en la prueba de nado forzado, es por ello que se realiza la prueba de campo abierto en la cual se evalúa la actividad motora, para descartar efectos de hipo e hiperactividad. El acicalamiento que es una conducta motivacional de aseo en el roedor además de que funciona como un indicador del estrés que se genera por el nado forzado y conlleva a 44 un estado de desesperanza (Richmond y Sachs, 1980), también es evaluado en campo abierto. Por último la conducta vertical es una actividad exploratoria, la cual no tiene una carga emocional, sino que es algo vital que realiza la rata y debe mantenerse; se sabe que esta actividad se modifica con agentes noradrenérgicos como la imipramina. Un aumento en la actividad locomotora puede disimular los efectos motivacionales de los antidepresivos, como ocurre con los estimulantes del sistema nervioso central (Porsolt et al., 1977; Wieland y Lucki, 1990), por lo que la evaluación de estos parámetros cuando se prueban sustancias con potencial antidepresivo es indispensable. El número de cuadros cruzados en la prueba de campo abierto es utilizado para identificar posibles alteraciones motrices inducidas por la manipulación experimental o por el tratamiento que pudiera interferir en la ejecución del nado forzado (Walf y Frye, 2007). En este sentido, las sustancias que aumentan la actividad motriz (por ejemplo la cafeína y nicotina) ejercen un efecto similar a los antidepresivos en nado forzado, dicho efecto es debido a que altera la actividad motora del animal. Bajo estas condiciones no se puede considerar como un efecto antidesesperanza ya que los fármacos antidepresivos no modifican la actividad motora o, en su caso, la reducen. Nuestros resultados no estaban relacionados con ninguna acción locomotora ejercida por el tratamiento con fluoxetina ya que en la prueba de campo abierto nuestro estudio muestra que hay una reducción de la locomoción a partir del día 14 y que es independiente de los tratamientos, es decir, se debe a un efecto de habituación de las ratas a la prueba, las ratas dejan de explorar, el ambiente deja de ser novedoso para ellas durante un tratamiento prolongado (Wieland y Lucki, 1990; Contreras et al., 1998). El acicalamiento es una conducta innata que se presenta en diversas especies animales (Berridge et al., 1987; Aldridge y Berridge, 1998), y se considera esencial para la sobrevivencia de los mamíferos. En las ratas y ratones, el acicalamiento juega un papel importante en la adaptación al estrés (Jolles et al., 1979). Por ejemplo, la frecuencia y el tiempo empleado en el acicalamiento incrementa bajo condiciones de estrés y ansiedad (Fentress, 1977; Van Erp et al., 1994); mientras que el estrés severo o crónico ejerce el efecto contrario, es decir, lo reduce (Van Dijken et al., 1992; Perrot45 Sinal et al., 2004). Esta reducción del acicalamiento es prevenida por la administración de fármacos antidepresivos a nivel experimental (Hata et al., 1988; D’Aquila et al., 2000). En tanto el acicalamiento es interpretado como una conducta motivacional (Richmond y Sachs, 1980). En nuestro estudio se muestra que sólo M. grandiflora (50 mg/Kg) mantiene esta conducta, fluoxetina lo mantienen a partir del día 21 de tratamiento y hasta las 48 horas de post-tratamiento; estudios anteriores muestran que fluoxetina mantiene esta variable a partir del día 14, sin embargo el extracto de M. grandiflora lo mantiene hasta las 24 horas de post-tratamiento, esto debido a que esta prueba se realiza antes del nado forzado y el animal no se encuentra estresado gracias al efecto protector del extracto de M. grandiflora durante el día 28, pero posteriormente que se realiza el nado a las 24 horas pos-tratamiento el sujeto se encuentra estresado y el efecto es cancelado a las 48 horas post-tratamiento. La conducta vertical no es considerada un parámetro emocional sino más bien de exploración; en nuestro estudio dicha variable no se ve modificada ya que se descarta que nuestros tratamientos estén actuando sobre otros sistemas de neurotransmisión como el sistema noradrenérgico, tal y como lo hace la imipramina, del cual se sabe que durante un tratamiento crónico tiende a aumentar el tiempo empleado en la conducta vertical a diferencia de fluoxetina (Reshma et al., 2014). Los datos antes señalados muestran que el extracto acuoso de Montanoa grandiflora no ejerce un efecto antidesesperanza como el que se ha reportado para fluoxetina en la prueba de nado forzado (Contreras et al., 2001; Castagne et al., 2009). Fluoxetina aumenta la latencia a la primera inmovilidad a partir del día 14 y se mantiene el efecto aun después de suspender el tratamiento. Recientemente, Adefunmilayo y colaboradores (2012) han reportado que el extracto metanólico de Melissa officinalis ejerce efecto ansiolítico en la prueba de brazos elevados y efecto antidesesperanza en la prueba de nado forzado en dosis de 30, 100 y 300 mg/Kg y sobre la latencia y el tiempo de inmovilidad sin modificar la actividad locomotora comparado con diazepam y fluoxetina respectivamente (Adefunmilayo et al., 2012). Este efecto es debido a que dicho extracto actúa sobre el receptor GABA y por tanto en la prueba de nado forzado la rata no llega a un estado de desesperanza. En este estudio se evaluó el efecto 46 durante un tratamiento agudo administrando el extracto una hora antes de la prueba y en un tratamiento crónico durante 10 días, pero el diseño del trabajo contempla otros factores, por ejemplo, el sexo de las ratas; en ese estudio se emplean ratas macho y hembra sin contemplar su fase de ciclo ovárico de estas últimas, lo que pone en entredicho el efecto “tipo antidepresivo” reportado. En nuestro estudio los datos en conjunto señalan que el efecto observado en el nado forzado pudiera estar relacionado con el efecto ansiolítico del extracto ya que se ha demostrado que actúa sobre el receptor GABAA (Carro-Juárez et al, 2012) lo que indica que a diferencia de fluoxetina que actúa sobre receptores metabotrópico especialmente sobre el receptor 5-HT1A el efecto se observa en un periodo más prolongado y perdura aun cuando se suspende el tratamiento a las 24 y 48 horas. Estudios demuestran que el efecto de fluoxetina sobre la inmovilidad en la prueba de nado forzado perdura durante 6 días de abandono del tratamiento crónico (VázquezPalacios et al., 2004, 2005), lo cual es concordante con los resultados del presente trabajo. El extracto acuoso de M. grandiflora ejerce sus efectos sobre receptores de membrana ionotrópicos relacionado con el efecto ansiolítico, el receptor GABAA. Tal y como ocurre con las hormonas esteroideas como progesterona, alopregnanolona y algunos metabolitos secundarios como los flavonoides, que establecen sus acciones sobre el sistema GABAérgico por lo que ejercen un aparente efecto “tipo antidepresivo” en la prueba de nado forzado ya que bloquean el estrés que genera la prueba sobre las ratas para que no alcancen un estado de desesperanza conductual (Rodríguez-Landa et al., 2007). En este sentido, parece ser que el efecto producido por el extracto en su forma aguda, no corresponde con un efecto antidepresivo, sino más bien a un efecto antiestrés, que de alguna manera protege a la rata para no desarrollar un estado de desesperanza. Este efecto se corrobora en la prueba de campo abierto al evaluar la conducta de acicalamiento que como se mencionó anteriormente es un indicador de estrés, en este caso M. grandiflora bloquea el efecto del estrés sobre el acicalamiento, de la misma manera que con la inmovilidad en el de nado forzado. 47 Una limitante del presente estudio es que no se realizó un perfil fitoquímico del extracto y no se identificaron los metabolitos secundarios responsables del efecto aquí estudiado, pero de acuerdo a los estudios reportados sobre la fitoquímica de M. grandiflora indican que los metabolitos presentes en sus hojas son de tipo monoterpénico, aceites esenciales, diterpenos, ácido grandiflorénico, ácido kaurenoico y kauradienoico y esteroles como el β-sitosterol y el estigmasterol, un precursor de progesterona, hormona que tiene un efecto importante sobre los trastornos emocionales como la depresión. Los esteroles presentes en las hojas de M. grandiflora pudieran ser los responsables del efecto inmediato observado en la prueba de nado forzado (PérezAmador et al., 2006; Rodríguez-Landa et al., 2007), debido que interactúan con el receptor GABAA que es de tipo ionotrópico, esta es una posibilidad que abre la pauta a realizar otros estudios para confirmar o refutar nuestra propuesta. Finalmente, nuestro estudio aporta información acerca del efecto de M. grandiflora sobre la desesperanza conductual en ratas forzadas a nadar, sin embargo es necesario continuar con los estudios para definir el mecanismo farmacológico y los metabolitos responsables de producir el efecto observado por el extracto acuoso de M. grandiflora, con la finalidad de dar continuidad a la búsqueda de nuevas opciones terapéuticas para el trastorno de la depresión asociada al estrés crónico, y del mismo modo, identificar los posibles efectos colaterales que pudieran limitar su uso en el futuro. Además, una aportación metodológica de este estudio es la de haber suspendido el tratamiento farmacológico y haber evaluado el post tratamiento, lo cual de alguna manera nos permite argumentar posibles cambios plásticos a nivel cerebral asociados al tratamiento con antidepresivos, pero no con sustancias que aunque reducen la inmovilidad, al parecer no están modificando la neurobiología cerebral y por lo tanto no pueden ser considerados como antidepresivos, sino como sustancias con potenciales efectos antiestrés, que podrían prevenir el desarrollo de enfermedades asociadas con el estrés crónico. 48 Conclusión El extracto acuoso de M. grandiflora (50 mg/kg) ejerce un efecto protector contra el estrés generado por el nado forzado, más que un efecto anti-desesperanza; lo cual contrasta con el efecto antidesesperanza producido por el antidepresivo fluoxetina. Estos datos soportan el uso tradicional de M. grandiflora para el control de las alteraciones de la ansiedad, pero no de la depresión, en los cuales el estrés pudiera ser el desencadenante principal. Prospectivas Para dar continuidad a este trabajo se debe elucidar la duración del efecto del extracto acuoso de M. grandiflora por medio de un estudio que evalúe el efecto en tiempos muy cortos durante 24 horas. Además se debe realizar el estudio fitoquímico del extracto para determinar cuál es el metabolito secundario responsable del efecto protector en la prueba de nado forzado que impide que se establezca la desesperanza en los animales forzados a nadar. Estos puntos permitirán estudiar nuevas opciones terapéuticas para los trastornos afectivos como la depresión. 49 Referencias Adefunmilayo, E., Taiwo, Leite, B. F., y Ferreira, V. M. Anxiolytic and antidepressant-like effects of Melissa officinalis (lemon balm) extract in rats: Influence of administration and gender. Indian J. Pharmacol. 2012. 44(2): 189-192. Aldridge, J.W., y Berridge, K.C. Coding of serial order by neostriatal neurons: a “natural action” Approach to movement sequence. J. Neurosci., 1998. 18: 2777-2787. American Psychiatric Association. DSM-IV, Diagnostic and statistical manual of mental disorders. 4 ed. Washington: APA; 2000. 345-59. Baldessarini, R.J., Faedda, G.L., y Itennen, J. Risk of mania with serotonin reuptake inhibitor vs. tricyclic antidepressants in children, adolescents and young adults. Arch. Pediatr. Adolesc. Med., 2005, 159:298-299. Baldessarini, R.J., Farmacoterapia de la depresión y de los trastornos de ansiedad, en las bases farmacologicas de la terapeutica, L.L. Brunton, J.S. Lazo, and K.L. Parker, Editors. 2007, McGraw Hill: Mexico. 429-59. Berridge, K.C., Fentress, J.C., y Parr, H. Natural syntax rules control action sequence of rats. Behav. Brain. Res., 1987. 23: 59-68. Carro-Juárez, M., Cervantes, E., Cervantes-Méndez, M., Rodríguez-Manzo, G. Aphrodisiacs properties of Montanoa tomentosa aqueous crude extract in male rats. Pharmacol Biochem and Behav., 2004. 78: 129–134. Carro-Juárez, M., Rodríguez-Landa, J. F., Rodríguez-Peña, M de L., RovirosaHernández, M de J., García-Orduña, F. The aqueous crude extract of Montanoa frutescens produces anxiolytic-like effects similarly to diazepam in Wistar rats: involvement of GABAA receptor. J. Ethnopharmacol. 2012; 143 (2). 592-8. Castagne, V., Moser P., Roux S., y Porsolt R. D. Rodent models of depression: forced swim and tail suspension behavioral despair tests in rats and mice. Curr, Protoc. Neurosci., 2011. Chapter 8: p. Unit 8 10A. Castagne, V., Porsolt, R.D., y Moser, P. Use of latency to immobility improves detection of antidepressant-like activity in the behavioral despair test in the mouse. Eur. J. Pharmacol., 2009. 616(1-3): 128-33. 50 Ceci, A., Baschirotto, A., Borsini, F. Effect of fluoxetine on the spontaneous electrical activity of fronto-cortical neurons. Eur. J. Pharmacol. 1993. 250: 461–464. Contreras, C. M., Chacón, L., Rodríguez-Landa, J. F., Bernal-Morales, B., GutiérrezGarcía, A. G., Saavedra, M. Spontaneous firing rate of lateral septal neurons decreases after forced swimming test in Wistar rat. Prog. Neuro- Psychopharmacol. Biol. Psychiat. 2004. 28: 343–348. Contreras, C. M., Rodríguez-Landa JF., Gutierrez-Garcia, AG., Bernal-Morales, B. The lowest effective dose of fluoxetine in the forced swim test significantly affects the firing rate of lateral septal nucleus neurones in the rat. J. Psychopharmacol., 2001. 15(4). 231. Contreras, C. M., Rodríguez-Landa, JF., Gutiérrez-García, AG., Bernal-Morales, B., Saavedra, M. El estudio experimental de la ansiedad y la depresión. Ciencia, 2003. 54:. 29-39. Contreras, C. M., Saavedra, M., Rodríguez-Landa, J. F., Bernal-Morales, B., GutiérrezGarcía, A. G. Neuroquímica de la emoción y la motivación. En HernándezGonzález M, ed. Motivación animal y humana. México: El Manual Moderno; 2002. 39-64. Contreras, C.M., Martínez-Mota, L., Saavedra, M., 1998. Desipramine restricts estral cycle oscillations in swimming. Prog. Neuropsychopharmacol. Biol. Psychiat. 22, 1121–1128. Contreras, C.M., Martinez-Mota, L., y Saavedra, M. Desipramine restricts estral cycle oscillations in swimming. Prog. Neuropsychopharmacol. Biol. Psych., 1998. 22(7): 1121-8. Contreras, C.M., Marvan, M.L., Alcalá-Herrera, V., y Guzmán-Sáenz, M.A. Chronic clomipramine increases firing rate in lateral septal nuclei of the rat. Physiol. Behav., 1990. 48(4): 551-4. Contreras, C.M., Rodríguez-Landa, J., Bernal-Morales, B., Gutiérrez-García, A.G., y Saavedra, M. Timing of progesterone and allopregnanolone effects in a serial forced swim test. Sal. Ment., 2011. 34: 309-314. 51 Cortez-Gallardo, V., Macedo-Ceja, JP., Arteaga-Aureoles, G., Hernández- Arroyo, M., Espinosa, D., Rodríguez-Landa JF. Farmacognosia: breve historia de sus orígenes y su relación con las ciencias médicas. Rev Biomed 2004; 15: 123-36. Critchley, H. Emotion and its disorders. Br Med Bull, 2003. 65: 35-47. D’Aquila, P.S., Peana, A.T., Carboni, V., y Serra, G. Exploratory behaviour and grooming alter repeated restraint and chronic mild stress: effect of desipramine. Eur. J. Pharmacol., 2000. 399: 43-47. De la Cruz-Badiano, Codex, 1552. Libellus de Medicinalibus Indorum Herbis. Ediciones del Instituto Mexicano del Seguro Social, México D.F. Detke, M.J., Johnson, J. y Lucki, I. Acute and chronic antide- pressant drug treatment in the rat forced swimming test model of depression. Exp. Clin. Psychopharmacol., 1997. 5(2): 107-12. DeVries, A.C., Glasper, E.R. y Detillion, C.E. (2003). Social modulation of stress responses. Physiol. Beh., 79, 399-407. Dolan, R.J., Emotion, cognition, and behavior. Science, 2002. 298(5596): 1191-4. Dubrovsky, B.O. Steroids, neuroactive steroids and neurosteroids in psychophathology. Prog. Neuropsychopharmacol. Biol. Psychiat., 2005; 29: 169-92. Duman, R.S. y Monteggia, L.M. A neurotrophic model for stress-related mood disorders. Biol. Psychiat., 2006. 59(12): 1116-27. Duncan, G.E., Jhonson, K.B., y Breese, G.R. Topographic patterns of brain activity in response to swim stress: Assessment by 2-deoxyglucose uptake and expression of fos-like immunoreactivity. J. Neurosci., 1993. 13(9): 3932-3243. Espejo, E.F., Miñano, F.J., 1999. Prefrontocortical dopamine depletion induces antidepressant-like effects in rats and alters the profile of desipramine during Porsolt’s test. Neuroscience 88, 609–615. Estrada, A.V., Enríquez, R.G., Lozoya, X., Bejar, E., Girón, H., Ponce- Monter,H.,Gallegos,A.J. The Zoapatle II. Botanical and ecological determinants. Contraception,. 1983 27,227–237. Estrada-Camarena, E., Fernandez-Guasti, A., y Lopez- Rubalcava, C. Antidepressantlike effect of different estrogenic compounds in the forced swimming test. Neuropsychopharmacol., 2003. 28(5): 830-8. 52 Estrada-Camarena, E., López-Rubalcava, C., Vega-Rivera, N., Récamier-Carballo, S., y Fernández-Guasti, A. Antidepressant effects of estrogens: a basic approximation. Behav. Pharmacol., 2010. 21(5-6): 451-64. Fentress, J.C. The tonic hypothesis and the patterning of behaviour. Ann NY Acad. Sci., 1977. 525: 370-394. Fernández-Teruel, A., Boix, F., Escorihuela, R.M., Yanez, P., y Tobeña, A. Activity of several GABAergic agents on the behavioral ‘despair’ test in rats. Psychiat. Psycobiol., 1989. 4: 167-173. Funada, M. y Hara, C. Differential effects of psychological stress on activation of the 5hydroxytryptamine and dopamine containing neu-rons in the brain of freely moving rats. B. Rese., (2001). 90, 247-251. Gallegos, A.J. The zoapatle I. A traditional remedy from Mexico emerging to modern times. Contraception., 1983. 27, 211–225. Gallegos, A.J. The zoapatle VI. Revisited. Contraception., 1985. 31, 487–497. Ghaemi, S.N., Lenox, M.S., y Baldessarini, R.J. Effectiveness and safety of long-term antidepressant treatment in bipolar disorder. J. Clin. Pshych., 2001, 62:565-569. Gourion, D. Antidepressants and their onset of action: a major clinical, methodological and pronostical issue. Encephale., 2008. 34(1): 73-81. Griebel, G., Sanger, D., Perrault, G. The use of the rat elevated plus-maze to discriminate between non-selective and BZ, selective, benzodiazepine receptor ligands. Psychopharmacol., 1996. 124, 245–254. Guest, P.C., Knowles, M.R., Molon-Noblot S., Salim, K., Smith, D., Murray, F., Laroque, P., Hunt, S.P., De Felipe, C., Rupniak, N.M., McAllister, G. Mechanisms of action of the antidepressants fluoxetine and the substance P antagonist L-000760735 are associated with altered neurofilaments and synaptic remodeling. Brain Res., 2004. 1002(1-2): 1-10. Gutiérrez-García, A.G., Contreras, C.M., Mendoza-López, M.R., Cruz-Sánchez, S., García-Barradas, O., Rodríguez-Landa, J.F., Bernal-Morales, B. A single session of emotional stress produces anxiety in Wistar rats. Behav Brain Res., 2006. 167(1): 30-5. 53 Hahn, D.W., Ericson, E.W., Lai, M.T., Probst, A. Antifertility activity of Montanoa tomentosa (Zoapatle). Contraception., 1981. 23, 133–140. Hata, T., Nishimura, Y., Kita, T., Itoh, E., y Kawabata, A. The abnormal open-field behavior of SART-stressed rats and effects of some drug son it. Jpn J. Pharmacol., 1988. 48(4): 479-490. Herrera-Perez, J.J., Martinez-Mota, L., y Fernandez-Guasti, A. Aging increases the susceptibility to develop anhedonia in male rats. Prog. Neuropsychopharmacol Biol. Psychiat., 2008. 32(8): 1798-803. Horst, W.D., y Preskorn, S.H. Mechanisms of action and clinical characteristics of three atypical antidepressants: venlafaxine, nefazodone, bupropion. J. Affect. Disord., 1998. 51(3): 237-54. Instituto de Biología. UNIBIO: "Montanoa grandiflora-IBUNAM: MEXU:OAX944615". Colecciones Biológicas. 2011-08-12. Universidad Nacional Autónoma de México. Consultada en: 2014-10-14. Disponible en <http://unibio.unam.mx/collections/specimens/urn/IBUNAM:MEXU:OAX944615> Johnson, E.O., Kamilaris, T.C., Chrousos, G.P. y Gold, P.W. Mechanisms of stress: a dynamic overview of hormonal and behavioral homeostasis. Neurosc. Y Biobehav. Rev., 1992. 16, 115–130. Jolles, J., Rompa-Barendregt, J., y Gispen, W.H. Novelty and grooming behavior in the rat. Behav. Neural. Biol., 1979. 25: 563-572. Kalueff, AV, Touhimaa, P. Contrasting grooming phenotypes in three mouse strains markedly different in anxiety and activity (129S1, BALB/c and NMRI). Behav Brain Res., 2005. 160(1): 1-10. Kalueff, AV, Touhimaa, P. Grooming analysis algorithm for neurobehavioural stress research. Brain Res. Protoc., 2004. 13(3): 151-158. Katz, R.J., Roth, K.A. y Carroll, B.J. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression. Neur and Biobehav Rev., 1981. 5, 247–251. Kinghorn, AD. Pharmacognosy in the 21st century. J. Pharm. Pharmacol., 2001; 53: 135-48. 54 Ladewig, J. Chronic intermittent stress: a model for the study of long-term stressors, en the biology of animal stress, Moberg, G.P., y Mench, J.A. Editors. 2000, CAB International: Wallingford. 159-69. Levine, S.D., Hahn, D.W., Cotter, M.l., Greenslade, F.C., Kanojia, R.M., Pasquale, S.A., Wachter, M., McGuire, J.L. The Mexican plant zoapatle (Montanoa tomentosa) in reproductive medicine. Past, present and future. J. Repr. Med., 1981. 26, 524– 528. Lozano-Hernandez, R., Rodriguez-Landa, JF., Hernandez-Figueroa, JD., Saavedra, M., Ramos-Morales, FR., Cruz-Sánchez, S. Antidepressant-like effects of two commercially available products of Hypericum perforatum in the forced swim test: A long-term study. J. Med Plan., 2010. 4: 131-7. Majewska, M.D. Neurosteroids: endogenous bimodal modulators of the GABAA receptor. Mechanism of action and physiological significance. Prog. Neurobiol., 1992. 38(4): 379-95. Martinez-Mota, L., Contreras, C.M., y Saavedra, M. Progesterone reduces immobility in rats forced to swim. Arch. Med. Res., 1999. 30(4): 286-9. Marván, ML., Alcalá-Herrera, V., Chacón, L., Contreras, CM. El desarrollo de los conceptos biológicos sobre la depresión. Bol. Est. Méd. Biol. Méx., 1988; 36: 6174. McEwen, B.S., Stressed or stressed out: what is the difference? J. Psychiatry Neurosci., 2005. 30(5): 315-8. McKinney, W.T., Bunney, W.F. Animal model of depression. I Review of evidence: implications for research. Arch. Gen. Psychiat., 1969. 240-248. Mercier, S., Frederic, C., Buguet, A., Cespuglio, R., Martin, S., y Burdon, L. Behavioral changes after an acute stress: stressor and test type’s influences. Behav. Brain Res, 2003. 139(1-2): 167-75. Moreau, J.L. Validation of an animal model of anhedonia, a major symptom of depression. Encephale., 1997. 23, 280–289. Moscoso, M.S. Estrés salud y emociones: estudio de la ansiedad, cólera y hostilidad. Revist. Psicol., 1998. 3, 9-17. 55 National Research Council, Guide for the Care and Use of Laboratory Animals, Publication no. 85-23, National Academy Press,Washington, DC, USA, 1985. NOM-062-ZOO-1999, Especificaciones Técnicas para la Producción, Cuidado y Uso de los Animales de Laboratorio, Secretarıa de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Ongur, D., Drevets, W.C., y Price, J.L. Glial reduction in the subgenual prefrontal cortex in mood disorders. Proc. Natl. Acad. Sci. U S A., 1998. 95(22): 13290-5. Páez, X., Hernández, L., Baptista, T. Avances en la terapéutica molecular de la depresión. Rev. Neurol., 2003; 37: 459-70. Pérez-Amador, M.C., Muñoz, V., Noyola, A., y García-Jiménez, F. Aceites esenciales y compuestos fototóxicos en Clibadium surinamense L. y Montanoa grandiflora D.C. (Asteraceae). Rev. Int. Bot. Exp., 2006. 75. 145-150. Ponce-Monter, H., Girón, H.,, Lozoya, X., Enríquez, R.G., Bejar, E., Estrada, A.V., Gallegos, A.J.The Zoapatle III. Biological and uterotonic properties of aqueous plant extract. Contraception., 1983 27, 239–253. Porsolt, R.D., Antón, G., Blavet, N. y Jalfre, M. Behavioral despair in rats: a new model sensitive to antidepressant treatments. Eur. J. Pharmacol., 1978. 47, 379-391. Porsolt, R.D., Le Pichon, M., y Jalfre, M. Depression: a new animal model sensitive to antidepressant treatments. Nature., 1977. 266(5604): 730-2. Rall, T.W., y Schleifer, L.S. Farmacos efectivos en el tratamiento de la epilepsia. En: Goodman, G.A., Ral, T.W., Niees, A.S., y Taylor, P. Ed. Las bases farmacológicas de la terapéutica, 8va. México. DF. Med. Panam., 1991. Rodríguez-Landa, J.F, Contreras, C.M, Gutiérrez-García, A.G, Bernal-Morales, B. Chronic, but not acute, clomipramine or fluoxetine treatment reduces the spontaneous firing rate in the mesoaccumbens neurons of the rat. Neuropsychobiol. 2003. 48: 116–123. Rodríguez-Landa, J.F., Bernal-Morales, B., Gutierrez-Garcia, A.G. Estrés Miedo ansiedad y depresión. Ed. Coria-Ávila, G.A. Neurofisiología de la conducta cerebro y comportamiento. Universidad veracruzana. 2012. ISBN: 9786075021911 56 Rodríguez-Landa, J.F., Contreras, C.M., Bernal Morales, B., Gutiérrez-García, A.G., Saavedra, M. Allopregnanolone reduces immobility in the forced swimming test and increases the firing rate of lateral septal neurons through actions on the GABAA receptor in the rat. J. Psychopharmacol, 2007. 21(1): 76-84. Rodríguez-Landa, J.F., Pulido-Criollo, F., y Saavedra, M. Depression in Precolumbian Mesoamerican medicine. Rev. Neurol., 2007. 44(6): 375-80. Rodríguez-Landa, J.F., Vicente-Serna, J., Rodríguez-Blanco, L.A., Rovirosa-Hernández, M.J., García-Orduña, F., y Carro-Juárez, M. Montanoa frutescens and Montanoa grandiflora extracts reduce anxiety-like behavior during the Metestrus-Diestrus phase of the ovarian cycle in Wistar rats. Biomed. Res. Intern., 2014. Rodríguez-Landa, J.F., y Contreras, C.M. A review of clinical and experimental observations about antidepressant actions and side effects produced by Hypericum perforatum extracts. Phytomedicine, 2003. 10(8): 688-99. Rodríguez-Landa, J.F., y Contreras, C.M. Aportación de la investigación básica al estudio de la participación de los neuroesteroides en la depresión. En: Trimboli, A., Fantin, J.C., Raggi, S., y Friedman, P. Ed. Encrucijadas actuales en salud mental. Buenos Aires. Akadia editorial., 2006. 103-106. Rodríguez-Landa, J.F., y Contreras, C.M. Los fármacos antidepresivos y sus acciones en algunas estructuras del sistema límbico. La ciencia y el hombre, 1998. 30: 5163. Rodríguez-Landa, J.F., y Contreras, C.M. Los fármacos antidepresivos y la conducta de inmovilidad en la prueba de nado forzado: participación de los sistemas de neurotransmisión. Arch. Neurocien. (Mex)., 2000. 5: 74-83. Roxo, M., Franceschini, P., Zubaran, C., Kleber, F., y Sander, J. The limbic system conception and its historical evolution. J. T.S.W., 2011. 11, 14. Rygula, R., Abumaria, N., Flugge, G., Fuchs, E., Ruther, E. y Havemann-Reinecke, U. Anhedonia and motivational deficits in rats: impact of chronic social stress. Behav. Brain Res., (2005) 162, 127-134. Sacher, J., Houle, S., Parkes, J., Rusjan, P., Sagrati, S., Wilson, A.A., y Meyer, J.H. Monoamine oxidase A inhibitor occupancy during treatment of major depressive 57 episodes with moclobemida or St. John’s wort: an [11C]-harmine PET study. J. Psych. Neurosci., 2011. 36(6): 375-82. Schatzberg, A.F., y Nemeroff, C.B. Tratado de Psicofarmacologia. España. Elsevier Press., 2006. 223-444. Seligman, M.E. y Maier, S.F. Failure to escape traumatic shocks. J. Exp. Psychiatric., 1967. 122, 1-9. Seligman, M.E., y Beagley, G. Learned helplessness in the rat. J. Comp. Physiol. Psychol., 1975. 88(2): 534-41. Selye, H. A syndrome produced by diverse nocuous agents. J. Neuropsych. Y Clin. Neurosc., 1936. 10, 230-231. Sheehan, T.P., Chambers, R.A., Russell, D.S. Regulation of affect by the lateral septum: implications for neuropsychiatry. Brain. Res. Rev. 2004 46: 71–117. Stassen, H.H., Angst, J., y Delini-Stula, A. Delayed onset of action of antidepressant drugs? Survey of recent results. Eur Psych., 1997. 12(4): 166-176. Stone, E.A., Lin, Y., y Quartermain, D. A final common pathway for depression? Progress toward a general conceptual framework. Neur. Biobehav. Rev., 2008. 32(3): 508-24. Tian, J., Zhang, F., Cheng, J., Guo, S., Liu, P., y Wang, H. Antidepressant-like activity of adhyperforin, a novel constituent of Hypericum perforatum L. Scient. Rep., 2014. 4. 5632. Trincavelli, M.L., Da Pozzo, E., Daniele, S., Martini, C. The GABAA-BZR complex as target for the development of anxiolytic drugs. Curr Top Med Chem., 2012 12, 254–269. Uriarte-Bonilla, V. Psicofarmacologia.. 2009, Mexico: Trillas. Uzunova, V., Sheline, Y., Davis, J.M., Rasmusson, A., Uzunov, D.P., Costa, E., y Guidotti, A. Increase in the cerebrospinal fluid content of neurosteroids in patients with unipolar major depression who are receiving fluoxetine or fluvoxamine. Proc. Natl. Acad. Sci. U S A., 1998. 95(6): 3239-44. Van Dijken, H.H., van der Heyden, J.A.M., Mos, J., y Tilders, F.J.H. Inescapable footshocks induce progressive and long-lasting behavioural changes in male rats. Physiol. Behav., 1992. 51(4): 787-794. 58 Van Erp, A.M., Kruk, M.R., Meelis, W., y Willekens-Bramer, D.C. Effect of environmental stressors on time course, variability and form of self-grooming in the rat: handling, social contact, defeat, novelty, restraint and fur moistening. Behav. Brain. Res.,1994. 65(1): 47-55. Van Praag, H.M. Can stress cause depression? Prog. Neuro-Psychopharmacol y Biolog Psych., 2004. 28: 891-907. Vanelli, M., y Coca-Perraillon, M. Role of patient experience in antidepressant adherence: a retrospective data analysis. Clin. Theraph., 2008. 30(9): 1737-1745. Varty, G.B., Morgan, C.A., Cohen-Williams, M.E., Coffin, V.L., Carey, G.J. The gerbil elevated plus-maze: I. Behavioral characterization and pharmacological validation. Neuropsychopharmacol., 2002 27, 357–370. Vázquez-Palacios, G., Bonilla-Jaime, H., y Velázquez-Moctezuma, J. Antidepressantlike effects of the acute and chronic administration of nicotine in the rat forced swimming test and its interaction with fluoxetine. Pharmacol. Bioch and Behav., 2004. 78. 165-169. Vermetten, E., y Bremner, J.D. Olfaction as a traumatic reminder in posttraumatic stress disorder: case reports and review. J. Clin. Psych., 2003. 64(2): 202-7. Wieland, S., y Lucki, I. Antidepressant-like activity of 5-HT1A agonists measured with the forced swim test. Psychopharmacol. (Berl)., 1990. 101(4): 497-504. Willner, P. Chronic mild stress (CMS) revisited: consistency and behaviouralneurobiological concordance in the effects of CMS. Neuropsychobiol., 2005. 52(2): 90-110. Wimbiscus, M., Kostenko, O., y Malone, D. MAO inhibitors: risks, benefits, and lore. Cleve Clin. J. Med., 2010. 77(12): 859-82. Ximenez, F. Quatro libros de la naturaleza y virtudes de las plantas y animales que están recibidos en el uso de medicina en la Nueva España, y la método, y corrección y preparación que para administrarllas se requiere con lo que el doctor Francisco Hernández escribió en lengua latina. Viuda de Diego López Davalos, México., 1615. Zhu, D., Wang, M.D., Bäckström, T., y Wahlström, G. Evaluation and comparison of the pharmacokinetic and pharmacodynamic properties of allopregnanolone and 59 pregnanolone at induction of anaesthesia in the male rat. Brit. J. Anaesth., 2001. 86(3):403-412. 60