Norma Toma de Muestras
Anuncio

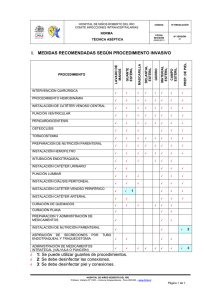
TOMA DE MUESTRAS MICROBIOLÓGICAS Fecha de actualización: Abril de 2008 En vigencia desde: Junio de 2008 DIRIGIDO A: Médicos Enfermeras Matronas Tecnólogos Médicos Técnicos Paramédicos OBJETIVOS: 9 Identificar las muestras representativas de los diferentes procesos infecciosos. 9 Conocer las condiciones adecuadas para el mejor rendimiento de los cultivos. 9 Racionalizar la toma de cultivos NORMAS GENERALES PARA LA TOMA DE MUESTRAS 9 9 9 9 9 9 9 9 Utilizar siempre precaución estándar. Realizar la recolección con equipo estéril y técnica aséptica Obtener las muestras, en lo posible, antes del uso de antibióticos. Para que la muestra sea representativa del sitio de infección, se debe evitar la contaminación de ésta, con la flora comensal del paciente. Recolectar una adecuada cantidad de muestra, para evitar resultados falsos negativos. Si la muestra se obtiene a través de punción de la piel, ej.: abscesos de tejidos blandos realizar aseo previo con agua y jabón y luego povidona yodada al 10%, dejar actuar por 2 minutos. Toda muestra debe ser enviada inmediatamente al Laboratorio, en medio de transporte específico de acuerdo al tipo de muestra, proporcionado por el Laboratorio, con tapa, rotulado con el nombre del paciente, N° de ficha o Rut, fecha y hora de la recolección. No debe contaminarse con muestra, la superficie externa del recipiente ni la solicitud de examen. Toda muestra debe acompañarse de una solicitud de examen que incluya los siguientes datos: nombre del paciente, edad, N° ficha o Rut, procedencia, tipo de muestra, examen solicitado, diagnóstico probable, uso previo de antibióticos y fecha. Todos estos datos aseguran el correcto Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] procesamiento de la muestra y la adecuada interpretación de los cultivos y/o test bacteriológico. Cuando se requiera la búsqueda de patógenos no habituales, debe especificarse en la solicitud del examen, para así adecuar el estudio. TIPO DE MUESTRAS MÁS FRECUENTES 9 Secreciones: Frotar con tórula humedecida e introducir en medio de transporte de Stuart 9 Deposiciones: Introducir tórula humedecida en la zona más alterada de las deposiciones recién emitidas e introducir en medio transporte Cary Blair 9 Sangre: Hemocultivos tomados por punción con Técnica aséptica e inoculación inmediata en frasco de hemocultivo. 9 Otros fluidos: Tomar alrededor de 2ml con Técnica Aséptica y transporte en tubo estéril. 9 Punciones: Tomar con Técnica Aséptica y enviar alrededor de 2ml en la misma jeringa debidamente sellada. 9 Anaerobios: Tomar con Técnica aséptica 10 ml en jeringa, sellar y enviar al laboratorio (en medio de transporte para anaerobios). Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] HEMOCULTIVOS 1) CONSIDERACIONES 9 Evitar la contaminación de la muestra durante la extracción, son contaminantes habituales los microorganismos de la piel y del personal que realiza la técnica. 9 La muestra debe ser tomada por personal capacitado, con técnica aséptica y utilizando guantes estériles. 9 No se debe extraer sangre a través de catéteres intravasculares. 9 Puede realizarse punción arterial o venosa. Momento de la extracción: Las muestras deben extraerse idealmente: 9 Al momento de la bacteremia, es decir antes de presentarse el peack febril (calofríos). 9 Antes de iniciar la terapia antimicrobiana. En pacientes que estén recibiendo terapia antimicrobiana, las muestras deben tomarse en el momento de menor concentración sanguínea del antibiótico. Si existiera urgencia clínica pueden tomarse en cualquier momento dentro de las 24 horas. Lugar y frecuencia de la extracción: Las muestras deben tomarse separadas por intervalos de 30 minutos y de sitios anatómicos distintos En caso de Urgencia las muestras pueden obtenerse a menor intervalo de tiempo pero siempre de sitios anatómicos diferentes. 2) PROCEDIMIENTO: Preparación de la piel: a) Lavar la piel de la zona de punción con agua y jabón. b) Friccionar la zona de punción, en forma concéntrica, con alcohol al 70% y dejar actuar hasta que se seque. c) Colocarse guantes estériles d) Proceder a extraer la muestra Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] Inoculación de los viales Se debe descontaminar el tapón de goma del frasco de hemocultivo con alcohol 70% y esperar que se seque antes de puncionar e introducir la muestra de sangre Volumen de la muestra: Se recomienda extraer una proporción de sangre/medio de cultivo de a lo menos 1:5 Adultos: 10 ml. y depositar en frasco Bact Alert FA de medio de cultivo. Niños: (2 a 12años) 3-5 ml. y depositar en frasco Bact Alert PF de medio de cultivo. Lactantes: 2-3 ml. y depositar en frasco Bact Alert PF de medio de cultivo. R.N.: 1-2 ml. y depositar en frasco Bact Alert PF de medio de cultivo. 3) NÚMERO DE MUESTRAS Es suficiente tomar 2 muestras para establecer el diagnóstico de infección, ya que con la tercera la sensibilidad de pesquiza no aumenta. En otros casos como endocarditis infecciosa el número de muestras puede ser mayor. 4) MANTENCIÓN Y TRANSPORTE DE LAS MUESTRAS: Mantener y transportar los viales a Tº ambiente y enviar de inmediato al laboratorio para su procesamiento. Nunca refrigerar 5) INFORME: Se emitirá dentro del período de estudio (5 días), salvo en aquellos casos especiales, en donde los informes se darán a conocer cuando se presente la positividad de los hemocultivos por la vía mas expedita. Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] DIAGNOSTICO DE INFECCION ASOCIADA A CATETER VENOSO CENTRAL Permiten el diagnóstico microbiológico de bacteremia asociada al uso de catéter venoso central 1. Técnica de cultivo semicuantitativo de Maki: Al retirar el catéter venoso central se deberá cortar 3 cm. de la punta con tijera estéril y depositar en tubo estéril. En forma simultánea se deben tomar 2 hemocultivos de sangre periférica del paciente, siguiendo las recomendaciones habituales de lugar, frecuencia y procedimiento de la toma de muestra y enviar de inmediato cada una de las muestras a laboratorio. 2. Técnica de hemocultivo cuantitativo (En caso que no se retire cateter): Consiste en la obtención de una muestra de sangre heparinizada por venopunción y, simultáneamente, una muestra de sangre heparinizada a través del catéter, además de dos hemocultivos periféricos. LOS CULTIVOS RUTINARIOS DE PUNTA DE CATÉTERES, POR SI SOLO NO SON PREDICTIVOS DE INFECCIONES DEL TORRENTE SANGUINEO, ESTA PRÁCTICA SÓLO CONSUME TIEMPO Y DINERO Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] INFECCION GASTRO INTESTINAL Para Coprocultivo 1) Introducir tórula limpia en la zona más alterada de las deposiciones recién emitidas (mucus o sangre), antes de instaurar terapia antibiótica. 2) Introducir la tórula en el tubo proporcionado por el Laboratorio que contiene medio de transporte cary-blair (medio color blanco). 3) Transportar de inmediato al Laboratorio. 4) Las muestras pueden tomarse directamente del recto, del pañal o receptáculo limpio. 5) En caso de tomar muestras durante la noche mantener, en el medio de transporte, a temperatura ambiental y entregarlas al Laboratorio a primera hora del día siguiente. 6) Las muestras por coprocultivos serán recepcionadas durante la jornada de rutina hasta las 16:00 horas. Aquellas muestras que se reciban con posterioridad, serán procesadas al día siguiente. Para leucocitos fecales: Enviar deposiciones frescas en tubo limpio y seco sin medio de transporte. Las muestras tomadas por rectoscopía o colonoscopías tienen mayor rendimiento, por cuanto de ser posible es recomendable obtener las muestras de esta forma. Para Clostridium difficile: Enviar 5 a 10 ml de deposiciones recién emitidas en tubo o frasco limpio y seco. Para vibrio spp y aeromonas: Tomar muestra de deposiciones recién emitidas, teniendo en consideración consignar en la solicitud del examen su búsqueda específica, esto asegura su búsqueda dirigida Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] INFECCIÓN URINARIA Muestra Miccional 1. Recolectar orina de primera micción de la mañana y segundo chorro, previo aseo genital prolijo, separando los labios en la mujer y retrayendo el prepucio en el varón durante el procedimiento empleando sólo agua tibia, no usar jabón o similar. 2. Recibir muestra de orina en receptáculo estéril; antes de instaurar terapia antimicrobiana. 3. Enviar de inmediato al Laboratorio, ya que la tardanza altera el recuento bacteriano e induce a falsos diagnósticos de infección urinaria. 4. Frente al uso de recolector de orina, este no debe permanecer en el paciente por más de 20 minutos ya que, se expone a contaminación externa. Muestra por punción de catéter urinario 1. No debe pinzarse el catéter antes de obtener la muestra 2. La superficie externa del catéter debe limpiarse con una tórula con alcohol 70% y esperar que seque. 3. La punción se efectúa con técnica y material estéril en un ángulo de 30° en el sitio indicado para ello. 4. Aspirar 5-6 cc de orina y depositar en frasco estéril. 5. Enviar de inmediato al Laboratorio. Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] SECRECIONES Toma de muestra secreciones: 1.- Lavar con agua y jabón la zona y desinfectar con povidona yodada al 10%, dejar actuar durante 2 minutos. Efectuar con Técnica Aséptica la aspiración percutánea. 2.- Tomar secreción con tórula o jeringa estéril, antes de instaurar terapia antibiótica e introducir en tubo con medio de transporte adecuado, semisólido (stuart), si la muestra es tomada con tórula. Si la muestra es líquida, introducirla en tubo seco estéril si además de cultivo se solicita otro procedimiento como por ejemplo una tinción de gram, enviar dos muestras. Transportar de inmediato al Laboratorio. 3.- Las punciones de líquidos pleurales, articulares y otras secreciones líquidas, donde haya que penetrar a cavidad aséptica debe hacerse con campo estéril. Depositar el contenido en tubo seco estéril. INFECCIONES DE HERIDA OPERATORIA Heridas y Ulceras: Toma de muestra Superficial: 1. Limpiar la herida por arrastre mecánico con suero. 2. Frotar con tórula estéril el centro y bordes internos de la lesión. 3. colocar en medio de transporte y enviar inmediatamente al laboratorio, de lo contrario poner muestra en tubo de medio de transporte Stuart. Toma de muestra profunda: 1. Limpiar la superficie cruenta con suero fisiológico 2. tomar la muestra con tórula de la parte más profunda de la herida 3. colocar en medio de transporte y enviarla al laboratorio. Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] ABCESOS CERRADOS 1. Desinfectar el sitio de punción con antiséptico. 2. Realizar punción del absceso con jeringa. 3. Aspirar la secreción obteniendo mínimo entre 2-5 cc. 4. Enviar al laboratorio en la misma jeringa, sellada con un tapón estéril. 5. Si se sospecha de anaerobios, tener la precaución de eliminar todo el aire remanente y sellar adecuadamente antes de enviar a Laboratorio. COMENTARIO Las muestras de pus tienen muy mal rendimiento, ya que el pH ácido de este material destruye rápidamente los microorganismos, siendo difícil su aislamiento posterior a la siembra. En caso de otras heridas de piel no operatorias, proceder a la toma de muestras como si se tratara de una herida superficial y transportarlas de igual forma que éstas. Secreción conjuntival: Limpiar la superficie externa del ojo con suero estéril, frotar con tórula humedecida el borde interno de la conjuntiva y colocarla en el medio de transporte stuart para su envío al laboratorio. Secreción ótica: Limpiar el canal auditivo externo, con suero fisiológico estéril, tomar la muestra con tórula estéril y colocarla en el medio de transporte para su envío al laboratorio. Secreción umbilical RN: Tomar muestra directa de la zona umbilical sin previa limpieza, colocar en medio de transporte y enviar al laboratorio. Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] MUESTRAS DE FLUIDOS Y CAVIDADES ESTERILES LIQUIDO CEFALORRAQUIDEO: La muestra de L.C.R. debe ser obtenida por un médico entrenado en la técnica de punción lumbar: Procedimiento: • • • • • Lavar la región lumbar del paciente con agua y jabón Realizar desinfección de la piel con antiséptico, mediante la realización de movimientos concéntricos que van desde el lugar donde se realiza la punción hacia fuera. Espera tiempo de latencia del antiséptico. Proceder a la punción lumbar con técnica aséptica. Recolectar el L.C.R. en dos frascos estériles. Utilizar el segundo frasco para el estudio microbiológico, ya que el primero tiene más posibilidades de contaminación. La cantidad L.C.R afecta directamente la sensibilidad del diagnóstico bacteriológico. En general cantidades de 1 a 3 ml. De L.C.R. para estudio bacteriológico son adecuadas. Transporte: Se debe realizar a la mayor brevedad posible, en frascos estériles ya que la mayoría de los microorganismos causantes de meningitis son sensibles a los cambios de temperatura y desecación. NO REFRIGERAR LIQUIDO PLEURAL: Toma de Muestra: Debe ser realizada por un médico entrenado en la técnica de toracocentesis. La punción aspirativa debe realizarse bajo rigurosa técnica aséptica. Transporte: Enviar la muestra rápidamente al laboratorio a temperatura ambiente en frasco estéril. Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] LIQUIDO ASCITICO Aspirar muestra a través de punción abdominal con técnica aséptica, vaciar a frascos de hemocultivos. Inocular aproximadamente 10 cc. de muestra en frascos de hemoculivo de adulto. (2), enviar al laboratorio. En Caso de solicitar además tinción de gram se deberá enviar una muestra de 1 ml en frasco estéril. MUESTRA DEL TRACTO RESPIRATORIO SUPERIOR SECRECION FARINGEA: Toma de Muestra: a) Cultivo Corriente: 9 Buena iluminación y exposición de la faringe del paciente. 9 Deprimir la lengua con bajalengua. 9 Frotar con tórula esteril amígdalas, pilares anteriores y pared posterior de la faringe. 9 Colocar en el medio de transporte. 9 enviar de inmediato al laboratorio. b) Cultivo en sospecha de Diftería: 9 Tomar dos muestras con tórula utilizando baja lengua, pasándola por reborde de la seudomembrana, o bajo seudomembrana. Transporte: a) Cultivo Corriente y sospecha de Diftería: • Menos de 2 horas enviar la tórula en un tubo estéril seco. • De 2 a 24 hrs. enviar la tórula en medio de transporte (Stuart). b) Cultivo Neissería Meningitidis, y otros anaerobios. • Sembrar inmediatamente en Thayer Martin, si no es posible, introducir la tórula en tubo con medio de transporte (Stuart.) y mantener a temperatura ambiente. Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] ESTUDIO DE VIRUS Y BORDETELLA PERTUSSIS CON SISTEMA DE ASPIRACIÓN TRAQUEAL Toma de Muestra 1. Romper el sobre que contiene el kit de aspiración y conectar el final del tubo con diámetro menor a una sonda de alimentación estéril. 2. Conectar el otro extremo de diámetro mayor a la bomba de vacío. 3. Insertar el tubo de alimentación por una fosa nasal del paciente. 4. Retirar el tubo girando suavemente, repetir el procedimiento en la fosa nasal. 5. Aspirar un volumen aproximado de 8-10 ml de solución tampón pH 7.2 frío, a través del tubo colector para arrastrar toda la secreción. 6. Cambiar la tapa del tubo colector, anotar los datos del paciente con letra clara y legible o en una etiqueta pagada al tubo. 7. Enviar al laboratorio inmediatamente con hoja de inscripción, la muestra debe estar todo el tiempo, hasta su llagada al laboratorio en baño de hielo MUESTRA DEL TRACTO RESPIRATORIO INFERIOR (Neumonía TBC y otras virales) TOMA DE MUESTRAS NO INVASIVAS Esta muestra puede ser obtenida de un paciente consiente, que comprenda las indicaciones. • Es preferible la obtención de la muestra, previo al inicio de la terapia antimicrobiana • El paciente debe lavarse los dientes y realizar enguajes con agua para limpiar cavidad oral. • Mediante tos profunda espontánea o provocada eliminar el esputo en un receptáculo esteril. • Es recomendable facilitar la expectoración con kinesiterapia respiratoria. Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] • En pacientes intubados realizar la aspiración endotraqueal con sonda estéril y técnica aséptica, introducirla, evitando su contaminación con gérmenes exógenos y aspirar depositando el contenido en tubo estéril para su estudio que puede ser cualitativo o cuantitativo. Este último tiene mejor perfil de especificidad. Transporte: Enviar de inmediato al laboratorio, si no es posible mantenerla refrigerada transitoriamente a 4º C por no más de dos hora INFECCIONES GINECO – OBSTETRICAS Secreciones vaginales: Para estudio bacteriológico y de hongos. A través de un especulo frotar con tórula estéril la mucosa vaginal e impregnarla de flujo de los fondos de saco, colocar en medio de transporte y enviar al laboratorio. Para Trichomonas, introducir suero fisiológico tibio, recoger y vaciar en tubo estéril de 3 a 5 ml. Enviar de inmediato al laboratorio. Endocervix: Previo aseo genital, introducir tórula hacia el canal cervical y rotar, colocar la tórula en medio de transporte stuart (color celeste) y enviar al laboratorio. COMENTARIO En caso de Endometritis Puerperal, los cultivos microbiológicos no son necesarios para su notificación ya que es suficiente el criterio clínico, por otra parte la etiología es polimicrobiana y predecible. En caso de brotes de endometritis puerperal, los cultivos se realizan a fin de detectar Streptococcus beta hemolitico grupo A u otro agente no habitual. Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] TRACTO GENITAL MASCULINO Secreción Uretral: Previo aseo genital, exprimir uretra y recibir la secreción en tórula estéril, colocar en medio de transporte y enviar a estudio. Si la secreción es escasa introducir la tórula unos 2 cm. por la uretra, girarla en ambos sentidos, permitiendo que absorba secreción y luego retirarla. La muestra debe tomarse a primera hora de la mañana o después de una hora de orinar. Transporte: La muestra debe transportarse a temperatura ambiente en forma inmediata al laboratorio. Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] VIRUS PROCEDIMIENTO: - Tomar secreción (aspirado nasofaríngeo) o deposiciones según corresponda. - Introducir muestras en recipientes limpios, secos y estériles. Enviar de inmediato al Laboratorio para su refrigeración. ROTAVIRUS: - Tomar muestra de deposición en tubo limpio y seco, y enviar al Laboratorio. ANAEROBIOS - Actualmente no se realiza cultivo para búsqueda de anaerobio en este servicio, sin embargo, es posible realizar tinción de gran cuando la situación lo requiera. PROCEDIMIENTO: - Preparar sitio a puncionar. - Tomar muestra por aspiración y sellar inmediatamente con tapón de goma. - Enviar al Laboratorio protegido para su estudio y corroboración con cultivo aerobio REFERENCIA: - www.ispch.cl/lab_sal/doc/proc_emo.pdf - http://www.biomerieux-diagnostics.com/upload/Blood_Collection_Wall_Chart.pdf - GARCIA C., Patricia, PAYA G., Ernesto, OLIVARES C., Roberto et al. Diagnóstico de las infecciones asociadas a catéteres vasculares centrales. Rev. chil. infectol., 2003, vol.20, no.1, p.41-50. ISSN 0716-1018. - Norma Nº 8 Toma de Muestra para Exámenes Microbiológicos, Junio 2003 Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected] TM Mario Barra Z. Tecnólogo Médico Comité de Infecciones Intrahospitalarias Dra. Mª Alejandra Lobos Floody Medico Jefe Comité de Infecciones Intrahospitalarias Dr. Luis Ferrada Christie Sub Director Médico Director (S) Hospital de Castro Castro, Abril de 2008 Comité de Infecciones Intrahospitalarias, anexo 787, email: [email protected]