Estequiometría
Anuncio

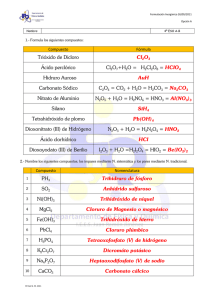
Estequiometría 1. Ajusta las siguientes reacciones: a) A2B3 + C2 A3C + C2B b) A2B + A3BC2 AC + B3C2 2. Ajusta las siguientes reacciones: a) SO2 + Na2CO3 + H2O NaHSO3 + CO2 b) Al(OH)3 + H2SO4Al2(SO4)3 + H2O 3. Clasifica las siguientes reacciones químicas: a) N2 + H2 NH3 b) H2O H2 + O2 c) NH3 + HNO3 NH4NO3 d) CuSO4 + Fe FeSO4 + Cu e) NaOH + HCl NaCl + H2O f) HCl + Zn ZnCl2 + H2 g) CaCO3 CaO + CO2 4. ¿Qué volúmenes de nitrógeno y de hidrogeno, medidos en condiciones normales, se precisan para obtener 20 l de amoníaco, medidos en esas mismas condiciones? Se supone que la reacción H2+ N2 NH3 es completa. 5. Se queman completamente 500 gramos de azufre puro. Si el dióxido de azufre que se desprende se recoge en un recipiente a 10 atm de presión y a 25 ºC de temperatura, ¿qué volumen habrá de tener dicho recipiente? 6. El óxido de plomo(II) se obtiene según la reacción: Sulfuro de plomo(II) + oxígeno óxido de plomo(II) + anhídrido sulfuroso ¿ Qué cantidad de óxido de plomo(II) se obtendrá al tostar una tonelada de galena (PbS) con una riqueza del 70% y qué volumen de anhídrido, medido en condiciones normales, se desprenderá? 7. La combustión del etanol (C2H6O) produce dióxido de carbono y agua. Se pide: A) Calcular el volumen de oxígeno medido en condiciones estándar que se necesitará para producir 2 moles de dióxido de carbono. B) Hallar el número de moléculas de agua que se producirán a partir de 25 moléculas de alcohol. C) Calcular el número de moles de etanol que reaccionarán con 4,6·1024 moléculas de oxígeno. 8. Disponemos de 200 kg de H2S y 300 kg de SO2 y queremos obtener azufre según la reacción: H2S + SO2 H2O + S a) Calcula la masa de azufre obtenido. b) Calcula la masa de azufre obtenido si la reacción tiene un rendimiento el 90%. 9. La fermentación de la glucosa para la obtención del etanol se realiza según la ecuación: C6H12O6 C2H5OH + CO2 Calcula la cantidad de etanol que se obtendrá a partir de 1 Kg de glucosa. 10. Calcula el rendimiento de la reacción de combustión del butano (C4H10), sabiendo que al quemar 40 g de butano se obtienen 80 g de CO2 11. El óxido de calcio reacciona con el ácido clorhídrico produciendo cloruro de calcio y agua. Calcula la masa de cloruro de calcio que se obtiene a partir de 200 g de un óxido de calcio con una pureza del 90%. 12. El cloruro potásico reacciona con el ácido nítrico y oxígeno para dar nitrato potásico, cloro gas y agua. ¿Qué volumen de cloro se obtiene en condiciones normales si hacemos reaccionar 100 g de cloruro potásico con 50 de ácido nítrico y 10 g de oxígeno? 13. ¿Qué volumen de ácido clorhídrico al 55% en masa y densidad 1,1 g/cm3 se necesitan para disolver completamente una muestra de 20 g de hidróxido sódico? 14. A partir del problema 13 ¿qué volumen sería necesario si la muestra tuviera una riqueza en hidróxido del 70%? 15. Hacemos reaccionar 100 ml de una disolución 1 M de hidróxido potásico con 50 ml de una disolución 2 M de ácido nitroso. Calcula la masa de sal obtenida. 16. El cloro gas reacciona con el hidróxido de bario para dar cloruro de bario, hipoclorito de bario y agua. Hacemos pasar una corriente de cloro a 20 ºC y 750 mm de presión por 2 l de disolución 1,5 M de hidróxido de bario, si la reacción es completa ¿qué cantidad de cloruro bárico se obtiene? 17. Al descomponer térmicamente la calcita, mineral que contiene carbonato cálcico, se obtiene cal viva (óxido de calcio) y se desprende dióxido de carbono. Si a partir de una tonelada de calcita se obtienen 400 kg de cal viva ¿cuál es la riqueza de la calcita? 18. El hidruro de calcio reacciona con agua formándose hidróxido cálcico y desprendiendo hidrógeno. Si a partir de 0,5 kg de hidruro se han obtenido 100 l de hidrógeno en condiciones normales ¿cuál es el rendimiento de la reacción?¿qué masa de hidruro es necesaria para obtener 300 l de hidrógeno? ¿qué masa de hidróxido se obtiene? 19. El sodio reacciona con agua dando hidróxido sódico e hidrógeno. Si añadimos 100 g de sodio a 150 ml de agua ¿qué volumen de hidrógeno medido en condiciones normales se obtiene? 20. La sosa cáustica, NaOH, se prepara comercialmente mediante la reacción del carbonato sódico con hidróxido de calcio, obteniéndose además carbonato cálcico. ¿Cuántos gramos de sosa cáustica pueden obtenerse tratando un 20 kg de carbonato sódico con 10 kg de hidróxido de calcio? 21. Para obtener cobre se realiza el siguiente proceso: Al + HCl → H2 + AlCl3 H2 + CuO → Cu + H2O ¿Cuántos gramos de cobre se obtendrán a partir de 500 g de Al con un exceso de cloruro de hidrógeno óxido de cobre (II)? 22. ¿Qué cantidad de ácido sulfúrico podrá obtenerse a partir de 100 kg de pirita (FeS2), de acuerdo con las siguientes reacciones: FeS2+ O2 → Fe2O3+ SO2 SO2 + O2 → SO3 SO3 + H2O → H2SO4 23. Las siguientes ecuaciones químicas corresponden a dos de las reaccionesconsecutivas que se dan en un alto horno: C(s) + CO2(g) → 2CO(g) Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g) Calcula la masa de carbono que se necesita para obtener una tonelada de hierro considerando que el rendimiento global del proceso es del 75%. 24. Cuando se pasa una corriente de oxígeno sobre metano (CH4), a una temperatura de 100 ºC, se obtiene dióxido de carbono y agua líquida. Hacemos pasar 40 l de oxígeno a través de 10 g de metano (a 1 atm y 100 ºC). Calcula el volumen de CO2 (medido en iguales condiciones) que se obtendría si: a) la reacción fuese total. b) la pureza del metano es del 70 %. c) la pureza del metano es del 80% y el rendimiento de la reacción de un 60%. 25. Se hacen reaccionar 50 g de cobre con 30 ml de ácido nítrico según la reacción: Cu + HNO3 Cu(NO3)2+ NO2+ H2O ¿Cuál es el rendimiento, si se han obtenido 100 g de sal?





![Hidróxido de Calcio 95% [ DESCARGAR FICHA ]](http://s2.studylib.es/store/data/005804902_1-709936cf3b806547c3c53c592781c1f4-300x300.png)


