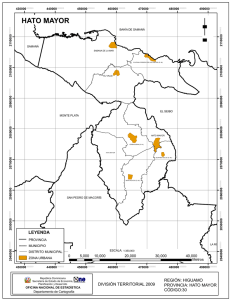
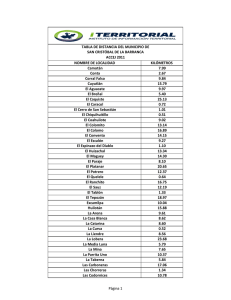
18_Implementacion_ac.. - FMVZ - UANL
Anuncio

Confederación Nacional de Organizaciones Ganaderas Programa Integral de Capacitación 2013 Prestador de Servicios Profesionales Consorcio Técnico del Noreste de México, A.C. Plan de Desarrollo Empresarial para Productores y Organizaciones Ganaderas Plan de formación para productores Implementar las acciones de salud animal para prevenir mortalidad y mejorar los parámetros productivos en el hato Dr. Ramiro Avalos Ramírez Dr. J. Rubén Cervantes Vega Directorio Confederación Nacional de Organizaciones Ganaderas Consejo Directivo Oswaldo Chazaro Montalvo Presidente MVZ. Freddy Priego Priego Secretario MVZ. Salvador Álvarez Moran Tesorero Comisión de Innovación y Transferencia de Tecnología Ing. Antonio Manuel García González Resultado de aprendizaje Implementar las acciones de salud animal para prevenir mortalidad y mejorar los parámetros productivos en el hato. Contenido Sanidad y rentabilidad Bioseguridad pecuaria Calendario de vacunación Calendario de desparasitación Control de Brucelosis Control de Tuberculosis Sanidad y Rentabilidad La rentabilidad de toda explotación pecuaria es afectada por una gran cantidad de factores, entre los que destacan la nutrición, la genética, el medio ambiente y la salud de los animales. Dentro de esta última condición, las enfermedades infecciosas representan una de las principales causas de pérdida económica al sector ganadero ya sea por provocar infecciones subclinicas (no hay síntomas de enfermedad), clínicas y muerte del animal. Si bien existen diversas estrategias para el manejo y control de las enfermedades infecciosas que van desde la administración racional de sustancias antimicrobianas (antibióticos) ó eliminación de los animales persistente o severamente afectados la práctica de la vacunación es una de las alternativas con mayor costo-beneficio, principalmente en aquellos ranchos o regiones en los cuales los índices de prevalencia son de moderados a altos ó carentes de medidas de bioseguridad. No obstante, el diseño e implementación de plan de vacunación es una tarea compleja dado que implica no solo saber si el agente infeccioso está presente (endémico) en el rancho, sino también se deben de conocer aspectos fundamentales de la biología misma de la enfermedad, es decir la naturaleza del agente causal (Virus, Bacteria, Protozoario), características de la infección-enfermedad (aguda, latente, crónica, persistente), Hospedadores o animales susceptibles(vacas, aves, perros, etc..), modos de transmisión (directa, indirecta -insectos, utensilios-) hasta la condición fisiológica del o los animales que se pretenden vacunar. Por otro lado, es necesario de considerar si existe vacuna disponible en el mercado, su costo, vía de administración y cuidados en su manejo. La presencia o ausencia de enfermedades en el rancho obedece a una intrincada red de eventos sucesivos en los cuales participan no solo los agentes causales, animales y el medio ambiente sino también el propio productor ó manejador del rancho mediante sus acciones. La pérdida de becerros antes del nacimiento o del destete, así como la infertilidad, diarrea, septicemia, enfermedad respiratoria, falta de productividad y muerte de los animales en forma general nos indican falta o irregularidades en las prácticas de manejo. La aplicación de criterios válidos y un esquema integral que contenga los aspectos básicos de la nutrición (incluida la suplementación con vitaminas y minerales) y de la sanidad y salud animal nos ayudaran en gran medida a disminuir las posibilidades de aparición de enfermedades en el rancho. Como ha sido señalado con anterioridad, la vacunación es una herramienta más que los ganaderos disponen para evitar la aparición de enfermedades en el rancho y mantener sanos sus animales. En breve, involucra la aplicación artificial de microorganismos (virus, bacterias, protozoarios, etc..) o fracciones de estos, generados en el laboratorio, incapaces de provocar enfermedad (atenuados ó muertos) pero con la propiedad de inducir un estado de resistencia ó inmunidad contra aquellos agentes infecciosos virulentos causantes de enfermedad. Mediante esta práctica, en conjunción con otros componentes de la bioseguridad pecuaria, se pueden controlar y erradicar aquellos agentes infecciosos que por su naturaleza provocan fuertes pérdidas a la economía del productor del sistema vaca-becerro. No obstante, antes de decidir cómo, cuándo, a quien y con qué vacunar es necesario tener en cuenta algunos aspectos básicos que involucran esta actividad. Entre otras consideraciones, es importante tener en cuenta que, por diversos motivos en la región una proporción alta de productores no incluyen en su manejo la vacunación de sus animales y en aquellos casos en los cuales se practica la vacunación esta se realiza sin tomar en cuenta algunos parámetros básicos para realizar esta actividad. La presencia, prevalencia é incidencia de las enfermedades en el rancho o región es otra de las características que se deben de tomar en consideración en conjunción con las características agroecológicas de la zona. El estado fisiológico del animal (embrión, feto, neonatos, becerros, adultos, preñez, animales viejos, etc..), el tipo de hato (cerrado ó abierto), la época del año (antes del empadre, antes de las lluvias y/o, invierno, primavera, etc..), el tipo de vacuna (inactiva, activa modificada, subunidades de antígenos, etc..), el costo, método y esquema de vacunación conformarían variables adicionales para realizar esta actividad. Este último, debería de ser analizado, comprendido y debe de realizarse en función del tipo de vacuna (inactivada, activa) y su potencia, ruta de administración, inmunidad ó exposición previa, necesidad de revacunación y equipo e instalaciones apropiadas así como personal capacitado. Bioseguridad pecuaria La bioseguridad involucra todas aquellas actividades y acciones que son llevadas a cabo para evitar la introducción de agentes infecciosos o productos de ellos hacia un área o grupo de animales. Usualmente si algún agente infeccioso o sus productos ya se encuentran presentes todas las acciones para evitar su diseminación entre los animales de una zona o lugar se conoce como biocontención. La bioseguridad aplicada a los sistemas pecuarios implica el uso de herramientas disponibles para evitar la introducción, diseminación, control y erradicación de agentes infecciosos y sus productos tanto en animales domésticos como silvestres. Este concepto ha emanado de la modernización de los procesos tecnológicos para generar animales, productos y subproductos de los mismos inocuos y seguros tanto para animales como para humanos. La bioseguridad en el rancho puede establecerse a varios niveles según el riesgo que cada productor o administrador del rancho desee aceptar para sus animales. Dado que no todos los agentes infecciosos o factores causantes de enfermedad están presentes en un área ó región, que su naturaleza es heterogénea y que cada rancho es diferente, las herramientas o procesos para aplicar la bioseguridad dependerán de la situación particular de cada uno de estos elementos. Una consideración importante cuando se define el nivel de bioseguridad que se desea tener es estimar el impacto potencial de la infección-enfermedad y sus consecuencias económicas. Es decir, no todos los agentes infecciosos tienen la misma habilidad para generar enfermedad y por consiguiente variarán los efectos económicos a corto, mediano y largo plazo. Se ha propuesto hasta seis niveles de bioseguridad en las unidades de producción con respecto a permitir la introducción de animales en cada unidad. Esto es, hato estrictamente cerrado (libre de patógenos específicos), hato en donde la salida y reentrada de los animales del mismo del mismo u otros ranchos no se permite, hatos que no se permite la entrada de animales de otra fuente pero se permite la reentrada de animales del mismo rancho, hatos en donde se aplica cuarentena y permite la entrada de animales de otras fuentes que cuentan con registros de salud y pruebas de laboratorio, hatos que permiten la entrada de animales de otro origen con registros de salud y pruebas de laboratorio pero no se aplica cuarentena ó aislamiento y hato donde se permite la entrada de animales de otras fuentes sin conocer el estado de salud, sin análisis de laboratorio y que no se practica la cuarentena. Si bien, la principal fuente de entrada para patógenos hacia el rancho son los mismos bovinos, ya sea incubando una enfermedad de reciente adquisición o de forma latente o persistente, otras formas de dispersión deben de tenerse en cuenta y van desde el uso de semen y embriones hasta alimentos (forraje, concentrados), agua, animales silvestres (aves, venados, coyotes, ratas) o “callejeros” (bovinos u otros rumiantes que deambulan libres entre los ranchos), garrapatas y otros insectos chupadores, vehículos de transporte, trabajadores, visitantes ó mascotas con acceso a otros ranchos. Los ganaderos debe de tener una visión empresarial a mediano y largo plazo para asegurase que se establezca el nivel adecuado de bioseguridad que su rancho necesita. En este sentido el establecimiento de medidas de bioseguridad es una inversión que requiere tiempo dinero y esfuerzo. De acuerdo al nivel de bioseguridad y salud del hato que el ganadero esté dispuesto a obtener será la inversión tanto económica, de tiempo y de recursos humanos. Inmunidad e inmunización El sistema inmunológico de los animales domésticos está constituido por una serie de factores y mecanismos que de manera colectiva defienden al organismo del ataque y colonización de agentes infecciosos. La multiplicación sin control de los agentes infeccioso ya sea bacterias, virus, parásitos conduce a la enfermedad. Si bien existen varios tipos de infecciones ( desde las subclínicas hasta las que causan evidente daño clínico) la aparición de la enfermedad es de origen multifactorial que acompaña una pobre o exacerbada respuesta del sistema inmunológico. Los mecanismos defensivos en el animal operan de forma inespecífica (inmunidad innata) o especifica (inmunidad adquirida). La inmunidad innata no es especifica hacia un antígeno o agente infeccioso ni requiere estimulo previo para operar y usualmente es la primera línea de protección e incluye barreras físicas como la piel, epitelio, moco, diarrea, etc.., enzimas, sistema complemento, inflamación, fagocitosis y la ausencia de receptores. La inmunidad adquirida o específica es llevada a cabo mediante la actividad ó estímulos de linfocitos y otras células accesorias con citocinas en conjunción con anticuerpos. Esta respuesta es específica del antígeno (inmunogeno) o agente infecciosos que le dio origen o estímulo y es el tipo de inmunidad que se intenta establecer en el animal mediante el uso de vacunas. La respuesta inmune adquirida puede dividirse en tres fases que son el reconocimiento (la identificación los agentes infecciosos como ajeno al cuerpo - antígenos ó inmunogenos- su procesamiento y presentación a linfocitos), la activación (los linfocitos estimulados por el antígeno proliferan generando poblaciones de linfocitos específicos del antígeno, amplifican la respuesta y se diferencian el células que eliminaran al antígeno), la efectora (los linfocitos activados ejecutan funciones que conducen al eliminación del agente infeccioso, incluye la producción de anticuerpos por parte de linfocitos B y la actividad de linfocitos T citotoxicos). Dependiendo de la constitución anatómica y fisiológica del animal y de estímulos previos de su sistema inmune la duración de las tres fases varía pero en su conjunto la respuesta ocurre entre 2 y 4 semanas después de la exposición a la sustancia extraña ó agente infeccioso. Cuando a un animal se le administra una vacuna lo que se pretende es crear un estado inmuneinmunización- en contra de los componentes (antígenos o agentes infecciosos) de la vacuna para que de esta manera en una exposición subsecuente en contra del agente infeccioso virulento el animal resista la infección y no se enferme. Debido a que el sistema inmune requiere de tiempo para responder a la vacunación es bien importante vacunar en el tiempo adecuado según la etapa fisiológica del animal y el nivel de riesgo de presencia de infecciones y enfermedades. Para ello es menester contar con un calendario de manejo en el cual se incluyan las vacunas de mayor relevancia en la zona de ubicación del rancho así como las desparasitaciones internas y externas acorde a la región. La administración de microminerales y vitaminas en la dieta o inyectadas deberá de tomarse en cuanta para asegurar una adecuada respuesta inmunológica y así una mejor salud del animal. Calendario de vacunación Se ha reportado en todo el País, la alta prevalencia de enfermedades reproductivas. En estudios parciales efectuados en establos seleccionados, se han encontrado anticuerpos en contra de la rinotraqueitis infecciosa bovina, la diarrea viral bovina, neosporosis y leucosis bovina y en algunos ranchos de ganado productor de carne con problemas de baja producción ganadera, se ha detectado que es alta la presencia de piroplasmosis, anaplasmosis, leptospirosis, diarrea viral bovina, rinotraquitis infecciosa y neosporosis, considerando a estas como las principales enfermedades que afectan a la reproducción serán revisadas brevemente. Rinotraqueitis Infecciosa Bovina, IBR o Herpesvirus Bovino 1. Es un virus cosmopolita y es uno de los agentes infecciosos considerados como los de mayor impacto económico para el ganadero debido a sus fuertes repercusiones negativas sobre la producción. La presencia de este virus limita la rentabilidad del rancho no solo por sus efectos sobre los animales son también por restricciones de tipo comercial que se imponen a los ranchos y áreas infectadas. El virus es altamente contagioso para los bovinos de cualquier edad. Una vez que ocurre la infección este virus permanece en estado ¨latente¨ en tejido nervioso (raíces de los nervios trigémino y sacro). Los animales infectados con el BoHV-1 pueden mostrarse clínicamente sanos, o sea no hay síntomas de enfermedad, de tal forma que se puede adquirir animales infectados que posteriormente al incorporarlos al rancho pueden diseminar el virus hacia animales susceptibles. Cuando los animales afectados muestran síntomas el rango puede ser muy amplio. Las diversas formas clínicas pueden abarcan desde la Rinotraqueitis Infecciosa Bovina (“IBR”), la Vulvovaginitis Pustular Infecciosa (“IPV”), la Balanopostitis (“IPB”) ó hasta conjuntivitis, infertilidad /aborto, enteritis y encefalitis. El BHV-1 ha sido dividido en los subtipos 1 (BHV1.1), 2a (BHV1.2a) y 2b (BHV1.2b). No obstante, se considera que todos pertenecen a un mismo grupo o tipo antigénico (serotipo). Es decir es el mismo virus pero diferentes formas de presentarse. El BHV1.1 comprende a los virus “clásicos” que han sido relacionados a infecciones respiratorias causando la Rinotraqueitis Infecciosa Bovina (IBR); no obstante se han reportado aislados de este subtipo como causa de abortos. Por otra parte, el BHV1.2a se ha encontrado como causante de IBR, IPV, IPB y abortos; mientras que BHV1.2b se ha detectado en infecciones respiratorias así como en el síndrome de IPV/IPB, pero no en abortos. En infecciones respiratorias se considera al BHV1b de menor “agresividad” que el subtipo BHV1.1. Este virus se trasmite de forma directa con relativa facilidad gracias a la gran cantidad virus infecciosos que salen de los animales afectados principalmente de secreciones respiratorias, oculares y del tracto genital (de forma importante en semen). No obstante, estas secreciones pueden contaminar diversos utensilios (Guantes de palpación, sujetadores nasales, empleados para el manejo de los animales por lo que el virus también puede diseminarse de forma indirecta entre los animales gracias a la intervención humana. El periodo de incubación de la enfermedad es variable de entre 2 y 7 días, pero depende del subtipo (cepa), sitio de entrada, inmunidad previa (si el animal fue vacunado o se infectó y se recuperó) y factores estresantes, entre otros. En hatos susceptibles no inmunes y expuestos al virus se ha demostrado que entre un 25 y 60% de la vacas pueden abortar después de exponerse al virus, independientemente del periodo de preñez. Otra proporción de vacas, y especialmente vaquillas, pueden resultar con infertilidad o muerte del embrión si adquieren la infección al momento de la cruza dado que el virus puede provocar inflamación del útero y de ovarios. Estudios previos y actuales en la región noreste de México han mostrado que la seroprevalencia de este virus es alta en esta zona. El diagnóstico molecular del virus basado en la Reacción en Cadena de la Polimerasa (PCR) se aplica con cierta rutina en el Noreste de México. En el Departamento de Virología de la Facultad de Medicina Veterinaria y Zootecnia de la UANL y en el Laboratorio Central Regional de Monterrey, A.C., el virus ha sido detectado en semen, secreciones vaginales, de prepucio y respiratorias de diversos hatos del sistema vaca cría. Un estudio, realizado en la región Noreste de México entre el año 2005 y 2007 ha detectado que 165 hatos del sistema vaca-becerro no vacunados contra BHV-1 de Nuevo León (45), Coahuila (25), Tamaulipas (18) y la Huasteca Potosina (10) resultaron seropositivos al virus. No obstante los rangos de seroprevalencia variaron de 20 a 76%. Esto significa que prácticamente todos hatos analizados no vacunados muestran anticuerpos contra el BHV-1 lo cual implica que el virus está ampliamente difundido en la zona y que eventualmente puede constituirse en brotes de abortos, infertilidad ó problemas respiratorios de forma individual o colectiva, dependiendo de la situación particular de cada hato, de la zona geográfica y de la infección concomitante con otros patógenos, entre otros. Virus de la Diarrea Viral Bovina El agente etiológico de la diarrea viral bovina pertenecen a las especies BVDV-1 y BVDV-2 agrupados dentro del género Pestivirus en la familia Flaviviridae, estas dos especies se han establecido de acuerdo a las diferencias genotípicas y antigénicas de los virus. Así mismo se ha dividido estas dos especies en subgrupos, así en BVDV-1 se han encontrado hasta 11 subgrupos genéticos y para BVDV-2 solamente 3 subgrupos. El genoma del virus es de RNA de cadena sencilla polaridad positiva, mide 12.3 Kb aproximadamente. Los viriones miden de 40 a 60 nm de diámetro y tienen forma esférica. De acuerdo al efecto que puede causar el virus sobre el cultivo celular se ha clasificado en dos biotipos, virus citopático (cp) y virus no citopatico (ncp). La transmisión del virus en un hato está influenciada por la presencia de animales persistentemente infectados (PI), animales con afección aguda y de las prácticas sanitarias que se realicen en los hatos. Se han reportado seroprevalencias que oscilan entre 60 y 85% para ganado de carne y bajo el mismo sistema han descrito una prevalencia para animales PI entre 0.5% y 2%. En sistemas semiintensivo con pastoreo en praderas del trópico en ganado de carne se ha descrito una prevalencia de 14% en el estado de Yucatán. En el estado de Nuevo León se ha descrito una prevalencia que oscila entre 28.5 y 67.8% para el sistema vacacría que se desarrolla en explotaciones de tipo semi-intensivo. La transmisión del virus dentro de un hato se presenta por la introducción de animales con infección aguda, animales PI, semen y embriones contaminados con el virus, hembras gestantes con un producto PI y uso de vacunas con virus vivo en hembras gestantes. El tiempo de seroconversión de los animales susceptibles con la presencia de un animal PI en el hato lo han estimado en 2 meses, mientras que la seroconversión tras la introducción de animales con afección aguda se lleva aproximadamente 5 meses. La transmisión entre hatos se presenta cuando se comparten pastas o agostaderos con otros hatos, préstamos de sementales y utensilios, participación en ferias. Los efectos en la reproducción bovina son variados y dependen muchos factores. Todos son adversos para la producción. Después de una infección aguda con BVDV existe una disfunción ovárica en las hembras (reducción de los ciclos del estro), disminución significativa de la calidad de los folículos, reducción de la actividad del cuerpo lúteo y reducción de las oleadas foliculares; se ha sugerido que estos cambios obedecen a la elevación de la concentración del cortisol en la sangre, que se observa en los periodos de viremia y que están involucrados directamente con la alteración en la retroalimentación sobre la secreción de las hormonas. Otros efectos observados en la disfunción folicular están involucrados con la capacidad del virus para intervenir en el descenso sobre la concentración en sangre de estradiol, además de intervenir en los procesos antes descritos, también influye en el desarrollo adecuado de un ciclo estral. En los órganos que comprenden el sistema reproductivo del macho se han asilado partículas virales, lo que compromete la función de los mismos; de tal forma que, se presenta anormalidades en los espermatozoides, disfunciones en la motilidad y baja producción de semen. Otro efecto importante es la presencia de abortos y la producción de animales PI; en el primero de los casos muchos autores han reportado el tiempo en que se puede presentar, sin embargo es de suma importancia ubicar las factores de riesgo para que este acontecimiento no suceda y de la misma forma con los animales PI . Leptospirosis La enfermedad es causada por bacterias gram negativas, pertenecen a la familia de las Spiroquetas, poseen forma delgada, helicolidal, son organismos móviles, con una longitud entre 10 y 20 µm; tienen un genoma de aproximadamente 5,000 Kb. La composición de lipopolisacáridos es similar a otras bacterias gram negativas, pero tienen baja actividad endo-tóxica; son bacterias aerobias obligadas con un crecimiento óptimo a temperaturas entre 28 a 30° C; el medio donde crecen debe ser enriquecido con vitaminas B 2 y B12, ácidos grasos de cadena larga y sales de amonio. La clasificación taxonómica de este grupo de bacterias se basa en diferencias serológicas y genéticas; la primera clasificación obedece a diferencias antigénicas observadas en ensayos de aglutinación, teniendo que, el género Leptospira se divide en 2 grandes especies: Leptospira interrogans y Leptospira biflexa, en la primer especie se agrupan todas aquellas bacterias patógenas, existiendo a la fecha 200 serovares y en la segunda especie se agrupan aquellas bacterias saprofitas, existiendo 60 serovares; los serovares que están antigenicamente relacionados se agrupan en serogrupos; la clasificación genética se basa en diferencias genéticas entre los aislados, de esta forma, existen a la fecha 16 “genomoespecies”. Los bovinos son portadores naturales del serovar Hardjo, y la infección por esta cepa se presenta eventualmente sin signos clínicos aparentes, de tal manera que, continuamente liberan por la orina al ambiente bacterias. Sin embargo son susceptibles a otros serovares que están presentes en el medio por excreción de otros animales que son portadores. La Leptospira spp., son bacterias ubicuas y están geográficamente relacionadas con ciertos tipos de suelos, así como, la interacción que guardan con los hospederos naturales, también denominados portadores asintomáticos que tienen un rol importante en la transmisión, pues contaminan el medio con grandes cantidades de bacterias por medio de la orina, debido a una infección crónica que sufren en el epitelio renal con algún serovar. De esta forma una vez que las bacterias han salido al medio pueden contaminar el agua, comida, utensilios, comederos; exponiendo así, a un gran número de animales y humanos susceptibles. La leptospirosis bovina es una enfermedad ampliamente distribuida en México que tiene una seroprevalencia elevada (49.7 %) y se encuentra presente en las distintas regiones ecológicas. El contagio está influenciado por factores climáticos como la humedad y la temperatura, los cuales permiten que la bacteria sobreviva externo al animal, favoreciendo la transmisión indirecta. La leptospirosis considerada la epizoodemia más difundida en el mundo, tiene tanto importancia económica como sanitaria. La repercusión económica más importante en la explotación, es el falla reproductiva, secuela crónica de la enfermedad en las vacas reproductoras, que causan mortinatos, abortos o nacimientos de animales débiles, disminución de la fertilidad, entre otros. Los estudios seroepidemiológicos sobre leptospirosis bovina en la región Noreste de México han detectado a esta enfermedad en donde la frecuencia serológica promedio es de 37.8 % (rango de 31 a 59 %). Las serovariedades con mayor prevalencia fueron cepa H-89 (hardjo genotipo hardjoprajitno), hardjo, wolffi y tarassovi. La infección con Leptospira spp., se ha ligado fuertemente a baja fertilidad, expresada en bajos niveles de concepción, repetición de calores y abortos que frecuentemente ocurren en 4 a 12 semanas después de una infección aguda y se han reportado en el 5 y 6 mes de la gestación. Otros efectos que se han descrito por efecto de la infección es el nacimiento de crías prematuras, débiles o mortinatos; con respecto a este efecto diversos estudios han encontrado la presencia de Leptospira spp en tejidos como placenta, hígado, riñones, cerebro del producto y se cree que el síndrome de nacimiento de crías débiles se debe a que la bacteria infecta la placenta y en este tejido se monta una inflamación fuerte, lo cual limita el transporte de nutrientes de la madre al feto Neospora caninum Es un protozoario que pertenece al phylum Apicomplexa, familia Sarcocystidae, a la que también pertenecen Toxoplasma gondii y Sarcocystis. El ciclo de vida de este parásito comprende un ciclo indirecto, donde la reproducción sexual (gametogonia) ocurre en el huésped definitivo (HD), mientras la reproducción asexual (merogonia) ocurre en el huésped intermediario (HI); se han descrito como HD los carnívoros domésticos y salvajes, empero los herbívoros domésticos y salvajes e incluso los propios carnívoros juegan el rol de HI. Dentro del ciclo de vida se reconocen los quistes tisulares que poseen forma ovalada y miden hasta 100µm de diámetro y se han reconocido en cerebro, médula espinal, retina y nervios periféricos de los HI, otros estadios son los ooquistes que tienen forma esférica y poseen un diámetro de 11µm, cada uno de ellos contiene en su interior dos esporoquistes, los ooquistes se encuentran en las heces del HD, las que posteriormente contaminarán el medio para que el HI se infecte y el ciclo siga su curso. Este parásito está relacionado con una afección neuromuscular en perros y terneros, abortos y mortinatos en bovinos. El ciclo de este parásito es indirecto, ya que ocurre entre los HD y los HI. En el ciclo se reconocen tres fases, la primera de ellas se denomina enteroepitelial o intestinal, en donde el HD ingiere quistes tisulares mediante el consumo de tejido placentario, muscular, nervioso o piel, en esta fase se desarrolla la reproducción asexual y sexual del parásito para posteriormente excretar junto con las heces los ooquistes sin esporular, lo cual lleva un tiempo entre 5 y 17 días después de haber consumido el HD el quiste tisular. Los rangos de seroprevalencia del parásito en bovinos de carne bajo un sistema vaca-cría en Nuevo León se han estimado entre 0 a 35%. Se reconocen dos formas de transmisión por las que el parásito puede diseminarse en la población bovina, la primera de ellas es la forma vertical (aparentemente la principal), esta vía se presenta en hembras gestantes cuando los taquizoitos invaden la placenta y por consiguiente el producto, la situación se ve favorecida por el descenso en la actividad del sistema inmune en las hebras gestantes y se acentúa con el progreso de la gravidez, lo repercute directamente en el aumento de las tasas de infección del feto, de acuerdo a esto, se dice que la probabilidad de transmisión vertical en hatos con infección latente se incrementa de un 81 al 100% a partir de la semana 20 de gestación; otros aspectos importantes sobre la infección de la progenie es el hecho que las madres infectadas pueden producir a lo largo de su vida descendencia con la misma condición, hasta hoy este acontecimiento es inconsistente por razones desconocidas, pero se ha encontrado que un 95% de los becerros afectados congénitamente nacen sin ninguna afección. La otra forma de transmisión es la horizontal que puede suceder después del nacimiento o en algún momento de la vida productiva del animal, en esta alternativa de infección participa activamente el o los hospederos definitivos, pues al liberar a través del excremento grandes cantidades de ooquistes infectivos contaminan el medio y aunado a esto que existan condiciones favorables de manejo para que suceda el ciclo de vida del parásito; bajo experimentación solo toma 2 a 4 semanas para que un becerro infectado monte una respuesta inmune frente al parásito y además se observó en un trabajo la capacidad de los taquizoitos depositados en calostro para infectar a un becerro, estos hallazgos no se han comprobado abiertamente, pero existe evidencia de seroconversión a las dos semanas de vida en becerros de madres seronegativas, sin ningún contacto aparente con las fuentes principales de contagio y bajo estas condiciones se han encontrado seroconversiones en 1% anual. Los efectos en la reproducción bovina son variados y pueden ser muy desastrosos. Algunas investigaciones concluyen que el 42% de las vacas gestantes en una explotación lechera pueden abortar debido a Neospora caninum, el riesgo de aborto en vaca seropositivas es de 3 veces más comparadas con las vacas seronegativas, para las hembras afectadas congénitamente el riesgo de aborto en su primer parto puede ser de 7 veces más que en vaquillas sin afección, los mortinatos son otro efecto del parásito, se ha descrito que las vacas seropositivas están dos veces más en riesgo de producirlos que las seronegativas, otros efectos observados son el retorno del celo constantemente, reabsorciones embrionarias, o el nacimiento de animales con hidrocefalia, y afecciones en la columna vertebral; en los machos se ha encontrado la presencia del parásito en semen pero no se ha descrito una anomalía asociada. Esquema de prevención de enfermedades Cuando tenemos un hato infectado por las enfermedades que afectan a la reproducción, la perdida de becerros antes del destete puede ser un grave problema. En la producción ganadera se está dando a conocer la importancia de tener en práctica un buen programa de bioseguridad. Aplicar el sentido común y un esquema integral que incluya la suplementación con minerales y vitaminas, la aplicación de biológicos veterinarios adecuados y en forma correcta y sencillas prácticas de limpieza y desinfección, en gran medida eliminaran la mayoría de las posibilidades de que ocurran enfermedades en el rancho Aunque el concepto de bioseguridad en los ranchos ganaderos esta en formación, con el propósito de contribuir a la definición del concepto se revisará un esquema de prevención de enfermedades en los becerros antes del destete y la definición de algunos de los términos usados comúnmente. Se describirá cómo es posible tener éxito en destetar becerros, existen cuatro periodos que requieren la atención de los productores estos son: El manejo de la vaca en el último tercio de la preñez, El-proveer de un cuidado apropiado al becerro durante las primeras 24 horas de su vida, Realizar ajustes en las necesidades y vacunaciones (si se requiere) Preparar al becerro para el destete. El manejo de la vaca en el último tercio de la preñez La condición corporal de la vaca es el factor más importante que cuidar al momento del parto aunque esta condición esta correlacionada con muchos factores como el intervalo entre partos, producción de leche, peso al destete de la cría y supervivencia de la cría. Las vacas y vaquillas deben de tener una condición corporal de entre 5 y 6 al parto y así mantenerse, para asegurar que se preñen ya que los animales con exceso o déficit de condición corporal tienen problemas reproductivos. La condición corporal es generalmente el reflejo de la carga animal o cantidad de animales, adecuada para la superficie del rancho aunque la presencia de enfermedades o parásitos pueden contribuir a tener una baja condición corporal, es necesario entonces tener un esquema general de manejo sanitario de todo el ganado y en el caso específico de las hembras en etapa de gestación avanzada o último tercio de la preñez, el manejo es delicado y se deberán de mover lo menos posible para evitar pérdidas por golpes u otras situaciones similares. Cuidado apropiado del becerro durante las primeras 24 horas de su vida. Los becerros deben de nacer en lugares que sean cálidos y secos. Los eventos que rodean las primeras 24 horas de vida del becerro son muy importantes para la salud futura del becerro. Como se mencionó anteriormente un manejo apropiado del becerro comienza con el manejo de las vacas o vaquillas preñadas. La alimentación con calostro. Los becerros deben de ingerir calostro en las primeras horas de vida, preferentemente las primeras dos horas. Inmunización activa. La inmunización activa de la madre es empleada para aumentar la producción de anticuerpos específicos en calostro y leche, es importante diseñar un programa de vacunación, con el propósito de controlar las enfermedades que están causando la mortalidad en las crías. Figura 1. Becerro débil persistentemente infectado con el virus de la diarrea Viral Bovina (DVB), note el pelo hirsuto y la postración resultado de la incapacidad para mantenerse de pie) Tabla de Esquema de prevención de enfermedades en vacas con preñez avanzada (7- 9 m). Actividad Producto Nombre comercial Control de Garrapata a)Organofosforados Asuntol b) Piretrinas Butox c) Amidinas Tak Tik Bovitraz Control de Mosca a) Fention Tiguvon Desparasitación interna a) Ivermectinas Ivomec b) Febendazol Panacur Prevención de IBR, DVB, Vacuna inactivada Horizon 4 PI3 Y VRSB. Respishield 4 Cattle Master Triangle 4 Prevención de Leptospirosis Bacterina con cinco Horizon 9 Combinada con serovariedades * * Verificar Virales cepas Leptobacterina (sola) existentes en el rancho Prevención de Hemophilus Bacterina Triangle 9 + HS somnus Prevención de pierna negra Bacterina siete vías Prevención de otras Vacunas en caso de Scour Guard E coli, Rotavirus, diarreas Ultrabac 7 Rotavec Corona Coronavirus Prevención de Vacunas en caso de Tricomoniasis, Vibriosis y infertilidad, piómetras y Neosporosis abortos tempranos NOTA. La mención de nombres comerciales es solo a manera de guía no implica recomendación o patrocinio en modo alguno. Desinfección. Una desinfección efectiva requiere que las superficies estén bien mojadas. Todas las áreas a ser desinfectadas deberán ser previamente limpiadas para eliminar la materia orgánica presente de lo contrario, existirá una reducción en la efectividad en la práctica, se recomienda un contacto de al menos 30 minutos para lograr una desinfección apropiada. Usar un programa de desinfección y bioseguridad con la asesoría de profesionales, el uso del laboratorio y la aplicación del sentido común puede salvar muchas vidas de becerros que al final del año podrán ser la diferencia entre perder o ganar dinero el rancho debe de tener una relación costo beneficios favorables. Esquema de prevención en Becerros de 4 a 8 m de edad Actividad Producto Nombre comercial Control de Garrapata a)Organofosforados Asuntol b) Piretrinas Butox c) Amidinas Tak Tik Control de Mosca Organofosforados Tiguvon Desparasitación interna a) Ivermectinas Ivomec b) Albendazol Valvazen Prevención de IBR, DVB, Vacuna inactivada Horizon 4 PI3 Y VRSB. Respishield 4 Prevención de Hemophilus Bacterina Triangle 9 + HS somnus Prevención de pierna negra Bacterina siete vías Ultrabac 7 Prevención de pasteurelosis Bacterina One Shot NOTA. La mención de nombres comerciales es solo a manera de guía no implica recomendación o patrocinio en modo alguno. Tabla.- Causas comunes de aborto en bovinos Nombre y Agente Fuentes del agente Historia Clínica Etapa en que Métodos de ocurre el aborto diagnostico Prevención y Control Muestras Brucelosis Brucella abortus Fetos Abortados Aborto, Becerros Débiles Placenta Retenida Infertilidad Infertilidad y Falla en la Concepción 6 A 9 Meses Vacunación de Hembras de 68 Meses Feto Placenta Sueros Cultivo a Partir de Fetos, Placenta, Contenido Abomasal. Anticuerpo en Moco Vaginal Cultivos y Anticuerpos Fluorescentes. Cultivos Urinarios Aglutinación Microscópica En Suero Aislamiento a partir de Feto y Placenta Vacunación I.A. con Semen Tratado con Antibióticos Placenta y Fetos para Cultivo. Moco Vaginal Mantener al ganado con alimentos sin hongos I.A. de toros no infectados Usar toros de 1 a 3 años. Aislamiento a Partir de Fluidos Uterinos, Leche, Placenta Etc. Aglutinación Vibriosis Campilo-bacter fetus venerealis Pene y Prepucio Infectado Leptospirosis Hardjo. Pomona Vacas Infectadas, Cerdos. Suelo y Alimento Mastitis Ictericia Anemia Fiebre Usualmente en el Ultimo Trimestre Listeriosis Listeria monocytogenes Pájaros Pescados Heces y Leche de Portadores Ensilados Alcalinos paja o heno Fiebre, Depresión y Placenta Retenida La mayoría en el ultimo trimestre Estacional con la mayor incidencia en primavera Cruza natural e infertilidad piometra y abortos De cuatro meses a termino Elementos micoticos a partir de piel o lesiones pulmonares Generalmente en el primer tercio de la gestación Encontrar el parásito en la descarga uterina, fluidos o contenido estomacal Enfermedad febril en el hato antes de aborto y becerros nacidos con daño cerebral Comúnmente después de un brote de enfermedad respiratoria conjuntival o de introducción de animales infectados Todas las etapas de gestación Anticuerpos suero neutralizantes en becerros con anormalidades oculares cultivo viral Vacunación a hembras de 8 meses De cuatro meses a termino Anticuerpos fluorescentes Vacunar hembras a los 8 meses de edad Hongos Aspergilus sp Tricomonas Trichomona fetus Toros infectados DVB Ganado infectado RIB Ganado infectado 6 A 8 Meses Bacterinas Placentas y Aislar Animales Fetos, Orina Infectados y Leche Sueros Pareados. Aislar Animales Placenta y Infectados Feto Placenta y fetos para estudios histológicos Placenta y feto en solución ringer y refrigerado. Placenta y feto Suero Feto y placenta sueros pareados de la vaca. Calendario de desparasitación para el control de Hemoparásitos y Enfermedades Hemoparasitarias en Bovinos Carne. David Domínguez Díaz, Rubén Cervantes Vega, Antonio Cantú Covarrubias, Ramiro Ávalos Ramírez, Reymundo Villarreal Mata, Alfredo Cisneros Ayala. Introducción La garrapata es un parásito que se alimenta de sangre la mayor parte de su vida, es vehículo de agentes infecciosos que causan diferentes enfermedades y adicionalmente se encuentra dispersa en amplias zonas ganaderas del país. Son de principal interés las garrapatas Boophilus microplus, Boophilus annulatus y Amblyoma spp., por encontrarse con mayor frecuencia en los hatos de bovinos de carne, además B. microplus es transmisor de Babesia bigemina, Babesia bovis causantes de los signos clínicos de piroplasmosis y Anplasma marginale que origina la anaplasmosis, por otra parte el género Amblyoma spp produce una gran cantidad de larvas en cada ciclo de vida que al alimentarse causan perdidas de sangre y por consiguiente baja producción de los bovinos afectados, por su comportamiento de tres hospederos puede propagar algunas enfermedades. La ocurrencia de infestaciones por garrapata es resultado de la interacción de factores climáticos, tipo de garrapata, raza de bovinos, densidad de hato, manejo del rancho, hatos vecinos, animales silvestres, grado de resistencia a los ixodicidas y de manejo en cada una de las unidades de producción, así bien, el tratamiento de las infestaciones tendrá que ser particular tomando en cuenta todos los elementos antes descritos. Actualmente los productores de bovinos carne en el estado usan abundantemente productos químicos para realizar baños por aspersión o inmersión en los periodos que cada ganadero considera adecuados obedeciendo ó no a la presencia de garrapatas sobre los bovinos, esta práctica se heredó de la implementación en los setentas del siglo pasado, del plan nacional para la erradicación de la garrapata y con los avances de la ciencia y evolución en el control de ésta parasitosis, en la actualidad, no resulta adecuada. El control integrado de las infestaciones involucra todos los factores ya descritos, aunque también incluye la prevención como una herramienta que apoyado en el conocimiento del ciclo vital de las garrapatas, el productor podrá hacer un uso apropiado de los recursos disponibles para reducir los efectos negativos de estos parásitos en la producción de bovinos carne. Ciclo de Vida de la garrapata Boophilus microplus Al igual que otros géneros de garrapata B. microplus tiene cuatro etapas evolutivas y son: huevo, larva, ninfa y adulto; además este tipo de garrapata es reconocida como de un solo hospedero, es decir, todos sus estados evolutivos los realiza sobre una especie animal, en condiciones ambientales óptimas (25-35 °C y humedad relativa superior al 60%) el ciclo biológico se completa en 19 a 21 días y puede originar hasta tres generaciones en un año; en la figura uno se esquematizan los cambios que experimenta la garrapata a través de su ciclo biológico. Para que las garrapatas lleguen a desarrollarse y aseguren su permanencia se reconocen tres periodos en su ciclo de vida: no parasitario, de encuentro y parasitario, así tenemos que en el estado no parasitario ó de vida libre se encuentra la mayor parte de la población de garrapatas y los factores adversos para su desarrollo en este periodo son ambientales principalmente, de tal manera que la postura de huevos se realiza hasta en 40 días, mientras que en situaciones singulares solo toma 3 días o la incubación de los huevos se prolonga hasta 5 meses en circunstancias adversas como una sequía prolongada. La forma de encuentro se refiere al tiempo en que la larva de la garrapata está lista para aproximarse al hospedero (bovinos, caballos, ovejas, perros, animales silvestres), las causas desfavorables para la fase de encuentro también son de índole ambiental logrando sobrevivir la larva en el agostadero hasta 8 meses, sin embargo el tipo de vegetación presente en el campo influye en el tiempo de aproximación, ya que algunos arbustos tienen la capacidad de repeler a las larva cuando suben, sin embargo, existen oportunidades para la larvas como un alto número de animales en una pasta o agostadero por desconocimiento del índice de agostadero del rancho, la falta de descanso de potreros, la raza de los bovinos, específicamente aquellos de tipo europeo, existen tratamientos alternativos al empleo de productos químicos como el uso de vacunas que tienen efectos sobre larvas que se alimentan de sangre, en la figura número dos se muestra una sinopsis de situaciones predisponentes y favorables para la garrapata en este estadio; el periodo parasitario hace referencia a los cambios que sufre la garrapata una vez que se encuentra sobre el hospedero al consumir sangre, para este tiempo se reconocen más acontecimientos a favor a causa de manejo, para lo cual se mencionaran ampliamente en los siguientes tópicos. Manejo de las infestaciones por la garrapata B. microplus El manejo de las infestaciones necesita contar con la prevención, conocimiento del problema y por consiguiente realizar un tratamiento adecuado a la situación del rancho en particular, puesto que no existe algún químico o receta eficaz para todos los ranchos; en el cuadro número uno se enlistan algunos factores importantes antes de establecer cualquier tratamiento contra las garrapatas. Factores a considerar antes de establecer un tratamiento La prevención es una herramienta elemental en cualquier establecimiento ganadero para evitar la entrada de enfermedades y en el caso de las garrapatas también es empleada en las situaciones que se apuntan a continuación: Encerrar por lo menos un mes a los animales de nuevo ingreso en corrales que no estén en contacto con los animales del rancho, en este punto usted podrá observar la presencia de garrapatas adultas, pues el encierro permite que los estados larvarios consuman sangre estando el animal en reposo, signos de alguna enfermedad tal vez sean evidentes, además conseguirá que el animal tenga influencia del microclima del rancho. Antes de poner en marcha algún tratamiento es primordial que usted conozca el tipo de garrapata y si estas son resistentes, para lo cual una muestra representativa deberá tomarse usando un 20% de los animales adultos que tengan más de un año en el rancho. Conociendo el estatus de las garrapatas se comprará solo los químicos adecuados y se evitaran perdidas de dinero; en las secciones siguientes la toma de muestras será revisada con detalle. Con el desecho de animales no productivos (animales viejos, vacas que no se cargan, animales enfermizos, becerros con pobre desarrollo, toros con baja fertilidad) usted hará un uso eficiente de los recursos, pues tiene la oportunidad de emplear tratamientos alternativos como un programa de vacunación contra la garrapata que tiene un costo elevado pero puede dar resultados satisfactorios si se usa adecuadamente. Toma de muestras El análisis de resistencia y taxonómico (tipo de garrapata) debe efectuarse por lo menos dos veces al año y el procedimiento para la toma de muestras es de la siguiente manera: 1. Encerrar por la tarde (5-7 pm) aproximadamente un 20% de los animales del rancho que tengan más de un año de estar en el predio, en corrales donde no tengan mucho movimiento. 2. Por la mañana siguiente (7-8 am) pasar a los animales por una manga de trabajo y revisar a contra pelo en zonas del cuerpo donde generalmente hay garrapatas. 3. Recoger estadios (garrapatas chicas) y garrapatas repletas de sangre con cuidado de no dañar ninguna de sus partes, porque las pruebas así lo requieren. 4. Es relevante recordar que para la prueba de resistencia los animales no se hayan bañado con productos químicos en 15 a 20 días o haber aplicado ivermectina por lo menos un mes previo a la toma de muestras. 5. Para determinar el tipo de garrapata se colocan garrapatas chicas y grandes en tubos de ensaye con alcohol al 70%, no colocar un número exagerado de garrapatas en un solo tubo puede emplear varios tubos y colocar garrapatas de diferentes animales en los tubos. 6. Para la prueba de resistencia se usan garrapatas repletas de sangre en buen estado en recipientes de doble fondo con perforaciones en la tapa que se proporcionan en el laboratorio. En el fondo colocar un algodón humedecido para crear un ambiente húmedo, nunca vierta agua en el recipiente porque puede matar a las garrapatas, enseguida deposite por lo menos 20 garrapatas en el otro recipiente y tape, entre más garrapatas repletas en buen estado pueda mandar será mejor. 7. Selle e identifique el envase con el nombre del rancho y la fecha de la toma de muestras, en una hielera se transportan las garrapatas hacia el laboratorio en el mismo día de la toma de las muestras de preferencia, si por algún motivo no logra conseguirlo pueden almacenarlas en la parte inferior del refrigerador y enviarlas lo más pronto posible con un máximo de hasta en 6 días posteriores a su colecta. Comportamiento de las Infestaciones El conocimiento de los periodos en los cuales hay infestaciones fuertes sobre el ganado nos ayudará a estar preparados para esa situación, además de contar con la oportunidad de tener opciones de tratamientos efectivos contra la población de larvas en el campo que como sabemos representa el mayor problema a combatir, como ejemplo se esquematiza en la figura 4 un comportamiento relativo de las infestaciones en el estado. En el ciclo biológico de la garrapata se apuntó que a través del año tiene relativamente tres generaciones y estas se manifiestan con picos de mayor infestación, estos picos pueden presentarse de forma homogénea en algunas regiones que comparten un microclima, pero aún así es prescindible conocer el comportamiento en el propio rancho y esto se puede lograr de la siguiente manera: 1. Encerrar por la tarde (5-7 pm) aproximadamente un 20% de los animales del rancho que tengan más de un año de estar en el predio, en corrales donde no tengan demasiado movimiento; este encierro tiene que realizarse cada mes y puede formar parte del calendario de manejo. 2. Por la mañana siguiente (7-8 am) pasar a los animales por una manga de trabajo y revisar a contra pelo en zonas del cuerpo donde generalmente hay garrapatas. 3. Poner atención a las garrapatas llenas de sangre para contarlas, si la mayoría de los animales presentan 20 garrapatas por lado o más esto indica según expertos que el resto del ganado del hato tendrá que bañarse; este parámetro de 20 garrapatas por lado se llama estabilidad enzótica, que no es más que el número de garrapatas con las cuales pueden convivir o subsistir los bovinos del rancho sin generar alguna enfermedad y se establece por las características climáticas de la zona y por el comportamiento que presentan las infestaciones de garrapatas, no obstante este número puede variar cuando existen condiciones por demás favorables para las garrapatas. 4. Anotar el número de garrapatas por lado de los animales encerrados y tomar decisiones según el conteo. Tratamiento Existen en el mercado muchas opciones de productos disponibles para el tratamiento de las infestaciones, sin embargo, es importante emplear solo aquellos que la SAGARPA tiene a bien recomendar pues han pasado por una serie de pruebas y/o ensayos para garantizar su eficacia; la lista de productos autorizados es la siguiente: Como se observó en la lista, los productos químicos se clasifican en cuatro familias y cada una de ellas tiene un mecanismo de acción particular sobre las garrapatas que las diferencia, así mismo, presentan un tiempo de vida o de utilidad característico, además de exhibir un espectro restringido en algunos tipos de moscas o garrapatas, para lo cual escoger una familia de químicos representa una decisión que deberá estar sustentada en una análisis de resistencia y apoyado por un Médico Veterinario en todo momento. Puntos clave para hacer un uso eficiente de un producto químico Realizar una prueba de Resistencia y Taxonómica antes de elegir alguno. Revisar las recomendaciones de DILUCIÓN DEL PRODUCTO; de forma general se recomienda usar como mínimo 6 litros de producto preparado para bañar mediante aspersión a los animales adultos y 4 litros para los animales jóvenes. Antes de verter el producto químico en el baño de inmersión o en el recipiente para aspersión DEBE diluir el contenido de un bote (litro o la cantidad que se use) de producto químico en un bote de 20 litros de agua para asegurar una mezcla homogénea y de esta forma evitar pérdidas de químico sobre las paredes del baño de inmersión o sobre otros contenedores. EVITAR usar agua con ALTO CONTENIDO DE SALES para diluir el producto químico, así como, AGUAS CON ELEVADO CONTENIDO DE MATERIA ORGÁNICA (tierra, hojas, materia fecal). Para el baño de aspersión se debe EVITAR diluir el producto químico en recipientes de METAL o aquellos que anteriormente contenían PINTURA, U OTROS PRODUCTOS QUÍMICOS, designe un recipiente NUEVO de PLÁSTICO solo para diluir el producto y contenerlo NO lo empleé para otra actividad. En las cuatro familias de productos químicos se han reportado resistencia por un uso indiscriminado. Recordar que el ciclo de la garrapata B. microplus en condiciones óptimas es de 21 días y se presentan tres generaciones de garrapatas por año aproximadamente. Ningún producto químico por si mismo puede eliminar todas las generaciones de garrapatas. Las AMIDINAS NO TIENEN efecto sobre moscas del cuerno. Las AMIDINAS requieren de un pH alcalino por encima de 7,12 en el baño de inmersión por ello se emplea el estabilizador (cal) y una tira indicadora de pH. Aquellos químicos para uso POUR-ON, solo deberían usarse en vacas gestantes para evitar golpes en el baño de inmersión o aspersión, o cuando el baño se encuentre retirado de donde los animales están agostando. En todo caso se recomienda tener cuidado con la dosificación, ya que por su presentación es fácil cometer errores y con esto incurrir en resistencia de las garrapatas. NO MEZCLAR diferentes presentaciones de productos químicos por separado, o en su defecto hacer mezclas caseras, ya existen mezclas autorizadas que se manejan con particular precaución. Todos los bovinos del rancho tienen que bañarse, revisar los demás animales domésticos (cabras, ovejas, caballos, perros) para la presencia de garrapatas y realizar un control apropiado para cada caso. Antes de bañar (aspersión, inmersión) revisar el pronóstico de lluvia para evitar pérdidas del garrapaticida una vez aplicado. Evitar el baño de los animales en las horas más calientes del día, pues se pierde producto químico por evaporación. Cuando se apliquen Endectocidas (Ivermectinas, Avemectinas) por vía subcutánea se prefiere usar una aguja por animal por cuestiones de bioseguridad, estas agujas pueden ser desechables o de acero inoxidable debidamente desinfectadas con alcohol al 70% (de venta libre en farmacias). Baño de Aspersión Este método de tratamiento es empleado con mayor frecuencia por ser práctico y poco costoso para el ganadero, existen diferentes formatos de este baño como la mochila aspersora, motobombas de gasolina y baños de aspersión en túnel que ofrece una ventaja sobre los otros métodos, ya que ahorra agua y producto químico, el baño de los animales es adecuado como si se tratase de un baño de inmersión, puede elaborarse de materiales de bajo costo y no requiere de mucho entrenamiento para ejecutarlo, sin embargo, presenta algunos inconvenientes en las boquillas aspersoras, pues se tapan con frecuencia con el pelo de los bovinos, por cada 30 bovinos el agua debe cambiarse por que contiene excremento, pelo, tierra que afecta la calidad del producto químico preparado, las partes móviles del equipo pueden ejercer daños físicos a los bovinos si estas no están perfectamente instaladas. En términos generales el baño de aspersión es una buena opción cuando el número de animales a bañar es reducido, pueden emplearse las corraletas ya existentes en el rancho para realizar el baño, no obstante, es de importancia revisar los siguientes puntos: Seguir un orden al tiempo de bañar a los animales (cabeza-lomo-parte media del cuerpo-extremidades). Colocar el aspersor a no más de un metro de los animales. No bañar en contra del viento. De forma práctica se pueden bañar adecuadamente con una motomba de gasolina hasta cuatro animales adultos a la vez en un corral reducido. Puede utilizar las mangas de manejo para el baño, siempre y cuando estas no sean de materiales que cubran gran parte del cuerpo de los animales. Tome su tiempo para bañar, bañar con prisa no es bañar. Recordar que el éxito del producto químico reside la aplicación de este en una superficie extensa de la piel para poder absorberse y llegar a la sangre que consumen las garrapatas. No dejar áreas sin bañar como orejas, ubre, escroto, parte ventral, inserción de la cola, área de cuernos y cabeza en general. A continuación se muestran fotografías de baño de aspersión incorrectas. Baño de Inmersión Este tipo de baño es adecuado para bañar un gran número de animales aunque requiere una inversión para realizar la instalación y las observaciones son las siguientes: Revisar que la cantidad de sólidos disueltos no rebase el 25% del contenido del baño, para lo cual puede tomar una muestra de agua que debe revolver antes para que la muestra sea homogénea, de preferencia en un recipiente de un litro dejarla reposar por una hora aproximadamente y revisar los sólidos, si estos rebasan el parámetro anotado anteriormente es indicativo que el baño debe limpiarse y reponerse con agua nueva y limpia. Conocer la capacidad del baño de inmersión, esto lo puede lograr siguiendo la fórmula que se anota en la figura 6, una vez que conozca este parámetro es recomendable anotar con pintura indeleble sobre las paredes del baño la cantidad de litros de agua que corresponde, esto ayudará al correcto depósito de agua y producto químico. Revisar con atención las indicaciones del fabricante de los productos químicos para hacer un buen uso de ello en la primer recarga como en la siguiente, es de especial precaución el uso de amidinas, pues requieren un estabilizador (cal) y un pH adecuado para funcionar. Recordar que es de suma importancia diluir previamente el contenido del producto químico en un recipiente con agua para asegurar una mezcla homogénea y posteriormente verte la mezcla sobre el agua del baño de inmersión. Control de Brucelosis Desde el año 1971 existe una Campaña oficial que fue reactivada en 1993. Figura: Fórmula y diagrama para calcular la capacidad del baño de inmersión. Existen las instancias oficiales que han caracterizado la enfermedad mediante estudios para la determinación de la prevalencia estableciéndose las zonas de riesgo. Se cuenta con biológicos tanto para el diagnóstico como para la profilaxis de la enfermedad: Se estableció la dosis reducida de la cepa 19 de B. abortus, para su aplicación en vacas, se inició el uso de esta modalidad de la vacuna en varios lugares del país; México es el único país del mundo que produce y expende comercialmente, además de la dosis para becerras, la dosis para vacas de la vacuna RB51 de B. abortus. Igualmente el país está organizado con instancias para operar, ejecutar y evaluar las actividades tendientes a la constatación de hatos y rebaños, así como la aplicación sistemática de vacunas. La Dirección General de Salud Animal tiene el registro de casi 2,000 Médicos Veterinarios Responsables Autorizados en el área de rumiantes para aplicar los esquemas de erradicación de la enfermedad. En el año 1994 el Estado de Sonora obtuvo el Reconocimiento de fase de Erradicación de Brucelosis bovina, en 2002 el Estado de Yucatán ingresó a la fase de erradicación, la Región Norte del Estado de Sonora fue reconocida como libre de Brucelosis bovina el 26 de noviembre de 2003. Durante 2010 se logró el cambio a fase de Erradicación del Estado de Baja California Sur, la Región “A” del Estado de Campeche, conformada por 10 municipios y la Región denominada “Costas” del Estado de Guerreo, conformada por 25 municipios. Las pruebas diagnósticas autorizadas por la SAGARPA son: - Prueba en tarjeta. - Prueba de rivanol. - Prueba de fijación del complemento. La prueba de tarjeta se efectúa con muestras de suero sanguíneo no bemolizado. Los resultados de la prueba de tarjeta arrojarán sólo dos clasificaciones: Positivos negativos, Dependiendo de la presencia o ausencia de aglutinación, según sea el caso. La prueba de rivanol Se debe realizar sólo en suero de bovino: Con sueros no bemolizados, positivos a la prueba de tarjeta, los resultados de la prueba de rivanol se clasifican En sueros positivos y negativos. Fijación del complemento Se debe realizar con sueros no bemolizados que hayan resultado positivos a las pruebas de tarjeta y/o rivanol. Los resultados clasificarán a los sueros como positivos los títulos mayores a 1/16 en frío o mayores a 1/8 en caliente y negativos. Procedimiento para la obtención de la constancia de hato libre Ganado productor de leche y de doble propósito.- En bovinos y caprinos se deben realizar tres pruebas diagnósticas con resultados negativos, realizadas con intervalos entre 60 y 90 días entre una y otra prueba. Ganado productor de carne.- En el bovino, caprino y ovino se deben realizar dos pruebas diagnósticas con resultados negativos, entre los siguientes 3 a 10 meses posteriores a la realización de la primera prueba. La aplicación de las pruebas diagnósticas oficiales en bovinos se realiza en hembras mayores de 22 meses de edad que recibieron la dosis clásica de vacuna cepa 19 entre los 3 y 6 meses de edad; en hembras vacunadas con dosis reducida, únicamente se podrán realizar las pruebas diagnósticas 10 meses después de la fecha de vacunación; en las hembras nunca antes vacunadas y en los machos enteros, el muestreo se debe realizar a partir de los 6 meses de edad. Al finalizar el número de pruebas que correspondan a un determinado hato, si los resultados fueron negativos, se expedirá la constancia de hato libre de brucelosis, la cual tendrá una vigencia de 14 meses. Bibliografía Norma Oficial Mexicana 041ZOO 1996 Campaña nacional contra la brucelosis en los animales. Control de Tuberculosis Bovina Introducción La tuberculosis es una enfermedad de transmisión directa e indirecta, febril, de curso típicamente crónico, que afecta a todos los animales, incluido el hombre. Es producida por bacterias del género Mycobacterium, el M. Bovis, el complejo M. avium (constituido por las especies M. avium, M. intracelulare y M. scrofulaceum) y el M. Tuberculosis. Se caracteriza patológicamente por un granuloma específico con tendencia a la caseificación. Costos de la Tuberculosis (Tb). En México no se tienen estadísticas confiables para estimar la perdida en la producción ganadera por concepto del virtual cierre de fronteras a la exportación, del ganado, sin embargo de los datos que se pueden extrapolar de nuestros vecinos del estado de Texas podemos tomar en cuenta la información que ellos liberan. En octubre del 2000, el USDA estimó que los productores de ganado de Texas (14,000,000 cabezas de Inventario) perderían de 260 a 788 millones de Dólares en 5 a 10 años, por los costos extra y disminución del valor de sus hatos al no poder sacar de Texas su ganado. En junio de 2002, Texas, perdió el estatus de libre de tuberculosis bovina. En 2001 se encontraron 2 de 153,000 hatos infectados. Estos dos hatos uno lechero y el otro productor de ganado de registro fueron despoblados y otros 150 hatos cercanos o ligados han sido probados siendo negativos. Para movilizar ganado fuera de Texas, deben de aretar y probar más de 1.5 millones de cabezas cada año. En el periodo de 1997 a 2001, se diagnosticaron en Texas 109 casos de Tb en ganado Mexicano. A partir de octubre 2002, se endurece la regulación que permite la exportación de ganado a Texas, especialmente el ganado de cría y de rodeo por el riesgo para el ganado en Texas, 6 de los toros de rodeo sacrificados en 2001 fueron positivos a Tb. Patogenia Se trata de una enfermedad cíclica, que cumple su proceso evolutivo en distintos períodos, caracterizados por síntomas y lesiones propios para cada uno de ellos. La evolución de los mismo, está condicionada a diversos factores ligados a: Huésped (estado inmunitario, edad, nutrición, genética, etc.), al bacilo (número, virulencia, etc.) y al medio ambiente. La infección ocurre en el 50% de los expuestos. De los infectados el 10 al 15% desarrollan la enfermedad en forma activa. Por la ruta aerogena, se necesitan 1 a 2 bacilos para infectar. Tuberculosis primaria El primer contacto del bacilo tuberculoso con un organismo sano, origina una lesión inflamatoria inespecífica. Su localización dependerá de la puerta de entrada (generalmente respiratoria o digestiva). La asociación entre la lesión inicial en la puerta de entrada y el nódulo regional constituyen lo que se denomina "complejo primario". Este tiene una evolución hacia diversas formas: Hacia la cura: pudiendo dejar o no cicatriz. Hay cura bacteriológica. Hacia la estabilización (foco latente): en esta forma el proceso evolutivo puede detenerse No hay cura bacteriológica, ya que hay bacilos virulentos enquistados en las lesiones. Hacia la generalización precoz inmediata: esta es la forma resultante de la diseminación bacilar por vía linfática o hemática a todo el organismo, produciendo lesiones tuberculosas en diversos órganos, siendo la lesión en los nódulos linfáticos una constante. Formación de complejo primario El bacilo llega a los alvéolos en donde se rodea de macrófagos. Tras la infección en los alvéolos se recubren de macrófagos, para formar el complejo primario La generalización precoz aguda: se presenta cuando la resistencia es baja, Son típicas las lesiones de tuberculosis miliar aguda (pequeños tubérculos, grises o amarillos). Se presentan en forma más común en pulmón. También puede haber lesiones exudativas (neumonía, meningitis), con desenlace fatal. La generalización precoz moderada o lenta: se manifiesta cuando hay resistencia parcial, Son típicas la tuberculosis nodular y la tuberculosis perlada (lesiones nodulares). Tuberculosis secundaria Son características las lesiones caseosas con formación de úlceras y nódulos. La diseminación del bacilo no es por vía linfohemática, sino por vía canalicular. Puede estabilizarse, sin compromiso inmediato de la vida. Pero puede evolucionar hacia una generalización aguda tardía. Es característica la tuberculosis miliar, lleva a la muerte. Inmunopatogenia Los macrófagos alveolares fagocitan y destruyen a la mayor parte de los bacilos, transportándolos eventualmente a los nódulos regionales. Se multiplican a nivel intracelular en forma logarítmica, en macrófagos reclutados del torrente sanguíneo, destruyéndolos. Liberados nuevamente, atraen por mecanismos quimiotácticos a monocitos y macrófagos, formándose un tubérculo primario inicial. Normatividad aplicable La NOM 031 ZOO 1995, Campaña Nacional contra la Tuberculosis Bovina, es de observancia obligatoria en todo el territorio nacional y tiene por objeto, regular y establecer los procedimientos, actividades, criterios y estrategias, técnicas y características para el control y erradicación de la tuberculosis bovina. Su campo de aplicación serán todas las explotaciones pecuarias que manejen bovinos, inclusive para aquellas personas que posean únicamente un animal. Para efectos de esta Norma, se entiende por: Animal enfermo: Es aquel animal de las especies bovinas del cual se aisló el Mycobacterium bovis. Animal expuesto: Es aquel de las especies bovinas que ha tenido contacto con un animal o animales enfermos de los cuales se aisló el Mycobacterium bovis. Animal negativo: Es aquel animal que ha sido sujeto a una o varias pruebas diagnósticas oficiales de tuberculosis y cuyos resultados han sido negativos. Animal reactor: Es el que ha sido sujeto a una o más pruebas diagnósticas oficiales de tuberculosis y cuyos resultados han sido positivos. Constancia de hato libre: Documento oficial otorgado por la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (Secretaría), al propietario del hato que ha demostrado mediante pruebas de tuberculina, que los animales se encuentran libres de tuberculosis bovina. Constancia de hato negativo: Documento oficial otorgado por la Secretaría, al propietario del hato que ha resultado negativo a una prueba de tuberculina. Prevalencia: Número de casos de tuberculosis que se presentan en una población animal, en un área geográfica definida durante un período de tiempo determinado. Pruebas diagnósticas: Aquellas autorizadas por la Secretaría para la Campaña y que son: Prueba de tuberculina: - en el pliegue caudal - cervical comparativa - cervical simple - Histopatología. -Aislamiento bacteriológico. Las tuberculinas autorizadas para efectos de Campaña son: PPD bovino: elaborado con Mycobacterium bovis cepa AN5, que se utilizará en la prueba caudal, cervical comparativa y cervical simple. PPD aviar: elaborado con Mycobacterium avium cepa D4, que será utilizada en la prueba cervical comparativa. La tuberculina de PPD aviar debe contener como colorante el rojo de Ponceau, para distinguirla de la de PPD bovino que no lleva colorante. Las tuberculinas deben ser transportadas y conservadas en frío a una temperatura de 4 a 8°C y protegidas de la luz solar directa durante el trabajo de campo, debe verificarse el lote y fecha de caducidad del producto. Una vez utilizado el antígeno, deberá desecharse el resto del contenido del envase si no se va a utilizar el mismo día. Las técnicas de manejo para la aplicación de tuberculina en el pliegue caudal consistirán en: Inmovilización del animal. Limpieza de la zona donde se aplicará el biológico. Además deberá efectuarse un minucioso examen de ambos pliegues, anotando cualquier irregularidad que pueda confundirse con la prueba. Insertar la aguja en toda su longitud intradérmicamente, haciendo un ángulo de 45°, aplicando 0.1 ml del biológico. En el sitio de la aplicación aparecerá un pequeño abultamiento. La interpretación de la prueba caudal se ajustará a lo siguiente: La lectura se hará por el mismo Médico Veterinario que efectuó la prueba, mediante la observación y palpación del sitio donde se practicó la inoculación, realizándose a las 72 horas (± 6 horas) posteriores a la aplicación del biológico, el médico verificará que se trata de los mismos animales inoculados. Las reacciones se clasifican como: Negativa: Cuando no se observe ni se palpe ningún cambio en la piel del sitio de aplicación. Reactor: Cuando sea visible y/o palpable cualquier engrosamiento, rubor, calor, dolor o necrosis en el sitio de aplicación. La Prueba Cervical Comparativa. Es la única prueba autorizada para confirmar o descartar animales reactores a la prueba de pliegue caudal. Se podrá efectuar por única vez dentro de los 10 días naturales siguientes a la lectura de la prueba caudal; o bien después de transcurridos 60 días naturales, debiéndose aplicar por un Médico Veterinario oficial o aprobado, se aplica en hatos o regiones con presencia de Mycobacterium paratuberculosis y/o Mycobacterium avium. Esta prueba no debe ser utilizada en hatos cuando el diagnóstico se haya obtenido por el aislamiento de M. bovis de las muestras de los animales sacrificados. Para la aplicación de la Tuberculina en la prueba cervical comparativa, se tomarán en cuenta las siguientes prácticas: Previo a la realización de la prueba, el Médico Veterinario deberá contar con la documentación de las pruebas anteriores para verificar la entrada o salida de animales del hato. Rasurar el área donde se inoculará la tuberculina en el tercio medio superior del cuello. El sitio de aplicación superior será cerca de 10 cm debajo de la cresta, el sitio inferior será aproximadamente de 13 cm debajo de la anterior, esta prueba se aplica mediante la inoculación intradérmica de 0.1 ml de PPD aviar y 0.1 ml de PPD bovino. Previo a la inoculación, se levanta un pliegue de piel en el centro de las áreas rasuradas y se procederá a medir el grosor de éstos, utilizando el cutímetro. El registro final de las medidas deberá redondearse según el siguiente criterio: de 6.2 baja a 6.0, 6.3 sube a 6.5; de 6.7 baja a 6.5; de 6.8 sube a 7; debiendo registrarse los valores en los formatos para prueba cervical comparativa. El PPD aviar se inocula intradérmicamente en el área rasurada superior y el PPD bovino en la inferior. La lectura de esta prueba se realizará 72 horas ( 6 horas), midiendo con el cutímetro el grosor de las reacciones, estas serán anotadas en el formato oficial de la prueba cervical comparativa, sustrayendo el valor de la primera lectura al de la segunda; una vez realizada esta operación se procede a graficar los valores obtenidos tanto de PPD aviar como del bovino y el punto de intersección dará el resultado de la prueba. De acuerdo a la gráfica oficial se interpretarán los resultados. Prueba cervical simple. Esta prueba se empleará para probar hatos en los que se conoce la existencia de M. bovis; o bien, para probar ganado que estuvo expuesto directa o indirectamente con hatos infectados con M. bovis. Se debe rasurar el área donde se inoculará la tuberculina en el tercio medio superior del cuello. El sitio de aplicación será aproximadamente 10 cm debajo de la cresta. Esta prueba se aplica mediante la inoculación intradérmica de 0.1 ml de PPD bovino en la región media cervical, haciendo la lectura el mismo Médico Veterinario que aplicó la prueba mediante la observación y palpación del sitio en donde se practicó, realizándose a las 72 ± 6 horas posteriores a su inoculación. Las reacciones se clasifican como: Negativa: Cuando no se observe ni se palpe ningún cambio en la piel del sitio de aplicación. Reactor: Cuando sea visible y/o palpable cualquier engrosamiento, rubor, calor, dolor o necrosis en el sitio de aplicación. Toma de muestras. La toma de muestras para estudios histopatológico y bacteriológico se realizará de la siguiente forma: Se seleccionarán y tomarán muestras de los siguientes órganos que presenten lesiones compatibles con tuberculosis o secreciones sugestivas: Nódulos Linfáticos. Tomando muestras preferentemente de los nódulos de la cabeza, preescapulares, mediastínicos anteriores y posteriores y bronquiales derecho e izquierdo. En el caso de tuberculosis miliar tomar muestras de nódulos mesentéricos. Pulmones. La lesión tuberculosa puede ser caseosa o calcificada o una cavidad franca. De este órgano se tomarán muestras de 2 cm por lado de las lesiones presentes. Útero en caso de metritis tuberculosa. Se caracteriza por secreción continua de grandes cantidades de pus amarilla teniendo el aspecto de leche cuajada. Se tomarán las muestras del órgano y de este exudado. Otros órganos. También se tomarán muestras de los siguientes órganos cuando presenten lesiones sugestivas de tuberculosis: bazo, hígado, riñón, médula ósea, ovarios, testículos y glándula mamaria. Si el animal es positivo a la prueba de tuberculina y en la necropsia no presenta cambios que sugieran la infección del animal, entonces se deberán enviar al laboratorio nódulos de la cabeza como los retrofaríngeos, mandibulares, parotídeos y las tonsilas faríngeas, así como los mediastínicos y mesentéricos. Todas las muestras deberán estar perfectamente identificadas, anotando: Nombre del propietario. Ubicación de la explotación de origen. Donde se obtuvo la muestra. Organo. Descripción del animal: especie, raza, sexo y edad. Identificación precisa del animal como arete, marca, u otro. Nombre, registro y domicilio del Médico Veterinario oficial o aprobado que remite la muestra. Destino del canal y vísceras, ya sea decomiso parcial o total. En el laboratorio las muestras serán sometidas a las pruebas de diagnóstico bacteriológico o histopatológico. Diagnóstico bacteriológico. Examen directo: Mediante la tinción de Ziehl Neelsen o de nueva fucsina para microorganismos ácido alcohol resistentes en frotis realizados con el material sospechoso. En caso de ser una muestra positiva, con esta tinción se observarán bacilos teñidos de color rojo. Puede utilizarse la microscopía de fluorescencia mediante la tinción con auraminarodamina, auramina acridina o auramina fenol, que tiñe a la bacteria de color verde brillante. Examen indirecto: Cultivo, aislamiento e identificación del Mycobacterium, a través de la siembra de material sospechoso en medios especiales como Herrolds con y sin huevo, Middle Brook y Stonebrink, Petragnani, ATS y Lowenstein Jensen. Diagnóstico histopatológico Se deberá utilizar la tinción de hematoxilina-eosina. Esta técnica permite identificar cualquier cambio morfológico de los tejidos, así como la presencia de los granulomas. Además pueden utilizarse las tinciones de Ziehl Neelsen y nueva fucsina en cortes o improntas realizados con el material sospechoso. Forma de envío de muestras para el aislamiento bacteriológico. Es necesario sumergir los tejidos en solución saturada de borato de sodio, si se trata de nódulos aparentemente afectados se deberán enviar completos sin grasa; si se trata de otro tejido, se deberá seleccionar la posible lesión y enviar muestras no mayores de 2 cm por lado. Hato libre Para la obtención de constancia de hato libre, será necesario llevar a cabo los siguientes pasos: Ganado Productor de leche y de doble propósito (mixto).- Se deberán realizar tres pruebas diagnósticas en forma homogénea a la totalidad con resultados negativos, con intervalos no menores de 60 días naturales ni mayores de 90 entre una y otra prueba a todos los animales mayores de 15 meses. En hatos lecheros con menos del 10% de prevalencia, se procederá al sacrificio de los animales reactores, en aquellos con más del 10%, tendrán la opción de ser enviados a Unidades de Producción Controlada, en un plazo no mayor de 10 días naturales o instrumentar esta unidad como tal. Ganado productor de carne.- Todo el hato mayor de 15 meses será sujeto a dos pruebas diagnósticas, realizándose con intervalos no menor de 10 meses y no mayor de 14. Los resultados en ambas pruebas deberán ser negativos. Para el reporte de los resultados de las pruebas diagnósticas, se deberá utilizar el dictamen oficial de la prueba de tuberculina. Personal oficial de la Secretaría, deberá revisar los dictámenes de prueba y enviar la documentación a la Comisión. que expedirá, cuando así proceda una constancia de hato negativo, en ganado de carne, cuando se obtengan resultados negativos en una primera prueba y a solicitud del interesado. Al finalizar el número de pruebas que correspondan a un determinado hato y si los resultados fueron negativos, la Comisión expedirá en un plazo no mayor de veinte días a partir de la recepción de la documentación comprobatoria, la constancia de hato libre de tuberculosis, la cual tendrá vigencia de 14 meses La Comisión enviará las constancias a la Delegación que corresponda y ésta, con el apoyo del Coordinador estatal de la Comisión, se hará cargo de remitirlas a los interesados. Los propietarios de hatos libres de tuberculosis deberán conservar los documentos señalados, a fin de que estén disponibles cuando se requiera su comprobación. Asimismo, será su responsabilidad gestionar oportunamente la revalidación. Revalidación de la constancia de hato libre: Se deberá demostrar con documentos, que todos los animales que ingresaron al predio en los últimos 16 meses, fueron negativos a la prueba diagnóstica oficial o que proceden de un hato libre. Realizar una prueba diagnóstica al 100% del pie de cría de los animales mayores de 24 meses, con resultados negativos, en un periodo no mayor de 30 días naturales antes de la fecha de vencimiento de la constancia. En el caso de que se detecten animales positivos, se cancelará la constancia de hato libre y se cuarentenará la unidad de producción. Los animales reactores de un hato serán sacrificados en un rastro autorizado por la Secretaría, en un periodo no mayor de 10 días naturales posteriores a la notificación del resultado, de acuerdo a la fase de Campaña, excepto el ganado lechero especializado en programa de monitoreo de la fase de control. En el incumplimiento a lo antes mencionado dará lugar a la cuarentena de la explotación, la que no podrá levantarse, hasta que en un siguiente muestreo del100% de los animales sujetos a la prueba diagnóstica del hato, realizado en un periodo no menor de 60 días ni mayor de 90 días naturales y no se identifiquen animales positivos. Todos los hatos o lotes en donde se encuentren animales reactores, deberán ser cuarentenados precautoriamente al momento de la notificación a la Secretaría y se deberá de programar dentro de los siguientes 30 días naturales una prueba de todo el hato. Los animales expuestos deben permanecer en el rancho en donde fueron encontrados para que les sea practicada la prueba correspondiente. Los reactores serán enviados a rastro y los negativos podrán permanecer en el rancho para que les sea practicada otra prueba, a menos que se obtenga el Certificado Zoosanitario para su movilización, en cuyo caso, debe realizarse directamente a un rastro autorizado por la Secretaría en donde se practicará el sacrificio inmediato y la inspección post-mortem. Los bovinos de 6 a 12 meses expuestos a M. bovis se les practicará la prueba caudal, los negativos podrán enviarse a corrales o praderas cuarentenarias dentro del estado. Los reactores deberán identificarse y enviarse rastro autorizado. Los hatos en donde la infección por M. bovis ha sido confirmada por resultado de laboratorio, deben permanecer bajo cuarentena hasta que pasen dos pruebas de tuberculinización con resultados negativos, realizadas a intervalos de 60 a 90 días naturales y una tercera prueba después de 180 días naturales de efectuada la primera prueba. Durante estos lapsos, la movilización de estos animales sólo se podrá realizar directamente al rastro y con el Certificado Zoosanitario correspondiente. Los hatos en donde los reactores no presenten lesiones macroscópicas ni microscópicas y que no haya sido posible encontrar o detectar la evidencia de M. bovis, podrán liberarse de la cuarentena, una vez que todo el hato haya sido probado después de 60 días de la última prueba y se obtengan resultados negativos y la constancia que así lo acredite. Los animales sospechosos que resulten de la prueba cervical comparativa, deben ser cuarentenados hasta que se les practique nuevamente la prueba cervical comparativa y se clasifiquen como negativos; o bien, si se desea movilizar a los animales directamente para el abasto, serán considerados como positivos por lo que deberán llevar la identificación correspondiente acompañados del Certificado Zoosanitario. Si los animales sospechosos al ser sacrificados no muestran lesiones macroscópicas ni microscópicas, deberá ser muestreado todo el hato entre los 60 y 90 días naturales siguientes. Los hatos que por rastreo sean el origen de los animales sospechosos y/o positivos, deberán ser cuarentenados en forma precautoria y se deberá programar dentro de los siguientes 30 días naturales una prueba de todo el hato. El futuro de la Tb Técnica diagnóstica alternativa La reacción en cadena de la polimerasa, amplifica el DNA de la bacteria M. Bovis, lo que permite distinguir la Tb de cualquier otro microorganismo 93% de eficiencia en 3 días después de recibir las muestras. Cultivos. Se redujo a una semana el tiempo requerido para el aislamiento. Vacunas. Se trabaja en varias líneas buscando con DNA que proteja al ganado y líneas resistentes a la Tb. Capacitación y actualización. Son las dos vías más efectivas para ayudar a los productores y veterinarios a que adopten medidas de prevención que minimicen el riesgo de introducción de enfermedades infecciosas. Bibliografía Álvarez-Ojeda, G. y col (2009). Protocolo de bioseguridad y biocontención en un rancho de China N.L. INIFAP. Desplegable para productores #10. INIFAP/CIRNE/P-123. Álvarez-Ojeda, G. y col (2010). Protocolo para implementar medidas de bioseguridad y biocontención en un rancho de Montemorelos, N.L.; INIFAP. Desplegable para productores #11. INIFAP/CIRNE/P-130. MX-0-310402-43-03-1312-11. Avalos-Ramírez, R. y col. (2004). Prevalencia y factores de riesgo asociadas a la presencia de IBR, DVB, Leptospirosis y Neosporosis en hatos de Nuevo León. Proyecto Fondos Mixtos CONACYT-NUEVO LEÓN. Clave NL-2004-C05-107. Avalos-Ramírez, R. Manejo para reducir la incidencia de enfermedades reproductivas en el sistema vaca-becerro. Cuarto Simposio sistema Vaca-Becerro. UGRNL. FMVZ-UANL. Cd. Guadalupe N.L. 15-16 mayo 2007. Cantú, C.A. (2002). Factores asociados a la epidemiología de los principales problemas reproductivos en bovinos productores de carne en el estado de Nuevo León (IBR, BVD, Leptospirosis). http://www.unionganaderanl.org.mx Cervantes Vega, R. y cols. (2011). Sistema de Producción Vaca-Becerro. En Consorcio Técnico del Noreste de México. Bioseguridad e inocuidad en la cadena bovinos carne en México. Monterrey, N.L. México. 2011. ISBN: 978-607-9154-004. Domínguez, D.D. (2006). Detección y diferenciación molecular del virus de la Diarrea Viral Bovina (BVDV) en el sistema vaca-cría de Nuevo León. Tesis de Licenciatura. FMVZ-UANL. Dominguez, D.D. (2008). Seropositividad y factores de riesgo para BVDV, IBR, Neosporosis y Leptospirosis en hatos del sistema vaca-cría de Nuevo León. Tesis de Maestría. FMVZ-UANL. Dubey, J. P., and Lindsay, D. S. (1996). A review of Neospora caninum and neosporosis. Vet Parasitol 67(1-2), 1-59. Fray, M. D., Mann, G. E., Clarke, M. C., and Charleston, B. (1999). Bovine viral diarrhea virus: its effects on estradiol, progesterone and prostaglandin secretion in the cow. Theriogenology 51(8), 1533-46. Howard., J. L. Current Veterinary Therapy. Food Animal Practice. Ed. W.B. Saunders. Philadelphia 1986. Levett, P. N. (2001). Leptospirosis. Clin Microbiol Rev 14(2), 296-326. Miller, D. A., Wilson, M. A., and Beran, G. W. (1991). Relationships between prevalence of Leptospira interrogans in cattle, and regional, climatic, and seasonal factors. Am J Vet Res 52(11), 1766-8. Muraira Valdez, J. y Morales Loredo, A. (2012). Comité de Fomento y Protección Pecuaria del Estado de Nuevo León. Comunicación Personal. OIE (2004). Infectious bovine rhinotracheitis / infectious pustular vulvovaginitis. In: Manual of Standards Diagnostic Tests and Vaccines 2004, Edition 5. Office International des Epizooties. http://www.oie.int OIE (2004). Bovine Viral Diarrhoea In: Manual of Standards Diagnostic Tests and Vaccines 2004, Edition 5. Office International des Epizooties. http://www.oie.int Rocha, T. (1998). A review of leptospirosis in farm animals in Portugal. Rev Sci Tech 17(3), 699-712. SAGARPA. www.sagarpa.gob.mx Salinas, M. J. A., Mora, G.J.J., Zárate, R., J.J., Riojas, V.V.M., Hernández, V.G., Dávalos, A.G., Ramírez, R.R., Galán, A.L.C., Ávalos, R.R. (2005). Frecuencia de anticuerpos contra Neospora caninum en ganado bovino del noreste de México. Vet. Méx 36(3), 303-311. Sanderson, M.W. and Gnad, D.P. (2002). Biosecurity for reproductive diseases. Vet. Clin. Food Anim. 18:79-98. Smith, D.R. (2006). Veterinary Clinical Epidemiology. Third edition.CRC Press. Solis-Calderon, J. J., Segura-Correa, V. M., and Segura-Correa, J. C. (2005). Bovine viral diarrhoea virus in beef cattle herds of Yucatan, Mexico: seroprevalence and risk factors. Prev Vet Med 72(3-4), 253-62. Texas Animal Health Comission en www.tahc.state.tx.us/ USAHA WEB www.usaha.org Valdez Santos, E. (2008). Implementación y evaluación de protocolos de bioseguridad en dos hatos bovinos del sistema vaca-cría de Nuevo León. Tesis de Licenciatura. FMVZ-UANL.