PEEC-Noticias
Anuncio

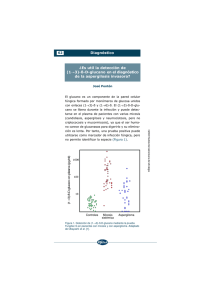
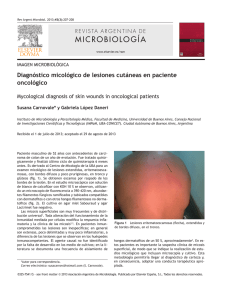
Programa de Evaluación Externa de Calidad PEEC-Noticias Junio 2011 PEEC-Micología La toma de muestra y procesamiento de materiales en el diagnóstico de las micosis superficiales María de las Mercedes Romero (1), Amadeo Javier Bava (2) (1) Residencia de Microbiología. Hospital de Enfermedades Infecciosas “Francisco J Muñiz” y (2) Cátedra de Micología. Facultad de Ciencias Exactas. Universidad Nacional de La Plata Las micosis superficiales son afecciones fúngicas que involucran a la capa córnea de la piel y sus faneras (pelos y uñas), así como a la capa superficial de las mucosas oral y genital. De evolución habitualmente benigna, estas micosis no ponen en peligro la vida del paciente, aunque si provocan lesiones que disminuyen su calidad de vida. La confusión de estos cuadros con otros clínicamente similares, ocasiona el empleo de medicamentos por lapsos prolongados (por ejemplo en las onicomicosis) con los consiguientes costos, eventuales efectos tóxicos, fracaso terapéutico e insatisfacción del paciente. Agentes causales de las micosis superficiales Dentro de estas micosis se incluyen diversos cuadros, entre los que predominan en la práctica diaria las dermatofitosis, las candidiasis y la pitiriasis versicolor. Otras micosis superficiales, como las piedras: blanca (provocada por especies de Trichosporon) y negra (Piedraia hortae) y la tinea negra (Phaeoannelomyces werneckii) son infrecuentes. Igual consideración podríamos aplicar a las dermatomicosis producidas por especies de Penicillium, Aspergillus, Fusarium, etc. (consideradas como oportunistas). Históricamente, y de manera errónea, se han estudiado dentro de estas patologías, infecciones tales como el eritrasma y la tricomicosis axilar, que reconocen una etiología bacteriana. La primera de ellas es producida por Nocardia (Corynebacterium) minutissima y la otra por N. (Corynebacterium) tenuis. Estos Actinomycetales no desarrollan bien en los medios habitualmente empleados en Micología y si pueden ser reconocidos en la microscopia en fresco y previa coloración (Gram, Giemsa y Kinyoun). El diagnóstico de las micosis superficiales La sospecha clínica (diagnóstico presuntivo) de una micosis superficial debe ser siempre confirmada mediante el diagnóstico microbiológico de certeza. Este último se basa en la visualización, el aislamiento y la tipificación de su agente causal en el laboratorio. Esto permitirá diferenciar estos cuadros de otros clínicamente similares y elegir el tratamiento antifúngico específico. El procedimiento de diagnóstico requiere de la adecuada preparación previa del paciente y la toma de una muestra representativa. El rápido transporte al laboratorio y el inmediato procesamiento impiden la pérdida de viabilidad de los hongos eventualmente presentes en la muestra. La microscopia aporta datos relevantes para el empleo posterior de una correcta metodología diagnóstica. La elección de medios de cultivo apropiados para inocular las muestras y la incubación a temperatura óptima favorecen las posibilidades de aislamiento del agente causal. La toma de las muestras La toma de muestras es el punto crítico o piedra angular para el diagnóstico certero, por lo que requiere de gran cuidado y dedicación del operador encargado de realizarla. “La calidad del procedimiento o la experiencia del observador nunca serán tan o más importantes que la calidad de la muestra a procesar”. La metodología a emplear dependerá del tipo de tejido afectado (piel, mucosas, pelos o uñas) y de las características propias de la lesión (descamativa, húmeda, ulcerada, etc.). Igualmente, según el caso, los materiales disponibles para la extracción serán sindesmótomo, bisturí, pinza de depilar, cinta adhesiva transparente o hisopo, todos ellos convenientemente esterilizados. La preparación previa asegura la recolección de un material representativo y evita la obtención de resultados erróneos, ya sea falso positivos (por el desarrollo de contaminantes ambientales) o negativos (por la existencia de medicación o sustancias que interfieren la observación microscópica o los resultados de los cultivos de la muestra). Las muestras obtenidas de pacientes que no hayan cumplido con tales instrucciones deberán ser desechadas o bien, de ser procesadas, debemos atenernos a las controversias que pudieran ocasionar los resultados obtenidos. El paciente debe evitar el uso de pomadas, cremas, lociones, talcos y/o antifúngicos de aplicación local o sistémica los días previos al estudio. Cuando la lesión se localiza en la piel, debe lavarse con agua y jabón blanco y luego enjuagarse con salmuera. Cuando están afectadas las uñas, las mismas deben cepillarse con agua y jabón y realizar baños en salmuera, al menos los tres días previos al estudio. Si la lesión involucra los pies, el paciente debe concurrir al momento de la toma de la muestra con los pies limpios, con medias y zapatos cerrados. Es responsabilidad del personal a cargo de la recepción de las muestras que el paciente comprenda todas las instrucciones, las cuales de preferencia deben ser explicadas y entregadas por escrito. Para una mejor interpretación de los resultados, es conveniente la realización de una anamnesis que permita establecer el tipo de actividades que desarrolla el paciente, el contacto con animales o suelos, sustancias irritantes, el padecimiento de enfermedades subyacentes o situaciones favorecedoras, alergia o estrés, el tiempo de evolución de la lesión, toma de medicamentos, etc. En el caso de las lesiones cutáneas, la muestra consta de escamas tomadas de la región periférica de las mismas, por raspado con un bisturí, sindesmótomo (lanceta odontológica) o cureta. En ocasiones, algunos recurren al uso de cinta engomada transparente (que se pega y despega de la superficie de la lesión), método que sólo permite la observación microscópica de la muestra. Ocasionalmente, puede emplearse el borde de un portaobjetos para obtener las escamas en lesiones cutáneas descamativas. Cuando las lesiones son húmedas o bien consisten en una maceración, podemos recurrir al hisopado de las mismas, a los efectos de no provocar daño de los tejidos. Con el material obtenido pueden realizarse extendidos (posteriormente fijados) o bien preparaciones en fresco, con el agregado de unas gotas de agua destilada o solución fisiológica estériles. El material córneo deberá colocarse entre dos portaobjetos previamente flameados, en cantidad suficiente para realizar la microscopia y los correspondientes cultivos. En el caso de las uñas, debe localizarse la zona afectada (la onicomicosis puede ser proximal, blanca superficial, distal y/o lateral subungueal o distrófica), raspando en el límite con la zona sana y recolectando el material córneo del mismo modo que en el caso de las lesiones cutáneas. Cuando se encuentran afectados los pelos, los mismos pueden obtenerse por depilación con pinza o por raspado de la zona alopécica en el caso que la hubiera. De existir lesiones inflamatorias y húmedas como el Kerion de Celso, puede emplearse el hisopado o la depilación de los pelos afectados. El procesamiento de las muestras Una vez obtenida la muestra, se separa una pequeña porción, se le coloca una gota de KOH al 40% (para clarificarla), se calienta suavemente sobre la llama del mechero, y se observa al microscopio en fresco con objetivos secos. En el caso de sospechar una pitiriasis versicolor se puede realizar el preparado con una gota de tinta Parker® azul negro permanente, que tiñe a las levaduras y filamentos de Malassezia. El resto de la muestra se siembra con un ansa estéril en un medio de cultivo, que puede ser Sabouraud, Lactrimel, agar avena, agar banana u otros, según el gusto del operador. El medio de Dixon permite el aislamiento de Malassezia, que no desarrolla en los medios antes mencionados o bien lo hace en Sabouraud con el agregado de aceite de oliva. Los tubos, que contienen el medio de cultivo en “pico de flauta”, deben incubarse en una estufa de cultivos a 28ºC (a 37º en el caso de requerirse el aislamiento de Malassezia) durante al menos 14 días, antes de considerarlos como negativos. Una vez que se observa el desarrollo de colonias sospechosas, se procederá a la identificación de la misma, en el caso de los hongos filamentosos, a través de preparaciones por disociación o bien microcultivos, si fuera necesario. Los primeros requieren de la toma de una porción de la colonia y su disociación mediante agujas, sobre la superficie de un portaobjetos, con el agregado de azul de lactofenol En el caso de las levaduras, a la microscopia se agregará la realización de pruebas bioquímicas fisiológicas, de asimilación y de fermentación. La identificación al nivel de especie así como las pruebas de susceptibilidad a los antifúngicos “in vitro” se reservan en general para casos particulares, por ejemplo ante la falta de respuesta a la medicación antifúngica. Las pruebas de susceptibilidad a los antifúngicos para los hongos dermatofitos son engorrosas y la interpretación de sus resultados puede ser controversial y puede no coincidir con la evolución clínica del cuadro. Las técnicas empleadas, en su mayoría en fase de investigación, requieren de personal especializado e infraestructura adecuada. En el caso de la susceptibilidad “in vitro” de las levaduras a los antifúngicos, existen equipos comerciales para estas determinaciones. Igualmente, su pedido debe reservarse para situaciones particulares. La confección del informe micológico La confección del informe micológico constituye otro paso fundamental, donde el laboratorista debe establecer claramente los hallazgos obtenidos en la muestra. En el caso particular de las micosis superficiales consta de dos ítems fundamentales, la microscopia y los cultivos. En casos particulares, el resultado de la microscopia puede entregarse mientras se encuentran en proceso los cultivos. El informe debe contener (en el ítem observaciones) todas aquellas consideraciones particulares que ayuden a la interpretación por parte del médico tratante. La repetición del estudio deberá proponerse en todos aquellos casos en los cuales existan dudas acerca del resultado obtenido o los mismos puedan tener una interpretación controvertida. Bibliografía Valdivia Blondet L, Las dermatofitosis: clínica, diagnóstico y tratamiento. Dermatol peru 13; 7-12, 2003. Weitzman I, Summerbell R C. The dermatophytes. Clin Micrbiol Rev 8; 240-59, 1995. Arenas R, Micologia Médica Ilustrada 2ªed., 2003 Bava A J, Introducción a la Micologia Medica, 1ª Ed. 2002 Procesamiento de las muestras superficiales, Asociación Española de Micología. Revista Iberoamericana de Micología, 2001 Koneman R. Micología. Práctica de laboratorio. 3ra edición Mycoses produced by dermatophytes and yeasts. Sanabria R, Fariña N, Laspina F, Balmaceda MA, Samudio M. Departamento de Microbiología, Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción Larone DH. Medically Important Fungi. A guide to identification. 3rd Ed. Washington DC: ASM Press; 1995.