Tema 8 Enlace metálico
Anuncio

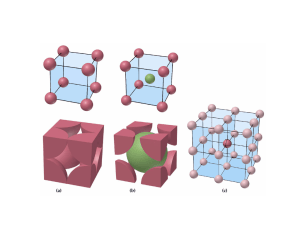
Tema 8 Enlace metálico Bibliografía: Petrucci, Housecroft y Sharpe, Casabó y Shriver y Atkins Metales 75% de los elementos ↓ E. Ionización: < 900 kJ/mol (except Hg: 1000) (No metales > 900 kJ/mol) Común nº de e de valencia < nº orbitales de valencia Na: 3s1 Æ 3s + 3p = 4 orbs vacíos Cu: 3d104s1 Æ vacíos los 4p y 4d ↓ E. Ionización Æ núcleos atraen poco a e- de valencia Moléculas diatómicas metálicas: ↓ E. Disociación Li2 (103) Na2 (73) , K2 (55) Estabilidad ↑ mucho cuando e- de valencia atraídos por varios núcleos (es posible al haber muchos orb. vacíos) e- tienen gran libertad de movimiento Conductores de la electricidad Enlace metálico Enlace fuerte Átomos metálicos (pocos e− valencia) no forman enlaces covalentes Æ compartiendo e− no adquieren la estructura de gas noble Se comparten los e− de valencia colectivamente Nube electrónica rodea al conjunto de cationes, empaquetados ordenadamente, formando una estructura cristalina de alto índice de coordinación Modelos que lo explican: Modelo del mar de electrones Modelo de bandas Estructuras de los metales Teorías de enlace T. del gas electrónico T. de bandas Propiedades físicas de los metales Estructura cristalina Disposición compacta de átomos: alta coordinación Cúbica simple Cúbica centrada en el cuerpo Cúbica complacta (centrada en las caras) Hexagonal compacta Algunos metales pueden presentar varias estructuras Æ POLIMORFOS Empaquetamiento de esferas NO compacto (1) el espacio no se aprovecha al máximo Estructura cúbica-primitiva 1 esfera por celda unidad (c.u.) a=b=c Empaquetamiento de esferas NO compacto (2) Se aprovecha algo más el espacio Estructura cúbica centrada en el cuerpo 2 esferas por celda unidad (c.u.) a=b=c Empaquetamiento de esferas compacto Máximo aprovechamiento del espacio forma más simple de empaquetamiento de esferas iguales, unidos por fuerzas no direccionales. (Estructuras con alta simetría) Empaquetamiento de esferas compacto: dos posibilidades politipos Hexagonal Cúbico Celdas unidad de los empaquetamientos compactos hexagonal 6 esferas por c.u. a=b≠c Cúbico centrado en las caras 4 esferas por c.u. a=b=c Nºdc cúbica simple o primitiva 6 Cúbica centrada en el cuerpo 8 esferas/c.u. 1 2 % 52% 68% empaquetamientos compactos Cúbico centrado en las caras 12 4 74% 12 6 74% hexagonal Relación r y a d= nºesferasxPa/Nav r3 Teoría del gas electrónico Metales: conjunto de cationes que se ordenan formando una red y entre ellos se sitúan los electrones que pueden moverse en el campo de varios núcleos Redes metálicas: más estables que los átomos aislados. Son un ejemplo extremo de enlace deslocalizado Teoría de bandas del enlace metálico Ej: Li Número de átomos enlazados Li Li2 Li3 .... Al aumentar el nº de átomos Æ aumenta el de orbs. moleculares que tienden a converger Conjunto de niveles muy próximos: banda de Energía Orbitales moleculares y banda s. Orbitales moleculares y banda p. Banda de Valencia y Banda de conducción ALCALINOTERREOS ALCALINOS nNa → ne- Grupo 13 p p p s s s nMg → n2e- CONDUCTORES nAl → n3e- B.C. E B.C. B.V. B.C. B.V. Conductor Semiconductor σ↓ al ↑ T σ ↑ al ↑ T B.V. Aislante Elemento Separación entre bandas (eV) Tipo de material Diamante 6.0 Aislante Silicio 1.1 Semiconductor Germanio 0.7 Semiconductor Estaño gris 0.1 Semiconductor Estaño blanco 0 Metal Plomo 0 Metal intrínsecos Semiconductor de tipo n Semiconductor de tipo p Propiedades de los compuestos metálicos • Son dúctiles y maleables debido a que no existen enlaces con una dirección determinada. Si se distorsiona la estructura los e– vuelven a estabilizarla interponiéndose entre los cationes. presión Propiedades de los compuestos metálicos Buenos conductores debido a la deslocalización de los e–. Si se aplica el modelo de bandas, puede suponerse que la banda vacía está muy próxima a la banda en donde se encuentran los e– de forma que con una mínima Eª éstos saltan y se encuentran con una banda de conducción libre. Bandas s y p, que pueden solapar o no Niveles ocupados y nivel de Fermi a 0 K Conductividad eléctrica Propiedades de los compuestos metálicos • Conducen el calor debido a la compacidad de los átomos que hace que las vibraciones en unos se transmitan con facilidad a los de al lado. • Tienen, en general, altos P. F. y P. E. Dependiendo de la estructura de la red. La mayoría son sólidos. • Tienen un brillo característico debido a la gran cantidad de niveles muy próximos de energía que hace que prácticamente absorban energía de cualquier “λ” que inmediatamente emiten (reflejo y brillo). • Puntos de fusión y fortaleza del enlace. General: cuantos más e- móviles y mayor carga + mayor fuerza de enlace (mayor punto de fusión) G1< G.2 < G. 13 En el mismo grupo al bajar: aumenta r y la distancia entre cargas + y -, los e- están menos atraídos y disminuye F de enlace y PF 1 18 2 13 14 15 16 17 Li Be Na Mg 5 V 8 9 10 11 12 7 6 Cr Mn Fe Co Ni Cu Zn K Ca 3 Sc 4 Ti Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd Cs Ba La Hf Ta W Re Os Ir Fr Ra Ac Rh Db Sg Bh Hs Mt Lantánidos Actínidos Pt Au Hg Ga Ge In Sn Sb Tl Pb Bi Po Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr ↑I, χ, ρ, p.fusión ↓ Radio atómico, volumen e-val. Al hasta Ni K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga 1 2 3 4 5 6 6 6 6 6 5 4 3 P I tetragonal P romboédrico (trigonal) P hexagonal P cúbico I F Sistema cristalino Redes de Bravais P triclínico P C P C monoclínico ortorómbico I F Estructura Cúbica simple (CS) a (r) a = 2r Número de coordinación Factor de empaquetamiento 6 0,52 --- Ejemplos Cúbica centrada en el cuerpo (CCI) a = 4r/√3 8 0,68 Fe, Ti, W, Mo, Nb, Ta, K, Na, V, Cr, Zr Cúbica centrada en las caras (CCC) a = 4r/√2 12 0,74 Cu, Al, Au, Ag, Pb, Ni, Pt 12 0,74 Ti, Mg, Zn, Be, Co, Zr, Cd Hexagonal a = 2r compacta (HC) c/a = 1,633 a