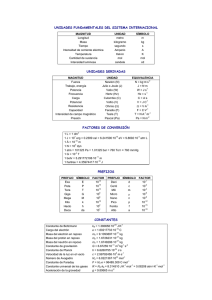
controles química - U
Anuncio

CM 1A1- QUIMICA Control-1 (2008-1) Nombre: …………………………………………………………………………… 1) ¿Cuál es la longitud de onda [en nm] de la línea espectral asociada con la transición desde n = 3 a n = 2 para el ión Li2+ ? a) 219 b) 73.0 c) 486 d) 4.0 e) 656 2) ¿Cuál es la frecuencia [seg-1]de la línea espectral que corresponde a la transición de un electrón desde n = 6 a n = 2 en el ión He+ ? a) 5.20 x 1013 b) 2.93 x 1015 c) 6.17 x 1014 d) 2.47 x 1015 e) 8.23 x 1015 3) ¿Cuál de las siguientes aseveraciones es correcta para un electrón que tiene los números cuánticos n = 4 y m l = -2? a) el electrón se encuentra en la segunda capa principal b) el electrón podría estar en un orbital p c) el electrón podría estar en un orbital d d) el electrón debe tener un número cuántico de spin m s = + ½ e) ninguna de las anteriores aplica a este electrón 4) Diga cuáles son las designaciones orbitales correctas para electrones con los siguientes números cuánticos: n l ml ms i) 3 2 0 -1/2 2i) 5 3 -1 -1/2 3i) 4 1 +1 -1/2 a) 3d,5f,4p b) 3p,5d,3s c) 2d,5d,4p d)2d,5f,4p e) 3p,5f,4s 5) ¿Cuál de los siguientes conjuntos de números cuánticos no pueden ser posible para un átomo de hidrógeno excitado? a) n = 4, l = 1, m l = -2, m s = +1/2 b) n = 27, l = 14, m l = -8, m s = -1/2 c) n = 2, l = 1, m l = -1, m s = +1/2 d) n = 3, l = 2, m l = 0, m s = -1/2 e) n = 100, l = 99, ml = -1, m s = +1/2 6) ¿Cuál de los siguientes conjuntos de números cuánticos describe el electrón más fácilmente removible en un átomo de Aluminio (Z = 13) en su estado base? a) n = 3, l = 1, m l = -1, m s = -1/2 b) n = 3, l = 0, m l = 0, m s = +1/2 c) n = 1, l = 0, m l = 0, m s = -1/2 d) n = 4, l = 1, m l = 1, m s = +1/2 e) n = 2, l = 1, m l = 0, m s = -1/2 7) Para la reacción (No balanceada) que se muestra a continuación, si la reacción de 85.7 gramos de HCl producen a 80.5% de rendimiento, el número de gramos de H 3 PO 4 que se producirían será: HCl + Na 3 PO 4 H 3 PO 4 + NaCl a) 15.35 b) 32.8 c) 77.2 d) 61.7 e) 83.5 8) Un electrón se mueve en la tercera órbita del átomo hidrogenoide Li+2. Si se puede conocer su momento con una precisión de un 1%, entonces la incertidumbre en la posición es: a) 2 .4 [Ǻ] b) 5.3 [Ǻ] c) 8.1 [Ǻ] d) 15.2 [Ǻ] e) 26.3[Ǻ] 9) Un electrón se mueve en la segunda órbita del átomo hidrógeno. Entonces la longitud de la onda asociada en Angstroms es: a) 6.6 [Ǻ] b) 5.4 [Ǻ] c) 1.5 [Ǻ] d) 8.9 [Ǻ] e) 11.3 [Ǻ] 10) Una sustancia compuesta de hidrógeno y carbono, contiene 85.7% C y 14.3% H y tiene una masa molar de 84 gr/mol. La fórmula molecular de este compuesto es: a) CH 2 b) C 2 H 4 c) CH 3 d) C 3 H 6 e) C 6 H 12 11) Calcule el porcentaje de rendimiento de hierro si 950 grs de Fe 3 O 4 reaccionan de acuerdo a la ecuación química que se muestra más abajo (no balanceada) y fue posible aislar 533 grs de Fe de la mezcla reaccionante. Fe 3 O 4 (s) + C(s) → CO 2 (g) + Fe(s) a) 25.9% b) 77.5% c) 56.1% d) 48.2% e) Ninguna de las anteriores. 12) Un compuesto con una composición de 87.5% en masa de N y 12.5% de H fue recientemente descubierto. La fórmula empírica de este compuesto es: b) N 2 H 3 c) NH d) N 2 H 2 e) N 2 H a) NH 2 13) El amoníaco, NH 3 , se produce industrialmente mediante la reacción de nitrógeno e hidrógeno. N 2 (g) + H 2 (g) → NH 3 (g) Determine la mayor cantidad de masa de NH 3 que se puede producer a partir de la reacción de 105 grs. de N 2 y 15.0 grs. de H 2 . a) 28.4 g b) 42.2 g c) 63.8 g d) 85.0 g e) 128 g 14) El principio de Incertidumbre de Heisenberg establece que: a) No es posible conocer ya sea el momento o la posición de un electrón con precisión b) No es posible conocer el momento de un electrón sin saber la posición c) Es posible conocer el momento o la posición de un electrón, pero no ambos simultáneamente d) Es posible conocer ambas variables, pero en experimentos separados e) Ninguno de los anteriores 15) La configuración electrónica de Ni2+ es: a) 1s22s22p63s23p64s23d8 b) 1s22s22p63s24s23d6 2 2 6 2 6 0 4 d) 1s 2s 2p 3s 3p 4s 3d e) 1s22s22p63s23p64s03d8 c) 1s22s22p63s23p54s03d9 16) ¿Cuál de las especies a continuación no es isoelectrónica con el resto? a) Ob) Fc) Mg2+ d) Na+ e) N317) Al quemar una muestra de un hidrocarburo CxHy según la reacción: CxHy + O 2 → CO 2 + H 2 O se obtuvieron 0.396 g of CO 2 and 0.163 g of H 2 O ¿Cuál de las siguientes fórmulas moleculares es consistente con el análisis? a) CH 4 b) C 2 H 6 c) C 2 H 2 d) C 2 H 4 e) C 3 H 8 18) Dados 8 moles de cada reactante, ¿cuál sería el reactivo limitante en la siguiente reacción? 4Au + 8NaCN + O 2 + 2H 2 O → 4NaAu(CN) 2 + 4NaOH a) Au b) NaCN c) O 2 d) H 2 O e) No hay reactivo limitante. 19) Según el modelo de Bohr para el átomo de hidrógeno, el radio de la órbita: a) es proporcional a n2. b) es menor a mayor estados energéticos. c) aumenta cuando un fotón de luz es emitido desde un átomo excitado. d) puede tener cualquier valor mayor que el radio del estado base. e) ninguno de los anteriores 20) De acuerdo a la teoría de Bohr, ¿cuál de las siguientes transiciones en el átomo de hidrógeno producirá el fotón menos energético? Use la ecuación: E n = (-2.18 x 10-18 J)(1/n2) a) n = 5 to n = 3 b) n = 6 to n = 1 c) n = 4 to n = 3 d) n = 5 to n = 4 e) n = 6 to n = 5 21) ¿Cuál de los siguientes enunciados acerca del modelo de Bohr del átomo de hidrógeno es correcto? a) El radio de una órbita es proporcional al número cuántico n. b) Un fotón se emite cuando el electrón se mueve desde el estado base a uno excitado. c) Una órbita es una región tridimensional del espacio en la cual es probable encontrar el electrón. d) Mientras más pequeña es la órbita, mayor es la energía del electrón. e) Ninguno de ellos es correcto. 22) La energía de un electrón en la primera órbita de Bohr (estado base) del átomo de hidrógeno es -13.6 eV. ¿Cuál de los siguientes estados es un posible estado excitado para el electrón? Recuerde la ecuación E n = -constante x (1/n2) a) -3.4 eV b) -6.8 eV c) –1.7 eV d) +13.6 eV e) -54.4 eV 23) De acuerdo al tratamiento mecánico cuántico del átomo de hidrógeno, ¿cuál conjunto de números cuánticos no está permitido? b) n = 3, l = 0, m l = 0 c) n = 3, l = 1, m l = 1 a) n = 3, l = 2, m l = 0 d) n = 3, l = 1, m l = -1 e) n = 3, l = 1, m l = 2 24) Para un átomo de hidrógeno excitado cuyo número cuántico n es igual a 9, ¿cuál de las siguientes aseveraciones e cierta? a) La energía del átomo es menor que la energía para el estado en el cual n es igual a 8. b) Si l = 0, hay nueve valores posibles para el número cuántico magnético m l . c) El menor valor del número cuántico magnético m l es -9. d) El electron debe encontrarse en uno de los orbitales d. e) El número cuántico de momento angular l puede tener valores 0, 1, 2, 3, 4, 5, 6, 7, 8. 25) Considere este conjunto de números cuánticos: n = 3, l = 2, m l = -1, m s = +½ . El número máximo de electrones que en un átomo pueden compartir este conjunto de números cuánticos es a) 1 b) 14 c) 3 d) 10 e) ninguno de los anteriores 26) ¿Cuál de las siguientes especies no es isoelectrónica con el resto? b) Ca2+ c) Ar d) Cle) S2a) V3+ 27) Los lentes de ciertas gafas para sol tienen incorporados pequeños cristales de cloruro de plata (AgCl). A1 exponerse a la luz de longitud de onda adecuada, sucede la siguiente reacción: AgCl → Ag + Cl Los átomos de Ag formados producen un color gris uniforme que atenúa los reflejos. Si la energía usada en la reacción de 1 mol de AgCl es 248 [kJ], la máxima longitud de onda de la luz que puede inducir este proceso es: a) 8250 Ǻ b) 5324 Ǻ c) 6248 Ǻ d) 4330 Ǻ e) 4825 Ǻ 28) El electrón de un átomo de H puede regresar desde un estado excitado al estado fundamental de dos maneras: a) por transición directa con emisión de un fotón de longitud de onda λ 1 y b) pasando por un estado excitado intermedio que se alcanza con la emisión de un fotón de longitud de onda λ 2 . Este intermediario decae posteriormente al estado fundamental emitiendo otro fotón de longitud de onda λ 3 . Entonces, la ecuación que relaciona λ 1 λ 2 y λ 3 es: 1 1 1 1 1 1 a) 1 2 3 b) 21 22 23 c) d) 1 2 3 e) 2 2 2 1 2 3 1 2 3 29) A continuación se muestra parte de los diagramas de orbital que representan las configuraciones electrónicas de ciertos elementos en su estado fundamental. ¿Cuál(es) de estos diagramas viola(n) el principio de exclusión de Pauli y la regla de Hund simultáneamente? i) iv) a) sólo i b) i y ii c) iv y v ii) iii) v) d) i y vi vi) e) ninguno 30) El sulfato de aluminio hidratado [Al 2 (SO 4 ) 3 . xH 2 O] contiene 8.20% en masa de Al, entonces x, es decir, el número de moléculas de agua asociadas con cada unidad de Al 2 (SO 4 ) 3 es: a) 5 b) 10 c) 8 d) 12 e) 3 ELIMINADA 31) Los números de electrones no apareados en el estado fundamental que existen en cada uno de los siguientes átomos: 4Be, 15P, 32Ge, 26Fe, son: a) 0 2 3 4 b) 0 0 0 2 c) 0 1 2 2 d) 0 3 2 4 e) 1 3 2 4 32) Cuando un electrón efectúa una transición entre los niveles de energía de un átomo de hidrógeno, no hay restricciones en los valores inicial y final del número cuántico principal n. No obstante, hay una regla en mecánica cuántica que restringe los valores inicial y final del momento angular l del orbital. Esto se denomina regla de selección que afirma que Δl =0, 1, es decir, en una transición el valor de l sólo puede no cambiar o aumentar o disminuir en una unidad. De acuerdo con esta regla, ¿serían permitidas las transiciones? I) ls2s, II) 2p ls, III) 1s 3d, IV) 3d 4f, V) 4d 3s a) Sólo I b) I y II c) II y III d) I, II y V e) I, II y IV 33) Una barra de hierro pesó 664 g. Después de que la barra se deja a la intemperie durante un mes, exactamente una octava parte del hierro se ha convertido en herrumbre (Fe 2 O 3 ). Entonces las masas finales del hierro y de la herrumbre son: a) 601 y 432 b) 540 y 315 c) 581 y 118.7 d) 581 y 342 e) 540 y 255 34) La potasa es cualquier mineral de potasio que se utiliza por su contenido de potasio. La mayoría de la potasa que se produce en Estados Unidos se utiliza en fertilizantes. Las principales fuentes de potasa son el cloruro de potasio (KCl) y el sulfato de potasio (K 2 SO 4 ). Si el costo de KCl es 0.055 dólares por kg, ¿a qué precio (dólares por kg) debe venderse el K 2 SO 4 para obtener la misma cantidad de potasio por dólar? a) 0.055 b) 0.047 c) 0.005 d)0.0235 e) 0.0325 35) Cuando se calientan 0.259 g de Mg a altas temperaturas, bajo una atmósfera de nitrógeno (N 2 ), ocurre una reacción química. El producto de la reacción pesa 0.364 g. La fórmula empírica del compuesto formado que contiene solo Mg y N es: a) MgN 2 b) Mg 3 N 2 c) Mg 2 N 3 d) MgN e) Ninguno de los anteriores 36) La retina del ojo humano es capaz de detectar luz cuando la energía radiante incidente es de por lo menos 4.0 x 10-17 J. ¿Cuántos fotones de una luz de 600 nm de longitud de onda equivalen a esta energía? a) 60 b) 120 c) 150 d) 240 e) 100 Datos: N 0 = 6.02 x 1023 [partículas/mol], h = 6.63 x 10-27 [erg. seg], c = 3.0 x 1010 [cm/seg] R H = 2.18 x 10-18 [J] = 109677 [cm-1] = 13.6 [eV] = 313.6 [kcal/mol, = 3.1416 m e = 9.1 x 10-28 [grs], m p = 1.67n x 10-24 [grs], carga electrón = 1.6 x 10-19 [C] Atomo H He Li C N O Na Ar S Cl K Ca Z 1 2 3 6 7 8 11 18 16 17 19 20 P.Atom. 1.0 4.0 6.9 12.0 14.0 16.0 24.3 39.9 32.0 35.5 39.1 40.1 Atomo P Mg Ni Au V Al Fe F Z 15 12 28 79 23 13 26 9 P.Atom. 31.0 24.3 58.7 197.0 50.9 27.0 55.8 19.0 CM 1A1- QUIMICA Control-1 (2008-1) USE SOLO LAPIZ PASTA Nombre: ........................................................................................ a 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 b X X c d e X X X X X X X X X X X X X X X X 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 A X b c d e X X X X X X X X X X X X X X X X NOTA: CADA PREGUNTA CORRECTA VALE 1/6 PUNTO CADA PREGUNTA INCORRECTA DESCUENTA 1/18 PUNTO CM 1A1- QUIMICA Control-2 (2008/1) NOMBRE………………………………………………. 1) En la siguiente reacción de oxidación, la geometría del reactante es ______ y la geometría del producto es ______: ICl 2 - ICl 2 + + 2 e- a) angular, angular b) lineal, lineal de T e) lineal, angular c) angular, lineal d) cuadrada plana, forma 2) Si la diferencia en electronegatividades entre los elementos A y X es 0.8, entonces el enlace en AX será probablemente: a) iónico insuficiente b) covalente c) covalente polar d) covalente apolar e) la información es 3) ¿Cuál de las siguientes es la estructura de Lewis correcta para HClO 3 ? (Faltan cargas formales!) a) b) c) d) e) 4) ¿Cuál/es de las siguientes especies no cumple/n con la regla del octeto de Lewis? II) CH 4 I) SO 3 a) solo II III) CO b) solo V IV) CO 2 c) I y V V) BH 3 d) I y III e) solo IV 5) Basado en las estructuras de Lewis de SO 2 y SO 3 , se puede concluir que: a) SO 2 tiene enlaces S-O más largos que SO 3 c) SO 3 tiene enlaces S-O más largos que SO 2 e) información insuficiente b) ambos tienen enlaces iguales d) la distancia S-O es menor para SO 3 6)¿Cuál(es) de los siguientes tiene(n) ángulos de enlace de aproximadamente 109.5o? 1) ClF 3 a) 2 y 3 2) BF 3 b) 1 y 4 3) ClO 4 c) sólo 4 4) SF 4 5) GeCl 4 d) 3 y 5 e) sólo 5 7) ¿Cuál de los siguientes átomos queda en el medio cuando los cinco elementos listados se ordenan en orden creciente de su primera energía de ionización? a) Br(35) b) Ge(32) c) As(33) d) Sn(50) e) Rb(37) 8) ¿Cuál de los siguientes queda en el medio cuando estos cinco elementos listados se arreglan en orden creciente de electronegatividad? a) Se(34) b) F(9) c) Te(52) d) Cl(17) e) Bi(83) 9) La adición de un electrón al O 2 y al C 2 causará que el orden de enlace en las moléculas: a) disminuya para ambos. b) permanezca igual para ambos. c) aumente para el O 2 , disminuya para el C 2 . d) disminuya para el O 2 , aumente para el C 2 . e) aumente para ambos. 10) ¿Qué propiedad se resume en el siguiente proceso? O-(g) + e- O2-(g) a) Primera afinidad electrónica del oxígeno. c) Primera energía de ionización del oxígeno. e) Ninguna de las anteriores. b) Segunda afinidad electrónica del oxígeno. d) Segunda energía de ionización del oxígeno. 11) La estructura de Lewis del aminoácido glicina se muestra a continuación. Dar la hibridación y el ángulo que forman los enlaces alrededor de los átomos indicados a) N 1 : sp3 , 90°; C 2 : sp2 , 90°; O 3 : sp3 , 180° b) N 1 : sp3 , 109.5°; C 2 : sp2 , 120°; O 3 : sp3 , 109.5° c) N 1 : sp3 , 109.5°; C 2 : sp3 , 109.5°; O 3 : sp3 , 109.5° d) N 1 : sp2 , 90°; C 2 : sp3, 90°; O 3 : sp, 180° e) N 1 : sp2 , 120°; C 2 : sp2 , 120°; O 3 : sp, 180° 12) En la tabla periódica, los elementos que tienen el mayor carácter metálico se encuentran: a) En la parte superior del grupo IIIA c) En la parte superior del grupo VIIA e) En la parte inferior del grupo VIIA b) En la parte superior del grupo IA d) En la parte inferior del grupo IA 13) ¿Cuáles de los iones enumerados abajo tiene el radio más pequeño? a) Li+ b) Na+ c) K+ d) Be2+ e) Mg2+ 14) Las energías sucesivas de ionización, 1ra, 2da, 3ra, etc., proporcionan evidencia de la estructura de niveles de energía del átomo. ¿Para el azufre, cuál energía de ionización muestra un aumento excepcionalmente grande sobre la energía de ionización precedente? a) 7da b) 3ra c) 4ta d) 5ta e) 6ta 15) ¿Cuál/es de las estructuras de Lewis es/son incorrecta/s? a) b) c) d) e) c y d. 16) El ión sulfato, SO 4 2-, es tetraédrico con cuatro distancias S-O iguales de 149 P.M. ¿No haciendo caso de la resonancia, cuál de las siguientes es la estructura más razonable consistente con estos hechos? a) b) c) d) c y b e) Ninguna de las anteriores. 17) ¿En cuál sustancia mostrada abajo el átomo central tiene la carga formal más baja? Asuma que la estructura de Lewis para cada especie obedece la regla del octeto y no haga caso de la resonancia. e) BCl 4 a) NO 3 b) CO 3 2c) SO 3 d) ClO 3 18) Los ángulos de enlace en el ion H 3 O+ son aproximadamente: a) 120o b) 90o y 120o c) 109o d) 90o e) 180o 19) ¿Cuáles de las moléculas siguientes no es plana? a) BCl 3 b) ClF 3 c) PCl 3 d) XeF 4 e) Todos los compuestos mostrados son planos 20) ¿Cuáles de las moléculas siguientes tienen un momento dipolar no nulo y un átomo central con hibridación sp3? a) CCl 4 b) BF 3 c) CHCl 3 d) BrF 3 e) C 2 H 4 21) El par de electrones solitario en el átomo de azufre en SO 2 está en: a) un orbital p b) un orbital s c) un híbrido orbital sp3 2 e) Ninguno de los anteriores. d) un orbital híbrido sp 22) ¿Cuál especie tiene dos pares de electrones no enlazantes en el átomo central? a) BCl 3 b) PCl 3 c) XeF 4 d) SF 4 e) SF 6 23) Asumiendo que una molécula de N 2 absorbe un fotón y alcanza su primer estado excitado. a) El N 2 excitado es menos estable que el N 2 en el estado fundamental. b) El N 2 excitado es más estable que el N 2 en el estado fundamental. c) La longitud de enlace del N 2 en el estado excitado es más corta que la longitud de enlace del N 2 en el estado fundamental. d) b y c son ambos verdades. e) La molécula de N 2 excitada se romperá en dos átomos de nitrógeno. 24) ¿Cuál de las siguientes afirmaciones sobre propiedades periódicas es incorrecta? a) La afinidad electrónica y la primera energía de ionización disminuyen hacia abajo en un grupo b) El tamaño atómico aumenta a la derecha a través de un período c) La primera energía de ionización aumenta a la derecha a través de un período d) El tamaño atómico aumenta hacia abajo en un grupo. e) La afinidad electrónica aumenta a la derecha a través de un período. 25) La electronegatividad es una medida de: a) La energía necesaria para quitar un electrón de un átomo gaseoso neutro. b) La energía desprendida cuando se agrega un electrón a un átomo gaseoso neutro. c) La magnitud de la carga negativa en un electrón. d) La atracción que ejerce un átomo hacia los electrones compartidos en un enlace químico. e) La magnitud de la carga negativa en una molécula. 26) De acuerdo con la teoría de repulsión de pares de electrones de valencia, los ángulos de enlace ideales alrededor de los dos átomos de carbono en el acetaldehído, CH 3 CHO son: (El primer carbono tiene solo enlaces a tres átomos de H y a un átomo de C; el segundo carbono tiene solo enlaces a C y a H, y un enlace doble al O.) a) 109°, 109° b) 109°, 120° c) 120°, 109° d) 120°, 90° e) 105°, 105° 27) ¿Cuál de las siguientes especies tiene el momento dipolar más grande? a) CS 2 b) AsCl 3 c) SO 3 d) BF 3 e) NH 4 + 28) ¿Cuál de los siguientes tiene los ángulos de enlace H-X-H más pequeños? a) H 2 O b) NH 3 c) CH 4 d) H 3 O+ e) NH 4 + 29) ¿Qué tipo de orbital describe el par de electrones solitario en el nitrógeno en la especie H 2 CNH? a) 2s b) 2p x c) sp d) sp2 e) sp3 30) Según el modelo de orbitales moleculares, el orbital molecular de mayor energía ocupado en la molécula de O 2 es: a) 2s b) 2p c) * 2s d) * 2p e) * 2p 31) ¿Cuál es el orden correcto para la longitud de enlace oxígeno-oxígeno en las siguientes especies? a) HOOH>O 2 ->O 2 +>O 2 d) HOOH<O 2 -<O 2 +<O 2 b) HOOH>O 2 ->O 2 >O 2 + e) HOOH>O 2 ->O 2 +>O 2 c) HOOH<O 2 +<O 2 -<O 2 32) Para las siguientes especies, la estructura de Lewis es correcta para: b) a) c) d) e) 33) De las siguientes sustancias es/son compuestos covalentes que contienen moléculas individuales: KF, CO, SiCl 4 , BaCl 2 . a) Sólo CO b) KF y CO c) SiCl 4 y BaCl 2 d) CO y SiCl 4 e) Sólo BaCl 2 34) Al ocurrir la siguiente reacción: I C l 3 + Cl - ICl 4 El yodo, I, cambia su hibridación de: a) sp3 a sp3d b) sp3d a sp3d2 c) sp2 a sp3 d) sp2 a sp3d e) no cambia de hibridación 35) ¿Cuál(es) de los siguientes iones es(son) diamagnético(s)? N 2 +, O 2 2-, Be 2 2+, O 2 a) O 2 2-, Be 2 2+, O 2 d) N 2 +, Be 2 2+ b) N 2 +, O 2 2-, Be 2 2+, O 2 e) N 2 +, O 2 - c) O 2 2-, Be 2 2+ 36) Qué diagrama abajo representa un orbital antienlazante pi, *. a) b) c) d) e) CM 1A1- QUIMICA Control-1 (2008-1) Nombre: ........................................................................................ a 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 b USE SOLO LAPIZ PASTA A b c d e 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 c d e NOTA: CADA PREGUNTA CORRECTA VALE 1/6 PUNTO CADA PREGUNTA INCORRECTA DESCUENTA 1/18 PUNTO CM 1A1- QUIMICA Control-3 (2008/1) NOMBRE………………………………………………. 1.Los átomos de argón no se combinan para formar especies tal como Ar2, a pesar de ello los átomos de argón se atraen uno a otro débilmente a través de: A) fuerzas de dipolo-dipolo C) fuerzas ion-dipolo E) puentes de hidrógeno 2.- B) fuerzas dipolo- dipolo inducido D) fuerzas de dispersión ¿Cuál de los líquidos siguientes tendría la viscosidad más alta a 25 ºC? A) HOCH2CH2OH D) CH3COOCH3 B) CH3CH2OH C) CH3CH2Cl E) CH3CH2OCH2CH3 3.El tetróxido de osmio, OsO4 es un cristal molecular. Cuál de las siguientes características generales esperaría usted que NO poseyera: A) Sólido mal conductor de la electricidad B) sólido más bien blando C) punto de fusión alrededor de 40 oC D) punto de fusión alrededor de 1600 oC E) Mal conductor de la electricidad fundido 4.Cuánta energía (calor) se requiere para convertir 248 g de agua de 0 oC a 154 oC? Suponga que el agua comienza como líquido, que el calor específico del agua es 4.184 J/g.oC en el líquido, que es el calor específico del vapor es 1.99 J/g.oC, y el calor de vaporización del agua es 40.79 kJ/mol. A) 562 kJ B) 130 kJ C) 692 kJ D) 589 kJ E) 639 kJ 5.- Cuál de las siguientes sustancias debe tener el calor de vaporización más alto? A) H2O B) H2S C) C6H6 D) CH3OH E) CH3OCH3 6.Entre 20 y 80oC, la entalpia de vaporización del benceno es 31.0 kJ/mol. A 26 oC, la presión de vapor del benceno es 100 torr. Calcular la presión de vapor del benceno a 45 oC. R = 8.314 J/K·mol. A) 18.1 torr B) 633 torr C) 47.6 torr D) 211 torr E) Ninguna de ellas 7.¿Cuáles de las siguientes sustancias pueden formar enlaces de hidrógeno con el agua? (1) CH3COCH3; (2) CH3OH; (3) C2H6; (4) HCOOH A) compuestos 1 y 2 D) compuestos 2 y 4 B) compuestos 1 y 3 E) compuestos 1, 2, y 4 C) compuestos 1, 2, y 3 8.¿En cuál de las siguientes sustancias las fuerzas de la dispersión son probablemente la interacción intermolecular más importante en la determinación de los puntos de fusión y de ebullición? A) Br2 B) H2S C) CO D) HCl E) ICl 9.El criptón cristaliza en una estructura que tiene cuatro átomos de Kr en cada celda unidad, y la celda unidad es un cubo. La longitud de la arista de la celda unidad es 0.559 nm. La densidad del Kr cristalino, en kg/m3 es: A) 9.97 x 10-13 kg/m3 D) 6.29 x 103 kg/m3 10.- B) 3.17 x 103 kg/m3 E) 6.29 x 103 g/cm3 C) 3.17 kg/m3 A temperatura ambiente, el SiO2 es un sólido, mientras que CO2 es un gas. Esto es porque: A) ambos son moleculares, pero las fuerzas de dispersión entre las moléculas de SiO2 son más fuertes porque el SiO2 es el más grande de los dos compuestos B) ambos son moleculares, pero CO2 es linear mientras que el SiO2 está doblado, y por lo tanto tiene atracciones dipolo-dipolo. C) CO2 es molecular, mientras que SiO2 es un sólido covalente. D) CO2 es molecular mientras que el SiO2 es iónico. E) Ninguna de las anteriores 11.Una muestra de 60.0 g de una aleación fue calentada a 96.00oC y entonces fue puesta en un recipiente que contiene 87.0 g de agua a una temperatura de 24.10oC. La temperatura del agua subió a una temperatura final de 27.63oC. El calor específico del agua es 4.184 J/g·oC. El calor específico de la aleación es: A) 0.313 J/g·oC B) 2.16 J/g·oC C) 0.118 J/g·oC o D) 1.72 J/g· C E) Ninguno de los anteriores. 12.A cuál de las siguientes reacciones, que ocurren a 25oC, se refiere el símbolo o ΔH f [H2SO4(l)]? A) H2(g) + S(s) + 2 O2(g) ----> H2SO4(l) C) H2(g) + S(g) + 2 O2(g) ----> H2SO4(l) E) 2 H(g) + S(g) + 4 O(g) ----> H2SO4(l) B) H2SO4(l) ----> H2(g) + S(s) + 2 O2(g) D) H2SO4(l) ----> 2 H(g) + S(s) + 4 O(g) 13.Encuentre la entalpía estándar de formación del etileno, C2H4(g), dado los datos siguientes: C2H4(g) + 3 O2(g) ----> 2 CO2(g) + 2 H2O(l) ΔHof = -1411 kJ; C(s) + O2(g) ----> CO2(g) ΔHof = -393.5 kJ; H2(g) + ½O2(g) ----> H2O(l) ΔHof = -285.8 kJ A) 731 kJ B) 2.77 x 103 kJ C) 1.41 x 103 kJ D) 87.3 kJ 14.Un proceso endotérmico A) aumenta la temperatura de un gramo de una sustancia en un grado Celcius B) absorbe calor de los alrededores. C) aumenta la acidez de los alrededores. D) emite calor a los alrededores. E) desprende dióxido de carbono a los alrededores. E) 52.4 kJ 15.- En cuál de los siguientes procesos ΔH = ΔE? A) 2HI(g) → H2(g) + I2(g) a presión atmosférica. B) Dos moles de gas amoníaco se enfrían de 325 °C a 300 °C a 1.2 atm C) H2O(l) → H2O(g) a 100 °C a presión atmosférica. D) CaCO3(s) → CaO(s) + CO2(g) at 800 °C a presión atmosférica. E) CO2(s) → CO2(g) a presión atmosférica. 16.- Datos: (1) H2(g) + ½O2(g) → H2O(g) ΔH = -241.8 kJ (2) H2(g) + ½O2(g) → H2O(l) ΔH = -285.8 kJ En base a los datos anteriores, cuál de las siguientes afirmaciones es falsa? A) La reacción (1) es exotérmica. B) La reacción (2) es la reacción de formación de H2O(l). C) El inverso de la reacción (2) es endotérmico. D) El contenido en energía de H2O(g) es menor que H2O(l). E) ΔH para la reacción: H2O(l) → H2O(g) es + 44 kJ/mol 17.La reacción de cianamida, NH2CN(s), con oxígeno fue realizada en una bomba calorimétrica, y se encontró que ΔE vale -742.7 kJ/mol de NH2CN(s) a 298 K. Entonces ΔH para la reacción a esta temperatura es: NH2CN(s) + 3/2O2(g) → N2(g) + CO2(g) + H2O(l) A) -727.8 kJ/mol anteriores. B) -737.7 kJ C) -741.5 kJ D) -742.7 kJ E) Ninguno de los 18.Cuál de las siguientes especies no tiene ΔH°formación cero bajo condiciones de estado estándar? A) H2(g) B) Li(s)C) C (grafito) D) Br2(l) E) O3(g) 19.El punto triple es: A) el final de la línea de equilibrio líquido-gas en un diagrama de fase. B) la relación entre el punto de ebullición, el punto de fusión y la presión de vapor de una sustancia. C) el punto en un diagrama de fase donde están en equilibrio el sólido, el líquido, y el gas. D) los tres datos necesarios para resolver la ecuación de Clausius-Clapeyron. E) La coordenada (P, V, T) de un punto en un diagrama de fase. 20.El metal bario cristaliza en una red cúbica centrada en el cuerpo. La longitud de la arista de la celda unidad es 502 pm. Calcular el radio atómico del Bario. A) 251 pm B) 217 pm C) 177 pm D) 125 pm E) 63 pm 21.¿Cuál de las siguientes propiedades indica que las fuerzas intermoleculares de un líquido son fuertes? A) tensión superficial muy baja, B) temperatura crítica muy baja, C) punto de ebullición muy bajo D) presión de vapor muy baja. E) ninguno de los anteriores. 22.De acuerdo a las propiedades del elemento boro: punto de fusión alto (2300°C), mal conductor del calor y electricidad, insoluble en agua, una sustancia muy dura., el sólido se puede clasificar como: A) covalente 23.- B) iónico C) molecular D) metálico E) ninguno de los anteriores. ¿Cuáles de los siguientes enunciados es/son falsos? 1) Las interacciones dipolo-dipolo entre las moléculas son mayores si éstas sólo poseen momentos dipolares temporales. 2) Todos los compuestos que contienen átomos de hidrógeno pueden participar en la formación de enlaces de hidrógeno. 3) Las fuerzas de dispersión existen en todos los átomos, moléculas e iones. 4) La magnitud de la interacción ión-dipolo inducido sólo depende de la carga del ión. A) 1 y 4 B) 1, 2 y 3 C) 3 y 4 D) 2 y 3 E) 1, 2 y 4 24.La entalpía estándar de formación del yodo molecular gaseoso es 62.4 kJ/mol. Con este dato se calcula que el calor molar de sublimación del yodo molecular a 25°C es: A) 124,8 kJ/mol. B) 62.4 kJ/mol. E) Insuficiente información. C) 76,4 kJ/mol. D) 31,2 kJ/mol. 25.- Dado las ecuaciones siguientes y los valores de ΔHo, determine el calor de reacción (kJ) a 298 K para la reacción que ocurre en un alto horno: Fe2O3(s) + 3 CO(g) →2 Fe(s) + 3 CO2(g) ΔHo/kJ = -46.4 3 Fe2O3(s) + CO(g) →2 Fe3O4(s) + CO2(g) FeO(s) + CO(g) →Fe(s) + CO2(g) ΔHo/kJ = +9.0 o Fe3O4(s) + CO(g) →3 FeO(s) + CO2(g) ΔH /kJ = -41.0 A) +24.8 B) -78.4 C) +78.4 D) +29.9 E) -24.5 26.- Con la siguiente información calcule el calor de formación de Fe2O3. Fe2O3(s) + 3 H2(g) →2 Fe(s) + 3 H2O(l) ΔHo = -35.5 kJ ΔHof H2O(l) = -285.9 kJ/mol A) -822.2 kJ/mol E) -250.4 kJ/mol B) -393.4 kJ/mol C) -464.4 kJ/mol D) -893.2 kJ/mol 27.- El difluoro de oxígeno reacciona con agua según la ecuación dada. Con los entalpías de formación, calcule la energía (kJ) liberada cuando reaccionan 5.00 g de OF2. (Pesos atómicos: O = 16.00, F = 19.00, H = 1.008 g/mol). OF2(g) + H2O(g) ΔHo H2O(g) = -241.8 kJ/mol A) 51.8 B) 29.4 → O2(g) + 2 HF(g) ΔHo HF(g) = -271.1 kJ/mol ΔHo OF2(g) = +17.6 kJ/mol C) 12.6 D) 75.6 E) 62.5 28.- La entalpia de combustión de la lactosa, C12H22O11, es -5652 kJ/mol. Una muestra de 2.50 g de lactosa fue quemada en un calorímetro que contenía 1350 g de agua. La capacidad calórica del calorímetro es 1630 J/oC, y la temperatura inicial era 24.58oC. Cuál será la temperatura final (oC)? (Pesos atómicos: C = 12.01, O = 16.00, H = 1.008 g/mol). A) 29.42 B) 31.78 C) 28.98 D) 26.82 E) 30.25 29.Una hoja de oro que pesa 10.0 g y se encuentra a una temperatura de 18.0°C se coloca sobre una hoja de hierro que pesa 20.0 g y que está a una temperatura de 55.6°C. ¿Cuál es la temperatura final de la combinación de los dos metales? Suponga que no hay pérdida de calor hacia los alrededores. A) 28,0 °C B) 27,9 °C C) 36,8 °C D) 43,07°C E) Insuficiente información. 30.Una muestra de 2.10 moles de ácido acético cristalino, inicialmente a 17.0 °C y 1 atm de presión, se deja fundir a 17.0 °C (ΔH°fosión = 45,7 kJ/mol) y posteriormente se calienta a 118.1 °C (su punto de ebullición normal, Cplíquido = 6,1 j/° mol) a 1.00 atm. La muestra se deja evaporar a 118.1 °C (ΔH°vaporización = 55,8 kJ/mol) y rápidamente se enfría a 17.0 °C, (Cpvapor = 3,2 j/° mol) cristalizándose de nuevo. El valor de ΔH° para el proceso total descrito es: A) 101,5 kJ B) 213,17 kJ C) 0 kJ D) 143,6 kJ E) Insuficiente información. Datos ⎛ P ⎞ ΔH vap ln⎜⎜ 2 ⎟⎟ = R ⎝ P1 ⎠ ⎡1 1⎤ N 0 = 6.02 x 1023 [partículas / mol ] ⎢T − T ⎥ 2⎦ ⎣ 1 R = 8.314 [J / °Kmol ] CM 1A1- QUIMICA Control-1 (2008-1) Nombre: ........................................................................................ a 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 b USE SOLO LAPIZ PASTA c d e A b 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 c d e NOTA: CADA PREGUNTA CORRECTA VALE 1/5 PUNTO CADA PREGUNTA INCORRECTA DESCUENTA 1/15 PUNTO CM 1A1- QUIMICA EXAMEN (2008-Prim.) Nombre: …………………………………………………………………………… 1.- Cual de los dopantes siguientes en el silicio produciría un semiconductor de tipo p: a) Ga 2.- b) Ge, c) As d) Cd e) Sb Se ha predicho que si se pudiera poner el elemento hidrógeno (normalmente un gas invisible de moléculas diatómicas a temperatura y presión ambiente) bajo presión suficientemente alta - millones de atmósferas - puede convertirse en un metal! ¿Cuáles de los diagramas de banda anteriores representan el hidrógeno sólido? a) A, 3.- b) B, b) solo B c) solo C d) A y B e) B y C b) solo 2 c) 2 y 3 d) 4 y 5 e) 1 y 2 ¿Cuáles de las especies siguientes son capaces de unirse entre sí por medio de enlaces de hidrógeno? 1) C 2 H 6 , 2) HI, 3)) KF, 4) BeH 2 , 5) CH 3 COOH. a) solo 1 6.- e) Ninguno de ellos En la molécula orgánica dibujada abajo qué átomo/s de carbono utiliza/n geometría triangular plana (u orbitales híbridos sp2) en la formación de sus enlaces? a) solo 1 5.- d) D ¿Cuáles de los siguientes diagramas electrónicos representan un estado fundamental correcto? a) solo A 4.- c) C b) solo 2 c) 2 y 3 d) 4 y 5 e) solo 5 Los siguientes compuestos RbF, CO 2 , CH 3 OH, CH 3 Br, están ordenados en orden creciente según su punto de ebullición en: a) RbF < CO 2 < CH 3 OH < CH 3 Br b) CH 3 Br < RbF < CH 3 OH < CO 2 c) CO 2 < CH 3 Br < RbF < CH 3 OH d) CO 2 < CH 3 Br < CH 3 OH < RbF e) CO 2 < CH 3 OH < CH 3 Br < RbF 7.- Los puntos de fusión de los óxidos de los elementos del tercer periodo están entre paréntesis: Na 2 O (1275°C), Al 2 O 3 (2045°C), SO 3 (16.8°C), Cl 2 O 7 (-91.5°C). Entonces son sólidos moleculares: a) SO 3 y Cl 2 O 7 b) Na 2 O y SO 3 e) ninguno de los anteriores. c) Al 2 O 3 y Na 2 O d) Cl 2 O 7 y Al 2 O 3 8.- El silicio cristalino tiene una estructura cúbica. La longitud de la arista de la celda unitaria es 543 pm. La densidad del sólido es 2.33 g/ cm 3 . Entonces el número de átomos de Si en cada celda unitaria es: a) 4 b) 8 c) 6 d) 2 e) 1 9.- Cuáles de los siguientes compuestos son sólidos covalentes? Se 8 , HBr, Si(diamante), CO 2 , C(grafito), P 4 O 6 , SiH 4 . a) SiH 4 b) CO 2 y C(grafito) c) Si(diamante) y C(grafito) d) C(grafito) y P 4 O 6 e) P 4 O 6 10.- ¿Cuáles de las siguientes propiedades influyen en la presión de vapor de un líquido en un recipiente cerrado? 1) el volumen sobre el líquido, 2) la cantidad de líquido presente, 3) la temperatura, 4) las fuerzas intermoleculares entre las moléculas del líquido. a) solo 1 11.- c) 2 y 3 d) 3 y 4 e) solo 3 ¿Cuánto calor (en kJ) se necesitaría para convertir 866 g de hielo a -10°C en vapor a 126°C? (Los calores específicos del hielo, del agua líquida y del vapor son 2.03 J/gr °C; 4.18 J/gr°C y 1.99 J/gr°C, respectivamente. H fusión = 6.01 kJ/mol; H vaporización = 40.68 kJ/mol) a) 1335.3 12.- b) solo 2 b) 2670.6 c) 2306.6 d) 1153.3 e) 1876.7 La presión de vapor del benceno, C 6 H 6 , es 40.1 mmHg a 7.6°C. ¿Cuál es su presión de vapor a 60.6°C? El calor molar de vaporización del benceno es 31.0 kJ/mol. a) 150.8 mmHg b) 760 mmHg c) 330.4 mmHg d) 390.7 mmHg e) 256.6 mmHg 13.- La presión de vapor del mercurio en su punto de ebullición normal (357°C) es: a) 0,25 atm 14.- b) 32.5 % c) 66.7 % e) 0 atm e) 45.0 % c) 52.36, 78.01, 74.06 % Las geometrías de cada una de las siguientes especies a) PCl 3 , b) TeCl 4 c) SiH 4 , son respectivamente: b) piramidal; cuadrada planar; tetraédrica d) piramidal; tetraédrica; cuadrada planar Los orbitales híbridos que utiliza el átomo de nitrógeno en cada una de las siguientes especies: a) NH 3 b) H 2 N ― NH 2 c) NO 3 - son respectivamente: a) sp3; sp2; sp 18.- d) 25.8 % b) 25.36, 68.01, 74.06 % e) 50.16, 61.01, 72.85 % a) piramidal; tetraédrica distorsionada; tetraédrica c) tetraédrica; cuadrada planar; piramidal e) bipiramidal; tetraédrica; cuadrada planar 17.- d) 1,31 atm Una medida cuantitativa de la eficiencia con que se empacan las esferas en las celdas unitarias se denomina eficiencia de empaquetamiento, que es el porcentaje del espacio de la celda ocupado por las esferas. Las eficiencias de empaquetamiento de una celda cúbica simple, una celda cúbica centrada en el cuerpo y una celda cúbica centrada en las caras son respectivamente: a) 52.36, 68.01, 74.06 % d) 74.06, 68.01, 52.36 % 16.- c) 0,15 atm Una muestra de agua de 1.20 g se inyecta en un matraz al vacío de 5.00 L a 65°C. Entonces, el porcentaje de agua que se evapora cuando el sistema alcanza el equilibrio será: (Suponga un comportamiento ideal del vapor de agua y desprecie el volumen del agua líquida). La presión de vapor de agua a 65°C es 187.5 mmHg. 1 atm = 760 mmHg a) 100 % 15.- b) 1 atm b) sp2; sp3; sp2 c) sp3; sp3; sp2 d) sp2; sp3; dsp3 e) sp3; sp2; dsp2 Los orbitales híbridos de los átomos de carbono señalados en las siguientes moléculas son respectivamente: a) sp3; sp2; sp; sp2 b) sp2; sp3; sp; sp2 c) sp; sp2; sp3; sp3 d) sp3; sp2; sp3; sp2 e) sp2; sp2; sp; sp 19.- Una muestra de 0.1375 g de magnesio sólido se quema en una bomba calorimétrica a volumen constante que tiene una capacidad calorífica de 1769 J/°C. El calorímetro contiene exactamente 300 g de agua y el aumento de la temperatura es de 0.126°C. Entonces, el calor liberado por la combustión del Mg, en kJ/g. (Calor específico del agua = 4.18 J/g°C) a) 0.381 kJ/g 20.- b) 3.81 kJ/g c) 380.9 kJ/g d) 22.7 kJ/g e) 2.77 kJ/g De los siguientes calores de combustión, CH 3 OH(l) + 3/2 O 2 (g) CO 2 (g) + 2H 2 O (l) C(grafito) + O 2 (g) CO 2 (g) 0 = -726.4 kJ H reaccion 0 = -393.5 kJ H reaccion H 2 (g) + 1/2 O 2 (g) H 2 O (l) 0 = -285.8 kJ H reaccion La entalpía de formación del metanol, CH 3 OH(l) a partir de sus elementos es: a) 726.4 kJ/mol 21.- b) 238.7 kJ/mol c) 119.9 kJ/mol d) –238.7 kJ e) –22.7 kJ/mol El acetileno (C 2 H 2 ) y el benceno (C 6 H 6 ) tienen la misma fórmula empírica. (ELIMINADA) 3C 2 H 2 (g) C 6 H 6 (l) Las entalpías de combustión para C 2 H 2 (g) y C 6 H 6 (l) son -1299,4 kJ/mol y -3267.4 kJ/mol, respectivamente. El cambio de entalpía para la formación de C 6 H 6 a partir de C 2 H 2 es: a) 1968 kJ b) –1968 kJ c) –1068 kJ d) 1068 kJ e) 2046 kJ (Resp. = -630.8) 22.- Si la diferencia en electronegatividades entre los elementos A y X es 0.8, entonces el enlace en AX será probablemente: a) iónico b) covalente c) covalente polar d) covalente apolar e) la información es insuficiente 23.- ¿Cuál(es) de los siguientes compuestos tiene(n) ángulos de enlace de aproximadamente 109.5o? 1) ClF 3 2) BF 3 a) 2 y 3 3) ClO 4 - 4) SF 4 b) 1 y 4 5) GeCl 4 c) sólo 4 d) 3 y 5 e) sólo 5 24.- ¿Cuál de las siguientes es la estructura de Lewis correcta para HClO 3 ? (Faltan cargas formales!) I) a) II II) b) IV III) c) I IV) d) V V) e) III 25.- El ion sulfato, SO 4 2-, es tetraédrico con cuatro distancias S-O iguales de 149 P.M. ¿No haciendo caso de la resonancia, cuál de las siguientes es la estructura más razonable consistente con estos hechos? a) 26.- b) c) d) C y B. e) Ninguna de las anteriores. ¿Cuáles de las moléculas siguientes no es plana? a) BCl 3 b) ClF 3 c) PCl 3 d) XeF 4 e) Todos los compuestos mostrados son planos 27.- De acuerdo con la teoría de repulsión de pares de electrones de valencia, los ángulos de enlace ideales alrededor de los dos átomos de carbono en el acetaldehído, CH 3 CHO son: (El primer carbono tiene solo enlaces a tres átomos de H y a un átomo de C; el segundo carbono tiene solo enlaces a C y a H, y un enlace doble al O.) a) 109°, 109° 28.- b) 109°, 120° c) 120°, 109° d) 120°, 90° e) 105°, 105° En cuál de los siguientes procesos ΔH = ΔE? a) 2HI(g) → H 2 (g) + I 2 (g) a presión atmosférica. b) Dos moles de gas amoníaco se enfrían de 325 °C a 300 °C a 1.2 atm c) H 2 O(l) → H 2 O(g) a 100 °C a presión atmosférica. d) CaCO 3 (s) → CaO(s) + CO 2 (g) at 800 °C a presión atmosférica. e) CO 2 (s) → CO 2 (g) a presión atmosférica 29) Dado los siguientes datos, la entalpía estándar de formación del etileno, C 2 H 4 (g), es: ΔHo f = -1411 kJ; ΔHo f = -393.5 kJ; ΔHo f = -285.8 kJ C 2 H 4 (g) + 3 O 2 (g) ----> 2 CO 2 (g) + 2 H 2 O(l) C(s) + O 2 (g) ----> CO 2 (g) H 2 (g) + ½O 2 (g) ----> H 2 O(l) a) 52.4 kJ 30.- b) 2.77 x 103 kJ c) 1.41 x 103 kJ d) 143,6 kJ e) Insuficiente información. Una muestra de 2.10 moles de ácido acético cristalino, inicialmente a 17.0 °C y 1 atm de presión, se deja fundir a 17.0 °C (H fosión = 45,7 kJ/mol) y posteriormente se calienta a 118.1 °C (su punto de ebullición normal, Cp líquido = 6,1 j/° mol) a 1.00 atm. La muestra se deja evaporar a 118.1 °C (H vaporización = 55,8 kJ/mol) y rápidamente se enfría a 17.0 °C, (Cp vapor = 3,2 j/° mol) cristalizándose de nuevo. El valor de H para el proceso total descrito es: a) 101,5 kJ b) 213,17 kJ c) 0 kJ d) 143,6 kJ e) Insuficiente información. 31.- En el equilibrio: 2NOCl(g) 2NO(g) + Cl 2 (g) Las condiciones iniciales son: [NOCl]o = 1.0 M; [NO] = 0.0 M; [Cl 2 ] = 0.0 M ¿Cuál es la expresión correcta para las concentraciones en el equilibrio? a) [NOCl] = 1.0-x, [NO] = x, [Cl 2 ] = x b) [NOCl] = 1.0-x, [NO] = 2x, [Cl 2 ] = x c) [NOCl] = 1.0-x, [NO] = x, [Cl 2 ] = 2x d) [NOCl] = 1.0-2x, [NO] = 2x, [Cl 2 ] = x e) [NOCl] = 1.0-2x, [NO] = 2x, [Cl 2 ] = 2x 32.- Considerar el equilibrio gaseoso de H 2 (g) + I 2 (g) <==> 2 HI (g). Según lo bosquejado abajo, las presiones, P, de estos tres gases están en el equilibrio en un envase. En un cierto tiempo, t, se agrega I 2 extra, según lo demostrado. ¿Cuáles de los sistemas de curvas muestran cómo responderá el sistema a esta situación? a) A 33.- b) B d) D e) ninguna La concentración de los iones [X-] en una disolución saturada de MX donde [M+] = 9.1 X 10-9 M. (Kps(MX) = 3.64x10-13) es: a) 4.0x10-5 M 34.- c) C b) 2.0x10-5 M c) 3.5x10-5 M d) 5.0x10-4 M e) 6.0x10-4 M El pH de una solución 0.1 M del ácido HA es 1.0. Por lo tanto, a) HA es un ácido fuerte. b) K a of HA is 1. e) no se da bastante información para determinar K a c) K a of HA is 0.1. d) K a of HA is 0.01. 35.- Cuál es el pH de una solución tapón de formato de sodio/ácido fórmico que contiene concentraciones iguales de ambos componentes? [K a ácido fórmico = 1.7 x 10-4] a) 7.00 b) 6.22 c) 3.77 d) 3.05 e) no se puede determinar el pH de la solución tapón a menos que se conozcan las concentraciones reales de los componentes. 36.- Las fórmulas correctas de los ácidos conjugados de cada una de las siguientes bases: a) HS-, b) HCO 3 -, c) H 2 PO 4 -, d) HSO 4 -, son: 1)H 2 S, 2) H 2 CO 3 -, 3) HPO 4 -, 4) H 2 SO 4 , 5) H 3 PO 4 , 6) SO 4 -2 a) 1 b) 1 y 6 c) 1, 4 y 5 d) 2 y 4 e) 3, 5 y 6 37.- Qué cantidad de NaOH (en gramos) se necesita para preparar 5 L de una solución con un pH de 10.00? a) 2.0 b) 0.2 c) 0.01 d) 1.0 e) 0.02 38.- El porcentaje de ionización de una disolución de ácido acetilsalicílico (aspirina) 0.20 M, que es monoprótico, para el cual K a = 3.0 x 10-4, es: a) 3.87 % b) 38.7 % c) 100 % d) 48.7 % e) 27.8 % 39.- El carbamato de amonio, NH 4 CO 2 ,NH 2 , se descompone según la reacción: NH 4 CO 2 NH 2 (s) 2NH 3 (g) + CO 2 (g) Comenzando únicamente con el sólido, se encuentra que a 40°C la presión total del gas (NH 3 y CO 2 ) es 0.363 atm. Entonces la constante de equilibrio K P .es: a) 5.09x10-3 b) 7.09x10-3 c) 2.36x10-3 d) 1.01x10-3 e) 4.03x10-3 40.- En el siguiente proceso de equilibrio, el equilibrio se desplaza a la derecha cuando: PCI 5 (g) PCl 3 (g) + Cl 2 (g) ΔH° = 92.5 kJ a) la temperatura se eleva; b) se agrega más cloro gaseoso a la mezcla de reacción; c) se retira algo de PCl 5 de la mezcla; d) la presión total del gas se incrementa; e) se agrega un catalizador a la mezcla de reacción. CM 1A1- QUIMICA Examen (2008-1) Nombre: ........................................................................................ a 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 b c USE SOLO LAPIZ PASTA d e A b c 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 d e NOTA: CADA PREGUNTA CORRECTA VALE 0.15 PUNTOS CADA PREGUNTA INCORRECTA DESCUENTA 0.04 PUNTOs Datos P H vap 1 1 N 0 6.02 x 1023 partículas / mol ln 2 P R T T 2 1 1 R 8.314 J / Kmol 1.98 cal / Kmol 0.082 atm.lt / Kmol CM 1A1- QUIMICA Examen (2008-1) Nombre: ........................................................................................ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 a X X b X X X X X X X X USE SOLO LAPIZ PASTA A c d e 21 22 23 X 24 X 25 X 26 27 28 X X 29 X X 30 31 X 32 33 X X 34 X 35 36 X 37 38 X X 39 X 40 X b c d e X X X X X X X X X X X X X NOTA: CADA PREGUNTA CORRECTA VALE 0.15 PUNTOS CADA PREGUNTA INCORRECTA DESCUENTA 0.04 PUNTOs CM 1A1- QUIMICA EXAMEN RECUPERATIVO (2008-1) Nombre: …………………………………………………………………………… 1.- Cual de los dopantes siguientes en el silicio produciría un semiconductor de tipo n: B, Ge, As a) solo B b) solo Ge c) solo As d) As y B e) B y Ge 2.- ¿Cuále(s) de los siguientes equilibrios se moverá(n) a la izquierda (productos cuándo el volumen del recipiente de la reacción se aumenta? a) A, 3.- b) B d) A y B, -3 -6 -3 -3 b) 7.7 10 -6 c) 1.7 10 d) 1.7 10 3 a) 104.8 kJ o ∆H f = -1411 kJ; o ∆H f = -393.5 kJ; o ∆H f = -285.8 kJ 3 b) 2.77 x 10 kJ c) 1.41 x 10 kJ d) 87.2 kJ e) 52.4 kJ Cuáles de los siguientes compuestos son sólidos moleculares? Se 8 , HBr, Si, CO 2 (s), SiH 4 a) Se 8 , CO 2 (s) 6.- e) Ninguno de ellos Encuentre la entalpía estándar de formación del etileno, C2H4(g), dado los datos siguientes: C2H4(g) + 3 O2(g) ----> 2 CO2(g) + 2 H2O(l) C(s) + O2(g) ----> CO2(g) H2(g) + ½O2(g) ----> H2O(l) 5.- e) B y C Si la solubilidad de BaF2 es 7.5 x 10 g/L, el producto de solubilidad, Kps del compuesto BaF2 es: a) 7.7 10 4.- c) C, → reactivos) b) SiH 4 , CO 2 (s) c) Si, SiH 4 d) Se 8 , Si, CO 2 (s) e) Si Cuál es la expresión correcta de la constante de equilibrio para la reacción siguiente? 2 Cu(s) + O2(g) → 2 CuO(s) 2 a) Keq = 1/[O2] d) Keq = [O2] 7.- 2 2 2 b) Keq = [CuO] /[Cu] e) Keq = 1/[O2] 2 c) Keq = [CuO] /[Cu] [O2] Considerar la siguiente reacción endotérmica: H2(g) + I2(g) ↔ 2 HI(g). Si se aumenta la temperatura, a) se producirá más HI b) se descompondrá algo de HI, formando H2 e I2 c) la magnitud de la constante de equilibrio disminuirá d) la presión en el envase aumentará e) la presión en el envase disminuirá 8.- Cuáles de las siguientes combinaciones, cuando se disuelven cantidades equimolares en agua, ¿produciría una solución tampón? a) NaCl y NaC2H3O2 d) NaNO3 y NH3 9.- c) HNO3 y NaOH -8 El Kps de PbI2 es 1.4 x 10 . Entonces la solubilidad molar de PbI2 en 0.01 M NaI es: -3 a) 1.5 x 10 M -2 d) 5.6 x 10 M 10.- b) HC2H3O2 y NaCl e) NH3 y NH4Cl -4 -6 b) 1.4 x 10 M c) 1.4 x 10 M e) ninguna de las anteriores ¿Cuál(es) de las siguientes aseveraciones concernientes a una disolución de un ácido débil HA 0.10 M es(son) cierta(s)? + a) El pH es 1.00 b) [H+] >> [A-] c) [H ] =[A-] d) El pH es menor que 1. e) Todas 11.- Se disuelve una muestra de 0.0560 g de ácido acético en la cantidad suficiente de agua + para preparar 50.0 mL de disolución. Entonces las concentraciones de H , CH3C00 y -5 CH3COOH en el equilibrio son aproximadamente: (Ka para el ácido acético = 1.8 X 10 .) -3 -4 -4 a) 5.7 10 , 5.7 10 , 0.186 -4 -4 d) 5.7 10 , 5.7 10 , 0.186 12.- b) 8.48 x 10-5 c) 1.93 x 10-2 d) 1.23 x 102 e) 3.95 x 104 ¿Cuántos gramos de NaCN se necesitan disolver en agua para obtener exactamente 3 -10 250 cm de una disolución con un pH de 10.00? (Ka(HCN)= 4.9 10 ) b) 38.9 c)29.8 d) 27.2 e) 33.5 Una disolución de ácido fórmico (HCOOH) tiene un pH de 2.53. ¿Cuántos gramos de -4 ácido fórmico hay en 100.0 ml de la disolución? (Ka(HCOOH) = 1.7 10 ) a) 14.21 15.- -3 Kc para la siguiente reacción a 2500oC es 1.93 x 10-2. ¿Cuánto vale Kp a esta temperatura? H2(g) + Cl2(g) 2 HCl(g) a) 39.8 14.- -3 c) 5.7 10 , 5.7 10 , 0.0186 La constante de equilibrio a) 2.15 13.- -4 b) 5.7 10 , 5.7 10 , 0.0186 -4 -4 e) 5.7 10 , 5.7 10 , 0.00186 b) 77.43 c) 88.54 d) 66.49 e) 89.86 Considere el siguiente proceso en equilibrio a 700°C: 2H2(g) + S2(g) ↔ 2H2S(g) -5 Un análisis muestra que hay 2.50 moles de H2, 1.35 x 10 moles de S2, y 8.70 moles de H2S contenidos en un matraz de 12.0 L. Entonces la constante de equilibrio Kc de la reacción es: 8 a) 1.076 10 16.- 6 b) 2.076 10 7 7 c)1.076 10 d) 2.076 10 6 e) 1.076 10 Considere el siguiente proceso de equilibrio heterogéneo: C(s) + CO2(g) ↔ 2CO(g) A 700°C, la presión total del sistema es de 4.50 atm. Si la constante de equilibrio KP es 1.52, las presiones parciales de CO2 y CO en el equilibrio son respectivamente: a) 2.536, 1.963 17.- b) 1.963, 2.536 c) 1.764, 2.963 a) 3, 5 b) 2 y 4 o H = -206.2 kJ o H = 172.5 kJ o H = -9.4 kJ o H = 285 kJ o H = 484.6 kJ c) 1, 2 d) 4 e) 3 Una solución 0.10 M de HF está ionizada en un 8.1%. Cuál es el valor de Ka? -4 a) 6.4 x 10 19.- e) 2.963, 2.122 Considerar las reacciones siguientes. ¿En qué casos la formación del producto es favorecida por un aumento en la temperatura y presión? 1) CO(g) + 3 H2(g) CH4(g) + H2O(g) 2) CO2(g) + C(s) 2 CO(g) 2 HI(g) 3) H2(g) + I2(g) 4) 3 O2(g) 2 O3(g) 5) 2 H2O(g) 2 H2(g) + O2(g) 18.- d) 2.122, 2.963 -4 b) 7.6 x 10 c) 7.1 x 10 -4 -4 d) 8.8 x 10 -4 e) 8.4 x 10 La estructura de Lewis del aminoácido glicina se muestra a continuación. La hibridación y el ángulo que forman los enlaces alrededor de los átomos indicados son: 3 2 3 a) N1 -- sp , 90°; C2 -- sp , 90°; O3 -- sp , 180° 3 2 3 b) N1 -- sp , 109.5°; C2 -- sp , 120°; O3 -- sp , 109.5° 3 3 3 c) N1 -- sp , 109.5°; C2 -- sp , 109.5°; O3 -- sp , 109.5° 2 3 d) N1 -- sp , 90°; C2 -- sp , 90°; O3 -- sp, 180° 2 2 e) N1 -- sp , 120°; C2 -- sp , 120°; O3 -- sp, 180° 20.- ¿Cuál(es) de las estructuras de Lewis es(son) incorrecta(s)? a) 21.- b) b) BF3 c) CHCl3 b) AsCl3 d) BrF3 e) C2H4 c) SO3 + d) BF3 e) NH4 El criptón cristaliza en una estructura que tiene cuatro átomos de Kr en la celda unidad, y 3 esta es cúbica. La arista es 0.559 nm. Entonces la densidad de Kr cristalino, en kg/m es: -13 3 a) 9.97 x 10 kg/m -3 3 e) 9.97 x 10 kg/m 24.- e) C y D. ¿Cuál de las siguientes especies tiene el momento dipolar más grande? a) CS2 23.- d) ¿Cuáles de las moléculas siguientes tienen un momento dipolar no nulo y un átomo central 3 con hibridación sp ? a) CCl4 22.- c) 3 b) 3.04 x 10 kg/m 3 c) 3.14 kg/m 3 3 d) 3.18 x 10 kg/m 3 o Una muestra de 60.0 g de una aleación fue calentada a 96.00 C y entonces fue introducida o en un recipiente que contenía 87.0 g de agua a una temperatura de 24.10 C. La o temperatura del agua subió a una temperatura final de 27.63 C. El calor específico del o agua es 4.184 J/g· C. Cuál es el calor específico de la aleación? o o o a) 0.321 J/g· C b) 2.162 J/g· C e) Ninguno de los anteriores o c) 0.118 J/g· C d) 1.721 J/g· C 1 H 1.008 3 2 2A 3A 4A 5A 6A 7A 4 5 6 7 8 9 Li Be B C N O F 6.941 11 9.012 12 10.811 13 12.011 14 Na Mg 24.305 20 21 22 23 24 25 26 27 28 29 30 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.098 37 40.078 38 44.956 39 47.867 40 50.942 41 51.996 42 58.693 46 63.546 47 65.39 48 69.723 49 72.64 50 74.922 51 78.96 52 79.904 53 83.80 54 Pd Ag Cd In Sn Sb Te I Xe 4B 5B 6B 7B 8B 8B 54.938 55.845 58.933 43 44 45 Rb Sr Y Zr Nb Mo Tc 85.468 55 87.62 56 88.906 57 91.224 72 92.906 73 95.94 74 (98) 75 Cs Ba La Hf Ta W Re Ru Rh 8B 1B 2B Al Si 28.086 32 P S Cl Ne 20.180 18 22.990 19 3B 26.982 31 14.007 15.999 18.998 15 16 17 He 4.003 10 30.974 32.065 35.453 33 34 35 Ar 39.948 36 101.07 102.906 106.42 107.868 112.411 114.818 118.710 121.760 127.60 126.904 131.293 76 77 78 79 80 81 82 83 84 85 86 Os Ir Pt Au Hg Tl 132.905 137.327 138.906 178.49 180.948 183.84 186.207 190.23 192.217 195.078 196.967 200.59 204.383 87 88 89 104 105 106 107 108 109 110 111 112 Po At Rn 207.2 114 Pb 208.980 (209) 116 Bi (210) (222) 118 Fr Ra Ac Rf Db Sg Bh Hs Mt Uun Uuu Uub Uuq Uuh Uuo (223) (226) (227) (261) (262) (266) (264) (277) (268) (289) (289) (293) 58 59 60 61 62 63 Lantánidos Ce Pr Nd 140.116 140.908 144.24 90 91 92 Actínidos Th Pa U 232.038 231.036 238.029 Pm Sm Eu (145) 93 (281) (272) (285) 64 65 66 67 68 Gd Tb Dy Ho Er 69 71 Lu 150.36 151.964 157.25 158.925 162.50 164.930 167.259 168.934 173.04 174.967 94 95 96 97 98 99 100 101 102 103 Np Pu Am Cm Bk Cf Es Fm Md No (237) (244) (247) (251) (252) (257) (258) (243) (247) Datos P ∆H vap ln 2 = R P1 70 Tm Yb 1 1 N 0 = 6.02 x 10 23 [partículas / mol ] T − T 2 1 R = 8.314 [J / °Kmol ] = 1.98 [cal / °Kmol ] = 0.082 [atm × lt / °Kmol ] (259) Lr (262) CM 1A1- QUIMICA Examen (2008-1) Nombre: ........................................................................................ a 1 2 3 4 5 6 7 8 9 10 11 12 b USE SOLO LAPIZ PASTA c d e A b 13 14 15 16 17 18 19 20 21 22 23 24 c d e NOTA: CADA PREGUNTA CORRECTA VALE 0.25 PUNTOS CADA PREGUNTA INCORRECTA DESCUENTA 0.06 PUNTOS CM 1A1 QUIMICA Control 1 (2008/2). Nombre: Forma A 1) ¿Cuál es la fórmula empírica de un óxido de nitrógeno que contiene 36,8% de nitrógeno? a) NO2 b) N2O3 c) NO d) N2O e) Ninguna de las anteriores 2) ¿Cuánto carbón se necesita para hacer reaccionar 1,5 kg de As2O3 de acuerdo con la siguiente reacción (no balanceada)?: As2O3(s) + C(s) ⎯→ As(s) + CO(g) a) 0,907 kg b) 1,5 kg c) 0,181 kg d) 1 kg e) 0,272 kg 3) Si los rayos X tienen una longitud de onda más corta que los rayos UV, ¿Cuál de las siguientes afirmaciones es verdadera? a) Los rayos X tienen menor frecuencia que los rayos UV. b) Los rayos X viajan más rápido que los rayos UV. c) Los rayos X tienen mayor energía que los rayos UV. d) Los rayos X tienen mayor amplitud que los rayos UV. e) Ninguna de las anteriores. 4) Identifique cuales de las siguientes transiciones son absorciones (Abs) y cuales emisiones (Emi) de energía. n=3 n=4 n=5 n=6 I n=2 II III n=1 IV V VI Todas pueden ser absorciones o emisiones (a) Abs:I, III, V Emi: II, IV, VI (b) Abs: II, V, VI Emi: I, III, IV (c) Abs: II Emi: I, III, IV, V, VI (d) Abs: I, III, IV Emi: II, V, VI (e) 5) ¿Cuál de las siguientes moléculas representa la correcta estructura de Lewis para el N2O5? (a) (b) (c) (d) (e) 6) Cuando una luz roja intensa incide sobre una muestra de metal de Cesio en un experimento del efecto fotoeléctrico, no se expulsa ningún electrón de la superficie. En cambio, la excitación de la muestra con la luz azul débil expulsa los electrones, cuya energía cinética puede ser medida. Este resultado es consistente ¿con cuál de las siguientes conclusiones? a) Los fotones rojos tienen más energía que los fotones azules. b) Los fotones rojos tienen menos energía que los fotones azules. c) Los fotones rojos tienen la misma energía que los fotones azules. d) no es posible concluir nada de lo anterior con el resultado del experimento. e) Ninguna de las anteriores. 7) ¿Cuál de las moléculas siguientes tiene la distancia nitrógeno-nitrógeno más corta? a) N2 b) N2O4 c) N2O d) N2H4 e) N2H2 8) Para la siguiente reacción, suponiendo un rendimiento del 100%, ¿Cuántos gramos del reactivo límite quedarán sin reaccionar si 16,8 gramos de C2H3N reaccionaran con 33,7 gramos de O2? 4 C2H3N + 13 O2 → 8 CO2 + 6 H2O + 4 NO a) 16,9 b) 4,225 c) 10,98 d) 0 e) no hay suficientes datos 9) Un compuesto contiene C, H, Cl y O. La combustión de 2,684 mg del compuesto dio 2,934 mg de CO2 y 1,501 mg de H2O. En un análisis separado 1,073 mg del compuesto fue convertido en 1,911 mg AgCl. ¿Cuál es la fórmula empírica? a) C2H5ClO2 b) C2H5ClO c) C2H4ClO d) C2H5Cl2O e) C2H4Cl2O 10) Con respecto a la siguiente pregunta: ¿Es probable que exista un electrón para el átomo de hidrógeno con un nivel de energía En = –1×10-20 J? Indique cual de las siguientes respuestas es correcta: a) Si, un átomo de hidrógeno puede tener cualquier nivel de energía. b) No, porque esa energía no corresponde a un número entero. c) No, porque ese nivel de energía no corresponde a un “n” entero. d) No, porque en el átomo de hidrógeno el electrón sólo puede estar en el nivel de energía n = 1. e) No, porque la energía de una órbita permitida debe ser positiva. 11) En un hidrogenoide, el número cuántico “l ” está relacionado con: a) La energía del orbital b) La orientación de un orbital c) El tamaño del orbital d) El espín del electrón e) La forma del orbital 12) ¿Cuál de las siguientes afirmaciones no es consistente con el modelo atómico de Bohr? a) Un átomo tiene un número discreto de niveles de energía (orbitales) en los cuales un electrón puede existir mientras emita continuamente radiación de energía definida. b) Un electrón puede saltar a una órbita de menor energía emitiendo radiación de frecuencia proporcional a la diferencia de energía entre las dos órbitas. c) Un electrón puede saltar a una órbita de mayor energía absorbiendo radiación de frecuencia proporcional a la diferencia de energía entre las dos órbitas. d) Un electrón se mueve en órbitas circulares alrededor del núcleo. e) La energía de un electrón está cuantizada. 13) ¿Cuál(es) de las siguientes especies es(son) paramagnética(s)?: Ca2+, Fe2+, Al, F − y S2−. a) Ca2+ y Fe2+ d) F − y S2− c) Fe2+ y Al b) Al e) F −, Ca2+ y S2− 14) De los siguientes conjuntos de n°s cuánticos, indique aquellas que representan soluciones permitidas de la ecuación de onda para el Hidrógeno: conjunto I II III IV V n 3 4 4 5 5 l 0 1 3 5 2 ml 1 1 -3 0 -3 ms −½ +½ +½ −½ +½ I, II y III I, III y V II y III II y V ninguna (a) (b) (c) (d) (e) 15) La reacción de 4,00 g de B5H9 y 10,00 g de O2 produce 8,32 g de B2O3 . ¿Cuál es el porcentaje de rendimiento? B5H9 + O2 → B2O3 + H2O (reacción no balanceada) B B a) 93,5 b) 91,8 c) 92,8 d) 88,6 e) 87,2 16) El electrón en el átomo de hidrógeno está en el estado fundamental. Absorbe suficiente energía de modo que su energía final sea mayor que cero. Entonces: a) el electrón está libre del núcleo del hidrógeno y tiene energía cinética adicional. b) el electrón puede tener solamente energías negativas. c) el electrón va al nivel de energía más alto. d) la energía va a la serie de Lyman. e) Parte de la energía va al nivel y la otra parte es absorbida por el electrón. 17) ¿Cuál de las siguientes transiciones está asociada al fotón (absorbido o emitido) con la mayor frecuencia? a) n = 2 a n =4 b) n = 2 a n = 1 c) n = 2 a n = 5 d) n = 4 a n = 3 e) n = 1 a n = 4 18) ¿Qué configuración electrónica para el átomo de carbono satisface la regla de Hund? a) 1s2 2s2 2px2 2py0 2pz0 b) 1s2 2s2 2px1 2py1 2pz0 c) 1s2 2s2 2px1 2py1 2pz1 d) 1s2 2s2 2px2 2py1 2pz1 e) ninguna de las anteriores 19) ¿Cuál de las siguientes especies tiene el radio mayor? a) Cl − b) Na+ c) Mg2+ d) P3− e) S2− P 20) ¿Cuál de los siguientes elementos queda penúltimo cuando se ordenan en orden decreciente de primer potencial de ionización? a) Br b) Cs c) Na d) Cl 21) Considerando los átomos de las siguientes configuraciones: (I) 1s2 2s2 (II) 1s2 2s2 2p1 (III) 1s2 2s2 2p3 (IV) 1s2 2s2 2p6 e) K (V) 1s2 2s2 2p6 3s1 El átomo que tiene el menor segundo potencial de ionización es: a) III b) I c) IV d) II e) V 22) ¿En cuál de estos tríos, las especies tienen la misma configuración electrónica? d) Co, Ni+, Zn2+ e) S2−, Cl −, K+ 23) Los iones Ni+2 y Ni+3 se diferencian por: (I) La estructura (II) La carga (III) El tamaño de electrónica nuclear la especie (IV) Propiedades magnéticas (V) El número de e-s 4s. Son correctas: a) I y IV d) II, IV y V e) IV y V a) Be, Mg, Ca b) F−, S2−, As3− b) I, III, IV c) Be2+, Mg2+, Ca2+ c) I, III y V 24) Si viajan a la misma velocidad, ¿Cuál de las siguientes ondas de materia tiene la longitud de onda más larga? a) electrón b) partícula (H+) c) neutrón d) partícula(He2+) e) protón 25) ¿Cuál de los siguientes iones tiene forma trigonal plana SO32− (a) PO43− (b) PF6− (c) CO32− (d) ClO4− (e) 26) Indique la alternativa incorrecta: en un átomo neutro con Z = 54 existen un total de: a) b) c) d) e) 10 orbitales d y 12 orbitales p ocupados 20 electrones situados en orbitales d. 18 electrones situados en la última capa. 10 electrones situados en orbitales s. 27 pares de electrones, cada uno con spines apareados. 27) Dadas las siguientes especies isoelectrónicas en estado gaseoso Cl −, S2− , K+, Ca2+, sus radios se ordenan de mayor a menor, de la siguiente manera: a) b) c) d) e) Ca2+, K+, S2−, Cl − Ca2+, K+, Cl−, S2− K+, Ca2+, Cl −, S2− S2−, Cl −, K+, Ca2+ S2−, Cl −, Ca2+, K+ 28) ¿Cuál de los siguientes conjuntos de números cuánticos puede describir al electrón más fácilmente removible en un átomo de Cu que se encuentra en su estado basal? a) b) c) d) e) n = 4, n = 3, n = 3, n = 3, n = 4, l = 0, l = 1, l = 2, l = 1, l = 1, ml = 0, ms = ½ ml = −1, ms = ½ ml = 2, ms = ½ ml = 1, ms = −½ ml = −1, ms = ½ 29) ¿Cuál de las siguientes moléculas representa la correcta estructura de Lewis para el HNO3? (a) (b) (c) (d) (e) 30) ¿Cuál de las siguientes es una estructura de Lewis aceptable para PH2PH2? (a) (b) (c) (d) (e) 31) ¿Cuál de las siguientes es una de las otras estructuras de resonancia del ión nitrato, NO3−? 3− (a) (b) (c) (d) − (e) 32) En el I3− la estructura de Lewis muestra tres pares de electrones no compartidos en el átomo central. Esta molécula tiene: a) b) c) d) e) una distribución piramidal trigonal de electrones y una geometría molecular lineal una distribución octaédrica de electrones y una geometría angular una distribución de bipirámide trigonal de electrones y una geometría molecular lineal. una distribución octaédrica de electrones y una geometría lineal la molécula no existe. 33) El SF4 tiene: 4 pares de e−s solitarios (a) 3 pares de e−s solitarios (b) 2 pares de e−s solitarios (c) 1 par de e−s solitarios (d) 0 pares de e−s solitarios (e) 34) El ión oxalato, C2O42− tiene los dos carbones enlazados entre si y cada carbón enlazado a dos oxígenos, entonces los ángulos O-C-O y O-C-C son: 109,5° y 109,5° (a) 120° y 120° (b) 109,5° y 120° (c) 120° y 109,5° (d) ninguno de los anteriores (e) 35) En la siguiente reacción: SiF4 + 2 e− ⎯→ SiF42− , la forma geométrica del reactante es …….… y la forma del producto es ………… : a) b) c) d) e) 36) tetraédrica, balancín tetraédrica, pirámide cuadrada en forma de T, cuadrada plana cuadrada plana, en forma de T en forma de T, tetraédrica ¿Cuáles de las siguientes especies tienen ángulos de enlace de aproximadamente 109,5o? I) IF4+ I y III (a) III) ClO4− II) PCl4+ III y IV (b) II y III (c) II y IV (d) IV) SF4 I y IV (e) Datos: No = 6,02×1023 [partículas×mol−1] ; h = 6,63×10−27 [erg×s] ; c = 3,0×1010 [cm×seg−1] En = − RH Z 2 , RH = 2,18×10−18 [J] = 109677 [cm−1] = 13,6 [eV] = 313,6 [kcal×mol−1] ; π = 3,1416 2 n me = 9,1×10−28 [g] ; mp = 1,673×10−24 [g] ; mn = 1,675×10−24 [g] ; carga electrón = 1,6×10−19 [C] 1 2 H H 1.008 3 2A 3A 4A 5A 6A 7A 4 5 6 7 8 9 N O F Li Be B C 6.941 11 9.012 12 10.811 13 12.011 14 Mg 24.305 20 21 22 23 24 25 26 27 28 29 30 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.098 37 40.078 38 44.956 39 47.867 40 50.942 41 51.996 42 58.693 46 63.546 47 65.39 48 69.723 49 72.64 50 74.922 51 78.96 52 79.904 53 83.80 54 Pd Ag Cd In Sn Sb Te I Xe 5B 6B 7B 8B 54.938 55.845 58.933 43 44 45 Rb Sr Y Zr Nb Mo Tc 85.468 55 87.62 56 88.906 57 91.224 72 92.906 73 95.94 74 (98) 75 Cs Ba La Hf Ta W Re 132.905 137.327 138.906 87 88 89 8B Ru Rh 8B 1B 2B Si 28.086 32 P S Cl Ne 20.180 18 Na 4B Al 4.003 10 22.990 19 3B 26.982 31 14.007 15.999 18.998 15 16 17 He 30.974 32.065 35.453 33 34 35 Ar 39.948 36 101.07 102.906 106.42 107.868 112.411 114.818 118.710 121.760 127.60 126.904 131.293 76 77 78 79 80 81 82 83 84 85 86 Os Ir Pt Au 178.49 180.948 183.84 186.207 190.23 192.217 195.078 196.967 104 105 106 107 108 109 110 111 Hg Tl Pb Bi Po At Rn 200.59 112 204.383 207.2 114 208.980 (209) 116 (210) (222) 118 Fr Ra Ac Rf Db Sg Bh Hs Mt Uun Uuu Uub Uuq Uuh Uuo (223) (226) (227) (261) (262) (266) (264) (277) (268) (281) (289) (289) (293) (272) (285) CM 1A1- QUIMICA Control-1 (2008/2) USE SOLO LAPIZ PASTA para marcar su respuesta Nombre:. Forma A a 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 b X c d e X X X X X X X X X X X X X X X X X a 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 b c d X e X X X X X X X X X X X X X X X X X NOTA: CADA PREGUNTA CORRECTA VALE 1/6 PUNTO CADA PREGUNTA INCORRECTA DESCUENTA 1/18 PUNTO CM 1A1 QUIMICA Control 2 (2008/2). Nombre: Forma A 1) ¿Qué aseveración sobre la formación de orbitales moleculares es incorrecta? a) Solamente orbitales cercanos en energía se combinan unos con otros. b) El número de orbitales híbridos formados es siempre igual al número de orbitales atómicos de hidrógeno utilizados. c) Los orbitales híbridos formados tienen características direccionales bien definidas. d) Hay orbitales moleculares localizados y deslocalizados. e) Ninguna de las anteriores. 2) Isoniacida es un agente anti-bacterial utilizado en contra de varias cepas de tuberculosis. ¿Cuántos enlaces sigma hay en la molécula? a) 10 b) 4 c) 22 d) 17 e) Ninguna de las anteriores 3) Considerando la forma geométrica la molécula de ClF 3 , ¿Qué orbitales en Cl están ocupados por pares de electrones solitarios? ¿Qué orbitales están implicados en la formación del enlace? a) Electrones en p; Orbital sp2 de Cl y sp3 de F b) Electrones en p; Orbital sp2 de Cl y p de F c) Electrones en sp2; Orbital sp2 de Cl y p de F d) Electrones en sp3d; Orbital sp3d de Cl y p de F e) Electrones en sp3d; Orbital sp3d de Cl y sp3d de F 4) El Polonio (Po) es el elemento mayor del grupo 16 y el único elemento conocido que forma un sistema cristalino cúbico simple. La distancia entre los átomos de Po vecinos más próximos en esta estructura es 335 pm. Determine el diámetro del átomo de Po y la densidad de su metal. (PA(Po) = 209 uma; 1pm = 1012m; 1m3 = 106cm3). 167,5 pm y 73,88 g cm 3 (a) 335 pm y 9,23 g cm 3 (b) 335 pm y 18,47 g cm 3 (c) 167,5 pm y 147,75 g cm 3 (d) Ninguna de las anteriores (e) 5) Las fuerzas intermoleculares: a) b) c) d) e) son de naturaleza eléctrica son más débiles que enlaces químicos varían su magnitud dependiendo de la distancia entre las moléculas. explica la formación de los estados líquidos y sólidos. todas las anteriores 6) El grafito es un conductor eléctrico porque: a) es un sólido con enlace metálico. b) es un sólido con interacciones entre iones C+ y C, lo que facilita el transporte de cargas eléctricas. c) es un sólido covalente de carbonos con hibridación sp y posee electrones deslocalizados capaces de conducir. d) es un sólido covalente de carbonos con hibridación sp2 y posee electrones deslocalizados capaces de conducir. e) es un sólido covalente de carbonos con hibridación sp3 y posee electrones deslocalizados capaces de conducir. 7) ¿Cuál(es) de las sustancias siguientes exhibe(n) fuerzas intermoleculares dipolo-dipolo y enlaces de hidrógeno entre sus moléculas? I HCl II H 2 S III F 2 O IV H 2 O V CH 3 NH 2 a) I, II y V b) solo IV c) III y IV d) I, II y IV e) IV y V 8) La molécula de aleno (CH 2 CCH 2 ) se obtiene indirectamente a partir del petróleo. Indique la hibridación de los átomos de carbono en esta molécula. a) sp2, sp2, sp2 b) sp2, sp, sp2 c) sp3, sp3, sp3 d) sp3, sp2, sp3 e) Ninguna de las anteriores 9) Los siguientes diagramas representan tres compuestos con la misma fórmula molecular C 4 H 8 O 2 . ¿Cuál(es) de ellos puede(n) formar puentes de hidrógeno con moléculas del mismo tipo? ; ¿Cuál tiene la mayor viscosidad? O CH 3 HO H3C HO CH 3 OH O O (I) a) I y II; I (II) b) I y II; II c) Todos; I (III) d) Todos; II e) Todos; III 10) El par de electrones solitario en el azufre en el ión sulfito (SO 3 2) esta en: a) un orbital p b) un orbital s c) un orbital híbrido sp3 d) un orbital híbrido sp2 e) Ninguna de las anteriores. 11) La presión de vapor de cuatro sustancias, en función de la temperatura, se muestra en el siguiente gráfico. Si la presión atmosférica fuera 80 kPa, ¿Cuáles sustancias hervirían a 60 °C? a) b) c) d) Cloroformo Cloroformo y Etanol Cloroformo, Etanol, y Agua Cloroformo, Etanol, Agua y Ácido Etanoico, e) Ninguna de ellas. 12) ¿Cuáles de las moléculas siguientes tienen un momento dipolar diferente de cero y un átomo central con hibridación sp3? a) CCl 4 b) BF 3 c) CHCl 3 d) BrF 3 e) C 2 H 4 13) En la galaxia NGX34, los orbitales moleculares de todas las moléculas siguen siempre el mismo orden: 1 , 1 *, 2 , 2 *, , p , *, p *, …..Allí, existe una especie química AB que se sabe puede estar formada por N, C y/o O. Si esta especie captura un electrón, entonces el ión AB tiene un enlace más corto, luego esta especie es: a) N 2 b) CO c) NO d) CN e) O 2 14) ¿Cuál(es) de las siguientes propiedades corresponde(n) a los cristales iónicos a presión normal? I) T ebullición bajos II) T ebullición altos III) Como sólidos son malos conductores, mientras que como líquidos conducen. IV) Como sólidos y líquidos son conductores. V) Ni como sólidos ni como líquidos conducen. a) Todas b) I y IV c) I y III d) II y III e) II y IV 15) Los electrones de mayor energía de un semiconductor a temperatura ambiente: a) b) c) d) e) están en estados de carácter enlazante. están en estados de carácter antienlazante. están en estados de carácter no enlazante. están exclusivamente en estados . están exclusivamente en estados . 16) Las fuerzas atractivas intermoleculares en la sustancia I son más fuertes que en la sustancia II. Por lo tanto: a) b) c) d) e) I tiene una presión de vapor más baja que II I tiene un calor de la vaporización más bajo que II I tiene un punto de fusión más bajo que II I tiene un punto de ebullición más bajo que II todas las anteriores 17) Asumiendo que una molécula de N 2 absorbe un fotón y sufre una transición a su primer estado excitado, entonces: (indique la alternativa correcta) a) El N 2 excitado es menos estable que el N 2 en el estado fundamental. b) El N 2 excitado es más estable que el N 2 en el estado fundamental. c) La longitud de enlace del N 2 en el estado excitado es más corta que la longitud de enlace del N 2 en el estado fundamental. d) b y c son ambos verdaderos. e) La molécula excitada se romperá en dos átomos de nitrógeno. 18) El calor de vaporización de CH 3 COCH 3 es 29,1 (kJ mol1). Complete la siguiente tabla: T (K) p (Torr) --86,59 220,69 4,05 a) 332,25 b) 184,97 d) -3,66103 c) 273,50 e) no se puede determinar 19) ¿Cuál de las siguientes especies posee orbitales moleculares deslocalizados? a) b) c) d) e) NO 3 CO 3 2 NH 4 + HO a y b 20) ¿Cuál es el diagrama orbital para la molécula C 2 en su estado fundamental? (b) (a) (c) (d) (e) 21) El Sodio y el Bario metálicos tienen una estructura cúbica centrada en el cuerpo. La longitud de la arista, a, de las celdas unitarias son: a Na = 4,29108 cm y a Ba = 5,04108 cm. La relación entre sus densidades Na / Ba es: a) 0,104 b) 0,197 c) 1,622 d) 0,271 e) 0,168 22) Para la molécula heteronuclear NO, cuál de las afirmaciones siguientes es incorrecta. a) es paramagnético b) El orden de enlace es 2,5. c) tiene cinco electrones antienlazantes. d) es menos estable que O 2 porque tiene un orden de enlace más bajo. e) Ninguna de las anteriores es incorrecta. 23) ¿Cuál es el estado de hibridación del átomo central de N en el ión azida N 3 ? a) sp b) sp2 c) sp3 d) sp3d e) Ninguna de las anteriores 24) El diagrama de fase para una sustancia pura se muestra en la figura adjunta. El punto triple ocurre a 43 atm. y 590º C . ¿Cuál será la única posible transición de fase que ocurrirá al disminuir la presión desde 50 atm y mantener la temperatura constante a 500ºC? a) b) c) d) e) vaporización condensación sublimación fusión cristalización p sólido líquido gas T 25) Respecto a las especies NO+, y N 2 +, ¿Cuál de las siguientes afirmaciones es verdadera? a) b) c) d) e) Ambas moléculas son paramagnéticas La distancia de enlace es más corta en el caso de N 2 + NO+ tiene 3 electrones en orbitales antienlazantes N 2 + es diamagnética Ninguna de las anteriores 26) ¿Cuál de las siguientes afirmaciones es falsa? a) b) c) d) e) El diamante corresponde a un sólido covalente El punto de fusión del NaCl(s) es mayor que el de C 4 H 10 (s) La conductividad eléctrica de los metales aumenta con la temperatura El NaCl líquido es capaz de conducir electricidad Ninguna de las anteriores 27) ¿Cuál de las siguientes afirmaciones es falsa? a) b) c) d) e) La teoría de orbitales moleculares permite saber si una molécula es paramagnética La distancia de enlace es directamente proporcional a la energía de enlace Un orbital * 2s tiene menor energía que un 2p El orden de enlace se correlaciona con la estabilidad de la molécula Ninguna de las anteriores 28) Si un átomo del grupo III se utiliza como impureza o dopante en un semiconductor del grupo IV, la conductividad aumenta porque: a) b) c) d) e) Aumenta el número de electrones libres. Se altera la geometría del cristal del semiconductor. Se aumenta la energía de la brecha entre bandas (band gap). Aumenta el número de huecos de carga positiva en el cristal del semiconductor. Falso, la conductividad disminuye. 29) Un sólido cristalino contiene tres tipos de iones, Na+, O2 y Cl. Las celdas unitarias de este sólido son cúbicas, con iones O2 en los vértices, iones Na+ en los centros de las caras e iones Cl en el centro de las celdas. ¿Cuál es la formula química de este compuesto?. Si la longitud de la arista de la celda es “a”, ¿Cuál es la distancia más corta desde el centro de un ion Na+ al centro de un ión O2? Na 3 OCl a/2 (b) Na 2 OCl a/2 (a) Na 2 OCl a/ 2 (c) Na 3 OCl a/ 2 (d) Ninguna de las anteriores (e) 30) ¿Cuál de los siguientes casos no corresponde a fuerzas intermoleculares: a) Fuerzas que previenen que el aceite se evapore a temperatura ambiente. b) Fuerzas que permiten que el benceno líquido cristalice al enfriarse. c) Fuerzas que impiden que el O 2 del aire forme átomos de O. d) Fuerzas responsables por el bajo punto de ebullición del hexano. e) Fuerzas que impiden que la mantequilla se derrita en el refrigerador. 31) En los siguientes pares de moléculas indique cuál especie tiene la mayor presión de vapor, respectivamente. (I) C 2 H 6 o C 4 H 10 C 4 H 10 , CH 3 CH 2 F, NH 3 (a) (II) CH 3 CH 2 OH o CH 3 CH 2 F C 2 H 6 , CH 3 CH 2 F, NH 3 (b) C2H6, CH 3 CH 2 OH, PH 3 (c) (III) NH 3 o PH 3 C 2 H 6 , CH 3 CH 2 F, PH 3 (d) C 4 H 10 , CH 3 CH 2 OH, NH 3 (e) 32) Cierto metal cristaliza en una red cúbica. La longitud de la arista, a, del cubo es: a = 2.87108 cm y su densidad es 7,9 (g cm 3). Su masa atómica es 55,9 (g mol 1). ¿Cuántos átomos hay en la celda unitaria ? a) 1 b) 4 c) 2 d) 12 e) 8 33) De las siguientes características del agua líquida: i) viscosidad, ii) tensión superficial, iii) temperatura de fusión, iv) presión de vapor; la(s) que permite(n) que un insecto "camine" sobre su superficie es(son): a) b) c) d) e) i) y ii) solo ii) solo iii) ii) y iv) Ninguna de las anteriores. 34) En la galaxia NGX33, las energías de los orbitales moleculares de todas las moléculas siguen siempre el mismo orden: 1 < 1 *< 2 < 2 *< p <<*< p *,…. En esta galaxia, las reglas cuánticas han cambiado y permiten que haya 3 electrones por orbital. El orden de enlace se define ahora como 1/3 [e(enlazantes) e(antienlazantes)], entonces el orden de enlace de NO y O 2 es respectivamente: a) 2/3 y 4/3 b) 1 y 1/3 c) 1 y 4/3 d) 1/3 y 1 d) 2 y 4/3 35) La figura muestra el diagrama de fase del CO 2 , para el cual se sabe que H vap = 25127 (J mol1) y H sub = 33756 (J mol1). Se envía una cápsula que contiene CO 2 (g) al planeta X de la galaxia NGC52 donde la presión atmosférica es 10 atm, y la temperatura ambiente es 250 K. Una vez equilibradas las presiones y temperaturas dentro de la cápsula con las del planeta; entonces, en el interior de la cápsula: 73 CO 2 (l) p (atm) CO 2 (s) 5,11 a) el CO 2 se licúa totalmente b) el CO 2 solidifica totalmente c) el CO 2 permanece gaseoso d) coexisten las fases CO 2 (liq) con CO 2 (g) e) coexisten las fases CO 2 (liq) con CO 2 (s) CO 2 (g) 56,4 T (°C) 31,1 36) ¿Cuál(es) de los siguientes compuestos es(son) más probablemente iónico(s)? I a) b) c) d) e) PCl 3 I y IV solo I solo IV II y V solo III II H 2 CO III N2H4 IV CaCl 2 V CH 3 Cl Datos: N o = 6,021023 [partículasmol1]; h = 6,631027 [ergs]; R = 1,98 [calmol1K1] = 8,314 [Jmol1 K1]; R H = 2,181018 [J] = 109677 [cm1] = 13,6 [eV] = 313,6 [kcalmol1] ; = 3,1416 m e = 9,11028 [g] ; m p = 1,6731024 [g] ; m n = 1,6751024 [g] ; carga electrón = 1,61019 [C] 1 2 H He 1.008 3 II III IV V VI VII 4 5 6 7 8 9 N O F Li Be B C 6.941 11 9.012 12 10.811 13 12.011 14 Na Mg 24.305 20 21 22 23 24 25 26 27 28 29 30 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.098 37 40.078 38 44.956 39 47.867 40 50.942 41 51.996 42 58.693 46 63.546 47 65.39 48 69.723 49 72.64 50 74.922 51 78.96 52 79.904 53 83.80 54 Pd Ag Cd In Sn Sb Te I Xe 4B 5B 6B 7B 8B 54.938 55.845 58.933 43 44 45 Rb Sr Y Zr Nb Mo Tc 85.468 55 87.62 56 88.906 57 91.224 72 92.906 73 95.94 74 (98) 75 Cs Ba La Hf Ta W Re 132.905 137.327 138.906 87 88 89 8B Ru Rh 8B 1B 2B Al Si 28.086 32 P S Cl Ne 20.180 18 22.990 19 3B 26.982 31 14.007 15.999 18.998 17 15 16 4.003 10 30.974 32.065 35.453 35 33 34 Ar 39.948 36 101.07 102.906 106.42 107.868 112.411 114.818 118.710 121.760 127.60 126.904 131.293 76 83 84 86 77 78 79 80 81 82 85 Os Ir Pt Au 178.49 180.948 183.84 186.207 190.23 192.217 195.078 196.967 109 104 105 106 107 108 110 111 Hg Tl Pb Bi Po At Rn 200.59 112 204.383 207.2 114 208.980 (209) 116 (210) (222) 118 Fr Ra Ac Rf Db Sg Bh Hs Mt Uun Uuu Uub Uuq Uuh Uuo (223) (226) (227) (261) (262) (266) (264) (277) (268) (281) (289) (289) (293) (272) (285) CM 1A1- QUIMICA Control-2 (2008/2) USE SOLO LAPIZ PASTA para marcar su respuesta Nombre:. Forma A a 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 b c d e a 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 b c d e NOTA: CADA PREGUNTA CORRECTA VALE 1/6 PUNTO CADA PREGUNTA INCORRECTA DESCUENTA 1/18 PUNTO CM 1A1 QUIMICA Control 3 (2008/2). Nombre: Forma A 1) Considerando las siguientes reacciones: H 2 ( g ) + 21 O2 ( g ) ⎯⎯→ H 2O( l ) ΔH o = −285,8( kJ ) C 3 H 4 ( g ) + 4O 2 ( g ) ⎯⎯→ 3CO 2 ( g ) + 2H 2O( l ) ΔH o = −1937( kJ ) C 3 H 8 ( g ) + 5O2 ( g ) ⎯⎯→ 3CO 2 ( g ) + 4H 2O( l ) ΔH o = −2219 ,1( kJ ) Se puede determinar que ΔH° para la reacción C 3 H 4 ( g ) + 2H 2 ( g ) ⎯⎯→ C 3 H 8 ( g ) es: 2219,1 (kJ) (a) −3,7 (kJ) (b) −289,5 (kJ) (c) −853,7 (kJ) (d) 567,9 (kJ) (e) 2) Se desea preparar una disolución 0,01 M de H2SO4 en agua. Se cuenta con una solución ¿Qué volumen de la solución concentrada se concentrada 2 M y un matraz aforado a 500 cm3. deberá usar? (a) 5 cm3 (b) 2,5 cm3 (c) 10 cm3 (d) 1,0 cm3 3) Si la constante de acidez Ka para un ácido, HA, es 8×10−4 a 25 °C. está disociado en una solución de HA 0,50 M a 25 °C? (a) 0,08% (b) 0,2% (c) 1% (e) 0,5 cm3 ¿Qué porcentaje del ácido (d) 2% (e) 4% 4) Calcule el cambio de entalpía cuando se transforma un mol de agua que está a +10 °C en hielo a −10 °C, a la presión de 1 atmósfera. ΔH fus = 6,03 ( kJ mol −1 ) ; c p (H 2O( l )) = 75,3 ( J mol −1K −1 ) ; c p (H 2O(s )) = 36,8 (J mol −1K −1 ) 7,151 (kJ) (a) −6,030 (kJ) (b) −7,151 (kJ) (d) 3,576 (kJ) (c) 6,030 (kJ) (e) 5) El hidróxido de magnesio es una base fuerte. Calcular [Mg2+] y [OH−] para una solución que se prepara disolviendo 3,2×10−5 moles de hidróxido de magnesio en 100,0 mL de agua. (a) 3,2×10−5; 6,4×10−5 (d) 3,2×10−4; 3,2×10−4 (b) 1,6×10−3; 3,2×10−3 (e) 3,2×10−4; 6,4×10−4 (c) 3,2×10−5; 3,2×10−5 6) ¿Cuál es la concentración de NH4+ en una solución que es 0,10 M NH3 y 0.20 M NaOH? NH3, Kb = 1,8×10−5. (a) (b) (c) (d) (e) Para 3,6×10−5 M 9,0×10−6 M 2,3×10−3 M 1,3×10−3 M 5,4×10−6 M 7) El carbamato de amonio se descompone según: NH 4CO 2 NH 2 ( s ) 2NH 3 ( g ) + CO 2 ( g ) entonces, la razón (Kp/Kc) es: (a) (RT)3 (b) (RT)1/2 (c) (RT)−3 (d) (RT)2 (e) (RT)1/3 8) ¿Cuál es la base conjugada de la anilina, C6H5NH2? (a) C6H5NH− (b) C6H5NH3− (c) C6H5NH2+ (d) C6H5NH3+ (e) C6H5NH2− 9) Señale cuál de las siguientes expresiones para el calor de una reacción química es cierta, independientemente de cómo se realice la reacción. ∆E (b) qP (a) ∆E − W (d) qv (c) ∆H (e) 10) El pH de una solución afecta su poder corrosivo sobre ciertos metales. ¿Cuál de las siguientes soluciones tiene el mayor pH?. (a) (b) (c) (d) (e) 0,010 M HCl 0,010 M CH3COOH 0,010 M NaOH 0,010 M N H3 todas tienen el mismo pH. 11) El sustituto del gas natural (SGN) es una mezcla de gases que contiene CH4(g) y que puede utilizarse como combustible. Una reacción para obtener esta mezcla es: 4CO(g) + 8H2(g) → 3 CH4(g) + CO2(g) + 2H2O(l) Utilizando los datos adecuados de entre los que se dan a continuación, calcule el ∆Ho para la reacción de obtención del SGN. C(grafito) + ½ O2(g) → CO(g) CO(g) + ½ O2(g) → CO2(g) H2(g) + ½ O2(g) → H2O(l) C(grafito) + 2H2(g) → CH4(g) CH4(g) + 2O2(g) → CO2 (g) + 2H2O(l) Falta información (a) −968,53 (kJ mol−1) (b) ∆Ho = −110,5 (kJ mol−1) ∆Ho = −283,0 (kJ mol−1) ∆Ho = −285,8 (kJ mol−1) ∆Ho = −74,81 (kJ mol−1) ∆Ho = −890,3 (kJ mol−1) −533,1 (kJ mol−1) (c) −654,13 (kJ mol−1) (d) −747,53 (kJ mol−1) (e) 12) ¿Cuál(es) de los siguientes esquemas podría(n) representar un sistema que ha alcanzado el equilibrio? concentración concentración tiempo tiempo (I) (II) concentración concentración (a) (II), (III) y (IV) tiempo tiempo (III) (IV) (b) (I) (c) (II) y (III) (d) (I) y (II) (e) sólo (III) 13) ¿Cuál es el pH de una solución de 0,49 M de ácido y 0,29 M de su base conjugada, si la constante de ionización es 5,92×10−8? (a) 7,72 (b) 7,46 (c) 7,00 (d) 8,21 (e) 7,98 14) El ácido fluoroacético, uno de los ácidos más venenosos conocidos, se encuentra en una variedad de marihuana. Una disolución 0,318 M de este ácido tiene un pH = 1,57. Calcule el valor de Ka para el ácido fluoroacético. CH2FCOOH(aq) + H2O H3O+(aq) + CH2FCOO (aq) 9,6×10−2 (a) 2,8×10−2 (b) 2,6×10−3 (c) 2,5×10−3 (d) Se requiere más información (e) 15) El calor de combustión del 2-propanol, C3H8O(l), a volumen constante y a 298,15 K es −33,41(kJ g−1) (suponiendo que los productos son CO2(g) y H2O(l)). Determine los valores de ∆E y ∆H para la combustión de un mol de 2-propanol. Dato: PM(C3H8O) = 60,11 (g mol−1), PV = nRT con R = 0,0083145 (kJ mol−1 K−1) -2008,3 (kJ mol−1) -2004,6 (kJ mol−1) (a) -0,56 (kJ mol−1) -4,28 (kJ mol−1) (b) -2008,3 (kJ mol−1) -2012 (kJ mol−1) (c) -0,56 (kJ mol−1) -3,16 (kJ mol−1) (d) -2008,3 (kJ mol−1) -2010,8 (kJ mol−1) (e) 16) Dado que Kw para agua es 2,4×10−14 M2 a 37oC, calcular la suma de pOH y pH para una solución acuosa neutra a 37 oC (temperatura normal del cuerpo humano). (a) 13,62 (b) 14,00 (c) 14,21 (d) 13,81 (e) 14,42 17) Basado en la siguiente información: H2(g) + ½ O2(g) → H2O(l) 2 Na(s) + ½ O2(g) → Na2O(s) Na(s) + ½ O2(g) + ½ H2(g) → NaOH(s) ∆Ho = x ∆Ho = y ∆Ho = z ¿Cuál es la entalpía estándar para la siguiente reacción?: (a) x + y + z (b) x + y − z (c) x + y − 2z Na2O(s) + H2O(l) → 2 NaOH(s) (d) 2z − x − y (e) z − x − y 18) De las siguientes especies, todas pueden ser consideradas bases de Brønsted, excepto: (a) (b) (c) (d) (e) H2O NH3 HCO3− CO32− todas funcionan como bases de Brønsted. 19) El calor de combustión de alcanfor (C10H16O) es 5903,6 (kJ mol−1). Una muestra de alcanfor de masa 0,1204 g se quema en una bomba calorimétrica. La temperatura aumenta en 2,28 °C. ¿Cuál es la capacidad calorífica (kJ K−1) del calorímetro? (a) 2,46 (b) 1,77 (c) 1,93 (d) 2,05 (e) 2,21 20) ¿Qué afirmación es correcta en la siguiente ecuación termoquímica?: CS2(l) + 3O2(g) → CO2(g) + 2SO2(g) ∆H = −1075 (kJ) (a) Esta reacción es endotérmica (b) Para consumir completamente 1 mol de CS2 se deben absorber 1075 kJ de energía térmica en la reacción. (c) 1075 (kJ) de energía térmica se liberan por mol de SO2 producido. (d) al formar 1 mol de CO2 , 1075 (kJ) de energía térmica se liberan. (e) Esta ecuación corresponde a la reacción de formación del SO2(g) 21) ¿Qué cantidad de propionato de sodio, CH3CH2COONa, tiene que disolverse en 0,500 L de CH3CH2COOH 0,525 M para producir una solución buffer con pH = 4,75? Considere que no hay cambio en el volumen. CH3CH2COOH + H2O H3O+ + CH3CH2COO− Ka = 1,3×10−5 (a) (b) (c) (d) (e) 0,19 g CH3CH2COONa 18 g CH3CH2COONa 0,38 g CH3CH2COONa 37 g CH3CH2COONa 14 g CH3CH2COONa 22) Una muestra de 1,00 g de NH4NO3 se descompone en una bomba calorimétrica. La temperatura del calorímetro aumenta 6,12 °C. La capacidad calorífica de la bomba es 1,23 (kJ K−1). ¿Cuál es el calor molar de la descomposición de NH4NO3? −7,53 (kJ mol−1) (a) −16,1 (kJ mol−1) (b) −602,5 (kJ mol−1) (c) −398 (kJ mol−1) (d) −1205 (kJ mol−1) (e) 23) En una bomba calorimétrica, se coloca 1 mol del aceite de una planta tropical y se realiza su combustión bajo una presión de 23000 (torr) de oxígeno. ¿Cuál de las siguientes aseveraciones es incorrecta? (a) la temperatura del calorímetro debe aumentar. (b) el agitador aumenta la temperatura de la bomba calorimétrica de manera despreciable. (c) la pared metálica de la bomba absorbe parte del calor de la combustión. (d) el agua de la bomba calorimétrica absorbe parte del calor de la combustión. (e) hay mucho oxígeno en la bomba y éste absorbe casi todo el calor de la combustión. 24) La reacción: Fe2O3(s) + 3H2(g) → 2Fe(s) + 3H2O(l) , tiene ΔHrxn = −35,1 (kJ) a la temperatura de 25ºC. Para esta reacción, la temperatura, cuando ΔHrxn = −28,5 (kJ), a presión constante, será: Datos: Compuesto: Fe2O3(s) Fe(s) H2(g) H2O(l) (a) 54 ºC Cp (J mol−1 K−1) 104,5 25,5 28,9 75,3 (b) 35 ºC (c) 102 °C (d) 79 °C (e) 139 °C 25) Considere el equilibrio: HgO(s) + 4 I − + H2O HgI42− + 2 OH− ; ΔH < 0 ¿Cuál de los siguientes cambios aumentará la concentración de HgI42−? (a) (b) (c) (d) (e) aumento de la concentración de OH− aumento de la temperatura aumento de la masa de HgO presente agregar 6 M HNO3 agregar un catalizador 26) La energía interna de una determinada cantidad de un gas ideal depende solamente de la temperatura. Si se permite que una muestra de este gas se expanda a temperatura constante ¿Cuál de las siguientes afirmaciones es falsa? (a) (b) (c) (d) (e) El gas realiza trabajo El gas no intercambia calor con los alrededores El valor de ∆E para el gas es igual a 0 La presión del gas disminuye Ninguna de las anteriores 27) Un ingeniero que estudia la oxidación del SO2 en la manufactura de ácido sulfúrico determina que K C = 1,7 × 10 8 a 600 K. 2SO 2 ( g ) + O 2 ( g ) 2SO 3 ( g ) En el equilibrio pSO3 = 300( atm ) y pO2 = 100( atm ) . Calcule pSO2 . 8,682×10−7 atm (a) 2,605×10−4 atm (b) 0,0161 atm 0,0003 atm 0,1076 atm (c) (d) (e) 28) Una barra de hierro de 400,0 g es calentada y luego puesta en un recipiente aislado que contenía 1,00 L de agua a 20,0 oC. La temperatura final, luego de que se alcanzó el equilibrio fue de 33,5oC. ¿Cuál era la temperatura (K) de la barra de hierro? Datos: calor específico del hierro es 25,10 (J g−1 K−1); calor específico del agua es 4,184 (J g−1 K−1). (a) 349 (b) 334 (c) 368 (d) 385 (e) 312 29) ¿Qué cambios ocurrirán en la siguiente reacción si se agregaran algunas gotas de HCl? CH3CO2− + H3O+ CH3CO2H + H2O (a) (b) (c) (d) (e) Decrece la fracción de ácido disociado Crece la fracción de ácido disociado Aumenta el pH No se observa cambio alguno Nada puede decirse 30) Para el sistema en equilibrio CO ( g ) + Fe 3O 4 ( g ) CO 2 ( g ) + 3FeO ( s ) . siguientes perturbaciones desplaza el equilibrio hacia la formación de productos?: I II III IV ¿Cuál(es) de las Adición de CO al sistema Remoción de CO2 al agregar NaOH sólido Adición de Fe3O4 al sistema Aumento de la presión del sistema II y III I y III I, III y IV I, II y III Todas las anteriores (a) (b) (c) (d) (e) 31) Una tabla da dos valores distintos para el calor de combustión del hidrógeno. H 2 ( g ) + 21 O2 ( g ) ⎯⎯→ H 2O( l ) ΔH o = −33,88( kcal / g H 2 ) ( 2 ) H 2 ( g ) + 21 O2 ( g ) ⎯⎯→ H 2O( g ) ΔH o = −28,67( kcal / g H 2 ) ( 1) Esta diferencia se debe a: (a) (b) (c) (d) (e) El calor de combustión está asociado al H2 en gramos en vez de moles. La diferencia corresponde a la entalpía de vaporización del agua. La reacción (2) implica un cambio de presión en el sistema. La reacción (1) implica un cambio de volumen en el sistema. Debe haber un error en la tabla 32) ¿Cuál de las siguientes reacciones no está correctamente emparejada con la expresión de la constante de equilibrio indicada en cada caso? (a) C(grafito) + CO2(g) (b) 4 CuO(s) 2 Cu2O(s) + O2(g) (c) CO(g) + H2O(g) (d) H2S(g) + I2(s) (e) NH4HS(s) 2 CO(g) [CO]2 [CO2 ] = [O 2 ] KC = KC CO2(g) + H2(g) K p = 2 HI(g) + S(s) NH3(g) + H2S(g) KC = pCO × pH2O pCO2 × pH2 [HI ]2 [H 2S ] K p = pNH3 × pH2S 33) ¿Cuál de las siguientes afirmaciones es verdadera? (a) (b) (c) (d) (e) q = ΔH a presión constante y q = ΔE a temperatura constante q = ΔH a temperatura constante y q = ΔE a volumen constante q = ΔH a volumen constante y q = ΔE a presión constante q = ΔH a presión constante y q = ΔE a volumen constante ninguna de las anteriores 34) Dados los valores de Ka de 5,6×10−10 y 1,7×10−5 para NH4+ y CH3CO2H , respectivamente, calcular la constante de equilibrio para la siguiente reacción: NH4+ + CH3CO2− (a) 1,7×10 −5 (b) 3,0×10 4 NH3 + CH3CO2H (c) 3,3×10−5 (d) 3,3 (e) 0,30 35) Una disolución acuosa saturada con fenol, C6H5OH, tiene un pH = 4,90. ¿Cuál es la molaridad de fenol en dicha disolución? H3O+ + C6H5O− C6H5OH + H2O Ka = 1,0×10−10 a) [C6H5OH] = 7,9×10−6 M b) [C6H5OH] = 1,6 M c) [C6H5OH] = 1,3×105 M d) [C6H5OH] = 6,3×1019 M e) [C6H5OH] = 0,63 M 36) A 700 °C se prepara una mezcla en la cual pH2S = 0,10 (atm ) , pCH 4 = 0,25 (atm ) , pCS2 = 0,65 (atm ) y pH2 = 0,10 (atm ) . Encuentre Qp. ¿Estará la mezcla en el equilibrio? ¿en qué dirección ocurre la reacción? 2 H2S(g) + CH4(g) (a) (b) (c) (d) (e) CS2(g) + 4 H2(g) Qp = 0,026; no; hacia la izquierda. Qp = 2,6; no; hacia la derecha. Qp = 3,4×10−4; si. Qp = 2,6; no; hacia la izquierda. Qp = 0,026; no; hacia la derecha. A 700 °C: Kp = 3,4×10−4 Si no, Datos: No = 6,02×1023 [partículas×mol−1]; h = 6,63×10−27 [erg×s]; 1 torr = 1 mm Hg ; 1 (atm) = 760 (mm Hg) ; 1 caloría = 4,184 Joule R = 0,0083145 (kJ mol−1 K−1) = 1,98 [cal ×mol−1 K−1] = 8,314 [J ×mol−1 K−1] ; π = 3,1416 1 2 H H 1.008 3 II III IV V VI VII 4 5 6 7 8 9 N O F Li Be B C 6.941 11 9.012 12 10.811 13 12.011 14 Mg 24.305 20 21 22 23 24 25 26 27 28 29 30 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.098 37 40.078 38 44.956 39 47.867 40 50.942 41 51.996 42 58.693 46 63.546 47 65.39 48 69.723 49 72.64 50 74.922 51 78.96 52 79.904 53 83.80 54 Pd Ag Cd In Sn Sb Te I Xe 5B 6B 7B 8B 8B 54.938 55.845 58.933 43 44 45 Rb Sr Y Zr Nb Mo Tc 85.468 55 87.62 56 88.906 57 91.224 72 92.906 73 95.94 74 (98) 75 Cs Ba La Hf Ta W Re Ru Rh 8B 1B 2B Si 28.086 32 P S Cl Ne 20.180 18 Na 4B Al 4.003 10 22.990 19 3B 26.982 31 14.007 15.999 18.998 15 16 17 He 30.974 32.065 35.453 33 34 35 Ar 39.948 36 101.07 102.906 106.42 107.868 112.411 114.818 118.710 121.760 127.60 126.904 131.293 76 77 78 79 80 81 82 83 84 85 86 Os Ir Pt Au Hg Tl 132.905 137.327 138.906 178.49 180.948 183.84 186.207 190.23 192.217 195.078 196.967 200.59 204.383 87 88 89 104 105 106 107 108 109 110 111 112 Po At Rn 207.2 114 Pb 208.980 (209) 116 Bi (210) (222) 118 Fr Ra Ac Rf Db Sg Bh Hs Mt Uun Uuu Uub Uuq Uuh Uuo (223) (226) (227) (261) (262) (266) (264) (277) (268) (281) (289) (289) (293) (272) (285) CM 1A1- QUIMICA Control-3 (2008/2) USE SOLO LAPIZ PASTA para marcar su respuesta Nombre:. Forma A a 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 b c d e a X X X X X X X X X X X X X X X X X X 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 b c d e X X X X X X X X X X X X X X X X X X NOTA: CADA PREGUNTA CORRECTA VALE 1/6 PUNTO CADA PREGUNTA INCORRECTA DESCUENTA 1/18 PUNTO CM 1A1 QUIMICA EXAMEN (2008/2). Nombre: Forma A 1) Indique la hibridación esperada para el átomo de fósforo en PCl6−. (a) (b) (c) (d) (e) sp6 sp3d2 sp3d sp3 s2d2p2 2) La especie química C2 es diamagnética, mientras que la especie B2 es paramagnética (B y C son Boro y Carbono, respectivamente). Entonces el último orbital molecular ocupado en B2 y C2 es, respectivamente: B B (a) σp y π (b) σp y σp (c) π y π (d) π y σp (e) σp y π* 3) El ión oxalato, C 2O42 − , y el ión permanganato, MnO4− , reaccionan en solución acuosa básica, produciendo ión carbonato. La ecuación química no balanceada es: a C2O42− (ac ) + b MnO4− (ac ) + c OH − (ac ) ⎯⎯→ x CO32− (ac ) + y MnO2 (s ) + z H2O(l ) ¿Cuál es la relación (a:b) en la ecuación balanceada? (a) 1:1 (b) 3:1 (c) 5:2 (d) 2:3 (e) 3:2 4) ¿A qué se debe que los semiconductores tengan propiedades eléctricas diferentes a las de los metales? (a) mayor número de electrones de valencia. (b) menor número de electrones de valencia. (c) la existencia de un band gap (separación, brecha) entre las bandas de conducción y de valencia. (d) la existencia de un band gap nulo entre las bandas de conducción y de valencia. (d) no hay diferencias importantes entre ambos tipos de sólidos. 5) El hierro cristaliza en una estructura en la cual el n° de coordinación es 8. ¿Qué estructura describe mejor al cristal? (a) (b) (c) (d) (e) cúbica simple cúbica centrada en el cuerpo cúbica compacta hexagonal compacta ninguna de las anteriores 6) Para el sistema en equilibrio A(g ) + B(g ) ¿Cuál(es) de las siguientes C ( g ) + 3D(s ) . perturbaciones desplaza el equilibrio hacia la formación de productos?: I II III IV Adición de A al sistema Remoción de C. Adición de B al sistema Aumento de la presión del sistema II y III I y III I, III y IV I, II y III Todas las anteriores (a) (b) (c) (d) (e) 7) ¿Cuál es el pH de una solución de 0,49 M de ácido y 0,29 M de su base conjugada, si la constante de ionización (acidez, Ka) es 5,92×10−8? a) 7,72 b) 7,46 c) 7,00 d) 8,21 e) 7,98 8) De las siguientes especies, conducen la corriente eléctrica en estado sólido y/o fundido: I) NaHg (a) (b) (c) (d) (e) II) SiO2 III) Si IV) KBr sólo I sólo II II y III I y IV sólo III 9) ¿Cuál de las siguientes especies experimenta solamente Fuerzas de dispersión? a) NH3 b) CH3−CH3 c) HCl d) CH3OH e) H2O 10) En un sencillo calorímetro a p constante, se colocan 100,0 g de agua a 295,0 K. Una pieza de 20 g. de cobre se calienta a 353,0 K y luego se arroja en el agua del calorímetro. ¿Cuál será la temperatura final del agua? (los calores específicos de agua y cobre son 4,18 y 0,385 (J g–1 K–1), respectivamente) (a) 296,0 K (b) 303,3 K (c) 307,2 K (d) 309,9 K (e) 343,2 K 11) ¿Cuál de las siguientes reacciones se desplazará hacia la derecha ante un incremento de temperatura y de presión? A(s ) + 2B( g ) ↔ C ( g ) + D(s ) A( g ) + 2B( g ) ↔ 2C ( g ) + D( g ) 2 A( g ) + 2B(g ) ↔ 2C (g ) + D(s ) 2 A(s ) + 2B( g ) ↔ 2C ( g ) + 2D( g ) A(s ) + 3B( g ) ↔ 2C ( g ) + D(s ) (a) (b) (c) (d) (e) ΔH = −α ΔH = +α ΔH = +α ΔH = −α ΔH = 0 12) El par de electrones solitario en el átomo de azufre en SO2 está en: (a) (b) (c) (d) (e) un orbital p un orbital s un orbital híbrido sp3 un orbital híbrido sp2 Ninguna de las anteriores. 13) En el I3− la estructura de Lewis muestra tres pares de electrones no compartidos en el átomo central. Esta molécula tiene: (a) (b) (c) (d) (e) una distribución piramidal trigonal de electrones y una geometría molecular lineal. una distribución octaédrica de electrones y una geometría angular. una distribución de bipirámide trigonal de electrones y una geometría molecular lineal. una distribución octaédrica de electrones y una geometría lineal. la molécula no existe. 14) ¿Cuál de las siguientes especies experimenta interacciones dipolo-dipolo? a) H2 b) He c) CO2 d) H2S e) CH4 15) Respecto a las especies NO+, y N2+, ¿Cuál de las siguientes afirmaciones es verdadera? (a) (b) (c) (d) (e) Ambas moléculas son paramagnéticas La distancia de enlace es más corta en el caso de N2+ NO+ tiene 3 electrones en orbitales antienlazantes N2+ es diamagnética Ninguna de las anteriores 16) La figura muestra el diagrama de fase del CO2, para el cual se sabe que ΔHvap = 25127 (J mol−1) y ΔHsubl = 33756 (J mol−1). Se envía una cápsula que contiene CO2(g) al planeta X de la galaxia NGC52 donde la presión atmosférica es 10 atm, y la temperatura ambiente es 250 K. Una vez equilibradas las presiones y temperaturas dentro de la cápsula con las del planeta; entonces, en el interior de la cápsula: 73 CO2(l) p (atm) CO2(s) 5,11 (a) el CO2 se licua totalmente (b) el CO2 solidifica totalmente (c) el CO2 permanece gaseoso (d) coexisten las fases CO2(liq) con CO2(g) (e) coexisten las fases CO2(liq) con CO2(s) CO2(g) −56,4 T (°C) 31,1 17) ¿Cuál de los sólidos siguientes debe tener el punto de fusión más alto? (a) (b) (c) (d) (e) Argón (Ar) Dióxido de azufre (SO2) Metano (CH4) Nitrato de sodio (NaNO3) Agua (H2O) 18) La reacción CH 3CHO ( g ) CH 4 ( g ) + CO( g ) , alcanza el equilibrio en un reactor cerrado. La reacción es endotérmica en el sentido directo (→). ¿Qué ocurre si se agrega algo de CH4 al reactor? (a) Aumentan las cantidades de todas las sustancias, en relación a las cantidades presentes en el equilibrio previo. (b) Aumenta el valor de K. (c) Aumentan las cantidades de CH 3CHO ( g ) y de CO (g ) , en relación a las cantidades presentes en el equilibrio previo. (d) Algo de calor es absorbido por el sistema. (e) Aumentan las cantidades de CH 3CHO ( g ) y de CH 4 ( g ) , en relación a las cantidades presentes en el equilibrio previo. 19) ¿Qué tipo de sólidos se caracterizan por un punto de fusión bajo y conductividad eléctrica baja? (a) (b) (c) (d) (e) Red covalente Iónico Molecular Metálico Iónico y molecular 20) Considere la siguiente celda galvánica: Ni2+(ac) + 2e− → Ni(s) E0 = −0,27 V Cr3+(ac) + 3e−→ Cr(s) E0 = −0,74 V Alambre de platino ¿Cual será el balance de la ecuación de la reacción que ocurre en la celda? (a) 3Ni2+(ac)+ 2Cr → 3Ni + 2Cr3+(ac) (b) 3Ni + 2 Cr3+(ac) → 3Ni2+(ac) + 2Cr (c) Ni + Cr3+(ac) → Ni2+(ac) + Cr (d) 2Ni2+(ac) + 3Cr → 2Ni + 3Cr3+(ac) (e) Ni2+(ac) + Cr → Ni + Cr3+(ac) Cr(s) puente salino 1M Cr(NO3)3(ac) Ni(s) 1M Ni(NO3)2(ac) 21) ¿Cuál de los siguientes compuestos tiene el mayor punto de ebullición? (a) CF4 (b) CCl4 (c) SiF4 (d) SiBr4 (e) SiH4 22) ¿Cuál de las siguientes substancias es el agente reductor más fuerte en el estado standard? datos: F2 (g ) + 2e − ⎯⎯→ 2F − (ac )E 0 = +2,9V Cu + (ac ) + e − ⎯⎯→ Cu(s )E 0 = +0,5V Al 3 + (ac ) + 3e − ⎯⎯→ Al (s )E 0 = −1,7V (a) F − (ac) (b) Cu+(ac) (c) Al3+(ac) 23) ¿Cuál es el ΔH0 para la reacción? : datos: ΔH f0 (NH3 (g )) = −46,19(kJmol −1 ) (d) Al(s) (e) Cu(s) 4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(l ) ΔH f0 (NO(g )) = 90,37(kJmol −1 ) ΔH f0 (H 2O(l )) = −285,85(kJmol −1 ) +984,10 (kJ) (a) −149,29 (kJ) (b) −241,67 (kJ) (c) −622,62 (kJ) (d) −1168,9 (kJ) (e) 24) El calor de combustión del C(s) es 394 (kJ) por mol y el calor de combustión del CO(g) es de 111 (kJ) por mol. ¿Cuál es el ΔH para la reacción siguiente?: 2C(s ) + O2 (g ) ⎯⎯→ 2CO(g ) (a) 566 (kJ) (b) +283 (kJ) (c) +566 (kJ) (d) 283 (kJ) (e) 505 (kJ) 25) ¿Cuál es el pH de una solución acuosa saturada de Ca(OH)2 a 25 °C? datos: Kps (Ca(OH)2) = 6,5×10−6 ; Kw = 1,0×10−14 (a) 11,93 (b) 12,37 (c) 13,07 (d) 11,41 (e) 8,81 26) Respecto de la estructura mostrada, ¿Cual de las siguientes aseveraciones es verdadera? (no se muestran pares electrónicos solitarios). (a) (b) (c) (d) (e) La hibridación de N es sp3. El ángulo H-N-H es 120°. Esta molécula tiene nueve enlaces σ (sigma). El átomo de carbono enlazado a oxígeno tiene hibridación sp3. Esta molécula tiene dos enlaces π (pi). 27) Dado que: Mg 2 + (ac ) + 2F − (ac ) K = 7,1×10−9 MgF2 (s ) HF (ac ) H + (ac ) + F − (ac ) K = 6,6×10-4 ¿Cuál será K para la reacción: MgF2 (s ) + 2H + (ac ) (a) 1,6×10-(2 (b) 1,3(10(3 Mg 2 + (ac ) + 2HF (ac ) ? (c) 1,1(10(5 (d) 4,7(10(12 (e) 3,1(10(15 28) El calor de combustión del 2-propanol, C3H8O(l), a volumen constante y a 298,15 K es −33,41(kJ g−1) (suponiendo que los productos son CO2(g) y H2O(l)). Determine los valores de ∆E y ∆H para la combustión de un mol de 2-propanol. dato: PM(C3H8O) = 60,11 (g mol−1), PV = nRT con R = 0,0083145 (kJ mol−1 K−1) -2008,3 (kJ mol−1) -2004,6 (kJ mol−1) (a) -0,56 (kJ mol−1) -4,28 (kJ mol−1) (b) -2008,3 (kJ mol−1) -2012 (kJ mol−1) (c) -0,56 (kJ mol−1) -3,16 (kJ mol−1) (d) -2008,3 (kJ mol−1) -2010,8 (kJ mol−1) (e) 29) En cual de los siguientes compuestos el Iodo tiene un estado de oxidación +3? (a) HIO3 (b) HOI (c) NaI3 (d) CrI3 (e) NaIO2 30) ¿Cuál(es) de las siguientes reacciones es(son) reacción(es) de óxido-reducción? (I) H 2CO3 (ac ) ⎯⎯→ H 2O(l ) + CO2 (g ) (II) 2Li (s ) + H 2O(l ) ⎯⎯→ 2LiOH (ac ) + H 2 (g ) (III) 4 Ag (s ) + PtCl 4 (ac ) ⎯⎯→ 4 AgCl (s ) + Pt (s ) (IV) 2HClO4 (ac ) + Ca(OH ) 2 (ac ) ⎯⎯→ 2H 2O(l ) + Ca(ClO4 ) 2 (ac ) (a) (b) (c) (d) (e) I y III II y III II y IV III y IV I , II , III y IV 31) ¿Cuál es la solubilidad molar de PbI2 en agua, si Kps = 3,2×10−8 ? (a) (b) (c) (d) (e) 1,6×10−5 (mol L−1) 1,6×10−4 (mol L−1) 4,0×10−4 (mol L−1) 2,0×10−3 (mol L−1) 3,2×10−8 (mol L−1) 32) El ión oxalato, C2O42− tiene los dos carbones enlazados entre si y cada carbón enlazado a dos oxígenos, entonces los ángulos O-C-O y O-C-C son: 109,5° y 109,5° (a) 120° y 120° (b) 109,5° y 120° (c) 120° y 109,5° (d) ninguno de los anteriores (e) 33) ¿Cuál será el pH del ácido fórmico, HCOOH(ac), en concentración 0,015 (mol L−1) a 25 °C? datos: HCOOH es un ácido monoprótico, Ka (HCOOH) = 1,9×10−4 , Kw = 1,0 10−14. (a) 6,82 (b) 5,55 (c) 3,72 (d) 2,80 (e) 1,82 34) ¿Qué masa de Cobre sólido, inicialmente a 25 °C, debe colocarse en contacto con 100 g. De vapor de agua, inicialmente a 100 °C, si se desea condensar exactamente la mitad de la masa del vapor? datos: calor específico del Cobre es 0,385 (J g–1 K–1), ΔH vap (H 2O ) = 2257(Jg −1 ) . (a) 30 g (b) 1,1 kg (c) 1,5 kg (d) 2,2 kg (e) 3,9 kg 35) Cuál de los siguientes compuestos no exhibe resonancia? (a) H2O2 (b) NO2− (c) SO3 (d) O3 (e) CO32− 36) A una temperatura particular, la constante de equilibrio para la reacción indicada es KC = 4,0 CO 2 ( g ) + NO( g ) CO( g ) + NO 2 ( g ) Si se colocan 4,0 moles de CO2 y 4,0 moles de NO dentro de un reactor con V = 1,0 L, ¿cuál es la concentración de equilibrio de CO ?. (a) (b) (c) (d) (e) 1,4 (mol L−1) 2,7 (mol L−1) 3,2 (mol L−1) 4,0 (mol L−1) 0,38 (mol L−1) Datos: No = 6,02×1023 [partículas×mol−1]; h = 6,63×10−27 [erg×s]; c = 3,0×1010 [cm×seg−1] 1 torr = 1 mm Hg ; 1 (atm) = 760 (mm Hg) ; 1 caloría = 4,184 Joule R = 0,0083145 (kJ mol−1 K−1) = 1,98 [cal ×mol−1 K−1] = 8,314 [J ×mol−1 K−1] = 0,082 (L atm mol−1 K−1) RH = 2,18×10−18 [J] = 109677 [cm−1] = 13,6 [eV] = 313,6 [kcal×mol−1] ; π = 3,1416 me = 9,1×10−28 [g] ; mp = 1,673×10−24 [g] ; mn = 1,675×10−24 [g] ; carga electrón = 1,6×10−19 [C] 1 2 H H 1.008 3 II III IV V 4 5 6 7 8 9 N O F Li Be B C 6.941 11 9.012 12 10.811 13 12.011 14 Na Mg 22.990 19 24.305 20 3B 4B 5B 6B 7B 8B 8B 8B 1B 2B 21 22 23 24 25 26 27 28 29 30 Mn Fe Co K Ca Sc Ti V Cr 39.098 37 40.078 38 44.956 39 47.867 40 50.942 41 51.996 42 54.938 55.845 58.933 43 44 45 Rb Sr Y Zr Nb Mo Tc 85.468 55 87.62 56 88.906 57 91.224 72 92.906 73 95.94 74 (98) 75 Cs Ba La Hf Ta W Re Ru Rh Al Si 26.982 31 28.086 32 VI VII S 4.003 10 Ne 14.007 15.999 18.998 15 16 17 P He Cl 20.180 18 Ar 30.974 32.065 35.453 33 34 35 39.948 36 Ni Cu Zn Ga Ge As Se Br Kr 58.693 46 63.546 47 65.39 48 69.723 49 72.64 50 74.922 51 78.96 52 79.904 53 83.80 54 Pd Ag Cd In Sn Sb Te I Xe 101.07 102.906 106.42 107.868 112.411 114.818 118.710 121.760 127.60 126.904 131.293 76 77 78 79 80 81 82 83 84 85 86 Os Ir Pt Au Hg Tl Pb 132.905 137.327 138.906 178.49 180.948 183.84 186.207 190.23 192.217 195.078 196.967 200.59 204.383 87 88 89 104 105 106 107 108 109 110 111 112 Po At Rn 207.2 114 208.980 (209) 116 Bi (210) (222) 118 Fr Ra Ac Rf Db Sg Bh Hs Mt Uun Uuu Uub Uuq Uuh Uuo (223) (226) (227) (261) (262) (266) (264) (277) (268) (289) (289) (293) (281) (272) (285) CM 1A1- QUIMICA EXAMEN (2008/2) USE SOLO LAPIZ PASTA para marcar su respuesta Nombre:. Forma A a 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 b c d e a X X X X X X X X X X X X X X X X X X 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 b c d e X X X X X X X X X X X x x x x x x x NOTA: CADA PREGUNTA CORRECTA VALE 1/6 PUNTO CADA PREGUNTA INCORRECTA DESCUENTA 1/18 PUNTO CONTROL 1 ( 01/09/2007) QUÍMICA CM1A1 Dpto. Ciencia de los Materiales 1. 2.3.4.5.- 2 1 1 1 2 NOMBRE:………………………………………………………………………... 1 NaHCO 3 => (NH 4 ) 2 Cr 2 O 7 => 3/2 C 2 H 3 O 2 Br + CaCO 3 + C 2 H 3 Cl + 1 Na 2 CO 3 + 1 N2 + 2 O2 = 1 H 2 SO 4 => 11/ O 2 => 4 1 4 1 CO 2 + 1 H2O + 1 CO 2 + CaSO 4 + CO 2 + 3 H2O Cr 2 O 3 1 H2O + 1 H2O + H2O + 1 HBr 1 CO 2 Cl 2 6. Marque la opción incorrecta. En el caso del Efecto Fotoeléctrico, “cuando se supera la frecuencia umbral” , se puede decir que: a) Mientras mayor sea de la luz incidente, mayor será la velocidad de los electrones emitidos. b) Mientras mayor sea la intensidad de la luz incidente, mayor número de electrones se emitirán por segundo. c) Mientras menor sea de la luz incidente, mayor será la velocidad de los electrones emitidos. d) Mientras mayor sea la intensidad de la luz incidente, mayor será la velocidad de los electrones emitidos. e) La velocidad de los electrones emitidos no depende de la intensidad de la luz incidente. 7. Marque la opción correcta. El espectro de emisión característico de un elemento se produce cuando: a) el nivel de energía del núcleo aumenta b) los electrones caen a un nivel menor de energía c) los electrones suben a un nivel mayor de energía d) los electrones son emitidos por el átomo e) el electrón colisiona con otros electrones 8. Marque la opción incorrecta. En términos generales, los “orbitales” : a) Corresponden a las soluciones de la ecuación de onda que describe el comportamiento de los electrones en el átomo. b) Se puede interpretar como una zona del espacio alrededor del núcleo donde se encuentra diseminada homogéneamente una carga eléctrica cuyo valor total es igual a la carga de los electrones. c) Son diferentes, según sea el estado cuántico que describe el comportamiento de los electrones en el átomo. d) Se podrían visualizar gráficamente, como la zona del espacio alrededor del núcleo donde existe en total una probabilidad del 90% o 99% (según la convención) de encontrar un electrón con la energía del estado correspondiente al orbital en estudio. e) Tienen tamaño infinito. 9. Marque la opción correcta. La teoría cuántica de la luz establece que: a) la luz está compuesta de partículas discretas llamadas fotones b) la luz está compuesta de partículas discretas llamadas protones c) la luz está compuesta de radiación electromagnética y viaja como onda d) la luz no es onda ni partícula. 10. Cuál de las siguientes aseveraciones no es parte del modelo de átomo de Rutherford. a) el átomo contiene un núcleo denso b) el núcleo contiene toda la carga positiva (protones) c) el diámetro del núcleo es 1x 10–12 cm d) los electrones orbitan el núcleo en orbitales tipo-p e) el número de protones es igual al número de electrones 1+ 11. Determine la configuración electrónica de As a) 1s22s22p63s23p63d104s24p2 b) 1s22s22p63s23p63d94s24p3 c) 1s22s22p63s23p63d104s24p3 2+ 12. Determine la configuración electrónica de Co a) 1s22s22p63s23p63d54s2 b) 1s22s22p63s23p63d64s1 c) 1s22s22p63s23p63d7 13. ¿Cuál es el cambio en energía (en unidades de R H ) que acompaña la transición del electrón en un átomo de hidrógeno entre los niveles n=9 a n= 3? a) 6 b) 2/9 c) 72/81 d) 2/81 e) ninguna de las anteriores 14. De los siguientes conjuntos de n°s cuánticos, indique aquellas que representan soluciones permitidas de la ecuación de onda para el Hidrógeno: conjunto I II III IV V a) b) c) d) e) I, II y III. I, III y V. II y III. IV y V ninguna n 3 4 4 5 5 l 0 1 3 5 5 ml 1 1 -3 0 -3 ms ½ +½ +½ ½ +½ 15. Cuál de los sgtes conjuntos de números cuánticos, n,l,m,s, es legítimo? a) 0, 0, 0, 1/2 b) 8, 4, -3, -1/2 c) 3, 3, 2, +1/2 d) 2, 1, -2, -1/2 e) 5, 3, 3, -1 16. Cuál será la configuración electrónica de un átomo en estado excitado? a) 1s22s1 b) 1s22s22p1 c) 1s22s22p5 d) 1s22s22p23s1 17. Cuál de las siguiente anotaciones representan isótopos del mismo elemento? a) 121 50 Sn y 119 50 Sn b) 19 8O y 9 F19 c) 121 50 Sn y 121 50 Sn d) 17 Cl39 y 19 K 39 18. ¿ Cuál de éstas listas de elementos es aquella en que los elementos están ordenados en orden creciente de carácter metálico? A). Si, P, S B). As, P. N C). Sr, Ca, Mg D). Br, Se, As E). Na, Ne, F 19. ¿ Cuál de éstas listas de elementos es aquella en que los elementos están ordenados en orden decreciente de su primer potencial de ionización? A). Si, P, S B). As, P, N C). Sr, Ca, Mg D). Br, Se, As E). Na, Ne, F 20. ¿ Cuál de éstas listas de elementos es aquella en que los elementos están ordenados en orden decreciente de electronegatividad? A). Si, P, S B). As, P, N C). Sr, Ca, Mg D). Br, Se, As E). Na, Ne, F 21. ¿En cuál de estas listas las especies tienen la misma configuración electrónica? A). Mg, Ca, Sr B). Mg2+, Ca2+, Sr2+ 2 + D). Fe, Co, Ni E). F , S2 , As3 C) S , Cl , K 22.- Cuál de la siguiente lista de átomos o iones está en orden creciente de radios? a) Na+ < Cl < Na < Cl b) Na+ < Na < Cl < Cl c) Na < Na+ < Cl < Cl d) Na < Na+ < Cl < Cl e) Cl < Na < Cl < Na+ 23. Cuál configuración representa un elemento que tiene la mayor primera energía de ionización ( I 1 ) ? a) 1s1 b) 1s2 c) 1s22s1 d) 1s22s2 e) 1s22s22p1 24. La siguiente estructura de Lewis es aceptable para el anión fosfato PO 4 -3 Cual es la carga formal sobre el átomo de fósforo ? a) -3 b) -2 c) -1 d) 0 e) +1 25. Del conjunto de moléculas que se muestran a continuación, ¿Cuáles son lineales? + I) I 3 II) I 3 III) H 2 O IV) CO 2 a) I y II b) II y III c) I y IV d) I,II y IV e) Todas 26. ¿En cuál(es) molécula(s) el ángulo es 109.5°? 27. a) b) c) d) e) I) NH 4 + II) HCN a) I y II b) II y III III) SO 2 IV) CH 4 c) II, III y IV d) I y IV e) en ninguna Utilice el modelo RPECV para predecir la geometría molecular del SF 2 . angular lineal piramide trigonal tetraedrica octahedrica 28. Cuales de las siguientes son estructuras resonantes del ion nitrito NO 2 ? a) b) c) d) e) 1y2 2y4 1, 2 y 3 2y3 1, 2 y 4 29. Cuál de las siguientes estructuras es correcta para el N 2 O? (a) a) b) c) d) e) (b) (c) (d) (e) 1 2 3 4 5 30. Existe un solo par de electrones no enlazantes en el átomo central en la estructura de lewis del ICl 5 . Esta molécula tiene: a) b) c) d) e) Una distribución piramidal trigonal de electrones y una geometria molecular octaédrica Una distribución octaédrica de electrones y una geometría pirámide cuadrada Una distribución de bipirámide trigonal de electrones y una geometría molecular de balancín. Una distribución octaédrica de electrones y una geometría bipirámide trigonal Una distribución bipirámide trigonal de electrones y una geometría bipirámide trigonal RESPUESTAS A B C D E 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 x x x x x x x x x x x x x x x x x x x x x x x x x CM1A1 – QUIMICA GUIA PREPARACION CONTROL 2 Prof. de cátedra: Francisco Martínez Prof. Auxiliar: Pamela Guzmán 15/09/08 1. De acuerdo con la teoría de bandas, la alta conductividad eléctrica de los metales se debe a: I) una banda de conducción parcialmente ocupada II) una banda de valencia sobrepuesta con una banda de conducción vacía III) una banda de valencia llena IV) una gran diferencia de energía entre las bandas de conducción y de valencia. Es(son) verdadero(s): A) solo IV B) III y IV C) solo III D) I y III E) I y II 2. Si el Silicio (grupo 4A (14)) es dopado con un elemento del grupo 5A (15), como Fósforo, el material formado será: A) semiconductor B) metal C) semiconductor tipo “n” D) aislante E) Semicond.. tipo “p” 3. El orden de valores de E entre banda de conducción y banda de valencia (E g ) es: A) conductor = semiconductor > aislante B) conductor > semiconductor aislante C) conductor semiconductor > aislante D) conductor > semiconductor > aislante (E g = 0) E) conductor (E g = 0) < semiconductor < aislante 4. Considere un cristal de germanio (IV A) que ha sido dopado con una cantidad de aluminio (grupo IIIA). El cristal dopado: A) tiene una menor conductividad de germanio B) tiene una conductividad mas alta que el germanio. C) es un superconductor. D) su conductividad no cambia E) es un semiconductor tipo n. 5.-Cual de los dopantes siguientes en el silicio produciría un semiconductor de tipo p: a) Ga b) Ge, c) As d) Cd e) Sb 6.- Se ha predicho que si se pudiera poner el elemento hidrógeno (normalmente un gas invisible de moléculas diatómicas a temperatura y presión ambiente) bajo presión suficientemente alta - millones de atmósferas - puede convertirse en un metal! ¿Cuáles de los diagramas de banda anteriores representan el hidrógeno sólido? a) A, b) B, c) C d) D e) Ninguno de ellos 7.- ¿Cuáles de los siguientes diagramas electrónicos representan un estado fundamental correcto? a) solo A b) solo B c) solo C d) A y B e) B y C 8. ¿Cual es la configuración electrónica del estado fundamental de C 2 (diamagnético)? A) B) D) diamante. C) E) No es posible formar C 2 , Sólo existe grafito y 9. Utilizando orbitales moleculares, encuentre el n° de enlace y el tipo de magnetismo (para=paramagnetico) de cada una de las siguientes moléculas: CN ; O 2 CN N°enlace: a)1 b)1,5 c)2 d)2,5 e)3 f)3,5 ; Magnetismo: a)diamagnetico b)para O 2 N°enlace: a)1 b)1,5 c)2 d)2,5 e)3 f)3,5 ; Magnetismo: a)diamagnetico b)para 10. Cuál de las siguientes afirmaciones es falsa? Un orbital molecular sigma (): A) se puede formar por superposición de orbitales atómicos p, perpendiculares al eje molecular B) se puede formar por superposición de orbitales atómicos p, a lo largo del eje molecular C ) se puede formar por superposición de orbitales atómicos s D) se puede formar por superposición de un orbital atómico s y uno p E) puede ser enlazante o antienlazante 11. Cuál de las siguientes hibridaciones del átomo central de Xe no es correcta? A) XeOF 4 ; sp3d2 C) XeO 3 ; sp3 B) XeF 4 ; sp3 D) XeF 2 ; sp3d E) Xe no forma enlace, es un gas noble 12. En la molécula de HOCN, el ángulo de enlace H-O-C es 108o, mientras que el ángulo de enlace O-C-N es 180o. Las hibridaciones del carbono y del oxígeno son, respectivamente B) C-sp2, O-sp2. A) C-sp2, O-sp3. C) C-sp, O-sp2 D) C-sp, O-sp3 E) C-sp, O-sp 13. ¿Qué aseveración sobre la formación de los orbitales atómicos híbridos es(son) incorrecta(s)? A) Se combinan los orbitales atómicos de energías relativamente similares. B) Los orbitales no combinados se mantienen como orbitales hidrogenoides. C) El número de orbitales híbridos formados es siempre igual al número orbitales atómicos hidrogenoides usados. D) Los orbitales híbridos formados tienen características direccionales bien definidas E) Ninguno de las anteriores. 14. La hibridización del átomo de oxígeno en el ion H 3 O+ es: A) sp3d B) sp3 C) sp3d2 D) sp E) sp2 15. ¿En qué tipo de orbital se encuentran los electrones del par solitario del Nitrógeno en H 2 CNH? A) 2s B) 2p x C) sp D) sp2 E) sp3 16. ¿Cuál de las siguientes moleculas tiene momento dipolar distinto de cero? I) CO 2 II) CH 3 Cl III) CCl 4 IV) C 3 H 8 A) solo I B) II y IV C) II y III D) I y IV E) solo II 17. Indique cual es el conjunto de moléculas cuyas temperaturas de ebullición está incorrectamente ordenado. A) Xe Ar He B) HF HCl HBr C) H 2O H 2Se H 2S D) C3 H 8 C 2H 6 CH 4 E) C 2 H 4 ( OH )2 C 2 H 5OH CH 3OH 18-Cuál de las siguientes sustancias debe tener el calor de vaporización más alto? A) H 2 O B) H 2 S C) C 6 H 6 D) CH 3 OH E) CH 3 OCH 3 19.- Considere las moléculas CH 3 CH 2 OH y CH 3 OCH 3 , que se muestran en la figura inferior: H H H C C H H H O H H C H H O C H H Cuál (es) de las siguientes afirmaciones es (son) falsa(s) para el compuesto puro: (I) Ambos compuestos exhiben fuerzas de dispersión. (II) Ambos compuestos exhiben fuerzas dipolo-dipolo. (III) Ambos compuestos exhiben puentes de hidrógeno. A) I B) II C) III D) Ninguna de las anteriores E) Todas las anteriores 20. La formula mínima del compuesto cuya celda unitaria se muestra es: A= B= C= A) A 2 B 3 C B) A 3 B 2 C C) A 3 B 4 C 2 D) A 4 B 3 C 2 21. ¿Cuál de los siguientes no corresponde a un sólido covalente reticulado? A) diamante B) SiO 2 C) NaF D)grafito E) Son todos sólidos covalentes reticulares. 22.El tetróxido de osmio, OsO 4 es un cristal molecular. Cuál de las siguientes características generales esperaría usted que NO poseyera: A) Sólido mal conductor de la electricidad B) sólido más bien blando C) punto de fusión alrededor de 40 oC D) punto de fusión alrededor de 1600 oC E) Mal conductor de la electricidad fundido 23.- En la molécula orgánica dibujada abajo qué átomo/s de carbono utiliza/n geometría triangular plana (u orbitales híbridos sp2) en la formación de sus enlaces? a) solo 1 d) 4 y 5 b) solo 2 e) 1 y 2 c) 2 y 3 24.Los orbitales híbridos de los átomos de c arbono señalados en las siguientes moléculas son respectivamente: a) sp3; sp2; sp; sp2 c) sp; sp2; sp3; sp3 e) sp2; sp2; sp; sp b) sp2; sp3; sp; sp2 d) sp3; sp2; sp3; sp2 25-¿Cuáles de las especies siguientes son capaces de unirse entre sí por medio de enlaces de hidrógeno? 1) C 2 H 6 , 2) HI, 3)) KF, 4) BeH 2 , 5) CH 3 COOH. a) solo 1 b) solo 2 c) 2 y 3 d) 4 y 5 e) solo 5 26.-Los siguientes compuestos RbF, CO 2 , CH 3 OH, CH 3 Br, están ordenados en orden creciente según su punto de ebullición en: a) RbF < CO 2 < CH 3 OH < CH 3 Br b) CH 3 Br < RbF < CH 3 OH < CO 2 c) CO 2 < CH 3 Br < RbF < CH 3 OH d) CO 2 < CH 3 Br < CH 3 OH < RbF e) CO 2 < CH 3 OH < CH 3 Br < RbF 27.-Los puntos de fusión de los óxidos de los elementos del tercer periodo están entre paréntesis: Na 2 O (1275°C), Al 2 O 3 (2045°C), SO 3 (16.8°C), Cl 2 O 7 (-91.5°C). Entonces son sólidos moleculares: a) SO 3 y Cl 2 O 7 b) Na 2 O y SO 3 c) Al 2 O 3 y Na 2 O d) Cl 2 O 7 y Al 2 O 3 e) ninguno de los anteriores. 28-El silicio cristalino tiene una estructura cúbica. La longitud de la arista de la celda unitaria es 543 pm. La densidad del sólido e s 2.33 g/ cm 3 . Entonces el número de á tomos de Si e n cad a c elda unitar ia es: a) 4 b) 8 c) 6 d) 2 e) 1 29.Cuáles de los siguientes compuestos son sólidos covalentes? Se 8 , HBr, Si(diamante), CO 2 , C(grafito), P 4 O 6 , SiH 4 . a) SiH 4 b) CO 2 y C(grafito) c) Si(diamante) y C(grafito) d) C(grafito) y P 4 O 6 e) P 4 O 6 30-¿Cuáles de las siguientes propiedades influyen en la presión de vapor de un líquido en un recipiente cerrado? 1) el volumen sobre el líquido, 2) la cantidad de líquido presente, 3) la temperatura, 4) las fuerzas intermoleculares entre las moléculas del líquido. a) solo 1 b) solo 2 c) 2 y 3 d) 3 y 4 e) solo 3 31. La presión de vapor del benceno, C 6 H 6 , es 40.1 mmHg a 7.6°C. ¿Cuál es su presión de vapor a 60.6°C? El calor molar de vaporización del benceno es 31.0 kJ/mol. a) 150.8 mmHg b) 760 mmHg c) 330.4 mmHg d) 390.7 mmHg e) 256.6 mmHg 32. La presión de vapor del mercurio en su punto de ebullición normal (357°C) es: a) 0,25 atm b) 1 atm c) 0,15 atm d) 1,31 atm e) 0 atm 33. Una medida cuantitativa de la eficiencia con que se empacan las esferas en las celdas unitarias se denomina eficiencia de empaquetamiento, que es el porcentaje del espacio de la celda ocupado por las esferas. Las eficiencias de empaquetamiento de una celda cúbica simple, una celda cúbica centrada en el cuerpo y una celda cúbica centrada en las caras son respectivamente: a) 52.36, 68.01, 74.06 % b) 25.36, 68.01, 74.06 % c) 52.36, 78.01, 74.06 % d) 74.06, 68.01, 52.36 % e) 50.16, 61.01, 72.85 % 34 Los orbitales híbridos que utiliza el átomo de nitrógeno en cada una de las siguientes especies: a) NH 3 b) H 2 N ― NH 2 c) NO 3 - son respectivamente: a) sp3; sp2; sp b) sp2; sp3; sp2 c) sp3; sp3; sp2 d) sp2; sp3; dsp3 e) sp3; sp2; dsp2