Métodos de colecta y muestreo de fauna Sergio Guerrero
Anuncio

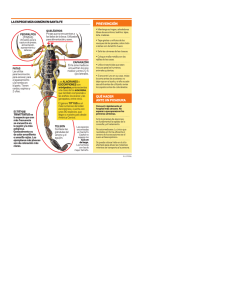
Métodos de colecta y muestreo de fauna Sergio Guerrero-Vázquez1, José Luis Navarrete-Heredia2, Silvia Socorro ZalapaHernández3, Miguel Vásquez-Bolaños4, Margarito Mora-Núñez5, Agustín CamachoRodríguez6 y Georgina A. Quiroz-Rocha7 Centro de Estudios en Zoología, Departamento de Botánica y Zoología, Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara. Km. 15.5 Carretera Guadalajara-Nogales, Las Agujas, Nextipac, Zapopan, Jalisco, México, C. P. 45220. [email protected], [email protected], [email protected], [email protected], [email protected], [email protected], [email protected] Introducción Los métodos de colecta nos permiten capturar especímenes de manera apropiada; la adecuada preservación nos ayuda a mantener las estructuras y características; mientras que el montaje permite que se puedan depositar en una colección, para que estos sean útiles durante mucho tiempo. Siendo los artrópodos un grupo tan diverso (más de 1´200,000 especies), tan variado en sus formas y presentes en todos los ambientes (terrestres y acuáticos), para cada grupo se han desarrollado métodos de colecta, preservación y montaje que ayuden al mejor estudio de estos. Existen métodos de colecta directa (manual) e indirecta (trampas). La colecta es la captura (extracción) de los organismos, para un mejor resultado se sugiere iniciar la colecta una vez que ya se definido el objetivo, se eligió el área de muestreo y el grupo con el cual se trabajará. Para esto se podrán utilizar uno o varios métodos de colecta dependiendo del grupo (Gaviño et al., 2000). Métodos de colecta para material paleontológico En el sitio que se haya seleccionado para la colecta de material fósil, debe examinarse detalla y cuidadosamente el terreno para que no se pase por alto ninguna evidencia; éstas pueden ser conchas, huesos o fragmentos de roca con impresiones de hojas o cualquier otro resto de material o evidencia paleontológica. Los fósiles van a encontrarse sobre todo en las superficies de estratificación; también suelen encontrarse buenos ejemplares en el interior de los nódulos que fácilmente se rompen con un golpe de martillo. Esto puede servir de guía para encontrar un yacimiento, pero es absolutamente necesario localizar el afloramiento del estrato que contiene fósiles, para lo cual se llevará a cabo un reconocimiento más detallado del lugar donde se encuentren los fósiles sueltos. El método de extracción depende de las características del yacimiento y de la naturaleza del fósil. Extracción de pequeños fósiles Cuando se trate de pequeños invertebrados, impresiones de vegetales o animales, moldes y rellenos, pequeños esqueletos de vertebrados, insectos, etc., se deberá proceder de la siguiente forma. Cuando el fósil se encuentre incluido en roca dura será necesario golpear alrededor de éste usando un martillo y un cincel. Para elegir el cincel más adecuado se puede comenzar utilizando los de calibre más delgado para la actividad antes mencionada. Si resulta insuficiente, entonces se sustituye por uno de calibre más grueso y así sucesivamente, hasta que sea posible trabajar con soltura sin dañar al fósil. Los golpes deben ser suaves pero firmes, procurando que el trozo de roca en que esté incluido el ejemplar sea mayor que éste. El exceso de roca se eliminará posteriormente en el laboratorio, o será utilizado como soporte natural al montar el fósil de manera definitiva. Nunca se debe tratar de eliminar el exceso de roca en el campo, pues se corre el riesgo de romper el fósil. Muchas veces los fósiles están firmemente incluidos, lo que hace imposible sacarlos de una sola pieza; cuando esto sucede, las piezas se envuelven juntas en papel periódico y se ponen dentro de una bolsa para posteriormente armarlas. Cuando el fósil se encuentre constituido por material muy frágil, puede cubrirse la superficie con una película delgada de goma laca para darle firmeza. Los ejemplares deben envolverse por separado en papel periódico y todos los que procedan de un mismo nivel estratigráfico deberán empaquetarse en una bolsa con una etiqueta numerada. Los fósiles han de marcarse con el mismo número que corresponde a la etiqueta de su bolsa. Se colocan en cajas y se transportan al laboratorio para su preparación. Extracción de grandes fósiles Cuando se trata de fósiles de gran tamaño, especialmente en los yacimientos de vertebrados, suele ser necesario realizar trabajos auxiliares de cierta consideración, para ponerlos al descubierto y extraerlos del yacimiento en buenas condiciones. Antes de proceder a la extracción, es necesario tener algunas precauciones que permitan la posterior reconstrucción del esqueleto completo, conservando la disposición que tenían en el yacimiento. Con este fin se traza un mapa cuadriculado en donde se dibuja la posición y disposición de cada pieza del esqueleto. Tal cuadriculado se realiza sobre el yacimiento utilizando cuerdas. También es de gran utilidad tomar fotografías de la disposición original. Una vez ubicada la disposición del esqueleto se procederá a la extracción de piezas, para lo cual es conveniente comenzar por eliminar la sobrecarga, y a medida que se va descubriendo, ir barnizando de goma laca las partes visibles. Luego se procede a aislarlo por los costados, de manera que los restos descansen sobre un pedestal de sedimentos; se cubren primero con papel periódico y después con tiras de manta de cielo (vendas) previamente impregnadas con yeso. Se deja secar completamente y por último se procede a separar los restos del pedestal, de esta forma se puede hacer el traslado con la confianza de que no se fracturará el fósil. Extracción de material micropaleontológico Si lo que nos interesa son microfósiles la colecta debe hacerse de preferencia en rocas poco consolidadas o sedimentos sueltos (ejemplo: margas, lutitas, areniscas, turbas, etc.), en donde medio kilogramo de muestra será suficiente. Para la colecta y transporte de estas muestras (y en general, de toda clase de fósiles pequeños) son muy útiles las bolsas de plástico, en cuyo interior se coloca la correspondiente etiqueta, que puede leerse sin necesidad de abrir la bolsa. Métodos de colecta, preservación y montaje para artrópodos Técnicas de muestreo Para el adecuado manejo y conservación de los artrópodos tanto en campo como en laboratorio se sugiere lo siguiente: I Directa. En este tipo de colecta es muy importante el “esfuerzo de colecta”, es decir el tiempo que se invierte en la búsqueda del organismo en un determinado lugar de estudio (Gaviño et al., 2000). A) Manual.- Es el método más sencillo ya que no requiere herramientas, los artrópodos son capturados sólo con la mano. Esto es útil para aquellos de tamaño mediano a grande, consistencia dura y que no son agresivos ni ponzoñosos: Crustáceos (cangrejos, camarones, cochinillas, etc.); miriápodos (milpiés, ciempiés); arácnidos (arañas, ácaros, opiliones, etc.); hexápodos (escarabajos, hormigas, chapulines, etc.). Además con este método se decide cuantos y cuales organismos son los que se colectaran (Gaviño et al., 2000). B) Aspirador.- Consta de un tubo de plástico con los dos extremos abiertos, un corcho a cada extremo y una manguera en cada corcho. Una manguera se coloca en la boca del colector y la otra hacia donde se encuentren los artrópodos (con una malla en el interior). Con el aspirador se capturan artrópodos pequeños, de movimientos rápidos y de consistencia blanda. Arácnidos (ácaros, seudoescorpiones); hexápodos (colémbolos, escarabajos, hormigas, etc.). También es útil para juveniles de diferentes grupos. C) Pinzas.- Se utilizan pinzas (de joyero o de relojero por ejemplo) para los organismos que son agresivos o ponzoñosos, pero que tienen consistencia dura y no serán dañados con esto. Crustáceos (cangrejos, langostas); miriápodos (ciempiés); arácnidos (alacranes, arañas, garrapatas, vinagrillos); hexápodos (avispas, abejas, hormigas, etc.). D) Pincel.- Un pincel delgado y de cerdas naturales funciona para este fin. Es útil para artrópodos de tamaño pequeño o de consistencia blanda. Arácnidos (ácaros); hexápodos (hormigas, escarabajos). E) Red aérea.- Consiste en un aro y un bastón de material ligero (aluminio o madera), el aro va cubierto de una maya o tela fina en donde se capturarán los organismos. También llamada red entomológica. Con esta herramienta se colectan artrópodos voladores o brincadores principalmente. Hexápodos (mariposas, libélulas, abejas, moscas, escarabajos, chapulines). F) Red acuática.- Parecida a la aérea, aunque se recomienda que la maya sea de plástico. Para artrópodos de hábitos acuáticos, tanto juveniles como adultos. Crustáceos (cangrejos, camarones); hexápodos (escarabajos, chinches, megalópteros, etc.). G) Red de golpeo.- Consiste en una tela gruesa extendida que se pasa por la vegetación golpeándola o sacudiéndola para que los organismos caigan en ella. Útil para organismos que están en la vegetación, de hábitos herbívoros, sobre todo para los considerados plagas agrícolas. Hexápodos (escarabajos, chinches, chicharras, chapulines, etc.). H) Cernido de hojarasca.- Se toma un metro cuadrado de hojarasca, se pasa por un cernidor. El proceso del material cernido (hojarasca) puede ser mediante embudos de Berlese o sacos Winkler. Los embudos de Berlese son de acero inoxidable y los sacos Winkler son de tela impermeabilizante, en ambos casos se coloca un frasco colector en la parte inferior (ALAS, LLAMA). Con este método se capturan artrópodos que viven en la hojarasca, principalmente estados inmaduros, de tamaño pequeño, consistencia blanda. Crustáceos (cochinillas); arácnidos (arañas, ácaros, seudoescorpiones); miriápodos (milpiés, ciempiés); hexápodos (escarabajos, hormigas, tijerillas, grillos, etc.). II Indirecta. Trampas. Para trabajos sistemáticos, en donde el tiempo de captura es mucho para hacerlo de manera manual se utilizan las trampas, que pueden durar desde unos días hasta un mes en campo. A) NecroTrampa Permanente modelo 1980 (NTP-80).- Consta de un bote de uno o dos litros de capacidad, que se entierra a nivel del suelo, se pone alcohol (70%) como líquido conservador hasta la mitad y se le coloca calamar o pulpo como atrayente. Es una trampa muy eficiente ya que se capturan artrópodos de varios grupos, principalmente de hábitos necrócolos. Crustáceos (cochinillas); arácnidos (arañas, ácaros); miriápodos (milpiés, ciempiés); hexápodos (escarabajos, moscas, avispas, hormigas, etc.) (Morrón y Terrón, 1984). B) Pozo seco.- Un recipiente de boca ancha, de uno o dos litros de capacidad enterrado a nivel del suelo, sin alcohol y sin cebo, se captura todo aquello que transite en torno a la trampa. Esta trampa es para artrópodos de hábitos terrestres (epigeos). Crustáceos (cochinillas); miriápodos (ciempiés, milpiés); arácnidos (arañas, alacranes, ácaros, opiliones, etc.); hexápodos (colémbolos, escarabajos, hormigas, grillos, chinches, etc.). C) De caída.- Un recipiente de boca ancha, de uno o dos litros de capacidad enterrado a nivel del suelo, con o sin alcohol. Puede o no colocarse cebo, así que se puede dirigir la captura hacia algún grupo en particular. El cebo que se coloca va desde atún, miel, hongo, excremento, fruta, etc. Esta trampa es para artrópodos de hábitos muy variados o muy específicos. Crustáceos (cochinillas); miriápodos (ciempiés, milpiés); arácnidos (arañas, alacranes, ácaros, opiliones, etc.); hexápodos (colémbolos, escarabajos, hormigas, grillos, chinches, etc.). D) Intercepción.- Es una placa de acrílico transparente o una malla (fina), extendida; colocada entre la vegetación, debajo y abracando la longitud de la maya se colocan charolas con líquido conservador. Esta trampa es útil para artrópodos voladores que no llegan a caer en otras trampas. Hexápodos (Escarabajos, avispas, moscas, mariposas). E) Luz.- Se coloca una tela blanca que funcionara como pantalla y una fuente de luz para atraer a los organismos. Este método es muy útil para aquellos artrópodos de hábitos nocturnos (principalmente voladores). Hexápodos (escarabajos, mariposas, avispas, hormigas (reproductores), tijerillas, chinches, megalópteros, neurópteros, etc.). F) Malaise.- Es una maya con toldo a manera de embudo invertido en la parte superior, puede ir al nivel del suelo o suspendida entre la vegetación. Sirve para colectar insectos voladores que tienden a subir cuando encuentran un obstáculo vertical. Hexápodos (mariposas, moscas, avispas, abejas) (Malaise, 1937). G) Fumigación o nebulización.- Se emplea un químico no residual de baja toxicidad hacia el dosel, liberado por una maquina termonebulizadora, los artrópodos caen en embudos con frascos colectores de gran diámetro colocados en el suelo. Es un método útil para el estudio de los artrópodos que habitan en el dosel de los arboles, permite conocer gremios tróficos, biomasa, abundancia. Arácnidos (arañas); hexápodos (chapulines, tijerillas, escarabajos, chicharras, chinches) (Gasca y Higuera, 2010). H) Trampa rampa.- Es una caja o recipiente colocado sobre el suelo con uno o varios orificios en los costados, una rampa en caca orificio para el ingreso de los organismos. Útil para los artrópodos terrestres. Crustáceos (cochinillas); miriápodos (ciempiés, milpiés); arácnidos (arañas); hexápodos (escarabajos, hormigas) (Bouchard et al., 2000). Preservación y montaje La formación de una buena colección científica o de docencia dependerá del buen estado de conservación en que se mantengan los ejemplares. La importancia y utilidad de los artrópodos colectados dependerá de la información de colecta y taxonómica con que se cuente, esta información es muy importante para futuros trabajos que se realicen sobre algún grupo, tópico o área en particular, para esto se elaboran etiquetas con la mayor cantidad de información posible. Información mínima para la etiqueta con información de campo País (abreviado y en mayúsculas); estado (abreviado y en mayúsculas); municipio (completo); localidad (o un punto de referencia preciso: kilometraje de carretera, cerro, río, etc.); coordenadas; altitud (en metros sobre el nivel del mar); tipo de vegetación; método de colecta; fecha de colecta (el día en números arábigos, el mes en números romanos y el año completo en números arábigos); colector(es). MEX: JAL, Zapopan, Bosque La Primavera Río Caliente, 1,700m, BPE, 28.VI.2014, 18º 0' 29.39" N 92º 55' 33.02" O J. Pérez col. Información mínima para la etiqueta con información taxonómica Nivel taxonómico al que fue posible determinar, de preferencia especie; Descriptor y año de descripción de dicha categoría; Determinador y año de determinación. Homo sapiens Linnaues, 1758 P. López, 2014 Det. Preservación La preservación de la mayoría de los ejemplares será en alcohol al 70%, arácnidos, miriápodos y hexápodos. Excepto para las libélulas, se utiliza acetona la cual se inyecta con una Jeringa. Para mariposas (diurnas y nocturnas), abejas, escarabajos, etc. Se utiliza acetato de etilo, para lo cual se elabora una cámara letal. Para los crustáceos acuáticos se recomienda formol al 10%. Montaje El mantener en seco los ejemplares permite observar las características y colores. Es recomendable montar sólo los hexápodos, algunos ordenes no todos y los adultos. Para la gran mayoría de los insectos se utilizarán alfileres entomológicos y/o unos pedazos de papel (mantequilla o acetato) si son muy pequeños. Colección Una vez montados los insectos y con las etiquetas se almacenarán en cajas de madera con tapa de cristal, estas se ordenarán según la nomenclatura vigente. Técnicas de muestreo de vertebrados Ecología es el estudio de los factores que influyen en la distribución y abundancia de las especies (Krebs, 1978). Bajo este planteamiento, Krebs destaca que la abundancia se convierte en el factor primordial en el estudio de la ecología de las especies. Así, uno de los aspectos centrales en el estudio de las poblaciones animales es determinar el número de individuos que las componen. Esta cuantificación está en función de los propósitos que se persigan con ello y de las especies de que se trate. Regularmente, la determinación del número de individuos que compone una población puede estar encaminada a tener un marco general del estado de la población, o bien enfocarse a detectar como la población de modifica en tiempo y espacio. Así, si lo que pretendemos es simplemente determinar cuántos individuos tenemos presentes en un sitio determinado, el obtener la abundancia podría ser suficiente; en cambio si la intención es determinar cuántos individuos podemos aprovechar en una temporada de caza, la determinación de densidad será necesaria. Estos elementos son fundamentales ya que las cuantificaciones de las poblaciones animales demandan un tiempo y un esfuerzo importante, lo cual repercute en los costos de operación del estudio. Sobre el muestreo y algunos conceptos básicos Una estimación es el valor calculado a partir de un conjunto particular de datos obtenidos de una muestra. La meta del investigador es estimar el tamaño poblacional o la densidad con base en una muestra representativa de la población de interés. Para ello, inicialmente se debe distinguir entre dos conceptos básicos: densidad y abundancia. La densidad es el número de individuos por unidad de área ocupada por la población. Para algunos animales, tales como el plancton, la densidad es mejor definida como el número de individuos por unidad de volumen. Puede ser calculada a partir de un censo, esto es el conteo de todos los individuos de la población presentes en un área determinada. Sin embargo, dadas las dificultades que un censo representa, se recurre a estimar la densidad en función del estudio de una porción representativa de la población, esto es a partir de un muestreo. La abundancia, es una medida basada en el conteo de los individuos con respecto a las unidades de muestreo utilizadas. Por ejemplo, se puede referir a captura por unidad de esfuerzo: captura por trampa/noche, individuos observados por hora, número de individuos capturados/red/hora, entre otros. Por su parte, un índice de abundancia poblacional está basado en algunos signos de animales, tales como huellas, pistas, grupos de pellets fecales, excretas, entre otros. Para que estos índices sean útiles deben presentar un incremento, preferentemente lineal, en función del tamaño de la población. El cuantificar la abundancia puede ser mucho más fácil y económico que la densidad, y puede ser perfectamente aplicable para la solución de algunos problemas se investigación sobre ciertas poblaciones animales. Si la pregunta que pretende ser respondida es si o no hay diferencia significativa entre dos áreas, o en diferentes tiempos, tales como antes y después de un experimento, una medida relativa puede arrojar datos adecuados para esas investigaciones con un menor esfuerzo. En cambio son de poco valor si las necesidades de dos especies requieren de ser comparadas, o bien si lo que está involucrado en el estudio en el conocimiento de la estructura de la población (adultos, subadultos, hembras, machos). Muestreo de peces Tradicionalmente, de para el estudio de peces, particularmente continentales, se han utilizado distintos tipos de redes, caracterizándose éstas por diferentes materiales de construcción, tamaños y luz de malla. En algunos sitios en donde la cantidad de agua es limitada y de poca profundidad, tales como pozas pequeñas, el uso de redes cuchara resulta de gran utilidad. En cambio, en sitios de mayor profundidad las redes atarraya, chinchorros y trasmallos resultan eficientes. Son estas las artes de pesca comúnmente usadas para la evaluación tanto de poblaciones como de comunidades de peces; la abundancia de los organismos frecuentemente es relacionada con un tiempo de muestreo, así se puede hablar de número de individuos capturados por hora (en el caso del uso de redes atarraya se deberá estandarizar, además, el número de lances por tiempo). En sitios de agua dulce el uso de la electropesca resulta eficiente. La electropesca utiliza electricidad para aturdir -y posteriormente incapacitar- peces sin causar ningún daño a largo plazo. A menudo tiene un uso en la recolección de muestras cuando se realizan estudios de las poblaciones de peces en lagos, ríos y represas. Los equipos van desde mochilas hasta los modelos montados en barcos. Los modelos de mochila para electropesca tienen uso en los cuerpos de agua superficiales y pequeños a los que los botes no tienen acceso. El equipamiento incluye una unidad de morral que contiene el circuito eléctrico y la batería que provee de energía a la herramienta. Una línea de cátodo de arrastre unida a la mochila cuelga permanentemente en el agua, y el operador activa la máquina al sumergir un polo del ánodo en el agua. En muchos casos, el polo del ánodo puede tener un diseño telescópico para permitir que la persona que está pescando lo ajuste a cierta longitud. Muestreo de reptiles Las técnicas más comunes para estimar la abundancia de los reptiles involucran la observación de los individuos o su captura, aunque Blomberg y Shine (1996) destacan que mucha más información puede ser obtenida de un individuo que ha sido capturado respecto a uno que solo fue visto. Sin embargo, cierto tipo de estudios no requieren de la captura, por lo que no se demanda esa información adicional. Los reptiles son ectotermos, esto es, regulan su calor corporal a partir del ambiente. Es esta una de las mayores implicaciones para cualquier técnica de estudio de este grupo, ya que las condiciones climáticas pueden afectar en gran medida su actividad y por lo tanto, su capturabilidad. Por lo que los cambios climáticos diarios y estacionales deben ser considerados en el diseño de un programa de muestreo. El método más simple utilizado para la captura de los reptiles es mediante la búsqueda intensiva en todos los microhábitats que frecuentan estas especies; una vez localizadas, son capturadas manualmente. En algunos casos se ha estandarizado la captura por unidad de esfuerzo, utilizando recipientes de un determinado tamaño y colocándolos de manera equidistante, los cuales son revisados de manera frecuente mediante un calendario previamente establecido. Para reptiles terrestres, las trampas más comúnmente utilizadas son las conocidas como trampas de caída ("pitfall traps"). Estas consisten de un recipiente el cual es enterrado de tal manera que la boca quede a ras de la superficie. Se cubre con una piedra de tal forma que pueda quedar oculta, solamente permitiendo el paso de los reptiles al interior del recipiente; una capa de hojarasca o humus es colocado en el fondo del recipiente para los animales que pudieran ser atrapados. Esto puede tener ciertas ventajas, ya que la hojarasca puede atraer a algunos artrópodos a la trampa, lo cual puede funcionar como cebo. Este tipo de trampas puede ser utilizado de forma combinada con cercas ("drift fences"). Estas estructuras consisten de cercas de unos 30 cm de altura, hechas con polietileno o algún otro material flexible, las cuales son mantenidas erectas mediante postes. La base de la cerca es enterrada algunos centímetros para evitar el escape de individuos por la parte baja del cercado. El uso de bandas para el estudio de los reptiles es una práctica que cada vez es más utilizada. La base de esta técnica es el uso de transectos en línea, los cuales son manejados mediante una anchura y longitud determinadas. La anchura de la banda está relacionada con el tipo de hábitat en el cual se trabaje. Por ejemplo, las características estructurales del bosque tropical caducifolio no permiten un ancho de banda considerable (aproximadamente tres metros), en cambio, en un bosque de encino o de pino, el ancho de banda puede ser mayor. La banda deberá ser recorrida lentamente y procurando buscar en todos los elementos del hábitat (troncos caídos, rocas, troncos de los árboles, dosel, hojarasca, etc.) que eventualmente pueden ser utilizados como sitios de percha o refugio de los reptiles. El uso de las bandas permite obtener valores de densidad para cada una de las especies registradas o bien obtenerse índices de abundancia. Muestreo de aves Debido a la diversidad existente en éste grupo animal, los métodos de captura y conteo son igualmente variados, ya que ciertas especies requieren de técnicas especializadas que no pueden ser usadas para otras, debido a las características particulares de su comportamiento o hábitat. La ventaja que presenta éste grupo respecto a otros más crípticos -como los mamíferoses que un buen número de especies pueden ser contadas por medio de observaciones directas, a excepción de aquéllas de hábitos primariamente nocturnos -por ejemplo, búhoso que son extremadamente tímidas -como los rálidos-. En estos casos, pueden utilizarse métodos indirectos como el conteo de cavidades de anidación. Otra ventaja que presentan las aves, en términos de la realización de conteos, es que son altamente vocales y pueden ser contadas y diferenciadas por sus cantos. Ciertos tipos de trampas han sido usados en la captura de aves. Un diseño de trampa permanente resulta muy eficiente cuando se realizan muestreos repetidamente en la misma zona y cuando las condiciones se prestan para ubicar una trampa permanente (por ejemplo, en áreas protegidas). Entre las que se han utilizado están: la trampa Heligoland (la cual consiste en un embudo de malla rígida o flexible que puede extenderse por cientos de metros); la trampa de puerta de caída; la red de caída (frecuentemente usadas para guajolotes, gansos y otro tipo de aves de gran tamaño); entre otras. Las redes de cañón son probablemente el método más refinado, costoso y elaborado de captura de aves. Consiste en una red de grueso calibre que es propulsada por explosivos sobre las aves, que son atraídas mediante sebos. Es usada principalmente para guajolotes, patos y gansos. Las redes de niebla son ampliamente usadas para capturar aves de todo tipo; las redes varían en tamaño, luz de malla y composición, para ser utilizadas en diferentes hábitats y especies, desde colibríes hasta aves de rapiña y patos. Éstas deben ser colocadas en lugares estratégicos, por donde las aves se muevan, de preferencia con vegetación por detrás que las mimetice y de ser posible en lugares sombreados. Para especies de hábitats abiertos, pueden colocarse sobre el agua o cerca de fuentes de alimento (Bibby et al., 1993). Para conteos directos de aves, la técnica más comúnmente utilizada es el conteo por puntos (Bibby et al., 1993). Al ubicarse en una posición, es posible contar todas las aves vistas y escuchadas. De la manera más simple, dicho método repetido en diferentes lugares permitirá obtener una lista de especies presente en un área. Considerando ciertos supuestos y el hecho de que la detectabilidad de las aves varía en relación con la distancia de observación, éste puede ser un método poderoso de medir tanto las abundancias relativas así como la densidad de manera eficiente. Puede también medirse el hábitat en un círculo alrededor del punto y se pueden construir inferencias sobre la selección del hábitat y preferencias de especies individuales o comunidades. Los puntos de conteos son similares a los transectos. Pueden imaginarse como transectos de cero longitudes conducidos a cero velocidades. Tienen la ventaja sobre los transectos de que pueden detectarse mayor cantidad de aves al permanecer en un punto por un período más largo de tiempo. Sin embargo, los transectos tienen la ventaja de que algunas aves que se asustan y vuelan al pasar el observador pueden ser detectadas. En los puntos de conteo éstas no se registrarán si al momento del comienzo del punto las aves se han movido. Por ésta razón, los puntos de conteo no deben ser usados en hábitats abiertos o para otras aves (generalmente de mayor tamaño) que pueden asustarse a la llegada de los observadores. La gran ventaja de los puntos de conteo sobre los transectos es que pueden incorporarse en un estudio formal de manera más fácil. Es más fácil ubicar puntos de conteo sistemática o aleatoriamente que el hacerlo con un transecto, ya que éste requiere rutas de acceso adecuadas que pueden sesgar los hábitats muestreados. Una muestra de series de puntos bien ubicados proveerá datos más representativos que unos pocos transectos. Frecuentemente se prefieren los puntos de conteo para hábitats diversos, ya que la ocurrencia de las especies puede ser relacionada más fácilmente con las características de los hábitats. Esta técnica es eficiente ya que un observador puede visitar 10 puntos en una mañana. Las variables más importantes a ajustar son la distancia a las cuales deben registrarse las aves y la duración de los conteos. Cuando un método se ha estandarizado para determinada especie en determinado hábitat, puede ser usado para especies similares en hábitats similares. Lo más importante es que el estudio sea uniforme a través del tiempo y que las condiciones en que se conduzcan sean las mismas, para así poder comparar a través del tiempo y evaluar el desarrollo de las poblaciones. Muestreo de mamíferos En algunos estudios de este grupo, las especies difícilmente son observadas y en ciertos casos no se ven en el transcurso del mismo. Un buen número de mamíferos son atractivos para el desarrollo de estudios de conservación, pero también en un buen número de casos ocurren en bajas densidades, lo que las hace extremadamente difícil de censar. En tales casos, indicios de su presencia y rastros de ellos son utilizados para conocer el estado de sus poblaciones o una aproximación. Estas técnicas usualmente arrojan un índice de abundancia, más que una medida de densidad. Dos grupos de técnicas has sido frecuentemente utilizadas con mamíferos para estimar la densidad de individuos de una población: técnicas de muestreo basadas en medidas de distancia y otras basadas en captura-recaptura. Para las técnicas de distancia, se requiere que al menos se establezca una línea o banda en el área. Esa línea es recorrida (a pie, en caballo, en vehículo, avión helicóptero, etc.) con el objetivo de detectar una muestra de los animales a estudiar. No es suficiente simplemente registrar el número de objetos registrados, además de ello, se deben registrar algunas medidas a partir del objeto a la línea de recorrido. Conocida la longitud del trayecto a recorrer, se deberá estimar la distancia perpendicular a dicho trayecto, considerando el punto en el cual se observa inicialmente el individuo. La propiedad fundamental y ventaja del muestreo mediante el transecto en línea es que no todos los individuos pueden ser detectados; más sin embargo, los individuos cercanos a la línea central del transecto tienen mayor probabilidad de ser detectados y esta probabilidad de detección se reduce conforme se incrementa la distancia de detección. Con las variables longitud del trayecto y la distancia perpendicular de cada uno de los individuos observados se puede obtener un estimado de la densidad poblacional (Seber, 1973). Por su parte, las técnicas de captura-recaptura se basan en capturar y marcar individuos de una población, liberarlos y entonces re-muestrear para ver que fracción de individuos llevan marca. El valor de las técnicas de marcaje-recaptura radica en que pueden proveer información de tazas de nacimiento, muerte y movimiento, adicional a la información de densidad. El problema es que requieren de tiempo y esfuerzo considerable para obtener los datos necesarios, además de que requieren de un grupo de suposiciones muy restrictivas acerca de las propiedades de la población que va a ser estudiada. Las técnicas de marcajerecaptura pueden ser usadas para poblaciones abiertas (p.e. método de Jolly-Saber) y poblaciones cerradas (p.e. método de Petersen) (Seber, 1973). Frecuentemente, la observación directa de los mamíferos es complicada y difícil, dada su conducta nocturna o crepuscular, pero aún las especies diurnas muestran una conducta evasiva ante la presencia del hombre, lo cual complica el que estos puedan ser detectados. Por ello, se han desarrollado y aplicado una amplia variedad de técnicas que implican el uso de rastros que con la actividad de estas especies dejan en su hábitat. Estos rastros, los cuales pueden ser cualquier indicio, vestigio o señal que dejan los mamíferos durante sus actividades, pueden consistir de huellas, excretas, senderos, madrigueras, nidos, sitios de descanso, marcas en las plantas, señales de alimentación, desechos de la alimentación, restos orgánicos, voces y sonidos, olores, entre otros (Aranda, 2000). Algunos de éstos han sido utilizados para generar índices que permiten tener una idea del estado que guarda la población de una especie determinada, estos permiten generar valores de abundancia relativa. Esta información, bajo ciertas circunstancias, permite generar resultados para la toma de decisiones relativas al manejo o conservación de las especies. Recientemente, se han aplicado técnicas en las que la tecnología resulta ser de gran ayuda. Tal es el caso del uso de cámaras trampa, las cuales han permitido no solo detectar la presencia de especies en zonas en donde el acceso resulta difícil para implementar muestreos de forma sistemática, sino también se han hecho estimaciones de la abundancia de especies mediante el uso de estos equipos. En grupos como felinos, se han hecho estimaciones usando la técnica de captura-recaptura, considerando que el patrón de moteado es diferente entre individuos de la misma especie. Así mismo, el uso de la telemetría ha contribuido de manera importante para evaluar rangos hogareños, uso de hábitat, patrones de desplazamiento, entre otros aspectos ecológicos de las especies. El uso de la bioacústica ha sido también una técnica que se ha usado para el estudio de grupos como los cetáceos y los murciélagos. En éstos últimos, ha permitido identificar especies que mediante el uso de las redes de niebla es difícil registrar. Aspectos como riqueza de especies, distribución, estructura y composición de ensamblajes, comportamiento y actividad espacial y temporal, han sido evaluados mediante está técnica. Agradecimientos Este trabajo forma parte del proyecto “Fauna urbana y periurbana de Jalisco: diversidad y ecología” del Cuerpo Académico de Zoología, financiado por PROMEP CA-UDG-51. Literatura citada ALAS. Aranda, M. 2000. Huellas y otros rastros de los mamíferos grandes y medianos de México. Instituto de Ecología, A. C, México. Bibby, C. J., N. D. Bureguess & D. A. Hill. 1993. Bird census techniques. Academic Press, London, UK. Bookhout, T. A. (Ed.). 1996. Research and management techniques for wildlife and habitats. The Wildlife Society, Bethesda, U.S.A. Blomberg, S. & R. Shine. 1996. Reptiles. Pages 218-226. En: Sutherland, W. (Ed.). Practical Census Techniques for Animal Populations. Cambridge University Press, Cambridge. Boitani, L. & T. K. Fulle (Eds.). 2000. Research Techniques in Animal Ecology: Controversies and Consequences. Columbia University Press, New York. Bouchard, P., H. A. Wheeler & H. Goulet. 2000. Design for a low-cost, covered, ramp pitfall trap. The Canadian Entomologist, 387-389. Davis, P. G. 1981. Trapping methods for bird ringers. British Trust for ornithology, Thetford, UK. De la Fuente, J. A. 1994. Zoología de artrópodos. Interamericana-McGraw -Hill, Madrid. Gasca, A. H. J. y D. D. Higuera. 2010. Protocolos y métodos de colecta para el estudio de artrópodos del dosel en bosques de niebla del neotrópico. Revista Colombiana Ciencias Animales, 2 (2): 385-398. Gaviño, T., G., J. C. Juárez y H. H. Figueroa. 2000. Técnicas biológicas selectas de laboratorio y de campo. LIMUSA-Noriega Editores, México, D. F. Gullan, P. J. & P. S. Cranston. 1994. The insects on outline of entomology. Chapman and Hall, Oxford. Kenward, R. E. 2001. A manual for wildlife radio tagging. Academic Press, London, UK. Krebs, C. 1978. Ecology: The experimental analysis of distribution and abundance. Second Edition, Herper & Row, USA. Krebs, C. 1999. Ecological Methodology. Second Edition, Adison Wesley Longman, Menlo Park, CA. LLAMA. Malaise, R. 1937. A new insect trap. Entomologisk Tidskrift, 58: 148-160. Medina-Gaud, S. 1977. Manual de pocedimientos para colectar, preservar y montar insectos y otros artrópodos. Boletín 254, Universidad de Puerto Rico, Puerto Rico. Meglistch, P. A. 1978. Zoología de invertebrados. H. Blume Ediciones, Madrid. Morrón, M. A. y R. Terrón. 1984. Distribución altitudinal y estacional de los insectos necrófilos en la Sierra Norte de Hidalgo, México. Acta Zoológica Mexicana, nueva seria, 3: 147. Redfern, C. P. F. & J. A. Clark. 2001. Ringer's manual. British Trust for Ornithology, Thetford, UK. Seber, G. A. F. 1973. The Estimation of Animal Abundance and Related Parameters. Charles Griffin & Company Limited, London. Simmons, J. E. Y. y Y. Muñoz-Saba. 2005. Cuidado, manejo, y conservación de las colecciones biológicas. Universidad Nacional de Colombia-Conservación Internacional ANDES CBC, Bogotá, D. C., Colombia. Skalski J. R. & D. S. Robson. 1992. Techniques for Wildlife Investigations: Design and Analysis of Capture Data. Academic Press, Inc., San Diego, CA. Sutherland, W. (Ed.). 1996. Ecological Census Techniques. Cambridge University Press, Cambridge, UK. Tanner, J. T. 1978. Guide to the Study of Animal Populations. University of Tennessee Press, Knoxville. Vázquez, G. L. 1987. Zoología del Phylum Arthropoda. Interamericana, México, D. F. Wilson, D. E., F. Russell Cole, J. D. Nichols, R. Rudran & M. S. Foster (Eds.). 1996. Measuring and Monitoring Biological Diversity: Standard Methods for Mammals. Smithsonian Institution Press, Washington.