Guia de Laboratorio Ecologia II. - Facultad de Ciencias-UCV
Anuncio

UNIVERSIDAD CENTRAL DE VENEZUELA
FACULTAD DE CIENCIAS
ESCUELA DE BIOLOGÍA
DEPARTAMENTO DE ECOLOGÍA
LABORATORIO DE ECOLOGIA II
GUIA DE TRABAJOS PRÁCTICOS
Profesores:
Rubén Candia
Laura Delgado
Ernesto González
Paula Spiniello (Coordinadora)
Caracas, Octubre de 2006
UNIVERSIDAD CENTRAL DE VENEZUELA
FACULTAD DE CIENCIAS
ESCUELA DE BIOLOGÍA
DEPARTAMENTO DE ECOLOGÍA
LABORATORIO DE ECOLOGÍA II
OBJETIVO
En este curso se evaluarán, por medio de trabajos prácticos, aspectos de la ecología
de comunidades y ecosistemas y algunos relacionados con problemas de contaminación de
ambientes naturales. En algunos casos se trabajará en situaciones naturales y semicontroladas, mientras que en otros el trabajo consistirá en la manipulación de datos
experimentales.
Al concluir el laboratorio, el estudiante deberá ser capaz de manejar apropiadamente
algunos métodos empleados en los estudios ecológicos de comunidades, ecosistemas y en
la evaluación del efecto de la contaminación orgánica sobre los ambientes acuáticos.
ESTRUCTURA DEL LABORATORIO
El curso contempla 6 trabajos prácticos. En el correspondiente al nivel
COMUNIDADES, se evaluarán aspectos de la estructura comunitaria de insectos
asociados a las brácteas de una planta del género Heliconia. Además, se estudiará la
sucesión que ocurre en la comunidad a lo largo del tiempo. Los trabajos prácticos del nivel
ECOSISTEMAS incluirán: a) estimación de la productividad primaria y la
descomposición en un ecosistema de sabana. b) estimación de la productividad primaria en
un ecosistema acuático. c) descripción y evaluación de la trama trófica de una comunidad
de peces que habita en un ambiente natural. d) evaluación de un modelo de simulación de
un ecosistema de sabana. En la unidad que trata sobre PROBLEMAS AMBIENTALES se
estudiarán, bajo condiciones semi-controladas, los efectos del enriquecimiento con
nutrientes sobre la comunidad del fitoplancton.
En resumen, las prácticas ofrecidas en cada unidad serán las siguientes:
UNIDAD I (COMUNIDADES)
1) Análisis de una comunidad: Estructura comunitaria de insectos asociados a las brácteas
de Heliconia caribaea.
UNIDAD II (ECOSISTEMAS)
1) Productividad Primaria:
Estimación de la productividad primaria y la descomposición en un ecosistema terrestre
Estimación de la productividad primaria en un ecosistema acuático.
2) Relaciones tróficas de un ambiente acuático.
1
3) Simulación del flujo de biomasa vegetal aérea en una sabana inundable
UNIDAD III (PROBLEMAS AMBIENTALES)
1) Efectos del enriquecimiento con nutrientes (nitrógeno y fósforo) sobre la comunidad del
fitoplancton
NORMAS DEL LABORATORIO
La asistencia a todas las sesiones de laboratorio es obligatoria y cualquier ausencia
deberá ser debidamente justificada ante el profesor. Respecto a los exámenes que se
realizarán en el curso, se citan a continuación las normas internas aprobadas por el Consejo
de la Escuela de Biología, vigentes desde el 16/01/79:
1) La obligación de los coordinadores de asignaturas de fijar y comunicar por escrito a los
estudiantes, a comienzos del semestre, la fecha de todos los exámenes a realizarse durante
el mismo.
2) La prioridad que deben tener los exámenes de asignaturas obligatorias sobre los
correspondientes a las asignaturas electivas y sobre otras actividades como salidas de
campo de asignaturas electivas, trabajos especiales de grado, etc.
3) La necesidad que el estudiante presente por escrito y acompañado de un certificado, en
un lapso máximo de 5 días posterior a la fecha de realización del examen, las razones de su
ausencia del mismo si fuese el caso.
EVALUACIÓN DEL LABORATORIO
El sistema de evaluación será parecido al empleado en el Laboratorio de Ecología I.
Debido a que el grado de complejidad de cada una de las unidades que componen este
laboratorio es variable, éstas tendrán los siguientes porcentajes:
UNIDAD I (COMUNIDADES): 30 %.
UNIDAD II (ECOSISTEMAS): 50 %.
UNIDAD III (PROBLEMAS AMBIENTALES): 20 %.
A su vez, cada unidad será evaluada de la siguiente manera:
Informe
Trabajo de campo y/o laboratorio
Examen corto
Discusión
Examen parcial
30 %
5%
15 %
10 %
40 %
2
El informe de cada trabajo práctico deberá contener los siguientes aspectos:
1) Título del trabajo práctico.
2) Introducción y objetivo del trabajo práctico.
3) Descripción de resultados obtenidos.
4) Análisis y discusión de resultados obtenidos.
5) Conclusión del trabajo realizado.
6) Referencias bibliográficas consultadas.
Los exámenes se distribuirán de la siguiente manera; un (1) examen correspondiente
a la práctica de Comunidades (Unidad I), un examen (1) correspondiente a las prácticas de
Productividad primaria terrestre y acuática (Unidad II), un (1) examen correspondiente a la
práctica de Relaciones tróficas (Unidad II) y un (1) examen correspondiente a la práctica de
Enriquecimiento (Unidad III).
3
Cronograma
Semana
1
Fecha
13 octubre
Tópicos
Introducción general del laboratorio.
Introducción a la práctica de Comunidades.
Procesamiento de muestras de la práctica de Comunidades
2
20 octubre
Primer examen corto (Comunidades).
Procesamiento de muestras de la práctica de Comunidades
3
27 octubre
Taller de trabajo de datos de la práctica de Comunidades
Introducción teórica y del trabajo de campo correspondiente a las prácticas sobre
Productividad Primaria Terrestre y Acuática
4
3 noviembre
5
6
7
8
9
Segundo examen corto (Productividad Primaria Terrestre y Acuática).
Entrega del informe de Comunidades
Introducción al trabajo de campo de la práctica de Relaciones Tróficas.
10 noviembre Discusión de la práctica de Comunidades
EVALUACIÓN DE LA PRACTICA SOBRE COMUNIDADES.
17 noviembre Salida de campo correspondiente a las prácticas: productividad primaria terrestre y
acuática, y relaciones tróficas (17 al 19 de Noviembre).
24 noviembre Introducción teórica a la práctica de Relaciones Tróficas
Taller de trabajo de los datos de las prácticas de productividad primaria terrestre y
acuática.
8 diciembre
Tercer examen corto (relaciones tróficas).
Entrega del Informe de las prácticas de productividad primaria terrestre y acuática.
Procesamiento de las muestras de la práctica de Relaciones Tróficas
15 diciembre Discusión de las prácticas de Productividad Primaria Terrestre y Acuática
EVALUACIÓN DE LAS PRACTICAS SOBRE PRODUCTIVIDAD PRIMARIA
TERRESTRE Y ACUATICA.
Procesamiento de muestras de la práctica de Relaciones Tróficas
10
12 enero
Taller de trabajo de los datos de la práctica de Relaciones Tróficas
Actividad Demostrativa de Modelos de Simulación.
11
19 enero
Entrega del informe de Relaciones Tróficas
Introducción teórica y del trabajo de campo de la práctica de Enriquecimiento.
12
26 enero
Discusión de la práctica de Relaciones Tróficas
EVALUACIÓN DE LA PRÁCTICA DE RELACIONES TRÓFICAS
13
2 febrero
Salida de campo correspondiente a la práctica de Enriquecimiento
14
9 febrero
Cuarto examen corto (Enriquecimiento)
Procesamiento de muestras de la práctica de Enriquecimiento
15
16 febrero
Entrega del informe de la práctica de Enriquecimiento.
16
23 febrero
Discusión de la práctica de Enriquecimiento.
EVALUACIÓN DE LA PRACTICA DE ENRIQUECIMIENTO
4
UNIVERSIDAD CENTRAL DE VENEZUELA
FACULTAD DE CIENCIAS
ESCUELA DE BIOLOGIA
DEPARTAMENTO DE ECOLOGIA
LABORATORIO DE ECOLOGIA II
Análisis de una comunidad
por Roberto Barrera y Maria E. Grillet
INTRODUCCION
Se puede llamar comunidad al conjunto de poblaciones (de distintas especies) que
coexisten en forma estable en un ambiente dado. En la naturaleza, los organismos individuales
interactúan entre sí y con el medio físico, y al sistema formado por ambos componentes
(biótico y abiótico) se le denomina ecosistema. Aunque ambos componentes son
funcionalmente inseparables, los seres vivos se han considerado aparte (la comunidad) a fin de
analizarlos como un nivel de organización más complejo que las poblaciones aisladas. Así, la
comunidad tiene atributos propios que difícilmente pueden inferirse a partir de la descripción
de las poblaciones que la constituyen. A este tipo de atributos se les llama propiedades
emergentes, y una de ellas es la estructura de la comunidad.
En general, se pueden identificar tres tipos de factores determinantes de la estructura
comunitaria: la dispersión o propagación espacial de las especies, su interacción con el medio
físico y las interacciones dentro del medio biótico. Como puede suponerse, el análisis de una
comunidad puede ser muy complejo si pretendemos incluir a todas las especies que la integran
y a todas las posibles interacciones entre ellas. Por estas y otras razones, los estudios de
comunidades se han realizado sobre sub-conjuntos de especies definidos con criterios
taxonómicos (comunidades de insectos), espaciales (comunidades litorales), tróficos
(comunidades de vertebrados frugívoros), entre otros.
En los últimos años se ha hecho énfasis en el estudio de las interacciones bióticas que
determinan la estructura de las comunidades. Entre ellas, la competencia y la depredación
figuran entre las más importantes. Tradicionalmente se ha supuesto que las interacciones con
otras especies determinan cuál fracción de los recursos va a ser explotada por una especie en
particular. Esto último es una versión del concepto de nicho ecológico, cuya formulación
original se debe a G. E. Hutchinson (1957). Hutchinson concibió el nicho como el conjunto de
intervalos de supervivencia (de una población monoespecífica) en aquellas dimensiones
ambientales pertinentes a la especie, como pueden ser la temperatura ambiental, el tamaño de
presa, pH del agua u otros. Es decir, es la posición de una población en un sistema
multidimensional de variables ambientales (recursos). Ahora bien, en la práctica se estudian
generalmente:
1) La variedad de recursos utilizada por cada especie en relación a lo disponible, así
como los cambios temporales (diarios, estacionales) en el patrón de uso.
5
2) La forma en que se explota un recurso: si una especie utiliza una gran parte de los
estados posibles de un recurso (Ej. Hay plantas capaces de crecer en una amplísima gama de
tipos de suelo) la definimos como generalista o de nicho ancho. Por el contrario, hay otras que
sólo utilizan una pequeña variedad de los recursos potencialmente utilizables (Ej. hay colibríes
que sólo se alimentan del néctar de algunas flores), por lo cual se les llama especialistas o de
nicho estrecho.
3) La explotación simultánea de uno o más recursos por varias especies, la cual se
denomina sobreposición de nichos. Al respecto, la sobreposición de nichos no implica que
ocurra competencia, mientras que la competencia sólo puede ocurrir si hay sobreposición de
nichos. Asimismo, se entiende por partición de recursos al conjunto de mecanismos (uso del
tiempo, espacio, alimento, conducta, etc.) que permiten la coexistencia estable de especies.
Cuando se hacen estos estudios, es frecuente encontrar que hay subgrupos de especies
que utilizan en común una gran proporción de sus recursos, y a estos grupos de especies se les
denomina gremios. El concepto de gremio tiene una utilidad más bien práctica por tratarse del
análisis de nichos en especies parecidas. Así, se puede hablar del gremio de aves insectívoras
y el gremio de las frugívoras dentro de la comunidad de aves de un bosque. En efecto, las
especies insectívoras tendrán más en común entre sí que con las frugívoras, y dentro de cada
gremio se esperaría encontrar mecanismos más finos de uso de los recursos. Un análisis como
el que se ha descrito, permite estudiar los mecanismos de estructuración comunitaria. Sin
embargo, con este enfoque es difícil hacer comparaciones entre comunidades muy diferentes.
Para poder comparar distintas comunidades se requiere del uso de propiedades
emergentes que sinteticen los rasgos más relevantes de su estructura, y que no dependan
explícitamente del tipo de organismos de cada una. Entre ellas se tienen la diversidad de
especies (usualmente expresada mediante índices), y el uso de técnicas estadísticas
multivariadas, las cuales permiten, entre otras cosas:
- Evaluar en forma rápida el grado de semejanza entre la estructura de dos o más
comunidades.
- Detectar si dos o más comunidades aparentes son una misma.
- Detectar la posible existencia de grupos de especies definidos dentro de una "comunidad"
aparentemente única.
- Examinar cuáles especies determinan las mayores diferencias entre distintas comunidades.
Otras medidas más sencillas de semejanza (o diferencias) entre comunidades son los
índices de similitud, en los cuales se utiliza generalmente el porcentaje de especies comunes a
dos comunidades como rasgo básico de semejanza. Las técnicas multivariadas, por el
contrario, pueden incluir simultáneamente los datos de presencia, ausencia, abundancia,
biomasa, etc., de todas las especies, así como también pueden incluir los datos del ambiente
abiótico respectivo.
Finalmente, es imprescindible recordar que las comunidades no son entidades
invariantes, sino que, por el contrario, cambian a lo largo del tiempo tanto en estructura como
en organización. A esta secuencia de cambios se le llama sucesión ecológica y pueden tomarse
como ejemplos la colonización de islas volcánicas oceánicas por parte de organismos vivos
6
del continente (sucesión primaria) o la reocupación de un conuco abandonado por la
vegetación original circundante (sucesión secundaria).
OBJETIVOS
Estudiar algunos de los atributos del nivel de organización comunitario tales como:
1) Diversidad (riqueza y equidad) en comunidades de diferentes edades en función de los
cambios en los recursos.
2) Patrón de utilización de recursos por las especies más comunes de la comunidad de insectos
(nicho).
MATERIALES Y METODOS
a.- La comunidad
La comunidad de insectos asociados a las brácteas de la planta Heliconia caribaea
Lamarck (Zingiberales: Musaceae) fue elegida para la realización de esta práctica por varias
razones:
1) La riqueza de especies de insectos es relativamente baja.
2) Los insectos viven en unidades de hábitat discretas (las brácteas) fácilmente
manipulables.
3) Existen múltiples réplicas que permiten la manipulación experimental.
4) La posibilidad que ofrece la inflorescencia de H. caribaea de considerarla como una
comunidad única, o de considerar a cada bráctea como una comunidad de edad
diferente.
Un individuo de H. caribaea está formado por un grupo de tallos vegetativos, cada uno
de los cuales puede llegar a tener una inflorescencia al año. La floración se extiende durante
todo el año, comenzando en diciembre-enero con un máximo entre junio y julio.
Una inflorescencia (Fig.1) está constituida por una serie de hasta 20 brácteas o espatas
verticalmente alternas. Cada bráctea abre en un período aproximado de una semana, contiene
de 20 a 30 flores. Las brácteas de mayor edad están situadas más abajo que las más jóvenes.
Conociendo estos antecedentes, se puede asignar la edad en semanas a cada bráctea. Las
brácteas de H. caribaea retienen agua proveniente de las lluvias y de procesos de transporte
desde las raíces. Dentro de la bráctea, las flores usualmente están sumergidas. Cuando una flor
madura, emerge desde el fondo, expone sus órganos reproductivos y es polinizada por
colibríes. La flor tiene seis estambres (5 fértiles y 1 infertil) y un estilo, los elementos de la
corola están fusionados en estructuras hialinas envolventes.
La comunidad de insectos que viven en las brácteas de H. caribaea consta de fases
pre-adultas acuáticas. La principal fuente de energía de esta comunidad proviene de los
tejidos florales. Existe alguna controversia acerca de si estos insectos son herbívoros
(depredadores de plantas) y consumen parte de las flores o semillas vivas, o si es una
7
comunidad de descomponedores (saprófagos) que se alimentan de las partes florales muertas
que ya cumplieron su función reproductiva.
La planta H. caribaea posee una distribución geográfica que coincide con las áreas
ocupadas por los bosques lluviosos tropicales. En ellos, esta planta crece en las márgenes de
las quebradas, en los claros del bosque producidos por las caídas de los árboles, a orillas de
carreteras y en zonas perturbadas del bosque donde existe una alta incidencia solar.
b.- Area de estudio
El personal docente hará un muestreo de inflorescencias e insectos en un lugar
preseleccionado de acuerdo a características tales como: la abundancia de plantas con
inflorescencias, la accesibilidad del lugar etc. La zona seleccionada, así como algunas
características climáticas de la misma, le será informada por su profesor en el momento de la
práctica.
c.- Trabajo de campo
El personal docente colectará inflorescencias en buen estado (no rotas) con 6 ó más
brácteas. Para cortar dichas inflorescencias se las mantiene en una posición vertical y se usan
tijeras de podar muy afiladas. Una vez obtenida la inflorescencia, se cortan las brácteas una a
una y se les transfiere individualmente a bolsas plásticas adecuadamente rotuladas. Cada
bráctea debe ser manipulada teniendo cuidado de que no se pierda su contenido. Una vez en la
bolsa, el material se preservará en etanol al 80%. Cabe destacar, que se considerará como de
mayor de edad a la bráctea basal y de menor edad a la apical. A la bráctea aún cerrada del
extremo superior de la inflorescencia se le asigna la edad cero.
8
d.- Procesamiento de las muestras
El material de estudio, previamente colectado por el personal docente, le será
entregado para su procesamiento el día de la práctica. El mismo se realizará en dos períodos
de práctica en los que se evaluarán los recursos disponibles para los insectos y se
identificarán y contarán estos últimos.
Para el procesamiento deberá traer pinzas finas, aguja de disección, gotero y pincel fino. A
cada equipo se le entregará una serie de brácteas (todas provenientes de una misma
inflorescencia) debidamente identificadas con la edad (en semanas) de cada bráctea. Una vez
verificado este material, proceda cuidadosamente como sigue:
Primer período de práctica.
1) Separación preliminar de los insectos libres.
En un recipiente con agua, se sumergirá y agitará suavemente cada bráctea por
separado a fin de separar los insectos y otros materiales no identificables a simple vista. Todo
lo incluido en la bolsa plástica también se transferirá al recipiente usando una piceta. Las
paredes de la bolsa deben quedar limpias. Usando pinzas, pincel o aguja de disección, se
colectará todo el material del recipiente, y se lo verterá en un frasco debidamente rotulado con
el grupo de práctica, equipo, y la edad de la bráctea.
Previa revisión, descarte los fragmentos de bráctea sobrantes. Debe ser muy cuidadoso
por el tamaño y fragilidad de algunas larvas (Ej. larvas de zancudo). Recuerde que un insecto
no colectado o muy maltratado puede incidir significativamente en sus resultados.
Una vez concluida esta primera operación, filtre toda el agua del recipiente en una
malla fina. Finalmente, lave la malla con etanol al 70% usando una piceta, y coloque el
material retenido en el tamiz en el frasco rotulado.
2) Evaluación del estado de los recursos.
Esta fase del trabajo es fácil de realizar pero debe hacerse con sumo cuidado porque de
ella dependen los resultados finales.
La evaluación se hará indirectamente, mediante clasificación de las flores según las
categorías arbitrarias de "descompuesta" o "no descompuesta" y los frutos por otra parte. El
personal docente le indicará el criterio para asignar a las flores estas categorías. El material
será agitado cuidadosamente en el recipiente con agua a fin de que los organismos presentes
queden en el agua del recipiente. Posteriormente las flores descompuestas de cada bráctea se
separarán de las no descompuestas y de los frutos.
En una planilla de resultados se anotarán: la edad de cada bráctea, la masa de flores
descompuestas, no descompuestas y los frutos. Los restos florales se retirarán del recipiente de
agua y los organismos provenientes de las flores deberán reunirse en el frasco respectivo.
Antes de descartar los restos florales, asegúrese de que no contienen organismos. La
9
planilla de datos de su equipo es indispensable para el resto de la práctica, por lo cual es
conveniente tener más de una copia.
Segundo período de práctica
Identificación y contaje de los insectos de cada bráctea.
En este período de procesamiento de muestras, los insectos se separarán de otros
materiales (fragmentos de flores, detritus) que hubiesen quedado de la etapa anterior y se les
identificará hasta el nivel taxonómico más específico posible, para lo cual se valdrá de las
ilustraciones y consultará la colección de referencia. Ambas tareas se harán usando una lupa.
En la planilla de resultados que contiene la información de los recursos, se reportará el número
de organismos (según su grupo taxonómico) presentes en cada bráctea.
IMPORTANTE: El análisis de resultados se hará con los datos de todo el grupo (sección) de
laboratorio, luego cada equipo es responsable de una parte de ese total. Como precaución, se
deben tener al menos dos copias de los resultados obtenidos por cada equipo en cada etapa.
Una tercera copia deberá entregarse a su preparador al finalizar el trabajo.
PROCESAMIENTO DE DATOS
a.- Estimaciones de diversidad y equidad
Para este fin, se considerará a cada una de las brácteas de la inflorescencia como una
comunidad, con edades y estados de los recursos diferentes.
Se han propuesto varios coeficientes para estimar la "diversidad" de una comunidad.
Los más usuales consideran los dos componentes de la diversidad: el número o riqueza de
especies y la distribución de los individuos presentes entre las mismas (la equidad de la
comunidad). La diversidad aumentará tanto con el número de especies como con la equidad en
la distribución de los individuos entre las especies. Una comunidad (o una muestra) que
contenga 100 especies muy probablemente será más diversa que otra que contenga cinco. La
importancia de la equidad no es tan obvia y se ilustrará con un ejemplo:
Supóngase que para muestrear dos comunidades se extraen 1000 individuos de cada
una (Ej.insectos de dos tipos de sabana) y que en ambos casos hay 10 especies en total. En la
primera hay 100 individuos por especie y en la segunda, una especie es ampliamente
dominante (digamos 800 individuos) y las otras son relativamente escasas. Aunque ambas
muestras tienen el mismo número de especies (riqueza), la muestra con mayor equidad, es
decir la primera, es la más diversa. Este primer ejemplo es un caso de máxima equidad. La
mínima equidad, o máxima dominancia, se tendría si hay 991 individuos de una especie y uno
de cada una de las restantes.
Es conveniente aclarar que para efectuar estas comparaciones, el número de individuos
de cada muestra no tiene que ser necesariamente el mismo porque para los cálculos de
diversidad y equidad no se usan frecuencias absolutas (número de individuos) sino las
relativas (fracciones).
10
Cualquier índice de diversidad matemáticamente probado y cuyo valor aumente al
aumentar la riqueza (S) o la equidad, será un posible índice de diversidad, y podría utilizarse
para tal fin. De hecho, se han creado varios índices, y en este trabajo práctico se utilizará el de
Shannon.
Indice de diversidad de Shannon
El índice de diversidad de Shannon es un índice muestral, por lo cual tiende a
estabilizarse a medida que aumenta el número de muestras. Los índices de diversidad se
pueden calcular tanto para especies de seres vivos, como para cualquier otra variable. Por
ejemplo, se puede calcular un índice de diversidad para los recursos alimentarios, para
variables del hábitat, etc. Este índice se calcula según la siguiente fórmula:
s
H'= - Σ (pi ln pi)
i=1
donde:
pi = Ni/N ; Ni = número de individuos de la especie i en la muestra.
N = el número total de individuos (todas las especies) de la muestra.
Indice de equidad asociado al índice de Shannon
Puede verse que si existe máxima equidad, el valor de todos los pi será el mismo e
igual a 1/S. Luego, el máximo valor de H' para un número dado (S) de especies, será:
s
H'max = - Σ (1/S log 1/S)= -log (1/S)
i=1
H'max = log S
Así, la equidad puede estimarse como el coeficiente V':
V'= H'/H'max = H'/log S
V' fluctúa entre 0 y 1, indicando este último valor la máxima equidad posible.
En nuestro caso se calculará la diversidad de especies en cada edad de las brácteas
utilizando todas las brácteas de la misma edad en cada caso, donde:
No Total de individuos de la especie i
pi = _______________________________________
No Total de individuos
11
s
H'a = - Σ (pi log pi) (para la clase de edad "a")
i=1
En igual forma, se calculará el valor de V' para cada clase de edad.
EVALUACIONES GRAFICAS
A fin de examinar gráficamente las relaciones entre las variables ambientales y la
diversidad de especies, así como entre los índices calculados de diversidad y equidad, se
pueden elaborar las siguientes figuras (solas o combinadas):
1) Número de flores descompuestas, no descompuestas y frutos vs. Edad de la bráctea;
2) No sp vs. Edad de la bráctea;
3) H' vs. Edad de la bráctea;
4) V' vs. Edad de la bráctea;
5) H' vs. V' ;
6) H' vs. No sp.
IMPORTANTE: En esta fase de interpretación de resultados, lo importante es que los
cursantes desarrollen su imaginación y sentido lógico para formularse preguntas y tratar de
responderlas, es decir, de extraer un máximo de información del ejercicio. Luego, si algún
alumno cree necesario aplicar otras técnicas u otro enfoque, puede hacerlo.
PATRÓN DE UTILIZACIÓN DE RECURSOS (ancho y sobreposición de nicho)
Para esto se considerará que la comunidad es la inflorescencia completa, y que las
brácteas, de diferentes edades representan diferentes estados de los recursos. Desde este punto
de vista, la secuencia de edades (1 a 8) representará un gradiente de estado de los recursos
(pH, cantidad de materia orgánica, densidad bacterial, contenido de agua, etc.), los cuales
varían en forma simultánea. Cada especie será capaz de explotar esta gama de recursos en una
forma determinada (ancho de nicho) con la posible simultaneidad de uso con otras especies
(sobreposición de nicho).
Una vez procesadas las muestras, se deben ordenar los datos según la siguiente matriz:
especie
1
2
.
S
1
# ind.
# ind.
# ind.
# ind.
2
# ind.
# ind.
# ind.
# ind.
Gradiente del estado del recurso
edad de la bráctea (estado del recurso)
3
4
5
………… ………… …………
………… ………… …………
………… ………… …………
………… ………… …………
6
…………
…………
…………
…………
7
# ind.
# ind.
# ind.
# ind.
12
Se utilizará el número de individuos para caracterizar la abundancia de la especie, pero
en otros casos, como organismos coloniales o de reproducción vegetativa, se puede utilizar la
biomasa. Para visualizar cómo se distribuyen los organismos en relación al estado de los
recursos se evaluará visualmente la gráfica que representa esta relación. Esas distribuciones
también se han llamado los patrones de uso de los recursos. A continuación se da un ejemplo
de esos patrones.
1) Relación entre la abundancia de cada especie y la edad de la bráctea.
ABUNDANCIA DE ESPECIES VS. EDAD DE LA BRÁCTEA
10
Número de
organismos
8
6
sp. 1
sp. 2
4
sp. 3
2
0
0
1
2
3
4
5
6
Edad de la bráctea (semanas)
2) Cálculo del ancho de nicho para cada una de las especies presentes, utilizando la siguiente
fórmula:
B'i = - Σ pij log pij
donde:
pij = nij/Ni
nij = No de individuos de la sp i presentes en la bráctea de
edad j.
Ni = No total de individuos de la sp i.
13
Ejemplo: Para Ni = 10
edad bractea
No. individuos
1
0
2
2
3
6
4
1
5
1
6
0
7
0
B'i = -[0,2 log(0,2) + 0,6 log(0,6) + 0,1 log(0,1) + 0,1 log(0,1)]
B'i = 0,47
Como puede verse, la fórmula para evaluar el ancho de nicho es la misma de
diversidad de Shannon, pero usando la matriz de datos transpuesta. En otras palabras, el ancho
de nicho se evalúa como la diversidad de estados de recursos que usa la especie.
3) Por último, se puede examinar la sobreposición de nicho entre las especies más
abundantes. Para ello, la fórmula a utilizar es la siguiente:
Cih = 1 - 1/2 Σ |pij - phj|
j
donde:
Pij y Phj son las proporciones de las especies i y h presentes en la bráctea de edad j, y
Cih es la sobreposición de nicho entre ambas especies. Tiene un valor máximo de 1
(sobreposición total) y un valor mínimo de 0 (no hay sobreposición).
Por ejemplo, se puede tener el siguiente caso:
especie
I
H
Pij = nij/Ni
Ni = 20
1
0
0
2
2
0
edad de la bractea
3
4
5
4
6
6
0
2
4
6
2
2
7
0
1
Ntotal
8
0
1
20
10
Phj = nhj/Nh
Nh = 10
14
especie
I
H
1
0
0
2
0.1
0
edad de la bractea
3
4
5
0.2
0.3
0.3
0
0.2
0.4
6
0.1
0.2
Cih = 1 - 1/2 |(0-0) + (0,1-0) + (0,2-0) + (0,3-0,2) + (0,3-0,4)
0,1)|
7
0
0.1
8
0
0.1
+ (0,1-0,2) + (0-0,1) + (0-
Cih = 1 - 1/2 (0,8) = 0,6
Los resultados de sobreposición de nichos pueden expresarse en forma compacta
mediante una semi-matriz de valores de sobreposición. En este ejemplo, Cab es la
sobreposición de nicho entre las especies A y B, Ccd entre C y D, etc.:
especie
A
B
C
D
E
F
a
1
b
Cab
1
especie
c
Cac
Cbc
1
d
Cad
Cbd
Ccd
1
e
Cae
Cbe
Cce
Cde
1
f
Caf
Cbf
Ccf
Cdf
Cef
1
El análisis de estos resultados puede ser de ayuda para determinar si existe relación
entre la diversidad de la comunidad y el grado de sobreposición de nicho en sus especies
componentes. En otras palabras, puede relacionar el patrón de uso de los recursos por la
comunidad y la diversidad de especies de la misma.
REFERENCIAS BIBLIOGRAFICAS
Barrera, R. 1983. Ecología de la comunidad de insectos de las brácteas de Heliconia
caribaea Lamarck (Zingiberales: Heliconiaceae). Trabajo de Acenso UCV, Fac.
Ciencias, I.Z.T., 234 p.
*Colwell, R.K. & D.J. Futuyma. 1971. On the measurement of niche breadth and niche
overlap. Ecology 52: 567-576.
Hill, M.O. 1973. Diversity and Eveness: an unifying notation and its consequences. Ecology
54: 427 - 432.
* Machado-Allison, C.E., D. J. Rodríguez, R. Barrera & C. Gómez-Cova. 1983. The
insect community associated with inflorescences of Heliconia caribaea Lamark in
15
Venezuela. En: Phitotelmata: L.P. Lounibos (Ed). Plexus Publications.
N.Y.
Medford,
Pianka, E.R. 1976. Competition and niche theory. En: Theoretical Ecology. Principles and
applications, Capítulo No.7. R.M. May Ed.
* Pianka, E.R. 1979. Evolutionary Ecology. 2nd. Edition. Capítulos 7 y 8. Harper & Row
Publ., New York.
Ricklefs, R.E. 1979. Ecology. Capítulos 37, 38 y 39. Chiron Press, New York.
* Seifert, P.R. 1982. Neotropical Heliconia Insect Communities. The Quaterly Review of
Biology 57(1):1-28.
Smith, B y J. B. Wilson. 1996. A consumer´s guide to evenness indices. Oikos 76: 70-82.
(*) Referencias de consulta obligatoria.
16
CLAVE PARA LA IDENTIFICACIÓN DE LA COMUNIDAD DE INSECTOS ASOCIADOS A
LAS BRÁCTEAS DE Heliconia caribaea, Musaceae
PRÁCTICA DEL LABORATORIO DE ECOLOGIA II: ANÁLISIS DE UNA COMUNIDAD
(Realizada por la Lic. Máyida El Souki y revisada por el Prof. Rubén Candia)
CLAVE PARA LARVAS
1.a. Larvas con aparato bucal masticador, con mandíbulas claramente distinguibles y
esclerotizadas------------------------------------------Orden: COLEOPTERA -------------------11
1.b. Aparato bucal diferente, no esclerotizado-----------------Orden: DIPTERA----------------------2
2.a. Larvas con cuerpo diferenciado en cabeza, tórax y abdomen; en algunos casos el tórax
solo es diferenciado por la presencia de propatas---------------------------------------------------------------------------------------------------DIPTERA Suborden: Nematocera- (Fig. 2a)----3
2.b. Cuerpo no como arriba, en algunos casos se puede diferenciar solo la cabeza-----------------------------------------------------------------DIPTERA Suborden: Brachycera--(Fig. 2b)---8
Cabeza
2a
2b
3.a. Cuerpo con sifón caudal respiratorio; cabeza diferenciada y presentando cepillos bucales
(labrales); segmentos torácicos típicamente engrosados y llevando un mechón de
setas laterales ------------------------------------------------------------Familia: Culicidae-------3c
3.b. Cuerpo diferente al anterior, puede presentar el último segmento abdominal alargado en
forma de tubo respiratorio, pero sin tórax claramente diferenciado--------------------------4
17
3.c.1. Sifón respiratorio alargado con setas abundantes y gruesas, con presencia de peine o
pecten en el sifón y en el último segmento caudal---------------------------Culicidae: Culex
3.c.2. Sifón respiratorio en forma de cono, con setas más dispersas y más cortas que en
Culex; último segmento caudal con placa esclerotizada-------------Culicidae: Wyeomyia
3.c.3. Sifón respiratorio sin pecten o peine; cuerpo robusto-----------Culicidae: Toxorhynchites
Toxorhynchites
4.a. Cabeza retráctil dentro del tórax; cuerpo con proyecciones carnosas, usualmente de
colores blancos, grises o negruzcos -----------------------------Familia: Tipulidae (Fig. 4a)
4.b. Cabeza no retráctil y claramente diferenciada, cuerpo blanco u oscuro-----------------------5
4a
4a
5.a. Larvas con el último segmento caudal en forma de tubo respiratorio esclerotizado;
segmentos del cuerpo frecuentemente subdivididos hasta formar anillos (“annulis”);
integumento comúnmente con placas dorsales esclerotizadas---Familia: Psychodidae
(Fig. 5a)
5.b. Cuerpo no como arriba--------------------------------------------------------------------------------------6
5a
18
6.a. Cuerpo cilíndrico con propatas torácicas---------------------------------------------------------------7
6.b. Cuerpo cilíndrico sin propatas, alargado y frecuentemente semejante a una anguila; con
cápsula cefálica claramente diferenciada y esclerotizada----Familia: Ceratopogonidae
a
b
7.a. Propatas ventrales del protoráx bifurcadas------------------------------Familia: Chironomidae
7.b. Propatas ventrales del protorax no bifurcadas (fusionadas)--------Familia: Thaumaleidae
Propatas bifurcadas
No bifurcadas
b
a
Propatas
8.a. Larvas con tubo respiratorio o espiráculo alargado en la zona caudal--------------------------9
8.b. Larvas sin tubo respiratorio, aplanadas dorsoventralmente; con cápsula cefálica
diferenciada, no retráctil; larvas de colores blanco, gris o negruzco------------------------10
9.a. Larvas muscoiformes cilíndricas, con espiráculo posterior en forma de tubo alargado, a
veces más largo que su propio cuerpo, y que puede ser retráctil o no----------------------------------------------------------------------------------------------------Familia: Syrphidae (Fig. 9a)
9.b. Larvas muscoiformes, con espiráculo posterior que consiste en un segmento caudal
alargado formando un tubo respiratorio retráctil. Parte ventral caudal con almohadilla
perianal bilobulada (disco carnoso)----------------------------Familia: Ephydridae (Fig. 9b)
9a
9b
Almohadilla o
disco carnoso
19
10.a. Larvas con integumento endurecido debido a depósitos de carbonato de calcio, cuerpo
presenta gran variedad de vibrisas (setas); cabeza parcialmente retráctil------------------------------------------------------------------------------------Familia: Stratiomyiidae: Quichuana
10.b. Cuerpo no como arriba, en ocasiones se puede observar un esclerito hypostomal en
forma de “H” en la cápsula cefálica---------------------Familia: Richardiidae: Beebeomyia
a
Esclerito
hypostomal
b
11.a. Larvas con forma cilíndrica------------------------------------------------------------------------------12
11.b. Larvas aplanadas dorsoventralmente y con forma de concha---------------------------------------------------------------------------------------------------------------Familia: Chrysomelidae---13
12.a. Larvas elongadas, ahusadas en ambos extremos, algo achatadas, esclerotizadas
dorsalmente y variadamente marcada; con pequeña cabeza retráctil, siendo curva;
frecuentemente con expansión torácica y tergo abdominal. Presencia de un órgano
lumínico en el segmento 8.--------------------------------------------------Familia: Lampyridae
12.b. Cuerpo de formas variadas: alargados, semicilíndricos, cilíndricos o moderadamente aplanados
en secciones transversales; cutícula usualmente blanda; pueden estar presentes tubérculos y
agallas en las larvas de algunos géneros---------------------------------------Familia: Hydrophilidae
a
b
20
13.a. Protórax con bifurcación-------------------Familia: Chrysomelidae: Xenarescus (Fig. 13a)
13.b. Protórax sin bifurcación -------------------Familia: Chrysomelidae: Cephaloleia (Fig. 13b)
Bifurcación
13a
13b
21
CLAVE PARA PUPAS
1.a. Pupas con forma curva, base del abdomen más estrecho que el tórax-------------------------------------------------------------------------------------------------------------Familia: Culicidae----2
1.b. Pupas con contorno ovalado visto desde arriba, base del abdomen no más estrecho que
el tórax--------------------------------------------------------------------------------------------------------3
b
a
2.a. Agallas caudales ovaladas-----------------------------------------------------------Culicidae: Culex
2.b. Agallas caudales estrechas----------------------------------------------------Culicidae: Wyeomyia
b
a
Agallas
3.a. Con sifón respiratorio----------------------------------------------------------------------------------------4
3.b. Con agallas respiratorias-----------------------------------------------------------------------------------6
Agallas
respiratorias
a
b
22
4. a. Patas proyectadas más allá del tórax alcanzando el abdomen-----------Familia: Tipulidae
4.b. Patas no sobrepasan el tórax-----------------------------------------------------------------------------5
a
Cabeza y Tórax
Patas
5.a. Segmento apical del abdomen termina en dos espinas o púas superiores y dos
inferiores------------------------------------------------------------------------Familia: Psychodidae
5.b. Segmento apical del abdomen termina en dos procesos cónicos, a veces pueden ser
largos y delgados y más o menos ovales en sección transversal------------------------------------------------------------------------------------------------------------Familia: Ceratopogonidae
Espinas
superiores
a
b
Espinas
inferiores
6.a. Varias agallas respiratorias a nivel torácico------------------------------Familia: Chironomidae
6.b. Dos agallas respiratorias a nivel caudal---------------------------------------Familia: Ephidridae
Agallas respiratorias
b
23
UNIVERSIDAD CENTRAL DE VENEZUELA
FACULTAD DE CIENCIAS
ESCUELA DE BIOLOGIA
DEPARTAMENTO DE ECOLOGIA
LABORATORIO DE ECOLOGIA II
PRODUCTIVIDAD PRIMARIA
INTRODUCCION GENERAL
La biosfera comprende la parte superior de la corteza terrestre, en donde se encuentra la
interfase agua, tierra y atmósfera. Esta interfase constituye el asiento de diferentes formas de vida que
interactúan entre sí y con el medio físico que las rodea. La energía proveniente del sol es la base de
mucho de los procesos que se dan en la biosfera, entre ellos la fotosíntesis, la cual es esencial para el
mantenimiento y funcionamiento de cualquier individuo, población, comunidad y ecosistema.
La fotosíntesis es el proceso a través del cual los organismos autótrofos convierten la energía
luminosa en energía química, que se almacena en forma de materia orgánica (carbono reducido) en
compuestos como carbohidratos, proteínas y lípidos. La cantidad de materia orgánica acumulada en
un instante y área determinada por los organismos autótrofos se denomina producción primaria,
mientras que la cantidad producida por unidad de tiempo (sobre una base de área o volumen) se
denomina productividad primaria. Por lo tanto, la productividad primaria puede ser entendida
como la tasa o la velocidad de la producción de la materia orgánica debida a los autótrofos.
Es importante resaltar que no todo el carbono fijado en la fotosíntesis es retenido por la
célula, pues una parte de ese carbono debe ser utilizado para liberar energía en el proceso de
respiración. Así, la cantidad total de carbono fijado se conoce como producción primaria bruta (y su
tasa correspondiente como productividad primaria bruta), mientras que la cantidad de carbono
remanente que es almacenado por la célula se denomina producción primaria neta (o productividad
primaria neta si es referida en función del tiempo).
Productividad Primaria Bruta (PPB) = Productividad Primaria Neta (PPN) + Respiración ( R)
El carbono o materia orgánica almacenado por los autótrofos es la base energética
fundamental para el mantenimiento de otros eslabones tróficos, como los consumidores de primer,
segundo y otros órdenes, así como los descomponedores que se alimentan de material muerto. De
manera que podría intuirse que a mayor productividad de un ecosistema, mayor es la cantidad de
energía y carbono para los eslabones tróficos a los cuales soportan los autótrofos y ello
eventualmente podría estar relacionado con una mayor abundancia y diversidad de organismos en
una comunidad. En ello estriba la importancia del estudio de la producción de materia orgánica
como característica funcional de los ecosistemas.
24
UNIVERSIDAD CENTRAL DE VENEZUELA
FACULTAD DE CIENCIAS
ESCUELA DE BIOLOGÍA
DEPARTAMENTO DE ECOLOGÍA
LABORATORIO DE ECOLOGÍA II
ESTIMACIÓN DE LA PRODUCTIVIDAD PRIMARIA EN UN ECOSISTEMA TERRESTRE
por Ismael Hernández
La productividad primaria depende de la fracción de energía solar radiante visible captada
por los cloroplastos, es decir, es una fracción directa de la fotosíntesis, por lo que puede ser limitada
por variables ambientales extrínsecas o intrínseca a las plantas. Dentro de las extrínsecas tenemos:
•
•
•
•
•
Radiación
Temperatura
Humedad
Disponibilidad de nutrimentos, etc
Relaciones intra e ínter específicas (parasitismo, mutualismo, herbivoría, competencia, etc)
Mientras que dentro de las intrínsecas, producto del genotipo y fenotipo, tenemos
•
•
•
•
Índice de área foliar
Orientación y edad de las hojas
Contenido de clorofila
Tipo de metabolismo fotosintético, etc.).
Dentro de los factores ambientales, la precipitación y la temperatura son fundamentales en la
velocidad del proceso productivo y por esta razón se han desarrollado modelos para predecir la PPN
de una determinada región de la tierra, en base a los valores de estos elementos del clima (Lieth,
1973; Lieth & Whittaker, 1975).También se han realizado modelos considerando la
evapotranspiración real (ETR) la cual expresa la pérdida de agua por evaporación del suelo y
transpiración de las plantas por unidad de área y tiempo.
Existe una variedad de metodologías para estimar la PPN, cuyo uso depende del ecosistema a
estudiar (terrestre, acuático ó bien herbáceo, forestal, agrícola, etc). Los métodos utilizados en
ecosistemas forestales son complicados y laboriosos (Newbould, 1967; Lieth & Whittaker, 1975), ya
que la disposición de capas o estratos y las diferencias en edades de las distintas especies arbóreas
hacen necesario aplicar técnicas de análisis dimensional en la mayoría de los casos. Las técnicas de
análisis multidimensional se basan en el uso de sistemas de ecuaciones de regresión que intentan
cuantificar las relaciones entre la biomasa con algún otro parámetro de fácil medición, como son el
diámetro del tronco o la altura del árbol, de manera que los aumentos en diámetro o altura del árbol
se asocian a cambios en biomasa por los procesos productivos.
En el caso de ecosistemas herbáceos, la metodología es más sencilla, ya que permite el uso de
métodos de cosecha como el simplificado de Lownicki et al. (1968) o el de Wiegert & Evans (1964).
Estos métodos permiten estimar la PPN con gran precisión en este tipo de ecosistemas y aunque son
25
destructivos, las la cubierta vegetal puede restablecerse rápidamente a diferencia de los ecosistemas
forestales. Para una revisión de los diversos métodos para estimar la PPN en comunidades terrestres
herbáceos, así como sus valores para los distintos tipos presentes en Venezuela consulte el trabajo
de Susach (1984).
En el presente trabajo se evaluará la productividad primaria de un ecosistema en donde la
vegetación es dominada por una cobertura herbácea, en donde la especie dominantes es Sporobolus
virginicus. Este tipo de ecosistemas es muy común en las franjas litorales de las costas venezolanas y se
caracteriza por la simplicidad en la composición de especies y estructura de la comunidad, debido a
particulares condiciones ambientales que pueden considerarse extremas, como son muy baja
precipitación (< 500 mm/año), altas temperaturas promedios anuales (> 25° C), suelos arenosos y
salinos, con baja capacidad de retención de agua y baja disponibilidad de nutrimentos. Pese a estas
características, la producción vegetal permite sostener diferentes elementos de la fauna como anfibios,
pequeños roedores, insectos y otros invertebrados.
OBJETIVOS
Al finalizar la práctica, el estudiante será capaz de:
1.- Comprender el concepto de PPN y su importancia para el mantenimiento y funcionamiento de un
ecosistema.
2.- Adquirir destrezas en la implementación de los métodos para estimar la PPN y las tasas de
descomposición en un ecosistema herbáceo.
3.- Conocer los factores ambientales e intrínsecos de las plantas más importantes que inciden en la
PPN.
4.- Evaluar las virtudes y defectos del método utilizado en la práctica para estimar la PPN; además de la
extensividad de su uso en:
a) Ecosistemas herbáceos naturales
b) Ecosistemas boscosos
5.- Conocer otros métodos alternativos para determinar la PPN, tanto en ecosistemas herbáceos,
como leñosos.
AREA DE ESTUDIO:
El estudio será realizado en el Centro de Estudios Oceanológicos (CEO) en Quizandal, Estado
Carabobo, aproximadamente a 3 Km. al este de Puerto Cabello. Esta estación pertenece a la
Universidad Simón Bolívar y se dedica a la investigación científica, especialmente en ecología marina.
En los terrenos de la estación se desarrollan pastizales adaptados a tenores moderados de sales en el
suelo, como es el caso de Sporobolus virginicus (vidrio), una gramínea típica de zonas litorales. En
esta práctica evaluaremos la PPN, la tasa de descomposición de la materia orgánica y el flujo de materia
orgánica en un pastizal de Sporobolus virginicus bajo condiciones de:
a) corte
b) corte y fertilización
26
METODOS
Para evaluar la PPN en los tratamientos mencionados, se establecerá una parcela de 10 x 2 m, la
cual a su vez estará dividida en 20 subparcelas de 1 m2 cada una. Dicha parcela será cortada al ras del
suelo con la ayuda de una segadora, de manera que la masa de vegetación remanente sea muy baja.
Diez (10) subparcelas serán fertilizadas con 30 g/m2 de N:P:K (nitrógeno, fósforo y potasio) 15-15-15,
lo cual equivale a 300 Kg/Ha, mientras que las otras diez (10) subparcelas se mantendrá sin
fertilización. Las parcelas serán regadas cada 4 días (si se observaba ausencia de lluvia durante el
período de ejecución del estudio). El proceso de fertilización se llevará a cabo siguiendo el esquema
que se presenta a continuación:
NF
(1)
F
(2)
NF
(3)
F
(4)
NF
(5)
F
(6)
NF
(7)
F
(8)
NF
(9)
F
(10)
F
(11)
NF
(12)
F
(13)
NF
(14)
F
(15)
NF
(16)
F
(17)
NF
(18)
F
(19)
NF
(20)
Carretera Interna de la Estación
10 m
NF = No fertilizada
F = Fertilizada
(1 al 20) = número de la subparcela
Para evaluar la descomposición de materia orgánica, se utilizará la técnica de las bolsas de
descomposición (“litter bags”). Esta técnica consiste en colocar 1 g (peso fresco) de material vegetal
fotosintéticamente no activo en una bolsa de malla plástica de 2 mm de apertura y de dimensión
aproximada de 20 x 10 cm. Las bolsas se elaborarán por triplicado para cada tratamiento (fertilizado y
no fertilizado) y se dejarán descansando sobre el suelo durante el período de estudio. Durante este
tiempo ocurrirá la descomposición del material vegetal, el cual será realizado por los microorganismos
y la micro y mesofauna que pueden entrar a las bolsas a través de sus agujeros. Una vez finalizado el
estudio se retirarán las bolsas y se determinará la pérdida de peso (peso seco) para estimar la tasa de
descomposición. Diez (10) alícuotas de similar peso serán traídas al laboratorio para determinar su peso
seco inicial.
Para la determinación de la PPN durante el tiempo de crecimiento de los pastos, se utilizará un
método de cosecha (Ver Apéndice). La estimación de la PPN será el resultado de las diferencias en la
cantidad de materia orgánica cosechada en diferentes tiempos. En la primera salida de campo, el
personal docente delimitará la parcela, realizará el corte de vegetación e implementará la fertilización
en las subparcelas seleccionadas. Para el segundo corte, esto es, el día de la visita de campo, a cada
equipo de estudiantes se le asignará una subparcela de 1 m2 en la cual realizarán las siguientes labores:
27
1) Delimitar un área de 0,75 x 0,75 m en el centro de la subparcela asignada.
2) Estimar la altura promedio de la vegetación dentro de área delimitada
3) Cosechar el material en pie dentro del área delimitada, para lo cual se cortará la vegetación al ras del
suelo con la ayuda de una tijera de jardín. Este material se colectará en una bolsa debidamente
rotulada donde se indique: el número de la parcela asignada, el tipo de tratamiento, el número (o
nombre) del equipo de estudiantes responsable de la subparcela, el nombre del profesor del curso
correspondiente.
4) Retirar el mantillo y colocarlo en la bolsa
5) Retirar las bolsas de descomposición
6) En el Laboratorio del CEO (Quizandal), las muestras de vegetación serán separadas en material
verde y material seco. El material separado se colectará en bolsas rotuladas con la misma
información que se indica en el punto 3, incluyendo además las siglas MV para material verde y MS
para material seco.
7) En los Laboratorios Docentes de la Facultad de Ciencias (UCV), se procederá a secar el material en
una estufa a 80°C y por 3 días, luego de lo cual se pesará en una balanza. Igual procedimiento se
seguirá para el material colectado en las bolsas de descomposición.
ESTIMACIÓN DE LA PRODUCTIVIDAD PRIMARIA
La PPN de nuestro estudio, en el sentido más simple, será el resultado del cambio de biomasa entre
el primer muestreo y el segundo muestreo. Así:
PPN = (Bf - Bi)/t
(1)
Donde:
Bf= Masa de materia orgánica al final del experimento(expresado en g/m2)
Bi= Masa de materia orgánica al inicio del experimento (expresado en g/m2)
t = Tiempo transcurrido (expresado en días)
Como inicialmente, todo el material vegetal fue removido, la biomasa inicial se considera despreciable
y en consecuencia la fórmula anterior queda expresada (para nuestro caso particular) como:
PPN = (Bf)/t
(2)
Sin embargo, este valor es una subestimación del valor real, ya que no considera la cantidad de
biomasa que eventualmente se produce y descompone durante el período de estudio. De esta forma, una
mejor expresión de la PPN sería:
PPN = [(Bf)/t] + D
(3)
Donde:
D = Cantidad de material que se descompone
28
Para resolver esto es necesario estimar las tasas de descomposición del material muerto y luego
las cantidades de material muerto que se descomponen diariamente. Nótese que las tasas de
descomposición y las cantidades de material descompuesto son conceptos diferentes. El
primero se refiere a la velocidad por unidad de masa y tiempo en la cual se descompone un material
dado, mientras que el segundo es el total de material descompuesto, por unidad de área y tiempo. Esto
se ilustrará mejor con un ejemplo. Si se tienen inicialmente 300 g/m2 de material seco y la tasa de
desaparición de dicho material es de 0,0013 g/g de material seco por día (significa que por cada gramo
de material muerto se descomponen 0,0013 g cada día). ¿Qué cantidad de material se descompone el
primer día? El resultado es:
D = Bsi . r
(4)
D = 300 g/m2 . 0,0013 g/g.día
D = 0,39 g/m2.dia
Donde:
D = Cantidad de material descompuesto (g/m2)
Bsi = Biomasa seca inicial (g/m2)
r = Tasa de descomposición (g/g.día)
Ello significa que el primer día se descomponen 0,39 g/m2 de material seco a una tasa de 0,0013
g/g.día. De manera que para el segundo día del experimento quedan remanente 299,61 g/m2 , para el
tercer día quedan 299,22 g y así sucesivamente. Una vez obtenido D, se puede calcular de mejor forma
la PPN de acuerdo a la ecuación (3). De esta forma la cantidad total de materia orgánica seca en un
lapso determinado que se descompone es igual a la sumatoria de las cantidades que se descomponen
cada día.
I=t
D= Σ
Bsii
i=1
Si hubiéramos iniciado el proceso de descomposición con 1000 g/m2, aunque la tasa de desaparición
hubiera sido la misma, las cantidades descompuestas en el primer día serían mayores. Como se puede
ver:
D = Bsi . r
D = 1000 g/m2 . 0,0013 g/g.día
D = 1,30 g/m2.dia
29
El ejercicio anterior es una simplificación de la realidad, ya que sólo considera la
descomposición del material seco inicial. Sin embargo, en el transcurso del experimento muere nuevo
material que también se descompone y, en consecuencia, las cantidades descompuestas son
Mayores, debido a los nuevos aportes de materia orgánica muerta. Una mejor aproximación es
considerar que las cantidades de materia orgánica muerta disponible para la descomposición es un
promedio de los valores iniciales y finales de la materia seca. Así:
MSP = (Bsi + Bsf)/2
(5)
Donde:
MSD = Masa seca promedio disponible para descomposición (g/m2)
Bsf = Biomasa seca final (g/m2)
Bsi = Biomasa seca inicial (g/m2)
Como todo el material inicial y final (verde y seco) fue retirado, entonces Bsi es igual a cero y
la expresión anterior (para nuestro caso particular) se reduce a:
MSP = Bsf/2
(6)
Así, el cálculo de D queda mejor expresado redefiniendo la ecuación (3):
D = MSP.r
(7)
La tasa intrínseca de descomposición (r) se calculará de acuerdo a la expresión de Wiegert y
Evans (1964):
r = - (ln wo/wi)/t
(8)
Donde:
wo = Peso inicial de material seco en la bolsa de descomposición (en g)
wi = Peso final de material seco en la bolsa de descomposición (en g)
El cálculo de la tasa de descomposición de acuerdo a la expresión de Wiegert y Evans (1964),
sugiere que la descomposición no ocurre a una cantidad uniforme, sino proporcional al material seco
existente. Ello se ha verificado en numerosos experimentos de descomposición en donde la pérdida de
masa es más rápida inicialmente y progresivamente disminuye, siguiendo una cinética exponencial
negativa. La razón de este comportamiento se debe a que inicialmente se degradan más rápidamente los
compuestos más lábiles (azúcares, proteínas, celulosas) y finalmente quedan los más resistentes de más
lenta degradación (lignina, ceras, fenoles y polifenoles, etc).
PROCESAMIENTO DE DATOS
1) Para cada tratamiento calcule: a) las tasas de descomposición, b) la cantidad de material que se
descompone y c) PPN. Evalúe bajo que condiciones se obtuvo una mayor respuesta de crecimiento y
productividad, así como mayores tasas de descomposición. Realice las pruebas estadísticas pertinentes
30
para detectar
fertilizado).
la existencia de diferencias significativas entre los tratamiento (fertilizado y no
2) Con los datos obtenidos, establezca los compartimientos y flujos de materia orgánica para los
diferentes casos. El esquema y el cálculo de los valores de los flujos y compartimientos se especifica en
la Figura 1. Analice el esquema, comprenda la lógica del mismo, clarifique conceptos y discuta sus
resultados.
PPN
Verde
= (Bvi +Bvf)/2
Mortalidad
= (Bsf-Bsi)/t + D
Seco
= (Bsi +Bsf)/2
Descomposición
=D
Figura 1. Esquema del flujo de materia orgánica durante el lapso de estudio para el pasto X
bajo el tratamiento Y.
3) Para un mismo tratamiento establezca si existe una correlación entre la PPN y la altura de las plantas.
Discuta los resultados.
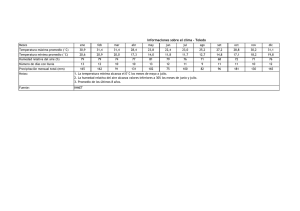
4) Con los datos de temperatura y precipitación y con la ayuda de las gráficas del Anexo 1 (figura 2),
calcule la PPN estimada para el área de estudio. Compare los resultados obtenidos en el trabajo de
campo, con los obtenidos con las gráficas.
31
ANEXO 1
ESTIMACIÓN DE LA PPN A PARTIR DE DATOS MACROCLIMÁTICOS
Introducción
Los datos macroclimáticos, tales como temperatura y precipitación media anual, promedios
anuales de radiación solar y los derivados de este último parámetro, también han sido utilizados en un
intento de predecir la productividad primaria de la vegetación de diferentes regiones de la tierra (Lieth y
Whittaker, 1975). De modo que usando variables macroclimáticas fáciles de obtener, como por ejemplo
la precipitación media anual, se puede estimar, an algunos casos, la productividad primaria de la
vegetación (Lieth, 1973). Esto se ilustra en las figuras anexas. El método de la clasificación climática
de Thornthwaite, el cual ya usted conoce, le permite calcular un parámetro meteorológico de gran
importancia como lo es la Evapotranspiración real mensual y anual (ETR) para la zona o región de
estudio.
La ETR es una medida de la disponibilidad de agua y energía en el ambiente, por lo que
también ha sido utilizada para predecir la tasa de productividad primaria neta (Rozenzweig, 1968).
Existe una preocupación mundial entre ecólogos, climatólogos, geógrafos y todas aquellas
disciplinas científicas que tengan algún interés en mejorar el nivel de vida de la especie humana, de
cuantificar la productividad primaria de los principales ecosistemas terrestres y acuáticos,
especialmente en la zona tropical, los cuales están aún poco estudiados.
La importancia de conocer el valor promedio de productividad primaria neta de diferentes
ecosistemas radica en el hecho que todos los consumidores de los diferentes niveles tróficos,
incluyendo al hombre, dependen directa o indirectamente de su magnitud. El cálculo directo de la PPN
en ecosistemas forestales es laborioso y complejo, por la falta de recursos humanos y físicos para
realizar dicha tarea. Por lo tanto, se ha tratado de explorar ciertos aproximados para estimar la tasa de
productividad primaria neta, mediante el uso de parámetros meteorológicos fácilmente obtenibles,
como lo es la precipitación, evapotranspiración real y la temperatura media anual.
Método
Con los datos obtenidos por usted de la evapotranspiración real anual, por el método de
Thornthwaite y mediante el uso de la temperatura y la precipitación media anual de una determinada
localidad, o de la región de estudio (Tucacas), estime la productividad primaria neta de la vegetación
predominante o terminal, utilizando las tres gráficas anexas (Figura 2).
32
Figura 2. Gráficas que relacionan la PPN con elementos del clima
CUESTIONARIO
33
1) Defina PPN, biomasa y PPB.
2) ¿Cuál es la importancia de medir la PPN?
3) Mencione cuáles son los factores que afectan la PPN.
4) Explique brevemente en que se fundamenta el método de análisis dimensional para determinar PPN
en ecosistemas forestales.
5) ¿Por qué cree usted, que no se debe aplicar el método de las cosechas a los ecosistemas forestales?
6) ¿Cuáles otros métodos se usan para medir PPN?
7) ¿Cómo puede afectar la temperatura y la precipitación a la PPN?
8) Explique brevemente el efecto de la fertilización sobre la PPN.
9) ¿Por qué cree usted se debe hacer un diseño muestral para estimar la PPN?
REFERENCIAS BIBLIOGRÁFICAS
*Bulla, L.; Pacheco, J. Y Miranda, R. (1981). A simple model for the measurement of primary
production in grasslands. Bol. Soc. Ven. Cienc.Nat. 139: 281-304
Chapman, S.B. (1986). Methods in plant ecology. Second Edition. Blackwell Sci. Public. London.
Golley, F.B. (1961). Energy for ecological materials. Ecology 42: 581-584.
Larcher, W. (1977). Ecofisiología vegetal. Ediciones Omega. Barcelona.
Lieth, H. (1973). Primary production: Terrestrial ecosystems. Human Ecology. 1: 303-332.
Lieth, H., & R.H. Whittaker. (1975). Primary productivity of the biosphere. Ecological studies 14.
Springer Verlag, New York.
Newbould, P.J. (1967). Methods for estimating the primary production of forests International
Biological Program Handbook No. 2. Blackell. Oxford.
Rozenzweig, M.L. (1968). Net primary productivility of terrestrial communities. Prediction from
climatological data. Am. Nat. 102: 67-74.
Susach, F. (1984). Caracterización ecológica de las sabanas de un sector de los llanos centrales bajos de
Venezuela. Tesis doctoral U.C.V.
Weigert, R.G. (1962). The selection of an optimum quadrat size for sampling the standing crop of
grasses and forbs. Ecology. 42: 125-129.
Weigert, R.G., & F.C. Evans. (1964). Primary production and disappearance of dead vegetation on an
old field in southeastern-Michigan. Ecology. 45: 49-63.
Whittaker, R.H. (1975). Communities and ecosystems. MacMillan Pub. New York.
34
APÉNDICE I . Algunos métodos para la estimación de PPP en ecosistemas herbáceos
I:1 Método simplificado de Lownicki para estimar la PPN
Lownicki et al. (1968), han sugerido un procedimiento simplificado, el cual supone que la descomposición
del material muerto es insignificante, si el tiempo entre los intervalos de muestreo es lo suficientemente corto.
Estos investigadores trabajaron con comunidades herbáceas y comprobaron que esta suposición es válida para
periodos no mayores de un mes. El procedimiento requiere de dos parcelas pareadas lo mas homogénea y
parecidas posible. Al comienzo del período de muestreo, en la parcela número 1, se retira el material muerto (a0),
mientras que el material vivo es dejado en pie. En la parcela número 2 únicamente se colecta el material vivo (b0).
Todos los materiales son secados (80 ˚C, 3 días) y pesados. Al final del intervalo de muestreo, en la parcela 1 se
retira el material vivo (b1), mientras que en la parcela 2 se retira el material muerto (a1).
1
2
Se retira el
material
muerto (ao)
Se retira el
material
vivo (bo)
T=0
30 días
1
2
Se retira el
materia
vivo (b1)
Se retira el
material
muerto (a1)
T=1
Con estos datos la producción primaria se obtiene por la siguiente ecuación:
PPN = (b1 – b0) + d
donde: d (material muerto)= (a1 - a0)
La forma, tamaño y número de parcelas a utilizar en este tipo de trabajo deben ser cuidadosamente
seleccionadas para que nos permita obtener resultados precisos y reproducibles.
I. 2. Método de Wiegert y Evans (1964)
Wiegert y Evans (1964), también trabajaron con comunidades herbáceas y ha diferencia del método anterior
consideran la contribución del material descompuesto dentro de la estimación de la PPN. Su propuesta de “bolsas
de descomposición” es mundialmente conocida y aún utilizada por los investigadores que trabajan en el área de
producción y ciclaje de nutrimentos. A continuación se resume su metodología.
1) Seleccione tres parcelas donde la densidad y composición florística sean los más parecidas entre sí y
márquelas en forma permanente con estacas.
2) En la parcela número 1, corte el material verde y seco de la planta a nivel del suelo; luego separe el material
verde y seco; colóquelos en bolsas separadas previamente marcadas.
3) En la parcela número 2, todo el material aéreo verde debe ser removido al igual que en la número 1, dejando
todo el material seco en el lugar. El material verde debe ser guardado en una tercera bolsa como réplica de la
parcela número 1. Para evitar que se pierda el material de la parcela número 2 por procesos diferentes al de
35
descomposición o por adición de materiales provenientes de lugares vecinos, las parcelas deben ser cubiertas con
tela metálica durante el periodo de muestreo.
4) En el laboratorio el material será secado a 80 oC por 3 días y después pesados.
5) Al final del periodo, el material seco debe ser colectado de la parcela número 2 y lo mismo se hará con el
material verde y seco en la parcela número 3. Estos, deben ser secado pesados al igual que las muestras
iniciales.
1
Se retira el
material
verde (bo)
y seco
(Wo)
2
Se retira el
material
verde
3
No se
retira
nada
30
días
1
2
3
No se retira
nada
Se retira el
material
seco (W2)
Se retira el
material
verde (b1)
y seco
(W1)
Cálculo de la productividad primaria neta
La tasa instantánea de desaparición del material seco (partes aéreas) se denominará "r" y puede ser
calculado por medio de los pesos del material seco en la parcela número 1 para el tiempo 1 (Wo) en el tiempo 0,
del material seco en la parcela número 2 para el tiempo 1 (W1), por medio de la siguiente ecuación:
r(g/g. día) = Ln (Wo/W1)
t1 - to
t1 - to = duración del período de producción en días.
Un estimado de la cantidad de material seco desaparecido de una parcela no alterada (X) puede ser
determinada a partir del material seco al comienzo y al final del período y de la tasa de desaparición (r) del
material seco, esta estimación viene dada por la fórmula:
X (g/parcela) = (Wo + W1) r . t
2
Wo = peso del material seco en la parcela número 1 para t = 0.
W1 = peso del material seco en la parcela número 3 para t = 1.
t = t1 - to.
La mortalidad del material verde (d) durante el intervalo de producción puede ser
obtenida del cambio en la cantidad de material seco al inicio y al final del período de producción y la cantidad de
material desaparecido durante el mismo período, por la siguiente ecuación:
d (g/parcela) = X + (W1 - Wo)
La producción neta (PN) durante el periodo, puede ser calculada del cambio en la cantidad del material
verde y de la estimación de la mortalidad:
36
PN (g/parcela) = (b1 - bo) + d
donde:
bo = es el peso del material verde en la parcela número 1 en t = 0.
b1 = es el peso del material verde en la parcela número 3 en t = 1.
La producción neta también puede ser expresada en cal/g de energía, mediante determinaciones del
valor calórico del material colectado. A este respecto, Golley (1960), Wiegert y Evans (1964), reportaron valores
para una variedad de materiales con cambios poco significativos en los valores calóricos provenientes de diversos
tipos de plantas herbáceas, tanto de gramíneas como de hoja ancha; ambas mostraron valores cercanos a 4.300
cal/g peso seco.
I.3: Estimación de la PPN en ecosistemas de bosques y matorrales.
El estudio de la productividad neta en las comunidades de bosques y matorrales, los cuales tienen plantas de
diferentes edades y tamaños, requieren de un enfoque diferente. La técnica más utilizada es el análisis
dimensional, la cual se resume a continuación:
1. Se delimita una cuadrata de dimensiones apropiada de acuerdo al tipo de bosque y estudio (ver apéndice
3).
2. En la cuadrata a cada árbol se le medirá el diámetro a nivel del pecho y la altura
3. Un grupo de árboles representativo de cada clase de edad y/o tamaño serán cortado y a cada uno de
ellos se le determinará el peso seco de sus fracciones (tallos, ramas, corteza, flores y frutos, así como su
peso total. Si es posible deben hacer determinaciones de clorofila
4. Se grafican los datos de altura vs peso y/o diámetro a nivel del pecho y peso y se ajustan los datos a la
función matemática con mejor ajuste. En este paso, la ayuda de programas de computación es requerida.
Por lo general los datos se ajustan bien a funciones logarítmicas.
5. Ya establecido la función matemática, se realizan mediciones a diferentes tiempos (por lo general
mayores de 3 meses) para cada uno de los árboles del área que se desea evaluar y finalmente se calcula
la biomasa final de la parcela como el producto de la sumatoria de las biomasas individuales. La PPN se
determina como:
PPN: BF-BI/Area. t
Donde:
BF: Biomasa final
BI: Biomasa inicial
A: Area de la parcela estudiada
t: Tiempo en la cual se evaluó la PPN
37
APENDICE II. Cálculo del tamaño, forma y número de la parcela
Tamaño de la parcela.- Este debe estar relacionado con la morfología y espaciamiento de los individuos. Para
determinar el tamaño de la parcela se procede así:
1) Se realiza un muestreo tentativo con diferentes tamaños de parcelas, distribuyéndolos al azar, por ejemplo
parcelas de 0,5, 1, 2 m2, etc.
2) Se calcula la varianza para cada tamaño de parcelas en base al peso seco del material colectado.
3) La muestra que presente la varianza y costo (tiempo y esfuerzo) mínimo será tomada como tamaño óptimo de
la parcela.
Forma de la parcela.- Una vez seleccionado el tamaño de la parcela, se procede a determinar su forma. La forma
rectangular es más eficiente que la forma cuadrada y circular porque la tendencia general de la vegetación es a
estar agrupada. Para determinar la forma de la muestra se procede así:
1) Realizar un muestreo tomando parcelas rectangulares, circulares y cuadradas de un mismo tamaño y
distribuidas al azar.
2) Se calcula la varianza para cada uno de los tipos de parcela y la forma que presente la menor se tomará como
la óptima para el muestreo.
Número de parcelas.- Al seleccionar el tamaño y forma de la parcela, se procede a determinar el número de
muestras necesarias que permiten repetir e interpretar los resultados. El número de muestras que puede
determinarse por aproximaciones estadísticas, depende del grado de precisión, costo o esfuerzo que se requiera.
Generalmente se acepta para la media una variación de alrededor del 10 % y un error del 5 % en su intervalo de
confianza, donde:
n = t.Sx
0,1 x
n = es el número de muestras necesarias para el muestreo.
x = media.
Sx = desviación estándar.
t = se busca en las tablas estadísticas.
Una forma práctica para estimar con precisión el número de parcelas, es finalizar la colección de muestras
acumulativas cuando la media no se vea afectada significativamente al añadir nuevas muestras.
Estimación del número de muestras:
1) Tome un cierto número de muestras al azar y aumente progresivamente su número, calcule la media y el error
estándar para cada subconjunto de muestras.
38
2) Represente graficamente la media vs número de muestras o la relación error estándar/media vs el número de
muestras.
3) Donde la media más o menos se estabiliza o cuando ésta, con un límite de 5 % de error, no presente
variaciones significativas, se toma como el número de muestras necesarias para el muestreo.
39
UNIVERSIDAD CENTRAL DE VENEZUELA
FACULTAD DE CIENCIAS
ESCUELA DE BIOLOGÍA
DEPARTAMENTO DE ECOLOGÍA
LABORATORIO DE ECOLOGÍA II
ESTIMACION DE LA PRODUCTIVIDAD PRIMARIA EN UN ECOSISTEMA
ACUÁTICO
Por: Paula Spiniello
INTRODUCCION
En los ecosistemas acuáticos, el fitoplancton constituye el grupo de organismos
autótrofos más relevante en virtud de su variedad, su abundancia y sus altas tasas de
recambio, y como tal, contribuyen sustancialmente a la productividad primaria y
conforman la base energética de las tramas tróficas acuáticas, particularmente en los
océanos.
Los sistemas acuáticos están influenciados por entradas de afluentes fluviales, por
corrientes marinas, o por ambos. Esto genera diferencias locales y/o temporales en
ciertos parámetros físicos y químicos que repercuten sobre la estructura de la
comunidad fitoplanctónica y en consecuencia sobre la productividad primaria del
sistema. Así entonces, existen un conjunto de factores tanto bióticos como abióticos que
limitan o regulan la productividad primaria fitoplanctónica provocando variaciones
temporales y espaciales (horizontales y verticales) en su magnitud. Entre estos factores
se encuentran la luz, los nutrientes, los procesos físicos de transporte de masas de agua
y la herbivoría.
La luz es un requisito indispensable para la productividad primaria, y en general,
para la vida sobre la tierra, proporcionando la energía necesaria para el proceso
fotosintético. Sin embargo, no todo el espectro electromagnético es requerido para
llevar a cabo la fotosíntesis, ya que los pigmentos fotosintéticos (clorofilas y pigmentos
accesorios) captan luz en un intervalo de longitudes de onda comprendido entre los 430
nm. y los 700 nm., el cual se conoce como Radiación Fotosintéticamente Activa ó RFA.
Así entonces, la luz como factor modulador del proceso fotosintético, y por ende de la
productividad primaria, debe ser evaluada no solo en términos de su cantidad o
intensidad, sino tamben en términos de su calidad.
La relación entre la tasa de fotosíntesis fitoplanctónica y la intensidad de luz
puede ser observada a través de la curva fotosíntesis-irradianza (fig. 1). La respuesta
fotosintética a un incremento en la irradianza es aproximadamente lineal, sin embargo,
ésta comienza a disminuir a niveles elevados de luz hasta que eventualmente se alcanza
un punto luego del cual, un incremento en la intensidad de luz no promueve un aumento
en la tasa de fotosíntesis. Este punto se conoce como la tasa máxima de fotosíntesis
(Fmax) y se alcanza a una intensidad de luz que se conoce como intensidad de
saturación (Is).
40
Si la intensidad de luz continúa aumentando, la tasa de fotosíntesis disminuye a
consecuencia de la fotoinhibición, esto es, la destrucción fotoquímica de los pigmentos.
En los sistemas acuáticos la intensidad de luz disminuye exponencialmente con la
profundidad, por lo tanto se espera que en la superficie del agua la productividad
primaria sea baja a consecuencia de la fotoinhibición, y que aumente progresivamente
hasta alcanzar su valor máximo (Pmax), para luego disminuir hasta una profundidad en
la cual la fijación fotosintética de carbono se hace igual su pérdida de carbono por
respiración y en consecuencia la productividad primaria neta es igual a cero (fig. 2).
Este punto se conoce como punto o profundidad de compensación (Ic) y puede
41
estimarse de forma aproximada como la profundidad a la cual la RFA es igual al 1% de
su valor en la superficie o a la profundidad que corresponde a 2,7 veces la lectura del
Disco de Secchi.
La estimación de la profundidad de compensación es un procedimiento muy
importante para los estudios de la ecología acuática, ya que este punto marca el límite
inferior de la zona fótica dentro de la cual ocurre una porción considerable de los
procesos de transferencia de energía en estos ecosistemas.
Las técnicas para la estimación de la porductividad primaria fitoplanctónica están
basadas en la estequiometría de la reacción resumida del proceso fotosintético:
6CO2 + 12 H2O
C6H12O6 + 6O2 + 6H2O
Así entonces la productividad primaria puede ser estimada a través de la tasa de
utilización de CO2, la tasa de producción de O2, o los cambios en la concentración de
materia orgánica.
Los métodos mas ampliamente utilizados en la evaluación de la productividad
primaria fitoplanctónica incluyen el de la incorporación de carbono radioactivo (C14) y
el de producción de O2 o método de la evolución de oxígeno disuelto. Ambas técnicas
contemplan el aislamiento de la comunidad fitoplanctónica en contenedores especiales.
Los cambios en la concentración de oxígeno disuelto o la tasa de incorporación del
carbono radioactivo pueden ser estimados luego que las muestras aisladas han sido
incubadas in situ y a la misma profundidad a la cual fueron colectadas. Dado que el
metabolismo del fitoplancton es altamente reactivo a cambios en las condiciones
ambientales, resulta ventajoso realizar las mediciones del metabolismo fotosintético
bajo condiciones naturales. Es por ello que el objetivo del método es modificar lo
menos posible el ambiente al cual naturalmente está expuesta la comunidad
fitoplanctónica durante el periodo de ensayo (incubación) de la muestra.
OBJETIVOS
Los objetivos de la presente práctica son los siguientes:
1. Estimar la productividad primaria fitoplanctónica de un cuerpo de agua por
medio de la técnica de la evolución de oxígeno
2. Estimar la profundidad de compensación realizando un perfil vertical de la
productividad primaria fitoplanctónca
3. Evaluar la efectividad de las mediciones de la RFA vertical y del Disco de
Secchi para la estimación del punto de compensación.
42
METODOLOGÍA
La estimación de la productividad primaria se llevará a cabo por el método de la
evolución del oxígeno y de la técnica de Winkler para estimar la concentración de
oxígeno disuelto (ver apéndice).
Las muestras se colectarán a distintas profundidades haciendo uso de una botella
de captación de tipo Van Dorn. Es importante que la botella sea opaca ya que se debe
tratar la manipular las muestras en ausencia de luz. Asimismo la botella debe ser no
metálica ya que en estas puede ocurrir la disolución de iones los cuales se transfieren a
las muestras y pueden afectar significativamente la tasa de fotosíntesis.
Las muestras de agua así colectada se colocarán en botellas de DBO debidamente
rotuladas. Para cada profundidad se llenarán 5 botellas DBO (3 botellas claras y 2
botellas oscuras). Una de las botellas claras será utilizada para la estimación de la
concentración de oxígeno disuelto INICIAL y por lo tanto, una vez llenada, se fijará de
inmediato con los reactivos Winkler correspondientes.
El procedimiento para llenar las botellas DBO debe llevarse a cabo
cuidadosamente y lo mas rápido posible. Para ello se colocará el tubo de la botella de
captación en el fondo de la botella DBO permitiendo que el agua fluya en forma
continua y por un periodo de tiempo igual o superior a 3 veces el tiempo que toma
llenar el volumen de la misma, ello con el objeto de eliminar o reducir de forma
significativa las burbujas de aire que puedan quedar en la botella y que provocan una
sobreestimación de la concentración de oxígeno disuelto en la misma. Luego, las
botellas se taparán y se guardarán en una caja oscura hasta que todas las botellas DBO
hayan sido llenadas.
Cada grupo de botellas a incubar (2 claras y 2 oscuras para cada profundidad) se
colocarán en soportes especiales y se sumergirán a la profundidad a la cual la muestra
ha sido colectada. El tiempo de permanencia de las botellas en el agua (tiempo de
incubación), el cual será indicado por el profesor, comienza desde el mismo momento
que el grupo de botellas ha sido sumergido y debe ser registrado con una precisión de
minutos. Es importante resaltar que las tasas de fotosíntesis y de respiración fluctúan a
lo largo del día. Se ha observado con bastante frecuencia que las tasas de fotosíntesis
neta son mayores a primeras horas de la mañana y disminuyen marcadamente hacia
finales de la tarde, por lo tanto las incubaciones deben realizarse en el periodo de tiempo
comprendido entre media mañana (10:00 a.m.) a media tarde (2:00 p.m.), para poder así
compensar estas variaciones y obtener un valor promedio.
Al finalizar el tiempo de incubación, las botellas se extraerán del agua y se fijarán
de inmediato con los reactivos Winkler correspondientes.
La estimación del perfil vertical de la productividad primaria se llevará a cabo
incubando dos grupos de botellas (2 réplicas) en las siguientes profundidades:
superficie, 1Se, 2Se y 3 Se, donde Se representa la profundidad del Disco de Secchi. La
muestras de agua serán colectada desde la superficie con el fin de perturbar lo menos
posible la columna de agua.
43
Simultáneo a la toma de muestras para la estimación de la productividad primaria,
se determinarán los siguientes parámetros:
− Profundidad de la estación
− Transparencia del agua con el Disco de Secchi
− Temperatura del aire y del agua. Respecto a la temperatura del agua se debe
realizar un perfil vertical de este parámetro con mediciones cada 0,5 metros de
profundidad, esto con la finalidad de detectar si ocurre una estratificación
térmica de la columna de agua.
− Radiación (RFA) en la superficie del agua y a las profundidades de incubación.
− Profundidad a la cual la RFA es igual al 1% de la RFA superficial
− Salinidad (o conductividad si la salinidad es inferior a 5 0/00)
− Condiciones del estado del tiempo (soleado, nublado, lluvioso)
− Concentración de clorofila a para cada profundidad de incubación. Para ello se
colectará una muestra de 100 cc en cada profundidad la cual será filtrada a través
de un filtro de fibra de vidrio Whatman GF/C o GF/F Una vez filtrada la
muestra, el filtro se dobla, se envuelve en papel de aluminio, se rotula y se
guarda en frió y oscuridad hasta su posterior análisis en el laboratorio. Es
importante resaltar que este procedimiento debe realizarse lo mas rápido posible
y en condiciones de muy baja iluminación (preferiblemente en oscuridad).
CALCULOS
Al culminar la incubación se espera que la concentración de oxígeno disuelto en
las botellas oscuras (OBO) sea inferior a la concentración de oxígeno disuelto en la
botella inicial (OBI) debido al consumo de oxígeno durante la respiración el cual
teóricamente ocurre solo en la botella oscura. También se espera que la concentración
de oxígeno disuelto en la botella clara (OBC) sea superior a la concentración de oxígeno
disuelto en la botella inicial (OBI) debido a la producción fotosintética neta de oxígeno.
Así entonces podemos expresar la productividad primaria fitoplanctónica y la tasa de
respiración a través de las siguientes ecuaciones:
Productividad Primaria Neta (PPN) (mg C/m3/h) = [ (OBC – OBI) x 1000 x 0,375 ] / T
Respiración (R) (mgC/m3/h) = [ (OBI – OBO) x 1000 x 0,375 ] / T
Productividad Primaria Bruta (PPB) = PPN + R, entonces:
Productividad Primaria Bruta (PPB)(mg C/m3/h) = [ (OBC – OBO) x 1000 x 0,375 ] / T
Donde:
1000 = valor de transformación de litros a m3
T = Tiempo de incubación en horas
0,375 = Cociente entre los átomos de Carbono (12) y los de oxígeno (32), y por lo tanto
permite convertir la masa de Oxígeno en masa de Carbono.
44
SUPUESTOS Y ERRORES DEL MÉTODO
Es importante resaltar que el método de la evolución de oxígeno estima el
metabolismo de todos los organismos presentes en el contenedor o botella DBO, así
entonces la tasa de respiración que se estima no es debida únicamente al fitoplancton
sino también al zooplancton y a las bacterias contenidas en la muestra. Algunos autores
sugieren la filtración previa de la muestra a través de mallas que permitan eliminar al
componente zooplanctónico, sin embargo se ha observado en numerosas oportunidades
que esta filtración solo elimina el zooplancton de talla grande, pero el de talla pequeña,
cuyo tamaño coincide con el del fitoplancton y el cual presenta las mayores tasas
metabólicas, no se elimina en el proceso de filtrado. Asimismo, si se escoge una malla
de poro muy pequeño (tal que elimine al componente microzooplanctónico), se filtrará
también al fitoplancton de mayor talla, comprometiendo así la estimación real de la
respiración autotrófica.
Asimismo se debe recordar que oscurecer repentinamente el ambiente en el cual
se encuentra el fitoplancton no implica una paralización igualmente inmediata del
proceso fotosintético. Para ello se le debe añadir a la muestra DCMU
(Diclorofenildimetil urea) que paraliza el transporte de electrones a través fotosistema
II, inhibiendo así la fotólisis del agua y con ello la producción de oxígeno en la botella
oscura.
El método supone en sus cálculos que la respiración solo ocurre en oscuridad y
este supuesto no es válido. La respiración es el resultado de dos procesos. El primero es
la actividad mitocondrial, la cual se sabe puede ser alterada por la luz. El segundo
proceso es la fotorespiración, esto es, la producción de CO2 generada a través del
metabolismo del glycolato, el cual depende de y es proporcional a la intensidad de luz.
Bajo condiciones técnicas ideales (muestreo, fijación con reactivos y titulación),
la estimación de la concentración de oxígeno disuelto por la técnica de Winkler permite
una precisión de 0,02 mg/l. Sin embargo estas condiciones técnicas ideales raramente se
cumplen comprometiendo así la precisión del resultado obtenido. Asimismo, el mínimo
nivel de detección posible con el método de la evolución de oxígeno es de 3 mgC/m3,
sin embargo valores por debajo de 10 mgC/m3 deben ser analizados con cautela.
ÍNDICES
Con la finalidad de estimar la eficiencia del sistema en términos de su producción
de Carbono se calcularán los siguientes índices:
R:PPB = Eficiencia de la Productividad
R:PPN = Eficiencia del mantenimiento del ecosistema
Ambos coeficientes nos dan una idea de como el sistema está distribuyendo las
reservas de carbono, entre la respiración para el mantenimiento de la comunidad
fitoplanctónica (R:PPB) y el rendimiento productivo (R:PPN). Mientras menores sean
los valores de estos índices, mayores serán sus respectivas eficiencias. Se ha observado
que para ecosistemas sanos y eficientes, las pérdidas de carbono por respiración no son
45
superiores al 10% del total de Carbono asimilado, en consecuencia en estos sistemas
ambos coeficientes presentan valores que oscilan alrededor de 0,1 - 0,2.
PPN/Clo-a = Coeficiente de asimilación de Carbono. Este cociente refleja la cantidad de
Carbono incorporado por unidad de clorofila a y es un indicativo de la eficiencia del
sistema para asimilar carbono en el proceso fotosintético a expensas de masa
autotrófica. Así, a mayores valores de este coeficiente mas eficientes serán los
autótrofos en producir Carbono. Se ha observado que bajo condiciones óptimas de luz y
nutrientes, los valores de este cociente oscilan alrededor de 25 mgC/mg Clo-a
TRANSFORMACIONES NUMÉRICAS DE LA PRODUCTIVIDAD PRIMARIA
ACUÁTICA
Conversión de mediciones volumétricas a mediciones de área
Los valores de producción primaria, expresados en mg C m-3 h-1, se grafican en un
perfil de profundidad. Estos valores se integran para expresar la producción primaria del
fitoplancton en unidades de área, para lo cual se utiliza la siguiente fórmula (cálculo del
área de un trapecio):
mgC ⋅ m − 2 ⋅ h −1 = ∑
( a + b )c
= (1)
2
Donde a = producción primaria del estrato superior
b = producción primaria del estrato inferior
c = profundidad entre los estratos superior e inferior
Expansión del período de incubación a valores diarios
El valor integrado (1) así obtenido debe ser expresado en miligramos de carbono
asimilados por área por día con la ayuda del registro diario de luz, empleando la misma
fórmula para calcular el área de un trapecio. Luego se calcula el área total bajo la curva
del registro diario de radiación solar y, por medio de una regla de tres, se calcula la
producción primaria del fitoplancton para el fotoperíodo completo:
46
Si (1) fue obtenido para el período de incubación
x mg C m-2 d-1 se obtendrán en el fotoperíodo completo
REFERENCIAS BIBLIOGRAFICAS
DARLEY, W.M. (1987). Biología de las Algas. Enfoque Fisiológico. Editorial Limusa,
Mexico D.F., Mexico. 263 p.
DAY, J.W., C.A.S. HALL, W.M. KEMP & A. YAÑEZ-ARANCIBIA. 1989. Estuarine
Ecology. Willey-Interscience Publ. 558 pp.
HARRIS, G.P. (1986). Phytoplankton Ecology. Structure, function and fluctuations.
Chapman and Hall Ltd. USA 384 pp.
STRICKLAND, J.D. 1960. Measuaring the Production on Marine Phytoplankton. Bull.
Fish. Res. Bd. Can. 122, 172 pp.
WETZEL, R.G. & G.E. LIKENS. 1991. Limnological Analyses. Segunda Edición.
Springer-Verlag. 391 pp.
47
ANEXO
METODO DE WINKLER PARA LA ESTIMACION DEL OXIGENO DISUELTO
EN EL AGUA
Principio:
El método Winkler fué desarrollado en 1988 y en la actualidad es una de las técnicas
mas confiables para la determinación de la concentración de oxígeno disuelto en el agua.
Este método depende de la oxidación del hidróxido manganoso por el oxígeno que
se encuentra disuelto en el agua, provocando la formación de un compuesto tetravalente.
Cuando el agua que contiene este compuesto se acidifica, los iones Mn+4 reaccionan con el
yoduro para liberar yodo, en una cantidad equivalente a la del oxígeno original. El yodo se
determina por titulación con una solución estandarizada de tiosulfato de sodio.
Reactivos:
1.- Solución de sulfato manganoso: Disolver 364 g de MnSO4.H2O (ó 400 g de
MnSO4.2H2O, ó 480 g de MnSO4.4H2O) en agua destilada. Llevar el volumen hasta un
litro con agua destilada.
2.- Solución de yoduro alcalino: Disolver 700 g de KOH y 150 g de KI (ó 500 g de NaOH
y 135 g de NaI) en agua destilada. Llevar el volumen hasta un litro con agua destilada.
3.- Acido sulfúrico concentrado.
4.- Solución de tiosulfato de sodio: Disolver el tiosulfato de sodio en agua destilada
hervida. Llevar el volumen hasta un litro con agua destilada. La cantidad de tiosulfato de
sodio a disolver dependerá de la concentración deseada:
N/40: 6,2050 g de Na2S2O3.5H2O
N/80: 3,1025 g de Na2S2O3.5H2O
N/100: 2,4818 g de Na2S2O3.5H2O
N/200: 1,2409 g de Na2S2O3.5H2O
Añadir 5 ml de cloroformo, o utilizar Ampolleta titrisol (Merck # 9950).
Estandarizar la solución de tiosulfato de sodio.
5.- Solución de almidón: Disolver 2,5 g de almidón en poca cantidad de agua destilada
fría. Completar el volumen hasta 500 ml con agua destilada hervida. Agitar. Dejar reposar
y utilizar el decantado (o filtrar la solución en papel de filtro plegado). Conservar con 1 g
de ácido salicílico.
6.- Solución de dicromato de potasio N/100: Secar el dicromato de potasio (K2Cr2O7) en
una estufa a 125oC por una hora. Dejar enfriar (en un desecador) y pesar exactamente
0,4904 g y disolver en agua destilada. Llevar el volumen a un litro con agua destilada.
Almacenar la solución en botellas de vidrio bien cerradas y protegidas de la luz, de la
evaporación y de la contaminación. Un ml de esta solución equivale a 0,08 mg de oxígeno
cuando se utiliza en la estandarización del tiosulfato de sodio.
7.- Acido clorhídrico concentrado.
Procedimiento en el campo:
1. Una vez colectada la muestra y colocada apropiadamente en la botella DBO, añadir
1ml de sulfato manganoso y 1 ml de ioduro de potasio alcalino a la muestra.
2. Tape la botella y agite vigorosamente
48
3. Permita la formación de un precipitado y vuela a agitar la muestra. Deje reposar
nuevamente para permitir la formación del precipitado el cual debe cubrir por lo
menos un tercio del volumen de la botella.
4. Añadir 1 ml de acido sulfurico concentrado
5. Tape la botella y agite su contenido
6. Cuando no sea posible titular la muestra justo después de la acidificación, la misma
debe mantenerse en oscuridad. La titulación debe ocurrir en un tiempo no superior
a 8 horas después de la acidificación de la muestra.
Determinación del oxígeno disuelto:
1. Medir 100 ml de la muestra de agua previamente fijada en el campo. Verter este
volumen en una fiola Erlenmeyer de 250 ml.
2. Titular con tiosulfato de sodio hasta que la muestra se torne amarillo claro
(champaña). Agitar la muestra simultáneamente con la adición del tiosulfato.
Anotar los ml de tiosulfato gastados en la titulación.
3. Agregar unas gotas de almidón. La muestra se tornará azul.
4. Continuar la titulación con tiosulfato de sodio hasta la desaparición completa
del color azul. Anotar los ml de tiosulfato de sodio finalmente gastados en la
titulación.
5. Repita los pasos 1 al 4 con otra submuestra de 100 ml a fin de obtener un duplicado
6. Calcular el contenido de oxígeno disuelto en la muestra de la siguiente forma:
1000 x B x F
mgO2/l = ----------------A
B = ml de tiosulfato consumidos
F = factor de estandarización del tiosulfato
A = ml de muestra titulados
Donde A = ml de muestra titulada.
B = ml de tiosulfato gastados en la titulación.
F = Factor de estandarización del tiosulfato.
49
UNIVERSIDAD CENTRAL DE VENEZUELA
FACULTAD DE CIENCIAS
ESCUELA DE BIOLOGÍA
DEPARTAMENTO DE ECOLOGÍA
LABORATORIO DE ECOLOGÍA II
ANÁLISIS DE UNA TRAMA TRÓFICA
por Mario Ortaz
INTRODUCCIÓN
Las plantas utilizan la energía solar y los nutrientes inorgánicos para producir
materia orgánica y se clasifican como autótrofos. Los animales y muchos
microorganismos, los cuales obtienen su energía y nutrientes de las plantas, animales
o del material muerto, se denominan heterótrofos. El papel dual de los organismos
vivos como productores y consumidores de alimento le da a un ecosistema una
estructura trófica, determinada por las interrelaciones alimentarias, a través de las
cuales la energía fluye y los nutrientes se reciclan.
La energía y los nutrientes almacenados en una especie de planta se
transfieren, vía consumo, a una especie de herbívoro el cual a su vez es presa de una
especie de carnívoro. Esta serie de pasos de transferencia de energía y materiales se
denomina cadena alimentaria. Elton (1927, citado en Krebs 1978) fue uno de los
primeros en aplicar esta idea en Ecología al proponer que las comunidades podían
estar organizadas por las relaciones alimentarias que ocurrían dentro de ellas.
En la naturaleza, muchos ecosistemas poseen un gran número de interacciones
tróficas interconectadas (cadenas alimentarias interconectadas) las cuales, vistas
como un todo, se denominan trama alimentaria (Ricklefs & Miller 2000). Esta
interconexión se debe a que en la naturaleza es raro encontrar que un organismo
dependa exclusivamente de otro de modo que lo frecuente es que los recursos se
compartan, lo cual es bastante evidente al comienzo de las cadenas alimentarias. Esto
significa, por ejemplo, que varias especies de plantas presentes en un ecosistema son
consumidas por una variedad de organismos los cuales son presas de una variedad de
depredadores. Adicionalmente, es frecuente encontrar que la dieta de una especie
dentro de una comunidad cambie, por ejemplo, con la edad de los miembros de esa
especie, de modo que los juveniles tienden a consumir presas distintas a las que
consumen los adultos. Esto significa que la representación de la transferencia de
energía y materiales entre las especies de una comunidad corresponde a una
interconexión de cadenas alimentarias.
Dentro de las tramas alimentarias se pueden reconocer varios componentes o
grupos en función del tipo de material consumido o procesado, los cuales se
denominan niveles tróficos. Una clasificación clásica de estos es la siguiente:
1) Productores primarios (plantas).- representan el primer nivel trófico o nivel basal
y es el grupo que depende de la radiación solar, de los nutrientes y del agua para
producir compuestos orgánicos.
50
2) Herbívoros.- representan el segundo nivel trófico. Este grupo se alimenta del tejido
de las plantas y sus miembros son capaces de convertir la energía almacenada en el
tejido de las plantas en tejido animal. Su papel en la comunidad es esencial y es un
grupo adaptado a vivir con una dieta alta en tejidos de sostén. Los herbívoros poseen
una serie de adaptaciones morfológicas y fisiológicas (estructura dentaria, diseño
estomacal e intestinal, microflora y microfauna asociada para la degradación del
material) para utilizar el material vegetal como fuente de alimento.
3) Carnívoros.- representan, al menos, el tercer nivel trófico. Este grupo obtiene su
energía de los herbívoros. Los organismos que se alimentan directamente de los
herbívoros se denominan carnívoros de primer nivel o consumidores de segundo
nivel. En las comunidades es frecuente que existan, a su vez, carnívoros que se
alimentan de los consumidores de segundo nivel y estos representan a los carnívoros
de segundo nivel o consumidores de tercer nivel. A medida que incrementa el número
de niveles tróficos de carnívoros, su número por nivel decrece y su ferocidad, agilidad
y tamaño incrementa.
4) Omnívoros.- No todos los consumidores poseen una dieta basada en organismos de
un solo nivel trófico. Este es el caso de los omnívoros que se alimentan de plantas y
animales, de manera que su ubicación en una representación de los niveles tróficos de
una comunidad es un tanto ubicua.
5) Detritívoros y Descomponedores.- Este grupo procesa la materia orgánica muerta
(designada en término general como detritus). Los detritívoros son principalmente
invertebrados, sin embargo, en ambientes acuáticos existen vertebrados detritívoros.
Convencionalmente los descomponedores se han considerado como el último grupo
de consumidores y su función básica es liberar los nutrientes contenidos en la
biomasa de las plantas y animales e introducirlos en el ciclo de nutrientes. Los
descomponedores están constituidos por hongos y bacterias. En general, la función de
los descomponedores es opuesta a la de los productores, los cuales convierten
nutrientes y energía en biomasa.
La clasificación de niveles tróficos es más bien funcional y en la mayoría de
los casos no es específica a una determinada especie ya que éstas pueden ocupar más
de un nivel trófico.
El concepto de niveles tróficos proporciona una descripción general de una
comunidad pero resulta poco útil para definir su organización. Una mejor
aproximación al respecto, consiste en subdividir cada nivel trófico en gremios, que
consisten en grupos de especies que explotan un recurso común y de una manera
similar (Root 1967, citado en Krebs 1978). Bajo este concepto, una comunidad puede
estar constituida por una compleja interacción de gremios, cada uno de los cuales
puede contener una o más especies. Una de las utilidades del concepto de gremio es
que reduce el número de componentes de una comunidad lo cual facilita la evaluación
de las interacciones dentro o entre comunidades.
51
Un aspecto implícito en el concepto de niveles tróficos dentro de una
comunidad es el relacionado con los procesos de transferencia de la energía entre los
distintos niveles. Esta idea fue introducida por Lindeman (1942, citado en Ricklefs &
Miller 2000), quien argumentó que una comunidad podía visualizarse como una
pirámide de transformación de la energía, en la que se va reduciendo la disponibilidad
energética hacia los niveles tróficos superiores debido a la disipación de energía que
ocurre en cada nivel trófico inferior antes que sea transferida a un nivel trófico
superior. Por ejemplo, de la luz que incide sobre un lago (Ao), las plantas asimilan
sólo una fracción (A1), representada por la producción primaria. Los herbívoros a su
vez, asimilan una fracción menor (A2) de la energía proveniente de las plantas, ya que
éstas utilizan parte de su propia producción para auto-mantenimiento antes que los
herbívoros las consuman, y así sucesivamente ocurre con los niveles tróficos
superiores. Las plantas usan entre el 15 % y el 70 % de la energía solar asimilada para
su propio mantenimiento. A su vez, los herbívoros y carnívoros son más activos que
las plantas e invierten una fracción mayor de su energía asimilada en mantenimiento.
Como resultado de esto, la productividad de cada nivel trófico es entre el 5 % y el 20
% de la correspondiente al nivel inmediato inferior (Figura 1).
Figura 1.- Representación de una pirámide ecológica. El ancho de cada barra
representa la productividad neta de cada nivel trófico. En este ejemplo, las eficiencias
ecológicas son 20 %, 15 % y 10 % entre los distintos niveles tróficos.
La cantidad de energía que llega a cada nivel trófico dependerá de la
producción primaria neta en la base de la cadena alimentaria y de la eficiencia con la
cual los animales transforman la energía del alimento en biomasa a través del
crecimiento y la reproducción en los niveles tróficos superiores.
52
En las plantas terrestres, especialmente en las especies leñosas, se destina una
fracción importante de la producción en la elaboración de estructuras de sostén que
son de difícil asimilación. Como resultado, una fracción importante de la producción
primaria terrestre no es consumida por los herbívoros y termina como materia
orgánica muerta (detrito) que es procesada por los detritívoros y descomponedores.
Esto significa que se pueden reconocer 2 rutas de procesamiento del material
orgánico, la ruta del pastoreo que implica el consumo directo de la materia orgánica
viva, y la ruta del detritus que consiste en el uso de la materia orgánica muerta. En los
ecosistemas terrestres, la primera ruta se origina gracias a la actividad alimentaria de
los animales relativamente grandes que se alimentan de hojas, frutos y semillas,
mientras que la segunda ruta se origina por la actividad de los organismos de menor
tamaño incluyendo a los microorganismos que consumen el detritus presente en el
suelo. Se considera que la energía del detritus tiende a moverse en sus cadenas
alimentarias más lentamente que lo que ocurre con la energía consumida por los
herbívoros.
La importancia relativa de las cadenas alimentarias basada en el pastoreo y en
el detritus variará dependiendo de la comunidad. Se considera que en las
comunidades acuáticas, como las que habitan en un lago, la ruta del pastoreo
predomina mientras que en las comunidades terrestres, como un bosque, la ruta del
detritus es la más importante.
El análisis de las tramas tróficas es un aspecto clave para entender el patrón y
la dinámica de las comunidades y es un campo de investigación muy activo en los
estudios ecológicos contemporáneos.
Los primeros análisis de las tramas tróficas fueron descriptivos. A comienzos
del siglo XX, los ecólogos representaban las tramas tróficas con diagramas en los
cuales una serie de flechas conectaban a las especies en la comunidad de acuerdo a
sus relaciones alimentarias. Sin embargo, estos diagramas resultaban muy complejos
y difíciles de comparar cuantitativamente, de modo que para algunos ecólogos, la
utilidad de tales diagramas era enfatizar la gran complejidad de los sistemas naturales,
por lo que era necesario simplificar su estructura, por ejemplo, reasignándolos en
grupos tróficos. Posteriormente, esta etapa descriptiva entró en una fase analítica (a
mediados de los 50), cuya premisa era la relación entre la complejidad de la trama
trófica y su estabilidad. En este caso, se pensaba que si la comunidad poseía una
trama trófica más compleja su estabilidad era mayor. Al respecto, se pensaba que si
un depredador se alimentaba de varias presas, su abundancia dependería menos de la
fluctuación en la abundancia de una presa en particular. Es decir, si la energía tenía
múltiples vías de transmisión dentro de un sistema, la interrupción de la transferencia
por una de las vías lo que provocaba era un incremento en la transferencia por otras
vías de modo que el resultado final era que el flujo global de energía se mantenía.
Esta aproximación analítica que combinaba aspectos como estabilidad
comunitaria, diversidad de especies y complejidad de las tramas tróficas estimuló un
enorme desarrollo teórico, comparativo y experimental en esta área de la ecología de
comunidades. Estos trabajos han seguido dos aproximaciones sobre el uso de las
tramas tróficas en los estudios de estructura de comunidades: a) el estudio de las
propiedades de los diagramas de las tramas tróficas con el objetivo de encontrar
53
patrones generales que sugieran mecanismos de estabilidad de las comunidades. Esto
se ha realizado comparando las tramas tróficas de comunidades naturales y la
simulación y elaboración de modelos matemáticos de tramas tróficas hipotéticas. Esta
investigación ha generado una serie de hipótesis sobre la estructura comunitaria; y b)
el análisis de las tramas tróficas para determinar el patrón de interacciones entre las
poblaciones de una comunidad y la intensidad relativa de tales interacciones.
Además del valor heurístico implícito en el estudio de tramas tróficas, la
información obtenida al respecto tiene una serie de aplicaciones en prácticas de
manejo de comunidades naturales o de ecosistemas artificiales con el fin, por
ejemplo, de reducir por medio de la biomanipulación de la trama trófica, algunas
alteraciones biológicas asociadas a procesos antrópicos de enriquecimiento orgánico
o de incrementar por esta vía las abundancias poblacionales de determinadas especies
que pueden estar sujetas a explotación (Winemiller 1990, De Bernardi & Giussani
1997).
Otro aspecto que se puede derivar del estudio de las tramas tróficas es la
Ecomorfología, es decir la relación entre la forma del cuerpo y la función ecológica
(trófica) de las especies, lo cual permite realizar estudios comparativos de las
relaciones ecológicas dentro de una comunidad por medio del análisis de los rasgos
morfológicos. Como ejemplo, en la ictiofauna existe una gran variedad de diseños
corporales los cuales tienden a corresponder con la ubicación espacial de las presas
consumidas. Así, por ejemplo, las especies que se alimentan cerca de la superficie
poseen un perfil dorsal recto, una boca superior y aletas pectorales bien desarrolladas.
Las especies bénticas, que se alimentan del fondo, tienden a poseer un perfil ventral
recto, una boca inferior y aletas pectorales poco desarrolladas y las especies que se
ubican en el estrato medio, tienden a poseer perfiles dorsal y ventral simétricos y una
boca terminal.
De lo anterior se deduce que por medio del análisis ecomorfológico, se puede
entender si las variaciones interespecíficas surgen de manera azarosa durante la
divergencia evolutiva, seguida de un proceso de especiación, o si, por el contrario,
están correlacionadas con la función ecológica de las especies. Si tal correlación
existe, sería una prueba del determinismo en la evolución de las especies. Al respecto,
algunos consideran que la competencia por el alimento, de manera directa o indirecta
vía selección de microhábitats, probablemente ha sido la principal fuerza de selección
natural ejercida sobre las características ecomorfológicas de las especies que
conforman a algunas comunidades.
OBJETIVO
El objetivo de este trabajo práctico consistirá en caracterizar la trama trófica
de una comunidad de peces que habita en un ambiente natural, por medio del análisis
de la dieta de las especies que conforman a la comunidad.
54
METODOS
Este ejercicio práctico se realizará con datos de campo que colectarán los
estudiantes y con información que se ha generado en cursos anteriores.
Trabajo de campo
Las muestras se recolectarán en una zona de la “boca” del Golfete de Cuare
(Estado Falcón), en la cual existe una franja de manglar y una vegetación de
macrófitas en el lecho litoral. El trabajo requiere recolectar el material biológico
(peces en este caso), para lo cual se emplearán equipos convencionales de pesca
(atarrayas, redes de ahorque y redes de cerco). Una vez seleccionado el sitio de
trabajo, se capturarán ejemplares de distintas especies y, en lo posible, de distintas
tallas dentro de cada especie. Después de la captura, los ejemplares se guardarán en
envases debidamente rotulados indicando: método de colecta, localidad de muestreo,
fecha y hora de muestreo, características del sitio de muestreo, y se colocarán en
cavas con hielo hasta su muerte después de lo cual se transferirán a una solución de
formol técnico al 10 % (v/v) en la que permanecerán por aproximadamente 15 días
para luego ser preservados en etanol técnico al 70 % (v/v). El número de ejemplares a
recolectar dependerá del rendimiento que se obtenga en el muestreo.
Trabajo de laboratorio
Lave bien los peces recolectados con agua corriente con el objeto de eliminar
el exceso de etanol (NOTA: TRABAJE CON GUANTES Y MASCARILLA).
Seleccione, en los casos en los que sea posible, individuos de distintos
tamaños de cada especie para los análisis de dieta. Con la ayuda de un vernier o una
cinta métrica estime la longitud estándar de cada ejemplar (longitud estándar:
distancia entre la base del pedúnculo caudal y la porción más extrema de la
mandíbula superior).
Proceda a realizar la disección de cada ejemplar siguiendo las instrucciones de
su profesor (NOTA: CADA ESTUDIANTE DEBE TRAER UN EQUIPO DE
DISECCIÓN).
Extraiga el tracto digestivo (estómago e intestino). En las especies con
estómago definido, sepárelo del intestino (no lo deseche), haga un corte longitudinal
del estómago, extraiga su contenido, colóquelo en una cápsula de Petri y agréguele
agua cuidadosamente. No agregue demasiada agua al contenido estomacal ni permita
que el material se seque ya que esto dificultaría su posterior identificación. En las
especies sin estómago definido, haga un corte a lo largo de todo el tracto digestivo y
proceda como en el caso anterior. Identifique y cuente el número de individuos de
cada ítem alimenticio consumido. En las especies con estómago definido, si este está
vacío, proceda a analizar el contenido intestinal. Debido al excesivo tiempo que
requiere una identificación taxonómica detallada, las presas se clasificarán en grandes
grupos según se indica en el Apéndice 1.
55
ANÁLISIS DE DATOS
Para facilitar el procesamiento de los datos elabore tablas que contengan la
siguiente información: especie analizada, talla de los individuos de las distintas
especies analizadas y composición de la dieta de cada individuo por cada especie
analizada.
La composición de la dieta estimada incluirá dos tipos de datos: a) presencia
de una presa en la dieta de un individuo analizado. b) número de organismos de un
tipo de presa en la dieta de un individuo analizado. Esto puede representarlo en dos
tablas, una con los datos de presencia o ausencia de presas y la otra con el número de
individuos de cada presa consumida.
Ejemplo:
Tabla 1.- Valores de presencia-ausencia de las presas consumidas por los individuos
analizados de la especie X.
Especie X
Individuo
Talla
Presa
Presa
Presa
Presa
(mm)
A
B
C
D
1
10
+
+
+
2
15
+
+
3
25
+
+
4
40
+
+
Tabla 2.- Abundancia numérica de las presas consumidas por los distintos individuos
analizados de la especie X
Especie X
Individuo
Talla
Presa
Presa
Presa
Presa
(mm)
A
B
C
D
1
10
5
10
0
50
2
15
10
20
0
0
3
25
15
0
10
0
4
40
20
0
5
0
Con los datos que obtuvo, se pueden estimar dos tipos de frecuencias de uso
de los recursos alimenticios por parte de las especies evaluadas: a) la frecuencia de
aparición y b) la frecuencia numérica.
La frecuencia de aparición se puede estimar, registrando el número de
individuos analizados (de cada especie) en los que apareció una presa determinada
con relación al número total de individuos con alimento, lo cual se expresa en
porcentaje. Por ejemplo, la frecuencia de aparición de las presas A, B, C y D en la
dieta de la especie X correspondiente al ejemplo de la Tabla 1 sería:
Frec. aparición presa A = (4 / 4) x 100 = 100 %.
Frec. aparición presa B = (2 / 4) x 100 = 50 %.
Frec. aparición presa C = (2 / 4) x 100 = 50 %.
56
Frec. aparición presa D = (1 / 4) x 100 = 25 %.
Note que en este caso en todos los individuos analizados (n = 4) apareció
algún tipo de alimento en sus estómagos y, por el contrario, el número de individuos
en los que apareció una presa en particular fue variable. Adicionalmente, observe que
la sumatoria de las frecuencias de aparición de las distintas presas es mayor al 100 %.
Con el cálculo anterior, se estima la frecuencia de aparición de cada tipo de
presa en la dieta, por ejemplo, de una población consumidora. Esta frecuencia de
aparición representa una medida de la amplitud en el uso de un recurso por parte de
un consumidor. En el ejemplo anterior, esto significa que la presa A está siendo
utilizada por toda la población evaluada mientras que la presa D es utilizada sólo por
una fracción de dicha población, de modo que, con esta información, se pueden
obtener indicios acerca de la diferenciación intra-poblacional en el uso del recurso
alimento.
La frecuencia numérica se puede estimar, registrando el número de individuos
consumidos de una presa particular con relación al número total de individuos de
todas las presas consumidas por cada especie depredadora, lo cual se puede expresar
en porcentaje. Al respecto, en el ejemplo de la Tabla 2, la frecuencia numérica de las
presas A, B, C y D sería:
Frec. numérica presa A
Frec. numérica presa B
Frec. numérica presa C
Frec. numérica presa D
= (50 /145) x 100 = 34,5 %.
= (30 / 145) x 100 = 20,7 %.
= (15 / 145) x 100 = 10,3 %.
= (50 / 145) x 100 = 34,5 %.
Fíjese que en este caso, la sumatoria de todas las frecuencias numéricas es
igual al 100 %. La frecuencia numérica proporciona una medida de la intensidad de
depredación sobre las poblaciones de presas que conforman la dieta de un
depredador.
Dependiendo de cómo se estime la frecuencia numérica, se puede obtener
información de la estrategia alimentaria de la población o de cada individuo que la
conforma. Adicionalmente, analizando en conjunto las frecuencias numérica y de
aparición se pueden explorar aspectos de la ecología trófica de una especie como su
estrategia alimentaria (generalización vs especialización) o las características de las
presas consumidas (rara o dominante). En el ejemplo anterior, si bien la frecuencia
numérica de las presas A y D es similar, la presa A es consumida por todos los
miembros de la población X mientras que la presa D es consumida sólo por un
individuo (individuo 1) de esta población, de modo que existen diferencias
intrapoblacionales en el consumo de estas presas.
Para cada especie analizada, agrupe los valores de frecuencias numérica y de
aparición de cada item con la siguiente expresión:
IAi = % f.a + % f.n
Donde IAi = índice absoluto de importancia de la presa “i”.
57
% f.a = porcentaje de frecuencia de aparición de la presa “i”.
% f.n = porcentaje de frecuencia numérica de la presa “i”.
Para poder comparar la importancia relativa de los distintos items consumidos
es necesario transformar los IAi a valores relativos. Esto lo puede hacer con la
siguiente expresión:
IRIi = IAi / ∑IAi
Donde IRIi = índice relativo de importancia de la presa “i”.
IAi = índice absoluto de importancia de la presa “i”.
Con los datos de dieta transformados en valores de IRIi construya la trama
trófica de la comunidad evaluada como se muestra en la Figura 2 (combine los
valores generados en el ejercicio más los que se muestran en el apéndice 1). En
este caso, cada compartimiento (cada elipse de la figura), representará a cada especie
evaluada y las líneas representarán la unión trófica entre especies.
3
1
4
7
8
9
12
13
16
10
2
5
14
15
6
11
17
18
19
Figura 2.- Diagrama de una trama trófica.
Complete el diagrama con información bibliográfica sobre la dieta de los
grupos de presas consumidas por la comunidad evaluada.
Del diagrama de la Figura 2 se puede extraer la siguiente información:
a) Tipo de consumidor.- El consumidor puede clasificarse como consumidor tope,
que es aquél que no es consumido (especies 1, 2, 3, 10, 11, 14 y 15), consumidor
basal, aquél que no se alimenta de ningún otro (especies 17, 18 y 19) y consumidor
intermedio, aquél que posee tanto presas como depredadores (especies 4, 5, 6, 7, 8,
9, 12, 13 y 16).
58
b) Relación entre el número de especies presas que explotan los consumidores
intermedios y el número de depredadores que los consumen. En el ejemplo de la
Figura 2 esta relación sería la siguiente:
Consumidor intermedio 4
Número de presas
2
Número de depredadores 1
5
1
1
6
1
3
7
2
2
8
2
2
9
2
2
12
1
2
13
1
2
16
2
7
c) Conectancia (C).- esta se puede estimar como la proporción entre el número real
de interacciones tróficas y el número de posibles interacciones, es decir:
C = 2 x U T / S (S – 1)
Donde:
C = conectancia.
UT = número total de uniones tróficas.
S = número de especies consumidoras.
(UT) puede estimarse cuantificando el número de uniones entre consumidores de
distintos niveles, por ejemplo entre los consumidores intermedios y topes,
intermedios y basales, intermedios e intermedios y basales y topes. En la figura 2 esto
sería:
Número de uniones intermedios – topes: 14.
Número de uniones intermedios – basales: 7.
Número de uniones intermedios – intermedios: 7.
Número de uniones basales – topes: 5.
Número total de uniones tróficas (UT): 33.
De modo que el valor de (C) = (66 / 342) = 0,193.
d) Densidad de uniones (D).- esta medida es una especie de promedio de uniones
tróficas dentro de una trama y se puede estimar como:
D = UT / S
e) Longitud de cadena.- En la Figura 2 la longitud mínima es 1, por ejemplo entre las
especies 1 y 17 o entre 15 y 19. La longitud máxima sería 4, por ejemplo en la serie 1
– 4 – 9 – 16 – 19. Esto indica que la longitud de cadena es igual al número de
especies que la conforman menos uno.
f) Omnivoría.- los omnívoros son especies que se alimentan de presas de más de un
nivel trófico. La omnivoría puede ocurrir en diferentes cadenas tróficas o en la misma
cadena trófica. En este último caso, un omnívoro se puede alimentar tanto de una
presa como de la presa de ésta. Algunos califican este tipo de depredación como
depredación intra – gremio. En el ejemplo de la Figura 2, las especies omnívoras
serían 1, 7, 8, 9 y 15.
Determine las características (a) a la (f) de la trama trófica bajo estudio.
59
Con base a la ubicación espacial de las presas consumidas (ver apéndice 2),
agrupe a las especies analizadas en los siguientes gremios tróficos:
a) Detritívoro: especie que se alimenta de la materia orgánica en distintos estados de
descomposición depositada en el fondo y a la cual están asociadas una serie de
microorganismos.
b) Zooplanctófago: especie que se alimenta de la comunidad del zooplancton
(organismos microscópicos presentes en la columna de agua).
c) Nectófago: especie que se alimenta de la comunidad del necton (organismos
macroscópicos presentes en la columna de agua).
d) Bentófago: especie que se alimenta de la comunidad del bentos (organismos
asociados al fondo).
Con el esquema de diseño corporal de las especies evaluadas que se muestra
en el apéndice 3, establezca de manera cualitativa, la relación entre la forma del
cuerpo y el tipo de alimento consumido. Para ello, considere las siguientes
características morfológicas del pez: a) perfil corporal (dorsal y ventral) y b) posición
de la boca (superior, media, inferior).
CUESTIONARIO
1) Describa las principales características de la trama trófica evaluada.
2) ¿Incluiría otras variables como descriptoras de la trama trófica evaluada?
Justifique.
3) Mencione otras definiciones de omnivoría y discuta brevemente al respecto.
4) ¿Cuál es la utilidad de los diagramas de tramas tróficas?
5) ¿Qué información aplicada se puede extraer de la asignación de las especies en
gremios tróficos?
6) ¿Cree usted que la asignación de las especies en gremios tróficos se mantendría si
se consideran las variaciones intraespecíficas de la dieta? Justifique.
7) Mencione las limitaciones de las variables que se emplearon para cuantificar la
dieta de las especies evaluadas. ¿Incluiría alguna otra variable de medición en el
análisis? Justifique.
8) ¿Cuáles son las rutas de transferencia de la materia y de la energía dentro de un
ecosistema? ¿En todos los ecosistemas la importancia relativa de estas rutas es la
misma? Justifique.
9) ¿Existe alguna relación entre la complejidad de una trama trófica y su estabilidad?
Discuta brevemente al respecto.
60
10) ¿Qué puede ocurrir con las características de la trama trófica de una comunidad si
se eliminan los depredadores tope? Mencione un ejemplo al respecto.
11) ¿Existirá alguna relación entre el tipo de presa consumida en función de su
ubicación espacial y la morfología del consumidor? Discuta brevemente al respecto.
12) ¿El muestreo realizado permite obtener una visión real de la trama trófica de la
comunidad evaluada?
REFERENCIAS BIBLIOGRAFICAS
• Amundsen, P.A., H.M. Gabler., & F.J. Staldvik. 1996. A new approach to graphical
analysis of feeding strategy from stomach contents data – modification of the Costello
(1990) method. J. Fish. Biol. 48: 607-614.
• Borjas von Bach, P. 2001. Empleo de dos métodos para el análisis de la dieta de
Creagrutus bolivari (Pisces: Characidae) y estimación de su variación temporal. Tesis
de Licenciatura, Escuela de Biología, U.C.V.
• De Bernardi, R., & G. Giussani. 1997. Directrices para la gestión de lagos: La
Biomanipulación en la gestión de lagos y embalses, vol. 7. Comité Interamericano de
Ambientes Lacustres y Programa de las Naciones Unidas para el Medio Ambiente.
• Cortés, E. 1997. A critical review of methods of studying fish feeding based on analysis
of stomach contents: application to elasmobranch fishes. Can. J. Fish. Aquat. Sci. 54:
726-738. (*)
• Hansson, S. 1998. Methods of studying fish feeding: a comment. Can. J. Fish. Aquat. Sci.
55: 2706-2707.
• Hyslop, E.J. 1980. Stomach contents analysis, a review of methods and their application.
J. Fish. Biol. 17: 411-429.
• Krebs, Ch.J. 1978. Ecology. Harper International Edition, New York.
• Pianka, E.R. 1994. Evolutionary Ecology. 5th edition. Harper Collins Publishers.
• Pimm, S.L., J.H. Lawton., & J.E. Cohen. 1991. Food web patterns and their
consequences. Nature. 350: 669-674. (*)
• Ricklefs, R.E., & G.L. Miller. 2000. Ecology. 4th edition, W. H. Freeman, New York. (*)
• Winemiller, K.O. 1990. Spatial and temporal variation in tropical fish trophic networks.
Ecol. Monographs. 60(3): 331-367.
• Winemiller, K.O. 1992. Ecomorphology of freshwater fishes. National Geographic
Research & Exploration. 8(3): 308-326. (*)
(*) referencia de consulta obligatoria.
61
APÉNDICE 1
Datos de dieta de algunas especies de peces capturadas en la boca del Golfete de Cuare (Estado Falcón)
Período de captura: noviembre/1998, octubre/1999, noviembre/2002, noviembre/2003 y diciembre/2004.
Método de pesca: chinchorro, atarraya y red de ahorque.
Especie
Cop
Mis
Anf
Ost
Tan
Gas
For
Cam
Rin
Pec
Pol
Mve
Det
Iso
Cla
Clupeidae sp. 1 (n: 27)
Anchoa sp. (n: 206)
Anchoa lamprotaenia (n: 261)
Atherinella brasiliensis (n: 18)
Eucinostomus sp. (n: 760)
Haemulon sp. (n: 39)
Hyporhamphus unifasciatus (n: 32)
Lutjanus analis (n: 142)
Ocyurus chrysurus (n: 97)
Mugil sp. (n: 2)
Odontoscion dentex (n: 66)
Opioscion sp. (n: 119)
Archosargus rhomboidalis (n: 127)
Sphoeroides testudineus (n: 10)
Sphoeroides sp. (n: 11)
Diodon sp. (n: 3)
Chilomycterus sp. (n: 1)
Diapterus sp. (n: 167)
Sphyraena barracuda (n: 8)
Strongylura timucu (n: 1)
Achirus lineatus (n: 1)
Centropomus pectinatus (n: 1)
Oligoplites saurus (n: 4)
Lutjanus sp. (n: 2)
Caranx hippos (n: 1)
Arius sp. (n: 1)
172(8)
445(63)
18160(226)
31(8)
5524(359)
38(5)
18(3)
916(32)
229(18)
3(1)
288(15)
123(22)
274(31)
30(1)
+(1)
589(54)
-
43(6)
453(88)
604(72)
319(16)
1373(149)
9(5)
9(2)
31(10)
1248(59)
54(31)
192(35)
532(51)
2(2)
389(41)
-
8(7)
1680(147)
927(69)
10(6)
1129(177)
110(4)
92(3)
75(11)
979(51)
122(25)
336(44)
949(73)
3(2)
+(1)
1767(108)
3(1)
-
33(8)
436(64)
2134(102)
5377(325)
17(4)
2(1)
67(18)
65(11)
45(9)
24(9)
106(30)
13(1)
98(3)
+(1)
408(47)
-
627(43)
282(37)
17(2)
50(7)
757(18)
42(9)
81(12)
51(13)
4(1)
44(15)
-
2(1)
174(12)
252(34)
180(3)
105(7)
4(3)
107(6)
1(3)
110(20)
406(8)
792(10)
7(2)
145(23)
-
2(2)
4(1)
276(24)
+(1)
8(3)
50(2)
6(1)
143(10)
6(1)
812(10)
1(2)
-
27(1)
95(8)
108(12)
2609(72)
82(18)
69(3)
2007(88)
1017(19)
11(7)
168(38)
114(17)
9(2)
50(4)
42(12)
1(1)
8(1)
-
(2)
+(1)
+(2)
7(4)
+(29)
+(7)
3(4)
16(11)
-
1(1)
5(1)
+(3)
+(35)
+(15)
+(84)
+(10)
+(28)
+(15)
+(10)
-
+(19)
+(76)
+(2)
+(1)
+(4)
+(2)
+(11)
+(5)
-
7(2)
1706(87)
55(13)
3(2)
3(1)
4(2)
176(9)
6(2)
-
36(8)
-
+ (36)
145(58)
+(7)
3(221)
+(7)
+(2)
+(47)
+(41)
+(7)
16(39)
3(24)
+(2)
+(2)
+(1)
24(16)
+(1)
+(1)
-
+(2)
+(8)
1(14)
+(5)
6(8)(*)
+(3)
7(2)
+(1)(●)
22(1)
+(3)
422(48)
1(1)
7(2)
7(3)
2(1)
6(4)
48(14)
3(1)
-
+(11)
+(27)
+(41)
+(4)
+(2)
+(1)
+(13)
+(1)
-
Cop: copépodo. Mis: misidáceo. Anf: anfípodo. Ost: ostrácodo. Tan: tanaidaceo. Gas: gastrópodo. For: foraminífero. Cam: camarón. Rin: larvas
de crustáceos decápodos. Pec: pez. Pol: poliqueto. Mve: material vegetal. Det: detrito. Iso: isópodo. Cla: cladócero. (+) = presencia en la dieta.
(*): Archosargus rhomboidalis. (●): engraúlido.
Se muestra el número de individuos de cada ítem alimenticio y entre paréntesis el número de peces en los cuales apareció dicho ítem alimenticio.
62
APÉNDICE 2
A continuación se muestra la ubicación espacial de las principales presas consumidas por las
especies de peces evaluadas en el ejercicio práctico (Fuente: Barnes, R.D. 1985. Zoología de los
Invertebrados. Editorial Interamericana., México D.F. 1157 pp).
Tanaidacea.- Bentos.
Amphipoda.- Los anfípodos gamarídeos son esencialmente bentónicos ya que aunque casi todos
los miembros pueden nadar lo hacen con poca frecuencia. Los anfípodos hiperiidos son
planctónicos.
Ostracoda.- Bentos.
Copepoda.- Los copépodos calanoides son esencialmente planctónicos, los harpacticoides son
bentónicos y los ciclopoides poseen especies del plancton y el bentos.
Mysidacea.- Plancton.
Gastropoda.- Bentos.
Foraminifera.- La mayoría son bentónicos con algunas especies planctónicas. Las especies
planctónicas tienen conchas más delicadas que las especies bentónicas y dichas conchas suelen
presentar espinas.
Decapoda (camarones).- Necton.
Decapoda (cangrejos).- Bentos.
Peces.- Necton.
Polychaeta.- Bentos.
63
APÉNDICE 3
Lista de especies cuyos esquemas aparecen en este apéndice
1. Familia Gerreidae (Eucinostomus sp).
2. Familia Atherinidae (Atherinella brasiliensis).
3. Familia Sparidae (Archosargus rhomboidalis).
4. Familia Mugilidae (Mugil sp).
5. Familia Clupeidae (sp. 1).
6. Familia Hemirhamphidae (Hyporhamphus unifasciatus).
7. Familia Tetraodontidae (Sphoeroides testudineus).
8. Familia Scianidae (Ophioscion sp.).
9. Familia Lutjanidae (Ocyurus chrysurus).
10. Familia Engraulidae (Anchoa lamprotaenia).
11. Familia Haemulidae (Haemulon sp.).
12. Familia Diodontidae (Diodon sp.).
13. Familia Scianidae (Odontoscion dentex).
14. Familia Sphyraenidae (Sphyraena barracuda).
15. Familia Lutjanidae (Lutjanus analis).
64
APÉNDICE 3 - Figuras
1
2
3
4
5
6
7
8
65
9
10
11
12
13
14
15
66
ANEXO
En la década de los 20, se comenzaron a considerar los aspectos funcionales dentro
de las comunidades. Elton (1927) (citado en Krebs 1978) fue tal vez el primero que intentó
describir la organización de las comunidades en función de las relaciones tróficas entre sus
miembros. En su propuesta él expresó la importancia de la transferencia de materiales y
energía a partir de las plantas, las cuales son consumidas por los herbívoros, que son presas
de los depredadores hasta llegar a los depredadores tope. El definió estos eslabones de
transferencia como cadenas alimentarias y a todas las conexiones que pueden existir
dentro de una comunidad como ciclos alimentarios o tramas alimentarias (Ricklefs y
Miller 2000). Elton también describió algunos atributos de las tramas alimentarias. Por
ejemplo, a medida que se asciende en la cadena alimentaria, ocurre un incremento en el
tamaño del cuerpo ya que por lo general muchos depredadores consumen presas más
pequeñas. Igualmente, ha medida que se asciende, disminuye el número promedio de
individuos por eslabón. Un ejemplo al respecto es un pozo en el cual la abundancia de
microalgas está el orden de millones de células por litro, la abundancia de sus
consumidores (zooplancton herbívoro) en el orden de miles por litro, la abundancia de
zooplanctófagos (larvas de insectos) en el orden de centenas por litro y la abundancia de
depredadores superiores (peces) en el orden de decenas por litro. Elton explicó esta
característica de la pirámide de número es decir ancha en la base y estrecha en el tope
utilizando argumentos de biología poblacional planteando que los pequeños herbívoros
debido a su pequeño tamaño tienen la habilidad de incrementar rápidamente (alta tasa de
recambio) y producir un gran número de individuos en corto tiempo mientras que sus
depredadores incrementan en menor proporción y más lentamente.
Lotka (1925) (citado en Krebs 1978) planteó que las comunidades podían tratarse
como sistemas termodinámicos de modo que cada comunidad podía representarse por una
serie de ecuaciones que explicaban las transformaciones de masa entre sus componentes.
Lotka planteaba que el tamaño del sistema y las tasas de transformación dentro de él
estaban determinadas por principios termodinámicos de modo que los cambios energéticos
dentro del sistema dependían de manera directa de su tamaño (masa total de sus
constituyentes), productividad (tasas de cambios) y eficiencias.
Otro planteamiento un tanto similar al de Lotka fue el propuesto por Lindeman
(1942) (citado en Krebs 1978) que se basaba en la idea de visualizar al ecosistema como un
sistema de transformación de la energía. Lindeman consideró como Elton, el concepto de
tramas alimentarias, incluyendo los nutrientes inorgánicos en la base de la trama
alimentaria como la mejor expresión de la estructura de un ecosistema. La cadena
alimentaria según este autor consistía de etapas o pasos: productores primarios, herbívoros,
carnívoros, que él denominó niveles tróficos. Sin embargo, en vez de plantear la idea de
Elton de la pirámide de número él propuso la pirámide de transformación de la energía
argumentando que la disponibilidad de energía iba disminuyendo progresivamente hacia los
niveles tróficos superiores debido al propio trabajo requerido para la transformación
energética en cada nivel trófico y a la ineficiencia de la transformación biológica de la
energía. Con base a esto, se propuso la idea de la eficiencia biológica de transformación
de la energía como la proporción entre la cantidad de energía presente entre niveles
tróficos.
67
Con estos conceptos, otros ecólogos como Odum (1953) (citado en Krebs 1978)
propuso describir a los ecosistemas por medio de diagramas de flujos energéticos en donde
cada nivel trófico estaba representado por un compartimiento que indicaba su contenido
energético o en biomasa en un tiempo dado y las comunicaciones entre los compartimientos
representeban el flujo de transferencia (de materiales o energía) entre ellos.
Payne (1980) (citado en Ricklefs & Miller 2000) distingue tres diferentes conceptos
de tramas alimentarias:
a) trama conectada.- también denominada trama alimentaria topológica o estática. En
esta se enfatiza las relaciones alimentarias entre los organismos, representadas como
uniones en la trama (Figura 1). En tal trama se indica sólo la presencia o no de una
interacción trófica y no la intensidad de la misma o los cambios en las relaciones
tróficas que pueden ocurrir debido al crecimiento de los individuos o cambios en la
estructura de edad de los consumidores o de las poblaciones de recursos.
b) trama de flujo de energía.- también denominada trama de flujo o bioenergética. Esta
representa una visión ecosistémica en la cual las conexiones entre poblaciones son
cuantificadas mediante flujos de energía entre un recurso y su consumidor.
c) trama alimentaria funcional o de interacción.- En esta se identifican las relaciones
alimentarias más importantes en determinar la estructura de la comunidad dentro de la
trama topológica.
(a)
(b)
(c)
Figura 1.- Tres tipos de tramas alimentarias. (a) trama conectada. (b) trama de flujo de
energía. (c) trama alimentaria funcional.
Del análisis de las tramas alimentarias han surgido algunas generalizaciones
(Ricklefs y Miller 2000):
a) El número de niveles tróficos en las tramas alimentarias parece ser relativamente
pequeño. Cohen y col (1990) (citado en Ricklefs y Miller 2000) examinaron 113 tramas
68
alimentarias de comunidades terrestres, dulceacuícolas y marinas y encontraron que casi
todas poseían cinco o menos niveles, siendo cuatro el número de niveles más frecuente.
Una de las razones planteadas del por qué en la naturaleza el número de niveles tróficos es
reducido se refiere a la ineficiencia en las transformaciones de la energía. Esto se debe a los
costos metabólicos de biosíntesis y mantenimiento que ocurren en cada nivel y a las bajas
eficiencias ecológicas (hipótesis del flujo de energía). Esta idea plantea que la tasa de
producción primaria influye y determina el número de niveles tróficos en una trama
alimentaria. Sin embargo, una serie de estudios de campo no convalidan esta idea.
b) La densidad de uniones de una trama se mantiene poco variable para distintos valores de
riqueza de especies. Esta idea plantea que ha medida que incrementa el número de especies,
la conectancia de la trama alimentaria decrece lo que sugiere que hay relativamente menos
interacciones en tramas alimentarias grandes que en pequeñas.
c) La proporción de organismos en los niveles tróficos tope, intermedio y basal es poco
variable entre tramas alimentarias.
Contrario a las generalizaciones anteriores, algunos ecólogos consideran que estas
pueden ser solo especulaciones. Uno de los argumentos al respecto es que muchas de estas
generalizaciones se han derivado de estudios comparativos de datos publicados sobre
tramas alimentarias, las cuales representan estudios realizados con diferentes objetivos,
usando distintas técnicas y con diferentes niveles de resolución.
En la década del 50 se intentó relacionar la complejidad de las tramas tróficas con
otros tópicos de la ecología comunitaria como la estabilidad y diversidad de especies. Esto
fue promovido por MacArthur (1955) (citado en Krebs 1978) quien sugirió que mientras
más compleja fuese la comunidad, es decir más compleja su trama trófica, mayor debería
ser su estabilidad. El autor planteó que si un depredador poseía varias presas alternativas, su
abundancia dependía menos de las fluctuaciones numéricas de una especie de presa
particular. El creía que en los casos en los que la energía podía seguir varias rutas a través
de un sistema (comunidad más compleja = mayor número de rutas), la interrupción del paso
de energía por una ruta haría que fluyera más energía por el resto de las rutas de modo que
al final no se interrumpía el flujo global de energía.
A partir de los años 50 y gracias al desarrollo teórico de la ecología de poblaciones
y comunidades promovido por investigadores como D. Lack, G.E. Hutchinson, R.
MacArthur y R. Levins, entre otros y a numerosos estudios de campo, se evaluó el papel de
la competencia y la depredación en determinar la estructura de las comunidades
intermareales de playas rocosas. Muchos de estos estudios de campo los realizaron J.
Connell y R. Payne y en ellos se comprobó el papel de la depredación en determinar la
estructura de la comunidad. En algunos de estos trabajos se comparó las tramas tróficas en
el Golfo de California y en la costa de Washington, las cuales estaban dominadas por dos
especies de estrella de mar depredadoras (Pisaster y Heliaster). En los experimentos
realizados se encontró que al remover a los depredadores, incrementaba rápidamente la
abundancia de una de sus presas, desplazando a otras especies del área de estudio lo que
provocaba una disminución de la diversidad y la complejidad de la trama trófica. Estos
trabajos indicaron la importancia de las relaciones consumidores – recursos para entender la
69
organización de las comunidades y permitieron describir diferentes maneras de
conceptualizar a las tramas tróficas incluyendo términos como:
a) conectancia.- idea planteada por Elton quien evaluó las relaciones alimentarias entre
organismos, es decir las denominadas cadenas dentro de las tramas alimentarias.
b) Flujo de energía.- idea planteada por Lindeman quien sugirió que las conexiones entre
especies podían cuantificarse por medio de flujos de energía entre los recursos y sus
consumidores.
c) Tramas funcionales.- que se refiere a la importancia de cada cadena en mantener la
integridad de la comunidad.
Así como Payne y otros investigadores utilizaron los diagramas de tramas tróficas para
evaluar la estructura de las comunidades naturales, otros evaluaron cómo las diferencias en
la estructura de la trama trófica afectaba la dinámica, estabilidad y persistencia de la
comunidad. En este caso surgieron preguntas como ¿ Un arreglo particular de las relaciones
alimentarias entre especies es intrínsecamente más estable que otro arreglo con el mismo
número de especies ? ó ¿ Cuán importante es la consideración de la estabilidad de una
trama trófica en la estructura de una comunidad natural ?
Lo anterior introduce el término estabilidad. Al respecto, la estabilidad de una
comunidad mide su sensibilidad a una perturbación. Asociado al término estabilidad existen
otros como:
a) resiliencia o elasticidad.- se refiere a la velocidad con la cual una comunidad retorna a
su estado original después que ha sido perturbada y desplazada de este estado.
b) Resistencia.- se refiere a la habilidad de una comunidad para evitar ser desplazada del
estado en que se encuentra.
Antes de la década del 70, se pensó que una comunidad más compleja (p.ej. mayor
número de especies, mayor número de interacciones) era más estable. Sin embargo,
posteriormente se sugirió que esto no necesariamente era cierto. Al respecto, May (1972)
(citado en Begon y col. 1986) propuso un modelo matemático en el cual intentó relacionar
la complejidad y estabilidad de una comunidad teórica. El modelo incluía las siguientes
variables:
B = representa el promedio de interacciones entre especies. Por ejemplo, Bij representa
el efecto de la especie “j” sobre la especie “i”. Este término puede ser positivo y negativo
para una interacción de tipo depredador – presa, respectivamente.
S = número de especies involucradas.
C = representa la conectancia de la trama trófica, es decir la fracción de todos los pares
de especies que interactúan directamente.
Según el modelo de May, una trama trófica teórica sería estable (p.ej: las
poblaciones pueden retornar al equilibrio después de una perturbación) si:
B (SC) ½ < 1
Este resultado significa que el incremento en conectancia (C), en el número de
especies (S) y en el promedio de interacciones tienden a incrementar la inestabilidad.
Justamente, cada uno de estos incrementos significa un incremento en complejidad.
70
Otros modelos matemáticos (Pimm 1979) (citado en Begon y col. 1996) son
consistentes con los planteamientos de May, es decir la existencia de una relación inversa
entre la conectancia y la estabilidad.
En general, aunque muchos modelos indican que la estabilidad tiende a disminuir
con el incremento en complejidad, las disparidades que se han obtenido sugieren que no
existe una relación simple en todas las comunidades. La gran mayoría de estos modelos se
refieren a comunidades construidas de manera aleatoria y las comunidades reales se alejan
mucho de esta premisa. Adicionalmente, el intervalo de predicción de las condiciones
ambientales varía mucho entre sitios. En un ambiente con condiciones ambientales estables
y predecibles, una comunidad experimentará sólo un intervalo pequeño de variaciones
ambientales de modo que una comunidad dinámicamente frágil puede persistir. Por el
contrario, en un ambiente variable e impredecible, sólo una comunidad dinámicamente
robusta podrá persistir.
En cuanto a la aplicación del modelo de May a situaciones reales, algunos
resultados sugieren una relación inversa entre algunas variables del modelo como “C” y
“S”. Adicionalmente, se ha encontrado que el producto SC permanece constante para
diferentes comunidades.
McNaughton (1977) (citado en Begon y col. 1996) evaluó el efecto de dos
perturbaciones experimentales sobre dos comunidades de plantas, una rica en especies y
otra pobre en especies. La primera perturbación consistió en la adición de nutrientes al
suelo y la segunda en el efecto del pastoreo. Los resultados obtenidos mostraron que cada
perturbación redujo significativamente la diversidad de especies en la comunidad rica en
especies pero no en la pobre en especies. Este resultado es consistente con la hipótesis que
plantea que es menos probable que una comunidad más compleja retorne a su estado previo
a una perturbación.
Cierto número de estudios teóricos han sugerido que una comunidad puede
incrementar su estabilidad si está compartimentalizada. Es decir, para dados valores de S, C
y B, una comunidad puede ser más estable si está organizada en sub - unidades dentro de
las cuales las interacciones son fuertes pero entre las cuales las interacciones son débiles.
En otros estudios sobre las propiedades de estabilidad de comunidades con distintos
arreglos tróficos, Pimm y Lawton (1977) (citado en Begon y col. 1996) mostraron que en
tramas con largas cadenas (mayor número de niveles tróficos) las fluctuaciones
poblacionales, como consecuencia de una perturbación, eran tan severas que la
probabilidad de extinción de los depredadores tope era mayor que en el caso de tramas con
cadenas cortas. En su modelo ellos encontraron que el tiempo de retorno después de una
perturbación fue mucho más corto en un modelo conformado por 4 especies con dos niveles
tróficos que en uno constituido por el mismo número de especies pero arregladas en tres o
cuatro niveles tróficos.
71
Bibliografía
Begon, M., J.L. Harper., & C.R. Townsend. (1996). Ecology: individuals, populations and
communities. Third Edition. Blackwell, Oxford.
Krebs, Ch.J. (1978). Ecology. Harper International Edition, New York.
Ricklefs, R.E., & G.L. Miller. (2000). Ecology. Freeman and Company. Fourth Edition,
New York.
72
UNIVERSIDAD CENTRAL DE VENEZUELA
FACULTAD DE CIENCIAS
ESCUELA DE BIOLOGÍA
DEPARTAMENTO DE ECOLOGÍA
LABORATORIO DE ECOLOGÍA II
EFECTO DEL ENRIQUECIMIENTO CON NUTRIENTES SOBRE LA
COMUNIDAD DEL FITOPLANCTON
por Ernesto González
INTRODUCCIÓN
El fitoplancton, componente vegetal del plancton, constituye el primer eslabón de la
cadena alimentaria de los ecosistemas acuáticos, ya que tiene la capacidad de producir materia
orgánica a partir del agua y del CO2 mediante la fotosíntesis (Margalef, 1980).
Los cambios estacionales en la disponibilidad de nutrientes pueden causar cambios en
la estructura comunitaria del fitoplancton. En efecto, Tundisi y Henry (1986), señalan que la
disponibilidad de nutrientes, particularmente fósforo y nitrógeno, es el factor limitante o
controlador principal del desarrollo de las comunidades del fitoplancton en los sistemas
dulceacuícolas tropicales.
Los asentamientos humanos en una cuenca de drenaje, la desaparición de los bosques,
la construcción de granjas y ciudades, entre otros factores, pueden acelerar de forma drástica el
proceso de envejecimiento o eutrofización de un lago natural o de un embalse hecho por el
hombre y reducir significativamente su tiempo de vida (Ryding y Rast, 1992). Este proceso,
llamado frecuentemente eutrofización cultural, va acompañado ordinariamente por un
deterioro en el cambio de la calidad del agua, lo cual puede interferir con su uso, por parte del
hombre, para diversos propósitos (consumo, usos recreativos, industriales, otros). Las fuentes
de nutrientes pueden provenir de aguas servidas domésticas, escorrentía rural, fertilización,
escorrentía urbana (por tormentas) y detergentes.
La eutrofización se define como el enriquecimiento en nutrientes de las aguas, que
provoca la estimulación de una serie de cambios sintomáticos, entre los que el incremento de
la producción de algas y macrófitas, el deterioro de la calidad del agua y otros cambios
sintomáticos resultan indeseables e interfieren con la utilización del agua (Organización para
la Cooperación Económica y Desarrollo - OECD, 1982; citado en Ryding y Rast, 1992).
La eutrofización cultural constituye un serio problema en la actualidad, debido a que
este proceso genera consecuencias ecológicas significativas. Cuando las poblaciones de algas
mueren y sedimentan en el fondo de una masa de agua, su descomposición por bacterias puede
reducir las concentraciones de oxígeno en el hipolimnion hasta niveles demasiado bajos para
mantener la vida de los peces, provocando su muerte. Tales condiciones de deficiencia de
oxígeno pueden darse también en aguas con cantidades excesivas de hierro y manganeso que
pueden interferir con el tratamiento de la potabilidad. Existen también riesgos potenciales para
la salud, especialmente en regiones tropicales, relacionados con enfermedades parasitarias
como esquistosomiasis, oncocercosis y malaria, que pueden verse agravados por la
73
eutrofización cultural al intensificar ésta los hábitats adecuados para la proliferación de estos
organismos.
Para evaluar los efectos de diferentes niveles de concentraciones de nutrientes sobre el
fitoplancton, simulando de esta manera un proceso de eutrofización, se han realizado diversos
estudios, muchos de ellos mediante el aislamiento de poblaciones de fitoplancton
(microcosmos) en condiciones de laboratorio o directamente en el ambiente natural (González
y Ortaz, 1998; González, 2000). En estos casos, los cambios que se observan en la estructura
de la comunidad, composición química y actividad del fitoplancton se registran por varias días
o semanas y se correlacionan con los parámetros ambientales.
Cada uno de estos experimentos tiene, por supuesto, sus limitaciones y sus ventajas.
Tal como lo expresa Diamond (1986), en los experimentos de laboratorio se puede regular
todo el ambiente abiótico, especialmente aquellas variables ecológicas importantes tales como
la luz, la temperatura, los nutrientes, entre otras, las cuales varían en espacio y tiempo de una
forma algo impredecible. Sin embargo, su desventaja consiste en la falta de realismo y en su
alcance limitado, debido a que sólo se puede estudiar una pequeña fracción del universo de
especies. En cambio, en los experimentos de campo, los estudios se realizan con comunidades
naturales más que con comunidades "sintéticas". El experimentador sólo manipula unas pocas
variables independientes mediante, por ejemplo, el aislamiento de las especies en el ambiente
natural. Con este tipo de experiencia se gana en realismo, aunque se pierde en control
regulador. Tiene, entre sus limitaciones, el hecho de estar "plagados" de pseudo-réplicas, ya
que las condiciones de réplicas son difícilmente igualadas. Tal como lo afirma Diamond
(1986), cada tipo de experimento tiene un objetivo preciso, y cada uno de ellos sirve para
demostrar aspectos diferentes de un sistema.
OBJETIVO
El objetivo de esta práctica es evaluar, a través de microcosmos, el efecto del
enriquecimiento de nutrientes sobre la comunidad del fitoplancton, simulando un proceso de
eutrofización.
CONCEPTOS Y HERRAMIENTAS INVOLUCRADOS EN LA PRACTICA
En este trabajo se manejan los conceptos relacionados con:
1) Comunidad: Se trabajará con poblaciones de organismos que habitan en un mismo sitio.
En este trabajo, la "unidad ecológica" será el fitoplancton.
2) Productividad: El fitoplancton asimila y fija el carbono inorgánico a través de la
fotosíntesis. Al enriquecerse las muestras de agua, se suministran nutrientes (N y P) que
pueden limitar el crecimiento y la actividad del fitoplancton, variando en un corto período
la biomasa total de la comunidad del fitoplancton. Esta variación puede ser determinada
por cambios en las concentraciones de clorofila y en el número de organismos totales
presentes en cada muestra de agua.
74
3) Eutrofización: El hecho de enriquecer las muestras de agua con nitrógeno y fósforo
simula un proceso de eutrofización en un ambiente acuático.
4) Microcosmos: El encerrar un volumen de agua (10 l) con los componentes del fitoplancton
genera un ambiente particular, el cual simula "a escala" e "in situ" el ambiente natural.
Aunque los microcosmos pueden tener limitaciones en su significado ecológico, permiten
obtener una aproximación valiosa para entender lo que ocurre en situaciones naturales
(González y col., 2001).
METODOS
TRABAJO DE CAMPO
Se establecerán microcosmos "in situ". Para ello, cada equipo tomará, con un balde
plástico, muestras de agua epilimnética de un embalse y se filtrarán a través de una malla con
un diámetro de poro igual a 77 µm, con la finalidad de excluir a los "pastoreadores"
(zooplancton herbívoro), mas no al fitoplancton. Se colocarán aproximadamente 10 l de agua
en bolsas de polietileno, las cuales se mantendrán en la superficie del embalse. Se aplicarán los
siguientes tratamientos por triplicado:
1) Bolsa N0P0: No se enriquecerá con nutrientes.
2) Bolsa N0P1: Se enriquecerá con 10 ml de solución de dihidrogeno-fosfato de potasio (1 ml
equivale a 10 µmol de P).
3) Bolsa N0P2: Se enriquecerá con 20 ml de solución de dihidrogeno-fosfato de potasio (1 ml
equivale a 10 µmol de P).
4) Bolsa N1P0: Se enriquecerá con 10 ml de solución de cloruro de amonio (1 ml equivale a
150 µmol de N).
5) Bolsa N1P1: Se enriquecerá con 10 ml de solución de cloruro de amonio (1 ml equivale a
150 µmol de N) y 10 ml de solución de dihidrogenofosfato de potasio (1 ml equivale a 10
µmol de P).
6) Bolsa N1P2: Se enriquecerá con 10 ml de solución de cloruro de amonio (1 ml equivale a
150 µmol de N) y 20 ml de solución de dihidrogenofosfato de potasio (1 ml equivale a 10
µmol de P).
7) Bolsa N2P0: Se enriquecerá con 20 ml de solución de cloruro de amonio (1 ml equivale a
150 µmol de N).
8) Bolsa N2P1: Se enriquecerá con 20 ml de solución de cloruro de amonio (1 ml equivale a
150 µmol de N) y 10 ml de solución de dihidrogenofosfato de potasio (1 ml equivale a 10
µmol de P).
9) Bolsa N2P2: Se enriquecerá con 20 ml de solución de cloruro de amonio (1 ml equivale a
150 µmol de N) y 20 ml de solución de dihidrogenofosfato de potasio (1 ml equivale a 10
µmol de P).
Las concentraciones de N y P se tomaron de Elser (1992) y de Elser y Goldman
(1991).
75
Las bolsas se cerrarán con una liga y se sujetarán con cuerdas a alguna base fija en la
superficie del agua donde permanecerán por 6 días. A la vez, se determinarán los parámetros
físicos y químicos que pueden afectar la estructura comunitaria del fitoplancton: temperatura
del agua, conductividad, oxígeno disuelto, transparencia del agua, radiación fotosintéticamente
activa y velocidad del viento.
Al término del período de incubación, se tomarán de los microcosmos las muestras de
fitoplancton (alícuotas de 1 l), las cuales serán preservadas con solución de lugol y otra
muestra (250 ml) para determinar la concentración de clorofila-a, la cual deberá almacenarse
en frío y oscuridad hasta su procesamiento en el laboratorio.
TRABAJO DE LABORATORIO
Para estimar la concentración de clorofila-a se procederá según el método descrito por
Nusch y Palme (1975) de extracción de pigmentos fotosintéticos con etanol (ver ANEXOS).
Para determinar la abundancia del fitoplancton se empleará el mismo procedimiento
utilizado en el Laboratorio de Ecología I para el contaje de fitoplancton. Para ello, las muestras
de fitoplancton deberán dejarse sedimentar desde el día anterior a la práctica, para luego
obtener un concentrado de 100 ml a partir de la muestra original de 1 l. Agite bien las muestras
concentradas y, con un gotero, tome una gota (0,05 ml) y colóquela en un portaobjeto limpio.
Coloque sobre la gota un cubreobjeto y proceda a examinar la muestra bajo el microscopio
con el aumento de 40x, contando todos los organismos que contiene la gota. Repita este
procedimiento dos veces más, a fin de examinar 0,15 ml de la muestra.
En la determinación del fitoplancton, el nivel de resolución taxonómico será el de
División: Bacillariophyta (diatomeas), Chlorophyta (algas verdes), Chrysophyta, Cryptophyta,
Cyanobacteria (algas verdiazules), Euglenophyta y Pyrrophyta.
Los resultados se expresarán en organismos por litro, para lo cual se sumarán los
resultados de las tres gotas (0,15 ml):
Y organismos Æ 0,15 ml
X organismos Æ 1 ml
X = Y multiplicado por 1 y dividido entre 0,15.
Donde:
Y = Nº organismos contados en los 0,15 ml.
X = Nº organismos/ml.
Pero las alícuotas provinieron de una muestra concentrada de 100 ml, la cual a su vez
provino de una muestra de 1 litro. Entonces, se debe multiplicar X por 100 para, finalmente,
poder expresar los resultados en Nº organismos/litro.
76
ANALISIS DE RESULTADOS
Si se sabe que para el nitrógeno 1 µmol equivale a 14 µg y que para el fósforo 1
µmol equivale a 31 µg, las concentraciones añadidas de N y P para cada tratamiento serán
como se indica en la tabla siguiente:
1.
2.
3.
4.
5.
6.
7.
8.
9.
•
•
•
•
•
N0P0: 0 µg/l de N y 0 µg/l de P.
N0P1: 0 µg/l de N y 310 µg/l de P.
N0P2: 0 µg/l de N y 620 µg/l de P.
N1P0: 2100 µg/l de N y 0 µg/l de P.
N1P1: 2100 µg/l de N y 310 µg/l de P.
N1P2: 2100 µg/l de N y 620 µg/l de P.
N2P0: 4200 µg/l de N y 0 µg/l de P.
N2P1: 4200 µg/l de N y 310 µg/l de P.
N2P2: 4200 µg/l de N y 620 µg/l de P.
Calcule y grafique las proporciones Nitrógeno/Fósforo (N:P) añadidas para cada
tratamiento.
Grafique los valores de abundancia del fitoplancton obtenidos para cada tratamiento.
Grafique las proporciones de las diferentes divisiones del fitoplancton obtenidas para cada
tratamiento.
Grafique los valores de biomasa (como clorofila-a) del fitoplancton obtenidos para cada
tratamiento.
Los valores obtenidos de clorofila-a, de biomasa y de abundancia del fitoplancton,
provenientes de las muestras enriquecidas con nutrientes y de las muestras sin enriquecer,
pueden ser analizados mediante una prueba de ANOVA de 2 vías, a fin de establecer si
hubo diferencias significativas entre cada uno de los tratamientos:
Nitrógeno
N0
N1
N2
P0
N0P0
N1P0
N2P0
Fósforo
P1
N0P1
N1P1
N2P1
P2
N0P2
N1P2
N2P2
Recuerde verificar si se cumplen las condiciones para la aplicación del Análisis de
Varianza.
77
REFERENCIAS BIBLIOGRÁFICAS
A.P.H.A., A.W.W.A. & W.E.F. 1992. Standard Methods for the Examination of Water and
Wastewater. 18th edition. A.P.H.A. Washington: 10.1-10.137.
Diamond, J. 1986. Overview: Laboratory experiments, field experiments, and natural
experiments. En: Community Ecology. J. Diamond y T.J. Case (ed.). Harper & Row.
New York: 3-22.
Elser, J.J. 1992. Phytoplankton dynamics and the role of grazers in Castle Lake, California.
Ecology, 73(3): 887-902.
Elser, J.J. & Goldman, C.R. 1991. Zooplankton effects on phytoplankton in lakes of
contrasting trophic status. Limnol. & Oceanogr., 36(1): 64-90.
González, E.J. 2000. Nutrient enrichment and zooplankton effects on the phytoplankton
community in microcosms from El Andino reservoir (Venezuela). Hydrobiologia,
434(1): 81-96.
* González, E.J. & Ortaz, M. 1998. Efectos del enriquecimiento con N y P sobre la
comunidad del fitoplancton en microcosmos de un embalse tropical (La Mariposa,
Venezuela). Rev. Biol. Trop., 46(1): 27-34.
* González, E.J.; Ortaz, M.; Peñaherrera, C.; Mendoza, J.; Cano, S.; Carrillo, V. &
Montes, E. 2001. Microcosmos en Limnología. Memorias del Instituto de Biología
Experimental (MIBE), 3: 141-144.
* Henry, R., & Tundisi, J.G. 1982. Efeitos de enriquecimento artificial por nitrato de fosfato
no crescimento da comunidade fitoplanctonica da represa do Lobo (Broa, Brotas Itirapina SP). Ciencia e Cultura, 34(4): 518-524.
Margalef, R. 1980. Ecología. 2a edición (3a reimpresión). Ediciones Omega, S.A. Barcelona,
951 p.
Ryding, S.O. & Rast, W. 1992. El control de la eutroficación en lagos y pantanos.
Ediciones Pirámide S.A. Unesco. Madrid, 385 p.
* Tundisi, J.G. & Henry, R. 1986. Effects of enrichment on the summer surface
phytoplanktonic community in a stratified tropical lake (Lake D. Helvécio - Parque
Florestal do Rio Doce - Minas Gerais). Rev. Brasil. Biol., 46(1): 231-237.
78
ANEXOS
1) Preparación de las soluciones para enriquecer las muestras con nutrientes:
Solución de dihidrogenofosfato de potasio (10 µmol/ml):
Se disuelven 0,1361 g de KH2PO4 en 100 ml de agua destilada. De esta manera, cada
ml de la solución contiene 10 µmol de P-PO4.
Solución de cloruro de amonio (150 µmol/ml):
Se disuelven 0,8025 g de NH4Cl en 100 ml de agua destilada. De esta manera, cada ml
de la solución contiene 150 µmol de N-NH4+.
Se añadirá a cada microcosmos 1 ml de cada una de las soluciones anteriores por cada
litro de muestra de agua.
2) Método para la determinación de la concentración de clorofila:
(Tomado de: Nusch, E.A. & Palme, G. 1975. Biologische Methoden für der Praxis der
Gewässeruntersuchung, Bestimmung des Chlorophyll-a und Phaeopigment-gehaltes in
Oberflachenwäser. GWF-Wasser/ Abwässer, 116: 562-565).
1) Se filtrarán 0,1 l de cada muestra de agua utilizando filtros Whatmann GF/C. Luego,
cada filtro se colocará en un tubo de ensayo.
2) Se agregarán 10 ml de etanol 96% en cada tubo de ensayo con los filtros que contienen
los organismos con pigmentos fotosintéticos.
3) Los tubos de ensayo con filtros se calentarán en un baño de María a 75 oC por 5 minutos.
Luego, se enfriarán con agua o con hielo. Después se macerarán los filtros.
4) Los tubos de ensayo con los filtros macerados se centrifugarán a 3000 rpm por un
tiempo entre 5 y 10 minutos.
5) Con una pipeta, se tomarán aproximadamente 5 ml de cada extracto centrifugado y se
medirá la absorbancia a 750 y a 665 nm en un espectrofotómetro. A 750 nm se
determinará la turbiedad de la muestra, para corregir la absorbancia de la clorofila a los
665 nm de longitud de onda. El blanco será etanol 96% .
6) Para destruir la clorofila, se acidificarán los extractos con HCl 0,4 M/l (se prepara llevando
12,57 ml de HCl hasta 1 litro con agua destilada). Se añadirán 0,01 ml por cada ml de
extracto y, después de un período de 5 - 30 minutos, nuevamente se determinará la
absorbancia a 750 nm y a 665 nm. El pH del extracto deberá estar, luego de la
acidificación, entre 2,6 y 2,8.
El proceso de filtrado y de extracción de la clorofila deberá hacerse en un cuarto con
poca iluminación.
79
Cálculos:
Clorofila − a =
29,6( A b − A a ) × v
V ×l
Donde:
Ab = Absorbancia del extracto a 665 nm antes de acidificar (corregida restando la absorbancia
a 750 nm).
Aa = Absorbancia del extracto a 665 nm después de acidificar (corregida restando la
absorbancia a 750 nm).
v = Volumen de etanol utilizado en la extracción (en ml).
V = Volumen filtrado (en litros).
l = Longitud de paso de luz a través de la celda (cm).
Feofitina =
29,6(1,7 A a − A b ) × v
V ×l
Los datos de las concentraciones de clorofila-a y de feofitina se expresan en µg/l.
En las ecuaciones anteriores hay algunas expresiones y factores que deben ser
explicados:
•
•
•
•
La absorbancia se mide a 665 nm, pues éste es el pico de absorción de la clorofila-a. Se
mide la absorbancia a 750 nm para determinar la turbiedad de las muestras, la cual se debe
restar a la absorbancia a 665 nm (absorbancia corregida).
La concentración de clorofila-a puede ser sobrestimada si se incluye la feofitina-a, la cual
tiene su pico de absorbancia a una longitud de onda (664 nm) muy cercana a la de la
clorofila-a (665 nm). La acidificación de la muestra permite realizar la corrección, ya que
hace que la clorofila-a pierda el átomo de magnesio, convirtiéndola en feofitina-a.
El factor 1,7 se emplea para corregir la concentración aparente de clorofila-a debida a la
feofitina-a. Este factor resulta del cociente entre la absorbancia a 664 nm antes de
acidificar la muestra y la absorbancia a 665 nm después de acidificar la muestra
(664b/665a). Este cociente es igual a 1,7 cuando la clorofila-a está en condiciones
fisiológicas excelentes, es decir, no contiene feofitina-a.
El factor 29,6 es un coeficiente de corrección de absorbancia.
La clorofila-a se emplea como un indicador de la biomasa algal (A.P.H.A., 1992).
Suponiendo que este pigmento constituye en promedio el 1,5% del peso seco de la materia
orgánica del alga, la biomasa algal se puede estimar multiplicando el contenido de clorofila-a
por un factor de 67.
80
CUESTIONARIO
1) ¿Cuáles condiciones evitarían la sedimentación del fitoplancton dentro de las bolsas
plásticas (microcosmos) dejadas en el campo?
2) ¿Cómo evitaría la sedimentación del fitoplancton si los microcosmos fueran sometidos a
condiciones de laboratorio?
3) ¿Qué respuestas del fitoplancton esperaría encontrar luego de la adición de nutrientes (N y
P) a los microcosmos?
4) ¿Encontraría diferencias en los resultados si el experimento fuera realizado con mayores
volúmenes de agua?
5) ¿Encontraría diferencias si el experimento fuera realizado en condiciones naturales (sin
encerrar el agua en microcosmos)?
6) Si en lugar de añadir nutrientes colocara organismos del zooplancton, ¿qué respuestas del
fitoplancton esperaría encontrar y por qué?
81
Universidad Central de Venezuela
Facultad de Ciencias
Escuela de Biología
Laboratorio de Ecología I
Semestre I-2005
Cómo hacer un ANOVA
Introducción
El ANOVA (siglas de “ANalysis Of VAriance”) es una técnica mediante la cual la variación total
presente en un conjunto de datos se distribuye en varios componentes, cada uno asociado con una
fuente específica de variación (Daniel 1977). Este procedimiento, permite averiguar cuánto contribuye
cada una de estas fuentes de variación a la variación total que encontramos en un sistema. El
propósito de esta guía es simplemente orientar al estudiante en la elaboración e interpretación de ese
análisis, invitándolo a complementar los conocimientos con una bibliografía más completa.
En nuestra práctica de laboratorio, vamos a estudiar algunos efectos sobre la supervivencia de larvas
de Aedes sp. Para ello, realizaremos un ANOVA para cada uno de los experimentos: a) efecto de la
densidad larval y calidad del alimento, b) efecto de la cantidad y calidad del alimento. En cada
experimento vamos a estudiar el efecto de dos factores, por ello usaremos un modelo de ANOVA de
dos vías. Si hiciéramos un estudio solo para medir el efecto de la densidad larval, o de la calidad del
alimento, o de la cantidad de alimento, el ANOVA sería de una sola vía.
En un ANOVA, tenemos dos tipos de variables: La (s) variable (s) independiente (s), que son fijadas a
criterio del investigador y la variable dependiente o variable respuesta, que es lo que obtenemos como
resultado del experimento (lo que medimos o lo que contamos). En el caso de nuestro ejemplo, las
variables independientes son el porcentaje de humedad y la temperatura. En la práctica de laboratorio,
las variables independientes serán: las densidades larvales (número de larvas en cada recipiente), y
la cantidad y calidad del alimento (en polvo o grano), mientras que las cuatro variables dependientes
que mediremos serán biomasa seca de larvas, biomasa seca de pupas, porcentaje de pupación y
porcentaje de mortalidad.
Para ilustrar el procedimiento, trabajaremos con un ejemplo similar. Los datos que presentamos a
continuación corresponden al porcentaje de eclosión de huevos de un coleóptero del género
Dermestes colocados a tres humedades (70, 80 y 90%) y cuatro temperaturas distintas (20, 23, 26 y
28°C). Esto significa que tenemos doce tratamientos distintos: el primero de ellos es 20°C a 70% de
humedad, luego 20°C a 80% de humedad, y así sucesivamente hasta combinar cada una de las
temperaturas existentes con cada uno de los porcentajes de humedad. Como queremos medir el
efecto simultáneo de dos variables (temperatura y humedad), el ANOVA debe ser de dos vías.
Los Datos
Los datos crudos son el resultado obtenido inmediatamente de realizar el experimento (Tabla 1). Las
celdas sombreadas muestran los porcentajes de eclosión de los huevos. Los valores que aparecen al
lado de cada uno de estos (en tamaño menor y en una celda no sombreada) son la media aritmética de
ambos valores (su promedio). Para la primera celda, se incubaron cierta cantidad de huevos de este
coleóptero, controlando que la humedad se mantenga al 70% y la temperatura a 20 °C
simultáneamente (esto es imprescindible para poder medir las interacciones entre ambas variables
como se verá más adelante). Luego de transcurrido un tiempo (que debe ser el mismo para todos los
tratamientos), se contó la cantidad de huevos que eclosionó y se determinó su porcentaje, que es el
dato crudo presentado en la celda sombreada. Se hizo lo mismo para cada uno de los demás
1
tratamientos. Además, se hizo el experimento dos veces, por eso hay dos valores en cada celda (son
réplicas del mismo tratamiento). Es necesario hacer réplicas para poder estimar la variabilidad dentro
del tratamiento y determinar si las diferencias que introduce el error experimental son mayores o
menores que las que introducen los efectos que queremos medir. La importancia de esto se
comprenderá más adelante.
Temperatura
°C
20
23
26
28
Σ
X
α = (X − X )
70
25
30
38
32
40
48
28
30
27,5
35,0
44,0
29,0
Humedad %
80
27
29
75
70
57
50
26
32
28,0
72,5
53,5
29,0
Σ
X
β = (X − X )
48,5
208
34,66
-2,76
37,5
290
48,33
+10,91
28,5
252
42,00
+4,58
16,0
148
24,66
-12,76
90
50
47
35
40
27
30
17
15
271
33,9
366
45,75
261
32,62
-3,52
+8,28
-4,77
898
X = 37.42
Tabla 1. Porcentaje de eclosión para huevos de Dermestes sp. para doce tratamientos de temperatura y
humedad. Explicación en el texto.
En esa tabla tenemos además una columna (a continuación de la columna de 90 %) con la sumatoria
de los valores de cada celda en cada temperatura; es decir 25+30+27+29+50+47=208. Si dividimos
208 entre el número de sumandos (6 en este caso), tenemos una media (34,66) para 20°C, que se
colocó en la siguiente columna. Se procede de la misma manera para calcular el promedio de cada
una de las temperaturas y humedades.
Ahora calculemos una media sobre todas las observaciones (cada uno de los 24 valores de las celdas
sombreadas que son 12 tratamientos x 2 réplicas). Esta media ‘total’ que se representa con el símbolo
X , es un estimador de µ, la media poblacional (el promedio de eclosión de los huevos de esa especie
de coleóptero) y la colocamos en la celda de la esquina inferior derecha de la tabla de datos originales
(Tabla 1).
La última fila y la última columna de la tabla muestran las diferencias de las medias de humedad y
temperatura respectivamente contra la media total. Estos valores se llaman efectos de humedad y
temperatura y se designan con las letras α y β respectivamente. Para comprender mejor su significado,
imaginemos por un momento el caso más sencillo de ANOVA, cuando hay una sola vía. Para esto,
supongamos que solo estamos trabajando con diferentes temperaturas y que estamos
manteniendo la humedad constante. Obsérvese detenidamente la Figura 1.
En la Figura 1 hay 4 curvas cuya forma intenta representar la distribución de los valores de eclosión
obtenidos para cada temperatura (a cualquier humedad constante para todos los tratamientos). Si no
hubiera efecto de la temperatura, las distribuciones de los valores de cada una de las cuatro curvas
deberían superponerse, o en términos más reales, diferir solamente por puro error experimental (esto
es lo que significa que sean “estadísticamente iguales”). Por lo tanto, estas curvas estarían todas
centradas alrededor de la media total que es representada por la media total µ (que es estimada por
X ).
2
Figura 1: Efectos de la temperatura en un ANOVA de una vía. Los números de la fila superior indican la
magnitud y sentido de los efectos de cada una de las cuatro temperaturas sobre la media total a una
humedad constante, mientras que los valores de la fila inferior identifican cada temperatura. Explicación
en el texto.
Si hubuiera efecto del factor temperatura, entonces algunas de las medias estarán desplazadas a
la derecha y otras a la izquierda de µ, como intentamos presentarlo en la Figura 1. Lo que
lógicamente ustedes se preguntarán es, si esas diferencias de posición a lo largo del eje horizontal
(temperatura) son producidas por la escala a la que estamos graficando, o si por el contrario existen
diferencias estadísticamente significativas que permitan afirmar que hay un efecto considerable de
la temperatura sobre el porcentaje de eclosión. Algo que es importante recalcar en este punto, es que
si no se hicieran réplicas, no se podría responder esta interrogante, como lo comprenderemos
más adelante.
Los valores de β indican cuánto se ha desplazado en cada sentido la media de los valores obtenidos
por efecto de esa temperatura. Un β más grande implica directamente que someter a los huevos a esa
particular temperatura produce un mayor efecto sobre el porcentaje de eclosión, ya que nos alejamos
más del valor esperado (la media µ). Si sumamos (algebraicamente) todos esos valores de β,
observaremos que se anulan.
Si el ANOVA se hace de dos vías, tenemos efectos β, pero también efectos denotados con α. Su
interpretación es perfectamente análoga, solo que referidos a lo que ocurre con el otro factor que
estamos considerando (en este ejemplo, la humedad).
A continuación, conoceremos el modelo nulo sobre el que se basa el ANOVA de dos vías, y
posteriormente pasaremos a explicar cómo obtener e interpretar sus resultados.
El Modelo Nulo
En toda prueba estadística se parte de un modelo nulo que queremos poner a prueba. En el caso de
un ANOVA, la hipótesis nula (H0) establece que todas las medias obtenidas en cada tratamiento
son iguales entre si y a la media total, y que solo difieren de ella por puro error experimental. Si
esa hipótesis nula se cumple, significa que no habría efecto de las variables independientes sobre la
variable dependiente que estamos midiendo y que por lo tanto, las medias de cada tratamiento no
están siendo desplazadas con respecto a la media total, al menos no de manera significativa. El
modelo se resume en la Expresión 1.
Xij= µ + αHum + βTemp + α x β + error
(Expresión1)
3
en donde el parámetro poblacional µ es estimado por X ( X da una idea de cuánto vale µ). Los
términos αHum y βTemp corresponden respectivamente a los efectos de humedad y temperatura que
calculamos como diferencia en la última fila y columna de la matriz de datos originales y el término αxβ
representa la interacción de ambos factores, cuyo significado explicaremos en este momento.
Cuando trabajamos con dos variables, es probable que tengamos además de sus efectos “puros o
separados” un efecto adicional que se produzca por la presencia simultánea de ambos factores. A
este efecto adicional se le conoce como interacción y puede ser aditiva o inhibitoria. Será aditiva
cuando el efecto de la interacción sea mayor que la suma de los efectos separados de ambas
variables, y hablaremos de una interacción inhibitoria, cuando uno de los factores bloquee el efecto del
otro (la interacción tenga un menor efecto que la suma de los efectos de ambas variables).
El ANOVA de dos vías que estamos explicando, nos permite identificar la contribución que tiene
sobre nuestro experimento, cada uno de estos efectos, combinados o separados. Cuando se
cumple H0 (y todas las medias son iguales) entonces α, β, y αxβ son iguales a cero y las diferencias
observadas entre Xij y µ son solamente efecto del error experimental. Esta afirmación puede verse
claramente en la Expresión 1.
Veamos ahora de qué manera un ANOVA nos proporciona esta información observando la Tabla 2,
que es uno de los principales resultados del análisis. Esta Tabla se conoce como “tabla ANOVA” y en
ella podemos ver que la variación total del sistema aparece descompuesta en sus dos fuentes:
“tratamiento” y “error”. A su vez, el tratamiento se ha descompuesto de acuerdo con los factores
que estamos poniendo a prueba en nuestro ejemplo: temperatura, humedad e interacción entre
ambos factores.
Fuente
Tratamiento
Temperatura
Humedad
Interacción
Error
Total
SC
5056,83
1862,64
838,55
2355,40
145,00
5201,83
GL
11
4-1 = 3
3-1 = 2
3x2 = 6
12
11+12 = 23
CM
F
620,61
419,79
392,57
12,08
51,36
34,74
32,49
Tabla 2. Tabla ANOVA para un modelo de dos vías con interacción. Explicación en el texto.
Ahora explicaremos cómo conseguir los valores de esta tabla y qué significan.
Los Cálculos, Paso A Paso...
La suma de cuadrados total es una distancia cuadrática que representa la acumulación de todos los
desvíos de cada observación con respecto a su media total (Expresión 2). Esto no es otra cosa que el
numerador de la fórmula de la varianza que conocemos, calculada con respecto a la media total
(Expresión 3).
Suma de cuadrados total: SCTotal = Σ( X − X )
Varianza poblacional:
δ 2x =
Σ( X − X ) 2
N
2
(Expresión 2)
(Expresión 3)
4
SCTotal = (25 - 37,42)² + (30 - 37,42)² +······+ (15 - 37.42)² = 5201,83
Podemos ayudarnos con una calculadora de funciones estadísticas para obtener este valor de manera
muy sencilla. Hagamos un ejemplo con los datos de la Tabla 1. La SCTotal, representa los desvíos de
todos los valores con respecto a la media total, de modo que debemos considerar los 24 valores que
obtuvimos en nuestro experimento (cada réplica de cada tratamiento: 25, 30, 38, 32,............17, 15).
Para la mayoría de los modelos de CASIO se procede de esta manera. Lo primero y muy importante
que hay que hacer es limpiar la memoria estadística de la máquina con el comando <SHIFT> SCL
porque si la han utilizado antes para un cálculo estadístico, los valores permanecerán en memoria
incluso si la máquina se apagó. Luego <colocamos> (“ingresamos”) cada dato, presionando la tecla M+
después que cada uno aparece en pantalla.
Cuando todos los datos están ingresados, calculamos la varianza poblacional que es EL CUADRADO
del número que se obtiene con la tecla de la desviación estándar poblacional (14,72) y que en las
calculadoras CASIO aparece como σn. Una vez que tenemos ese valor (216,74), lo multiplicamos por
N, el número de datos ingresados a la calculadora, en este caso, 24. Con este procedimiento,
obtenemos el número 5201,83 que es la suma de cuadrados total de nuestro ejemplo. También
obtenemos el mismo valor si usamos la varianza muestral (tecla σn-1), pero multiplicando el resultado
al cuadrado (266,17) por 23 (recordemos que la fórmula de varianza muestral es similar pero dividida
por n-1).
La SCHum se obtiene exactamente del mismo modo, pero en lugar de trabajar con los datos de cada
réplica y tratamiento, debemos ingresar las tres medias de humedad (33,9; 45,75 y 32,62). El
resultado obtenido con la tecla σn, debemos elevarlo al cuadrado y multiplicarlo por 24. Con este
procedimiento, obtenemos el número 838,55 que es el valor de la suma de cuadrados de la humedad.
Para calcular la SCTemp ingresamos las cuatro medias de temperatura y procedemos como en el caso
de la SCHum. En nuestro ejemplo, tenemos el valor 1862,64. Para obtener la SCTrat se ingresan las doce
medias de cada tratamiento y se sigue el procedimiento que hemos descrito (siempre multiplicando por
el número total de observaciones).
Para calcular la suma de cuadrados del error, basta despejar este término de la Expresión 3, dado que
ya hemos calculado los otros dos sumandos. En nuestro ejemplo, tenemos que: SCError = 5201,83 5056,83 = 145,00.
SCTotal = SCTrat + SCError
(Expresión 3)
Para calcular el valor de la suma de cuadrados de la interacción, utilizamos la Expresión 4 (que se
deriva del modelo nulo del ANOVA) y despejamos:
SCTrat = SCTemp + SCHum + SCTempx Hum
SCTempx Hum = SCTrat - SCTemp - SCHum
(Expresión 4)
La SCError indica las variaciones “dentro” de cada tratamiento. Nos interesa es determinar si las
variaciones introducidas por la temperatura, humedad e interacción son significativamente más
grandes que las que se producen solo por error. Una forma de determinar cuánto más grandes son
las variaciones producidas por cada tratamiento con respecto al error, es dividir las variaciones
producidas por cada uno de los tratamientos entre las variaciones producidas por el error. Sin
embargo, esto no puede hacerse directamente con las sumas de cuadrados.
Es lógico pensar, que las sumas de cuadrados representan desvíos acumulados y un valor
acumulado producido por la suma de tres valores puede ser más pequeño que uno producido por 30
5
valores, solo por el hecho de haber sido el resultado de ‘menos’ términos en la suma. Esto puede
enmascarar los efectos que queremos medir. Por ello, hacemos una corrección de cada suma de
cuadrado dividiéndola por sus respectivos grados de libertad y al resultado de esta división se le
conoce como Cuadrados Medios (CM), que son también los valores que aparecen en la Tabla 1.
Los grados de libertad (GL) de la temperatura serán 4 - 1 (generalizando a T-1, donde T es la cantidad
de temperaturas distintas utilizadas en el experimento). Los grados de libertad de la variable Humedad
se calculan de modo similar: 3 - 1 porque hay 3 porcentajes de humedad, es decir (H-1) siendo H la
cantidad de humedades empleadas en el experimento. La interacción tendrá el producto de los GL de
ambos tratamientos, es decir (H-1)(T-1). Los GL del error serán (H x T)(n-1) en donde n es el número
de réplicas utilizadas en cada caso. La suma de todos estos grados de libertad (Humedad,
Temperatura, Interacción y Error) produce los grados de libertad del totales, que corresponden a la
expresión (N-1), en donde N es el total de valores obtenidos para la variable dependiente o variable
respuesta (suma de todas las réplicas de todos los tratamientos).
En este momento, ya podemos comparar los CM de cada fuente de variación con el CM del error para
ver si son significativamente mayores que éste y determinar si el efecto producido por el tratamiento es
estadísticamente mayor que el que se produce por error. La forma como lo haremos es dividiendo el
CM de cada tratamiento por el CM del error. Este cociente lo llamamos F. Ahora, veamos algo: los CM
son también sumas de cuadrados, y el cociente de dos sumas de cuadrados sigue una distribución F
de Fisher, que como recordarán tiene dos parámetros (grados de libertad) que se conocen como ν1 y
ν2. El primero de ellos, es el GL del numerador (la fuente de variación) y el segundo, es siempre el del
error. Como lo aprendieron en Bioestadística, pueden determinar las zonas de aceptación y no
aceptación de Ho, para α = 0,01 o para α = 0,05 (Figura 2).
Figura 2: Zonas de aceptación y rechazo (no aceptación) de Ho. Aquellos cocientes (F experimentales)
que superen el F crítico, indican que la fuente de variación que se está evaluando produce un efecto
significativamente mayor que el que se produce solamente por error. La zona de rechazo aparece
sombreada.
Los valores críticos de F obtenidos de las tablas se presentan en la Tabla 3.
F3,12
F2,12
F6,12
α = 0,05
3,49
3,88
3,00
α = 0,01
5,95
6,93
4,82
Tabla 3. Valores críticos de la distribución F de Fisher para los casos planteados.
Es necesario determinar valores críticos de F para cada tratamiento, porque cada tratamiento puede
tener distintos grados de libertad. Con estos valores críticos, podemos establecer zonas de aceptación
y rechazo de H0 y pueden proceder como ya aprendieron en Bioestadística: si el valor experimental es
mayor que el valor crítico para un dado nivel de significancia, esa fuente de variación tiene un efecto
6
significativo sobre la variable dependiente. Todos los valores de F obtenidos experimentalmente
superaron los valores críticos, de modo que los efectos que hemos estudiado son estadísticamente
significativos a esos valores de confianza. También podemos observar que el F producido por la
temperatura es mayor que el producido por la humedad y éste a su vez es ligeramente mayor que el
producido por la interacción, lo cual nos da una idea de su magnitud.
¿Y Si Trabajo En Computador?
A continuación indicaremos los pasos para obtener la Tabla ANOVA de manera automática si disponen
de una computadora y algún programa estadístico. Normalmente no es complicado <correr>
(“ejecutar”) los programas, pero es necesario saber cómo <colocar> (“ingresar”) los datos, saber qué
vamos a calcular con el programa y cómo interpretar esa información. La mayoría de los
programas funcionan con una lógica muy parecida. En esta guía describiremos brevemente las
indicaciones para proceder con algunos programas conocidos: STATISTICA para WINDOWS
(versiones 5.X y 6.0), XLStat versión 7.1 para Windows y Minitab versión 14. En todos estos casos, los
datos se ingresan exactamente de la misma manera, para lo cual sugerimos detallar cómo la Tabla 1
se convierte ahora en la Tabla 4 de forma de precisarle al programa cuál valor de la variable
dependiente pertenece a cada particular combinación de humedad y temperatura.
Si tienen los datos copiados en una hoja de Excel, preparen la matriz de la manera más sencilla
posible (sin formatos de subrayado, colores, sombras, negritas o itálicas). En la primera fila de cada
columna, deben ingresarse los nombres de las variables independiente (s) y dependiente, traten de no
utilizar más de 8 caracteres en la identificación de cada variable.
STATISTICA para Windows (v.5.x y 6.0)
El programa STATISTICA para Windows (StatSoft 1999, 2001) es una excelente herramienta para
hacer ANOVA y otras pruebas estadísticas, aunque no es un programa de copia libre. En STATISTICA
(y la mayoría de los programas), las filas del 1 al 24 se llaman “casos” y las columnas “variables”. Las
versiones 5.0 o 5.5 tienen distintos módulos, ingresen en el módulo de ANOVA-MANOVA. Luego
incorporen los datos al programa de la manera en que aparece en la Tabla 4. Esto pueden hacerlo
directamente copiando y pegando valores de su hoja de Excel, o de un modo manual en la hoja que
tiene el STATISTICA. Luego coloquen los nombres a las variables (haciendo doble “click” en la parte
superior de cada columna y escribiendo un nombre que no supere los 8 caracteres).
Seguidamente, <guarden> (“salven”) los datos (el programa creará un archivo con extensión *.sta). y
en el menú principal seleccionen ANALYSIS e inmediatamente RESUME ANALYSIS ↵. Con estas
indicaciones aparecerá un cuadro que tiene un botón para seleccionar las VARIABLES. Se presiona y
se le especifica cuáles son las independientes y cuál es la dependiente (recordemos que sólo puede
haber una variable dependiente por experimento). Se presiona el botón OK y el programa reportará un
cuadro para escoger el tipo de resultados. Se selecciona la opción ALL EFFECTS, y obtenemos la
tabla ANOVA que comentamos anteriormente, bajo el formato que ofrece el programa (Tabla 5), pero
observen que es esencialmente la misma información que obtuvimos en la Tabla 2.
7
Caso
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
TEMP
20.000
20.000
20.000
20.000
20.000
20.000
23.000
23.000
23.000
23.000
23.000
23.000
26.000
26.000
26.000
26.000
26.000
26.000
28.000
28.000
28.000
28.000
28.000
28.000
HUMEDAD
70.000
70.000
80.000
80.000
90.000
90.000
70.000
70.000
80.000
80.000
90.000
90.000
70.000
70.000
80.000
80.000
90.000
90.000
70.000
70.000
80.000
80.000
90.000
90.000
ECLOSION
25.000
30.000
27.000
29.000
50.000
47.000
38.000
32.000
75.000
70.000
35.000
40.000
40.000
48.000
57.000
50.000
27.000
30.000
28.000
30.000
26.000
32.000
17.000
15.000
Tabla 4. Forma de ingresar los datos presentados en la Tabla 1 a los programas estadísticos.
Summary of all Effects; design: (coleop.sta)
1-TEMPERAT, 2-HUMEDAD
1
2
12
df
Effect
3
2
6
MS
Effect
620.6111
419.7917
392.5695
df
Error
12
12
12
MS
Error
12.08333
12.08333
12.08333
F
51.36092
34.74138
32.48851
p-level
.000000
.000010
.000001
Tabla 5. Tabla ANOVA bajo el formato del programa STATISTICA para WINDOWS. coleop.sta fue el
nombre que se le dio al archivo en el cual se guardaron los datos al realizar esta corrida.
Pudiéramos observar los F y compararlos con los valores críticos de la Tabla 3, pero ni siquiera es
necesario ir a un libro a consultar la distribución, porque el programa nos da también los niveles de
significancia de la prueba, que en la tabla aparecen como p-level (cuando escriban el informe
llámenlos niveles de significancia y no p-level). Estos valores indican la probabilidad de que se
obtenga ese valor si Ho es cierta. Analicemos esto con más detalle: si este valor es pequeño (menor
a 0.05, que es el nivel de confianza de la prueba), entonces es muy poco probable haberlo obtenido
cuando Ho es cierta, por lo tanto, Ho debería rechazarse. Esto implica que la fuente de variación
8
asociada a este valor produce efectos estadísticamente significativos sobre las medias del
experimento. Si por el contrario este valor es grande, es muy probable haberlo obtenido cuando Ho es
cierta, y por lo tanto, la fuente de variación no está produciendo cambios significativos en las
medias. La última línea de la tabla corresponde al efecto de la interacción de las variables 1 y 2. (El
programa lo coloca como ‘12’ para indicar que están involucradas ambas variables). Al observar los
niveles de significancia podemos comparar con más precisión la magnitud de los efectos de cada
fuente de variación. En este caso, la humedad actuó como un factor que disminuyó el efecto de la
temperatura, porque el efecto de temperatura solo, es mayor que el efecto de temperatura en
presencia de la humedad.
Si disponen del programa STATISTICA en su versión 6.0 (StatSoft 2001), no tienen varios módulos,
sino que todos los análisis están integrados en uno solo. En este caso, vayan a la opción Statistics en
el menú principal, y seguidamente seleccionen la opción ANOVA (Figura 3). Seguidamente aparece
una ventana donde pregunta el tipo de ANOVA que quieren realizar. Para nuestro caso es ANOVA
FACTORIAL donde consideran la interacción entre ambos factores. En ese punto, el procedimiento se
hace igual que para las versiones anteriores.
Figura 3. Interfase gráfica del programa Statistica para Windows. v. 6.0
Xlstat (v.7.1)
Pueden obtener en internet (http://www.xlstat.com) una versión demostrativa del programa XLSTAT
(Addinsoft 2005) que se asocia con Excel y que pueden utilizar por 30 veces o por 30 días (momento
en el cual deberán comprarlo o el programa dejará de funcionar). Al abrir este programa, les aparecerá
una advertencia diciendo que la hoja contiene Macros. Permitan que estos macros se activen (opción
“enable macros” para que pueda funcionar el programa). Abran la hoja de Excel donde ingresaron sus
datos y presionen el quinto botón de la barra XLSTAT (lo hemos marcado en un círculo). Con esto, se
desplegará una barra de opciones para modelado de los datos, en la cual van a seleccionar el tercer
botón (ANOVA, identificado con una a minúscula), como pueden verlo en la Figura 4.
Al presionar el botón a, les aparece una ventana de diálogo que van a llenar exactamente como
aparece en la de la Figura 5.
9
La primera caja de texto (donde aparece la variable dependiente) le indica al programa cuál es el
“bloque” que contiene el rango de valores que quieren analizar. En nuestro caso, es en la hoja 1
(sheet1), desde la celda C1 hasta la C25. Pero esto es muy fácil hacerlo con el ratón (“mouse”). Para
ello, presionamos el botón derecho de esa caja de texto (en el circulo) y desaparece la ventana
anterior, dando lugar a otra (Figura 6). Inmediatamente sombreamos (seleccionamos) con el ratón el
bloque que contiene la variable (incluido su nombre) y presionamos el botón que en la Figura 5
aparece encerrado en un círculo, con lo que inculiremos todo el rango de nuestra variable dentro de la
caja de texto de la variable dependiente (Figura 5). Hacerlo con el programa es mucho más fácil que
leer estas instrucciones.
Al presionar el botón OK (Figura 5) el programa arrojará todos los resultados de la prueba en una
nueva hoja del libro de Excel donde incorporaron sus datos.
Figura 4. Interfase gráfica del programa XLSTAT.
10
Figura 5. Interfase gráfica del programa XLSTAT para hacer un ANOVA.
Figura 6. Interfase gráfica del programa XLSTAT para introducir datos.
11
Minitab v.14.
Para trabajar con el programa Minitab (Minitab Inc 2003), seleccionen Stat, luego ANOVA y finalmente
two-way anova (Figura 7. Seguidamente van a tener una caja de diálogo (Figura 8) donde seleccionan
las variables dependientes e independientes. Para que el modelo sea de dos vías con interacción,
deben marcar la casilla Fit additive model, o el ANOVA será de dos vías pero sin interacción.
Figura 7. Interfase gráfica del programa Minitab 14 para seleccionar el ANOVA.
Figura 8. Ventana para escoger las variables en el programa Minitab 14. Originalmente las variables
aparecen en la ventana grande ubicada a la izquierda de este cuadro de diálogo, hasta el momento en
que son seleccionadas a las pequeñas ventanas nombradas como Response (variable dependiente), Row
factor (una de las vías) y Column Factor (otra de las vías).
12
¿Y cómo puedo interpretar la información obtenida?
Con las tablas obtenidas hasta este momento (Tabla ANOVA), solo podemos aceptar o rechazar la
hipótesis nula, en favor de la Hipótesis alternativa (H1) que con frecuencia se enuncia ‘Al menos una de
las medias es distinta’. Recordemos que se rechaza la H0 cuando los niveles de significancia son
pequeños, lo cual indica que los F están sobrepasando los valores críticos. Pero hay un problema,
porque esa decisión no nos indica cuál o cuales medias son distintas a las demás. ¡No sabemos
cuál tratamiento difiere de otro! Solo sabemos que la humedad ha actuado como un factor que está
disminuyendo el efecto de la temperatura, pero deberíamos conocer cómo varían estos efectos a lo
largo de todos los tratamientos. ¿Será, por ejemplo 70% de humedad a 28°C distinto de 90% de
humedad a 26°C?.
La Solución...
Lo más sencillo e ilustrativo es elaborar un gráfico con todas las medias implicadas y probar sus
diferencias con ayuda de una prueba a posteriori. Estas pruebas se obtienen muy fácilmente con los
programas estadísticos mencionados y hacen una comparación entre todos y cada uno de los
tratamientos (como si comparásemos por pruebas t de student todos los tratamientos entre sí). En
estas pruebas obtenemos matrices en las cuales observamos algún valor o símbolo que nos indica si
las medias comparadas son iguales o no (estadísticamente), y a partir de esos resultados podemos
hacer el análisis y concluir sobre el experimento.
El programa STATISTICA hace automáticamente estos gráficos, pero ustedes también pueden también
hacerlos manualmente puesto que conocen todas las medias. En el mismo recuadro donde se
seleccionó la opción ALL EFFECTS, está otra opción con el nombre MEANS/GRAPHS. Se presiona
ese botón y aparecen las tres fuentes de variación (Temperatura, Humedad y la interacción de ambas).
Se sombrea el gráfico deseado (si se sombrea Temperatura, graficará las medias de temperatura
(Figura 9). Si se sombrea Humedad, sólo las de humedad (Figura 10) y si se presiona 12 (la
interacción de las dos variables), aparecerán las medias de cada tratamiento pues hay una interacción
para cada tratamiento (Figura 11).
El programa XLSTAT también hace gráficos automáticamente si marcan la opción “Residual” y “Chart”
(Figura 5). Con estas opciones, aparecen estos gráficos y otros, que por el momento pueden pasar por
alto. Si no marcan la opción “Residual”, los gráficos (charts) no aparecerán.
Plot of Means (unweighted)
TEMPERAT Main Effect
F(3,12)=51.36; p<.0000
55
50
Variable: %_ECLOS
45
40
35
30
25
20
G_1:20
G_2:23
G_3:26
G_4:28
TEMPERAT
Figura 9. Medias de los tratamientos para las cuatro temperaturas.
13
Plot of Means (unweighted)
HUMEDAD Main Effect
F(2,12)=34.74; p<.0000
48
46
Variable: %_ECLOS
44
42
40
38
36
34
32
30
G_1:70
G_2:80
G_3:90
HUMEDAD
Figura 10. Medias de los tratamientos para las tres humedades.
Plot of Means
2-way interaction
F(6,12)=32.49; p<.0000
80
70
Variable: %_ECLOS
60
50
40
30
20
10
G_1:20
G_2:23
G_3:26
G_4:28
HUMEDAD
G_1:70
HUMEDAD
G_2:80
HUMEDAD
G_3:90
TEMPERAT
Figura 11. Medias de cada uno de los doce tratamientos (todas las combinaciones de temperatura y
humedad).
El programa Minitab también hace los gráficos automáticamente si se seleccionan en el botón
GRAPHS del cuadro de diálogo (Figura 8).
Para determinar si las variaciones que observamos entre estos valores son significativas (descartar
que sean producto de la escala a la que estamos graficando, seleccionamos del cuadro de resultados
la opción POST-HOC COMPARISIONS y aparecerá una ventana que permite seleccionar las variables
independientes a comparar. Podemos seleccionar solo una (temperatura o humedad) o ambas (en este
caso se escogieron las dos variables). Luego aparece un cuadro con todas las pruebas a posteriori que
dispone el programa. Una muy fácil de interpretar es la de “Diferencias mínimas significativas” (LSD
test or planned comparisions). Al seleccionar esta opción obtenemos la matriz que presentamos en la
Tabla 6 y que explicaremos a continuación:
14
LSD test; variable %_ECLOS (coleop.sta)
Probabilities for Post-Hoc Tests
INTERACTION: 1 x 2
{1}
medias - 27.5
>
20
70 {1}
20
.888
80 {2}
20
.000
90 {3}
23
.052
70 {4}
23
.000
80 {5}
23
.014
90 {6}
26
.000
70 {7}
26
.000
80 {8}
26
.779
90 {9}
28
.674
70 {10}
28
.674
80 {11}
28
.006
90 {12}
{2}
28.0
{3}
48.5
{4}
35.0
{5}
72.5
{6}
37.5
{7}
44.0
{8}
53.5
{9}
28.5
{10}
29.0
{11}
29.0
{12}
16.0
.888
.000
.052
.000
.014
.000
.000
.779
.674
.674
.006
.000
.067
.000
.018
.001
.000
.888
.779
.779
.005
.002
.000
.008
.220
.176
.000
.000
.000
.000
.000
.486
.024
.000
.086
.110
.110
.000
.000
.000
.000
.000
.000
.000
.000
.086
.001
.024
.031
.031
.000
.018
.001
.001
.001
.000
.000
.000
.000
.000
.888
.888
.004
1.00
.003
.000
.067
.002
.000
.000
.000
.018
.008
.486
.000
.001
.220
.024
.000
.086
.000
.176
.000
.000
.001
.018
.888
.000
.086
.000
.024
.001
.000
.779
.000
.110
.000
.031
.001
.000
.888
.779
.000
.110
.000
.031
.001
.000
.888
1.00
.005
.000
.000
.000
.000
.000
.000
.004
.003
.003
.003
Tabla 6. Probabilidades resultantes de la prueba de “Diferencias mínimas significativas” para los doce
tratamientos obtenidas con el programa STATISTICA para Windows.
Los números entre corchetes sirven para identificar cada tratamiento (combinación de temperatura y
humedad), especificado en la primera columna (el número superior es el valor de temperatura y el
inferior el de humedad). En la primera fila, además de esto, tenemos los valores de las medias para
cada tratamiento (lo que está graficado) y lo que se indica en la matriz, son las probabilidades que
tienen de aparecer las diferencias obtenidas cuando Ho es cierta. La Ho de esta prueba es que todas
estas medias son iguales. Veamos esto con un ejemplo: el tratamiento 10 (70% de humedad y 28°C)
no difiere significativamente del tratamiento 9 (90% de humedad y 26°C) porque hay una alta
probabilidad (88,8%) de obtener la diferencia observada cuando Ho se cumple. En otras palabras, las
diferencias entre esas medias son producidas por error experimental y son prácticamente iguales.
Por el contrario, el tratamiento 10 si difiere del tratamiento 8 (80% de humedad y 26°C) porque la
probabilidad de obtener la diferencia observada si Ho se cumple, es muy baja (son aparentemente muy
distintas, más de lo que cabría esperarse por puro error experimental). Es lógico que no aparezcan
valores en la diagonal principal de la matriz, porque un mismo valor debe ser idéntico a sí mismo.
15
El programa XLSTAT también calcula comparaciones a posteriori. Para ello, en la ventana de la Figura
4 deben marcar las opciones “Comparisions” e “Interactions” (si no marcan esta última, no dará ambos
efectos ni el efecto de la interacción). Seguidamente aparecerá una ventana donde podrán especificar
si quieren solo el efecto de la temperatura, solo de la humedad o de la interacción entre ambas.
Cuando le dan OK, aparece el tipo de pruebas que pueden pedirle al programa y pueden seleccionar la
que prefieran.
La Tabla para la prueba de Diferencias Mínimas Significativas aparece con otro formato distinto (Tabla
7) al que da el programa STATISTICA, pero pueden comprobar que contiene la misma información y
además contiene una columna donde señala si las diferencias son significativas o no.
Categories
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-28*HUMEDAD-90
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-20*HUMEDAD-70
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-20*HUMEDAD-80
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-26*HUMEDAD-90
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-28*HUMEDAD-80
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-28*HUMEDAD-70
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-23*HUMEDAD-70
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-23*HUMEDAD-90
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-26*HUMEDAD-70
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-20*HUMEDAD-90
TEMPERAT-23*HUMEDAD-80 ~ TEMPERAT-26*HUMEDAD-80
TEMPERAT-26*HUMEDAD-80 ~ TEMPERAT-28*HUMEDAD-90
TEMPERAT-26*HUMEDAD-80 ~ TEMPERAT-20*HUMEDAD-70
TEMPERAT-26*HUMEDAD-80 ~ TEMPERAT-20*HUMEDAD-80
TEMPERAT-26*HUMEDAD-80 ~ TEMPERAT-26*HUMEDAD-90
TEMPERAT-26*HUMEDAD-80 ~ TEMPERAT-28*HUMEDAD-80
TEMPERAT-26*HUMEDAD-80 ~ TEMPERAT-28*HUMEDAD-70
TEMPERAT-26*HUMEDAD-80 ~ TEMPERAT-23*HUMEDAD-70
TEMPERAT-26*HUMEDAD-80 ~ TEMPERAT-23*HUMEDAD-90
TEMPERAT-26*HUMEDAD-80 ~ TEMPERAT-26*HUMEDAD-70
TEMPERAT-26*HUMEDAD-80 ~ TEMPERAT-20*HUMEDAD-90
TEMPERAT-20*HUMEDAD-90 ~ TEMPERAT-28*HUMEDAD-90
TEMPERAT-20*HUMEDAD-90 ~ TEMPERAT-20*HUMEDAD-70
TEMPERAT-20*HUMEDAD-90 ~ TEMPERAT-20*HUMEDAD-80
TEMPERAT-20*HUMEDAD-90 ~ TEMPERAT-26*HUMEDAD-90
TEMPERAT-20*HUMEDAD-90 ~ TEMPERAT-28*HUMEDAD-80
TEMPERAT-20*HUMEDAD-90 ~ TEMPERAT-28*HUMEDAD-70
TEMPERAT-20*HUMEDAD-90 ~ TEMPERAT-23*HUMEDAD-70
TEMPERAT-20*HUMEDAD-90 ~ TEMPERAT-23*HUMEDAD-90
TEMPERAT-20*HUMEDAD-90 ~ TEMPERAT-26*HUMEDAD-70
TEMPERAT-26*HUMEDAD-70 ~ TEMPERAT-28*HUMEDAD-90
TEMPERAT-26*HUMEDAD-70 ~ TEMPERAT-20*HUMEDAD-70
TEMPERAT-26*HUMEDAD-70 ~ TEMPERAT-20*HUMEDAD-80
TEMPERAT-26*HUMEDAD-70 ~ TEMPERAT-26*HUMEDAD-90
TEMPERAT-26*HUMEDAD-70 ~ TEMPERAT-28*HUMEDAD-80
TEMPERAT-26*HUMEDAD-70 ~ TEMPERAT-28*HUMEDAD-70
TEMPERAT-26*HUMEDAD-70 ~ TEMPERAT-23*HUMEDAD-70
TEMPERAT-26*HUMEDAD-70 ~ TEMPERAT-23*HUMEDAD-90
TEMPERAT-23*HUMEDAD-90 ~ TEMPERAT-28*HUMEDAD-90
TEMPERAT-23*HUMEDAD-90 ~ TEMPERAT-20*HUMEDAD-70
TEMPERAT-23*HUMEDAD-90 ~ TEMPERAT-20*HUMEDAD-80
TEMPERAT-23*HUMEDAD-90 ~ TEMPERAT-26*HUMEDAD-90
TEMPERAT-23*HUMEDAD-90 ~ TEMPERAT-28*HUMEDAD-80
TEMPERAT-23*HUMEDAD-90 ~ TEMPERAT-28*HUMEDAD-70
TEMPERAT-23*HUMEDAD-90 ~ TEMPERAT-23*HUMEDAD-70
TEMPERAT-23*HUMEDAD-70 ~ TEMPERAT-28*HUMEDAD-90
TEMPERAT-23*HUMEDAD-70 ~ TEMPERAT-20*HUMEDAD-70
TEMPERAT-23*HUMEDAD-70 ~ TEMPERAT-20*HUMEDAD-80
TEMPERAT-23*HUMEDAD-70 ~ TEMPERAT-26*HUMEDAD-90
TEMPERAT-23*HUMEDAD-70 ~ TEMPERAT-28*HUMEDAD-80
TEMPERAT-23*HUMEDAD-70 ~ TEMPERAT-28*HUMEDAD-70
TEMPERAT-28*HUMEDAD-70 ~ TEMPERAT-28*HUMEDAD-90
TEMPERAT-28*HUMEDAD-70 ~ TEMPERAT-20*HUMEDAD-70
TEMPERAT-28*HUMEDAD-70 ~ TEMPERAT-20*HUMEDAD-80
TEMPERAT-28*HUMEDAD-70 ~ TEMPERAT-26*HUMEDAD-90
TEMPERAT-28*HUMEDAD-70 ~ TEMPERAT-28*HUMEDAD-80
TEMPERAT-28*HUMEDAD-80 ~ TEMPERAT-28*HUMEDAD-90
TEMPERAT-28*HUMEDAD-80 ~ TEMPERAT-20*HUMEDAD-70
TEMPERAT-28*HUMEDAD-80 ~ TEMPERAT-20*HUMEDAD-80
TEMPERAT-28*HUMEDAD-80 ~ TEMPERAT-26*HUMEDAD-90
TEMPERAT-26*HUMEDAD-90 ~ TEMPERAT-28*HUMEDAD-90
TEMPERAT-26*HUMEDAD-90 ~ TEMPERAT-20*HUMEDAD-70
TEMPERAT-26*HUMEDAD-90 ~ TEMPERAT-20*HUMEDAD-80
TEMPERAT-20*HUMEDAD-80 ~ TEMPERAT-28*HUMEDAD-90
TEMPERAT-20*HUMEDAD-80 ~ TEMPERAT-20*HUMEDAD-70
TEMPERAT-20*HUMEDAD-70 ~ TEMPERAT-28*HUMEDAD-90
Difference Standardized difference
56.500
16.254
45.000
12.946
44.500
12.802
44.000
12.658
43.500
12.514
43.500
12.514
37.500
10.788
35.000
10.069
28.500
8.199
24.000
6.904
19.000
5.466
37.500
10.788
26.000
7.480
25.500
7.336
25.000
7.192
24.500
7.048
24.500
7.048
18.500
5.322
16.000
4.603
9.500
2.733
5.000
1.438
32.500
9.350
21.000
6.041
20.500
5.897
20.000
5.754
19.500
5.610
19.500
5.610
13.500
3.884
11.000
3.164
4.500
1.295
28.000
8.055
16.500
4.747
16.000
4.603
15.500
4.459
15.000
4.315
15.000
4.315
9.000
2.589
6.500
1.870
21.500
6.185
10.000
2.877
9.500
2.733
9.000
2.589
8.500
2.445
8.500
2.445
2.500
0.719
19.000
5.466
7.500
2.158
7.000
2.014
6.500
1.870
6.000
1.726
6.000
1.726
13.000
3.740
1.500
0.432
1.000
0.288
0.500
0.144
0.000
0.000
13.000
3.740
1.500
0.432
1.000
0.288
0.500
0.144
12.500
3.596
1.000
0.288
0.500
0.144
12.000
3.452
0.500
0.144
11.500
3.308
Critical value
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
2.179
Pr. > Diff Significant
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
0.000
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
0.000
Yes
0.001
Yes
0.018
Yes
0.176
No
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
< 0.0001
Yes
0.000
Yes
0.000
Yes
0.002
Yes
0.008
Yes
0.220
No
< 0.0001
Yes
0.000
Yes
0.001
Yes
0.001
Yes
0.001
Yes
0.001
Yes
0.024
Yes
0.086
No
< 0.0001
Yes
0.014
Yes
0.018
Yes
0.024
Yes
0.031
Yes
0.031
Yes
0.486
No
0.000
Yes
0.052
No
0.067
No
0.086
No
0.110
No
0.110
No
0.003
Yes
0.674
No
0.779
No
0.888
No
1.000
No
0.003
Yes
0.674
No
0.779
No
0.888
No
0.004
Yes
0.779
No
0.888
No
0.005
Yes
0.888
No
0.006
Yes
Tabla 7. Probabilidades resultantes de la prueba de “Diferencias mínimas significativas” para los doce
tratamientos obtenidas con el programa XLSTAT para Windows.
16
¿Y biológicamente cómo se interpreta todo esto?
En primer lugar, hay que enfocarse en conocer si los efectos que estudiamos fueron significativos. Una
manera de reportar estos resultados (válida para artículos científicos) se ejemplifica con un caso
hipotético en el que la temperatura tuvo un nivel de significancia p=0.0435. Se colocará: “La
temperatura tuvo un efecto significativo sobre el porcentaje de eclosión de los huevos (p<0.05)”. Si no
hubiese sido significativo se escribe: “La temperatura no tuvo un efecto significativo sobre el porcentaje
de eclosión de los huevos (p>0.05)”. Si hubiese dado p=0.0021, el nivel que se reporta es por ejemplo
de p<0.005 (pueden poner un límite que sea mayor que el valor que obtienen, pero cuanto “menos
mayor” sea, más “significancia” mostrarán con su resultado. Queremos decir con esto, que si ponen
p<0.01 también es válido, porque 0.0021 es menor que 0.005 y que 0.01, pero 0.005 implica que el
valor que obtuvieron está más alejado del límite que delimita la zona de aceptación y de rechazo.
En segundo lugar, queremos saber cómo fueron los efectos. El efecto de la temperatura lo podemos
ver directamente en la Figura 9, donde se aprecia que el aumentar 3 grados la temperatura (paso de
20 a 23°C) aumenta el % de eclosión de los huevos (si se miran las medias, puede verse cuánto se
aumenta, y si se mira la prueba de diferencias mínimas significativas, puede determinarse si este
aumento es significativo). A partir de este valor, si se continúa aumentando la temperatura, el
porcentaje de eclosión desciende, hasta ser muy bajo en situación de extremo calor. Pueden concluir
que la temperatura 23°C fue una condición de calor que proporcionó mejores resultados que los que se
obtuvieron probando con temperaturas fijas por debajo y por encima de este valor. De una manera
análoga se puede interpretar el resultado para la humedad a partir de la Figura 10.
Las interacciones se interpretan a partir de la Figura 11. Cuando trabajamos a 70% de humedad (línea
contínua), obtenemos mayores porcentajes de eclosión a 26°C. Si no hubiera interacción, este
comportamiento se repetiría al trabajar en todas las humedades, y hemos visto que no es así. Esto nos
indica que hay una interacción (de hecho, en la Tabla 2, ya sabemos que la interacción es significativa)
y esta se manifiesta cuando vemos que “la mejor temperatura” para la eclosión de los huevos depende
de cuál humedad estamos considerando.
Observemos que si la humedad aumenta a 80% (línea a rayas), se alcanzan los mayores valores de %
de eclosión para todo el experimento (p<0.000) (haber colocado eso le dice a un lector cualquiera que
ese valor es absolutamente distinto de los restantes a cualquier nivel de confianza). Pero además, en
80% de humedad, el valor esperado (la media para 80%) es 45,75 (lo podemos ver en la gráfica, o en
la Tabla 1) y ahora observamos que este valor es modificado dependiendo de la temperatura a la que
nos encontremos. Esto es lo que significa que los factores humedad y temperatura están
interactuando. A 20°C, el % de eclosión es menor del 30%. Si subimos a 23°, se dispara por encima
del 70% de eclosión, haciendo evidente que esta particular combinación de temperatura y humedad
favorece mucho el desarrollo de estos insectos, pero un aumento del calor, desfavorece o inhibe el %
de eclosión en casi la mitad (efecto del calor).
Algunas Notas
Daniel (1977) contiene explicación detallada a nivel general y básico sobre Análisis de Varianza. Si
desea profundizarse más al respecto, se puede consultar Montgomery (1991) con un nivel más
avanzado y numerosas aplicaciones.
El programa STATISTICA para WINDOWS en cualquiera de sus versiones tiene una “ayuda” muy
completa referente a todos los tratamientos estadísticos que hace el programa. A pesar de estar en
inglés, está muy bien escrita, por lo que es fácil de comprender y contiene temas que muchas veces no
se plantean con ese nivel de sencillez en los libros.
En la página http://www.cse.csiro.au/poptools/, pueden descargar el Programa POPTOOLS. Este
programa es gratuito (libre copia) y tiene una gran cantidad de herramientas que pueden utilizar para la
Ecología Poblacional. Pero además hace varias pruebas estadísticas entre las que aparece el ANOVA
de una sola vía.
17
Esperamos que esta simple guía los haya ayudado a comprender un poco la base de un análisis como
este que tiene aplicación tan amplia en biología y otras ciencias. Este trabajo pretende simplemente
orientarlos en la realización del análisis y en su interpretación, pero no contiene una explicación sobre
los supuestos que deben cumplirse para poder aplicar un ANOVA, que son importantes y que son
imprescindibles de revisar cuando trabajen en su tesis o en cualquier otro trabajo que desarrollen
más adelante.
Referencias
Addinsoft 2005. XL Stat para Windows. 224 Centre Street, 3rd Floor. New York, NY 10013. USA.
http://www.xlstat.com.
Daniel W. 1977. Bioestadística. Base para el Análisis de las Ciencias de la Salud. Editorial Limusa.
Mexico.
Minitab Inc. 2003. Minitab v. 14. Quality Plaza, 1829 Pine Hall Road, State College, PA 16801-3008,
U.S.A. http://www.minitab.com
Montgomery, D. 1991. Diseño y análisis de experimentos. Grupo editorial suramericana. México.
StatSoft Inc. 1999. STATISTICA for Windows. Versión 5.5. [Computer program manual]. Tulsa, OK.
http://www.statsoft.com
StatSoft Inc. 2001. STATISTICA for Windows. Versión 6.0. [Computer program manual]. Tulsa, OK.
http://www.statsoft.com
Agradecimiento
Al Dr. Luis Bulla, Dr Rubén Candia y Dr. Ernesto González, así como al Lic. Víctor Hugo Aguilar por el
estímulo y ayuda que proporcionaron durante su elaboración (en 1996) y posteriores revisiones.
© 2005. Lourdes Suárez V. con apoyo de
en: http://www.geocities.com/statvenezuela
[email protected]
18