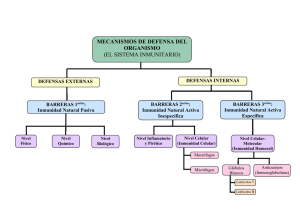
1.35. Sistema inmune y mecanismos de inmunidad
Anuncio

1.35. Sistema inmune y mecanismos de inmunidad innata y adaptativa Alfonso Ruiz-Bravo López María Jiménez Valera Capítulo 1.35. Sistema inmune y mecanismos de inmunidad innata y adaptativa 1. Introducción 2. Inmunidad no específica 2.1. Reconocimiento de estructuras microbianas ubicuas 2.2. Sistemas de moléculas plasmáticas que reconocen estructuras extrañas 2.2.1. Sistema de quininas 2.2.2. Sistema del complemento: vías de activación 2.2.3. Sistema del complemento: vía efectora común y actividades biológicas de los fragmentos generados durante la activación 2.3. Reconocimiento de estructuras microbianas inespecíficas por receptores celulares 2.4. Inflamación y fagocitosis 2.4.1. Reacción inflamatoria 2.4.2. Inflamación aguda 2.4.3. Fagocitosis 2.4.4. Citokinas proinflamatorias y efectos sistémicos de la inflamación aguda 2.4.5. Inflamación crónica 2.5. Citotoxicidad natural 2.6. Interferones 2.6.1. Tipos de interferones 2.6.2. Mecanismos de acción antiviral 2.6.3. Otras actividades biológicas de los interferones 3. Inmunidad específica 3.1. Antígenos 3.1.1. Conceptos de antígeno, epítopo y hapteno 3.1.2. Inmunización, coadyuvantes y BRM 3.2. Linfocitos, sus receptores y otras moléculas de la superficie linfocitaria 3.2.1. Linfocitos B y T 3.2.2. Inmunoglobulinas 3.2.3. Generación de la diversidad de especificidades 3.2.4. Receptor de células B y marcadores de diferenciación del linaje B 3.2.5. Sistema principal de histocompatibilidad 3.2.6. Receptor de células T 3.2.7. Ontogenia de células T, marcadores y subpoblaciones 3.3. El papel crucial de las células Th 3.3.1. Presentación de epítopos a las células Th 3.3.2. Respuestas Th1 y Th2 3.4. Respuesta de anticuerpos 3.4.1. Activación de linfocitos B 3.4.2. Producción de anticuerpos, cambios de clase y maduración de afinidad 3.4.3. Los anticuerpos como moléculas efectoras 3.5. Inmunidad celular 3.5.1. Respuesta de células Th1 y activación de macrófagos 3.5.2. Linfocitos T citotóxicos 4. Resumen 5. Bibliografía 6. Enlaces web Objetivos n Explicar las diferencias entre inmunidad innata e inmunidad específica, y clasificar cualquier mecanismo inmunitario en una de ambas categorías. n Explicar el concepto de PAMP (Pathogen-Associated Molecular Patterns). n Describir las vías de activación y efectora del sistema del complemento. n Describir el proceso de fagocitosis y evaluar el papel biológico de las reacciones de inflamación. n Describir la citotoxicidad natural y comprender la estrategia de los receptores de activación y de inhibición de las células NK. n Describir el reconocimiento de antígenos por linfocitos B y T. n Comprender la capacidad decisoria de las células T en dos niveles: la distinción entre antígenos exógenos y endógenos por células T CD4+ y T CD8+, y la discriminación entre patógenos extra e intracelulares por células Th2 y Th1. n Explicar el papel biológico de los antígenos de histocompatibilidad. n Explicar los aspectos básicos de la respuesta de anticuerpos. n Explicar los aspectos básicos de la inmunidad celular. 1. Introducción E n la historia evolutiva de los seres vivos, la capacidad de distinguir entre las estructuras propias y las de otros sistemas biológicos aparece tempranamente. Esta capacidad de discriminación entre propio y extraño es la base de los mecanismos inmunitarios que han desarrollado los animales, hasta alcanzar sus mayores niveles de complejidad en aves y mamíferos. Tal como se conoce hoy, el sistema inmune es realmente complejo: comprende una amplia diversidad de linajes celulares e implica un notable número de moléculas, unas presentes en los líquidos corporales y otras en la superficie de las células. Las células inmunitarias se concentran en el compartimento linfoide, constituido por una serie de órganos de tejido linfoide (timo, bazo, ganglios linfáticos, amígdalas, placas de Peyer, tejido linfoide difuso) conectados a una red de vasos que forman el sistema linfático, conectado a su vez con la circulación sanguínea; pero hay también células inmunitarias que abandonan la circulación y pasan a los diversos tejidos del organismo. Desde el punto de vista funcional, el sistema inmune opera reconociendo y eliminando estructuras extrañas al organismo. Estas funciones permiten mantener el medio interno libre de la colonización por microorganismos que encontrarían en él un hábitat óptimo (temperatura, humedad, riqueza de nutrientes). Se pueden distinguir dos grandes niveles de reconocimiento de estructuras: el de la inmunidad no específica (también denominada innata), que limita su capacidad de discriminación a distinguir entre las estructuras propias y algunas estructuras extrañas (generalmente, superficies de microorganismos); y el de la inmunidad específica, adquirida o adaptativa, basada en la generación de una enorme diversidad de receptores, cada uno de los cuales reconoce una determinada estructura (epítopo), ya sea propia o extraña, lo que implica a su vez el desarrollo obligado de mecanismos que impidan la autoagresión. El fallo eventual de estos mecanismos reguladores es la causa de las enfermedades autoinmunes. Aunque la distinción entre inmunidad no específica e inmunidad específica es real, y no una clasificación meramente académica, lo cierto es que existen numerosas conexiones entre ambos tipos de mecanismos, que actúan de forma integrada. Los mecanismos no específicos son mayoritariamente constitutivos, esto es, están listos para actuar, por lo que constituyen las primeras barreras que se oponen a la entrada de un agente patógeno. En cambio, la respuesta inmune específica es un proceso de inducción relativamente lenta, aunque de eficacia mucho mayor. En muchas ocasiones, la inmunidad no específica resulta insuficiente para eliminar al microorganismo infeccioso, pero se opone a su diseminación y proliferación dando 1195 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... tiempo a la elaboración de una respuesta específica esterilizante (es decir, capaz de eliminar a todos los microorganismos patógenos presentes en los tejidos). La mayor parte de las respuestas específicas generan memoria, es decir, las nuevas respuestas frente a una misma estructura son más rápidas y potentes. Esta propiedad de la inmunidad específica, en la que se basan los procedimientos de vacunación, reduce el papel de la inmunidad innata en el control inmediato de agentes patógenos frente a los que exista una memoria previa. Cabría preguntarse si un sistema tan complejo (y, por tanto, biológicamente costoso) e, incluso, potencialmente peligroso (como demuestra la existencia de las patologías autoinmunes) es realmente necesario para salvaguardar el medio interno frente a la amenaza de la infección. Hay que tener en cuenta que los microorganismos patógenos han evolucionado bajo la presión selectiva de los mecanismos inmunitarios que se oponen a su persistencia en el medio interno de sus hospedadores, y han ido adquiriendo factores de virulencia y estrategias sofisticadas para escapar del control inmunitario. Pero, sin necesidad de especulaciones teóricas, la necesidad de poseer un sistema inmune eficaz queda documentada por las situaciones en las que algunas partes del sistema fallan: los déficit inmunitarios o inmunodeficiencias. Se conoce un gran número de diferentes síndromes de inmunodeficiencia, congénitos y adquiridos, en los cuales la vida del enfermo se ve gravemente amenazada por la incidencia de infecciones, incluso por patógenos oportunistas (que no causarían enfermedad en un individuo inmunocompetente). El sistema inmune tiene conexiones importantes con otros sistemas, como el nervioso y el endocrino, y, también como ellos, es muy sensible al estado nutricional del individuo. Por otra parte, hay evidencias convincentes de que determinados alimentos funcionales como los probióticos (y, a través de ellos, los prebióticos) pueden ejercer efectos modificadores sobre mecanismos inmunitarios (inmunomodulación). Por todo ello, un estudio sistemático de la nutrición no debe olvidar las implicaciones inmunitarias. Este Capítulo presenta una visión básica del sistema inmune, que facilite la comprensión de otras partes de este tratado que se apoyan en conceptos inmunológicos. 1196 2. Inmunidad no específica 2.1. Reconocimiento de estructuras microbianas ubicuas Para ser eficaces como primera línea defensiva frente a las infecciones, los mecanismos de la inmunidad innata deben ser capaces de reconocer estructuras compartidas por grandes grupos de microorganismos. Recientemente, se ha acuñado la expresión Pathogen-Associated Molecular Patterns (PAMP), para designar estructuras de la superficie microbiana, comunes a muchos microorganismos. Ejemplos de PAMP son el peptidoglicano, que forma la capa de mureína presente en la pared celular de bacterias Gram-positivas y Gram-negativas; el lipopolisacárido (LPS) de la pared de bacterias Gram-negativas; las lipoproteínas, también de la pared de bacterias Gram-negativas; los ácidos lipoteicoicos, de la pared de bacterias Gram-positivas; los lipo-arabino-mananos, de la pared de micobacterias; la flagelina (proteína constitutiva de los flagelos bacterianos); el zimosán presente en la pared de levaduras, etc. Los receptores que reconocen PAMP se conocen con las siglas PRR (Pattern Recognition Receptors). Hay PRR solubles, que son proteínas plasmáticas; otros se ubican en la superficie de células implicadas en la inmunidad, como monocitos y macrófagos, células dendríticas, mastocitos e incluso algunas células epiteliales (células de la mucosa intestinal). 2.2. Sistemas de moléculas plasmáticas que reconocen estructuras extrañas Se trata de conjuntos de proteínas presentes en el plasma de forma constitutiva. En su estado nativo, carecen de actividad biológica. La presencia de determinados PAMP inicia la activación de estos sistemas, que es secuencial, esto es, sigue un orden: un componente del sistema se activa y actúa sobre el siguiente en la secuencia, activándolo a su vez, y así sucesivamente (en su estado nativo, son proenzimas que al activarse adquieren capacidad de actuar enzimáticamente sobre su sustrato, que es el componente siguiente). Como cada componente activado actúa enzimáticamente, en cada paso de A. Ruiz-Bravo López | M.ª Jiménez Valera la secuencia hay un efecto amplificador, ya que una sola molécula de enzima cataliza la conversión de un gran número de moléculas de sustrato. Frecuentemente, la proteína que se activa se rompe en dos fragmentos, cada uno de los cuales puede exhibir actividades biológicas adicionales, relacionadas con la inducción de los dos mecanismos característicos de las reacciones inflamatorias: la extravasación de plasma y la llegada de células inflamatorias. 2.2.1. Sistema de quininas Consta de tres componentes: el factor Hageman o HF (factor XII del sistema de coagulación de la sangre), el kininógeno de alto peso molecular (HMWK: High Molecular Weight Kininogen) y la prekalikreína. El reconocimiento de estructuras extrañas corre a cargo del HF, que se activa en contacto con polianiones, frecuentes en la superficie de algunos microorganismos (como el LPS presente en la pared celular de las bacterias Gram-negativas). La secuencia de activación del sistema es la siguiente: el HF activado forma un complejo con el HMWK, que actúa como cofactor; este complejo actúa sobre la prekalikreína, convirtiéndola en kalikreína; a su vez, la kalikreína actúa sobre el HMWK, generando bradiquinina. Este sistema sencillo es suficiente para inducir una reacción inflamatoria: tanto el HF activado como la bradiquinina son mediadores vasoactivos, que actúan sobre el endotelio vascular incrementando su permeabilidad y facilitando, por tanto, la extravasación de macromoléculas y, consiguientemente, de plasma; por su parte, la kalikreína actúa también sobre un componente del sistema del complemento, denominado C5, generando el fragmento C5a, que es quimiotácticamente atractivo para los leucocitos polimorfonucleares neutrófilos. 2.2.2. Sistema del complemento: vías de activación El complemento es un conjunto de una veintena de proteínas plasmáticas, 14 de las cuales se activan según varias secuencias que confluyen en una vía final común, generando mediadores de inflamación y un complejo capaz de destruir membranas biológicas, denominado complejo de ataque a membrana o MAC (Membrane Attack Complex); las demás son inhibidores que regulan el proceso de activación, lo cual reviste gran importancia, dado el potencial agresivo de este sistema para los propios tejidos (Tabla 1). El complemento pertenece a la inmunidad no específica, pero una de sus posibles secuencias de activación, denominada vía clásica, suele iniciarse en presencia de inmunocomplejos (complejos formados por antígenos unidos a sus anticuerpos específicos), lo que supone la existencia previa de una respuesta de inmunidad específica; adicionalmente, la vía clásica también puede iniciarse en ausencia de inmunidad específica, por acción de una proteína de reconocimiento, denominada proteína C reactiva o CRP (C Reactive Protein). Las otras vías de activación (alternativa y de lectinas) operan en ausencia de inmunidad específica. En la vía alternativa intervienen, secuencialmente, los factores C3, B, D y P (Figura 1). Esta vía se activa espontáneamente, porque C3 tiene un enlace interno lábil, que al romperse genera C3i, la cual captura al factor B. Cuando este factor está formando el complejo bimolecular C3iB, se vuelve susceptible a la hidrólisis catalizada por el factor D, rompiéndose en dos fragmentos, Ba (que se pierde) y Bb. El complejo C3iBb tiene la capacidad de catalizar la rotura de C3 en C3a y C3b, por lo que se le denomina convertasa de C3. Parte del C3b generado se comporta como C3i, capturando más factor B para, finalmente, originar más convertasa de C3; pero C3b también puede unirse a esta convertasa, formando el complejo trimolecular C3bBb3b, que, a su vez, es una convertasa de C5, puesto que cataliza la rotura de este componente en C5a y C5b, con lo que se entra en la vía efectora común. Varios de los fragmentos generados tienen actividades biológicas relacionadas con la inflamación, como se verá en el apartado 2.2.3. El papel del factor P (properdina) es estabilizar las convertasas generadas por esta vía. Es obvio que la activación espontánea de la vía alternativa debe estar bajo control, para evitar la inducción inmotivada de inflamación, con el consiguiente daño tisular. En efecto, apenas se ha formado, la convertasa C3bBb es escindida, por la proteína plasmática H, en sus dos componentes; H actúa como cofactor para que el factor I inactive a C3b. Si 1197 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... Tabla 1. SISTEMA DEL COMPLEMENTO Componente C1q C1r C1s C2 C3 C4 C5 C6 C7 C8 C9 B D P (properdina) C1-INH C4bp H I S Carboxipeptidasa Función - Reconocimiento, vía clásica - Activación, vía clásica - Activación, vía clásica - Activación, vía clásica, y generación de C2a (forma parte de convertasas de C3 y C5) - Activación, vías clásica y alternativa, y generación de C3a (anafilotoxina, agregación de plaquetas) y C3b (opsonina y parte de convertasas de C3 y C5) - Activación, vía clásica, y generación de C4a (anafilotoxina) y C4b (forma parte de convertasas de C3 y C5) - Vía efectora común y generación de C5a (anafilotoxina, atracción quimiotáctica de neutrófilos) y C5b (parte del MAC) - Vía efectora común (parte del MAC) - Vía efectora común (parte del MAC) - Vía efectora común (parte del MAC) - Vía efectora común (parte del MAC) - Activación, vía alternativa, y generación de Bb (forma parte de una convertasa de C3) - Activación, vía alternativa - Estabilización de C3bBb (convertasa de C3) - Inhibición de C1 - Cofactor en la inactivación de C4b por el factor I - Cofactor en la inactivación de C3b por el factor I - Inactivador de C4b y C3b - Inactivador del MAC (C5b6789) - Inhibición de las anafilotoxinas C3a, C4a y C5a Sólo se incluyen proteínas plasmáticas. Otras proteínas presentes en la membrana celular, como la CD46 (MCP, Membrane Cofactor Protein) y CD55 (DAF, Decay Accelerating Factor), actúan de cofactores en la inactivación de C3b y C4b por el factor I en la superficie de las células del organismo. Tampoco se han incluido la proteína C reactiva (CRP) ni la proteína de unión a manosa (MBP), que son proteínas de reconocimiento capaces de iniciar la activación del complemento por las vías clásica y de lectinas, respectivamente. C3bBb llega a depositarse en la superficie de células del organismo, hay en la membrana citoplásmica moléculas, como DAF (Decay Accelerating Factor) y MCP (Membrane Cofactor Protein), que, asimismo, escinden el complejo y facilitan la inactivación de C3b por I. Pero diversas estructuras, frecuentes en la superficie de los microorganismos, tienen la capacidad de unir la convertasa C3bBb protegiéndola de su inactivación por el factor I; por ello, se denominan superficies activantes, ya que sobre ellas tiene lugar la activación de la vía alternativa (Figura 1). Por tanto, las superficies activantes se comportan como PAMP y el complejo C3bBb actúa como un PRR soluble; en consecuencia, la vía alternativa del complemento tiene capacidad para discriminar entre superficies propias (que la inactivan) y superficies microbianas (sobre las que se activa, generando 1198 mediadores de inflamación y conectando con la vía efectora común). La secuencia de activación de la vía clásica es C1, C4, C2 y C3 (Figura 2). C1 es un complejo constituido por una molécula de C1q, dos de C1r y dos de C1s. La proteína de reconocimiento es C1q, que se activa en presencia de determinados inmunocomplejos, pero también, en ausencia de inmunidad específica, por acción de CRP. Ésta es una proteína de fase aguda, esto es, la producen los hepatocitos en el curso de reacciones inflamatorias (ver apartado 2.4.4). CRP es un PRR soluble que se une a fosfatidilcolina, presente en la pared celular de numerosos microorganismos (bacterias, levaduras), lo que dispara la activación de C1q, que a su vez activa a C1r y éste a C1s. C1s activado cataliza la rotura de C4 en C4a y C4b. C4b tiene tendencia a depositarse en A. Ruiz-Bravo López | M.ª Jiménez Valera C4b2a es una convertasa de C3, que cataliza la conversión de C3 en C3a y C3b. C3b también se deposita en superficies celulares. Parte del C3b formado originará el complejo trimolecular C4b2a3b, que es la convertasa de C5 de la vía clásica. A partir de aquí, se entra en la vía efectora común. Es importante reseñar que la vía clásica conecta con la alternativa, ya que el C3b generado por acción de la convertasa de C3 de la vía clásica puede atrapar al factor B, formando C3bB; esto propicia la acción catalítica del factor D, generando C3bBb, Figura 1. Vía alternativa de activación del complemento. lo que significa que, en el paso siguiente, se producirá también C3bBb3b; por tanto, estas dos convertasas de C3 y C5 aparecen en el curso de la activación por cualquiera de ambas vías. En la vía de activación por lectinas (Figura 2), el reconocimiento corre a cargo de la proteína de unión a manosa o MBP (Mannose Binding Protein); esta proteína es una lectina (las lectinas son glicoproteínas que reconocen glúcidos), por lo que también se la conoce como MBL (Mannose Binding Lectin). MBL es un PRR que reconoce azúcares terminales no reductores, como manosa, N-acetilFigura 2. Activación del complemento por las vías clásica y de lectinas (la barra horizontal glucosamina y fucosa, fresobre C1qrs denota activación). MASP: MBL-Associated Serine Proteases. cuentes en el glicocálix de microorganismos. MBL tiene superficies celulares, formando enlaces con grupos semejanzas estructurales con C1q, y, cuando se une amino e hidroxilo presentes en ellas, y, desde allí, a superficies microbianas, se asocia con unas serinatrapa a C2. En estas condiciones, C1s rompe C2, proteasas denominadas MASP (MBL-Associated generando C2a, que permanece unido a C4b en la Serine Proteases) que cumplen funciones similares superficie celular, y C2b. El complejo bimolecular a las de C1r y C1s, iniciando la activación a nivel de 1199 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... del complemento es un proceso potencialmente autoagresivo, pero el daño tisular se limita por la existencia de los factores inhibidores reseñados en la Tabla 1. Como se ha indicado antes, varios de los fragmentos que aparecen en el curso de estas vías tienen actividades biológicas. C3a, C4a y C5a son anafilotoxinas (Figura 4). Este término define la propiedad de estas moléculas de unirse a receptores presentes en la superficie de unas células denominadas mastocitos, Figura 3. Vía efectora común del complemento y citólisis por inserción del MAC (complejo presentes en los epitelios de Cib6789) en la membrana citoplasmatica. la superficie corporal (piel y mucosas). El citoplasma de C4 y C2, para seguir a partir de ahí la secuencia que los mastocitos es rico en gránulos que contienen se acaba de ver para la vía clásica. aminas vasoactivas (en la especie humana, histamina). Cuando las anafilotoxinas se unen a sus receptores, se genera una señal de activación celular, en 2.2.3. Sistema del complemento: respuesta a la cual ocurren varios acontecimientos: vía efectora común y actividades los gránulos migran hacia la membrana citoplásbiológicas de los fragmentos mica, se fusionan con ella y vierten al exterior la generados durante la activación histamina que contienen; además, la célula pone en marcha dos vías metabólicas que parten del ácido La vía efectora común (Figura 3) arranca de araquidónico, la vía de la lipooxigenasa, que genera la rotura de C5 en C5a y C5b, catalizada por cualleucotrienos, y la de la ciclooxigenasa, que produce quiera de las dos convertasas de C5 (C4b2a3b o prostaglandinas. Al igual que la histamina, los leucoC3bBb3b). C5b se deposita en superficies celulares, trienos y prostaglandinas son mediadores de inflay, a continuación, se depositan secuencialmente los mación, que incrementan la permeabilidad vascular restantes componentes, C6, C7, C8 y C9. El compledeterminando extravasación de plasma, además de jo C5b6789, conocido con las siglas MAC ya mentener otros variados efectos biológicos. cionadas, tiene la propiedad de insertarse a través Además de ser anafilotoxinas, C3a y C5a caude bicapas lipídicas, formando un poro funcional. san agregación plaquetaria, y C5a tiene una fuerte Por tanto, cuando se fije en membranas biológicas, actividad quimiotáctica sobre los neutrófilos y, en como la membrana citoplásmica o la membrana menor medida, sobre los monocitos. C2b es conexterna de la pared celular de bacterias Gram-nevertida por una proteína plasmática (la plasmina) gativas, destruye la barrera de permeabilidad, lo que en C2b-quinina, que actúa directamente sobre el tiene como consecuencia la lisis de la célula afectada. endotelio vascular, causando contracción de las Además de bacterias y virus con envoltura, las procélulas endoteliales y extravasación de plasma. pias células del tejido donde ocurre la activación del De las fracciones que se unen a las superficies complemento pueden ser destruidas por el MAC. activantes (superficies microbianas), C3b tiene esEsto es beneficioso en el caso de células infectadas pecial interés. Diversos tipos de leucocitos tienen por patógenos intracelulares (como los virus), pero receptores para C3b o para sus derivados inactitambién pueden lisarse células sanas: la activación vados. Estos receptores se conocen con las siglas 1200 A. Ruiz-Bravo López | M.ª Jiménez Valera • CR3, o CD11b/CD18, y CR4 o CD11c/CD18, presentes en los fagocitos, son receptores para iC3b (un producto de inactivación de C3b), e intervienen también en la opsonización. Resumiendo, en cuanto a las actividades biológicas derivadas de la activación del complemento, hay que destacar la inducción de los dos componentes esenciales de la reacción inflamatoria, que son la extravasación de plasma y la infiltración del tejido inflamado por leucocitos atraídos quimiotácticamente; la lisis de céFigura 4. Activación y desgranulación de mastocitos por la acción de las anafilotoxinas lulas infectadas o alteradas y C3a, C4a y C5a. de ciertas bacterias y virus, y la facilitación de la elimiCR (Complement Receptor) seguidas de un número, nación de partículas extrañas, microorganismos y pero también tienen otra nomenclatura, dentro del restos celulares mediante opsonización. sistema CD (Clusters of Differentiation) que se utiliza para designar un gran número de proteínas de la superficie leucocitaria, cuya presencia permite 2.3. Reconocimiento diferenciar unos leucocitos de otros. A continuade estructuras ción se examinarán las funciones de los principales microbianas inespecíficas receptores para C3b y sus derivados: por receptores celulares • CR1, o CD35, es un receptor de C3b presente en fagocitos (neutrófilos y monocitos/macrófagos); Diversos linajes celulares que participan en los microorganismos y otras partículas recubiertas procesos de inflamación y fagocitosis poseen PRR de C3b se unen fácilmente a la superficie de los en su superficie. La unión de PAMP a PRR genera fagocitos, por la afinidad entre C3b y CR1, y esto faseñales de activación celular, que se traducen en cilita su posterior ingestión por fagocitosis. Esta facidiversos efectos, entre otros la síntesis y secreción litación de la fagocitosis se denomina opsonización; de citokinas. Las citokinas son proteínas que actúan C3b es, por tanto, una opsonina inespecífica. Tamcomo moléculas de comunicación entre células. La bién los hematíes poseen CR1, lo que les permite mayor parte de las citokinas producidas por leucounir inmunocomplejos solubles que hayan activado citos se denominan interleukinas y se representan el complemento y en los que se haya fijado C3b; al por las siglas IL seguidas de un número, pero otras, circular por los vasos de órganos como el bazo o como los interferones (IFN) o lo factores estimuel hígado, que poseen sus propias células fagocíticas, ladores de colonias (CSF), conservan denominacioestos inmunocomplejos son endocitados, lo que nes peculiares (ver Capítulo 1.4). constituye un mecanismo de depuración (eliminaLos macrófagos son células especialmente ricas ción de inmunocomplejos) de la sangre. en PRR. Uno de éstos es el receptor para manosa o • CR2, o CD21, es receptor para productos de MMR (Macrophage Mannose Receptor), actualmendegradación de C3b (como C3d) y se encuentra te designado como CD206, que se une a ligandos en la superficie de los linfocitos B, estando implicacon manosa comunes en la superficie de bacterias do en su activación (ver apartado 3.4.1). Gram-positivas y Gram-negativas y de hongos pató- 1201 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... genos. Se supone que el MMR facilita la fagocitosis de estos microorganismos (ver apartado 2.4.3). Especial interés reviste una familia de PRR conocida como receptores tipo Toll o TLR (Toll-Like Receptors), por su homología y relaciones filogenéticas con la proteína Toll de la mosca del vinagre (Drosophila). Esta proteína es necesaria en la embriogénesis de Drosophila y, además, juega un papel en la resistencia de las moscas frente a infecciones bacterianas y fúngicas. Hasta el presente, se ha descrito una decena de TLR en mamíferos (de TLR1 a TLR10). Uno de los mejor conocidos es TLR4, presente en macrófagos, e implicado en el reconocimiento del LPS de bacterias Gram-negativas. Este proceso es importante porque es una causa común de reacción inflamatoria en infecciones por este tipo de bacterias, y, en casos de septicemia, sería uno de los mecanismos responsables del choque séptico (un estado de inflamación generalizada), cuyo desenlace puede ser fatal. El proceso de reconocimiento de LPS (Figura 5) se inicia cuando algunas de estas moléculas, desprendidas de la superficie bacteriana, se unen a una proteína plasmática denominada LBP (LPS Binding Protein). El complejo LBP-LPS es reconocido por un receptor de la superficie del macrófago, denominado CD14. Finalmente, el complejo LBP-LPS-CD14 interacciona con TLR4, lo que dispara la correspondiente señal de activación celular. Los macrófagos estimulados a través de LTR4 producen diversas citokinas proinflamatorias, radicales oxidantes derivados del óxido nítrico y péptidos antimicrobianos. 2.4. Inflamación y fagocitosis 2.4.1. Reacción inflamatoria Se ha visto que la presencia de estructuras extrañas en los tejidos pone en marcha mecanismos de reconocimiento, humorales (quininas, complemento) o celulares (células portadoras de PRR) que inician una reacción inflamatoria. La función defensiva de la inflamación consiste en focalizar elementos defensivos en el tejido donde ha aparecido un agente extraño, potencialmente peligroso para el organismo. Los elementos defensivos son moléculas y células que proceden del compartimento vascular, y que son capaces de matar y eliminar microorganismos. Los signos aparentes de 1202 la inflamación son consecuencia de las alteraciones vasculares que propician la extravasación de plasma y la salida de leucocitos, y clásicamente se han descrito como tumor (la hinchazón o edema debido al plasma extravasado), rubor (enrojecimiento por la vasodilatación y el incremento de flujo sanguíneo en el tejido inflamado), calor (incremento local de temperatura, por las mismas causas) y dolor (consecuencia de la excitación de terminaciones nerviosas por la presión causada por el edema y por la liberación de mediadores químicos). Adicionalmente a la infección, otras causas pueden iniciar un proceso inflamatorio: un trauma, la muerte de células por necrosis (por el contrario, la apoptosis no induce inflamación, lo que concuerda con su carácter de proceso fisiológico), y, también, respuestas de inmunidad específica que utilizan la inducción de inflamación como mecanismo efector (p. ej., la activación de la vía clásica del complemento como consecuencia de la formación de inmunocomplejos). Pero la acumulación de células defensivas, esto es, con un potencial agresivo, capaces de secretar radicales oxidantes, y la formación del MAC como consecuencia de la activación del complemento por cualquiera de las vías, causa también daño a las células del propio tejido. Es importante tener presente que las reacciones inflamatorias, además de su aspecto defensivo, tienen también una contrapartida negativa, ya que inevitablemente causan daño tisular. Se puede considerar que, en muchas ocasiones, merece la pena pagar este precio con tal de frenar un proceso infeccioso, pero, en otras ocasiones, las consecuencias de la inflamación superan la amenaza de la infección por un patógeno de escasa virulencia, y, con alguna frecuencia, tales consecuencias forman parte, a veces principal, de la patología infecciosa. 2.4.2. Inflamación aguda La reacción inflamatoria sigue una secuencia que se inicia con vasodilatación, seguida de extravasación de plasma e infiltración del tejido con células inflamatorias. La dilatación de los capilares y arteriolas responsables de la microcirculación del tejido inflamado se debe principalmente a la acción de mediadores liberados por los mastocitos: la histamina es responsable de la vasodilatación precoz, mientras que A. Ruiz-Bravo López | M.ª Jiménez Valera Figura 5. Estimulación de macrófagos por LPS. las prostaglandinas ejercen un efecto vasodilatador más prolongado. Las anafilotoxinas C3a y C5a, además de desencadenar la desgranulación de los mastocitos, también pueden causar vasodilatación, así como la bradiquinina. El incremento de la permeabilidad vascular es consecuencia de la contracción de las células endoteliales, inducida por mediadores de mastocitos (histamina, prostaglandinas, leucotrienos), por la bradiquinina y por algunas citokinas (como el factor linfocitario de permeabilidad). La infiltración del tejido por leucocitos inflamatorios requiere la producción de mediadores quimioatrayentes en el foco de inflamación y un intercambio de información entre las células endoteliales y los leucocitos circulantes. En la inflamación aguda debida a mecanismos de la inmunidad innata, las primeras células en llegar al foco inflamatorio son los neutrófilos, a los que siguen los leucocitos mononucleares (macrófagos y linfocitos), que llegan a ser dominantes en el caso de que la inflamación se cronifique. Diversas moléculas actúan como mediadores quimiotácticamente atractivos para leucocitos: los mediadores exógenos son de origen microbiano, como el LPS o los oligopéptidos iniciados con N-formil-metionina que las bacterias excretan como subproductos de la síntesis de proteínas; los endógenos pueden ser fragmentos procedentes de la activación de kininas o del complemento (es el caso de la kalikreína y de C5a, respectivamente), o mediadores producidos por mastocitos (leucotrieno B4), por células endoteliales o por las propias células inflamatorias (citokinas denominadas quimiokinas). Los mediadores quimioatrayentes y algunas otras moléculas liberadas en el foco inflamatorio (histamina, citokinas proinflamatorias) actúan sobre las células endoteliales, activándolas. En respuesta, estas células sintetizan nuevas moléculas de superficie, como la selectina P. Cuando los neutrófilos circulantes pasan por un vaso cuyo endotelio se ha activado y expresa esta selectina, se pegan a las paredes del vaso, ya que en la superficie de los neutrófilos existe una L-selectina que es el ligando de la P-selectina endotelial. La interacción entre ambas selectinas no inmoviliza al neutrófilo; éste se desplaza rodando sobre la superficie endotelial, pero sin separarse de ella. En estas condiciones, el neutrófilo experimenta a su vez el estímulo de los mediadores quimiotácticos acumulados en las células endoteliales o, incluso, producidos por ellas, y responde incrementando la expresión de β2-integrinas (los complejos CD11a/ CD18 y CD11b/CD18), que interaccionan con otras moléculas de adhesión (ICAM-1 e ICAM-2) de la superficie endotelial activada. El resultado de esta multiplicidad de interacciones fuertes entre ambas superficies celulares es que el neutrófilo “rodante” se detiene, estableciendo uniones adicionales (entre sus β2-integrinas y la E-selectina del endotelio activado) que refuerzan su adhesión a la pared vascular. Finalmente, el neutrófilo se abre paso entre dos células endoteliales contiguas (diapédesis) y abandona el compartimento vascular, 1203 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... citado. A continuación, se examinan dichas etapas: La unión de microorganismos a la superficie de los fagocitos puede ocurrir directamente, a través de la unión de receptores celulares (PRR) a sus correspondientes ligandos microbianos (PAMP). Sólo algunos PRR, de los diversos que pueden encontrarse en la superficie de los fagocitos, participan en la fagocitosis: entre los mejor conocidos, se puede citar el receptor de manosa (CD206), ya mencionado; el CD14 (receptor de LPS), y la dectina-1, Figura 6. Infiltración del tejido inflamado por neutrófilos atraídos por mediadores receptor de β-glicanos quimiotácticos. presentes en la superficie de levaduras. pasando al tejido en el cual se moverá a favor del Otros receptores de fagocitosis actúan indirecgradiente de concentración de mediadores quitamente, uniendo proteínas plasmáticas que se han miotácticos, que le conducirá al foco inflamatorio. depositado en la superficie microbiana (opsonizaEl proceso se ilustra en la Figura 6. ción). Entre las opsoninas inespecíficas, figuran la fibronectina y vitronectina; las partículas recubiertas por ellas se unen a diversas integrinas de la super2.4.3. Fagocitosis ficie del fagocito, como son CD49d/CD29 (integrina α4β1), CD49e/CD29 (α5β1) o CD51/CD61 Las primeras células que llegan al foco inflamato(αVβ3). También C3b, procedente de la activación rio, los neutrófilos, están especializadas en eliminar del complemento, y su derivado inactivo iC3b, son partículas extrañas mediante fagocitosis. Asimisopsoninas inespecíficas: las partículas recubiertas mo, entre las células mononucleares que infiltran de C3b se unen a CR1; y recubiertas de iC3b, lo posteriormente el tejido, figuran los macrófagos, hacen a CR3 y CR4. que proceden por maduración de los monocitos Los anticuerpos de las clases IgG e IgA (ver aparcirculantes, y que son también especialistas en tado 3.2.2) pueden actuar como opsoninas específifagocitosis. cas: estas moléculas se unen, por su parte específica, La fagocitosis es un proceso de endocitosis o a los antígenos presentes en la superficie de microingestión de partículas en el que se distinguen varias organismos, y por la parte inespecífica (denominada fases (Figura 7): unión de la partícula a la membraFc), a receptores en la superficie de los fagocitos na del fagocito; ingestión de la partícula por engolfa(receptores para Fc o FcR). Se conocen varios tipos miento, para formar la vacuola fagocítica o fagosoma; de FcR, tres de ellos para IgG, denominados FcγRI activación de mecanismos microbicidas y fusión de la o CD64, FcγRIIA o CD32 y FcγRIII o CD 16; y uno membrana del fagosoma con las membranas de los para IgA, el FcαRI o CD89. Ésta es una importante gránulos lisosomiales (presentes en el citoplasma del conexión entre ambos tipos de inmunidad: la eficafagocito), para formar el fagolisosoma o fagosoma secia de la fagocitosis, que es un mecanismo de inmucundario o maduro; y degradación del material fagonidad innata, se ve notablemente incrementada por 1204 A. Ruiz-Bravo López | M.ª Jiménez Valera Figura 7. Fagocitosis. la participación de los anticuerpos, producidos en una respuesta inmune específica. El internamiento de la partícula para formar el fagosoma es un proceso complejo, que implica a un gran número de moléculas (proteínas que unen actina, canales de iones, kinasas y lipasas). La partícula a fagocitar se rodea de extensiones citoplásmicas (pseudópodos) que finalmente se fusionan formando una vacuola fagocítica. La naturaleza de los receptores de fagocitosis implicados en el proceso tiene influencia en el mecanismo de internamiento; por ejemplo, en la fagocitosis a través de FcγR participan tirosina kinasas, pero en la mediada por CR no, aunque en este último caso se requieren estímulos adicionales (citokinas proinflamatorias o unión del fagocito a la matriz extracelular). Los mecanismos microbicidas intracelulares pueden agruparse en dependientes de oxígeno e independientes de oxígeno. Los mecanismos dependientes de oxígeno se generan a partir de un drástico incremento en el ritmo respiratorio del fagocito e implican la activación de la enzima NADPH oxidasa, cuyas subunidades, normalmente distribuidas entre la membrana y el citosol, se ensamblan en la membrana del fagosoma. La activación de la NADPH oxidasa no ocurre siempre, sino que depende de los receptores implicados en la fagocitosis; la mayoría de los FcR, que poseen secuencias intracitoplásmicas capaces de activar tirosina kinasas (ITAM: Im- munoreceptor Tyrosine-based Activation Motifs), inducen la activación de la enzima; pero los CR no, al menos en los macrófagos. La NADPH oxidasa cataliza la formación de anión superóxido (O2-), que pasa al interior del fagosoma, donde genera oxidantes microbicidas como el peróxido de hidrógeno, el oxígeno singlete y, en los neutrófilos (que poseen mieloperoxidasa), ácido hipocloroso. Otro mecanismo microbicida conectado con el incremento respiratorio es la producción de radicales de nitrógeno reactivo. La enzima clave es una sintetasa inducible de óxido nítrico (iNOS: inducible Nitric Oxide Synthase). Esta enzima es inducida por ciertos PAMP a través de TLR; citokinas como el factor necrosante de tumores o TNF (Tumor Necrosis Factor), IL-1 e interferón gamma (IFN-γ) ejercen acciones sinérgicas con los estímulos inductores de iNOS. El óxido nítrico generado reacciona con el anión superóxido para formar peroxinitrito, con potente acción microbicida. Los gránulos lisosomiales del citoplasma de los fagocitos contienen moléculas microbicidas independientes del oxígeno. La lisozima es una muramidasa, que destruye la mureína de la pared celular bacteriana. Las defensinas constituyen una familia de péptidos catiónicos que tienen en común una secuencia de seis cisteínas con tres puentes disulfuro. Las defensinas están presentes en los gránulos azurófilos de neutrófilos y, en menor extensión, en los de macrófagos, y la fusión lisosomial los vierte en el fagolisosoma. Su acción microbicida, de amplio espectro (hongos, bacterias Gram-positivas y Gram-negativas, virus con envoltura) se basa en su capacidad para insertarse en bicapas lipídicas, permeabilizándolas. Las catelicidinas son precursores de péptidos antimicrobianos, que contienen un dominio N-terminal conservado, de un centenar de aminoácidos, denominado catelina, y una parte Cterminal de tamaño variable (entre 12 y 80 aminoácidos). Se encuentran en los neutrófilos, en gránulos no azurófilos que secretan su contenido al medio 1205 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... que incrementa la expresión de β2-integrinas por los neutrófilos, favoreciendo su adhesión al endotelio y, una vez que han salido del vaso, los atraen hacia el foco inflamatorio (Figura 8). Otras numerosas quimiokinas producidas por macrófagos, fibroblastos, células endoteliales, etc., son quimioatrayentes para neutrófilos, macrófagos y linfocitos T (ver Capítulo 1.4). Citokinas leucopoyéticas. La salida de leucocitos (neutrófilos y macrófagos) del compartimento vascular para acudir al foco inflamatorio hace descender los niveles de leucocitos circulantes. Adicionalmente, muchos de los leucocitos Figura 8. Efectos sistémicos de las citokinas proinflamatorias. GM-CSF: Granuinflamatorios mueren en el tejido locyte Macrophage-Colony Stimulating Factor. inflamado, por la acción de toxinas (desgranulación). La mayoría de las catelicidinas microbianas. Se hace por tanto necesario reponer experimentan una rotura proteolítica cuando son estas células, que (como todas las células hemátisecretadas, liberando el péptido antimicrobiano. En cas) se originan en la médula ósea hemopoyética. el fagolisosoma también se liberan otras proteínas Los macrófagos inflamatorios producen una citokiantimicrobianas, como BPI (Bactericidal Permeabilina denominada factor estimulador de colonias de ty-Inducing Protein), hidrolasas ácidas, etc. granulocitos y macrófagos (GM-CSF: Granulocyte Adicionalmente a los mecanismos reseñados, el Macrophage-Colony Stimulating Factor). Esta citopH ácido de los fagosomas y la ausencia de hierro kina pasa a sangre y al llegar a la médula hemocontribuyen asimismo a la muerte de muchos de poyética actúa sobre células madre, progenitoras los microorganismos fagocitados. del linaje mieloide/monocitoide, promoviendo su proliferación y diferenciación en granulocitos (neutrófilos) y monocitos (precursores de macrófagos), 2.4.4. Citokinas proinflamatorias que abandonarán la médula y pasarán a reemplazar y efectos sistémicos los contingentes perdidos del compartimento vasde la inflamación aguda cular (Figura 8). Pirógenos endógenos e inductores de fase aguda: Los fagocitos que infiltran un tejido inflamado son Tres monokinas proinflamatorias comparten estos capaces de producir citokinas que contribuyan a los efectos sistémicos: TNF, IL-1 e IL-6 (Figura 8). mecanismos defensivos frente a la infección. EspeLa temperatura corporal está controlada por una cialmente, los macrófagos son células muy versátiles jerarquía de estructuras neuronales, cuyo centro que, en respuesta a estímulos procedentes del recode coordinación se ubica en la región preóptica del nocimiento de PAMP, producen un considerable núhipotálamo. La fiebre es una elevación reversible de mero de citokinas (denominadas monokinas, por ser la temperatura corporal por encima del margen producidas por células del linaje de los monocitos), superior establecido por la homeostasis. Estas tres algunas de las cuales se consideran a continuación. citokinas inducen la síntesis de prostaglandinas, que Mediadores quimiotácticos: como se indicó en el parecen ser los mediadores finales de la neuroesapartado 2.4.2, algunas citokinas tienen la capacidad timulación hipotalámica que fija la regulación de la de atraer quimiotácticamente a los leucocitos intemperatura a un nivel superior. Aunque se suele flamatorios, por lo que se denominan quimiokinas. considerar como un síntoma molesto, la fiebre es Los macrófagos producen quimiokinas, como IL-8, un mecanismo defensivo, conservado filogenética- 1206 A. Ruiz-Bravo López | M.ª Jiménez Valera mente; incrementa la reactividad del sistema inmune y, al elevar la temperatura (aunque sea muy pocos grados) por encima de la óptima para los microorganismos patógenos, se ralentiza su proliferación. La inducción de fiebre por TNF, IL-1 e IL-6 se acompaña de otros efectos sistémicos: somnolencia, taquicardia, incremento del catabolismo, ferropenia y un notable incremento de la síntesis, en el hígado, de las llamadas “proteínas de fase aguda”. La presencia, en el plasma, de niveles elevados de estas proteínas es un indicador de inflamación de gran valor clínico. Entre las proteínas de fase aguda destacan las ya mencionadas CRP y MBP (ver apartado 2.2.2), que se unen a PAMP de la pared microbiana, activando, respectivamente, las vías clásica y de lectinas del complemento; la ceruloplasmina, que detoxifica de radicales oxidantes el tejido inflamado; el inhibidor de proteinasa α-1, o antitripsina, que inhibe la actividad de las proteasas liberadas por los neutrófilos, limitando el daño tisular que pueden causar; y otras proteínas plasmáticas, como el amiloide sérico A o SAA (Serum Amyloid A) y la α2-macroglobulina. Además de sus efectos sistémicos, las citokinas proinflamatorias tienen actividades propias. TNF puede, en determinadas condiciones, inducir apoptosis (su nombre lo debe a su citotoxicidad para algunos tumores experimentales); en las células endoteliales, incrementa la expresión de ICAM-1, facilitando la adhesión de neutrófilos y su posterior diapédesis, y favorece la coagulación (reacción trombogénica). IL-1 también actúa sobre el endotelio vascular induciendo una reacción inflamatoria; además, es un coestimulador de la proliferación de células T en respuesta a mitógenos y promueve la maduración de los linfocitos B (en parte, de forma indirecta porque induce la síntesis de IL-6); IL-6 favorece la diferenciación de las células B activadas a células secretoras de inmunoglobulinas (ver Capítulo 1.4). 2.4.5. Inflamación crónica Cuando el agente extraño cuya presencia en el medio interno ha desencadenado la reacción inflamatoria, persiste durante algún tiempo (p. ej., bacterias resistentes a la fagocitosis, o sustancias difícilmente biodegradables), la infiltración de células inflamatorias se prolonga en el tiempo y se pasa a una situación de inflamación crónica. En la inflamación crónica, los neutrófilos (que son las células predominantes en la fase aguda) son progresivamente reemplazados por células mononucleares (macrófagos y linfocitos). La persistencia del material difícil de degradar ocasiona la formación de granulomas, definidos como focos de linfocitos, macrófagos, células epitelioides, células gigantes y fibroblastos, rodeados por varias capas de tejido conectivo. Las células epitelioides, parecidas a queratinocitos, son realmente macrófagos con inclusiones de material fagocitado, no digerido, cuyo aspecto se asemeja al de la queratina. Las células gigantes son el resultado de la fusión de macrófagos o de células epitelioides, dando lugar a sincitios. 2.5. Citotoxicidad natural En la sangre y en el tejido linfoide se encuentra una población de células que, por su morfología, se denominan linfocitos grandes granulares (LGL, de Large Granular Lymphocytes). Estas células son capaces de inducir la muerte de células infectadas por virus y de algunas células tumorales. Dado que no hay reconocimiento previo de antígenos específicos en las células diana (las células que son destruidas), se trata de un mecanismo de inmunidad innata, por lo que se le conoce como citotoxicidad natural, y a los LGL efectores se les denomina células matadoras naturales o NK (Natural Killer). Las células NK poseen una gran diversidad de receptores de superficie, de los cuales unos están implicados en la activación y otros en inhibir la actividad citotóxica (Figura 9). Entre los activadores figuran NKp30, NKp44 y NKp46, que reconocen moléculas en la superficie de células tumorales o infectadas por virus; pero también otros que se unen a la superficie de células normales. El paradigma de los receptores inhibidores es KIR (Killer-cell Immunoglobulin-like Receptor), también denominado CD158, que reconoce los antígenos de histocompatibilidad de clase I (ver apartado 3.2.5) presentes en todas las células normales del cuerpo. Por tanto, si una célula NK se une a una célula sana, el receptor KIR transmite una señal que bloquea la activación de la célula NK y la inducción de citotoxicidad. Pero en las células infectadas por virus frecuentemente se detiene la síntesis de proteínas celulares (en beneficio de la síntesis de proteínas víricas), por lo que no pueden reponer los antígenos de histocompatibilidad que se pierden de la superficie celular; al desaparecer los ligandos de KIR, éste no puede 1207 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... la cuales inducen mecanismos que bloquean la síntesis de proteínas virales. Los interferones no son específicos de virus, por lo que se clasifican dentro de la inmunidad innata. En cambio, se ven limitados por barreras de especie, de forma que los interferones de otras especies animales no son capaces de inducir refractariedad a la infección vírica en células humanas, y viceversa. En su forma abreviada, el interferón se representa por las Figura 9. Citotoxicidad mediada por células NK (Natural Killer). KIR: Killer-cell Immusiglas IFN. Recientemennoglobulin-like Receptor. MHC-I: Major Histocompatibility Complex-I. te, se han descrito dos citokinas, IL-28 e IL-29, transmitir señales inhibidoras, por lo que la célula con actividad antiviral, que parecen guardar alguna NK se activa y desencadena el mecanismo de citorelación con los IFN (ver Capítulo 1.4). toxicidad. También en algunas células tumorales los antígenos de histocompatibilidad están alterados o no se expresan, lo que explica la susceptibilidad a la 2.6.1.Tipos de interferones citotoxicidad mediada por NK. El mecanismo de citotoxicidad consiste en la seEn la especie humana se conocen dos tipos de creción de perforinas, que se polimerizan abriendo IFN, I y II. Los de tipo I son citokinas antivirales canales en la membrana citoplásmica de la célula diana, resistentes a pH ácido, que están codificadas por a través de los cuales penetran en ella proteasas denogenes ubicados en el cromosoma 9; mientras que minadas granzimas, que ponen en marcha el proceso el tipo II, codificado por un gen no relacionado con de muerte celular programada o apoptosis. los anteriores, localizado en el cromosoma 12, se Las células NK expresan CD16, que es un recepcaracteriza por su actividad inmunorreguladora y tor para la parte no específica de la IgG (FcγRIII); por inactivarse cuando desciende el pH. Cada tipo esto les permite unirse a células que expresen antíde IFN se une a un receptor diferente. genos reconocidos específicamente por IgG y maHay varios IFN de tipo I; los principales son IFN-α tarlas, fenómeno que se conoce como citotoxicidad (una proteína generalmente no glicosilada) e IFN-β mediada por células, dependiente de anticuerpos (una glicoproteína). IFN-α es producido por leucoci(ver apartado 3.4.3). tos, mientras que IFN-β predomina en la respuesta de fibroblastos y células de linajes no hemopoyéticos. El principal estímulo inductor de la producción de IFN 2.6. Interferones de tipo I es la infección viral, y, concretamente, la presencia de RNA bicatenario. Hay que tener presente Como la mayor parte de las citokinas, los interfeque en las células infectadas por virus con genoma rones son moléculas pleiotrópicas, pero se definen constituido por RNA monocatenario, la formación por su capacidad para bloquear la replicación viral. de los llamados “intermediarios de replicación” (RNA En respuesta a determinados estímulos, una célula de sentido complementario al genómico, necesarios produce moléculas de interferón que se unen a para actuar como moldes en la replicación) da lugar receptores en la superficie de células vecinas, en transitoriamente a complejos de RNA bicatenario; 1208 A. Ruiz-Bravo López | M.ª Jiménez Valera El primero de estos mecanismos se inicia con la síntesis de la enzima 2’-5’-oligoadenilato sintetasa o 2-5(A), en forma de proenzima, que alcanza su actividad enzimática en presencia de RNA bicatenario (por tanto, el mecanismo antiviral sólo será operativo en células infectadas por virus). 2-5(A) cataliza la polimerización de ATP para formar oligoadenilatos de distintas longitudes, que se unen a una enzima latente, la RNAsa L, dimerizándola. En estas condiciones, la RNAsa L degrada moléculas de mRNA, que en la célula Figura 10. Mecanismos antivirales inducidos por los interferones. PKR: proteína kinasa R; eIFinfectada serán el resul2: factor de iniciación de la traducción. tado de la trascripción de los genes virales. por su parte, en los virus con genoma DNA bicateEl segundo mecanismo se inicia con la síntesis de nario, la trascripción de genes contiguos en cadenas la serina-treonina proteína kinasa PKR. Como en el distintas, cuyas secuencias llegan a solaparse, genera mecanismo anterior, PKR se forma como proenzimoléculas de mRNA que pueden hibridar parcialma, que adquiere actividad en presencia de RNA mente, dando porciones bicatenarias. bicatenario. El sustrato de PKR es un factor necesaEl IFN de tipo II se denomina IFN-γ, y es una glicorio para la síntesis de proteínas denominado eIF-2 proteína producida por células NK activadas por IL(eukaryotic Translation Initiation Factor 2); la enzima 12, y por linfocitos T activados, ya sea específicamente fosforila este factor, que queda irreversiblemente por antígenos, ya inespecíficamente por mitógenos. inactivado. Adicionalmente, la activación de PKR puede inducir apoptosis en la célula infectada. Como se ve, ambos mecanismos convergen en 2.6.2. Mecanismos de acción antiviral un mismo resultado: la detención de la síntesis de proteínas en las células infectadas con virus. Pero La unión de IFN a sus receptores celulares induce los IFN también activan otros mecanismos antivila dimerización de éstos y la fosforilación de tirorales, como la síntesis de proteínas Mx, que inhiben sinas en sus dominios citoplásmicos, catalizada por la replicación del virus de la gripe y de miembros tirosina kinasas de la familia Janus (Jaks). El resultado de las familias Paramyxoviridae y Rhabdoviridae. final es la derrepresión de gran número de genes (más de 300), distintos para cada tipo de IFN, que incluyen los responsables de la acción antiviral. Los 2.6.3. Otras actividades dos mecanismos principales de acción antiviral de biológicas de los interferones los interferones son la inactivación de un factor de iniciación de síntesis proteica y la degradación de Los IFN ejercen diversas acciones en células no RNA mensajero (mRNA) en las células infectadas infectadas. En general, son inhibidores de la prolipor virus (Figura 10). feración celular, lo que ha dado lugar a su empleo 1209 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... como agentes antitumorales citostáticos (especialmente el IFN-α). También promueven la expresión de antígenos de histocompatibilidad (ver apartado 3.2.6). IFN-γ tiene un importante papel en la inmunidad celular, frente a patógenos intracelulares: induce la activación de macrófagos, un proceso que incrementa drásticamente la eficacia fagocítica y la capacidad microbicida de estas células. 3. Inmunidad específica 3.1. Antígenos 3.1.1. Conceptos de antígeno, epítopo y hapteno Antígeno es cualquier macromolécula capaz de inducir una respuesta inmune específica. Las células que responden son linfocitos, que poseen receptores de superficie capaces de reconocer específicamente determinadas estructuras moleculares, denominadas determinantes antigénicos o epítopos, de forma que la totalidad de los linfocitos de un mamífero asegura el reconocimiento de varios millones de especificidades distintas. Por tanto, la primera condición que una molécula debe poseer para ser antígeno es la posesión de epítopos. Pero, además, se requiere un cierto tamaño molecular y complejidad estructural. Una molécula pequeña, aunque posea uno o más epítopos, no es capaz de inducir una respuesta inmune, si bien será capaz de reaccionar con anticuerpos específicos para sus epítopos. Esto permite disociar dos propiedades de los antígenos: la inmunogenicidad (capacidad de inducir respuestas) y la especificidad (capacidad de reaccionar específicamente con anticuerpos). Las moléculas que, por su pequeño tamaño, carecen de inmunogenicidad, pero, por poseer epítopos, conservan especificidad, se denominan haptenos. Si un hapteno se conjuga con una proteína de suficiente tamaño (denominada portador o carrier), el conjunto se comporta como un antígeno y es capaz de inducir respuestas específicas frente al hapteno. De esta forma se pueden obtener anticuerpos específicos frente a moléculas pequeñas que, de por sí, carecen de inmunogenicidad. Los antígenos son, mayoritariamente, proteínas que reúnen las condiciones necesarias de tamaño, 1210 complejidad estructural y presencia de epítopos. Los polisacáridos ramificados también pueden ser buenos antígenos, mientras que los lípidos no destacan por sus propiedades antigénicas. 3.1.2. Inmunización, coadyuvantes y BRM El organismo entra en contacto con antígenos extraños por diversas vías. En el periodo prenatal, dentro del claustro materno, el feto se encuentra en un entorno protegido por la barrera placentaria, por lo que los contactos con antígenos extraños son mínimos, excepto en el caso de infección intrauterina por transmisión trasplacentaria de agentes patógenos. Desde el momento del parto, el organismo queda expuesto a una notable diversidad de estímulos antigénicos. Muchos componentes de la dieta son antígenos y, aunque la mayoría son hidrolizados durante la digestión, algunas macromoléculas poco o nada degradadas atraviesan la mucosa intestinal y pasan al medio interno. De hecho, las células M de dicha mucosa están especializadas en la traslocación de macromoléculas desde la luz intestinal hasta el medio interno, donde son endocitadas por macrófagos y presentadas a linfocitos. Pero, en términos generales, la introducción de antígenos por vía oral no es adecuada para obtener buenas respuestas, excepto en el caso de microorganismos patógenos, que inducen reacciones inflamatorias (la inflamación potencia las respuestas específicas), y que, muchas veces, se diseminan a través del organismo, alcanzando los ganglios linfáticos mesentéricos e incluso el bazo, a través de la circulación sanguínea. Los antígenos pueden ser introducidos por vía parenteral de forma natural (agentes patógenos vehiculizados por picaduras de artrópodos, o que penetran a través de heridas) o artificial (vacunas). En general, la eficacia de una inmunización depende de varios factores: unos propios del antígeno (tamaño, complejidad estructural, número y variedad de epítopos) y otros de la pauta de inmunización (dosis administrada, vía de administración, número de dosis e intervalo de tiempo entre ellas). Se conocen diversos agentes que, administrados junto con el antígeno o en intervalos de tiempo apropiados, potencian la respuesta inmune específica para dicho antígeno; a estos agentes se les denomina coadyu- A. Ruiz-Bravo López | M.ª Jiménez Valera Figura 11. Origen de los linfocitos B y T. vantes de la respuesta. Entre los coadyuvantes más conocidos figuran microorganismos o estructuras de origen microbiano, como el LPS o el muramil-dipéptido (derivado de la mureína). Los mecanismos de acción de los coadyuvantes son complejos, pero muchos tienen en común la capacidad de inducir reacciones inflamatorias. El término, más reciente, de “agentes modificadores de la respuesta biológica” o BRM (Biological Response Modifiers) se aplica a sustancias capaces de ejercer efectos no específicos sobre el sistema inmune, a través de la red de citokinas, lo que incluye la capacidad de potenciar o deprimir las respuestas específicas frente a distintos antígenos (inmunomodulación). 3.2. Linfocitos, sus receptores y otras moléculas de la superficie linfocitaria 3.2.1. Linfocitos B y T Como las otras células hemáticas, los linfocitos se originan en la médula ósea roja o hemopoyética, a partir de células madre pluripotenciales. Bajo la influencia de diversos factores hemopoyéticos, las células madres entran en sucesivas etapas de diferenciación. En las primeras etapas, se separan las células madre de las series eritroide y mieloide- monocitoide, por una parte, y de la serie linfoide, por otra. Las células progenitoras de la serie linfoide tienen dos caminos de diferenciación: el de las linfocitos B, que requiere el microambiente de la propia médula ósea, y el de las células T, que se inicia con la salida de células pre-T del compartimento medular para completar su desarrollo en el timo (Figura 11). Médula ósea y timo son órganos linfoides primarios, ya que de ellos adquieren la inmunocompetencia los linajes B y T, respectivamente. Por inmunocompetencia se entiende la capacidad para responder a los estímulos antigénicos, lo que requiere poseer receptores específicos para reconocer los correspondientes epítopos. Los receptores específicos para antígenos, presentes en los linfocitos (sean B o T), están codificados por genes que adquieren su configuración definitiva mediante procesos de reorganización que ocurren durante la diferenciación en los órganos linfoides primarios. Por tanto, durante la diferenciación se adquiere la especificidad. Cada linfocito maduro expresa receptores de una única especificidad. Como, durante la diferenciación y una vez que se ha seleccionado la especificidad, hay proliferación celular, el resultado es una familia de células que, por proceder de un ancestro común (una célula que completó la reorganización de genes para definir su especificidad), comparten receptores de la misma especificidad: esto es lo que se conoce como un clon de células. Los linfocitos, tanto B como T, están organizados en clones, cada uno de los cuales representa una especificidad. Los linfocitos B son responsables de la respuesta de anticuerpos. Las células T se agrupan en subpoblaciones: las células T cooperadoras o helper (Th) colaboran con las respuestas de otros linfocitos; las células T citotóxicas o CTL (Cytotoxic T Lymphocytes) funcionan como células citotóxicas específicas. 3.2.2. Inmunoglobulinas Los anticuerpos son glicoproteínas específicas que se encuentran en la superficie de los linfoci- 1211 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... Figura 12. Estructuras de las inmunoglobulinas. tos B (donde constituyen el receptor específico para antígenos), o aparecen en el plasma y otros humores orgánicos, como resultado de una respuesta inmune. La separación electroforética de las proteínas plasmáticas sitúa a los anticuerpos en la región de las γ-globulinas. Por su función como proteínas de la inmunidad específica, se les denomina también inmunoglobulinas (abreviadamente, Ig). Estructuralmente, una molécula de inmunoglobulina está formada por cuatro cadenas polipeptídicas, iguales dos a dos, y unidas entre sí por puentes disulfuro: las dos menores se denominan cadenas ligeras o L (Light), con una masa aproximada de 25 kDa (cerca de 220 aminoácidos), y las dos mayores, cadenas pesadas o H (Heavy), de unos 50 kDa (alrededor de 440 aminoácidos) (Figura 12). Esta unidad estructural, con un tamaño mínimo de 150 kDa, es bivalente (tiene dos sitios de unión al antígeno). De acuerdo con las secuencias de aminoácidos, cada cadena posee una parte aminoterminal variable (V) y una carboxiloterminal constante (C). En las cadenas L, el tamaño de VL es aproximadamente igual al de CL; en las H,VH viene a ser una cuarta parte de CH. La diversidad de aminoácidos por posición no es uniforme a lo largo de las partes V, sino que se con- 1212 centra en tres regiones llamadas hipervariables. Las regiones hipervariables son las que constituyen el sitio de unión al antígeno y en ellas reside, por tanto, la especificidad de la inmunoglobulina. Como la especificidad de unión implica una complementariedad tridimensional entre el epítopo y las regiones hipervariables, éstas se denominan también CDR (Complementarity-Determining Regions). La estructura terciaria de las cadenas L y H incluye unos plegamientos en forma de ovillo, cerrados por puentes disulfuro intracatenarios, que se denominan dominios (Figura 13). En una cadena L hay dos dominios, correspondientes a las partes VL y CL, respectivamente. En una cadena H hay un dominio VH y tres (en algunas clases, cuatro) dominios CH. Los dominios muestran semejanzas de secuencia entre sí, revelando que proceden de un gen ancestral que experimentó duplicaciones y diversificaciones durante la evolución. Junto con otras proteínas no inmunoglobulínicas, con dominios similares, las inmunoglobulinas constituyen una superfamilia de macromoléculas relacionadas filogenéticamente. El ser humano puede producir dos tipos distintos de cadenas L, que se diferencian por las secuencias de aminoácidos de las partes CL: estos tipos se denomina kappa (κ) y lambda (λ). En cuanto a las cadenas H, se pueden fabricar cinco clases distintas, con diferentes secuencias en las partes CH: se denominan gamma (γ), mu (μ), alfa (α), delta (δ) y épsilon (ε). En cada molécula de inmunoglobulina, las dos cadenas L son del mismo tipo, y las dos H de la misma clase, pero en cada individuo de la especie humana están representados los dos tipos y las cinco clases, por lo que se definen como isotipos: variedades que todas ellas están presentes en cada individuo de la misma especie. A nivel celular, existe exclusión alélica para el tipo de cadena L, de forma que un mismo linfocito B producirá siempre inmunoglobulinas del mismo tipo; pero, en cambio, la clase de cadena H puede variar. A. Ruiz-Bravo López | M.ª Jiménez Valera la única clase capaz de atravesar la barrera placentaria, lo que significa que la madre transfiere al feto anticuerpos de clase IgG que le aseguran un cierto nivel de protección pasiva durante los primeros meses de vida posnatal. La IgG es, además, la principal clase de inmunoglobulina que puede actuar como opsonina específica, ya que, como se ha indicado en el apartado 2.4.3, en la superficie de los fagocitos hay receptores para Fc de IgG. Cuando está presente en la superficie linfocitaria como receptor específico de antígeno, la IgM adopta forma monomérica (por monómero se entiende Figura 13. Dominios globulares y estructuras de IgG, IgM sérica e IgA en secreciola unidad estructural de cuatro nes (las líneas delgadas que unen monómeros representan puentes de disulfuro). cadenas), pero la IgM sérica es un pentámero, constituido por Es importante tener presente el hecho de que cinco unidades estructurales idénticas entre sí y un una molécula de inmunoglobulina es una proteína péptido de 15 kDa denominado cadena J (Figude gran tamaño, que reúne todas las condiciones ra 13). Sólo la IgM y la IgG son capaces de activar necesarias para comportarse como un antígeno. la vía clásica del complemento cuando se unen a Por tanto, las moléculas de anticuerpo pueden, a sus antígenos específicos. Los anticuerpos de clase su vez, actuar como antígenos. Es posible obtener IgA presentes en el suero son monómeros, pero anticuerpos que reconozcan específicamente los en las secreciones de las mucosas la IgA está en distintos isotipos (es decir, anticuerpos frente a forma dimérica (dos monómeros y una cadena J), cadenas L de tipo κ, anticuerpos frente a cadenas y va unida a una proteína no inmunoglobulínica llaL de tipo λ, y, del mismo modo, anticuerpos frente mada pieza secretora (Figura 13). La IgD sérica a cada una de las clases de cadenas H). Obviamenes muy escasa; su principal papel es como receptor te, para obtener anticuerpos frente a isotipos es en la superficie linfocitaria. Finalmente, la IgE tiene preciso inmunizar, con las correspondientes cadela propiedad de unirse, por su parte no específica, nas L o H, animales pertenecientes a una especie a receptores en la superficie de mastocitos; cuandiferente, ya que todos los individuos de la especie do dos o más moléculas de IgE se entrecruzan en humana poseen todos los isotipos y no responden la superficie del mastocito, por haberse unido al frente a ellos. antígeno, se genera una señal de activación que Las inmunoglobulinas se clasifican en clases, causa la desgranulación de la célula (liberándose según la clase a la que pertenezca la cadena H. En histamina), y la síntesis y liberación de derivados el ser humano, por tanto, hay cinco clases de inmuactivos del ácido araquidónico (prostaglandinas y noglobulinas, denominadas con la letra inicial de la leucotrienos). palabra griega que designa a la clase de cadena H: IgG (cadenas H de clase γ), IgM (cadenas H de clase μ), IgA (cadenas H de clase α), IgD (cadenas H de 3.2.3. Generación de la clase δ) e IgE (cadenas H de clase ε). Esta clasificadiversidad de especificidades ción es importante, porque cada clase de inmunoglobulinas posee propiedades biológicas peculiares, El sistema inmune de un mamífero como el ser que definen distintos papeles en la defensa del humano tiene capacidad para reconocer varios miorganismo (Tabla 2). La IgG (Figura 13) es llones de epítopos diferentes. Este repertorio de 1213 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... Tabla 2. CLASES DE INMUNOGLOBULINAS Y SUS PROPIEDADES Propiedad IgG IgM IgA IgD IgE Concentración sérica (mg/ml) 13 1,4 4 0,03 < 0,0005 Peso molecular y configuración 150.000 Monómero 180.000 Monómero (receptor de células B) 160.000 Monómero (plasma) 180.000 Monómero 190.000 Monómero 900.000 Pentámero (plasma) 350.000 Dímero (secreciones) Activación de C1q Sí Sí No No No Paso a través de la placenta Sí No No No No Unión a receptores en células Sí (FcγR) en NK y fagocitos No Sí (FcαR) en fagocitos No Sí (FcεR) en mastocitos especificidades se consigue mediante procesos de reorganización génica que ocurren durante la diferenciación de las células inmunocompetentes. En el genoma humano hay tres loci independientes que contienen genes de inmunoglobulinas: uno para las cadenas L de tipo κ (en el cromosoma 2), otro para las de tipo λ (cromosoma 22) y un tercero para las cadenas H (cromosoma 14). Una cadena κ es el resultado de la trascripción de tres exones:V, que codifica la mayor porción de la parte variable, desde el extremo amino-terminal hasta la tercera de las regiones hipervariables (incluyendo dos regiones hipervariables y parte de la tercera); J, que codifica lo que resta de la parte variable (no confundir con la cadena J de las inmunoglobulinas multiméricas, ya que no guardan ninguna relación), y C, que codifica la totalidad de la parte constante. En la línea germinal, el locus κ presenta unos 50 segmentos V funcionales; y, a cierta distancia de ellos, cinco secuencias J seguidas de un único exón C. El proceso de reorganización que ocurre durante la diferenciación de los linfocitos B consiste en que uno de los segmentos V se fusiona con uno de los segmentos J, ambos elegidos alea- 1214 toriamente. Cuando este bloque génico se transcribe, la secuencia que separa al segmento J elegido del exón C se comporta como un intrón y, por tanto, es cortada y eliminada del mRNA maduro (Figura 14). Teóricamente, este proceso de reorganización génica permite generar 50 x 5 = 250 especificidades distintas, que en realidad son más, ya que existe un cierto grado de imprecisión en la elección del punto de recombinación entre V y J. En las cadenas λ, el proceso es similar, con algunas peculiaridades: el número de segmentos V funcionales no llega a 40; y hay cuatro segmentos C, cada uno de ellos asociado a una secuencia J. Una cadena H está codificada por los exones V, D y J, para la parte variable, más tres o cuatro exones C (uno por cada dominio), para la constante (adicionalmente, hay dos exones finales para una porción extra, carboxilo-terminal, que constituye la parte transmembrana y la cola citoplásmica de la cadena H en el caso de las inmunoglobulinas ancladas en la superficie linfocitaria como receptores específicos para el antígeno). En la línea germinal, hay poco más de 40 segmentos V, una treintena de segmentos D y seis segmentos J, seguidos de los A. Ruiz-Bravo López | M.ª Jiménez Valera exones correspondientes a las partes constantes μ, λ, ε y α. La reorganización de genes incluye una primera fusión, entre un segmento D y uno J, y una segunda, entre un segmento V y el bloque DJ. Un cálculo teórico arroja más de 7.200 posibles especificidades, que habría que multiplicar por la suma de especificidades de ambos tipos de cadenas L (> 400): el resultado se aproxima a 3 x 106, pero en realidad es mayor, porque la ya señalada imprecisión en la recombinación contribuye a la generación de diversidad también en las cadenas H (incluso en mayor grado que en las L). Las células B expresan primero receptores de la clase IgM, por lo que la transcripción se detiene entre los exones μ y δ. Posteriormente, se transcribe un mRNA que contiene los exones de ambas clases de cadenas H, y un mecanismo de rotura (splicing) alternativo permite a la célula B sintetizar receptores IgM e IgD, obviamente con la misma especificidad (el bloque VDJ no cambia, sólo cambian los exones de la parte constante). En el curso de la respuesta de anticuerpos, nuevas reorganizaciones y delecciones permiten a las células cambiar la clase de inmunoglobulina producida, siempre sin que la especificidad se vea afectada (ver apartado 3.4.2). La reorganización de genes de inmunoglobulinas en las células B está limitada por fenómenos de exclusión alélica. Por ello, todas las células de un mismo clon fabrican inmunoglobulinas de una única especificidad (y no de doble especificidad, que sería lo esperado si las reorganizaciones ocurriesen tanto en los cromosomas maternos como en los paternos), y con un solo tipo de cadena L. 3.2.4. Receptor de células B y marcadores de diferenciación del linaje B El receptor específico de antígeno de las células B, o BCR (B-Cell Receptor), es un complejo que incluye una molécula de inmunoglobulina, anclada en la superficie celular a través del segmento transmembrana y del tallo citoplásmico de las cadenas H. El tallo citoplásmico es demasiado pequeño para participar en las reacciones que generan las señales de activación celular, por lo que esta función corre a cargo de un heterodímero inespecífico: dos cadenas peptídicas unidas por puentes disulfuro, denominadas Igα-Igβ o, en el sistema CD de nomenclatura de proteínas superficiales, CD79a-CD79b. Los tallos citoplásmicos de estas dos cadenas poseen motivos ITAM (ver apartado 2.4.3) y son capaces de iniciar vías de activación. La estructura del BCR se presenta en la Figura 15. Cabe ya adelantar aquí el concepto de que la activación de una célula con el potencial defensivo de los linfocitos es un fenómeno complejo, y que generalmente requiere de señales accesorias (coestimulación). Los marcadores de diferenciación celular son moléculas, propiedades y funciones que aparecen o se pierden a lo largo del proceso de diferenciación de un linaje celular, y que, por tanto, permiten definir diversos estados de diferenciación. En el caso de las células B, el proceso ocurre en la médula roja o hemopoyética. Las células madre, dado su estado de indiferenciación, son muy pobres en marcadoFigura 14. Generación de diversidad y expresión de las cadenas κ. res. La célula madre linfoide 1215 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... mRNA) (ver apartado 3.2.3). La activación, en respuesta al antígeno específico, incluye la pérdida progresiva de marcadores: las células B activadas pierden CD21 y CD23; las células terminales de este linaje, que son los plasmocitos, han perdido la mayor parte de los marcadores, aunque reexpresan CD38. Los plasmocitos funcionan como fábricas de anticuerpos, que son secretados y aparecen en el plasma. La búsqueda de marcadores superficiales, mediante técnicas de inmunofluorescencia, usando anticuerpos específicos para ellos, y la detección de las reorganizaciones génicas, meFigura 15. Estructuras del BCR (B-Cell Receptor), TCR (T-Cell Receptor) y antígenos de histocompatibilidad de clases I y II. MHC-I: Major Histocompatibility Comdiante hibridación con sondas, plex-I; MHC-II: Major Histocompatibility Complex-II; ITAM: Immunoreceptor permite definir el estadio de diTyrosine-based Activation Motifs. ferenciación en que se encuentra una célula B. Pero, obviamente, los marcadores CD son expresa la molécula de superficie CD34, que esproteínas de la superficie celular que desempeñan tará presente tanto en las células B como en las T. diversas funciones fisiológicas. CD21 es CR2, recepLa diferenciación del linaje B se inicia con el primer tor de C3d; es capaz de unir antígenos microbianos paso en la reorganización de los genes de cadenas que hayan activado el complemento, y entonces forH, consistente en la fusión de los segmentos D y J; ma con CD19 un complejo que genera señales de paralelamente, se expresa el heterodímero Igα-Igβ; coestimulación para la célula B. CD40 es el receptor además, aparece ya un marcador superficial típico de CD154 (antes llamado CD40L, de CD40 Ligand), del linaje, la molécula CD19, y otro que se perderá a través del cual la célula B recibe también señales en el curso de la diferenciación, CD10: este estadio coestimuladoras (ver apartado 3.4.1). se denomina pro-B. El siguiente estadio es el pre-B, en el cual se completa la reorganización de los genes de cadenas H y, posteriormente, se reorganizan 3.2.5. Sistema principal los de cadenas L, con lo que la célula ya ha fijado de histocompatibilidad su especificidad y dará origen a un clon; las cadenas H y L aparecen en el citoplasma a finales de este Los trasplantes alogénicos (entre individuos de estadio, en el que se expresan, además de CD10 la misma especie) suscitan reacciones de rechazo, y CD19, otros marcadores como CD21, CD22, debidas al reconocimiento, por el sistema inmune CD38 y CD40. En el estadio siguiente, que es el de del receptor, de antígenos presentes en los tejidos células B inmaduras, aparece la inmunocompetendel donante pero no compartidos por el receptor. cia (capacidad de responder al estímulo antigéniLos más importantes de estos antígenos están co), ya que se expresa el BCR, constituido por IgM codificados por genes que forman un complejo de membrana asociado a Igα-Igβ; se pierden CD10 denominado MHC (Major Histocompatibility Comy CD38, y se inicia la expresión de CD23. El paso plex), lo que se traduce como “complejo principal a célula B madura conlleva la expresión simultánea de histocompatibilidad”. En el ser humano, el MHC de IgM e IgD de membrana (splicing alternativo de se designa con las siglas HLA (Human Leucocyte 1216 A. Ruiz-Bravo López | M.ª Jiménez Valera Antigens) y está ubicado en el brazo corto del cromosoma 6. Durante mucho tiempo, se ignoró el significado biológico de estos aloantígenos (antígenos distribuidos dentro de una especie, de forma que hay grupos de individuos definidos por expresar unas u otras especificidades, como ocurre con los grupos sanguíneos), pero hoy se sabe que juegan un papel esencial en el reconocimiento de antígenos extraños por los linfocitos T. Existen dos tipos de antígenos codificados por el MHC: las moléculas de clase I y las de clase II. Ambas pertenecen a la superfamilia de las inmunoglobulinas. Los antígenos de clase I están constituidos por una cadena, designada como cadena α, con tres dominios extracelulares, una parte transmembrana y una cola citoplásmica (Figura 15). Las partes polimórficas de esta molécula (es decir, aquellas partes donde la secuencia de aminoácidos puede variar de unos individuos a otros, y donde residen, por tanto, los epítopos que definen los distintos aloantígenos) se localizan en los dominios α1 y α2, que son los más alejados de la superficie celular. Las moléculas de clase I se asocian (de forma no covalente) a una proteína extracelular invariante, llamada β2-microglobulina, cuyo papel es mantener desplegada en una determinada configuración espacial a la cadena α. Es muy importante tener presente, en relación con su función biológica, que los antígenos de clase I se expresan, en mayor o menor cantidad, en todas las células nucleadas del cuerpo. Los antígenos de clase II son heterodímeros, compuestos de una cadena α y otra β, ambas constituidas por dos dominios extracelulares y las correspondientes partes transmembrana y citoplásmica (Figura 15). Las partes polimórficas residen en los dominios más alejados de la superficie celular, que son α1 y β1, respectivamente. La expresión de estos antígenos está restringida a determinados linajes celulares: macrófagos, células de Langerhans, células dendríticas y linfocitos B. En el ser humano, existen tres loci funcionales para genes de clase I, designados como HLA-A, HLA-B y HLA-C, y otros tres para clase II, que son HLA-DP, HLA-DQ y HLA-DR. Para cada uno de estos loci se conocen gran número de alelos, y cada individuo tiene dos juegos de ellos, uno en el cromosoma materno y otro en el paterno. En consecuencia, la posibilidad de que dos humanos (que no sean gemelos univitelinos) coincidan en su repertorio de aloantígenos HLA es mínima. 3.2.6. Receptor de células T El receptor específico para antígenos de las células T, o TCR (T-Cell Receptor) es un complejo de varias proteínas (Figura 15). La especificidad reside en un heterodímero, que puede estar constituido por una cadena α y otra β, o bien por una cadena γ y otra δ; en ambos casos, las cadenas pertenecen a la superfamilia de las inmunoglobulinas y están unidas por un puente disulfuro. Hay una población, mayoritaria, de células Tα/β, y otra, mucho menor, Tγ/δ. La especificidad reside en las partes variables de estas cadenas, que contienen regiones hipervariables, generadas por reorganización de segmentos de genes de la línea germinal, de forma similar a como se ha visto para las inmunoglobulinas (ver apartado 3.2.3). Hay que señalar aquí ya el concepto de que las células T, a diferencia de las B, no interaccionan nunca con antígenos nativos, sino que reconocen fragmentos (epítopos) de antígenos extraños, presentados en la superficie de células auxiliares, asociados a los antígenos del MHC expresados por dichas células auxiliares (el procesamiento y presentación de antígenos por las células auxiliares se explica en el (ver apartado 3.3.1). El TCR reconoce simultáneamente una estructura propia (antígeno de histocompatibilidad propio) y otra ajena (epítopo de un antígeno extraño). Como ocurre con el BCR, el reducido tallo citoplásmico del heterodímero específico no es capaz de intervenir en las reacciones de fosforilación necesarias para iniciar una señal de activación. Este papel lo cumplen las proteínas inespecíficas del TCR: un complejo de dos heterodímeros denominado globalmente CD3, constituido por los pares γ/ε y δ/ε (no confundir con las cadenas H de los mismos nombres); y un homodímero ζ/ζ, cuyos tallos citoplásmicos contienen motivos ITAM. 3.2.7. Ontogenia de células T, marcadores y subpoblaciones Las células progenitoras del linaje T, procedentes de la célula madre linfoide (CD34+), abandonan la médula ósea y pasan al timo, donde se denominan timocitos. En este órgano, las células adquieren el marcador CD2, y, posteriormente, ocurren las reorganizaciones génicas que les permiten expresar 1217 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... el TCR, incluyendo el complejo CD3. Ambos son marcadores “pan-T”, esto es, están presentes en todas las células del linaje. La diferenciación de los timocitos α/β está bien definida: junto con CD3, expresan también los marcadores CD4 y CD8, presentando el fenotipo CD2+CD3+CD4+CD8+. Más del 95% de las células que proliferan en el timo mueren por apoptosis, como resultado de un doble proceso de selección que ocurre en este estadio: la selección positiva rescata a los timocitos cuyo TCR muestra afinidad por los antígenos propios del MHC (un cierto grado de afinidad es necesario para que el TCR reconozca epítopos extraños asociados a moléculas del MHC propio), y la selección negativa elimina a los que expresan un TCR con alta afinidad por dichos antígenos (eliminando, así, los clones potencialmente autorreactivos). Las selecciones positiva y negativa constituyen la llamada “educación intratímica”, para la cual son necesarias interacciones de los timocitos con otros linajes celulares presentes en el timo: en la selección positiva parecen participar las células del epitelio tímico, mientras en la negativa participan células de origen hemopoyético (macrófagos, células dendríticas) igualmente presentes en este órgano. La maduración de los timocitos α/β concluye con la pérdida de uno de los dos marcadores CD4 o CD8, y así se separan dos fenotipos: CD2+CD3+CD4+CD8-, que corresponde a la subpoblación de linfocitos T cooperadores o helper (células Th), y CD2+CD3+CD4-CD8+, que corresponde a la subpoblación de linfocitos T citotóxicos o CTL (Cytotoxic T Lymphocytes). Ambas subpoblaciones abandonan el timo y pasan a colonizar los órganos linfoides periféricos. Como ya se ha indicado, los marcadores CD son proteínas superficiales con funciones propias. En concreto, CD4 posee afinidad por partes no polimórficas de las moléculas MHC-II; por este motivo, las células Th reconocen epítopos extraños asociados a moléculas MHC-II propias. Por su parte, CD8 tiene afinidad por partes no polimórficas de las moléculas MHC-I, por lo que los CTL reconocen epítopos extraños asociados a moléculas MHC-I propias. Las células T sólo reconocen epítopos extraños asociados a moléculas MCH propias; la combinación epítopo propio/MHC propio no debe ser reconocida si la educación intratímica ha sido correcta (se trataría de células T autorreactivas), y la combinación epítopo extraño/MHC extraño 1218 tampoco, ya que la selección positiva rescata timocitos cuyo TCR tenga afinidad (aunque baja) por los antígenos MHC propios, que son los únicos representados en el entorno tímico (el requisito de que la célula T y la presentadora de antígeno sean histocompatibles se denomina restricción de histocompatibilidad). Pero, además, las células T pueden distinguir entre antígenos extraños sintetizados fuera de las células propias, esto es, antígenos exógenos, y antígenos extraños sintetizados dentro de células propias (p. ej., por un patógeno intracelular), o sea, antígenos endógenos (nótese que endógeno no significa propio). Como se explica en los apartados siguientes, los epítopos de antígenos exógenos son presentados en asociación con moléculas MHC-II, a células T CD4+ (es decir, Th), mientras que los epítopos de antígenos endógenos son presentados, en asociación con moléculas MHC-I, a células T CD8+ (es decir, CTL). Además de su papel decidiendo qué subpoblación de linfocitos T puede responder frente a un antígeno, según cuál sea la molécula MHC presentadora, tanto CD4 como CD8 actúan como correceptores, siendo necesarios para la activación del TCR. Otras moléculas de superficie intervienen en la recepción de señales coestimuladoras, como CD28, que es el receptor de CD80, expresado por las células presentadoras de antígeno. 3.3. El papel crucial de las células Th 3.3.1. Presentación de epítopos a las células Th Sólo aquellos linajes celulares que expresan moléculas MHC-II son capaces de presentar antígenos a las células Th. Células dendríticas, macrófagos y linfocitos B reúnen esta condición y, por ello, se las considera “células presentadoras de antígeno profesionales” o APC (Antigen-Presenting Cells). El sistema linfático está organizado de forma que la presentación de antígenos a células Th ocurra mayoritariamente en los órganos linfoides periféricos. Los antígenos extraños presentes en un tejido pueden ser arrastrados por el drenaje linfático y, al llegar al ganglio local o regional, serán endocitados por los macrófagos o las células dendríticas que allí abundan, procesados y presentados a los linfocitos A. Ruiz-Bravo López | M.ª Jiménez Valera Th. Alternativamente, las llamadas células de Langerhans, que no son sino precursores de células dendríticas ubicados en la piel, pueden endocitar antígenos y dejarse llevar por el drenaje linfático hasta los ganglios, donde ellas mismas llevarán a cabo la presentación. Funciones parecidas desempeñan los macrófagos atraídos quimiotácticamente a un foco inflamatorio. Las APC ingieren antígenos que estaban inicialmente fuera de ellas, es decir, antígenos exógenos. El procesamiento de los antígenos exógenos endocitados incluye su hidrólisis parcial por la acción de las proteasas endosomiales, generándose diversos oligopéptidos. Por su parte, la APC sintetiza continuamente nuevas moléculas de histocompatibilidad, para reponer las que se pierden de la superficie celular (las proteínas superficiales suelen presentar una alta tasa de recambio o turnover). Las moléculas MHC-II recién sintetizadas pasan del retículo endoplásmico al aparato de Golgi y de allí a las vesículas endosómicas, donde coinciden con los oligopéptidos resultantes de la digestión proteolítica del antígeno. Aquellos oligopéptidos con un tamaño y características apropiadas encajan en la hendidura que existe entre las partes polimórficas de las cadenas α y β (es decir, entre los dominios α1 y β1). Los complejos MHC-II/péptido que alcancen un suficiente grado de estabilidad, son finalmente exportados hasta la membrana celular. Los péptidos capaces de unirse establemente a moléculas MHC-II son, por tanto, los epítopos reconocidos por las células Th; frecuentemente, corresponden a secuencias internas del antígeno, que, en cambio, no pueden actuar como epítopos para las células B, ya que el BCR interacciona con el antígeno nativo (sin procesamiento previo) y, por tanto, sólo puede reconocer epítopos externos, que sobresalgan de la superficie del antígeno. En consecuencia, las células T y las B suelen reconocer epítopos diferentes en la misma molécula antigénica. Como ya se ha indicado, las células Th tienden a unirse transitoriamente a las APC, en base a la afinidad existente entre CD4 y partes no polimórficas de la molécula MHC-II. En tal situación, la parte específica del TCR tiene la oportunidad de examinar el conjunto formado por las partes polimórficas de la molécula MHC-II y el oligopéptido encajado en la ranura. Si la especificidad del TCR no coincide con la combinación propio/extraño de este conjunto, la célula Th se separará y será susti- tuida por otra. Cuando, finalmente, el oligopéptido sea presentado a un TCR capaz de reconocer específicamente esa combinación propio/extraño, se iniciará el proceso de activación de la correspondiente célula Th. Los ITAM de los tallos citoplásmicos de los heterodímeros CD3 y del homodímero ζ, que forman parte del TCR, son fosforilados por una kinasa asociada al correceptor CD4. A partir de aquí, se ponen en marcha varias vías de señalización, que finalmente determinan la activación de factores de transcripción y la derrepresión de gran número de genes. En la relación entre la APC y la célula Th intervienen numerosas moléculas de la superficie de ambas células, además de las anteriormente mencionadas. Estas interacciones se ven facilitadas por una peculiar reorganización de las membranas citoplásmicas de ambas células, en la zona de contacto, que recibe el nombre de “sinapsis inmunológica”. La sinapsis se forma a partir de los llamados dominios de membrana (en inglés, rafts), zonas discretas con una composición lipídica diferente al resto de la membrana (en los rafts lipídicos predominan esfingolípidos y colesterol, en lugar de fosfolípidos). La sinapsis concentra, en la superficie de la célula Th, complejos TCR, correceptores (CD4), coestimuladores (CD28) y moléculas de adhesión. De especial importancia es la necesidad de señales coestimuladoras, generadas como consecuencia de la interacción de CD28 con su ligando, CD80 (también llamado B7). CD80 es expresado por las células dendríticas, por macrófagos estimulados (p. ej., por PAMP bacterianos) y por linfocitos B activados. Algunos pasos claves en las vías de transducción de la señal de activación generada por el TCR dependen de la coestimulación desde CD28. En ausencia de coestimulación, el proceso de activación celular no puede completarse y la célula T llegará a una situación de anergia (falta de respuesta), o incluso podría entrar en apoptosis. El conjunto de este complicado diálogo celular se resume en la Figura 16. Por último, hay que tener presente que las células del sistema inmune también se comunican a distancia: las citokinas son moléculas mensajeras que se unen a receptores en la superficie celular, donde generan las correspondientes señales. Diversas citokinas pueden potenciar o deprimir el proceso de activación de la célula Th, que, a su vez, una vez activada, producirá su propio perfil de citokinas. 1219 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... de la inmunidad innata. Los patógenos extracelulares, que interaccionan con sistemas humorales como el complemento, causan la activación de mastocitos por anafilotoxinas, y los mastocitos activados producen IL-4, la cual promueve la diferenciación en Th2; estas células cooperan con los linfocitos B en la respuesta de anticuerpos. Los patógenos intracelulares estimulan la producción de IL-12 por los macrófagos, y la IL-12 promueve la diferenciación en Th1; estas células participan en la inmunidad celular (ver apartado 3.5.1), eficaz frente a este tipo de patógenos. La Figura 16. Reconocimiento de antígenos exógenos y activación de células Th. APC: diferenciación en Th1 o Th2 Antigen-Presentig Cells. ocurre durante la expansión del clon. Si el proceso de activación se completa satisLa elección de uno u otro tipo de respuesta no factoriamente, la célula activada entra en el ciclo es necesariamente excluyente; por ejemplo, los antícelular y se divide repetidamente, lo que determigenos de los patógenos intracelulares también induna la ampliación del clon. En condiciones óptimas, cen respuestas de anticuerpos con cooperación de como las aportadas por la presencia de reacciones linfocitos Th2, ya que frecuentemente se encuentran inflamatorias inducidas por agentes patógenos o fuera de las células, lo que les permite interaccionar por coadyuvantes de la respuesta inmune, se han con el sistema del complemento (aparte del hecho descrito ampliaciones de hasta un centenar de de que las citokinas producidas por Th1 también faveces, respecto del número inicial de células en el vorecen la producción de algunas subclases de IgG). clon. Sin embargo, se ha observado que muchas de Sin embargo, el predominio de una u otra opción de las células resultantes mueren en el tejido linfoide. diferenciación Th es de importancia crucial, ya que Si la inmunización se ha realizado en condiciones favorecerá una rama de la inmunidad adaptada al óptimas, la proporción de células que sobreviven tipo de agente patógeno. es mayor. Las células supervivientes se convierten en células T memoria. 3.4. Respuesta de anticuerpos 3.3.2. Respuestas Th1 y Th2 3.4.1. Activación de linfocitos B Una vez activados, los linfocitos Th tiene ante sí dos opciones de diferenciación: pueden convertirse en Th1, que producen IL-2 e IFN-γ; o en Th2, productoras de IL-4, IL-5, IL-6 e IL-10. La elección de una u otra opción depende de varios factores, entre ellos el microambiente de citokinas previamente generado como consecuencia de las interacciones entre los agentes patógenos y las células Algunos antígenos (generalmente, polisacarídicos) son capaces de activar células B sin necesitar la cooperación de linfocitos Th2, por lo que se denominan timo-independientes; pero, mayoritariamente, los antígenos proteicos son timo-dependientes. Como se ha explicado en el apartado 3.3, una APC endocita moléculas de un determinado an- 1220 A. Ruiz-Bravo López | M.ª Jiménez Valera Figura 17. Activación de células B. BCR: B-Cell Receptor. tígeno extraño, las procesa por la vía de los antígenos exógenos y presenta los correspondientes epítopos en el hueco configurado por las partes polimórficas de la molécula MHC-II. Una célula Th, mediante su TCR, reconoce un epítopo asociado a la molécula MHC-II compatible, y se activa, diferenciándose en Th2. Paralelamente, un linfocito B ha reconocido, mediante su BCR, un epítopo en la superficie de otras moléculas del mismo antígeno. Una consecuencia de ello es la generación de una primera señal de activación, que se inicia con la fosforilación de los ITAM presentes en las cadenas citoplásmicas del heterodímero CD79, a cargo de tirosina kinasas citoplásmicas como Lyn o Syk. Otra consecuencia del reconocimiento del antígeno por el BCR es que el complejo inmunoglobulina/antígeno es endocitado por el linfocito. En la vesícula endocítica, el descenso del pH disocia el complejo, y el antígeno es procesado por proteasas lisosomiales (las mismas que actuaron en el procesamiento del antígeno por la célula dendrítica que lo presentó al linfocito Th). Finalmente, el linfocito B, actuando como una APC, presentará a las células Th los mismos epítopos que presentó la célula dendrítica. Pero hay una diferencia, y es que ya existen células Th que han respondido a esos epítopos y se han activado como células Th2. La activación conlleva algunas alteraciones en los patrones de expresión de moléculas de la superficie celular. Entre ellos, destaca la expresión de CD154, ausente en las células T vírgenes, pero presente en las activadas. CD154 es el ligando de CD40, un receptor de coestimulación presente en la superficie de las células B. En términos de transferencia de información, cuando CD40 interacciona con CD154, es como si la célula Th2 le contase a la B que ella también se ha encontrado con el mismo antígeno. En cambio, una célula Th virgen no podría enviar este mensaje, ya que carece de CD154. El mensaje recibido a través de CD40 tiene, para la célula B, el valor de una segunda señal de activación. Los intercambios de señales entre las células B y Th se hacen a través de una sinapsis inmunológica, como se ha explicado en el apartado 3.3.1. El proceso de activación se esquematiza en la Figura 17. Adicionalmente, el linfocito B en proceso de activación puede recibir señales procedentes de citokinas. Dentro del perfil de citokinas producidas por células Th2, el trío IL-4, IL-5 e IL-6 actúan sobre las células B preactivadas, promoviendo la proliferación y diferenciación a plasmocitos y los cambios de clase de las inmunoglobulinas secretadas. La activación completa del linfocito B tiene varios efectos. Por una parte, hay alteraciones en la expresión de moléculas de la superficie celular: entre las que aparecen, cabe destacar CD80, cuya presencia permitirá al linfocito B enviar señales coestimuladoras, vía CD28, a las sucesivas células Th del mismo clon específico que se vaya encontrando (los pares CD80/CD28 y CD40/CD154, generadores de señales coestimuladoras, permiten a células B y Th irse pasando sucesivamente el mensaje de activación). Por otra parte, las células B activadas entran en el ciclo celular, convirtiéndose en linfoblastos. Parte de estos linfoblastos se diferencian a plasmocitos secretores de anticuerpos, mientras que otros originan células B memoria. 1221 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... El cambio de isotipo se debe a una nueva reorganización de los genes de inmunoglobulinas, reorganización inducida por algunas citokinas; sólo se produce en células que han sido coestimuladas a través de CD40; y es irreversible, porque conlleva la delección de los segmentos CH correspondientes a los dominios constantes de las cadenas μ, de modo que la célula que hace el cambio y sus descendientes ya no pueden volver a sintetizar IgM. Como las células B memoria se generan a partir de células que ya han realizado el cambio de clase, las respuestas Figura 18. Producción de anticuerpos séricos: respuestas primaria y secundaria. ulteriores al mismo antígeno (respuesta secundaria) no incluyen 3.4.2. Producción de producción apreciable de IgM (Figura 18). anticuerpos, cambios de clase La afinidad es la medida de la fuerza de unión y maduración de afinidad del anticuerpo al antígeno. Es un concepto distinto del de especificidad: anticuerpos distintos pueden La cooperación de células Th2 es necesaria para tener igual especificidad (reconocen el mismo el cambio de clase de inmunoglobulinas y el increepítopo) pero diferentes afinidades (unos se unen mento de afinidad de los anticuerpos en el curso con más fuerza que otros). La afinidad depende del de la respuesta, así como para la generación de ajuste fino, topográfico y de distribución de cargas, memoria. Al analizar estos aspectos de la respuesta entre el epítopo y las CDR, y se puede variar si en de anticuerpos, es preciso distinguir entre respuesta las regiones hipervariables se producen cambios primaria, que es la que corresponde a la primera vez puntuales de un aminoácido por otro. que el sistema inmune entra en contacto con un A lo largo de la respuesta primaria de anticuerdeterminado antígeno, y respuesta secundaria, que pos se observa un incremento de afinidad. Los es la que se obtiene en contactos posteriores con el primeros anticuerpos que se producen (la IgM y las mismo antígeno, y se basa, por tanto, en la memoria primeras IgG) son de baja afinidad, pero al final de la inmunológica desarrollada tras el primer contacto. respuesta, los anticuerpos de clase IgG son de alta Los primeros anticuerpos secretados por linfoafinidad. Estos mismos anticuerpos de alta afinidad blastos y plasmocitos en el curso de la respuesta son los que aparecen en la respuesta secundaria. primaria son la forma soluble de la IgM de memLa causa del incremento de afinidad es el proceso brana que constituye el BCR (Figura 18). Sin de maduración de afinidad, que se describe a conembargo, durante la expansión clonal, ocurre un tinuación. cambio de clase (isotipe switching) que conduce a Tras su activación por el antígeno y las células la producción mayoritaria de anticuerpos de clase Th2, las células B proliferan y parte de ellas se difeIgG, aunque también se producen IgA, y, en determirencian en plasmocitos que producen los primeros nados casos, cantidades apreciables de IgE (ciertos anticuerpos. Otras migran a los folículos primarios antígenos, como los de parásitos animales, inducen (las áreas ocupadas por los linfocitos B en los órrespuestas de IgE; y personas en las que concurren ganos linfoides periféricos), donde proliferan en determinados factores genéticos tienen facilidad torno a las llamadas “células dendríticas foliculares”, para realizar potentes respuestas de IgE frente a constituyendo un microambiente especializado, antígenos irrelevantes, lo que es causa de algunos distinguible dentro del folículo como un “centro tipos de alergia, incluyendo alergias a alimentos). germinativo”. Las células dendríticas foliculares son 1222 A. Ruiz-Bravo López | M.ª Jiménez Valera células especializadas en capturar y retener por largo tiempo moléculas intactas de antígeno (no guardan relación con las células dendríticas que actúan como APC para los linfocitos Th). Las células B que proliferan en el centro germinativo se llaman centroblastos. En los centroblastos se pone en marcha un mecanismo de hipermutación que afecta a la totalidad de los bloques VH D H J H y VLJ L , sin afectar a los exones no recombinados que codifican los dominios constantes. Las mutaciones no se limitan a las CDR, pero sólo las que las afectan tienen posibilidad de repercutir en la afinidad, ya sea aumentándola o disminuyéndola. Los centroblastos originan centrocitos, cuyas inmunoglobulinas de membrana son ya portadoras de los cambios debidos al mecanismo de hipermutación. Los centrocitos están programados para morir, pero son rescatados de la apoptosis si las inmunoglobulinas de membrana se mantienen unidas al antígeno. Obviamente, las inmunoglobulinas mutadas de los distintos centroblastos competirán entre sí y con las moléculas solubles de los anticuerpos ya producidos, por las moléculas de antígeno retenidas por las células dendríticas foliculares; esta competencia seleccionará a los centroblastos portadores de inmunoglobulinas de alta afinidad, que serán los únicos que sobrevivan y generen plasmocitos y células B memoria. 3.4.3. Los anticuerpos como moléculas efectoras Los anticuerpos pueden ejecutar una diversidad de funciones defensivas, lo que en muchos casos depende de las propiedades de la clase de inmunoglobulina. En este apartado, se describen algunas de estas funciones. Eliminación de antígenos: cuando se introduce un antígeno extraño en el medio interno, y tras su distribución en los distintos compartimentos del organismo, se alcanzan unos niveles plasmáticos que irán descendiendo gradualmente, a medida que el antígeno (generalmente, una proteína) es catabolizado y asimilado o excretado. Pero la aparición de anticuerpos específicos acelera drásticamente la cinética de desaparición del antígeno. Ello es debido a la formación de inmunocomplejos, en cuya formación generalmente participan anticuerpos de las clases IgM o IgG; los inmunocomplejos activan la vía clásica del anticuerpo, se recubren de C3b y sus derivados, y son depurados de la sangre por los fagocitos fijos abundantes en órganos muy irrigados como el bazo y el hígado. Neutralización de toxinas y de virus: muchas toxinas, como las exotoxinas bacterianas, son proteínas que, para ejercer su acción tóxica, han de unirse a receptores en la superficie celular. Un anticuerpo que se una, con suficiente afinidad, al ligando de la toxina, o a algún epítopo lo suficientemente próximo como para que el ligando quede bloqueado o distorsionado, interferirá en la unión de la toxina al receptor celular. Los virus también usan ligandos, ubicados en la superficie del virión, para unirse a receptores celulares; el bloqueo de estos ligandos por anticuerpos de alta afinidad impide su acceso a los receptores y neutraliza la infectividad. Adicionalmente, anticuerpos que se unan a otros epítopos de la superficie del virión y que no impidan su unión a receptores celulares, pueden ser neutralizantes si interfieren con etapas posteriores del proceso de infección vírica, como son la entrada en la célula y la descapsidación que libera el genoma viral en el interior de la célula. Los anticuerpos neutralizantes de toxinas y virus suelen ser IgG de alta afinidad. Opsonización específica: como ya se ha indicado en el apartado 2.4.3, los anticuerpos de la clase IgG pueden actuar como opsoninas específicas, facilitando la fagocitosis de microorganismos y poniendo en marcha los mecanismos microbicidas contenidos en los fagocitos. Activación de la vía clásica del complemento: la capacidad de los anticuerpos de clases IgM e IgG para activar la vía clásica del complemento les faculta para desencadenar todos los efectos biológicos descritos en el apartado 2.2.3, incluyendo la inducción de inflamación y la lisis de células portadoras de antígenos superficiales extraños, lisis de bacterias Gram-negativas e inactivación de virus con envoltura. Citotoxicidad mediada por células, dependiente de anticuerpos: hay células con potencial citotóxico, como las NK o los macrófagos activados, que poseen en su membrana FcγRs; por tanto, anticuerpos de clase IgG que reconozcan específicamente antígenos extraños (p. ej., virales) en la superficie de una célula (que será la célula “diana”), pueden unirse por la parte no específica (Fc) a los FcγRs. La molécula de anticuerpo actúa entonces de puente de unión entre la célula diana y la célula efectora 1223 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... citotóxica, la cual destruirá a la célula diana. Se trata de otra conexión entre la inmunidad innata y la específica: la célula que mata no es específica, pero el anticuerpo marca específicamente a la célula diana para su destrucción. Este mecanismo se conoce como citotoxicidad (es la muerte de una célula) mediada por células (la que mata es otra célula) dependiente de anticuerpos (la IgG conecta ambas células, diana y efectora), o ADCC (AntibodyDependent Cell-Mediated Cytotoxicity). 3.5. Inmunidad celular 3.5.1. Respuesta de células Th1 y activación de macrófagos Como ya se ha indicado, la activación de células T CD4+ en un entorno apropiado conduce a su diferenciación en Th1. Uno de los factores determinantes es la producción de IL-12 por los macrófagos que han fagocitado patógenos intracelulares. El patrón de citokinas producidas por las células Th1 incluye IL-2 e IFN-γ. IL-2 estimula la proliferación de las células T activadas. Como las propias células Th1 expresan el receptor para IL-2, esta citokina ejerce una estimulación autocrina. En cuanto al IFN-γ, entre sus diversas acciones destaca su participación en la activación de macrófagos. Los patógenos intracelulares, ya sean bacterias como Salmonella, Listeria, Mycobacterium o Legionella, o protozoos como Tripanosoma o Leishmania, están adaptados a vivir, no sólo en células no fagocíticas, sino incluso en macrófagos. Para ello, ponen en juego diversas estrategias, mediadas por los correspondientes factores de virulencia: ser endocitados por vías que no estimulen los mecanismos microbicidas, inhibir la fusión lisosomial, escapar de los fagosomas al citoplasma, etc. Por esto, el proceso de activación de macrófagos es crucial en la inmunidad frente a patógenos intracelulares: los macrófagos activados incrementan su actividad fagocítica y la expresión de mecanismos microbicidas (como la producción de radicales de nitrógeno activo), de forma que son capaces de matar a los patógenos intracelulares, a pesar de sus factores de virulencia y sus estrategias de adaptación. La activación de macrófagos se inicia con la señal promovida por la unión de IFN-γ a sus receptores superficiales, pero parece ser necesaria una segun- 1224 da señal coestimuladora, que podría provenir de la interacción entre moléculas de las superficies del macrófago y de la célula Th1, de otras citokinas como el TNF, o incluso de algunos PAMP. Además de las células Th1, otras células pueden producir IFN-γ: es el caso de las NK y de las Tγ/δ. Se acepta que la producción precoz de IFN-γ por células NK constituiría un primer paso en la estrategia para contener la infección por patógenos intracelulares, aunque insuficiente para conseguir su completa eliminación, que correría finalmente a cargo de la inmunidad celular, más lenta pero más eficiente. Un papel similar podrían tener las células Tγ/δ, cuyo repertorio de especificidades parece mucho más restringido que el de las células Tα/β. Los macrófagos activados, como consecuencia de su potencial microbicida, basado en gran parte en la producción de radicales oxidantes, son células muy agresivas que pueden causar daños en los tejidos del organismo. Pero la vida del macrófago activado es corta, ya que la activación parece poner en marcha el programa de apoptosis, lo que limita los posibles daños tisulares. 3.5.2. Linfocitos T citotóxicos En el apartado 3.2.7 se señalaba la posibilidad de que los antígenos microbianos se sinteticen fuera de la célula presentadora (antígenos exógenos) o dentro de ella (antígenos endógenos). En cada caso, la vía de procesamiento es diferente. Las proteínas sintetizadas dentro de cualquier célula del organismo están sometidas a un proceso de control: algunas de estas proteínas son degradadas por proteasas citosólicas agrupadas en un complejo de casi 30 subunidades, al que se denomina proteosoma. Como estas proteasas son distintas de las existentes en los lisosomas, un mismo antígeno se descompone en oligopéptidos diferentes, según que sea procesado por la vía endógena o por la exógena (es decir, los epítopos reconocidos por células T CD8+ y por células T CD4+ son diferentes). Los oligopéptidos resultantes de la digestión por el proteosoma pasan a la luz del retículo endoplásmico (por acción de transportadores especializados), donde se encuentran con las moléculas MHC-I recién sintetizadas, y, algunos de ellos, son capaces de encajar en la hendidura existente entre A. Ruiz-Bravo López | M.ª Jiménez Valera Figura 19. Reconocimiento de antígenos endógenos por Major Histocompatibility Complex-I. los dominios polimórficos α1 y α2. De esta manera, las moléculas MHC-I que, finalmente, se insertan en la membrana celular, van cargadas con los correspondientes oligopéptidos. La afinidad existente entre la molécula CD8 y partes no polimórficas de la molécula MHC-I hace que esta subpoblación de células T tenga la capacidad de unirse transitoriamente a células de los diversos tejidos y explorar, mediante su TCR, los oligopéptidos que se le presentan. Como siempre, las combinaciones MHC-I propio/oligopéptido propio no serán reconocidas (los clones T autorreactivos han sido eliminados durante la educación intratímica), pero las combinaciones de MHCI con oligopéptidos extraños (o propios alterados, procedentes de proteínas mutadas) tienen alta probabilidad de encontrar clones que las reconozcan específicamente. El proceso se esquematiza en la Figura 19. Dado que todas las células nucleadas del organismo expresan moléculas MHC-I, todas ellas pueden, en caso de infección por un patógeno intracelular (protozoo, bacteria o virus), presentar los correspondientes epítopos a las células T CD8+. La cooperación de células Th1, productoras de IL-2, es necesaria para una activación óptima. La activación de las células T CD8+ las convierte en linfocitos citotóxicos específicos (CTL), que matarán a las células que presenten en su superficie la combinación de MHC-I con el epítopo que células T CD8+. MHC-I: corresponda a la especificidad del clon. El mecanismo de muerte parece ser la inducción de apoptosis (como en el caso de las células NK). Está claro que esta respuesta defensiva causa la destrucción de células propias infectadas. En el caso de la infección por virus, la destrucción de la célula infectada evita su conversión en una fábrica de nuevos viriones, lo que, ciertamente, contribuye a limitar la infección. El balance del mecanismo defensivo dependerá, por un lado, de la patogenicidad del virus, y, por otro, de la importancia de la célula destruida y las posibilidades de reemplazarla (p. ej., en una infección leve del sistema nervioso, la acción de los CTL puede ser más perjudicial que beneficiosa, con el resultado de agravar la patología). En el caso de infecciones por bacterias intracelulares, la destrucción de la célula infectada libera a las bacterias, que resultan así susceptibles de ser fagocitadas por macrófagos activados (hay una colaboración entre los dos brazos paralelos de la inmunidad celular). 1225 Capítulo 1.35. Sistema inmune y mecanismos de inmunidad... 4. Resumen El sistema inmune opera reconociendo y eliminando estructuras extrañas al organismo. Estas funciones permiten mantener el medio interno libre de la colonización por microorganismos patógenos. Se pueden distinguir dos grandes niveles de reconocimiento de estructuras: el de la inmunidad no específica (también denominada innata), que limita su capacidad de discriminación a distinguir entre las estructuras propias y algunas estructuras extrañas, comunes a grandes grupos de microorganismos, y denominadas PAMP; y el de la inmunidad específica, basado en la generación de una enorme diversidad de receptores, cada uno de los cuales reconoce una determinada estructura (epítopo), ya sea propia o extraña, lo que implica a su vez el desarrollo obligado de mecanismos que impidan la autoagresión. Gran número de mecanismos de la inmunidad innata participan en la elaboración de reacciones inflamatorias, definidas por la extravasación de plasma y la infiltración del tejido con leucocitos neutrófilos, macrófagos y, posteriormente, linfocitos. Los sistemas de quininas y del complemento son conjuntos de proteínas plasmáticas que se activan en presencia de PAMP y ponen en marcha reacciones inflamatorias. La fagocitosis, por neutrófilos y macrófagos, es el mecanismo defensivo principal en el foco inflamatorio. En la inmunidad frente a virus, juegan un papel clave los mecanismos de citotoxicidad natural, a cargo de células NK, y la producción de interferones. La inmunidad específica es elaborada por los linfocitos, en respuesta al reconocimiento de antígenos. Los linfocitos están organizados en clones; los componentes de cada clon comparten receptores de la misma especificidad y reconocen al mismo antígeno. Los genes que codifican receptores específicos adoptan su configuración definitiva en las células precursoras linfoides, por reorganización de segmentos génicos presentes en la línea germinal. Los linfocitos B adquieren sus receptores específicos en la médula ósea, y son los responsables de la respuesta de anticuerpos. Los linfocitos T adquieren sus receptores específicos en el timo y se agrupan en dos subpoblaciones,Th y T citotóxicos o CTL. A su vez, hay dos subpoblaciones Th: las células Th1 participan 1226 en la inmunidad celular, sobre todo a través de la activación de macrófagos, mientras que las células Th2 cooperan con los linfocitos B en la respuesta de anticuerpos frente a los antígenos timodependientes. Los linfocitos B se activan por interacción con antígenos nativos, reconociendo epítopos externos; pero las células T sólo reconocen epítopos (oligopéptidos) asociados a moléculas de histocompatibilidad, en la superficie de células presentadoras que, previamente, han procesado e hidrolizado parcialmente al antígeno. Los fenómenos de presentación de antígenos y cooperación entre células requieren la interacción de ligandos y receptores de la superficie celular y la producción de citokinas. Los anticuerpos desempeñan diversas funciones defensivas: eliminación acelerada de antígenos por formación de inmunocomplejos, neutralización de virus y toxinas, opsonización de microorganismos, y fenómenos de citólisis, bacteriólisis y virólisis mediados por la activación del complemento. La inmunidad celular promueve la destrucción de patógenos intracelulares, por activación de macrófagos, y de células infectadas, mediada por CTL. A. Ruiz-Bravo López | M.ª Jiménez Valera 5. Bibliografía Annual Review of Immunology (anual, desde 1983). Annual Reviews. California. Colección de revisiones autorizadas y rigurosas sobre temas de actualidad en inmunología. Cada volumen anual incluye un índice acumulativo, ordenado por temas. Goldsby RA, Kindt TJ, Osborne BA, Kuby K. Immunology, 5th ed. WH Freeman. New York, 2003. Un texto excelente de inmunología fundamental, con buena iconografía y muy didáctico. Janeway CA, Travers, P, Walport M, Shlomchik MJ. Immunobiology, 3rd ed. Current Biology. London, 2003. Uno de los mejores textos de inmunobiología, por su enfoque original y adaptado a los más recientes conocimientos, su excelente nivel, compatible con unas sobresalientes cualidades didácticas, y el apoyo de una magnífica iconografía. Roitt IM, Delves PJ. Roitt’s Essential Immunology, 10th ed. Blackwell. London, 2001. Desde principios de los 70, se han sucedido las ediciones del texto de Ivan Roitt, que, realmente, son un exponente fiel de la historia reciente de la inmunología. Los últimos formatos han enriquecido notablemente la iconografía, manteniendo el estilo didáctico y conceptual de las primeras ediciones. Sigue siendo muy recomendable. Rose NR, Hamilton RG, Detrick B (eds.). Manual of Clinical Laboratory Immunology, 6th ed. ASM Press. Washington, 2002. Compendio periódicamente actualizado de inmunología clínica, cubre aspectos básicos y técnicos de todas las situaciones clínicas en las que se recurre al diagnóstico inmunológico. Sánchez-Pérez M (ed.). Introducción a la inmunología humana, 1ª ed. Editorial Síntesis. Madrid, 1997. Compilación de capítulos de varios autores; el nivel es excelente y tiene la ventaja de estar escrito originalmente en castellano. Sell S. Immunology, Immunopathology and Immunity, 6th ed. ASM Press. Washington, 2001. Tratado amplio, actualizado, que reúne, como indica el título, aspectos fundamentales y aplicados (inmunidad de los procesos infecciosos y enfermedades de base inmunológica). 6. Enlaces web www.inmunologia.org/main.htm www.efis.org www.med.sc.edu:85 www.roitt.com 1227