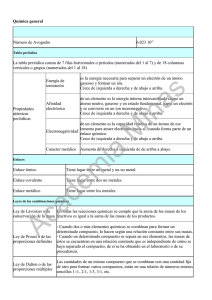
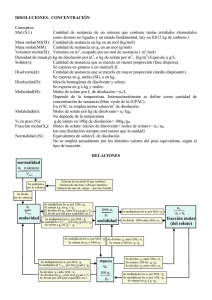
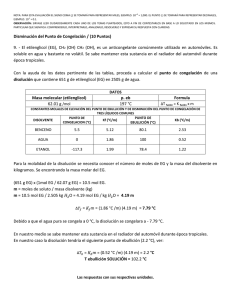
examen de química general (qmc-lab) - todoesquimica-I
Anuncio

SOLUCIONES Y PROPIEDADES COLIGATIVAS EXIJA SU LIBRO 3.1 DEFINICIÓN DE SOLUCIÓN M uy pocos materiales que encontramos en la vida diaria son sustancias puras; la mayor parte son mezclas y muchas de ellas son homogéneas, Recordemos que las mezclas homogéneas se denominan soluciones o disoluciones, por ejemplo: el aire que respiramos es una mezcla homogénea de varias sustancias gaseosas. El latón es una solución de cinc en cobre. Los océanos son una solución de muchas sustancias que se han disuelto en agua. Una solución es una mezcla homogénea de dos o mas sustancias puras, denominadas componentes de la solución, las cuales pueden ser gaseosas, líquidas o sólidas; debido a que las soluciones líquidas son las mas comunes, en esta sección enfocaremos nuestro estudio en dicho estado. Sin embargo, el estado físico de una solución lo determina a menudo el estado de su componente principal, denominado disolvente. El otro u otros componentes se denominan soluto. Disolvente o solvente, es la sustancia donde se disuelve el llamado soluto. Generalmente es aquella que se encuentra en mayor cantidad. En toda solución existe un solo solvente. YUPI Soluto es la sustancia que se disuelve a través del disolvente en forma de moléculas o iones para formar una sola fase. En una solución puede existir mas de un soluto. AGUA En la figura 3.1 es un resumen de la relación entre los materiales (materia), recuerde que las sustancias pueden ser mezcladas por procesos físicos y se pueden usar otros procesos físicos para separar la mezcla en 1sustancias. Ebbing Darrell D. Según este autor una sustancia (o sustancia pura) es una clase de materia que no puede ser separada en otras clases de materia por ningún proceso físico. 1 COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 58 3.2 PSEUDO - SOLUCIÓN, SUSPENSIÓN Y COLOIDE materia C uando una sustancia se disuelve o dispersa a través de otra, formaremos una mezcla donde encontramos tres posibilidades diferentes de tamaños de partículas. Cada uno de estos casos dará lugar a mezclas denominadas: solución, coloide y suspensión, con propiedades diferentes. La tabla 4.1 muestra una clasificación según el tamaño partículas. sustancias mezclas Mezclas homogéneas (soluciones) elementos compuestos Mezclas heterogéneas Figura 3.1 Relación entre los materiales 1. Cuando la sustancia se disuelve en forma de moléculas o iones entonces se denomina solución y los componentes son denominados soluto y disolvente. 2. Cuando la sustancia se dispersa (no es soluble) y permanece firmemente dividida se denomina coloide y sus componentes son llamados fase dispersa y fase dispersante. 3. Cuando el tamaño de la sustancia a quién se le denomina realmente micela, es mas grande en comparación a los dos casos anteriores se denominará suspensión. TABLA 3.1 Clasificación de la mezclas según el tamaño de miscela TAMAÑO DE MISCELAS SOLUCION COLOIDE SUSPENSIÓN 1-10Å 10-10000Å >10000Å 3.2.1 Coloides hidrofílicos e hidrofóbicos oloide es una pseudo – solución, es una mezcla heterogénea en la cual las partículas del soluto no precipitan, se dispersan a través de una fase dispersante, se clasifican en dos clases principales: coloides hidrofílicos y coloides hidrofóbicos. Un coloide hidrofílico (que aman el agua) es un coloide en el cual hay una atracción fuerte entre la fase dispersa y la fase continua (agua). Muchos de estos coloides consisten en macromoléculas (moléculas muy grandes) dispersas en agua. Excepto por el gran tamaño de las moléculas dispersas, estos coloides parecen soluciones normales. Un coloide hidrofóbico (que rechazan el agua), es un coloide en el cual hay una falta de atracción entre la fase dispersa y la fase continua (agua) Los coloides hidrofóbicos son básicamente inestables. C La tabla 3.2 muestra una clasificación de 8 tipos de coloides que son producto de la mezcla entre los estados sólido, líquido y gaseoso, pero respetando el orden para identificar a la fase dispersa y fase dispersante. No se incluye la mezcla gas-gas porque estos se componen de moléculas individuales. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 59 TABLA 3.2 Clasificación de los coloides según el estado de agregación FASE DISPERSA Gas Líquido Sólido Gas Líquido Sólido Gas Líquido Sólido FASE DISPERSANTE Gas Gas Gas Líquido Líquido Líquido Sólido Sólido Sólido TIPO DE COLOIDE ................. Aerosol líquido Aerosol sólido Espuma Emulsión Sol y gel Espuma sólida Emulsión sólida Sol sólida EJEMPLO .................. Niebla Humo Espuma de cerveza Leche Pintura, jabón en agua Esponja, piedra pómez Mantequilla Porcelana Una de las formas prácticas que permite identificar a los coloides, es el hecho de aprovecha el efecto Tyndall, donde se refleja la luz mucho mas intensa en una suspensión que en un coloide, en una solución no hay dicho reflejo. 3.3 CLASIFICACIÓN SOLUCIONES L DE LAS as soluciones se pueden clasificar, atendiendo a 5 aspectos importantes: Haz de luz no visible Fuente luminosa A B C Haz de luz no visible 3.3.1 Según el número de componentes Soluciones binarias: de dos componentes Soluciones ternarias: de tres componentes Soluciones cuaternarias: de cuatro componentes 3.3.2 Según la naturaleza del disolvente Haz de luz visible Haz de luz visible Figura 3.2 Dispersión de un haz de luz por partículas coloidales conocido como efecto Tyndall. La presencia de partículas coloidales pueden detectarse con facilidad con ayuda de un haz de luz. A: Oro coloidal, una solución dorada B: Solución de NaCl C: Humo de tabaco, Un aerosol Soluciones acuosas: el disolvente es el agua Soluciones orgánicas: El disolvente puede ser: benceno, acetona, etc 3.3.3 Según la naturaleza del soluto Soluciones ácidas: presencia de sustancias ácidas: HCl, HNO3, etc. Soluciones básicas: presencia de sustancias básicas: NaOH, Ca(OH)2 Soluciones neutras: presencia de sales neutras: NaCl, KNO3, etc. 3.3.4 De acuerdo a la cantidad de sus componentes Soluciones diluidas: Cuando la masa del soluto es pequeña con respecto al volumen total de la solución. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 60 Soluciones concentradas: Es aquella donde la cantidad del soluto es grande respecto al volumen total de la solución. Soluciones saturadas: Es aquella solución que ha alcanzado su máxima concentración a una temperatura determinada, es decir que no admite mas soluto porque este comienza a precipitar. Soluciones sobresaturadas: Es cuando se disuelve mas soluto que la solución saturada debido a ciertos factores mecánicos, por ejemplo la agitación donde se encuentra en equilibrio inestable. 3.3.5 Según los estados de agregación de la materia Soluciones sólidas: Donde sus componentes se hallan en el estado sólido. Soluciones liquidas: Donde sus componentes están estado líquido. Soluciones gaseosas: Donde sus componentes están en estado gaseoso. Ejemplo 3.1.- Dar un ejemplo de una solución constituida por las siguientes fases a) gas-gas, b) líquido-gas, c) líquido-líquido, d) líquido-sólido, e) sólido-sólido. Solución: a) b) c) d) Gas- gas : Líquido – gas: Líquido – líquido: Líquido – sólido: e) Sólido-sólido: Aire (O2, CO2, etc en N2) Soda ( CO2 (g) en H2O ()) alcohol para fricciones (H2O () en i-C3H7OH ()) agua de mar (NaCl, LiCl, etc en H2O ()) “oro” de 14 quilates (Cu en Au) 3.4 SOLUBILIDAD L 3.4.1 Factores solubilidad que afectan la 200 Solubilidad en g soluto/100 g agua a solubilidad se define como la cantidad de una sustancia que se disuelve en una cantidad dada de disolvente (por ejemplo agua) a una temperatura dada para dar una solución saturada; es la concentración máxima posible. Por ejemplo, la sal de cocina tiene una solubilidad de 36 g por 100 g de agua; por lo tanto, al añadir 40 gramos de NaCl, quedaran 3 g de sal sin disolverse. KI 180 160 KNO3 140 120 100 80 60 40 20 KBr KCl NaCl K2SO4 L a solubilidad de un sólido es muy 10 20 30 40 50 60 70 80 90 100 Temperatura en grados Celcius sensible a los cambios de temperatura; pero los cambios ordinarios de presión no producen ninguna variación Figura 3.3 Efecto de la temperatura en las solubilidades de algunas significativa. La figura 3.3 muestra cómo sales. la temperatura afecta la solubilidad de algunos sólidos corrientes en agua, por ejemplo la sacarosa, el nitrato de amonio y el hidróxido de potasio ilustran muy bien este fenómeno; por el contrario, la solubilidad del COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 61 NaCl casi no se ve afectada por un cambio de temperatura. En algunos casos es posible lograr concentraciones superiores a las concentraciones de saturación, y entonces se tiene una solución sobresaturada. Una solución sobresaturada se puede producir enfriando una solución concentrada caliente. Los compuestos iónicos son solubles en agua, alcohol metílico y amoniaco líquido; e insolubles en octano, benceno y tetracloruro de carbono. Las moléculas de agua, alcohol metílico y amoniaco son polares; cada molécula posee centros positivos y negativos de carga H O O eléctrica como muestra la figura 3.4. Otros + + + líquidos polares también actúan eficientemente C H H H en la disolución de compuestos iónicos. Las AGUA H H moléculas de octano y benceno son no polares N (ver figura 3.5). Puesto que las ALCOHOL METILICO electronegatividades del carbono y del hidrógeno H H es muy pequeña, cualquier enlace entre estos dos H AMONIACO átomos es no polar. El enlace entre el cloro y el carbono sí es polar, como se puede deducir al Figura 3.4 estudiar las 2electronegatividades de la tabla 1.3 Algunas moléculas polares del capítulo 1 (página 20) Por regla general los líquidos no polares son ineficientes en la disolución de compuestos iónicos. También encontramos que un líquido polar disolverá otros compuestos polares. El amoniaco y el alcohol metílico se disuelven en agua. La sacarosa, sólido polar (no iónico), es soluble en agua y alcohol metílico, e insoluble en benceno, octano y tetracloruro de carbono. Los disolventes no polares disuelven compuestos no polares. Las grasas y aceites, hidrocarburos no polares, se disuelven en cualquiera de los tres solventes no polares que hemos discutido previamente, pero son virtualmente insolubles en los tres disolventes H Cl polares. La regla que se sigue en la elección de disolventes dice: “ sustancias similares C C disuelven sustancias similares”. Los H C C H disolventes polares disuelven compuestos H C C H Cl iónicos y polares; y los no polares disuelven Cl compuestos no polares. C Cl H 3.4.2 Solubilidad de los gases BENCENO TETRACLORURO DE CARBONO L os gases son muy poco solubles en agua y Figura 3.5 otros líquidos corrientes. La solubilidad de Algunas moléculas no polares un gas puede acrecentar aumentando la presión sobre el gas que se halla por encima de la solución. La solubilidad del oxígeno a diferentes presiones aparece en la tabla 4.3. Es obvio que al observar la última columna, que la solubilidad es directamente proporcional a la presión del gas. Este comportamiento es normal para soluciones de gases en líquidos. 2 La electronegatividad de un elemento mide la tendencia relativa del átomo a atraer los electrones hacia sí cuando se combina químicamente con otro átomo ( véase capítulo 1 ). COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 62 TABLA 3.3 Solubilidad del oxígeno en agua a 25 ºC P [mmHg] Solubilidad, [moles O2 m 10 6 constante por litro de H2O] P La solubilidad de los gases en los líquidos, al contrario de la de los sólidos o líquidos, disminuye a medida 175 0.000307 1.75 que aumenta la temperatura. Un 300 0.000500 1.67 químico pondrá a hervir una muestra 414 0.000688 1.66 610 0.00100 1.64 de agua para reducir la concentración 760 0.00128 1.68 de gases atmosféricos disueltos. Puesto que la solubilidad del oxígeno en agua se reduce considerablemente con el calor, al vaciar agua caliente en los ríos y lagos puede causar serio perjuicio a la vida acuática. TABLA 3.4: Efecto de la temperatura sobre la solubilidad de los gases en agua Gas 0 ºC 10 ºC 50 ºC 100 ºC H2 0.000960 0.000873 0.000717 0.000715 N2 0.00105 0.000830 0.000485 0.000423 O2 0.00212 0.00170 0.000933 0.000758 0.0533 0.0194 La solubilidad se expresa en moles del gas disueltas por litro de agua La presión del gas encima de la solución es 1 atm. El efecto de la temperatura sobre la solubilidad de los gases se muestra en la información de la tabla 3.4. La solubilidad del CO2 es mucho mayor que la de los otros tres gases, debido a que el CO2 reacciona con el agua para forma ácido carbónico: CO2 0.0765 CO2 + H2O H2CO3 3.5 EL PROCESO DE DISOLUCIÓN U na sustancia puede disolverse con o sin reacción química en el disolvente. El sodio metálico se disuelve en agua desprendiendo burbujas de hidrógeno y cantidades considerables de calor, se produce un cambio químico en el cual el H2 y el hidróxido de sodio iónico soluble, NaOH, son los productos, la ecuación iónica total será: 2Na(s) + 2H2O 2Na+(ac) + OH-(ac) + H2(g) (1) El cloruro de sodio sólido, por otra parte, se disuelve en agua sin evidencia de reacción química: NaCl(s) Na+(ac) + Cl-(ac) (2) Si la primera solución (1) se evapora a sequedad, se obtiene hidróxido de sodio sólido, NaOH, en lugar de sodio sólido metálico. Esto junto con los productos de burbujas de hidrógeno, indica que se efectúa una reacción con el disolvente. La evaporación de la solución de cloruro de sodio (2) permite obtener en NaCl original. La facilidad del proceso de disolución depende de dos factores: a) el cambio de energía (reacción exotérmica o endotérmica) y b) el cambio de desorden 3 (entropía) que acompaña al proceso, es decir el proceso de disolución procede hacia la disminución de la energía del sistema, lo cual corresponde a un proceso exotérmico y hacia un incremento de desorden del sistema. 3 Whitten Kennet W. define entropía como la medición del desorden de un sistema, mientras mayor sea el desorden de un sistema, mayor será su entropía. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 63 El primer factor que se refiere al cambio de energía se denomina calor de solución, Hsolución. En un líquido puro, las fuerzas intermoleculares se producen todas entre moléculas similares; al mezclar un líquido con un sólido, cada molécula experimenta fuerza procedente de otras moléculas o iones diferentes y también de moléculas similares. Las fuerzas relativas de estas interacciones ayudan a determinar el grado de solubilidad de un soluto en un disolvente. Las principales interacciones que afectan la disolución de un soluto en disolvente son: 1. Atracciones soluto-soluto 2. Atracciones disolvente-disolvente 3. Atracciones disolvente-soluto La disolución se favorece cuando el valor de los dos primeros incisos son relativamente pequeños y el del tercero es relativamente grande. Es preciso vencer las atracciones intermoleculares o interiónicas entre las partículas de soluto para que se disuelva, esta parte del proceso requiere consumo de energía. La separación de moléculas de disolvente también consume energía. Sin embargo, cuando las partículas de soluto y las moléculas del disolvente interaccionan en la solución se libera energía y el proceso de disolución es exotérmico. Muchos sólidos se disuelven en líquidos por procesos 4endotérmicos. La razón de que estos procesos se produzcan es que la endotermicidad es contrarrestada por un mayor incremento en el desorden del soluto que acompaña al proceso de disolución. Casi todos los procesos de disolución están acompañados de un incremento de desorden tanto en el disolvente como en el soluto. Por tanto, este factor de desorden suele ser favorable a la solubilidad. 3.6 UNIDADES DE CONCENTRACIÓN L a concentración de un soluto es la cantidad de soluto disuelto en una cantidad dada de disolvente o de solución. La cantidad de disolvente o de solución se puede expresar en términos de volumen o en términos de masa o de cantidad molar. Así, hay varias formas para expresar la concentración de una solución. La concentración de una solución suele expresarse como masa de soluto por unidad de volumen; pero es mas significativa expresarla en términos de número de moles por unidad de volumen. Los términos de concentración mas importantes utilizados por los químicos son: molaridad, molalidad, normalidad y fracción molar. 3.6.1 Molaridad L a concentración molar , o molaridad [M], se define como los moles de soluto disueltos en un litro de solución. Molaridad M moles de soluto litro de solución (3.1) 4 Proceso endotérmico es cuando en el proceso de disolución de un soluto, en el disolvente, éste absorbe energía del medio ambiente. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 64 Una solución acuosa de HCl que es 0.2 M, contiene 0.2 moles de HCl por litro de solución, en la práctica si se quiere preparar esta solución, se agrega a un matraz volumétrico aforado de 1.00 una cierta cantidad de agua por ejemplo ¼ , al cual añadimos 0.2 moles de HCl ( debe hacerse cálculos a partir de los datos que lleva la etiqueta del frasco). En seguida se llena el matraz con agua adicional a la marca hasta el cuello y se mezcla la solución. Ejemplo 3.2.- 0.25 g de una muestra de sulfato de cobre pentahidratado (CuSO45H2O) se coloca en un matraz aforado de 250 cc. El matraz se llena con agua hasta la marca en el cuello. ¿Cuál es la molaridad de la solución resultante? Solución.- Para determinar la molaridad, se necesitan los moles de soluto. Por consiguiente convertiremos los gramos de CuSO4.5H2O a moles: n 0.25 g CuSO4 5H 2 O 1 mol CuSO4 5H 2 O 0.1 mol CuSO4 5H 2 O 249.54 g El volumen de la solución es 0.25 litros, en consecuencia la molaridad es: Molaridad 0.1 mol CuSO4 5H 2 O 0.4 M 0.25 litros 3.6.2 Equivalente - gramo de ácidos y bases e define un equivalente – gramo de un ácido como el peso en gramos de éste que puede producir un mol de H+ y un equivalente – gramo de una base como el peso en gramos de ésta que pueda producir un mol de OH-. El peso equivalente o equivalente - gramo de un ácido se obtiene dividiendo su peso fórmula o peso molecular entre el número de hidrógenos ácidos que aporta una molécula del ácido. El peso equivalente o equivalente - gramo de una base se obtiene dividiendo su peso fórmula o peso molecular entre el número de iones hidróxido. A partir de definiciones anteriores, se ve que un equivalente gramo de cualquier ácido reacciona con un equivalente – gramo de cualquier base. S No es cierto que un mol de cualquier ácido reacciona con un mol de cualquier base en una reacción química específica. En consecuencia, según la definición de equivalentes, 1 eq-g ácido = 1 eq-g base. Por lo general, se puede escribir la siguiente expresión para todas las reacciones ácido base que llegan hasta el 5punto final. Eq de ácido = eq de base o meq de ácido = meq de base (3.2) Donde: meq = miliequivalentes, 1 eq = 1000 meq 3.6.3 Equivalente – gramo en reacciones Redox n reacciones de oxidación – reducción se debe recordar que un agente oxidante acepta electrones, y un agente reductor los produce. El principio de equivalente permite hacer cálculos estequiométricos en reacciones redox. El equivalente gramo del agente oxidante y del agente reductor es respectivamente: E 5 Punto final es el punto en el cual el indicador cambia de color y se define la titulación en una reacción de neutralización. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS Eq g (agente oxidante) Eq g (agente reductor) 65 peso molecular No. e ganados peso molecular No. e perdidos 3.6.4 Normalidad L a concentración normal , o normalidad [N], de una solución se define como el número de pesos equivalentes o simplemente equivalentes (eq) de soluto por litro de solución. Normalidad N Número de peso equivalent e de soluto o litro de solución No. de miliequivalente de soluto Normalidad N litro de solución (3.3) Ejemplo 3.3 ¿Cuál es la normalidad de una solución que contiene 10 g de H2SO4 en 500 ml de solución? Solución.- El número de moles de H2SO4 es: n 10 g H 2SO4 1 mol H 2SO4 0.102 mol H 2SO4 98 g H 2SO4 El volumen de la solución es 0.5 litros, en consecuencia la normalidad es: Normalidad 0.102 moles H 2 SO 4 2eq gH 2 SO4 0.408 N 0.5 litros 1molH 2 SO4 3.6.5 Molalidad L a concentración molal , o molalidad [m], se define como los moles de soluto disueltos en un kilogramo de disolvente. Molalidad m moles de soluto kg de disolvente (3.4) Ejemplo 3.4.- El tolueno, C6H5CH3, es un compuesto líquido similar al benceno, C6H6. Es la materia prima para otras sustancias, entre ellas el trinitrotolueno (TNT). Encuentre la molalidad del tolueno en una solución que contiene 5 g de tolueno en 25 g de benceno. Solución.- El número de moles de tolueno es: 5 g C6 H 5CH3 1 mol de C6 H 5CH3 0.0543 mol C6 H 5CH3 92 g C6 H 5CH3 La masa del benceno que constituye el disolvente es: 0.025 kg C6H6 molalidad 0.0543 mol C6 H 5CH3 mol soluto 2.172 2.172 molal 0.025 kg C6 H 6 kg solvente COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA 66 3.6.6 Formalidad SOLUCIONES Y PROPIEDADES COLIGATIVAS L a formalidad de una solución es el número de peso fórmula en gramos de soluto por litro de solución; el símbolo de esta unidad es F. La formalidad es muy similar a la molaridad, por ejemplo 1 formal que se simboliza 1F del ácido clorhídrico es igual a su peso fórmula, es decir 36.5 g HCl, por litro de disolución. 3.6.6 Fracción molar L a fracción molar de una sustancia A (A), componente de una solución se define como los moles de sustancia A divididos entre los moles totales de solución, esto es: A n moles de sustancia A A moles totales de la solución n t (3.5) 3.7 DILUCIÓN E n la práctica de laboratorio con frecuencia se usan soluciones concentradas de concentración conocida para preparar a partir de ellas soluciones diluidas. Por tanto, es importante ver cómo los cambios de volumen afectan la concentración de una solución. Cuando la concentración se expresa en una escala volumétrica, la cantidad de soluto contenido en un volumen determinado de la solución es igual al producto del volumen por la concentración, es decir: Cantidad de soluto disuelto = volumen concentración Cuando se diluye una solución, el volumen aumenta y la concentración disminuye, pero la cantidad total de soluto permanece constante. Por esta razón, dos soluciones de concentraciones diferentes pero que contengan las mismas cantidades de soluto, están relacionadas por la siguiente expresión: Volumen1 Concentración1 = Volumen2 Concentración2 V1 C1 = V2 C2 (3.6) Para reacciones de neutralización ácido – base la ecuación correspondiente y de mucha utilidad es: N1V1 = N2V2 (3.7) Donde N1 y N2 son concentraciones normales y V1 y V2 son los volúmenes requeridos para la neutralización de una base y una ácido. No obstante se usa también para diluciones. Ejemplo 3.4.- 0.25 de una solución contiene 75 g de NaCl por litro. a) ¿A qué volumen se debe diluir para obtener una solución de concentración 15 g de NaCl por litro?, b) ¿qué cantidad de agua se necesita para este propósito? Solución: a) Considerando la expresión (3.6) y despejando Volumen se tiene: V1 C1 = V2 C2 COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 67 V C 0.25 75 g/ V2 1 1 1.25 C2 15 g/ b) La cantidad de agua que se requiere para esta dilución es: (1.25 – 0.25) = 1 Ejemplo 3.5.- Calcule el volumen aproximado del agua que se debe agregar a 250 cm3 de una solución 1.25 N para preparar una solución de concentración 0.5 N (desprecie los cambios en volumen) Solución: Considerando la expresión (3.7) se puede determinar inicialmente el volumen de la nueva concentración y luego el volumen de agua requerido en la dilución de la concentración original. N1V1 = N2V2 V2 N1V1 1.25 N 250 cm 3 625 cm 3 N2 0.5 N La cantidad de agua es: (625 – 250) cm3 = 375 cm3 Ejemplo 3.6.- Si una solución se prepara a partir de 1 mol de etilenglicol y 9 mol de agua, los moles totales de la solución son 10 moles, en consecuencia la fracción molar del etilenglicol es: 1 mol etilenglicol 0.1 10 moles Recordemos que la suma de las fracciones de todos los componentes de una solución es igual a 1. n X i 1 (3.8) i 1 3.8 REACCIONES SOLUCIONES QUÍMICAS EN C omo es de conocimiento, se discutió el método para resolver problemas en que intervienen reacciones químicas, ahora estamos preparados para extender el método a reacciones en solución y poder efectuar cálculos estequiométricos a partir de un volumen de una concentración determinada a la cantidad de soluto presente. Algunas estrategias: La molaridad y la normalidad se calculan partiendo de la densidad y del porcentaje de composición de una solución. En soluciones diluidas la densidad de la solución es muy semejante a la densidad del disolvente puro. Para calcular la molalidad y fracción molar solo es necesario conocer el porcentaje de composición de la solución. Los problemas en esta reacción se basan en dos principios: El número de equivalentes de todas las especies en una reacción química es el mismo. Volumen normalidad = número de equivalentes COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 68 Ejemplo 3.7 ¿Cuántos mililitros de NaOH 4.0 N se necesitan para neutralizar 20 ml de HCl 3.0 N? Solución: Se puede usar el concepto de miliequivalentes, esto es: 4.0 N Si: N1 = 4.0 N N2 = 3.0 N V2 = 20 ml HCl V1 = ¿? V1 4.0 meq 3.0 meq y 3.0 N 3 cm cm 3 N 2 V2 3.0 20 ml 15 ml NaOH N1 4.0 Ejemplo 3.8.- ¿Cuántos gramos de NaOH se necesitan para neutralizar 90 ml de HCl 1.5 M? Solución: Para resolver el problema es conveniente transformar la concentración molar en normalidad, esto es, 1 eq-g HCl = 1 mol HCl En consecuencia: 1.5 moles HCl 1 eq g HCl 1.5 N 1 mol HCl Por tanto, en una reacción ácido base se tiene: No eq HCl = No eq NaOH 90 ml solución 1.5 meq HCl 135 meq HCl 135 meq NaOH 1 ml solución Por consiguiente la masa de NaOH requerida es: 135 meq NaOH 1 eq g NaOH 40 g NaOH 5.4 g NaOH 1000 meq NaOH 1 eq g NaOH Ejemplo 3.9.-Encuentre el peso equivalente de KMnO4 en la siguiente reacción: MnSO4 + KMnO4 + H2O MnO2 + H2SO4 + K2SO4 b) ¿Cuántos gramos de MnSO4 se oxidan con 50 cm3 de una solución de KMnO4 0.1 N? Solución: Para resolver el problema efectuaremos la igualación de la ecuación química. Mn+2 + SO4= + K+ + MnO4- + H2O0 MnO20 + 2H+ + SO4= + 2K+ + SO4= 3 e- + 4 H+ + MnO4- MnO20 + 2 H2O0 2 3 2 2 H2O0 + Mn+2 + 2 H2O + Mn+2 MnO4- MnO20 + 4 H+ + 2 e 5 MnO20 + 4 H+ La ecuación igualada es: 3 MnSO4 + 2 KMnO4 + 2 H2O 5 MnO2 + 2 H2SO4 + K2SO4 a) el peso equivalente del permanganato de potasio es: COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS eq g KMnO 4 69 158 g 52.67 g 3 b) La masa de sulfato manganoso requerido es: 50 cm 3 0.1 eq KMnO 4 1 mol KMnO 4 3 mol MnSO4 151 g MnSO4 0.3775 g MnSO4 3 eq KMnO 4 2 mol KMnO 4 1 mol MnSO4 1000 cm 3 3.9 PROPIEDADES COLIGATIVAS A lgunas propiedades físicas de las soluciones difieren mucho de las del disolvente puro. Por ejemplo, el agua pura se congela a 0 ºC, pero las soluciones acuosas se congelan a temperaturas menores. El etilenglicol se adiciona al agua de los radiadores de los automóviles, pues es un anticongelante ya que abate (disminuye) el punto de congelación de la solución; también eleva el punto de ebullición de la solución sobre la del agua pura, permitiendo que el motor funcione a una temperatura mas alta. Una solución, que conste de dos o mas componentes, carece de las propiedades físicas constantes de una sustancia pura; estas propiedades dependen de la concentración de las partículas del soluto y no de su naturaleza. Tales propiedades se conocen como propiedades coligativas y éstas son: el descenso de la presión de vapor; la depresión en el punto de congelación; la elevación en el punto de ebullición y la presión osmótica. Las propiedades coligativas se pueden usar en la determinación de los pesos moleculares de las sustancias disueltas y pueden dar además información acerca de las propiedades del soluto si se conocen las propiedades del disolvente. Todas las soluciones obedecen las leyes que se discuten en este capítulo , cuando la concentración es suficientemente baja. Por esta razón se les conoce como leyes de las soluciones diluidas. 3.9.1 Descenso de la presión de vapor y la ley de Rault M uchos experimentos han demostrado que las soluciones que contienen líquidos no volátiles o sólidos como solutos, siempre tienen presiones de vapor mas bajas que los disolventes puros. Fig. A Fig. B Fig. C FIGURA 3.6 La figura A muestra la presión de vapor del agua pura, la figura B el equilibrio de dos sistemas que contienen agua pura, en la figua C la presión manométrica (diferencia de altura) de los dos líquidos se debe al vapor de agua pura. Esta presión es menor sobre la solución azucarada, por que hay menos moléculas de agua por unidad de área de superficie al evaporarse. Cuando un soluto no volátil se disuelve en un líquido; parte del volumen total de la solución es ocupada por moléculas de soluto, y por lo tanto, hay menos moléculas de disolvente por unidad de área en la superficie. Esto ocasiona el descenso de presión de vapor del disolvente. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 70 El descenso de la presión de vapor asociados con solutos no volátiles y no ionizables se resume en la ley de Rault: “La presión de vapor de un disolvente en una solución es igual a la presión de vapor del disolvente puro multiplicada por la fracción molar del mismo en la disolución”. Matemáticamente se expresa: P = Xd.Pº (4.9) Donde: Xd, representa la fracción molar del disolvente en la solución, Pº es la presión de vapor del disolvente puro y P es la presión de vapor del disolvente en la solución. Esta ley permite calcular pesos moleculares. Ejemplo 3.10.- La presión de vapor del agua pura a 25 ºC es 23.76 mmHg y la presión de vapor de una mezcla formada por 5.4 g de soluto no volátil en 90 g de agua es 23.32 mmHg. Determinar el peso molecular de dicho soluto. Solución: De acuerdo a la ley de Rault: P = Xd.Pº Xd P P o 23.32 0.9815 23.76 Puesto que la fracción molar se define como: n moles de sustancia A A moles totales de la solución n t XA Se puede expresar en términos de sus pesos moleculares: 0.9815 reemplazando datos: md Md md m s Md Ms 90 g 18 0.9815 90 g 5.4 g 18 Ms despejando Ms: Ms= 57.3 g/mol Ejemplo 3.11.- Determine la presión de vapor a 25 ºC de una solución acuosa que consta de 10 g de sacarosa, C12H22O11 y 75 g de H2O. Solución: De acuerdo a la ley de Rault: P = Xd.Pº La fracción molar del disolvente es: Xd d md Md md m s Md Ms 4.17 0.993 4.17 0.0292 COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 71 Pv = 0.993 23.76 mmHg = 243.59 mmHg Por consiguiente La presión de vapor es: 3.9.2 La ley de Rault y las soluciones de solutos volátiles E n soluciones en las cuales tanto el disolvente como el soluto tienen una presión de vapor apreciable, se puede aplicar la ley de Rault a ambos componentes: Para lograr cierta comprensión de tales mezclas, considere una solución ideal que contiene dos componentes, A y B, según la ley de Rault: PA = XA.PAº y PB = XB.PBº La presión total del sistema es entonces, la suma de las presiones parciales de cada componente volátil: Ptotal = PA + PB = XA.PAº + XB.PBº (3.10) Ejemplo 3.12.- ¿Cuál es la presión de vapor que ejerce una mezcla formada por 100 gramos de benceno y 100 g de tolueno a 25 ºC? A dicha temperatura las presiones del vapor de benceno y tolueno puros son, respectivamente 95.1 y 28.4 mmHg. Solución: De acuerdo a la expresión (3.6) Ptotal = PC6H6 + PC7H8 P total = XC6H6* PC6H6º + XC7H8 * PC7H8º Las fracciones molares de las dos sustancias son: n 100 g 100 g 1.282 n tolueno 1.087 g g 78 92 mol mol n total 1.282 1.087 2.369 1.282 1.087 0.541 χ C7 H8 0.459 2.369 2.369 benceno χ C6 H 6 La presión de vapor será: Pt = 0.549* 95.1 mmHg + 0.459 * 28.4 mmHg Pt = 52.21 + 13.04 = 65.25 mmHg P = Xd.Pº La figura 3.8 muestra la ley de Rault aplicado a soluciones que tienen dos componentes volátiles. Este diagrama se cumple para: A PRESION DE VAPOR DEL DISOLVENTE Este diagrama se cumple para: PRESION DE VAPOR DEL DISOLVENTE Las soluciones pueden representarse gráficamente. La figura 3.7 muestra la ley de Rault para una solución ideal de un soluto en un líquido volátil. La presión de vapor que ejerce el líquido es III proporcional a su fracción molar en la solución. II Xdisolvente Figura 3.7 B I A Xdisolvente B Figura 3.8 COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 72 Ptotal = PA + PB = XA.PAº + XB.PBº En la figura 3.8 la línea (I) es la presión parcial de A y la línea (II) es la presión parcial de B y la línea (III) es la presión total para diferentes concentraciones de los dos líquidos volátiles. PRESION DE VAPOR DEL DISOLVENTE La figura 3.9 muestra una desviación negativa de la ley de Rault, Las fuerzas intermoleculares existentes en la solución son superiores a las fuerzas intermoleculares de los componentes puros aisladamente. A Xdisolvente B A Xdisolvente Figura 3.9 Figura 3.10 B La figura 3.10 muestra la presión de vapor superior a la presión predicha por la ley de Rault (desviación positiva). Las fuerzas intermoleculares existentes en la solución son más débiles que las de los componentes puros independientemente. 3.9.3 LEY DE HENRY E l efecto de la presión sobre la solubilidad de un gas en un líquido se puede predecir de manera cuantitativa. Para soluciones diluidas de un gas no reactivo en un líquido, puede aplicarse una expresión muy similar a la ley de Rault, conocida como la ley de Henry, cuya expresión matemática es: Pgas = KXgas (3.11) Donde Pgas es la presión del gas sobre la superficie de la solución y k es una constante para un gas y un disolvente determinados a una determinada dada. Xgas representa la fracción molar del gas disuelto; la relación es válida a bajas concentraciones y a bajas presiones. Ejemplo 3.13.- Si 29 mg de N2 se disuelven en un litro de agua a 0 ºC y 760 mmHg de presión de N2, ¿qué masa de N2 se disolverá en un litro de agua a 0 ºC y 5 atm de presión? Solución: De acuerdo con la ecuación (3.11), en principio se determinará la constante de Henry K, para luego determinar la masa de nitrógeno disuelto en las nuevas condiciones de presión y concentración. La fracción molar del gas es: 29 mg N 2 1 H 2 O 1g N2 1 mol N 2 1.036 10 3 mol N 2 1000 g N 2 28 g N 2 1000 ml 1 g 1 mol H 2 O 55.56 mol H 2 O 1 H 2 O 1 ml 18 g H 2 O χ N2 1.036 10 3 molN2 1.8646 10 5 55.561 COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 73 La constante de Henry será: K Pgas 1 atm 5.36310 4 χgas 1.8646 10 5 La masa de nitrógeno disuelta en 1 litro de agua a 5 atm será: χ N2 Pgas 5atm 9.323 10 5 4 K 5.363 10 1 litro de H2O = 55.56 mol N2 nN2 n N 2 n H 2O nN 2 n N 2 55.56 9.323 10 5 Resolviendo la ecuación se tiene: 5.18 10 3 mol N 2 28 g N 2 1000 mg N 2 145.04 mg N 2 1 mol N 2 1 g N2 3.9.4 Aumento del punto de ebullición R ecordemos que el punto de ebullición de un líquido es la temperatura a la cual la presión de vapor se iguala a la presión aplicada en su superficie, por ejemplo la temperatura de ebullición normal del agua sobre el nivel del mar es 100 ºC Se ha visto que la presión de vapor de un disolvente a una temperatura dada, desciende por la presencia de un soluto no volátil. Las soluciones de este tipo deben calentarse a temperaturas mas altas que el disolvente puro para que su presión de vapor iguale a la presión atmosférica. El incremento en el punto de ebullición, Te ( en relación al punto de ebullición del disolvente puro), es directamente proporcional al número de partículas de soluto por mol de disolvente. Sabemos que la molalidad expresa el número fijo de moles de disolvente. Así Te es proporcional a la molalidad, como se muestra en la siguiente expresión matemática: Te = Kem (3.12) Te = Tf(solución) – Tf(disolvente) Ejemplo 3.14.- Una disolución de glicocola preparada al disolver 1.62 g de sustancia en 19.62 g de agua, hierve a 100.6 ºC. Hallar el peso molecular de la glicocola. (Ke = 0.52 ºC/molal). Solución: Datos: Te = 100.6 ºC Ke = 0.52 ºC/molal De acuerdo a la relación (2.7) Te = Kem Se puede determinar la molalidad COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 74 m ΔTe (100.6 100)C 1.154 molal ke 0.52 C/ molal A partir de este dato se puede evaluar el número de moles de soluto: 1.154 moles de soluto 19.62 g de agua 0.0226 moles de soluto 1000 g de agua En consecuencia el peso molecular de soluto será: M ms 1.62 g 71.68 g/mol n s 0.0226 moles Para hallar el peso molecular se puede considerar un segundo método propuesto por el Prof. José Ibarz Aznárez, el cuál expresa: Si una disolución está constituida por a gramos de soluto y A g de disolvente, y el peso molecular del soluto es M, la molalidad de disolución es: m a 1000 AM (3.13) Considerando la expresión (3.8), y despejando M se tiene: M a 1000 1.62 1000 71.55 g/mol Am 19.62 1.154 3.9.5 Descenso del punto de congelación E n contraste con el punto de ebullición, el punto de congelación de una solución generalmente es mas bajo que el punto de congelación del solvente puro, como muestra la figura 3.6. La diferencia entre estas dos temperaturas se conoce como depresión en el punto de solidificación y se designa por Tc, y es proporcional a la concentración molal del soluto. Esta proporcionalidad, convertida en igualdad se puede expresar por medio de la siguiente ecuación: (3.14) Tc = Tf(disolvente) – Tf(solución) La figura 3.11 muestra como un soluto no volátil abate la presión de vapor de un disolvente, el punto de ebullición se eleva y el punto de congelación desciende con respecto a los puntos correspondientes en los disolventes puros. La magnitud de elevación del punto de ebullición Te es menor que la magnitud del abatimiento del punto de congelación Tc. Presión de vapor mmHg T c = K cm P Tc Te Temperatura ºC Figura 3.11 Diagrama de fase del H2O y de una solución acuosa COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 75 Ejemplo 3.15.- Se funde una mezcla de 0.436 g de acetanilida con 14.06 g de alcanfor de punto de fusión 176.2 ºC. La mezcla se deja solidificar y enfriar, se reduce a polvo, se mezcla íntimamente y se calienta. En el momento en que se termina de fundir su temperatura es de 167.0 ºC. Hallar el peso molecular de la acetanilida. (kcalcanfor = 40.0 ºC/molal) Solución: Los datos son los siguientes: Tc = 176.2 ºC kc = 40.0 ºC/molal De acuerdo a la relación (3.7) Tc = kcm Se puede determinar la molalidad: m ΔTc (176.2 167.0)C 0.23 molal kc 40.0 C/ molal A partir de este dato se puede evaluar el número de moles de soluto: moles de soluto 14.06 g de alcanfor 1000 g de alcanfor n 0.00323 moles de soluto n 0.23 En consecuencia el peso molecular de soluto será: M ms 0.436 g 134.98 g/mol n s 0.00323 moles Para hallar el peso molecular se puede considerar la expresión (3.8), y despejando M se tiene: M a 1000 1.62 1000 71.55 g/mol A m 19.62 1.154 TABLA 3.2 Algunas propiedades de disolventes comunes PUNTO DE ke PUNTO SOLVENTE EBULLICION [ºC/m] FUSION [ºC] [ºC] H2O 100.00 0.52 0.0 C6H6 80.10 2.53 5.50 CCl4 76.80 5.02 -22.3 C2H5OH 78.40 1.22 -114.6 ClCHO 61.20 3.63 -63.50 kc [ºC/m] 1.86 5.12 29.80 1.99 4.68 3.9.6 Aplicaciones del aumento y descenso del punto de ebullición y fusión respectivamente COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 76 Ejemplo 3.16.- El punto de ebullición de una solución de 0.402 g de naftaleno, en 26.6 g de cloroformo, es 0.455 ºC mas alto que el del cloroformo puro. ¿Cuál es la constante ebulloscópica del cloroformo? Te = Kem, se puede despejar Ke, puesto que Te Solución: A partir de la expresión (2.6) = 0.455° y la molalidad es: m 0.402 g C10H8 1000 g CHCl3 1 mol C10H8 m 0.118 molal 26.6 g CHCl3 1 kg CHCl3 128 g C10H8 Ke ΔTe 0.455 C 3.86 C/molal m 0.118 m Ejemplo 3.17.- La presión de vapor de una solución acuosa diluida es 23.45 torr a 25 ºC, mientras que la presión de vapor del agua pura a la misma temperatura es 23.76 torr. Calcúlese la concentración molal del soluto, y utilícense los valores tabulados de K e del agua para predecir el punto de ebullición de la solución. Solución: Puesto que la concentración molal se define como: Molalidad m moles de soluto kg de disolvente se puede considerar la masa del disolvente como 1 kg = 1000 g H2O. De acuerdo a la ley de Rault: P = Xd.Pº Xd P P o 23.45 0.987 23.76 Puesto que la fracción molar se define como: XA n moles de sustancia A A moles totales de la solución n t Se puede expresar en términos de sus pesos moleculares: 0.987 md Md md m s Md Ms reemplazando datos: 1000 g 18 0.987 1000 g ns 18 El número de moles del soluto, despejando de la anterior expresión es en consecuencia: ns = 0.727 mol COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 77 y la molalidad será: m 0.727 mol de soluto 0.727 molal 1 kg de agua El punto de ebullición de la solución es: De acuerdo a la relación (3.7) Te = Kem Te = 0.52 °C/m 0.727 m = 0.38 °C La temperatura de ebullición de la solución es: Te = (100 + 0.38) °C = 100.38 °C 3.10 OSMOSIS Y PRESIÓN OSMÓTICA L a osmosis es el proceso espontáneo por el cual las moléculas del disolvente atraviesan una membrana semipermeable de una solución de menor concentración de soluto hacia una solución con mayor concentración de mayor soluto Para definir la presión osmótica es conveniente considerar el sistema de la figura 2.12. El cual muestra un experimento en una cámara de presión osmótica. Solución de azúcar Agua Membrana Figura 3.12 Rebalse de la solución Figura 3.13 Las moléculas de agua atraviesan la membrana Las moléculas de azúcar no pueden atravesar la membrana Figura 3.14 H = = gh Disolvente puro (Agua) Figura 3.12 - 3.14 Experimento de ósmosis. El agua pasa a través de la membrana a la solución de azúcar en el compartimiento del sistema. El flujo de agua cesa cuando el líquido en el embudo ejerce hacia abajo una presión suficiente (la presión osmótica). a) La figura 3.12 muestra el inicio de la determinación de la presión osmótica, los niveles de solución del lado izquierdo y del disolvente del lado derecho son iguales. b) Después del inicio del experimento, las moléculas del disolvente tienden a fluir hacia la solución, entonces observamos rebalse de la solución como era de esperarse, como muestra la figura 3.13. c) Para evitar el rebalse instalemos un tubo en la cámara de la disolución; durante cierto tiempo de iniciado el experimento, el flujo de la moléculas hacia la solución cesa y el sistema alcanza el equilibrio cuando el menisco se ha elevado hasta una determinada altura, como se puede observar en la figura 3.14. En estas condiciones de equilibrio, la solución se encuentra COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 78 bajo una presión hidrostática mayor que el disolvente puro. La altura del menisco multiplicada por la densidad de la solución y la aceleración de la gravedad, dá la presión adicional sobre la solución y ésta es la presión osmótica . Por la medición experimental realizada en soluciones diluidas de concentración conocida, se sabe que la relación entre la presión osmótica y la concentración está dada simplemente por: = cRT (3.15) Donde c es la concentración de la disolución en moles/litro, R es la constante universal de los gases y T es la temperatura absoluta. La presión osmótica es proporcional a la temperatura absoluta porque afecta el número de colisiones del disolvente con la membrana por unidad de tiempo, también es proporcional a la concentración molar, ya que ésta afecta a la diferencia en el número de moléculas del disolvente que chocan contra la membrana de cada lado. Ejemplo 3.18.- Estime el peso molecular de una macromolécula biológica si se disuelve una muestra de 0.194 gramos en 82.4 ml de benceno y se observa una presión osmótica de 14.20 torr a 25 °C. Solución: De la ecuación (3.15) = cRT: c π 14.20 mmHg mol 7.64 10 4 RT 62.4 mmHg 298K K mol Considerando que el volumen de la solución es 82.4 ml, se puede determinar el número de moles de la macromolécula biológica: 7 10 4 mol 0.0824 5.768 105 mol El peso molecular de dicha sustancia biológica es: M m 0.194g g 3363.38 n 5.768x105 mol 3.10.1 Ósmosis Inversa l6 proceso de ósmosis inversa se ha aplicado al problema de la purificación del agua, en particular el método se ha utilizado para desalar el agua del océano (esto es para eliminar lar sales del agua de mar y obtener agua que se pueda beber o que sea industrialmente utilizable). En la ósmosis normal, el disolvente fluye a través de una membrana de una solución diluida a una solución mas concentrada, el proceso de ósmosis se puede detener. E Figura 3.15 Sistema de desalación que utiliza la ósmosis inversa. Cuando el agua del océano se somete a una presión mayor que su presión osmótica, el agua pura pasa a través de una serie de membranas y dejan detrás una solución de sal más concentrada. Si se aplica una presión aún mayor, el proceso osmótico puede ser invertido, entonces el disolvente fluye de la solución concentrada (que pueda ser agua del océano), a través de una membrana, a una solución más diluida (que pueda ser agua mas o menos pura). En la figura 3.15 se presenta un sistema que utiliza ósmosis inversa para desalar el agua del océano. 6 COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 79 3.11 Propiedades Coligativas de las Soluciones Ionicas P ara explicar las propiedades coligativas de las soluciones iónicas, debe aceptarse que la concentración total de iones, es mas importante que la concentración de una sustancia iónica. Por ejemplo, la depresión de congelación de una solución 0.100 m de cloruro de sodio es casi el doble del de una solución 0.100 m de glucosa. Puede explicarse esto diciendo que el cloruro de sodio se disuelve en agua para formar los iones Na+ y Cl-. Cada unidad fórmula de NaCl da dos partículas. Para cada propiedad coligativa de las soluciones iónicas se pueden considerar tres valores: el valor calculado Tm, suponiendo el compuesto formado por moléculas; el valor real, T, bastante mayor, encontrado experimentalmente; y el valor ideal Ti, mayor todavía, que puede también calcularse al suponer el compuesto formado por iones que se comportasen en la disolución como si fueran partículas neutras.. 3.11.1 Factor de van’t Hoff La relación: i ΔT ΔTm (3.16) donde i es mayor a la unidad, se conoce como factor de van’Hoff. Cuando se suponía que los electrolitos estaban constituidos por moléculas se aceptó que una fracción de las mismas se disociaba en iones y que se establecía un equilibrio entre las moléculas sin disociar y los iones formados. La fracción de las moléculas ionizadas o disociadas se denomina grado de disociación. Para los electrolitos fuertes se establece actualmente la relación: ΔT g ΔTi (3.17) donde g es menor que la unidad y que se conoce como coeficiente osmótico. Cuanto mas se acerca a la unidad el valor de g mayor es el comportamiento ideal de los iones en la disolución iónica. Si una supuesta molécula del electrolito se disocia en iones, es evidente que: Ti = Tm , y por tanto; g i (3.18) En el caso de los electrolitos débiles, si es el grado de ionización, y una molécula forma realmente iones, 1 mol del electrolito dará lugar a moles y quedaran sin ionizar ( 1 - ) moles, por lo cual, en vez de un mol de compuesto tendremos: [1+( - 1)] moles de partículas, y puesto que cualquier propiedad coligativa es i veces mayor que el valor teórico correspondiente al numero de moléculas o moles disueltos, tendremos COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA 80 SOLUCIONES Y PROPIEDADES COLIGATIVAS i = 1 + ( - 1) (3.19) i 1 1 (3.20) y α Esta expresión se aplica también corrientemente a los electrolitos fuertes, aunque ya se ha indicado que es incorrecto hablar en ellos de grado de disociación. Para no romper con esta costumbre nos referiremos nosotros a un grado de disociación aparente para explicar el comportamiento de los electrolitos fuertes. El factor de van’t Hoff i para soluciones iónicas en las expresiones de las propiedades coligativas se puede escribir: Descenso de la presión de vapor P P md Md (3.21) md ms i Ms Ms Aumento del punto de ebullición Te = iKem (3.22) Tc = iKcm (3.23) = icRT (3.24) Descenso del punto de fusión Presión osmótica Ejemplo 3.19.- A 100 °C la presión de vapor de una disolución de 10.0 g de nitrato cálcico en 150 g de agua es de 746.8 mmHg. Hallar el grado de disociación aparente del nitrato cálcico en esta disolución. Solución: Para hallar el grado de disociación aparente (véase ecuación 3.15) del nitrato cálcico (electrolito fuerte) debemos determinar el coeficiente de van’t Hoff a partir de la ecuación (3.16) y el número de iones Ca(NO3)2 = [ Ca++ + 2NO3-] =3 Así que, de la ecuación (3.16): P P md Md md ms i Ms Ms reemplazando datos: 150 18 746.8 760 150 10 i 18 164 efectuando operaciones con una máquina electrónica: 0.982 8.33 8.33 0.0608 i COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 81 i = 2.42 Aplicando la expresión (3.15) i 1 2.42 1 0.71 1 3 1 Ejemplo 3.20.- Una disolución 0.065 molal de cloruro cálcico empieza a congelar a – 0.322 °C, hallar: a) el grado de disociación del cloruro cálcico y b) la concentración de los iones cloruro y de los iones calcio en la disolución. Suponer la densidad de la disolución igual a la unidad. Kc(H2O = 1.86 °C/mol) Solución: a) Para hallar el grado de disociación haremos uso de la ecuación (2.15), sin embargo es preciso evaluar i y . El cloruro de calcio se disocia: CaCl2 = [ Ca++ + 2Cl- ] =3 De la ecuación (3.18) Tc = iKcm: Despejamos i: i ΔTc [ 0 (0.322) ] 2.66 Kc m 1.86 0.065 Por consiguiente 2.66 1 100 0.83 3 1 b) Para hallar la concentración molar de los iones, determinaremos en primera instancia la concentración del cloruro de calcio: La masa total de la solución se puede calcular: 0.065 mol CaCl2 111 g CaCl2 7.215 g CaCl2 1000 g H 2O 1 mol CaCl2 1000 g H 2O Es decir la masa de la solución es: msolución = 1000 g puesto que la densidad es 1.0 g/ml El volumen de la solución es: V = 1000 ml = 1.000 La concentración molar de la solución iónica de CaCl2 es: M 0.065 mol de CaCl2 0.065 molar 1.000 y las concentraciones de los iones determinamos a partir de : 0.065 0.83 = 0.0540 CaCl2 = 1 mol Ca++ + 2Cl1 mol 2 mol [ Ca++ ]= 0.0540 molar, la relación es 1:1 COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 82 [ Cl ] = 2 ( 0.0540) = 0.108 molar la relación es 1:2 PROBLEMAS RESUELTOS 3.1 Una solución de ácido sulfúrico tiene densidad de 1.84 g/ml y contiene 98% en masa de H2SO4. ¿Qué volumen ocuparán 200 g de H2SO4 puro? Solución: Se puede considerar los conceptos básicos de factores de conversión: 200 g H 2SO4 100 g de solución 1 cm 3 de solución 110.91 cm 3 de solución 98 g H 2SO4 1.84 g de solución 110.91cm 3 VH 2 O VH 2SO 4 (1) El volumen de agua es: 200 g H 2SO4 2 g de H 2 O 1 cm 3 H 2 O 100 g de solución 4.082 cm 3 H 2 O 98 g H 2SO4 100 g de solución 1 g H 2 O En consecuencia, considerando la ecuación (1), el volumen de H2SO4 puro es: VH 2SO 4 110.91 4.082 106.82cm 3H 2SO4 3.2 Calcule la molalidad, fracciones molares de soluto y disolvente, y la molaridad de las siguientes soluciones: a) una solución acuosa de H2SO4 que es 50 % en masa y tiene una densidad de 1.4 g/ml, b) una solución acuosa de sacarosa, C12H22O11, que es 19 por ciento sacarosa en masa, y tiene una densidad de 1.08 g/ml, y c) una solución compuesta de 24.4 g de NaOH y 97.6 de H2O con un volumen de 100 ml. Solución: a) La molalidad de la solución de H2SO4 se puede determinar a partir de la composición centesimal, vale decir: m 50 g H 2SO4 1000 g H 2O 1 mol H 2SO4 m 10.2 molal 50 g H 2O 1 kg H 2O 98 g H 2SO4 La fracción molar se determina calculando previamente los moles del soluto y disolvente: 50 g H 2SO4 50 g H 2O 1 mol H 2SO4 0.510 mol H 2SO4 98 g H 2SO4 1 mol H 2O 2.78 mol H 2 O 18 g H 2 O La fracción molar será entonces : 0.510 0.155 3.290 1 0.155 0.845 X H 2SO 4 X H 2O La molaridad se calcula considerando la densidad de la solución COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS M 1.4 83 g Solución 50 g H 2SO4 1 mol H 2SO4 1000 mlSol. 7.14 molar ml Solución 100 g Solución 98 g H 2SO4 1 Solución b) La molalidad de la solución de C12H22O11, se puede determinar a partir de la composición centesimal, vale decir: m 19 g C12 H 22O11 1000 g H 2O 1 mol C12 H 22O11 0.6859 molal 81 g H 2O 1 kg H 2O 342 g C12 H 22O11 La fracción molar se determina calculando previamente los moles del soluto y disolvente: n C12H 22O11 19 g C12H 22O11 81 g H 2O 1 mol C12H 22O11 n C12H 22O11 0.0555 mol C12H 22O11 342 g C12H 22O11 1 mol H 2O 4.50 mol H 2O 18 g H 2O La fracción molar será entonces : 0.0555 0.012 4.5555 1 0.012 0.988 X C12H 22O11 XH 2O La molaridad se calcula considerando la densidad de la solución M 1.08 g Solución 19gC12 H 22 O11 1 mol C12 H 22 O11 ml Solución 100 g Solución 342 g C12 H 22 O11 1000 ml Solución 0.6 molar 1 Solución 3.3 Una solución acuosa de cloruro de sodio que contiene 8.00 g de NaCl por 100 g de solución posee una densidad de 1.054 g/ml a la temperatura de 25ºC. Determine: a) la concentración molar y b) la concentración molal de la solución. Solución: a) 8 g NaCl/100 g sol. Molaridad = Nº moles de soluto 1 litro de solución = 1.054 g/ml moles de soluto : n= m 8g 0.137 mol NaCl M 58.5 g/mol -Cálculo del volumen en litros de solución: V 100 g 1 ml de solución 94.88 ml 1.054 g V= 0.0949 litros Molaridad : COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 84 M b) 0.137 mol NaCl 1.44 molar 0.0949 Molalidad = Nº de moles de soluto kg de solvente Cálculo de la masa en kilogramos de solvente Masa del solvente = masa (solución) - masa (soluto) = 100 g - 8 g = 92 g de solvente Kg de solvente = 92g = 0.092 Kg 0.137 mol de soluto 1.49 molal 0.092 kg de solvente Molalidad = 3.4 Se prepara 1.5 litros de una solución de H2O y C2H5OH, cuya densidad relativa resulta 0.947 en una proporción volumétrica de 3:1 respectivamente. Determinar: a) La densidad del alcohol etílico. b) La fracción molar del alcohol etílico. c) La molaridad. d) La molalidad. Solución: Datos: Vsolución = 1.5 solución = 0.947 kg/ %VH2O = 75% %VC2H5OH = 25% a) VH2O = 1.5 0.75 = 1.125 VC2H5OH = 1.5 0.25 = 0.375 ρ sol msol ρ sol Vsol 0.947 msol Vsol kg 1.5 msol 1.4205 kg En consecuencia la masa del alcohol etílico es: mC2H5OH = msol – mH2O mC2H5OH =1.4305 – 1.125 = 0.2955 kg mC2H5OH = 295.5 g La densidad del alcohol etílico es: m 295.5g 0.788g/ml V 375ml n C H OH χ C 2 H 5 OH 2 5 nT ρ b) n C 2 H 5 OH n H 2O 295.5 g 6.424 mol g 46 mol 1125 g 62.5 mol g 18 mol nT = 6.424+62.5= 68.924 mol C2 H 5OH 6.424mol 0.093 68.924mol COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS c) M d) m 85 n soluto 6.424 C 2 H 5OHmol 4.28 molar solución 1.5 solución n soluto kg dilsolvente 6.424 molC2 H 5OH 5.71 molal 1.125 kg H 2 O 3.5 ( 20 puntos, 20 min) La densidad relativa de una disolución acuosa de cloruro de potasio que contiene 24.6 g KCl es de 1.131 a 21 ºC, mientras que la densidad relativa del cloruro de potasio sólido, a la misma temperatura es 1.984. Calcular: a) la molaridad, b) la normalidad, c) la molalidad, d) la fracción molar, y e) el tanto por ciento en volumen. (K = 39; Cl = 35.5) Solución: Datos: Solución= 1.131 g/ml; mKCl = 24.6 g KCl= 1.984 g/ml; mH2O = x mtotal m KCl m H 2O solución Vtotal V KCl V H 2O H2O= 1.0 g/ml; mH2O = VH2O m 24.6 g V KCl KCl 12.40ml KCl 1.984 (2) (1) (3) Reemplazando en (1) 1.131 24.6 g m H 2O 12.4 m H 2O mH2O = 80.76 g VH2O = 80.76 ml Volumen total: Vsolución = 12.4 ml + 80.76 ml = 93.16 ml a) la molaridad es: 24.6 gKCl 1000ml 1molKCl 3.54molar 93.16ml 1 74.5 gKCl b) La normalidad es: 24.6 gKCl 1000ml 1molKCl 1eq gKCl 3.54normal 93.16ml 1 74.5 gKCl 1molKCl c) La molalidad: 24.6 gKCl 1000 gH 2O 1molKCl 4.09molal 80.76 gH 2O 1KgH 2O 74.5 gKCl d) La fracción molar: 24.6 gKCl 1molKCl 0.33molKCl 74.5 gKCl X KCl e) El % en volumen: 0.33 0.068 4.82 %V KCl 80.76 gH 2 O X H 2O 12.4ml 1molH 2 O 18 gH 2 O 4.49molH 2 O 4.49 0.932 4.82 100% 13.31% 93.16ml COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 86 3.6.- Determinar: a) la concentración molal, b) la fracción molar y la molaridad de una solución de ácido sulfúrico del 50% en masa y cuya densidad es 1.4 g/ml. Solución: a) La molalidad de la solución de H2SO4 se puede determinar a partir de la composición centesimal, vale decir: m 50 g H 2SO4 1000 g H 2O 1 mol H 2SO4 10.2 molal 50 g H 2O 1 kg H 2O 98 g H 2SO4 La fracción molar se determina calculando previamente los moles del soluto y disolvente: 50 g H 2SO4 50 g H 2O 1 mol H 2SO4 0.510 mol H 2SO4 98 g H 2SO4 1 mol H 2O 2.78 mol H 2 O 18 g H 2 O La fracción molar será entonces : 0.510 0.155 3.290 1 0.155 0.845 X H 2SO 4 X H 2O La molaridad se calcula considerando la densidad de la solución M 1.4 50 g H 2SO4 1 mol H 2SO4 1000 ml Solución g Solución 7.14 molar ml Solución 100 g Solución 98 g H 2SO4 1 Solución 3.7 A 100 ml de una disolución de ácido sulfúrico del 96% en masa y de densidad relativa 1.84, se añadieron 400 ml de agua, obteniéndose una solución de peso específico relativo igual a 1.22. En la solución resultante determinar: a) la concentración en tanto por ciento en masa. b) La concentración molar c) La concentración molal d) La normalidad e) La fracción molar Solución: El lector debe hacer énfasis en esquemas de manera que le permitan ver objetivamente el problema: H2O V = 100 ml 96%H2SO4 = 1.84 V = ¿? %H2SO4 =¿? = 1.22 A 100 ml de una solución de ácido sulfúrico se añade 400 ml de agua, a esta operación se denomina dilución, que obviamente modificará la concentración y la densidad de la solución. Para resolver el problema calcularemos el volumen de agua de la solución original para luego sumar a los 400 ml de agua que se añadieron, a partir de este dato la masa de agua de modo COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 87 que sumados a la masa de ácido sulfúrico puro y considerando la densidad de la solución resultante se podrá determinar el volumen de la solución resultante. Determinación de la masa de H2O y H2SO4 de la solución original 1.84 g de sol. 184 g de solución 1 ml de sol. 96 g H 2SO4 184 g de solución 176.64 g H 2SO4 100g de solución m agua 184 g 176.64 g 7.36 g H 2 O 100 ml de sol. la masa de agua en la solución resultante será: mH2O = (7.36 + 400) g = 407.36 g H2O De acuerdo a algunas estrategias recomendadas en el presente texto es fundamental conocer la concentración de la solución resultante en tanto por ciento: a) El tanto por ciento del ácido sulfúrico se determina a partir de: m H2SO4 = 176.64 g m H2O = 407.36 g La masa total es: (176.64 + 407.36) g = 584 g %H 2SO4 176.64 100% 43.36% 407.36 b) La concentración molar se determina conociendo la densidad de la solución y la concentración en tanto por ciento en masa de ácido sulfúrico: M 1.22 g solución 1000 ml solución 43.36 g H 2SO4 1 mol H 2SO4 ml solución 1 de solución 100 g solución 98 g H 2SO4 M 5.398 molar c) Determinación de la molalidad: Sólo se considera la concentración en tanto por ciento en masa: Masa de H2SO4 = 43.36 g Masa de H2O = (100 - 43.36) g = 56.64 g En consecuencia: molalidad 43.36 g H 2SO4 1000 g H 2O 1 mol H 2SO4 7.811 molal 56.64 g H 2O 1 kg H 2O 98 g H 2SO4 d) Determinación de la normalidad: Se puede calcular a partir de la molaridad considerando que en esta solución: COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA 88 SOLUCIONES Y PROPIEDADES COLIGATIVAS 1 mol H 2SO4 2 2 eq g H 2SO4 1 mol H 2SO4 1 eq g H 2SO4 Por tanto: 5.398 moles H 2SO4 2 eq g H 2SO4 10.796 N 1 solución 1 mol H 2SO4 d) Determinación de la fracción molar: Para calcular la fracción molar requerimos los moles del soluto y del disolvente: nH 2SO4 176.64 g H 2SO4 nH 2O 407.36 g H 2O 1 mol H 2SO4 1.802 mol 98 g H 2SO4 1 mol H 2O 22.63 mol 18 g H 2O Las fracciones molares son: 1.80 0.07 24.43 22.63 χ H 2O 0.93 24.43 χ H 2 SO 4 3.8 Una instalación de cámaras de plomo suministra diariamente 12 m3 de ácido de cámara de densidad relativa 1.49 y de una concentración del 60% en masa. Si se desea preparar un ácido concentrado del 98% a) ¿Qué cantidad de agua se debe evaporar diariamente? b) Calcular la normalidad, molaridad y la molalidad del ácido de cámara. Solución: El ácido de cámara del que se habla no es más que el ácido sulfúrico. a) Efectuaremos un balance másico sin reacción química puesto que se trata de un proceso físico, donde la masa de la solución mA de ácido de cámara es: m A 12 m3 1.49 t m3 17.88 t 7 Asumiremos como base de cálculo 17.88 t por día. Ácido de cámara (60%) H2SO4 A Q B C Q Q Agua evaporada (0%) H2SO4 Ácido resultante ( 98%) H2SO4 7 5 Fuente: Viceministerio de Industria y comercio interno. De acuerdo al Sistema Internacional de unidades el símbolo de tonelada métrica es t COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS mA = mB + mC (1) amA = bmB + cmC (2) 89 En la ecuación (2) b = 0, por tanto la masa la masa del ácido resultante mc es: mc am a 60 17.88 t 10.947 t c 98 De la ecuación (1) despejamos la masa de agua: mB = mA - mC mB = 17.880 - 10.947 = 6.933 t H2O Puesto que la densidad del agua es 1 t/m3 El volumen de agua que se evapora diariamente es de 6.933 m3 b) La concentración molar del ácido de cámara se puede determinar a partir de su densidad y tanto por ciento en peso. M 1.49 g solución 1000 ml solución 60.00 g H 2SO4 1 mol H 2SO4 9.12 molar ml solución 1 de solución 100 g solución 98 g H 2SO4 La normalidad se puede calcular a partir de la molaridad considerando que en esta solución: 1 mol H 2SO4 2 2 eq g H 2SO4 1 mol H 2SO4 1 eq g H 2SO4 Por tanto: 9.12 moles H 2SO4 2 eq g H 2SO4 18.24 N 1 solución 1 mol H 2SO4 Para determinar la molalidad sólo se considera la concentración en tanto por ciento en masa: masa de H2SO4 = 60.0 g masa de H2O = (100 – 60.0) g = 40.0 g En consecuencia: molalidad 60.0 g H 2SO4 1000 g H 2O 1 mol H 2SO4 15.31 molal 40.0 g H 2O 1 kg H 2O 98 g H 2SO4 3.9 Una disolución de hidróxido ferroso a 25 ºC de temperatura tiene una solubilidad de 1.78 g/100g H2O. Determinar: a) la molaridad, b) la normalidad, c) la molalidad y la fracción molar del soluto suponiendo solución ideal. Solución: a) Cuando la solución es ideal la densidad de la solución tiende a ser la densidad del agua, sin embargo la masa total de la solución se debe considerar: COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA 90 SOLUCIONES Y PROPIEDADES COLIGATIVAS (100 g + 1.78g) = 101.78 g 1.78 g Fe(OH) 2 1 mol Fe(OH) 2 1 g solución 1 000 cm 3solución 0.194 molar 101.78 g solución 90 g Fe(OH) 2 1 cm 3 solución 1 litro de solución b) Para determinar la normalidad de la solución, hallamos la relación de moles y equivalentes gramo del soluto: 1 mol Fe(OH) 2 2 2 eq g Fe(OH) 2 1 mol Fe(OH) 2 1 eq g Fe(OH) 2 0.194 mol (FeOH) 2 2 eq g Fe(OH) 2 0.388 N 1 de solución 1 mol Fe(OH) 2 c) A partir de la solubilidad es posible calcular la molalidad: 1.78 g Fe(OH) 2 1 mol Fe(OH) 2 1 000 g agua 0.198 molal 100 g de agua 90 g Fe(OH) 2 1 kg de agua a) Las fracciones molares serán: 1.78 g Fe(OH) 2 0.0198 mol 90 g/mol 100 g H 2 O 5.56 mol 18 g/mol n Fe(OH) 2 n H 2O Fe(OH) 2 0.0198 0.0035 5.5798 3.10 Se tiene una solución de dicromáto de potasio al 1%, considerando solución ideal, calcular el volumen de esta solución que se necesita para preparar 250 cm3 de solución 0.1 normal de dicromato al actuar como oxidante. Solución: Para resolver éste problema se debe tomar en cuenta que el dicromáto actúa como oxidante, esto implica tener cuidado en el cálculo del equivalente gramo ya que se trata de una reacción de oxidación y reducción. El dicromáto de potasio al entrar en contacto con el agua se disocia según: K2Cr2O7= = 2 K+ + Cr2O7= En solución el dicromáto se reduce de acuerdo a: 6e- + 14H+ + Cr2O7= 2Cr+3 + 7H2O0 En consecuencia el equivalente gramo del dicromáto de potasio es: 1 mol K 2Cr2O7 6 6 eq g K 2Cr2O7 1 mol K 2Cr2O7 eq g K 2Cr2O7 COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 91 1 g K 2 Cr2 O 7 1 mol K 2Cr2 O 7 6 eq gK 2 Cr2O 7 1 g de solución 100 g de solución 294 g K 2 Cr2O 7 1 mol K 2Cr2 O 7 1 cm 3 de solución 1000 cm 3 de solución 0.204 N 1 litro de solución Al igualar los equivalentes de las dos soluciones se tiene: N1V1 N 2 V2 V2 250 cm 3 0.1 N 122.55 cm 3 0.204 N 3.11 Se queman 80 litros de fosfamina medidos a 18 °C y 756 mmHg. El ácido fosfórico formado se disuelve en agua y se obtiene un litro de disolución. Calcular la normalidad de la disolución ácida. Solución: El proceso de formación de una disolución de H3PO4 viene a partir de la siguiente ecuación química: PH3 + 2O2 H3PO4 A partir de esta ecuación química se calcula estequiométricamente la cantidad de sustancia de H3PO4 Considerando la ecuación de estado: PV = nRT se tiene: 756 mmHg 80 3.33 mol NH 3 mmHg 62.4 291 K K mol 1 mol H 3PO4 3.33 mol NH 3 3.33 mol H 3PO4 1 mol PH3 n PV RT La relación entre moles del ácido y los eq-g se obtiene: 1 mol H 3PO4 3 3eq g H 3PO4 1 mol H 3PO4 1eq g H 3PO4 La normalidad de la solución ácida será: N 3.33 mol H3PO4 3 Eq g H3PO4 10 N 1 litro de solución 1 mol H3PO4 3.12 Calcular el número de gramos de sulfato ferroso que se oxidarán en una disolución de esta sal acidificada con ácido sulfúrico, con 24 ml de permanganato de potasio, en solución 0.25 N, considerando como agente oxidante para esta reacción. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 92 Solución: Formulamos e igualamos la ecuación química por el método ión - electrón FeSO4 + H2SO4 + KMnO4 Fe2(SO4)3 + MnO + K2SO4 + H2O Las semirreacciones son: 2 Fe+2 2 Fe+3 + 2 e- (1) 5 e- + 8H+ + MnO4- Mn+2 + 4H2O (2) multiplicando la primera ecuación por 5 y la ecuación (2) por 5: 10 Fe+2 + 16H+ + 2 MnO4- 10 Fe+3 + 2 Mn+2 + 8H2O La ecuación igualada es 10FeSO4 + 8 H2SO4 + 2 KMnO4 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + 8 H2O Para la determinación del eq – g de KMnO4, debemos considerar los electrones ganados porque se trata de una reacción de oxidación – reducción. 1 mol KMnO4 5 5 eq g KMnO4 1 mol KMnO4 1 eq g KMnO4 La masa de sulfato ferroso que se oxida es: 24 ml KMnO 4 0.25 Eq g KMnO 4 1 mol KMnO 4 10 mol FeSO4 1000 ml solución 5 eq g KMnO 4 2 mol KMnO 4 152 g FeSO4 0.912 g FeSO4 1 mol FeSO4 Propiedades coligativas: 3.13 A 25 ºC la presión de vapor saturado del agua constituye 23.76 mmHg. Hallar a la misma temperatura, la presión del vapor saturado sobre una disolución acuosa al 5% de carbamida , CO(NH2)2. Solución: Aplicaremos la ley de Rault: P = Xd.Pº La fracción molar del disolvente se puede evaluar a partir de la composición que nos dan en el problema, vale decir: 5 g de carbamida y 95 g de agua COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 93 1 mol CO(NH 2 ) 2 60 g 0,083 mol CO(NH 2 ) 2 5 g CO(NH 2 ) 2 95 gH 2 O H 2O 1 mol H 2 O 5.28 mol H 2 O 18 g H 2 O 5.28 0.985 5.363 P = 0.985 23.76 mmHg 3.14 La solución saturada de fenol en agua tiene a 21 ºC la presión de vapor de 18.3 mmHg, mientras que la del agua pura es 18.65 mmHg. a) Determinar la solubilidad del fenol en agua , suponiendo la idealidad. Exprese también el resultado como b) molaridad, c) molalidad y d) tanto por ciento en masa. Solución: Datos: P = 18.3 mmHg P° = 18.65 a) solubilidad = ? b) M = ? c) m = ? d) % masa = ? a) La solubilidad se define: solubilidad g soluto 100 g de disolvente Aplicaremos la ley de Rault: De la ecuación (3.5): P = P°: md Md P P md ms Ms Ms reemplazando datos: 100 18 18.3 18.65 100 ms 18 94 efectuando operaciones con una máquina electrónica: ms 0.1077 94 m s 10.12 g C6 H 5OH Por tanto la solubilidad es: solubilidad 10.12 g de soluto 100 g de agua b) molaridad Para soluciones ideales se considera la densidad 1 g/ml La masa total de la solución es: (100 + 10.12) g = 110.12 g COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS V = 110.12 g / 1 g/ml = 110.12 ml = 0.11 litros 94 Los moles de fenol: 10.12 g / 94 = 0.108 mol M 0108 mol C6 H5OH 0.98 molar 0.11 litros solución m 0.108 mol C6 H 5OH 1.08 molal 0.10 kg H 2O c) molalidad d) % masa: %C 6 H5OH 10.12 100% 9.19%C6 H5OH 110.12 3.15 Cuando se disuelven 60 g de una mezcla de glucosa (C6H12O6) y sacarosa (C12H22O11) en 200 g de agua, se registra una presión de vapor en la disolución de 23.28 mmHg a 25 ºC. La presión de vapor del agua pura a dicha temperatura es 23.76 mmHg. Determinar la composición porcentual en masa en la mezcla de glucosa y sacarosa. Solución Datos: 60 g de mezcla de C6H12O6 y C12H22O11 sean : C6H12O6 = x y P = 23.28 mmHg C12H22O11 = y en 200 g de H2O. Pº = 23.76 mmHg Aplicando la ley de Rault: P = PºXdisolvente; despejando Xd: Xd P 23.28mmHg 0.98 Pº 23.76mmHg por definición de fracción molar: X disolvente n H 2O n H 2O n soluto mH 2O X disolvente MH 2O mH 2O MH 2O reemplazando datos: M 264.63 m soluto M soluto 200 18 0.98 200 60 18 M g mol Considerando la ecuación: nx + ny = nT y x 60 180 342 264.63 (1) x y 60 (2) COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 95 Resolviendo el sistema de ecuaciones se determina: x = 19.6 g %C6H12O6 = 32.67% y = 40.4 g %C12H22O11 = 67.33% 3.16 Calcular la cantidad de C2H6O2 que se debe añadir a 1 kg de etanol para reducir su presión de vapor en 9.5 mmHg a 35 ºC. La presión de vapor del etanol puro a esta temperatura es 100 mmHg. Solución: La presión de vapor de la solución es: (100 - 9.5) mmHg = 90.5 mmHg Considerando la ley de Rault: P = PºXdisolvente; Xd P 90.5 mmHg 0.905 Pº 100 mmHg por definición de fracción molar: X disolvente n H 2O n H 2O n soluto m C 2 H 5 OH X disolvente M C 2 H 5 OH m C 2 H 5 OH M C 2 H 5 OH m soluto M soluto 1000 46 0.905 1000 m 46 62 ms 2.282 62 ms = 141.49 g C2H6O2 3.17 A 30 ºC, la presión de vapor del éter dietílico es de 646 mmHg y de la acetona pura de 283 mmHg. Calcule la composición molar de una mezcla cuya presión sea de 460 mmHg, suponiendo la idealidad. Solución: Puesto que ambas sustancias son volátiles (A = éter dietílico; B = acetona) se cumple que: Ptotal = PA + PB = XA.PAº + XB.PBº 460 = A646 + B283 (1) A + B = 1 (2) A = 1 - B (3) (3) reemplazando en (1): 460 = 646 (1 - B ) + 383 B Despejando la fracción molar de la acetona B = 0.51; A = 0.49 COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 96 La composición molar es %nacetona = 0.51100 = 51.0% %néter = 0.49100 = 49.0% 3.18 En un compuesto orgánico recientemente sintetizado, al realizar el análisis químico se ha encontrado que contiene 63.2% de carbono, 8.8% de hidrógeno y el resto oxígeno. Una disolución de 0.0702 gramos de este compuesto en 0.804 g de alcanfor deprime el punto de solidificación en 15.3 °C. ¿Cuál es la fórmula molecular del compuesto desconocido? La constante crioscópica del alcanfor es igual a 40. Solución: Determinación de la fórmula empírica: 5.266 3 1.75 8.8 H: 5 1.75 1.75 O: 1 1.75 63.2 5.266 12 8.8 H: 8.8 1 18 O: 1.75 16 C: C: La fórmula empírica es: C3H5O (M = 57) Para determinar la fórmula molecular debemos calcular el peso molecular de la sustancia a partir de la expresión del descenso crioscópico. Tc = Kcm m = 15.3 °C / 40 °C/mol = 0.3825 El peso molecular calculamos a partir de la expresión (3.8) m M a 1000 AM a 1000 0.0702 1000 228.27 Am 0.804 0.3825 En la expresión: (C3H5O)n n La fórmula molecular es: 228.27 4 57 C12H20O4 3.19 Hallar la concentración en gramos por litro de una solución de glucosa C 6H12O6 que a 25 °C es isosmótica con una disolución de úrea CO(NH2)2 a 12 °C la cual contiene 3 g de úrea en un volumen de 150 cm3. Solución El término isosmótico implica la misma presión osmótica pero a diferentes temperaturas, así que se puede escribir la expresión de presión osmótica para ambas sustancias e igualarlas. = cRT COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 97 Para la solución de glucosa se tiene: 1 = c1RT1 (1) 2 = c2RT2 (2) Para la solución de úrea: T1 = 25 + 273 = 298 K T2 = 12 + 273 = 285 K La concentración C2, de la úrea es: C2 3 g úrea 1 mol de úrea 1000 ml solución 0.333 molar 150 ml solución 60g úrea 1 litro solución Igualando las ecuaciones (1) y (2) c1RT1 = c2RT2 Despejando C1: c1 T2 285 c2 0.333molar 0.318molar T1 298 0.318 moles C6 H12O 6 180 g C6 H12O 6 57.24 g/ 1 litro de solución 1mol C6 H12O 6 3.20 El bromuro de etileno, C2H4Br2, y el 1,2 dibromopropano C3H6Br2, forman una serie de disoluciones ideales en todas sus concentraciones. A 85 ºC, la presión de estos dos líquidos puros es 173 y 127 torr respectivamente. a) Si se disuelven 10 g de bromuro de etileno en 80 g de 1,2 dibromopropano, calcúlese la presión de cada componente y la presión total de la solución a 85 ºC. b) Calcúlese la fracción molar del bromuro de etileno en el vapor en el equilibrio con la solución anterior. c) Cuál será la fracción molar del bromuro de etileno en una solución a 85 ºC en equilibrio con una mezcla de 50:50 moles en el vapor? Solución: Para calcular la presión de cada componente se debe considerar la ley de Rault: PC2H4Br2 = C2H4Br2 P° C2H4Br2 PC2H4Br2 = C3H6Br2 P° C3H6Br2 P° C2H4Br2 = 173 mmHg P° C3H6Br2 = 127 mmHg Las fracciones molares son: 10 g C 2 H 4 Br2 1 mol C 2 H 4 Br2 0.053 mol C 2 H 4 Br2 187.84 g C 2 H 4 Br2 80 g C 3 H 6 Br2 1 mol C 3 H 6 Br2 0.396 mol C 2 H 4 Br2 201.84 g C 3 H 6 Br2 0.053 0.118 0.449 1 0.118 0.882 χ C 2 H 4 Br2 χ C3H 6 Br2 Las presiones de vapor parciales son: PC2H4Br2 = 0.118 173 mmHg = 20.414 mmHg COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA 98 SOLUCIONES Y PROPIEDADES COLIGATIVAS PC3H6Br2 = 0.882 127 mmHg =112.014 mmHg La presión de vapor de la solución es: Ptotal = PC2H4Br2 + PC3H6Br2 = (20.414 + 112.014) mmHg Ptotal = 132.428 mmHg Puesto que se trata de soluciones ideales, su comportamiento puede mostrarse en un diagrama fracción molar vs presión de vapor de ambas soluciones: Por ejemplo se puede dar eventualmente la presión total de la solución ideal cuando las fracciones molares de ambas sustancias son iguales, es decir 0.5. Trace una línea en la fracción molar 0.5 y lea la intersección en presión de vapor esto da aproximadamente 150 mmHg. en la práctica resulta muy útil el uso de estos diagramas. 0.88 Presión de vapor [mmHg] Del diagrama realizada a escala se puede dar una interpretación del comportamiento de estas soluciones. Dibromo propano 0.5 173 150 132 127 0.12 0.5 1.0 Bromuro de etileno c) Para determinar las fracciones molares de estas sustancias en fase vapor, debemos recordar un concepto muy importante de las fracciones molares en función de las presiones parciales. χA PA Ptotal Entonces la fracción molar del bromuro de etileno en la fase vapor es: χ C2 H 4 Br2 20.414 0.154 132.428 d) La fracción molar del bromuro de etileno en la fase líquida cuando las fracciones molares en fase gaseosa son iguales será: Sean: A = C2H4Br2 y B = C3H6Br2 PA PT En fase gaseosa se cumple: X A' Además: PA PA X A y X B' PB PT PB PB X B (1) (2) Donde X’A y X’B son las fracciones molares en fase gaseosa y XA y XB, son las fracciones molares en solución Despejando PA y PB de (1) COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS PA PT X A' PB PT X B' 99 (3) Igualando ahora las ecuaciones (2) y (3) PA X A PT X A' PB X B PT X B' Dividiendo estas ecuaciones y tomando en cuenta que X’A = X’B = 0.5 PA X A PB X B X A PB 127torr 0.734 X B PA 173torr Considerando además que: XA + XB = 1 Y resolviendo el sistema de ecuaciones, encontramos que las fracciones molares en fase líquida son: XA = 0.42 XB = 0.58 3.21 El benceno congela a 5.5 °C y hierve a 80.2 °C. Los calores latentes de fusión y ebullición del benceno son, respectivamente, 30.3 y 94.2 cal/g. Calcular las constantes molales de los puntos de a) congelación y de b) ebullición del benceno. Los valores experimentales so 5.12 y 2.67 °C/molal, respectivamente Solución: Las constantes molales dependen del calor latente de ebullición y fusión respectivamente, y aproximadamente se puede calcular considerando la siguiente ecuación: a) cal 278.5K2 K mol 5.09 K/mol 1000 g 30.3 cal/g RTc2 Kc 1000Δ00 1.987 RTe2 Ke 1000Δ00 1.987 b) cal 353.2K2 K mol 2.63 K/mol 1000 g 94.2 cal/g 3.22 En un aparato para helados de tipo casero se abate el punto de congelación de un baño de agua que rodea el helado disolviendo NaCl para obtener una solución salina. Se observa que una solución salina al 15% se congela a – 10.880 °C. ¿Cuál es el factor de van’t Hoff, i, para esta solución? Solución: Datos Tf(agua) = 0 °C Tf(solución) = -10.88 °C Kc = 1.86 °C/m COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA 100 SOLUCIONES Y PROPIEDADES COLIGATIVAS m 15 g NaCl 1 mol NaCl 1000 g H 2O m 3.02 molal 85 g H 2O 58.5 g NaCl 1 kg H 2O Consideremos la ecuación Tc = iKcm y despejando i, se tiene: i i ΔTc Kc m 0C (10.88C ) 1.94 C 1.86 3.02m m 3.23 El cloruro de cesio se disuelve en agua según la siguiente reacción: CsCl Cs+ + ClUna solución 0.121 m de CsCl se congela a – 0.403. Calcule i y la disociación porcentual de CsCl en esta disolución. Solución: Considerando la ecuación Tc = iKcm y despejando i, se tiene: i ΔTc Kc m donde: Tc = 0 °C – (- 0.403 °C) = 0.403 °C El factor de Van’t Hoff será: i 0.403C 1.7906 C 1.86 0.121m m La disociación porcentual se calcula considerando la ecuación: α i 1 1 los iones formados, como se observa en la ecuación de disociación es: = 2, reemplazando en la anterior expresión: α 1.7906 1 0.7906 2 1 La disociación porcentual es: = 0.7906 100% = 79.06% 3.24 El compuesto complejo, K3[Fe(CN)6], se disuelve en agua según la siguiente reacción: K3[Fe(CN)6] 3K+ + [Fe(CN)6-3] Una solución 0.126 m de K3[Fe(CN)6] se congela a – 0.649 °C. Calcule el factor de Vant’ Hoff y la disociación porcentual de K3[Fe(CN)6] en esta solución. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 101 Solución: Considerando la ecuación Tc = iKcm y despejando i, se tiene: i ΔTc Kc m donde Tc = 0 °C – (- 0.649 °C) = 0.649 °C El factor de Van’t Hoff será: i 0.649 C 2.769 C 1.86 0.126 m m La disociación porcentual se calcula considerando la ecuación: α i 1 1 los iones formados, como se observa en la ecuación de disociación es: = 4, reemplazando en la anterior expresión: α 2.769 1 0.5897 4 1 La disociación porcentual es: = 0.5897 100% = 58.97% 3.25 Al mezclar 17.6 kg del anticongelante comercial (etilenglicol, C2H6O2) con 6 galones de agua, se abate su punto de congelación a –10.0 °F. Suponga que se desea lograr el mismo efecto con sacarosa, C12H22O11 (que es una mala idea), en vez de etilenglicol. ¿Cuántos kilogramos de sacarosa necesitaría disolver? 1 galón = 3.785 litros. Solución: En principio calcularemos la molalidad del etilenglicol, puesto que hay que abatir el punto de congelación a – 10.0 °F las molalidades deben ser idénticas, es decir: m 12.5 17.6 kg C 2 H 6 O 2 1000 g C 2 H 6 O 2 1 mol C 2 H 6 O 2 12.5 molal 3.785 1 kg 1 kg C 2 H 6 O 2 62 g C 2 H 6 O 2 6 gal H 2 O 1 gal 1 moles C12H 22O11 342 g C12H 22O11 1 kg C12H 22O11 1 kg H 2 O 3.785 H 2 O 1 kg H 2 O 1 mol C12H 22O11 1 000 g C12H 22O11 1 H 2 O 1 gal H 2 O 6gal 97.09 kg C12H 22O11 a partir de la molalidad ha sido posible determinar la masa en kg de sacarosa para abatir la temperatura de congelación, esto es se necesitan 97.09 kg de sacarosa. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA 102 SOLUCIONES Y PROPIEDADES COLIGATIVAS PROBLEMAS PROPUESTOS (Soluciones) 3.1 a) Calcular la cantidad de sosa caústica y de agua que se necesita para preparar 5 litros de una solución al 20%, cuya densidad es 1.219 g/ml, b) Cual es la normalidad de está disolución?, c) Cuál es la molalidad? Rpta.- 1219 g NaOH y 4876 g H2O; 6.095 N 3.2 Calcular el volumen de disolución al 12% en peso de CuSO4, que podrá prepararse con 1 kg de sulfato cúprico cristalizado, (CuSO45H2O). La densidad de la solución es 1.131 g/ml. Rpta.- 4.71 litros 3.3 Determinar la masa de sulfato magnésico heptahidratado, (MgSO47H2O), que debe añadirse a 1.5 de agua para obtener una disolución al 20% en masa de sulfato anhídro. 3.3 Se disuelven X g de MgCl2 en agua formando 2 litros de solución, observándose una concentración de 24 mg de Mg+2 en cada cm3 de solución. Hallar el valor de X. Rpta. 190 3.5 Se disuelven 130 g de una base de metal monovalente desconocida en agua formándose 1 litro de solución. Hallar su normalidad si se sabe que 0.78 g de la base produce 0.03 moles de (OH)-1. Rpta. 5 normal 3.7 Calcular el volumen de una disolución de ácido sulfúrico de densidad 1.827 g/ml y 92.77% de H2SO4 que se necesita para preparar 10 litros de ácido sulfúrico 3 normal. Rpta.- 868.2 ml 3.8 Determinar el volumen de una disolución 2 normal de sulfato cúprico que se necesita para preparar 10 g de óxido cúprico previa precipitación del cobre como carbonato y calcinación posterior de éste a óxido. Considerar las siguientes reacciones: Na2CO3 + CuSO4 → CuCO3 + Na2SO4 CuCO3 + calor → CuO + CO2 3.9 ¿Qué volumen de ácido nítrico diluido, de densidad 1.11 g/ml y al 19% en masa de HNO3, contiene 10 g HNO3 ? 3.10 Calcúlese la molalidad de una solución que contiene a) 0.65 moles de glucosa, en 250 g de agua, b) 45 g de glucosa en 1 kg de agua, c) 18 g de glucosa en 1 libra de agua. Rpta.- a) 2.6 m, b) 0.25 m, c) 0.30 m 3.11 Una solución acuosa etiquetada muestra una concentración del 35% en masa de HClO4, una densidad de 1.251 g/cc. ¿Cuál es la concentración molar y la molalidad de la solución? COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 103 Rpta.- 4.36 M; 5.36 m 3.12 El agua y el metanol son miscibles en todas las proporciones, si se mezclan 16 g de metanol con 27 g de agua. ¿Cuál es la fracción molar del metanol en la solución? 3.13 Realice las siguientes conversiones siguientes: a) b) c) d) e) Ca(OH)2 0.1 N en molaridad 20 mg CuSO3/ml en molaridad y normalidad 2.4 mg CaCl2/ml en molaridad y normalidad 1.2 molal de nitrato de plata en tanto por ciento en masa 2 N de H3PO4 en molaridad 3.14 Una reacción requiere 3.4 milimoles de Na3PO4. ¿Cuántos mililitros de una disolución 1.8 N se usarían? 3.15 Se mezclan 150 cc de K2SO4 3 M con 80 cc de NaNO3 2M. ¿Cuál es la concentración de cada sal en la disolución al final? 3.16 ¿Cuántos mililitros de H2SO4 3.0 M se necesitan para neutralizar 200 ml de 0.34 N de Ca(OH)2 ? ¿Cuántos miliequivalentes de CaSO4 se formaran? 3.17 El ácido clorhídrico concentrado tiene una concentración de 37% en masa de HCl y tiene una densidad relativa de 1.184. Hallar la molaridad, normalidad y molalidad. 3.18 Se titularon exactamente 50 cc de una disolución de Na2CO3 con 65.8 cc de HCl 3.0 N de acuerdo a: Na2CO3 + 2HCl → NaCl + CO2 + H2O Si la densidad de la solución de Na2CO3 es 1.25 g/cc. ¿Qué porcentaje de Na2CO3 en masa contiene? Rpta.- 16.7% 3.19 a) Que volumen de K2Cr2O7 0.40 N se necesita para liberar el cloro de 1.2 g de NaCl en una solución acidifícada con H2SO4 ? Cr2O7= + Cl- + H+→ Cr+3 + Cl2 + H2O b) ¿Cuántos gramos de cloro gaseoso se liberan? Rpta.- 51 ml; 0.73 g 3.20 ¿Qué volumen de una disolución de perclorato férrico 0.5 N se necesitan para preparar 25 g de cloruro férrico?, en una solución básica de hidróxido plumboso, considerando la siguiente reacción química. Pb(OH)2 + Fe(ClO4)3 → FeCl3 + Pb3O4 + H2O 3.21 Si 600 cc de una solución 1.1 N de HCl son diluidos hasta formar exactamente la solución 1 normal. ¿Qué cantidad de agua ha sido adicionada? COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 104 3.22 Una solución de NaOH es 0.9 N. ¿Qué cantidad de la misma será necesaria para preparar un litro de solución 0.1 N? 3.23 40 ml de solución 0.5 N de HCl se mezclan con 30 cc de solución normal de H 2SO4. ¿Cuántos ml de solución 0.333 N de NaOH serán necesarios para neutralizar la mezcla de ácidos? 3.24 Una muestra de un hidróxido alcalino puro (NaOH o KOH) es disuelta en agua y requiere 50 cc de solución ácida 0.5 N para su neutralización. ¿De cuál de las dos bases indicadas era la muestra? 3.25 Una muestra de 1.5 g de un metal puro ha necesitado 45.9 cc de solución normal de HCl para ser disuelta. El metal es bivalente; calcular su peso atómico aproximado. 3.26 Cuantos gramos de hierro se disuelven en medio litro de solución 0.1 N de HCl? 3.27 10 g de una solución acuosa que contiene solamente Na2SO4 y H2SO4 se valora con solución 0.5 normal de NaOH, de la cual se gastan 24.26 cc para la neutralización; la solución resultante es tratada con BaCl2 en exceso y se obtiene 3.1526 g de BaSO4. Calcular el porcentaje de a) H2SO4 y b) Na2SO4 en la solución original. 3.28 Si 51 cc de solución 0.1 N de HCl son tratados con 49 cc de solución 0.1 N de NaOH, calcular: a) la normalidad en ácido de la solución resultante; b) el número de gramos de NaCl que dejará la solución al ser evaporada a sequedad. 3.29 La solución de HCl de peso específico relativo 1.9545 contiene 10.94% de HCl en masa, ¿Cuántos ml son necesarios para preparar dos litros de solución 2 N? 3.30 Cuántos litros de gas NH3 seco medido a 27 ºC y 733 mmHg , serán necesarios para preparar dos litros de solución exactamente ½ N de NH4OH. 3.31 25 cc de solución 0.5 N de H2SO4 son agregados a 40 cc de solución 0.25 N de NaOH. ¿Cuál está en exceso y en que cantidad?. Expresar la normalidad de la solución resultante en función de a) el ácido o la base en exceso; b) el ión sulfato. 3.32 Calcular la pureza en tanto por ciento de una muestra de H2C2O42H2O partiendo del dato de que 1.00 g de la misma es neutralizado por 31.4 cc de solución básica 0.5 N. 3.33 Si 1 g de H2C2O42H2O puro neutraliza 33.0 cc de una solución de KOH, calcular la concentración de ésta en: a) gramos de KOH por litro; b) normalidad como bases; c) molaridad. 3.34 La solución de NH4OH de peso específico relativo 0.954 contiene 11.64% de NH3. Calcular su normalidad como base. 3.35 Masa iguales de NaOH y KOH son disueltos separadamente en la misma cantidad de agua. ¿Cuál es la relación de sus normalidades?. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 3.36 Calcular la normalidad de una solución de K2Cr2O7 oxidan 1.375 g de FeSO47H2O puro. 105 sabiendo que 48 cc de la misma 3.37 Una solución de H2SO4 de peso específico relativo 1.160 contiene 22.25% en masa de H2SO4. Calcular: a) su normalidad; b) su molaridad, c) su molalidad, d) su fracción molar. 3.38 Leemos en un libro de prácticas de química: Si se miden 40 ml de HCl concentrado (densidad 1.195 g/ml, 38.72% HCl) y se diluye hasta formar un litro de solución, ésta resulta aproximadamente 0.5 N. Háganse los cálculos para ver si esto es verdad. Rpta. 0.507 N 3.39 Calcular la normalidad de una solución concentrada de H2SO4 según los datos siguientes, densidad 1.8068 g/ml y 87.81% en masa 3.40 Se desea preparar exactamente 10 litros de solución 0.750 N de NaOH. ¿Cuántos mililitros de solución de sosa cáustica de densidad 1.160 y 14.45% en masa de NaOH deben emplearse?. 3.41 Para preparar 10 litros exactos de solución 0.111 N de KOH, disponemos de 40.22 g de KOH puro. ¿Cuántos ml de solución de potasa cáustica, de peso específico 1.3010 del 31% en masa de KOH son necesarios para completar la solución? 3.42 Se disuelve 350 g de cloruro de cinc anhidro (densidad relativa 2.91) en 650 g de agua, se obtiene una disolución cuyo volumen total, a 20 ºC es de 740 ml. Calcular: a) la molaridad, b) la normalidad, c) la molalidad, d) las fracciones molares, e) el tanto por ciento en masa Rpta. 3.47 M, 6.94 N, 3.95 m, 0.0665, 35% ZnCl (Propiedades Coligativas) 3.43 A la temperatura de 65 ºC hallar la presión de vapor sobre una disolución que contiene 13.68 g de sacarosa en 90 g de agua, si la presión de vapor saturado sobre el agua a la misma temperatura es igual a 25.0 kPa (187.5 mm Hg). 3.44 ¿A que es igual la presión de vapor saturado sobre una disolución al 10% de carbamida CO(NH2)2 a 100 ºC? 3.45 A la temperatura de 315 K, la presión de vapor saturado sobre el agua es igual a 8.2 kPa (61.5 mmHg). ¿Cuanto disminuirá la presión de vapor a la temperatura señalada, si en 540 g de agua se disuelven 36 g de glucosa? 3.46 A 293 K la presión de vapor saturado sobre el agua es igual a 2.34 kPa (17.53 mmHg). ¿Cuántos gramos de glicerina C3H5(OH)3 se deben disolver en 180 g de agua para disminuir la presión de vapor en 133.3 Pa? 3.47 ¿Cuántos grados aumentará el punto de ebullición del agua si en 100 g de ésta se disuelven 9 g de glucosa? 3.48 ¿A que temperatura, aproximadamente, hervirá la disolución al 50% en masa de sacarosa? COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA 106 SOLUCIONES Y PROPIEDADES COLIGATIVAS 3.49 ¿A que temperatura, aproximadamente, cristalizará la disolución al 40% en masa de alcohol etílico?. 3.50 ¿Cuántos gramos de sacarosa se deben disolver en 100 g de agua para: a) disminuir la temperatura de cristalización en 1 grado; b) aumentar la temperatura de ebullición en 1 grado? 3.51. ¿En que relación deben encontrarse las masas de agua y de alcohol etílico para que al mezclarlos, se obtenga una disolución que se cristalice a –20 ºC?. 3.52 En el radiador de automóvil vertieron 9 litros de agua y añadieron 2 litros de alcohol metílico ( = 0,8 g/ml. Hecho esto, ¿a que temperatura mínima se puede dejar el coche al aire libre sin temer que el agua en el radiador se congele? 3.53 Al disolver 5.0 g de sustancia en 200 g de agua se obtiene una disolución no conductora de corriente, la cual se cristaliza a -1.45 ºC. Determine el peso molecular del soluto. 3.54 Al disolver 13 g de no electrolito en 400 g de éter dietílico (C2H5)2O, la temperatura de ebullición se elevó en 0.453 K. Determinar el peso molecular del soluto. 3.55 En 60 g de benceno están disueltos 2.09 g de cierta sustancia cuya composición elemental en masa es como sigue: 50.69% de C; 4.23% de H y 45.08% de O. La disolución se cristaliza a 4.25 ºC. Establecer la fórmula molecular de la sustancia. El benceno puro se cristaliza a 5.5 ºC 3.56 Una disolución acuoso-alcohólica que contiene 15% de alcohol desconocido ( = 0.97 g/ml) se cristaliza a -10.26 ºC. Hallar el peso molecular del alcohol desconocido y la presión osmótica de la disolución a 293 K. 3.57 La temperatura de ebullición de la disolución acuosa de sacarosa es igual a 101.4 ºC. Calcular la concentración molal y el tanto por ciento en masa de la sacarosa en la disolución. ¿A que temperatura se congela esta disolución? 3.58 ¿Cuántos gramos de glucosa C6H12O6 deben encontrarse en 0.5 litros de disolución para que su presión osmótica (a igual temperatura) sea la misma que la de una disolución, 1 litro de la cual contiene 9.2 g de glicerina C3H5(OH)3? 3.59 A 25 ºC la presión osmótica de la disolución cuyos 200 ml contiene 2.80 g de compuesto macromolecular es igual a 0.70 kPa. Hallar el peso molecular del soluto. 3.60 A la temperatura de 20 ºC y 1 litro de disolución de un no electrolito cuya presión osmótica es de 243.4 kPa se mezcla con 3 litros de disolución de no electrolito cuya presión osmótica es igual a 486.8 kPa. Determinar la presión osmótica de la disolución mezclada 3.61 Una disolución en cuyos 100 ml se encuentran 2.3 g de cierta sustancia presenta, a 298 K, una presión osmótica igual a 618.5 kPa. Determinar el peso molecular de la sustancia 3.62 Un ml de disolución contienen 1018 moléculas de no electrolito disuelto. Calcular la presión osmótica de la disolución a 298 K. COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 107 3.63 La presión de vapor del agua pura a 25 ºC es de 23.76 mmHg, ¿Cuál es la presión de vapor de una disolución que contiene 12 g de glucuosa, en 50 g de agua ? 3.64 Se disuelven 24.63 g de glucosa en 150 g de agua. A 23 ºC la presión de vapor de la disolución es de 20.73 mmHg y la del agua pura es de 21.07 mmHg. ¿Qué peso molecular tiene la glucosa? 3.65 A 30 ºC, la presión de vapor del eter dietílico es de 646 mmHg y la de la acetona pura de 283 mmHg.. Calcule la composición de una mezcla cuya presión sea 460 mmHg, suponiendo la idealidad. 3.66 A 11 ºC las presiones de vapor del clorobenceno, C6H5Cl y del bromobenceno C6H5Br son, respectivamente de 400 y 200 mmHg. Determinar la presión de vapor a esta temperatura de una mezcla líquida supuesta ideal, formada por un 30% de C 6H5Cl y 70% de C6H5Br, en masa. 3.67 Suponga que se disuelven 5.0 gramos de una mezcla de naftaleno y antraceno, en 300 gramos de benceno. Se observa que la disolución se congela a 4.85 ºC. Encuentre la composición porcentual (en masa) de la mezcla. 3.68 Al mezclar 17.6 kg del anticongelante comercial (etilenglicol, C2H6O2) con 6 galones de agua, se abate su punto de congelación a –10 ºF. Suponga que se desea lograr el mismo efecto en sacarosa, C12H22O11 ( que es una mala idea), en vez de etilenglicol. ¿Cuántos kg de sacarosa necesitaría disolver? ( 1 galón = 3.785 ) 3.69 El calor latente de fusión del cloruro mercúrico (HgCl2) es de 16.9 cal/g en su punto de fusión de 265 °C. Al colocar en 50 g de aquél, que actúa como disolvente, 0.849 g de cloruro mercuroso que actúa como soluto, el punto de fusión de la solución desciende en 1.24 °C. Estimar el peso molecular del cloruro mercuroso y su fórmula molecular. Rpta.- 236.1; Hg2Cl2 3.70 Una disolución de 0.52 g de cloruro potásico en 83.6 g de agua congela a - 0.291 °C. Calcular el factor de van’t Hoff, el coeficiente osmótico y el grado de disociación aparente del KCl. Kc(H2O) = 1.86 °C/mol. Rpta. i = 1.876; g = 0.938; = 0.876 3.71 El punto de ebullición de una disolución de 3.41 g de cloruro cálcico en 100 g de agua es 100.21 °C. Calcular el factor de van’t Hoff, el coeficiente osmótico y el grado de disociación aparente del cloruro de bario. Ke(H2O) = 0.52 °C/mol Rpta. i = 2.466; g = 0.822; = 0.733 3.72 Una disolución de cloruro de cinc al 1%, y de densidad prácticamente la unidad, congela a – 0.28 °C. Calcular el grado de disociación aparente del cloruro de cinc, y a partir de él, la concentración de los iones en la disolución. Rpta. = 0.516; [Zn+2] = 0.0375 M COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA SOLUCIONES Y PROPIEDADES COLIGATIVAS 108 3.73 Calcular la presión de vapor a 100 °C de una disolución de cloruro de sodio al 10%, suponiendo que el grado de disociación aparente de la sal sea del 90%. Rpta. 713.6 mmHg 3.74 Una disolución de cloruro potásico que contiene 1 g de sal por litro ejerce , a 14 °C, una presión osmótica de 456 mmHg. Calcular el valor del coeficiente osmótico y el grado de disociación aparente del cloruro potásico. Rpta. g = 0.951; = 90.1% 3.75 Calcular la presión osmótica a 18 °C de una solución de cloruro sódico que contiene 2.5 g de sal en 100 cm3, si el factor de van’ Hoff es igual a 1.83. Rpta. 18.68 atm 3.76 Un cloruro hidratado de calcio contiene 27.21% de Ca y 28.30% de Cl. La disolución formada al disolver 0.364 g del compuesto en 50 g de agua empieza a congelar a – 0.29 °C. a) Escribir la fórmula racional del compuesto, b) determine el factor de van’t Hoff. Kc(H2O) = 1.86 °C/mol Rpta. CaCl2H2O; i = 3.12 3.77 Una solución acuosa con 5.00% en peso de ácido sulfúrico, tiene un punto de congelación de – 2.17 °C. Calcular: a) El factor de Van’t Hoff. b) El coeficiente osmótico de la solución Rpta.- 2.17; 0.723 3.78 Una solución acuosa 0.100 molal de ácido acético, presenta disociado el CH3COOH en 1.35%. Calcular: a) El punto de congelación de la solución b) La presión osmótica de la solución Rpta.- -0.188 °C; 2.48 atm 3.79 Se ha disuelto 160 g de ácido oxálico en 1000 g de agua, resultando que la solución hierve a 102.41 °C, a la presión de 1 atm. Calcular el grado de disociación del COOH – COOH. Rpta.- 0.82 3.80 El descenso de la presión de vapor producido por un mol de NaCl en 1000 g de agua a 18 °C, es de 0.475 mmHg. La tensión de vapor de agua a 18 °C es de 15.477 mmHg. Calcular: a) El factor de Van’t Hoff. b) La presión osmótica Rpta.- 1.734; 41.38 atm COMPENDIOS DE QUÍMICA GENERAL PARA ESTUDIANTES DE CIENCIAS E INGENIERÍA