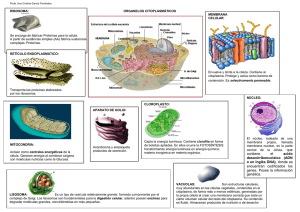
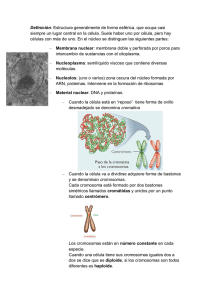
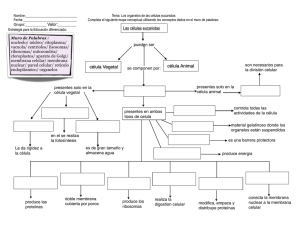
1 Introducción a la biología celular 1.1 Observación de
Anuncio

Miércoles, 01 de octubre de 2003 1 Introducción a la biología celular 1. 2. 3. 4. 5. Procariotas Protistas – algas unicelulares Plantas Hongos Animales 3,5000 X 106 – la primera célula. La primera célula se formó a partir de una molécula de ARN que podía reproducirse y traducirse a proteínas, envuelta por una membrana lipidia. RNA Proteínas Materia inorgánica de la atmósfera Nucleótidos RNA Bicapas ¿Por qué se cree que el ARN era el ácido nucleico inicial? Se cree que el ácido nucleico inicial era el ARN porque el ARN es más diverso y no tan rígido como el ADN es, además, el ARN tenía funciones de catalizador. El ARN como catalizador fue reemplazado por las proteínas, y como codificador de información génica fue reemplazado por el ADN. El ARN funciona como mensajero entre el ADN y la síntesis de proteínas. 1.1 Observación de las células 1mm = 103 µm = 106 nm = 107 Å DEF. Resolución de un microscopio óptico (d): 1. Diámetro del objeto más pequeño que se ve 2. Distancia mínima a la que tiene que estar separados dos puntos para poderlos apreciar como distintas. d= 0.612 ⋅ λ n ⋅ sin α 1 λ – longitud de onda α – la mitad del ángulo formado por el cono de luz al penetrar el objeto n – índice de reflexión d ojo – 0.1-0.2 mm Lupa binocular – permita ver células vivas como no hace falta fijar las muestras, por tanto se utiliza en fecundación en Vitro y en botánica (células gruesas) d microscopio óptico – 0.2 µm d microscopio electrónico 0.1-0.2 nm (en muestras biológicas el limite es 2 nm) 1.1.1 Microscopio óptico Para conservar muestras, hay que fijar la muestra, tantas muestras de tejido sólido como de suspensión celular. Tipos de microscopios ópticos: 1) Microscopio óptico convencional (d = 0.2 µm). Aumenta por 1000-1200. Hay que teñir la muestra o que ella misma sea colorada para verla. No se puede ver células vivas en este microscopio. 2) Microscopio óptico contrasta fases. Aumenta por 400 Este microscopio transforma el retraso en la onda de luz que ha pasado a través de partes de la célula a cambios en la longitud de onda, que se ven como cambios de color. Este microscopio es útil para ver células que es importante mantenerlas vivas. Viernes, 03 de octubre de 2003 3) Microscopio óptico contrasta inferencial Nomarski. Aumenta por 400. Se ven células sin teñirlas, por tanto se puede mantenerlas vivas. Este tipo de microscopio se caracteriza por producir una imagen tridimensional con la textura de la célula. Por tanto, es útil en experimentos de transgenia y fecundación en Vitro. 3. todos estos microscopios son microscopios de campo claro 4) Microscopio invertido. en el microscopio invertido el ojo es a la parte más baja del microscopio 5) Microscopio de fluorescencia. Este microscopio es útil para ver células que no hace falta mantenerlas vivas (el proceso las mata). El microscopio se basa en dos elementos: 1. Lámpara de mercurio – emite radiación UV. 2. Fluorocromos – moléculas que se caracterizan por que emiten radiación visible al ser agitadas por radiación UV. el aventaje de este tipo de microscopio óptico es la información que nos provee: 1. Identificación de proteínas: para detectar una proteína especifica dentro de la célula, se usan anticuerpos especiales marcados con fluorocromos. Después, se lava la célula y sólo quedan teñidas las proteínas unidas a los 2 anticuerpos. 2. Identificación de ADN: para detectar un segmento específico de ADN, se usan segmentos complementarios a esta secuencia de ADN marcados con fluorocromos. Después, se lava la célula y se quedan sólo las secuencias marcadas con los fluorocromos. 1.1.2 Microscopio confocal Cuando hay en células grandes fluorocromos, no se puede distinguirlos en las diferentes profundidades – hay demasiados fluorocromos para obtener resolución buena. El microscopio confocal dirige luz en foco a las diferentes profundidades y así toma diferentes imágenes de las diferentes profundidades de la célula, en buena resolución. 1.1.3 Microscopio electrónico En cualquier tipo microscopio electrónico, hay que fijar la célula, por tanto no se puede ver la célula y mantenerla viva. 1. Microscopio electrónico de transmisión. para poder ver el imagen bien, hace falta que 50-90% de los electrones pasen a través de la muestra. la imagen se forma así: en la pantalla de visualización, donde no llega ningún electrón, hay un punto oscuro, y donde llega un electrón un punto claro. Los átomos con Nº atómico más alto no dejan pasar a los electrones mientras que los átomos con Nº atómico más bajo si que los dejan pasar. Como en una muestra biológica los átomos tienen Nº atómico muy cercano uno al otro, resulta que el contrasto no es muy bueno. Para mejorar el contrasto, se añade a la muestra sales de metales, como el osmio, que se adhiere bien a los lípidos. En este tipo de microscopio también se puede detectar proteínas específicas usando anticuerpos que están marcadas con elementos densos. Esta técnica se llama Immunogold. Lunes, 06 de octubre de 2003 2. Microscopio electrónico de rastreo (scanning). En este tipo de microscopio se ven los electrones que se reflejen de la muestra y se ve la superficie de la muestra. no se puede cortar tallas, sino la imagen es plana. para que el reflejo de la muestra sea más fácil, se puede cubrir la muestra en metales pesados. este tipo de microscopio no tiene buena resolución. Para obtener buena resolución y mantener la sensación tridimensional, se usa el microscopio electrónico de transmisión y criofractura. Criofractura: se congelan las muestras en N2 líquido a -196º, y luego se rompen las muestras. Se produce una fractura, que en general separa las dos capas de la membrana celular. Luego, la muestra está cubierta en platina, en ángulo no directo (no toda la superficie esta cubierto por la platina). Después, la muestra está cubierta en carbono, en ángulo directo (cubre todo el superficie). Por ultimo, se lava la muestra en un solvente fuerte que disuelva toda la materia orgánica. Los partes del molde hechos de platina no dejan pasar a los electrones, y se ven áreas oscuros, mientras las áreas donde hay solo carbono dejan pasar a los electrones y se ven áreas claras. 3 1.2 Visualizar moléculas en células vivas 1. Cambios en concentración de intracelular de iones – se usan indicadores sensibles a iones que emiten luz. Ej.: Aqueronina, que emite luz en presencia de Ca2+. Ejemplo de uso: la concentración intracelular de calcio es relativamente baja todo el tiempo. Durante la fecundación, hay una liberación de Ca2+ causada por la penetración del espermatozoide a la célula. Esta liberación provoca la fusión de las membranas y la creación del zigoto. Al usar la Aqueronina se ven los cambios de concentración de Ca2+ en la célula. 2. Precursores inactivos fotosensibles (moléculas empaquetadas) – moléculas que se activan cuando las agitan usando LASER. Molécula X inactiva Molécula X activa Molécula empaquetada Aplicación importante: uso de fluorocromos empaquetados (ej.: fluorescencia). El fluorocromo no emite luz mientras está inactivo. Ej.: experimento en el cual se tiñan una célula en mitosis y se observan el movimiento de la tubulina. DAPI – azul – ADN RHO – rojo – tubulina FLOU inactiva – verde – tubulina Al inicio, se ve solamente la tubulina teñida roja. Luego, al agitar la flourscencia con LASER, se ve la tubulina teñida verde, y su movimiento hacia la parte izquierda de la célula. 3. Proteína fluorescente verde (GFP) la proteína fluorescente verde tiene su origen en medusas luminescentes. Se extraía la proteína y se sabe el código genético que la codifica. cuando se quiere examinar alguna proteína que su código genético ya es conocido en la célula, se unen el código genético de aquella proteína que se quiere examinar con el de la GFP para crear una célula transgenia. El producto de este tipo de experimento es una célula en la cual se ven las proteínas en actividad. 4 1.3 Isótopos radioactivos Los isótopos radioactivos se aplican sobre las células vivas, pero la observación las mata. La radiación que emiten los isótopos radioactivos de los elementos que construyen la célula se ve en imágenes fotográficas. Los elementos cuyo uso es frecuente son 3H, 14C y 32P. Miércoles, 08 de octubre de 2003 El proceso de trabajo con los isótopos es así: se sintetizan moléculas con isótopos radioactivos (ej.: dATP*, UTP*, leu*). Estas moléculas penetran a la célula y se observan los procesos en los cuales participan las moléculas marcadas con los isótopos radioactivos (dATP* ! síntesis de ADN, UTP* ! síntesis de ARN, leu* ! proteínas). Autoradiografía – el proceso usado para visualizar la radiación radioactiva. En este proceso, las células están fijadas sobre el portaobjetos. El portaobjetos se cubierta en emulsión fotosensible. Después de algún periodo de tiempo, cuando se observa esta preparación, se ven la imagen producido por la emisión radioactiva de los isótopos. Pulse y captura – a un cultivo de células se añaden las moléculas marcadas en isótopos, para un tiempo corto que les permite absorber una cantidad de las moléculas (por ejemplo, leu*). Después de este periodo corto de tiempo, se lava el cultivo. Se toman autoradiografías de las células después del lavado, y se observan los procesos en los cuales participan las moléculas (ej.: en células de páncreas, después de añadir leu* se observan los procesas en los cuales participa la leu*. t0 ! retículo endoplasmático, t10 ! aparato de golgi, t45 ! vesículas de secreción). 1.4 Técnicas para el estudio de ADN – FISH Hibridación in situ fluorescente (fluorescente in situ hibridation). Incluye: " ADN celular (núcleo) " ADN sonda (marcado en fluorocromos) Para realizar este proceso hace falta desnaturalizar el ADN. El ADN celular pasa desnaturalización sobre el portaobjetos, y el ADN sonda lo pasa separado. Normalmente la desnaturalización se produce con calor. Después de la desnaturalización la sonda se aplica sobre el portaobjetos ! hibridación de ADN celular con el ADN sonda. Se lava la muestra y se observa en microscopio óptico de fluorescencia. Este método se aplica normalmente a célula en mitosis, en la fase metafísica, en la cual se ven claramente los diferentes cromosomas. Utilizaciones: " Presencia o ausencia de determinadas secuencias – muy importante para diagnostico prenatal. Se usa para detectar aneploideas (en cromosomas nº 13, 18, 21, 22, x, y. ej.: síndrome de Down aparece cuando hay triploidea del cromosoma nº 21). " Translocación de genes. Ej.: los genes ABL (cromosoma 9) y BCR (cromosoma 22) controlan la reproducción celular. Normalmente, al estar separados, funcionan bien. A veces, en casos de Leucemia Mioloidea Crónica, hay translocación del ABL del cromosoma 9 a cromosoma 22 al lado del BCR. Esta translocación crea un gen quiromerico, que al ser trascrito a ARN y mas tarde a proteína, causa la replicación incontrolable de la célula y la formación de un tumor. Para detectar este tipo de defecto, se usan sondas específicas para cada gen (una para ABL y una para BCR). Si se ven los 5 segmentos completamente, no hay translocación. Si se ven los segmentos unidos, hay translocación. " " " Cromosoma 9 Cromosoma 22 Cromosoma 22 con translocación Célula normal Célula anormal Localización de genes en los cromosomas – aplicación de sondas especificas para el gen. Localización de secuencias en los cromosomas – aplicación de sondas especificas para la secuencias. Ej.: secuencias de telomeros o de centrómeros. Pintada cromosoma – teñir todos los cromosomas en una colección de sondas que son todas complementarias a secuencias del mismo cromosoma Viernes, 10 de octubre de 2003 2 DNA 2.1 Estructura del DNA Estudio personal 2.2 Replicación del DNA 2.2.1 Características generales replicación mitosis 1 molécula de AND 2 moléculas de ADN 1 molécula de AND 1 doble hélice 2 doble hélices 1 doble hélice 1 cromátida 2 cromátidas 1 cromátida 1 cromosoma 1 cromosoma 1 cromosoma La síntesis de la cadena nueva se hace por adición secuencial de nucleótidos. El nucleótido conecta al grupo HOC libre en el extremo 3’ de la cadena de ADN. La energía de polimerización llega de la rotura de los enlaces de fósforo del nucleótido que son ricos en energía (3P ! 1P). 6 Para replicar el ADN hace falta romper los puentes de hidrogeno que hay entre las bases. Las bases quedan libres, y se unen con los nucleótidos. Dos enzimas preforman la apertura de la doble hélice: 4. proteínas iniciadoras – empiezan el proceso de la separación de la cadena doble. 5. DNA helicasa – separa las cadenas de la doble hélice. La DNA Polimerasa se engancha a la cadena molde y sintetiza la nueva cadena de ADN. La DNA polimerasa es muy fiel – la reproducción produce muy pocos errores (1 en 109-1010 veces) y es capaz de corregirse y eliminar bases erróneos. 2.2.2 Limitaciones de la DNA polimerasa • • La DNA polimerasa puede sintetizar solo en dirección 3’-5’ ! añadir nucleótidos sobre el extremo 3’ libre de la cadena creciente. Consecuencia – como la cadena es anticomplementaria se puede replicar solo una cadena de la doble hélice. Resolución: síntesis DNA en fragmentos de Okazaki (ver apéndice) La DNA polimerasa no puede iniciar la síntesis de ADN. Solo puede seguir sintetizando la cadena que ya existe. Resolución: RNA cebedor, segmento de 10 bases de RNA producidos por la enzima primasa que marcan el inicio de la síntesis de la cadena. En la cadena conductora hay un cebedor, mientras que en la cadena retardada hay tantos cebadores como fragmentos de Okazaki. Lunes, 13 de octubre de 2003 3' 5' 5' 3' 5' 3' 5' 5' 3' 3' 3' 3' 5' 5' Fragmentos de Okazaki 5' 3' 5' 3' 5' 5' 3' 3' 3' 5' 3' 5' 3' 3' 5' 5' 3' 5' 3' 5' 7 2.2.3 Orígenes de replicación Los orígenes de replicación son trozos de ADN ricos en adenina y timina (es mas fácil romper los puentes de hidrógeno entre a timina y la adenina que los puente de hidrógeno entre la guanina y la citosina). Las proteínas iniciadoras empiezan a separar las dos cadenas en los orígenes de replicación. En bacterias hay 1 origen de replicación. En eucariotas hay unos orígenes de replicación en cada cromosoma. Los orígenes de replicación se activan en forma asincrónica. Cada horquilla avanza hacia la izquierda y hacia la derecha en el mismo tiempo, hasta llegar a la horquilla vecina. 2.2.4 Telomeros y telomerasa Los telomeros son secuencias de ADN repetitivo que se encuentran en os extremos de os cromosomas. As secuencias de los telomeros es idéntica en todos los vertebrales (5’ TTAGGG3’, 5’AATCCC3’). La telomerasa está formada por una proteína y una secuencia de RNA. La telomerasa replica estas secuencias mediante un proceso de transcripción inversa. La secuencia de RNA sirve para la transcripción inversa. La telomerasa se engancha al extremo más largo de la cadena (‘3) según las dos bases complementarias a los dos últimos de la cadena. Luego, la telomerasa añade bases a la cadena según a secuencia de RNA que forma parte de la telomerasa. Cuando la telomerasa termine se parte, se añade un cebador y la DNA polimerasa sintetiza la secuencia del telomero. Overhang – la parte libre del extremo mas largo del cromosoma. Siempre queda overhang. Cada vez que interviene la telomerasa prolonga el cromosoma. No cada división hay intervención de la telomerasa, y no todas las células tienen telomerasa. Las células somáticas no tienen telomerasa mientras que las células germinales y embrionarias si que la tienen. El hecho que las células somáticas no tienen telomerasa ! los telomeros sirven como un reloj biológico – cada división se corta un trozo del telomer hasta que llegue el momento que ya se corta trozos de información génica y la célula no puede replicarse más. 95% de las células cancerosas tienen telomerasa. 2.2.5 Relación telomer-cáncer Otra función que tienen los telomeros es impedir que los cromosomas se enganchen uno al otro en el overhang. Los telomeros forman t-loops (telomer loops). 95% de los casos de cáncer son carcinomas – deriven de células epiteliales. Las celdas epiteliales proliferan durante toda la vida hasta recibir una señal de parar la división. A veces hay células que no dejan de replicarse. Estas células continúan dividirse y pierden sus telomeros completamente ! pierden el t-loop ! se forman cromosomas dicéntricos ! 8 se forma ciclo BFB (bridge fusión break) ! se forman translocaciones (típico de celdas cancerosas) Miércoles, 15 de octubre de 2003 3 Del DNA a la proteína 3.1 Del DNA al RNA (transcripción) 3.1.1 Características generales La estructura del DNA es diferente de la estructura del RNA: DNA – doble hélice RNA – Cadena sencilla, que se pliega formando estructuras complejas. Diferentes tipos de RNA: • • • • mRNA – codifica proteínas rRNA – forma parte de la estructura del ribosoma y participa en la síntesis de proteínas. tRNA – utilizado en la síntesis de proteínas como un adaptador entre el RNA y los aminoácidos. RNA pequeños – participa en la maduración del pre-mRNA, el transporte de las proteínas hacia el retículo endoplasmático y en otros procesos celulares. La síntesis del RNA se produce por la RNA polimerasa. Cada tipo de RNA está sintetizado por un tipo distinto de RNA polimerasa. 3.1.2 Transcripción La RNA polimerasa es capaz de abrir localmente la doble hélice. Después de abrir la doble hélice la RNA polimerasa empieza a sintetizar el RNA siguiendo la secuencia del ADN de una cadena de las dos. El RNA siempre se sintetiza del extremo 5’ al extremo 3’ (5’!3’). A medida que el RNA crece, sale de la horquilla y la doble cadena de DNA vuelve a su estructura de doble hélice. La síntesis de RNA se produce en forma asincrónica – se sintetizan unas cadenas de RNA al mismo tiempo. Cada gen está codificado en una sola cadena (es decir, la secuencia complementaria no codifica el gen). Promotor es una secuencia determinada de DNA que forma parte del gen pero no se transcribe. La RNA polimerasa tiene mucha afinidad para el promotor. La secuencia del promotor es asimétrica en forma que orienta la RNA polimerasa hacia la dirección correcta del gen (derecha o izquierda). La cadena molde tiene que ir de 3’ a 5’ (para que la síntesis de RNA se haga de 5’ a 3’) y la RNA polimerasa elige la cadena que va de 3’ a 5’ de las dos cadenas de DNA. La síntesis sigue hasta que la RNA polimerasa llega al terminador (= secuencia de acabo). 3.1.3 Maduración del RNA 9 Las moléculas de cualquier tipo de RNA se denominan transcrito primario hasta que sufren la maduración. La maduración es diferente según el tipo de RNA. La maduración del RNA contiene tres fases: • Eliminación de intrones que son segmentos de RNA no codificante. Después de la eliminación de intrones queda secuencia de exones (segmentos codificantes). • Adición de cola poliadenina que se produce en el extremo 3’ • Adición de metil-guanosina que se produce en el extremo 5’ 3.2 Del RNA a la proteína 3.2.1 Características generales de traducción • • • • Código genético Codon y anticodon Como funciona el tRNA Como funciona la enzima aminacil RNA sintetasa. 3.2.2 Función de los ribosomas mRNA!!proteína El ribosoma está formado por proteínas (~80) y RNA. Se divide en dos subunidades, la subunidad mayor y subunidad menor. Los dos subunidades del ribosoma se desplazan sobre el mRNA. Captura moléculas de tRNA con los anticodones complementarios a los codones del mRNA. En la subunidad menor cada anticodon del tRNA se une al codon del mRNA. En la subunidad mayor se produce el enlace peptídico. Después de la formación del enlace peptídico el tRNA sale del ribosoma y el proceso repite hasta que el ribosoma llegue a secuencia de parada, que provoca la separación de las dos subunidades. El ribosoma tiene tres centros activos: • El área donde se capta el tRNA. • El área donde se produce el enlace peptídico. • El área por la cual se expulsa el tRNA libre. 3.2.3 Poliribosomas Cuando un mRNA sale del núcleo, se engancha a un ribosoma. El ribosoma empieza a sintetizar la proteína según la secuencia del RNA y después de un tiempo el extremo 5’ del mRNA queda libre. Entonces otro ribosoma se engancha al mRNA y el proceso repite. Así se forman los poliribosomas, que en realidad son una cadena de ribosomas sintetizando la misma proteína según una cadena única de mRNA al mismo tiempo. Viernes, 17 de octubre de 2003 3.2.4 Plegamiento de las proteínas La proteína tiene que plegarse para ser activada. La estructura tridimensional es muy importante y determina la función de la proteína. A veces aunque la secuencia es correcta, la proteína no se pliega correctamente. A veces, la proteína puede plegarse sin ayuda, y a veces necesita ‘ayuda’. Las proteínas que ayudan a otras proteínas plegarse se llaman ‘chaperones’. Hay dos tipos de chaperones: • hsp 70 – actúa en forma co-traduccional. Las hsp-70 se enganchan a la proteína a medida que ella sale del ribosoma, y la pliega. 10 hsp 60 – actúa en forma post-traduccional. Las proteínas que no han plegado correctamente a pesar de la ayuda de la hsp 70, entran dentro de la hsp 60 (la hsp 60 tiene forma de cavidad cerrada) y se engancha a las paredes internas de la hsp 60. Entonces la hsp 60 modifica la estructura tridimensional de la proteína y la pliega en forma distinta de la que tenía la proteína antes. En caso de malplegamiento a pesar de las dos proteínas chaperones, la proteína se degrada en la proteosoma. La proteosoma contiene enzimas llamadas proteasas, y degrada proteínas mal plegadas y proteínas con vida media corta. • Enfermedades causadas por proteínas mal plegadas A veces se forman proteínas mal plegadas que la proteosoma no puede degradar. Estas proteínas no degradables se acumulan en la célula, y causan la muerte de la célula. Después de la muerte de la célula se acumulan en el espacio intra-celular. Cuando esta acumulación está producida en un tejido de gran importancia (como tejido nervioso en el encéfalo) está acumulación causa enfermedades como alzheimer, BFE (vacas locas) y Creutzfeldt Jacob Disease (CJD). Hay gran diferencia entre el alzheimer y BFE y CJD. Normalmente, el cambio de proteína bien plegada a proteína mal plegada no degradable es muy raro. En BFE y CJD una proteína mal plegada, prion, tiene capacidad de modificar el plegamiento de una proteína normal en malplegamiento similar al del prion. Así se forma acumulación de los priones, y se produce los síntomas de la enfermedad. Estos priones no son degradables, y por tanto al comer tejido que contiene priones causa la enfermedad. 3.2.5 Control de la cantidad de proteína • • • • Control transcripcional Control del procesamiento del RNA Control de la traducción Control de la actividad de la proteína 4 Cromosomas y regulación génica 4.1 Estructura de cromosomas en eucariotas Núcleo – 5-8 µm ! DNA ha de plegarse de forma muy ordenada DNA – 2m Dos tipos de proteínas están encargadas del plegamiento del DNA: • Histonas • No histonas DNA + proteínas histonas y no histonas + proteínas de trascripción y regulación + proteínas de replicación + proteínas de reparación = CROMATINA Un cromosoma: • 1 moléculas de DNA + proteínas asociadas (antes de la replicación) • 2 moléculas de DNA + proteínas asociadas (después de la replicación) 11 El Nº de cromosomas puedes se parecido en especies cercanas (hombre y chimpancé) o distinto (ciervo chino y ciervo indio). Una forma de estudiar los cromosomas es utilizar colorantes con afinidad a las diferentes bases colorando los diferentes cromosomas según su riqueza de cada base. Lunes, 20 de octubre de 2003 Los cromosomas están completamente condensados solo durante la mitosis (metafase). El resto del tiempo, están mas condensados en unas áreas y menos condensados en otros, y no llegan al nivel de condensación que hay durante la mitosis. Hay diferentes niveles de condensación de los cromosomas mitóticos. • Nivel 1 – doble hélice 2nm • Nivel 2 – fibra de nucleosomas – 11 nm (collar de perlas) Nucleosoma – DNA envuelto alrededor de un núcleo proteico. Cada núcleo proteico está formado por 8 moléculas de histonas: 2H2A, 2H2B, 2H3, 2H4. el DNA que rodea el núcleo proteico contiene 146 pares de bases nitrogenadas más 50 pares de bases hasta la siguiente nucleosoma. Las histonas tienen carga positiva, por tanto tienen gran afinidad al DNA que está cargado negativamente. Esta interacción entre las histonas y el DNA ocurre en todo el DNA, porque no es específico a cierta secuencia de DNA. • Nivel 2 – fibra zigzag – 30 nm Este nivel de empaquetamiento está producido por otra histona – H1. la H1 produce cruzamiento de las ‘colas’ del DNA plegando la fibra de nucleosomas para formar fibra que tiene forma zigzag. Hay proteínas que se enganchan al DNA en secuencias específicas. Estas proteínas se enganchan al DNA en secuencias que no están enrolladas alrededor de nucleosomas, o en secuencias que están enrolladas alrededor de nucleosomas – en este caso la proteína desenrolla un poco la doble hélice de la nucleosoma para que sea mas accesible. Estas proteínas tienen varias funciones, por ejemplo, regulación génica. • Nivel 3 – fibra de 300 nm Este nivel consta de plegamiento de la fibra de 30 nm formando lazos. Las proteínas no histonas son las cuales que producen el enlace en la base de la fibra. La RNA polimerasa y DNA polimerasa pueden pasa al DNA sin deshacer todos las nucleosomas. Cuando es necesario transcribir o replicar el DNA, se abre el segmento del DNA a nivel de 11 nm para producir la transcripción/replicación. • Nivel 4 – fibra de 700 nm la fibra de 300 nm se enrolla alrededor de si misma (forma helicoidal). En este nivel se encuentra el empaquetamiento máximo del DNA. En la célula interfásica Hay zonas mas condensadas que se denomina heterocromatina (300nm). Las zonas de heterocromatina están diferenciadas de la eucromatina (11 nm ! transcripción o replicación, 30 nm ! quieto). La heterocromatina se encuentra en la periferia 12 del núcleo, y se ve mas oscuro (condensado) en el microscopio electrónico. Hay dos tipos de heterocromatina: • Heterocromatina constitutiva –tiene secuencias muy repetitivas de DNA y no codifican ninguna proteína tampoco ningún tipo de RNA. Se encuentra en humanos cerca de los centrómeros y de los telomeros. • Heterocromatina facultativa – se encuentra en las hembras de los mamíferos. En las hembras de los mamíferos, hay desactivación de uno de los cromosomas X durante el desarrollo embrionario que ocurre al azar. El cromosoma X desactivado nunca transcribe. Por tanto, cada hembra de mamífero es una mosaica de de cromosomas X – en unas células se expresa el X maternal y en otras se expresa el X paternal. Ejemplo: en gatos uno de los genes codificantes al color del pelo está localizado en el cromosoma X. al cruzar una hembra de color negro con un macho de color naranja se produce una descendiente con mosaica naranja-negro. El cromosoma X desactivado se denomina corpuscle Barr. Miércoles, 22 de octubre de 2003 4.2 Núcleo interfasico Sale: mRNA, tRNA, subunidades ribosómicas. Entra: DNA polimerasa, RNA polimerasa, proteínas de replicación, telomerasa, proteínas ribosómicas. El núcleo interfasico es muy ordenado, cada cromosoma ocupa un lugar delimitado dentro del núcleo. En todas las células los telomeros se enganchan a la envoltura nuclear (la envoltura nuclear consta de dos membranas lípidicas) alrededor de todo el núcleo. Nucleolo Un ejemplo extremo del orden nuclear es el nucleolo – estructura esférica en el centro del núcleo. No se rodea en membrana, por tanto no se considera como orgánulo. El nucleolo se ve como una zona más densa en el microscopio electrónico, y también se ve en el microscopio óptico. En los vertebrales hay muchas copias de los genes que codifican los cuatro rRNA repetidos uno tras el otro (en los brazos cortos de cromosomas Nº 13, 14, 15, 21, 22). El nucleolo es la región donde se encuentran todas las copias de estos genes codificantes a rRNA. Fabricación de rRNA en el nucleolo 1. transcripción de rRNA – transcrito primario no activo de gran tamaño. El transcrito primario consta de tres de los cuatro tipos de rRNA que existen, por tanto tiene tamaño así grande. 2. maduración del rRNA – el transcrito primario es cortado en los tres rRNA que lo forman. 3. la unión entre los rRNA maduros con las proteínas ribosómicas que entran al núcleo forma las dos subunidades de la ribosoma. 13 4.3 Regulación génica Introducción A partir de una única célula se obtienen diferentes tipos de célula bien diferenciados. En cada célula hay exactamente la misma información genética (excepto en los gametos, los eritrocitos (no tienen núcleo) y los linfocitos, que tienen capacidad de recombinar genes para adaptarse a estimulación constante produciendo nuevos anticuerpos, por tanto hay diferencias en la información genética que comportan). Las células son diferentes porque expresan diferentes genes: Célula Páncreas – células β Páncreas – células α Reticulocitos Linfocitos Mastocitos Proteínas comunes RNA polimerasa DNA polimerasa Proteínas de replicación Proteínas de membrana Tubulina, actina Proteínas diferenciadoras Insulina Glucagon Hemoglobina Anticuerpos Histamina ¿Cómo sabe cada célula que genes se expresan y que genes no se expresan? Hay proteínas que están activadas en la célula, y otras que están desactivadas. La activación o desactivación se produce por proteínas que se encuentran sobre la doble hélice. Promotores y regiones reguladoras Los genes en eucariotas tienen regiones reguladoras además de los promotores. Promotor – la zona en que se fija la RNA polimerasa al DNA para transcribir un gen. Región reguladora – la zona a la cual se unen las proteínas reguladoras. Las proteínas reguladoras son las que permiten o impiden la transcripción de un gen, reconocen la forma exterior de la secuencia reguladora de la doble hélice, que varía según la secuencia de bases, y se enganchan a ella. Las proteínas reguladoras se unen a la doble hélice a trabes de enlaces débiles, como puentes de hidrogeno. Cada proteína reguladora es específica a una secuencia reguladora de un gen. Viernes, 24 de octubre de 2003 4.3.1 Regulación de genes en Procariotas La activación o desactivación de genes es una función de las fuentes de alimentación en el medio. Hay dos mecanismos de regulación: represora y activadora. Regulación represora El complejo proteína reguladora + sustancia inhibe la activación del gen. Por ejemplo, la zona con los cinco genes codificantes para las diferentes enzimas que sintetizan triptófano quedan desactivados mientras hay triptófano en el medio, ya que el complejo proteína reguladora + triptófano inhibe la activación del gen. Cuando baja la concentración del 14 triptófano en el medio, el complejo no se forma y el gen está activado. Este mecanismo tiene carácter de feedback negativo. Regulación activadora En este tipo de regulación el complejo proteína reguladora + sustancia activa el gen. Por ejemplo, en presencia de glucosa no hay en la célula enzimas para otros tipos de azucares. Cuando hay falta de glucosa, la enzima adenilado ciclasa transforma ATP en cAMP, que se une a la proteína reguladora del gen codificante a enzimas para la lactosa. El complejo proteína reguladora + cAMP activa el gen. 4.3.2 Regulación de genes en eucariotas Las diferencias entre regulación procariota y eucariota: " La RNA polimerasa no es capaz de transcribir el DNA sola, sino que necesita la colaboración de factores generales de transcripción, que son proteínas pequeñas. Unos de las factores de transcripción se unen a la caja TATA (que tiene secuencia repetida de TA) y otros se unen a la RNA polimerasa. Estas proteínas no regulan la transcripción, ya que son generales y participan en todas las transcripciones. Entonces la participación de los factores de transcripción es necesaria pero no suficiente. " En eucariotas la mayoría de las proteínas reguladoras son activadoras y no represoras. " En procariotas hay una secuencia de zona reguladora-promotor-gen en contacte uno al otro. En eucariotas, las regiones reguladoras pueden estar alejados de los promotores. Para resolver el problema de la falta de contacte, la proteína reguladora se engancha a la RNA polimerasa plegando la doble hélice formando lazos de DNA. " En procariotas hay para cada gen (o bien un grupo de genes) una zona de regulación y una proteína de regulación. En eucariotas, para cada gen hay más de una zona de regulación, y por tanto más de una proteína de regulación, que están separadas una de la otra. Otra vez, para resolver el problema de la falta de contacte, la doble hélice se pliega para poner en contacte todas las proteínas reguladoras con la RNA polimerasa formando unos lazos de DNA. Como hay más de una proteína reguladora, la transcripción de un gen depende de estas varias proteínas. Este mecanismo de control génico se llama control combinatorio, y consta de comités de regulación. Una proteína puede formar parte en más de una comité reguladora. El control combinatorio es muy importante durante el desarrollo embrionario. Experimento Mioblastos – células de músculo estriado. Mientras el factor MioD no está en las células aquellas mantienen su estructura mononuclear y no contienen miosina y actina. Cuando aparece la MioD se produce fusión de células y se producen actina y miosina. Al añadir MioD a fibroblastos se produce fusión de células y producción de actina y miosina. Conclusión – los comités de regulación de los fibroblastos son muy parecidos a los comités de regulación de los mioblastos. 15 ¿Qué determina que algún gen sea activado mediante la adición de proteína reguladora? Las moléculas señales están producidas por pocas células embrionarias y están liberadas hacia fuera de aquellas células. Las moléculas señales difunden hacia las células vecinas alrededor de las células productoras y activan determinados genes en las aquellas células vecinas. ¿Qué provoca la producción y liberación de las moléculas señales? En un ovocito/cigoto hay diferentes concentraciones de sustancias en diferentes zonas del ovocito/zigoto. Al dividirse, estas sustancias se dividan entre las dos células hijas en forma no homogénea, según la concentración que había en la zona de la cual se forma, así que una célula tiene gran concentración y la otra pequeña concentración. La concentración de aquellas sustancias determina la diferenciación de las células. La célula que tiene la concentración alta formará parte del embrión, y la célula que tiene menor concentración formará las membranas externaembrionarias – la placenta etc. Lunes, 27 de octubre de 2003 Hasta el estado de ocho células todas son totipotentes (se pueden desarrollar en individuo completo). 6 Estructura de membranas La membrana determina el contenido de la célula o del orgánulo. Sirve como un filtre selectivo que permite la entrada a algunas sustancias y otras no. Funciones de las membranas Membranas plasmáticas: " Transporte – mediante proteínas de transporte a través de las cuales penetran las moléculas. " Receptora de información – mediante proteínas receptoras de señales. " Desplazamiento – mediante proteínas de adhesión (adhieren a superficies en el espacio intracelular y producen movimiento). Membranas intercelulares " Transporte " Soporte para reacciones enzimáticas. Estructura de la membrana 16 # Lípidos determinan la forma y característicos mecánicos # Proteínas determinan la función de la membrana # Sacáridos Doble capa lipidica en la cual sumerjan proteínas y sacáridos. Característicos mecánicos de membranas " se pueden extender sin romperse, lo hace por incorporación de moléculas. " En caso de rotura la membrana se arregla inmediatamente. 6.1 Bicapa lipidica La bicapa lipidica es una consecuencia del comportamiento de los lípidos en agua. Los lípidos son moléculas amfipáticas – tolerantes a dos medios diferentes. Tipos de lípidos: " Fosfolípidos – formados por una molécula de glicerol que está conectada a un grupo fosfato. El grupo fosfato está conectado a un grupo variado que determina el nombre del fosfolípido. Por el otro lado la molécula de glicerol está conectada a dos cadenas carbonadas que varían entre 14 y 24 C y pueden ser saturadas o insaturadas. Tienen una región polar, que es el grupo en la cabeza del fosfolípido, zona intermedia (glicerol) con polaridad mediana y región apolar que es las dos cadenas carbonadas. " " Esteroles o Colesterol – muy importante en células animales. Tiene una región polar muy pequeña, que es el grupo hidroxilo, zona intermedia muy rígida que es los cuatro anillos (polaridad mediana) y región apolar que es la cola carbonada. Glicolípidos – tiene una zona polar es la cabeza formada por un sacárido (simple o complejo) y una zona apolar que es la resta de la molécula. Todos tipos de lípidos so amfipáticos, es decir están bajos fuerzas conflictivas. Las estructuras que solucionan este conflicto son la micela y la bicapa lipidica. Las reacciones entre la bicapa y el agua – puentes de hidrogeno. Las reacciones entre los lípidos dentro de la bicapa – fuerzas de Van Der Vals. Las bicapas tienden a formar una esferas llenas de agua – explica porque la membrana se arregla inmediatamente al romperse. Micela 6.1.1 Fluidez de la bicapa El movimiento de cualquier lípido es dentro de su capa ! las capas se consideran como fluidos bidimensionales (el movimiento es solo en dos direcciones). Monocapa lipidica Movimientos permitidos " Rotación alrededor del eje vertical " Flexión respecto al eje vertical " Difusión lateral desplazamiento del lípido dentro de su capa lipidica. 17 Estos movimientos están debidos a la energía térmica. ↑ T ⇒↑ movimiento Movimientos prohibidos " Flipflop movimiento entre las dos capas lípidicas. No se produce naturalmente ya que el lípido necesita pasar su cabeza polar por dentro de toda la región apolar para moverse de una capa lipidica a otra. ↑ T ⇒↑ fluida la bicapa ⇒ la membrana ↓ T ⇒↓ fluida la bicapa ⇒ la membrana El grado de fluidez depende de: " Longitud de la cadena carbonada – mas larga la cadena carbonada se producen más fuerzas de Van Der Vals que causan que la membrana sea menos fluida. ↓ longitud ⇒↑ fluidez " Grado de saturación – entre cadenas saturadas hay mas contacte y se produce más fuerzas de Van Der Vals que causan que la membrana sea menos fluida. ↑ cadenas insaturadas ⇒↑ fluidez Miércoles, 29 de octubre de 2003 ¿Por qué es importante la fluidez de la membrana? La fluidez de la membrana para su funcionamiento. Cuando la membrana está rígida, no puede funcionar bien. Tres funciones perjudican a consecuencia de la solidificación de la membrana: " El transporte no lleva a cabo correctamente. " La de recepción de información no funciona correctamente, ya que en muchas ocasiones la proteína receptora, al recibir la señal, tiene que moverse dentro de la superficie de la membrana, y cuando la membrana no es fluida no se produce este movimiento y la recepción de la señal no lleva a cabo. " La redistribución de sustancias en la membrana no se produce, ya que las sustancias llegan a la membrana del interior de la célula en ciertos lugares delimitados, y si la membrana no es fluida no se pueden dispersar por difusión lateral en toda la membrana. Por la gran importancia de la fluidez de la membrana, organismos que no mantienen su temperatura, como bacteria, levaduras y animales de sangre fría mantienen la fluidez de sus membranas celulares cambiando la composición de los lípidos en sus membranas, por ejemplo, cuando baja la temperatura, producen mas lípidos de cadena corta y con mayor grado de instauraciones. Por otro lado, una membrana demasiado fluida no es deseada tampoco, porque cuando la membrana es demasiado fluida es también muy frágil. El papel del colesterol 18 El colesterol se coloca en los agujeros formados entre los fosfolípidos insaturados. Cuando hay muchas instauraciones la relación entre las moléculas de colesterol y los fosfolípidos pueden llegas hasta 1:1. El colesterol tiene una zona rígida formada por sus anillos carbonados rígidos, y esta estructura da rigidez a la membrana; por otro lado, el colesterol prohíbe la formación de fuerzas de Van Der Vals entre las cadenas carbonadas, así que tiene una función de tampón – mantiene la fluidez deseada en un rango mayor de temperaturas. 6.1.2 Asimetría de la bicapa lipidica. Las membranas son asimétricas, una capa es distinta de la otra. Componentes que determinan la asimetría: " Composición de los fosfolípidos. Dentro de cada capa hay una composición distinta de fosfolípido, que crea diferencia de carga entre las dos monocapas (la monocapa citosólica). " Los glicolípidos siempre se encuentran en la monocapa no citosólica. " Orientación de las proteínas – las proteínas se fijan en una cierta dirección y no se pueden cambiarla dando vueltas. Asimetría de fosfolípidos La asimetría de fosfolípidos se produce durante la síntesis de los fosfolípidos por el retículo endoplasmático liso – REL (el colesterol también es sintetizado allí). Las enzimas de síntesis de lípidos están sumergidas dentro de la membrana del REL así que su centro activo está mirando hacia la monocapa citosólica. Durante la síntesis la monocapa citosólica crece mientras que la monocapa no citosólica no crece. Para resolver este problema de crecimiento en una sola monocapa hay las flipasas. Las flipasas son enzimas que están encargados con el papel de facilitar el movimiento ‘flipflop’ de una monocapa a otra, movimiento que no se produce en condiciones normales. Las flipasas son específicas para cada tipo de fosfolípidos, así que la composición de la capa no citosólica está determinada por la composición de flipasas en cierta célula. Los trozos de bicapa lipidica formados en el REL llegan a las diferentes membranas en la célula mediante vesículas de transporte. Las bicapas siempre mantienen su orientación, tanto en el REL, en la vesícula de transporte y en la membrana plasmática. Asimetría de los glicolípidos La asimetría de los glicolípidos se produce durante la síntesis de los glicolípidos. La síntesis de los lípidos se produce en el REL, pero la glicocilación lleva a cabo en el aparato de golgi. Las enzimas de glicocilación están se localizan en la monocapa no citosólica del aparato de golgi, donde los lípidos sufren la glicocilación. Los glicolípidos llegan a la monocapa no citosólica de la membrana citoplasmática mediante vesículas de transporte manteniendo siempre su orientación. 6.1.3 Permeabilidad de la bicapa lipidica La bicapa lipidica es una barrera frente casi todas las moléculas hidrófilas. Moléculas que pueden pasar a través de la bicapa lipidica: " Moléculas hidrófobas pequeñas – O2, CO2, N2, benceno. " Moléculas hidrófilas no cargadas pequeñas – H2O, urea, glicerol. Moléculas que no pueden pasar a través de la bicapa lipidica: " Moléculas hidrófilas no cargadas grandes – aminoácidos, glucosa. Muy raramente atraviesan la bicapa lipidica, y si la atraviesan lo hacen con gran dificultad. " Iones – no pasan nunca por la bicapa lipidica ya que tienen carga formal. 19 6.2 Proteínas de membrana En general, la composición de lípidos y proteínas es 50%-50%. Hay casos particulares de membranas que tienen diferentes proporciones, como la membrana interna de la mitocondria, que tiene 75% de proteínas y 25% de lípidos, o de la membrana celular de las vainas de mielina, que contiene 75% de lípidos y 25% de proteínas. Como el tamaño de las proteínas es mas grande que lo de los lípidos, la proporción numeral es de una proteína para cada 50 moléculas de lípidos. Viernes, 31 de octubre de 2003 Clasificación de las proteínas de membrana según su Glicoproteína función: " Proteínas de transporte. Ej.: bomba Na+/K+. forman un poro acuoso a través del cual pasan los compuestos hidrófilos. " Proteínas conectoras. Se conectan con la matriz extracelular, con el citoesqueleto intracelular y con ambos. Ej.: integrina, que se adhiere a la actina (citoesqueleto) y con la fibronectina (matriz extracelular). " Proteínas receptoras. Son capaces de recibir señales moleculares del exterior y transmitir la orden adecuada al interior de la célula. Ej.: receptores para el factor de crecimiento derivado de plaquetas (PDGF) (plaquetas – )טסיות דם. En cualquier caso la señal no penetra a la célula. " Proteínas con actividad enzimática. Ej.: adenilado ciclasa (ATP ! cAMP) ha de estar enganchada a membrana para funcionar. Clasificación de las proteínas según su reacción con la membrana " Proteínas integrales. Tienen mucha interacción con la membrana. Se distinguen tres tipos: o Proteínas integrales transmembranosas: atraviesen la bicapa entera (salen por los dos extremos de la membrana) o Proteínas integrales no transmembranosas: tienen unión fuerte (por enlaces covalentes) con la membrana, pero están localizados fuera de la membrana. Se encuentran en las dos monocapas. o Proteínas que atraviesan solo una monocapa " Proteínas periféricas. Proteínas que están completamente fuera de la bicapa y están unidas a otras proteínas de membrana mediante enlaces intermoleculares – puentes de hidrogeno y fuerzas de Van Der Vals. Se encuentran tanto en la monocapa citosólica como en la monocapa no citosólica. 6.2.1 Patrones (patterns) de plegamiento 20 Las proteínas de membrana tienen estructuras muy especializadas para tener la estabilidad máxima dentro de la membrana. Para mantener esta estabilidad, como el esqueleto de la cadena polipeptídica es hidrófilo, las cadenas laterales de los aminoácidos que están mirando hacia los fosfolípidos de la membrana serán hidrófobas siempre. La cadena polipeptídica puede tomar forma de αhélice o de β-lámina. Cuando se forma una estructura de α-hélice, el esqueleto forma la estructura helicoidal por puentes de hidrogeno entre α-hélice aminoácidos consecutivos, y las cadenas laterales hidrófobas interaccionan con las cadenas carbonadas de los lípidos de membrana. Además, tiene cadenas lateral hidrófilas que miran hacia el interior del poro acuoso. Cuando se produce una estructura de β-lámina los puentes de hidrogeno se forman entre aminoácidos no consecutivos; las cadenas carbonadas que miran hacia los lípidos de membrana son hidrófobas, mientras que las que miran hacia el interior del poro son hidrófilas. Los poros celulares suelen ser formados por proteínas que atraviesen la membrana unas veces, especialmente cuando el poro está formado por βláminas. Los poros formados por β-láminas son de gran tamaño y tienen estructura muy rígida de β-lámina forma de barril, mientras que los poros formados por α-hélice son mucho más pequeños. Los poros celulares formado por β-láminas son los que dan mayoritariamente permeabilidad a la célula. 6.2.2 Corteza celular La corteza celular es un esqueleto proteico que se encuentra debajo de la membrana citoplasmática en células animales. Este esqueleto da forma a la membrana e impide que se rompan; la corteza está enganchada a la membrana por conexiones con proteínas de la membrana. El esqueleto está formado por espectrinas, proteínas formadas por dos cadenas polipeptídicas. Las espectrinas se enganchan una a otra formando una red bidimensional que se asocia a las proteínas de membrana. La función de este esqueleto en los eritrocitos es impedir que se rompan cuando pasen por los capilares más estrechos que ellos mismos. Hay anemias hemolíticas debidas a un gen codificante de la espectrina defectuoso, que produce eritrocitos que rompen con facilidad. 21 Lunes, 03 de noviembre de 2003 6.2.3 Movilidad de proteínas de membrana Experimento: Se hace fusionar una célula humana y una célula de ratón. Las proteínas de membrana de la célula humana están marcadas en verde, y las proteínas de la célula del ratón en rojo. En tiempo cero, hay disposición de 50%-50% de la célula humana. Después de 45 minutos las diferentes proteínas de membranas – tanto humana como de ratón se han dispersado por difusión lateral por toda la membrana. Sistemas para eliminar el movimiento de proteínas de membrana: " Adhesión de las proteínas a algún elemento fijo en el espacio intracelular. " Adhesión de las proteínas a algún elemento fijo en el espacio extracelular. " Reacción entre las proteínas y otras proteínas de membrana de una célula vecina. " Limitación de la zona de movimiento poniendo barreras fijas. Es muy notable en células epiteliales, en las cuales las proteínas de membrana en la zona apical tienen función muy distinta de las proteínas de membrana de la zona base-lateral. 6.2.4 Glicocálix Está formado por todos los sacáridos de una membrana. Aparece en la membrana plasmática, aparto de golgi y retículo endoplasmático. Siempre está mirando hacia la cara no citosólica, enganchado a lípidos o proteínas de membrana. Sus funciones: " Proteger y lubricar la célula. Como tiene gran cantidad de azucares, que tienden a absorber agua, esta zona queda viscosa y por tanto impide que la membrana se rompa fácilmente. " Reconocimiento de la célula. El glicocálix contiene información del reconocimiento de la célula, según su tipo, especie e individuo. Ejemplo: reconocimiento espermatozoide-ovocito, que lleva a cabo por las proteínas ZP3 en la membrana pelúcida (que es realmente un glicocálix) que están reconocidas por receptores específicos en los espermatozoides. Los espermatozoides solo reconocen el ZP3 de su especie. " Inhibición por contacte. Células en cultivo crecen hasta que pongan en contacto con otras células. El contacto entre el glicocálix de una células y los receptores proteicos de otra produce una señal de parada de crecimiento, y es reciproco. Células tumerales no tienen esta inhibición por contacte. " Extravasación. Los neutrófilos, que se transportan por vías sanguíneas, funcionan en los tejidos, cuando se produce allí una infección se desplazan hacia la infección y fagocitan las bacteria. Los neutrófilos atraviesan las paredes de los vasos sanguíneos por un mecanismo que consta de dos fases – primeramente se adhieren a las células endoteliales por receptores especiales para los neutrófilos que se encuentran en la membrana de las células endoteliales, y luego atraviesan la pared del vaso sanguínea entre las células endoteliales. 22 7 Transporte a través de la membrana Las sustancias que no pueden atravesar la bicapa lipidica necesitan penetrar a la célula por otro camino – por proteínas de transporte. Hay dos tipos de proteínas de transporte: " proteínas transportadoras opermeasas (carrier). En aquellas proteínas el soluto se une a la proteína transportadora, que sufre un cambio conformacional (que puede ser espontáneo o debido a liberación de energía) que causa la liberación del soluto hacia el otro lado de la membrana (interior ! exterior y viceversa). Este tipo de transporte sirve para iones inorgánicos y moléculas orgánicas pequeñas y no cargadas). " Proteínas de canal. El soluto no se une a la proteína de membrana. Normalmente sirve para iones inorgánicos: Na + , K + , PO4-3 , HCO3- , Ca 2+ . Especificación: Tanto las proteínas transportadora carrier como las proteínas transportadoras de canal son específicas para el soluto que transportan. La especificación de proteína transportadora carrier derive de su estructura tridimensional, que es única y especifica para cada soluto. La especificación de las proteínas de canal está debida a la carga del ión y a su tamaño. Estas proteínas portadoras tienen un cuello muy estrecho. Los aminoácidos que están en el cuello del canal determinan que carga podrá pasar, y el diámetro del cuello determina que tamaño de iones podrá pasar. Para impedir que pasen iones más pequeños que el cuello pero no específicos al canal hay otro mecanismo, como se puede ver en el canal de potasio. El diámetro del ión potasio es de 2,66 Å, mientras que el ión de sodio tiene diámetro de 1,9 Å. El potasio se engancha al canal, que tiene exactamente su diámetro. El potasio se pone en contacto con los grupos cetonas de la proteína y ellos le liberan de la molécula del agua a la cual ha estado enganchado. Solo entonces puede atravesar la proteína. Como el ión sodio tiene diámetro menor, no se pone en contacto con los grupos cetonas, no se libera del agua a la cual está enganchado y por tanto no puede atravesar la proteína. Miércoles, 05 de noviembre de 2003 Diferencias entre difusión simple y difusión facilitada Velocidad: La difusión facilitada tiene un límite de velocidad debido a la saturación de las proteínas transportadoras, mientras que la velocidad de la difusión simple aumenta linealmente con el aumento en la concentración del soluto. La velocidad de la difusión facilitada es más alta que la velocidad de la difusión simple hasta el límite de velocidad. Transporte activo y pasivo Transporte pasivo – a favor del gradiente. Transporte activo – contra el gradiente (normalmente – hay también casos de transporte active a favor del gradiente). Las proteínas canales funcionan a favor del gradiente – preforman transporte pasivo. Las proteínas transportadoras preforman transporte activo tanto como pasivo. 23 Cuando se considera un soluto sin carga eléctrica, solo interviene el gradiente de concentraciones en la difusión del soluto. Se consideran solo las moléculas del soluto en el gradiente de concentraciones. Cuando se considera un soluto con carga eléctrica, intervienen el gradiente de concentraciones y el gradiente electroquímico en los dos lados de la membrana. El gradiente electroquímico constituye la diferencia de cargas entre los dos lados de la membrana; se consideran todas las moléculas cargadas en el gradiente electroquímico. 7.1 Transporte por permeasas 7.1.1 Transporte pasivo Una de las proteínas transportadoras más importantes es la glucosa permeasa, que permite el transporte de glucosa a favor del gradiente. Se encuentra en la membrana plasmática de muchos tipos de células, como por ejemplo, en células del hígado. La glucosa permeasa atraviesa la membrana plasmática 12 veces formando un poro acuoso. La glucosa permeasa tiene dos conformaciones – una abierta hacia fuera y la otra abierta hacia dentro. El cambio de conformaciones se produce espontáneamente, es decir, no consume energía. La dirección neta de la difusión esta a favor del gradiente (como el cambio de conformaciones es espontáneo, la probabilidad de pasar una glucosa a través de la membrana es mas grande en dirección concentración alta ! concentración baja). Como funciona la glucosa permeasa (célula de hígado): " Después de comer. Concentración alta de glucosa en la sangre. La glucosa permeasa transporte glucosa de la sangre a la célula, a favor del gradiente. La glucosa polimeriza formando glicógeno, molécula de reserva. " Unas horas después de comer. La concentración de la glucosa en la sangre baja, y hay necesidad de liberar la glucosa almacenada en células del hígado. Como consecuencia del estimulo de una hormona, se produce la hidrólisis del glicógeno a glucosa. Hay transporte de glucosa a favor del gradiente, de las células hacia la sangre. 7.1.2 Transporte pasivo Las células a veces deben transportar solutos contra el gradiente, para mantener una cierta concentración en una zona de la célula, en la célula entera o fuera de la célula. Se distinguen dos tipos de transporte activo, según la fuente de energía que se utiliza: " Proteínas que utilizan la energía liberada durante la hidrólisis del ATP, denominadas ATPasas o bombas. " Proteínas que copulan un soluto A que entra a la célula a favor del gradiente (transporte pasivo) con un soluto B que entra a la célula contra el gradiente, utilizando la energía liberada en el transporte pasivo del A para transportar el B. El ión que permite este tipo de transporte en células animales es el Na+, y en células vegetales y bacteriales es el H+. Transporte pasivo libera energía mecánica, que las proteínas de transporte pasivo no pueden utilizar. Unas de las proteínas de transporte activo la pueden utilizar para transportar activamente otros solutos contra el gradiente. Viernes, 07 de noviembre de 2003 24 • ATPasa o bomba Na+/K+ En células animales hay muchas copias de esta bomba. La bomba mantiene la concentración del ión sodio baja y del ión potasio alta. Los dos solutos están transportados contra el gradiente, por tanto es un transporte que consume energía, que derive de la hidrólisis de un ATP por ciclo. En un ciclo de actividad de la bomba salen de la célula 3 Na+ y entran 2 K+. El ciclo de la bomba Na+/K+: 1. Inicialmente la conformación de la bomba es abierta hacia el interior de la célula. Se produce la unión entre la bomba y tres iones de sodio. 2. La unión entre los tres iones de sodio causa la hidrólisis de una molécula de ATP. La hidrólisis del ATP produce fosforilación de la bomba. 3. La energía liberada por la hidrólisis del ATP provoca el cambio de conformación – entonces la bomba está abierta hacia el exterior de la célula. 4. Los tres iones de sodio salen de la bomba. 5. Entran a la bomba dos iones de potasio. 6. La unión entre los dos iones de potasio provoca la defosforilación de la bomba, que en su turno provoca un cambio de conformación. 7. La bomba está abierta hacia el interior de la célula. 8. Los dos iones de potasio salen de la bomba, que vuelve a su estado inicial. La bomba de sodio/potasio tiene funcionamiento cíclico – no puede funcionar al revés (entrar sodio y sacar potasio). La bomba puede cumplir 60 vueltas al segundo, es decir, gasta 60 moléculas de ATP cada segundo. 30% del ATP producido por la célula animal están gastados para el mantenimiento de concentración baja de sodio dentro de la célula. Hay una droga, oubaina, que se une a los centros activos de las bombas sodio/potasio, e inhiben el funcionamiento de la bomba. El exceso de potasio sale de la células por canales de fuga de potasio (aun se mantiene la concentración de potasio mas alta dentro de la célula que fuera). Funciones de la bomba sodio-potasio • Mantener el volumen de la célula. Las células animales mantienen una concentración baja de solutos inorgánicos para recompensar la concentración alta de solutos orgánicos. La concentración del ión cloro se mantiene bajo por la carga relativa dentro de la célula, que es negativa (como en el ciclo del funcionamiento de la bomba sodiopotasio siempre salen mas sodios que entran potasios, se produce una carga relativa negativa). Por tanto, el ión cloro, que tiene carga negativa, esta repulsado. • Transporte activo acoplado. Transporte activo en las células del epitelio intestinal. El sodio penetra a la célula a favor del gradiente a través de la proteína de transporte acoplado. El transporte de sodio a favor del gradiente libera energía que la proteína utiliza para transportar la glucosa contra el gradiente – desde la cavidad intestinal hacia el interior de la célula. Así se produce un transporte una única dirección, independiente del gradiente. Mas tarde la glucosa sale de la célula al espacio extracelular por permeasas. El exceso de sodio está expulsado por la bomba de sodiopotasio, que se encuentran sobre toda la membrana. Vibrio Cholera – bacteria que causa la cólera. Produce una toxina que inhibe el funcionamiento de la bomba de sodio-potasio en la membrana de las células del epitelio intestinal. Las concentraciones del sodio dentro y fuera de las células se igualan, que como consecuencia causa que no haya transporte acoplado. La concentración de solutos en la 25 cavidad intestinal aumenta – agua pasa por osmosis a la cavidad intestinal – diarrea y deshidratación. • ATPasa o bomba Ca2+ La concentración del ión calcio se mantiene muy bajo dentro de la célula, ya que el calcio función como molécula señal dentro de la célula. Si la concentración no se mantuviera baja, la célula no podría distinguir fácilmente las diferencias en la concentración del calcio, y ello perdería su eficacia como molécula señal. Ejemplos del funcionamiento del ión calcio: • Células secretoras (tienen muchas vesículas de secreción. Ejemplo: células β del páncreas) – ↑ ⎡⎣Ca 2+ ⎤⎦ ⇒ exostosis de las vesículas de secreción. • Células musculares – ↑ ⎡⎣Ca 2+ ⎤⎦ ⇒ contracción de los filamentos de actina y miosina. Lunes, 11 de noviembre de 2003 En las células musculares las bombas de Ca2+ se encuentran en la membrana del REL que funciona como almacén de Ca2+ de la célula. Membrana REL Citosol La bomba Ca2+ mantiene la concentración del REL ión calcio bajo dentro de la célula, entonces las ↓↓ ⎡⎣Ca 2+ ⎤⎦ ⇒ 2+ fibras de actina y miosina están en estado Ca relajado. Al recibir el estimulo, las proteínas Relajación ATP canales se abren, entra calcio a la célula a favor estimulo del gradiente y se produce la contracción de las 2+ 2+ Δ ⎡ Ca ⎤ ⇒ fibras de actina y miosina, que es la contracción Ca ⎣ ⎦ del músculo. (Ver esquema). Contracción • ATPasa o bomba de H+ Células vegetales El transporte acoplado en células vegetales se produce mediante H+, por tanto, la célula tiene que mantener la concentración de H+ baja en el interior de la célula y alta en el exterior de la célula. En la vacuola se mantiene el pH bajo (ácido) mediante la bomba de H+. Las enzimas que se encuentran allí necesitan pH bajo para funcionar. Células animales El pH bajo en los lisosomas se mantiene bajo mediante la bomba H+ que expulsa los protones del citosol hacia el interior de la lisosoma. El pH tiene que mantenerse bajo en el lisosoma para desactivar las enzimas hidrolíticas que se encuentran allí. • ATPasa Cl– o bomba Cl– Las personas homocigotos para la mutación en el gen que codifica para la bomba Cl– presentan la enfermedad Fibrosis Cistica, la enfermedad genética mas frecuente en el ser humano, que se caracteriza por infecciones frecuentes en los tractos respiratorios e intestinales. Células del epitelio bronquial El moco que envuelve la cavidad bronquial debe ser expulsado regularmente, por tanto tiene que ser fluido. La fluidez de la mucosidad se mantiene por la bomba de Cl–. La bomba 26 expulsa Cl– hacia la mucosidad, donde se produce presión osmótica, que causa la osmosis del agua hacia la mucosidad. En un caso de una persona que es homocigoto para la mutación en el gen de la bomba Cl– , no hay expulsión de Cl– hacia la mucosidad, que queda muy viscosa, como consecuencia, los microorganismos que se acumulan en la mucosidad demasiado viscosa causan infecciones repetidas. • p170 o bomba MDR (Multi Drug Resistance) La bomba MDR es la única que no transporta iones. Su funcionamiento es la expulsión de drogas que pueden perjudicar la célula, por tanto se encuentra en células que están expuestas a drogas: riñón, hígado intestino. En algunos de los casos de tumores en aquellos tejidos, aparece una resistencia a la quimioterapia, que está debida a ampliación del gen que codifica la bomba MDR. Estas células tumorales, como presentan una multitud de bombas MDR, pueden sobrevivir la quimioterapia. La ampliación se produce en la mayoría de los casos por intercruzamiento. Otra enfermedad que está influida por la ampliación de este gen es la malaria. La malaria está causada por un parásito denominado plasmodium falciparum. La mayoría de los enfermos responden a una droga denominada cloroquina, pero hay casos en los cuales los pacientes no responden a aquella droga. En estos pacientes la enfermedad no responde a la cloroquina ya que en el plasmodium se produjo una ampliación del gen p170 que le da resistencia contra la cloroquina. 7.2 Transporte pasivo Velocidad de transporte de proteína canal – 106 iones/s Velocidad de transporte de proteína transportadora – 1000 moléculas o iones/s Los canales no gastan energía, ya que el transporte se produce a favor del gradiente. Los canales ‘gastan’ gradiente. Los canales no siempre están abiertos, pueden abrirse o cerrarse. En algunos de los casos, se abren y se cierren al azar, como en el caso del canal de fuga de potasio. El potasio sigue saliendo de la célula por el canal de fuga de K+ hasta que su gradiente electroquímico sea igual a cero. Como que cada vez que salga un ión K+ la carga interna va siendo más negativa, es más difícil para el K+, que tiene carga positiva, salir. Tipos de regulación de canales: Los canales están cerrados y sólo cuando se produce algún cambio determinado que provoca el cambio de su conformación y entonces se abren. • Canales regulados por voltaje – están reguladas por cambios en el potencial de membrana. Entre estos canales se encuentran los canales de Na+, K+ y Ca2+ que intervienen en la transmisión del impulso eléctrico a lo largo de la neurona. El canal regulado por voltaje más importante es el canal de sodio. Los canales regulados por voltaje tienen funcionamiento en reacción de cadena – un canal se abre, cambia el potencial de membrana en sus alrededores que provoca la abertura de otros canales que en su turno provocan la abertura de otros canales etc. 27 Miércoles, 12 de noviembre de 2003 • Canales regulados por unión a transmisor químico – un transmisor se une al canal provocando su abertura. El centre de unión puede estar localizado en ambos lados de la membrana, tanto interno como externo. Ejemplos: canales de Na+ y Ca2+ regulados por acetilcolina, que son responsables a la transmisión del impulso nervioso de la neurona al músculo. El impulso nervioso llega al final de la neurona, y provoca la abertura de los canales de Ca2+ regulados por voltaje. El Ca2+ que ha penetrado a la célula provoca la exocitosis de vesículas de acetilcolina. La acetilcolina se une a canales de Na+ en la célula muscular, y este canal al abrirse cambia el potencial de membrana en la célula muscular. El cambio del potencial de membrana provoca la abertura de canales de calcio regulados por voltaje, que están comunicados con los canales de Ca2+ en el REL (no se sabe exactamente como están comunicados) que se abren también. Por lo tanto, aumenta la concentración del Ca2+ y se contraen las fibras de actina y miosina, y se produce la contracción del músculo. • Canales regulados por estrés mecánico – estos canales no son específicos a algún ión, sino que dejan pasar a cualquier ión positivo cuando algo los aprieta. Por ejemplo, en las células ciliadas en los oídos, hay canales regulados por estrés mecánico en los cilios. Los canales están conectados cada uno a su cilio vecino. Cuando llega una onda sonar a los cilios, se produce movimiento de los cilios y el filamento que conecta el canal a su cilio vecino se mueve aplicando presión al canal que se abre. Entonces penetra al cilio iones positivos, que cambian el potencial de membrana y provocan la reacción de cadena a lo largo de la célula hasta que llegue el impulso a los nervios que pasan por debajo de las células ciliadas. 8 Mitocondria Las mitocondria son los responsables de que las células eucariotas sean aerobias. Células que no tengan mitocondria dependen en la glicólisis como fuente exclusivo de energía. 2ATP Sin mitocondria Glucosa Piruvato NAD Con mitocondria Glucosa + + NADH2 O2 CO2 + H2O 8.1 Características generales de mitocondria Las mitocondrias se encuentras tanto en células animales como en células vegetales. Normalmente tienen forma cilíndrica pero también pueden tener forma esférica o ramificada. A la mayor parte de las células las mitocondria se disponen a lo largo de los Microtubulos. Tambien pueden tener una disposicion más arreglada, formando trama y urdimbre ()שתי וערב con los filamentos de actina y miosina, como se ve en el músculo cardiaco. 28 Organización general de las mitocondria • Membrana mitocondrial externa • Membrana mitocondrial interna • Espacio interno • Matriz mitocondrial Las membrana interna se pliega formando las crestas mitocondriales, que se disponen en forma mas o menos paralela (el ATP se produce en la membrana interna, por tanto si se maximice la superficie de esta membrana se puede producir mas ATP). Los plegamientos de la membrana interna también pueden tomar forma de túbulos. Viernes, 14 de noviembre de 2003 8.2 Comparación química • Membrana mitocondrial exterior Es muy permeable debido a proteínas de transporte denominadas porinas. Las porinas están formadas por β-laminas, y tienen una forma de poro acuoso muy grande. Las porinas dejan pasar a cualquiera molécula hasta peso molecular de 5,000 D (D – Dalton, unidad de peso molecular). • Espacio intermembranoso En el espacio intermembranoso hay una composición química semblante a la del citosol, ya que la membrana exterior es muy permeable. • Membrana mitocondrial interna La membrana mitocondrial interna es muy impermeable, debida a su composición de lípidos, que contiene la cardiolipina, un fosfolípido con cuatro cadenas carbonadas, que aumenta la impermeabilidad de la membrana. También influye la composición de las proteínas transportadoras en la membrana. Composición química: o 76% proteínas o 24% lípidos o proteínas transportadoras (ATP, ADP) o proteínas de cadena respiratoria o ATP sintetasas • Matriz La matriz mitocondrial tiene la siguiente composición química: o Enzimas oxidativas o 5-6 moléculas de DNA circular (codifica unas cuantas proteínas que intervienen en las rutas metabólicas que llevan a cabo en la mitocondria además de unos lípidos) o ribosomas o mRNA sintetizan las proteínas que la mitocondria necesita o tRNA o rRNA o pocos H+ ! pH alto. 29 8.3 Hidrólisis oxidativa de nutrientes Las fuentes principales de energía son la oxidación de glucosa y de ácidos grasos. ¿Por qué se prefiere almacenar energía en forma de grasa? Porque el glicógeno se hidrata y así pesa más; una unidad de peso de grasa acumula 6 veces más energía que una unidad de peso de glicógeno. Orden de utilización: Glicógeno ! grasa propio de la célula ! movilización de grasa del tejido adiposo Tres grupos de reacciones: 1. reacciones de oxidación de metabolitos (azul) 2. reacciones de la cadena respiratoria (verde) 3. reacciones de fosforilación oxidativa (rojo) 8.3.1 Oxidación de metabolitos dentro de la mitocondria Oxidación de sacáridos Glucosa Glicólisis Piruvato Acetil CoA Ciclo de Krebs 2 CO2 3 NADH 1 FADH2 Oxidación de ácidos grasos Ácido graso β-oxidación Acetil CoA Ciclo de Krebs 2 CO2 3 NADH 1 FADH2 β-oxidación NADH Acil CoA (n C) 30 FADH2 Acetil CoA + Acil CoA ((n-2)C) Jueves, 20 de noviembre de 2003 8.3.2 Cadena respiratoria H+ + e- H H+ 2eFAD+ NADH 2H+ FADH2 2eFAD Los electrones pasan del NADH/FADH2 a las proteínas de la cadena respiratoria cuando éstos se oxidan en la cadena respiratoria, que consiste de proteínas sumergidas en la membrana mitocondrial interna. Los electrones se unen al oxigeno al final de su recorrido en la cadena respiratoria. Los protones, antes de unirse al oxigeno, están bombeados hacia el espacio intermembranoso. Las proteínas de la cadena respiratoria no tienen capacidad de movimiento, pero las moléculas pequeñas de la cadena se ponen en contacto con ellas y así pasan los electrones entre las proteína (proteína ! molécula pequeña !proteína). Los electrones pasan de una molécula con menor afinidad a los electrones a una molécula con mayor afinidad a los electrones. La afinidad depende del potencial Redox (reducción-oxidación) de la molécula. Mayor potencial Redox, mayor afinidad a electrones y viceversa. Cuando el electrón pasa de una molécula con cierto potencial Redox a una molécula con mayor potencial Redox se libera energía. El NADH tiene el potencial Redox mas bajo, y la pareja oxigeno + protón tiene el potencial mas alto. Las proteínas utilizan la energía liberada por el movimiento de los electrones de potencial Redox bajo a potencial Redox alto para bombear los protones H+ hacia el espacio intermembranoso contra el gradiente. Así se produce la acumulación de protones en el espacio intermembranoso, que sirve como almacén de energía. 8.3.3 Utilizaciones del gradiente de H+ La membrana mitocondrial interna es impermeable a H+ excepto a través de unas proteínas, así se produce el gradiente de H+ que sirve de almacén de energía. Este gradiente sirve para unas finalidades: • Fosforilación oxidativa • Transporte acoplado de nutrientes • Producción de calor (solo en algunas células) 8.3.3.1 Fosforilación oxidativa Para realizar la fosforilación oxidativa se utiliza la energía acumulada en el gradiente de H+. Una de las proteínas que permiten el transporte de H+ es la ATP sintetasa. La ATP sintetasa es una proteína enorme que deja pasar a los H+ a favor del gradiente y utiliza la energía liberada por este transporte para sintetizar ATP. La ATP sintetasa funciona como una turbina (turbina – traduce energía cinética en energía eléctrica). El flujo de H+ crea movimiento dentro de la proteína, que utiliza este movimiento capturando energía química en forma de enlaces éster en los ATPs el componente eléctrico del gradiente es mas potente que el gradiente químico en este caso. 8.3.3.2 Transporte de metabolitos 31 • Transporte acoplado H+ + piruvato • Transporte acoplado H+ + P– • Transporte acoplado ATP4– + ADP3– Los dos primeros gastan gradiente químico, mientras que el último gasta gradiente electroquímico: el ATP sale de la matriz a favor del gradiente eléctrico, liberando energía que la proteína utiliza para transportar el ADP contra el gradiente eléctrico. ATP +++++ ------ +++++ ------ ADP 8.3.3.3 Producción de calor No todas las mitocondrias pueden producir calor, solo las mitocondrias de las células del tejido adiposo oscuro. Aquellas mitocondrias tienen en su membrana mitocondrial interior un tercer tipo de proteínas, que se denominan proteínas termogénicas, además de la ATP sintetasa y las proteínas de transporte activo acoplado. Estas proteínas son muy parecidas a la ATP sintetasa, pero no tienen la parte que parece a una turbina. La energía que se libera el transporte de H+ a favor del gradiente, como no hay ninguna parte que la utiliza, se libera en forma de calor. El tejido adiposo oscuro se encuentra en mamíferos recién nacidos y en mamíferos hibernantes. Viernes, 22 de noviembre de 2003 9 Compartimentos intracelulares y transporte Como en células eucariotas hay reacciones incompatibles (síntesis de proteínas y degradación de proteínas, por ejemplo), hay que delimitar cada reacción en un compartimiento. 9.1 Organuelos rodeados por membrana Los microtubuolos determinan la localización de los orgánulos, y sus funciones se determinan a partir de su composición de proteínas. El movimiento de las vesículas de transporte entre los orgánulos se produce siguiendo los microtubulos. 9.1.1 Origen evolutivo de los orgánulos. Membrana RE Membrana AG Membrana EN (envoltura nuclear) Membrana endosomas (compartimiento por donde pasan las moléculas adquiridas por endocitosis antes de ser degradadas por la lisosoma) • Membrana lisosoma Todas estas membranas se formaron por la ‘invasión’ de membrana plasmática rodeando ciertas áreas en el citosol en las cuales se producían ciertas reacciones. La mitocondria y el cloroplasto se han enterado a la célula por endocitosis, y antes eran microorganismos independientes. Por tanto, estos orgánulos tienen dos membranas: la interior, que antes era propia del microorganismo, y la exterior, que proviene de la membrana plasmática. No hay trafico de vesículas entre la mitocondria y el cloroplasto y tampoco entre ambos y la EN, el AG o el RE. • • • • 32 9.1.2 Importación de proteínas a los orgánulos Todos los orgánulos han de crecer ya que se dividen entre las dos células hijas durante la mitosis. Los orgánulos crecen por incorporación de proteínas (macromoléculas) y de lípidos (a sus membranas). La síntesis de casi todas las proteínas comienza en el citosol (excepto 5% de las proteínas de la mitocondria y 10% de las proteínas del cloroplasto). ¿Qué ruta sigue una proteína para llegas a su destinación? La ruta que sigue la proteína depende de su destino: • Proteínas que terminan su síntesis en el citosol y se dirigen directamente a su destino: o Proteínas del citosol (actina, miosina, enzimas etc.) o Proteínas del interior del núcleo o Proteínas de la mitocondria o Proteínas del cloroplasto o Proteínas del peroxisoma • Proteínas que empiezan su síntesis en el citosol pero para cumplirla tienen que pasa por el RE. Solo después se dirigen a su destino: o Proteínas del AG o Proteínas de los endosomas o Proteínas de las lisosomas o Proteínas del exterior de la célula o Proteínas de la membrana plasmática o Proteínas de la envoltura nuclear RE AG Membrana plasmática Secreción Lisosomas La proteína se puede quedar en el RE o en el AG si es una proteína de uno de ellos. La mayoría de las proteínas es hidrófila, como las proteínas tienen que atravesar la membrana, eso crea problemas. Por tanto, hay unos mecanismos que permiten a las proteínas atravesar la membrana del orgánulo de destino: • Transporte a través de poros nucleares. Las proteínas penetran al núcleo completamente plegadas. • Transporte a través de las membranas (membranas de la mitocondria y del cloroplasto). Las proteínas tienen que atravesar la membrana a través de proteínas translocadors que están sumergidas en la membrana. Para atravesar han de desplegarse, porque el diámetro del poro de la proteína translocadora. • Transporte por vesículas (sirve para comunicación entre RE, AG, membrana plasmática, vesículas de secreción y lisosomas. La membrana del RE está comunicada con la membrana de la envoltura nuclear entonces las proteínas se pueden mover por difusión lateral.). La posición que tiene la proteína en el RE quedará durante todo su recorrido por vesículas y también en su orgánulo de destino. 9.1.3 Secuencias señal Las secuencias señal son secuencias de aminoácidos que forman parte de la proteína y que la dirigen hacia su orgánulo de destino. A veces lo importante es la secuencia de los aminoácidos, pero a veces lo que importa es que la proteína tenga secuencia de aminoácidos cargados positivamente. Siempre es importante la localización de la secuencia dentro de la 33 proteína. Cuando la proteína llega a su destino, se le elimina la secuencia señal si ésta se encuentra al inicio o al final de la cadena polipeptídica. Proteínas de citosol no necesitan secuencia señal ya que no necesitan entrar a ningún orgánulo. Lunes, 24 de noviembre de 2003 9.2 Transporte de proteínas a través de membranas 9.2.1 Importación de proteínas adentro del núcleo El núcleo está envuelto por doble membrana. Toda molécula que entra al núcleo o sale de él tiene que atravesar esta membrana doble, y eso se hace por los poros nucleares. Las moléculas pequeñas pasan casi sin problema, pero las macromoléculas, como son demasiado grandes para pasar sin ayuda por los poros, tienen un mecanismo que hace posible su paso por el poro. Proteínas: Solo las proteínas que marcadas con una señal de importación nuclear, que es una secuencia con carga positiva, pueden entrar al núcleo. Los receptores de importación nuclear reconocen la señal de importación nuclear y se enganchan a ella. Cuando el complejo proteína-receptor se acerca al poro nuclear, provoca la abertura de su diafragma así que el complejo puede atravesar el poro. Cuando el complejo ya está dentro del núcleo, éste se disocia y el receptor vuelve al citosol. Solo entonces el poro vuelve a su estado inicia. Si cambia solo un aminoácido dentro de la secuencia señal la proteína ya no puede penetrar al núcleo. RNA: Parte del RNA propio es conocido como secuencia de exportación del núcleo. Funciona en la misma manera como la importación de la proteína pero en sentido contrario. 9.2.2 Importación de proteínas a la mitocondria La mayoría de las proteínas de la mitocondria está sintetizada en el citosol, entonces la mitocondria necesita importarlas del citosol hacia su interior. La secuencia señal contiene aminoácidos cargados positivamente, pero no consecutivas (hay solapamiento en la secuencia) en posición amino-terminal de la proteína. La proteína está reconocida por un receptor sobre la membrana de la mitocondria, que forma parte de un complejo de proteínas de membrana. Al reconocerse se unen la proteína y el receptor formando el complejo proteína-receptor-translocadora. Entonces este complejo se mueve hacia un punto de contacto (zona en la cual hay contacto entre las dos membranas) y allí se pone en contacto con otra translocadora. Solo entonces empieza a penetrar la proteína a la células, secuencia señal primera – como tiene carga positiva es fácil para ella a penetrar porque la matriz tiene carga negativa. Antes de penetrar a la mitocondria por las translocadoras la proteína tiene que perder su plegamiento. Los chaperones (hsp 70) le ayuda a desplegarse, y a medida que penetra a la mitocondria vuelve a plegarse, otra vez con la ayuda de los chaperones (hsp 70). Las proteínas que se importan del citosol siempre llegan primeramente a la matriz mitocondrial. Las proteínas de membrana interna o de espacio intermembranoso tienen una señal además de la señal de importación a la mitocondria. Cuando la ésta se elimina, se descubre la segunda señal, que permite a la proteína pasar por otra translocadora a través de la membrana interna; la proteína queda enganchada a la membrana interna por la secuencia señal. Si la proteína es de membrana, quedará enganchada a la membrana; si es una proteína 34 de espacio intermembranoso, se corta la secuencia señal y la proteína ‘cae’ hacia el espacio intermembranoso. Los lípidos llegan a la mitocondria por proteínas de transporte de fosfolípidos: la proteína ‘coge’ un fosfolípido (estas proteínas son especificas a cada fosfolípido) de la membrana del REL, y lo lleva a la membrana de la mitocondria; lo deja allí y vuelve a recoger un lípido mas (funcionamiento cíclico). Los lípidos cambian de monocapa por flipasas, y camban de una membrana a otra en los puntos de contacte. 9.2.3 Importación de proteínas al RE Las proteínas que han penetrado al RE tienen dos posibilidades: caer a la cavidad del RE (que determina que siempre estarán dentro de cavidades) o quedar sumergidas en la membrana del RE (que determina que serán proteínas de membrana). La secuencia señal es la que determine cual de los dos posibles camino cogerá la proteína. Miércoles, 26 de noviembre de 2003 Cuando el mRNA sale del núcleo, se enganchan a él los dos subunidades del ribosoma, que empieza a sintetizar la proteína. Si la proteína tiene en su extremo amino-terminal (por el cual empieza la síntesis) una señal de importación al RE (para terminar allí su síntesis) todo el complejo mRNA-ribosoma-proteína en síntesis se traslada a la membrana del RE. El mecanismo por el cual se traslada es el siguiente: Una proteína – SRP – reconoce la secuencia señal de la proteína en síntesis, y se une a la secuencia señal. Esta unión provoca parada temporal de síntesis en la ribosoma. El complejo entero es reconocido por una proteína receptora en la membrana del RE que es específica a la SRP cuando ésta esté unida a la secuencia señal. La SRP se une al receptor y el complejo se engancha a la membrana del RE. Una vez el complejo esté enganchado a la membrana, la SRP se libera de la secuencia señal y la proteína vuelve a ser sintetizada. Al volver a ser sintetizada penetra por una proteína translocadora que se encuentra al lado del receptor secuencia señal primera. A medida que avanza la síntesis la proteína cae a la cavidad del RE, pero la secuencia señal queda dentro de la proteína translocadora todo el tiempo, así que se forma un ‘loop’. Cuando la síntesis de la proteína ha terminado el ribosoma se libera al citosol y la proteína queda enganchada a la translocadora. La translocadora se abre y libera la proteína, que aun ésta queda enganchada a la membrana por la secuencia señal. Si la proteína nueva es una proteína de cavidad, una enzima corta la proteína de la secuencia señal y ésta cae a la cavidad; si es una proteína de membrana, se queda enganchada a la membrana por la secuencia señal. Las proteínas pueden tener una señal de ‘stop’ que para su transporte a través de la translocadora. Estas secuencias señales son las partes de la proteína que quedan sumergidos en la membrana. Proteínas que atraviesan la membrana más de una vez tienen señales de ‘start’ y ‘stop’ alternadas. La primera señal se elimina, y el resto de las señales queda sumergido en la membrana. 35 9.3 Bases del transporte vesicular La entrada de la proteína al RE muchas veces es solo el primer paso en el camino de la proteína. Hay tres vías conectadas por vesículas: • Ruta biosintética secretora: RE AG Vesículas Membrana plasmática Exterior Endosomas Lisosomas • Ruta endolítica: exterior → membrana plasmática → endosomas → lisosomas • Rutas de recuperación: Reciclaje de receptores – ruta de devolución de receptores de los orgánulos a su origen. En cada uno de los compartimientos las proteínas y los lípidos pueden quedarse. Cada vesícula ha de contener las proteínas adecuadas a su destino. Además, cada vesícula ha da saber a que molécula tiene que fusionarse. Las proteínas SNARE son las que se encargan de asegurar que la vesícula se fusione con la membrana adecuada. 9.3.1 Formación de vesículas recubiertas Las proteínas que intervienen en la formación y la fusión de las vesículas son: • Proteínas de recubrimiento: o Clatrinas o COP I o COP II • Proteínas SNARE Todas las proteínas de recubrimiento tienen funcionamiento similar pero en diferentes rutas. Nos concentramos solo en las clatrinas para demostrar este funcionamiento. Las clatrinas son proteínas libres en el citosol. Mientras no funcionan tienen forma de trípode angulada. Cuando se unen a una membrana le causan a la membrana una depresión. A la medida que se unen mas clatrinas a la membrana, la depresión se hace mas profunda hasta que forma una esfera que está unida al orgánulo por un ‘cuello’. La vesícula se libera del orgánulo cuando una enzima se enrolla sobre el cuello de la vesícula y lo estrangula. Así se forma una vesícula independiente. Mientras la vesícula está recubierta por las clatrinas, no puede fusionarse a ningún orgánulo. Las proteínas de recubrimiento no se enganchan directamente a la membrana; se unen a adaptadoras (por ejemplo, adaptina) que se unen a los receptores de moléculas de cargo de la vesícula. Las clatrinas concentran las moléculas en una zona que dará lugar a la vesícula. Viernes, 28 de noviembre de 2003 9.3.2 Fusión vesícula-orgánulo Las proteínas SNARE se dividen en dos grupos, V y T (V – vesícula, T – target). Cada VSNARE reconoce solo un T-SNARE. Las vesículas solo se fusionan con el orgánulo que tiene un T-SNARE que corresponde a su V-SNARE. Las vesículas necesitan acercarse lo máximo a la membrana del orgánulo de destino para fusionarse con él. Por tanto, como las proteínas de recubrimiento son una barrera entre las dos membrana, ha de desaparecerse antes de la fusión. La bacteria anaerobia C. butulinis produce una toxina que rompe los V-SNARE de las vesículas de secreción de neurotransmisores. Como consecuencia, estas vesículas no pueden 36 fusionarse con la membrana plasmática y liberar su contenido a la sinapsis ! no hay transmisión de señales nerviosas ! no hay actividad muscular. 9.4 Ruta biosintética secretora RE AG Vesículas Endosomas Membrana plasmática Lisosomas Exterior 9.4.1 RE – síntesis de proteínas y de lípidos Funciones del RE – síntesis de proteínas y de lípidos. La síntesis de lípidos está producida en el REL y a diferencia de la síntesis de ADN, RNA y proteínas (replicación o traducción de una secuencia codificada), esta síntesis consta de la unión de unidades prefabricadas por enzimas. 9.4.2 RE – glicosilación de proteínas Las proteínas sintetizadas al RE frecuentemente llevan un grupo de sacáridos. En proteínas transmembranales el grupo sacárido siempre se encuentra en la cavidad. Las cligosilaciones en el ER se hacen moviendo sacáridos en bloques, por tanto todas las glicoproteínas que se encuentran en el RE tienen el mismo grupo sacárido, que contiene 14 monosacáridos. 9.4.3 Paso por AG Primeramente, el AG reconoce todas las proteínas residentes del RE y los devuelve a él. Todas las proteínas residentes de RE tienen una secuencia KDEL. Al reconocer esta secuencia en alguna proteína, el AG le envía al RE. El reconocimiento de la señal KDEL es gracias a proteínas receptoras a la membrana del AG. El AG se organiza formando dictiosomas. El transporte de proteínas siempre se hace en dirección cis → trans. En nivel estructural hay tres regiones: • Red cis golgi formada por vesículas y túbulos. Su función es recibir las proteínas y lípidos del RE. • Región media de golgi, formada por sacos aplanados. Su función es manipular los lípidos y proteínas. • Red trans golgi formada también por vesículas y túbulos. Su función es distribuir las proteínas y lípidos a la membrana plasmática y a lisosomas. 9.4.4 Glicosilación a AG A AG se glicosilan proteínas y lípidos, normalmente cuando pasan por el compartimiento medio. ¿Cómo son aquellas glicosilaciones? • Proteínas glicosiladas – se corta el grupo sacárido y se produce diversidad añadiendo diferentes monosacáridos. • Proteínas y lípidos no glicosilados – se añaden monosacáridos produciendo nuevos glicoproteínas y glicolípidos. Utilización: Grupos sanguíneo en los mamíferos. Los eritrocitos no tienen RE ni AG, por tanto ¿dónde se han producido los glicolípidos que son los antígenos A, B y O? Los antígenos A, B y O se han producido en el ER y AG de los eritroblastos, que son las células precursoras de los eritrocitos. Todos los individuos tienen capacidad de producir el anfígeno O. Los individuos de grupo A tienen además una enzima que convierte este anfígeno a anfígeno A, los individuos de grupo 37 B otra enzima que convierte el anfígeno O a anfígeno B y los individuos de grupo AB tienen las dos enzimas. ¿Para qué sirve la glicosilación? La glicosilación tiene diferentes funciones según el orgánulo de destino: Membrana plasmática → glicocálix, reconocimiento Lisosomas → proteger las proteínas de membrana del lisosoma. Los sacáridos dificultan la degradación de las proteínas de membrana por las enzimas hidrolíticas del lisosoma. 9.4.5 Transporte de vesículas hacia la membrana plasmática Todas las vesículas que van desde el AG para fusionarse con la membrana plasmática forman parte de la ruta secretora. Secreción constitutiva La secreción constitutiva es la que consiste en formación de vesículas de transporte que a medida que se forman, fusionan con la membrana plasmática. Al fusionarse con la membrana llevan proteínas y lípidos de membrana, además de proteínas solubles en agua al exterior de la célula. Estas vesículas no portan ninguna señal. Secreción reguladora En la secreción reguladora las vesículas quedan en el citosol hasta que llega una señal que provoca la fusion de todas las vesículas almacenadas en la célula. La señal que provoca esta secreción es una señal de agregación. No todas las células preforman este tipo de transporte de vesículas – solo las células secretoras que producen alguna proteína en gran cantidad con la finalidad de segregarla, como las células-β del páncreas, los linfocitos, mastocitos. Por ejemplo, los mastocitos están encargados de producir una proteína – la histamina. La célula produce histamina constantemente mientras esté inactiva. Los mastocitos tienen anticuerpos que reconocen ciertos antígenos. Cuando los mastocitos se ponen en contacto con un antígeno que proviene de infección, la célula segrega todas las vesículas de secreción regulada (que están llenas de histamina) al mismo tiempo. La histamina aumenta la permeabilidad de la pared de los vasos sanguíneos para facilitar el movimiento de los linfocitos – facilitar la reacción defensiva. 9.4.6 Transporte de proteínas hacia lisosomas El transporte de proteínas hacia lisosomas siempre pasa por endosmas. A partir del AG se forman vesículas que se dirigen hacia los lisosomas, y contienen enzimas hidrolíticas y proteínas de membrana del lisosoma. El AG reconoce las proteína que han de empaquetarse en vesículas que se dirigen a lisosomas y endosomas por una señal que llevan todas – un sacárido menosa fosforilado. El AG reconoce esta señal por receptores, a los cuales se enganchan las enzimas. Se forma una vesícula que va a fusionarse con una endosoma. Los receptores liberan las proteínas y vuelven al AG vacíos por vesículas de recuperación de receptores. La parte proteica ! síntesis en RE Grupo sacárido ! RE La fosforilación lleva a cabo en la red cis golgi. La enzima fosfotransferasa, residente de la red cis golgi reconoce una parte de la estructura secundaria (esta estructura especial se denomina ‘signal patch’) de la proteína que es muy parecida en todas las enzimas de los lisosomas, y los fosforila. Señales que intervienen en el transporte de proteínas: 38 • • • • • Retención a RE – KDEL, KKXX Retención a AG – desconocidos Lisosomas – menosa fosforilada Secreción constitutiva – nada Secreción reguladora – señal de agregación. 9.5 Rutas de endocitosis Partícula >>macromolécula Hay tres mecanismos básicos de endocitosis: • Fagocitosis – permite la entrada de partículas. No todas las células pueden hacer fagocitosis. Funciones: defensa, renovación celular. • Pinocitosis – permite entrada de macromoléculas del exterior celular. Es un proceso no selectivo. Existe en todas las células. • Endocitosis mediada por receptores – también permite la entrada de macromoléculas, pero es un proceso específico. Existe en todas las células. 9.5.1 Fagocitosis En animales hay pocos tipos de células que son capaces de preformar fagocitosis. La fagocitosis se hace por pseudopodas, que son estructuras formadas por los microtubulos, porque esta estructura es demasiado grande para ser formada por clatrinas. Las fibras se polimerizan y así envuelven la partícula, formando una vesícula muy grande denominada fagosoma, que va a pasar el mismo proceso como las vesículas que provienen del pinocitosis y del endocitosis por tanto el resto del proceso ocupará otro apartado. 9.5.2 Pinocitosis En la pinocitosis se forman pequeñas vesículas a nivel de la membrana plasmática. Estas vesículas contienen líquido extracelular rico en macromoléculas. La entrada no es especifica, por tanto penetran tantas macromoléculas deseadas como no deseadas. 9.5.3 Endocitosis El endocitosis es un proceso selectivo, a diferencia del pinocitosis. En este caso hay receptores en la membrana plasmática que reconocen las macromoléculas deseadas y las captan. Alrededor de la macromolécula captada se forma una vesícula que la transporte al interior de la célula. El transporte del colesterol, por ejemplo, se hace así. El colesterol no está libre en la sangre, sino que está acumulado en partículas formadas por proteínas (LDL, HDL etc.). Aunque son partículas, en relación del transporte se comportan como macromoléculas. El LDL es reconocido por los receptores en la membrana de la célula y se engancha a él. Entonces se forma una vesícula alrededor del LDL y la partícula penetra a la célula. Miércoles, 03 de diciembre de 2003 El receptor de LDL reconoce la parte proteica del LDL y los dos se unen. Al receptor unido al LDL se une la adaptina, a la cual se une clatrina mas tarde para formar una vesícula. La vesícula se une a una endosoma, que tiene pH mas bajo. El pH bajo provoca la separación del LDL del 39 receptor. Los receptores se concentran y se empaquetan en una vesícula de reciclaje mientras que el LDL se empaqueta en una vesícula destinada a unirse a lisosoma. El lisosoma degrada el LDL y libera colesterol libre al citosol. Hipercolesterolemia familiar – el nivel alto de colesterol sanguíneo causa su acumulación sobre las paredes de las arterias formando capas arterioscleróticas, que causan ataques cardíacos en jóvenes. La enfermedad está debida a mutaciones en el gen que codifica el receptor para el LDL. En algunos de los casos, la mutación se encuentra en la secuencia que codifica la parte interior del receptor, entonces el receptor puede unirse con el colesterol, pero no puede unirse con la adaptina, por tanto no forma una vesícula y el colesterol queda unido a la membrana celular. En otros casos, hay deformación en el centro de reconocimiento del receptor, por tanto el LDL no se une al receptor. Muchas sustancias están transportados por el endocitosis mediada por receptores, como la vitamina B12, hierro etc. El HIV sabe manipular y utilizar este mecanismo de transporte para penetrar a células. 9.5.4 Endosomas El material que es captado por Pinocitosis y endocitosis mediado por receptores pasa por endosomas. En la célula hay dos tipos de endosomas, primarias y secundarias. Las endosomas primarias se encuentran cerca de la membrana plasmática; las endosomas secundarias se encuentran cerca del núcleo. Endosomas primarias – compartimiento de clasificación y distribución del material. A partir de ésta salen vesículas, que van hacia tres destinos: • Vía de reciclaje • Endosomas secundarios y lisosomas • Trancitosis El trancitosis es un proceso en el cual material adquirido por endocitosis mediada por receptoras está empaquetado en la endosoma en vesículas destinadas a exocitosis. El trancitosis sirve solo en células que tienen dos fluidos completamente diferentes, como las células epiteliales del intestino. Este mecanismo es muy importante para la captación de anticuerpos de la leche en mamíferos recién nacidos. Los anticuerpos, mientras están en el intestino, están inactivados por el pH intestinal. Los receptores en la membrana de células del epitelio intestinal reconocen los anticuerpos por la parte común de todos los anticuerpos. Los anticuerpos son transportados adentro de la célula por endocitosis mediada, y se dirigen hacia una endosoma. En la endosoma son empaquetados en otra vesícula, que se une con la membrana plasmática preformando exocitosis. Al llegar a la sangre se activan los anticuerpos por el cambio de pH. Así se absorban los anticuerpos en la sangre del recién nacido, que no tiene aun capacidad de producir sus anticuerpos por si mismo. Endosomas secundarias – contienen la parte del material adquirido en la endocitosis y pinocitosis que no ha sido reciclado ni ha pasado trancitosis. En la endosoma secundaria se encuentran enzimas hidrolíticas, y allí iniciará la hidrólisis del material, pero no es completa porque el pH (6) de la endosoma no es adecuado para la función de las enzimas. La digestión se acaba en el lisosoma. 9.5.5 Lisosomas El lisosoma es el compartimiento donde se realiza la mayor parte de la digestión del material obtenido por endocitosis. Los lisosomas contienen una barrera de enzimas hidrolíticas denominadas hidrolasas ácidas, que funcionan en pH ácido (5). En la membrana del lisosoma hay bombas de protones que están encargadas de mantener el pH ácido, y proteínas de transporte que permiten exportar al citosol los productos de la digestión. El lisosoma no degrada únicamente material de endocitosis, sino que también material que proviene de 40 autofage y de fagocitosis. El autofagosoma se forma cuando el orgánulo viejo es recubierto por membrana del REL, poco a poco, hasta formar una cavidad que contiene el orgánulo. El autosoma es equivalente al fagosoma. Autofagosoma pueden fusionarse con una endosoma o con un lisosoma. 10 Citoesqueleto 10.1 Introducción El citoesqueleto es un conjunto de fibras que se encuentra en células eucariotas. Tienen funciones muy importantes: • Dar forma a la célula. • Cambiar de forma – contracción de células musculares, producir el movimiento de la célula durante el desarrollo embrionario. • Responsable de mantener la célula en su lugar. • Responsable del movimiento de células. • Responsable del movimiento de vesículas. El citoesqueleto está formado por tres tipos de filamentos: • Actina (proteína característica: actina) • Microtubulos (proteína característica: tubulina) • Filamentos intermedios (diferentes proteínas) 10.2 Filamentos intermedios 10.3 Microtubulos 10.3.1 Estructura de los microtubulos Los microtubulos son los filamentos más gruesos de los tres tipos. Son tubos vacíos de diámetro de 50 nm. Los microtubulos son polímeros de tubulina, una proteína formada por dos polipéptidos, α-tubulina β-tubulina. Las moléculas de tubulina se ponen una detrás de la otra formando un protofilamento. El microtubulo tiene 13 protofilamentos ordenados así que en un extremo hay solo α-tubulina y en el otro solo β-tubulina. Este orden polariza el microtubulo, que tiene en el extremo α carga negativa y en el extremo β carga positiva. 41 Viernes, 05 de diciembre de 2003 Cada protofilamento está polarizado, por tanto los microtubulos también están polarizados. Los dos extremos del microtubulo se comportan diferentemente. In Vitro • [tubulina libre] ↑⇒ crece más rápidamente en el extremo positivo que en el extremo • negativo. [tubulina libre] ↓⇒ en el extremo positivo crece y en el extremo negativo decrece. In Vivo Los dos extremos se comportan diferentemente. El extremo negativo está protegido por tanto solo crece y decrece el extremo positivo. En raras ocasiones el extremo negativo no está recubierto y puede crecer y decrecer. 10.3.2 Clasificación de microtubulos Los microtubulos siempre forman estructuras en la célula, pero las estructuras que forman pueden variar en su grado de estabilidad. Como los microtubulos son todos idénticos en toda estructura, la inestabilidad está debida al montaje y desmontaje constantes. Estructuras inestables – microtubulos citosolicos Red radial – se encuentra solo en células en interfase. Sale de su centro a toda la célula. Cuando la célula empieza a dividirse, la tubulina está desmontada y de la tubulina libre se forman los husos mitóticos o husos acromáticos en dos estructuras radiales – los polos de huso. El comportamiento de los microtubulos es distinto en la red radial frente al huso mitótico. Los microtubulos del huso acromático tienen una dinámica más rápida de los microtubulos de la red radial, ya que tienen que producir movimiento mientras que la red radial tiene que sostener los organuelos de la célula. Función red radial: mantener orgánulos a su lugar correspondiente. Función huso mitótico: separar cromátidas segregando el material genético. Estructuras estables – microtubulos no citosolicos Se encuentran en cilios, flagelos y axones de neuronas, estructuras axonemales. 10.3.3 Centros de organización de microtubulos (MTOC) Todo microtubulo, tanto de estructura lábil como de estructura estable inicia su polimerización con la ayuda de centros de organización de microtubulos. El microtubulos sale del centro de organización. Hay diferentes centros de organización en función de las estructuras que inician a construir. • célula no ciliada en interfase: un MTOC denominado centrosoma. Al centrosoma se une el extremo negativo y el extremo positivo va hacia la periferia de la célula. • célula no ciliada en mitosis: 2 MTOC, que son los polos de huso. Aquí la disposicion de los microtubulos es similar a la anterior (red radial). • célula ciliada en interfase: tiene un centrosoma y un MTOC para cada cilio/flagelo, denominado cuerpo basal. Dentro del cuerpo basal hay un sentidlo. nota – las células ciliadas en eucariotas se encuentran en interfase la mayoría del tiempo – no proliferan mucho. Funciones generales de los MTOC 42 • • Hincar la formación de microtubulos. Estabilizar el extremo negativo del microtubulo y protegerlo. Constituyentes de centros organizadores: • Centrosomas y polos de huso: un par de centriolos y material periocentriolar (membrana que envuelta los centriolos). • Cuerpo basal: centriolo del cuerpo basal. Estructura de los centriolos Los centriolos están formados por 9 grupos de 3 microtubulos organizados en estructuras periféricas. Cada grupo de microtubulos está formado por un microtubulo completo, A (13 protofilamentos) y dos microtubulos incompletos, B y C (10 protofilamentos). ¿Cómo se montan los centros organizadores para iniciar la formación de un microtubulo? • Cuerpo basal – se alarga los microtubulos del cuerpo basal, pero solo los microtubulos A y B (uno completo y uno incompleto). • Centrosoma – el material periocentriolar tiene otro tipo de tubulina – γ-tubulina, que forma anillos de 13 unidades gracias a ayuda de otras proteínas del material periocentriolar. El anillo funciona como sitios iniciadores a partir los cuales inicia la formación de los protofilamentos, de cada γ-tubulina del anillo se forma un protofilamento. El papel del centriolo en un centrosoma y un polo de huso es facilitar la multiplicación del centrosoma. Los centriolos en los cuerpos basales se forman a partir de las centrosomas durante el desarrollo embrionario (van duplicándose). 10.3.4 Dinámica de microtubulos citosolicos Los microtubulos polimerizan y despolimerizan en sus extremos positivos en función de la concentración de tubulina libre en el citosol: [tubulina libre] ↑⇒ Polimeriza [tubulina libre] ↓⇒ Despolimeriza La velocidad de la polimerización es más lenta que la velocidad de la despolimerización. Esta diferencia se denomina inestabilidad dinámica. Por eso, al mismo tiempo hay en la célula microtubulos en crecimiento y microtubulos que decrecen o recién decrecidos. Los nuevos microtubulos se forman a partir de la tubulina liberada por la despolimerización de otros microtubulos. Miércoles, 10 de diciembre de 2003 43 El motivo de la inestabilidad dinámica es una molécula de GTP que el dimero de tubulina lleva pegado a él. Poco después de la polimerización de la tubulina (su unión a protofilamento) el GTP hidroliza a GDP, que hace la conexión entre las tubulinas mas frágil. [tubulina libre] ↑⇒ Velocidad de polimerización > velocidad de hidrólisis del GDP ! el microtubulo crece. [tubulina libre] ↓⇒ Velocidad de polimerización < velocidad de hidrólisis del GDP ! el capucho GTP desaparece y el microtubulo descompone. La conformación de protofilamento formado por tubulina unida a GTP (protofilamento recto) es diferente de la conformación de protofilamento formado por tubulina unida a GDP (curvado). Como a lo largo del protofilamento se produce constantemente la hidrólisis del GTP, lo que mantiene la estabilidad del microtubulo es el capucho GTP, que estabiliza todo el microtubulo. Si desaparece, el microtubulo es inestable y va descomponiéndose. ¿Para qué sirve la inestabilidad dinámica? La inestabilidad dinámica sirve para la exploración de la célula. Solo los microtubulos que encuentran una estructura de la célula se mantienen estables, por tanto los que no encuentran ninguna estructura se descomponen dejando material para la formación de otros microtubulos que irán en direcciones diferentes para buscar estructuras celulares. 10.3.5 Proteínas asociadas a microtubulos La función y la estabilidad de los microtubulos están determinadas por las proteínas asociadas que llevan. Hay dos tipos de proteínas asociadas: MAP estructurales y MAP motoras. MAP estructurales Estas proteínas median la interacción de los microtubulos con estructuras celulares; se asocian por un lado al microtubulo y por el otro a la estructura. Por ejemplo, estas proteínas unen los microtubulos a la membrana plasmática. Esta unión provoca la polimerización del microtubulo, que produce el crecimiento de la célula. Las MAP estructurales están encargadas de la distribución de los orgánulos en la célula a lo largo de los microtubulos, una función muy importante para el funcionamiento de la célula. MAP motoras Las MAP motoras producen un movimiento relativo de estructuras celulares a lo largo del microtubulo. Hay dos tipos de MAP motoras: dineina y quinesina. Las dos tienen estructuras similares, pero se distinguen en el sentido de movimiento que producen: la dineina produce movimiento hacia el extremo negativo, y la quinesina produce movimiento hacia el extremo positivo. Depende del sentido deseado, la vesícula (o cualquiera estructura) se une a la proteína correspondiente. Ejemplo: en peces y anfibios hay un tipo de células que se denominan melanoforos. Los melanoforos pueden tener color oscuro o claro según la repartición de los pigmentos en la célula. Cuando se concentran todos los gránulos de pigmento cerca del núcleo, la piel es clara. Cuando se dispersan los gránulos en la célula, la piel tiene color oscuro. La dispersión de los gránulos está producida por su movimiento a lo largo de los microtubulos. 44 10.3.6 Microtubulos estables – cilios y flagelos Los cilios y los flagelos tienen la misma estructura, pero se distinguen en su longitud, número y movimiento. Los cilios son cortos, abundantes (en las células ciliadas). Producen un movimiento pendulante (empieza en cierto punto, produce el movimiento y se recupera la localización inicial). Los cilios son capaces de producir movimiento en el medio alrededor de la célula. Las células ciliadas se encuentran en el aparato respiratorio, en el cual se encargan de expulsar la mucosa, en los oviductos en los cuales se encargan de facilitar la bajada del embrión hacia el útero etc. Los flagelos son largos, de menor cantidad. Producen un movimiento ondulado que mueve la célula propia dentro del medio. El ejemplo mas conocido de célula que tiene flagelo es el espermatozoide. Axonema – el eje del cilio/flagelo. Estructura de los cilios y los flagelos Los cilios y flagelos están formados por microtubulos y MAPs. • 9 pares de microtubulos, en cada par hay un microtubulo completo y un incompleto. (estos pares se denominan microtubulos periféricos) y un par de microtubulos centrales (los dos completos) – forman estructura de (9+2). • Dineina en forma de brazo. Del microtubulo A de cada par de microtubulos sale dos brazos de dineina que se proyectan hacia el microtubulo B al lado. Las dineinas se disponen discontinuamente al largo del microtubulo. • Puentes de nexina – conectan permanentemente los pares de microtubulos periféricos entre si. Los puentes de nexina aparecen en intervalos más grandes que los brazos de dineina. • Fibras radiales – estructuras que salen de los microtubulos periféricos hacia el centro. • Vaina central – estructura que envuelve los dos microtubulos centrales continuamente. El movimiento de los cilios y los flagelos está debido a los brazos de dineina. Los brazos de dineina de un microtubulo se enganchan temporalmente a su microtubulo vecino y ‘caminan’ sobre éste provocando el movimiento de un microtubulo respecto el otro. Como los microtubulos están unidos a su base, se produce la flexión del axonema. La dineina axonemal funciona igual que la dineina citosólica (aunque tiene estructura un poco diferente). Este movimiento gasta ATP. La flexión del microtubulo depende de la zona en la cual se produce el movimiento relativo por la dineina. Hay que sincronizar el movimiento de los brazos para producir un movimiento eficaz ! el par central está encargado de la sincronización de los movimientos. Síndrome de Kartagener Mutación en el gen que codifica la dineina axonemal ! los cilios y flagelos son inmóviles. Los pacientes presentan: posición alterada de las vísceras, sufren infecciones repetidas en el tracto respiratorio y los machos son infértiles. Este síndrome se conoce en humanos y en animales. Hay otras enfermedades que presentan movimiento asincronizado de cilios y flagelos ! movimiento ineficaz. 45 10.4 Filamentos de actina 10.4.1 Estructura y composición química Los filamentos de actina son estructuras flexibles de 7nm de diámetro. Se encuentran en todas las células eucariotas. Son formados por actina y proteínas asociadas. La estructura que forman depende de las proteínas asociadas. Forman estructuras muy permanentes como microvellosidades, fibras de estrés (mantenimiento de la estructura celular) etc.; también forman estructuras inestables como filopodios y lamelopodios. Cada filamento de actina está formado por unidades idénticas de actina, y tiene dos extremos (está polarizado) que se comportan diferentemente. Actina y mielina Viernes, 12 de diciembre de 2003 Las actinas llevan una molécula de ATP enganchada, siempre en el mismo lugar en la molécula. Las moléculas se ordenan siempre con la misma orientación de la molécula de ATP, así formando un filamento polarizado: un extremo negativo y el otro positivo. 10.4.2 Dinámica de los filamentos de actina Cuando la actina se une a otra (se polimeriza) el ATP está enganchado a la molécula. Después de cierto periodo de tiempo, el ATP se hidroliza. ↑ [actina ] ⇒ Polimerización ↓ [actina ] ⇒ Despolimerización Concentración crítica – la concentración al borde entre la polimerización y despolimerización. En los filamentos de actina los dos extremos son activos, pero tienen diferentes dinámicas; el extremo positivo crece mas de prisa que el extremo negativo – por tanto, dos graficas representan dos concentraciones críticas. El extremo positivo necesita concentración relativamente baja para polimerizarse; el extremo negativo necesita concentración relativamente elevada para polimerizarse. Hay un margen de concentraciones en el cual el extremo positivo crece mientras que el extremo negativo decrece. Efecto noria ()גלגל מים En determinada concentración el crecimiento y decrecimiento son iguales – se mantiene la longitud total del filamento de actina. El efecto noria produce trabajo en la célula, que está utilizado por el movimiento celular sobre superficie (macrófagos, por ejemplo, utilizan el efecto noria para producir este tipo de movimiento). 46 10.4.3 Proteínas asociadas a filamentos de actina Las distintas estructuras se diferencian en estabilidad, geometría y longitud de filamentos. Los filamentos son iguales en toda estructura, lo que varía es la composición de proteínas asociadas. • Timosina, profilina – proteínas que se enganchan a los monómeros de actina y no les permite polimerizarse. • Proteínas nucleadoras – potencian la polimerización (función parecida a la de MTOC). La proteína nucleadora se engancha al extremo positivo y el filamento crece por donde está unido a la nucleadora. Este mecanismo es lo que produce las microvellosidades. • Filamina – produce entrecruzamiento entre los filamentos formando redes. La filamina está formada por dos polipéptidos, que se unen cada uno a un filamento ! los filamentos crecen cruzados (uno sobre el otro) formando una red. • Fimbrina, α-actinina – producen conexiones paralelas entre filamentos de actinas. Se diferencian por su tamaño o Fimbrina – es muy pequeña, entonces los filamentos de actina están muy cercanos uno al otro ! las proteínas contráctiles no pueden entrar entre los filamentos de actina ! forma fibrillas no contráctiles. o α-actinina – tiene conformación de ejes paralelos muy alejados uno del otro. Entre medio si que se pueden entrar las proteínas contráctiles, por tanto estas fibrillas pueden tener funcionamiento contráctil. • Tropomiosina – se engancha al largo del filamento de actina y lo refuerza. Entre aquellas proteínas se establecen relaciones de cooperación y competición: Filamina Redes Cooperación Filamentos de actina α-actinina + miosina tropomiosina competición • Competición Fimbrina Fibrillas contráctiles cooperación Fibrillas no contráctiles Miosina I y miosina II – proteínas motoras – son capaces de desplazarse sobre el filamento de actina. No son contráctiles; solo motoras, pero su movimiento a lo largo del filamento produce la contracción. o Miosina II Proteína formada por dos 6 cadenas polipeptídicas que tiene 2 cabezas y dos colas trenzadas ()שזור. Las cabezas tienen capacidad ATPasa. Las miosinas se asocian formando filamentos. Las cabezas de las miosinas están en la periferia del filamento, y las colas forman el interior del filamento. Lunes, 15 de diciembre de 2003 o Miosina I Proteína formada por una cabeza y una cola corta. Produce transporte de vesículas y gránulos al largo del filamento de actina. Las miosinas se unen a la vesícula y la transportan caminando sobre el filamento. Cuando la vesícula tiene que recorrer una distancia notable, lo hace sobre los microtubulos, mientras que cuando el recorrido es corto, lo hace sobre los filamentos de actina. 47 • Gelsolina - la gelsolina es una proteína que rompe el filamento de actina en dos partes, y se une a uno de los extremos formados por la rotura tapándolo. Mientras está tapado, este extremo no puede ni crecer ni decrecer. Los filamentos de actina fragmentados tienen dinámica acelerada, porque tienen mas extremos activos, por tanto la concentración critica no varia, el aumento de crecimiento al elevar la concentración de actina libre es considerable mayor que el aumento cuando se produce el mismo cambio de concentración en filamentos no fragmentados. Plaquetas Las plaquetas son células pequeñas sin núcleo cuya función es ayudar la coagulación. Mientras la plaqueta está inactivada, los filamentos de actina son largos y están tapados por una proteína. Cuando la plaqueta se activa, sea por una señal externa o por haber encontrado una herida en la pared del vaso sanguíneo, se activa también la gelsolina, que empieza fragmentar los filamentos de actina. Al aumentar el numero de extremos reactivos, los filamentos de actina se alargan y forman parte de una de las dos estructuras posibles; una – se unen a filamina que produce una estructura de forma de red, o dos, que se enganchan a αactinina, y forman fibrillas contráctiles. Los filamentos de actinas contráctiles se unen a otros filamentos de actinas que crean ‘hilos’ que van hacia los labios de la herida del vaso sanguíneos y al contraerse cierran la herida; la estructura de red da forma aplanada a la célula, que se pone arriba de un coagulo para impedir la salida de mas sangre a través de la herida. 10.4.4 Organización FA no musculares • • • 48 Red → Corteza celular Debajo de la membrana plasmática, donde hay corteza celular, no llegan los orgánulos, y en el caso de que una vesícula tiene que ser expulsada por exocitosis la célula tiene que quitar un poco de la corteza para dejarle pasar. La función de la corteza es dar flexibilidad a la célula, es decir, que pueda deformarse sin romperse. Fibrillas paralelas rígidas (no contráctiles) → Microvellosidades Las microvellosidades son prolongaciones en forma de dedo de la membrana plasmática. Son estructuras permanentes cuya función es aumentar la superficie de absorción de la célula. Están formadas por 20-30 filamentos de actina uno al lado del otro, asociados con fimbrina – forman fibrillas muy estrechas y no contráctiles. → Filopodios y lamelipodios Los filopodios y lamelipodios son relacionados con el movimiento celular – unas proyecciones en la parte anterior de la célula. El lamelipodio tiene forma de lámina, y es menos orientado que el filopodio, que tiene forma de hilo o de aguja, y sus filamentos están más orientados en el espacio. Los filamentos de actina tienen su extremo positivo enganchado a la membrana plasmática por una proteína nucleadora y allí se produce el crecimiento. Filopodios Fibrillas paralelas contráctiles → Cinturones de adhesión Los cinturones de adhesión son estructuras permanentes formados por filamentos de actina unidos a α-actinina y miosina II, ordenadas en el espacio celular formando un anillo que envuelve la célula debajo de la corteza celular, pero unidos a la membrana celular a través de ella. Los cinturones aparecen sobre todo en las células epiteliales, por debajo de las uniones tight. Cuando el anillo se contrae, se contrae también la célula. Este mecanismo es muy importante sobre todo durante el desarrollo embrionario, durante el cual permite las invaginaciones de células. → Anillo contráctil El anillo contráctil es una estructura no permanente que se forma cuando la célula ya ha pasado la metafase, y desaparece después de la citocinesis. El anillo, que envuelve la célula madre, se contrae, y al contraerse ‘estrangula’ la célula y le hace dividir el citosol entre las dos células hijas. → Fibras de estrés Las fibras mantienen la superficie de la célula estirada. Son estructuras contráctiles no permanentes – solo aparecen en las células en interfase. Cuando la célula empieza a dividirse, se desmontan las fibras de estrés y la célula recibe forma esférica. Las fibras están puestas por debajo de la corteza celular y se unen a la membrana plasmática a través de ella. El punto por donde se une la fibrilla a la membrana plasmática se denomina contacte focal. La estructura del contacte focal consta de las fibrillas contráctiles de la fibra de estrés, unidos a estructuras extracelulares – colágeno y sobre todo fibranectrina, a través de proteínas de membrana. Miércoles, 17 de diciembre de 2003 12 Control ciclo celular Las células se pueden cualificar según sus fases de división: • células diferenciadas – células que no se dividen nunca durante la vida adulta del organismo (-neurona). • células quiescentes – células que mantienen su tasa de divisiones baja, pero al recibir cierto estimulo empiezan a dividirse rápidamente (-linfocitos – estimulado por antígeno, -hepatocitos – estimulados por la disminución en el tamaño del hígado). • células proliferantes – células que se dividen regularmente y frecuentemente (-células epiteliales del intestino, espermatogonias). 12.1 Fases del ciclo celular G1 → S → G2 1 4 4 42 4 4 43 replicación de DNA → M mitosis/meiosis +citocinesis interfase Cada una de las diferentes fases tiene una duración característica; la mitosis es siempre las mas corta, y la G1 es la mas larga. La duración de G2, S y M son parecidas en todas las células; la duración de G1 puede variar, según el tipo de la célula. Las células embrionarias de mamíferos siguen más o menos esta distribución; las células embrionarias de otras no la siguen, porque fases G1 y G2 son casi inexistentes, porque las células no crecen, solo dividen y cada vez son más pequeñas. 49 La masa celular aumenta al largo de todo el ciclo, y depende de la síntesis de proteínas y RNA. → Síntesis de RNA – durante G1, G2, y S. En M los cromosomas son demasiado condensados para transcribir el RNA. → Síntesis de proteínas – al largo de todo el ciclo celular. 12.2 Control ciclo celular La progresión del ciclo celular depende de señales extracelulares y señales intracelulares. Las señales intracelulares aseguran que la célula ha acabado un ciclo antes de empezar un nuevo, y que ha acabado una fase antes de entrar a la fase siguiente. En organismos unicelulares, el factor limitante de la proliferación es la existencia o ausencia de nutrientes en el medio; en organismos pluricelulares hay señales extracelulares en forma de factores de crecimiento, que son proteínas pequeñas producidas por pocas células y son capaces de inducir crecimiento o impedirlo en otras células. Si los factores de crecimiento son adecuados, la célula pasa por puntos de control (checkpoints) al terminar la G1. Si los factores de crecimiento no son adecuados, la célula se desvía hacia G0 (en vez de entrar a S) y queda allí hasta que reciba las señales adecuadas. Es una desviación reversible. Las células que se encuentran en la fase G0 son activas metabolicamente, pero no se están preparando para la división. Señales internas Las señales internas aseguran que la secuencia de las fases sea correcta y que se ha una fase antes de empezar la siguiente. Por ejemplo, antes de empezar la división, aseguran que la célula ha crecido lo suficiente y sobrepasa el volumen crítico; durante la mitosis aseguran que todos los cromosomas están alineados en la placa ecuatorial. El mecanismo de control interno tiene que ser flexible, para asegurar que todos los condiciones para seguir se cumplen, por ejemplo, si la célula tarda tiempo en llegar al volumen critico, el control prolonga la fase G1 en vez de seguir hacia S y G2. Por eso, si se produce una citocinesis inigualada (una célula grande y la otra pequeña), la pequeña célula tardará mas tiempo en la fase G1, empezará la replicación mas tarde y se dividirá mas tarde que la célula grande. Puntos de control Hay tres puntos de control al largo del ciclo celular. 1º Al final de G1, ‘inicio’ o ‘punto de restricción’. En este punto se decide si la célula puede empezar la replicación. Es un punto de control tanto para señales extracelulares como para señales intercelulares. Factores adecuados Factores inadecuados G1 terminado G1 no terminado G0 División Prolongación G1 2º Al final de G2. En este punto de control se decide si la célula puede entrar a la mitosis o si se queda parada en G2. Es un punto de control exclusivamente de señales internas. Si las señales internas le permiten, la célula entra a la mitosis, si no, el estado de G2 es prolongado para que la célula los termine. 3º A la salida de la mitosis. Solo responde a señales internas. Si las señales le permiten, la célula puede acabar la mitosis; si no todos los cromosomas están alineados en la placa ecuatorial, la célula no puede completar la mitosis. 50 El sistema de control interno funciona siempre por fosforilación de proteínas llaves. Proteínas llaves Inicio de replicación Inicio de división Terminación de la mitosis Las proteínas llaves se activan cuando se fosforilan. La fosforilación está producida por enzimas denominadas quinasas. La enzima fosforila las proteínas enganchado a las proteínas residuos de SER/THR. Las quinasas que intervienen en la fosforilación de las proteínas llaves son las quinasas dependientes de ciclina (CDK), que son activas solo cuando están unidas a ciclina, una proteína cuya concentración en el citosol varía en forma cíclica. Solo cuando la concentración de ciclina sobrepasa cierta concentración (concentración critica), las quinasas se activan. Hay unos tipos de ciclinas: • Ciclina mitótica – se une a la CDK mitótica (al final de la G2) y provoca la entrada la fase M. El complejo ciclina mitótica-CDK mitótica se conoce como MPF. • Ciclina de la fase S – se engancha a la CDK correspondiente al final de la fase G1. esta unión provoca el inicio de la fase S. Al final de cada fase se degrada la ciclina que corresponde al CDK de aquella fase, que vuelve a ser inactivada. Viernes, 20 de diciembre de 2003 12.2.1 Punto de control al final de G2 La actividad del MPF, cuando está representada en una gráfica, tiene carácter ondulado – inactiva durante la interfase y llega a vértice en la mitosis. La concentración de de la CDK es constante en la célula durante todo el ciclo celular; la concentración de la ciclina es la que varía – va acumulando al largo de la interfase, hasta que sobrepasa cierta concentración critica, en la cual se activa la CDK. La MPF fosforila determinadas proteínas: • Condensinas – proteínas que tiene dos ‘brazos’ que se enganchan cada uno a un bucle de DNA. cuando son fosforilados, ‘cierran’ los brazos condensando el DNA. • Proteínas de golgi (GM 130) – proteínas que al estar fosforiladas rompen el AG y el RE en fragmentos, para que cada una de las dos células hijas tengan un poco de ambos. • Lamina A, B y C – mientras no están fosforiladas, pueden unirse formando red bidimensional que mantiene la envoltura nuclear. Al estar fosforiladas, se rompen y junto con ellas se rompe la envoltura nuclear, en fragmentos de membrana unidos a monómeros de filamentos intermedios. • MAPs – cuando las MAPs son fosforiladas, se rompen los microtubulos de la red radial liberando tubulinas al citosol, que poco después se utiliza para formar los husos mitóticos. La dinámica de los microtubulos formados entonces es mucho mas rápida, y está debida al hecho que las MAPs están fosforiladas. • Miosina II – cuando las proteínas miosina II unidas a las fibras de estrés se fosforilan, se rompen las fibras de estrés librando al citosol actina, que se utiliza para formar el anillo contráctil. 51 12.2.2 Punto de control al final de la mitosis APC – complejo promotor del anafase. Cuando todos los cromosomas se han alineado en la placa ecuatorial, generan una señal que provoca la activación del APC por el MPF. La señal que provoca esta activación es una proteína unida al (cinetocor), que se libera cuando el cromosoma se engancha a microtubulos por los dos lados (uno a cada cromátida). El APC no es una quinasa, sino que es una uniquitinasa – proteína que añada un grupo ubiquitina (señal marcadora para la degradación de la proteína) a proteínas que han de degradarse. El APC permite la degradación de cohesinas, proteínas que unen las dos cromátidas; la degradación de las cohesinas permite la separación de las dos cromátidas. Además, provoca la degradación de la ciclina de la MPF – que la inactiva. La desactivación de las CDKs provoca la activación de fosfatasas, que tienen la actividad contraria de las CDKs – defosforilar proteínas. Los fosfotasas defosforilan: • Proteínas de unión entre cromátidas hermanas – separación de las cromátidas. • Condensitas – descompensación de la cromatina. • Laminas A, B y C – formación de la envoltura nuclear. • Activación de MAPs – rotura de los husos mitóticos y formación de la red radial. • Miosina II – contracción del anillo contráctil ! citocinesis. 12.2.3 Punto al final de G1 Como la concentración de la CDK de la fase S es constante, lo que provoca su activación es la concentración de la ciclina de la fase S, que se va acumulando a lo largo de la fase G1. El complejo CDK-ciclina de la fase S fosforila las proteínas reguladoras de transcripción de los genes de la maquinaria de replicación del DNA – DNA polimerasa, DNA ligasa, DNA helicasa, factores de iniciación. 12.2.4 Frenes moleculares La síntesis de la ciclina lleva a cabo en cierto ritmo constante, así funciona como un reloj. Normalmente, el ritmo de síntesis da suficiente tiempo para que la célula cumpla todos los procesos de la fase, pero a veces la célula aun necesita mas tiempo (si ha tenido que corregir daños en el DNA, crecer etc.) para terminar la fase. En estos casos, la célula utiliza frenes moleculares para tardar la subida en la concentración de la ciclina. Por ejemplo, hay proteínas cuya función es ‘caminar’ sobre el DNA y reconocer secuencias dañadas. Cuando ha reconocido una secuencia dañada, activa la maquinaria d corrección del DNA, y el gen p53, para producir la proteína p53, que se engancha sobre la ciclina y la desactiva, dando tiempo a la célula para cumplir la fase G1 correctamente. Lunes, 12 de enero de 2004 13 División celular 13.2 Mecánica de la división celular Profase • • • 52 Formación de microtubulos unidos (parte del huso acromático) Separación de los dos polos de huso. Adición de dos estructuras proteicas – cinetocoros – a cada cromosoma. Prometafase • • Rotura de la lamina nuclear ! rotura de la envoltura nuclear en pequeñas vesículas de membranas ! los cromosomas se ponen en contacto con el citosol ! los microtubulos pueden encontrar los cromosomas. Formación de microtubulos cinetocóricos unidos a cromosomas: el microtubulo, al alargarse, encuentra un cromosoma, y entonces se produce una interacción lateral entre ambos; el microtubulo sigue alargándose, y aun no es cinetocórico. El cromosoma ‘cae’ en hacia el extremo negativo del microtubulo, y cuando se produce la despolimerización del microtubulo el cinetocoro del cromosoma se pone en contacto con el extremo positivo del microtubulo, se produce la interacción que produce el microtubulo cinetocórico fijado cuyo extremo está fijado al cinetocoro. La interacción del otro cinetocoro de aquel cromosoma se produce directamente, sin interacción lateral. ¿Cómo se evitan errores de tipo dos cromátidas unidas al mismo polo de huso? Los microtubulos tienen que ser pensionados, entonces si los dos cinetocoros de un cromosoma están unidos al mismo polo de huso, no hay tensión y por tanto los microtubulos unidos a alguno de los dos cinetocoros es desmontado y el cinetocoro queda libre para unirse al microtubulo del huso correspondiente. • • • La orientación perpendicular respecto a los dos polos de huso es producida por la unión de los dos cineteocoros con microtubulos. Formación de microtubulos astrales o libres – quedan libres (con inestabilidad dinámica) hasta cierto punto de la mitosis. Están encargados de la interacción del huso acromático con la membrana plasmática. ´ Formación de la placa ecuatorial – intervienen dos fuerzas opuestas: Fuerzas atractivas – se producen entre los microtubulos cinetocóricos, así que los cromosomas se atraen hacia los polos. La atracción aumenta cuando la distancia entre el cromosoma y el polo de huso es más grande. Fuerzas de repulsión – repelen los cromosomas desde los polos hacia el centro. La fuerza aumenta cuando mas cerca se encuentran los cromosomas al polo de huso. Se cree que las dos fuerzas están debidas a dos proteínas motoras, una que va hacia el extremo negativo (atracción) y una que va hacia el extremo positivo (repulsión). Las primeras están unidas al cinetocoro y las otras a los extremos de las cromátidas. Metafase • • Los cromosomas oscilan dentro de la placa ecuatorial y las dos fuerzas corrigen su posición todo el tiempo. Los microtubulos polares y cinetocóricos decrecen por el extremo negativo y crecen por el extremo positivo produciendo ‘efecto noria’ así que parecen inmóviles. Es la única excepción en el comportamiento de los microtubulos, que nunca producen el ‘efecto noria’. Los microtubulos astrales mantienen su inestabilidad dinámica. Anafase • Todos los cromosomas separan las cromátidas hermanas (APC ubiquitina las cohesinas que unen las dos cromátidas). La separación es producida por dos procesos que ocurren a la vez: Anafase A Separación de cromátidas debida a decrecimiento de microtubulos cinetocóricos por los dos extremos. El decrecimiento se produce con el movimiento de los cromosomas 53 • en dirección extremo negativo por proteínas motoras. Anafase B Crecimiento de los microtubulos polares separando los dos polos. Este alargamiento de microtubulos polares en conjunto con el movimiento de las proteínas motoras en la zona del solapamiento disminuye ésta, que produce la separación de los dos polos de huso y el alargamiento de la célula. Los microtubulos astrales pierden su inestabilidad dinámica y empiezan reaccionar con la corteza. Consecuencia – los polos de huso se acercan a la corteza. Miércoles, 14 de enero de 2004 Telofase • Defosforilación de los filamentos intermedios que forman la lámina nuclear ! formación de la envoltura nuclear alrededor de cada grupo de cromosomas. Cuando los dos núcleos ya están formados, se bombean adentro las proteínas nucleares por los poros nucleares. Citocinesis Células animales: La estructura responsable de la citocinesis es el anillo contráctil, formado por filamentos de actina y miosina II en geometría circular. El anillo está pegado a la membrana, y cuando se contra forma el surco de segmentación. El anillo contráctil se monta al inicio de la mitosis pero se activa durante la metafase cuando las miosinas son defosoforiladas. Al final de la mitosis se desmonta. La posición del anillo contráctil es muy importante porque determina la división del material celular entre las dos células hijas. La posición está determinada por el huso mitótico – el anillo siempre se forma en perpendicular al eje entre los dos polos de huso y a medio camino entre ambos. En esta manera, la célula asegura que cada célula hija queda con un núcleo. Células vegetales: A partir de la metafase el aparato de golgi produce mayoritariamente componentes de pared celular, que se acumulan en forma de vesículas. Estas vesículas, a partir del anafase se concentran en el medio entre los dos polos do huso y empiezan formar la pared celular, del centro hacia la periferia de la célula. 14 Meiosis Tipo especial de división celular asociada con la reproducción sexual. 14.1 Comparación mitosis-meiosis Similitudes • células que entran a meiosis o a mitosis tienen 2n cromosomas. • Las células previamente a la división han de pasar por la fase S y replicar su DNA. Diferencias • Meiosis implica dos divisiones celulares consecutivas; la mitosis una sola división. • Durante la primera división meiotica se separan cromosomas homólogos; en la 2ª división meiotica y la división mitótica se separan cromátidas hermanas. • En la mitosis las dos cromátidas hermanas no deben ser idénticas, en cambio, en la mitosis si que lo deben ser. 54 • Al final de la mitosis, cada célula hija tiene una copia constituida por una cromátida de cada pareja de cromosomas (2n); al final de la meiosis cada célula hija tiene una copia constituida por una cromátida de un cromosoma (n). 14.2 Consecuencias de la meiosis • • Reducción del grado de haploidía 2n → n Aumento de la variedad genética producido por dos motivos: o Distribución al azar de los homólogos o Recombinación génica durante la meiosis Distribución al azar Producida durante la 1ª división meiotica. Produce 2n células diferentes, n siendo el número de cromosomas homólogos. Por ejemplo, en humanos hay 8.4·106 diferentes combinaciones posibles de cromosomas. Recombinación meiotica Producida por la rotura de un segmento en dos cromátidas de los dos homólogos (una cromátida materna y una cromátida paterna) e intercambio entre los dos segmentos. El resultado es una combinación de genes distinta de la que existe en las células somáticas. En mamíferos, para cada par de cromosomas se produce entre 2 y tres recombinaciones con entrecruzamiento, y como mínimo una – si no se produce al menos una aumenta la probabilidad de aneploidia) el lugar donde se produce la rotura se escoge al azar. La recombinación no se ven el microscopio, solo cuando empiezan a separar los homólogos, y entonces se ven en forma de quiasmas. La recombinación puede ser producida entre cualquier par de cromátidas homologas. 14.3 Proceso meiotico Las células germinales percusoras de gametos (CGP) se multiplican por mitosis después de cierto número de divisiones mitóticas, deben entrar a la meiosis. Profase I Es la fase mas larga de toda la meiosis – 90% del ciclo. En el hombre dura 16 días, y en la mujer puede durar años. Tiene más características de G2 que de anafase, porque hay síntesis de RNA y de DNA, para reparar los fragmentos producidos por la recombinación. Complejo sinaptonémico – estructura proteica amplia que se observa al largo de los cromosomas que produce la sinapsis entre dos homólogos. Se monta a las primeras fases de profase I y se desmonta a su final. Los elementos laterales del sinaptonémio se montan en el leptoteno, uno sobre cada cromosoma del par de homólogos. El elemento central es montado cuando ya hay sinapsis, al final del zigoteno. El complejo se desmonta al inicio del diploteno, cuando los cromosomas empiezan a separar. Leptoteno • Cromosomas formados por dos cromátidas que empiezan a condensar. • Cada cromosoma está unido por los telomeros a la envoltura nuclear. • El complejo sinaptonemico tiene solo elementos laterales – los cromosomas aun no están unidos. Zigoteno • Se inicia la sinapsis, aparece el elemento central. La sinapsis se inicia por los telomeros y ajunta los dos elementos laterales como una cremallera. • Condensación progresiva de los cromosomas. 55 Paquiteno • Todos los cromosomas están en sinapsis completa. • Aparecen estructuras proteicas en determinados puntos de los complejos. Estas estructuras, denominadas nódulo de recombinación, son de carácter enzimático y son las que permiten la recombinación; donde se monta una estructura de este tipo, habrá recombinación. Diploteno – los ovocitos quedan en esta fase. • Continúa la condensación progresiva • Empiezan a separar los bivalentes y aparecen los quiasmas. Diacinesis • Se rompe la envoltura nuclear • Los cromosomas homólogos siguen separándose pero aun quedan unidos por quiasmas. • Los cromosomas se unen al huso acromático. Metafase I Todos los cromosomas están alineados en la placa ecuatorial. Los quiasmas tienen función importante – sirven como centrómero entre dos homólogos. Por eso, es obligatorio tener al menos un quiasma entre homólogos. El síndrome de Down está producido, en 90% de los casos, por un error en la 1ª división meiotica en la madre. Produce un embrión que tiene dos copias maternales y una copia paternal del cromosoma 21. Las dos copias maternales son iguales a los cromosomas que tiene la madre – no se han entrecruzado, y esto produjo el error. El cromosoma X y el cromosoma Y tienen una región de homología, donde se produce un quiasma. A metafase I los microtubulos cinetocóricos de cromátidas hermanas van en el mismo sentido, y los de homólogos en sentidos opuestos. Anafase I Disolución de los quiasmas, los homólogos se dirigen hacia los dos polos opuestos. Telofase I Se forma la envoltura nuclear alrededor de cada grupo de cromosomas. Citocinesis Diferente en el macho que en la hembra. Profase I Las células que entran a profase II tienen solo un cromosoma de cada pareja de homólogos, pero formado por dos cromátidas. Se rompe la envoltura nuclear Metafase II Cromosomas alineados en la placa ecuatorial. Los microtubulos enganchados a cromátidas hermanas tibian hacia polos opuestos. Anafase II Segregación de cromátidas hermanas. 56 Telofase II Se forma la envoltura nuclear. Citocinesis Diferente en macho y hembra – incompleto en los machos. Resultado – 4 células con n cromosomas. 57