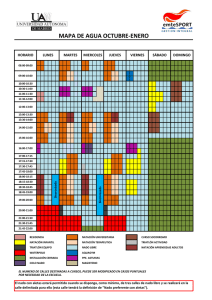
discriminación de los efectos de fluoxetina y cocaína sobre la
Anuncio

DISCRIMINACIÓN DE LOS EFECTOS DE FLUOXETINA Y COCAÍNA SOBRE LA EJECUCIÓN EN EL TEST DE NADO FORZADO EN RATAS CEPA WISTAR EVELYN JIMENA RUGE GIL PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE BIOLOGÍA Bogota, D.C. Septiembre de 2007 1 DISCRIMINACIÓN DE LOS EFECTOS DE FLUOXETINA Y COCAÍNA SOBRE LA EJECUCIÓN EN EL TEST DE NADO FORZADO EN RATAS CEPA WISTAR EVELYN JIMENA RUGE GIL TRABAJO DE GRADO Presentado como requisito parcial Para optar al titulo de BIOLOGO LUIS FERNANDO CARDENAS PARRA DIRECTOR FABIO ENRIQUE RUIZ SANCHEZ CO-DIRECTOR PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE BIOLOGÍA Bogota, D.C. Septiembre de 2007 2 NOTA DE ADVERTENCIA Articulo 23 de la Resolución Nº 13 de Julio de 1946 “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velara por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia” 3 Bogotá D.C., 05 de Febrero de 2008 Señores PONTIFICIA UNIVERSIDAD JAVERIANA Ciudad Estimados Señores Yo EVELYN JIMENA RUGE GIL, identificada con la cédula de ciudadanía número 52.778.564 expedida en Bogotá, autor del trabajo de grado titulado DISCRIMINACIÓN DE LOS EFECTOS DE FLUOXETINA Y COCAÍNA SOBRE LA EJECUCIÓN EN EL TEST DE NADO FORZADO EN RATAS CEPA WISTAR , presentado como requisito para optar al titulo de Biólogo en el año de 2008; autorizo a la universidad a: a) Reproducir el trabajo en medio digital o electrónico con el fin de ofrecerlo para la consulta en la Biblioteca General.___Si____ b) Poner a disposición para la consulta con fines académicos, en la página web de la Facultad, de la Biblioteca General y en redes de información con las cuales tenga convenio la Universidad Javeriana. ___Si____ c) Enviar el trabajo en formato impreso o digital, en caso de que sea seleccionado para participar en concursos de trabajos de grado. ___Si____ d) Distribuir ejemplares de la obra, para la consulta entre las entidades educativas con las que la facultad tenga convenio de intercambio de información, para que este sea consultado en las bibliotecas y centros de documentación de las respectivas entidades. ___Si____ e) Todos los usos, que tengan finalidad académica. ___Si____ Los derechos morales sobre el trabajo son de los autores de conformidad con lo establecido en el artículo 30 de la Ley 23 de 1982 y el artículo 11 de la Decisión Andina 351 de 1993, los cuales son irrenunciables, imprescriptibles, inembargables e inalienables. Atendiendo lo anterior, siempre que se consulte la obra, mediante cita bibliográfica se debe dar crédito al trabajo y a su(s) autor(es). Este documento se firma, sin perjuicio de los acuerdos que el autor(es) pacte con la Unidad Académica referentes al uso de la obra o a los derechos de propiedad industrial que puedan surgir de la actividad académica. Cordialmente, EVELYN JIMENA RUGE GIL Estudiante de la carrera de biología C.C. 52 778564 LUIS FERNANDO CÁRDENAS Director Trabajo de Grado C.C. 79 328718 4 DISCRIMINACIÓN DE LOS EFECTOS DE FLUOXETINA Y COCAÍNA SOBRE LA EJECUCIÓN EN EL TEST DE NADO FORZADO EN RATAS CEPA WISTAR EVELYN JIMENA RUGE GIL APROBADO ________________________ ________________________ Luís Fernando Cárdenas Parra Fabio Enrique Ruiz Sánchez Director del Trabajo de Grado Co- Director del Trabajo de Grado _________________________ __________________________ Jurado Jurado 5 DISCRIMINACIÓN DE LOS EFECTOS DE FLUOXETINA Y COCAÍNA SOBRE LA EJECUCIÓN EN EL TEST DE NADO FORZADO EN RATAS CEPA WISTAR EVELYN JIMENA RUGE GIL APROBADO _________________________ __________________________ Jairo Bernal Parra Andrea Forero Decano del Medio Universitario Director Carrera de Biología Facultad de Ciencias Facultad de Ciencias 6 DESCRIPCIÓN TRABAJO DE GRADO AUTOR Apellidos Nombres Ruge Gil Evelyn Jimena Apellidos Nombres Cárdenas Luís Fernando Apellidos Nombres Ruiz Sánchez Fabio Enrique DIRECTOR ASESOR TRABAJO PARA OPTAR POR EL TÍTULO DE: BIOLOGO TÍTULO COMPLETO DEL TRABAJO: DISCRIMINACIÓN DE LOS EFECTOS DE FLUOXETINA Y COCAÍNASOBRE LA EJECUCIÓN EN EL TEST DE NADO FORZADO EN RATAS CEPA WISTAR FACULTAD: CIENCIAS PROGRAMA: Carrera __X__ Especialización ____ Maestría ____ Doctorado ____ NOMBRE DEL PROGRAMA: CIUDAD: BOGOTA BIOLOGIA APLICADA AÑO DE PRESENTACIÓN DEL TRABAJO: 2008 NÚMERO DE PÁGINAS: 68 TIPO DE ILUSTRACIONES: • Tablas, gráficos y diagramas • Láminas • Fotografías • 7 DESCRIPTORES O PALABRAS CLAVES. COCAINA, FLIOXETINA, HALOPERIDOL, PORSOLT, WISTAR. RESUMEN DEL CONTENIDO El Test de Nado Forzado de Porsolt (TNF), es uno de los modelos más ampliamente utilizados para detectar actividad antidepresiva en un gran número de sustancias, sin embargo tiene algunas limitaciones ya que puede llegar a presentarse falsos positivos. Se evaluó la eficacia de este Test para discriminar los efectos de una sustancia antidepresiva (Fluoxetina) y una sustancia estimulante (Cocaína); para tal fin se utilizaron 46 ratas macho cepa Wistar de 45 días de edad, estas fueron divididas en dos grupos, y tratadas crónicamente durante 7 días con: experimento 1 (solución salina y Fluoxetina, Experimento 2 (Solución Salina, Fluoxetina y Cocaína). Cada grupo fue expuesto a una sesión de entrenamiento y test siguiendo la metodología desarrollada por Porsolt 1977. El día del test los individuos recibieron previa inyección de Haloperidol o solución Salina. Una vez efectuado el análisis estadístico no se encontró el efecto esperado de la Fluoxetina como droga antidepresiva corroborando, las falencias que tiene esta como medicamento para la depresión. Los datos obtenidos por los grupos tratados con Cocaína mostraron mayor tiempo de nado y latencia, lo cual se debe al efecto dopaminérgico evaluado por el test. Se tiene en cuenta también el sesgo que representa el tamaño de la muestra en la obtención de datos menos robustos. 8 DEDICATORIA Dedico este trabajo a Mónica quien siguió detalladamente el desarrollo del mismo brindándome su apoyo incondicional en momentos difíciles, gracias por tus consejos, y tus ayudas sobre todo las ayudas que sin ellas no hubiera sido posible la culminación de mi trabajo de grado. Gracias por corregir mis errores y hacerme crecer como persona, es bueno saber que puedo contar contigo. Duda siempre de ti mismo, hasta que los datos no dejen lugar a dudas. Louis Pasteur 9 AGRADECIMIENTOS Mis más sinceros agradecimientos a todas aquellas personas que intervinieron de una u otra forma en el desarrollo de este trabajo. A mi familia por su apoyo y paciencia. A mi director Fernando Cárdenas que con sus consejos y enseñanzas no solo me guiaron durante el desarrollo de mi trabajo también se ha convertido en mi ejemplo a seguir. A mi codirector Fabio Ruiz por su tiempo y ayuda. A lalita por su colaboración y alegría incondicional en cada una de las actividades que realice durante este tiempo. Agradezco especialmente a Mónica, por darme animo en los momentos mas difíciles, por ser paciente, por ayudarme, explicarme colaborarme, etc. A la universidad de los Andes por abrirme las puertas no solo de sus instalaciones también de cada uno de los trabajadores que cada fin de semana me colaboraban incondicionalmente Finalmente agradezco a la hermosa universidad Nacional de Colombia ya que por medio de ella conocí a Fernando (mi director) y además obtuve el 99.9% de las Ratas por las que tanto sufrí buscando. 10 TABLA DE CONTENIDOS Pág. 1. Introducción 2 2. Marco Teórico 4 2.1 Antecedentes 4 2.2 Validez de un modelo 5 2.3 Modelo animal 6 2.4 Investigación animal 6 2.5 Animal de experimentación 7 2.6 Cepa Wistar 8 2.6.1 Reproducción 9 2.6.2 Almacenamiento 10 2.6.2.1 Micro y Macro ambiente 10 2.7 Depresión 10 2.7.1 Causas 11 2.7.2 Factores genéticos 12 2.7.3 Factores químicos 13 2.7.3.1 Serotonina 13 2.7.3.2 Noradrenalina 13 2.7.3.3 Dopamina 14 2.8 Motricidad 14 2.8.1 Sistema motor piramidal y extrapiramidal 14 2.9 Modelos para el estudio de la depresión 15 2.9.1 Modelos para probar depresión 15 2.9.1 Modelos para inducir depresión 16 2.10 Catecolaminas e indolamina 17 2.11 Serotonina 18 2.11.1 Historia y descripción 18 2.11.2 Síntesis y degradación 19 2.11.3 Receptores y vías serotoninergicas 21 2.11.4 Implicaciones 23 2.12 Dopamina 25 2.12.1 Historia y descripción 26 11 2.12.2 Síntesis y degradación 26 2.12.3 Receptores y vías dopaminérgicas 28 2.12.4 Implicaciones 31 2.13 Antidepresivos 32 2.13.1 Antidepresivos tricíclicos (ADT) 32 2.13.2 Inhibidores de la monoaminoxidasa (IMAO) 33 2.13.3 Inhibidores de la recaptacion de serotonina (ISRS) 33 2.14 Fluoxetina 33 2.14.1 Descripción 33 2.14.2 Historia 34 2.14.3 Mecanismos de acción 35 2.14.4 Metabolismo 35 2.15 Neurolépticos 35 2.15.1. Funcionamiento Bioquímica 35 2.15.2 Efectos secundarios 36 2.15.3 Mecanismos de acción 36 2.16 Haloperidol 36 2.16.1 Acción farmacológica 37 2.16.2 Efectos colaterales y secundarios 38 2.16.3 Farmacocinética 38 2.17 Relación entre dopamina y haloperidol 39 2.17.1 Antagonistas dopaminérgicos 39 2.17.2 Fármacos que actúan sobre la sinapsis dopaminergica 39 2.18 Cocaína 39 2.18.1 Descripción 39 2.18.2 Farmacocinética 40 2.18.3 Absorción 40 2.18.4 Distribución 41 2.18.5 Metabolismo 41 2.18.6 Eliminación 41 2.18.7 Mecanismo de acción 42 2.18.9 Acciones Farmacológicas 42 3. Formulación del problema y justificación 12 44 3.1 Problema 44 3.2 Preguntas de investigación 44 3.3 Justificación 44 3.4 Hipótesis 45 4. Objetivos 46 4.1 Objetivo general 46 4.2 Objetivos específicos 46 5. Materiales y métodos 47 5.1 Diseño de la investigación 47 5.1.1 Muestra y variables 47 5.2 Métodos 47 5.2.1 Animales 47 5.2.2 Drogas 47 5.2.3 Procedimiento 48 5.3 Análisis de información 49 6. Resultados 50 6.1 Experimento 1 50 6.1.1 Diferencia de latencias entre el entrenamiento y el test 50 6.1.2 Diferencia en el tiempo de nado entre el entrenamiento y el test 51 6.1.3 Latencia en el test 51 6.1.4 Tiempo de nado en el test 52 6.1.5 Tiempo de nado y latencia en el entrenamiento 53 6.2 Experimento 2 53 6.2.1 Diferencia de latencias entre el entrenamiento y el test 53 6.2.2 Diferencia en el tiempo de nado entre el entrenamiento y el test 54 6.2.3 Latencia en el test 54 6.2.4 Tiempo de nado en el test 55 7. Discusión 56 8. Conclusiones 59 9. Recomendaciones 60 10. Literatura Citada 61 13 LISTA DE TABLAS Pág. Tabla1.Resultados de la ANOVA de dos vías aplicada a los comportamientos medidos 14 53 LISTA DE FIGURAS Pág. Figura 1. Foto Rata Cepa Wistar. 8 http:/www.iar.or.jp/shodobutsu/wi_rat/index.html Figura 2. Foto Rata Cepa Wistar 8 http://www.iar.or.jp/shodobutsu/wi_rat/index.html Figura 3. Fotografía de crías Rata Wistar (4, 15 y 20 días 9 de edad respectivamente). Foto tomada por Evelyn Jimena Ruge, Bioterio Universidad de lo Andes. Figura 4. Fotografía caja de almacenamiento de los 10 Animales. Foto tomada por Evelyn Ruge. LAB de Neuro-anatomía Universidad de lo Andes. Figura 5. Imagen estructural de la serotonina (Izq), imagen 18 Tridimensional de la serotonina (Der). http://www.wikipedia.org/wiki/serotonin. Figura 6. Síntesis de Serotonina. 21 http://guiasdeneuro.com.ar/neurotrans.htm. Figura 7. Resumen receptores serotoninegicos (Baker et al2001) 22 Figura 8. Vías serotoninergicas (Manter and Gatz`s 1992) 23 Figura 9. Imagen estructural de la Dopamina (Izq), 25 Imagen tridimensional de la dopamina (Der). http://enwikipedia.org/wiki/dopamine 15 Figura 10. Síntesis de Dopamina. http://guiasdeneuro.com.ar 27 /neurotrans.htm Figura 11. Vías Dopaminérgicas (Manter and Gatz`s 1992) 28 Figura 12. Imagen estructural de Fluoxetina (Izq), Imagen 33 tridimensional de Fluoxetina (Der). Figura 13. Fluoxetina (Prozac). Presentación en Capsulas de 20mg y 34 10mg. http://www.melhorqueprozac.blogs.pt/2004_11.html Figura 14. Acción de la cocaína en el cerebro (Volkow 2001) 39 Figura 15. Test de nado forzado (Porsolt). http://psyweb.vghtpe.gov.tw 48 /Animal%20models%20of%20depression-detail.htm. Fig. 16. Diferencia tiempo de latencia entrenamiento/ test 50 Fig. 17. Diferencia tiempo de nado entrenamiento/ test 51 Fig. 18. Tiempo de latencia test 51 Fig. 19. Tiempo de nado test 52 Fig.20. Diferencia tiempo de latencia entrenamiento / test 53 Fig. 21. Diferencia tiempo de nado entrenamiento/ test 54 Fig.22. Tiempo de latencia Test 54 Fig. 23. Tiempo de nado test 55 16 RESUMEN El Test de Nado Forzado de Porsolt (TNF), es uno de los modelos más ampliamente utilizados para detectar actividad antidepresiva en un gran número de sustancias, sin embargo tiene algunas limitaciones ya que puede llegar a presentarse falsos positivos. Se evaluó la eficacia de este Test para discriminar los efectos de una sustancia antidepresiva (Fluoxetina) y una sustancia estimulante (Cocaína); para tal fin se utilizaron 46 ratas macho cepa Wistar de 45 días de edad, estas fueron divididas en dos grupos, y tratadas crónicamente durante 7 días con: experimento 1 (solución salina y Fluoxetina, Experimento 2 (Solución Salina, Fluoxetina y Cocaína). Cada grupo fue expuesto a una sesión de entrenamiento y test siguiendo la metodología desarrollada por Porsolt 1977. El día del test los individuos recibieron previa inyección de Haloperidol o solución Salina. Una vez efectuado el análisis estadístico no se encontró el efecto esperado de la Fluoxetina como droga antidepresiva corroborando, las falencias que tiene esta como medicamento para la depresión. Los datos obtenidos por los grupos tratados con Cocaína mostraron mayor tiempo de nado y latencia, lo cual se debe al efecto dopaminérgico evaluado por el test. Se tiene en cuenta también el sesgo que representa el tamaño de la muestra en la obtención de datos menos robustos. Palabras clave: Cocaína, Fluoxetina, Haloperidol, Porsolt, Wistar. 17 ABSTRACT The Porsolt Forced swim test (FST) is one of the most widely used behavioural test in the evaluation of the antidepressant effects of drugs. Nevertheless it has some limitations since they can get to appear false positives. The effectiveness of this Test was evaluated to discriminate the effects of an antidepressing substance (Fluoxetine) and a stimulating substance (Cocaine), for such aim were used 46 rats male Wistar strain, of 45 days of age, these were divided in two groups, and dealt chronically during 7 days with: experiment 1 (saline solution and Fluoxetina) , Experiment 2 (Saline Solution, Fluoxetina and Cocaine). Each group was exposed to a training session and test following the same methodology developed by Porsolt 1977, the day of the test the individuals received previous injection of Haloperidol or saline solution. Once carried out the statistical analysis was not observed the effect of fluoxetine like antidepressing drug corroborating, the mistakes that it has as a medicine for depression . The data collected by the groups dealt with Cocaine showed greater time of swim and latency, because of the dopaminergic effect evaluated by the test. It must be consider the slant that represents the sample size. Key words: Cocaíne, Fluoxetine, Haloperidol, Porsolt, Wistar. 18 1. Introducción La depresión es un trastorno altamente complejo que afecta a un porcentaje elevado de la población general y a pesar de los abundantes estudios clínicos y experimentales, aun se desconocen diversos aspectos implicados en su fisiopatología y en las acciones de las terapias farmacológicas utilizadas en su manejo (Alguacil 1996). Debido a que consideraciones éticas y de sentido común restringen la investigación en humanos existen diferentes formas de estudiar la depresión por medio de modelos animales. El uso de estos modelos animales es fundamental para el estudio de mecanismos anatómicos, fisiológicos, bioquímicos y moleculares de las enfermedades que afectan al hombre. Los modelos más utilizados para el estudio de la depresión se realizan con roedores debido a la gran cantidad de ventajas que tienen estos como fácil cuidado y mantenimiento, costo accesible de manutención, alta capacidad reproductiva y tiempo corto de generación entre otras (Anisman 1978). Existen gran variedad de modelos que han servido para analizar la eficacia de diferentes fármacos denominados antidepresivos, estos son un grupo de medicamentos que actúan frente a la depresión aumentando la concentración de aminas neurotransmisoras en la sinapsis neuronal, la mayoría de las veces impidiendo su recaptación (Armario 1989). Uno de los modelos más ampliamente utilizados en el estudio de la depresión es el Test de nado forzado descrito por Porsolt (1977) debido a la gran cantidad de exigencias que debe satisfacer una práctica animal para ser considerada un modelo validado, la mayoría de estos cumplen algunos pero no todos estos requisitos de validez. El test de nado forzado posee una fuerte validez de predicción y semejanza pero es débil en cuanto a la validez de constructo siendo esta una de las más importantes (Benoit et al .2005). Estos problemas de validez pueden llevar a que fármacos de acción estimulante puedan ser catalogados como antidepresivos, en tanto podrían ser descartados fármacos con potenciales acciones antidepresivas sobre sistemas no locomotrices (Benoit et al .2005). 19 Mediante el presente estudio se pretende determinar la eficacia del modelo de nado forzado para discriminar los efectos de un antidepresivo y un estimulante con el fin de proporcionar resultados más precisos y con ello disminuir la probabilidad de que fármacos con potencial estimulante sean considerados antidepresivos. Todo esto redundaría en mejorar su validez de constructo. 20 2. Marco Teórico 2.1. Antecedentes La depresión constituye uno de los trastornos psiquiátricos más comunes y es uno de los problemas médicos más frecuentes. Un informe de la Organización Mundial de la Salud consideró a la depresión como una de las condiciones médicas que provoca mayor agobio en el mundo, situándola en cuarto lugar, de acuerdo a los años de vida perdidos por muerte prematura o vividos con una discapacidad severa y de larga duración. A pesar de esta realidad, un importante número de personas afectadas no recibe un diagnóstico y un tratamiento apropiados (Alguacil 1996). Sin embargo, no puede negarse que el estudio de los modelos experimentales de depresión y de los efectos farmacológicos de los antidepresivos suponen una aproximación muy importante al conocimiento de este trastorno afectivo; de esta forma, la validez de los modelos existentes ha sido cuestionada bien por sus dudosos fundamentos teóricos o por la falta de similitud entre las respuestas inducidas y las situaciones clínicas (Willner 1986). Numerosos intentos han creado modelos animales de depresión o al menos de los síntomas de depresión, John F. Cryan y colaboradores plantean la duda de la investigación en modelos animales específicamente en términos de depresión (Cryan et al. 2002). Uno de los modelos más utilizados en el estudio de la depresión es el test de nado forzado descrito por Porsolt en 1977, este se basa en la observación de ratas las que inicialmente siguen movimientos de escapatoria, desarrollando una postura de inmovilidad cuando se encuentran en un cilindro sin salida, la inmovilidad refleja una perdida de persistencia en el comportamiento de escape (desesperanza conductual) o el desarrollo de un comportamiento pasivo (Cryan et al. 2002). Como ya se ha dicho anteriormente el test de nado forzado posee una fuerte validez de predicción y semejanza pero es débil en cuanto a la validez de constructo ya que es difícil establecer este tipo de validez en este test debido a que la inmovilidad observada durante el test es difícil de interpretar además de no existir un estresor relevante no-ecológico que produzca este tipo de comportamiento (Wilner et al. 2002). Un estudio realizado por Benoit Petit y colaboradores 2005, con el fin de comprobar los tres tipos de validez del test de nado forzado, demuestran que solo un tipo de antidepresivo utilizado durante el estudio dio resultados significativos para 21 el T.N.F, ya que el resto de antidepresivos utilizados presentaron falsos positivos debidos a una actividad locomotriz. En este estudio se concluye que la actividad dopaminergica no resulta medible en el Test de Nado Forzado. Con el fin de incrementar la sensibilidad, especificidad y validez tradicional del test de nado forzado se han desarrollado algunas modificaciones al test como el aumento de la profundidad del agua en el cilindro, diámetro del cilindro, tiempo de tratamiento, temperatura del agua, intervalos de observación entre otros, como resultado se ha obtenido menor inmovilidad que en el test tradicional además de otros comportamiento que resultan poco significativos para darle una mayor validez al test (Cryan et al. 2002). Existen métodos complementarios afines a la prueba de la natación forzada que permiten reducir el número de antidepresivos que se comportan como falsos negativos (Stéru 1985). Entre los falsos positivos se encuentran diversos psicoestimulantes, además de anticolinergicos y antihistamínicos; sin embargo, el hecho de que la actividad antihistamínica y/o anticolinérgica pueda jugar un papel en la reversión de la depresión no puede descartarse, y de hecho se ha sugerido que pueden contribuir al efecto antidepresivo de los tricíclicos (Onodera 1991). Un estudio realizado en Colombia por Cárdenas y colaboradores durante el 2006, demuestra que existen falencias en el test de nado forzado ya que este podría enmascarar el efecto antidepresivo de los fármacos con acción sobre sistemas no locomotrices. 2.2. Validez de un Modelo Cualquier practica animal debe satisfacer algunas exigencias antes de ser considerada un modelo animal; para esto existen tres tipos de validez que se deben tener en cuenta validez de semejanza o analogía, validez de constructo u homología y validez de predicción o correlación (Herraez et al. 2004). La validez de semejanza verifica la similaridad entre el modelo y la patología que se desea modelar, la validez de constructo presupone semejanza entre la interpretación teórica del modelo y los conocimientos que la neurobiología posee sobre la patología modelada. Finalmente, la validez de predicción se fundamenta en la existencia de correlación entre los 22 efectos de determinados fármacos tanto en el modelo como en la clínica (Willner 1984). De esta forma, solo podrán ser considerados como modelos de patologías, aquellas situaciones experimentales que satisfagan estos tres criterios (Willner 1984). 2.3. Modelo Animal Modelar un fenómeno biológico significa reducirlo a sus características más relevantes, con una consistencia estadística adecuada de modo que sea fácilmente abordable con la metodología de investigación disponible. A pesar de sus obvias limitaciones, los modelos animales en Psiquiatría constituyen una interfase de utilidad con las Neurociencias. Por una parte, son el canal más importante para que los desarrollos terapéuticos farmacológicos se incorporen dentro de la perspectiva clínica; además, los modelos animales aportan información sobre el fundamento psicobiológico de las patologías psiquiátricas (Yannielli et al. 1999). Un modelo animal puede definirse como el uso de un animal de experimentación que reproduce una enfermedad (o procesos de una enfermedad) de manera más o menos parecida al humano para permitir su conocimiento o abordaje mediante diferentes técnicas terapéuticas (Herraez et al. 2004). En relación a la depresión, los modelos animales son ampliamente usados por la industria farmacéutica para el desarrollo de antidepresivos. Asimismo, en los últimos tiempos estos modelos también se han introducido en la investigación psicobiológica de la depresión, así como en los estudios de los mecanismos neuroquímicos por los cuales los antidepresivos revierten los síntomas fisiológicos y/o conductuales asociados a la depresión (Sherman et al. 1998). 2.4. Investigación Animal El uso de la experimentación animal puede explicarse por las siguientes razones: • No se puede aplicar directamente en el ser humano (Herraez et al. 2004). • Se necesita saber la cantidad y calidad de los nuevos descubrimientos, y comprobarlo en un número adecuado de elementos vivos más o menos comparables con el ser humano, para conseguir una validez estadística (Herraez et al. 2004). 23 • La experimentación humana en las primeras fases de una nueva investigación puede ser censurable, aunque lógicamente, una vez superada esta primera fase, tenga que realizarse sobre voluntarios para verificar realmente su utilidad (Herraez et al. 2004). En el campo de la investigación biológica se utilizan modelos animales para experimentación, pero esto debe hacerse apreciando el valor de estas especies, asegurándose de su protección, respeto y cuidado. En conclusión el uso de animales en la investigación, enseñanza y pruebas, es aceptable solamente si contribuye en forma efectiva a la mejor compresión de principios biológicos fundamentales o al desarrollo de conocimientos que, razonablemente, pueden beneficiar a los seres humanos (Herraez et al. 2004). 2.5. Animal de Experimentación Un animal de laboratorio o experimentación es aquel que se engendra y se cría para una investigación con algún fin científico. Los animales de laboratorio deben tener unas cualidades controlables desde el punto de vista de la experimentación, para que sean homogéneos desde tres puntos de vista: Somático: peso, forma, sexo, etc. Genético: por su igualdad o similitud biológica. Sanitario: sin gérmenes (axénicos), gérmenes controlados (gnotoxénicos) o normales sanos (Murray et al. 1996). Los animales mas utilizados en experimentación sobre todo a nivel neurofisiológico y comportamental han sido los roedores dentro de los cuales se prefiere la rata (Murray et al. 1996). La rata de laboratorio surge de la domesticación de la rata noruega Rattus novegicus, especie cosmopolita. Fue la primera especie de mamíferos domesticada con propósitos científicos (Kennet et al. 1986). 24 Fig 1. Foto Rata Cepa Wistar http:/www.iar.or.jp/shodobutsu/wi_rat/index.html La rata tiene muchas particularidades que le favorecen como animal de laboratorio. Esta perfectamente caracterizada desde el punto de vista anatómico, fisiológico y genético. Se reproduce muy bien por exo y endocría por lo que existen muchas cepas inbred y outbred. Algunas de las outbred son: Sprague dawley (Sd), Wistar (Wi), Long evans (Le). Las cepas inbred mas utilizadas incluyen: Fisher 344 (f344), Brown norway (Bn), Lewis (l), y Wistar-furth (Wf) (Ferreira et al. 1998). Son animales muy adaptables, fáciles de cuidar y manejar. Es posible producirlas libres de gérmenes y de enfermedades con lo cual se reduce la principal variable no controlada que invalida la investigación con animales (Ferreira et al. 1998). 2.6. Cepa Wistar Fig 2. Foto Rata Cepa Wistar http://www.scanbur.eu/products__Lab_animals.htm 25 Para efecto de estudios en el sistema nervioso, el modelo animal que se ajusta mejor a la experimentación es la rata de la cepa Wistar, Rattus norvegicus (Berkenhout orden: Rodentia , familia: MURIDAE) criada en el laboratorio, gracias a sus características biológicas tales como el tamaño de los individuos y su reproducción constante a lo largo de todo el año; esto último redunda en el abasto, así como en la reducción del número de individuos usados en investigación y de las variables en los resultados obtenidos, además la rata reacciona fácilmente ante cosas o situaciones nuevas y su docilidad permite una fácil manipulación (Osorio et al. 2000). La cepa Wistar es original del instituto Wistar en el reino unido en 1947. Luego adquirida por laboratorio Charles River (Crl) (Osorio et al. 2000). 2.6.1. Reproducción: Fig 3. Fotografía de crías Rata Wistar (4, 15 y 20 días de edad respectivamente). Foto tomada por Evelyn Jimena Ruge, bioterio Universidad de lo Andes. La rata cepa Wistar posee un ciclo estral de cuatro a cinco días, el celo dura 12 Horas aproximadamente y se produce generalmente durante la noche, el apareamiento puede tardar hasta ocho días de adaptación entre el macho y la hembra y la gestación dura un promedio de 12 días (Osorio et al. 2000). 26 2.6.2. Almacenamiento 2.6.2.1 Microambiente y Macroambiente Fig 4. Fotografía caja de almacenamiento de los animales. Foto tomada por Evelyn Ruge. LAB de Neuro-anatomía Universidad de lo Andes. Las cajas o jaulas deben ser de preferiblemente de plástico o metálicas, con tapas de acero inoxidable o alambre galvanizado (Osorio et al. 2000). Deben permanecer a una temperatura ideal de 18º C a 24º C, La ventilación es importante debiéndose hacer de 10 a 15 cambios de aire por hora (Osorio et al. 2000). 2.7. Depresión La depresión es un trastorno de una elevada frecuencia en la población general. Constituye uno de los trastornos psiquiátricos más comunes y es uno de los problemas médicos más frecuentes. Un informe de la organización mundial de la salud consideró a la depresión como una de las condiciones médicas que provoca mayor agobio en el mundo, situándola en cuarto lugar, de acuerdo a los años de vida perdidos por muerte prematura o vividos con una discapacidad severa y de larga duración (Arango et al. 1990). Diversas evidencias sugieren que la depresión tiene una etiología biológica. No obstante, a pesar de la enorme cantidad de investigación destinada a develar sus bases orgánicas y de los notables progresos alcanzados, aún persisten muchas interrogantes sin respuesta (Duman et al. 1997). 27 Las primeras hipótesis etiológicas sobre la depresión se enfocaron en los sistemas monoaminérgicos. Inicialmente se planteó que la depresión se debía a un déficit en la neurotransmisión monoaminergica. Aunque desde una perspectiva actual las hipótesis de depleción de monoaminas parecen una visión sobresimplificada de la fisiopatología de la depresión (Richardson 1991). Algunos autores señalan que los signos neurovegetativos son más útiles para el diagnóstico de la depresión que aquellos síntomas subjetivos comunicados por los pacientes (Richardson 1991), uno de los criterios básicos para el diagnóstico de la depresión es la presencia prolongada de un estado disfórico cuya evaluación en modelos animales siempre es muy aventurada (Richardson 1991). 2.7.1. Causas La depresión se debe básicamente a la suma de factores tanto biológicos como de estrés psicosocial con incapacidad del individuo para afrontarlo. Por lo tanto se deben considerar dos formas básicas de depresión, exógena y endógena. La depresión exógena (o reactiva) obedece a una causa externa generalmente bien definida (pérdida de un familiar o un ser amado, pérdida monetaria o de posición social, enfermedad invalidante, etc. (Alguacil 1996). La depresión endógena, en cambio, no tiene causa externa manifiesta, lo cual lleva a considerarla una alteración biológica, como ocurre en las psicosis bipolar (maniaco-depresiva) o unipolar (depresiva) (Alguacil 1996). En la vida diaria los estímulos que pueden generar depresión son multifactoriales, todos ellos tienen como denominador común el constituir estresores con valor afectivo sólo para el individuo afectado. Ese valor afectivo varía de individuo a individuo por lo tanto la experiencia de cada individuo es la variable que introduce la diferencia en la respuesta. En otras palabras, el estrés es un factor importante para que el estado depresivo reactivo se genere y éste no puede separarse de los cambios biológicos (fisiológicos y hormonales) que normalmente son concomitantes con el estrés, asociado todo ello al eje hipotálamo-hipófisis-suprarrenal. Por lo tanto, se puede inferir que la llamada depresión exógena depende a su vez de ambos factores, la calidad y la cantidad del estimulo ambiental estresor y los sustratos biológicos (genéticos, bioquimicos y moleculares) que determinan las alteraciones en la homeostasis y por ende en la función cerebral (Guadarrama et al 2006). 28 Las características claves por medio de la cuales se podrían definir los desordenes depresivos son: • Talante bajo • Energía reducida • Perdida del interés Otros síntomas comunes incluyen baja concentración, reducida autoestima, pensamientos de culpabilidad, ideas de auto daño o suicidio, disturbios del sueño y alteraciones del apetito. El papel de los factores físicos o biológicos en la patogénesis de la depresión se ha sospechado desde la antigüedad. Sin embargo solo en la mitad tardía del siglo XX la tecnología y la metodología experimental han estado disponibles para estudiar estos procesos en los desordenes del talante (Guadarrama et al 2006). En conclusión la depresión tiene muchas causas, las cuales incluyen: • Factores genéticos • Factores químicos: alteraciones de neurotransmisores • Factores psicosociales: experiencias adversas en la infancia: dificultades cotidianas y crónicas, eventos indeseable en la vida, red social limitada, baja autoestima (Guadarrama et al 2006). 2.7.2. Factores Genéticos La influencia genética es más marcada en pacientes con formas graves de trastorno depresivo y síntomas de depresión endógena. El riesgo de morbilidad en parientes de primer grado (padres, hermanos o hijos) esta incrementado en todos los estudios que se han llevado a cabo, y es independiente de los efectos del ambiente o educación. Marcadores genéticos potenciales para los trastornos del talante han sido localizados en los cromosomas X, 4, 5, 11, 18 y 21 (Guadarrama et al 2006). Estudios realizados por Guadarrama (2006) proveen evidencia de la interacción genético-ambiental, en la cual la respuesta de un individuo a los estímulos ambientales es moderada por la organización genética del mismo. 29 2.7.3. Factores Químicos Existe evidencia que la alteración de diferentes neurotransmisores como niveles anormales de serotonina (5-hidroxitriptamina, 5-HT), norepinefrina y dopamina, podrían ser importantes en la fisiopatología de la depresión (Guadarrama et al 2006). 2.7.3.1. Serotonina La serotonina ejerce importante acción en el talante, conducta, movimiento, apreciación de dolor, actividad sexual, apetito, secreciones endocrinas, funciones cardiacas y el ciclo de sueño-vigilia. La mayoría de la serotonina cerebral se genera en los núcleos de rafe, principalmente en el noveno núcleo de rafé, que se localiza encordado entre la línea media del puente y el bulbo raquídeo, estructuras que forman parte del tallo cerebral (Arango et al. 1990). La serotonina es producida a partir del aminoácido triptofano, el cual es trasportado a través de la barrera hematoencefalica hasta las neuronas por el gran transportador neutral de aminoácidos (LNAA) (Guadarrama et al 2006). 2.7.3.2. Noradrenalina El locus coeruleus (LC) es el núcleo del encéfalo, en el tallo cerebral, que genera la noradrenalina (NA); las neuronas del LC envían sus axones principalmente a las estructuras limbicas, que incluyen la amígdala, la formación hipocampica y la corteza prefrontal. El locus coeruleus, estructura que forma parte de la formación reticular, posee actividad tónica como marcapaso (Richardson 1984). La actividad de las neuronas del LC aumenta significativamente en la vigilia y en episodios de estrés, en los cuales su actividad neuronal alcanza niveles de intensidad máxima, y de ese modo contribuye a alertar el organismo lo necesario para sobrevivir. El estrés crónico genera depresión reactiva, como se observa en los modelos animales de depresión, y que las reservas de NA en el LC obviamente tienden a repletarse, lo que conduce a mantener el estado de depresión reactiva; en el caso de los individuos con depresión secundaria al estrés crónico ocurre un fenómeno fisiológico similar (Richardson 1984). La carencia de este neurotransmisor o su desequilibrio con la serotonina puede ser la causa de psicosis depresiva unipolar o bipolar (Richardson 1984). 30 2.7.3.3. Dopamina La dopamina es una catecolamina que se genera por las neuronas pigmentadas en la pars compacta del locus Níger; y en las neuronas de la parte ventral del tegmento mesencefalico; de aquí se origina la vía que existe entre la sustancia Nigra y el cuerpo estriado (vía nigroestriada), la vía que va del área tegmental ventral del mesencefalo hacia el núcleo accumbens del sistema limbico y a la corteza prefrontal (vía mesolímbico-cortical). Una tercera vía dopaminergica se origina de neuronas del tuber de la hipófisis a la adenohipofisis (vía tuberohipofisiaria), aunque esta ultima únicamente participa en la sintesis de prolactina (Collu et al. 1997). La dopamina es principalmente un neurotransmisor inhibitorio. Este neurotransmisor, en las vías mesocortical y mesolimbica, participa en el mantenimiento del estado de alerta. Se deriva del aminoácido tirosina y la síntesis es por la misma vía de la noradrenalina (Collu et al. 1997). La serotonina y la noradrenalina tienen fuerte influencia en patrones conductuales y función mental mientras que la dopamina esta más involucrada en la función motriz. Estas tres sustancias son sin duda fundamentales para el funcionamiento normal del cerebro; por esta razón dichos neurotransmisores han sido el centro de estudios neurocientíficos durante muchos años (Richardson 1984). 2.8. Motricidad 2.8.1. Sistema Motor Piramidal y Extrapiramidal El sistema motor piramidal es una vía monosinaptica (formada por una sola neurona) que tiene su origen en varias zonas de la corteza: Una parte se origina en el área motora primaria (área cuatro de Broadmann) y está situada en el giro precentral por delante de la cisura central o de Rolando. De esta área parten el 45% del total de las fibras piramidales. El resto de fibras parten de áreas situadas en la corteza frontal o corteza parietal (Kandel et al. 2001). El sistema piramidal está compuesto por neuronas corticales, cuyos axones sinaptan directamente con las neuronas motoras de la médula espinal, sin relevo en el tronco del encéfalo (Kandel et al. 2001). Existen dos vías piramidales: el tracto corticoespinal o piramidal. Y la Vía tracto corticonuclear o corticobulbal (Kandel et al. 2001). 31 Por otro lado el sistema motor extrapiramidal, Incluye: Ganglios basales, Núcleo subtalámico, Núcleo rojo, Sustancia negra y Formación reticular. Las lesiones de estas estructuras dan lugar a alteraciones muy graves como la Atetosis, Baile de San Vito y/o el Parkinsonismo (Kandel et al. 2001). 2.9. Modelos Para El Estudio De Depresión Debido a que los síntomas principales de la depresión clínica involucran cambios en el estado de ánimo, los modelos animales de depresión han sido difíciles de estudiar. Gran cantidad de modelos animales caracterizados involucran el comportamiento asociado con la depresión o la capacidad de detectar selectivamente efectos de drogas antidepresivas (Martín et al. 1998). Existen diferentes modelos para el estudio de la depresión. Algunos sirven para probar directamente la depresión mientras que otros la inducen. A continuación se describirán brevemente algunos de ellos (Martín et al. 1998). 2.9.1. Modelos Para Probar Depresión Dentro de los test para probar la depresión se encuentra el Test de suspensión de cola (TST) en el cual los individuos se suspenden de la cola usando una tapa adhesiva a una barra horizontal, típicamente las ratas entran en agitación seguida temporalmente por luchas de inmovilidad irreversibles para tratamientos con antidepresivos (Stéru 1985). Este test es sensible a varios antidepresivos incluyendo triciclitos e ISRS. En este test se ven superados los problemas de hipotermia y disfunción motor los cuales podrían presentarse en el TNF, por lo tanto puede ser útil como una alternativa al TNF (Stéru 1985). Otro test es el Test de Nado Forzado propuesto por Porsolt en 1987 y modificado por Detke en 1995 es uno de los más ampliamente utilizados, por su valor predictivo, ya que posee una alta capacidad para detectar actividad antidepresiva en un gran número de sustancias El test consiste en colocar una rata en un cilindro de 35 cm de altura generalmente por 24 cm de diámetro con un contenido aproximado de 13.5 cm de agua, el procedimiento normalmente se divide en dos, sesión de previa exposición al test (pretest) con una duración de 15 min A las 24 h se realiza la exposición directa o (test) con una duración de 5 min. 32 Durante este tiempo asignado para la observación comportamental de la rata se registra el tiempo de latencia el cual corresponde al tiempo de nado del animal desde el momento en que se le coloca sobre la superficie del agua hasta que se queda inmóvil, y el tiempo de inmovilidad. Se considera inmovilidad cuando el animal realiza apenas los movimientos mínimos necesarios para mantener la cabeza fuera del agua (Porsolt et al.1977). La sesión de pretest induce en ratas un tiempo prolongado de flote durante la sesión de test, este tiempo prolongado de flote ha sido interpretado como un estado de desesperanza reflejado por parte del animal (Porsolt et al. 1978). El tiempo de flote durante la sesión de test puede ser reducido por una gran variedad de drogas conocidas por su eficacia en el tratamiento para la depresión humana. Esto ha permitido usar el tiempo de flote, o tiempo de inmovilidad, para determinar la eficacia de los agentes antidepresivos en el T.N.F (Porsolt et al. 1978). No obstante este test presenta inconsistencias como el requerimiento de test adicionales para distinguir los antidepresivos de otras clases de drogas como estimulantes psicomotores. Para incrementar la validez de predicción de este test además de una gran cantidad de estudios, se han propuesto variaciones metodologicas como el largo y la profundidad del cilindro, las cuales han resultado satisfactorias (West 1990). 2.9.2. Modelos Para Inducir Depresión Existen diferentes modelos para inducir depresión como la Bulbectomia olfatoria (OB) la cual involucra la remoción del bulbo olfatorio, dos semanas antes de comenzar el tratamiento crónico con antidepresivos. La bulbectomia olfatoria en roedores esta caracterizada por el incremento del campo de actividad y la privación en el déficit de aprendizaje, los cuales son atenuados por la administración crónica del antidepresivo. OB ha sido utilizada en ratones mostrando una reversión en el campo de déficit de aprendizaje y una evitación pasiva del comportamiento seguida de un tratamiento crónico con antidepresivos tricíclicos, amitriptilina e imipramina y el atípico trazadon. Sin embargo no existe una larga validación farmacológica de los diferentes tipos de antidepresivos en ratas usando el modelo OB incluyendo SSRIs (Cairncross et al. 1977). 33 Otra forma muy conocida de inducir depresión es el Estrés crónico moderado (CMS) el cual tiene en cuenta una serie de estresores ambientales impredecibles y variables (Ferreira et al. 1998). En modelos de depresión basados en el aislamiento, los animales son separados de sus progenitores o sus congéneres, lo que lleva consigo usualmente una respuesta bifásica caracterizada por un período de protesta seguido de un estado de desesperanza (Dalvi et al. 1999). Por ultimo se puede describir la Indefensión aprendida dentro de los modelos para inducir depresión ya que este se basa en la aplicación de un estímulo estresante, de forma que el animal no pueda evitar ni predecir su presentación, ni pueda escapar una vez aplicado (Sherman, 1979). Las consecuencias comportamentales de esta estimulación presentan similitudes importantes con la sintomatología de la depresión: disminución de la efectividad en tareas de aprendizaje, hipoactividad, disminución de la ingesta, disminución de la agresividad o inhibición de conductas que conllevan un refuerzo positivo como la estimulación eléctrica intracraneal (Dalvi et al. 1999). La versión más extendida del test consiste en la aplicación de shocks eléctricos a la rata y el examen posterior del aprendizaje de un comportamiento de evitación en una jaula de evitación “shuttle box” o en una jaula de Skinner (Dalvi et al. 1999). La validez teórica del modelo ha sido criticada por diversas razones; algunos autores atribuyen los déficit conductuales simplemente a una disminución de la actividad motora, lo que pone en cuestión que la indefensión conlleve modificaciones sustanciales de la conducta. Tampoco se conoce con exactitud si el estrés incontrolable en el hombre produce un estado de “indefensión” comparable, y en cualquier caso dicha supuesta indefensión no parece constituir un factor de riesgo para el desarrollo de un cuadro depresivo (Willner 1986). 2.10. Catecolamina e Indolaminas Las monoaminas constituyen el grupo principal de neurotransmisores del sistema nervioso. La característica diferencial de estas sustancias es la presencia de un grupo amino (-NH2), por lo que se denominan monoaminas o también aminas biogénicas. Proceden de aminoácidos precursores y forman dos grupos: las catecolaminas derivadas de la fenilalanina; (dopamina, noradrenalina y adrenalina) 34 y las indolaminas (serotonina y su neurotransmisor), que derivan del triptofano (Devlin 2004). 2.11. Serotonina Fig 5. Imagen estructural de la serotonina (Izq), imagen tridimensional de la serotonina (Der). http://www.wikipedia.org/wiki/serotonin. 2.11.1. Historia y Descripción La indolalquilamina 5-hidroxitriptamina (5-HT; serotonina) fue inicialmente identificada por el interés de sus efectos cardiovasculares (Arango et al. 1990). A principios del siglo veinte, las plaquetas fueron identificadas como la fuente de esta sustancia, a finales de la década de los 40, Page y colaboradores, aislaron y caracterizaron esta sustancia tónica del suero (serum; desde aquí, serotonina). La Serotonina es una amina aromática pertenece a la familia de las indolaminas y está compuesta de un anillo indol hidroxilado en la posición cinco, y una cadena lateral etilamínica, se distribuye ampliamente entre animales, plantas y el hombre. En los mamíferos se localiza en las plaquetas, mastocitos y células enterocromafines (Arango et al. 1990). La importancia de este neurotransmisor comenzó a ser reconocida cuando se investigo la fisiología del sueño. Descubriéndose como modulador del sueño, de la actividad sexual y de la conducta agresiva (Arango et al. 1990). 35 La combinación del grupo hidroxilo en la posición cinco del núcleo indol y una amina nitrogenada primaria actuando como receptor de un protón del pH fisiológico, hace de la 5-HT una sustancia hidrofilica lo cual dificulta el traspaso de la barrera hematoencefalica, por lo que Twarog y Page en 1953 descubrieron que esta era sintetizada en el cerebro. La observación simultánea de que la droga psicodélica Dietilamida del Acido Lisérgico (LSD) antagoniza una respuesta producida por 5-HT conformo la idea de que la 5-HT era un producto de nuestro cerebro y tiene importante efectos conductuales (Arango et al. 1990). El aminoácido esencial, Triptofano, una vez absorbido del tracto gastrointestinal se distribuye a los tejidos de todo el organismo. Su absorción por las distintas membranas, incluyendo la barrera hematoencefalica, se realiza por competencia de transporte con el aminoácido Tirosina. Consecuentemente, su concentración final en el sistema nervioso central depende de un estricto balance dietario, lográndose un ritmo circadiano propio, el cual también se halla bajo la influencia del ciclo de luzoscuridad, mediado por la glándula pineal, responsable de la N-metilación de la Serotonina a Melatonina (Arango et al. 1990). No todas las células que contienen 5-HT, lo sintetizan. Las plaquetas no sintetizan 5-HT; acumula la 5-HT del plasma por un mecanismo de transporte activo (Arango et al. 1990). 2.11.2. Síntesis y Degradación Pasos en la síntesis de la serotonina: a. Transporte facilitado del aminoácido L-triptofano de la sangre hasta el cerebro. b. Las neuronas serotoninergicas contienen la enzima triptofano- hidroxilasa, que convierte el triptofano en 5- hidroxitriptofano (5-HTP). c. La otra enzima implicada en la síntesis de serotonina es la descarboxilasa de los aminoácidos L-aromático (aminoácido descarboxilasa: AADC), que convierte 5-HTP en 5-HT. Esta enzima además de estar presente en las neuronas serotoninergicas también se encuentra en las catecolaminergicas 36 donde convierte 3,4-dihidroxifenilalanina (DOPA) a dopamina (Baker et al2001). La hidroxilación inicial del triptofano parece ser el peldaño limitante en la síntesis de serotonina más que la decarboxilación de 5-HTP. La evidencia en apoyo para este punto de vista incluye el hecho de que 5-HTP se encuentra sólo en pequeñas cantidades en el cerebro, presumiblemente porque es decarboxilado casi tan rápidamente como se forma (Baker et al2001). El aumento de la síntesis resulta desde la conversión realzada del triptófano en 5HTP y tiene una absoluta dependencia del Ca+2 extracelular. Por contraste, las situaciones que requieren aumentos en la síntesis y emisión de 5HT a largo plazo, resultan en la síntesis de la proteína triptófano-hidroxilasa (Baker et al2001). La degradación se produce en el espacio intersináptico. Una vez en el interior de la neurona presinaptica, la serotonina puede ser empaquetada de nuevo en vesículas sinápticas, o puede ser metabolizada. La ruta principal para su degradación es la desaminacion oxidativa al correspondiente acetaldehído, catalizada por la enzima monoaminoxidasa. Posteriormente el aldehído se oxida a 5- hidroxiindol-3-acetato mediante una aldehído deshidrogenada (Baker et al2001). 37 (anión del acido 5- hidroxiindolacetico) Fig 6. Síntesis de Serotonina. http://guiasdeneuro.com.ar/neurotrans.htm. 2.11.3. Receptores y Vías Serotoninergicas La serotonina actúa sobre el receptor postsináptico. Hay siete receptores diferentes para la serotonina: 5HT-1, 5HT-2, 5HT-3, 5HT-4, 5HT-5, 5HT-6 y 5HT-7 (Bonilla et al. 1998, Baker et al2001). 38 Fig 7. Resumen receptores serotoninegicos (Baker et al2001). Las vías serotoninergicas proceden de los núcleos del rafe en la protuberancia y se proyectan hacia la médula espinal regulando varias funciones vegetativas como las gastrointestinales o se proyectan hacia la corteza cerebral y estructuras subcorticales regulando funciones cognoscitivas y afectivas (Bonilla et al. 1998, Baker et al2001). 39 Fig 8. Vías serotoninergicas (Manter and Gatz`s 1992). 2.11.4. Implicaciones La Serotonina tiene efecto modulador general e inhibidor de la conducta, influye sobre casi todas las funciones cerebrales, inhibiendo en forma directa o por estimulación del GABA. De este modo regula la timia, el sueño, actividad sexual, apetito, ritmos circadianos, funciones neuroendocrinas, temperatura corporal, dolor, actividad motora y funciones cognitivas (Bedoya 1998). • Regulación del sueño: La Serotonina es el mediador responsable de las fases III y IV del sueño lento. El ritmo sueño vigilia esta regulado por el balance adrenérgico-serotoninérgico, y la disminución de la latencia REM, característica de los estados depresivos debida a un desbalance serotoninérgico-colinérgico (Bedoya 1998). • Regulación de la actividad sexual: La Serotonina presenta un efecto inhibitorio sobre la liberación hipotalámica de gonadotropinas con la consecuente disminución de la respuesta sexual normal. La disminución farmacológica de la Serotonina directa o por competitividad aminérgica facilita la conducta sexual (Bedoya 1998). • Regulación de las funciones neuroendocrinas: La Serotonina es uno de los principales neurotransmisores del núcleo supraquiasmático hipotalámico del cual depende la sincronización de los ritmos circadianos endógenos de todo el organismo. Influye también en la regulación inhibitoria o estimuladora de 40 los factores peptidérgicos de los ejes hipotálamo-hipófiso-periféricos (Bedoya 1998). • Regulación termo-nociceptiva: La Serotonina produce un efecto dual sobre la termia según sea el receptor estimulado. El 5TH1 produce hipotermia y el 5HT2 hipertermia. En el sueño de ondas lentas se produce el pico mínimo de temperatura coincidente con la aparición del pico máximo de secreción de hormona del crecimiento. La Serotonina es un neuromodulador nociceptivo importante. Los agonistas producen analgesia en animales de laboratorio, siendo bien conocido el efecto antagónico de los antidepresivos tricíclicos (Bedoya 1998). • Serotonina en estados depresivos (Bedoya 1998). Numerosas teorías intentan dar una explicación biológica de los fenómenos depresivos, La más antigua es la clásica hipofunción noradrenérgica; algo posterior es la de la hipofunción indolamínica, y más recientes son las hipótesis de la sensibilización del receptor y la de la desregulación circadiana. Finalmente se publica la teoría hipercolinérgica. En el estado actual de nuestros conocimientos, la alteración cuanti-cualitativa de la serotonina y su unión a receptores específicos corroboran la hipótesis indolamínica, de modificación del receptor y de alteración circadiana, pudiendo involucrar además las otras teorías por desbalance global Avalan la teoría serotoninérgica las siguientes pruebas clínicas y experimentales (Bedoya 1998). - La disminución del triptofano plasmático en pacientes depresivos. - La disminución cefalorraquídeo del de ácido 5-hidroxi-indolacético parasuicidas y pacientes en líquido depresivos con hostilidad manifiesta o larvada. - El aumento de la unión de los receptores 5HT2 en plaquetas de pacientes depresivos no medicados. - La disminución de la unión a la imipramina tritiada en el suero de pacientes depresivos. - La disminución de la respuesta hipotermizante a la ipsapirona en animales de laboratorio medicados con antidepresivos. - La aparición de síntomas de depresión por depleción experimental de triptofano dietario. 41 - La anulación de la respuesta normal de las siguientes pruebas neuroendocrinas en humanos: Triptofano y/o Fenfluramina/Prolactina; y Triptofano y/o Fenfluramina/Hormona del crecimiento (Tovar 2001). Los principales receptores involucrados en la depresión serotoninérgica son el 5HT1a, 5-HT1c y 5-HT2 (Tovar 2001). La normalización terapéutica de la depresión indolaminérgica puede obtenerse por varios mecanismos: • Utilización de precursores: triptofano y 5-Hidroxitriptofano, en dosis muy variables y personalizadas, recordando que su administración debe realizarse lejos de las comidas para evitar la competencia aminoacídica que disminuiría la absorción del triptofano (Tovar 2001). • La utilización de liberadores, como la fenfluramina, cuyo poder adictivo la convierte en droga de riesgo, disminuyendo la posibilidad de uso terapéutico (Tovar 2001). • Los clásicos inhibidores inespecíficos de la recaptura, antidepresivos tricíclicos donde sobresale la Clorimipramina, de efectiva acción no sólo antidepresiva sino ansiolítica, antifóbica, antiobsesiva y anticompulsiva (Tovar 2001). • Los nuevos inhibidores específicos de la recaptacion de Serotonina, con menor período de latencia, mejor tolerancia y ausencia de efectos anticolinérgicos (Tovar 2001). 2.12. Dopamina Fig 9. Imagen estructural de la Dopamina (Izq), Imagen tridimensional de la dopamina (Der). http://enwikipedia.org/wiki/dopamine 42 2.12.1. Historia y descripción En la década de los 50, Carlsson realizó estudios pioneros que mostraron que la dopamina es un importante mensajero químico del sistema nervioso. Antes de estos estudios se consideraba que esta sustancia sólo era un precursor necesario para la síntesis de otro neurotransmisor, la noradrenalina. Mediante un método de alta sensibilidad desarrollado por él mismo, demostró que la dopamina se encontraba en áreas del cerebro en las que no existían cantidades significativas de noradrenalina, lo que le llevó a postular que la dopamina era un transmisor por sí mismo. La dopamina existe en altas concentraciones en las áreas del cerebro denominadas ganglios basales, de gran importancia para la conducta motora, y en la corteza cerebral frontal, donde su función se relaciona con la afectividad y el estado de ánimo (Muller et al. 1989). Podemos decir que la dopamina es la catecolamina más importante precisamente porque presenta una localización encefálica más elevada que la noradrenalina y, por tanto, su repercusión comportamental es más comprometida. Los núcleos cuneiformes, el núcleo rojo, la sustancia negra y las áreas tegmentales son estructuras claramente dopaminérgicas. Lo más significativo de estas estructuras, es que sus fibras constituyen tres fascículos altamente característicos del encéfalo: el fascículo nigroestriado, que se proyecta esencialmente a los núcleos grises basales; el fascículo mesocortical, que alcanzan además de estructuras internas de la corteza, la gran estructura prefrontal. De ahí que la acción de la dopamina debe estar inexorablemente implicada en el control y regulación del movimiento, en la expresión de los estados afectivos y en la capacidad de proposición y juicio, como anteriormente hemos referido (Muller et al. 1989). 2.12.2. Síntesis y degradación El proceso sintético es el mismo que de la norepinefrina. El aminoácido Fenilalanina, normalmente es transformado en Tirosina en el hígado, por acción de la Fenilalanina-Hidroxilasa. La transformación de la Tirosina en Dihidroxifenilalanina (DOPA), está regulada por la enzima Tirosin-hidroxilasa y tiene lugar ya en la terminación nerviosa. La DOPA es descarboxilada por la enzima Dopadescarboxilasa, con lo que aparece la DOPAMINA, ésta se almacena en el pie 43 terminal del axón, en unos minúsculos sacos delimitados por una membrana llamados vesículas sinápticas. En un solo pie terminal hay millares de ellas y cada una contiene entre 10 000 y 100 000 moléculas de DA. La llegada de un impulso nervioso al pie del axón es la causa de la liberación, que se desencadena porque aumenta la permeabilidad del pie terminal a los iones de calcio, los cuales activan los mecanismos de liberación (Muller et al. 1989). Fig 10. Síntesis de Dopamina. http://guiasdeneuro.com.ar/neurotrans.htm. La biodegradación de la dopamina se efectúa por dos vías diferentes: a nivel neurocitoplasmático, experimenta desaminacion oxidativa y es convertida en Ácido dihidroxifenilacético por la MAO localizada en la membrana externa mitocondrial. Y a nivel extracelular, la dopamina que no se encuentra unida a los receptores es metilada y convertida en O-metil-dopamina por la Catecol-O-metiltransferasa. Los 44 dos productos de la degradación sufren transformación enzimática antes de dar origen al metabolito inactivo más importante de la Dopamina, el Ácido homovanílico .Recientemente se ha documentado un patrón de variaciones diurnas en las concentraciones plasmáticas de Ácido homovanílico, cambios que se cree se hallan relacionados con cambios en el metabolismo celular de la Dopamina (Muller et al. 1989). Una forma de destrucción es la posible transformación de la DA, en NE. Ahora bien, existen también vías metabólicas enzimáticas a cargo de la MAO y la COMT, las cuales pueden actuar. LA Dopamina (DA), por acción de la COMT que se encuentra preferentemente a nivel del espacio intersináptico, es transformada en 3Metoxitiramina (3MT). La 3MT por acción de la MAO extraneuronal, es transformada en Ácido Homovanílico (HVA) (Muller et al. 1989). 2.12.3. Receptores y Vías Dopaminérgicas Fig 11. Vías Dopaminérgicas (Manter and Gatz`s 1992). Las neuronas de la parte compacta de la sustancia negra son origen de una vía dopaminergica que actúa sobre el caudado y putamen (Muller et al. 1989). Las neuronas del caudado y putamen que proyectan al globo pálido interno y parte reticular de la sustancia negra tienen receptores para la dopamina de tipo D1, que son activadores, por lo que la dopamina activa la vía directa estimuladora de los movimientos (Muller et al. 1989). 45 Las neuronas del caudado y putamen que proyectan al globo pálido externo tienen receptores para la dopamina de tipo D2, que son inhibidores, por lo que la dopamina inhibe a la vía indirecta inhibidora del movimiento. La dopamina por tanto, estimula el movimiento por las dos vías, porque estimula la vía estimuladora e inhibe a la vía inhibidora (Muller et al. 1989). El sistema dopaminérgico tiene una distribución más restringida y una función más definida que el sistema noradrenérgico. En la actualidad se conocen cuatro sistemas dopaminérgicos bien definidos, que son los siguientes: a) Sistema Nigroestrial Se origina en la zona compacta de la Sustancia Negra (pequeña región del mesencéfalo), y desde allí se proyecta al Cuerpo Estriado, mediante fibras muy ramificadas (Muller et al. 1989). b) Sistema Tuberoinfundibular Tiene su origen, principalmente, en el Núcleo Arcuatus del Hipotálamo e inerva la capa externa de la eminencia media y la porción nerviosa e intermedia de la Hipófisis (Muller et al. 1989). Una característica de este sistema es que cuando sus neuronas se activan durante un tiempo largo, se defeccionan marcadamente de DA, y que no son destruidas por la 6-hidroxidopamina (sustancia muy tóxica que se forma por hidroxilación del carbono 6 de la DA, en el espacio intersináptico). c) Sistema Mesolímbico Las células que forman esta vía tienen su origen en el mesencéfalo. Fueron denominadas neuronas A 10 por Dahltrom y Fuxe (1964). Las áreas inervadas por estas células incluyen los Tubérculos Olfatorios y los Núcleos Accumbens; los Núcleos centrales de la Amígdala y el Núcleo Lateral del Septum. Evidencias recientes sugieren que las neuronas A10 se proyectan también a los núcleos basales laterales y posteriores laterales de la amígdala, así como al núcleo caudado ventral lateral (Muller et al. 1989). d) Sistema Mesocortical No es todavía bien conocido si las células A10 tienen ramas que inervan, unas las áreas limbicas y otras las áreas corticales, o si son células independientes para cada sistema. En términos de respuesta a las drogas las neuronas A10 aparecen relativamente homogéneas (Muller et al. 1989). 46 En 1973 se sugirió la existencia de una proyección dopaminergica cortical, basándose en evidencias bioquímicas. También en ese mismo año se descubrió una adenil-ciclasa sensible a la DA, en el cortex frontal (Muller et al. 1989). Concretamente la inervación dopaminergica puede ser detectada en el Cortex Prefrontal, Circunvolución del Cíngulo y Cortex Entorrinal (Muller et al. 1989). Receptores dopaminérgicos Las moléculas de DA liberadas cruzan velozmente el espacio intersináptico actuando sobre receptores específicos situados en la membrana postsináptica. Estos receptores están constituidos por moléculas de proteínas. Existe en la superficie de la proteína receptora una región que corresponde exactamente con la forma y configuración de la molécula de Dopamina. Además de este “primer receptor”, se ha demostrado que la DA actúa sobre una sustancia que hace a modo de “segundo mensajero”. Sutherland identifico la sustancia de “segundo mensajero” como la molécula de AMP cíclico. Según este autor, la proteína receptora de la DA está acoplada al enzima adenilciclasa que cataliza la conversión del ATP en AMP cíclico. Seguidamente el AMP cíclico actúa sobre la maquinaria bioquímica de la célula, iniciando la respuesta fisiológica característica del transmisor. La posibilidad de que esta adenilciclasa catalizadora del AMP cíclico, sensible a la dopamina, forma parte del receptor dopaminérgico, viene apoyada por el hecho de que en todas las regiones cerebrales donde la dopamina ha sido localizada como neurotransmisor, se ha descubierto la actividad enzimática de esta adenilciclasa (Tovar 2001). Los receptores de dopamina que se conocen hasta hoy son: • D1: acoplados a la actividad de la adeniciclasa y localizados en la corteza de seres humanos, su activación induce relajación de la fibra muscular lisa en los vasos arteriales renales y de otros territorios vasculares (p. Ej. de musculatura esquelética). A nivel del túbulo renal inhibe la reabsorción de Na+ y aumenta la diuresis. Activa el aparato yuxtaglomerular favoreciendo la secreción de renina (Tovar 2001). • D2: asociación negativa a la adenilciclasa. Se reconocen el D2a y el D2b, y se localizan preferencialmente en el sistema límbico y estriado. Al inhibir la función los nervios noradrenérgicos, bloquea la actividad simpática en el 47 corazón y en algunos territorios vasculares; como consecuencia aparece bradicardia y reducción de la resistencia periférica. Este efecto ha sido ampliamente estudiado con fines terapéuticos para controlar la hipertensión o para aliviar la insuficiencia cardiaca congestiva (Tovar 2001). • D3: de localización mesolímbica; • D4: en asociación con el receptor del nucleótido Guanina, y de amplia distribución mesolímbica. Se han identificado las variaciones polimórficas D4-2, D4-4 y D4-7, y es muy probable la existencia de las variaciones D4-6 y D4-8. Este receptor D4 tiene gran afinidad con el antipsicótico clozapina (Tovar 2001). • D5: de localización mesocortical y de gran afinidad dopaminergica, con activación de la enzima adenilciclasa (Tovar 2001). 2.12.4. Implicaciones Las acciones de la dopamina son complejas de analizar porque se comporta como activador de baja afinidad de receptores alfa y beta-adrenérgios, y como activador de receptores dopaminérgicos. Además, la estimulación de receptores DA2 presinápticos puede originar una inhibición indirecta de la actividad simpática. Por todo ello la acción resultante es variable y muy dependiente de la dosis, vía de administración y especie animal en que se estudie (Tovar 2001). Por su acción adrenérgica produce taquicardia, aumento de la contractilidad cardiaca, arritmias, vasoconstricción y vasodilatación de diversos territorios vasculares (Tovar 2001). A nivel de ganglios simpáticos la dopamina inhibe o modera la transmisión ganglionar, aunque la activación de algunos receptores presenta un componente facilitador. En el tracto gastrointestinal produce efectos excitadores e inhibidores tanto sobre la actividad del músculo liso como sobre la secreción exocrina. Los efectos inhibidores de la motilidad (relajación o inhibición de la contracción espontánea) son más apreciables en el tercio inferior del esófago, estómago, intestino delgado y grueso; pero como antes se ha indicado, no está claro si se debe a activación de receptores dopaminérgicos. En cuanto a la actividad secretora en la especie humana, la acción de la dopamina es bastante dudosa (Tovar 2001). 48 Existen diferentes trastornos que están relacionados a la dopamina como la Enfermedad de parkinson, Demencia, Funciones viso-espaciales y Trastornos afectivos y depresión (Tovar 2001). 2.13. Antidepresivos Los antidepresivos son un grupo de medicamentos que actúan frente a la depresión. Todos aumentan la concentración de aminas neurotransmisoras en la sinapsis neuronal, la mayoría de las veces impidiendo su recaptacion. Así, bloquean la recaptacion, general o selectiva de noradrenalina, serotonina y más raramente de dopamina (Bal-Klara et al.1990). Existen diferentes clasificaciones de los antidepresivos en función de su estructura química, su mecanismo de acción o su antigüedad. Si tenemos en cuenta este último criterio, distinguiremos entre antidepresivos clásicos y nuevos. Los clásicos comprenden los antidepresivos tricíclicos (ADT), los inhibidores de la monoaminoxidasa (IMAO) y finalmente, los denominados atípicos, que comprenden la mianserina y la trazodona. Los nuevos antidepresivos comprenden los inhibidores selectivos de la recaptacion de serotonina (ISRS) (Majeroni et al.1997). Existen diferentes tipos de antidepresivos como: 2.13.1. Antidepresivos Tricíclicos (ADT) Los ADT son potentes inhibidores de la recaptacion de serotonina y noradrenalina. La potencia y selectividad sobre la recaptacion de los neurotransmisores varía entre los diferentes componentes del grupo. Así, por Ejemplo, la nortriptilina y la desimipramina (aminas secundarias tricíclicas) son más potentes en la recaptacion de noradrenalina, mientras que la imipramina y la amitriptilina lo son de serotonina. Los ADT también actúan sobre otros receptores, como los colinérgicos e histaminérgicos, que ocasionan otras acciones ajenas a su efectividad antidepresiva (Frazer 1997). La mayoría de los ADT presentan actividad anticolinérgica, que es la responsable de muchos efectos adversos como la sequedad de boca, retención urinaria, taquicardia, estreñimiento y visión borrosa. Asimismo, presentan propiedades antihistamínicas, que son las responsables de la sedación y la fatiga (Bal-Klara et al.1990). 49 2.13.2. Inhibidores de la Monoaminoxidasa (IMAO) Los IMAO son un grupo de fármacos que inhiben la Monoaminoxidasa (MAO) y por tanto impiden el metabolismo de las aminas neurotransmisoras aumentando su concentración en la sinapsis. Los primeros IMAO’s (fenelcina, tranilcipromina), actúan irreversiblemente sobre dicha enzima, esto implica que el tejido no puede disponer de actividad MAO hasta que no se sintetice de nuevo esta enzima; por ello, el efecto de estos fármacos es de al menos 15 días (Bueno et al. 1985). 2.13.3. Inhibidores de la Recaptacion de Serotonina (ISRS) Los ISRS son un grupo de fármacos que actúan inhibiendo «selectivamente» la recaptacion de serotonina. Presentan la misma eficacia que los ADT, aunque su tolerabilidad es superior, puesto que en general muestran una afinidad mucho menor por los receptores muscarínicos, alfa-1-adrenérgicos e histaminérgicos que los ADT. Éste, al igual que el de ADT, es también un grupo heterogéneo en el que los fármacos que lo comprenden presentan diferentes variabilidades farmacodinámicas, el citalopram es de los más selectivos, y parece tener una menor incidencia de disfunción sexual. La Fluoxetina presenta una ligera acción noradrenérgica y tiene un perfil activador. La fluvoxamina presenta un perfil más sedante (dosis nocturna), mientras que la paroxetina tiene un cierto efecto sedante y también anticolinérgico. La sertralina presenta una perfil activador con cierta acción dopaminergica (Bonilla 1998). 2.14. Fluoxetina 2.14.1. Descripción Fig 12. Imagen estructural de Fluoxetina (Izq), Imagen tridimensional de Fluoxetina (Der). http://enwikipedia.org/wiki/fluoxetine 50 La Fluoxetina (Clorhidrato de (dl)-n-metil-3-fenil-3-[(a, a, a-trifluoro-p-tolil) oxi] propilamina) a menudo conocida por el nombre comercial Prozac, es un fármaco inhibidor selectivo de la recaptacion de serotonina (ISRS) con propiedades antidepresivas (Benfiel et al. 1986). Está indicado para tratar la depresión moderada a severa, el trastorno obsesivo-compulsivo (TOC), la bulimia nerviosa, los trastornos de pánico y el trastorno disfórico premenstrual, es uno de los mas antiguos en el mercado y por lo tanto el mejor conocido, sus efectos anticolinergicos son mínimos; no incrementa la depresión del sistema nervioso central cuando se combina con alcohol u otros tranquilizantes, no tiene acción adictiva y actúa mas rápido que otros conocidos (Bonilla 1998). Fig 13. Fluoxetina (Prozac). Presentación en capsulas de 20mg y 10mg. http://www.melhorqueprozac.blogs.pt/2004_11.html. 2.14.2. Historia En 1986, fue lanzada en estados unidos como nuevo tratamiento para el trastorno depresivo mayor. Fue el primer agente de esta clase de antidepresivos (ISRS). Desde entonces, se fueron agregando en esa lista drogas como sertralina, fluvoxamina, citalopram, escitalopram y paroxetina, e hicieron su aparición nuevas familias de antidepresivos, como los dúales, cuyo ejemplo más representativo es la venlafaxina, pero incluye también agentes como la duloxetina o el minalcipram (Goodnick 1991). 2.14.3. Mecanismo de Acción 51 La Fluoxetina es un fármaco de acción específica: inhibidor potente de la recaptación de serotonina en la neurona presinaptica, con acción relativamente más débil sobre la noradrenalina (Wong et al.1997). 2.14.4. Metabolismo La Fluoxetina es desmetilada en el hígado a norFluoxetina, su principal metabolito activo. Se excreta por la orina en 80%, de los cuales 2,5% lo hace como droga madre y 10% como norFluoxetina. Los restantes son metabolitos conjugados. Con la materia fecal se elimina 15%. La vida media de la Fluoxetina es de dos a tres días no se observan diferencias significativas en el metabolismo de Fluoxetina en pacientes normales y en urémicos (Malone et al. 1992). 2.15. Neurolépticos Los neurolépticos también denominados antipsicóticos y antiesquizofrénicos, son fármacos utilizados en el tratamiento de la esquizofrenia y otras psicosis, caracterizadas por la agitación y el juicio alterado. Además poseen otras propiedades que pueden ser de utilidad clínica, como su efecto antiemético y antihistamínico, y la capacidad de potenciar a los analgésicos, sedantes y anestésicos generales. Comparten la capacidad de antagonizar las acciones de la dopamina, lo cual se acepta (aunque existen muchas incertidumbres) como mecanismo de acción más importante para explicar la mayoría de sus efectos sobre el SNC (Aparicio et al. 2003). Los neurolépticos están divididos actualmente en típicos y atípicos 2.15.1. Funcionamiento Bioquimico Los neurolépticos funcionan a nivel bioquímico antagonizando los receptores dopaminérgicos. Los neurolépticos son antagonistas de los receptores de la dopamina (Aparicio et al. 2003). Todos los neurolépticos bloquean los receptores de la DA, no se sabe en que punto es decisiva la acción antipsicótica de los Neurolépticos, pero se piensa que está muy relacionado con la esquizofrenia (Aparicio et al. 2003). 52 2.15.2. Efectos Secundarios Efectos extrapiramidales (neurológicos): Son efectos motores que afectan al sistema extrapiramidal, como: Distonías agudas, parkinsonismo, Akatisia, discinesia tardía, problemas cardiovasculares, trastornos gastrointestinales Trastornos sexuales, renales, endocrinos, hepáticos entre otros (Aparicio et al. 2003). 2.15.3 Mecanismos de acción De las dos principales familias de receptores dopaminérgicos centrales (D1 y D2), los neurolépticos actúan como antipsicóticos bloqueando preferentemente los D2 (y los D4). El efecto se pone de manifiesto, inicialmente, por un aumento en la producción dopaminergica en las áreas centrales más ricas en terminaciones dopaminérgicas (sistema límbico y estriado). La administración crónica conduce a una disminución, que se observa a las 2-3 semanas en animales de experimentación, en la actividad bioquímica y electrofisiológica dopaminergica en estas áreas. Coincidente en el tiempo con este último efecto, se detecta un aumento en el número de receptores dopaminérgicos y la instauración de una supersensibilidad farmacológica a la dopamina. Posiblemente algunos de los efectos neurolépticos se deban al bloqueo dopaminérgico inicial, pero parece claro que los efectos antipsicóticos (cuya aparición se retrasa dos a tres semanas) dependen de algún otro mecanismo adaptativo y, quizás, a la instauración de un nuevo equilibrio neuroquímico en el que participen otros sistemas. A concentraciones terapéuticas los neurolépticos bloquean también receptores 5-HT2 y, con diferente sensibilidad, algunos otros subtipos de receptores noradrenérgicos, colinérgicos e histaminérgicos (Aparicio et al. 2003). 2.16. Haloperidol El Haloperidol es un fármaco antipsicótico típico, que forma parte de las butirofenonas. Se trata de uno de los primeros medicamentos que se usaron en el siglo XX para el tratamiento de la enfermedad mental, en particular de la esquizofrenia (Aparicio et al. 2003). Es un agente antipsicótico usado en síntomas tales como agitación, ansiedad y tensión, violencia, alucinaciones, hostilidad e hiperactividad. Eficaz en el tratamiento 53 de pacientes que presentan manifestaciones de psicosis, esquizofrenia, paranoia, cuadros maníaco-depresivos y reacciones asociadas con síndrome orgánico cerebral o retardo mental (Alguacil et al. 1996). Es un bloqueador no selectivo de los receptores de dopamina en el cerebro Actúa bloqueando los receptores postsinápticos en el sistema mesolímbico y bloqueando los autoreceptores dopaminérigos somatodentríticos D2 (Alguacil et al. 1996). 2.16.1. Acción Farmacológica Haloperidol es un neuroléptico, perteneciente al grupo de las butirofenonas. Potente antagonista de los receptores dopaminérgicos centrales y, por lo tanto, clasificado como un neuroléptico muy incisivo (Alguacil et al. 1996). No posee actividad antihistaminérgica ni anticolinérgica. Como consecuencia directa del efecto bloqueante dopaminérgico central, este posee una actividad incisiva sobre delirios y alucinaciones (probablemente debido a una interacción en los tejidos límbico y mesocortical) y una actividad sobre los ganglios basales (vía nigrostriada) (Alguacil et al. 1996). Produce una eficaz sedación psicomotriz, que explica el favorable efecto que produce en manía y otros síndromes de agitación. Sobre la base de su actividad límbica, el Haloperidol posee una actividad sedativa neuroléptica y ha demostrado ser útil como adyuvante en el tratamiento del dolor crónico. La actividad sobre los ganglios basales probablemente sea la razón de los indeseables efectos motores extrapiramidales (distonía, acatisia y parkinsonismo) (Alguacil et al. 1996). Los efectos antidopaminérgicos más periféricos explican su acción sobre náuseas y vómitos (vía la zona químico receptora), la relajación de los esfínteres gastrointestinales y el aumento de liberación de prolactina (a través de una inhibición de la actividad del factor de inhibición de la prolactina, PIF) (Alguacil et al. 1996). 2.16.2 Efectos colaterales y Secundarios 54 Los más comunes son los efectos a nivel neurológico. Presenta síntomas extrapiramidales al igual que todos los neurolépticos. Además de estar asociado a efectos del SNC como depresión, sedación, agitación, somnolencia, insomnio, cefaleas, confusión, vértigo, convulsiones de tipo gran mal y aparente agravamiento de síntomas sicóticos (Kokkinidis et al.1980). 2.16.3. Farmacocinética Los niveles plasmáticos máximos de Haloperidol se producen entre dos y seis horas después de la administración oral y a los 20 minutos aproximadamente después de la administración intramuscular. Después de la administración oral, la biodisponibilidad de la droga es del 60-70% (O’ Neill et al. 1982). La vida media plasmática (eliminación final) es de 24 horas (rango = 12-38) después de la administración oral y de 21 horas (rango = 13-36) después de la administración intramuscular. Se ha sugerido que se requiere una concentración plasmática de Haloperidol variable entre 4 g/l hasta un límite máximo de 20 a 25 g/l para que se produzca la respuesta terapéutica (O’ Neill et al. 1982). Haloperidol cruza la barrera hematoencefalica fácilmente. La unión a proteínas es del 92%. La excreción se produce con las heces (60%) y con la orina (40%). Aproximadamente el 1% de Haloperidol ingerido se excreta sin cambios por la orina (O’ Neill et al. 1982). El volumen de distribución a estado estable (VDss) es grande (7.9 + 2.5 l/kg). Existe una gran variabilidad inter-individual, pero una escasa variabilidad intra-individual, en las concentraciones plasmáticas de Haloperidol y en la mayoría de los parámetros farmacocinéticas. Como con muchas otras medicaciones, que se metabolizan en el hígado, esta variabilidad puede explicarse parcialmente por el paso metabólico reversible de oxidación/reducción que se produce en el hígado. Otros pasos metabólicos incluyen N-dealquilación oxidativa y glucoronidación (O’ Neill et al. 1982). 2.17. Relación Entre Dopamina y Haloperidol 2.17.1. Antagonistas Dopaminérgicos 55 Las principales familias pertenecen a los grupos de fármacos denominados antipsicóticos. Las fenotiacinas y tioxantenos son antagonistas inespecíficos, las benzamidas bloquean más selectivamente los receptores DA2 y D2, las butirofenonas ocupan una posición intermedia, y el nuevo fármaco SCH 23390 se comporta como antagonista DA1 y D1 (O’ Neill et al. 1982). 2.17.2. Fármacos que Actúan Sobre La Sinapsis Dopaminergica Las sustancias que alteran la síntesis de NE también lo hacen con la de dopamina, ya que participan en la misma vía biosintética. Sin embargo, algunas otras afectan las sinapsis dopaminérgicas de forma selectiva (Cami et al. 1998). Entre los fármacos que actúan sobre la sinapsis dopaminérgicas destacan los siguientes: L-dopa., reserpina, anfetaminas, apomorfinas benzotropina y neurolépticos (Cami et al. 1998). 2.18. Cocaína Fig 14. Acción de la Cocaína en el cerebro (Volkow 2001). 2.18.1. Descripción La Cocaína se obtiene de las hojas del arbusto del coca (Erytroxylon coca), planta originaria de los andes y que se cultiva en América del Sur, en Indonesia. La coca es un arbusto de la familia de las eritroxiláceas, con hojas alternas, aovadas y enteras, flores blanquecinas y fruto en baya pequeña y roja, crece hasta una altura media de un metro y contiene hasta 14 – 17 alcaloides distintos de los que el más conocido y estudiado es la Cocaína, este es un compuesto cristalino, su formula molecular es C17 H21 N O4, con un peso de 339.82 de color blanco y sabor amargo; es soluble en agua y reacciona con los ácidos formando sales. Penetra 56 directamente en el sistema nervioso central (S.N.C a través del torrente sanguíneo. Se comporta como una amina simpático mimética de acción indirecta, es decir, es capaz de remedar las acciones de las catecolaminas no actuando directamente sobre los receptores adrenérgicos o dopaminérgicos, sino aumentando la disponibilidad del neurotransmisor en la brecha sináptica (Cami et al. 1998). 2.18.2. Farmacocinética La Cocaína atraviesa las membranas celulares de forma rápida. Esnifada o administrada por vía intravenosa se encuentran niveles de Cocaína en el cerebro en 30 segundos, mientras que fumada sólo tarda 5 segundos en tener efectos centrales (Cami et al. 1998). 2.18.3. Absorción La cantidad relativa de Cocaína que se absorbe a nivel sistémico depende fundamentalmente de la vía de administración (Cami et al. 1998). La absorción por la mucosa nasal después de esnifar y la absorción a través del tracto digestivo después de su administración oral es similar y mucho más lenta que después de fumar o después de la administración intravenosa (Cami et al. 1998). La biodisponibilidad nasal u oral es de un 30-40%, aunque la variabilidad es mayor para la vía oral. La biodisponibilidad de la Cocaína fumada varía entre un 10% y un 20%, siendo el porcentaje menor el más común (Cami et al. 1998). Las concentraciones máximas venosas y arteriales después de las diferentes administraciones varían enormemente. No sólo dependen de las dosis y de las vías de administración sino también de la frecuencia de las inyecciones (Cami et al. 1998). La Cocaína puede absorberse tras administrarla por diferentes vías: aspiración ("esnifado"), inhalación (fumando la Cocaína base), inyección intravenosa o ingestión (Gawin et al.1988). a. Cocaína aspirada. Una "raya" de clorhidrato de Cocaína contiene entre 10 mg y 35 mg, de la droga, según su pureza. La Cocaína aspirada se absorbe muy rápidamente y lleva a máximos plasmáticos a los 15-60 minutos. Después de aspirar una dosis de 1.5 mg/kg de Cocaína se alcanza una concentración plasmática máxima en un abanico entre los 120 y los 474 mg/ml. Una dosis algo mayor, de 2 mg/kg, llevó a un pico plasmático promedio de Cocaína en el abanico anterior, de 161 mg/ml una hora después. La Cocaína también puede administrarse sobre las 57 mucosas oral o genital. La administración oral de 2 mg/kg de Cocaína lleva a picos plasmáticos a los 50-90 minutos de la administración y de magnitud similar a los conseguidos por la vía intranasal (Gawin et al.1988). b. Cocaína inhalada. Se inhalan los productos de la combustión del hidrocloruro de Cocaína o de la Cocaína base (crack). La Cocaína inhalada pasa inmediatamente a la sangre, como mínimo tan rápido como tras la inyección, porque la mayoría de ella llega a los pulmones en las primeras cuatro aspiraciones del cigarrillo (Gawin et al.1988). c. Cocaína intravenosa. La concentración máxima de Cocaína en la sangre se alcanza 4-6 minutos después de inyectarla, aunque según los autores puede tardar hasta 8 minutos (Gawin et al.1988). d. Cocaína oral. La concentración máxima de Cocaína en la sangre se alcanza unos 60 minutos después de ingerirla (Gawin et al.1988). 2.18.4. Distribución La Cocaína después de ser administrada, se distribuye ampliamente por todo el organismo (Gawin et al.1988). 2.18.5. Metabolismo La Cocaína es rápidamente metabolizada, generalmente por hidrólisis enzimática para producir benzoilecgonina (BE), ecgonina metil ester y posteriormente ecgonina. En un 1-5% se excreta por la orina sin cambios (Hatsukami 1996). La combinación de alcohol y Cocaína supone un riesgo y un aumento de la morbimortalidad asociada a la Cocaína. En estudios in vitro se ha visto que el etanol inhibe la actividad de la metilesterasa, disminuyendo la hidrólisis a benzoilecgonina. En presencia de etanol, la Cocaína es transesterificada por esterasas hepáticas a etilCocaína o cocaetileno y se incrementa la N-demetilación a NorCocaína. Este metabolito –cocaetileno- posee actividad farmacológica y tóxica (fundamentalmente a nivel cardiaco e incluso hepático) (Hatsukami 1996). 2.18.6. Eliminación El aclaramiento de la Cocaína es muy rápido, variando entre 20 a 30 ml/min./Kg (Hatsukami 1996). 2.18.7. Mecanismo de Acción 58 La Cocaína es un inhibidor de los procesos de recaptación tipo I (recaptación de noradrenalina y dopamina desde la brecha sináptica a la terminal presinaptica) lo que facilita la acumulación de estos neurotransmisores en la brecha sináptica (Gawin, F.H., Ellinwood, J.R. 1998), también bloquea la recaptación de serotonina. El consumo crónico de esta sustancia produce cambios en estos neurotransmisores con una disminución de la biodisponibilidad que se refleja en la disminución de los metabolitos 3-metoxi-4-hidroxifenetilenglicol (MHPG) y ácido 5-hidroxiindolacético (5-HIAA). Estos efectos sobre la neurotransmisión catecolaminérgica constituye la base de su mecanismo de acción como droga causante de adicción (Hatsukami 1996). 2.18.8. Acciones Farmacológicas a. Sistema nervioso simpático y aparato cardiovascular: La Cocaína produce: vasoconstricción por su efecto simpaticomimético periférico y aumento de la presión arterial por su efecto inotrópico y cronotrópico positivo unido al efecto vasoconstrictor. Bradicardia a dosis bajas por depresión del nodo sinusal y más frecuentemente taquicardia por estímulo sinusal, como consecuencia directa del estímulo simpático. Aumento de la fuerza de contracción y de la frecuencia cardiaca por un estímulo de los receptores b1 fundamentalmente. También produce midriasis, temblor y sudoración por estímulo simpático (Hatsukami 1996). b. Temperatura corporal Además del aumento de la producción de calor por aumento de la actividad muscular y de la disminución de su pérdida por la vasoconstricción, la Cocaína aumenta la temperatura corporal por pérdida del control dopaminérgico de receptores hipotalámicos reguladores de la temperatura, por agotamiento de los depósitos de dopamina, con hipertermia de rebote. Esta hipertermia puede estar acompañada de convulsiones (Hatsukami 1996). c. Sistema nervioso central La Cocaína es un potente estimulante del SNC, aunque sus efectos como tal dependen de factores tales como tipo de consumidor, ambiente, dosis y vía de administración (Hatsukami 1996). Dosis moderadas ocasionan: elevación del estado de ánimo, sensación de mayor energía y lucidez, disminución del apetito, insomnio, mayor rendimiento en la 59 realización de tareas, disminución de la sensación de fatiga, hiperactividad motora, verbal e ideativa. Pasado el efecto agudo aparece un periodo de cansancio, fatiga y disforia, más pronunciada cuanto más rápido e intenso son los efectos producidos por la Cocaína (Hatsukami 1996). Se han descrito en los consumidores de Cocaína alteraciones de la percepción, alteraciones de la capacidad crítica y discriminativa (decisiones erróneas), seudoalucinaciones táctiles, auditivas y visuales, conducta estereotipada, bruxismo y movimientos compulsivos (Hatsukami 1996). 60 3. Formulación del Problema y Justificación 3.1. Problema Los modelos, para el estudio de la depresión presentan diversos inconvenientes, comenzando por la creciente tendencia a disminuir el uso de animales de experimentación por razones éticas. Por otra parte, y cualquiera que sea el modelo de depresión considerado, hay que asumir de antemano la imposibilidad de reproducir la totalidad de la sintomatología observable en clínica, ya que resulta claro que los signos subjetivos de la depresión no pueden ser valorados convenientemente en animales de experimentación (Alguacil et al .1996). El test de nado forzado, a pesar de ser ampliamente utilizado como modelo animal de depresión, presenta algunos problemas de validez que llevan a que fármacos de acción estimulante puedan ser catalogados como antidepresivos, en tanto que descartaría fármacos con potenciales acciones antidepresivas sobre sistemas no locomotrices. 3.2. Preguntas de Investigación - ¿Existe diferencia en la latencia durante el test de nado forzado entre el tratamiento con un antidepresivo y un estimulante? - ¿Existe diferencia en el tiempo de nado durante el test entre el tratamiento con un antidepresivo y un estimulante? 3.3. Justificación Existe un gran riesgo de utilizar el test de nado forzado como único modelo para el estudio de la neurobiología de la depresión, así, los resultados obtenidos en este test deberían ser complementados con datos obtenidos en otros modelos, con la finalidad de aumentar la precisión y disminuir la probabilidad de que fármacos con potencial estimulante sean considerados antidepresivos. La actividad de nuevas sustancias tanto en éste como en otros modelos animales puede suponer un paso importante en el conocimiento de la depresión y en la adopción de estrategias para su tratamiento. 61 3.4. Hipótesis La latencia y el tiempo de nado en el test de nado forzado se ven igualmente aumentados por el tratamiento con un antidepresivo (Fluoxetina) y un estimulante (Cocaína). 62 4. Objetivos 4.1. Objetivo General Determinar la eficacia del modelo de nado forzado para discriminar los efectos de un antidepresivo y un estimulante en ratas cepa Wistar. 4.2. Objetivos Específicos • Medir los efectos de Fluoxetina sobre la tarea de nado forzado en ratas cepa Wistar con y sin pretratamiento de Haloperidol. • Medir los efectos de la Cocaína sobre la tarea de nado forzado en ratas cepa Wistar con y sin pretratamiento de Haloperidol. • Comparar los resultados obtenidos de los tratamientos (Fluoxetina y Cocaína) con el fin de observar la latencia y el tiempo de nado entre los dos. 63 5. Materiales y Métodos 5.1. Diseño de la investigación En este estudio las unidades de muestreo son cada una de las ratas cepa Wistar, el conjunto de estos individuos se define como la muestra que a su vez es la unidad de respuesta. Las variables de respuesta son la latencia y el tiempo de nado encontrado en cada una de las unidades de muestreo a partir de las cuales se hicieron inferencias para la muestra total. Los tratamientos conforman el factor de diseño y los niveles de este factor son los pretratamientos. 5.1.1. Muestra y Variables La muestra tuvo un total de 46 individuos. La variable independiente fue el tratamiento que se le realizo a cada uno de los individuos, y la variable dependiente fue el comportamiento a analizar (latencia y tiempo de nado). 5.2. Métodos 5.2.1. Animales Para la realización del estudio se utilizaron 46 ratas cepa Wistar de 45 días de edad provenientes de la facultad de veterinaria de la Universidad Nacional de Colombia. Los animales fueron ubicados en cajas plásticas (34 X 27 cm) y mantenidos bajo condiciones controladas de temperatura (23 ± 2 °C) e iluminación (14 h luz/10 h oscuridad comenzando oscuridad a las 18:00). La comida y el agua estuvieron libremente disponibles. El protocolo experimental fue realizado bajo las normas de cuidado animal institucional 5.2.2. Drogas Los siguiente agentes fueron utilizados en el estudio: (Clorhidrato de (dl)-n-metil-3fenil-3-[(a, a, a-trifluoro-p- tolil) oxi] propilamina) o Fluoxetina (Laboratorio Franco Colombiano LAFRANCOL S.A), Haloperidol (BLASKOV, frasco por 10 ml) y Chlorhydratum cocaine, la Fluoxetina y la Cocaína fueron disueltas en solución salina y administradas en un volumen de 0.01ml/g por peso corporal. El grupo control recibió el mismo volumen de solución salina. 64 5.2.3. Procedimiento Las ratas fueron forzadas a nadar individualmente dentro del tanque, antes de ser devueltas a la caja luego de ejercer el nado fueron secadas. La actividad de nado fue grabada automáticamente minuto a minuto con cámara de computadora Genius. Las sesiones de nado fueron divididas en dos; sesión de previa exposición al test (entrenamiento) con una duración de 15 minutos de nado e intervalos de un minuto entre cada individuo, y a las 24 la exposición directa o (test) con una duración de cinco minutos de nado y tres minutos de intervalo entre cada individuo. Se realizaron dos experimentos en el primero se utilizo como tratamiento solución salina y Fluoxetina las cuales fueron administradas de forma crónica durante siete días, luego los individuos de este experimento fueron expuestos a la sesión de entrenamiento, a las 24 horas estos mismos fueron sometidos al test con una previa inyección de Haloperidol, Cocaína y salina respectivamente. Durante el segundo experimento los individuos fueron distribuidos en tres grupos donde uno fue tratado con Fluoxetina, otro con salina y el otro con Cocaína. Los cuales recibieron el día del test previa inyección de Haloperidol como antagonista dopaminérgico con el fin de discriminar los efectos entre Fluoxetina y Cocaína. Fig 15. Test de nado forzado (Porsolt). http://psyweb.vghtpe.gov.tw/Animal%20models%20of%20depressiondetail.htm. 65 5.3. Análisis de Información Se realizaron análisis de varianza parametricos (ANOVA) (Experimento 1; dos vías, experimento 2; una vía) para establecer diferencias significativas entre los tratamiento (Salina, Cocaína, Fluoxetina) en sus diferentes niveles. En los casos de significancia estadística se realizo la prueba post hoc Student Newman-Keuls (SNK). Los datos se consideraban significativos cuando p< 0.05. Los resultados se expresan como grupos de datos mostrando el error estándar. Para los datos sin normalidad estadística se utilizó la adición del máximo negativo. Se realizo una prueba t de Student entre dos tipos de tratamiento (experimento 1) y una prueba de Mann – Whitney para muestras independientes. Todas las estadísticas se realizaron con el software estadístico SIGMASTAT 3.5 (systat, Inc. 2002). 66 6. Resultados 6.1 Experimento 1 En la Tabla 1 se encuentra el resumen de los análisis estadísticos para los resultados obtenidos 6.1.1 Diferencia de latencias entre el entrenamiento y el test SAL 250 FLX latencia (s) 200 150 100 50 0 -50 COC HAL SAL Fig. 16. Diferencia tiempo de latencia entrenamiento/ test. El ANOVA mostró que hubo diferencia significativa para el factor pretratamiento (F [2,29]= 10.295; P<0.001). La comparación post hoc, utilizando el test Student Newman-Keuls, mostró que, como efecto general, los sujetos del grupo pretratado con Cocaína presentaron una diferencia menor en las latencias exhibidas en las sesiones entrenamiento y test, al de los otros grupos. El ANOVA también mostró que no hubo diferencias significativas para el factor tratamiento (F [1,29]= 0.179; P=0.675). Igualmente no se encontraron diferencias significativas para las interacciones entre los factores (tratamiento y pretratamiento) (F P=0.867). 67 [2,29]= 0.143; 6.1.2 Diferencia en el tiempo de nado entre el entrenamiento y el test SAL 60 FLX % tiempo de nado 40 20 0 -20 COC HAL SAL -40 -60 Fig. 17. Diferencia tiempo de nado entrenamiento/ test. El ANOVA mostró que hubo diferencia significativa para el factor pretratamiento (F [2,29]= 16.328; P<0.001). La comparación post hoc, utilizando el test Student Newman-Keuls, mostró que, como efecto general, los sujetos del grupo pretratado con Haloperidol presentaron una diferencia menor en el porcentaje de tiempo de nado en comparación con los otros grupos. El ANOVA también mostró que no hubo diferencias significativas para el factor tratamiento (F [1,29]= 0.177; P=0.677). Igualmente no se encontraron diferencias significativas para las interacciones entre los factores (tratamiento y pretratamiento) (F [2,29]= 0.228; P=0.798). Latencia (s) 6.1.3 Latencia en el test FLX 180 160 140 120 100 80 60 40 20 0 SAL COC HAL Fig. 18. Tiempo de latencia test. 68 SAL El ANOVA mostró que hubo diferencia significativa para el factor pretratamiento (F [2,29]= 3.549; P=0.042). La comparación post hoc, utilizando el test Student Newman- Keuls, mostró que, como efecto general, los sujetos del grupo pretratado con Haloperidol presentaron un tiempo de latencia menor al de los otros grupos. El ANOVA también mostró que no hubo diferencias significativas para el factor tratamiento (F [1,29]= 0.581; P=0.452). Igualmente no se encontraron diferencias significativas para las interacciones entre los factores (tratamiento y pretratamiento) (F [2,29]= 0.272; P=0.764). % tiempo de nado 6.1.4 Tiempo de nado en el test FLX 90 80 70 60 50 40 30 20 10 0 SAL COC HAL SAL Fig. 19. Tiempo de nado test. El ANOVA mostró que hubo diferencia significativa para el factor pretratamiento (F [2,29]= 9.038; P <0.001). La comparación post hoc, utilizando el test Student Newman- Keuls, mostró que, como efecto general, los sujetos del grupo pretratado con Haloperidol presentaron un porcentaje de tiempo de nado menor al de los otros grupos. El ANOVA también mostró que no hubo diferencias significativas para el factor tratamiento (F [1,29]= 0.277; P=0.603). Igualmente no se encontraron diferencias significativas para las interacciones entre los factores (tratamiento y pretratamiento) (F [2,29]= 0.0409; P=0.960). 69 6.1.5 Tiempo de nado y latencia en el entrenamiento Fueron realizadas comparaciones con pruebas t para grupos no relacionados para las diferencias del tiempo de nado para los sujetos de los dos grupos de tratamiento en la condición de entrenamiento. Los resultados de las pruebas no arrojaron diferencias significativas entre los niveles del tratamiento para el tiempo de nado (t (33)= 1.125; P=0.269). Las diferencias en las latencias fueron evaluadas utilizando el test de Mann-Whitney, no se observaron diferencias significativas (t (16,19) = 251.500; P= 0.233) Tabla 1 Resultados de la ANOVA de dos vías aplicada a los comportamientos medidos Comportamientos medidos Pretratamiento Tratamiento F [2,29] P F [1,29] P tto x pre F [2,29] P Diferencia tiempo de latencia 10.295 <0.001 0.179 0.675 0.143 0.867 entrenamiento/ test Diferencia tiempo de nado entrenamiento/ test 16.328 <0.001 0.177 0.677 0.228 0.798 Tiempo de latencia test 3.549 Tiempo de nado test 9.038 <0.001 0.277 0.603 0.0409 0.96 0.042 0.581 0.452 0.272 0.764 6.2 Experimento 2 6.2.1 Diferencia de latencias entre el entrenamiento y el test SH FH CH 350,0 300,0 latencia (s) 250,0 200,0 150,0 100,0 50,0 0,0 Fig.20. Diferencia tiempo de latencia entrenamiento / test. 70 El ANOVA mostró que no hubo diferencias significativas para el factor tratamiento (F [2,14]= 2.806; P=0.094). 6.2.2 Diferencia en el tiempo de nado entre el entrenamiento y el test SH FH CH 50,0% 45,0% % tiempo de nado 40,0% 35,0% 30,0% 25,0% 20,0% 15,0% 10,0% 5,0% 0,0% Fig. 21. Diferencia tiempo de nado entrenamiento/ test. El ANOVA mostró que no hubo diferencias significativas para los tratamientos (F [2,14]= 1,436; P=0,271). 6.2.3 Latencia en el test SH FH CH 35,0 30,0 latencia (s) 25,0 20,0 15,0 10,0 5,0 0,0 Fig.22. Tiempo de latencia Test. 71 El ANOVA mostró que no hubo diferencias significativas para las los tratamientos (F [2,14]= 0.295; P=0.749). 6.2.4 Tiempo de nado en el test SH FH CH 45,0% 40,0% % tiempo de nado 35,0% 30,0% 25,0% 20,0% 15,0% 10,0% 5,0% 0,0% Fig. 23. Tiempo de nado test. El ANOVA mostró que no hubo diferencias significativas para las interacciones entre los tratamientos (F [2,14]= 2.990; P= 0.083). 72 7. Discusión Los SSRI son un grupo de fármacos considerados antidepresivos, que actúan inhibiendo «selectivamente» la recaptacion de serotonina. Entre ellos se encuentra la Fluoxetina una de las drogas mas ampliamente utilizadas para el tratamiento de la depresión (Bonilla 1998, Benfiel et al. 1986). La administración del la sustancia puede ser de forma crónica o aguda, se recomienda la realización de tratamientos de forma crónica ya que con este se evitan efectos ansiolíticos y ansiogenicos que pueden presentarse con tratamientos agudos, modificando la respuesta del individuo ante la ejecución del test, las dosis fueron administradas según el peso del individuo (Borelli et al. 2004). El test de nado forzado es uno de los más utilizados por su valor predictivo, ya que posee una alta capacidad para detectar actividad antidepresiva de un gran número de sustancias (Stéru 1985). A pesar de que muchos antidepresivos han sido probados en el test de nado forzado, para este caso en especial no se pudo demostrar el efecto de la Fluoxetina como droga antidepresiva durante la ejecución de los diferentes experimentos, observándose con claridad en el experimento 1, una no significancia para la Fluoxetina comparada con el grupo control, la no existencia de diferencias significativas puede ser debida a varias razones como: la acción reforzadora que constituye el retirar el individuo una vez ha terminado el periodo de nado, lo cual hace que el animal aprenda a “ esperar” la acción de retiro y deje de nadar en un menor tiempo (González 1994). Las condiciones de ejecución del test influyen de manera importante demostrando nuevamente que la influencia de estímulos externos podrían convertirse en señales que indican al animal la posibilidad de ser “rescatado” de la situación de nado (González 1994). Un factor limitante para el comportamiento de la rata en el test son las condiciones en las que se lleva a cabo, como luz y aislamiento las cuales no fueron precisas en el momento de la ejecución del test (Osorio et al. 2000). 73 Con algunas modificaciones del test como: el diámetro del tanque, profundidad y temperatura del agua se han obtenido diferentes resultados en cuanto al rango de sensibilidad de diferentes fármacos antidepresivos, así mismo el tamaño de cada uno de los individuos dentro de un misma profundidad del agua influye de manera notoria en el comportamiento de nado. Un individuo que alcance a tocar el mínimo de fondo con sus patas adopta una posición de inmovilidad prolongada (Willner 1986). Al obtener un aumento en el tiempo de nado en ratas pretratadas con Cocaína, podría deducirse que la cocaína actúa de forma similar a los antidepresivos, lo cual según antecedentes es incorrecto. Según resultados obtenidos con el uso de una droga estimulante y un antidepresivo el test de nado forzado es más sensible a mecanismos dopaminérgicos, ya que no mide específicamente efectos antidepresivos asociados a sistemas dopaminérgicos como ha sido previamente referenciado, esto queda argumentado al utilizar antagonistas dopaminérgicos como el Haloperidol el cual disminuyo notablemente el tiempo de nado (Porsolt et al.1977). En el experimento 2 se observa que en promedio el grupo que tuvo la mayor diferencia en el tiempo de latencia al comparar el entrenamiento y el test fue el grupo Cocaína-Haloperidol, y los individuos con mayor tiempo de latencia en el test fueron los del grupo tratado con Salina (Andreatini, R. 1999). Al analizar el tiempo de latencia entre el entrenamiento y el test, se observa que en promedio todos los grupos presentaron mayor tiempo de latencia en el entrenamiento que en el test, esta diferencia fue significativa para el grupo Haloperidol. Además los grupos pretratados con Cocaína presentaron muy poca diferencia en el tiempo de latencia, comportándose de manera similar en el entrenamiento como en el test (Aparicio et al. 2003). En cuanto al análisis del tiempo de nado, los individuos del grupo Haloperidol presentaron menor nado el día del test, por el contrario los individuos del grupo Cocaína presentaron un tiempo de nado mayor el día del test (Aparicio et al. 2003). 74 El efecto negativo que se observa en los datos del grupo pretratado con Cocaína se debe a un mayor tiempo de nado en el día del test Al administrar la Cocaína de forma crónica se produce un efecto denominado downregulation, mostrando con mayor significancia el antagonismo dopaminérgico debido al Haloperidol, esto se puede evidenciar claramente (Experimento 2) al obtener una diferencia grande en los tiempos de latencia y muy poco porcentaje de tiempo de nado ( Huston 2007). Los resultados de los individuos tratados y pretratados con fluoxetina sobre la ejecución del test de nado forzado, no evidencian sensibilidad del test ante sistemas serotoninérgicos, planteando a esta droga como un antiimpulsivo en lugar de antidepresivo, lo cual ha sido previamente investigando por diferentes laboratorios ( Wolf 2002). Es claro que los modelos animales necesitan ser replanteados continuamente con el fin de mejorar su validez de constructo ya que en determinados casos pueden influir variables externas y presentar resultados diferentes para un mismo análisis, como el caso presente de la Fluoxetina cuyo resultado no concuerda con los datos planteados en la literatura (Cryan et al. 2002). El refinamiento de los modelos animales a través de los años han ido demostrado que un mismo paradigma puede estar sujeto a modificaciones futuras (Cryan et al. 2002). Se debe tener en cuenta el sesgo que representa el tamaño de la muestra. Ya que esto dificulta tanto el análisis estadístico como la generalización de resultados, arrojando posibles datos no significativos debido a la ausencia de muestras mas robustas. 75 8. Conclusiones Según los resultados obtenidos por el Test de nado forzado, la Fluoxetina (Prozac), no tuvo efectos específicos sobre sistemas serotoninérgicos, dando la posibilidad de ampliar los estudios sobre esta droga como antidepresivo ya que es también considerado en pocos casos como un antiimpulsivo. Por el contrario el test de nado forzado permitió evidenciar de forma clara su sensibilidad ante sistemas dopaminérgicos, por medio del uso de sustancias estimulante como la Cocaína. El Haloperidol antagonizo de manera evidente los efectos dopaminérgicos de la Cocaína durante la ejecución del Test. El estrés y modificaciones producidas por variables del entorno no previstas, pueden ocasionar cambios en los comportamientos de cada uno de los individuos sujetos a la prueba. 76 9. Recomendaciones • Para futuros experimentos se recomienda aumentar el tamaño de la muestra para obtener unos datos más robustos que permitan observar con mayor claridad los resultados significativos. • Se deben controlar de forma más estricta las variables externas, o condiciones ambientales que puedan alterar los comportamientos de, los individuos durante la fase de investigación. • Realizar estudios con un rango más amplio de fármacos tanto estimulantes como antidepresivos que permitan realizar una comparación y generalización de resultados. • Mantener la misma cantidad de individuos constante y bajo las mimas condiciones de estrés desde el comienzo hasta la culminación de la investigación. 77 10. Literatura Citada Alguacil, F. L., Alamo, C., Iglesias, V. 1996. Contribución de los estudios preclínicos, los acontecimientos y terapéutica de la depresión. Psicothema . 8 (3): 657-667. Andreatini, R., Bacellar, L.F.S. 1999. the relationship between anxiety and depression in animal models: a study using the forced swimming test and elevated plus-mase. Brazilian Journal Of medical and Biological Research. 32: 1121-1126. Anisman, H. 1978. Neurochemical changes elicited by stress. En H. Anisman y G. Bigmani (Eds). Psychopharmacology of aversively motivated behaviour 119-172. Aparicio, F. C., Velasco, F. 2003. El paradigma de la elección de barrera: evaluación del Haloperidol con ocho alternativas de respuestas y dos requisitos de traslado. Univ Psicol. Bogota (Colombia) 2 (2): 109-135. Arango, V., Ernsberger, V., Marzuk, P.M., Chen, I.S., Tierney, H., Stanley, M., Reis, D.J. Mann, J.J. 1990. Autoradiographic demonstration of increased serotonin 5-ht2 and b-adrenergic receptor binding sites in the brain of suicides victims. Archives of general psychiatry. 47: 1038-47. Armario, A. 1989. Valoración crítica de los modelos animales de depresión. Revista de farmacología Clínica y Experimental. 6(3): 125-126. Baker, Roger. A., Barass, S., Neal, M.J. 2001. Neurociencia en esquemas. Ars Médica. España. Baldessarini, R. J 1991. Los fármacos y el tratamiento de enfermedades psiquiatricas. En: Go en odman, G.A., Ral, T.W., Niees, A.S., Taylor, P. (Ed). Las bases farmacológicas de la terapéutica. (8va ED). México, D. F. Médica panamericana. 381-432. 78 Bal-Klara, A., Bird, M. M. 1990. The effects of various antidepressant drugs on the fine-structure of neurons of the cingulate cortex in culture. Neuroscience. 37: 685-92. Bedoya, A. T. 1998. Síndrome de interrupción del inhibidor selectivo de la recaptacion de serotonina (ISRS). Universitas medica. 39 (4): 161-170 Benfield, P., Heel, R. C., Lewis, S. P. 1986. Fluoxetine. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy in depressive illness. Drugs. Dec.32(6):481-508. Benoit, P. D., Cheng, F., Bourin, M. 2005. Forced swimming test in mice: a review of antidepressant activity. Psychopharmacology. (2005) 177: 245–255 Bonilla, U.V.1998. Manual clínico de los antidepresivos. Medicina. México. D.F Salvat. 73-249 pp. Borsini, F., Meli, A. 1988. Is the forced swimming test a suitable model for revealing antidepressant activity?. Psychopharmacology. 94(2): 147-160. Bueno, J. A., Saboner, F., Salvador, L., Gascon, J. 1985. Psicofarmacologia clínica. Capitulo 6: antidepresivos inhibidores de la Monoaminoxidasa (IMAO). Salvat editores. S.A. Barcelona. España. 173-199 Cairncross, K.D., Wren, A.F., Cox, B., Schnieden, H. 1977. Effects of olfactory bulbectomy and domicile on stress-induced corticosterone release in the rat. Physiology and Behaviour. 19(4): 485-487. Cami, J., Farre, M., González, M. L., Segura, J., de la Torre R. 1998. Cocaine metabolism in human alters Use of alcohol. Clinical and research implications. Recent dev alcohol.. 14: 437-55. Collu, M., Poggiu, A.S., Devoto, P. Serra, G.1997. Behavioural sensitization of 79 mesolimbic dopamine D2 receptors in chronic fluoxetine-treated rats. European journal of pharmacology. 322: 123-7. Connor TJ, Kelliher P, Shen Y, Harkin A, Kelly JP, Leonard BE. 2000Effect of subchronic antidepressant treatments on behavioural, neurochemical, and endocrine changes in the forced-swim test. Pharmacol, Biochem Behav;65:591– 7. Copyright Sygmastat, Inc. 2002. Systat, software Inc. USA Cryan, F.J., Markou, A., Lucki, I. 2002. Assessing antidepressant activity in rodents: recent developments and future needs. Trens in Pharmacological Science. May. 2002. 23 (5):238-245. Dalvi, A., Lucki, I. 1999. Murine Models of Depression. Psychopharmacology 147: 14-16 Devlin, Tomhas. M. 2004. Bioquímica: libro de testo con aplicaciones clínicas. Barcelona, España. Reverte. 4ª ED. Duman, R.S., Heninger, G.R., Nestler, E.J. 1997. A molecular and cellular theory of depression. Archives of general psychiatry. 54: 597-606. Ferreira, N., Bonilla, Jaime., Becerril, C., Velásquez, O. 1998. Modelos animales de depresión. Bases neurobiológicas y ecológicas de la conducta. Tlaxcala: universidad autónoma de tlaxcala y universidad autónoma metropolitana: 449-71. Frankowska, M., Filip, M., Papp, M., Przegalinski, E. 2001. Whitdrawal from cocaine self-administration or chronic mild stress increase immobility in the forced swim test in rats. Behavioural Pharmacology. P.2.08. s45pp Frazer, A 1997. Pharmacology of psychopharmacology. 17(2s): 2-18. 80 antidepressants. Journal of clinical Gawin F.H, Ellinwood Ehjr. 1988.Cocaine and other stimulants: Actions, abuse and treatment. N. Engl. J. Med. 318: 1173-82. Goodnick, P.J. 1991. Pharmacokinetics of second generation antidepressant: fluoxetine. Psychopharmacology bulletin, 27: 503-11. Guadarrama, L., Escobar, A., Zhang, L. 2006. Bases neuroquímicas y neuroanatómicas de la depresión Revista Facultad Medicina México. 49 (2): 66-72 Guías de neuro.2004 Neurotransmisores. (En línea) (http://guiasdeneuro.com.ar /ne urotrans.htm) (Consulta ago. 15 2007) Hatsukami, D.K., Fischman. M.W. 1996. Crack cocaine and Cocaine hydrochloride. Are the differences Myth or reality?. Jama.. 276: 1580-8. Herraez, J. V., Herranz, M. R., Gálvez, L. A., 2004. Que es un modelo animal. Gaceta Óptica Nº 382 Mayo. Hong CJ,. 2006. Anumal models of depression. Test de nado forzado (Porsolt). (En línea). (http://psyweb.vghtpe.gov.tw/Animal%20models%20of% 20depression- detail.htm). (Consulta abr 22. 2007). Institute For Animal Reproduction. (En línea). 2005. Iar: Wistar_Imamichi Rat. (http:/www.iar.or.jp/shodobutsu/wi_rat/index.html) (Consulta 22 jun. 2007). Kandel, Eric R., Schwartz, James Harris, ED. Jessell, Thomas M., ED. Agud Aparicio, José Luís Tr. 2001. Principios de Neurociencia. Neurofisiología. Katz, R. J., Roto, K. A., Carroll, B.J. 1981. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression. Neuroscience and Bio behaviour Review. 5(2): 247-251. 81 Kennet, G.A., Chaouloff, F., Marrou, M. Curzon, G. 1986. Female rats are more vulnerable than males in an animal model of depression: the possible role of serotonin. Brain Research. 382(2): 416-421. Kokkinidis, L., Zacharko, R.M., Predy, P.A.1980. Post-amphetamine depression of self-stimulation responding from the substantial nigra: reversal by tricyclic antidepressants. Pharmacology Biochemistry and Behaviour, 13(3), 379-383. Laboratorio en la Experimentación Biológica. ED. Universidad Nacional de Colombia. 27 pp. León, L.A., Ruge, E., Espinosa, C., García, L., Romero, A., Merchán, M., Cárdenas, F.P. 2006. Efectos del pretratamiento con el antagonista dopaminérgico Haloperidol sobre la tarea de nado forzado en ratas tratadas con dos antidepresivos. Universidad de los Andes. Grupo de Neurociencia y comportamiento. Investigacion en proceso. Facultad de sicologia. Majeroni, B.A ., Hess, A.P. 1998. The pharmacologic treatment of depression. The journal of the American board of family of depression. 11(12): 127-139. Malone, D.A., Dimeff, R.F. 1992. The use of fluoxetine in depression associated with anabolic steroid withdrawal: a case series. J Clin Psychiatry. Apr. 53(4):130-2. Manter and Gatz`s. 1992. Essentials of clinical Neuroanatomy and neurophysiology. Edition 8th. F.A. Davis Co. Philadelphia. (En línea). (http://www.psicofarmacologia. info/curso/farmacodinamica/fig8.html) (Consulta ago. 15. 2007). Martín, P., Soubrié, P., Simón, P. 1986. Shuttle box deficits induced by inescapable shocks in rats: reversal by the beta-adrenergic stimulants clenbuterol and salbutamol. Pharmacology Biochemistry and Behaviour. 24 (2): 177-181. Melhor que Prozac. 2004. Blog, todo sobre Prozac (Fluoxetina) y afines. (En línea). (http://www.melhorqueprozac.blogs.pt/2004_11.html). (Consulta abr 22. 2007). 82 Mrad de Osorio A., Cardozo de Martínez C. 2000. Utilización de Animales de Muller, E., Thurner, M. 1989. The role of brain dopamine. Basic and Clinical Aspects of Neuroscience. Vol3. 33-41 Murray, CJ., López, A.D. 1996. Evidence-based health policy-lessons from the Global Burden of Disease Study. Science. 274:740-3. Neuropharmacologically irrelevant animal model of depression. Neuropharmacology. 18(1): 891-893. O’Neill, K.A., Valentino, D. 1982. Escapability and generalization: Effect on behavioural despair. European Journal of Pharmacology. 78(3): 379-380. Onodera, K. 1991. Effects of antidepressants and antihistaminics on catalepsy induced by intracerebroventricular administration of histamine in mice. Methods and Findings in Experimental and Clinical Pharmacology, 13, 397-403. Porsolt, R.D, Pichon, M.L. Jalfre. M. 1977. Depression: a new model sensitive to the antidepressant treatment. Nature. 266: 730-2. Porsolt, R.D., Anton, G., Blavet, N. Jalfre, M. 1978. Behaviour despair in rats: a new model sensitive to antidepressant treatment. European journal of pharmacology. 47: 379-91. Porsolt, R.D., McArthur, R.A., Lenègre, A. 1993. Psychotropic screening procedures. En F. van Haaren (Ed.) Methods in Behavioral Pharmacology. 23-51. Richardson, J.S. 1984. Neurochemical psychiatry as a source of hypotheses concerning the role of homeostatic mechanisms in brain function. International Journal of Neuroscience. 24(2): 197-202. 83 Richardson, J.S. 1991. Animal models of depression reflect changing views on the essence and etiology of depressive disorders in humans. Progress in NeuroPsychopharmacology and Biological Psychiatry. 15(2): 199-204. Rodriguez, J.F., Contreras, C.M. 1998. Los fármacos antidepresivos y sus acciones en algunas estructuras del sistema límbico. La ciencia y el hombre, 10: 51-61. Scanbur.2005. Mice and Rats. (En Línea): 12-07-2007. (http://www.scanbur.eu/products__Lab_animals.htm) (Consulta jun. 2007). Sherman, A.D., Allers, G.L., Petty, F. Henn,F.A.1979. A Stephen, M., Stahl, A. 1998. Psicofarmacologia esencial. Bases neurocientíficas y aplicaciones clínicas. Capitulo 5: depresión. Barcelona. España. 111-175 pp. Steru, L., Chermat, R., Thierry, B., Simon, P. 1985. The tail suspension test: A new method for screening antidepressants in mice. Psychopharmacology. 85(3): 367370. Tovar, J. A. 2001. Libros virtuales. Neurobioquimica. Programa postgrado. Facultad de ciencias. Pontificia Universidad Javeriana. Volkow, N .D. 2001. Serie de reportes de investigación. Cocaína abuso y adicción. Instituto Nacional Sobre el abuso de drogas. (En línea). 1-8pp. (http://www.nida.nih.gov/PDF/RRCocaina.pdf). (Consulta may 25. 2007). West, A.P. 1990. Neurobehavioral studies on forced swimming: the role of learning and memory in the forced swim test. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 14(6): 863-877. Wikipedia the free enciclopedia. 2007. Dopamine (En línea). 11-15-2007. (http://www.wikipedia.org/wiki/serotonin) (consulta 6 ago. 2007). 84 Wikipedia the free enciclopedia. 2007. Fluoxetin. (En línea). 11-15-2007. (http://www.wikipedia.org/wiki/serotonin) (consulta 6 ago. 2007). Wikipedia the free enciclopedia. 2007. Serotonin. (En línea). 11-15-2007. (http://www.wikipedia.org/wiki/serotonin) (consulta 6 ago. 2007). Willner, P. 1984. The validity of animal models of depression. Psychopharmacology. 83: 1-16. Willner, P. 1986. Validating criteria for animal models of human mental disorders: Learned helplessness as a paradigm case. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 10(6): 677-690. Willner, P. 1991. Animal models of depression. En: P. Willner (Ed.) Behavioral models in psychopharmacology. 91-125. Cambridge University Press. Willner, P., Mitchell, P.J. 2002. The validity of animal models of predisposition to depression. Behav Pharmacology 13:169–1888. Wong, D.T., Bymaster, F.P., Englenman, E.A. 1997. Prozac (fluoxetine, Lilly 110140), the first selective serotonin uptake inhibitor and an antidepressant drug: twenty years since its first publication. Life Sci. 57(5):411-41. Yannielli, C.P., Cardinali, P.D. 1999. Cronobiología de la ansiedad y de la depresión en estudio de modelos animales. LAB de Neurociencias. Departamento de Fisiología, Facultad de Medicina. Universidad de Buenos Aires. Paraguay. 22551121. Buenos Aires. 85