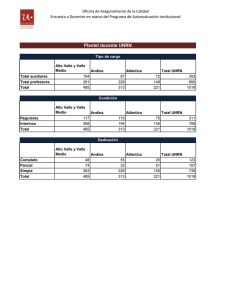
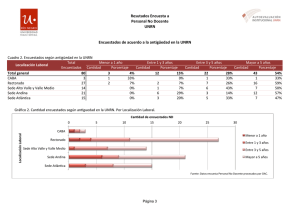
Programa Quimica General e Inorganica Satti 2016 con firma
Anuncio

Sede y localidad Sede Andina, San Carlos de Bariloche Carrera Ingeniería Ambiental Programa de la asignatura Asignatura: Química General e Inorgánica Año calendario: 2016 Cuatrimestre: Segundo Créditos: Carga horaria semanal: 6 (seis) hs. Carga horaria total: 96 hs Días y horario de cursada: Teoría: Martes y Jueves de 9 a 10,30hs. Práctica: Martes de 13 a 16 hs (Comisión 1) Jueves de 17 a 20 hs (Comisión 2) Horarios, días y lugar de consulta para alumnos: Consultas de Teoría. Martes y jueves de 8,30 a 9 y de 10,30 a 11 Sede Mitre 630. Consulta de Prácticas. Martes de 15 a 18. Sede Tacuarí. Horas de estudio recomendadas (extra clase): 6 horas semanales. Profesor : Email: Dra. Patricia Satti [email protected] Auxiliar: Email: Lic. Gabriela Perren (Comisiónes 1 y 2) [email protected] Lic. Mariana Langhenheim (Comisión 1 y 2) [email protected] Programa Analítico de la asignatura Contenidos mínimos establecidos por Plan de Estudio: Sistemas materiales. Estructura atómica. Propiedades periódicas. Enlaces químicos. Estequiometría. Estados de agregación de la materia. Sistemas coloidales, líquidos y gaseosos. Gases ideales y reales. Fuerzas de Van del Waals. Estado líquido. Soluciones. Propiedades coligativas. Estado sólido. Termoquímica. Reacciones químicas. Equilibrio químico. Cinética química. Hidrólisis. pH. Reacciones redox. Electroquímica: ecuación de Nernst. Descripción El curso está destinado a Alumnos de Ingeniería Ambiental. El objetivo fundamental del curso es presentar al alumno los conceptos básicos de química, profundizando a traves de aplicación a problemas concretos de campo de la tecnología, justificándolos a partir de la estructura de la materia. La amplia cantidad de temas a desarrollar y la escasa carga horaria obliga a una selección de los Creada por Ley 26.330 /Colón 450 Oficina 1. CP8500 Viedma. Río Negro /[email protected]/www.unrn.edu.ar mismos. En este curso se dio particular atención a estequiometría y soluciones, brindando herramientas sólidas para el desarrollo de temas específicos como cinética y electroquímica. Objetivos de la asignatura: * Presentar una visión amplia de la química y su significancia para la civilización y la importancia de los procesos químicos en las diversas áreas de la ingeniería. * Desarrollar en los estudiantes una apreciación del espíritu de la ciencia y del método científico. * Dar los fundamentos y principios sobre los que se basa la ciencia y dar ejemplos de aplicación de estos principios. * Inducir a la interpretación cualitativa de los procesos naturales y artificiales en los cuales hay transformaciones de la materia. * Proveer de las herramientas de cálculo necesarias como para poder interpretar cuantitativamente dichos procesos. * Integrar los conocimientos adquiridos con los de otras ciencias. * Manejar bibliografía y fuentes de información. * Integrar los conocimientos adquiridos con la actividad ingenieríl y la tecnología. * Relacionar los procesos industriales y las propiedades de los materiales. * Desarrollar en los estudiantes habilidades para la resolución de problemas, basado en los principios del razonamiento lógico y sus capacidades de observación y de manejo de instrumentos experimentales Propuesta Metodológica: La asignatura consistirá de clases teóricas y clases prácticas que ocuparán 54 y 42 horas respectivamente del total de horas dedicadas a la asignatura. En las clases teóricas se desarrollarán las unidades del programa de la asignatura introduciendo al estudiante en los aspectos conceptuales y teóricos que, conjuntamente con la ejemplificación, faciliten la asimilación de los contenidos y permitan al alumno desarrollar capacidad analítica tendiente a la correcta clasificación y encuadre de los diversos temas que se plantean. En las clases prácticas se buscará que, mediante la ejercitación el alumno adquiera capacidades para asimilar y aplicar los conceptos teóricos aprendidos, y aplicar los contenidos al funcionamiento de trabajos prácticos de laboratorio de baja complejidad. Se estimulará la participación y discusión por parte de los alumnos y el trabajo en condiciones de seguridad. Asistencia: para alcanzar la condición de regularidad es necesario que el alumno presente una asistencia, en las clases de laboratorio del 90% y en las clases de problemas del 60%. El alumno puede registrar un porcentaje inferior de presencias en clases de problemas si las justifica debidamente ante los docentes de la asignatura y el coordinador de la carrera. La asistencia a las clases teóricas no es obligatoria Evaluación: la evaluación del curso consiste en dos exámenes parciales y una instancia de recuperación en la que se podrán recuperar ambos parciales de la materia. Para tener derecho a la Creada por Ley 26.330 /Colón 450 Oficina 1. CP8500 Viedma. Río Negro /[email protected]/www.unrn.edu.ar instancia de recuperación se deberá haber asistido al parcial o haber presentado un certificado de es obligatoria. Evaluación: la evaluación del curso consiste en dos exámenes parciales y una instancia de recuperación en la que se podrán recuperar ambos parciales de la materia. Para tener derecho a la instancia de recuperación se deberá haber asistido al parcial o haber presentado un certificado de inasistencia por enfermedad. El recuperatorio tendrá lugar en la última semana de clases del semestre. Regularización: el alumno será regularizado en la materia si alcanza el requisito de asistencia y obtiene en cada parcial, o recuperatorio en el caso que corresponda, una calificación mayor o igual a seis (6). Promoción: alcanzará dicha condición el alumno que obtenga en cada parcial una nota mayor o igual a ocho (8). En caso de desaprobarse un parcial se pierde automáticamente la instancia de promoción. Contenidos dictados en clases teóricas Unidad I La materia: definición, clasificación, sustancias y mezclas, elementos y componentes, estados y cambios. Propiedades extensivas e intensivas. Átomos y moléculas. Estructura electrónica. Periodicidad química: tabla periódica, energía de ionización, afinidad electrónica. Elementos, Grupos, Relaciones entre los grupos. Las leyes fundamentales de la química. Nomenclatura de compuestos moleculares. Mol. Masa molar. Composición porcentual másica. Determinación de formulas empíricas y moleculares. Duración tentativa del dictado de la unidad: 1 semana y media Unidad II Modelo atómico moderno. Orbitales atómicos. Propiedades atómicas y enlace químico: Regla del octeto. Tipos de enlace. Enlace iónico, covalente. Nomenclatura y formulación. Número de oxidación. Clases e fuerzas intermoleculares: Fuerzas ión-dipolo. Fuerzas dipolo–dipolo. Enlace puente hidrógeno. Fórmulas químicas. Sustancias químicas. Óxidos, hidróxidos, oxácidos, etc. Su formación y clasificación. Nomenclatura. Duración tentativa del dictado de la unidad : 1 semana y media Unidad III Reacciones químicas y ecuaciones químicas. Estequiometría: cantidad de reactivos; Reactivo limitante. Balanceo de ecuaciones. Tipo de reacciones: Reacciones de combinación. Reacciones de Creada por Ley 26.330 /Colón 450 Oficina 1. CP8500 Viedma. Río Negro /[email protected]/www.unrn.edu.ar descomposición. Reacciones de desplazamiento. Solubilidad de compuestos iónicos. Reacciones acuosas iónicas: Reacciones de precipitación; Reacciones de neutralización. Duración tentativa del dictado de la unidad : 2 semanas Unidad IV Hidrólisis. Tipos de soluciones: Solubilidad: Equilibrio en un proceso de formación de una solución. Efecto de la temperatura sobre la solubilidad. Expresiones físicas y químicas de concentración. Unidades de concentración: normalidad, molaridad, fracción molar, porcentaje masa-masa, porcentaje masa-volumen, porcentaje volumen-volumen, partes por millón y partes por mililitro. El estado gaseoso. Las fuerzas intermoleculares y los líquidos y sólidos. Sustancias que existen como gases. Presión de un gas. Las leyes de los gases. La ecuación del gas ideal. Ley de Dalton de las presiones parciales. La teoría cinético molecular de los gases. Formación de fases condensadas Estado líquido. Estructura de los líquidos. Fuerzas intermoleculares. Propiedades coligativas. Estado sólido. Estructura de los sólidos. Cambios de fase. Diagramas de fase. Duración tentativa del dictado de la unidad : 3 semanas Unidad V Energía de las reacciones químicas. Concepto de sistema. Estado y funciones de estado. Trabajo y calor. Primer principio de la termodinámica. Conceptos de entalpía. Termoquímica. Procesos exotérmicos y endotérmicos. Calores de reacción. Ley de Hess. Reversibilidad y espontaneidad de las reacciones químicas. La entropía y el segundo principio. Interpretación molecular de la entropía. Entropías absolutas y tercer principio. Energía libre y espontaneidad de una reacción. Equilibrio químico. Constante de equilibrio y energía libre de una reacción. Ley de acción de masas. Formas de expresión de la constante de equilibrio. Desplazamiento del equilibrio: principio de Le Chatelier. Variación de la constante de equilibrio con la temperatura. Duración tentativa del dictado de la unidad: 2 semanas Unidad VI Análisis cualitativo de los aspectos que influyen sobre la velocidad de reacción. Expresión de la velocidad: velocidad promedio, instantánea e inicial, expresión de la velocidad en términos de reactivos y productos. La ley de velocidad y sus componentes: efecto de la concentración de los reactivos, efecto de la temperatura. Explicación de los efectos de la concentración de reactivos y de la temperatura sobre la velocidad de reacción: Teoría de colisiones. Teoría estado de transición, naturaleza del estado activado. Mecanismo de reacción: Reacciones elementales y molecularidad. Paso determinante de la velocidad. Mecanismos de reacción. Catálisis homogénea y catálisis heterogénea Creada por Ley 26.330 /Colón 450 Oficina 1. CP8500 Viedma. Río Negro /[email protected]/www.unrn.edu.ar Duración tentativa del dictado de la unidad: 1 semana y media Unidad VII Equilibrio iónico: Aplicación de los principios del equilibrio químico a distintos sistemas. Teoría general de ácidos y bases. Producto iónico del agua. Concepto y determinación de pH. Fuerza de los ácidos y las bases. Constantes de disociación. Titulaciones ácido-base. Indicadores. Soluciones reguladoras. Variación del pH en ausencia y en presencia de sustancias reguladoras. Soluciones de sales poco solubles. Producto de solubilidad, definición y cálculo. Efecto de ión común y del pH. Predicción de la formación de precipitado. Soluciones de iones complejos. Duración tentativa del dictado de la unidad: 2 semanas y media Unidad VIII Procesos de óxido-reducción. Concepto de estado de oxidación. Estequiometría de las reacciones redox. Termodinámica de las reacciones redox. Celdas galvánicas. Descripción. Potencial estándar de hemicelda. Tabla de potenciales electroquímicos. Predicción de reacciones redox. Variación del potencial redox con la concentración: Ecuación de Nernst. Celdas de concentración. Potenciales de celda y constante de equilibrio. Ejemplos de pilas galvánicas. Corrosión. Aplicaciones analíticas. Electrólisis: fundamentos. Leyes de Faraday. Equivalente electroquímico. Procesos electródicos. Métodos electrolíticos de importancia industrial. Duración tentativa del dictado de la unidad: 2 semanas Bibliografía: Clases teóricas suministradas en formato pdf y puestas a disposición de los alumnos en el blog de la materia. Problemas y Trabajos prácticos elaboarados por el personal de cátedra y puestas a disposición de los alumnos en el blog de la materia. Brown, T.L.; Le May, H.E.; Bursten, B.E. Química: la ciencia central. 11ª ed., Pearson Educación, México, 2009. 1109 pp a a Atkins P.W.; Jones L. Principios de Química. Los caminos del descubrimiento. 3 ed., 3 reimp, Ed. Médica Panamericana, Buenos Aires, 2010. 738 pp Chang, R.; College, W. Química General. 10ª ed., Ed. Mc Graw Hill Interamericana, México, 2010. 1085 pp. Whitten, K.W.; Peck, M.L, Stanley, G. Química General. 8ª ed., Cengage Leaning, México, 2008.1066 pp Petrucci, R.; Harwood, W. S.; Herring, F. Química General: Enlace Químico y estructura de la materia 10ª ed., Pearson Educación, Madrid, 2011. 1432 pp. a Atkins P.W.; De Paula, J. Química Física. 8 ed., Ed. Médica Panamericana, Buenos Aires, 2008. 1096 pp Burns, R Fundamentos de Química. Pearson Educacion, Colombia. 2003. 784 pp. López Cancio, J. Problemas de Química. Prentice Hall, Madrid. 2000. 368 pp. Shriver, D.; Atkins, PW; Langfod, C.H. Química Inorgánica. Reverté, Barcelona.. 1998. 968 pp. Creada por Ley 26.330 /Colón 450 Oficina 1. CP8500 Viedma. Río Negro /[email protected]/www.unrn.edu.ar Bibliografía complementaria: Temas de Química General. M. C. Angelini y otros, Ed. Eudeba, Buenos Aires, 1995. Ingeniería Ambiental. J. G. Henry y G. Heinke, 2ª ed., Prentice Hall, México, 1999. Sistemas Químicos. Chemical Bond Approach Project. Ed. Reverté S.A. Ingeniería de las Reacciones Químicas. O. Levenspiel, 2ª ed., Ed. REPLA, SA, México, 1987. Química Básica. C. Di Risio, M. Roverano e I. Vázquez, 4ª ed., Ed. CCC Educando, Buenos Aires, 2011. Química y reactividad química. J. Kotz y P. Treichel, 5ª ed., Thomson, México, 2003. Química Ambiental. Baird, C. Reverté, Barcelona. 2001. 622 pp. Fundamentos de Química. Zumdahl, S. Mc Graw-Hill. 1992. 712 pp. Química Medioambiental. Spiro, T.; Stigliani, W. Pearson. Madrid. 2004. 520 pp. Química Ambiental de sistemas terrestres. Domenech, X.; Peral, J. Reverté, Barcelona. 2006.239 pp. La Química está entre nosotros. Andrade Gamboa, J.; Corso, H. Siglo Veintiuno Editores,Buenos Aires, 2013. 128 pp. a Pasaporte a la química universitaria. Andrade Gamboa, J.; Corso, H. 2d . Ed. Buenos As, Dunken. 2001.224 pp. Seminarios de problemas: Seminario 1: Errores y densidad. Seminario 2: Nomenclatura. Seminario 3: Estequiometría de la reacción. Seminario 4: Soluciones. Seminario 5: Gases. Seminario 6: Termoquímica, termodinámica y cinética. Seminario 7: Equilibrio químico. Seminario 8: Equilibrio Iónico: pH. Seminario 9: Electroquímica y potencial Redox Laboratorios: TP 1 ¿Cómo se escribe un informe de laboratorio?. Nociones de seguridad en el laboratorio. TP 2 Reconocimiento de Material de Laboratorio. TP 3 Determinación de densidad de sólidos y líquidos. Propagación de errores. TP 4 Estequiometría. Reactivo Limitante. Obtención de carbonato de calcio. TP 5 Soluciones: preparación de HCl por dilución y NaOH por disolución. Valoración de ambas. TP 6: Gases. Obtención del peso molecular del Mg por reacción de HCl con H2. TP 7: Determinación de la concentración de soluciones por espectrofotometría. TP 8: Equilibrio químico. Creada por Ley 26.330 /Colón 450 Oficina 1. CP8500 Viedma. Río Negro /[email protected]/www.unrn.edu.ar