descargar - Facultad de Ciencias Veterinarias
Anuncio
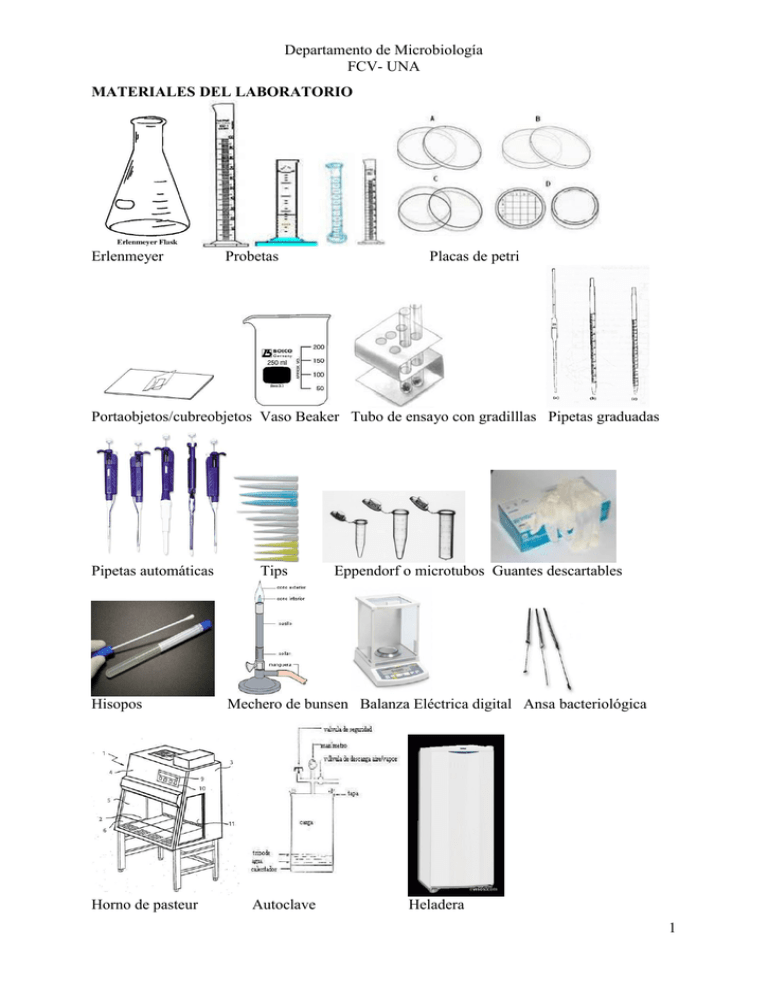
Departamento de Microbiología FCV- UNA MATERIALES DEL LABORATORIO Erlenmeyer Probetas Placas de petri Portaobjetos/cubreobjetos Vaso Beaker Tubo de ensayo con gradilllas Pipetas graduadas Pipetas automáticas Hisopos Horno de pasteur Tips Eppendorf o microtubos Guantes descartables Mechero de bunsen Balanza Eléctrica digital Ansa bacteriológica Autoclave Heladera 1 Departamento de Microbiología FCV- UNA CLASE PRÁCTICA 1 EL LABORATORIO DE MICROBIOLOGÍA El laboratorio de microbiología montado posee características especiales que lo distingue de otros tipos como el laboratorio de química, física, parasitológica, anatomopatológica, etc. Puede estar organizado para realizar varias funciones o bien ser altamente especializado, dependiendo esto de su equipamiento humano y material. El laboratorio de microbiología esta equipado para cumplir con los fines de la universidad a saber: 1- Docencia 2- Investigación 3- Diagnostico 4- Extensión Universitaria - 1- Ubicación: En lo posible aislado de otras dependencias para evitar la difusión del material que se manipula. Evitar las personas ajenas al servicio. 2- Las aguas servidas: Deben ser sometidas a tratamiento antes de ser eliminados. Las personas que entran en el área restringida deben tener cuidado o tomar ciertas precauciones para evitar sacar materiales contaminantes o introducirlos dentro del laboratorio. 3- Área Física: a-) Área sucia: donde se realiza el manipuleo de las muestras, donde queda el material, se procede a desinfección y autoclavado de todos los materiales. b-) Área limpia: Una vez autoclavado, se lava y se esteriliza, queda listo para su uso. Equipos: - Vidriería: Vaso Beaker - Erlenmeyer - Tubos de distintas medidas, pipetas, placas de petri. - Aparatos: Como autoclave, Horno de Pasteur. - Estufas: A temperaturas variadas. - Heladeras: Para guardar drogas y muestras. - Centrífuga: Para centrifugar sangre, orina, etc. - Microscopio: Imprescindible en el laboratorio. - Baño María. Mechero de Bunzen: A gas. Conducta personal y de grupo. Los trabajos de laboratorio de los estudiantes exige el cumplimiento de un conjunto de reglas de conducta, tanto personal como de grupo para asegurar un cierto orden. Citamos las reglas de Salle: Fundamentales principios de bacteriología, rogando su estricto cumplimiento. 1) No depositar prendas personales sobre la mesa de trabajo. 2) Entrar en el laboratorio con guardapolvo, para proteger la ropa de la calle y contra posibles contaminaciones. 3) No traer comida ni comer en el laboratorio. Aprenda a no colocar en la boca lápices ni útiles de laboratorio. 4) Humedecer los rótulos con agua y no con la lengua. 5) Observar el mayor cuidado posible en el uso de aparatos y equipos de laboratorio. 6) El ansa de platino debe ser esterilizado antes y después de su uso. 7) No fumar. 8) Apagar teléfono celular – radio. 9) No tomar tereré, mate, etc. 2 Departamento de Microbiología FCV- UNA CLASE PRÁCTICA 2 MICROSPCOPIA Microscopio Óptico: consta de varios sistemas: Sistema de soporte: - Pie - Brazo o vástago - Revolver - Platina - Carro Sistema de iluminación: - Fuente de iluminación - Espejo (para luz externa) - Condensador (de campo claro, de campo oscuro, de contraste) - Diafragma - Filtros (azules, excitadores, frenadores, atenuadores del rojo) Sistema óptico: - Lentes objetivos - Lentes oculares )mono y binoculares) - Prismas (para los binoculares) Sistema de ajuste o enfoque: - Macrométrico - Micrométrico 3 Departamento de Microbiología FCV- UNA Tipos de microscopio - Microscopio compuesto es un aparato óptico hecho para agrandar objetos, consiste en un número de lentes formando la imagen por lentes o una combinación de lentes posicionados cerca del objeto, proyectándolo hacia los lentes oculares u el ocular. El microscopio compuesto es el tipo de microscopio más utilizado. - Microscopio óptico también llamado "microscopio liviano", es un tipo de microscopio compuesto que utiliza una combinación de lentes agrandando las imágenes de pequeños objetos. Los microscopios ópticos son antiguos y simples de utilizar y fabricar - Microscopio digital tiene una cámara CCD adjunta y esta conectada a un LCD, o a una pantalla de computadora. Un microscopio digital usualmente no tiene ocular para ver los objetos directamente. El tipo triocular de los microscopios digitales tienen la posibilidad de montar una cámara, que será un microscopio USB. - Microscopio fluorescente o "microscopio epi-fluorescente" es un tipo especial de microscopio liviano, que en vez de tener un reflejo liviano y una absorción utiliza fluorescencia y fosforescencia para ver las pruebas y sus propiedades. - Microscopio electrónico es uno de los más avanzados e importantes tipos de microscopios con la capacidad más alta de magnificación. En los microscopios de electrones los electrones son utilizados para iluminar las partículas más pequeñas. El microscopio de electrón es una herramienta mucho más poderosa en comparación a los comúnmente utilizados microscopios livianos. 4 Departamento de Microbiología FCV- UNA CLASE PRACTICA 3 COMPORTAMIENTOS DE LAS BACTERIAS ANTE AGENTES FÍSICOS Y QUÍMICOS A) Agentes físicos 1) Temperatura: El calor actúa desnaturalizando las proteínas y los ácidos nucleicos de la célula y fragmentando las membranas celulares. El tiempo requerido para la esterilización esta universalmente relacionado con la temperatura de exposición. Hay parámetros que pueden ser usados para indicar el grado de resistencia al calor que tienen los microorganismos: - El punto térmico letal es la temperatura más baja en la cual muere una población bacteriana en determinado tiempo. El tiempo térmico letal es el menor tiempo necesario para matar el 100% de una población de microorganismos a determinada temperatura bajo condiciones específicas del medio. Calor seco: - Calor directo: flameado de la llama del. - Incineración: se emplea para destruir cadáveres y materiales de desechos. Calor húmedo:- Con presión: el autoclave utilizado a 1.5 atmósferas de presión, a 121 ° C durante 15 a 30 min., con este método la mayoría de las formas vivientes mueren incluyendo sus esporas. - Sin presión: Ebullición alcanza una temperatura de 100 ° C, la cual destruye en unos 10 min. las formas vegetativas de la mayoría de las bacterias y muchos virus. Las esporas y ciertos virus, como el de la hepatitis humana o el de la AIE no son inactivados. - Tindalización: consiste en tres calentamientos de 60-80 °C durante 30 min., separado por dos incubaciones a 37 °C durante 24 Horas. Se emplea sobre elementos en los cuales la alta temperatura puede alterar sus propiedades, por ejemplo: hidratos de carbono o leche pasteurización. Las bajas temperaturas no son nocivas para los gérmenes si es que se aplican en forma lenta y gradual (1°C x min.), sirve incluso para conservar con vida a la bacteria. 2) Humedad y desecación: las bacterias responden de distintas maneras a la humedad, por ejemplo los estreptococos requieren de humedad, en cambio los bacilos tuberculosos prefieren medios secos. La desecación: el aire seco produce la muerte de la mayoría de las bacterias, por el contrario las esporas resisten por largos periodos incluso años. Ej. Bacillus antracis 3) Presión y vacío: la acción del vacío esta relacionada con el frío o la congelación a muy bajas temperaturas, (liofilización). El vacío por si solo ejerce muy poca o nula acción sobre los microbios. 4) Luz: La energía se trasmite a través del espacio por las radiaciones (una de sus formas). Dentro de estas se encuentran las electromagnéticas de alta energía o ionizantes: comprende los rayos alfa, beta, gama y roentgen (rayos X). Radiaciones no ionizantes: comprenden a las radiaciones ultravioletas (UV) e infrarrojas (IR) 5 Departamento de Microbiología FCV- UNA 5) Sonidos: La acción letal de los ultrasonidos se debe al fenómeno de cavitación (formación de burbujas de aire dentro del citoplasma) que lleva a la desintegración del microorganismo por ruptura de su pared, liberando los antigenos, enzimas, etc. 6) Electricidad: carecen de acción bacteriana, tanto la corriente de tipo continua como la alterna, sean de bajo, medio o alto voltaje. Solamente son letales cuando engendran calor por otros motivos. B) Agentes Químicos 1) Concentración salina, sales: Hay sales nocivas y también sales útiles y necesarias para el crecimiento bacteriano, la mayoría de las bacterias precisan del Cloruro de Na, para poder germinar. Las sales bactericidas son las que tienen metales pesados como las de Mercurio y Plata, que tienen eficacia germicida hasta en dosis de una parte por millón. 2) Ácidos y bases: el elevado poder bactericida de los ácidos y bases, esta relacionada con el grado de disociación de los mismos, la acción germicida de los ácidos inorgánicos, difiere algo una del otro, pero son mas eficaces que los ácidos orgánicos. En cuanto a los álcalis, el ión metálico tiene de por si acción intensa. Los ácidos y álcalis se usan en la limpieza y desinfección de vidriería del laboratorio. 3) Iones Metálicos: las sales de Hg y Ag desnaturalizan las proteínas en concentración altas pero son perjudiciales para los tejidos humanos. se emplean en concentraciones bajas, en estas condiciones actúan combinándose con los grupos sulfhídricos. El Hg se pude emplear con seguridad para uso externo 4) Detergentes y Compuestos cuaternarios: los detergentes actúan desorganizando la función normal de las células. Estos detergentes llamados también tensio-activos, actúan sobre la tensión superficial en los que se disuelven disminuyéndolas debido a que poseen un grupo hidrófilo y otro lipófilo. Según su carga eléctrica pueden ser: - Aniónicos (jabón natural, sales biliares) - Catiónicos, siendo estos derivados del amonio cuaternario y los que tienen poder bactericidas. 5) Halógenos: se encuentra el yodo, que se usa en solución alcohólicas al 10% (tintura de yodo) y combinado con detergente y sustancias orgánicas y el cloro empleado en forma de cloruro gaseoso bióxido hipoclorito y cloraminas. Para desinfección pueden usarse el agua oxigenada, permanganato de K, la tintura de yodo y la povidona yodada. 6) Alcoholes: el alcohol etílico es coagulante y deshidratante, su mayor poder bactericida lo tiene entre el 60 a 80 %. 7) Aldehídos: los dos aldehídos mas usados son el aldehido fórmico o formol y el aldehído glutárico o glutaraldehido, el formol con acción coagulante sobre las proteínas se presenta en solución acuosa al 40 % (formalina), al 10% se lo utiliza para el embalsamiento de cadáveres y en conservación a piezas histológicas (fijación). El glutaraldehido en solución al 2% es activo contra bacterias, esporas, virus y ciertos hongos, usándose para desinfección de equipo de endoscopia, guantes e instrumentos que no aguantan la esterilización por calor. 8) Fenoles y Cresoles: el fenol es de acción coagulante, muy bactericida en solución del 1-2 %, como derivados del fenol, se tienen el hexaclorofeno con menor toxicidad y mayor 6 Departamento de Microbiología FCV- UNA causticidad y los cresoles que son derivados metálicos y pueden usarse también en la desinfección de la piel. La clorhexidina por ser muy activa, poco toxica, de acción rápida en segundos y efectos residual prolongado es muy usada en cirugía para lavado de manos. Características del desinfectante 1 Poder germicida: el desinfectante debe poseer un elevado poder germicida, esto es debe “matar a las bacterias en soluciones muy diluidas”. 2 Estabilidad: para que un desinfectante sea relativamente útil debe ser relativamente “estable en presencia de materia orgánica”. Algunos de los desinfectantes más activos se combinan con la materia orgánica formando compuestos insolubles y precipitándose casi totalmente, por ello su actividad puede disminuir rápidamente hasta el punto de no ser letal para los microorganismos. 3 Homogeneidad: los desinfectantes deben ser de composición homogénea. Las sustancias que se compran pura o cristalizadas son ideales desde este punto de vista. 4 Solubilidad: El desinfectante ideal seria el que “se disolviera en todas las proporciones posibles en el agua”. Ej. Alcohol. 5 Atoxicidad para seres superiores: El desinfectante ideal no debe ser toxico para el hombre y animales superiores. La mayor parte de los desinfectantes eficaces son algo nocivo para los tejidos. 6 Falta de acción corrosiva: Teniendo en cuenta que los desinfectantes frecuentemente se ponen en contacto con metales, tejidos y otros productos es de desear que no los atasquen, tiñan ni dañen. 7 Penetración: Los desinfectantes difieren mucho en su poder de penetración en los productos a esterilizar. El desinfectante ideal debe penetrar rápida y eficazmente. 8 Economía: El desinfectante ideal debe ser barato, pero el precio no puede juzgarse por el volumen, sino por su efecto letal. Un desinfectante puede ser más caro que otro por unidad de volumen, pero puede tener el doble de poder germicida. 9 Poder de eliminación de suciedad y grasa: Una fina capa de aceite o grasa sobre la superficie a desinfectar puede anular totalmente la acción de ciertos desinfectantes. Naturalmente las que son capaces de eliminar la suciedad y las grasas de todas clases son mucho más eficaces. 10 Poder desodorante: El desodorante capas de combinarse y destruir las sustancias malolientes, es preferible a otro que no tiene estas propiedades con tal que no tenga olor desagradable. CLASE PRÁCTICA 4 MEDIOS DE CULTIVO Se entiende por medio de cultivo a una sustancia o conjunto de sustancias que reúnan las condiciones que permitan la multiplicación in vitro de las bacterias que allí se siembran. 7 Departamento de Microbiología FCV- UNA Los microorganismos en crecimiento se multiplican, y por lo tanto requieren nutrientes. Entre las finalidades de un medio de cultivo se incluyen: 1) el aislamiento de microorganismos en colonias puras, 2) el estudio de características culturales, 3) el estudio de actividades metabólicas, 4) la preparación de vacunas y antígenos, 5) la conservación de cepas bacterianas en colección, 6) la obtención de grandes masas microbianas para estudios físicos y químicos, 7) la obtención de bacterias con fines industriales (preparación de productos lácteos, vitivinícolas, antibióticos, enzimáticos y ensilajes). CLASIFICACIÓN DE LOS MEDIOS DE CULTIVO A) Según su estado físico (consistencia) 1) Medios líquidos: Son los que se presentan en este estado, denominándose por esta razón caldos. Se utiliza fundamentalmente cuando se pretende la obtención de una suspensión bacteriana de una determinada concentración. 2) Medios sólidos: Se preparan a partir de los medios líquidos, agregándoles un agente gelificante (agar). Contienen de 1.5 a 2% de agar en su formulación. Estos medios inmovilizan a las células, permitiéndoles crecer y formar masas aisladas visibles llamadas colonias. 3) Medios semisólidos: Se preparan a partir de los medios líquidos, agregando a éstos un agente solidificante en una proporción menor que para preparar medios sólidos. Uno de sus usos es la investigación de la movilidad de las bacterias B) Según su utilización 1) Medios comunes: Son aquellos que poseen los componentes mínimos para que pueda producirse el crecimiento de bacterias que no necesiten requerimientos especiales. El medio más conocido de este grupo es el agar nutritivo o agar común y otros el agar tripticasa de soja, el agar Columbia, etc. 2) Medios de enriquecimiento: Son aquellos que, además de las sustancias nutritivas normales, incorporan una serie de factores indispensables para el crecimiento de microorganismos exigentes. Este enriquecimiento se hace por adición de sangre u otros productos biológicos (sangre, suero, leche, huevo, bilis, etc.) que aportan dichos factores o es posible añadir suplementos artificiales. 3) Medios selectivos: El fundamento de estos medios consiste en facilitar nutricionalmente el crecimiento de una población microbiana específica. 8 Departamento de Microbiología FCV- UNA 4) Medios inhibidores: Los medios inhibidores se consiguen habitualmente por adición de sustancias antimicrobianas o de cualquier otra que inhiba completamente el desarrollo de una población determinada. Un ejemplo de medio inhibidor es el MacConkey que permite el crecimiento de las bacterias Gram negativas e impide el crecimiento de las Gram positivas. 5) Medios diferenciales: Se utilizan para poner en evidencia características bioquímicas que ayuden a diferenciar géneros o especies de bacterias. Ej. El medio MacConkey es un medio diferencial porque permite distinguir las bacterias que fermentan la lactosa de aquellos que no lo hacen. 9) Medios de transporte: Se usan para el transporte de muestras clínicas que no pueden sembrarse inmediatamente. Su utilización debe hacerse introduciendo la torunda con la que se obtuvo la muestra en el interior del medio (generalmente en un tubo). Ejemplo típico de este grupo es el Medio de Stuart. 1. Medios comunes 2. Enriquecimiento 3. Selectivos 5. Diferenciales PREPARACION DE LOS MEDIOS DE CULTIVO Materiales: - Mechero - 1 agitador - 1 erlenmeyer de 500 mL - 1 balanza - 1 espátula - 1 probeta de 250 mL - 10 cajas placas de Petri estériles desechables - Papel aluminio - Pincel - Trapo - Reactivos para el medio de cultivo Equipo - Autoclave Procedimiento: 1. Pesar los reactivos necesarios para preparar 250 mL de medio. Colocarlos en el matraz. 2. Con la probeta, medir 250 mL de agua destilada y añadirla al erlenmeyer con el polvo. 3. Tapar el erlenmeyer con pedazo de aluminio y colocarlo sobre el agitador. 4. Cuando la solución esté homogénea, retirarla del agitador. 9 Departamento de Microbiología FCV- UNA 5. El autoclave estará prendido previamente por la profesora. Con su ayuda, introducir el erlenmeyer en el interior de la autoclave. Cerrarla siguiendo las indicaciones de la Profesora. 6. Una vez que empiece a salir vapor, cerrar la válvula del autoclave, para que la presión comience a subir. Tiene que llegar hasta 121ºC durante 15 minutos. 7. Transcurridos los 15 minutos, desconectar el autoclave. Comenzar a abrir la válvula para liberar el vapor y que la presión comience a bajar. El autoclave puede abrirse únicamente cuando el manómetro marque cero. ¡Antes NO, ya que podría explotar! 8. El autoclave se abre desde atrás, procurando que nadie quede de frente hacia donde se abre la tapa, ya que saldrá mucho vapor caliente que causa quemaduras. Una vez que se abrió con cuidado, con ayuda del guante de asbesto, sacar el erlenmeyer. 9. Verter el medio en las placas de Petri estériles siguiendo la técnica aséptica. Las placas no pueden ser destapadas a menos que sea entre los mecheros o dentro de la campana de flujo laminar. Las tapas no se tocan por dentro con los dedos, ni se sacan del área de esterilidad. 10. Permitir que el medio solidifique a medio ambiente por unos minutos y una vez solido el medio de cultivo, las placas se cierran adecuadamente y se etiquetan indicando el medio, equipo, grupo y fecha de elaboración. Guardar en el refrigerador para utilizar en la siguiente práctica. CLASE PRACTICA 5 1. TOMA DE MUESTRA Para la recolección de muestra, tener en cuenta que debe ser: Representativa Cantidad de volumen adecuado Esterilidad Animal sin previo tratamiento con antibiótico, si existe tratamiento esperar 48 hs para la colecta de muestras. Datos de los animales: Especie, edad, sexo, localidad, vacunas, numero de animales afectados, síntomas, enfermedad aguda o crónica, tratamiento, diagnostico presuntivo. 2. TIPOS DE MUESTRA Otocultivo: Hisopado ótico en medio de transporte Stuart o en frasco estéril, con hisopo estéril. Urocultivo: chorro medio, sondeo vesical, punción vesical. Piel: punción-aspirado, hisopado Coprocultivo: heces, hisopado rectal, en envases estériles. Organos: representativos de las lesiones, tomados en forma estéril durante la necropsia en placas estériles. Fluidos: Leche, liq. Pericardico, etc… 3. OBSERVACION EN FRESCO DE LA MUESTRA Sin coloración: Sin la utilización de colorantes de contraste, se observa la muestra (con o sin liquido de montar) al microscopio 10 Departamento de Microbiología FCV- UNA Con coloración: acorde al diagnóstico presuntivo. Tinción Gram o coloración de Gram es un tipo de tinción diferencial empleado en microbiología para la visualización de bacterias, sobre todo en muestras clínicas. Se utiliza tanto para poder referirse a la morfología celular bacteriana como para poder realizar una primera aproximación a la diferenciación bacteriana, considerándose Bacteria Gram positiva a las bacterias que se visualizan de color moradas y Bacteria Gram negativa a las que se visualizan de color rosa o rojo. Recoger muestra estéril - Hacer un extendido sobre un portaobjeto con formas de espiral - Dejar secar a temperatura ambiente - Fijar la muestra al calor (flameando el portaobjetos 3 veces aprox.) - Una vez realizado el frotis se procederá a realizar la coloración de Gram - Agregar cristal violeta sobre el extendido y esperar 1 minuto. Este tinte dejará de color morado las bacterias Gram positivas. - Enjuagar con agua corriente. - Agregar lugol y esperar 1 minuto. - Enjuagar con agua corriente. - Agregar alcohol y/o acetona por goteo y esperar 15 segundos. - Enjuagar con agua hasta escurrir todo el excedente de colorante. - Agregar safranina y esperar 30 segundos. Este tinte dejará de color rosado las bacterias Gram negativas. - Enjuagar con agua. Chorro suave ya sea con pipeta o directo de la llave. Permitir secar la lamina. Para observar al microscopio óptico es conveniente hacerlo a 100x con aceite de inmersión (para bacterias) - Obs: los tiempos dependen de cada marca comercial. Frotis teñido con la coloración de Gram para su posterior identificación. 4. CULTIVO En microbiología, un cultivo es un método utilizado para la multiplicación de microorganismos, tales como bacterias y hongos, en el que se prepara un medio óptimo para favorecer el proceso deseado. Un cultivo es empleado como un método fundamental para el estudio de las bacterias y otros microorganismos que causan enfermedades en medicina humana y veterinaria. Un microorganismo se puede sembrar en la superficie de un medio sólido de agar. Los medios de cultivo contienen distintos nutrientes que van desde azúcares simples hasta sustancias complejas como la sangre o el extracto de caldo de carne. Para aislar o purificar una especie bacteriana a partir de una muestra que contiene muchos tipos de bacterias, se siembra en un medio de cultivo sólido donde las células que se multiplican no cambian de localización quedando atrapadas en el agar; tras muchos ciclos reproductivos, 11 Departamento de Microbiología FCV- UNA cada bacteria individual genera por escisión binaria una colonia macroscópica compuesta por decenas de millones de células bacterianas similares a la original. Como realizar un cultivo: - - - - Cerca del mechero se descarga la muestra en la placa de petri con el medio de cultivo seleccionado. Se esteriliza el ansa por medio de calor directo en el mechero de bunsen, enfriando en el agar el ansa se pasa a realizar las estrías por agotamiento, que son líneas en zigzag que tienen como finalidad ir de la mayor concentración a la menor de carga bacteriana obteniendo así colonias aisladas. Las formas de las estrías y su distribución se pueden realizar de distintas maneras el objetivo es desconcentrar la cantidad de bacterias para poder trabajar con colonias de bacterias puras. Se pueden trazar imaginariamente cuadrantes, donde en el primer cuadrante se realizan las mayor cantidad de estrías una debajo de la otra, en el segundo cuadrante las estrías se separaran más y serán en menor cantidad, en el cuarto aumentar más la distancia entre estrías y finalmente en el último cuadrante el ansa se debe esterilizar con el mechero de bunsen, enfriar nuevamente en el agar y realizar las ultimas estrías esto para reducir la carga a cero y así obtener colonias aisladas, esterilizar el ansa y cerrar la placa. Una vez realizado el cultivo la muestra será incubada en la estufa generalmente a 37°C dependiendo del tipo de microorganismo a ser aislado y se dejarán por 24-48 horas. Se revisarán al termino de las horas correspondientes para evaluar el desarrollo de las colonias bacterianas y describir su desarrollo en dicho medio de cultivo. 12 Departamento de Microbiología FCV- UNA CLASE PRÁCTICA 6 PRUEBAS CONFIRMATORIAS Observación en fresco Cultivo - Directo - Coloración - Origen de la muestra - Posibles agentes etiológicos - Características nutricionales de los microorganismos. Pruebas bioquímicas Sensibilidad - Antibiograma IDENTIFICACION SEGÚN TINCIÓN DE GRAM 13 Departamento de Microbiología FCV- UNA Enfermedades provocadas por Estafilococos - Puede causar infecciones en el tracto urinario, pueden causar infecciones de la piel como foliculitis, furúnculos, impétigo, y celulitis que están limitadas a una pequeña área de la piel, también puede segregar sustancias tóxicas que pueden conllevar a enfermedades como una intoxicación alimenticia o el Síndrome de Shock Tóxico. Enfermedades provocadas por Estreptococos El estreptococo del grupo A causa: Infección en la garganta: garganta adolorida, enrojecimiento, a veces con plaquetas blancas en las amígdalas Escarlatina: erupción color rojo en el cuerpo Impétigo: infección en la piel Síndrome del shock tóxico Celulitis y fascitis necrotizante (enfermedad necrotizante) Los estreptococos del grupo B pueden causar infecciones sanguíneas, neumonía y meningitis en los recién nacidos 14 Departamento de Microbiología FCV- UNA Enfermedades producidas por bacilos grampositivos formadores de esporas: Los bacilos grampositivos formadores de esporas son las especies de los géneros Bacillus y Clostridium. Estos bacilos son cosmopolitas y debido a que forman esporas, pueden sobrevivir en el ambiente por muchos años. El género Bacillus es aerobio, en tanto que los clostridios son anaerobios obligados. De las numerosas especies de ambos géneros, Bacillus y Clostridium, que causan enfermedades importantes en el hombre. El ántrax sigue siendo una enfermedad importante de los animales. y en ocasiones del hombre. Bacillus cereus causa envenenamiento por alimentos y a veces infecciones oculares y otras localizadas. Los clostridios causan varias enfermedades graves mediadas por toxinas: Clostridium tetani, tétanos; Clostridium bofulinum, botulismo; Clostridium perfringens, gangrena gaseosa; y Clostridium difficile, colitis seudomembranosa. Enfermedades producidas por bacilos gram positivos no formadores de esporas: - Corynebacterium: Causa difteria y otras especies acompañan a infecciones oportunistas. Listeria monocytogenes: (listeriosis) causa meningitis, septicemia en recién nacidos y en adultos inmunodeprimidos 15 Departamento de Microbiología FCV- UNA Pruebas Bioquímicas Las pruebas bioquímicas consisten en distintos test químicos aplicados a medios biológicos, los cuales, conocida su reacción, nos permiten identificar distintos microorganismos presentes. Su sistema de funcionamiento generalmente consiste en determinar la actividad de una vía metabólica a partir de un sustrato que se incorpora en un medio de cultivo y que la bacteria al crecer incorpora o no. Para realizar las pruebas bioquímicas se dispone de multiples medios, los cuales se deben aplicar de acuerdo a las exigencias del microorganismo en estudio. Algunas pruebas bioquímicas de interés pueden ser: - Triple azúcar de Hierro (TSI): Fermentación de glucosa y lactosa SIM: Producción de Indol, Movimiento y acido sulfhídrico Caldo de rojo metilo/ Voges Proskauer (RM/VP): Producción Acetilmetilcarbinol Urea: Producción de ureasa Citrato de Simmons: Utilización de Citrato de Sodio LIA: Lisina descarboxilasa SIM: Movilidad Fermentación de Hidratos de Carbono de TSI (Triple azúcar de hierro) 1. Si la bacteria problema fermenta la glucosa, acidificará el medio haciendo virar a amarillo el indicador en el fondo del tubo, mientras que si no es fermentadora de glucosa, el medio permanecerá de color rojo. 2. Si la bacteria problema fermenta lactosa y/o sacarosa, acidificará el medio en su superficie volviéndolo de color amarillo, mientras que si no lo es, la superficie del medio continuará de color rojo. 3. Si produce ácido sulfhídrico (debido a la reducción de las sales de hierro), se presentará un ennegrecimiento del tubo. La producción de sulfhídrico y el consiguiente ennegrecimiento pueden impedir ver la fermentación de la glucosa (fondo amarillo), pero este hecho implica directamente que la bacteria es fermentadora de glucosa. 4. Si aparece rotura o desplazamiento del medio, significa que la bacteria es productora de gas. 16 Departamento de Microbiología FCV- UNA LIA (Lisina Descarboxilasa) 1) Lisina descarboxilasa (LIA) positiva 2) Lisina descarboxilosa (LIA) positiva productora de acido sulfhidrico 3) Lisina descarboxilasa (LIA) negativa CITRATO 1) Citrato de Simmons positivo 2) Citrato de Simmons negativo SIM 1) Indol positivo 2) Indol negativo 3) Movimiento negativo/Movimiento positivo UREA 1) Urea de Christensen negativo 2) Urea de Christensen positivo 17 Departamento de Microbiología FCV- UNA ROJO METILO/VOGES PROSKAUER 1) Rojo metilo positivo/Rojo metilo negativo 2) Voges proskauer negativo /Voges proskauer positivo FERMENTACION DE HIDRATOS DE CARBONO 1) La fermentación se puede observar mediante el cambio de color del medio de amarillo a rojo o fucsia para indicar positiva la fermentación, por medio del viraje del pH. Enfermedades ocasionadas por oxidasa negativa (Enterobacterias): La mayoría de las especies son oportunistas, pero algunas son altas y específicamente patógenas y causan enfermedad entérica, urinaria o sistémica. Las enterobacterias pueden vivir libres en la naturaleza y habitualmente forman parte de la FLORA NORMAL DEL COLON HUMANO. Pueden encontrarse transitoriamente en la piel (especialmente perianal), el tracto genital femenino y, muy ocasionalmente, el tracto respiratorio superior de los individuos sanos. Las enterobacterias aparecen en una mayor proporción en la flora de individuos hospitalizados, especialmente en aquellos que sufren enfermedades graves y debilitantes. Escherichia coli es la especie más comúnmente encontrada en la flora normal, seguida en orden de importancia por Klebsiella, Proteus y Enterobacter. Los géneros Salmonella, Shigella y Yersinia son patógenos primarios para el hombre y no forman parte de la flora normal. Ciertos serotipos de E.coli son patógenos primarios. RECORDAR: las enterobacterias forman parte del 80 % de infecciones por GRAM (-) y además constituyen el 50 % de los aislamientos clínicos relevantes Enfermedades producidas por oxidasa positiva - Brucelosis: La brucelosis está causada por varias especies de Brucella que infectan a animales: cerdos y ganado vacuno. Después de varios días o semanas (período de incubación) comienzan a manifestarse el síntoma principal es el aborto, fiebre, dolor de articulaciones. - Enfermedad causada por pseudomonas: Pseudomonas aeruginosa, habitante permanente del suelo y agua dulce, causa varias enfermedades que pueden ser difíciles de tratar porque esta bacteria es notablemente resistente a la mayoría de los antibióticos, infecciones del tracto urinario, la mayoría de las infecciones de oído, infecciones sobre quemaduras extensivas y pneumonías en pacientes con fibrosis quísticas. 18 Departamento de Microbiología FCV- UNA - Enfermedades causadas por Bordetella y Haemophillus: La tos ferina, está causada por Bordetella pertussis, un aeróbio que se adquiere de otras personas y que se desarrolla en la garganta. Después de un período de incubación de 7 a 16 días comienzan los síntomas, parecidos a un resfrío, luego durante los próximos 7 a 14 días se desarrolla una tos rápida e intensa ininterrumpida. Haemophillus influenzae habitante común de la garganta en personas sanas es un anaeróbio facultativo. Esta bacteria crece en la garganta y laringe produciendo una severa epiglotitis que puede provocar ahogos. CLASE PRACTICA 5 ANTIBIOGRAMA – SENSIBILIDAD A ANTIBIOTICOS Como actuán los antibióticos? 19 Departamento de Microbiología FCV- UNA Método de Difusión en Agar La sensibilidad bacteriana a los antimicrobianos in vitro se puede determinar por varios métodos la difusión en agar se utiliza de rutina en laboratorios clínicos en bacterias. Están indicadas en los casos en que la bacteria infectante sea capaz de mostrar resistencia a los antibióticos usados habitualmente para tratamiento. Las pruebas se deben realizar sobre cada uno de los microorganismos con probable rol patógeno aislados en una muestra clínica. Categorías de interpretación 1. Sensible (S) Esta categoría implica que una infección dada por la cepa en estudio puede ser tratada apropiadamente con la dosis de antibiótico recomendada para el tipo de infección y la especie infectante. 2. Intermedio (I) Incluye cepas que a un determinado antibiótico puede ser alcanzada en sangre y tejidos. Esta categoría sugiere que puede alcanzarse éxito clínico aumentando la concentración del antimicrobiano en el sitio de la infección, siempre que las dosis usadas puedan ser incrementadas. 3. Resistente (R) Las cepas resistentes no son inhibidas por las concentraciones séricas normalmente alcanzadas a dosis habituales y/o caen en el rango donde son comunes mecanismos específicos de resistencia microbiana. Reactivos para la Prueba de difusión por disco. - Medio Agar Müeller Hinton - Discos de antibióticos - Agua destilada - Ansa bacteriológica - Tubos - Hisopos estériles - Placas de petri - Mezclador (Mixer) Procedimiento para la realización del test de difusión por disco para sensibilidad Preparación del inoculo - Para preparar el inoculo, seleccionar 3 a 5 colonias de igual morfología de la placa de cultivo. - Preparar una suspensión en 4 a 5 ml con agua destilada y las colonias seleccionadas. - Mezclar hasta alcanzar la turbidez del estándar 0,5 de la escala de Mc Farland. Inoculación de las placas 20 Departamento de Microbiología FCV- UNA - - Después de ajustado el inoculo sembrar a las placas de Müeller Hinton por medio de un hisopo estéril. Presionar el hisopo por las paredes del tubo por encima del nivel del liquido a fin de escurrir el exceso de inoculo. Inocular por hisopado en tres direcciones rotando la placa 60° cada vez para asegurar una completa distribución del inoculo. Como paso final se debe hisopar la circunferencia de la placa. De esta manera se deberían obtener zonas de inhibición uniformemente circulares y desarrollo homogéneo. Aplicación de los discos - Colocar los discos sobre la superficie del agar inoculado con pinza estéril, aplicando una ligera presión a una distancia no menor de 24 mm desde un centro al otro. Debido a que algunas drogas difunden casi instantáneamente, un disco no debe ser reubicado una vez que tomo contacto con el agar. - Incubar las placas a 35° por 24 horas. Lectura de las placas e interpretación de resultados - Después de 24 horas de incubación examinar cada placa y medir los diámetros de las zonas de inhibición, se mide con regla o calibre, sosteniendo la placa sobre un fondo oscuro e iluminada con luz refleja. - Los tamaños de la zona de inhibición serán interpretados en las tablas correspondientes y los organismos se informarán: sensibles, intermedios o resistentes frente al antimicrobiano ensayado. Preparacion del inoculo Inoculación de las placas Aplicación de los discos 21 Departamento de Microbiología FCV- UNA Lectura de las placas e interpretación de los resultados CLASE PRÁCTICA N° 8 DETERMINACIÓN DE HONGOS Observación en directo - - Identificar la muestra de acuerdo al número designado por el libro de recepción de muestras. Preparar la mesa de trabajo con los materiales necesarios, portaobjetos, cubre objetos, hidróxido de potasio 40% como medio de montar, pinzas, placa de petri estéril, papel desechable, ansa, etc. Colocar sobre la placa estéril o papel desechable, el portaobjetos de modo a trabajar asépticamente. Colocar la muestra en el portaobjetos tratando de tomar representativamente siendo ideal, pelos afectados, piel de la zona afectada, etc. Con pipeta Pasteur embeber con hidróxido de potasio al 40%, la muestra, mediante goteo. Colocar el cubreobjetos Llevar al microscopio donde se observará con el menor de los aumentos, para ir aumentando gradualmente para enfocar correctamente. Recorrer todo el campo buscando lentamente observar alguna morfología correspondiente a hongos o levaduras y evaluando los pelos. Cultivo de muestra - - Identificar la muestra de acuerdo al número designado por el libro de recepción de muestras. Preparar la mesa de trabajo con los materiales necesarios, placa de petri con medio de cultivo para hongos (Sabouraud) seca, ansa, mechero, alcohol, papel desechable, etc. Si se trata de hisopado otico se debe descargar el hisopo varias veces en el primer cuadrante. Luego estriar con el ansa estéril. Si fuesen muestras de raspados, descargarlas en el centro del medio de cultivo. Incubar a 22°C o 37°C por 24 a 48 horas. Para interpretar los resultados del crecimiento de las colonias se deben evaluar en placa las características de las mismas leyendo colores y características del reverso y del anverso. De esta manera se pueden clasificar en hongos y levaduras los cuales deberán ser observados al microscopio. 22 Departamento de Microbiología FCV- UNA - - - Al portaobjetos se le adicionará una gota de liquido de montar, como el azul de lactofenol si es que los hongos son despigmentados, si son pigmentados (negros) con líquido de montar de Patterson que no posee colorantes. Se tomarán las colonias crecidas en las placas con ansa en gancho estéril, se picará una buena porción de colonia que se colocará en el portaobjetos con el liquido de montar y cubrirá con el cubreobjetos. Llevar al microscopio donde se observará con el menor de los aumentos, para ir aumentando gradualmente para enfocar correctamente. Recorrer todo el campo buscando lentamente observar alguna morfología correspondiente a hongos o levaduras y así identificarlas Observación Para la identificación de hongos se deben considerar tanto la observación en directo como la obtenida luego del crecimiento en medios de cultivo ya que se deben verificar la patogenicidad o no de algunos ambientales mediante criterios microbiológicos. Identificación al microscopio GéneroAspergillus. Hifomicetos. Aspergillus flavus Género Epidermophyton Teleomorfos Epidermophyton floccosum 23 Departamento de Microbiología FCV- UNA Género Microsporum Microsporum canis Género Trichophyton Trichophyton mentagrophites 24








