Quiste pancreático en una mujer de 60 años
Anuncio
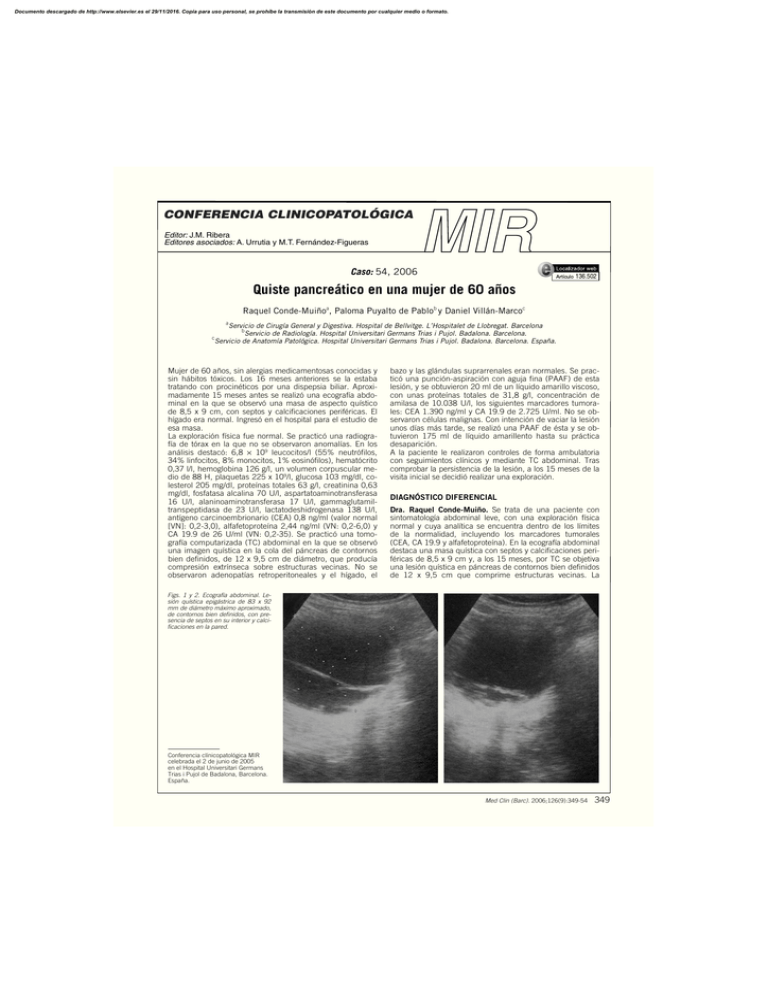
Documento descargado de http://www.elsevier.es el 29/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CONFERENCIA CLINICOPATOLÓGICA Editor: J.M. Ribera Editores asociados: A. Urrutia y M.T. Fernández-Figueras Caso: 54, 2006 136.502 Quiste pancreático en una mujer de 60 años Raquel Conde-Muiñoa, Paloma Puyalto de Pablob y Daniel Villán-Marcoc a Servicio de Cirugía General y Digestiva. Hospital de Bellvitge. L’Hospitalet de Llobregat. Barcelona b Servicio de Radiología. Hospital Universitari Germans Trias i Pujol. Badalona. Barcelona. Servicio de Anatomía Patológica. Hospital Universitari Germans Trias i Pujol. Badalona. Barcelona. España. c Mujer de 60 años, sin alergias medicamentosas conocidas y sin hábitos tóxicos. Los 16 meses anteriores se la estaba tratando con procinéticos por una dispepsia biliar. Aproximadamente 15 meses antes se realizó una ecografía abdominal en la que se observó una masa de aspecto quístico de 8,5 x 9 cm, con septos y calcificaciones periféricas. El hígado era normal. Ingresó en el hospital para el estudio de esa masa. La exploración física fue normal. Se practicó una radiografía de tórax en la que no se observaron anomalías. En los análisis destacó: 6,8 × 109 leucocitos/l (55% neutrófilos, 34% linfocitos, 8% monocitos, 1% eosinófilos), hematócrito 0,37 l/l, hemoglobina 126 g/l, un volumen corpuscular medio de 88 H, plaquetas 225 x 109/l, glucosa 103 mg/dl, colesterol 205 mg/dl, proteínas totales 63 g/l, creatinina 0,63 mg/dl, fosfatasa alcalina 70 U/l, aspartatoaminotransferasa 16 U/l, alaninoaminotransferasa 17 U/l, gammaglutamiltranspeptidasa de 23 U/l, lactatodeshidrogenasa 138 U/l, antígeno carcinoembrionario (CEA) 0,8 ng/ml (valor normal [VN]: 0,2-3,0), alfafetoproteína 2,44 ng/ml (VN: 0,2-6,0) y CA 19.9 de 26 U/ml (VN: 0,2-35). Se practicó una tomografía computarizada (TC) abdominal en la que se observó una imagen quística en la cola del páncreas de contornos bien definidos, de 12 x 9,5 cm de diámetro, que producía compresión extrínseca sobre estructuras vecinas. No se observaron adenopatías retroperitoneales y el hígado, el bazo y las glándulas suprarrenales eran normales. Se practicó una punción-aspiración con aguja fina (PAAF) de esta lesión, y se obtuvieron 20 ml de un líquido amarillo viscoso, con unas proteínas totales de 31,8 g/l, concentración de amilasa de 10.038 U/l, los siguientes marcadores tumorales: CEA 1.390 ng/ml y CA 19.9 de 2.725 U/ml. No se observaron células malignas. Con intención de vaciar la lesión unos días más tarde, se realizó una PAAF de ésta y se obtuvieron 175 ml de líquido amarillento hasta su práctica desaparición. A la paciente le realizaron controles de forma ambulatoria con seguimientos clínicos y mediante TC abdominal. Tras comprobar la persistencia de la lesión, a los 15 meses de la visita inicial se decidió realizar una exploración. DIAGNÓSTICO DIFERENCIAL Dra. Raquel Conde-Muiño. Se trata de una paciente con sintomatología abdominal leve, con una exploración física normal y cuya analítica se encuentra dentro de los límites de la normalidad, incluyendo los marcadores tumorales (CEA, CA 19.9 y alfafetoproteína). En la ecografía abdominal destaca una masa quística con septos y calcificaciones periféricas de 8,5 x 9 cm y, a los 15 meses, por TC se objetiva una lesión quística en páncreas de contornos bien definidos de 12 x 9,5 cm que comprime estructuras vecinas. La Figs. 1 y 2. Ecografía abdominal. Lesión quística epigástrica de 83 x 92 mm de diámetro máximo aproximado, de contornos bien definidos, con presencia de septos en su interior y calcificaciones en la pared. Conferencia clínicopatológica MIR celebrada el 2 de junio de 2005 en el Hospital Universitari Germans Trias i Pujol de Badalona, Barcelona. España. Med Clin (Barc). 2006;126(9):349-54 349 Documento descargado de http://www.elsevier.es el 29/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CONDE-MUIÑO R ET AL. QUISTE PANCREÁTICO EN UNA MUJER DE 60 AÑOS Figs. 3 y 4. Tomografía computarizada abdominal antes y tras la administración de contraste por vía intravenosa, a los 70 s. En la cola pancreática, se aprecia una lesión de bajo coeficiente de atenuación, bien delimitada, con una pared fina y regular que presenta un débil realce tras la administración de contraste por vía intravenosa. La lesión produce efecto masa sobre los órganos vecinos, a los que desplaza sin invadirlos. PAAF demuestra un líquido viscoso (mucinoso), con valores muy elevados de amilasa, CEA y CA 19.9, sin células malignas. Antes de proseguir me gustaría que la radióloga comentara los hallazgos de las pruebas de imagen. Dra. Paloma Puyalto de Pablo. En la ecografía abdominal (figs. 1 y 2) se observa una lesión quística epigástrica de 83 x 92 mm de diámetro máximo aproximado, de contornos bien definidos, con presencia de septos en su interior y calcificaciones en su pared1. En la TC abdominal (figs. 3 y 4), sin contraste intravenoso y con él, en la cola pancreática se observa una lesión de bajo coeficiente de atenuación, bien delimitada, con una pared fina y regular que presenta un débil realce tras la administración de contraste. La lesión produce efecto de masa sobre los órganos vecinos, a los que desplaza sin invadirlos. En la TC abdominal con contraste por vía intravenosa practicada a los 4 meses del vaciado (fig. 5), se observa la reaparición de la lesión, de características similares a la inicial. Dra. R. Conde-Muiño. Hay que tener en cuenta que, en el diagnóstico diferencial de las lesiones quísticas del páncreas, el 90% son seudoquistes pancreáticos. El 10% restante corresponde a las neoplasias quísticas del páncreas, que Fig. 5. Tomografía computarizada abdominal con contraste por vía intravenosa a los 70 s. Reaparición de la lesión, de características similares a la lesión inicial, a los 4 meses del vaciamiento. 350 Med Clin (Barc). 2006;126(9):349-54 fueron descritas por primera vez por Compagno y Oertel2 en 1978. En 1980 y 1982, Ohashi et al3 describieron la neoplasia mucinosa papilar intraductal. Desde entonces se han publicado numerosas series en todo el mundo, pudiéndose diferenciar claramente de otras entidades. Se ha podido demostrar recientemente que no es un proceso nuevo, sino que ya existía previamente, pero no era reconocido4. De todas las neoplasias pancreáticas, sólo el 1% son tumores quísticos. La nomenclatura de los tumores quísticos del páncreas se ha ido modificando con el tiempo. Según la clasificación propuesta por la Organización Mundial de la Salud (OMS)5, se incluyen de mayor a menor frecuencia la neoplasia quística serosa (también denominada cistadenoma seroso), el tumor quístico mucinoso (antes llamado cistadenoma o cistadenocarcinoma mucinoso, según sea benigno o maligno) y la neoplasia papilar mucinosa intraductal. Hay otros tumores quísticos de muy baja frecuencia (menos del 5% de todos los tumores quísticos del páncreas), como son la neoplasia quística papilar, el tumor quístico de los islotes pancreáticos y los linfangiomas quísticos del páncreas. En primer lugar evaluaré la posibilidad de que se trate de un seudoquiste pancreático. A favor está el hecho de que es un quiste único, con un contenido rico en amilasas. También puede tener valores elevados de CA 19.9, pero el CEA suele ser bajo. Sin embargo, los seudoquistes no tienen septos ni calcificaciones en la pared. En contra está también el hecho de que el páncreas no tiene signos inflamatorios de pancreatitis aguda o crónica, y la paciente tampoco relata una historia compatible con pancreatitis. Por todo esto, el diagnóstico de seudoquiste parece poco probable. La neoplasia quística serosa, también llamada cistadenoma seroso, es un tumor quístico casi siempre benigno y se asocia a la enfermedad de Von Hippel-Lindau. Se han dado casos de malignidad, pero es altamente infrecuente (hay menos de 10 casos descritos en la bibliografía)6. Predominan en mujeres en torno a los 65 años y se localizan en la cola y el cuerpo del páncreas, lo que concuerda con lo observado en esta paciente. Por lo general, adoptan una morfología con múltiples quistes pequeños (< 2 cm) en panal de abeja (ocasionalmente microquísticos) y es muy típica la cicatriz central calcificada (patognomónica cuando se encuentra)7. La forma poliquística se da en el 70% de los casos. El 20% tiene un patrón en panal de abeja y tan sólo en el 10% de los Documento descargado de http://www.elsevier.es el 29/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CONDE-MUIÑO R ET AL. QUISTE PANCREÁTICO EN UNA MUJER DE 60 AÑOS casos son macroquísticos. En esta paciente se debe plantear el diagnóstico diferencial con la forma macroquística, ya que se pueden descartar las otras dos presentaciones mediante técnicas de imagen. En este caso es de utilidad el estudio del líquido obtenido por PAAF, puesto que los cistadenomas serosos suelen tener valores bajos de CEA y amilasa, así como baja viscosidad, lo que descarta también esta entidad. La neoplasia mucinosa quística se presenta en más del 80% de los casos en mujeres, e incluso algunos grupos sugieren que sólo ocurre en mujeres8, en torno a los 60 años. Suelen ser tumores voluminosos, localizados en el cuerpo y la cola del páncreas. En cuanto a la morfología, son macroquísticos en el 80% de los casos, el 20% restante son multiloculados o cuentan con varios quistes adyacentes. Una característica muy importante es que no comunican con el conducto pancreático principal y están recubiertos de un epitelio cúbico. En las pruebas de imagen es característico que presenten una cápsula que los englobe, con excrecencias internas en forma de septos. Las calcificaciones no son frecuentes (< 20%), pero cuando las hay suelen localizarse en la periferia de las paredes del quiste7. En esta paciente, los hallazgos de la ecografía y de la TC abdominal podrían corresponder a una neoplasia mucinosa quística. En estos tumores el contenido del quiste es viscoso y tiene concentraciones elevadas de CEA, pero habitualmente las de amilasa son bajas. La concentración de CA 19.9 es variable9. En contra de este diagnóstico estaría la concentración elevada de amilasa, que sería más típica de quistes que se encuentran en contacto con el conducto pancreático principal, como la neoplasia mucinosa papilar intraductal o los seudoquistes. La neoplasia mucinosa papilar intraductal se presenta sobre todo en varones a una edad de 65 años. El 60-75% se localiza en la cabeza, el 14-25% en la cola y un 15-25% es difuso y afecta a toda la glándula pancreática10-12. Se caracterizan por una dilatación que puede afectar al conducto pancreático principal o a una rama secundaria que se comunica con la lesión quística y produce abundante secreción de mucina (es patognomónico objetivar la secreción de mucina a través de la ampolla de Vater durante una endoscopia). El contenido del quiste suele tener concentraciones elevadas de CEA y amilasa y variables de CA 19.9. En esta paciente, el contenido del quiste es muy sugestivo de corresponder a un tumor mucinoso papilar intraductal. En contra estarían las pruebas de imagen que no informan de dilatación del conducto pancreático principal, así como la presencia de septos y calcificaciones. La neoplasia quística papilar o tumor seudopapilar supone menos del 5% de las neoplasias quísticas. Afecta sobre todo a mujeres muy jóvenes (el 50% son menores de 18 años) y suelen ser tumores muy voluminosos con una zona central quística por degeneración, con una gruesa cápsula fibrosa; puede tener calcificaciones. Las concentraciones de amilasa en el quiste son bajas. Dada la edad de la paciente es poco probable este diagnóstico. El tumor quístico de los islotes pancreáticos se presenta con igual frecuencia en varones y mujeres, en torno a los 50-60 años, y el 25% presenta síndrome funcional. En la TC se suele observar como tumores sólido-quísticos con necrosis y hemorragia, que no se corresponde con las imágenes de esta paciente, por lo que podemos descartar este diagnóstico. Por último, cabe citar los linfangiomas quísticos del páncreas, muy raros, que suelen aparecer en mujeres. En la TC o la ecografía se observan como multiquísticos, de gran tamaño y con líquido claro. Este diagnóstico se puede descartar por su rareza y por la falta de concordancia de las imágenes. En resumen, el diagnóstico diferencial se centra en dos entidades: la neoplasia mucinosa papilar intraductal y la neo- plasia quística de páncreas. Ambas pueden ser benignas, malignas o limítrofes y, por lo general, el diagnóstico definitivo del grado de malignidad se hace mediante el estudio histológico de la pieza quirúrgica. Dada su potencial malignidad en ambos casos, el tratamiento aconsejado es la exéresis quirúrgica oncológica (duodenopancreatectomía cefálica, si está en la cabeza, o pancreatectomía distal con esplenectomía, en el caso de que se localice en el cuerpo o la cola). Una prueba que podría ayudarnos en el diagnóstico diferencial es la colangiorresonancia magnética (CRM). En caso de que se objetive una dilatación del conducto pancreático principal o una de sus ramas, o una comunicación de él con el quiste, estaríamos ante una neoplasia mucinosa papilar intraductal. La ausencia de esta dilatación o comunicación sugiere la neoplasia quística mucinosa. La colangiopancreatografía retrógrada endoscópica podría aportar los mismos datos, pero el riesgo de complicaciones posteriores es mayor, por lo que considero que la prueba que estaría indicada para completar el diagnóstico es la CRM. Por otra parte, el hecho de que la paciente no presente afección del estado general, ni sintomatología dolorosa, me inclina a pensar que el tumor no está degenerado. La presencia de una masa sólida intra o periquística, las metástasis quísticas hepáticas o la ascitis sugieren malignidad. Ninguna de estas características está presente en esta paciente, por lo que presumiblemente el tumor será benigno, pero dado que tiene potencial de malignización, en cualquier caso estaría indicada la exéresis quirúrgica. El diagnóstico definitivo del grado de malignidad lo dará el estudio anatomopatológico. A excepción del tumor quístico seroso, las demás lesiones quísticas neoplásicas son premalignas o malignas, por lo que cuando se objetivan por la TC no está indicada la punción para establecer el diagnóstico. El beneficio que reporta es bajo, puesto que en todos los casos estaría indicada la resección quirúrgica, pero se corre el riesgo de diseminar una neoplasia maligna, de que se sobreinfecte o de provocar una hemorragia. Ante el diagnóstico por imagen estaría indicada la exéresis quirúrgica, con la realización de un análisis peroperatorio de la muestra y, si es maligno, se debe completar la cirugía oncológica (linfadenectomía y/o esplenectomía). En el caso de benignidad, no se debe realizar una enucleación, puesto que el riesgo de complicaciones, como la fístula pancreática en el postoperatorio, es más alto que con la resección pancreática reglada. Con las pruebas que tenemos y dado que se trata de una mujer, que la lesión está localizada en el cuerpo-cola, que tiene morfología de quiste único, con septos y calcificaciones y el contenido de mucina tiene una concentración de CEA elevada, creo que el diagnóstico más probable es el de neoplasia quística mucinosa o tumor quístico mucinoso (antes llamado cistadenoma o cistadenocarcinoma mucinoso, según sea benigno o maligno). DIAGNÓSTICO CLÍNICO Dr. Antonio Alastrué. Pensamos que se trataba de una neoplasia quística serosa y propusimos a la paciente la intervención quirúrgica. La paciente inicialmente se negó a la intervención y prefirió seguir controles. Entonces se intentó el vaciado, pero al comprobar la evolución que se había reproducido, la paciente se convenció de la conveniencia de la intervención. DIAGNÓSTICO DE LA DRA. R. CONDE-MUIÑO Neoplasia quística mucinosa (cistoadenoma mucinoso). Med Clin (Barc). 2006;126(9):349-54 351 Documento descargado de http://www.elsevier.es el 29/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CONDE-MUIÑO R ET AL. QUISTE PANCREÁTICO EN UNA MUJER DE 60 AÑOS Fig. 6. Lesión en relación con el páncreas. Hematoxilina-eosina. Fig. 7. Epitelio plano o cúbico. Hematoxilina-eosina. DISCUSIÓN ANATOMOPATOLÓGICA Dr. Daniel Villán. La pieza de resección quirúrgica recibida en el Servicio de Anatomía Patológica medía 8 x 4 x 1,5 cm y, al examen macroscópico, correspondía a la cola del páncreas, fragmentos de grasa pancreatoesplénica y el bazo. El peso y las dimensiones de este último estaban dentro de la normalidad. En continuidad con el páncreas, se observó una lesión nodular de 14 cm de diámetro, de superficie lisa y brillante y focos congestivo-hemorrágicos. Al corte de la lesión se observó una cavidad quística con un contenido líquido transparente y amarillento y una pared lisa y brillante de 3 mm de grosor (fig. 6). Fig. 8. Células caliciformes ocasionales. Hematoxilina-eosina y PAS-diastasa. 352 Med Clin (Barc). 2006;126(9):349-54 Desde el punto de vista microscópico, había una buena delimitación de la lesión en relación con el parénquima pancreático, y se apreciaba una cápsula fibrosa que presentaba focos congestivos y hemorrágicos en su pared libre. Ocasionalmente, se observaron quistes microscópicos en la cápsula. La estroma que separaba estos microsquistes contenía parénquima pancreático atrapado y agregados linfocitarios. El quiste principal, así como los microquistes contenidos en su cápsula, estaban tapizados por una monocapa de células epiteliales cuboidales o planas, de citoplasma eosinófilo, con un núcleo redondo y ovalado, sin nucléolo evidente. No se encontraron figuras de mitosis ni atipia citológica (fig. 7). De manera focal se identificaron células caliciformes con mucina, intensamente positivas con la tinción de PAS-diastasa (fig. 8). El resto del páncreas, tanto en su porción exocrina como en la endocrina, y el bazo no pusieron de manifiesto alteraciones patológicas. Con estos hallazgos histológicos se realizó el diagnóstico de adenoma seroso oligoquístico con áreas de mucosecreción. Entre las lesiones quísticas del páncreas, ya sean neoplásicas o no, las neoplasias serosas corresponden al 3% (1-2% de los tumores del páncreas exocrino). Como en este caso, son más frecuentes en el sexo femenino (3 de cada 4 casos) y su edad de presentación oscila entre los 30 y los 90 años. En la reciente clasificación de la OMS, este grupo incluye el adenoma seroso microquístico o neoplasia quística serosa microquística, el adenoma seroso oligoquístico o neoplasia quística serosa oligosquística (menos frecuente que el anterior) y el cistoadenocarcinoma seroso (con sólo 9 casos descritos). Es decir, se trata de tumores que en la gran mayoría de los casos presentan un comportamiento benigno5,13. La etiología es desconocida, aunque a la vista de su predisposición por el sexo femenino se postulan factores genéticos y hormonales. La variante oliogoquística se asocia al síndrome de Von Hippel-Lindau y en las pocas neoplasias serosas descritas en los niños se ha observado infección por citomegalovirus en el páncreas adyacente. Desde el punto de vista macroscópico, el adenoma seroso microquístico se presenta como una lesión nodular, bien delimitada, de hasta 25 cm de diámetro, con una cicatriz central y múltiples cavidades quísticas de menos de 2 cm de diámetro, rellenas de un líquido acuoso, con una arquitectura que recuerda a un panal de abejas o a una esponja. En la variante oligoquística hay menos quistes (a veces uno solo), que son de mayor diámetro, y no hay cicatriz central. El cistoadenocarcinoma seroso pone de manifiesto idénticas características, pero con estructuras papilares en la superficie interna e invasión del parénquima pancreático adyacente y/o de las estructuras vecinas. Al examen microscópico, tanto en la variante microquística como en la oligoquística, los quistes están revestidos por un epitelio plano o cuboidal. Las células tienen un citoplasma claro o eosinófilo, con un núcleo redondo y ovalado y un nucléolo poco llamativo. No se observan mitosis ni atipia citológica. La estroma acelular, ocasionalmente hialinizada, puede contener vasos, nervios o parénquima pancreático atrapado. En las escasas formas malignas se observa, focalmente, pleomorfismo nuclear, invasión perineural y otras características de malignidad14,15. El pronóstico es excelente, y no hay recurrencias ni metástasis documentadas, a excepción de los infrecuentes casos de cistoadenocarcinoma16. Comentaré brevemente el resto de las lesiones quísticas, algunas de ellas ya apuntadas en la discusión clínica. El seudoquiste pancreático es la causa del 90% de las lesiones quísticas del páncreas y es tan frecuente en varones como en mujeres, aunque en los casos asociados a pancreatitis Documento descargado de http://www.elsevier.es el 29/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CONDE-MUIÑO R ET AL. QUISTE PANCREÁTICO EN UNA MUJER DE 60 AÑOS crónica aumenta el porcentaje de varones. Además de a la pancreatitis aguda o crónica, el seudoquiste pancreático se asocia a los traumatismos en el 10% de los casos. Cabe señalar que entre el 25 y el 40% de los casos se resuelven espontáneamente. Desde el punto de vista macroscópico, el seudoquiste pancreático es una cavidad quística de contenido necrohemorrágico y con áreas de esteatonecrosis ocasionales a su alrededor. Al microscopio óptico, carece de epitelio de revestimiento y en su lugar se observa tejido de granulación e inflamación aguda y crónica con células gigantes multinucleadas de tipo cuerpo extraño. Las neoplasias mucinosas corresponden al 4,5% de las lesiones quísticas del páncreas (el 2,5% de los tumores del páncreas exocrino). De forma característica, el 66% de éstas afecta a mujeres de edades comprendidas entre la segunda y la sexta décadas. Dependiendo del grado de agresividad, la clasificación de la OMS distingue el cistadenoma mucinoso, el tumor quístico mucinoso con displasia moderada y el cistoadenocarcinoma mucinoso no invasivo e invasivo. Todas ellas son neoplasias que deben considerarse como potencialmente malignas, incluso las de apariencia histológica benigna, como el cistoadenoma mucinoso. La etiología de las neoplasias mucinosas es desconocida, pero, como en las neoplasias serosas, la predisposición por el sexo femenino sugiere factores genéticos y hormonales. Al estudio macroscópico son lesiones nodulares, bien delimitadas (hasta 35 cm de diámetro), que a la superficie de corte presentan una cavidad única o múltiple, repleta de un material gelatinoso. La superficie interna es lisa, pero en el caso del cistoadenocarcinoma se observan proyecciones papilares o nódulos y/o invasión de las estructures vecinas. En cuanto a la histología del cistoadenoma mucinoso, el epitelio que recubre los quistes es cilíndrico. Las células poseen un núcleo basal y un citoplasma apical, basófilo y distendido, con abundante mucina. No se observa mitosis ni atipia citológica. En el otro extremo, al añadir atipia, mitosis y reducción de la producción de mucina, se sitúa el cistoadenocarcinoma mucinoso, que puede ser no invasivo o invasivo, si hay infiltración de la estroma5,17. El tumor mucinoso intraductal papilar corresponde al 2% de las lesiones (1% de los tumores del páncreas exocrino). Es el único tumor pancreático quístico que es más frecuente en los varones (el 66%) entre la tercera y novena décadas. Ha recibido desde su descripción inicial una gran variedad de nombres que hacen alusión a sus características macroscópicas e histológicas, como papiloma intraductal, adenoma papilar, adenoma velloso, adenocarcinoma papilar intraductal difuso, carcinoma velloso difuso del conducto de Wirsung, entre otros. De acuerdo con el grado de agresividad, la actual clasificación de la OMS contempla el adenoma mucinoso intraductal papilar, la neoplasia mucinosa intraductal papilar con displasia moderada y el carcinoma mucinoso intraductal papilar no invasivo e invasivo. Así pues, el tumor mucinoso intraductal papilar sigue el mismo esquema que las neoplasias mucinosas y, como éstas, debe considerarse como una lesión premaligna que, de forma característica, se disemina por los ductos pancreáticos. Su etiología es desconocida, aunque muchos de los pacientes eran fumadores. En el examen endoscópico se observa extravasación frecuente de material mucoso por la ampolla de Vater. Desde el punto de vista macroscópico, se aprecia una dilatación quística del ducto, con proliferaciones papilares o sesiles en su interior. En el estudio microscópico se observa una hiperplasia papilar del epitelio ductal, con abundante moco intracelular e intraductal. Dependiendo del grado de atipia y/o invasión del estroma, se considera como un adenoma, una neoplasia mucinosa intraductal papilar con displasia moderada o un carcinoma mucinoso intraductal papilar no invasivo o invasivo5,17. El tumor sólido seudopapilar corresponde al 0,3% de las lesiones quísticas (1% de los tumores del páncreas exocrino) y de manera característica afecta a mujeres jóvenes (en especial adolescentes), aunque se ha descrito algún caso en el sexo masculino. También, como en la entidad anterior, ha recibido desde su descripción inicial una gran variedad de nombres relacionados con sus características macroscópicas e histológicas. Entre ellos cabe destacar los de tumor de Frantz, tumor sólido quístico, tumor papilar quístico, tumor sólido quístico papilar, neoplasia epitelial sólida y papilar y neoplasia epitelial papilar de páncreas. En la actualidad, el término propuesto por la OMS es el de tumor sólido seudopapilar de páncreas. Debe considerarse una neoplasia de bajo grado de malignidad, aunque de manera excepcional puede recurrir e incluso metastatizar. La etiología es desconocida y vuelven a señalarse, por su predisposición por el sexo femenino, factores genéticos y hormonales. Se ha relacionado con la toma de anticonceptivos orales durante un largo período. En el examen macroscópico recuerda al seudoquiste pancreático, dado que presenta extensos cambios necróticos y hemorrágicos y sólo en la periferia se observan zonas conservadas compuestas de tejido violáceo y grisáceo, que corresponden a las áreas más viables. Desde el punto de vista histológico, las células son relativamente uniformes, de morfología poligonal, con abundante citoplasma eosinófilo y un núcleo central ovoideo de cromatina fina. Estas células ponen de manifiesto patrones de crecimiento muy diversos. El primero de estos patrones es organoide, con las células formando nidos sólidos rodeados de tractos fibrovasculares. En otras zonas las células presentan un patrón microquístico, con formación de cavidades microscópicas que contienen hematíes y un material basófilo acelular que es negativo para las tinciones de mucina. El tercer patrón es consecuencia de la falta de cohesión y fragilidad que adquieren las células a medida que se alejan de los vasos, formando estructuras seudopapilares. Es preciso destacar los extensos cambios necróticos y hemorrágicos de esta tumoración5,17. Las variantes quísticas de los tumores de las células de los islotes de Langerhans, del carcinoma de células acinares y del adenocarcinoma ductal, así como algunas neoplasias no asociadas al parénquima pancreático, tales como linfangiomas, hemangiomas, teratomas y paragangliomas (por orden de frecuencia) son lesiones quísticas del páncreas aún menos frecuentes (tan sólo el 0,2% del total de las lesiones quísticas de este órgano)5,17. Por último, cabe comentar la casuística de lesiones quísticas pancreáticas del Servicio de Anatomía Patológica del Hospital Universitari Germans Trias i Pujol de Badalona. En el período comprendido entre 1983 y 2005 se han diagnosticado 32 seudoquistes pancreáticos, 7 neoplasias mucinosas, 2 neoplasias serosas (curiosamente, ambas de la variante oligoquística) y 1 tumor sólido seudopapilar, lo que proporciona unos porcentajes similares a los de otros centros18. Dr. Agustín Urrutia. ¿Cómo está la paciente? Dr. Antonio Alastrúe. Completamente asintomática desde la exéresis de la masa. DIAGNÓSTICO ANATOMAPATOLÓGICO Neoplasia quística serosa oligoquística (adenoma seroso oligoquístico) con áreas de mucosecreción. Med Clin (Barc). 2006;126(9):349-54 353 Documento descargado de http://www.elsevier.es el 29/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CONDE-MUIÑO R ET AL. QUISTE PANCREÁTICO EN UNA MUJER DE 60 AÑOS REFERENCIAS BIBLIOGRÁFICAS 1. Kim YH, Saini S, Sahani D, Hahn PF, Mueller PR, Auh YH. Imaging diagnosis of cystic pancreatic lesions: pseudocyst versus nonpseudocyst. Radiographics. 2005;25:671-85. 2. Compagno J, Oertel JE. Mucinous cystic neoplasms of the pancreas with overt and latent malignancy (cystadenocarcinoma and cystadenoma). A clinicopathologic study of 41 cases. Am J Clin Pathol. 1978;69:573-80. 3. Ohashi K, Murakami Y, Takekoshi T, Ohta H, Ohashi I. Four cases of mucin producing cancer of the pancreas on specific findings of the papilla of Vater. Prog Dig Endosc. 1982;20:348-51. 4. Tollefson MK, Libsch KD, Sarr MG, Chari ST, DiMagno EP, Urrutia R, et al. Intraductal papillary mucinous neoplasm: did it exist prior to 1980? Pancreas. 2003;26:e55-8. 5. Hamilton SR, Aaltonen LA, editors. World Health Organization Classification of Tumours. Pathology and genetics. Tumors of the digestive system. Lyon: IARC Press; 2000. p. 234-40. 6. George DH, Murphy F, Michalski R, Ulmer BG. Serous cystadenocarcinoma of the páncreas-A new entity. Am J Surg Pathol. 1999;23:410-22. 7. Sarr MG, Murr M, Smyrk TC, Yeo CF, Fernández-del-Castillo C, Hawes RH, et al. Primary cystic neoplasms of the pancreas: neoplastic disorders of emerging importance– current state-of-the-art and unanswered questions. J Gastrointest Surg. 2003;7:417-28. 8. Thompson LDR, Becker RC, Przygodzki RM, Adair CF, Feffess CS. Mucinous cystic neoplasm (mucinous cystadenocarcinoma of low grade malignant potential) of the pancreas. Am J Surg Pathol. 1999;23:1-16. 9. Brugge WR, Lauwers GY, Sahani D, Fernández-del-Castillo C, Warshaw AL. Current concepts: cystic neoplasms of the pancreas. N Engl J Med. 2004;351:1218-26. 354 Med Clin (Barc). 2006;126(9):349-54 10. Cari ST, Raimondo M, Clain JE, Norton ID, Pearson RK, Petersen BT, et al. Is benign pancreatic intraductal papillary tumor (IPMT), trully benign? Gastrenterology. 2000;18 Suppl 1:A642. 11. Iacobuzi-Donahue CA, Klimstra DS, Adsay NV, Wilentz RE, Arganai P, Sonh TA, et al. DPC-4 protein is expressed in virtually all human intraductal papillary mucinous neoplasms of the pancreas. Am J Surg Pathol. 2000;157:755-61. 12. Gigot JF, Deprez P, Sempoux C, Descamps C, Meairie S, Glineur D, et al. Surgical management of intraductal papillary mucinous tumors of the páncreas. Arch Surg. 2001;136:1246-62. 13. Sawai H, Okada Y, Fumahashi H, Matsuo Y, Tanaka M, Manabe T. Immunohistochemical anaysis of molecular biological factors in intraductal papillary-mucinous tumors and mucinous cystic tumors of the pancreas. Scand J Gstroenterol. 2004;11:1159-65. 14. George DH, Murphy F, Michalski R, Ulmer BG. Serous cystadenocarcinoma of the pancreas: a new entity? Am J Surg Pathol. 1989;13:61-6. 15. Oshimi N, Sugie S, Tanaka T, Aijin W, Bunai Y, Tatematsu A, et al. A rare case of serous cystadenocarcinoma of the pancreas. Cancer. 1992;69:2449-53. 16. Eriguchi N, Aoyagi S, Nakayama T, Hara M, Miyazaki T, Kutami R, et al. Serous cystadenocarcinoma of the pancreas with liver metastases. J Hepatobiliary Pancreat Surg. 1998;5:467-70. 17. Solcia E, Capella C, Klöppel G. Tumors of the pancreas. Washington, D.C.: AFIP; 1995. 18. Balcon JH, Fernández del Castillo C, Warshaw AL. Cystic lesions in the pancreas: when to watch, when to resect. Current Science. 2000;2: 152-8.








