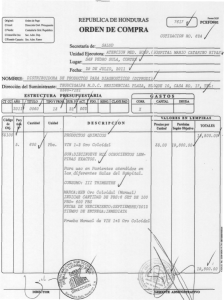
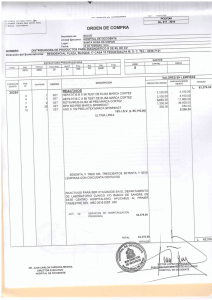
Internet - BVS-INS - Instituto Nacional de Salud
Anuncio

2 © Ministerio de Salud INSTITUTO NACIONAL DE SALUD Jr. Cápac Yupanqui 1400, Jesús María Telf. 471-3254 / Fax: 471-7443 Lima, Perú, 1996 3 MANUAL DE PROCEDIMIENTOS DE LABORATORIO PARA EL DIAGNÓSTICO DE ARBOVIROSIS COMITÉ DE REDACCIÓN: Blgo. Victoria Guitérrez Peceros Dra. Lourdes Belaunde de Juárez Blgo. Miguel Cobos Zelada COMITÉ EDITOR: Dr. Alfonso Zavaleta Martínez-Vargas Dr. César Cabezas Sánchez Dr. Jaime Chang Neyra MINISTERIO DE SALUD ALTA DIRECCIÓN Dr. Marino Costa Bauer Ministro Dr. Alejandro Aguinaga Recuenco Viceministro INSTITUTO NACIONAL DE SALUD Dr. Carlos Carrillo Parodi Jefe CENTRO NACIONAL DE LABORATORIOS DE SALUD PÚBLICA Dr. César Cabezas Sánchez Director General 4 PERFIL DEL AUTOR Blga. Victoria Gutiérrez Peceros Bióloga, Especialidad Virología. Jefe del Laboratorio de Arbovirosis y Rickettsias, División de Virología, Centro Nacional de Laboratorios de Salud Pública, INS, MINSA. Dra. Lourdes Belaunde Villalón Bióloga, Especialidad Virología. Directora Ejecutiva del Centro Nacional de Laboratorios de Salud Pública, INS, MINSA. Dr. Miguel Cobos Zelada Biólogo, Especialidad Virología. Director Ejecutivo de Laboratorios de Referencia, Centro Nacional de Laboratorios de Salud Pública, INS, MINSA. Profesor Asociado Tiempo Parcial, Facultad de Tecnología Médica, Universidad Nacional Federico Villarreal. PERFIL DE LOS EDITORES Dr. Alfonso Zavaleta Martínez-Vargas Médico Cirujano, Doctor en Farmacología. Director General, Centro Nacional de Control de Calidad, INS, MINSA. Profesor Principal D.E.S., Sección Farmacología, Departamento Académico de Ciencias Fisiológicas, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia Miembro, Instituto de Medicina Tropical “Alexander von Humbolt”, Universidad Peruana Cayetano Heredia. Dr. César Cabezas Sánchez Médico Cirujano, Master en Medicina, Especialista Enfermedades Infecciosas y Tropicales. Director General, Centro Nacional de Laboratorios de Salud Pública, Instituto Nacional de Salud Pública, INS, MINSA. Profesor invitado de Medicina Tropical, Universidad Nacional Mayor de San Marcos, Universidad Peruana Cayetano Heredia. Dr. Jaime Chang Neyra Médico Cirujano, Master of Science in Community Health in Developing Countries. Director Ejecutivo de Garantía de la Calidad, Centro Nacional de Control de Calidad, INS, MINSA. Investigador, Instituto de Medicina Tropical “Alexander von Humbolt”, Universidad Peruana Cayetano Heredia. El Comité Editor expresa su agradecimiento a los doctores Magna Suárez Jara; Antonio Antunez de Mayolo; a los técnicos de laboratorio María P. García Mendoza, Rosa Acosta Chávez y Benedicta Yana Calatayud. Asimismo, a los doctores Douglas Watts y Johnny Callahan (U.S. NAMRID) por las valiosas sugerencias efectuadas al manuscrito. A la Organización Panamericana de la Salud, por el apoyo económico brindado para la publicación de esta obra. 5 ÍNDICE Presentación........................................................................................................................................................8 Resolución Jefatural ...........................................................................................................................................9 CAPITULO I Introducción........................................................................................................................................................10 CAPITULO II Normas de Bioseguridad en los Laboratorios .....................................................................................................11 CAPITULO III Obtención y Envío de Muestras para el Diagnóstico de Arbovirosis..................................................................12 CAPITULO IV Preparación de Antígeno y Conjugado para Pruebas Sexológicas......................................................................16 CAPITULO V Prueba de Hemaglutinación (HA).......................................................................................................................20 CAPITULO VI Prueba de Inhibición de la Hemaglutinación (IH)...............................................................................................23 CAPITULO VII ELISA de Captura de IgM (MAC-ELISA) .........................................................................................................26 CAPITULO VIII Diagnóstico Virológico .......................................................................................................................................31 CAPITULO IX Aislamiento Viral................................................................................................................................................36 CAPITULO X Pruebas de Identificación - Tipificación Viral ....................................................................................................39 CAPITULO XI Prueba de Neutralización ....................................................................................................................................42 CAPITULO XII Referencias bibliográficas...................................................................................................................................45 ANEXOS Anexo 1 Instrucciones para la Obtención, Mantenimiento y Envío de Muestras Séricas ................................................................................................................................. 47 Anexo 2 Titulación de los reactivos para la Prueba de MAC-ELISA ...............................................................................48 Anexo 3 Titulación de los reactivos para la Prueba de Inmunofluorescencia Indirecta ..............................................................................................................................................................49 Anexo 4 Preparación de los Reactivos para Antígeno y Conjugado .................................................................................50 Anexo 5 Preparación de Reactivos para la Prueba de Hemaglutinación (HA) y de Inhibición de Hemaglutinación (IH) ..........................................................................................................52 Anexo 6 Preparación de Reactivos y Soluciones para la Prueba ELISA de 6 Captura de IgM ...................................................................................................................................................54 Anexo 7 Preparación de Reactivos y Soluciones para la Prueba de Inmunofluorescencia (IFI) ............................................................................................................................. 55 Anexo 8 Preparación de Reactivos y Soluciones para el Diagnóstico Virológico ...........................................................................................................................................................56 Anexo 9 Contaje de Células ..............................................................................................................................................58 Anexo 10 Ficha Clínico Epidemiológico de Fiebre Amarilla..............................................................................................60 Anexo 11 Ficha Clínico Epidemiológica de Dengue...........................................................................................................62 Anexo 12 Titulación de antígeno por HA............................................................................................................................64 Anexo 13 Consolidado de titulación de Antígeno ...............................................................................................................65 Anexo 14 Protocolo de Inhibición de Hemaglutinación......................................................................................................66 Anexo 15 Protocolo para la prueba de ELISA.....................................................................................................................67 Anexo 16 Protocolo de Cultivo Celular ..............................................................................................................................68 7 PRESENTACIÓN Las enfermedades causadas por arbovirus, constituyen un serio problema de Salud Pública en el Perú, siendo las de mayor impacto la fiebre amarilla, el dengue, la encefalitis equina, el oropouche; las cuales tienen una morbi-mortalidad variable en la costa norte y la selva del país. En ese contexto es importante el diagnóstico de laboratorio, particularmente en las enfermedades virales, que permitan la confirmación etiológica y sobre esa base plantear las medidas de control y vigilancia epidemiológicas. Una estrategia para contar con un diagnóstico confiable y oportuno, de estas patologías es la transferencia tecnológica a los laboratorios regionales donde las arbovirosis constituyen problema de salud, por lo que el presente manual sale a luz con el objetivo de servir de guía y estandarizar los procedimientos para el diagnóstico de las arbovirosis en la Red Nacional de Laboratorios de Salud Pública. El Comité Editor 8 9 CAPÍTULO I INTRODUCCIÓN Los Arbovirus son un grupo de virus que presentan en común un ARN de cadena simple con envoltura lipoproteica conteniendo aglutininas. Se transmiten por la picadura de artrópodos y son causantes de diversas enfermedades en humanos y animales constituyendo serios problemas de salud pública. En nuestro medio los Arbovirus más importantes pertenecen a las familias Flaviviridae (virus de la Fiebre Amarilla y Dengue), Bunyaviridae (virus Oropuche), Togaviridae (virus Mayaro, Encefalitis equinas virales) y otros. Estos son mantenidos en la naturaleza por la transmisión cíclica entre los vectores hematófagos y hospederos vertebrados, distribuidos en diferentes áreas del país. El diagnóstico de laboratorio está dado por la confirmación etiológica mediante el aislamiento viral en sistemas biológicos, a partir de muestras de sueros y tejidos (obtenidos en la fase aguda de la enfermedad). Las técnicas serológicas son utilizadas para la identificación del virus aislado y para la cuantificación de anticuerpos. Actualmente, en el país se presentan casos de Fiebre Amarilla Selvática y Dengue en su forma clásica con circulación de los serotipos 1 , 2 y 4, existiendo el riesgo de que se den las formas hemorrágicas y la potencial urbanización de la Fiebre Amarilla teniendo como vector común al Aedes aegypti. Por ello, el Instituto Nacional de Salud ha considerado conveniente implementar técnicas serológicas en las regiones en riesgo, para apoyar en el control y vigilancia de las Arbovirosis. 10 CAPÍTULO II NORMAS DE BIOSEGURIDAD EN LOS LABORATORIOS La información reunida en este manual tiene por finalidad orientar y facilitar el trabajo del personal de laboratorio y demás personas con responsabilidades en los programas de seguridad en los laboratorios de las diferentes regiones del país. En relación a los trabajos de laboratorio aumentan los riesgos de enfermar por la exposición a los agentes biológicos, sea a través de accidentes con agujas o jeringas contaminadas, aerosoles, manejo de material contaminado, o por falta de vacunación contra dichos agentes. Cabe resaltar, con referencia a los laboratorios que trabajan con material infectado, que es preciso proteger no sólo al operador, sino también al personal que realiza tareas de apoyo. Además, se debe proteger al material de las posibles contaminaciones cruzadas que pueden ocasionar falsos resultados. Las reglas de bioseguridad más importantes se mencionan a continuación: - Se debe mantener el laboratorio limpio y aseado y retirar del mismo cualquier material que no tenga relación con el trabajo. Las superficies de trabajo se deben descontaminar al menos una vez al día en casos de derrame de sustancias potencialmente peligrosas. En las zonas de trabajo del laboratorio no se debe permitir al personal comer, beber, guardar alimentos ni usar cosméticos. En el laboratorio se deben utilizar mandiles; no se debe llevar ropa de laboratorio fuera de éste. Han de desinfectarse las prendas contaminadas por procedimientos apropiados. No deben usarse sandalias o zapatos abiertos. Nunca pipetear con la boca; usar mascarilla y propipeta. Todo material contaminado se debe autoclavar o incinerar. En caso de ser eliminado, introducir en bolsas resistentes o impermeables. Se debe solicitar oportunamente la fumigación de los laboratorios contra los insectos y la aplicación de rodenticidas para la eliminación de los roedores. Todos los miembros del personal del laboratorio, y demás personas expuestas, deben proporcionar cada cierto tiempo una muestra sérica para su control oportuno. El jefe del laboratorio debe ocuparse de que el personal reciba una formación apropiada sobre seguridad en el laboratorio. Con respecto al laboratorio de cultivos celulares, se debe tener presente que el manejo de ciertos materiales implica un riesgo; tal es el caso de los cultivos primarios donde se usan tejidos animales, los que deben ser tratados como materiales potencialmente infecciosos. Para el manejo de mantenimiento de líneas celulares se deben emplear laboratorios de nivel de bioseguridad II. Para trabajos de aislamiento viral y preparación de antígenos los laboratorios son de nivel de bioseguridad III. (Véase Manual de Bioseguridad del INS.) Además, cumplir con las normas de bioseguridad establecidas por la OMS. 11 CAPÍTULO III OBTENCIÓN Y ENVÍO DE MUESTRAS PARA EL DIAGNÓSTICO DE ARBOVIROSIS El éxito de las pruebas de laboratorio depende en gran medida del cuidado que se ponga en la recolección, manejo y envío de las muestras. (Véase Anexo 1) 3.1 TIPOS DE MUESTRA REQUERIDA Para el diagnóstico serológico se requiere de sueros pareados obtenidos en: - Fase aguda (5 primeros días de la enfermedad). - Fase de convalecencia (a partir de la segunda o tercera semana). Para el diagnóstico virológico se requiere: - Muestra de suero de la fase aguda. - En caso de fallecidos obtener fragmento de tejido (hígado, cerebro, bazo, riñón u otros), sin ningún preservante. Para el diagnóstico histopatológico se requiere de fragmentos de tejido (hígado, cerebro, bazo, riñón u otros), en formol al 10%. 3.2 MATERIALES Y EQUIPO NECESARIO - Jeringa o Vacutainer Ligadura Algodón Tubos y frascos de boca ancha Alcohol yodado Recipiente para descarte Gradilla Pipeta Pasteur Viales Esparadrapo Refrigeradora Centrífuga refrigerada Propipeta Viscerótomo 3.3. PROCEDIMIENTOS 3.3.1 OBTENCION DE MUESTRA DE SUERO - Identifique los tubos o viales con el nombre completo o clave del paciente de quien se obtendrá la muestra sanguínea. 12 - Extraer 5 cc de sangre sin anticoagulante. - Colocar la muestra en un tubo estéril y dejarlo reposar en plano inclinado por una hora, luego centrifugar a 1500 r.p.m. por 10 minutos. - Con una pipeta Pasteur aspire el suero, cuidando de no incluir hematíes. - Deposite el suero en viales o frascos de penicilina estéril con tapa hermética. - Separar en alícuotas y almacenar a -20ºC hasta el momento de remitir la muestra al laboratorio. 13 3.3.2 OBTENCION DE MUESTRA DE TEJIDO La obtención de una muestra de tejido para aislamiento viral puede hacerse con la ayuda de un viscerótomo, o de lo contrario, durante la necropsia. La muestra debe ser dividida en 2 partes: una para aislamiento y una para estudio histopatológico. Para el aislamiento viral obtener un fragmento de tejido cuyo volumen sea de 2 cm3, colocar en un frasco de boca ancha estéril con tapa hermética, sin añadir nada. Rotular y congelar a -20°C hasta su envío al laboratorio. 3.3.2.1 TÉCNICA DEL VISCERÓTOMO Este instrumento tiene dos cuchillas, siendo la superior flexible y corrediza. La persona que va a tomar la muestra debe colocarse a la izquierda del cadáver. Se realiza una pequeña incisión de 2cm con un bisturí o una cuchilla corriente en la parte superior del ángulo formado por el borde costal derecho y el esternón (la boca del estómago). Por la incisión, se introduce de izquierda a derecha y orientando ligeramente hacia arriba el viscerótomo cerrado. En la cavidad abdominal, abrir el viscerótomo y seguirlo introduciendo hasta tocar el hígado (sensación de resistencia), luego penetrar hasta llegar a la parte posterior de las costillas (el viscerótomo no avanza más). Se cierra el viscerótomo y se retira. Si no se obtiene muestra, se vuelve a realizar el mismo procedimiento. Terminada la operación se sutura con seda o se coloca un tapón de algodón en la incisión. Una vez obtenida la muestra, esta se divide en dos partes: una sin ningún preservante para aislamiento viral y otra al frasco con formol al 10% para estudio histopatológico. El tamaño de la muestra debe ser de 2 cm3, aproximadamente. 3.4 EMPAQUE Y REMISIÓN DE MUESTRAS: Los procedimientos de empaque y remisión de muestras deben ser hechos en forma tal que no ofrezcan riesgos para el personal que las manipula, ni para terceros. Asegure las tapas de los tubos o viales y séllelos con esparadrapo. Lo ideal es que cada tubo se proteja individualmente dentro de una envoltura o recipiente con material suave. Si lo anterior no es posible, haga pequeños paquetes de 4 a 6 tubos y únalos con una ligadura de jebe; luego introdúzcalos dentro de una doble bolsa de plástico. Colóquelos con cuidado en un segundo recipiente (caja térmica) con hielo seco. Rellene los espacios vacíos con papel, viruta o espuma plástica. A falta de hielo seco, utilice refrigerantes o bolsas que contengan cubos de hielo. 14 Selle la caja de embalaje con un precinto adecuado y coloque la etiqueta para remisión de las muestras con dirección a: INSTITUTO NACIONAL DE SALUD CENTRO NACIONAL DE LABORATORIOS DE SALUD PUBLICA División de Virología Cápac Yupanqui 1400 – Jesús María, Lima 11 Telf. 014-719920, Anexo 134 – 148 Fax 014-712529 URGENTE CONTIENE MATERIAL BIOLOGICO. MANTENER REFRIGERADO. Se deberá comunicar al Instituto Nacional de Salud vía telefónica o vía fax, antes de la remisión de las muestras. “TODO MATERIAL BIOLÓGICO REMITIDO PARA IDENTIFICACIÓN Y/O CONFIRMACIÓN DEBERÁ ESTAR ACOMPAÑADO DE SU RESPECTIVA FICHA CLÍNICA ADECUADAMENTE LLENADA, EN CASO CONTRARIO, NO SE REALIZARÁ NINGÚN ESTUDIO” Los formularios de los casos clínicos no deben ser incluidos dentro de la caja térmica. Han de asegurarse en la parte externa de la tapa. 15 CAPÍTULO IV PREPARACIÓN DE ANTÍGENO Y CONJUGADO 4.1 PREPARACIÓN DE ANTÍGENO POR EL MÉTODO SACAROSA ACETONA Existen varios métodos para la preparación de antígenos de Arbovirus, siendo la técnica más utilizada la extracción con sacarosa-acetona que proporciona antígenos estables con títulos altos. La acetona permite un mayor rendimiento viral al actuar sobre los lípidos del cerebro. La sacarosa protege a las partículas virales de la acción de la acetona. La relación entre las concentraciones de sacarosa, cerebro, acetona y agua parecen ser críticas en el rendimiento viral. El proceso es potencialmente peligroso y deben tomarse las medidas necesarias de bioseguridad para la manipulación del virus infeccioso, de la acetona (inflamable) y de la sustancia inactivadora (carcinogénica). 4.1.1 REACTIVOS (Véase Anexo Nº 4) - Sacarosa al 8,5% Acetona Solución Borato Salina pH 9 (BS) Medio mínimo esencial con sales Hank’s (H-MEM) Hydroxymethyl aminometano (Tris) Beta propiolactona (BPL) Alcohol 70° Desinfectante 4.1.2 EQUIPOS Y MATERIALES - Conge1adora -70°C y -20°C Refrigeradora Cabina de flujo laminar Centrífuga refrigerada Micropipeta graduable Homogenizador mecánico o eléctrico Kitasatos y otros materiales de vidrio Bomba de vacío Jeringa de 50 cc Viales Aguja de pipeteo N° 18, 6” Puntas para micropipeta 4.1.3 PROCEDIMIENTO PARA LA EXTRACCIÓN DEL ANTÍGENO MATERIAL - Cepa viral obtenida en ratones lactantes. OBTENCIÓN DE CEREBRO DE RATÓN LACTANTE (CRL) INFECTADO - - Inocular en ratones lactantes de 24 - 48 horas de nacidos (8 ratones lactantes por familia/cada jaula) por vía intracerebral con 0,02 mL de la cepa al 10% en H-MEM o PBS + AB 2% + antibiótico-antimicótico al 1%. Controlar los ratones inoculados por lo menos dos veces al día. Cuando presenta signos de enfermedad, congelar a -70°C. Durante el proceso de extracción, deben reenvasarse varias ampollas conteniendo cerebro de ratón solo 16 o al 10% de H-MEM o PBS, las cuales se guardarán a -70°C y servirán como virus “semilla” para el pase en ratones y mantenimiento del virus. 4.1.4 Preparación del antígeno - - - Trabajar en cabina de flujo laminar y manipular con extremo cuidado durante todo el proceso. Debe evitarse el uso de mechero. Durante todo el procedimiento, trabajar sobre recipientes que contengan hielo. Descongelar los ratones y extraer asépticamente los cerebros por aspiración empleando jeringa. Luego, colocados en un frasco estéril, proceder al pesado. Por cada volumen de cerebro de ratón extraído, añadir 4 volúmenes de sacarosa fría. Homogenizar la suspensión por 1 minuto, en tres ciclos, permitiendo al material sedimentar entre cada ciclo. Colocar en un kitasato acetona fría a proporción de 20 volúmenes a 1 volumen del homogenizado. Aspirar la suspensión con una jeringa (sin aguja). Seguidamente, colocar la aguja de pipeteo. Introducir luego en el kitasato y verter rápidamente para evitar que se formen precipitados. Agitar vigorosamente, en ambos sentidos, y dejar reposar en baño de hielo durante 15 minutos. Aspirar la acetona completamente y con el empleo de bagueta de vidrio romper el precipitado. Añadir otros 20 volúmenes de acetona fría. Dejar sedimentar el antígeno y reposar en baño de hielo durante 90 minutos. Aspirar la acetona en su totalidad, luego proceder al secado del antígeno utilizando la bomba de vacío durante aproximadamente una hora. Rehidratar con buffer Tris-BS con 0,4 volúmenes del homogenizado de cerebro-sacarosa. Colocar en un erlermeyer estéril con tapa de rosca e incubar a 4°C hasta el día siguiente. Centrifugar a 10000 r.p.m. por 30 minutos a 4°C. Recuperar el sobrenadante y adicionar BPL (sustancia inactivadora) a fin de obtener una concentración final de 0,1%. Mezclar la suspensión e incubar a 4°C por dos días, agitando dos veces al día. En caso de algunos Arbovirus más virulentos como el virus de Encefalitis Equina Venezolana (EEV), la inactivación con BPL es al 0,3%, y se debe trabajar en laboratorio de bioseguridad de nivel IV. Distribuir el antígeno tratado en alicuotas y guardar a -70°C. En el caso de liofilizado, almacenar a 20°C. Chequear si la inactivación del antígeno preparado fue efectiva inoculando 0,02 mL de antígeno preparado en RL por vía intracerebraI. No debe producir ninguna sintomatología en los RL. 4.2 PREPARACIÓN DE CONJUGADO-PEROXIDASA POR EL MÉTODO PERYODATO DE SODIO Los métodos inmunológicos están basados en el inmunoensayo enzimático sobre fase sólida conocido como ELISA, sistema ampliamente empleado para la detección de antígeno y la cuantificación de anticuerpo. Uno de los componentes principales de este sistema lo constituyen los conjugados que están formados por enzimas ligadas a un antígeno o anticuerpo determinado, las que han sido utilizadas como marcadores por ser estables, altamente reactivas y puras, entre las que se encuentran: la Acetil coliniesterasa, Citocromo C, B-D-galactosidasa y otras. Sin embargo, la Fosfatasa alcalina y la Peroxidasa han sido las más utilizadas por su bajo costo, fácil conjugación, y su amplia variedad de sustrato. Entre los métodos de conjugación más utilizados se encuentran el del Glutaraldehido de 2 pasos y el del Peryodato, siendo éste último el que brinda mejores resultados cuando se trabaja con peroxidasa. 4.3 PRECIPITACIÓN DE INMUNOGLOBULINAS CON SULFATO DE AMONIO 4.3.1 REACTIVOS (Véase Anexo N°4) - Solución saturada de sulfato de amonio pH 7 - Solución salina al 0,85% 4.3.2 EQUIPOS Y MATERIALES - Dispensador automático Agitador magnético Espectrofotómetro Barra magnética 17 - Micropipetas graduables Refrigeradora Centrífuga refrigerada Material de vidrio Viales Membrana parafilm Tubo de diálisis Puntas para micropipeta 4.3.3 PROCEDIMIENTO - - Colocar en un beaker 2 mL de suero humano conteniendo anticuerpos inhibidores de la hemaglutinación con títulos>1:1280, ejemplo para el virus Dengue, luego adicionar 2 mL de solución salina. Agregar 4 mL de solución saturada de sulfato de amonio, gota a gota. Mezclar con ayuda del agitador magnético durante 45 minutos. Centrifugar a 5000 r.p.m. por 30 minutos a 4°C. Eliminar el sobrenadante. Resuspender el precipitado con 2 mL de solución salina y adicionar 2 mL de sulfato de amonio de la forma antes indicada, luego centrifugar. Repetir dos veces este procedimiento. Eliminar el sobrenadante y agregar 2 mL de solución salina. Dializar las inmunoglobulinas en 2 litros de solución salina hasta el día siguiente. Repetir este proceso 3 veces a 4°C. Una vez dializado, colocar en viales. Realizar la lectura espectrofotométrica a 260 y 280 nm para conocer las densidades ópticas (DO). Realizar los cálculos correspondientes para conocer la concentración de la inmunoglobulina precipitada: Calcular la relación de la DO de 280/260 determinando el factor F según tabla. Sustituir los valores en la siguiente ecuación: Concentración de proteínas (mg/mL) = F x l/d x DO 280 d = ancho de la cubeta en centímetros DO = densidad óptica En la tabla siguiente se muestran algunos valores de R (280/260) y F. 4.4 CONJUGACIÓN POR EL MÉTODO DE PERYODATO DE SODIO 4.4.1 REACTIVOS (Véase Anexo N° 4) - Buffer Acetato de sodio 1mM, pH 4,4 - Buffer Bicarbonato de sodio 0,2 M, pH 9,5 18 - Buffer Carbonato-bicarbonato 0,01 M pH 9,5 Buffer Borato 0,1 M pH 7,4 Peryodato de sodio 0,01 M Borohidruro de sodio Horseradish Peroxidase (HRP) tipo VI Glicerol 4.4.2 EQUIPOS Y MATERIALES - Dispensador automático Agitador magnético Micropipeta graduable Barra magnética Refrigeradora Material de vidrio Viales Membrana parafilm Tubo de diálisis Puntas para micropipeta 4.4.3 PROCEDIMIENTO - - - Disolver 8 mg de HRP en 1 mL de agua destilada y colocarlo en un beaker estéril. Añadir lentamente 200 μL de peryodato de sodio y homogenizar con ayuda de agitador magnético a temperatura ambiente por 20 minutos. Dializar la mezcla en buffer acetato de sodio a 4°C hasta el día siguiente. Añadir 20 μL de buffer bicarbonato de sodio a la peroxidasa. Adicionar 1 mL de inmunoglobulinas a concentración de 10 mg/mL (previamente dialisadas con buffer carbonato-bicarbonato por dos horas a temperatura ambiente con ayuda del agitador magnético). Adicionar 100 μL de borohidruro de sodio recién preparado a la mezcla y mantener en agitación por 2 horas a 4°C. Dializar la mezcla con buffer borato hasta el día siguiente a 4°C. Para separar el conjugado del no conjugado, pasar la mezcla por una columna de Sephadex G-200 equilibrada con buffer borato. Determinar los valores de densidad óptica de cada fracción, a 280 y 403 nm, colectando aquellas donde coincidan los valores máximos para ambas longitudes de onda. Agregar Albúmina Bovina (AB) para una concentración final de 1% y glicerol a igual volumen del conjugado. Determinar el título del conjugado mediante la técnica ELISA. Repartir en pequeños volúmenes y almacenar a -20°C. 19 CAPÍTULO V PRUEBA DE HEMAGLUTINACIÓN (HA) 5.1 OBJETIVO Determinar las unidades hemaglutinantes del antígeno. 5.2 ASPECTOS GENERALES Esta prueba generalmente se emplea en Arbovirosis para determinar la presencia de partículas virales (antígeno) debido a la presencia de aglutininas a nivel de proteínas de envoltura (E) que van a interactuar con los receptores de la membrana de los hematíes de ganso a determinado pH. 5.3 REACTIVOS (Véase Anexo N° 5) - Antígeno preparado por el método de sacarosa-acetona Solución de Alsever Hematíes de ganso adulto, macho Solución Stock de Buffer (monobásico, dibásico) Solución Stock de Borato Salina pH 9 (BS) Solución albúmina bovina (AB) fracción V al 0,4% en borato salina (BS) pH 9 (ABBS) Solución suero fisiológico (NaCl al 0,9%) Desinfectante 5.4 EQUIPOS Y MATERIALES - Estufa regulada a 37°C Congeladora de -70°C ó de -20°C Refrigeradora Centrífuga refrigerada Balanza analítica Dispensador automático Potenciómetro Espejo bicóncavo Mechero Micropipeta multicanal (12) de 25-250 μL Micropipetas graduadas de 2-20 μL y 20-200 μL Dispensador automático Placas de poliestireno de 96 cavidades fondo en U Puntas según modelo de micropipetas Gradilla para tubos de prueba Propipetas Recipiente para descartar Papel filtro Material de vidrio Viales Bandeja con hielo En caso de no tener micropipetas se pueden usar: - Asas microdilutoras de 25 y 50 μL - Microgoteros de 25 μL y 50 μL 20 5.5 FUNDAMENTO DEL MÉTODO DE HEMAGLUTINACIÓN 5.6 PROCEDIMIENTOS 5.6.1 OBTENCIÓN DE HEMATÍES DE GANSO - - - Tener un ganso adulto, macho (las hembras no se utilizan ya que los cambios en el ciclo hormonal pueden cambiar los títulos hemaglutinantes), de preferencia realizar el sangrado como mínimo una vez por semana. Extraer sangre de la vena radial del ganso, empleando una jeringa con aguja N°20. Colectar la cantidad necesaria para la prueba (1 parte de sangre + 3 de Alsever). Guardar la sangre de ganso a 4°C. No debe utilizarse pasados los 10 días. Lavar el volumen de sangre requerido para la prueba, 3 veces con solución salina. Centrifugar a 1500 r.p.m. por 10 minutos a 4°C. Una vez lavados los hematiés de ganso, resuspender al 0,5% con cada uno de los buffers de los diferentes pH. (Véase Anexo N°5). Comprobar su densidad óptica empleando filtro de 490 nm (DO óptima es de 0,75). 5.6.2 TITULACIÓN DE ANTÍGENO POR LA PRUEBA DE HEMAGLUTINACIÓN (HA) - Rotular la microplaca con los diferentes pH y antígenos a trabajar, las que deben mantenerse frías sobre un recipiente que contenga hielo. Rehidratar el antígeno liofilizado con agua destilada estéril y mantener a 4°C por 1 hora; luego almacenar a-70°C. Añadir 25 μL de diluyente (ABBS) a todos los pozos de la placa, a partir de la segunda columna. (Ver esquema). Realizar la dilución 1:10 del antígeno a titular (100 μL del Ag + 900 μL de ABBS). Repartir 50 μL a todos los pozos de la primera columna de la placa. Hacer diluciones al doble comenzando por la primera columna utilizando pipeta multicanal o asas dilutoras de 25 μL. Añadir 25 μL de la suspensión de hematíes de ganso al 0,5% con cada uno de los diferentes pH a los respectivos pozos. Incubar a 37°C, o a temperatura ambiente, por 30 minutos. Realizar la lectura. 21 5.7 LECTURA E INTERPRETACIÓN Para determinar el título hemaglutinante y su pH óptimo del antígeno empleado se consideran, como punto final la dilución más alta que muestra aglutinación completa, denominándose una unidad hemaglutinante (uHA). Ejemplo: 1: 2,560 .................... 1 uHA/25 μL 1: 1,280 .................... 2 uHA/25 μL 1: 640 ....................... 4 uHA/25 μL 1: 320 ....................... 8 uHA/25 μL 1: 160 ..................... 16 uHA/25 μL Para la prueba de Inhibición de la Hemaglutinación se emplea antígeno con 4 u 8 unidades hemaglutinantes, es decir, que son válidas las diluciones de 640 y 320 por cada 25 μL de antígeno. Nota: Para la prueba de ELISA emplear antígeno a 16 uHA. Patrón de Hemaglutinación: - No hemaglutinación: los glóbulos rojos sedimentan en el fondo del pozo observándose como un botón. Hemaglutinación parcial: se observa en el centro un anillo de células aglutinadas, no se lee como punto final de la hemaglutinación. Hemaglutinación completa: los glóbulos rojos forman una capa fina y bien distribuida en el pozo, se lee como punto final de la hemaglutinación. 22 CAPÍTULO VI PRUEBA DE INHIBICIÓN DE LA HEMAGLUTINACIÓN (IH) 6.1 OBJETIVO Detectar anticuerpos totales de los diferentes grupos antigénicos. 6.2 ASPECTOS GENERALES La prueba de IH se fundamenta por la reacción del antígeno hemaglutinante con su anticuerpo específico, produciendo una inhibición de la actividad hemaglutinante. Esta prueba se emplea para clasificar a los Arbovirus en grupos antigénicos, asÍ como para conocer el tipo de respuesta ante una infección. 6.3 REACTIVOS (Véase Anexo N° 5) - Antígeno preparado por el método de sacarosa – acetona Suero control positivo y negativo de referencia Solución de Alsever Hematíes de ganso adulto, macho Solución Stock de buffer (monobásico, dibásico) Solución Stock borato salina pH 9 (BS) Solución albúmina bovina (AB) fracción V al 0,4% en borato salina (BS) pH 9 (ABBS) Solución kaolín al 25% en BS. Solución suero fisiológico (NaCl al 0,9%) Desinfectante 6.4 EQUIPOS Y MATERIALES - Congeladora de -70ºC ó de -20°C. Refrigeradora Centrífuga refrigerada Balanza analítica Dispensador automático Potenciómetro Espejo bicóncavo Estufa regulada a 37°C Mechero Micropipeta multicanal (12), de 25-250 μL Micropipeta graduadas de 2-20 μL y 20-200 μL Placas de poliestireno de 96 cavidades fondo en U Puntas según modelo de micropipetas Gradilla para tubos de prueba Propipetas Dispensador automático Material de vidrio Viales Papel de filtro Bandeja con hielo Recipiente para descartar En caso de no tener micropipetas se pueden usar: - Asas microdilutoras de 25 y 50 μL - Microgoteros de 25 y 50 μL 23 6.5 PROCEDIMIENTOS 6.5.1 TRATAMIENTO DE SUEROS CON KAOLIN Rotular los tubos de prueba y colocar 100 μL de sueros problema Añadir 400 μL de solución borato salina (BS). Agregar 500 μL de solución de kaolín (elimina los inhibidores inespecíficos) Incubar a temperatura ambiente por 25 minutos y agitar cada 10 minutos. Centrifugar a 2000 r.p.m. durante 25 minutos a 4°C. Adicionar 25 μL de hematíes de ganso al 50% lavados con suero fisiológico por 3 veces (elimina las aglutininas inespecíficas). Incubar a temperatura ambiente por 25 minutos a 4°C. Centrifugar a 2000 r.p.m. durante 25 minutos a 4°C. Transferir el sobrenadante a otro tubo. La dilución final del suero tratado es 1:10. - 6.5.2 PRUEBA DE INHIBICIÓN DE LA HEMAGLUTINACIÓN (IH) 6.5.2.1 FUNDAMENTO DE LA PRUEBA DE INHIBICIÓN DE LA HEMAGLUTINACIÓN 6.5.2.2 CONTROLES La prueba debe contener los siguientes controles: - Control de suero positivo (no debe variar el título indicado), contiene suero + diluyente + antígeno + suspensión de hematíes. - Control de suero negativo (no debe tener ninguna reacción), contiene suero + diluyen te + antígeno + suspensión de hematíes. - Control de suero tratado (permite observar la optimicidad del tratamiento), contiene suero + diluyente + suspensión de hematíes. - Control de antígeno (indica si las unidades HA empleadas son las correctas), contiene diluyente + antígeno + suspensión de hematíes. Denominado titulación simultánea (T.S.). - Control de suspensión de hematíes (permite observar reacción de aglutinación inespecífica), contiene diluyente + suspensión de hematíes. 6.5.2.3 DILUCIONES Y TITULACION - - Rotular la microplaca con el número de sueros problema y el antígeno a utilizar. Adicionar 25 μL de diluyente (ABBS) a todos los pozos, a partir de la segunda columna. Añadir 50 μL de sueros tratados y sueros controles en los respectivos pozos de la primera columna, y 25 μL en los pozos de la última columna. Diluir al doble con micropipeta multicanal de 25 μL hasta la penúltima columna. Agregar a todos los pozos 25 μL de antígeno con las 4 u 8 unidades HA (conservadas en recipiente con hielo), excepto a la última columna. En la última fila de la placa, realizar la titulación simultánea agregando al primer pozo 50 μL del antígeno empleado, hacer diluciones al doble. Luego adicionar 25 μL de la suspensión de hematíes con el pH óptimo. Agitar e incubar a temperatura ambiente por 45 minutos. Añadir 50 μL de la suspensión de hematíes de ganso con el pH óptimo del antígeno a todas los pozos de la placa, excepto a los de la titulación simultánea. 24 - Agitar y dejar reposar a 37°C, o a temperatura ambiente por, 30 minutos. Realizar la lectura. 6.5.3 LECTURA E INTERPRETACIÓN Para dar validez a la prueba, verificar la lectura de la titulación simultánea del antígeno empleado. El título inhibidor de la hemaglutinación es la mayor dilución de cada suero que produce inhibición completa. 6.5.3.1 Patrón de IH - No inhibición: sin niveles detectables de anticuerpo (negativo). Los glóbulos rojos forman una capa fina y bien distribuida en el pozo. - Inhibición completa: presencia de niveles de anticuerpo (positivo). Los glóbulos rojos sedimentan en el pozo observándose un botón. 6.5.3.2 Variedad de respuesta sexológica - Respuesta primaria: cuando el individuo se pone en contacto por primera vez con el virus; ejemplo: Familia Flaviviridae. - Respuesta secundaria: cuando el individuo se pone en contacto por segunda vez con otro virus de la misma familia. Según OMS : Títulos < 1 : 1280 respuesta primaria Títulos > 1 : 1280 respuesta secundaria - Respuesta monotípica: incremento del título de anticuerpos hasta 4 veces o más para uno de los determinantes antigénicos; ejemplo: serotipos de virus Dengue. - Respuesta heterotípica: incremento del título de anticuerpos hasta 4 veces o más para uno de los determinantes antigénicos; ejemplo: un serotipo de virus Dengue y otro género de la familia Flaviviridae. - Resultado no concluyente: cuando el nivel de anticuerpo es bajo es necesario una segunda muestra. 25 CAPÍTULO VII ELISA DE CAPTURA DE IgM (MAC-ELISA) 7.1 OBJETIVO Detección temprana de anticuerpos de tipo IgM en respuesta a una infección reciente. 7.2 ASPECTOS GENERALES El sistema de inmunoensayo enzimático sobre fase sólida (ELISA) ha sido utilizado como método para diagnóstico serológico en un gran número de enfermedades virales. Uno de los métodos aplicados es el de captura de IgM, empleado para demostrar infecciones actuales o recientes. Para ello se emplean inmunoglobulinas anti IgM humana fijadas en las cavidades de los pozos de la placa, lo cual formará el complejo Ag-Ac por la unión de la inmunoglobulina marcada con enzima peroxidasa. La cuantificación de la actividad enzimática se realiza por la adición del sustrato produciendo coloración. Es importante señalar el empleo de placas de poliestireno (inmulón II), siendo de mejor calidad, lo que permite separar fácilmente los reactantes libres en el proceso de los lavados. 7.3 REACTIVOS (Véase Anexo N° 6) - Antígeno preparado por el método sacarosa-acetona Control normal de Ag (CRL obtenido por método sacarosa - acetona) Sueros controles positivos y negativos de referencia Igs anti IgM humana, purificada (fracción μ) Conjugado - peroxidasa Suero Humano Normal (SHN) Albúmina Bovina (AB) fracción V Buffer carbonato-bicarbonato pH 9,5 Buffer fosfato salina (PBS) Buffer fosfato citrato pH 5 Orto phenylene diamine (OPD) Peróxido de hidrógeno Twen 20 Ácido sulfúrico 2N Solución de sustrato 7.4 EQUIPOS Y MATERIALES - Lector de placa o de tira Lavador o bomba de vacío Estufa regulada a 37° C. Congeladora de -70 C ó -20 C Refrigeradora Potenciómetro Dispensador automático Placas de poliestireno fondo plano Inmulón II® Dispensador automático Micropipeta multicanal 20-200 μL Micropipeta graduada 2-20 μL y 20-200 μL Puntas, según micropipetas Material de vidrio Viales Gradillas para tubos Papel de filtro Cubetas Desinfectante 26 7.5. FUNDAMENTO DE LA PRUEBA DE ELISA 7.6 PROCEDIMIENTOS PARA LA PRUEBA DE ELISA 7.6.1 Sensibilización de la placa - Impregnar los pozos con 100 μL de Igs anti IgM humanas (previa titulación); ejemplo: dilución 1:200 con buffer carbonato-bicarbonato pH 9,5, dejando libre el primer pozo como control blanco. Incubar la placa hasta el día siguiente a 4°C en cámara húmeda. En caso de no realizar la prueba ese mismo día, absorber el contenido de los pozos y sellar la placa completamente para ser almacenada a 20°C hasta el momento de su uso (tiempo máximo un año). Rotular correctamente la placa sensibilizada y lavar por cinco veces con PBS + Tween al 0,05%. 7.6.2 Reacción de bloqueo - Agregar 150 μL de buffer carbonato-bicarbonato + AB al 4% a todos los pozos. Incubar en cámara húmeda a 37° C por 30 minutos. Lavar la placa por cinco veces. 7.6.3 Adición de suero, antígeno y conjugado - - - Adición de suero: Los sueros son diluidos a 1:40 con PBS + AB al 0.5%. Distribuir 50 μL de suero control positivo (1), controles negativos (4) y los sueros problema en las filas correspondientes para el antígeno (Ag) y control normal de Ag (CNAg). (Ver esquema). Incubar en cámara húmeda a 37° C por dos horas. Lavar la placa por cinco veces. Adición de antígeno: El antígeno es diluido con PBS + AB al 2% + SHN al 2%, conteniendo 16 uHA. Distribuir 50 μL del Ag a las filas correspondientes. De igual modo proceder para el CNAg. Incubar en cámara húmeda a 4°C hasta el día siguiente. Lavar la placa por cinco veces. Adición de conjugado: El conjugado es diluido con PBS + AB al 2% a la concentración óptima. Ejemplo: conjugado 6B6C-l (anticuerpo monoclonal grupo Flavivirus) a dilución 1:6000. Distribuir 25 μL de conjugado a todos los pozos, con excepción del control de sustrato. Incubar en cámara húmeda a 37°C por una hora. Lavar la placa por siete veces. 7.6.4 Revelado - Agregar 100 μL de la solución de sustrato a todos los pozos e incubar en cámara oscura a temperatura ambiente por 30 minutos. 27 - Detener la reacción con la adición de 100 μL ácido sulfúrico 2N. Realizar la lectura inmediatamente al espectrofotómetro a 492 nm. 7.6.5 LECTURA Lectura Visual: - El control positivo presenta color El control negativo no presenta color Los C.C y C.S no presentan color Los pozos de CNAg no presenta color. 28 29 7.8 INTERPRETACIÓN - Se considera positivo cuando IR > 1. - Se considera negativo cuando IR< 1. - En caso de obtener IR cercano a 1, realizar una dilución mayor 1:100. En caso de repetirse los valores, solicitar segunda muestra. 30 CAPÍTULO VIII DIAGNÓSTICO VIROLÓGICO Para realizar el diagnóstico virológico, primero debe efectuarse el aislamiento viral utilizando un huésped vivo de cualquiera de los sistemas biológicos: cultivos celulares, animales de laboratorio o huevos embrionados, siendo característico para cada virus. La identificación y tipificación del virus puede hacerse por la prueba de Inmunofluorescencia (IF) y/o Neutralización (Nt), empleando fluidos ascíticos de ratón o anticuerpos monoclonales específicos. 8.1 CULTIVO CELULAR En Virología el cultivo de células es el sistema más empleado para el aislamiento y replicación de virus. 8.2 TIPOS DE CULTIVOS CELULARES 8.1. Cultivos Primarios: Las células presentan el mismo cariotipo (características cromosómicas específicas de un individuo o especie) del tejido que le dio origen. 8.2. Cultivos Secundarios: Son cultivos celulares que se mantienen in vitro por pasajes sucesivos, pueden ser diploides (75% de las células tienen el mismo cariotipo del tejido original) o heterodiploides (25% de células con igual cariotipo del tejido original) con un potencial de sub-cultivos indefinidos. Dentro de cada línea celular pueden establecerse clones celulares, que son poblaciones derivadas de una sola célula de esa línea celular. En los últimos años se han desarrollado una serie de líneas celulares de mosquitos, que han resultado ser mucho más sensibles que las líneas celulares producidas de mamíferos, para los estudios de Arbovirosis. - Línea celular C6-36 : La línea celular C6-36 es un clone obtenido de glándulas salivales del mosquito Aedes albopictus. - Línea celular TRA-284-SF: Es una sublínea de la TRA-284, obtenida del mosquito Toxorhynchites amboinensis - Línea celular AP-61: La línea celular AP-61 obtenida de mosquito Aedes pseudoscutellaris - Línea celular de mamíferos *VERO : Línea celular obtenida de riñón de mono verde africano Cercopithecus aethiops *BHK-21: Línea celular obtenida de riñón de Hámster lactante. *LLCMK2: Línea celular obtenida de riñón de mono Rhesus Macaca mulatta. 8.3 TIPOS DE CRECIMIENTO CELULAR Las células se desarrollan sobre una superficie formando monocapa celular o en suspensión. - Cultivos en monocapa: Las células se adhieren a una superficie sólida (vidrio, plástico) formando una capa celular que puede ser observada en el microscopio. Para el mantenimiento de la línea celular se realiza sub-cultivos (pasajes). - Cultivos en suspensión: Las células proliferan sin adherirse a una superficie. Los subcultivos se realizan por dilución de las suspensiones celulares. 31 8.4 CONDICIONES IMPORTANTES PARA EL CRECIMIENTO DE CULTIVO CELULAR Para el crecimiento y mantenimiento de las líneas celulares se debe considerar: a. Empleo adecuado de material de soporte: - Plásticos de poliestireno, policarbonato, polipropileno, etc., estériles y descartables. - Vidrios de calidad de carbonato de sodio y borosilicato. Son esterilizados por calor seco. b. Medio de cultivo: De crecimiento: suplementado con 10% de suero bovino fetal que favorece el desarrollo celular. De mantenimiento: suplementado con 2% de suero bovino fetal para mantener viables las células durante un tiempo más largo, pero no permite su crecimiento. Mantiene la sobrevivencia de la célula in vitro debido a la presencia de: Gases: La vida de la célula depende de la presencia de CO2 y O2 - Presión osmótica: Los iones inorgánicos junto con la glucosa influyen directamente. - pH: La célula permite una variación de pH 6,8 - 7,8. Se emplean el carbonato de sodio y HEPES. - Carbohidratos: Proveen la energía necesaria para el desarrollo de las células. - Iones inorgánicos: Los iones (Na, K, Ca, Mg, Cl, PO4, CO3) son necesarios para mantener la presión osmótica y el pH. - Aminoácidos: Son importantes para la formación de las proteínas. - Vitaminas: Pequeñas cantidades son esenciales para las células. - Suero: Se emplean como fuente de factores de crecimiento y diferenciación celular. - Agua: Se debe emplear agua bidestilada, deionizada y estéril. - Antibióticos: No son necesarios para el crecimiento de las células. c. Temperatura El crecimiento y mantenimiento de las líneas celulares tiene una temperatura óptima que oscila entre 20 a 38° C, según la especie. 8.5 AGENTES DE DISPERSIÓN CELULAR La separación de la monocapa celular puede realizarse por procedimientos mecánicos o mediante tratamiento enzimático utilizando la Tripsina-EDTA. 8.6 CONSERVACIÓN DE CÉLULAS Para la criopreservación de las células se emplean sustancias químicas que, por congelamiento lento, impiden la formación de grandes cristales de hielo que rompan las estructuras celulares; ejemplo: dimetilsulfóxido (DMSO). Sus ventajas: - Elimina la necesidad de subcultivar en períodos en que no se trabaja. - Reduce el riesgo de pérdidas de líneas celulares por contaminación bacteriana. - Permite trabajar con pasajes bajos. 8.7 MULTIPLICACIÓN DE LAS LÍNEAS CELULARES 8.7.1 Línea Celular C6-36 8.7.1.1 Objetivo: Mantener el crecimiento de la línea celular. 8.7.1.2 Reactivos (Véase Anexo N° 8) - Medio de crecimiento - Buffer fosfato salina (PBS) - Azul de tripan o cristal violeta 8.7.1.3 Equipos y materiales - Cabina de Flujo Laminar 32 - Dispensador automático Cámara de Neubauer Estufa 28°C Refrigeradora Microscopio invertido Monocapa celular C6-36 Cell scraper Frascos para cultivo Material de vidrio Alcohol 70° Gasas estériles Recipiente para descartar 8.7.1.4 Procedimiento - Con ayuda del microscopio observar la monocapa confluente del frasco de cultivo que va a ser empleado para la multiplicación celular, luego proceder a eliminar el medio de cultivo. Lavar 2 veces con PBS, muy suavemente. Desprender las células con cell scraper. Añadir 10 mL del medio de crecimiento para resuspender delicadamente hasta separar las células (si se usa más de un frasco, juntar en un solo envase). Realizar el contaje de células. (Véase Anexo 9) Para formar la monocapa en tres días, obtener a concentración de 5-6 x 105 células/mL Completar con medio de crecimiento y luego repartir la suspensión celular en frascos de cultivo. Incubar a 28°C. Una vez formada la monocapa, replicar nuevamente. 8.7.2 Línea Celular VERO 8.7.2.1 Objetivo: Mantener el crecimiento de la línea celular. 8.7.2.2 Reactivos (Véase Anexo N° 8) - Medio de crecimiento Buffer fosfato salina (PBS) Azul de tripan o cristal violeta Tripsina-EDTA 8.7.2.3 Equipos y materiales - Cabina de Flujo Laminar Dispensador automático Cámara de Neubauer Estufa regulada a 37°C Microscopio invertido Refrigeradora Monocapa celular VERO Frascos para cultivo Material de vidrio Alcohol 70° Gasas estériles Recipiente para descarte 8.7.2.4 Procedimiento - Realizar la multiplicación celular a partir de un frasco de cultivo con monocapa confluente. Decantar el medio de cultivo y lavar 2 veces con PBS. Añadir Tripsina-EDTA (volumen depende del frasco de cultivo) cubriendo la monocapa celular y eliminar inmediatamente. Agregar nuevamente Tripsina y dejar por algunos minutos en la estufa a 37°C. Una vez desprendida la monocapa celular, añadir 10 mL de medio de crecimiento y resuspender 33 - vigorosamente. Realizar el contaje de células. Completar con medio de crecimiento para obtener una concentración de 3 x 105 células/mL y luego distribuir la suspensión celular en frascos de cultivo. Incubar a 37°C. Una vez formada la monocapa, replicar nuevamente. 8.7.3 Línea Celular BHK-21 y LLCMK2 8.7.3.1 Objetivo: Mantener el crecimiento de la línea celular. 8.7.3.2 Reactivos - Medio de crecimiento Buffer fosfato salina (PBS) Azul de tripan o cristal violeta Tripsina-EDTA 8.7.3.3 Equipos y materiales - Cabina de Flujo Laminar Dispensador automático Refrigeradora Cámara de Neubauer Estufa regulada a 37°C Microscopio invertido Monocapa celular Frascos para cultivo Material de vidrio Alcohol 70° Gasas estériles Recipiente para descarte 8.7.3.4 Procedimiento Realizar la multiplicación celular del modo indicado para la línea celular VERO. 8.8 CONGELAMIENTO DE CELULAS 8.8.1 Reactivos (Véase Anexo N° 8) - Tripsina EDTA Medio de crecimiento Buffer fosfato salina (PBS) Dimetil sulfóxido (DMSO) 8.8.2 Equipos y materiales - Microscopio invertido Cabina de flujo laminar Contenedor de nitrógeno líquido Congeladoras de -20 y -70° C Refrigeradora Dispensador automático Cámara de Neubauer Monocapa celular Cell scraper Viales o criotubos Materia de vidrio Recipiente para descartar 34 - Gasa estéril Alcohol 70° 8.8.3 Procedimiento - - Seleccionar un frasco de cultivo con monocapa confluente Realizar los pasos indicados para la multiplicación celular hasta el contaje de células. Obtener una concentración de 5 x 105 células/mL. En un tubo estéril sumergido en un recipiente con hielo, realizar la mezcla a congelar a la siguiente proporción: 7 mL de suspensión celular 2 mL de suero bovino fetal 1 mL de DMSO. Homogenizar con cuidado y distribuir 1 mL en los criotubos estériles. Rotular correctamente. Pasar los viales a una caja de poliespuma y guardarlos a -4°C por 30 minutos; pasar luego a -20°C por 30 minutos y posteriormente a -70°C hasta el día siguiente. Finalmente, guardar en el contenedor de nitrógeno líquido hasta el momento de su uso. 8.9 DESCONGELAMIENTO DE CÉLULAS: 8.9.1 Reactivos (Ver Anexo N° 8) Medio de crecimiento 8.9.2 Equipos y materiales - Microscopio invertido Cabina de Flujo Laminar Dispensador automático Centrífuga refrigerada Estufa Criotubos conteniendo células congeladas Frascos de cultivos Termómetro Material de vidrio Tubos cónico de centrífuga Frasco para descartar 8.9.3 Procedimiento - Preparar un beaker con agua a una temperatura de 37°C. Extraer del tanque de nitrógeno líquido un vial conteniendo células y colocarlo rápidamente en el beaker. Desinfectar con alcohol el vial. Transferir el contenido a un tubo cónico y centrifugar al 000 r.p.m. por 10 minutos. Eliminar el sobrenadante. Resuspender las células con un volumen apropiado de medio para crecimiento. Incubar a temperatura óptima, según la línea celular. Luego de 24 horas, si es necesario, cambiar el medio de crecimiento. 35 CAPÍTULO IX AISLAMIENTO VIRAL 9.1 OBJETIVO Recuperar partículas virales a partir de muestras problemas y empleando sistemas biológicos para el aislamiento y replicación viral. 9.2 PROCESAMIENTO DE MUESTRAS Durante todos los procesos trabajar las muestras en un recipiente con hielo, luego almacenar a -70°C hasta el momento de su inoculación. 9.2.1 Reactivos (Véase Anexo N°8) - Medio de mantenimiento Buffer fosfato salina (PBS) Albúmina bovina (AB) Alcohol yodado Desinfectante 9.2.2 Equipos y materiales: - Cabina de flujo laminar Dispensador automático Congeladora de -70°C Refrigeradora Centrífuga refrigerada Homogenizador Viales Material de vidrio Homogenizador de vidrio (grinder) Bandeja para descartar 9.2.3 Procedimientos según tipo de muestra 9.2.3.1 Suero: Diluir a 1:5 con medio de mantenimiento o PBS + AB al 2%. 9.2.3.2 Tejido: - Empleando un mortero estéril frío, triturar 1gr. de tejido Adicionar 9 mL de medio de mantenimiento o PBS + AB al 2%, homogenizar y verter a un tubo cónico. Centrifugar a 10000 r.p.m. por 30 minutos a 4°C. Filtrar el sobrenadante y alicuotar. 9.2.3.3 Vector (mosquito): - - La obtención de mosquitos adultos se realiza por diversos métodos de captura, luego son clasificados y almacenados a -70° C hasta su procesamiento. (Véase Manual de Obtención y Envío de Muestras, INS.) Extraer de la congeladora los viales conteniendo mosquitos, trabajar por grupos de especie. Adicionar 2 mL de PBS + AB al 2% para su lavado, dejar incubar por 1 hora a 4°C; luego aspirar todo el PBS. Homogenizar en grinder con medio de mantenimiento o PBS a la siguiente proporción: 36 < 25 mosquitos ...................... 2,5 mL 25 -50 mosquitos ...................... 5,0 mL > 50 mosquitos ..................... 7,5 mL - Centrifugar a 10000 r.p.m por 30 minutos a 4°C. Filtrar el sobrenadante y alicuotar. 9.3 INOCULACIÓN EN CULTIVO CELULAR 9.3.1 Reactivos (Véase Anexo N°8) - Medio de crecimiento Medio de mantenimiento Tripsina-EDTA Buffer fosfato salina (PBS) Alcohol 70° Desinfectante 9.3.2 Equipos y materiales: - Microscopio invertido Cabina de flujo laminar Dispensador automático Congeladora -70° C Refrigeradora Centrífuga refrigerada Micropipeta graduable Homogenizador Puntas, según micropipeta Monocapa celular Cell scraper Tubos 16 x 125 con tapa de rosca (cultivo celular) Tapones de jebe para tubos de cultivo Gradilla para tubo de cultivo Viales Material de vidrio Bandeja para descartar 9.3.3 Procedimiento - A partir de un frasco de cultivo con monocapa confluente de C6-36 y VERO, preparar la suspensión celular a concentración de 2 - 3 x 105 células/mL. Distribuir 1 mL de la suspensión celular a todos los tubos de la gradilla correspondiente para sembrar las líneas celulares, luego colocar los tapones de jebe. Incubar a 28°C (C6-36) y 37°C (VERO). Pasadas las 24 horas, rotular los tubos con los códigos de la muestra a inocular. Eliminar el medio de crecimiento, luego inocular por duplicado 100 μL de muestra procesada a los tubos correspondientes. Dejar en absorción por 30 minutos. Adicionar 1 mL de medio de mantenimiento y colocar los tapones a presión. Incubar a la temperatura indicada. Observar y dar lectura diaria (tiempo máximo 15 días). 37 - Si presenta efecto citopático (ECP), congelar a-70° C. Para realizar la identificación-tipificación viral es necesario realizar un pasaje en la misma línea celular o en una más susceptible. 9.4 INOCULACIÓN EN RATONES LACTANTES: Para los Arbovirus se emplean ratones lactantes (RL) de 24-48 horas de nacido, cepa albina suiza en buenas condiciones. 9.4.1 Reactivos - Medio de mantenimiento Buffer fosfato salina (PBS) Albúmina bovina (AB) Alcohol yodado 9.4.2 Equipos y materiales - Cámara de flujo laminar Congeladora -70°C Centrífuga refrigerada Jaulas conteniendo ratones lactantes (RL) Equipo de disección Jeringa de tuberculina Viales Material de vidrio Recipiente con hielo 9.4.3 Procedimiento - - Controlar si los RL se encuentran en buenas condiciones. Rotular dos jaulas por muestra con su código respectivo. Colocar en la mesa de trabajo los RL y limpiar la cabeza con alcohol yodado. Inocular a cada ratón por vía intracerebral 0,02 mL de las muestras procesadas. Controlar diariamente los ratones inoculados (tiempo máximo 20 días). Si presentan síntomas relacionados al sistema nervioso central, como parálisis de miembros, descoordinación motora e hipersensibilidad; o cambios ligeros como erizamiento de pelo y diarrea, colocarlos en bolsas de plástico resistente, rotular y congelar a -70°C (incluir los ratones muertos recientemente). Realizar un pasaje en el mismo sistema en otro más susceptible. 9.4.3.1 Procesar los cerebros como se indica a continuación: - Sacar de la congeladora de -70°C los ratones lactantes infectados y colocar en la mesa de trabajo. Limpiar con alcohol yodado la zona de la cabeza. Extraer los cerebros de cada ratoncito por succión empleando jeringa fría. Verter en el tubo de centrífuga y adicionar el medio de mantenimiento o PBS frío para tener una concentración de 10%. Centrifugar a 5000 r.p.m. por 30 minutos a 4°C. Recolectar el sobrenadante y alicuotar. Inocular en RL, controlar y dar lectura diaria. 9.4.3.2 Observación: - Los ratones lactantes no deben morir a las 24 horas de inoculados; en caso de suceder, volver a inocular. Realizar la identificación-tipificación viral por pruebas de IFI y Nt. 38 CAPÍTULO X PRUEBAS DE IDENTIFICACIÓN – TIPIFICACIÓN VIRAL 10.1 PRUEBA DE IMNUNOFLUORESCENCIA (IF) La inmunofluorescencia es un método rápido basado en la unión inmunológica de un anticuerpo marcado con fluorocromo a su antígeno homólogo. El fluorocromo de más aplicación es el Isotiocianato de Fluoresceina (FITC). La identificación viral puede realizarse por el método directo o indirecto, siendo éste último más sensible porque permite trabajar con variedades de anticuerpos primarios. 10.2 PREPARACIÓN DEL SUSTRATO ANTIGÉNICO EN RATÓN 10.2.1 Reactivos - Acetona a -20°C Alcohol yodado 10.2.2 Equipos y materiales - Cabina de flujo laminar Microscopio para IF Congeladora -20° y -70°C Refrigeradora Equipo de disección Cerebro de RL infectado Papel de filtro Láminas de IF de 12 ó 24 pozos Koplin Portaláminas Material de vidrio Recipiente para descartar 10.2.3 Procedimiento - Para realizar las improntas en las láminas, de preferencia procesar los ratones recientemente muertos. Con el equipo de disección, extraer el cerebro de los RL y colocar una porción sobre el papel de filtro. Rotular las láminas adecuadamente. Realizar improntas (2 láminas x muestra) presionando suavemente el papel de filtro sobre los pozos de las láminas para formar una monocapa delgada de células. Dejar secar las láminas a temperatura ambiente. Colocar las láminas en koplin y añadir acetona fría. Incubar por 30 minutos a -20°C para su fijación. Retirar las láminas y guardar en portaláminas a temperatura de -70°C hasta el momento de la prueba. 10.3 PREPARACIÓN DEL SUSTRATO ANTIGÉNICO EN CÉLULAS: Para utilizar las células como sustrato antigénico deben ser inoculados como está establecido para cada línea celular, teniendo en cuenta sus requerimientos individuales. 10.3.1 Reactivos - Buffer fosfato salina (PBS) 39 - Tripsina Acetona a -20°C 10.3.2 Equipos y materiales - Cabina de flujo laminar Microscopio invertido Congeladora -20° y-70° C Homogenizador Micropipetas graduables Monocapa celular infectada Puntas, según micropipeta Pipeta Pasteur Láminas para IF de 12 ó 24 pozos Koplin Portaláminas Viales Material de vidrio Recipiente para descarte 10.3.3 Procedimiento - Trabajar con los tubos de cultivo que presenten ECP 2+. Eliminar el medio de cultivo y lavar 2 veces con PBS. Desprender la monocapa celular con tripsina, agregar 500 μL de PBS y homogenizar hasta separar los grumos celulares. Colocar 10 μL de la suspensión a un pozo de la lámina para observar la concentración de células. Una vez optimizado la concentración celular entre 30 - 40 células x campo, distribuir 10 μL a todos los pozos de la lámina (2 láminas correctamente rotuladas x muestra). Poner a secar las láminas a temperatura ambiente. Colocar las láminas en koplin y añadir acetona fría. Incubar por 30 minutos a -20°C para su fijación. Retirar las láminas y guardar en portaláminas a temperatura de - 70°C hasta el momento de la prueba. 10.4 PRUEBA INMUNOFLUORESCENCIA INDIRECTA (IFI): 10.4.1 Reactivos - Conjugado - FITC - Líquido Ascítico Hiperinmune de ratón (LAH) - Anticuerpo Monoclonal (AcM) - Buffer fosfato salino (PBS) - Azul de Evan's - Buffer glicerina 10.4.2 Equipos y materiales - Microscopio de IF Agitador magnético Ventilador Congeladora -70° C Estufa Koplin Laminillas Micropipetas graduables Puntas según micropipeta Láminas fijadas Viales Material de vidrio Recipiente para descartar 40 10.4.3 Procedimiento Ejemplo: virus Dengue - Sacar las láminas fijadas del congelador -70°C y dejar secar. Rehidratar los LAH y AcM y preparar la dilución óptima para la prueba con PBS. Adicionar 10 μL de PBS en los pozos de la primera columna (control negativo). Distribuir 10 μL de LAH y AcM a los pozos correspondientes. (Ver esquema). Incubar en cámara húmeda a 37°C por 45 minutos. Colocar las láminas en el koplin y lavar 2 veces con PBS empleando agitador magnético por 10 minutos (cambie de PBS). Sacar las láminas y dejar secar (el uso de un ventilador ayuda al proceso de secado). Agregar 10 μL de conjugado -FITC antiratón a concentración óptima + azul de Evan's 1:l000. Incubar en cámara húmeda a 37°C por 45 minutos. Lavar 2 veces con PBS. Secar cuidadosamente las láminas, agregar glicerina bufferada y colocar una laminilla Realizar la lectura usando microscopio de IF. 10.4.4 Lectura e Interpretación - POSITIVO Presencia de fluorescencia de color verde brillante en todo el citoplasma. - NEGATIVO Todas las células se observan de color rojo debido al empleo de contraste. 41 CAPÍTULO XI PRUEBA DE NEUTRALIZACIÓN 11.1 OBJETIVO - Determinar el título viral. Determinar la pérdida de la infectividad por la acción neutralizante del anticuerpo específico. 11.2 ASPECTOS GENERALES Para realizar la prueba de Neutralización (Nt) es necesario efectuar el pasaje de la muestra aislada, ya sea en la línea celular de VERO, BHK-21 y LLCMK-2. La prueba de Neutralización por el método de plaqueo permite conocer el título viral; mientras que el método por reducción de placas, permite la identificación viral y la detección de anticuerpos. 11.3 Reactivos (Véase Anexo N° 8) - Medio de crecimiento Medio Carboximetilcelulosa (CMC) Buffer fosfato salina (PBS) Tripsina – EDTA Naphthol Blue Black (NBB) 11.4 Equipos y materiales - Cabina de flujo laminar Microscopio invertido Incubadora de 37° C de CO2 Agitador magnético Homogenizador Micropipetas graduables Micropipeta multicanal (12) Monocapa celular BHK-21 Puntas para micropipeta Pipeta Eppendorf Jeringuilla Cornwall Placas para cultivo fondo plano de 96 pozos Placas para cultivo fondo plano de 24 pozos Material de vidrio 11.5 TITULACIÓN DE VIRUS DENGUE EN CÉLULAS BHK-21 - De un frasco de cultivo de 75 cm2 con monocapa confluente, realizar los pasos indicados para obtener la suspensión celular. Calcular el número de células necesarias para una concentración de 2,5 x 105 células/mL x 0,5 mL/pozo x 24 pozos x placa. Distribuir 500 mL de la suspensión celular a todos los pozos de la placa. Incubar a 37° C con CO2 al 5%. Inocular pasadas las 24 horas. Descongelar el virus a titular y conservar a baja temperatura. Preparar las diluciones de virus: Distribuir 900 μL de medio de mantenimiento a todos los tubos rotulados, desde 10-1 a 10-7; mantener en recipiente con hielo. Colocar 100 μL de virus al tubo 10-1 y homogenizar. Transferir con una nueva pipeta 100 μL del tubo 10-1 al siguiente tubo y así sucesivamente. Rotular la placa con monocapa celular (3 pozos por cada dilución). 42 - Inocular 50 μL de cada dilución viral a los pozos correspondientes. Incubar a 37° C con CO2 por 4 horas. Agregar 500 μL de medio CMC. Incubar a 37° C con CO2 por 7 días. Descartar el medio y lavar suavemente con agua corriente. Colorear las células con NBB. Adicionar 500 μL por pozo y dejar en incubación a temperatura ambiente por 10 - 15 minutos. Lavar con agua y dejar secar. Realizar la lectura. 11.6 LECTURA E INTERPRETACIÓN Contar las placas (puntos no coloreados por el NBB visibles en el fondo de cada pozo). Cada placa formada se conoce como Unidad Formadora de Placa (UFP). Para conocer el título viral se aplica la siguiente fórmula: UFP/mL = P x 20 x 10 P = Promedio del número de placas obtenido donde se realizó el conteo. 20 = Promedio del número de placa para virus Dengue. 10 = Representa el factor de dilución Reemplazando los valores: Título: 3 x 20 x 10-4 = 60 x 10-4 UFP/mL 11.7 NEUTRALIZACIÓN POR REDUCCIÓN DE PLACAS - Para conocer el título del suero, preparar en base 4 las diluciones de suero problema a utilizar, diluir con PBS y mantener a 4° C. 1:20 - - - 1:80 1:320 1:1280 Para screening una sola dilución determina la presencia o no de anticuerpos. Preparar la dilución de virus que contenga un aproximado de 15-20 UFP/50 μL (1:1000). Para esto se prepara una dilución de trabajo de 40 UFP/50 μL para que cuando se mezcle con el suero resulten las 20 UFP. Calcular el volumen de virus necesario de la dilución de trabajo multiplicando el número de suero a probar más los controles por 100 μL. Realizar la mezcla de virus - suero en microplacas de 96 pozos (el volumen de cada pozo debe ser suficiente para inocular por triplicado en la placa de 24 pozos), es decir 100 μL de virus + 100 μL de suero. Incubar a 37° C por una hora. Rotular una placa de 24 pozos con monocapa formada para control. 43 - 2 pozos para control de virus 1:1000 (100 μL de la dilución de virus 1:1000) 2 pozos para control de virus 1:100 (100 μL de la dilución del virus 1:100) 2 pozos para control de virus 1:10 (100 μL de la dilución del virus 1:10) 2 pozos para control de células (100 μL de PBS) Colocar la placa sobre hielo. Rotular la placa de 24 pozos con monocapa formada para la prueba. Inocular 50 uL de la mezcla virus suero por triplicado. Incubar a 37° C con CO2 por 4 horas. Añadir 500 uL de medio CMC a ambas placas. Incubar a 37° C con CO2 por 5 - 7 días y realizar la coloración explicada anteriormente. Realizar la lectura y cálculos. Calcular el promedio del número de placas en el control de virus. Calcular el porcentaje de reducción de placas para cada mezcla virus - suero en relación al promedio de control de virus. Ejemplo: 5/20 = 25% 100% - 25% = 75% de reducción Cuando el % de reducción es > 50% se considera que el suero problema es positivo (en screening y para la titulación del suero). 44 CAPÍTULO XII REFERENCIAS BIBLIOGRÁFICAS 1. Center for Disease Control. (1981). Dengue Laboratory Diagnostic Procedures for the Americas. July. San Juan, C.D.C. Puerto Rico, San Juan Laboratories. 160 págs. 2. Division of Vector-Borne Infectious Diseases. (1981). Center for Disease Control and Prevention: Procedures for detection of yellow fever viral antigen-antibody by capture enzyme inmunoassay. Atlanta, C.D.C. Fort Collins - Colorado - USA. 3. Instituto de Medicina Tropical Pedro Kouri. (1991). Manual de Laboratorio para Arbovirus. La Habana. 100 págs. 4. Universidad Nacional de Córdova. Instituto de Virología. Facultad de Ciencias Médicas. (1979). Metodología Básica del Laboratorio Virológico. Córdova. 41 págs. 5. Instituto Nacional de Diagnóstico y Referencias Epidemiológicas. Dr. Manuel Martínez Baez. (1993). Manual de Diagnóstico de Laboratorio de Enfermedades Febriles Exantemáticas. México. 114 págs. 6. Organización Mundial de la Salud. (1994). Manual de Bioseguridad en el Laboratorio. 2da. Edición. Ginebra, OMS. 149 págs. 7. Ruth, B.; Fornester, F.T. (1981) Basic Laboratory Techniques in Cell Culture. Atlanta Deparment of Health and Human Services. Centers for Health Services. 101 págs. 8. Clarke, D.H. and Cassals J. (1958). Techniques For Hemagglutination and Hemagglutination Inhibition with arthopod - borne viruses. Am. J. Trop. Med. Hyg. 7: 561-573. 9. Fields. (1995). Virology, vol. 1, 3ra. Edición. Philadelphia, Lippincott-Raven Publisher. 1504 págs. 10. Kuno G., Gubler D.J. et al. (1991). An ELISA procedure for the diagnosis of dengue infections. J. of Virol. Meth. 33:101-103. 11. Lennette E.H., Schmidt N.J. Eds. (1979). Diagnostic procedures for viral, rickettsial and chlamydial infections. 5th. Ed. Washington, American Public Health Association. 1200 págs. 12. Russell, P.K., Nisalak A. (1967). Dengue virus identification by the plaque reduction neutralization test. J. Inmunol. 99: 291-296. 13. Schmith, N.J. Emmons E.W. (1989). Diagnostic procedures for viral, Rickettsial and Chlamydial infections. 6th Ed. Washington, American Public Health Association. 1225 págs. 45 ANEXOS 46 ANEXO 1 INSTRUCCIONES PARA LA OBTENCION, MANTENIMIENTO Y ENVÍO DE MUESTRAS SÉRICAS OBTENCIÓN DE MUESTRA.- Cantidad de sangre : Aislamiento Viral Retracción del coágulo : : Separación del suero : 5 a 10 mL en tubo estéril. Tubo a temperatura ambiente por no más de 1 hora, y luego centrifugar a 1500 r.p.m. por 10 minutos. Colocar el suero en tubo o vial estéril rotulado con el nombre completo y fecha de colecta. Detección de anticuerpos Retracción del coágulo : Tubo a temperatura ambiente, por 1 a 2 horas. Separación del suero : Igual procedimiento. Almacenamiento : Refrigeración a 4°C (diagnóstico serológico) congeladora de -20° a-70° C (diagnóstico virológico). Tiempo de envío : No debe exceder de un mes de obtenidas las muestras. Embalaje : Colocar los viales en recipiente plástico o metálico, cubrir con papel o bolsa de plástico, colocar en caja térmica con bastante hielo y cerrar herméticamente. Identificar la caja como: URGENTE, MATERIAL BIOLÓGICO. Modo de envío : Mensajero: vía fluvial, terrestre o aéreo. Las muestras que son para aislamiento viral mantener con hielo hasta su entrega al laboratorio. Destino : Instituto Nacional de Salud Av. Cápac Yupanqui 1400 - Jesús María. Teléfono: 471-9920 Anexo 148, 471-2529 47 ANEXO 2 TITULACIÓN DE LOS REACTIVOS PARA LA PRUEBA MAC-ELISA Considerar los reactivos, equipos y materiales mencionados en el capítulo VII. A.2.1 PROCEDIMIENTO - Rehidratar la inmunoglobulina anti IgM humana con el diluyente indicado por el producto. Realizar la dilución de la inmunoglobilina, con buffer carbonato - bicarbonato a las siguientes concentraciones: 2,5; 5,0; 10,0 y 20,0 μg. - Emplear dos placas, en cada una distribuir 100 μL de Igs de diferentes concentraciones a los pozos correspondientes. (Ver esquema.) Incubar a 4°C hasta el día siguiente. Lavar las placas 5 veces con PBS + Tween 20. Bloquear las placas con 150 μL de buffer carbonato-bicarbonato + AB al 4% a 37°C por 1 hora. Lavar las placas 5 veces. Adicionar en una de las placas 50 μL de las diluciones del suero positivo y en la otra 50 μL de las diluciones del suero negativo a los pozos indicados. Lavar las placas 5 veces. Adicionar a las placas 50 μL de antígeno conteniendo 16 uHA a todos los pozos. Incubar a 4°C hasta el día siguiente. Lavar las placas 5 veces. Adicionar a las placas 50 μL de las diluciones de conjugado - peroxidasa a los pozos correspondientes. Incubar a 37°C por 1 hora. Lavar las placas 7 veces. Adicionar a las placas 100 μL de sustrato. Incubar a temperatura ambiente por 30 minutos. Detener la reacción con la adición de 100 μL ácido sulfúrico 2N. Realizar la lectura a 492 nm. Obtener la curva de saturación de los reactivos trabajados, considerando los títulos óptimos a la dilución anterior. - 48 ANEXO 3 TITULACIÓN DE LOS REACTIVOS PARA LA PRUEBA DE INMUNOFLUORESCENCIA INDIRECTA Considerar los reactivos, equipos y materiales mencionados en el capítulo X. A.3.1 PROCEDIMIENTO - - Sacar de la congeladora de -70° C 3 láminas infectadas. Dejar secar a temperatura ambiente. Realizar las diluciones 1:10 hasta 1:160 de los líquidos ascíticos hiperinmunes (L.A.H) y anticuerpos monoclonales (AcM) específicos, usando como diluyente PBS. Preparar diluciones 1:25, 1:50 y 1:100 de conjugado-FITC con diluyente PBS (el conjugado tiene que ser de la misma especie de preparación de los anticuerpos). Rotular debidamente las láminas de IFI, según protocolo de trabajo. Agregar 10 μL de PBS en los pozos de la primera columna (control negativo). Agregar 10 μL de las diluciones de L.A.H. y AcM a los pozos correspondientes a partir de la segunda columna de las 3 láminas. Incubar en cámara húmeda a 37°C por 45 minutos. Lavar 2 veces con PBS y dejar secar a temperatura ambiente con ayuda de un ventilador. Agregar 10 μL de conjugado - FITC a dilución 1:25 a todos los pozos de la primera lámina; a la segunda lámina, a dilución 1:50 y a la tercera lámina a dilución 1:100. Incubar en cámara húmeda a 37° C por 45 minutos. Lavar 2 veces con PBS y dejar secar a temperatura ambiente. Realizar el montaje de las láminas con buffer glicerina. Observar al microscopio de inmunofluorescencia, dar lectura y anotar los resultados en el protocolo. A.3.2 INTERPRETACIÓN: - Considerar los títulos óptimos de los L.A.H. y de los AcM empleando la dilución anterior donde se observa fluorescencia. Positivo = Fluorescencia de color verde en todo el citoplasma Negativo = Color rojo 49 ANEXO 4 PREPARACIÓN DE LOS REACTIVOS PARA ANTÍGENO Y CONJUGADO A.4.1 Solución Buffer Borato Salina (BS) pH 9 NaCL 1,5 M ....................... 80 mL. H3BO3 0,5 M ....................... 100 mL. Completar 1 litro de agua destilada y ajustar el pH 9 con el NaOH 1.0 M. Esterilizar por autoclave. No debe usarse luego de 30 días de su preparación. A.4.2 Solución Saturada de Sulfato de amonio Preparar el sulfato de amonio al 40% en agua destilada. La solución debe prepararse con varios días de anticipación para garantizar su saturación y debe ser filtrada antes de usarse. A.4.3 Solución Salina al 0,85 % Disolver 8,5 g de NaCl en 1L de agua destilada y esterilizar por autoclave. A.4.4 Buffer Acetato de sodio 1mM pH 4.4 Solución A: Acetato de sodio anhidro .......................... 8,24 g Agua destilada ............................................... 1 L Solución B: Acido acético ................................................ 6 mL Agua destilada ............................................... 1 L Añadir 1 parte de A para 2 partes de B a fin de ajustar el pH Diluir 1:100 con agua destilada para obtener 1mM A.4.5 Buffer Bicarbonato de sodio 0,2 M pH 9,5 Solución A: Carbonato de sodio anhidro 0,2 M ................... 21,2 g Agua destilada ....................................................... 1 L Solución B: Bicarbonato de sodio 0,2M .......................... 16,802 g Agua destilada ....................................................... 1 L Añada A a B a fin de obtener pH 9.5 A.4.6 Buffer Tris 1M Tris ................................................................. 1,211 g Cloruro de sodio 0,85% .................................... 10 mL Esterilizar por autoclave y guardar a 4°C. A.4.7 Peryodato de sodio 0.01 M Peryodato de sodio ........................................... 21 mg Agua destilada .................................................... 1 mL 50 A.4.8 Borohidruro de sodio Borohidruro de sodio ........................................ 4 mg Agua destilada ................................................... 1 mL A.4.9 Carbonato/Bicarbonato 0,01M pH 9,5 Carbonato de sodio anhidro .......................... 1,59 g Bicarbonato de sodio..................................... 2,39 g Disolver en 1L de agua destilada y ajuste el pH si es necesario. Diluir 1:5 para obtener 0,01 M A.4.10 Buffer Borato 0,1M pH 7,4 Acido bórico ................................................ 24,732 g/4L agua destilada Bórax ........................................................... 19,07 g/0,5 L agua destilada Añada aproximadamente 115 mL de bórax a 4 L de ácido bórico, ajuste pH 7,4 51 ANEXO 5 PREPARACIÓN DE REACTIVOS PARA LA PRUEBA DE HEMAGLUTINACIÓN (HA) Y DE INHIBICIÓN DE HEMAGLUTINACIÓN (IH) A.5.1 Solución Alsever Dextrosa ..................................20,50 g Cloruro de sodio ..................... 4,20 g Acido cítrico ........................... 0,55 g Citrato de sodio ....................... 8,00 g Agua destilada ......................... completar a 1 litro Esterilizar en autoclave durante 10 minutos a 10 lb. de presión. A.5.2 Solución Buffer Borato Salina (BS) pH 9 NaCL 1,5 M ............................ 80 mL H3BO3 0,5 M .......................... 100 mL NaOH 1,0 M ............................ 24 mL Completar 1 litro de agua destilada y ajustar el pH 9 con NaOH 0,01M. Esterilizar por autoclave. No debe usarse luego de 30 días de su preparación. A.5.3 Solución Stock de buffer (monobásico dibásico) Solución A pH 8.8 (dibásico): NaCl 1,5 M .................................. 100 mL Na2HPO4 0,5 M ................................... 100 mL H2O completar ....................................1000 mL Ajustar el pH y esterilizar por autoclave. Solución B pH 4,3 (monobásico): NaCl 1,5 M ..................................100 mL NaH2PO4 1 M .................................... 200 mL H2O completar ...................................1000 mL Ajustar el pH y esterilizar por autoclave. Tabla de valores para la preparación de bufferes de diferentes pH 52 Nota: El pH final es obtenido mezclando volúmenes iguales de borato salino con cada una de las soluciones anteriores (A+B). El ajuste de los pH se hace con las soluciones A y B (dependiendo si hay que acidificar o alcalinizar). Las soluciones de pH pueden guardarse a 4°C., menos las que están por encima de pH 6,8 que pueden cristalizarse. A.5.4 Albúmina Bovina Sérica (AB) 4 % pH 9: Albúmina Bovina fracción V ........................... 8 g Borato Salino (BS) pH 9 ............................. 200 mL Ajustar el pH 9 con NaOH., esterilizar por filtración utilizando membranas de 0,22 ó 0,45 μm. A.5.5 Kaolín al 25% Kaolín .......................................................... 25 g BS pH 9 ..................................................... 100 mL Esterilizar por autoclave y guardar a 4° C. A.5.6 Solución de Suero Fisiológico Na Cl .............................................................. 9 g Agua destilada .......................................... 100 mL Esterilizar por autoclave y guardar a 4°C. A.5.7 Antígenos (preparados en el INS - Dpto. Virología): - Se utilizan antígenos preparados a partir de cerebro de ratones lactantes infectados tratados por el método de sacarosa - acetona. El control de Antígeno Normal contiene cerebro de ratones lactantes no infectados tratados por el mismo método. Si los antígenos se encuentran liofilizados se rehidratan con agua destilada estéril a volumen indicado, y se mantienen a 4°C hasta el día siguiente. Los antígenos, una vez rehidratados, deben almacenarse en volúmenes pequeños a -70°C. 53 ANEXO 6 PREPARACIÓN DE REACTIVOS Y SOLUCIONES PARA LA PRUEBA DE ELISA DE CAPTURA DE IgM A.6.1 Buffer carbonato-bicarbonato 0,05 M pH 9,5 Carbonato de sodio anhidro .............. 1,59 g Bicarbonato de sodio ........................ 2,93 g Disolver en 1 litro de agua destilada, ajustar el pH si es necesario, y mantener a 4°C. No usar después de 15 días de su preparación. A.6.2 Buffer fosfato salino (PBS 1X pH 7,2 - 7,4) Na Cl ......................... 8,0 g K Cl ........................... 0,2 g KH2PO4 .................... 0,14 g Na2HPO4 ................... 0,91 g Con H2O destilada completar a un litro y ajustar el pH. Esterilizar por autoclave y guardar a temperatura ambiente A.6.3 Buffer fosfato citrato 0,05 M pH 5 Acido cítrico .............. 5,1 g Na2HPO4 .................... 7,47 g Disolver en 1 litro de agua destilada, ajustar a pH 5 y mantener a temperatura ambiente, por un tiempo máximo de 1 mes. A.6.4 Solución de sustrato OPD ....................................... 10 mg Peróxido de hidrógeno ........... 10 μL Buffer fosfato citrato .............. 25 mL Importante: Esta solución es preparada al momento de la prueba y debe protegerse de la luz. A.6.5 Suero Humano Normal (SHN) extraído en acetona : - Obtener 10 mL de suero o plasma (libre de reacción para virus VIH y Hepatitis B). Añadir 500 mL de acetona (50 veces el volumen de suero). Agitar por 15 minutos a temperatura ambiente. Reposar hasta el otro día, inclinando el envase aproximadamente en ángulo de 45° Remover el sobrenadante, de preferencia por succión. Repetir los pasos de la adición de acetona. Los residuos de acetona deben evaporarse a 37°C de un día para otro o utilizando desecador al vacío aproximadamente 2 - 3 horas. El sedimento seco (proteínas) se rehidrata con 20 mL de PBS (2 veces el volumen original de suero) y se mezcla por 1 ó 2 horas a temperatura ambiente. Centrifugar y distribuir el sobrenadante en pequeños volúmenes. Almacenar a -70°C. 54 ANEXO 7 PREPARACIÓN DE REACTIVOS Y SOLUCIONES PARA LA PRUEBA DE INMUNOFLUORESCENCIA (IFI) A.7.1 Solución Buffer Fosfato Salina (PBS) 10X pH 7,2 - 7,4 NaH2PO4 . H2O .................................... 6,65 g Na2HPO4 ............................................ 35,00 g NaCl ................................................. 225,00 g Agregar las sales, en el orden citado, a un volumen final de 2L de agua destilada, agitándolo bien después de cada adición; agregar cloroformo al 2% para preservarlo. Diluir 1:10 con agua destilada y ajustar el pH. A.7.2 Tripsina-Versene NaCL ....................................................... 8,0 g/L KH2PO4 ................................................... 0,2 g/L KCl .......................................................... 0,2 g/L Na2HPO4 ................................................ 1,15 g/L Tripsina (1:250) ....................................... 0,5 g/L Versene ..................................................... 0,2 g/L Agua destilada ........................... completar 1 litro Agitar por una hora. Esterilice por filtración y distribúyase. Almacenar a -20°C. A.7.3 Azul de Evan's Disolver 1 g de azul de Evan's en 100 mL de agua destilada (1:100). No es necesario filtrar. Almacenar a 4°C. Ejemplo de una preparación: Si se necesita una dilución final 1:40 de conjugado-FICT, mezclar: 0.1 mL 0.1 mL 0.8 mL 1 mL conjugado-FITC a dilución de 1:4 en PBS azul de Evan's 1:100 PBS Dilución final de conjugado : 1:4 x 1:10 = 1:40 Dilución final del contrateñido : 1:100 x 1:10 = 1:1000 El azul de Evan's (contrateñido) reduce el fondo verde inespecífico, pero también reducirá el brillo de la inmunofluorescencia específica si está demasiado concentrado. A.7.4 Buffer Glicerina Preparar 9 volúmenes de glicerina + 1 volumen de PBS pH 7,2. Esterilizar por autoclave y almacenar a 4°C. 55 ANEXO 8 PREPARACIÓN DE REACTIVOS Y SOLUCIONES PARA DIAGNOSTICO VIROLÓGICO A.8.1 Buffers Fostato Salino PBS pH 7,2 - 7,4 Na Cl ....................................................... 8,00 g K Cl ......................................................... 0,20 g Na2HPO4 .................................................. 1,44 g KH2PO4 .................................................... 0,20 g H2O .......................................................... 1000 mL Agregar 2 mL de rojo fenol al 0.5% para 1 litro de solución, luego ajustar el pH. Esterilizar por autoclave y almacenar a 4°C A.8.2 Tripsina - EDTA 0,2 - 0,002 % Tripsina: Es una enzima obtenida de páncreas de cerdo o de bovino usado como agente disgregante de la células en monocapa. Se inhibe por la presencia de iones divalentes, razón por lo cual se coloca el EDTA o VERSENE. Tripsina Difco 1:250 ................................ 2 g EDTA ....................................................... 0,2 g PBS (Ca y Mg) ..................................... 1000 mL Esterilizar por filtración con membrana de 0,22 μm, repartir y almacenar a -20°C. A.8.3 Medio de Crecimiento Medio Mínimo Esencial con sales Hanks (H-MEM) 10,63 g/L Bicarbonato de Sodio 0,35 g/L Aminoácidos No Esenciales 100x 1% Piruvato de Sodio 100x 1% L-Glutamina 100 X 1% Antibiótico y Antimicótico 100 X 1% Suero Bovino Fetal 5-10 % HEPES 1g Agua bidestilada completar 1L Esterilizar por filtración con membrana de 0,22 ó 0,45 μm, almacenar a 4°C A.8.4 Medio de Mantenimiento Medio Mínimo Esencial con sales Earles (E-MEM) 9,526 g/L Bicarbonato de Sodio 2,2 g/L Aminoácidos No Esenciales 100x 1% Piruvato de Sodio 100x 1% L-Glutamina 100 X 1% Antibiótico y Antimicótico 100 X 1% Suero Bovino Fetal 2-5% HEPES 1g Agua bidestilada completar 1L Esterilizar por filtración con membrana de 0,22 ó 0,45 μm, almacenar a 4°C A.8.5 Solución de Cristal Violeta Cristal violeta ................................... 1,0 g Alcohol etílico .................................. 100 mL 56 A.8.6 Medio CMC Suero Bovino Fetal ............................. 10 mL L-Glutamina .......................................... 1 mL Antibióticos .......................................... 1% MEM sin rojo fenol ............................ 100 mL CMC 3% estéril .................................. 50 mL Nota: Carboximetilcelulosa (CMC). Se prepara al 3%, es decir, a 50 mL de agua bidestilada añadir 1,5 g de CMC. Disolver a 4°C durante uno o dos días. Esterilizar por autoclave y almacenar a 4°C. A.8.7 Naphthol Blue Black (NBB) Naphthol Blue Black ............................ 1 g Acetato de sodio .................................. 13,6 g Acido acético glacial ............................ 60 mL H2O a completar ................................ 1000 mL No es necesario esterilizar, se puede almacenar por periodo largo. 57 ANEXO 9 CONTAJE DE CÉLULAS El recuento de células es importante para observar la viabilidad celular y la densidad óptima. A.9.1 REACTIVOS - Cristal violeta - Azul de tripan - Buffer fosfato salina (PBS) pH 7,2 - 7,4 A.9.2 EQUIPOS Y MATERIALES - Cámara de flujo laminar - Microscopio invertido - Dispensador automático - Cámara de Neubauer - Micropipetas graduables - Puntas para micropipeta - Viales - Material de vidrio A.9.3 PROCEDIMIENTO - Una vez realizado el desprendimiento de la monocapa celular realizar el contaje de la suspensión celular empleando el colorante. - Colorantes: • Determinar el porcentaje de viabilidad empleando azul de tripan (0,5% en solución salina). Las células muertas se colorean y las vivas no retienen el color. • Determinar el número total de células usando cristal de violeta (0,5% en 0.1 M de ácido cítrico). - Realizar la mezcla con 1 mL de la suspensión celular con 1 mL del colorante, obteniendo un factor de dilución 2. - Transferir con una micropipeta a cada uno de los dos compartimientos de la cámara de Neubauer. - Realizar el contaje de células de cada uno de los cuatro cuadrantes de la cámara de Neubauer. - Calcular el promedio de células de los cuatro cuadrantes. - Calcular la concentración de la suspensión celular con la fórmula siguiente: 58 59 60 61 62 63 64 65 66 67 68 Esta publicación se terminó de imprimir en noviembre de 1996 en los Talleres Gráficos de Art. Lautrec S.R.Ltda. Av. Paseo de la República 731 - Lima 13 Telfax 423-7616 69