nivelación bioquímica
Anuncio

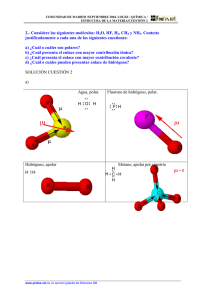
COLEGIO CAFAM LOS NARANJOS – EFA CURSO COMPLEMENTARIO JUNIO 2015 SEMANA: Junio 20 A JULIO 10 DE 2015 ASIGNATURA: BIOLOGIA Y QUIMICA PERIODO (S): 1 SEMESTRE GRADO: SEPTIMO NOMBRE: ___________________ CURSO: NIVELACIÓN BIOQUÍMICA SÉPTIMO 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. ¿Qué son los recursos naturales? Dibuja uno Explica cuáles son los diferentes recursos naturales que existen y dibújalos Realiza una sopa de letras con los recursos naturales renovables Realiza un crucigrama con los recursos naturales no renovables Escribe un cuento donde se manifieste la importancia del petróleo, pero también los perjuicios que ocasiona Has una lista de los recursos naturales más importantes del país y representa algunos con un dibujo Explica que es la flora y la fauna y cuál es su importancia en el ecosistema Representa con dibujos: la flor y el árbol nacional y algunas especies propias de nuestro país Que instituciones protegen nuestro recursos naturales, descríbelas Que son los parques naturales, cuales existen en nuestro país Explica cuáles son los factores abióticos de un ecosistema, dibújalos Realiza una sopa de letras con los factores abióticos del ecosistema Realiza un crucigrama con los factores bióticos del ecosistema Que son las adaptaciones al ambiente, que clases existen, dibújalas Que relaciones se establecen entre los seres vivos del ecosistema, dibuja y explica en cada caso Explica como fluye la energía en los ecosistemas Dibuja una cadena alimentaria y sus partes Dibuja una red trófica y sus partes Dibuja una pirámide alimenticia y sus componentes Explica en qué consiste el equilibrio ecológico, dibuja un ecosistema en equilibrio y otro en desequilibrio Explica cuál es la importancia del equilibrio ecológico en los ecosistemas Que son las adaptaciones del ser vivo al ambiente, dibuja algunas Que son las estrategias de supervivencia, cuales existen, dibújalas Cuáles son los organismos generalistas y cuales especialista dibuja un ejemplo en cada caso Cuáles son los tipos de contaminación que afectan los ecosistemas, dibuja un ejemplo de cada caso Dibuja y explica los siguientes ciclos naturales: del agua, del carbono, del nitrógeno y del oxigeno Que son las alteraciones en el ecosistema y que tipos existen, dibuja un ejemplo en cada caso Realiza una sopa de letras con las alteraciones naturales en un ecosistema Realiza un crucigrama con las alteraciones antrópicas en un ecosistema Escribe un cuento con dibujo, donde se mencione las diferentes alteraciones en el agua. COLEGIO CAFAM LOS NARANJOS – EFA CURSO COMPLEMENTARIO JUNIO 2015 SEMANA: Junio 20 A JULIO 10 DE 2015 ASIGNATURA: BIOLOGIA Y QUIMICA PERIODO (S): 1 SEMESTRE GRADO: OCTAVO NOMBRE: ___________________ NIVELACIÓN BIOQUÍMICA OCTAVO CURSO: COLEGIO CAFAM LOS NARANJOS – EFA CURSO COMPLEMENTARIO JUNIO 2015 SEMANA: Junio 20 A JULIO 10 DE 2015 ASIGNATURA: BIOLOGIA Y QUIMICA PERIODO (S): 1 SEMESTRE GRADO: NOVENO NOMBRE: ___________________ BIOQUÍMICA NOVENO EVOLUCIÓN BIOLÓGICA CURSO: COLEGIO CAFAM LOS NARANJOS – EFA CURSO COMPLEMENTARIO JUNIO 2015 SEMANA: Junio 20 A JULIO 10 DE 2015 ASIGNATURA: BIOLOGIA Y QUIMICA PERIODO (S): 1 SEMESTRE GRADO: DECIMO NOMBRE: ___________________ CURSO: BIOQUÍMICA PRIMERA PARTE 1. 2. 3. 4. 5. a. b. c. d. 6. 7. Cuáles son las propiedades de la tabla periódica, debe explicarlas Dibuje una tabla periódica indicando en ella las propiedades de la tabla periódica Qué es la configuración electrónica Explique cada uno de los modelos atómicos y haga el dibujo de cad uno de los modelos atómicos Realice la distribución electrónica de los siguientes números atómicos y diga el periodo y grupo en el cual se encuentran ubicados: Z=21 Z=45 Z=36 Z=82 Qué es la química Cuáles son las ramas de la química SEGUNDA PARTE LECTURA: Todos los días, podemos relacionarnos con las personas que nos rodean, gracias a que utilizamos el mismo idioma o lenguaje. De la misma manera, los químicos, sin importar que idioma hablen, necesitan comunicarse entre sí de manera muy específica; para ello se ha creado un lenguaje propio como es la nomenclatura química. El planeta Tierra está formado por una serie de sustancias que se unen, se mezclan y se combinan para formar una gran cantidad de materiales. Se los puede encontrar en los tres estados de la materia y forman las diferentes capas dela Tierra: la geosfera (sólida), la hidrosfera (líquida), y la atmósfera (gaseosa). Todas permanecen en constante agitación existiendo transferencia de materia entre ellas, y absorbiendo parte de la energía radiante que llega del Sol. Cada una de las capas posee componentes indispensables para la vida (biosfera). También se encuentran en ellas otros componentes que el ser humano extrae para su beneficio como materia prima: minerales metálicos, petróleo, c a r b ó n , s a l , a g u a , a z u f r e , c a l i z a s , a r c i l l a s e i n c l u s o o x í g e n o y n i t r ó g e n o d e l a i r e , e t c . E s t o s r e c u r s o s s o n transformados en diversos productos terminados: jabones, dentífricos, medicamentos, abonos, plásticos, papel, fibras, explosivos, electrodomésticos, automóviles, alimentos elaborados y sintéticos, etc. Gracias al desarrollo científico y tecnológico de la sociedad industrial en que vivimos existen muchos bienes y servicios, pero al mismo tiempo éstos producen desechos, subproductos y residuos que dañan el ambiente. Por otra parte, el ser humano emplea casi todos los tipos de materia que existen en la Tierra. Para su subsistencia utiliza el aire, el agua, la roca y minerales que forman el suelo donde siembra las semillas que acabarán siendo sus alimentos, además de otros materiales que le hacen la vida más fácil y más segura. Te habrás dado cuenta con esta breve lectura que existen en la Tierra una serie de sustancias químicas que utilizamos cotidianamente indispensables para sostener la vida sobre el planeta o que utilizamos en nuestro beneficio. A través de estas actividades veremos la utilidad de algunos compuestos inorgánicos los que se derivan principalmente de fuentes minerales. 1. Con tus propias palabras define el concepto de función química inorgánica. 2. explica cuáles son los tipos de funciones que maneja la química inorgánica para clasificar sus elementos y de acuerdo a ello asignar la nomenclatura pertinente. Resuelve las preguntas del número 3 al 8 utilizando el mecanismo de selección múltiple 3. La función química es un grupo de compuestos con características y comportamientos comunes. Las funciones químicas se describen a través de la identificación de grupos funcionales. De acuerdo a esto se puede inferir que un grupo funcional es: a. Un conjunto de sustancias con comportamientos comunes b. Un átomo o grupo de átomos que le confieren a los compuestos pertenecientes a una función química sus propiedades principales. c. Un grupo de átomos con propiedades diferentes. d. Átomos que proporcionan a una función química propiedades relevantes. 4. a. b. c. d. Los compuestos inorgánicos se clasifican principalmente en: Óxidos, hidróxidos o bases, ácidos y sales. Bases, hidrácidos, óxidos, hidróxidos. Hidróxidos, oxácidos, óxidos básicos, y ácidos. Óxidos ácidos, hidróxidos, ácidos y sales. 5. Utilizando los tres tipos de nomenclatura en estricto orden (stock, sistemática y tradicional) los nombres correctos para el compuesto Cr2O6 son: a. Oxido de cromo (VI), dióxido de hexacromo, oxido cromoso. b. Oxido de cromo (VI), hexaóxido de dicromo, oxido crómico. c. Oxido de cromo (VI), hexaóxido de dicromo, oxido percromico. d. dióxido de hexacromo , Oxido de cromo (VI), , oxido hipocromoso . 6. La fórmula correcta para el óxido férrico es: a. Fe2O b. FeO c. Fe2O2 d. Fe2O3 7. El oxígeno se puede combinar directamente con todos los elementos, excepto con los gases nobles, los halógenos y algunos de los metales menos activos, como el cobre y el mercurio. Un Óxido es un compuesto binario, existen óxidos ácidos y óxidos básicos. El último es la combinación del oxígeno con: a. Agua b. Metal c. No metal d. Hidrogeno 8. Hidróxido: el grupo OH formado por un átomo de oxígeno y otro de hidrógeno que deriva de la combinación del agua con: a. Oxigeno b. Metal c. Oxido básico d. Hidrácido 9. Completa el siguiente mapa conceptual: 10. Después de haber completado el anterior mapa conceptual explica cómo se forman cada uno de los siguientes compuestos: a. Un oxido ácido b. Un Oxácido c. Un Oxido básico d. Un Hidróxido. e. Un hidrácido COLEGIO CAFAM LOS NARANJOS – EFA CURSO COMPLEMENTARIO JUNIO 2015 SEMANA: Junio 20 A JULIO 10 DE 2015 ASIGNATURA: BIOLOGIA Y QUIMICA PERIODO (S): 1 SEMESTRE NOMBRE: ________________________________________________________ CURSO:___________ GRADO: ONCE NIVELACION QUIMICA ONCE QUIMICA GRADO ONCE HISTORIA DE LA QUIMICA ORGANICA Antoine Laurent Lavoisier (1743-1794): Químico, economista, técnico en agricultura y funcionario público en París. Puso énfasis en los aspectos cuantitativos de las reacciones químicas, desarrolló un esquema conceptual alternativo a la teoría en uso del flogisto, explicó los procesos de combustión y respiración mediante la toma de oxígeno, y fue una figura clave en el desarrollo de la nomenclatura ÓN QUÍMICA química moderna. Fue guillotinado durante la Revolución Francesa por ser miembro de una oficina recaudadora de impuestos. Lavoisier fue Secretario del Tesoro de la Comisión que estableció el sistema métrico de pesas y medidas Carl Wilhelm Scheele (1742-1786): Boticario de Uppsala y Köping en Suecia. Descubrió e identificó el cloro, el oxígeno (observó que el dióxido de manganeso calentado al rojo vivo producía un gas que denominó "aire de fuego" por las chispas que producía en contacto con polvo de carbón caliente), el fluoruro de hidrógeno, el cianuro de hidrógeno, el ácido láctico, el cítrico y otros ácidos orgánicos. También descubrió la adsorción de los gases por el carbón y el efecto catalítico de los ácidos minerales en la esterificación de ácidos orgánicos. Sus estudios de plantas y animales fueron muy importantes para la química fisiológica John Dalton (1766-1844): Químico, físico y meteorólogo de Manchester en Inglaterra. Dalton y el irlandés Higgins aplicaron independientemente las concepciones atómicas de Galileo, Boyle y Newton a la elucidación de reacciones químicas. Dalton puso un énfasis especial en los pesos de los átomos. Fue el primero en describir la ceguera al color (daltonismo) que él mismo sufría. Jöns Jakob Berzelius (1779-1848): Profesor de Química de Estocolmo en Suecia. Descubrió el selenio, el silicio y el torio. Fue el primero en determinar pesos atómicos y ayudó con ello al establecimiento de la teoría atómica de la química. Berzelius propuso el sistema de símbolos que se usan hoy en día para la designación de los elementos. Fue un escritor prolífico de libros de texto, revisiones anuales y artículos. Su apoyo o rechazo de nuevas teorías químicas tuvo una gran influencia sobre los químicos de su tiempo. Amadeo Avogadro (1776-1856): Físico, abogado y Profesor de Física-Matemática de Turín en Italia. Fue el primero en distinguir entre átomos y moléculas de los elementos, si bien sus puntos de vista fueron ignorados durante mucho tiempo. Stanislao Cannizzaro (1826-1910): Profesor de Química de Genoa, Palermo y Roma. Antes de estudiar química estudió medicina y fisiología. Fué exilado a París por su apoyo a la revolución de Garibaldi de 1847. Fue el primero en preparar cianamida (NH2CN); también hizo amplios estudios sobre aldehídos aromáticos, incluyendo la Reacción de Cannizzaro de aldehídos con bases. Alexander Crum Brown (1838-1922): Profesor de Química de Edinburgo y alumno de Bunsen y Kolbe. Trabajó en la orientación de las reacciones de sustitución aromática, estudió los alcaloides e hizo importantes contribuciones a la simplificación de las fórmulas moleculares. Louis Pasteur (1822-1895): Quimico y bacteriólogo; profesor de Lille y París. Llevó a cabo estudios cristalográficos e investigaciones sobre fermentación, sentó las bases de la bacteriología, e introdujo la inoculación contra las enfermedades (vacuna contra la viruela) y el método de esterilización de la leche que lleva su nombre. Friedrich Wöhler (1800-1882): Profesor de Química de Göttingen en Alemania. Alumno de Gmelin y Berzelius y muy amigo de Liebig. Además de sus extensos estudios de química orgánica, aisló el aluminio y el berilio, preparó el carburo cálcico y el silano (SiH4), y demostró la existencia de analogías entre la química del carbono y el silicio. Auguste Laurent (1807-1853): Profesor de Química de Burdeos en Francia. Trabajó junto a Gerhardt en la sistematización de los compuestos orgánicos para reemplazar la teoría dualista de Berzelius. Aisló y caracterizó el antraceno, el ácido ftálico y la ftalimida. Ejerció una gran influencia sobre Pasteur en sus estudios cristalográficos Química orgánica, rama de la química en la que se estudian el carbono, sus compuestos y reacciones. Existe una amplia gama de sustancias (medicamentos, vitaminas, plásticos, fibras sintéticas y naturales, hidratos de carbono, proteínas y grasas) formadas por moléculas orgánicas. Los químicos orgánicos determinan la estructura de las moléculas orgánicas, estudian sus reacciones y desarrollan procedimientos para sintetizar compuestos orgánicos. Esta rama de la química ha afectado profundamente a la vida en el siglo XX: ha perfeccionado los materiales naturales y ha sintetizado sustancias naturales y artificiales que, a su vez, han mejorado la salud, han aumentado el bienestar y han favorecido la utilidad de casi todos los productos empleados en la actualidad. El experimento de Wöhler rompió la barrera entre sustancias orgánicas e inorgánicas. Los químicos modernos consideran compuestos orgánicos a aquéllos que contienen carbono y otros elementos (que pueden ser uno o más), siendo los más comunes: hidrógeno, oxígeno, nitrógeno, azufre y los halógenos. Por ello, en la actualidad, la química orgánica tiende a denominarse química del carbono. 1. 2. 3. 4. 5. Taller: En una hoja examen ubicar en una línea de tiempo descubrimientos relativos a la Química orgánica y asociando a sus autores según la lectura Consulta las ramas de la química orgánica Representa como tu quieras las principales aplicaciones o usos de la química organica (esquema, dibujo, cuento, canción) o sea el impacto de la química orgánica en la vida actual, donde queden expresadas las ventajas y desventajas Consulta y copie de internet un mapa conceptual sobre la química orgánica. ¿Quién fue Friedrich Wohler y cuál es la contribución que hizo a la química orgánica? Taller 2: Lectura 2: Química del Carbono Es aquella parte de la química que estudia los compuestos qué contienen carbono. También llamada química orgánica veamos porque: Su nombre se debe a que inicialmente estudiaba todas las sustancias obtenidas como producto de las transformaciones que se realizaban en organismos animales y vegetales, .esto no es del todo cierto, debido a que muchas sustancias orgánicas se obtienen todavía de los seres vivos y no se han logrado sintetizar en el laboratorio, sin embargo, en contraposición se han conseguido fabricar materiales orgánicos que no produce la naturaleza tales como nylon, el PVC, muchos colorantes que se utilizan en la industria y centenares de drogas de aplicación farmacéutica. HISTORIA E IMPORTANCIA DE LA QUIMICA ORGANICA El conocimiento y utilización de los compuestos orgánicos se confunde con el origen mismo del ser humano. En la Biblia existen múltiples referencias, desde la época de Noé, a la utilización del vino, del vinagre, de los colorantes de los venenos, remedios, pócimas, ungüentos, perfumes y esencias, que están constituidos por sustancias orgánicas. Los antiguos egipcios utilizaban la médula de la planta de papiro para escribir sus jeroglíficos. Los colorantes de origen natural eran conocidos y manejados por el hombre desde tiempos antiguos, como la tintura azul de índigo, obtenida de la especie indigofera, utilizada por los egipcios para colorear las vendas de sus momias, la tintura de cochinilla (ácido carmínico), que aún se extrae de la hembrea de la cochinilla, insecto que habita en los cactus de Centroamérica, tintura muy apreciada por los grandes maestros de la pintura renacentista. Los fenicios obtenían el colorante púrpura real (púrpura de Tiro), extraída de un molusco del mediterráneo. Se fabricaban también extractos de plantas para causar la muerte. Famoso es el caso del filósofo griego Sócrates que en 399 ac. Fue condenado a beber cicuta, Extracto de una planta que contiene la cicutina; alcaloide muy toxico. Pero por fortuna también se extraían sustancias benéficas que servían para recuperar la salud. El mismo Hipócrates (hacia 460 a 377a.C) considerado el padre de la medicina, establece referencias de sustancias curativas de origen natural: en los siglos XVI y XVII tuvo gran desarrollo la iatroquímica o química médica creada por Paracelso. Existen referencias del conocimiento que tenían los chinos de plantas antimaláricas en épocas muy antiguas. En el siglo V ac. Conocían los griegos el proceso de destilación, desarrollado mucho tiempo después (Siglo VII dc.) por los árabes, que les permitió elaborar alcohol etílico, y ácido acético. En la época actual, la química orgánica lograra sintetizar gran variedad de compuestos naturales o artificiales, para usos en la industria, en la medicina en el transporte, hasta el punto que se han conseguido entre otras, la síntesis de sustancias tales como la insulina, hormona secretada por el páncreas que regula el metabolismo de los azucares, utilizada en el tratamiento de la diabetes. Se han sintetizado además numerosos materiales plástico para diferentes usos y la primera vacuna sintética, contra la malaria, elaborada por el médico Colombiano Manuel Elkin Patarroyo y su equipo de colaboradores. Parte muy importante de la investigación se dirige hoy en día hacia la síntesis de nuevos materiales con propiedades específicas para solucionar problemas concretos y mejorar la calidad de vida de la humanidad. Diferencias entre compuestos orgánicos e inorgánicos Compuestos orgánicos Compuestos inorgánicos Son combustibles Muy pocos son combustibles Son solubles en sustancias orgánicas y poco solubles en agua Son insolubles en sustancias orgánicas y solubles en agua Forman enlaces covalentes Forman enlaces iónicos actualmente se conocen alrededor de2,000,000 Solo forman 60,000 compuestos Presentan puntos de fusión y ebullición bajos Presentan puntos de fusión y ebullición altos Formados principalmente por carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N) entre otros pocos elementos Formados por la mayoría de los elementos químicos Gracias a sus características químicas, el átomo de carbono presenta siempre cuatro enlaces (puede estar unido a otros cuatro elementos) veamos: Cada uno de los guiones que aparecen en la formula entre el átomo de carbono y los átomos de hidrogeno representan un enlace químico. Clases de fórmulas en química orgánica Fórmula Definición Ejemplo Estructural Muestran los enlaces entre todos los átomos e indican la forma de la molécula en el espacio Semicondensada Muestra únicamente los enlaces presentes entre los átomos de carbono e indica el número de átomos de los otros elementos CH3 — CH3 condensada Solo indica la clase y el número de átomos presentes en un compuesto C2H2 Taller de lectura 2: 1. ¿Qué estudia la química orgánica? 2. ¿A qué se debe el nombre de química orgánica? 3. ¿Qué materiales se han podido fabricar que no produce la naturaleza? 4. ¿A qué se refiere el término industria farmacéutica? 5. ¿Qué nombre recibía la planta con la cual los egipcios escribían los jeroglíficos? 6. ¿Qué usos tenía la tintura azul de índigo, la de cochinilla y la púrpura de tiro? 7. ¿Qué es la cicuta? 8. ¿A qué se refiere el término iatroquímica y quien lo empleó? 9. ¿Qué compuestos orgánicos se pueden elaborar mediante la destilación? 10. ¿Qué función cumple la insulina en el organismo humano? 11. ¿En qué sustancias son solubles los compuestos orgánicos? 12. El punto de ebullición es la temperatura a la cual una sustancia liquida pasa a gas (se evapora). ¿Cómo es el punto de ebullición en los compuestos orgánicos? 13. ¿Qué elementos forman a los compuestos orgánicos? 14. ¿Qué elementos forman a los compuestos inorgánicos? 15. ¿Cuántos enlaces presenta un átomo de carbono y como se representan en una fórmula? 16. ¿Qué diferencia hay entre una formula estructural; una semicondensada y una condensada? Taller 3: Lectura3: Clasificación de Compuestos Orgánicos Clases de átomos de carbono Los átomos de carbono pueden ser primarios, secundarios, terciarios o cuaternarios según el número de átomos de carbono que tengan enlazados veamos: Carbono primario: es aquel que está unido a otro átomo de carbono Carbono secundario: es aquel que está unido a otrosdos átomos de carbono Carbono terciario: es aquel que está unido a otrostres átomos de carbono Carbono cuaternario: es aquel que está unido a otroscuatro átomos de carbono En el siguiente mapa conceptual se hace un resumen de la clasificación de los compuestos orgánicos, en cuanto al tipo de cadenas de carbono que se presentan (cadenas abiertas y cadenas cerradas) Veamos algunos ejemplos: Recordemos que el grupo funcional son los átomos cuya presencia en una molécula o cadena de carbono, determina las propiedades características de una función. Así por ejemplo, el grupo funcional que identifica a la función ácido es: Recordemos también que el grupo funcional es la parte activa de los compuestos. Y que el resto de la molécula es la parte inactiva, que se llama Radical y resulta de quitar un hidrogeno a una cadena de carbono y se representa con la letra: R O también se representa así a un radical ácido Veamos ahora algunos grupos funcionales de la química orgánica Función Parafina (alcano) Grupo Funcional Fórmula General —H R—H —C≡C— R—C≡C—R Olefina (alqueno) Alquino Alcohol — OH R — OH —O— R—O—R Ácido Cetona Éter Taller de lectura 3: 1. ¿Cómo pueden ser las clases de átomos de carbono según sus enlaces? 2. ¿Cuándo un carbono es primario, secundario, terciario o cuaternario? Dé un ejemplo de cada uno 3. ¿Cuáles pueden ser las dos grandes clases de compuestos orgánicos? 4. ¿Qué diferencia hay entre un compuesto cíclico y uno acíclico? 5. ¿Qué tipo de enlaces entre átomos de carbono, presentan los compuestos saturados como los alcanos? 6. Los alqueno y alquinos son compuestos insaturados. ¿Qué tipo de enlaces presentan estos compuestos? 7. ¿Qué diferencia se puede establecer entre los compuestos saturados como los alcanos y los insaturados como alquenos y alquinos? 8. ¿Qué diferencia hay entre un compuesto carboxílico y uno heterocíclico? 9. Cuál es la característica de los compuestos aromáticos? 10. Observe las fórmulas de un compuesto alifático saturado y uno insaturado y escriba cuál es su diferencia 11. ¿Qué es un grupo funcional? 12. Escriba cuales son los grupos funcionales de los siguientes compuestos: Alcanos . Alquenos . Alquinos . Alcoholes . Ácidos . 13. ¿De dónde resulta un radical? 14. Escriba en su cuaderno los siguientes radicales y de dónde provienen: Al metano CH4 se le quita un hidrógeno se forma el radical llamado metil CH 3— Al etano C2H6 se le quita un hidrógeno y se forma el radical llamado etil C 2H5— Al propano C3H8 se le quita un hidrogeno y se forma el radical llamado propil C3H7— 15. Complete la siguiente tabla: Nombre Fórmula condensada Radical Nombre Metano CH4 CH3— Metil Etano C2H6 . . Propano C3H8 . . Butano C4H10 . . Pentano C5H12 . . Taller 4 Lectura 4: Nomenclatura de Compuestos Orgánicos En los comienzos de la química orgánica no había una forma determinada de nombrar sus compuestos. Por lo que se les fueron dando nombres de acuerdo a su origen, propiedades, aplicaciones etc. por ejemplo ácido fórmico (que provenía del ácido que inyectan las hormigas cuando pican), ácido cítrico proviene del ácido presente en las frutas ácidas) o ácido láctico ( que proviene del ácido presente en los productos derivados de la leche). Este sistema se volvió muy confuso, cuando los científicos descubrieron muchos nuevos compuestos. Solo hasta, en 1949 se reunió la UNION INTERNACIONAL DE QUÍMICA PU APLICADA (IUPAC) y desde entonces viene publicando informes periódicos de aplicación y corrección de esta nomenclatura. Este sistema de nomenclatura establece una serie de reglas especiales y específicas que nos facilitan dar el nombre a cada uno de los compuestos orgánicos. Veamos cuales son esas reglas: Para nombrar compuestos orgánicos se utilizan prefijos y sufijos Los prefijos indican el número de carbonos presente en el compuesto Los sufijos indican el grupo funcional N° de carbonos Prefijo Grupo funcional Sufijo 1 met Alcano ano 2 et Alqueno eno 3 prop Alquino ino 4 but Alcohol ol 5 pent Aldehido alt 6 hex Cetona ona 7 hept Amina amina 8 oct Nitrilo nitrilo Observemos el siguiente ejemplo: Taller de lectura 4: 1. ¿En dónde se encuentran el ácido fórmico, láctico y cítrico, y a qué se deben tales nombres? 2. ¿Qué significa la sigla IUPAC? 3. ¿Qué indican los prefjos y sufijos en la nomenclatura de compuestos orgánicos? 4. Escriba frente a cada prefijo el número de carbonos que indica, completando el cuadro Prefijo N° de carbonos Ejemplo met 1 metano . . etano . . propano . . butano . . pentano 5. ¿Qué número de carbonos indican los prefijos: pent, hex, oct, non y dec respectivamente? 6. De acuerdo con la tabla de los sufijos, escriba frente a cada compuesto orgánico, si se trata de un alcano, alqueno, alquino o alcohol. 7. 8. Compuesto Grupo funcional metanol alcohol eteno . etino . propano . etanol . penteno . butino . propanol . ¿Por qué los alcanos o parafinas son llamados hidrocarburos saturados? Complete la siguiente tabla: Compuesto N° de carbonos sufijo Grupo funcional metano 1 ano alcano etano . . . propano . . . butano . . . pentano . . . hexano . . . 9. Según lo respondido en la tabla anterior ¿A qué grupo funcional pertenecen todos los compuestos y cuál es la terminación o sufijo que los identifica? 10. Escriba a qué grupo funcional pertenecen los siguientes compuestos: compuesto Grupo funcional sufijo eteno, propeno, buteno y penteno alqueno eno etino, propino, butino y pentino . . Metanol, etanol, propanol y butanol . . Propanona, butanona y pentanona . . Taller 5 Lectura 5: Propiedades químicas en alcanos, alquenos y alquinos Veamos algunas propiedades químicas que presentan los alcanos: combustión u oxidación Halogenación:reacción con halógenos (elementos del grupo VIIA) Cl, Br, I, F Los cicloalcanos también presentan propiedades químicas como: Hidrogenación catalítica: reacción con H Las propiedades químicas de los alquenos son: Hidrogenación Halogenación Oxidación Veamos algunas propiedades químicas que presentan los alquinos Oxidación Hidrogenación Escriba en su cuaderno todo el contenido de este taller y realice los ejercicios Taller de lectura 5: 1. En el siguiente cuadro, complete con palabras las casillas vacías con el nombre del hidrocarburo correspondiente: Hidrocarburo con Alcano (ano) Alqueno (eno) Alquino (ino) Un carbono metano . . Dos carbonos . eteno . Tres carbonos . . propino Cuatro carbonos . . . Cinco carbonos . . . 2. Complete el siguiente cuadro con las fórmulas estructurales del hidrocarburo correspondiente y escriba el nombre Hidrocarburo con Alcano (ano) Alqueno (eno) Alquino (ino) Un carbono . . Dos carbonos . . Tres carbonos . . Cuatro carbonos . . . Cinco carbonos . . . 3. 4. 5. 6. 7. 8. 9. ¿Qué elemento se emplea para la combustión de un alcano? ¿Qué otro nombre recibe la combustión? ¿Qué productos se obtienen después de hacer reaccionar un alcano con el oxígeno? ¿A qué se refiere, en la química orgánica, el concepto de halogenación? ¿Cuáles son los halógenos? Según la reacción de halogenación ¿Qué productos se forman después de la reacción? Si el derivado halogenado cloro-metano, se forma de hacer reaccionar el metano con el cloro según la ecuación química: CH4 + Cl2 → CH3−Cl + HCl. Metano Cloro Cloro-metano Ácido clorhídrico 10. Complete las siguientes ecuaciones con bromo (Br) y con yodo (I) y escriba el nombre de los productos. CH4 + Br2 → CH4 + I2 → 11. Teniendo en cuenta que metano más cloro, da como resultado cloro-metano más ácido clorhídrico, escriba frente a cada caso, los resultados de la reacción. Metano + Cloro → Cloro-metano + Ácido clorhídrico Etano + Bromo → Propano + Yodo → 12. Los ciclo-alcanos como ciclo-propano, ciclo-butano, ciclo-pentano, etc. Reaccionan con hidrógeno y producen los alcanos de cadena abierta correspondientes. Complete las siguientes reacciones: + H2 → CH3 − CH2 − CH3 + H2 → + H2 → 13. ¿A qué se refiere la reacción química llamada hidrogenación? 14. Según lo anterior, de la hidrogenación del eteno se forma el etano. Es decir que un Alqueno forma un alcano. Complete las siguientes reacciones: Eteno + Hidrógeno → Etano Propeno + Hidrógeno → Buteno + Hidrógeno → penteno + Hidrógeno → 15. ¿Qué es halogenación de un alqueno? 16. ¿Qué compuesto se forma de la halogenación de un alqueno? 17. Complete la ecuación química de la halogenación del alqueno eteno con bromo + Br2 → 18. 19. 20. 21. ¿Qué compuestos se obtienen de la reacción con permanganato de potasio (KMnO 4)? ¿Qué compuestos químicos se forman de la oxidación de un alquino con el gas ozono (O 3)? ¿Qué se obtiene de la hidrogenación de un alquino? ¿Qué se obtiene si se vuelve a hidrogenar el compuesto que queda? Taller 6 Lectura 6: Hidratos de carbono o carbohidratos Son carbohidratos las comestibles los almidones y los azúcares. La celulosa, el algodón y la madera son también carbohidratos. Algunos animales como las termitas, pueden alimentarse de estos materiales, con ayuda de bacterias. En los organismos, los carbohidratos son fuentes de energía y componentes estructurales. Los carbohidratos contienen átomos de carbono, hidrógeno y oxígeno en una proporción aproximada de un carbono por cada dos hidrógenos y un oxígeno (CH2O). El término carbohidrato se origina de la proporción 2:1 del hidrógeno con respecto al oxígeno, que es la misma proporción que se observa en el agua (H2O). Los carbohidratos se clasifican en monosacáridos, disacáridos y polisacáridos. Monosacáridos y disacáridos son conocidos como azúcares y se diferencian de los polisacáridos, entre otras cosas, por ser dulces y solubles en agua. Monosacáridos Son azúcares simples que contienen de tres a seis átomos de carbono. Son polialcoholes con función aldehído o cetona. Según el número de carbonos pueden ser triosas (3 carbonos), tetrosas (4 carbonos), pentosas (5 carbonos) y hexosas (6 carbonos). Pueden presentar fórmulas estructurales de cadena abierta o cerrada. Los carbohidratos más simples tienen tres átomos de carbono y se denominan triosas, como el gliceraldehído, que posee una función aldehído y dos funciones alcohólicas (aldotriosa), y la dihidroxiacetona, con una función cetona y dos funciones alcohólicas (cetotriosa). La ribosa es una pentosa común (aldopentosa) que es componente del ácido ribonucleico (RNA); su derivado desoxigenado, la desoxirribosa, que carece de hidroxilo alcohólico en la posición 2, forma parte del ácido desoxirribonucleico (DNA). La glucosa, la galactosa y la manosa son aldohexosas, mientras que la fructosa es una cetohexosa. La tabla 1 muestra la clasificación de los monosacáridos y da ejemplos con sus fórmulas estructurales. Tabla 1: Clasificación de los monosacáridos Según el número de carbonos Según el grupo funcional Número de carbonos nombre Aldosas (con grupo funcional aldehído) 3 triosas 4 tetrosas 5 pentosas 6 hexosas Cetosas (con grupo funcional cetona) La glucosa (C6H12O6) es el monosacárido más común. En la fotosíntesis las algas y las plantas producen glucosa a partir de CO 2 y agua, utilizando luz solar como fuente de energía. En la respiración celular de los seres humanos se rompen los enlaces de la molécula de glucosa, liberando la energía almacenada para que ésta pueda utilizarse en el metabolismo celular. Otras aldohexosas de importancia biológica son la manosa y la galactosa de la leche. La principal cetohexosa es la fructosa (dulce natural de las frutas), que al unirse a la glucosa forma el disacárido sacarosa o azúcar d mesa extraída de la caña de azúcar. Disacáridos Son compuestos formados por dos monosacáridos unidos mediante un enlace covalente glucosídico, que generalmente se forma entre el C1 de una molécula y el C4de la otra molécula. La maltosa (azúcar de malta) tiene dos moléculas de glucosa unidas por un enlace covalente. La lactosa (el azúcar de la leche) se compone de una molécula de glucosa y otra de galactosa. La sacarosa es una molécula de glucosa unida a otra de fructosa. La formación de disacáridos se ilustra en las siguientes reacciones: Glucosa + glucosa → maltosa Glucosa + galactosa → Lactosa Glucosa + fructosa → sacarosa Polisacáridos Son macromoléculas en las que se asocian varias unidades de azúcares simples, generalmente glucosa. Aun cuando el número de unidades presentes es variable, por lo general se encuentran miles de ellas en una sola molécula de polisacárido, que puede ser una cadena simple larga o ramificada. El almidón es la forma típica en que se almacenan carbohidratos en las plantas; es un polímero de subunidades de glucosa cuyos monómeros se unen por enlaces glucosídicos. El almidón se encuentra en dos formas: amilosa y amilopectina. La amilosa es la forma más simple sin ramificaciones. La amilopectina es la forma habitual; consta de cerca de 1 000 unidades en una cadena ramificada. Las ramificaciones ocurren cada 20 o 25 unidades. Las plantas almacenan almidón en gránulos dentro de organelos especializados, llamados plástidos. Cuando se requiere energía para el metabolismo celular, la planta somete a hidrólisis el almidón y libera subunidades de glucosa. El ser humano posee enzimas capaces de hidrolizar o digerir el almidón. El glucógeno (almidón animal) es la forma en que se almacena la glucosa en los tejidos animales. Este polisacárido es una cadena muy ramificada que es más soluble en agua que el almidón. La glucosa no puede almacenarse como tal; sus moléculas pequeñas, sin carga y fácilmente solubles, escaparían de las células; por ello el glucógeno se almacena en hígado y células musculares. Las células vegetales están rodeadas por una fuerte pared celular de soporte constituida principalmente por celulosa. Ésta es un polisacárido insoluble compuesto por la unión de moléculas de glucosa. Sus enlaces no se desdoblan por las enzimas que hidrolizan el almidón. Los seres humanos no tienen enzimas con las cuales digerir la celulosa y, por tanto, no pueden utilizarla como nutriente. Sin embargo, la celulosa es un componente importante de la fibra de la dieta, y coadyuva mantener el buen funcionamiento del tracto digestivo. Taller de lectura 6 1. Nombre los carbohidratos comestibles y no comestibles 2. ¿Cómo hacen las termitas para alimentarse de la madera? 3. ¿Qué función cumplen los carbohidratos en los organismos? 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. ¿Qué tipo de átomos contienen los carbohidratos y en qué proporción? Escriba la fórmula general. ¿De dónde se origina el término carbohidrato? ¿Cómo se clasifican los carbohidratos? ¿En qué se diferencian los azúcares de los polisacáridos? ¿Qué son los monosacáridos y qué tipo de funciones tienen? ¿Cómo se llaman los azúcares que hay en el ARN y el ADN? Escriba la fórmula molecular de la glucosa ¿Qué relación tiene la glucosa con la fotosíntesis y la respiración? ¿qué son disacáridos? Escriba de dónde se obtiene cada uno de los siguientes azúcares: Fructosa Maltosa Lactosa Sacarosa Escriba las reacciones por las que se forman la maltosa, lactosa y sacarosa ¿Qué son polisacáridos? ¿En qué formas se encuentra el almidón y cuál es la diferencia entre ellas? ¿Cómo almacenan las plantas el almidón y cómo lo utilizan? ¿Qué es el glucógeno y dónde se almacena? Nombre el polisacárido que forma la pared celular de las células vegetales y diga cómo está compuesto. LECTURA 7: Equilibrio ácido–base El equilibrio ácido–base depende de la concentración de iones hidrógeno (H+). Si la concentración de iones hidrógeno está elevada la solución se vuelve más ácida, pero si disminuye entonces se vuelve más alcalina. La cantidad de hidrógeno ionizado en solución se determina por el concepto de pH definido en 1909 por el danés Lauritz Sörensen. El pH es el logaritmo negativo de la concentración de iones H+. Un pH menor de 7 se considera ácido, y superior de 7 se considera alcalino. Un pH de 7 corresponde a neutralidad. Una solución con un pH de 7 es neutra, ya que a esa concentración el número de iones hidrógeno (H+) está equilibrado por el número de iones hidroxilo (OH—) presentes (figura 1). El líquido extracelular es levemente alcalino, con un pH de 7.35 a 7.45. Si el pH se incrementa se produce un estado de alcalosis, pero si cae por debajo de lo normal, entonces se presenta un estado de acidosis. Cuando el pH del líquido corporal se eleva por encima de 7.7 o cae por debajo de 7 se pone en peligro la vida. La regulación de la concentración del pH sanguíneo depende de tres mecanismos: Regulación respiratoria. Sistemas amortiguadores (buffer). Regulación renal del pH. Los sistemas buffer Las soluciones buffer o tampón, tienen como función absorber el exceso de iones hidrógeno o los liberar iones hidrógeno, según los requerimientos. Toda solución buffer está formada por la conjugación de un ácido y una base. En el organismo existen tres sistemas buffer, de los cuales, el sistema del bicarbonato es el más importante, porque regula las concentraciones relativas de ácido carbónico (H 2CO3) y bicarbonato de sodio (NaHCO3). Taller de lectura 7 1. ¿De qué depende el equilibrio ácido–base? 2. ¿Qué le pasa a una solución si la concentración de iones de hidrógeno está elevada y si disminuye? 3. ¿Cuál es el concepto que permite determinar la cantidad de hidrógeno ionizado en solución? 4. ¿Qué es el pH? 5. ¿Qué valores de pH se consideran ácidos, alcalinos y neutros? 6. ¿Por qué se dice que una solución de pH = 7 es neutra? 7. Copie la figura 1 8. ¿Cuál es el pH del líquido extracelular? 9. Complete las siguientes frases con la palabra acidosis o alcalosis 10. Si el pH se incrementa por encima de lo normal se produce un estado de ________ 11. La _________ se presenta cuando el pH cae por debajo de lo normal 12. Nombre los 3 mecanismos que regulan el pH en la sangre 13. ¿Cuál es la función de una solución buffer o tampón? 14. ¿Cómo está formada una solución buffer? 15. ¿Por qué es importante el sistema buffer de bicarbonato en el organismo?