Avaluació de protocols i dictamen
Anuncio

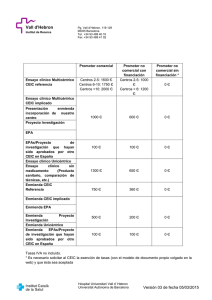
Avaluació de protocols i dictamen Codi: F0130 – F0772 Avaluació de protocols i dictamen Estat Realitzat Data Abril 2007 Àrea CEIC Revisat Maig -Juny 2007 Juny-Juliol 2008 18/09/2008 Maig – Juliol 2012 26/07/2012 CEIC Revisat Aprovat Revisat Aprovat CEIC CEIC CEIC Responsable Carme Fabrega Bosacoma Jesús Pineda Sánchez Carme Fabrega Bosacoma Jesús Pineda Sánchez Carme Fabrega Bosacoma Jesús Pineda Sánchez CEIC Acta 08/08 Jesús Pineda Sánchez Pau Ferrer Salvans CEIC Acta 07/12 ÍNDEX 1. OBJECTE ......................................................................................................2 2. ABAST ...........................................................................................................2 3. RESPONSABILITATS ....................................................................................2 4. DESCRIPCIÓ DEL PROCEDIMENT ..............................................................3 5. DOCUMENTACIÓ DE REFERÈNCIA ............................................................7 6. ANNEXES ......................................................................................................9 PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 1 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 1. OBJECTE L'objecte d'aquest Procediment Normalitzat de Treball (PNT) és: - - - l'avaluació dels aspectes metodològics ètics i legals i les modificacions rellevants dels assaigs clínics amb medicaments en els centres sanitaris de l'àmbit d'actuació acreditat, l'avaluació dels aspectes metodològics ètics i legals i les modificacions rellevants de les investigacions clíniques amb productes sanitaris en els centres sanitaris de l'àmbit d'actuació acreditat, l'avaluació dels aspectes metodològics ètics i legals de estudis postautorització amb medicaments, l'avaluació dels aspectes metodològics ètics i legals de estudis farmacogenòmics i farmacogenètics, i l'avaluació dels aspectes metodològics ètics i legals d'altres projectes de recerca biomèdica que se'ls puguin encomanar. Avaluació de les sol·licituds de mostres als biobancs de l’Hospital Sant Joan de Déu de Barcelona i del Parc Sanitari Sant Joan de Déu de Sant Boi del Llobregat. 2. ABAST El procediment s'aplicarà als protocols d' assaigs clínics amb medicaments i productes sanitaris i modificacions, protocols d'estudis postautorització amb medicaments, protocols d'estudis farmacogenòmics i farmacogenètics i d'altres protocols de recerca dels que es sol·liciti avaluació i dictamen al CEIC de la Fundació Sant Joan de Déu que compleixin amb els requeriments establerts en el procediment corresponent. 3. RESPONSABILITATS Es responsabilitat del CEIC avaluar els protocols de recerca i garantir la salvaguarda de la dignitat, els drets, la seguretat i el benestar dels subjectes d'investigació. A més ha de vetllar per la qualitat metodològica dels resultats, per tal d’evitar que qualsevol persona sigui sotmesa a riscs per a obtenir uns resultats de les investigacions no fiables. PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 2 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 4. DESCRIPCIÓ DEL PROCEDIMENT Aspectes generals Els protocols d’assaig clínic s’avaluaran segons les indicacions del RD 223/2004 de 6 de febrer Article 17. Els estudis postautorització s’avaluaran d’acord amb lo establert en el RD 1344/2007 de 11 de octubre, Article 19., amb la Instrucció 1/2003 de la Direcció General de Recursos Sanitaris i amb l’ordre SAS/3470/2009 reguladora dels estudis observacionals i postautorització. Els altres projectes de recerca biomèdica, estudis farmacogenòmics i farmacogenètics s’avaluaran d’acord amb lo establert en la Llei 14/2007, de 3 de juliol, d’investigació biomèdica. Quan algun membre del CEIC sigui investigador principal o col·laborador en el protocol a avaluar, no participarà en l’avaluació i es retirarà de la reunió i constarà en l’acta corresponent. Quan el CEIC ho estimi oportú, sol·licitarà l'assessorament de persones expertes que no pertanyin al Comitè, que respectaran el principi de confidencialitat. (RD 223/2004, article14). No tindran dret a vot i abandonaran la reunió abans de que es dugui a terme el debat de resolució. Quan el Comitè avaluï protocols d'investigació clínica amb procediments quirúrgics, tècniques diagnostiques o productes sanitaris, contarà, a més, amb al menys una persona experta en el procediment o tecnologia a avaluar.(RD 223/2004, article 14). No tindrà dret a vot en les mateixes circumstàncies del paràgraf anterior. Cadascun dels membres del CEIC exposarà els aspectes que vulgui comentar, aclariments addicionals que cregui convenient demanar al promotor i les seves conclusions sobre els aspectes avaluats El secretari recollirà i integrarà els suggeriments, indicacions i/o aclariments que es vulguin fer o demanar al promotor, s’especificarà el grau de rellevància d’aquests suggeriments, indicacions i/o aclariments, indicant si caldrà una reavaluació de les respostes per part de la totalitat del CEIC o es considerarà suficient la valoració de la resposta per part del secretari i/o els vocals que es determini per la tramitació del dictamen del protocol. La revisió es documentarà, s’informarà al CEIC i es recollirà en l’acta de la convocatòria corresponent Acabat el torn d'intervencions, el president del CEIC farà una proposta d'acceptació, reavaluació o rebuig del projecte i en aquest últim cas de les raons que l'aconsellen. Els acords del CEIC sobre l’avaluació de les propostes de protocols de recerca s’adoptaran per consens de tots els membres presents en cada reunió Excepcionalment, si no s'aconseguís el consens, els acords es podran adoptar per majoria simple. PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 3 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 En aquest darrer cas, constarà a l’acta que l’acord ha estat per majoria, però no s’hi esmentaran els membres que hagin votat en contra, llevat que algun d’ells vulgui fer constar el seu vot particular. Es considera necessari que el CEIC valori i ratifiqui explícitament les esmenes rellevants fetes als protocols una vegada aprovats i/o iniciats. Avaluació segons tipus de projecte Assaigs clínics amb medicaments i productes sanitaris: tots els membres del CEIC revisaran la totalitat del protocol d’assaig i la informació i procediment per la obtenció del consentiment informat i assentiment; disposaran de documents per orientar la revisió; faran la seva aportació de forma verbal; el secretari comprovarà que s’han revisat tots els aspectes a tenir en conte i registrarà les conclusions per tal de procedir al dictamen corresponent. Modificacions als protocols d’assaig clínic sol·licitades durant el procés d’avaluació: o o Aclaracions menors: la secretaria del CEIC revisarà la resposta del promotor i en fera l’avaluació; registrarà i informarà del contingut de la resposta i del resultat de l’avaluació a la resta de membres a la propera reunió per tal de procedir al dictamen corresponent. Aclaracions majors: la secretaria del CEIC i els membres directament implicats amb la sol·licitud d’aclaracions majors revisaran la resposta del promotor i en faran l’avaluació; el secretari registrarà i informarà del contingut de la resposta i del resultat de l’avaluació a la resta de membres a la propera reunió per tal de procedir al dictamen corresponent d’acordar el dictamen final. Quan el CEIC actuï com CEIC de referència, a la reunió corresponent, tots els membres del CEIC valoraran les aportacions dels CEICs implicats per tal de procedir a elaborar el dictamen corresponent Modificacions als protocols d’assaig clínic aprovats pel comitè: o Modificacions no rellevants: la secretaria del CEIC revisarà la proposta de modificació no rellevant del promotor; registrarà i informarà del contingut de la modificació proposada a la resta de membres a la propera reunió. o Modificacions rellevants: la secretaria del CEIC revisarà la proposta de modificació rellevant del promotor; registrarà i informarà del contingut de la modificació proposada a la resta de membres a la propera reunió; s’obrirà un torn de paraules per tal de procedir al dictamen corresponent. PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 4 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 • Estudis postautorització: revisió de la totalitat del protocol i de la informació i procediment per la obtenció del consentiment informat i assentiment per tots els membres del CEIC; disposaran de documents per orientar la revisió; (veure Avaluació de Estudis Post-autorització (EPA) de tipus observacional, Guias operativas para los CEIC, Division de Farmacoepidemiologia y Farmacovigilancia, Agencia Española de Medicamentos y productos Sanitarios) segons la Ordre SAS /3470/2009 faran la seva aportació de forma verbal; el secretari comprovarà que s’han revisat tots els aspectes a tenir en compte i registrarà les conclusions per tal de procedir al dictamen corresponent. • Estudis farmacogenòmics i farmacogenètics: revisió de la totalitat del protocol i de la informació i procediment per la obtenció del consentiment informat i assentiment per tots els membres del CEIC; disposaran de documents per orientar la revisió; faran la seva aportació de forma verbal; el secretari comprovarà que s’han revisat tots els aspectes a tenir en compte i registrarà les conclusions per tal de procedir al dictamen corresponent. • D’altres projectes de recerca: revisió de la totalitat del protocol i de la informació i procediment per la obtenció del consentiment informat i assentiment per grups de revisors prèviament constituïts a criteri del President i Secretari segons sigui el protocol. Exposaran les seves conclusions a la resta del CEIC de forma verbal; el secretari comprovarà que s’han revisat tots els aspectes a tenir en compte i registrarà les conclusions per tal de procedir al dictamen corresponent. Contingut de l'avaluació - Avaluació metodològica segons indicacions consensuades pel CEIC (veure Annex II). Avaluació ètica segons indicacions consensuades el CEIC (veure Annex II). Avaluació de la informació i procediment pel consentiment informat i assentiment segons indicacions consensuades pel CEIC (veure Annex II). Avaluació de l’equip investigador en base a la seva experiència clínica i investigadora. Avaluació de la viabilitat local del protocol, disponibilitat de població reclutable i disponibilitat de temps de l'equip investigador. Comprovació de l'existència d’una assegurança segons determini la legislació vigent. Valoració dels aspectes econòmics segons determina la legislació vigent Valoració del pressupost i memòria econòmica. Criteris de valoració - Pertinença de la investigació tenint en compte el coneixement disponible. Pertinença del disseny per la obtenció de les conclusions fundamentades amb el numero adequat de subjectes en relació a l’objectiu de l’estudi. Criteris de selecció i retirada i selecció equitativa de subjectes. PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 5 de 19 Avaluació de protocols i dictamen - - - - Codi: F0130 – F0772 Justificació dels riscs i inconvenients previsibles en relació amb els beneficis esperats pels subjectes de investigació, per altres pacients i per la comunitat a la llum de lo que es determina en l’article 3 del RD 223 /2004. Justificació del grup control (placebo o tractament actiu). Previsions pel seguiment de l’assaig. Idoneïtat de l’investigador i dels seus col·laboradors. Idoneïtat de les instal·lacions. Idoneïtat de la informació escrita pels subjectes d’investigació i del procediment per la obtenció del consentiment informat i assentiment; justificació de la investigació en subjectes incapaços de donar el consentiment informat. Assegurança o garantia financera previstos. Previsions de remuneració o compensacions pels investigadors i subjectes de la investigació i aspectes rellevants de qualsevol acord entre el promotor i el centre que han de constar en el contracte previst en l’article 30 del RD 223/2004. Pla previst per reclutar els subjectes d'investigació. Per tal de facilitar que s’ha avaluat tots els aspectes es preveu la utilització d’un "check list". Resultat de l'avaluació/Dictamen S'obtindrà per consens i cas de no ser possible, per majoria simple. - - - Aprovació definitiva (sense modificacions). Aprovació amb modificacions: en aquell cas en que l'aprovació del protocol quedi supeditada a que el promotor/investigador acceptin la modificació sol·licitada pel CEIC i la incorporin al protocol. Sol·licitud d'aclaracions: en aquell cas que es sol·licitin aclaracions a aspectes concrets del protocol; la resolució de les aclaracions considerades majors serà preceptiva per l'aprovació del protocol i es sotmetrà a valoració de tots els membres del CEIC. Denegació: caldrà fer constar les causes del informe desfavorable. Dictamen únic en els assaigs clínics multicentrics En el cas dels assaigs clínics multicentrics caldrà emetre un únic dictamen independentment del numero de CEIC,s implicats en la seva avaluació, El dictamen únic s'adoptarà de conformitat amb lo previst en l’Article 19 del RD 223/2004 i seguint el procediment descrit en els documents al respecte emesos pel Ministeri de Sanitat i Consum: "Criterios y procedimientos para la obtención del dictamen único en la evaluación de protocolos de ensayos clínicos multicéntricos por los CEIC" (veure Annex 1 al PNT) y "Aclaraciones sobre la aplicación de la normativa de ensayos clínicos a partir del 1 de mayo de 2004 (versión nº 6 , mayo de 2008 i succesives actualitzacions). PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 6 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 Per tal de facilitar l’intercanvi d’informes i dictàmens i donar compliment als tràmits de notificació als CEICs implicats, al promotor, al Centre Coordinador de CEICs i a la AEMPS, que estableix el RD 223/2004 per la obtenció del dictamen únic, els CEICs estan connectats mitjançant una aplicació informàtica “Sistema Informático de Conexión de los CEICs” (SIC-CEIC). En qualsevol cas la secretaria del CEIC comunicarà el resultat de l'avaluació per escrit i/o utilitzant l’aplicació SIC-CEIC segons el cas, als investigadors principals, a les persones i/o institucions interessades i a qui correspongui en els terminis legalment establerts segons el tipus de projecte o documentació de que es tracti. S'especificarà la valoració del CEIC i els comentaris pertinents. El dictamen constarà en l’ acta corresponent, fent referència explícita als documents i aspectes que s'ha revisat. Avaluació de les sol·licituds de beques, ajuts a la recerca, projectes de fi de màster, projectes de tesi doctoral i altres projectes de tipus pedagògic que encara no estiguin a punt per a la seva realització L’activitat de les agències de promoció de la recerca, tant públiques com privades, la influència del Pla Bolònia i l’activitat pròpia d’un Hospital Universitari, condicionen l’arribada al CEIC de nombrosos projectes amb un termini molt curt per a la seva avaluació. En molts cassos l’agència que convoca l’ajut exigeix l’aprovació del CEIC quan encara no se sap si el projecte rebrà l’ajut. A més el format dels projectes per a sol·licitar un ajut és insuficient, i amb una orientació inadequada, per que el CEIC pugui resoldre una avaluació positiva (no tenen en compte les Normes de Bona Pràctica Clínica). La situació empitjora si el projecte rep la subvenció abans d’haver estat avaluat pel CEIC: la disponibilitat dels diners dona una sensació fictícia de qualitat y pressa per a començar la recerca. Per aquests motius el CEIC emetrà un certificat d’haver rebut el projecte i de que serà avaluat en la primera reunió en que hi hagi possibilitat de fer-ho. D’altra part el president del CEIC, el secretari i la secretaria administrativa, classificaran els projectes segons el seu contingut, risc previsible i complexitat. Els grups de projectes classificats s’assignaran a grups de vocals del CEIC (per no sobrecarregar a tot el CEIC), per que puguin detectar les insuficiències a temps de ser corregides abans de que els projectes siguin subvencionats. Aquestes avaluacions s’inclouran en la sessió ordinària del CEIC i en l’acta corresponent, emetent una resolució. En els cassos en que sigui adient, s’informarà a l’investigador de que haurà de donar al seu projecte el format d’un protocol d’assaig clínic o el que correspongui, per poder dur-lo a terme en el cas de que rebi la subvenció, i que el protocol definitiu haurà de ser avaluat pel CEIC com estableix la legislació. . Avaluació de les sol·licituds de mostres als Biobancs vinculats a aquest CEIC. El CEIC de la Fundació Sant Joan de Déu va acordar en la reunió del dia dd/mm/aa acceptar constituir-se com a Comitè Extern dels biobancs de l’hospital de Sant Joan de Déu de Barcelona i del Parc Sanitari Sant Joan de Déu de Sant Boi del Llobregat. PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 7 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 Les mostres es sol·liciten formant part de projectes de recerca dels propis hospitals o d’institució i hospitals aliens, formant part de projectes de recerca que han de haver estat aprovats per aquest mateix CEIC o el propi de la institució corresponent. L’avaluació de la sol·licitud de mostres es farà una vegada rebuda tota la documentació del projecte de recerca que la sol·licita, i que tindrà d’incloure com a mínim: • Formulari de petició segons el model establert pel Biobanc corresponent. • Resum del projecte d’investigació. • Certificat del CEIC corresponent de que ha avaluat favorablement l’esmentat projecte. Las reunions del Comitè Ètic del Biobanc es faran segons un calendari predeterminat i per part del CEIC hi assistiran el president i el secretari, que hauran rebut i avaluat prèviament la documentació dels projectes de l’ordre del dia. Els acords adoptats s’inclouran en un acta de la que s’informarà al CEIC en sessió ordinària, i es transcriuran a l’acta del propi CEIC. Els Serveis de l’Hospital de Sant Joan de Déu que tinguin acords amb el Biobanc per a dipositar les seves mostres automàticament al Biobanc, quan sol·licitin l’avaluació d’un projecte al CEIC, aquest en remetrà una còpia al Biobanc per que pugui verificar la correcció dels procediments. 5. DOCUMENTACIÓ DE REFERÈNCIA • • • • • • • • REAL DECRETO 223/2004 de 6 de febrer pel que se regulen los assaigs clínics con medicaments. DECRET 406/2006 de 24 d'octubre, pel qual es regulen els requisits i el procediment d'acreditació dels comitès ètics d'investigació clínica. Ley 14/2007 de 3 de julio, de investigación biomédica. Orden SCO/256/2007, de 5 de febrero por la que se establecen los principios y las directrices detalladas de buena práctica clínica. Orden SAS/3470/2009, de 16 de diciembre, por la que se publican las directrices sobre estudios posautorización de tipo observacional para medicamentos de uso humano. Real Decreto 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios. Real Decreto 1616/2009, de 26 de octubre, por el que se regulan los productos sanitarios implantables activos. Real Decreto 1716/2011, de 18 de noviembre, por el que se establecen los requisitos básicos de autorización y funcionamiento de los biobancos con fines de investigación biomédica y del tratamiento de muestras biológicas de origen humano, y se regula el funcionamiento y organización del Registro Nacional de Biobancos para investigación biomédica. PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 8 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 Annex 1 al PNT Criterios y procedimientos para la obtención del dictamen único en la evaluación de protocolos de ensayos clínicos multicéntricos por los CEIC (versión 30 abril 2004), MINISTERIO DE SANIDAD Y CONSUMO Anexo 2 (versión 30 abril 2004) Criterios y procedimientos para la obtención del dictamen único en la evaluación de protocolos de ensayos clínicos multicéntricos por los CEIC La aplicación del Real Decreto 223/2004 requiere la adopción de una serie de medidas de coordinación y de sincronización por parte de los Comités Éticos de Investigación Clínica (CEICs) con el fin de hacer posible la obtención del dictamen único en los plazos legalmente establecidos. A tal efecto, se considera necesario que los promotores y los CEICs acreditados en nuestro país sigan las siguientes normas: Consideraciones generales 1. Para facilitar el intercambio de informes y dictámenes y cumplir los trámites de notificación a los CEICs implicados, al promotor, al Centro Coordinador de CEICs y a la AEMPS, que establece el Real decreto 223/2004 para la obtención del dictamen único, los CEICs estarán conectados mediante una aplicación informática denominada "Sistema Informático de Conexión de los CEICs (SIC-CEICS)". 2. Los CEICs deberán tener un registro de entrada a fin de que quede constancia de la fecha de recepción de cada solicitud de evaluación, tanto para nuevos ensayos clínicos, como para modificaciones y respuestas a las aclaraciones solicitadas. 3. El promotor elegirá el CEIC de referencia de común acuerdo con éste. 4. El solicitante deberá presentar las solicitudes de ensayo clínico o modificación relevante acompañada de la documentación correspondiente de manera simultánea a todos los CEIC implicados. La documentación debe ser completa e idéntica para todos los CEIC, excepto la correspondiente a los aspectos específicos de centro. 5. En la carta de acompañamiento que se incluya en la documentación el solicitante deberá identificar los centros en que se prevea realizar el ensayo y los CEICs implicados, indicando cual de ellos será el CEIC de referencia. Presentación de la solicitud y calendario de evaluación 6. El CEIC de referencia tendrá un plazo máximo de 60 días naturales para emitir un dictamen definitivo motivado sobre el ensayo, y podrá pedir información adicional al solicitante una sola vez. Con el fin de hacer posible el cumplimiento de este requisito, es necesario que el plazo máximo para emitir el dictamen inicial no supere los 31 días. De esta manera, en el caso de que se hayan pedido PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 9 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 aclaraciones, quedarán 29 días para evaluar la respuesta que presente el promotor a las mismas. 7. El plazo máximo para emitir el dictamen definitivo en el caso de modificaciones relevantes es de 35 días naturales. 8. La presentación de documentación a los CEICs por parte del solicitante debe realizarse únicamente dentro de los periodos siguientes: Protocolos y modificaciones relevantes: días laborables del 1 al 5 de cada mes. Respuesta a las aclaraciones mayores solicitadas: días laborables del 16 al 20 de cada mes. El promotor deberá asegurarse de que todos los CEICs han recibido correctamente toda la documentación en los periodos citados e informará de ello al CEIC de referencia. 9. Cada CEIC verificará la validez de la documentación específica de centro recibida y contactará con el solicitante para subsanar posibles deficiencias. El CEIC de referencia verificará, además, la validez de la documentación común para todos los comités. Cuando un CEIC implicado no comunique al CEIC de referencia la existencia de deficiencias en la documentación específica de centro, el CEIC de referencia dará por válida la solicitud. 10. El CEIC de referencia deberá agotar el plazo de 10 días de validación antes de considerar la documentación válida, dar de alta el documento (protocolo o modificación) en la aplicación SIC-CEICS y notificar el calendario de evaluación a los CEICs implicados, al solicitante y a la AEMPS. 11. El día 16 de cada mes se considerará día 1 del calendario de evaluación para todas las solicitudes de nuevos ensayos o modificaciones consideradas válidas en ese mes. 12. Todos los CEICs deberán reunirse entre el día 21 y fin de mes con el objeto de evaluar los protocolos, las modificaciones y las respuestas a aclaraciones que se hayan recibido en dicho mes. 13. El último día para que los CEICs implicados notifiquen su informe al CEIC de referencia (mediante la aplicación informática SIC-CEICS) será el día 3 del mes siguiente al de la presentación de la documentación válida por parte del solicitante. A partir del día 4, el CEIC de referencia podrá consultar los informes de los CEIC implicados. 14. El día 15 del mes siguiente al de la presentación de una solicitud válida, el CEIC de referencia notificará el dictamen correspondiente (favorable, petición de aclaraciones o desfavorable) al solicitante, los CEICs implicados y a la AEMPS. El cómputo del plazo de evaluación se detendrá cuando el CEIC de referencia solicite aclaraciones. Si en el dictamen del CEIC de referencia se solicitan aclaraciones, el solicitante deberá presentar la respuesta a las mismas entre los días 16 y 20 del mes en PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 10 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 curso o, a lo sumo, del mes siguiente. La ausencia de respuesta en dicho plazo motivará un dictamen desfavorable por parte del CEIC de referencia. 15. Los CEIC que actúen como CEIC de referencia tendrán que hacer necesariamente dos reuniones al mes: - Una para la evaluación de los nuevos ensayos, modificaciones relevantes y respuestas a aclaraciones previamente solicitadas (entre el día 21 y fin de mes). - Otra para la revisión de los informes de los CEICs implicados y elaboración del dictamen correspondiente (entre el día 4 y 15 de cada mes). Resumen secuencial del calendario propuesto 1. Del 1 al 5: presentación de la documentación a los CEICs de nuevos ensayos y modificaciones relevantes. 2. Del 6 al 15: validación de la documentación presentada y notificación por el CEIC de referencia de acuse de recibo de una solicitud válida y calendario de evaluación a los CEICs implicados, al solicitante y a la AEMPS. 3. Día 16: se considerará el día 1 del procedimiento. 4. Del 16 al 20: presentación de las respuestas a las aclaraciones solicitadas por el CEIC en el mes actual o en el anterior. El CEIC de referencia debe comprobar que la respuesta del promotor a las aclaraciones es válida y comunicar el calendario de evaluación a los CEICs implicados y al promotor. 5. Del 21 a fin de mes: reunión de los CEICs. Cambio de mes 6. Día 3 del mes siguiente: fecha límite para que los CEIC implicados comuniquen su informe (favorable, objeciones, desfavorable) al CEIC de referencia. 7. Entre el 4 y el 15: reunión del CEIC de referencia para revisar los informes de los CEIC implicados y preparar el dictamen (favorable, petición de aclaraciones o desfavorable). 8. Día 15: fecha límite para que el CEIC de referencia notifique el dictamen a los CEICs implicados, solicitante y a la AEMPS. 9. Día 16 al 20: Presentación, en su caso, de las respuestas a las aclaraciones solicitadas. El proceso continúa en el apartado 4. Dictamen único: evaluación de nuevos ensayos PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 11 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 Si un CEIC implicado no ha remitido su informe en el plazo fijado, se considerará que su opinión es desfavorable. Dictamen único: evaluación de modificaciones relevantes Los CEICs implicados siempre podrán emitir un informe respecto a las modificaciones relevantes de los ensayos clínicos multicéntricos. Cuando la modificación suponga la incorporación de un nuevo centro o investigador principal la falta de informe del CEIC implicado que corresponda, se considerará indicativa de informe desfavorable. Para otras modificaciones relevantes, la falta de informe por parte de un CEIC implicado se considerará indicativa de opinión favorable. PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 12 de 19 Codi: F0130 – F0772 Avaluació de protocols i dictamen Annex 2 al PNT Orientacions per l’avaluació de projectes de recerca: TIPUS ASSAIG CLINIC AMB MEDICAMENTS AMB PRODUCTES SANITARIS ESTUDI POSTAUTORITZACIÓ (EPA) EPA de seguiment prospectiu (EPA-SP) EPA retrospectiu o transversal (EPA-OD) EPA a instancia de l’autoritat reguladora (EPA-LA) ESTUDI OBSERVACIONAL No-EPA (prevalencia malalties) ALTRES PROJECTES D’INVESTIGACIÓ IDENTIFICACIO DEL PROTOCOL TITOL__________________________ CODI CEIC_______________________ CODI PROMOTOR_______________________ VERSIO_______________________________ Nº EUDRACT __________________________________ INVESTIGADOR PRINCIPAL_______________________________________ PROMOTOR______________________________________ DATA D'AVALUACIÓ_______________________________ ASSAIGS CLINICS IDONEÏTAT DEL PROTOCOL Generalitats • Existeixen elements que justifiquin la realització de l’estudi? PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 13 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 • Hi ha dades suficients referides a estudis previs en animals i/o estudis clínics previs ? • Els objectius, estan clars i es poden aconseguir amb la metodologia proposada? Metodologia • Les característiques de la població i el tamany de la mostra, son els apropiats pels objectius de l’estudi? • Els criteris d’inclusió, son apropiats? • Els criteris d’exclusió, son apropiats? • Contempla el risc de teratogènia i les mesures a utilitzar per evitar-lo? • Els mètodes de reclutament ,son legals ètics i lliures de coacció? • S’hi justifica la utilització de placebo? • Pels estudis controlats amb placebo cas de que hi hagi tractaments efectius per la condició en estudi: 1. s’hi justifica la utilització del placebo ? 2. la durada del tractament/placebo es la mínima necessària per avaluar la eficàcia ? 3. els intervals d’avaluació dels subjectes, son suficients per detectar qualsevol problema derivat de l’ús de placebo? 4. el protocol, indica d’una manera clara la persona de contacte per tal d’assegurar el seguiment apropiat dels subjecte? • Les raons i/o condicions de retirada de l’estudi, estan ben definides? • Hi ha justificació estadística al tamany de la mostra? • El tractament estadístic es l’apropiat pel disseny de l’estudi? PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 14 de 19 Codi: F0130 – F0772 Avaluació de protocols i dictamen Valoració del risc/benefici • Els riscos estan clarament definits ? • Hi ha suficients garanties de que es procurarà que el risc sigui mínim ? • Es contemplen les mesures a prendre per tal d’assegurar la detecció i tractament de qualsevol malaltia o lesió? • Hi ha garanties de que es comunicarà al comitè qualsevol informació que modifiqui les condicions de benefici/risc.? • S’assegura el respecte a la confidencialitat tant durant com després de finalitzat l’estudi i en la publicació dels resultats? • S’hi descriuen, cas que n’hi hagin els beneficis potencials pel subjecte? • Els beneficis potencials pel subjecte/ societat superen els riscs implícits? IDONETÏTAT DE L'EQUIP INVESTIGADOR • L’equip investigador té capacitat i formació suficients per dur a terme l’estudi? INFORMACIÓ AL SUBJECTE D'ASSAIG/CONSENTIMENT INFORMAT • Descriu d’una manera clara l’objectiu de l’estudi? • S’explica clarament que es tracta d’ un estudi d’investigació? • Hi consta clarament i explícitament el caràcter voluntari de la seva participació? • S’ hi expliquen clarament els tractaments i procediments experimentals de l’estudi? • S’explica clarament el període que pot estar sense tractament si s’utilitza placebo? • Es descriuen satisfactòriament els tractaments alternatius? • Hi consta la situació de registre del medicaments a utilitzar? • S’hi expliquen clarament les anàlisi/exploracions complementaries que es faran com a conseqüència de l’estudi? • S’informa d’una manera clara i complerta dels riscs o molèsties que pugui implicar la seva participació en l’estudi? PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 15 de 19 Codi: F0130 – F0772 Avaluació de protocols i dictamen • Descriu clarament les raons i conseqüències de retirada de l’estudi? • S’informa dels beneficis potencials pel pacient? • L’extensió i la forma son apropiades a la complexitat de l’estudi? • El llenguatge que s’utilitza es clar, concís, no tècnic? • Els apartats i seqüència de la informació son els adequats? • El document identifica inequívocament l’assaig al que correspon? • Hi consten el nom, adreça i telèfon dels investigadors? • Hi consta qui finança l’estudi? • Descriu qui tindrà accés a la informació que es derivi de l’estudi? • Informa de la protecció dels subjectes mitjançant l’ assegurança de l’estudi? COMPENSACIÓ/ASSEGURANÇA • L’assegurança s’adequa a la legislació vigent? COMPENSACIONS ECONÒMIQUES • Les obligacions financeres del promotor de l’ investigador i de la institució estan clarament definides? • La compensació econòmica als investigadors es considera suficient i no coercitiva? ALTRES CONSIDERACIONS • Indiqui si considera necessari o convenient aclarir o modificar algun altre aspecte del protocol o de la documentació complementària PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 16 de 19 Avaluació de protocols i dictamen Codi: F0130 – F0772 Orientacions per l’avaluació d’estudis postautorització • Els objectius, estan clars i es poden aconseguir amb la metodologia proposada? • Les característiques de la població i el tamany de la mostra, son els apropiats pels objectius de l’estudi? • S’assegura el respecte a la confidencialitat tant durant com després de finalitzat l’estudi i en la publicació dels resultats? • Els medicaments, s’utilitzen d’acord amb els condicions establertes en l’autorització de comercialització recollides en la fitxa tècnica? • S’estableixen procediments per tal de garantir que no es modificaran els hàbits de prescripció o de dispensació dels professionals involucrats? • S’hi considera la possibilitat d’obtenir mostres biològiques? PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 17 de 19 Codi: F0130 – F0772 Avaluació de protocols i dictamen FORMULARIO DE CONSENTIMIENTO INFORMADO PARA INVESTIGACIÓN CLÍNICA Yo, __ _______________________ ____________ (nombre y apellidos del adulto responsable) con DNI ________________________, en calidad de: Padre / Madre / Tutor de ______________________________ __________ • _____________________(nombre y apellidos del niño) Si No Autorizo su participación en el proyecto de investigación --------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------- • Manifiesto haber recibido y comprendido la información completa acerca de los Si No objetivos, los procedimientos, técnicas empleadas y la voluntariedad del estudio • He podido resolver todas las dudas referentes al mismo. • He sido informado por el Dr. ___________________________ (investigador Si No responsable) • Comprendo que la participación de ________________________________ Si No (nombre y apellidos del participante) es voluntaria. • Comprendo que los datos obtenidos del mismo, así como de la historia clínica y las pruebas administradas serán incluidos en una base de datos informática manteniéndose la confidencialidad de acuerdo con la legislación nacional vigente Si No de protección de datos (Ley Orgánica 15/1999 y Real Decreto 561/93). • Comprendo que _____________________________________________ es libre para abandonar el estudio en el momento que quiera sin que esto repercuta en sus cuidados médicos. PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 18 de 19 Si No Codi: F0130 – F0772 Avaluació de protocols i dictamen • En mi presencia se ha dado a____________________________________________ Si No (nombre y apellidos del niño) toda la información pertinente adaptada a su nivel de entendimiento y está de acuerdo en participar. Ante cualquier duda acerca del estudio puede informarse ahora o poniéndose en contacto con el investigador principal, Dr./ Dra. ______________________ __________________________________ Teléfono.: ____________________ ________________________________ _____________ Firma del representante legal del menor Fecha ________________________________ _____________ Firma del menor Fecha ________________________________ ______________ Firma del investigador Fecha PNT-CEIC: Versió 13 de juliol de 2012 Pàgina 19 de 19