Lección inaugural del curso 2012-13
Anuncio

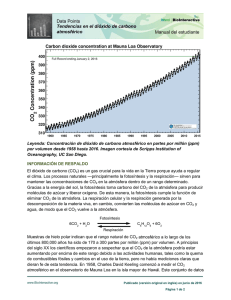
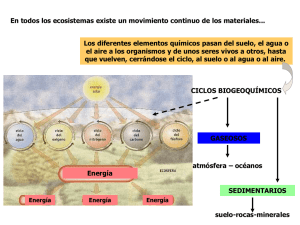
Lección inaugural del Curso 2012-13 Instituto Alfonso X el Sabio “De la química de la naturaleza y sus avatares” Mª de los Ángeles Gómez Hernández Catedrática jubilada de Física y Química 1 El milagro de la vida, desde un punto de vista químico, responde a una estrategia perfectamente organizada con dos fines primordiales: permitir que la vida en la Tierra sea posible y que el Planeta sea autosostenible. Ahora bien, la autosostenibilidad planetaria no es tan sencilla como puede parecer. Recientes estudios han puesto de manifiesto que este perfecto equilibrio es vulnerable, y, la inquietud por impedir daños irreversibles, ha llevado a definir un área de estudio, en auténtico auge, dentro de lo que se considera “naturaleza” y que es el “medio ambiente”, entendido como la zona de la tierra en la que se desarrolla la vida. Pero, ¿en qué consiste la estrategia capaz de propiciar las condiciones idóneas para permitir la existencia de los organismos vivos en la Tierra? Para intentar entender la naturaleza, tenemos recurrir a la química, una de las ciencias más antiguas, y plantearnos ¿Cuáles son los Elementos Químicos esenciales para existencia de la vida? A priori, dejándonos llevar por la intuición, podríamos pensar que sólo conocemos unos pocos de los cientos de miles de elementos químicos que conforman el Universo, pero, nada más lejos de la realidad. Hasta lo que ahora sabemos, el Cosmos está formado por unos cuantos elementos químicos, que son siempre los mismos, aunque unos más abundantes y otros más escasos. Incongruentemente, los más valorados por la sociedad, quizá por su escasez, como el oro, la plata o el platino, son absolutamente innecesarios para la vida; sin embargo, otros más abundantes como el hidrógeno, el oxígeno, el nitrógeno y el carbono, forman, junto con otros como el calcio, fósforo, hierro, etc., los ladrillos que conforman los seres vivos. ¿Y qué papel tiene el Sol? El denominado astro rey, es una estrella que tiene unos 4.500 millones de años y a la que se estima que le quedan otros 5.500 millones más. Esto ocurrirá cuando el sol agote su combustible y se convierta primero en gigante roja y a continuación en enana blanca, momento en el que la vida en la Tierra dejará de ser posible. Volviendo a los elementos químicos, el combustible del Sol está compuesto fundamentalmente de hidrógeno, el elemento más ligero de la naturaleza, de una reactividad tal, que en la tierra se encuentra siempre combinado, como sabemos forma parte del agua, los hidrocarburos, las proteínas y un largo etcétera. La superficie del Sol está a unos 6.000ºC (de ahí su color amarillo), temperatura muy baja en comparación a la de su interior que alcanza unos 15 millones de grados y una presión de miles de millones de atmósferas (cifras difíciles de concebir). En estas condiciones tan sumamente extremas, los núcleos de los átomos de H están dotados 2 de tantísima energía que chocan entre sí, con unos choques tan eficaces que se fusionan dando lugar a otro núcleo diferente, el helio, con la particularidad de que la masa final de He es algo menor que la suma de las masas iniciales de los hidrógenos que lo formaron (aproximadamente un 0,7% menor). Estas reacciones termonucleares son bombas de hidrógeno, las llamadas “Bombas H”. La masa perdida no desaparece sin más (la materia no se crea ni se destruye, se transforma), sino que se transforma en energía radiante, luz (ondas electromagnéticas acompañadas de sus fotones correspondientes). Entre el Sol y la Tierra hay vacío, es decir una gran zona desprovista de materia, ahora bien, las ondas electromagnéticas que forman la luz solar son capaces de transmitirse en el vacío, por ello llegan a la Tierra, tanto la luz blanca visible por el ojo humano que está compuesta por siete radiaciones de diferente longitud de onda (rojo, naranja, amarillo, verde, azul, añil y violeta), como las fracciones invisibles, por un lado la radiación infrarroja (onda que trasmite el calor) que al tener poca energía se queda en la epidermis y no es perjudicial, y por otro, la radiación ultravioleta conocida como rayos UVA. Los rayos ultravioleta son unas ondas muy cortas, de mucha energía y capaces de atravesar la epidermis y entrar en la dermis, donde activan a los melanocitos, que son las células que producen melanina, nos ponen morenos cuando tomamos el sol, e incluso pueden inducir al envejecimiento prematuro de la piel y al temido melanoma; dado que las células de la piel humana tienen memoria acumulativa para la radiación UVA recibida a lo largo de la vida de las personas. La radiación ultravioleta (rayos UVA A y B) puede alterar el ADN de los organismos vivos, pudiendo llegar a ser muy perjudiciales para la conservación de la vida. Por estas razones, si toda la radiación ultravioleta producida por el Sol llegase a la Tierra, no sería posible la existencia tal y como la conocemos, pero en la Naturaleza está todo previsto. En la Estratosfera hay una capa formada por Ozono, la ozonosfera, que tiene como misión retener parte de la radiación ultravioleta procedente del Sol, de manera que la superficie del planeta esté sometido a una cantidad de rayos UVA no perjudicial, con una exposición al sol razonable. El ozono es una variedad alotrópica del Oxígeno, formada por tres átomos de oxígeno (O3), que produce en la Estratosfera una serie de complicadas reacciones químicas, en unas de las cuales se destruye la molécula de O3 y en otras se regenera (manteniéndose de forma natural constante la concentración de O3 en la ozonosfera), este es el Ciclo del Ozono. 3 Ambas reacciones son endotérmicas, es decir es necesario que los reaccionantes absorban energía suficiente para que reaccionen, en este caso la energía necesaria para que se produzcan tanto la reacción directa como la inversa son los rayos UVA; de este modo, el ozono estratosférico actúa como auténtico escudo protector de los seres vivos al absorber parte de la radiación ultravioleta procedente del Sol. Consecuencia de ello es que a la Tierra sólo llegan cantidades discretas de rayos ultravioleta. La experiencia nos indica que siempre que hay una explosión hay una onda sonora (el BOOM que acompaña a las explosiones de cualquier naturaleza). ¿Sería posible la vida en la Tierra si el sonido producido por las múltiples bombas H del Sol llegase a ella? Efectivamente, si esto ocurriera, la Tierra estaría sometida a tales vibraciones que se parecería a una batidora, donde el estado sólido sería imposible, las reacciones químicas que constituyen la vida serían muy improbables y éste sería un planeta estéril y formado por corrientes de polvo posiblemente incandescente. Aunque, ya hemos indicado antes, en la Naturaleza está todo previsto, las ondas sonoras son ondas mecánicas que sólo se transmiten en medios materiales (sólidos, líquidos o gaseosos), es el aire el que nos permite oír la explosión de un cohete de feria, y por lo tanto las ondas sonoras no pueden atravesar la gran zona de vacío que separa el Sol de la Tierra, por lo que la vibración del sonido de las explosiones solares queda confinado en la atmósfera solar, permitiendo el desarrollo de los organismos en la Tierra. ¿Qué características tienen los elementos químicos imprescindibles para la vida? El oxígeno es un gas ligero que se encuentra en un 21% en las zonas bajas de la atmósfera en la que se desarrollan los seres vivos, la Biosfera. El oxígeno es tan activo desde el punto de vista químico, que es capaz de reaccionar con todos los demás elementos químicos (reacciones de oxidación), en la atmósfera está en forma de molécula diatómica (O2), es poco soluble en agua, pero lo es en cantidad suficiente como para permitir la respiración de los peces y plantas acuáticas. El oxígeno es el gas que permite la respiración de la mayoría de los seres vivos tanto animales como vegetales. La respiración es una reacción exotérmica, es decir que cuando se produce hay un desprendimiento de energía (verdaderamente es una combustión lenta), esta energía generada en la respiración es la que permite a los seres vivos desarrollar su actividad y mantener la organización de sus órganos y sistemas corporales. 4 Como producto de la respiración, como de cualquier otra combustión de compuestos orgánicos, se produce CO2 y vapor de agua que van a la atmósfera. De lo expuesto podríamos pensar que el oxígeno atmosférico se va consumiendo en la inspiración, e irremediablemente va siendo sustituido por CO2 en la espiración. Nada más lejos de la realidad, debido a la existencia de la masa vegetal de la superficie terrestre. Las plantas mientras que reciben luz llevan a cabo una serie compleja de reacciones químicas destinadas a formar los distintos tejidos vegetales, llamadas fotosíntesis, en las que se consume CO2 atmosférico y se desprende oxígeno. La luz es la energía necesaria para que estas reacciones endotérmicas se realicen; sin la luz solar la naturaleza como la conocemos, con sus maravillosos paisajes verdes, no sería posible. Este proceso es el Ciclo del Oxígeno, que por un lado es consumido por los seres vivos en la respiración, y por otro es generado por las plantas en las horas de sol, por lo que la masa arbórea de la Tierra es la garante de la conservación del O2 atmosférico. El nitrógeno es un gas que se presenta en la naturaleza en forma de moléculas diatómicas (N2), es algo más ligero que el oxígeno, y a diferencia de éste el N2 es un gas muy inerte, es decir no tiende a producir reacciones químicas. Se encuentra en la atmósfera en cantidades ingentes, casi un 78% de los gases atmosféricos es nitrógeno, por lo que se puede considerar a la atmósfera como una fuente inagotable de este gas. ¿Qué efecto tiene un gas inerte en la atmósfera? El nitrógeno atmosférico tiene como misión contrarrestar los efectos oxidantes del oxígeno. Si desde que nace un ser vivo respirase únicamente oxígeno, su vida se acortaría extraordinariamente por oxidación y destrucción de las células de su aparato respiratorio, pero en cada inspiración el nitrógeno absorbido hace de vehículo del oxígeno y en la espiración se elimina todo el nitrógeno intacto. El nitrógeno sólo pasa a la Tierra en las tormentas, los rayos comunican la energía suficiente para vencer la inercia del nitrógeno y hacerlo reaccionar con el oxígeno atmosférico, produciendo su oxidación en pequeñas cantidades. Los compuestos resultantes caen a la Tierra disueltos en la lluvia, constituyendo los nitratos uno de los principales fertilizantes para los suelos. Por lo tanto, podemos decir que las reservas de nitratos en la Tierra se mantienen constantes gracias a la actividad de las tormentas. 5 Asimismo, las bacterias nitrificantes son capaces de fijar parte del nitrógeno atmosférico enriqueciendo al suelo en la zona próxima a las raíces de ciertos vegetales. El nitrógeno es fundamental para la formación de los tejidos vivos, ya que los aminoácidos, las proteínas, el ADN, así como la mayoría de los compuestos bioquímicos, que son la base química de todos los seres vivos, están formados por N, O, H y C. El carbono es un elemento químico más ligero que el nitrógeno. ¿Cuál es la razón por la que el carbono no se encuentra libre en la atmósfera? Ello es debido a una propiedad que lo diferencia del resto de los elementos químicos. El carbono es el único elemento que tiende a formar enlaces covalentes consigo mismo, llegando a formar largas y ramificadas cadenas con infinitas posibilidades, que son la base de todos los compuestos orgánicos y por lo tanto de la vida; o los codiciados diamantes que son carbono puro cristalizado en tetraedros. Como hemos expuesto, el carbono atmosférico está en forma de CO2. En los primeros tiempos de la Tierra la atmósfera estaba prácticamente toda formada por dióxido de carbono, y la temperatura en el planeta era altísima. A lo largo de las eras geológicas las plantas fueron absorbiendo el CO2 atmosférico y haciendo crecer grandes bosques de helechos y otras especies. En los sucesivos movimientos geológicos se formaron grandes depósitos subterráneos de plantas, plancton marino y otros organismos vivos, que debido a las altas presiones y temperaturas del subsuelo se convirtieron en combustibles fósiles, los cuales constituyen actualmente las fuentes de energía: los carbones naturales (antracita, hulla, lignito y turba), el petróleo y el gas natural. Asimismo, microorganismos y organismos acuáticos más complejos fueron absorbiendo a lo largo de las eras geológicas CO2 atmosférico, algo soluble en agua, que junto a la cal disuelta en el mar formaron sus caparazones o estructuras coralinas, de carbonato de calcio, los cuales al irse sedimentando y metamorfizando dieron lugar a las rocas carbonatadas, islas y atolones coralinos, provocando todo ello la eliminación el exceso de CO2 primigenio atmosférico y el enfriamiento subsiguiente de la Tierra Se puede asegurar que los océanos son grandes sumideros de CO2. Estos procesos se han repetido durante millones de años y han permitido disminuir el CO2 atmosférico y mantenerlo en niveles idóneos. 6 El CO2 es un gas incoloro e inodoro, es transparente a la luz solar y opaco a los rayos infrarrojos (la radiación calorífica), por lo tanto un exceso de CO2 atmosférico produce que el calor desarrollado en la Tierra por efecto de la luz solar, que calienta los objetos de la superficie terrestre, no pueda salir al exterior, que los infrarrojos sean reflejados por la capa de CO2 otra vez hacia la Tierra y en consecuencia que ésta sufra un recalentamiento. Es la misma propiedad que tiene el cristal, los plásticos y los policarbonatos, que al ser transparentes a la luz solar permiten que ésta entre en un recinto acristalado, los objetos que hay dentro se calientan y emiten radiación infrarroja, que no puede atravesar el cristal hacia fuera y el calor queda confinado en el interior, calentando más el recinto y produciendo una fuerte elevación de la temperatura interior aunque en el exterior la temperatura sea baja. A este fenómeno se llama Efecto Invernadero, y es por ello que las plantaciones bajo plástico o las puertas de los hornos y de los microondas puedan ser de cristal, ya que la radiación infrarroja no pasa el cristal o el plástico y el calor queda en el interior. El agua es la molécula sencilla e imprescindible para la vida que presenta mayor cantidad de anomalías, con respecto a lo que cabría esperar de su formulación química. La molécula de agua está formada por un átomo de oxígeno y dos de hidrógeno (H2O), estos enlaces covalentes podrían dar un compuesto apolar (H-O-H) muy mal disolvente de las sales. ¿A qué se debe, pues, que el agua disuelva las sales? Esto es debido a que en la molécula de agua los tres átomos no están en línea recta, sino que los dos hidrógenos forman entre sí un ángulo agudo, lo que le comunica un cierto carácter polar (una zona con carga positiva y otra zona negativa). Esta es la razón por la que el agua es un magnífico disolvente de sales minerales, por ello el agua del mar es salada, y la sangre o la savia son portadoras de los nutrientes necesarios para la alimentación de las células de animales y plantas. La molécula de agua tiene una masa molecular muy baja, casi la tercera parte de la masa de la molécula de CO2. ¿Cómo es posible que el CO2 casi tres veces más pesado sea un gas ligero a temperatura ambiente, y el agua sea líquida? Esta es otra de las maravillosas excepciones de la naturaleza, un comportamiento anómalo del agua pero imprescindible para que la vida sea posible. 7 Este hecho sorprendente consiste, en que los hidrógenos de cada una de las moléculas de agua saltan a las moléculas próximas, lo que lleva consigo que las moléculas de agua se acerquen entre sí, tanto que no quedan espacios libres entre ellas, pero gozan de la libertad de poder resbalar unas con respecto a las otras. Estas son las características del estado líquido. A este fenómeno que justifica la presencia del mar, ríos y lagos en la Tierra y por ende la vida sobre ella, se denomina Puente de hidrógeno. ¿La cantidad de agua que hay en el planeta está disminuyendo? Categóricamente no, en la Tierra la cantidad de agua es prácticamente constante, ya que el Ciclo del agua comprende su evaporación en los mares y océanos por efecto de la energía solar; el vapor transferido a la atmósfera forma las nubes que son movidas por el viento y la distribuyen por todo el mundo, precipitándose, cuando se condensa, en forma de lluvia, eso sí con una distribución heterogénea que produce zonas secas y otras húmedas. Hasta aquí hemos descrito el papel de los elementos químicos H,O,N,C, la importancia del Sol, el aspecto protector del Ozono en la estratosfera, los efectos del CO2 atmosférico y el agua, como agentes productores o protectores de la vida y sus ciclos de destrucción y regeneración que permiten la estabilidad de sus concentraciones, la conservación de la vida y la autosostenibilidad del planeta. Si en 1837, fecha de la fundación del Instituto Alfonso X el Sabio, se hubiesen conocido todas estas cosas, lo explicado sería una realidad tangible y esta exposición sería una loa a la Naturaleza. Ahora bien, no debemos minimizar la acción del hombre sobre su entorno. En los últimos 100 años, el imparable desarrollo industrial, el consumo exagerado de combustibles fósiles para la automoción, el uso de pesticidas, fertilizantes químicos y gases de refrigeración son tan poco respetuosos con el Medio Ambiente, que se están produciendo desequilibrios alarmantes en los ciclos naturales ¿Cuál es la situación actual? Hay una serie de circunstancias que debemos analizar: El aumento del CO2 atmosférico está produciendo el Efecto invernadero, que podría aumentar la temperatura de la Tierra conllevando a grandes sequías en unas zonas e inundaciones en otras, con las temidas hambrunas, así como la fusión de los glaciares polares que podría modificar el diseño de las costas. 8 La contaminación atmosférica en las grandes ciudades por óxidos de nitrógeno y de azufre, originados por la circulación rodada, pasan a las nubes y producen lluvias ácidas que ya han destruido bosques en el centro de Europa. La contaminación de las aguas continentales por exceso de fosfatos usados como fertilizantes en la agricultura extensiva y en los detergentes, son arrastrados por las corrientes subterráneas y llegan a los ríos y lagos, hacen crecer de modo desmesurado las algas y éstas en su respiración consumen el oxígeno disuelto en el agua, no permiten entrar a los rayos del sol y mueren los peces y demás especies acuáticas. A esto se le llama Eutrofización de las aguas. La presencia en los océanos de residuos plásticos llegan a formar auténticas islas y que tardarán decenios en degenerarse. La acumulación de tal cantidad de residuos urbanos en los vertederos de las ciudades que su gestión es cada vez más difícil. La destrucción de la capa de ozono estratosférico por el uso de gases CFC (compuestos muy ligeros y estables, que llegan a la ozonosfera y destruyen el ozono sin sufrir ellos modificación) que han sido empleados en los sistemas de refrigeración y como propelentes en los sprays, lo que conlleva que el índice ultravioleta sea cada vez más alto. La creciente deforestación de la selva del Amazonas y otros grandes bosques, por lo que los pulmones de la Tierra van disminuyendo. ¿Cuáles pueden ser las posibles soluciones para este tremendo estado de cosas? En 1992 se celebró en Río de Janeiro la Cumbre de la Tierra, en la que los delegados de los diferentes países trataron de llegar a acuerdos sobre cuáles eran los gases provocadores del calentamiento global y la cantidad real de emisiones a la atmósfera. Después de varias reuniones en años sucesivos se llegó en 1997 a la Convención de Kyoto, convocada para tratar de encontrar una solución coordinada al problema de la emisión de CO2 y otros gases de tipo industrial; fue firmada por todos los países asistentes, pero el Protocolo definitivo no fue ratificado por EEUU, el cual no cumple con los compromisos de reducción de emisión, ni aporta dotación económica. El compromiso de reducción de la emisión acordado en Kyoto, es variable de un país a otro, la media global de reducción es del 5% sobre las emisiones de cada país en 1990. Desde ese momento ha habido 17 reuniones llamadas COP, en las que se han ido obteniendo apoyos, el año 2012 era el año límite marcado para que se cumpliese todo el Protocolo de Kyoto, pero debido a la crisis económica actual el plazo se ha dilatado. 9 La sustitución los gases CFC por otros que no afecten el ozono estratosférico, es uno de los puntos en los que todos los países se han puesto de acuerdo siguiendo el Protocolo de Kyoto, y actualmente se van cambiando los CFC por otros gases igualmente eficientes, pero respetuosos con el Medio Ambiente. Asimismo, las industrias petroquímicas, siguiendo las indicaciones del Protocolo de Kyoto, han realizado una redefinición a nivel mundial, de nuevas formulas para los combustibles líquidos de consumo en automoción y calefacciones domésticas (gasolinas y gasóleos) habiéndose conseguido disminuir de forma ostensible la presencia de gases derivados del benceno y óxidos de azufre en el aire de las ciudades, potencialmente cancerígenos, emitidos por las combustiones de los combustibles antiguos. Algunos autores consideran que en estos momentos, con el vasto desarrollo de la Energías Renovables (solar, eólica, etc.), el uso masivo de los mecanismos con alta eficiencia energética, etc. nos encontramos al borde de la 3ª revolución industrial en la que la protección de la Naturaleza será una prioridad mundial. Esto, que hace dos o tres años parecía una realidad inminente, se está viendo mermado por la crisis económica. La Iglesia Católica también ha tomado postura desde el principio a favor de la protección del medio ambiente, en mayo de 1991 el papa Juan Pablo II en su Encíclica “Centesimus annus” defiende la protección de la biodiversidad y un cambio en los estilos de vida encaminados a la protección de la naturaleza, asimismo, el papa Benedicto XVI en su Encíclica “Cáritas in veritatis” publicada en junio de 2009, recomienda un cambio de mentalidad y de voluntad dirigidos a un uso racional de los recursos. Actualmente se intenta llegar a un Desarrollo Sostenible, de modo que los peligros se transformen en oportunidades, imponiendo como misión del hombre poner su inteligencia al servicio de la protección del planeta. Debemos considerar que la clave para la solución del problema no solo es de voluntad política, sino de concienciación, educación y compromiso personal. Muchas gracias. Mª de los Ángeles Gómez Hernández Catedrática jubilada de Física y Química del I.E.S. Alfonso X el Sabio Murcia, 17 de septiembre de 2012 10