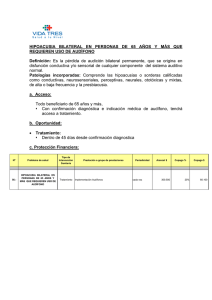
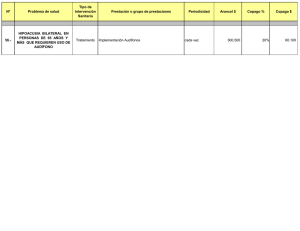
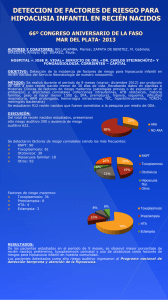
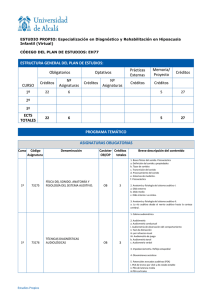
costo-efectividad del screening y tratamiento de hipoacusia bilateral
Anuncio

COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS Departamento de Economía de la Salud División de Planificación Sanitaria Subsecretaría de Salud Pública MINSAL 2013 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS REGISTRO PROPIEDAD INTELECTUAL: Nº INSCRIPCION 231.424 ISBN (VERSION IMPRESA) 978-956-348-029-0 ISBN (VERSION DIGITAL ) 978-956-348-030-6 Febrero 2013 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 4 Informe preparado por los siguientes profesionales del DESAL: Carla Castillo Laborde Sergio Loayza Saldivia Mónica Aravena Pastén Berenice Freile Gutiérrez Marianela Castillo Riquelme Febrero 2013 FINANCIAMIENTO El trabajo ha sido financiado enteramente por el Ministerio de Salud de Chile (MINSAL) a través de la contratación de los autores de este documento. Los recursos fueron canalizados a través del Departamento de Economía de la Salud (DESAL) de la División de Planificación Sanitaria de la Subsecretaría de Salud Pública. DECLARACIÓN DE CONFLICTOS DE INTERÉS Carla Castillo Laborde es economista y se desempeñó desde septiembre del 2005 hasta septiembre del 2012 como investigadora del DESAL de la Subsecretaría de Salud Pública del MINSAL. Realiza además, actividades de docencia en economía y economía de la salud en universidades, incluyendo participaciones como docente en talleres de fármaco-economía financiados por la industria farmacéutica. Mónica Aravena Pastén es enfermera y se desempeña desde Septiembre de 2008, como profesional del DESAL de la Subsecretaría de Salud Pública del MINSAL. Desde enero del 2012 asume la jefatura del DESAL. Ha participado en calidad de asistente en talleres de fármaco-economía financiados por la industria farmacéutica. Berenice Freile Gutiérrez es ingeniero civil industrial y se desempeña desde septiembre de 2008 como investigadora en el DESAL de la Subsecretaría de Salud Pública del MINSAL. Marianela Castillo Riquelme es economista en salud y se desempeña desde el 2009 como asesora en el DESAL de la Subsecretaría de Salud Pública del MINSAL. Realiza, además, actividades de docencia en evaluación económica, incluyendo participaciones como docente en talleres de fármaco-economía financiados por la industria farmacéutica. Sergio Loayza Saldivia, es médico especialista en salud pública y desde el año 2008 participa en el Ministerio de Salud como asesor en diferentes departamentos de ambas subsecretarías, colaborando desde el 2010 con el DESAL de la Subsecretaría de Salud Pública. Desde Enero 2013, se desempeña como profesional del Departamento de Epidemiología del Ministerio de Salud. Realiza, además, actividades de docencia en salud pública, metodología de la investigación y administración de salud en la Universidad Diego Portales. Ha participado en calidad de asistente en talleres de fármacoeconomía financiados por la industria farmacéutica. Ninguno de los autores ha sido consultor para la industria farmacéutica en materia de análisis de costo efectividad u otras evaluaciones económicas. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 5 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 6 ÍNDICE Contenido 1.Listado de abreviaciones 2.Agradecimientos 3.Resumen ejecutivo 4.Objetivos 5.Antecedentes 5.1.Historia natural y epidemiología 5.2.Métodos diagnósticos de hipoacusia. 5.3.Efectividad del tratamiento de la hipoacusia neurosensorial bilateral moderada a severa 5.4.Descripción guías clínicas minsal 6.Evaluaciones económicas en el tema a nivel internacional 7.Metodología 7.1.Tipo de evaluación económica 7.2.Comparadores 7.3.Perspectiva 7.4.Tipo de población 7.5.Efectividad y outcomes 7.6.Encuesta expertos. 7.7.Horizonte temporal 7.8. Uso de recursos 7.9. Modelo utilizado 7.10. Tasa de descuento 7.11.Incertidumbre 8. Resultados 8.1.Resultados variables epidemiológicas 8.2.Resultados encuestas epidemiológicas. 8.3.Resultados de efectividad y outcome en salud 8.4.Resultados de costo 8.5.Resultados de costo efectividad 8.6.Análisis de sensibilidad 9.Discusión 10.Referencias 11.Anexos Anexo 1. Encuesta consultas específicas sobre epidemiología en chile en hipoacusia bilateral Anexo 2. Formas encuestas eq-5d Anexo 3. Árbol de decisión Anexo 4. Parámetros del modelo Anexo 5. Listado de expertos consultados en encuesta epidemiológica Anexo 6. Listado de expertos participantes en encuesta eq-5d Página 7 9 10 17 17 20 24 25 26 33 36 36 36 37 37 37 38 42 42 43 44 44 45 46 46 47 50 58 59 70 73 78 79 81 93 97 106 108 I. LISTADO DE ABREVIACIONES AAP ASD ASP CAE CASEN CE CMV DALY dB DEIS DE DIGERA EQ-5D EOA EOAET ESP FN FND FP FR GASP GES HUI ICER IHE IMSS INR IT-MAIS MAIS MAV MDS MINSAL MUSS OMS PEAT PEAAT PTA QALY RMN RN SFR : American Academy of Pediatrics : Análisis de Sensibilidad Determinístico : Análisis de Sensibilidad Probabilístico : Conducto Auditivo Externo : Encuesta de Caracterización Socioeconómica Nacional : Costo Efectividad : Citomegalovirus : Disability Adjusted Life Year : Decibeles : Departamento de Estadísticas e Información en Salud (del MINSAL) : Desviación Estándar : División de Gestión de Redes Asistenciales (del MINSAL) : EuroQol 5 Dimensions Survey :Emisiones Oto-Acústicas :Emisiones Oto-Acústicas Evocadas Transitorias :Speech Early Perception :Falso Negativo :Fondo Nacional de la Discapacidad :Falso Positivo :Factor de Riesgo :Glendonald Auditory Screening Procedure Word and Sentence Tests :Garantías Explícitas en Salud :Health Utility Index :Incremental Cost Effectiveness Ratio :Institute of Health Economics :Instituto Mexicano de Seguridad Social :Indian Rupiees :Infant Toddler-Meaningful Auditory Integration Scale :Meaningful Auditory Integration Scale :Método Auditivo Verbal :Ministerio Desarrollo Social :Ministerio de Salud de Chile :Escala de Uso Significativo del Lenguaje :Organización Mundial de la Salud :Potenciales Evocados Auditivos de Tronco Cerebral :Potenciales Evocados Auditivos Automatizados de Tronco Cerebral :Pure Tone Audiometry :Quality Adjusted Life Year :Resonancia Magnética Nuclear :Recién Nacido :Sin Factor de Riesgo COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 7 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 8 SSMO : Servicio de Salud Metropolitano Oriente SSMSO : Servicio de Salud Metropolitano Sur Oriente STSG : Screening Test of Spanish Grammar TAC : Tomografía Axial Computarizada TECAL : Test para la Comprensión Auditiva del Lenguaje TEPROSIF: Test Procesos de Simplificación Fonológica UK : Reino Unido (United Kingdom) USA : Estados Unidos de América VN : Verdadero Negativo VP : Verdadero Positivo VPN : Valor Predictivo Negativo VPP : Valor Predictivo Positivo II. AGRADECIMIENTOS Los autores agradecen la participación de los especialistas que contestaron las encuestas de valoración de estados de salud (EQ-5D) y/o de epidemiología. Se agradece por el tiempo entregado, así como por el entusiasmo y los comentarios recibidos de los profesionales que se indica en orden alfabético: Nicolás Albertz, Margarita Arancibia, Martha Arrocet, Gonzalo Bonilla, Sofía Bravo, Loretho Bustamante, José Luis Calderón, Mario Campos, Andrea Cárdenas, Rodrigo Cárdenas, Jorge Caro, Isabel Carranza, Claudia Cornejo, Elena Cuitiño, Claudia Delucchi, Luis Dentone, Carolina Der, Marcelo Friant, Nora Gardilcic, Carolina Giesen, Cristián Godoy, Marcos Goycolea, Elizabeth Guajardo, Mariza Henríquez, Ximena Hormazábal, Monserrat Jara, Francisca Mansilla, Cecilia Mellado, Beatriz Muñoz, Ximena Pérez, Myriam Pinto, Enrica Pittaluga, Maritza Rahal, Leopoldo Razeto, Cecilia Reyes, Marcelo Ríos, Michel Royer, Eduardo Sáez, Sergio Sanhueza, Hernán Soto, Mariela Torrente y Javiera Vivanco. En forma especial se agradece la participación en la selección de los expertos en hipoacusia, así como en las respuestas a las encuestas, a la Sra. Cecilia Reyes, enfermera, Coordinadora Redes Neonatales y Pediátricas, de la Subsecretaría de Redes Asistenciales del MINSAL. Los autores reconocen y valoran la ayuda prestada por los especialistas en otorrinolaringología infantil, doctores Sergio Sanhueza y Mauricio Cohen, especialmente durante la etapa de las definiciones técnicas del estudio. Por último, recibimos la valiosa cooperación de los doctores Enrica Pittaluga, Maritza Rahal y Felipe Cardemil, quienes nos aportaron su experiencia respecto del screening de hipoacusia de recién nacidos prematuros en el sector público. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 9 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 10 3. RESUMEN EJECUTIVO INTRODUCCIÓN La hipoacusia neurosensorial es una de las discapacidades congénitas más habituales. Se presentaría con una frecuencia de entre 1 y 3 por 1.000 nacidos vivos (Gerner de García et al, 2011; Ptok, 2011; Grill et al, 2005; AAP, 1999). En aquellos recién nacidos (RN) con factores de riesgo como prematurez, bajo peso de nacimiento u hospitalización en Unidad de Cuidados Intensivos neonatales, la frecuencia aumentaría en 10 a 20 veces (Thompson et al, 2001). Durante el primer año y en particular los primeros meses de vida, los sonidos sirven para modular y completar el desarrollo del sistema nervioso y la función auditiva, siendo una etapa fundamental para que posteriormente aparezca el lenguaje. Es por esto, que el diagnóstico tardío del déficit, que sin un screening dirigido se da en promedio entre los 2 ½ y 3 años, determina retraso en el desarrollo de esta última función que finalmente se expresaría en la vida adulta en un trastorno de las funciones sociales y académicas, con el consiguiente deterioro de la calidad de vida (Wolff et al, 2010; Grill et al, 2005; Kennedy et al, 2006; Yoshinaga-Itano et al, 1998; Shulman et al, 2010; Makki-Torkko et al, 1998; Mehl y Thompson, 1998). Estudios han demostrado que con un diagnóstico precoz, seguido de una intervención precoz (terapia de amplificación, implantes cocleares con terapia de lenguaje) determinan una mejoría en los niveles de las distintas dimensiones del lenguaje (Yoshinaga-Itano et al, 1998; Yoshinaga-Itano y Apuzzo, 1998; Moeller, 2000; Yoshinaga-Itano, 2003). El desarrollo de tecnología que eleva la precisión en el diagnóstico ha permitido que varios países hayan desarrollado programas de screening de hipoacusia. En Chile, en el contexto del Régimen de Garantías Explícitas en Salud (GES), se implementó un screening selectivo en RN prematuros <32 semanas o <1.500 gramos. En este contexto, cabe la pregunta de cuán costoefectivo sería para el sector público del Sistema de Salud pasar de una estrategia de screening selectivo como la actual a una estrategia universal de tamizaje de hipoacusia neurosensorial congénita. Se revisaron 5 evaluaciones económicas que buscaban responder la pregunta antes planteada (Burke et al, 2012; Hessel et al, 2003; Keren et al, 2002; Kemper y Dows, 2000; Kezirian et al, 2001). En general, evaluaron el paso de una estrategia de screening selectiva, basada en factores de riesgo, a una universal, considerando outcomes intermedios (caso detectado) para el cálculo de los costos incrementales. Los estudios mostraron que ampliar la cobertura del screening, resultaba costo-efectiva, y en algunos casos costo-ahorrativa. Sin embargo, las diferencias metodológicas, así como de los contextos sanitarios en que se realizaron esos estudios, hacen difícil la extrapolación de resultados. Por otro lado, el uso de outcomes intermedios limita la interpretación de los mismos. Materiales y métodos Se realizó un estudio de costo utilidad para evaluar la costo-efectividad de pasar de una situación de screening selectivo1 de hipoacusia neurosensorial congénita bilateral en RN a un programa de screening universal de esta condición. El análisis se realizó desde la perspectiva del sector público del sistema de salud y se consideró como horizonte temporal la sobrevida de una cohorte de RN. La metodología del estudio se rigió por los lineamientos de la Guía Metodológica para la Evaluación Económica de Intervenciones en Salud en Chile, desarrollada por el MINSAL recientemente (MINSAL 2011). Las estrategias a comparar fueron el screening de hipoacusia de dos etapas usando en ambas Potenciales Evocados Auditivos Automatizados de Tronco Cerebral (PEAAT). La diferencia de ambas estrategias corresponde a la cobertura de RN, siendo la estrategia actual a <32 semanas o <1.500 gramos y la universal a toda la población de RN. La información epidemiológica se obtuvo de fuentes oficiales del Ministerio de Salud, de la literatura y de una encuesta realizada a expertos en esta condición. La precisión de los test diagnósticos se obtuvo de la literatura y la caracterización del proceso de screening de las Guías Clínicas nacionales. Por su parte, la efectividad de los tratamientos de amplificación se obtuvo por consulta a expertos. Para la medición de beneficios se determinaron outcomes intermedios (caso pesquisado) y outcomes finales que reflejaran los efectos en calidad de vida y mortalidad (QALY). Para la generación de estos se estableció como supuesto que la condición no determinaba una disminución de la expectativa de vida y que el peso estaría dado por la calidad. Los QALYs se calcularon asociando valores a 6 posibles estados finales para esta condición: hipoacusia moderada, severa y profunda, en caso de diagnóstico y tratamiento precoz versus diagnóstico y tratamiento tardío. En la determinación de los estados finales se consultó a expertos, a través de una encuesta y usando como instrumento el Cuestionario Europeo de 5 dimensiones (EQ-5D). Para asignarles un coeficiente de calidad de vida a los estados, se utilizaron las valoraciones nacionales de los estados de salud de la encuesta EQ-5D (Superintendencia de Salud, 2008; Zarate et al, 2011). Para los costos, se definieron los protocolos de tamizaje, confirmación diagnóstica y tratamiento, de acuerdo con lo planteado en las Guías Clínicas del Régimen GES del MINSAL. El valor de las prestaciones fue obtenido del Estudio de Verificación de Costo 2009, actualizado a mayo del 2012 (MINSAL 2010b). Para el análisis de la información se utilizó un modelo de árbol de decisión con el software TreeAge Pro 2011. Se usó una tasa de descuento de 3% para costos y beneficios. En el análisis de sensibilidad se determinaron escenarios con tasas de 0% y 6% indiferenciadas para costos y beneficios y un escenario con tasa diferenciada de 1,5% para beneficios y 3% para costos. En la literatura el concepto de screening selectivo de hipoacusia se usa para definir estrategias enfocadas en población con algún factor de riesgo de presentar esta condición en contraposición de estrategias universales cuya población objetivo es el 100% de los susceptibles. Para Chile, el screening selectivo de hipoacusia es más acotado al que se describe en la literatura, puesto que solo incorpora un factor de riesgo (prematurez) y además, lo restringe a menores de 32 semanas o 1.500 gramos al nacer. 1 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 11 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 12 Se realizó un análisis de sensibilidad determinístico (ASD) univariado, modificando las prevalencias de hipoacusia, la sensibilidad del screening y los costos. Finalmente se realizó un análisis de sensibilidad probabilístico (ASP) mediante una simulación de Montecarlo. Resultados: Se estimó que Chile tendría una prevalencia de hipoacusia congénita moderada a profunda de 3,0 por 1.000 nacidos vivos (Makki-Torkko et al, 1998; Fortnum et al, 2002; Nazar et al 2009; Russ et al, 2003; Mather et al, 2000). El porcentaje de RN con factores de riesgo se determinó en un 10% (Thompson et al, 2001; Torrente et al 2001) mientras que la frecuencia de prematuros <32 semanas fue de 1,3% (DEIS, 2009). La Tabla 1, muestra las prevalencias de hipoacusia congénita en los principales grupos incorporados al modelo de decisión. Tabla 1: Prevalencias de Hipoacusia en sub grupos de recién nacidos, por 1.000 nacidos vivos. Prevalencia de hipoacusia moderada a severa (por 1.000 nacidos vivos) Escenario Base Min Max Fuente Global en RN 2,0 1,0 3,0 Makki-Torkko et al, 1998; Fortnum et al, 2002; Nazar et al, 2009; Russ et al, 2003; Mather et al, 2000 RN prematuros (<32 semanas y/o <1500gr) 30 20 40 Minsal, 2009; Torrente et al, 2007; Cañete y Torrente, 2011. RN con factores de riesgo para hipoacusia. 10 5 15 Basado en Torrente et al, 2001 y Thompson et al, 2001 RN no prematuros (> 32 semanas y 1.500 gr) 1,6 - - En base a la prevalencia global y la prevalencia en prematuros de <32 semanas o <1500 gr. RN sin factores de riesgo 1,1 - - En base a la prevalencia global, la de hipoacusia en RN de alto riesgo y la proporción de niños con factores de riesgo De acuerdo con los resultados de la encuesta a expertos realizada, la distribución de RN con hipoacusia por intensidad del déficit es de un 44,78% (±19,79) para moderada, un 27,08% (±10,44%) para severas y un 28,14% para profundas (esta última frecuencia se obtiene de las dos anteriores para efectos del modelo). Los valores de sensibilidad y especificidad del PEAAT, usado en el screening de dos etapas evaluado, fueron de 95% y 90%, respectivamente (Burke et al, 2012; Keren et al, 2002). De acuerdo con la consulta a expertos al diagnosticar y tratar precozmente a un RN con hipoacusia, no responderían a terapia de amplificación y requerirían de implante coclear un 4,68% (±7,01) de los moderados, un 41,80% (±20,68) de los severos y en un 91,00% (± 15,94) de los profundos. Con el diagnóstico tardío, la no respuesta aumentaría a un 6,63% (±8,94), 52,77% (±25,12) y 91,88% (±12,73), para moderados, severos y profundos, respectivamente. De acuerdo a consulta a expertos, los valores asociados a los estados de salud finales mostraron una reducción del nivel de calidad de vida asociada a salud descendiente en la medida que aumentaba la intensidad de la hipoacusia y el diagnóstico y tratamiento se realizaba tardíamente. En la Tabla 2 se muestran los valores promedios y las desviaciones estándar de las valoraciones reportadas por los expertos a través de la encuesta EQ-5D. Tabla 2: valores de estados de salud definitivos de pacientes con hipoacusia bilateral congénita según intensidad del déficit y oportunidad de diagnóstico y tratamiento. Intensidad de hipoacusia y oportunidad de diagnóstico y tratamiento Valor promedio Desviación estándar Hipoacusia moderada diagnóstico y tratamiento precoz 0,936 0,122 Hipoacusia moderada diagnóstico y tratamiento tardío 0,516 0,178 Hipoacusia severa diagnóstico y tratamiento precoz 0,910 0,112 Hipoacusia severa diagnóstico y tratamiento Tardío 0,511 0,213 Hipoacusia profunda diagnóstico y tratamiento Precoz 0,905 0,139 Hipoacusia profunda diagnóstico y tratamiento Tardío 0,473 0,226 Muerte 0 - Salud perfecta 1 - La Tabla 3, por su parte muestra los resultados de costos para cada una de las etapas del screening y tratamiento de la hipoacusia bilateral congénita. Los valores se encuentran a mayo del 2012, y se indica el año en que se realizaría la canasta. Los costos totales por RN de la estrategia de screening selectivo fueron de $26.486,4 y para la estrategia universal de $32.620,5, en tanto que la efectividad en QALY fue de 30,0523 y de 30,0708, respectivamente. Esto determina una Razón Incremental de Costo Efectividad (ICER) de $331.368,22. Comparada con un umbral de disposición a pagar de 1 producto interno bruto per cápita como plantea la Guía de Evaluaciones Económicas para Chile (MINSAL, 2011), ascendente a 6,97 millones para el 2011, se puede señalar que la estrategia de screening universal es costo-efectiva en relación a la estrategia de screening selectivo. Tabla 3: Costos de cada etapa del proceso de screening, diagnóstico y tratamiento de hipoacusia bilateral congénita. Etapa del diagnóstico y tratamiento Screening hipoacusia Test 1 Screening hipoacusia Test 2 (RN factor de riesgo o prematuro) Screening hipoacusia Test 2 (RN sin factor de riesgo) Confirmación diagnóstica Valor (Mayo 2012) $ 8.274 $ 14.170 $ 8.274 $ 59.002 Implementación bilateral de audífonos año 1 $ 932.704 Implementación bilateral de audífonos año 2 $ 406.556 Implementación bilateral de audífonos tercer y cuarto año. $ 863.194 Implementación bilateral de audífonos 5, 6 y 7 años. $ 346.788 Implementación bilateral de audífonos año 8 en adelante $ 101.802 Evaluación implante coclear Implante coclear $ 173.309 $ 19.953.986 Seguimiento implante coclear año 2 $ 557.978 Seguimiento implante coclear año 3 $ 776.670 Seguimiento implante coclear año 4 $ 719.234 Seguimiento implante coclear año 5, 6, 7 $ 355.738 Seguimiento implante coclear año 8 en adelante $ 5.896 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 13 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 14 En términos poblacionales, si se considera una cohorte de RN de 252.240 niños, como la del año 2009, la estrategia de screening selectivo permite pesquisar precozmente 88 RN prematuros con esta discapacidad, sin embargo, se dejan de diagnosticar oportunamente 416 niños. La estrategia de screening universal permitiría pesquisar 455 niños con hipoacusia, con unos 49 RN falsos negativos. El costo estimado de la estrategia selectiva incluyendo el proceso diagnóstico y el tratamiento es de $6.680,82 millones y de la universal $8.228,06 millones. El costo por caso extra de hipoacusia bilateral congénita detectado precozmente al pasar de una estrategia a otra es de $4.215.913 (US$8.875,61)2 . En el análisis de sensibilidad determinístico se valoró las variaciones del resultado en base a 5 parámetros: tasa de descuento, prevalencia de hiopoacusia en RN, prevalencia hipoacusia en RN prematuros, sensibilidad y costo primer test (PEAAT). Los resultados del ASD pueden verse en la Tabla 4. Tabla 4: Resultados análisis de sensibilidad determinístico de una vía. Variable Escenario base Rango Rango ICER Tasa de descuento (indiferenciada) 3% 0% - 6% 87.385,69 a 718.682,02 Tasa de descuento (diferenciada) 3% 3% costos y 1,5% outcomes a 6% costos y 3% outcomes 216.618,34 a 394.171,4 Prevalencia global hipoacusia en RN 2 por 1.000 nacidos vivos 1, a 3,0 por 1.000 nacidos vivos 2.998.918,06 a -117.053,71 Prevalencia hipoacusia en RN prematuros 30 por 1.000 nacidos vivos 20 a 40 por 1.000 nacidos vivos 308.602,49 a 357.860,46 Sensibilidad del test (PEAAT) primera fase del screening 95% 90% a 100% 380.722,33 a 287.270,97 $8.274 $6.619 a $9.929 235.004,54 a 427.731,91 Costo del test (PEAAT) primera fase del screening En términos generales, ningún parámetro modificó sustancialmente el sentido del ICER resultante en el escenario base, manteniéndose para todos los rangos de valores de las variables seleccionadas, la estrategia universal como costo-efectiva en relación con la selectiva. En el ASP se obtuvo un ICER promedio de $615.037,3 por QALY ganada. La estrategia universal aparece como costo-ahorrativa para aproximadamente el 11,0% de los posibles resultados y en el 0,2% es no costo-efectiva. Al comparar con el umbral de disposición a pagar definido por la Guía de Evaluaciones Económicas para Chile (MINSAL, 2011), correspondiente a un producto interno bruto per cápita ($MM 6,97), el paso de una estrategia selectiva a una universal tendría una probabilidad de 99,2% de ser costo-efectiva. La Tabla 5 y la Figura 1 muestran los resultados del ASP. Cambio 1 Dólar son $475 (11 de septiembre 2012). 2 Tabla 5: resultados estadísticos ASP (Simulación de Montecarlo, 5.000 iteraciones) Costos incrementales ($2012) QALYs Ganadas ICER Media $ 6.158,5 0,0184 $ 615.037,3 Desviación estándar $ 4.953,8 0,0079 $ 3.043.271,4 Máximo $ 19.925,3 0,0485 $ 180.182.255,5 Percentil 95 $ 13.883,9 0,0323 $ 1.747.212,2 Mediana Percentil 5 Mínimo $ 6.363,4 0,0179 $ 350.457,3 -$ 2.517,3 0,0066 $ -109.021,7 -$ 14.623,2 -0,0040 $ -34.254.726,6 Figura 1: Diagrama de dispersión ASP, Simulación de Montecarlo. Discusión. De acuerdo a los resultados obtenidos, el pasar de la estrategia selectiva focalizada en RN <32 semanas y <1.500 gramos a una estrategia universal resulta costo-efectivo para el escenario base. Este resultado aparece robusto puesto que no se modificó con la variación de parámetros con incertidumbre asociada en los ASD y ASP. Con una disposición a pagar de $6,97 millones la probabilidad de que la ampliación a una estrategia universal de tamizaje resulte costo-efectiva es de un 99,3%. Esto se mantuvo aun cuando se bajó la prevalencia de la hipoacusia y, por lo tanto, los valores predictivos de los test de screening fueran menores que en la situación actual. Los resultados favorables en relación a la estrategia de screening universal se pueden explicar considerando algunas características del problema de salud en particular. Por una parte, la detección de un mayor número de niños de manera precoz, aprovechando la ventana fisiológica que se expresará como una mejoría de sus outcome finales, aporta desde el punto de vista de las ganancias en salud. Por el lado de los costos, si asumimos que los niños a los que no se le realiza el screening serán COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 15 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 16 necesariamente detectados cuando la hipoacusia se manifieste como un retraso del lenguaje, los costos del tratamiento al cambiar de estrategia solo se retrasan, estando la diferencia determinada principalmente por el valor del screening (al ampliar la cobertura) y el diferencial del tratamiento debido a la tasa de descuento. Una limitación del estudio que pudiese repercutir en los resultados es escasez de información epidemiológica a nivel nacional la que se tuvo que enfrentar mediante datos de la literatura. De la misma manera se desconoce para Chile la distribución por intensidad de hipoacusia, lo cual hizo necesaria la consulta expertos en esta patología. Existe también, poca literatura nacional e internacional que dé cuenta de la calidad de vida de las personas con hipoacusia y cuánto la detección precoz podría mejorarla. La construcción de QALYs a través de consulta a expertos mediante el cuestionario EQ-5D, pudiese presentar sesgos a favor de un resultado costo-efectivo, al estar estos profesionales interesados en la aplicación universal de la estrategia, aun cuando la metodología usada buscaba reducir esta fuente de error. Sin embargo, se debe considerar un avance el uso de las valoraciones nacionales de diferentes estados de salud. Por último, y también en relación a las limitaciones antes señaladas, el análisis considera las especificidades y sensibilidades del test PEAAT reportadas en la literatura internacional, y por tanto, representan un escenario que podría denominarse “ideal” en relación a que dichos parámetros estarían más cercanos a la eficacia que a la efectividad del test. Esto requiere una reflexión adicional relativa a la importancia de lograr, en la implementación de una estrategia universal, niveles de sensibilidad y especificidad de los tests cercanos a los reportados. Aun así, es posible encontrar consistencia entre este resultado y los reportados en otras evaluaciones económicas. A pesar de las diferencias metodológicas (perspectivas, outcomes y costos considerados) los estudios analizados tienden a considerar como costo-efectiva la ampliación de la cobertura del programa de screening de hipoacusia (Burke et al, 2012; Kazarian et al, 2001; Keren et a, 2002). Dado que el análisis se realizó desde la perspectiva del sector público de salud, no es posible la generalización de los resultados a todo el país, aun cuando sobre el 70% de la población es beneficiaria del seguro público. Pareciera razonable, de acuerdo a estos resultados, explorar la factibilidad técnica y de recursos de ampliar la cobertura de la detección precoz de hipoacusia en particular porque significa aumentar de 3 mil evaluaciones a sobre 250 mil. 4. OBJETIVOS El objetivo principal de este estudio es determinar la costo-efectividad incremental de pasar de una estrategia selectiva de screening y tratamiento oportuno de hipoacusia bilateral congénita enfocada en recién nacidos (RN) prematuros (< 32 semanas o < 1.500 gramos) a un programa universal de screening y tratamiento oportuno de hipoacusia bilateral congénita. Son objetivos específicos: a.Determinar y describir las características epidemiológicas de la hipoacusia congénita en Chile, el programa de screening actualmente vigente, las intervenciones diagnósticas existentes, las características del tratamiento y de su efectividad. b.Desarrollar un modelamiento matemático del screening de hipoacusia congénita y su posterior tratamiento considerando como comparadores un programa universal versus uno selectivo para RN prematuros. c.Determinar los outcomes en salud asociados a los programas de screening y tratamiento antes definidos. d.Determinar los costos asociados a los programas de screening y tratamiento antes definidos. e.Determinar la razón de costo efectividad incremental para un programa de screening universal de hipoacusia congénita v/s un programa de screening selectivo a RN prematuros. f. Realizar un análisis de sensibilización (determinístico y probabilístico) de los resultados, en consideración a la incertidumbre asociada a los parámetros incorporados en el modelo. 5. ANTECEDENTES De acuerdo a las estadísticas de la Organización Mundial de la Salud (OMS), considerando la discapacidad como una pérdida de salud en los ámbitos de movilidad, cognición, audición y visión, el 2,9% de la población mundial tendría un problema de salud que determinaría una discapacidad severa, en tanto que un 12,4% tendría una discapacidad moderada de larga evolución. La frecuencia de discapacidad aumentaría con los años y se relaciona con el nivel de desarrollo del país. Las causas más frecuentes de discapacidad son la hipoacusia, problemas de visión y los trastornos mentales (WHO, 2004). COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 17 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 18 El primer Estudio Nacional de la Discapacidad en Chile (FND, 2005), realizado en el año 2004, mostró que en el país existirían 2.068.072 personas con algún tipo de discapacidad, cifra correspondiente al 12,9% de la población. Estas personas agregarían, aproximadamente 3,4 millones de déficits. Por su parte, 292.720 personas tendrían problemas de tipo auditivos, representando un 14,2% del total de personas discapacitadas. En relación al total de déficits la disminución de la capacidad auditiva correspondería al 8,7% del total de deficiencias encontradas. La distribución por tipo de déficit de las personas con discapacidad, según esta encuesta se puede observar en la Tabla 6. Tabla 6: Distribución por tipo de déficit, Estudio Nacional de la Discapacidad Chile, 2005. Deficiencias Distribución (Número de personas) Física 31.3% (1.048.347) Visual 19% (634.906) Viscerales 13,9% (466.584) Múltiples (3 o más) 10,3% (343.797) Intelectual Auditivas 9,0% (301.591) 8.7% (292.720) Psíquicas 7.4% (262.720) Trastornos Severos de la Comunicación 0.5% (262.151) Implementación bilateral de audífonos año 8 en adelante $ 101.802 Fuente: adaptado de 1º Estudio Nacional de la Discapacidad en Chile (Pág. 61). Abril 2005. Por otro lado, los resultados de la encuesta CASEN 2009 (MDS, 2009), muestran que el 7,6% de la población presenta algún tipo de discapacidad y que un 13,6% de los déficit correspondería a sordera o dificultad auditiva. Del total de discapacidades declaradas, el 21,6% son de carácter congénito mientras que el 54,4% tendrían su origen en una enfermedad ocurrida con posterioridad al nacimiento. La mudez o dificultad para hablar son principalmente congénitas, alcanzando a un 47,3% de los casos, en tanto que el 14,5% de la hipoacusias tendrían este origen. La tasa de analfabetismo afecta en un 26,5% a quienes tienen mudez o dificultad en el habla, en un 14,2% de las personas con déficit auditivo y en un 26,2% a quienes tienen alguna discapacidad de nacimiento. El déficit auditivo o hipoacusia es la discapacidad congénita más habitual entre los RN vivos. Torrente et al. (2001) mencionan, a partir de literatura internacional, que la incidencia de hipoacusia neurosensorial bilateral profunda a severa se estima en 1 por 1.000 nacidos vivos, y que si se considera sólo a la población con factores de riesgo, esta incidencia aumenta a entre 1 a 2 por 100 nacidos vivos. En los RN la discapacidad auditiva es una deficiencia no evidente, dado que el niño puede dar una falsa percepción de estar escuchando al reaccionar a la luz, ruidos de altos decibeles, movimientos o a las vibraciones, retrasando el diagnóstico. Por su parte, la audición está directamente relacionada con la consecución del lenguaje y este con el desarrollo de habilidades propias de la vida moderna. En consecuencia, el diagnóstico tardío de este déficit, dificultará el desarrollo cognitivo, afectivo e integración social del niño afectando, por lo tanto, su vida futura. En este escenario, la búsqueda dirigida del déficit en los primeros meses de vida cobra importancia (MINSAL, 2009). En este contexto, varios países han incorporado el tamizaje de hipoacusia universal, por ejemplo Reino Unido, Australia y Estados Unidos, que cuentan con legislación implementada, y en varios otros se está avanzando en su implementación (Aurélio y Tochetto, 2010). Gerner de García et al. (2011) revisaron, entre 2007 y 2008, el estado de los servicios asociados a la detección y tratamiento temprano de la hipoacusia en Latinoamérica. A través de una encuesta contestada por Chile, Costa Rica, Guatemala, México, Panamá, Uruguay y Puerto Rico se reportan los diferentes abordajes y esfuerzos por alcanzar la estrategia de screening universal en RN. A la fecha de la revisión, sólo Puerto Rico contaba con un programa de screening universal. De Chile se destaca la existencia del requerimiento por ley del screening de hipoacusia a RN prematuros en el Régimen de Garantías Explícitas en Salud (GES), y de algunas iniciativas pilotos de programas de screening universal en hospitales públicos y privados. Para el resto de los países se reporta la existencia tanto de screening selectivo como universal, en algunos hospitales. Cabe mencionar el caso de México, país que desde el 2005 cuenta con el requerimiento por ley de screening a todo RN, aunque al momento de la revisión sólo había sido implementado en algunos hospitales. Por otra parte, en Argentina se ha aprobado recientemente la creación del Programa Nacional de Detección Temprana y Atención de la Hipoacusia que incluye screening neonatal universal dentro del primer mes de vida. En este país la discapacidad auditiva abarca un 18% del total de las discapacidades (Superintendencia de Servicios de Salud, Argentina, 2011). En Chile, en consideración a la magnitud de este problema en los RN prematuros, población en la cual la prevalencia es mayor, el año 2005 se incorporó en el Régimen GES, el problema de salud denominado “Prematurez – Hipoacusia Neurosensorial Bilateral del prematuro”, otorgando así a la población de prematuros de < 32 semanas o con peso de nacimiento <1.500 gramos, independiente de la previsión o condición económica de la madre, las garantías de Acceso, Oportunidad, Protección Financiera y Calidad tanto para su diagnóstico cómo para el tratamiento. En este contexto de screening selectivo garantizado actualmente vigente en el país, cabe preguntarse respecto de la posibilidad de ampliar la cobertura a todos los RN. Dado que, tal decisión resultaría en un importante uso de recursos adicionales, la medición de los beneficios obtenidos al pasar de una estrategia selectiva a una de screening universal y de la eficiencia en el uso de tales recursos, a través de una evaluación económica (EE) se presenta como un importante insumo para la toma de decisiones. A continuación se presentan antecedentes respecto de la historia natural y epidemiología de la hipoacusia neurosensorial bilateral en Chile, así como una descripción del protocolo de atención garantizado en el Régimen GES. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 19 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 20 5.1. HISTORIA NATURAL Y EPIDEMIOLOGÍA Definición y clasificación El término hipoacusia hace alusión a la pérdida de la capacidad de percepción sensorial de sonidos con un umbral auditivo de 20 a 26 decibeles (dB) o más en un rango de frecuencias fundamental para el reconocimiento del lenguaje hablado (500 a 4000 Hertz). Este déficit puede ser unilateral o bilateral; permanente, transitorio, recurrente, fluctuante o progresivo; y según su origen, congénito o adquirido (Nelson et al, 2008; MINSAL, 2009; IHE, 2007; Patel y Feldman, 2011). Se pueden clasificar las hipoacusias según la parte del órgano auditivo afectado en: conductivas, neurosensoriales o mixtas. En el primer grupo están todas aquellas en que se vean afectadas estructuras del oído externo como el pabellón auricular o conducto auditivo externo (CAE), o estructuras del oído medio como la membrana timpánica, la cadena osicular, o el espacio aéreo del oído medio. Son ejemplos de hipoacusia conductivas de origen congénito, la microtia (malformaciones o ausencia del pabellón auricular), la atresia o estenosis del CAE, y diferentes anomalías de la cadena osicular. Este tipo de hipoacusia no tiene comprometida estructuras neuronales o de los receptores acústicos y en la mayoría de los casos su tratamiento es médico o quirúrgico (Smith y Gooi, 2012; IHE, 2007). En las hipoacusias neurosensoriales, se ven afectadas estructuras del oído interno, del octavo par craneal o del sistema nervioso central asociadas a la función auditiva. Entre las de origen congénito, destacan las de causa infecciosa (citomegalovirus, toxoplasmosis, rubéola, sífilis), las malformaciones del oído interno y las causadas por enfermedades hereditarias (Síndrome de Alport, Sindrome de Jervell-Lange Nielsen, Síndrome de Waaldenberg, entre otros). Por su parte en las hipoacusias de origen mixto, hay componentes conductivos y neurosensoriales que determinan finalmente el déficit. Un número importante de este tipo de hipoacusia se beneficiaría de terapias de amplificación e implante coclear. Un grupo especial de hipoacusias adquiridas que se comportan como congénitas (se adquieren durante los primeros meses de vida) se produce en RN de bajo peso al nacer (<1500 gramos). Este grupo presenta un riesgo mayor de adquirir un déficit auditivo (1- 2%) (Torrente et al, 2001; Cañete y Torrente, 2011), el cual se estima estaría asociado a diferentes exposiciones durante el periodo perinatal (drogas ototóxicas, hipoxia, acidosis, hiperbilirubinemia, ruido ambiental) (Smith y Gooi, 2012). La intensidad de la pérdida auditiva se establece en base al oído con mejor nivel de audición detectado en exámenes audiológicos, clasificándose en leves, moderadas, severas y profundas. Los rangos de audición (en dB) definidos para situar a una persona en un nivel no son universales, presentándose algunas diferencias según el grupo de estudio. En la Tabla 7, se presentan los rangos más usados. En términos generales, las mayores diferencias se dan en el nivel en que se establece la hipoacusia severa y profunda, coincidiendo el nivel de inicio de la hipoacusia moderada. Tabla 7: Clasificación de hipoacusias según niveles de audición Severidad de la Hipoacusia Sociedad Británica de audiología; Asociación británica de profesores de sordos.* Organización Mundial de la Salud (Mather et al, 2000) Sociedad de pediatría Canadiense (Patel and Feldman, 2011). Guía clínica hipoacusia neurosensorial México (IMSS, 2010) Leve 20-40 dB 26-40 dB 20 – 40 dB Moderada 41- 70 dB 41-60 dB 40 – 60 dB Severa 71 – 95 dB 61 – 80 dB 60 – 80 dB > 95 dB >80 dB > 80 dB Profunda Fuente: elaboración propia en base a la fuentes señaladas. *La Guía Clínica de Hipoacusia Bilateral neurosensorial del Prematuro Chilena, adhiere a esta clasificación (MINSAL, 2009). Cuadro clínico La hipoacusia congénita bilateral en sí misma no se manifiesta o no es detectable por los padres hasta que se expresa en un déficit del desarrollo del niño, particularmente del lenguaje. Se debe considerar que el RN puede responder a múltiples estímulos (visuales, vibraciones, etc.) que pueden ocultar la falta de respuesta a los estímulos sonoros. Estos hechos determinan que en promedio, la edad de detección del déficit sin un programa de screening sea a los 2 ½ a 3 años de vida (Shulman et al, 2010; Grill et al, 2005; Wolff et al, 2010; Makki-Torkko et al, 1998; Mehl y Thompson, 1998). Las diferencias en la edad del diagnóstico, cuando no existe una pesquisa dirigida, dicen relación con la intensidad del déficit y el nivel de sospecha asociado al riesgo del RN. Como sería de esperar, mientras más profunda es la pérdida de la función auditiva mayor será el compromiso del lenguaje y, por ende, más precozmente los padres tenderán a sospechar la existencia de un problema. Por el contrario, en la medida que la pérdida sea menor (hipoacusias leves y moderadas) o unilaterales puede ser el desarrollo de problemas conductuales o el fracaso escolar los que lleven a sospechar de la existencia de un problema de audición (Vohr, 2003). Existen algunos factores reconocidos como de riesgo para presentar hipoacusia neurosensorial bilateral, que facilitan la sospecha, la búsqueda dirigida del déficit y, por lo tanto, el diagnóstico precoz de este. El 50% de los niños con hipoacusia presentarían alguno de estos factores de riesgo (Makki-Torkko et al, 1998). De acuerdo con la American Academy of Pediatrics (AAP, 2007), los principales factores de riesgo para el desarrollo de hipoacusia en la infancia son: • Historia familiar de hipoacusia permanente en la infancia • Historia de estadía de más de 5 días en unidad de cuidados intensivos neonatal o cualquiera de las siguientes situaciones independiente de los días de estada: ventilación asistida, uso de oxigenación por membrana extracorpórea, exposición a medicamentos ototóxicos, uso de diuréticos de asa, e hiperbilirrubinemia que haya requerido transfusión • Infección intrauterina (citomegalovirus, herpes, rubeola, sífilis, toxoplasmosis) • Anomalías cráneo faciales • Hallazgos físicos asociados con síndromes que incluyen hipoacusia neurosensorial o conductiva • Trastornos neurodegenerativos • Infecciones postnatales asociadas con hipoacusia como meningitis viral o bacteriana COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 21 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 22 • Trauma encefálico, especialmente si hay fractura de la base del cráneo y del hueso temporal • Quimioterapia • Preocupación de los cuidadores del niño respecto de su nivel de audición, lenguaje y desarrollo en general Según Thompson et al. (2001) la proporción de RN que tendrían estos factores de riesgo variaría entre un 10% y un 30%. Por su parte, el mismo autor plantea que entre el 50% y 70% de los RN con hipoacusia, tendría uno de estos factores. Se sabe que la función auditiva al momento del nacimiento no se encuentra totalmente desarrollada y que durante los primeros 18 meses de vida, el estímulo sonoro participaría en este proceso neurológico y su vínculo con la función del lenguaje y otras funciones cognitivas (Wolff et al, 2010; Grill et al, 2005). Es por este motivo que se considera que el abordaje terapéutico precoz de los infantes con problemas auditivos permite exponer al oído interno y sus redes neuronales a los estímulos necesarios para completar su desarrollo. Una exposición tardía, por fuera de la ventana de desarrollo de este sentido, determinaría resultados inferiores en las funciones del leguaje, sociales y académicas (Kennedy et al, 2006; Yoshinaga-Itano et al, 1998). Epidemiología En términos generales, se acepta que la prevalencia de hipoacusia neurosensorial bilateral varía en un rango que va entre 1 y 3 por 1.000 nacidos vivos (Gerner de García et al, 2011; Ptok, 2011; Grill et al, 2005; AAP, 1999), sin embargo, dependiendo de la metodología usada, la edad en la cual es evaluado el niño, la definición de hipoacusia que se consideró (en particular el umbral en decibeles), la raza y la región en que se realizan los estudios, se amplía el rango de prevalencia de 0,05% a 7,7% según lo publicado por Mather et al, 2000. Un estudio realizado en localidades del norte de Finlandia (Makki-Torkko et al, 1998), para una cohorte de niños nacidos entre 1973 y 1992, encontró una prevalencia de hipoacusia moderada a profunda (>40 dB, 0,5 a 4 Hz) de 1,2 por 1.000 nacidos vivos, de los cuales el 83% se consideró como congénita o adquirida precozmente, el 87,7% fue de origen neurosensorial, el 5,1% conductiva, el 3,6% mixta y 3,6% desconocida. En el caso de los congénitos o precozmente adquiridos, el 55% fue moderada (40-70 dB), el 12% fue severa (70-95 dB) y el 32% fue profunda (>95 dB). Fortnum et al. (2002) encuentran una prevalencia de hipoacusia moderada a profunda (> 40 dB) de 2,05 por 1.000 nacidos vivos para UK, siendo el 53% moderada (40-70 dB), el 21% severa (70-95 dB) y el 25% profunda (>95 dB). Con una metodología similar, un estudio en el estado de Victoria, Australia (Russ et al., 2003), encontró una distribución de hipoacusia profunda (>90 dB), severa (61-90 dB) y moderada (40-60 dB) de 15%, 28% y 57% respectivamente. La prevalencia en ese estudio para hipoacusia bilateral mayor a 40 dB, fue de 1,12 por 1.000 nacidos vivos, habiendo sido pesquisadas en el periodo neonatal el 90% de estas. En Chile no existen datos oficiales respecto de la epidemiología de la hipoacusia congénita, aunque algunos estudios nos entregan antecedentes relevantes. Nazar et al. (2009) evaluaron con screening de dos etapas a 10.001 RN a las 36 horas de vida que no requirieron unidad de paciente crítico en la Clínica las Condes de Santiago, entre el año 2001 y el 2007 (100% de cobertura). La prevalencia global de hipoacusia encontrada fue de 2,8 por 1.000 nacidos vivos, en tanto, para hipoacusia bilateral moderada a profunda, la prevalencia fue de 1,0 en 1.000 nacidos vivos (10 casos confirmados). En este grupo, la distribución fue de 70% moderados, 10% severos, 20% profundas. Tabla 8. Prevalencia hipoacusia neurosensorial bilateral moderada a profunda Estudio País Makki-Torkko et al. (1998) Norte de Finlandia Fortnum et al. (2002) Criterio Prevalencia PTA(0,5 – 4 kHz) >40 dB 1,2 por 1.000 RN United Kindom > 40 dB (0,5-4 kHz) 2,05 por 1.000 RN Nazar et al (2009) Santiago, Chile No se indica 1,0 por 1.000 RN Russ et al. (2003) Victoria, Australia > 40 dB (0,5, 1 y 2 kHz) 1,12 por 1.000 RN Fuente: elaboración propia en base a los estudios mencionados. Tabla 9. Distribución por intensidad de hipoacusia neurosensorial bilateral moderada a profunda Estudio País Makki-Torkko et al. (1998) Norte Finlandia Fortnum et al. (2002) Russ et al. (2003) Nazar et al. (2009) Santiago, Chile Moderada Severa Profunda 55% (40-70dB) 12% (70-95dB) United Kindom 53% (40 -70 dB) 21% (70-95 dB) 25% (>95 dB) Victoria, Australia 57% (40 – 60 dB) 28% (90-61 dB) 15% (> 90 dB) 70% 10% 20% Fuente: elaboración propia en base a los estudios mencionados. 32% (>95 dB) Algo más de información se encuentra disponible en el caso de los RN prematuros, o más específicamente de los <32 semanas o <1.500 gramos. Esto porque desde el 2005 este grupo de RN tuvo acceso garantizado al screening de hipoacusia. De acuerdo a datos del DEIS, desde ese año hasta el 2009, este grupo de prematuros constituyó entre el 1,23% y el 1,36% del total de RN vivos (Tabla 10). Tabla 10. Recién nacidos menores de 32 semanas o 1.500 gramos, Chile, 2005-2009 Año Recién nacidos <32 semanas o < 1.500 gramos Total recién nacidos Porcentaje RN < 32 semanas o < 1.500 gramos. 2005 2.831 230.831 1,23% 2006 3.153 231.383 1,36% 2007 3.120 240.569 1,30% 2008 3.290 246.581 1,33% 2009 3.300 252.240 1,31% Fuente: elaboración propia en base a datos del DEIS. En un estudio de seguimiento de RN de muy bajo peso (<1.500 gramos) en el Hospital San Juan de Dios de Santiago (Torrente et al, 2007) durante los años 1999 y 2004, se determinó una prevalencia de hipoacusia neurosensorial bilateral de moderada a profunda (>40 dB) de un 4%. La muestra consideró al 53,6% del universo potencial, a los que se les evaluó con potenciales auditivos evocados y examen clínico, y luego confirmación con audiometría. Todos los casos presentaron umbrales auditivos mayores a 60 dB. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 23 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 24 En el Hospital Padre Hurtado del SSMSO desde el 2005 al 2009, con un protocolo de tamizaje en dos etapas con PEAAT se evaluaron 166 RN <32 semanas o 1.500 gramos, confirmando 5 RN con hipoacusia bilateral leve a profunda, de los cuales 2, durante el seguimiento, modificaron su estatus. La prevalencia reportada fue de 1,8% (un moderado y dos profundos) (Cañete y Torrente, 2011). De acuerdo a la Guía Clínica Ministerial (MINSAL, 2009), existen otros dos reportes con prevalencia de hipoacusia neurosensorial para prematuros < 32 semanas o <1.500 gramos. Uno de ellos es del SSMO con una prevalencia de 2,2% entre los años 1999 y 2001. El segundo reporte es del SSMSO con una prevalencia de 1,7%. Ninguno de estos dos reportes habría sido publicado. Se estima que el riesgo de hipoacusia moderada a profunda de RN que han pasado por una unidad de paciente crítico neonatal es 10 a 20 veces mayor que el de la población general (Thompson et al, 2001). 5.2. MÉTODOS DIAGNÓSTICOS DE HIPOACUSIA. Para el diagnóstico precoz de la hipoacusia en el RN, se han implementado una variedad de esquemas que combinan diferentes test capaces de censar de manera objetiva el déficit a nivel del receptor y las vías nerviosas auditivas. Estos esquemas o estrategias, pueden ser de una etapa, vale decir, se realiza un test y luego a los que resulten positivos se les confirma el diagnóstico con una batería de exámenes y evaluación por especialistas, o bien de dos etapas, en que se realizan dos test y habiendo dado positivo en ambas etapas, se le confirma el déficit. Son dos las principales tecnologías utilizadas, ya sea solas o en combinación, para las estrategias de screening de hipoacusia en el RN: Emisiones Otoacústicas (EOA) y los Potenciales Evocados Auditivos de Tronco Encefálico (PEAT). Ambas tecnologías están en pleno desarrollo y han ido derivando en dispositivos de mayor sensibilidad y especificidad, facilidad de uso y aceptabilidad. Cada uno de estos test tienen ventajas y desventajas, sin embargo, no es objetivo de este estudio profundizar en los aspectos técnicos de los diferentes test, más allá de su precisión para el diagnóstico de hipoacusia. Una primera aproximación a la efectividad del screening y tratamiento de la hipoacusia dice relación con la precisión del screening y de la confirmación, en otras palabras la capacidad de la secuencia de pruebas para detectar los casos de hipoacusia correctamente, evitando clasificar como positivos a niños que no padezcan la enfermedad (falsos positivos) y como negativos a niños que sí presentan dicha condición (falsos negativos). Esta capacidad de los tests se mide a través de la sensibilidad y especificidad, y sus valores predictivos positivos y negativos, estos últimos, dependientes de la prevalencia de la enfermedad. La Tabla 11, muestra los valores de los parámetros de sensibilidad y especificidad asociados a los test de scree- ning (EOA) y confirmación (PEAT) obtenidos del resumen de evidencia realizado por Thompson et al. (2001). Tabla 11: Sensibilidad y especificidad Thompson et al. (2001) Parámetro escenario base EOA Observaciones Sensibilidad 98% Para hipacusia profunda 80% Para hipacusia moderada PEAT Especificidad 80% Para hipacusia profunda Sensibilidad 84% Especificidad 90% Fuente. Elaboración propia en base al estudio de Thompson et al, 2001. Además, la Tabla 12, resume los parámetros asociados a sensibilidad y especificidad utilizados por las cinco evaluaciones económicas (EE) revisadas en la sección de antecedentes, así como los rangos que consideraron para dichos valores. Tabla 12: Sensibilidad y especificidad evaluaciones económicas revisadas Test Burke et al, 2012 EOAET PEAAT Sensibilidad Especificidad 95% 85% 95% 90% 96% (96% - 100%) 89% (77% - 96%) 98% 98% EOAET 95% (90% - 100%) 85% (80% - 100%) PEAAT 95% (90% - 100%) 90% (80% - 100%) EOAET 80% (66% - 100%) 92% (91% - 93%) PEAAT 98% (80% - 100%) 96% (86% - 98%) PEAAT 95% (90% - 98%) 95% (78% - 99%) EOA 95% (90% - 98%) EOA: Emisiones Otoacústicas; EOAET: Emisiones Otoacústicas Evocadas Transitorias. PEAAT: Potenciales Evocados Auditivos Automatizados de Tronco Cerebral; Fuente. Elaboración propia en base a los artículos mencionados. 90% (84% - 96%) Hessel et al, 2003 PEAAT-EOAET-C Confirmación (Further diagnostic) Keren et al, 2002 Kezirian et al, 2001 Kemper y Dows, 2000 5.3. EFECTIVIDAD DEL TRATAMIENTO DE LA HIPOACUSIA NEUROSENSORIAL BILATERAL MODERADA A SEVERA En relación a la calidad de vida de un niño con hipoacusia, cabe destacar que se ha constatado la escasa literatura asociada a este tema. Sin embargo, se ha encontrado una evaluación de costobeneficio del cuidado intensivo neonatal (Pharoah et al, 1988) que distribuye en cuatro categorías a los RN de acuerdo a la severidad de sus discapacidades (normal, leve, moderada y severa), sin diferenciar por tipo de discapacidad. El estudio considera a los niños sordos (con pérdida mayor a los 70 dB) en la categoría de discapacidad severa, asignándoles un coeficiente de calidad de vida de 0,25 (es decir, una pérdida del 75% de su calidad de vida por año). COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 25 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 26 No existe evidencia empírica proveniente de ensayos clínicos randomizados que apoye el hecho que la calidad de vida de los RN varíe según sean detectados y tratados de manera temprana versus tardíamente. Como señalan Yoshinaga-Itano et al (1998), por diferentes razones ese tipo de estudio es poco factible de realizar en el presente, debido al creciente número de países incorporando el screening universal entre sus recomendaciones (lo que dificultaría asignar aleatoriamente a ambos grupos), o porque incluso en países que no cuentan con este programa, la cooperación de los padres en este tipo de estudios sería probablemente baja. Sin embargo, a pesar de la ausencia de este tipo de evidencia, en las últimas décadas se han llevado a cabo varios estudios que comparan los resultados para niños diagnosticados e intervenidos a distintas edades, generalmente en términos del desarrollo del lenguaje, asociado también a otras variables como socio-emocionales, de discurso, vocabulario, etc. (Yoshinaga-Itano, 2003). Estos estudios han mostrado que los niños identificados e intervenidos tempranamente (antes de los 12 o 6 meses, dependiendo del estudio), reportan resultados significativamente superiores en términos de desarrollo del lenguaje, lo cual a su vez estaría relacionado con el desarrollo emocional y social (Yoshinaga-Itano et al, 1998; YoshinagaItano y Apuzzo, 1998; Moeller, 2000; Yoshinaga-Itano, 2003). Yoshinaga-Itano et al. (1998), incluyen en su estudio a 150 niños sordos y con problemas de audición de entre 1 y 3 años, demostrando que aquellos niños identificados antes de los 6 meses presentan un puntaje mayor para lenguaje total (incluye leguaje receptivo y lenguaje expresivo), que los niños identificados después de los 6 meses (79,0 versus 63,8 en escala del 1 al 100). Según la edad en que se detectó el déficit, los resultados en el puntaje de lenguaje total fueron de 58,2 entre 7 y 12 meses; 59,9 entre 13 y 18 meses; 61,8 entre 19 y 24 meses; y 56,5 entre 25 y 34 meses. En suma, considerando sólo a los niños con habilidades cognitivas normales, el puntaje promedio para el grupo de niños identificados tempranamente fue de 91.3, mientras que para el grupo de niños identificados después de los 6 meses fue de 70,2. Por último, Moeller (2000) en su estudio de niños hipoacúsicos de 5 años de edad, muestra que si se comienza a intervenir antes de los 11 meses de edad estos niños desarrollarían habilidades de vocabulario y razonamiento verbal superiores al que tendrían si se les interviene tardíamente. Para el primer caso, dentro del rango normal de los niños de su edad y entre 1 a 1,5 desviaciones estándar (DE) por debajo en el caso de los segundos. Estos antecedentes hacen suponer que a igual tratamiento (audífonos, terapia auditivo verbal o implante coclear), el factor determinante en la efectividad es la edad de inicio de la terapia y, por lo tanto, el momento en que se realiza el diagnóstico definitivo. Se puede plantear, además, que al tener mejores indicadores de lenguaje y comunicación con la terapia de inicio precoz, la calidad de vida, como outcome final, se verá también beneficiada en la medida que se diagnostique y se trate de manera temprana el déficit auditivo. 5.4. DESCRIPCIÓN GUÍAS CLÍNICAS MINSAL Guía Clínica de Hipoacusia Neurosensorial Bilateral del Prematuro 2009 (MINSAL, 2009) El MINSAL, en el contexto del Régimen GES que define la Ley Nº 19.966 del 2005, desarrolló una guía clínica que reúne la evidencia respecto de este problema de salud y las intervenciones de screening y tratamiento precoz que se encuentran garantizadas. La primera versión fue publicada el 2005, en el contexto de los primeros problemas de salud incluidos en el régimen. La versión actual fue revisada y publicada el 2009. El universo al cual está dirigida la Guía son los niños prematuros <32 semanas o con peso de nacimiento inferior a 1.500 gramos. A este grupo se realizaría la pesquisa de hipoacusia y a quienes resulten positivos del tipo neurosensorial, correspondería el tratamiento. La guía establece algunas definiciones del problema: • Hipoacusia: déficit auditivo, uni o bilateral, que se traduce en umbrales de audición mayor a 20 dB. • Hipoacusia de trasmisión o conductiva: aquellas cuya causa son localizables en el oído externo y medio, y que determinan una alteración en la trasmisión de la onda sonora al receptor ubicado en el oído interno. • Hipoacusia neurosensorial: aquellas cuya alteración es localizable en el oído interno y/o en las vías neuronales auditivas centrales. • Hipoacusia mixta: aquellas en que se den simultáneamente alteraciones del oído interno o medio con el interno o vías neuronales auditivas centrales. Como se dijo anteriormente la Guía adhiere a la clasificación de intensidad de la hipoacusia establecida en 1988 por la Sociedad Británica de Audiología y la Asociación Británica de Profesores de Sordos (ver Tabla 2). Se establecen las siguientes recomendaciones claves3 : • El método de screening en esta población debe realizarse mediante estudio universal en la población < 32 semanas o <1.500 gramos, y se recomienda que esto se haga mediante Potenciales Evocados Automáticos Auditivos de Tronco Encefálico (PEAAT) RECOMENDACIÓN GRADO A • La detección de sordera antes de 6 meses de vida, seguida por intervención antes de 12 meses de vida muestra mejoría en el desarrollo del lenguaje y habilidades cognitivas en pacientes con pérdida significativas de la audición. RECOMENDACIÓN GRADO A • Los niños con factores de riesgo para hipoacusia deben ser controlados con monitoreo audiológico cada 6 meses hasta los 3 años. RECOMENDACIÓN GRADO B • Se equipará con audífonos a todos los niños que presenten hipoacusia neurosensorial bilateral. RECOMENDACIÓN GRADO B • Los niños que presenten hipoacusia neurosensorial unilateral deben quedar en controles en el servicio de Otorrinolaringología y ser equipados según evolución clínica. RECOMENDACIÓN GRADO B • El método auditivo verbal (MAV), ha sido eficaz para desarrollar lenguaje oral con cualidades de voz lo más cercana a lo normal, permitiendo la integración de los niños a escuelas educación regular. RECOMENDACIÓN GRADO B 3 Ministerio de Salud. (2009). Guía Clínica Hipoacusia Neurosensorial Bilateral del Prematuro. Santiago: MINSAL, 2009. Página 6. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 27 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 28 Aspectos relevantes de la etapa de screening • Respecto de la primera recomendación, la Guía diferencia el método diagnóstico usado en la población objetivo respecto del recomendado en RN no prematuros. En este punto aclara que en este último grupo el PEAAT y las Emisiones Otoacústicas (EOA) constituyen intervenciones diagnósticas equivalentes. • El PEAAT debe ser realizado de preferencia por fonoaudiólogo o tecnólogo médico con mención en audiología. De no ser posible podría ser realizado por otro profesional de la salud (matrona, enfermera) capacitados para tales fines. • El PEAAT debe ser realizado en ambos oídos, con el niño en sueño fisiológico, en un lugar aislado del ruido externo, sin embargo, no sería necesaria una cabina sonorizada. El momento para realizar el examen es previo al alta de la unidad de neonatología. • Para los niños que no pasan el examen (positivo para hipoacusia uni o bilateral) se les programa repetición del examen para 2 a 4 semanas. Este examen es realizado por el mismo profesional caracterizado previamente. • En el segundo PEAAT, un niño con resultado normal (en ambos oídos) es derivado a un programa de seguimiento de prematuro en el que se evaluará el desarrollo del lenguaje. Por el contrario, si se pesquisa hipoacusia uni o bilateral de cualquier intensidad, se deriva a consulta con otorrinolaringólogo para iniciar el proceso de confirmación diagnóstica definitiva del déficit sensorial. Aspectos relevantes de la etapa de confirmación diagnóstica • Se recomienda una evaluación por otorrinolaringólogo antes de la evaluación auditiva. • El diagnóstico se hace con potenciales evocados auditivos de tronco cerebral extendidos (PEAT) con el niño en sueño fisiológico, en ambiente aislado de ruido, sin ser necesaria una cámara sonorizada. Se hacen especificaciones técnicas del examen. • Si el PEAT resulta normal es derivado al programa de seguimiento de prematuro en el que se evaluará el desarrollo del lenguaje. • Si el PEAT es anormal y el RN tiene una impedanciometría con curva B sin reflejo, sugerente de hipoacusia de tipo mixta, debe ser evaluado con otomicroscopía. Según diagnóstico y evolución se podría hacer punción transtimpánica y reevaluar con PEAT. Si el resultado final es sugerente de hipoacusia neurosensorial debe completar el estudio de confirmación diagnóstica y derivación a terapia de amplificación antes de los 6 meses de edad corregida. En caso de sospechar hipoacusia de tipo conductivo, debe manejarse según protocolos del servicio de otorrinolaringología. • Si el PEAT determina una hipoacusia unilateral, el paciente es derivado a control con otorrinolaringólogo. • Si PEAT es anormal y la impedanciometría es anormal, sugerente de hipoacusia neurosensorial, el paciente es derivado a otorrinolaringólogo, se le realiza un segundo PEAT extendido un mes después y si persiste alterado de manera bilateral es derivado para audiometría de campo libre. • El proceso de confirmación diagnóstica, debe ser realizado por otorrinolaringólogo en conjunto con fonoaudiólogo o tecnólogo médico con mención en audiología. • Con el diagnóstico confirmado se debe iniciar tratamiento antes de los 6 meses de edad corregida, incluyendo apoyo psicológico para padres y evaluación por asistente social. • El niño con factores de riesgo de hipoacusia, aun cuando se le haya descartado, debe ser seguido con monitoreo audiológico cada 6 meses por 3 años. Para estos efectos, la Guía define un listado de factores de riesgo de hipoacusia de aparición tardía4. Aspectos relevantes del tratamiento de hipoacusia bilateral neurosensorial del prematuro: terapia de amplificación. • La terapia de amplificación se realiza con audífonos bilaterales a niños con diagnóstico de hipoacusia neurosensorial bilateral. De existir un componente de trasmisión (otitis media con efusión) debe ser tratado previo al inicio de la terapia de amplificación. • La definición del audífono adecuado requiere: • Audiometría de campo libre sin audífono para buscar umbrales de reflejo a tono puro y a la voz • Toma de moldes • Entrega de audífonos: incluye control electroacústico del audífono con equipo analizador de audífono digital, programación de ganancia y salida máxima en base a PEAT y audiometría de campo libre, pruebas de verificación de ganancia con audífono, entrega de orientaciones en el uso y cuidado del audífono y entrega de Pauta de Registro de Conductas Auditivas • Se deriva a equipo de rehabilitación. Sesión de control de uso de audífono que incluye: verificación de funcionamiento del audífono, programación del audífono, prueba de verificación de ganancia con audífonos con audiometría de campo libre o prueba de ganancia de inserción in situ, orientaciones en el uso y cuidado del audífono e información del equipo rehabilitador. • Los controles se realizan con la siguiente frecuencia desde la entrega de audífonos: 7, 14 y 28 días, luego 2, 3 y 6 meses • Seguimiento del audífono: • A los tres años evaluar cambio de audífono. Luego control semestral hasta los 6 años y anual desde los 7 años • Control con otorrinolaringólogo al menos una vez al año • Evaluación auditiva: • Año: PEAT • 2 y 3 años: audiometría de campo libre por refuerzo visual • Anual 4-7 año: audiometría tonal completa Aspectos relevantes del tratamiento de hipoacusia bilateral neurosensorial del prematuro: implante coclear • La Guía plantea la existencia de un 10% de casos de hipoacusia en que la terapia auditivo verbal y el uso de audífonos no bastaría para la adquisición de lenguaje oral a través del canal auditivo. Este grupo, entonces, se beneficiaría con implante coclear. • Se plantea requisito previo al acceso de implante coclear: niños con hipoacusia neurosensorial bilateral profunda con terapia auditivo verbal y con audífonos por a lo menos 6 meses y que no haya evidencia de beneficio o el niño se encuentre en una fase estacionaria en el desarrollo de 4 Ver listado en páginas 26 y 27 de la Guía. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 29 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 30 las habilidades auditivas y lingüísticas. • El implante debe ser realizado por un otólogo acreditado para este tipo de intervención. Sin embargo, el equipo que participa en este tratamiento incluye: neurofisiólogos, neuroradiólogos, sicólogos, bioingenieros, audiólogos y fonoaudiólogos. • Previo a la decisión del implante coclear, el paciente se debe someter a una completa evaluación cócleovestibular que incluye: audiometrías tonal y vocal, impedanciometría, PEAT, TAC de hueso temporal, valoraciones sicológicas y neurológicas. • Contraindicaciones para el implante coclear: • Contraindicaciones médicas • Sordera debida a lesión en el nervio acústico o ausencia de éste • Infección del oído medio • Osificación o ausencia de la cóclea • Patología psiquiátrica severa como autismo • Trastornos de conducta severos con autoagresión • Hiperactividad severa • Habilidades de aprendizaje nulas o muy reducidas • Convulsiones con muchos espasmos • Enfermedades malignas con expectativas de vida reducida • Expectativas irreales de la familia (transitoria) Aspectos relevantes del tratamiento de hipoacusia bilateral neurosensorial del prematuro: Rehabilitación auditiva. • La rehabilitación se plantea en 4 etapas, las que se describen en la Tabla 13: • Primera etapa: desde la confirmación diagnóstica hasta las 16 primeras sesiones de tratamiento • Segunda etapa: desde la sesión 17 a los 24 meses de edad corregida • Tercera etapa: desde los dos años a los 4 años • Cuarta etapa: desde los 4 años hasta los 7 años Tabla 13: Características de las etapas del proceso de rehabilitación Primera etapa Segunda etapa Tercera etapa Cuarta etapa Inicio Confirmación diagnóstica 17ª sesión 2 años 4 años Término 16ª sesión. (4º a 6º mes) 2 años de edad corregida 4 años 7 años Frecuencia y duración Una vez por semana, 1 hora Una vez por semana, 1 hora Dos veces por semana, 45 minutos cada sesión 1 sesión semanal, no se especifica duración Lugar Centro de atención al prematuro. Una domiciliaria Centro de atención al prematuro Centro de atención al prematuro Centro de atención al prematuro si asiste a escuela normal, en escuela especial si no Profesionales Fonoaudiólogo, psicólogo No se especifica No se especifica No se especifica Evaluación Al final del periodo Al final del periodo Anual Evaluación orofacial Anatómica y de funciones prelingüísticas Anatómica y de funciones prelingüísticas Anatómica y de funciones prelingüísticas Anatómica y de funciones prelingüísticas Evaluación de lenguaje, habla y comunicación Conductas comunicativas y escalas de etapas de desarrollo; MUSS; voz Conductas comunicativas y escalas de etapas de desarrollo; voz. TECAL, STSG (expresivo), TEPROSIF, Test de articulación a la repetición, Bley, voz TECAL, STSG, TEPROSIF, Test de articulación a la repetición, Bley, voz Evaluación de percepción acústica Detección de los 6 sonidos del test de Ling; IT-MAIS; escala edades auditivas-verbales IT-MAIS, MUSS, Test de Ling, ESP verbal baja, escala edades auditivas-verbales PIP-S, PIP C-10, PIP-V PIP C-20, C-25, C-50, Matriz de vocals y consonants, OFA-N, GASP Evaluación psicológica Bayley; otras pruebas Bayley; otras pruebas Bayley; otras pruebas Bayley; otras pruebas Fuente: MINSAL, 2009. • Al final de cada etapa se evalúa el cumplimento de objetivos. Si se cumplen, se deriva el paciente a la etapa siguiente. De no cumplirse, se debe evaluar posibles determinantes del fracaso, lo cual incluye: • Derivación a asistente social o psicólogo si el determinante es de orden familiar o social • Derivación a otorrinolaringólogo si el determinante es un problema de la amplificación. Se debe evaluar en estos niños la terapia de implante coclear • Derivación a otros profesionales, si existen otros déficit que entorpezcan el proceso • Los niños que reciben implantes cocleares deben realizar también terapia de rehabilitación a cargo de fonoaudiólogo o terapeuta del lenguaje debidamente capacitado. Se inicia desde el momento que el equipo es programado. Se estima un tiempo promedio de terapia de 4 años. No se precisan más aspectos de este. Guía de Práctica Clínica: Implante Coclear (MINSAL, 2008) Esta guía fue realizada por el Ministerio de Salud el 2008 y está orientada a la rehabilitación de personas con hipoacusia neurosensorial bilateral severa y profunda. Dado que su público objetivo es la totalidad de la población con esta discapacidad, solo se describirá aquellos aspectos relativos a los RN que pueden detectarse con el screening de hipoacusia analizado. En relación con cada etapa del proceso se establece: COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 31 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 32 Confirmación diagnóstica: es similar a lo planteado por la Guía Clínica de Hipoacusia del Prematuro, solo difiere en uno de los exámenes a realizar, puesto que aquí se plantea la realización de EOA en vez de audiometría de campo libre. En caso de que se confirme hipoacusia severa o profunda el paciente es derivado a centro de implante para evaluación, sin perjuicio de que se inicie la terapia de amplificación y auditivo verbal precozmente. Selección de candidatos a implante coclear: Los pacientes con hipoacusia severa y moderada son evaluados por un equipo de implante coclear (dos otorrinolaringólogos, fonoaudiólogo, psicólogo, anestesista y radiólogo) para confirmar indicación de implante. La evaluación consiste en: • Evaluación imagenología: determina estructuralmente la factibilidad del implante, con un TAC de cóclea. Algunos pacientes pudiesen requerir Resonancia Magnética Nuclear (RMN). • Evaluación audiológica: con impedanciometría, EOA, PEAT (al menos dos). En mayores de 2 años y medio, audiometría tonal, logoaudiometría, audiometría campo libre. • Evaluación fonoaudiológica. • Evaluación psicológica de los padres del RN. • Evaluación por Asistente Social. Implante coclear: Pacientes con indicación de implante deben seguir en control con otorrinolaringólogos para información y educación. Luego, son evaluados por anestesista, en a lo menos 2 ocasiones. El implante corresponde a una intervención quirúrgica mayor con anestesia general y uso profiláctico de antibioterapia que atraviese la barrera hematoencefálica, por el riesgo de meningitis. Se estiman 1 a 2 días de hospitalización. Dos controles post alta con otorrinolaringólogo a los 7 y 30 días. Luego de verificar ausencia de lesiones de CAE o membrana timpánica, se indica encendido y calibración del dispositivo. Este último proceso puede determinar un número variable de sesiones con fonoaudiólogo. Seguimiento: Posterior al encendido y primera calibración, se espera el siguiente calendario de calibraciones por fonoaudiólogo: • • • • Primer año: cuatro controles a los 3, 6, 9 y 12 meses. Segundo año: dos controles al año. Tercer año: un control anual. Cuarto año y siguientes: a criterio del rehabilitador y según necesidad. Previo a cada calibración se recomienda realizar una audiometría de campo libre y control con otorrinolaringólogo. Habilitación: Para menores de tres años, se plantea como terapia para el desarrollo de lenguaje, la terapia auditivo-verbal. 6. EVALUACIONES ECONÓMICAS EN EL TEMA A NIVEL INTERNACIONAL Se identificaron cinco artículos que reportan resultados de costo efectividad del screening universal de hipoacusia en RN. Cuatro de ellos comparan esta intervención con una estrategia de screening selectivo (Burke et al, 2012; Hessel et al, 2003; Keren et al, 2002; Kemper y Dows, 2000), mientras que uno (Kezirian et al, 2001) analiza diferentes estrategias de screening universal. Además, Burke et al. (2012) reportan un segundo análisis en que comparan las estrategias de una o dos etapas para el screening universal. Un primer punto que se debe tener en consideración, es que en estos estudios, cuando se plantea la estrategia de screening selectivo, el criterio usado es más amplio que el de Chile, puesto que se basa en la presencia de varios factores de riesgo, donde la prematurez es uno de ellos. Además, en nuestro caso, como ya se mencionó, se restringe dentro de los prematuros a los <32 semanas o < 1.500 gramos. La Tabla 14, presenta algunas características generales sobre los artículos considerados. Tabla 14: Características generales de los estudios de costo efectividad analizados. Examen (screening) Tipo de modelo Tasa de descuento Outcome Perspectiva Burke et al. (2012) Dos etapas (EOAET, PEAAT); Una etapa (EOAET) Árbol de decisión No reportan Casos detectados. Sistema de salud (otro escenario con perspectiva social) Hessel et al. (2003) Dos etapas EOAET Markov (ciclos: 1 mes; horizonte: 1 año) 3% para costos y outcomes Casos detectados, detected Child month. Sistema de Salud Keren et al. (2002) Dos etapas (EOAET; PEAAT) Árbol de decisión 3% para costos Caso diagnosticado antes de 6 meses, Caso tratado antes de 12 meses, niño con hipoacusia que desarrolla lenguaje normal. Sociedad Kezirian et al. (2001) PEAAT (dos etapas); PEAAT (una etapa); EOA (dos etapas); EOA + PEAAT (una etapa) Árbol de decisión No reportan Caso detectado Hospital Kemper y Dows. (2000) Dos etapas (EOA, PEAT) Árbol de decisión No reportan Caso detectado Sistema de Salud Fuente. Elaboración propia en base a los artículos mencionados. EOAET: Emisiones otoacústicas evocadas transitorias; PEAAT: Potenciales Evocados Auditivos Automatizados de Tronco cerebral; EOA: Emisiones Otoacústicas. PEAT: Potenciales evocados auditivos de Tronco cerebral. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 33 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 34 Como se puede ver, a excepción de Hessel et al. (2003), que utiliza un modelo Markov, los estudios utilizaron modelos de árboles decisión para desarrollar su análisis. En general, los artículos incluyen como población objetivo a los RN con hipoacusia bilateral moderada a profunda, definiéndolo como una intensidad mayor a 40 dB en el mejor oído. La excepción es el artículo de Kezirian et al. (2001), quienes consideraron la hipoacusia bilateral y unilateral, sin explicitar el nivel de intensidad. Con estas poblaciones objetivo, los parámetros de prevalencia utilizadas se muestran en la Tabla 15. Tabla 15. Prevalencias hipoacusia en RN utilizadas en estudios de costo efectividad Prevalencia RN Burke et al. (2012) Hessel et al. (2003) Prevalencia RN alto riesgo Kemper y Dows. (2000) Proporción RN alto riesgo 0.15% (UK) 0.8% (UK) 0.08% 10% 0.496% (India) 0.796% (India) 0.463% 10% 0.38% 0.09% 20% 0.83% (US) 0.06% 13% 0.15% (Alemania) Keren et al. (2002) Kezirian et al. (2001) Prevalencia RN bajo riesgo 3.5 por mil (uni y bilateral) (US) 0.11% (US) Fuente. Elaboración propia en base a los artículos mencionados. En relación a los outcomes utilizados, los cinco estudios consideran el outcome intermedio ‘caso detectado’ o ‘caso detectado apropiadamente’. Hessel et al. (2003) consideraron, además, otros outcomes intermedios, como el número de ‘detected child months5’ orientado a dar importancia a la detección precoz de la hipoacusia. Por otra parte, de los artículos revisados, el de Keren et al. (2002) es el único que incluye un outcome de largo plazo, como el desarrollo normal del lenguaje. En este caso, la probabilidad de que los niños con hipoacusia, ya sea que tuviesen o no factores de riesgo, con y sin tratamiento, desarrollaran normalmente el lenguaje fue obtenida de un panel de expertos y posteriormente abordada en el análisis de sensibilización. La perspectiva del estudio, así como el tipo de outcomes considerados tienen directa implicancia sobre los costos. De esta manera, los costos por pérdida de productividad sólo fueron incluidos en aquellos estudios que consideraron la perspectiva social. Por su parte, los costos del tratamiento asociado a los niños detectados por el screening y posteriormente confirmados sólo se incluyeron en el estudio que considera un outcome de largo plazo. Los distintos estudios revisados abordaron los costos de distintas maneras. Burke et al. (2012) consideraron los costos directos para el sistema de salud en el escenario base y los costos desde la perspectiva social en un escenario alternativo (incluyendo tiempo de viaje y pérdida de productividad por ausentismo laboral relacionado a síntomas). Además, consideran una consulta extra de otorrinolaringólogo como una manera de incluir costos extra para los falsos positivos (otros costos que señalan en esta línea, pero que no incluyen, son: ansiedad de los padres, seguimientos innecesarios, intervenciones innecesarias). En el Artículo definen el indicador “detected Child months” como la cantidad de meses en un determinado marco de tiempo de 6, 12 o 120 meses, en el cual un problema auditivo es conocido. A modo de ejemplo, se plantea que un niño, en el marco de tiempo de 6 meses, cuyo diagnóstico es realizado al mes de vida aportaría con 6 “detected child months”, mientras que si se diagnóstica a los 4 meses, su aporte sería de 2 “detected Child months”. 5 Por su parte, Hessel et al. (2003) identifican varios posibles costos relevantes para el análisis, como los costos directos médicos (implementación del programa, tests, organización del programa, seguimiento, confirmación para los niños detectados como positivos, costos asociados al tratamiento, controles regulares, tratamiento con audífonos o implantes cocleares), los costos directos no-médicos (transporte asociados al diagnóstico y tratamiento, costos adicionales por educación especial para niños con desordenes auditivos) y costos indirectos (tiempo laboral perdido por los padres, tiempo laboral perdido por adultos con desordenes auditivos, ingresos perdidos debido a los desórdenes auditivos, pérdida de productividad debido a muerte prematura). Sin embargo, señalan que debido a la falta de datos de costos y outcomes, finalmente no incluyeron los costos por tratamiento y educación de los niños, ni tampoco los costos indirectos, incluyéndose sólo los costos de los exámenes y de la confirmación. En el caso del estudio de Kemper y Dows (2000), se analizan los costos desde la perspectiva del sistema de salud, incluyéndose los costos de los tests (dos etapas, EOA y luego PEAT), y de la confirmación (follow-up screening) y no incluyéndose los costos del tratamiento o potenciales ahorros de la detección temprana porque serían desconocidos, ni tampoco los costos indirectos. En tanto, Kezirian et al. (2001) analizan los costos desde la perspectiva del hospital, incluyendo los costos directos para el establecimiento (equipamiento, personal, gastos generales, trabajo administrativo), calculados para equipos usados comúnmente para cada categoría de test. Por último, Keren et al. (2002) analizaron los costos desde la perspectiva de la sociedad, descontando los costos futuros al 3% según recomendaciones del panel de Washington. Para el outcome de corto plazo (niños detectados) se incluyó el costo del screening en 2 etapas (EOA y luego PEAT) y de la confirmación diagnóstica (ORL, PEAT, completa evaluación auditiva). Los costos fueron calculados a partir de los costos fijos (máquinas) y los costos variables (insumos y salarios). Incluyeron, en el caso del screening selectivo, el costo de reconocimiento de los factores de riesgo (3 minutos enfermera a US$19/hr.). Para el outcome de largo plazo (desde la perspectiva social), se incluyó la pérdida de productividad, educación especial, rehabilitación vocal, costos médicos y costo de los dispositivos. A partir de distintos supuestos (disminución de la pérdida de productividad (75%), disminución de la necesidad de educación especial (10%), disminución de la necesidad de rehabilitación vocal (75%), señalan que el mejoramiento del lenguaje debido a tratamiento temprano resulta en una disminución de los costos de aproximadamente US$430.000 por individuo, implementando variadas sensibilizaciones sobre estos parámetros. En relación a los resultados reportados por los distintos estudios, Burke et al. (2012) estiman un costo incremental por caso detectado de £36.181 para UK (US$ 58.497) y de INR 157.084 para India (US$ 9.863), pasando de una estrategia de screening selectivo a uno universal. Cuando comparan la estrategia de dos etapas versus la de una etapa, obtienen ICER más altos para ambos países (£120.972 y INR 926.675 para UK e India, respectivamente). Cuando incorporan el costo por caso tratado y por caso no tratado (estimado por Keren et al, 2002, incluyendo pérdida de productividad, educación especial, rehabilitación vocal, dispositivos de ayuda, costos médicos), la costo-efectividad incremental (universal vs selectivo) se transforma en costo-ahorradora (estrategia dominante). Por último, señalan que la costo-efectividad calculada, debido a falta de evidencia disponible, considera solo los costos, pero que en realidad la identificación temprana también produciría mejoras en los outcomes COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 35 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 36 y, por lo tanto, en la calidad de vida de los niños. Señalan que de considerarse, la verdadera relación de costo-efectividad de la intervención podría ser mayor aún. Hessel et al. (2003) reportan un costo por caso detectado de € 13.395, € 6.715 y € 4.125 para las estrategias de screening universal, selectivo y no-screening, respectivamente, mientras que Kemper y Dows (2000) estimaron que moverse de una estrategia de screening selectivo a una universal costaría US$ 23.930 extra por caso detectado. Para Kezirian et al. (2001), el costo por protocolo varía de US$13 a US$25 por niño y la razón de costo efectividad de US$5.100 a US$9.500 por niño identificado con hipoacusia. En este estudio el protocolo EOA/EOA resulta ser el de menor costo y más costo-efectivo. El ICER entre la estrategia EOA/ EOA y la estrategia PEAAT/no screening es de US$92.000 por caso identificado. Por último, para Keren et al. (2002) la estrategia de screening universal resulta dominante, ya que a partir de ésta se obtendrían mejores outcomes y mayores reducciones de costos en relación a screening selectivo y no screening. Señalan, que si la detección temprana resulta en un mejoramiento del lenguaje, menores costos educacionales, y en un aumento en la productividad a lo largo de la vida, entonces, la estrategia de screening universal tendría el potencial de ser costo-ahorradora, y también el screening selectivo. Sin embargo, esto es sostenible, de acuerdo al análisis de sensibilización, sólo para un limitado rango de las probabilidades de desarrollar un lenguaje normal (dado tratamiento temprano) y de aumento de la productividad asociado a lenguaje normal. Esto resalta la importancia de la implementación del programa y de que se asegure que el diagnóstico precoz llevará a un tratamiento oportuno y a resultados óptimos de éste. Además, los resultados mostraron ser bastante sensibles a cambios en el porcentaje de seguimiento de los niños para la evaluación diagnóstica. Por lo tanto, los resultados no dependerían sólo de la precisión de los test utilizados para el screening, sino también de la habilidad de los profesionales para dar seguimiento a los niños que no pasan dichos tests. 7. METODOLOGÍA 7.1. TIPO DE EVALUACIÓN ECONÓMICA Para responder a la pregunta planteada, se realizó un estudio de costo-utilidad usando QALY como medida de outcome genérica de salud, lo que permite sintetizar los efectos que tiene una intervención tanto en la expectativa de vida como en la calidad en que esos años son vividos (Alvis y Valenzuela, 2010). Esta opción permite evaluar eficiencia de asignación al poder comparar los resultados con otros estudios que han usado estas medidas genéricas y al comparar con un umbral de gasto previamente definido (MINSAL, 2011). En concreto se usa la metodología de QALY con datos de preferencias por estados de salud EQ-5D chilenos (Zárate et al, 2011) para estimar la costo-utilidad de la estrategia de screening universal comparada con la situación actual de screening selectivo, estimando el costo por cada QALY ganada. 7.2. COMPARADORES La intervención a evaluar en el presente estudio corresponde a una estrategia de screening universal de hipoacusia neurosensorial, es decir, a la detección en todos los RN de un déficit auditivo bilateral de carácter congénito. Siguiendo las directrices definidas en la Guía Metodológica para Evaluaciones Económicas (MINSAL, 2011), como comparador se utiliza la situación actual de screening. En la actualidad existe una estrategia de screening y tratamiento para hipoacusia neurosensorial bilateral en RN prematuros <32 semanas o <1.500 gramos al nacer, considerado como parte del Régimen GES. Para los RN que no pertenecen a este grupo, no se aplica screening sistemáticamente, con la excepción de algunos establecimientos del sector privado de salud. El proceso diagnóstico que se realiza en nuestro país contempla un screening auditivo automatizado del RN prematuro en dos etapas, que de ser positivo se completa con la confirmación de hipoacusia por otorrinolaringólogo y otros estudios audiológicos. Los prematuros confirmados pasan a la etapa de tratamiento con implementación bilateral de audífonos, implante coclear si es necesario, terapia de rehabilitación y seguimiento hasta el segundo año, según GES. De acuerdo a las entrevistas con expertos, la terapia de amplificación o el implante, así como la rehabilitación con terapia auditivoverbal se extiende hasta el séptimo año y posteriormente se considera un seguimiento de régimen (igual para todos los años), desde el octavo año en adelante. El screening en dos etapas del RN prematuro considera un primer examen de PEAAT al momento del alta y luego, aproximadamente dos semanas después, un segundo PEAAT para aquellos RN con resultado positivo en el primer test. El considerar screening en dos etapas, permite que los niños que fallan en la primera pesquisa, puedan ser re-evaluados dentro de las primeras 10 semanas de vida, según lo contempla la Guía Clínica (MINSAL 2009). No obstante, igualmente en las dos etapas de screening se presentarán falsos negativos (FN), es decir, niños que teniendo hipoacusia no quedan clasificados en este grupo y su detección COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 37 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 38 será en controles posteriores (Control del Niño Sano), lo que retrasará su diagnóstico y tratamiento. Se asume que estos niños serán diagnosticados entre su segundo y tercer año de vida, como sucedería en condiciones sin screening. El escenario actual antes descrito será contrastado con la estrategia alternativa de screening universal, en la cual, el tamizaje en dos etapas se aplica a todos los RN al momento del alta. Si el resultado del primer PEAAT resulta positivo para hipoacusia, el examen se repite y si vuelve a ser positivo, el RN es derivado a confirmación. Para aquellos RN que no presenten factores de riesgo6 , el segundo PEAAT se realiza inmediatamente después del primer test, mientras que para los RN con factores de riesgo este examen se realiza posterior al alta. Para ambos grupos, la confirmación final de hipoacusia no difiere con la del comparador. El tratamiento en ambas estrategias considera: implementación bilateral de audífonos, implante coclear de ser necesario, rehabilitación con terapia auditivo-verbal para todos los pacientes por 7 años (aun cuando las garantías incluyen solo los dos primeros años) y luego seguimiento. 7.3. PERSPECTIVA La evaluación económica realizada se llevó a cabo desde la perspectiva del sector público del sistema de salud. 7.4. TIPO DE POBLACIÓN Como se planteó previamente, la estrategia de screening universal estaría dirigida a todos los RN del país, mientras que la estrategia selectiva solamente a aquellos RN que cumplan con los criterios de prematurez definidos para el Régimen GES (<32 semanas o <1.500 gramos). Para efectos del modelaje se utilizó la población de RN del 2009, obtenida del DEIS. Del mismo modo, para determinar las características epidemiológicas de la hipoacusia neurosensorial congénita que se incorporarían al modelo, se acudió a las fuentes oficiales de información a nivel ministerial y en aquellos parámetros en los que la información no existiera o bien fuera poco confiable, a la literatura nacional e internacional. Esto fue válido tanto para la prevalencia general de hipoacusia como para los diferentes subgrupos derivados de las estrategias a comparar: RN con factores de riesgo, RN sin factores de riesgo, RN < 32 semanas o < 1.500 gramos, RN > 32 semanas y > 1.500 gramos. En conocimiento de la escasez de información a nivel nacional respecto de la distribución de los RN con hipoacusia por intensidad del déficit y de que no existen datos consistentes en la literatura, esta información se obtuvo mediante juicio de experto, a través de una encuesta que se describe más adelante en la metodología. Esta información es relevante, puesto que parte del tratamiento (probabilidad de requerir implante coclear) depende de la intensidad de la hipoacusia. Si bien la opinión de expertos no constituye la mejor evidencia, ante la falta de datos confiables y la imposibilidad de contar con estudios epidemiológicos y clínicos en este ámbito, su uso, basado en la experiencia con pacientes chilenos, entrega la mejor información en los plazos requeridos. Como en otros aspectos, se sensibilizan los parámetros de acuerdo a las desviaciones estándar (DE) observadas en las respuestas. Aquellos señalados en la Guía de Práctica Clínica (MINSAL, 2009), y revisados en la sección 5.1 del presente informe. 6 7.5. EFECTIVIDAD Y OUTCOMES Posterior a la identificación de RN con hipoacusia, la efectividad del programa está dada por la efectividad del tratamiento del niño detectado. En este caso, se requiere de un outcome final asociado al tratamiento, como la mortalidad evitada, la sobrevida, los años vividos con completa calidad de vida ganados, etc. Al no existir evidencia consistente de que la hipoacusia sea una patología asociada a mortalidad prematura, se consideró la calidad de vida como el outcome más apropiado para la evaluación. De esta forma, se cuantificaron los años de vida ajustados por calidad (QALY) asociados a los distintos resultados en salud posibles. Para este fin se debió identificar las características de la calidad de vida definitiva (esto es a partir de los 15 años) asociada a una situación de detección y tratamiento temprano (antes del año de vida), así como a una situación de detección y tratamiento tardío (después del año de vida), para niños nacidos con hipoacusia bilateral congénita en cada una de sus intensidades (6 estados finales). La caracterización de los estados de salud de los diferentes grupos de pacientes con hipoacusia se basó en el juicio de experto obtenido por medio de una encuesta EQ-5D que se detalla más adelante en la metodología. Una vez obtenidos los perfiles de salud para cada uno de los seis estados definitivos, estos fueron valorados para obtener los QALY. Para esto, se utilizó los resultados de Zarate et al, (2011), que analiza los datos del estudio efectuado por la Superintendencia de Salud en Chile (Superintendencia de Salud, 2008). Esta valoración considera en conjunto las cinco dimensiones del EQ-5D: movilidad, cuidado personal, actividades habituales, dolor/malestar y ansiedad/depresión, en los tres niveles de respuesta: 1, 2 o 3. Para la valoración del coeficiente de calidad de vida asociado a los QALY, el valor máximo es 1 o de salud completa, donde cada dimensión es evaluada con la mejor valoración (11111) mientras que el valor mínimo es de -0,497, que corresponde a la peor valoración de cada una de las cinco dimensiones incluidas (33333). De este modo, hay tres tercios distinguibles de valores de salud estimados, estos son: de -0,5 a 0, de 0 a 0,5 y de 0,5 a 1. 7.6. ENCUESTA EXPERTOS Se aplicó una encuesta a profesionales especialistas en hipoacusia del RN en Chile. Los requisitos definidos para incorporarlos a la muestra fue tener experiencia clínica en este problema de salud, ya sea en el sector público como privado del sistema de salud y/o haber participado previamente en otros estudios del MINSAL o en la generación de guías clínicas de hipoacusia para el GES. De este modo, la muestra estuvo conformada por otorrinolaringólogos, médicos relacionados con el tema de la hipoacusia en RN, fonoaudiólogos, tecnólogos médicos y educadores en trastornos de la audición. Los objetivos de la encuesta fueron: a) Determinar la distribución por niveles de intensidad de los RN con hipoacusia. b) Determinar el porcentaje de pacientes que requerirían de implante coclear para cada nivel de intensidad de hipoacusia en un escenario de screening universal y selectivo. c) Caracterizar los estados de salud final de los pacientes en cada nivel de intensidad de hipoacusia y habiendo sido detectado y tratado precoz y tardíamente. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 39 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 40 7.6.1. Aplicación del instrumento a los expertos 7.6.1.1. Tipo de muestreo Se realizó un muestreo en dos etapas, la primera, correspondió a un muestreo subjetivo por decisión razonada (Anderson et al, 2008), en el cual se seleccionan individuos que de antemano se sabe tienen una información vital o sobresalen del resto según algún criterio preestablecido, en el fondo, individuos con alto valor según dicho criterio. En este caso, la muestra se ha elegido en función de la expertise en la atención profesional a niños con hipoacusia. En la segunda etapa, se utilizó un muestreo en “bola de nieve”, que consiste en identificar sujetos con características análogas a las definidas para el primer muestreo, pero a partir de las referencias dadas por los primeros encuestados. 7.6.1.2. Instrumento de Medición El instrumento utilizado está constituido por dos partes, la primera corresponde a una encuesta que busca dar respuesta a los objetivos a) y b) y que consta de tres consultas epidemiológicas7: 1.Porcentaje de RN con hipoacusia bilateral de distintos niveles de intensidad de hipoacusia: leve, moderada, severa y profunda. 2.Porcentaje de RN sin beneficio por uso de audífonos en situación actual para los niveles de intensidad de hipoacusia: moderada, severa, profunda. 3.Porcentaje de RN sin beneficio por uso de audífonos en la situación con screening y tratamiento antes del primer año de vida para los niveles de intensidad de hipoacusia: moderada severa, profunda. La segunda parte del instrumento estaba dirigida a cumplir el objetivo c) de la encuesta, es decir, a obtener por parte de un grupo de expertos en el ámbito de la hipoacusia en niños, mediante la aplicación de la encuesta EQ-5D, el perfil definitivo (a partir de los 15 años) en cinco dimensiones (movilidad, cuidado personal, actividades habituales, dolor/malestar y ansiedad/ depresión) en niños nacidos con distintos niveles de intensidad de hipoacusia bilateral, y de acuerdo a si tuvieron acceso o no a diagnóstico y tratamiento temprano. Para efectos de este estudio se definieron 6 estados asociados a hipoacusia bilateral, los cuales dan origen a las siguientes 6 formatos de encuesta que fueron distribuidas entre los expertos (Anexo 2). 7 Ver cuestionario completo en Anexo 1. • • • • • • Forma 1-A: Moderada, detectada y tratada tempranamente Forma 1-B: Moderada, detectada y tratada tardíamente Forma 2-A: Severa, detectada y tratada tempranamente Forma 2-B: Severa, detectada y tratada tardíamente Forma 3-A: Profunda, detectada y tratada tempranamente Forma 3-B: Profunda, detectada y tratada tardíamente 7.6.2. Consideraciones respecto del instrumento utilizado Como se mencionó antes, los resultados entregados por diferentes estudios consideran outcomes intermedios8, generalmente asociados al puntaje obtenido en tests de desarrollo del lenguaje (receptivo, expresivo, de vocabulario, razonamiento verbal, etc.), los cuales no son directamente traducibles a outcomes finales en salud9. Existe una gran variedad de instrumentos diseñados para capturar o medir resultados en salud asociados a lo que se denomina calidad de vida, estado de salud o calidad de vida relacionada a la salud. Estos instrumentos se pueden dividir en dos grandes grupos, los genéricos y los específicos a la condición o enfermedad. Como su nombre lo indica, los primeros han sido relacionados para ser relevantes a un amplio rango de problemas de salud, mientras que los segundos han sido diseñados para ser relevantes a problemas específicos (Fitzpatrick, 2010). Los instrumentos como el EQ-5D o el HUI (Health Utility Index) que son relacionados con la medición de calidad de vida en términos de ‘utilidad’ generalmente se clasifican como parte de los instrumentos genéricos, aunque también pueden ser considerados un grupo en sí mismos. Los argumentos a favor del uso de instrumentos específicos generalmente señalan que al poder incluir ítems específicos relevantes a la condición estudiada, estas medidas son más sensibles, por lo tanto, capturan de mejor manera, cambios en la calidad de vida relacionada con salud asociados a una intervención sanitaria que los instrumentos genéricos. Sin embargo, Fitzpatrick (2010) señala que algunos estudios han fallado en identificar esas ventajas empíricamente, mencionando específicamente los estudios de Walsh et al. (2003) y Wiebe et al. (2003). En este último estudio, encuentran que mientras más pequeños los efectos terapéuticos en los ensayos clínicos, menores y menos significativas serían las diferencias entre ambos tipos de instrumentos y que en el caso de efectos mayores, los instrumentos específicos serían más sensibles. Algunas desventajas comúnmente asociadas a los instrumentos específicos son el hecho de que no se pueden administrar en muestras que no presentan la condición en estudio, y que no permiten la comparación de los resultados entre tratamientos para diferentes problemas de salud, lo cual reduce las posibilidades de informar a la toma de decisiones sobre asignación de recursos a nivel macro. Ambas dificultades son abordadas por los instrumentos genéricos. De esta forma, la diferencia entre instrumentos genéricos y específicos se podría resumir, a modo muy general, como la existencia de un trade-off entre el nivel de detalle y relevancia lograda, y la posibilidad de usar el instrumento para un amplio rango de problemas de salud. 8 9 Marcadores subrogados o secundarios, como la reducción del colesterol o de la presión arterial en una intervención del tipo cardiovascular. Como sobrevida, reducción de la mortalidad, QALY (años de vida ajustados por calidad) o DALY (años de vida ajustados por discapacidad). COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 41 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 42 El ámbito en el cual el presente estudio se desarrolla, en relación a la necesidad de obtener la información a partir de la opinión de expertos (en chile no se cuenta con un grupo de pacientes identificados y tratados tempranamente) y de contar con información que pueda ser contrastada con los resultados de evaluaciones para intervenciones asociadas a distintos problemas de salud, en un contexto amplio de asignación de recursos, hace que resulte más apropiada la utilización de instrumentos genéricos. La encuesta EQ-5D es un instrumento genérico de medición de estados de salud, que evalúa cinco dimensiones (movilidad, cuidado personal, actividades habituales, dolor/malestar y ansiedad/depresión), cada una en tres niveles o graduaciones. El uso de este instrumento está validado para EE en salud y ha sido aplicado para evaluar intervenciones de diversos problemas de salud (EuroQol, 2012). Además, en Chile, a partir de un estudio contratado por la Superintendencia de Salud (Zarate et. al, 2011), se cuenta con valoraciones locales para los distintos estados de salud, que permite asignar dichas valoraciones a los perfiles obtenidos de la aplicación de la encuesta EQ-5D. 7.6.3. Metodología de aplicación de encuestas La encuesta se envió vía email a 42 profesionales, de los cuales 37 correspondían al grupo obtenido por muestreo subjetivo por decisión razonada y cinco a profesionales referidos mediante la técnica de “bola de nieve”. Para obtener una mejor participación, se efectuó previo al envío electrónico, un contacto telefónico breve con el fin de explicar los objetivos del estudio, y posteriormente, seguimiento de las encuestas enviadas. A cada experto se le envió la primera parte de la encuesta (encuesta epidemiológica) y se le asignó de manera aleatoria 2 de las formas antes mencionadas de encuesta EQ-5D. La distribución se realizó a partir de la fórmula para generar número aleatorios en Excel. Se hizo un sorteo para asignar a cada forma de la encuesta sus correspondientes expertos, avanzando en orden desde el formato 1-A hasta 3-B. En la asignación se tuvo dos precauciones: 1. Que un mismo formato no fuera asignada dos veces al mismo experto 2. Que a cada experto se le asignaran sólo dos de los formatos Como la asignación se fue haciendo secuencialmente (un sorteo a la vez), cada vez que alguna de las dos situaciones descritas ocurría, se repetía el sorteo hasta obtener un número que sí cumpliera con ambas precauciones. El procedimiento se repitió para la asignación de encuestas a los encuestados identificados en el segundo grupo. Para mejorar el nivel de participación, se efectuó un seguimiento de las encuestas enviadas. Para ello, posterior a la fecha de plazo de respuesta, indicada en la solicitud hecha a los expertos, se tomó contacto con los que aún no daban respuesta, ya sea para recordarles o bien para reenviar las encuestas. Este seguimiento fue hecho para los dos grupos de asignación de encuestas. 7.7. Horizonte Temporal En las dos alternativas evaluadas (screening universal y sólo en prematuros) se sigue a los RN por su sobrevida. Si bien los costos de la intervención se observan mayoritariamente en los primeros años de vida, los efectos obtenidos se prolongan por toda la vida. La simulación por la sobrevida es posible por el uso de software para análisis de decisiones como Tree-Age Pro Suite. 7.8. Uso De Recursos La metodología de costeo consistió en revisar las canastas de prestaciones para cada una de las intervenciones de salud definidas para el Régimen GES, para hipoacusia neurosensorial bilateral del prematuro en las diferentes etapas contempladas, lo cual fue complementado a partir de reuniones con expertos y lo definido en las guías clínicas antes detalladas. De esta forma, se consideran las siguientes etapas: screening en dos etapas, confirmación diagnóstica, tratamiento y seguimiento. Para el diagnóstico, los costos asociados a la intervención screening auditivo (PEAAT) en su primera etapa se realizará al 100% de los RN objeto de estudio (prematuros en estrategia actual y todos en la estrategia universal), y a la proporción de niños cuyo primer test resulte positivo en una segunda etapa. En aquellos RN que tengan resultado positivo (a hipoacusia) en la segunda etapa del screening, corresponde realizar la confirmación diagnóstica. Posteriormente, en la etapa de tratamiento se consideró la implementación bilateral de audífonos al 100% de los niños confirmados con diagnóstico de hipoacusia bilateral moderada a profunda. Todos los niños con discapacidad severa y profunda pasarán por una evaluación de implante coclear durante el primer año de tratamiento con audífonos, mientras que aquellos con un nivel moderado se someterán a dicha evaluación sólo en el caso de no mostrar resultados positivos con el tratamiento (durante el segundo año). En todos los casos el tratamiento se inicia con terapia de amplificación a través de audífonos asociada a terapia auditivo-verbal. Por otra parte, las intervenciones también contemplan la evaluación para implante coclear (año 1 o 2 según intensidad de la hipoacusia) y si esta es positiva se realiza el implante coclear (año 2) y continúa con la terapia auditivo-verbal y el respectivo seguimiento a lo largo de la vida. Los recursos económicos de las prestaciones contenidas en cada canasta, se valorizaron recurriendo a los costos y precios públicos obtenidos por el estudio de Verificación de Costos 2009 para el GES, los que corresponden a moneda de junio de 2009 (MINSAL, 2010b). Para actualizar estos precios a junio de 2012 se usó la variación del IPC entre el período junio 2009-mayo 2012, que se muestra en la Tabla 16. Tabla 16: Evolución IPC Junio 2009-Febrero 2012 (Base promedio 2009=100) IPC Jun-09 100,06 Mayo-12 107,53 Variación Junio-09 - mayo-2012 7,73% Fuente: Banco central COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 43 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 44 7.9. Modelo Utilizado Siguiendo a Kemper y Downs (2000), se construyó un árbol de decisiones en TreeAge Pro 2011, adaptando el modelo a los protocolos de atención en Chile y a la incorporación de resultados finales en salud, de manera de evaluar la costo-efectividad de las siguientes dos alternativas: 1. Estrategia selectiva de screening y tratamiento oportuno de hipoacusia bilateral congénita en RN prematuros (< 32 semanas o < 1.500 gramos) 2. Programa universal de screening y tratamiento oportuno de hipoacusia bilateral congénita Respecto de la estructura del modelo (ver Anexo 3), cada estrategia corresponde a una rama inicial. En el caso de la estrategia de screening selectivo, una primera apertura divide a la población de RN entre prematuros (< 32 semanas o <1.500 gramos) y de término10, mientras que en el caso de la estrategia de screening universal la primera apertura los divide entre RN con y sin factores de riesgo. Se asume que el esquema de diagnóstico, confirmación y tratamiento es el mismo en ambas estrategias en términos de estructura11, por lo que sólo difieren en la población objetivo. De esta forma, las ramas asociadas a los prematuros y a los RN con y sin factores de riesgo son iguales para ambas estrategias. Solo difiere la rama de RN de término (de la estrategia selectiva) a quienes no les aplica el tamizaje. La información disponible asociada tanto a la sensibilidad y especificidad de los tests de screening, prevalencias, coeficientes de calidad de vida y costos asociados a las distintas intervenciones ha sido abordada en extenso en las diferentes secciones del presente informe. El Anexo 4 presenta los valores de los parámetros utilizados en el escenario base y sus fuentes, diferenciados en primarios (utilizados directamente en el modelo o para calcular otros parámetros), y secundarios (calculados en base a los parámetros primarios). Cada parámetro primario presenta un rango y una distribución asociada, ambos necesarios para el análisis de sensibilidad. Así por ejemplo, los coeficientes de calidad de vida obtenidos a partir de la aplicación del cuestionario EQ-5D, son parámetros primarios que fueron utilizados para calcular el valor presente de los QALY asociado a la calidad de vida de los niños con los distintos resultados de salud de acuerdo a la intensidad de su hipoacusia y la oportunidad con que fueron diagnosticados y tratados, incorporando en el cálculo la expectativa de vida al nacer. Otros de los parámetros secundarios son los asociados a costos de tratamiento y seguimiento, los cuales corresponden a valores presentes y fueron calculados considerando los perfiles de atención para cada año de tratamiento y seguimiento de los niños ya sea con audífonos o implante coclear. Por otra parte, las probabilidades asociadas a los resultados positivos o negativos (VPP y VPN) de los tests diagnósticos y la confirmación también corresponden a parámetros secundarios, los cuales fueron calculados a partir de las prevalencias en la población de la rama en cuestión12 , y a la sensibilidad y especificidad de los tests en cada etapa. En este estudio el concepto “de término” se usa para aludir al resto de RN (los > de 32 semanas y > de 1.500 gramos) 10 En el caso de la segunda etapa del screening existe una diferencia en términos del momento en que se toma el test, siendo éste antes del alta en el caso de RN sin factores de riesgo (en estrategia universal) y posterior al alta en el caso de los RN con factores de riesgo (estrategia universal) y prematuros (estrategia selectiva). Sin embargo, esta diferencia no determina cambios en la estructura del modelo, si no sólo en el uso de los recursos asociados a las diferentes ramas. 11 En los casos de las etapas posteriores al primer test las “prevalencias” (número de niños con hipoacusia en relación al número de niños que el test previo identificó como positivo) correspondieron a los valores predictivos positivos de los tests. 12 Los parámetros utilizados en el análisis fueron calibrados en orden de asegurar la consistencia interna (y externa) del modelo. 7.10. Tasa de Descuento De acuerdo a la recomendación de la Guía Metodológica de Evaluaciones Económicas (MINSAL, 2011), se utilizó una tasa de descuento de 3% para el escenario base (para costos y outcomes). Además, se calcularon escenarios sin descuento (0%) y con descuento del 6% indiferenciado para costos y outcomes. Por último, también se consideraron dos escenarios con tasas diferenciadas, el primero con tasa del 6% para costos y 3% para outcomes, y el segundo con tasa de 3% para costos y 1,5% para outcomes. 7.11. Incertidumbre De acuerdo a la Guía Metodológica (MINSAL, 2011) existen tres tipos de incertidumbre. La incertidumbre metodológica, la incertidumbre estructural y la incertidumbre de parámetros. La incertidumbre metodológica se aborda siguiendo los lineamientos metodológicos básicos de la guía, como son la perspectiva, las tasa de descuento y el horizonte temporal de evaluación entre otros. La incertidumbre estructural se evalúa con una amplia justificación de la estructura del modelo. En ese sentido, si se considera la naturaleza de la patología y que el tiempo en que se producen las diferencias entre las estrategias se puede considerar, aun cuando la hipoacusia es una condición crónica, como de carácter agudo, y por ende lo más recomendado es un modelo con la estructura de un árbol de decisiones. La incertidumbre asociada a los parámetros se analiza tanto con análisis de sensibilidad determinístico (ASD) como probabilístico (ASP). En cuanto al ASD, los parámetros considerados, además de la tasa de descuento, son aquellos asociados a las prevalencias de hipoacusia en RN y en prematuros, la sensibilidad del screening y el costo de éste. Para el ASP se realizó una simulación de Montecarlo con 5.000 iteraciones. Para este, se consideraron los principales parámetros que fueron obtenidos a partir de encuestas desarrolladas para fines de este estudio (valoraciones de calidad de vida, distribución de las intensidades de audición, porcentaje de niños que requerirían implante coclear) y los costos de las distintas etapas. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 45 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 46 8. RESULTADOS Para facilitar la entrega de resultados estos se presentan en las siguientes secciones: variables epidemiológicas, de variables de efectividad y outcomes en salud, de costos, de costo-efectividad y análisis de sensibilidad. Los resultados de la encuesta a expertos se analizan en las dos primeras secciones de acuerdo a los objetivos definidos para cada instrumento aplicado. Tabla 17: Valores de parámetros epidemiológicos usados en el modelo de decisión. Variable Fuente Prevalencia global de hipoacu- Makki-Torkko et al, 1998; Fortnum et sia en RN (por 1.000 nacidos al, 2002; Nazar et al, 2009; Russ et al, vivos) 2003; Mather et al, 2000 Escenario Base Min Max Distribución 2,0 1,0 3,0 Triangular 1,3% 1,2% 1,4% Triangular Prevalencia de hipoacusia en Minsal, 2009; Torrente et al, 2007; RN prematuros (<32 semanas Cañete y Torrente, 2011. o <1500gr) (por 1.000 nacidos vivos) 30 20 40 Triangular Porcentaje de RN con factores Thompson et al, 2001 y Torrente et de riesgo para hipoacusia al 2001. El primero dice 10 – 20% para usuarios de neonatología y el segundo para <32 sem y 1.500 g. 10% 5% 20% - Basado en Torrente et al (2001) y Thompson et al (2001), que plantean un riesgo de hipoacusia 10 a 20 veces mayor en prematuros (<32 semanas o <1.500 gramos) y usuarios de UCI neonatal, respectivamente. El valor usado corresponde a un aumento del riesgo de 5 veces considerando todos los posibles factores de riesgo. 10 5 15 - Prevalencia de hipoacusia en Calculado en base a la prevalencia RN no prematuros (> 32 sema- global y la prevalencia en prematunas y 1.500 gr) (por 1.000 na- ros de <32 semanas o <1500 gr. cidos vivos) 1,6 - - - Prevalencia de hipoacusia en Apoya Nazaret al,(2009). Pero se calRN sin factores de riesgo (por cula en base a la prevalencia global, 1.000 nacidos vivos) la prevalencia de hipoacusia en RN de alto riesgo y la proporción de niños con factores de riesgo 1,1 - - - Porcentaje RN prematuros (<32 DEIS 2009 (2005-2009) semanas y/o <1500 gr) Prevalencia de hipoacusia en RN con factores de riesgo para hipoacusia (por 1.000 nacidos vivos) 8.1. Resultados Variables Epidemiológicas Para el análisis se consideró una cohorte de 252.240 RN vivos, con un porcentaje de prematurez (<32 semanas o < 1.500 gramos), de 1,3%, ambos valores correspondientes a la situación país 2009. La Tabla 17, muestra los valores incorporados al modelo de decisión usado para el análisis, incluye valores mínimos, máximos y la distribución usada en el análisis de sensibilidad probabilístico, así como la fuente de origen o el criterio con el cual se definió el valor. 8.2. Resultados encuestas epidemiológicas De los 42 expertos encuestados (37 en primera etapa y 5 en segunda etapa), cuatro expresaron explícitamente su intención de no participar, recibiéndose finalmente 28 encuestas contestadas (66,7% de participación). De las encuestas recibidas, una fue descartada por ser considerada outlier, mientras que en otras, no todas las preguntas fueron respondidas. De esta manera, las respuestas válidas fueron 26, 24 y 25 para las preguntas 1, 2 y 3, respectivamente. En el Anexo 5 se nombran los profesionales que participaron de la encuesta. 8.2.1.1. Pregunta 1 encuesta epidemiológica.- Distribución de RN según intensidad de hipoacusia bilateral. La frecuencia promedio (DE) encontrada por nivel de intensidad fue de 20,3% (14,04) para hipoacusia leve, 35,7% (15,76) para moderada, 21,6% (8,31) para severa y 22,4% (15,70) para profunda. En la Tabla 18 se pueden ver los estadísticos de tendencia central y dispersión para las respuestas de esta pregunta. Para efectos del valor ingresado al modelo, dado que no se consideran las hipoacusias leves, la distribución porcentual (DE) fue de 44,78% (19,79) para moderadas y 27,08% (10,44) para severas. Las profundas se consideraron como la diferencia del 100% ya sea para el escenario basal y el análisis de sensibilidad. Tabla 18: Distribución de RN por intensidad de hipoacusia bilateral según encuesta epidemiológica a expertos. (n=26) Promedio General Leve( %) Moderada (%) Severa ( %) Profunda( %) 20,30 35,66 21,56 22,41 30 30 20 20 0 10.00 7.00 3.00 Máximo 49,54 70,00 40,00 60,00 Desviación Estándar 14,04 15,76 8,31 15,70 Moda Mínimo 8.2.1.2. Pregunta 2 encuesta epidemiológica.- Porcentaje de RN sin beneficio por uso de audífono en la situación actual. La proporción promedio (DE) de RN con hipoacusia, dada la situación actual de screening y tratamiento, que no se beneficiaría con la terapia de amplificación sería de 6,63% (8,94) para hipoacusia moderada, 52,77% (25,12) para severa y 91,88% (12,73) para profunda. En la Tabla 19, se pueden ver los estadísticos de tendencia central y dispersión para las respuestas de esta pregunta. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 47 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 48 Tabla 19: Proporción de RN con hipoacusia según su intensidad, que no se beneficia con la terapia de amplificación en situación de screening y tratamiento actual. (n=24) Moderada (%) Promedio General Severa ( %) Profunda( %) 6,63 52,77 91,88 Moda 0 50,00 100,00 Mínimo 0 0 50,00 Máximo 30,00 90,00 100,00 8,94 25,12 12,73 Desviación Estándar 8.2.1.3. Pregunta 3 encuesta epidemiológica.- Porcentaje de RN sin beneficio por uso de audífono en la situación de detección y tratamiento temprano. La proporción promedio (DE) de RN con hipoacusia, dada una situación de screening y tratamiento temprano, que no se beneficiarían con la terapia de amplificación sería de 4,68% (7,01) para hipoacusia moderada, 41,80% (20,68) para severa y 91,00% (15,94) para profunda. En la Tabla 20, se pueden ver los estadísticos de tendencia central y dispersión para las respuestas de esta pregunta. Tabla 20: Proporción de RN con hipoacusia según su intensidad, que no se beneficia con la terapia de amplificación en situación de screening y tratamiento temprano. (n=26) Moderada (%) Promedio General Moda Severa ( %) Profunda( %) 4,68 41,80 91,00 0 50,00 100,00 Mínimo 0 0 30,00 Máximo 30,00 80,00 100,00 7,01 20,68 15,94 Desviación Estándar Existe consistencia en las respuestas de los expertos respecto del beneficio de la terapia de amplificación logrado por los RN con hipoacusia bilateral en sus diferentes grados de intensidad en el escenario de tratamiento temprano y en la situación actual. En ambos casos se observa una relación entre severidad de la discapacidad y la ausencia de beneficio de tal modo que a mayor severidad, menor es la probabilidad de beneficio con la terapia de amplificación. Si se comparan las respuestas a la preguntas dos y tres de la encuesta, se puede inferir que la situación de tratamiento temprano disminuye las posibilidades de ausencia de beneficio en los grupos moderados y severos, aun cuando esta disminución es leve. En las hipoacusias profundas, el efecto de la detección precoz, en cuanto al éxito de la terapia de amplificación es casi nulo. 8.3. Resultados de efectividad y Outcome en salud 8.3.1. Efectividad del screening Se consideró el PEAAT para el screening de hipoacusia en dos etapas, asumiendo una sensibilidad y especificidad de 95% y 90%, respectivamente, de acuerdo a lo publicado por Burke et al (2012) y Keren et al (2002). En tanto, como supuesto, que la sensibilidad y especificidad del proceso de confirmación sería de 95%. La Tabla 21, muestra los valores de sensibilidad, y los máximos y mínimos utilizados en el modelo. Tabla 21: valores de sensibilidad, especificidad de los test de screening y confirmación de hipoacusia. Descripción Fuente Escenario Base Sensibilidad PEAAT Burke et al, 2012; Keren et Min Max 0,95 0,9 1 0,9 0,85 1 al, 2002 Especificidad PEAAT Burke et al, 2012; Keren et Especificidad confirmación Supuesto 0,95 0,9 1 Sensibilidad confirmación Supuesto 0,95 0,9 1 al, 2002 8.3.2. Muestra encuestas EQ-5D En total, se enviaron 112 encuestas EQ-5D a los expertos de la muestra, de las cuales, se recibieron de vuelta y con respuesta 84 encuestas (74,1% de participación). En la Tabla 22, se resume por Forma de encuesta el proceso de sondeo de estados de salud asociados a hipoacusia. Se puede observar, que la forma 2-A fue la que menos participación obtuvo (63,2%) y la forma 1-B la con mayor nivel de respuesta (89,5%). Tabla 22: Tamaño muestral encuesta EQ-5D. Forma 1-A Forma 2-A Forma 3-A Forma 1-B Forma 2-B Forma 3-B Encuestas enviadas 18 19 20 19 19 17 Participantes 18 17 17 19 18 15 Respuestas recibidas 16 12 13 17 14 12 Respuestas válidas 16 12 12 17 14 12 8.3.3. Resultados Encuestas EQ-5D._Perfiles de salud La caracterización de los estados de salud definitivos de los pacientes con hipoacusia bilateral congénita, se puede observar en la Tabla 23. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 49 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 50 Tabla 23: Caracterización de los estados de salud definitivos de personas con hipoacusia de origen congénito, según encuesta EQ-5D realizada a expertos. Forma Intensidad 1-A (n=16) Sin problemas Movilidad Cuidado personal Activida- Dolor/ des Malestar habituales Ansiedad/ depresión 93,8% 100,0% 87,5% 100,0% 81,3% Algunos problemas 6,3% - 12,5% - 18,8% Muchos problemas - - - - - 82,4% 52,9% 11,8% 94,1% 5,9% Algunos problemas 17,6% 47,1% 76,5% 5,9% 58,8% Muchos problemas - - 11,8% - 35,3% 100,0% 100,0% 91,7% 100,0% 58,3% Algunos problemas - - 8,3% - 41,7% Muchos problemas - - - - - 92,9% 92,9% 7,1% 92,9% 14,3% Algunos problemas 7,1% 7,1% 64,3% 7,1% 35,7% Muchos problemas - - 28,6% - 50,0% 100,0% 100,0% 75,0% 100,0% 66,7% - - 25,0% - 33,3% 1-B (n=17) Sin problemas 2-A (n=12) Sin problemas 2-B (n=14) Sin problemas 3-A (n=12) Sin problemas Algunos problemas Muchos problemas - - - - - 75,0% 83,3% 8,3% 91,7% - Algunos problemas 25,0% 16,7% 66,7% 8,3% 50,0% Muchos problemas - - 25,0% - 50,0% 3-B (n=12) Sin problemas Forma 1-A: Hipoacusia moderada, diagnóstico y tratamiento precoz Forma 1-B: Hipoacusia moderada, diagnóstico y tratamiento tardío Forma 2-A: Hipoacusia severa, diagnóstico y tratamiento precoz Forma 2-B: Hipoacusia severa, diagnóstico y tratamiento tardío Forma 3-A: Hipoacusia profunda, diagnóstico y tratamiento precoz Forma 3-B: Hipoacusia profunda, diagnóstico y tratamiento tardío En general, se puede plantear una clara diferencia al comparar los estados de salud, cuando son producto de un diagnóstico y tratamiento precoz frente a uno tardío. La diferencia es tanto en la magnitud de los problemas como en las dimensiones afectadas. Así, en el caso de los tratados precozmente (Formas A), hay coincidencia en que no se afectarían las dimensiones de cuidado personal y dolor/malestar, mientras que algunos expertos consideran que si habría algunos problemas en el desarrollo de actividades habituales y en la dimensión de ansiedad y depresión. Un encuestado consideró, además, efectos negativos en la dimensión de movilidad para casos moderados. Cuando el diagnóstico y tratamiento es tardío (Formas B), para todas las dimensiones a lo menos un encuestado consideró habría algunos problemas o dificultades, independientemente de la intensidad de la hipoacusia, en tanto que un número menor de expertos consideró que este grupo de pacientes tendría muchas dificultades en las dimensiones de actividades habituales y depresión/ansiedad. Entre las intensidades de hipoacusia (Formas 1, 2 y 3), para una misma oportunidad de diagnóstico y tratamiento no se observa tan claramente una diferencia en los patrones de los estados de salud definitivos entre pacientes con hipoacusia moderada, severa y profunda. En los resultados de valoraciones de estados de salud (EQ-5D) la tendencia antes descrita se mantiene, siendo más clara la diferencia entre los estados finales por oportunidad de diagnóstico y tratamiento que por intensidad de hipoacusia. Aun así, se aprecia que a mayor intensidad de hipoacusia, el estado final se alejaría más de la salud perfecta, independiente de la oportunidad de atención. La Tabla 24, muestra los resultados antes mencionados., junto a otras variables estadísticas. Tabla 24: Aplicación de valoraciones chilenas EQ-5D a los estados de salud definitivos de pacientes con hipoacusia. Intensidad Hipoacusia Moderada Severa Profunda Oportunidad diagnóstico y tratamiento Precoz Tardío Precoz Tardío Precoz Tardío Forma 1-A (n=16) 1-B (n=17) 1-A (n=12) 1-B (n=14) 1-A (n=12) 1-B (n=12) Promedio 0,936 0,516 0,910 0,511 0,905 0,473 Moda 1,000 0,682 1,000 0,682 1,000 0,682 Desviación estándar 0,122 0,178 0,112 0,213 0,139 0,226 Máximo 1,000 0,808 1,000 1,000 1,000 0,682 Mínimo 0,574 0,252 0,682 0,134 0,682 0,026 Conclusiones EQ-5D En base a las respuestas recibidas, si consideramos la oportunidad de atención constante, es decir temprana o tardía, la valoración de salud estimada va en orden de magnitud descendente desde la hipoacusia bilateral moderada a la profunda. Por otra parte, los estados de salud resultantes de las encuestas válidas, tienen asociada una diferencia considerable en sus valoraciones cuando los pacientes con hipoacusia bilateral son tratados tempranamente versus un tratamiento tardío. Por último, para todo nivel de severidad, las dimensiones del EQ-5D que más se ven afectadas por el tratamiento tardío son las de actividades habituales y las de ansiedad/depresión. Asimismo, estas dimensiones son las más afectadas para cada nivel de severidad, independiente de la oportunidad de inicio de tratamiento. 8.4. Resultados de Costos A continuación se presenta la composición de las canastas de prestaciones asociadas a cada una de las etapas de la intervención, screening en dos etapas, confirmación diagnóstica, tratamiento de amplificación, terapia auditivo verbal, implante coclear y seguimiento, según corresponda. Los costos de las prestaciones están en pesos chilenos actualizados a mayo del 2012. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 51 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 52 8.4.1. Etapa diagnóstico Screening hipoacusia Test 1 Población objetivo: Estrategia selectiva: RN prematuro Código Glosa PNA3114301 (código EVC) Screening auditivo con potenciales auditivos de tronco cerebral automatizado (PEAAT) Estrategia universal: RN con riesgo y sin factores de riesgo de hipoacusia Cant. Frec. 1 Costo 100% $ 8.274 Valor Total Observaciones $ 8.274 Antes del alta. Screening hipoacusia Test 2 Población objetivo: Estrategia selectiva: RN prematuro Código Glosa PNA-3114301 (código EVC) Screening auditivo con potenciales auditivos de tronco cerebral (PEAAT) 1 100% $ 8.274 $ 8.274 Ambulatorio a los 15 días del alta. 0102005-GES Consulta por fonoaudiólogo 1 100% $ 5.896 $ 5.896 Total $14.170 Estrategia universal: RN con riesgo y sin factores de riesgo de hipoacusia Cant. Frec. Costo Valor Total Observaciones Población objetivo: Estrategia universal: RN sin factores de riesgo de hipoacusia con Test 1 positivo (+) Código Glosa PNA-3114301 (código EVC) Screening auditivo con potenciales auditivos de tronco cerebral automatizado (PEAAT) Cant. Frec. 1 Costo 100% $ 8.274 Valor Total Observaciones $ 8.274 Antes del alta. Confirmación diagnóstica: Población objetivo: Todo RN que ha tenido un resultado positivo en la segunda etapa del screening, es decir, que se ha detectado hipoacusia bilateral moderada a profunda. Código Glosa 0101112-GES Consulta integral de especialidades en Urología, Otorrinolaringología, Medicina Física y Rehabilitación Dermatología, Pediatría y Subespecialidades 2 100% Potenciales evocados en tronco 1 100% $ 10.482 Impedanciometría 1 100% $ 4.266 $ 4.266 Fonoaudiólogo o Tecnólogo Médico capacitado Audiometría a campo libre 1 100% $ 28.738 $ 28.738 Fonoaudiólogo o Tecnólogo Médico capacitado 0102005-GES Cant. Frec. Costo $ 7.758 Total Valor Total Observaciones $ 15.516 Otorrinolaringólogo $ 10.482 $59.002 8.4.2. Etapa tratamiento Implementación bilateral de audífonos año 1 de nacimiento (primer año) Población objetivo: Todo RN confirmado con hipoacusia bilateral niveles de moderada a profunda. Código Glosa Cant. Frec. Costo Valor Total 0101112-GES Consulta integral de especialidades en Urología, Otorrinolaringología, Medicina Física y Rehabilitación Dermatología, Pediatría y Subespecialidades 1 100% $ 7.758 $ 7.758 Otorrinolaringólogo 0102005-GES Consulta por fonoaudiólogo 14 100% $ 5.896 $82.544 0102007-GES Atención integral por terapeuta ocupacional 1 100% $ 6.844 $6.844 0903002-GES Consulta o control por psicó- 1 logo clínico 100% $ 7.482 $7.482 1301010 Prueba de audífonos 7 100% $ 2.970 $20.790 Audiometría a campo libre 8 100% $ 28.718 $229.744 Fonoaudiólogo o Tecnólogo Médico capacitado Audífono digital bilateral 2 100% $280.691 $561.382 Incluye molde, sujetador, tubo conector, pilas. Moldes de soporte audífonos 2 100% $ 8.080 Observaciones A los 0, 7, 14 y 28 días, luego a los 2, 3 y 6 meses $16.160 Total $932.704 Implementación bilateral de audífonos segundo año Población objetivo: Todo RN confirmado con hipoacusia bilateral moderada a profunda que no requiere implante. Código Glosa Cant. Frec. Costo Valor Total 0101112-GES Consulta integral de especialidades en Urología, Otorrinolaringología, Medicina Física y Rehabilitación Dermatología, Pediatría y Subespecialidades 1 100% $ 7.758 0102005-GES Consulta por fonoaudiólogo 42 100% $ 5.896 $247.632 0102007-GES Atención integral por terapeuta ocupacional 5 100% $ 6.844 $34.220 0903002-GES Consulta o control por psicólogo clínico 5 100% $ 7.482 $37.410 1301010 Prueba de audífonos 2 100% $ 2.970 $ 5.940 Audiometría a campo libre 2 100% $ 28.718 Moldes de soporte audífonos 2 100% $ 8.080 Observaciones $7.758 Otorrinolaringología 1 sesión semanal $ 57.436 con y sin audífono $ 6.160 Total $ 406.556 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 53 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 54 Implementación bilateral de audífonos tercer y cuarto año. Población objetivo: Todo RN confirmado con hipoacusia bilateral moderada a profunda que no requiere implante. Código Glosa Cant. Frec. Costo Valor Total 0101112-GES Consulta integral de especialidades en Urología, Otorrinolaringología, Medicina Física y Rehabilitación Dermatología, Pediatría y Subespecialidades 1 100% $7.758 0102005-GES Consulta por fonoaudiólogo 84 100% $5.896 0102007-GES Atención integral por terapeuta ocupacional 10 100% $6.844 0903002-GES Consulta o control por psicólogo clínico 10 100% $7.482 $74.820 1301010 Prueba de audífonos 1 100% $ 2.970 $2.970 Audiometría a campo libre 2 (sin implante y sin audífono) 100% $28.718 Audífono digital bilateral 0,5 100% $280.691 Moldes de soporte audífonos 2 100% Observaciones $7.758 Otorrinolaringología $495.264 2 veces por sema$68.440 na sesiones de 45 minutos $57.436 con y sin audífono $140.346 $8.080 $16.160 Total $863.194 Incluye molde, sujetador, tubo conector, pilas. Implementación bilateral de audífonos 5, 6 y 7 años. Población objetivo: Todo paciente confirmado con hipoacusia moderada a profunda que no requiere implante. Código Glosa Cant. Frec. Costo Valor Total Observaciones 0101112-GES Consulta integral de es- 1 pecialidades en Urología, Otorrinolaringología, Medicina Física y Rehabilitación Dermatología, Pediatría y Subespecialidades 100% $7.758 $7.758 Otorrinolaringólogo 0102005-GES Consulta por fonoaudiólogo 42 100% $ 5.896 0102007-GES Atención integral por terapeuta ocupacional 5 100% $6.844 $247.632 Una vez por semana sesiones de 45 $34.220 minutos 0903002-GES Consulta o control por psicólogo clínico 5 100% $ 7.482 $37.410 1301010 # Prueba de audífonos 1 100% $ 2.970 $2.970 Audiometría a campo libre ( sin implante y sin audífono) 1 100% $28.718 Moldes de soporte audífonos 1 100% $ 8.080 $8.080 Total $346.788 $28.718 con y sin audífono Implementación bilateral de audífonos año 8 en adelante Población objetivo: Todo paciente confirmado con hipoacusia moderada a profunda que no requiere implante. Código Glosa Cant. Frec. 0102005-GES Consulta por fonoaudiólogo 1 100% $5.896 $5.896 1301010 Prueba de audífonos 1 100% $2.970 $2.970 Audiometría tonal (sin implante y sin audífono) 1 100% $28.718 $28.718 Con y sin audífono Audífono digital bilateral 0,2 100% $280.691 $56.138 Duración audífono 5 años Moldes de soporte audífonos 100% 1 Costo Valor Total Observaciones $8.080 $8.080 Total $101.802 Evaluación implante coclear (año 1). Población objetivo: Niños con hipoacusia severa a profunda (en primer año). Niños con hipoacusia moderada que no muestran beneficios con uso de audífonos (en segundo año) Glosa Cant. Frec. Costo Valor Total Observaciones 0101112-GES Consulta integral de especialidades en Urología, Otorrinolaringología, Medicina Física y Rehabilitación Dermatología, Pediatría y Subespecialidades 2 100% $ 7.758 $ 15.516 Otorrinolaringólogo 0101110 Consulta integral de especialidades en Medicina Interna y Subespecialidades, Oftalmología, Neurología, Oncología (en CDT) 1 100% $ 8.042 $8.042 Neurólogo 0102005-GES Consulta por fonoaudiólogo 2 100% $ 5.896 $11.792 0903002-GES Consulta o control por psicólogo clínico 2 100% $ 7.482 $14.964 Potenciales evocados en tronco (examen clínico) 2 100% $ 10.482 $20.964 0403006 Temporal-oído (incluye coronales) (40 cortes 2 mm) 1 100% $ 40.750 $40.750 TAC 0405001-GES Cráneo-cerebro 1 100% $ 57.015 $57.015 RNM 1301009 -GES Impedanciometría 1 100% $ 4.266 $4.266 Total $173.309 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 55 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 56 Implante coclear (año 2) Población objetivo: Niños con hipoacusia moderada, severa y profunda en porcentaje que requiera implante coclear Glosa Cant. Frec. 0101112-GES Consulta integral de especialidades en Urología, Otorrinolaringología, Medicina Fisica y Rehabilitación Dermatología, Pediatría y Subespecialidades 3 100% $ 7.758 $23.274 Otorrinolaringólogo 0301011-GES Coagulación, tiempo de 1 100% $20.353 $20.353 0301045-GES Hemograma (incluye 1 recuentos de leucocitos y eritrocitos, hemoglobina, hematocrito, fórmula leucocitaria, características de los elementos figurados y velocidad de eritrosedimentación) 100% $1.732 $1.732 0301072-GES Sangría, tiempo de (Ivy) 1 (no incluye dispositivo asociado ) 100% $2.205 $2.205 0203001-GES Día cama hospitaliza3 ción integral medicina, cirugía, pediatría, obstetricia-ginecología y especialidades (sala 3 camas o más) 100% $54.028 $162.084 0203003-GES Día cama hospitaliza1 ción integral pediátrica en Unidad de Cuidado Intensivo (U.C.I). 100% $219.256 $219.256 Intervención quirúrgica implante coclear (incluye prótesis) 100% $19.525.082 $19.525.082 Total $ 19.953.986 1 Costo Valor Total Observaciones Seguimiento implante coclear año 2 Población objetivo: Niños con implante coclear Código Glosa Cant. Frec. Costo Valor Total 0101112-GES Consulta integral de especialidades en Urología, Otorrinolaringología, Medicina Física y Rehabilitación Dermatología, Pediatría y Subespecialidades 4 100% $7.758 0102005-GES Consulta por fonoaudiólogo 48 100% $ 5.896 $283.008 0102007-GES Atención integral por terapeu- 5 ta ocupacional 100% $ 6.844 $34.220 0903002-GES Consulta o control por psicólogo clínico 5 100% $ 7.482 $37.410 Audiometría a campo libre (sin implante y sin audífono) 6 100% $28.718 $172.308 Total $557.978 Observaciones $31.032 Otorrinolaringología Seguimiento implante coclear año 3: Población objetivo: Niños con implante coclear Código Glosa Cant. Frec. Costo 0101112-GES Consulta integral de especialidades en Urología, Otorrinolaringología, Medicina Física y Rehabilitación Dermatología, Pediatría y Subespecialidades 3 100% $7.758 0102005-GES Consulta por fonoaudiólogo 84 100% $5.896 0102007-GES Atención integral por terapeu- 10 ta ocupacional 100% $6.844 0903002-GES Consulta o control por psicólogo clínico 10 100% $7.482 Audiometría a campo libre ( sin implante y sin audífono) 4 100% $28.718 Total Valor Total Observaciones $23.274 Otorrinolaringólogo $495.264 $68.440 Dos veces por semana sesiones de $74.820 45 minutos $114.872 con y sin audífono $776.670 Seguimiento implante coclear año 4 Población objetivo: Niños con implante coclear Código Glosa Cant. Frec. Costo 0101112-GES Consulta integral de especialidades en Urología, Otorrinolaringología, Medicina Física y Rehabilitación Dermatología, Pediatría y Subespecialidades 3 100% $ 7.758 0102005-GES Consulta por fonoaudiólogo 84 100% $5.896 0102007-GES Atención integral por terapeu- 10 ta ocupacional 100% $6.844 0903002-GES Consulta o control por psicólogo clínico 10 100% $7.482 Audiometría a campo libre ( sin implante y sin audífono) 2 100% $28.718 Total Valor Total Observaciones $23.274 Otorrinolaringólogo $495.264 $68.440 Dos veces por semana sesiones de $74.820 45 minutos $57.436 con y sin audífono $ 719.234 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 57 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 58 Seguimiento implante coclear año 5,6,7: Población objetivo: Niños con implante coclear Código Glosa Cant. Frec. Costo 0101112-GES Consulta integral de especialidades en Urología, Otorrinolaringología, Medicina Física y Rehabilitación Dermatología, Pediatría y Subespecialidades 1 100% $7.758 0102005-GES Consulta por fonoaudiólogo 42 100% $5.896 0102007-GES Atención integral por terapeu- 5 ta ocupacional 100% $6.844 0903002-GES Consulta o control por psicólogo clínico 5 100% $7.482 Audiometría a campo libre ( sin implante y sin audífono) 1 100% $28.718 Total Valor Total Observaciones $7.758 Otorrinolaringólogo $247.632 $34.220 Una vez por semana sesiones de 45 $37.410 minutos $28.718 con y sin audífono $355.738 a) Seguimiento implante coclear año 8 en adelante: Población objetivo: niños con implante coclear Población objetivo: niños con implante coclear Código Glosa 0102005-GES Consulta por fonoaudiólogo Cant. 1 Frec. 100% Costo $ 5.896 Valor Total Observaciones $5.896 En la Tabla 25, se muestran los valores totales de cada etapa del proceso diagnóstico y tratamiento de la hipoacusia moderada a profunda, a valor presente. Tabla 25: Resumen costo por etapa screening, diagnóstico y tratamiento de hipoacusia bilateral moderada a profunda. Etapa Costo Screening en RN con Factor de Riesgo o <32 semanas y <1.500 gr. $ 22.444 Screening en RN sin Factor de Riesgo $ 16.548 Todo RN con test 1 y test 2 (+) $ 59.002 Tratamiento audífonos en Valor presente* Tratamiento implante coclear en valor presente* *El valor presente se calculó con una tasa de descuento del 3% y una expectativa de vida de 78,7 años. $ 6.308.050 $ 23.330.973 En resumen, los recursos a utilizar consideran el 100% de RN, con screening etapas 1 y 2, total $22.444 ó $16.548 por cada niño según el grupo de población en la que se encuentre. Además, se debe considerar que un porcentaje de estos niños pasa a confirmación diagnóstica, con un costo de $59.002 por cada confirmación, un porcentaje menor necesitará tratamiento con audífonos ($6.308.050) y otro porcentaje de niños necesitará implante coclear ($23.330.973). 8.5. Resultados de Costo efectividad La Tabla Nº26 presenta los resultados de costos, efectividad en QALYs y de costo/efectividad para las dos estrategias estudiadas, calculados en base al modelo y a los parámetros señalados en las secciones anteriores. La Tabla muestra, además, el análisis incremental de pasar de una estrategia a otra. Tabla 26: Resultados de Costo efectividad para el escenario Base. Costos ($ 2012) Efectividad (QALY) CE promedio Cost_Incr ($2012/QALY) Selectivo (prematuros) 26.486,35 30,0523 881,34 Universal 32.620,49 30,0708 1.084,79 6.134,14 Efec_Incr 0,0185 ICER 331.368,22 Mientras en la estrategia actual de screening selectivo (prematuros) el costo esperado por RN es de $26.486, obteniéndose en promedio 30,0523 QALY por niño, al pasar a la estrategia universal tanto el costo como la efectividad aumentan, alcanzando los $32.621 y 30,0709 QALY por RN, respectivamente. Lo anterior implica una razón de costo-efectividad incremental (ICER) de $331.368,22 es decir, al pasar de la estrategia de screening selectiva a la universal por cada QALY ganado, se deben invertir aproximadamente 331 mil pesos. La Figura 2, incluye una representación gráfica de los costos y efectividades de ambas estrategias. Los valores incrementales de costos y de efectividad, sitúan a la estrategia de screening universal en el cuadrante noreste (superior derecho) del plano de costo efectividad, es decir, aumentan tanto los costos como los beneficios en salud, lo cual indica la necesidad de un análisis de umbral. Figura 2 Gráfico de costo- efectividad de las estrategias de screening de hipoacusia bilateral congénita. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 59 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 60 Si se considera un PIB per cápita chileno del orden de los $6,97 millones para el año 201113 como umbral de disposición a pagar por un QALY extra (MINSAL, 2011), pasar de una estrategia de screening selectivo (prematuros) a una de screening universal resulta costo-efectiva. En términos poblacionales, si se considera una cohorte de RN de 252.240 niños, como la del año 2009, con una estrategia de screening selectivo, la evaluación se realizaría al 1,3% de la cohorte, correspondiente a los niños prematuros de < 32 semanas o < 1.500 gr., esto es aproximadamente 3.280 niños. Considerando una prevalencia para la hipoacusia bilateral congénita moderada a profunda del 3% en prematuros, y teniendo en cuenta que por la sensibilidad y especificidad del test se pierden en la detección aproximadamente 10 niños, se logra detectar precozmente a aproximadamente 88 RN prematuros con esta discapacidad. Entre los RN no prematuros también se deja de detectar tempranamente a aproximadamente 406 niños a los cuales no se les realiza el screening y que también presentan hipoacusia bilateral congénita moderada a profunda. Por otra parte, con una estrategia de screening universal, a todos los RN se les evalúa su audición y como resultado se logra detectar tempranamente a 455 niños, perdiéndose en el proceso alrededor de 49 niños (falsos negativos). En definitiva, se detectan 367 casos extra al pasar de una estrategia a la otra. En relación a los costos, a nivel poblacional se tendría un costo estimado de $6.680,82 millones para la estrategia selectiva y uno de $8.228,06 millones para la estrategia universal. Por el lado de los efectos, para la cohorte analizada en un escenario de screening selectivo, se obtienen 7,580 millones de QALYs, versus los 7,585 millones que se generarían en un escenario de screening universal. Dado que estos QALYs no son asociables directamente con hipoacusia, o no de manera exclusiva, se debe considerar la ganancia de salud de pasar de una estrategia a otra, la cual para este estudio sería de aproximadamente 5 mil QALYs. El costo por caso extra detectado al pasar de una estrategia a otra fue de $4.215.913 (aproximadamente US$ 8.875,6 14). 8.6. Análisis de sensibilidad La última etapa del estudio corresponde a la sensibilización de los parámetros utilizados en el escenario base que se asocian a mayor incertidumbre. Este análisis fue abordado primero a partir de un análisis de sensibilidad determinístico (ASD) de una vía, y luego a partir de un análisis de sensibilidad probabilístico (ASP) en que se consideraron simultáneamente múltiples parámetros y sus distribuciones estadísticas asociadas. 8.6.1. Análisis de sensibilidad determinístico - ASD Además de la tasa de descuento, en que las sensibilizaciones consideradas siguieron los lineamientos de la Guía Metodológica (MINSAL, 2011), se sometieron a análisis de sensibilidad univariados los 4 parámetros que se consideró podrían tener mayor impacto individual en los resultados de costo efectividad: sensibilidad del PEAAT en primera etapa, el costo del PEAAT, la prevalencia de hipoacusia en RN y la prevalencia de hipoacusia en RN prematuros (<32 semanas y/o <1500gr). A continuación se presentan los resultados para estas 5 sensibilizaciones. Según cifras preliminares del Banco Central, el PIB para el año 2011 asciende a $ 120.232.603 millones. Por otra parte, la población Chilena proyectada por el INE para el año 2011 es de 17.248.450. 14 Cambio 1 US$ es a $475 13 Tasa de descuento La Tabla 27, presenta los análisis de sensibilización para los distintos valores de la tasa de descuento. La tasa de descuento del escenario base corresponde a un 3% para costos y outcomes, y para los escenarios alternativos se consideran tasas de 0 y 6% para el numerador y denominador, y otros dos escenarios con tasas diferenciadas de 3 y 6% para costos y de 1,5 y 3% para outcomes, respectivamente. De esta forma el ICER se encontraría en un rango entre $87.385,69 y $718.682,02 por QALY ganado al pasar de un escenario con tasa de descuento de 0% a uno con un descuento de 6%. Tabla 27: Análisis de sensibilidad determinístico: tasa de descuento Tasa Descuento Estrategia Costos ($2012) 0% Selectiva 34.797,75 78,6327 442,54 - - - Universal 39.030,36 78,6811 496,06 4.232,61 0,0484 87.385,69 3% (escenario base) Selectiva 26.486,35 30,0523 881,34 Universal 32.620,49 30,0708 1.084,79 6.134,14 0,0185 331.368,22 6% Selectiva 22.920,09 16,4826 1.390,56 - - - Universal 30.216,81 16,4928 1.832,12 7.296,73 0,0102 718.682,02 Selectiva 26.486,35 45,9720 576,14 Universal 32.620,49 46,0003 709,14 6.134,14 0,0283 216.618,34 6% Costos - Selectiva 3% OutcoUniversal mes 22.920,09 30,0523 762,67 - - - 30.216,81 30,0708 1.004,85 7.296,73 0,0185 394.171,40 3% Costos - 1,5% Outcomes Efectividad CE promedio (QALY) Costo Increm Efect Increm. ICER ($2012) Sensibilidad del test utilizado en la primera etapa del screening La Tabla 28, presenta el costo, la efectividad y el ICER para cada estrategia al variar el valor del parámetro de Sensibilidad del Test usado en la primera etapa del proceso de screening (PEAAT). En el escenario base dicho parámetro tomó un valor de 95%, y para el ASD se consideró un rango entre 90% y 100%, de acuerdo a lo presentado en Anexo 4. De esta manera, el ICER varía entre $380 mil a $287 mil al pasar la sensibilidad del test diagnóstico de 0,9 a 1. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 61 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 62 Tabla 28: Análisis de sensibilidad determinístico: Test primera etapa (PEAAT) Sensibilidad Estrategia Costos test 1 ($2012) 90% Efectividad CE promedio (QALY) Selectivo 26.484,47 30,05 881,29 Universal 33.138,03 30,07 1.102,05 Selectivo 26.485,41 30,05 881,31 Universal 32.879,20 30,07 1.093,41 95% (escenario base) Selectivo 26.486,35 30,05 881,34 Universal 32.620,49 30,07 1.084,79 97,5% Selectivo 26.487,29 30,05 881,37 Universal 32.361,91 30,07 1.076,17 Selectivo 26.488,22 30,05 881,40 Universal 32.103,46 30,07 1.067,55 92,5% 100% Costo Efect Increm. ICER ($2012) 6.653,56 0,02 380.722,33 6.393,79 0,02 355.331,39 6.134,14 0,02 331.368,22 5.874,63 0,02 308.716,17 5.615,24 0,02 287.270,97 Costo del PEAAT La Tabla 29, presenta el costo, la efectividad y el ICER para cada estrategia al variar el valor del parámetro costo del PEAAT. En el escenario base dicho parámetro tomó un valor de $8.274, y para el ASD se consideró un rango de más menos el 20%, lo que determinó que una variación entre $6.619 y $9.929. Tabla 29: Análisis de sensibilidad determinístico: Test primera etapa (PEAAT) Costo PEAAT ($2012) Estrategia Costos ($2012) 6.619,0 Selectivo 26.464,83 30,05 880,63 Universal 30.815,13 30,07 1.024,75 Selectivo 26.475,59 30,05 880,98 Universal 31.717,81 30,07 1.054,77 8.274,0 (escenario base) Selectivo 26.486,35 30,05 881,34 Universal 32.620,49 30,07 1.084,79 9.101,5 Selectivo 26.497,11 30,05 881,70 Universal 33.523,17 30,07 1.114,81 Selectivo 26.507,86 30,05 882,06 Universal 34.425,85 30,07 1.144,83 7.446,5 9.929,0 Efectividad CE promedio (QALY) Costo Efect Increm. ICER ($2012) 4.350,30 0,02 235.004,54 5.242,22 0,02 283.186,38 6.134,14 0,02 331.368,22 7.026,06 0,02 379.550,07 7.917,98 0,02 427.731,91 En este caso, el ICER aumenta de $235 mil a $427 mil al pasar del menor al mayor valor del rango considerado. Prevalencia de hipoacusia bilateral moderada a profunda en RN La Tabla 30, presenta el costo, la efectividad y el ICER para cada estrategia al variar el valor del parámetro prevalencia de hipoacusia en RN. En el escenario base dicho parámetro tomó un valor de 2,0 por 1.000 nacidos vivos, y para el ASD se consideró un rango entre 1,0 y 3,0 por 1.000 nacidos vivos. Tabla 30: Análisis de sensibilidad determinístico: prevalencia hipoacusia RN PrevaEstrategia lencia Hipoacusia RN (Por 1.000 nacidos vivos) Costos ($2012) 1,0 Selectivo 13.368,87 30,07 444,63 Universal 29.525,12 30,07 981,79 16.156,26 Selectivo 19.927,61 30,06 662,93 Universal 31.048,75 30,07 2 (escenario base) Selectivo 26.486,35 30,05 881,34 Universal 32.620,49 30,07 1.084,79 2,5 Selectivo 33.045,09 30,04 1.099,86 Universal 34.239,75 30,07 1.138,67 Selectivo 35.905,93 30,07 1.194,12 Universal 39.603,83 30,04 1.318,49 1,5 3,0 Efectividad CE pro(QALY) medio Costo 1.032,49 11.121,14 Efect Increm. ICER ($2012) 0,01 2.998.918,06 0,01 930.245,73 6.134,14 0,02 331.368,22 1.194,66 0,03 47.677,53 3.697,90 -0,03 -117.053,71 Del análisis se desprende que, la prevalencia de hipoacusia en RN es un parámetro que puede variar considerablemente los resultados. La relación se da en el sentido inverso, en la medida que la prevalencia aumenta, el ICER tiende a disminuir. De esta forma, de ser aproximadamente $3 millones cuando la prevalencia baja a 1 por mil nacidos vivos, pasa a una situación en que la estrategia de screening selectivo es dominada por la de screening universal cuando la prevalencia aumenta a 3 por mil niños. A este nivel de prevalencia, la estrategia de screening universal no sólo es más efectiva, sino que también menos costosa que la situación actual. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 63 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 64 Prevalencia de hipoacusia en RN prematuros (<32 semanas y/o <1500gr) La Tabla 31, presenta el costo, la efectividad y la razón de costo efectividad para cada estrategia al variar el valor del parámetro Prevalencia de hipoacusia en RN prematuros (<32 semanas o < 1.500 gramos). En el escenario base dicho parámetro tomó un valor de 30 por 1.000 nacidos vivos, y para el ASD se consideró un rango entre 20 y 40 por 1.00 nacidos vivos Tabla 31: Análisis de sensibilidad determinístico: prevalencia hipoacusia RN PrevaEstrategia lencia Hipoacusia RN (Por 1.000 nacidos vivos) Costos ($2012) 20 Selectivo 26.475,60 30,05 881,02 Universal 32.620,49 30,07 1.084,79 Selectivo 26.480,97 30,05 881,18 Universal 32.620,49 30,07 1.084,79 30 (escenario base) Selectivo 26.486,35 30,05 881,34 Universal 32.620,49 30,07 1.084,79 35 Selectivo 26.491,73 30,05 881,50 Universal 32.620,49 30,07 1.084,79 Selectivo 26.497,10 30,05 881,66 Universal 32.620,49 30,07 1.084,79 25 40 Efectividad CE pro(QALY) medio Costo Efect Increm. ICER ($2012) 6.144,89 0,02 308.602,49 6.139,52 0,02 319.570,48 6.134,14 0,02 331.368,22 6.128,76 0,02 344.093,59 6.123,39 0,02 357.860,46 En este caso, el ICER aumenta a medida que va aumentando la prevalencia en prematuros, pasando de $308 mil a $357 mil desde el menor al mayor valor del rango. 8.6.2. Análisis de sensibilidad Probabilístico - ASP Las Tablas 32 a la 34, muestran los valores del escenario base, rangos mínimos y máximos y las distribuciones asociadas a cada uno de los parámetros incluidos en el análisis de sensibilidad probabilístico. Se consideró para este fin, las prevalencias de hipoacusia bilateral congénita, la distribución por intensidad del déficit, porcentajes de pacientes que llegarían a requerir implante coclear, coeficientes de calidad de vida asociado a los estados de salud definitivos del paciente con hipoacusia y los costos de las estrategias. Tabla 32: Parámetros de frecuencia de grupos de RN, prevalencia de hipoacusia y frecuencia de implante coclear incorporados a la ASP Descripción Escenario Base Min Max Distribución Porcentaje RN prematuros (<32 semanas y/o 1,3% <1500 gr) 1,2% 1,4% Triangular Prevalencia hipoacusia en RN prematuros (<32 semanas y/o <1500gr) por 1.000 nacidos vivos, 30 20 40 Triangular Prevalencia hipoacusia en RN por 1.000 nacidos vivos 2 1 3 Triangular Porcentaje de hipoacusias bilaterales moderadas 44,78% 34,99% 64,58% Beta (DE: 0,198) Porcentaje de hipoacusias bilaterales severas 27,08% 16,64% 37,51% Beta (DE: 0,104) Porcentaje de RN con hipoacusia bilateral moderada, detectada y tratada tempranamente que llega a implante coclear 4,68% 0% 11,69% Beta (DE: 0,070) Porcentaje de RN con hipoacusia bilateral 41,8% severa, detectada y tratada tempranamente que llegaría a implante coclear 21,12% 62,48% Beta (DE: 0,207) Porcentaje de RN con hipoacusia bilateral profunda, detectada y tratada tempranamente que llega a implante coclear 75,06% 100% Beta (DE: 0,159) Porcentaje de RN con hipoacusia bilateral 6,63% moderada, detectada y tratada tardíamente que llega a implante coclear 0% 15,57% Beta (DE: 0,089) Porcentaje de RN con hipoacusia bilateral severa, detectada y tratada tardíamente que llega a implante coclear 52,77% 27,67% 77,89% Beta (DE: 0,251) Porcentaje de RN con hipoacusia bilateral profunda, detectada y tratada tardíamente que llega a implante coclear 91,88% 79,15% 100% Beta (DE: 0,127) 91% Tabla 33: Parámetros de coeficientes de calidad de vida para diferentes oportunidades de atención según grado de intensidad de la hipoacusia, incorporados al ASP Descripción Escenario Base Min Max Distribución Coeficiente de calidad de vida asociado a hipoacusia bilateral moderada detectada tempranamente 0,936 0,814 1 Beta (DE: 0,122) Coeficiente de calidad de vida asociado a hipoacusia bilateral profunda detectada tempranamente 0,91 0,798 1 Beta (DE: 0,112) Coeficiente de calidad de vida asociado a hipoacusia bilateral severa detectada tempranamente 0,905 0,766 1 Beta (DE: 0,139) Coeficiente de calidad de vida asociado a hipoacusia bilateral moderada detectada tardíamente 0,516 0,338 0,694 Beta (DE: 0,178) Coeficiente de calidad de vida asociado a hipoacusia bilateral profunda detectada tardíamente 0,511 0,298 0,724 Beta (DE: 0,213) Coeficiente de calidad de vida asociado a hipoacusia bilateral severa detectada tardíamente 0,473 0,247 0,699 Beta (DE: 0,226) COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 65 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 66 Tabla 34: Parámetros de costos incorporados al ASP Descripción Escenario Base ($2012) Costo PEAAT Min ($2012) Max ($2012) Distribución 8.274 6.619 9.929 Triangular Costo PEAAT más consulta fonoaudiólogo 14.170 11.336 17.004 Triangular Costo Confirmación 59.002 47.202 70.802 Triangular Costo tratamiento audífonos, año 1 932.704 746.163 1.119.245 Triangular Costo tratamiento audífonos, año 2 406.556 325.245 487.867 Triangular Costo tratamiento audífonos, años 3 y 4 863.104 690.483 1.035.725 Triangular Costo tratamiento audífonos, años 5 y 6 366.788 293.430 440.146 Triangular Costo seguimiento audífonos desde año 8 101.802 81.442 122.162 Triangular Costo evaluación implante 173.309 138.647 207.971 Triangular Costo tratamiento implante, año 1 19.953.986 15.963.189 23.944.783 Triangular Costo seguimiento implante, año 1 557.978 446.382 669.574 Triangular Costo seguimiento implante, año 2 776.670 621.336 932.004 Triangular Costo seguimiento implante, año 3 719.234 575.387 863.081 Triangular Costo seguimiento implante, año 4 355.738 284.590 426.886 Triangular Costo seguimiento implante, año 5, 6 y 7 355.738 284.590 426.886 Triangular 5.896 4.717 7.075 Triangular Costo seguimiento implante, desde año 8 La Tabla 35, presenta los resultados del ASP a partir de 5.000 iteraciones para costos y efectos de cada una de las estrategias de screening. La media de los costos obtenidos para las estrategias selectiva y universal, fue de $26.354,6 y $32.513,1, respectivamente, mientras que la media de la efectividad fue de 30,052 y 30,071 QALYs para las respectivas estrategias. Esto mismo se puede ver en la Figura 3, en las cuales se grafica cada uno de los resultados de la simulación en términos de costos y QALYs. En general, se puede observar que los posibles resultados de cada estrategia presentan cierto nivel de superposición en términos de sus costos y efectos. Respecto de los primeros, la estrategia selectiva muestra una mayor amplitud de posibles resultados que la universal, encontrándose esta última contenida en el rango de resultados de la primera. Desde el punto de vista de los efectos en salud, también la estrategia selectiva presenta un rango de resultados más amplios, en tanto que la estrategia universal, con un rango más acotado tiende a estar más hacia la derecha (mayor salud) que la selectiva. Tabla 35: Estadísticos de tendencia central y dispersión para outcomes y costos por estrategia resultantes de Simulación de Montecarlo, 5.000 iteraciones. Screening Selectivo Screening Universal Costos Costos QALYs QALYs Media $ 26.354,6 30,052 $ 32.513,1 30,071 Desviación Estándar $ 7.253,18 0,0086 $ 4.438,7 0,0034 Máximo $ 58.194,7 30,073 $ 49.609,6 30,077 Percentil 95 $ 39.135,9 30,065 $ 40.167,5 30,075 $ 25.822,37 30,053 $ 32.216,6 30,072 $ 15.608,0 30,037 $ 25.621,9 30,064 $ 9.947,9 30,016 $ 19.255,8 30,050 Mediana Percentil 5 Mínimo COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 67 Figura 3: Gráfico dispersión de costos y efectos por estrategias. En la Tabla 36, por su parte, se aprecian los parámetros de tendencia central y dispersión para los costos incrementales, QALYs ganados y el ICER asociados al paso de una estrategia de screening selectivo a uno universal. Como se puede ver, el ICER promedio de las 5.000 iteraciones fue de $615.037,3 por QALY ganada, con un amplio rango que va desde los $180.182.255,5 a -$34.254.736,6 Tabla 36: Resultados ASP (Simulación de Montecarlo, 5.000 iteraciones) Costos incrementales ($2012) QALYs Ganadas ICER Media $ 6.158,5 0,0184 $ 615.037,3 Desviación estándar $ 4.953,8 0,0079 $ 3.043.271,4 Máximo $ 19.925,3 0,0485 $ 180.182.255,5 Percentil 95 $ 13.883,9 0,0323 $ 1.747.212,2 $ 6.363,4 0,0179 $ 350.457,3 -$ 2.517,3 0,0066 $ -109.021,7 -$ 14.623,2 -0,0040 $ -34.254.726,6 Mediana Percentil 5 Mínimo COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 68 Si se contrastan estos resultados con el umbral de disposición a pagar definida en la Guía Metodológica de Costo Efectividad (MINSAL, 2011), correspondiente a 1 PIB per cápita ($MM 6,970) la media encontrada nos indica que el pasar de una estrategia de screening selectivo, enfocada en prematuros <32 semanas o <1.500 gramos, a una estrategia universal, sería costo-efectiva. El límite de costo-efectividad se encontraría sobre el percentil 95, puesto que el máximo obtenido queda por sobre este umbral. Cabe destacar, que 11 valores de los inferiores, corresponden a situaciones en que hubo una reducción de QALYs con un incremento de costos. Estos resultados estarían indicando, junto a los máximos encontrados, ineficiencia al pasar de una estrategia selectiva a una universal. La Figura 4, muestra una representación gráfica de cada uno de resultados obtenidos en las 5.000 iteraciones del ASP en términos de sus costos incrementales y QALYs ganadas. Se puede observar que la mayor parte de los puntos del gráfico se encuentran en el cuadrante noreste (superior derecho) del plano de costo efectividad, en el cual el aumento de los beneficios en salud se acompaña de un mayor gasto, en tanto, un porcentaje menor se encontraría en el cuadrante sureste (inferior derecho) indicando costo efectividad, puesto que con menores costos se incrementarían los resultados. Además, habría 11 posibles resultados en el cuadrante noroeste (superior izquierdo) indicando que se podría perder salud con mayores costos. Figura 4: Diagrama de dispersión de costos incrementales y QALYs Ganadas Figura 5: Curva de aceptabilidad Por último, al considerar un rango de disponibilidad a pagar (o umbral) entre MM$ 1,0 y MM$10,0 tal como se observa en la Figura 5, podemos observar una curva de aceptabilidad que va desde una probabilidad de costo efectividad de 62,8% a 99,2%. Para el umbral de disposición a pagar definido para Chile, la probabilidad de que sea costo-efectivo pasar desde una estrategia de screening selectivo a una universal es de un 99,2%. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 69 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 70 9.DISCUSIÓN La evaluación económica realizada analiza, desde el punto de vista de la eficiencia en el uso de los recursos, un posible escenario de ampliación de la actual estrategia nacional de screening de hipoacusia congénita de carácter selectivo, enfocada en RN de < 32 semanas o <1.500 gramos de peso de nacimiento, a una estrategia universal en la cual todo RN sea tamizado. Algunos elementos que hicieron necesaria la realización de este análisis fueron la baja prevalencia de este déficit en población sin factores de riesgo, la existencia de un test de screening de sensibilidad y especificidad que no permiten una alta precisión en el diagnóstico, que la confirmación de la hipocusia requiera de recursos especializados de alto costo y la existencia de evidencia, aunque no de la mejor calidad, que indica que el diagnóstico precoz aumentaría la efectividad del tratamiento redundando en una mejor calidad de vida. De acuerdo a los resultados obtenidos, al pasar de la estrategia selectiva a la universal el costo de obtener un QALY extra es de aproximadamente 331 mil pesos (ICER), valor muy por debajo un PIB per cápita (aproximadamente $6,97 millones para el año 2011) que es el umbral definido en la Guía Metodológica de Evaluaciones Económicas de Chile (MINSAL, 2011) como disposición a pagar por obtener un QALY extra. Esto significaría que al ampliar la estrategia a todos los RN, se mantendría la eficiencia en el uso de los recursos. Además, los análisis de sensibilidad realizados (ASD y ASP), mostraron que el sentido del resultado se mantiene a pesar del uso de rangos amplios para los parámetros epidemiológicos, de costo y de efectividad ingresados al modelo. En consideración de esto, se puede plantear que el resultado obtenido es robusto, es decir, que la estrategia de screening universal es costo-efectiva en relación a la estrategia de screening selectivo a pesar de la incertidumbre asociada a los parámetros. El análisis de umbral muestra una situación similar, siendo el 99,2% de las 5000 posibles combinaciones efectuadas, costo-efectivas. Los resultados favorables en relación a la estrategia de screening universal dan cuenta, por una parte de las ganancias de salud en términos de la detección de un mayor número de niños (cuatro veces el número de niños que se puede detectar y tratar con la estrategia selectiva). Esto es, cerca de 300 niños más podrían acceder a un tratamiento oportuno, con los consiguientes efectos positivos en su desarrollo y calidad de vida, los cuales, como se desprende de los resultados de las encuestas EQ-5D aplicadas a los expertos, son significativos, sobre todo en las dimensiones de desarrollo de actividades habituales y angustia/depresión. Por otra parte, en relación a los costos, las características de la historia natural de la hipoacusia moderada a profunda y la forma como es abordada actualmente por el sistema de salud, determinan que, independiente de la edad del niño, una vez detectada, ésta debería ser confirmada y tratada. Lo anterior implica que los costos de confirmación y tratamiento de los niños detectados no son en realidad costos evitables, sino más bien desplazables hasta el momento del diagnóstico. De esta manera, cuando se aplica una tasa de descuento a los costos estos serán menores en la estrategia selectiva por el hecho de que a un porcentaje de los pacientes se les confirma y trata con posteriori- dad a lo que sucederían en la estrategia universal. Así, los costos incrementales más importantes de la estrategia universal serían los asociados a las dos etapas de screening (alrededor de $2 mil millones) como consecuencia del incremento en la cobertura, más que del costo asociado al tratamiento de los niños con hipoacusia que se detectan precozmente. Entonces, la ganancia en calidad de vida asociada a salud como consecuencia del tratamiento precoz de niños no prematuros, el fenómeno de postergación de los costos de tratamiento a niños no tamizados en la estrategia selectiva y la consideración de los costos de screening en todos los RN al seguir la estrategia universal (versus sólo en los prematuros en la estrategia selectiva), son los principales aspectos estructurales del modelo que determinan los resultados de manera más importante. En este contexto, la prevalencia de hipoacusia sería una de las principales variables que pudiesen afectar los resultados. Sin embargo, el análisis de sensibilidad mostró que con prevalencias inferiores a las descritas en la literatura, la costo-efectividad se mantiene. Es importante considerar algunas limitaciones del estudio que pudiesen repercutir en los resultados. Uno de los principales problemas enfrentados fue la escasez de información epidemiológica a nivel nacional. No se encontraron estudios de prevalencia con representación país. En ese sentido solo se contó con la experiencia publicada de la Clínica Las Condes (Nazar et al, 2009) en población de RN sanos y de la experiencia de screening en el contexto del Régimen GES en el sector público (Torrente et al,2001; Torrente et al, 2007). De la misma manera se desconoce para Chile la distribución por intensidad de hipoacusia, lo cual hizo necesaria la consulta expertos en esta patología. Por otra parte, un aspecto a considerar, es la inexistencia de estudios, a nivel internacional y nacional, respecto de la efectividad de la detección y tratamiento temprano en términos del mejoramiento de la calidad de vida de los niños tratados. La evidencia existente revela importantes efectos sobre todo en el desarrollo del lenguaje, y en algunos estudios también muestran efectos en términos de habilidades emocionales y sociales, sin embargo, el vínculo entre estos resultados intermedios y outcomes finales, como los de calidad de vida, no ha sido explorado en la literatura. El contexto recién descrito fue abordado en este estudio a partir de la aplicación de encuestas de calidad de vida (EQ-5D) a un grupo de profesionales especialistas en el tema, metodología que puede ser considerada débil en términos de las escalas de graduación de la evidencia, pero que al mismo tiempo, por lo menos en relación a la aplicación del EQ-5D puede ser considerada pionera en términos de intentar relacionar la detección y tratamiento temprano con outcomes finales y también de la utilización de las valoraciones de calidad de vida disponibles para nuestro país. Aun así, no se puede desconocer la posibilidad de un sesgo en los resultados como consecuencia de una sobre valoración de la capacidad que tendría la detección precoz en mejorar la calidad de vida de estos niños una vez adultos. Por un lado, podría haber una predisposición, consciente o no, de influir en los resultados, de manera de mejorar las posibilidades de implementar un screening, y por otro, pudiese ser que la visión de los especialistas no necesariamente corresponde a la de los pacientes, quienes al poseer una condición crónica, hayan de alguna manera compensado sus déficit y aumentado su sensación subjetiva de bienestar o calidad de vida. Por último, y también en relación a las limitaciones antes señaladas, el análisis considera las especificidades y sensibilidades del test PEAAT reportadas en la literatura internacional, y por tanto, re- COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 71 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 72 presentan un escenario que podría denominarse “ideal” en relación a que dichos parámetros estarían más cercanos a la eficacia que a la efectividad del test. Esto requiere una reflexión adicional relativa a la importancia de lograr, en la implementación de una estrategia universal, niveles de sensibilidad y especificidad del test cercano a los reportados, con las consecuentes implicancias en términos de las necesidades de equipamiento e infraestructura óptimos y también de recursos humanos capacitados. Ninguna de las EE analizadas en este estudio da cuenta de outcomes finales, sin embargo, los resultados tienden a ser consistentes. Burke et al. (2012) concluyen que lo resultados dependen de la prevalencia, en la medida que esta sea mayor, más costo efectiva será la estrategia universal versus la selectiva. En este estudio, el costo incremental por caso detectado, varió desde US$58.497 para UK a US$ 9.863 para India. Por su parte Kazarian et al. (2001) detectaron costos por caso detectado de US$9.500, también recomendando la ampliación del screening, aunque usando como test de tamizaje las emisiones otoacústicas. Finalmente, para Keren et al (2002), quienes incluyeron outcomes de largo plazo, la estrategia universal domina a la selectiva cuando se analiza desde la perspectiva de la sociedad. Esto se explicaría porque la mejoría en el nivel de lenguaje secundario al diagnóstico y tratamiento precoz, reduciría costos futuros en educación y mejoraría la productividad de la vida adulta. También, concluyen que con una mirada de corto plazo, el costo del programa de screening no se diferenciaría de otros programas de pesquisa en RN, motivo por el cual debiera ser implementable. El costo incremental por caso adicional detectado antes de los 6 meses al pasar de una estrategia de screening selectivo a una universal fue de US$44.000. Sin embargo, dada la heterogenidad en los diseños de estos estudios, las perspectivas y los horizontes de tiempo utilizados, es complejo comparar estos resultados con los de este estudio. Dado que el análisis se realizó desde la perspectiva del sector público de salud, no es posible la generalización de los resultados a todo el país, aun cuando sobre el 70% de la población es beneficiaria del seguro público. Otro factor que podría influir en la generalización de los resultados, tiene que ver con el amplio uso del sector privado por los beneficiarios de FONASA para la atención del embarazo y parto y, por lo tanto, podría existir otro patrón de costos para los test de screening. Con estos antecedentes sería interesante contar con información respecto de la capacidad técnica de ampliar la cobertura del diagnóstico precoz de hipoacusia. Dado que la red de atención del parto normal es más amplia que la que se hace cargo de los prematuros, el sistema debiera ser capaz de aumentar la posibilidad de evaluación sin reducir la sensibilidad y especificidad del test (PEAAT). De la misma manera, es importante que exista posibilidad de confirmación diagnóstica y de tratamiento, sin que signifique lista de espera en cuyo caso el objetivo de la detección precoz no se cumpliría. 10. REFERENCIAS 1. Alvis N, Valenzuela MT. (2010). Los QALYs y DALYs como indicadores sintéticos de salud. Revista Médica de Chile, 138 (suppl.2): 83-87. 2. American Academy of Pediatrics, Task force on Newborn and Infant Hearing. (1999). Newborn and Infant Hearing Loss: detection and intervention. Pediatrics, 103;527. 3. American Academy of Pediatrics, Joint Committee on Infant Hearing. (2007). Year 2007 position statement: Principles and guidelines for early hearing detection and intervention programs. Pediatrics, 120: 898–921. 4. Anderson, D., Sweeny, D., Williams, T. (2008). Estadística para Administración y Economía, 10a Edición Capítulo 7, Págs. 257- 290. 5. Aurélio FS, Tochetto TM. (2010). Newborn Hearing Screening: Experiences of Different Countries. International Archives of Otorhinolaryngology, 14(3):355-363. 6. Burke M, Shenton R, Taylor M. (2012). The economics of screening infants at risk of hearing impairment: An international analysis. International Journal of Pediatric Otorhinolaryngology, 76: 212–218. 7. Cañete O, Torrente M. (2011). Evaluación del program de detección precoz de hipoacusia en recién nacidos prematuros extremos (RNPE), experiencia Hospital Padre Hurtado. Revista de Otorrinolaringología y Cirugía de Cabeza y Cuello, 71: 117-122. 8. Departamento de Estadísticas de Salud, 2009. Estadísticas de Natalidad: nacidos vivos inscritos según duración de la gestación, por grupo de edad de la madre. Chile 2005-2009. Ministerio de Salud de Chile. [Disponible en: http://www.deis.cl/estadisticas-natalidad] 9. EuroQol webpage (2012). What is EQ-5D. [disponible en: http://www.euroqol.org/eq-5d/whatis-eq-5d.html]. 10. Fitzpatrick R (2010). Patient-reported outcome measures and performance measurement. Sección 2.2, P.63-86, en: Performance Measurement for Health System Improvement: Experiences, Challenges and Prospects. Ed. Smith PC, Mossialos E, Leatherman S, Papanicolas I. Cambridge University Press: Cambridge. 11. Fondo Nacional de la Discapacidad - FND. (2005). Primer estudio nacional de la discapacidad en Chile. Pág. 42 a 62. FND. [Disponible en: http://www.ine.cl/canales/chile_estadistico/encuestas_discapacidad/discapacidad.php COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 73 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 74 12. Fortnum H, Davis A, Summerfield Q. (2002). Epidemiology of UK population of hearing impaired children, including characteristics of those with and without cochlear implants- audiology, aetiology, comorbidity and affluence. International Journal of Audiology, 41:170-179. 13. Gerner de García B, Gaffney C, Chacon S, Gaffney M. (2011). Overview of newborn hearing screening activities in Latin America. Revista Panamericana de Salud Pública, 29(3):145-152. 14. Grill E, Hessel F, Siebert U, Schnell-Inderst P, Kunze S, Nickisch A, Wasem J. (2005) Comparing the clinical effectiveness of different new-born hearing screening strategies. A decision analysis. BMC Public Health, 5:12. 15. Instituto Mexicano de Seguridad Social. (2010). Guía de práctica clínica hipoacusia neurosensorial bilateral e implante coclear. IMSS, 2010. 16. Hessel F, Grill E, Schnell-Inderst P, Siebert U, Kunze S, Nickisch A, von Voß H, Wasem J. (2003). Economic evaluation of newborn hearing screening: modelling costs and outcomes. German Medical Science, vol. 1. 17. Institute Health Economics (2007). IHE Report, Screening Newborns for Hearing. [Disponible en: http://www.ihe.ca/documents/IHE_Report_Screening_Newborns_for_Hearing_Feb_2007. pdf] 18. Kennedy C, McCann D, Campbell M, Law C, Mullee M, Petrou S, Watkin P, Worsfold S, Ming Yuen H, Stevenson J. (2006). Language ability after early detection of permanent childhood hearing impairment. New England Journal of Medicine, 354: 2131-2141. 19. Keren R, Helfand M, Homer C, McPhillips H, Lieu T. (2002). Projected Cost-Effectiveness of Statewide Universal Newborn Hearing Screening. Pediatrics, 110: 855-864. 20. Kemper A, Downs S. (2000). Cost-effectiveness Analysis of Newborn Hearing Screening Strategies. Archives of Pediatrics and Adolescent Medicine, 154. 21. Kezirian E, White K, Yueh B, Sullivan S. (2001). Cost and cost-effectiveness of universal screening for hearing loss in newborns. Otolaryngology– Head and Neck Surgery, 124(4): 359-367. 22. Makki-Torkko EM, Lindholm PK, Vayrynen MRH, Leisti JT, Sorri MJ. (1998). Epidemiology of Moderate to Profound Childhood Hearing Impairments in Northern Finland: Any Changes in Ten Years? Scandinavian Audiology, 27:95-103. 23. Mather C, Smith A, Concha M. (2000). Global burden of hearing loss in the year 2000. Global burden of disease 2000. World Health Organization. 24. Mehl A, Thomson V. (1998). Newborn Hearing Screening: the great omission. Pediatrics, 1998 jan 101(1):E4. 25. Ministerio de Desarrollo Social (2009). Encuesta Caracterización Socioeconómica Nacional 2009: discapacidad. Pag 2 y 6. [Disponible en: http://observatorio.ministeriodesarrollosocial. gob.cl/layout/doc/casen/publicaciones/2009/Discapacidad_casen_2009.pdf] 26. Ministerio de Salud de Chile. (2005). Estudio verificación del costo esperado individual promedio por beneficiario del conjunto priorizado de problemas de salud con garantías explícitas. Informe Final. Ejecutado por Bitrán y Asociados Ltda. [Disponible en: http://desal.minsal.cl/DOCUMENTOS/PDF/Documentos/vce%20bitran%20pdf.pdf] 27. Ministerio de Salud de Chile. (2007a). Estudio de carga de enfermedad y carga atribuible. Informe Final. Ejecutado por el Departamento de Salud Pública, Escuela de Medicina, Pontificia Universidad Católica de Chile. [Disponible en: http://epi.minsal.cl/epi/html/invest/cargaenf2008/ Informe%20final%20carga_Enf_2007.pdf 28. Ministerio de Salud de Chile. (2007b). Estudio verificación del costo esperado individual promedio por beneficiario del conjunto priorizado de problemas de salud con garantías explícitas. Informe Final. Ejecutado por la Facultad de Economía y Negocios, Universidad de Chile. [Disponible en: http://desal.minsal.cl/DOCUMENTOS/PDF/Documentos/INFORME%20FINAL_AGOSTO2007.pdf]. 29. Ministerio de Salud de Chile. (2008). Guía Clínica Implante Coclear. Santiago: MINSAL, 2008. 30. Ministerio de Salud de Chile. (2009). Guía Clínica Hipoacusia Neurosensorial Bilateral del Prematuro. Santiago: MINSAL, 2009. [disponible en: http://www.minsal.gob.cl/portal/url/page/ minsalcl/g_gesauge/guias.html] 31. Ministerio de Salud de Chile. (2010a). Estudios de Costo-Efectividad de Intervenciones en Salud. Ministerio de Salud. Informe Final. Ejecutado por Centro de Excelencia CIGES, Universidad de la Frontera. [Disponible en: http://desal.minsal.cl/DOCUMENTOS/PDF/GES/1.2/01CostoEfectividad. pdf]. 32. Ministerio de Salud de Chile. (2010b). Estudio verificación del costo esperado individual promedio por beneficiario del conjunto priorizado de problemas de salud con garantías explícitas. Informe Final. Ejecutado por Bitrán y Asociados Ltda. [Disponible en: http://desal.minsal.cl/DOCUMENTOS/PDF/GES/1.1/01EVC2009.pdf ] 33. Ministerio de Salud de Chile. (2011). Guía Metodológica para la Evaluación Económica de Intervenciones en Salud en Chile. (Documento de Consulta) y Anexos Guía Metodológica de Evaluaciones Económicas en Salud. Chile. [Disponible en: http://desal.minsal.cl/DOCUMENTOS/ PDF/2011/Sistematización.pdf]. 34. Moeller MP. (2000). ‘Early intervention and language development in children who are deaf and hard hearing’. Pediatrics, 106(3): p.e43. COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 75 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 76 35. Nazar G, Goycoolea M, Godoy JM , Ried E, Sierra M. (2009) Evaluación auditiva neonatal universal: Revisión de 10.000 pacientes estudiados. Rev. Otorrinolaringol. Cir. Cabeza Cuello 2009; 69: 93-102 36. Nelson HD, Bougatsos C, Nygren P. (2008). Universal Newborn Hearing Screening: Systematic Review to Update the 2001 U.S. Preventive Services Task Force Recommendation. Evidence Synthesis No. 62. AHRQ Publication No. 08-05117-EF-1. Rockville, Maryland: Agency for Healthcare Research and Quality, July 2008. 37. Patel H, Feldman M. (2011).Universal newborn hearing screening. Paediatrics and Child Health, 16(5): 301-305. 38. Pharoah P, Stevensin R, Cooke R, Sandu B. (1988). ‘Costs and benefits of neonatal intensive care’. Archives of Disease in Childhood, 63:715-718. 39. Ptok M. (2011). Early detection of hearing impairment in newborns and infants. Deutsches Ärzteblatt International, 108(25): 426–31. DOI: 10.3238/arztebl.2011.0426. 40. Russ S, Poulakis Z, Baker M, Wake M, Richards F, Sauders K, Oberklaid F. (2003). Epidemiology of congenital hearing loss in Victoria, Australia. International journal of audiology, 42: 385-390. 41. Shulman S, Besculides M, Slatzman A, Ireys H, White K, Forsman I. (2010). Evaluation of the universal newborn hearing screening and intervention program. Pediatrics, 126; S19. 42. Smith R, Gooi A. (2012). Etiology of hearing impairment in children. UpToDate 2012. 43. Superintendencia de Salud (2008). Valoración social de los Estados de salud EQ-5D en la población de la RM de Chile 2008. disponible online en: http://www.supersalud.cl/documentación/569/articles-5213.html (Último acceso 08 de noviembre 2012). 44. Superintendencia de Servicios de Salud, Ministerio de Salud Argentino (2011). Presentación Programa Nacional de Detección Temprana y Atención de la Hipoacusia (Nota de prensa). [disponible en : http://www.sssalud.gov.ar/index/index.php?cat=institucion&opc=novedadesdetalle &id=98144] 45. Thomson D, McPhillips H, Davis R, Lieu T, Homer J, Helfand M. (2001). ‘Universal Newborn Hearing Screening. Summary of Evidence’. JAMA, 286(16):2000-2010. 46. Torrente, M. Arancibia, M., Poblete, C., Leyton, J., Nuñez, M., Corssen, C., Henriquez, MT., Valdebenito, R. (2001). Evaluación del seguimiento auditivo del recién nacido prematuro extremo en Hospital San Juan de Dios. Revista de Otorrinolaringología y cirugía de cuello y cabeza, 61:3136. 47. Torrente M, Retamal J, Nuñez M. (2007) Seguimiento audiológico del recién nacido de muy bajo peso. Revista de Otorrinolaringología y Cirugía de Cabeza y Cuello, 67: 115-121. 48. Vohr B. (2003). Overview: infants and children with hearing loss-part I. Mental retardation and developmental disabilities research reviews, 9: 62-64. 49. Walsh TL, Hanscom B, Lurie JD, Weinstein JN. (2003). Is a condition-specific instrument for patients with low back pain/leg symptoms really necessary? The responsiveness of the Oswestry Disability Index, MODEMS, and SF-36. Spine, 28: 607-615. 50. Wiebe S, Guyatt G, Matijevic S, Sidwell C. (2003). Comparative responsiveness of generic and specific quality of life instruments. Journal of Clinical Epidemiology, 56: 53-60. 51. Wolff R, Hommerich J, Riemsma R, Antes G, Lange S, Kleijnen J. (2010). Hearing screening in newborns: systematic review of accuracy, effectiveness, and effects of interventions after screening. Arch Dis Child 2010;95:130–135. 52. World Health Organization (2004). The Global Burden of Disease:2004 update. WHO. [accesible en: http://www.who.int/healthinfo/global_burden_disease/2004_report_update/en/index. html] 53. World Health Organization (2010). Newborn and infant hearing screening. Current issues and guiding principles for action. WHO, 2010. 54. Yoshinaga-Itano C, Apuzzo ML. (1998). ‘Identification of hearing loss after age 18 months is not early enough’. Annals of the deaf, 143(5):380-387. 55. Yoshinaga-Itano C, Sedey A, Coulter D, Mehl A. (1998). ‘Language of early and later identified children with hearing loss’. Pediatrics, 102:1161-1171. 56. Yoshinaga-Itano C. (2003). ‘From screening to early identification and intervention: discovering predictors to successful outcomes for children with significant hearing loss’. Journal of Deaf Studies and deaf Education, 8(1):11-30. 57. Zarate V, Kind P, Valenzuela P, Vignau A, Olivares-Tirado P, Muñoz A. (2011). Social Valuation of EQ-5D Health States: The Chilean Case. Value in Health, 14:1135-1141 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 77 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 78 11. ANEXOS Anexo 1. Encuesta Consultas específicas sobre epidemiología en Chile en Hipoacusia Bilateral Anexo 2. Formas encuestas EQ-5D Anexo 3. Árbol de decisión Anexo 4. Parámetros del modelo Anexo 5. Listado de expertos consultados por encuesta epidemiológica Anexo 6. Listado de expertos participantes en encuesta EQ-5D Anexo 1. Encuesta Consultas específicas sobre epidemiología en Chile en Hipoacusia Bilateral COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 79 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 80 Anexo 2. Formas encuestas EQ-5D COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 81 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 82 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 83 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 84 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 85 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 86 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 87 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 88 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 89 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 90 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 91 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 92 Anexo 3. Árbol de decisión Estructura general Rama RN de término (screening selectivo) COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 93 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 94 Rama RN prematuro (screening selectivo) Rama RN con factores de riesgo (screening universal) COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 95 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 96 Rama RN sin factores de riesgo (screening universal) Anexo 4. Parámetros del modelo a) Parámetros primarios Distribución de grupos de grupos de recién nacidos y Prevalencias de hipoacusia. Nombre Descripción Fuente Escenario Base Min Max Distribución p_RN_ prematuro Porcentaje recién nacidos prematuros (<32 semanas y/o <1500 gr) DEIS 2009 (2005-2009) 0,013 0,012 0,014 Triangular p_H_ prem Prevalencia de hipoacusia en recién nacidos prematuros (<32 semanas y/o <1500gr) Minsal, 2009; Torrente, 2007; Cañete y Torrente, 2011. 0,03 0,02 0,04 Triangular Triangular p_H_RN Prevalencia de hipoacusia en recién nacidos (global) Makki-Torkko et al, 1998; 0,002 Fortnum et al. (2002); Nazar et al (2009); Russ et al, 2003; Mather et al, 2000 0,001 0,003 p_FR Porcentaje de recién nacidos con factores de riesgo Thompson, 2001(dice 10-20% para usuarios de neonatología) y Torrente lo mismo pero para los <32 sem y 1.500 g 0,1 0,05 0,2 p_H_FR Prevalencia de hipoacusia en recién nacidos con factores de riesgo Basado en Torrente et al (2001) y Thompson et al (2001), que plantean un riesgo de HL 10 a 20 veces mayor en prematuros (<32 semanas o 1.500 gramos) y usuarios de UCI neonatal, respectivamente. El valor usado corresponde a un aumento del riesgo de 5 veces considerando todos los posibles factores de riesgo. 0,01 0,005 0,015 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 97 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 98 Distribución según severidad de la hipoacusia y probabilidad de requerir implantes. Nombre Descripción Fuente p_moderada Porcentaje de las hipoacusias bilaterales de moderada a profunda que corresponden a moderada p_severa Min Max Distribución Encuesta sobre 0,4478 epidemiología en Chile 0,2499 0,6458 Beta (DE: 0,198) Porcentaje de las hipoacusias bilaterales de moderada a profunda que corresponden a severa Encuesta sobre 0,27075 epidemiología en Chile 0,1664 0,3751 Beta (DE: 0,1044) p_imp_ temp_ mod Porcentaje de RN con hipoacusia bilateral moderada, detectatda y tratada tempranamente que llegaría a implante coclear Encuesta sobre 0,0468 epidemiología en Chile 0 0,1169 Beta (DE: 0,0701) p_imp_ temp_ sev Porcentaje de RN con hipoacusia bilateral severa, detectada y tratada tempranamente que llegaría a implante coclear Encuesta sobre 0,418 epidemiología en Chile 0,2112 0,6248 Beta (DE: 0,2068) p_imp_ temp_ prof Porcentaje de RN con hipoacusia bilateral profunda, detectada y tratada tempranamente que llegaría a implante coclear Encuesta sobre 0,91 epidemiología en Chile 0,7506 1 Beta (DE: 0,1594) p_imp_ tard_ mod Porcentaje de RN con hipoacusia bilateral moderada, detectada y tratada tardíamente que llegaría a implante coclear Encuesta sobre 0,0663 epidemiología en Chile 0 0,1557 Beta (DE: 0,0894) p_imp_ Porcentaje de RN con tard_sev hipoacusia bilateral severa, detectada y tratada tardíamente que llegaría a implante coclear Encuesta sobre 0,5277 epidemiología en Chile 0,2765 0,7789 Beta (DE: 0,2512) p_imp_ tard_ prof Encuesta sobre 0,9188 epidemiología en Chile 0,7915 1 Beta (DE: 0,1273) Porcentaje de RN con hipoacusia bilateral profunda, detectada y tratada tardíamente que llegaría a implante coclear Escenario Base Sensibilidad y Especificidad de los Test Nombre Descripción Fuente Escenario Base Min Max SE_test1 Sensibilidad Test 1 (test 1: PEAAT) Burke et al. (2012); Keren et al. (2002) 0,95 0,9 1 SP_test2 Especificidad Test 2 (test 2: PEAAT) Burke et al. (2012); Keren et al. (2002) 0,9 0,85 1 SE_test2 Sensibilidad Test 2 (test 2: PEAAT) Burke et al. (2012); Keren et al. (2002) 0,95 0,9 1 SP_test1 Especificidad Test 1 (test 1: PEAAT) Burke et al. (2012); Keren et al. (2002) 0,9 0,85 1 SE_confirmación Especificidad confirmación Supuesto 0,95 0,9 1 SP_confirmación Sensibilidad confirmación Supuesto 0,95 0,9 1 Distribución Coeficientes de Calidad de Vida Nombre Descripción Fuente Escenario Base Min Max Distribución v_salud_ temp_ mod Coeficiente de calidad de vida asociado a hipoacusia bilateral moderada detectada tempranamente Cálculo a partir de los parámetros definidos 0,936 0,814 1 Beta (DE: 0,122) v_salud_ temp_ sev Coeficiente de calidad de vida asociado a hipoacusia bilateral profunda detectada tempranamente Cálculo a partir de los parámetros definidos 0,91 0,798 1 Beta (DE: 0,112) v_salud_ temp_ prof Coeficiente de calidad de vida asociado a hipoacusia bilateral severa detectada tempranamente Cálculo a partir de los parámetros definidos 0,905 0,766 1 Beta (DE: 0,139) v_salud_ tard_ mod Coeficiente de calidad de vida asociado a hipoacusia bilateral moderada detectada tardíamente Cálculo a partir de los parámetros definidos 0,516 0,338 0,694 Beta (DE: 0,178) v_saCoeficiente de calidad de lud_ vida asociado a hipoacusia tard_sev bilateral profunda detectada tardíamente Cálculo a partir de los parámetros definidos 0,511 0,298 0,724 Beta (DE: 0,213) v_salud_ tard_ prof Cálculo a partir de los parámetros definidos 0,473 0,247 0,699 Beta (DE: 0,226) Coeficiente de calidad de vida asociado a hipoacusia bilateral severa detectada tardíamente v_saCoeficiente de calidad de Supuesto salud lud_no_ vida asociado a una persona completa hip sin hipoacusia 1 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 99 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 100 Costos y otros parámetros primarios Nombre Descripción Fuente Escenario Base Min Max Distribución c_PEAAT Costo PEAAT Metodología costeo 8.274 6.619 9.929 Triangular c_PEAAT_fa Costo PEAAT más consulta fonoaudiólogo Metodología costeo 14.170 11.336 17.004 Triangular c_confirmación Costo Confirmación Metodología costeo 59.002 47.202 70.802 Triangular c_tto_ aud_t1 Costo tratamiento audífonos, año 1 Metodología costeo 932.704 746.163 1.119.245 Triangular c_tto_ aud_t2 Costo tratamiento audífonos, año 2 Metodología costeo 406.556 325.245 487.867 Triangular c_tto_ aud_ t3y4 Costo tratamiento audífonos, años 3 y 4 Metodología costeo 863.104 690.483 1.035.725 Triangular c_tto_ aud_ t5_6y7 Costo tratamiento audífonos, años 5 y 6 Metodología costeo 366.788 293.430 440.146 Triangular c_seg_ aud_t8 Costo seguimiento audí- Metodología fonos desde año 8 costeo 101.802 81.442 122.162 Triangular c_ev_ imp Costo evaluación implante Metodología costeo 173.309 138.647 207.971 Triangular c_tto_ imp_t1 Costo tratamiento implante, año 1 Metodología costeo 19.953.986 15.963.189 23.944.783 Triangular c_sgto_ Costo seguimiento imimp_t1 plante, año 1 Metodología costeo 557.978 446.382 669.574 Triangular c_sgto_ Costo seguimiento imimp_t2 plante, año 2 Metodología costeo 776.670 621.336 932.004 Triangular c_sgto_ Costo seguimiento imimp_t3 plante, año 3 Metodología costeo 719.234 575.387 863.081 Triangular c_sgto_ Costo seguimiento imimp_t4 plante, año 4 Metodología costeo 355.738 284.590 426.886 Triangular c_sgto_ Costo seguimiento imimp_ plante, año 5, 6 y 7 t5_y7 Metodología costeo 355.738 284.590 426.886 Triangular c_sgto_ Costo seguimiento imimp_t8 plante, desde año 8 Metodología costeo 5.896 4.717 7.075 Triangular TD Tasa de descuento Guía Metodológica 0,03 0 0,006 TD_ outcomes Tasa de descuento outcomes Guía Metodológica 0,03 0 0,006 exp_ vida Expectativa de vida al nacer INE 78,7 b) Parámetros secundarios (calculados a partir de los parámetros primarios/ escenario base) Valor presente costos tratamiento Nombre Descripción Fuente Escenario Base c_total_aud Valor presente de los costos asociados al tratamiento completo de audífonos Cálculo a partir de los parámetros definidos (c_tto_aud_t1; c_tto_aud_t2; c_tto_ aud_t3y4; c_tto_aud_t5_6y7; c_seg_ aud_t8; TD; exp_vida) 6.308.049,50 c_total_imp Valor presente de los costos asociados al tratamiento completo de implante Cálculo a partir de los parámetros definidos (c_tto_imp_t1; c_sgto_imp_t1; c_sgto_ imp_t2; c_sgto_imp_t3; c_sgto_imp_t4; c_sgto_imp_t5_y7; c_sgto_imp_t8; TD; exp_vida) 23.330.972,96 Prevalencias Nombre Descripción Fuente Escenario Base p_H_ termino Prevalencia de hipoacusia en recién nacidos no prematuros (> 32 semanas y 1.500 gr) Calculado en base a la prevalencia global y la prevalencia en prematuros. 0,00160 p_H_ SFR Prevalencia de hipoacusia en recién nacidos sin factores de riesgo Apoya Nazar, 2009. Pero se calcula en base a la prevalencia global, la prevalencia de hipoacusia en niños de alto riesgo y la proporción de niños con factores de riesgo 0,0011 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 101 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 102 Probabilidad test (+) Nombre Descripción Fuente Escenario Base p_pos_test1_u_ Probabilidad de que el Test 1 de poFR sitivo en niños con factores de riesgo, con screening universal Cálculo a partir de los parámetros definidos (p_H_FR; SE_test1; SP_test1) 0,1085 p_pos_test1_u_ Probabilidad de que el Test 1 de poSFR sitivo en niños sin factores de riesgo, con screening universal Cálculo a partir de los parámetros definidos (p_H_SFR; SP_test1; SE_test1) 0,10094 p_pos_test2_u_ Probabilidad de que el Test 2 de poFR sitivo en niños con factores de riesgo, con screening universal Cálculo a partir de los parámetros definidos (VPP_test1_u_ FR; SE_test2; SP_test2) 0,174423 p_pos_test2_u_ Probabilidad de que el Test 2 de poSFR sitivo en niños sin factores de riesgo, con screening universal Cálculo a partir de los parámetros definidos (VPP_test1_u_ SFR; SE_test2; SP_test2) 0,10888 p_pos_ Probabilidad de que la confirmación confirmacion_u_ sea positiva en niños con factores de FR riesgo, con screening universal Cálculo a partir de los parámetros definidos(VPP_test2_u_ FR; SE_confirmación; SP_confirmacion) 0,47688 p_pos_ Probabilidad de que la confirmación confirmacion_u_ sea positiva en niños sin factores de SFR riesgo, con screening universal Cálculo a partir de los paráme- 0,05852 tros definidos (VPP_test2_u_ SFR; SE_confirmación; SP_confirmacion) p_pos_test1_s Probabilidad de que el Test 1 de positivo en niños prematuros, con screening selectivo Cálculo a partir de los parámetros definidos (p_H_prem; SE_test1; SP_test1) 0,125499 p_pos_test2_s Probabilidad de que el Test 2 de positivo en niños prematuros, con screening selectivo Cálculo a partir de los parámetros definidos (VPP_test1_s; SE_test2; SP_test2) 0,293027 p_pos_ confirmacion_s Probabilidad de que la confirmación sea positiva en niños prematuros, con screening selectivo Cálculo a partir de los parámetros definidos (VPP_test2_s; SE_confirmación; SP_confirmacion) 0,736233 Valores predictivos negativos Nombre Descripción Fuente Escenario Base VPN_test1_u_FR Valor predictivo negativo del test 1 en niños con factores de riesgo, con screening universal Cálculo a partir de los parámetros definidos (p_H_FR; SP_test1; SE_test1) 0,9994 VPN_test1_u_ SFR Valor predictivo negativo del test 1 en niños sin factores de riesgo, con screening universal Cálculo a partir de los parámetros definidos (p_H_SFR; SP_test1; SE_test1) 0,9999 VPN_test2_u_FR Valor predictivo negativo del test 2 en niños con factores de riesgo, con screening universal Cálculo a partir de los parámetros definidos (VPP_test1_u_FR; SE_test2; SP_test2) 0,9947 VPN_test2_u_ SFR Valor predictivo negativo del test 2 en niños sin factores de riesgo, con screening universal Cálculo a partir de los parámetros definidos (VPP_test1_u_SFR; SE_test2; SP_test2) 0,99941 VPN_ Valor predictivo negativo de confirmacion_u_ la confirmación en niños con FR factores de riesgo, con screening universal Cálculo a partir de los parámetros definidos(VPP_test2_u_FR; SE_ confirmacion; SP_confirmación) 1 VPN_ Valor predictivo negativo de la confirmacion_u_ confirmación en niños sin factores SFR de riesgo, con screening universal Cálculo a partir de los parámetros 0,9994 definidos (VPP_test2_u_SFR; SE_ confirmacion; SP_confirmación) VPN_test1_s Valor predictivo negativo del test 1 en niños prematuros, con screening selectivo Cálculo a partir de los parámetros definidos (p_H_prem; SE_test1; SP_test1) VPN_test2_s Valor predictivo negativo del test 2 en niños prematuros, con screening selectivo Cálculo a partir de los parámetros 0,984 definidos (VPP_test1_s; SE_test2; SP_test2) VPN_ confirmacion_s Valor predictivo negativo de la Cálculo a partir de los parámetros confirmación en niños prematuros, definidos (VPP_test2_s; SE_concon screening selectivo firmacion; SP_confirmación) 0,9982 1 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 103 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 104 Valores predictivos positivos Nombre Descripción Fuente Escenario Base VPP_test1_u_FR Valor predictivo positivo del test Cálculo a partir de los paráme1 en niños con factores de ries- tros definidos (p_H_FR; SP_test1; go, con screening universal SE_test1) 0,0876 VPP_test1_u_ SFR 0,010457 Valor predictivo positivo del test Cálculo a partir de los parámetros 1 en niños sin factores de riesgo, definidos (p_H_SFR; SP_test1; con screening universal SE_test1) VPP_test2_u_FR Valor predictivo positivo del test Cálculo a partir de los parámetros 2 en niños con factores de ries- definidos (VPP_test1_u_FR; SE_ go, con screening universal test2; SP_test2) 0,47688 VPP_test2_u_ SFR 0,0094708 Valor predictivo positivo del test Cálculo a partir de los parámetros 2 en niños sin factores de riesgo, definidos (VPP_test1_u_SFR; SE_ con screening universal test2; SP_test2) VPP_ Valor predictivo positivo de Cálculo a partir de los parámetros confirmacion_u_ la confirmación en niños con definidos(VPP_test2_u_FR; SE_ FR factores de riesgo, con screening confirmación; SP_confirmación) universal 0,945416 VPP_ Valor predictivo positivo de Cálculo a partir de los parámetros confirmacion_u_ la confirmación en niños sin definidos (VPP_test2_u_SFR; SE_ SFR factores de riesgo, con screening confirmación; SP_confirmación) universal 0,153737 VPP_test1_s Valor predictivo positivo del test 1 en niños prematuros, con screening selectivo Cálculo a partir de los parámetros definidos (p_H_prem; SE_test1; SP_test1) 0,22709 VPP_test2_s Valor predictivo positivo del test 2 en niños prematuros, con screening selectivo Cálculo a partir de los parámetros definidos (VPP_test1_s; SE_test2; SP_test2) 0,736233 VPP_ confirmacion_s Valor predictivo positivo de la confirmación en niños prematuros, con screening selectivo Cálculo a partir de los parámetros definidos (VPP_test2_s; SE_confirmación; SP_confirmación) 0,93328 QALY Nombre Descripción Fuente u_salud_temp_ mod Valor presente para la expectativa Cálculo a partir de los parámetros de vida al nacer asociado al coefi- definidos (v_salud_temp_mod; ciente de calidad de vida asociado TD; exp_vida) a hipoacusia bilateral moderada detectada tempranamente 28,153052 u_salud_temp_ sev Valor presente para la expectativa de vida al nacer asociado al coeficiente de calidad de vida asociado a hipoacusia bilateral severa detectada tempranamente Cálculo a partir de los parámetros definidos (v_salud_temp_sev; TD; exp_vida) 27,371023 u_salud_temp_ prof Valor presente para la expectativa Cálculo a partir de los parámetros de vida al nacer asociado al coefi- definidos (v_salud_temp_prof; ciente de calidad de vida asociado TD; exp_vida) a hipoacusia bilateral profunda detectada tempranamente 27,220632 u_salud_no_hip Valor presente para la expectativa de vida al nacer asociado al coeficiente de calidad de vida de una persona con salud completa Cálculo a partir de los parámetros definidos (v_salud_no_hip; TD; exp_vida) 30,078047 u_salud_tard_ mod Valor presente para la expectativa Cálculo a partir de los parámetros de vida al nacer asociado al coefi- definidos (v_salud_tard_mod; ciente de calidad de vida asociado TD; exp_vida) a hipoacusia bilateral moderada detectada tardíamente 15,520272 u_salud_tard_ sev Valor presente para la expectativa de vida al nacer asociado al coeficiente de calidad de vida asociado a hipoacusia bilateral severa detectada tardíamente 15,369882 u_salud_tard_ prof Valor presente para la expectativa Cálculo a partir de los parámetros 14,226916 de vida al nacer asociado al coefi- definidos (v_salud_tard_prof; TD; ciente de calidad de vida asociado exp_vida) a hipoacusia bilateral profunda detectada tardíamente Cálculo a partir de los parámetros definidos (v_salud_tard_sev; TD; exp_vida) Escenario Base COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 105 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 106 106 Anexo 5. Listado de expertos consultados en Encuesta Epidemiológica Primer Grupo Nombre Profesión 1 Nicolas Albertz M édico .Tesista M agister S . Pública . Costos en la implementación Programa Pesquisa Universal de Hipoacusia 2 M artha Arrocet Directora M agíster Fonoaudióloga 3 Gonzalo Bonilla S. . U. Andrés Bello . Otorrinolaringólogo . Presidente Sociedad Chilena Otorrinolaringología M ed y Cirugía Cabeza y Cuello. 4 Sofía Bravo Del Pilar Fonoaudiólogo . Universidad Andrés Bello 5 Loretho Bustamante Fonoaudiólogo . Centro Rehabilitación Auditiva Hospital Sotero del Río 6 José Luis Calderón Tecnólogo M édico . Clínica Tabancura 7 Rodrigo Cárdenas Fonoaudiólogo . Hospital Barros Luco Trudeau 8 Claudia Delucchi 9 Luis Dentone . . Educadora Diferencial en Trastornos de Audición . Universidad M etropolitana de Ciencias de la Educación . Otorrinolaringólogo 10 Nora Gardelcic Fonoaudiólogo . Centro Audiológico y de Trastornos de la Comunicación Audilen 11 Carolina Giesen Fonoaudiólogo .Centro Rehabilitación Auditiva Hospital Sotero del Río 12 Cristián Godoy Barrera Fonoaudiólogo . Hospital Sótero del Río 13 M arcos Goycolea Otorrinolaringólogo . Jefe Servicio Otorrino Clínica Las Condes 14 Beatriz M uñoz Jaramillo Fonoaudiólogo . Responsable rescreening universal 15 Enrica Pittaluga P. Pediatra Neonatóloga . Coordinadora Programa Sordera 16 M aritza Rahal Espejo Jefe Servicio Otorrinolaringología 17 Leopoldo Razeto Otorrinolaringólogo . M edico Jefe Hospital San Juan de Dios 18 Cecilia Reyes Enfermera . Coordinadora Guías Clínicas M INSAL 19 M arcelo Rios Otorrinolaringólogo . Hospital G Grantt B 20 Eduardo Saez Otorrinolaringólogo . Jefe de Servicio Hospital Carlos Van Buren 21 Sergio Sanhueza Otorrinolaringólogo . CENTROM ED . 22 Hernán Soto Fonoaudiólogo . Jefe Departamento de Discapacidad y Rehabilitación 23 M ariela Torrente Otorrinolaringólogo . Hospital Padre Hurtado 24 Javiera Vivanco Fonoaudiólogo . M INSAL . . . Hospital Sótero del Río . . Hospital Barros Luco Trudeau . . . . Concepción . . . . M INSAL -DIPRECE . Segundo Grupo Nom bre Profesión 1 Isabel Carranza Otorrinolaringólogo , encargada screening universal hipoacusia recién nacido 2 Margarita Arancibia Otorrinolaringólogo . Hospital San Juan de Dios 3 Jorge Caro Otorrinolaringólogo . Hospital Clínico U . Católica . 4 Michel Royer Otorrinolaringólogo . Hospital Dr . Luis Calvo Mackenna . Hospital Padre Hurtado . . Clínica Dávila . COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 107 COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 108 108 Anexo 6. Listado de Expertos participantes en Encuesta EQ-5D Primer Grupo Nombre Profesión 1 Martha Arrocet Directora MagísterFonoaudióloga . U. Andrés Bello . 2 Gonzalo Bonilla S. Otorrinolaringólogo . Presidente Sociedad Chilena Otorrinolaringología Med y Cirugía Cabeza y Cuello . 3 Sofía Bravo DelPilar Fonoaudiólogo . Universidad Andrés Bello 4 Loretho Bustamante Fonoaudiólogo . Centro Rehabilitación Auditiva HospitalSotero delRío 5 José Luis Calderón Tecnólogo Médico . Clínica Tabancura 6 Andrea Cárdenas Educadora Diferencialcon especialidad en Trastornos de Audición y Lenguaje Directora COMUNICA : Centro de Audición , Lenguaje y Aprendizaje 7 Rodrigo Cárdenas Fonoaudiólogo . HospitalBarros Luco Trudeau . . . Educadora DiferencialEspecialista en Audición y Lenguaje . Directora INSERTA (Centro de Atención Integral ), Santiago Educadora Diferencialen Trastornos de Audición . Universidad Metropolitana de Ciencias de la Educación . 8 Claudia Cornejo 9 Claudia Delucchi 10 Luis Dentone Otorrinolaringólogo 11 Carolina DerMusa Otorrinolaringólogo 12 Nora Gardilcic Fonoaudiólogo . Centro Audiológico y de Trastornos de la Comunicación Audilen 13 Carolina Giesen Fonoaudiólogo .Centro Rehabilitación Auditiva HospitalSotero delRío 14 Cristián Godoy Barrera Fonoaudiólogo . HospitalSótero delRío 15 Marcos Goycolea Otorrinolaringólogo . HospitalCalvo Mackenna . . Jefe Servicio Otorrino Clínica Las Condes . 17 Cecilia Mellado Educadora Diferencialcon especialidad en Trastornos de Audición y Lenguaje Centro de Terapia IntegralAMJU, Temuco Genetista . Responsable estudio genético en programa de Detección Precoz de hipoacusia . H Sotero delRio . H Universidad Católica . 18 Beatriz Muñoz Jaramillo Fonoaudiólogo . Responsable rescreeninguniversal 19 Enrica Pittaluga P. Pediatra Neonatóloga 20 Maritza RahalEspejo Jefe Servicio Otorrinolaringología 21 Leopoldo Razeto Otorrinolaringólogo 22 Cecilia Reyes Enfermera . Coordinadora Guías Clínicas MINSAL 23 Marcelo Rios Otorrinolaringólogo . HospitalG Grantt B 24 Eduardo Saez Otorrinolaringólogo . Jefe de Servicio HospitalCarlos Van Buren 25 Sergio Sanhueza Otorrinolaringólogo . CENTROMED . 26 Hernán Soto Fonoaudiólogo . Jefe Departamento de Discapacidad y Rehabilitación DIPRECE. 27 Mariela Torrente Otorrinolaringólogo 28 Javiera Vivanco Fonoaudiólogo . MINSAL . 16 Mariza Henríquez J . . HospitalSótero delRío . . . Coordinadora Programa Sordera . HospitalBarros Luco Trudeau . Medico Jefe HospitalSan Juan de Dios . . . . Concepción . . HospitalPadre Hurtado . . . MINSAL - Segundo Grupo Nombre Profesión 1 Margarita Arancibia Otorrinolaringólogo 2 Mario Cam pos Fonoaudiólogo . U. San Sebastián -Antofagasta . 3 Jorge Caro Otorrinolaringólogo . Hospital Clínico U Otorrinolaringólogo , encargada screening universal hipoacusia recién nacido 4 Isabel Carranza . Hospital San Juan de Dios . Hospital Padre Hurtado . . Católica . Clínica Dávila . 5 Elena Cuitiño Fonoaudiólogo . 6 Marcelo Friant Fonoaudiólogo . Universidad Austral de Puerto Montt 7 Elizabeth Guajardo Fonoaudiólogo . 8 Xim ena Horm azábal Fonoaudiólogo . Medicina -U. de Chile 9 Montserrat Jara Fonoaudiólogo . 10 Francisca Mansilla Fonoaudiólogo . Hospital Barros Luco Trudeau 11 Xim ena Pérez Fonoaudiólogo . 12 Myriam Pinto Fonoaudiólogo . Universidad de La Frontera 13 Michel Royer Otorrinolaringólogo . . Hospital Dr . Luis Calvo Mackenna . COSTO-EFECTIVIDAD DEL SCREENING Y TRATAMIENTO DE HIPOACUSIA BILATERAL EN RECIÉN NACIDOS 109