IED SAN JOSÉ DE CASTILLA. “
Anuncio

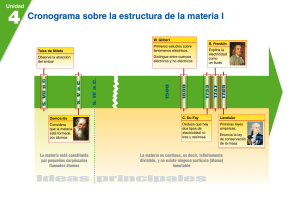
IED SAN JOSÉ DE CASTILLA. “UN CAMINO PARA LA CONVIVENCIA Y LA COMUNICACIÓN EN RED CON EL MUNDO” AREA CIENCIAS NATURALES Y EDUCACION AMBIENTAL J. M Docente Stella Vásquez Ávila ESTRUCTURA DEL ATOMO; SU DESARROLLO HISTORICO. Primera parte El hombre siempre ha buscado entender y construir explicaciones sobre los fenómenos que ocurren a su alrededor, cuando estos son muy complejos o abstractos lo ha hecho a través de modelos en los cuales se idealiza y se simplifica la explicación. A continuación se presentan los principales acontecimientos que han acompañado el desarrollo de este concepto. Modelo atómico de John Dalton, 1808. Basado en tres leyes empíricas de las composiciones químicas; la ley de la conservación de la materia, la ley de las proporciones definidas y la ley de las proporciones múltiples, elaboro un modelo atómico donde consideraba a los átomos como diminutas esferas rígidas e indestructibles, cuya propiedad más importante era su masa. Caracteristicas del modelo; Introduce la idea de la discontinuidad de la materia, es decir, es la primera teoria científica que considera que la materia esta dividida en átomos (dejando aparte a precursores de la antigüedad como Demócrito y Leucipo, cuyas afirmaciones no se apoyaban en ningún experimento riguroso, pero fueron los primeros en utilizar este término). Los postulados basicos de esta teoría atomica son: 1. 2. 3. 4. La materia está dividida en unas particulas indivisibles e inalterables, que se denominan átomos. Todos los atomos de un mismo elemento son identicos entre sí, es decir, presentan igual masa e igual propiedades. Los atomos de distintos elementos tienen distinta masa y distintas propiedades. Los compuestos se forman cuando los atomos se unen entre si, en una relación constante y sencilla. Los fisicos y quimicos emplearon el modelo hasta que se demostro experimentalmente que la materia al ser de naturaleza electrica, esta conformada por particulas sub atomicas de carga positiva, negativa, o neutra . Situación no contemplada en el modelo. Las insuficiencias del modelo son: a. b. Se sabe que los atomos si pueden dividirse y alterarse Las experiencias realizadas por thomson Los físicos y químicos emplearon el modelo atómico de Dalton hasta que se demostró experimentalmente que la materia al ser de naturaleza eléctrica, está formada por partículas subatómicas de carga positiva, negativa o neutra, situación no contemplada en dicho modelo. Uno de los acontecimientos que revelaron la naturaleza eléctrica de la materia fue la construcción de la batería por Alejandro Volta 1800, pero fue solo con los trabajos de Faraday, Crookes, Thomson y Millikan que se llegó a determinar la presencia de los electrones y sus características. Michael Faraday 1830, estudio la naturaleza eléctrica de la materia e identifico las relaciones entre la electricidad y las reacciones químicas. Son frutos de sus estudios todos los procesos actuales sobre recubrimiento de metales por procesos electrolíticos. William Crookes, 1896 construyo tubos de vidrio herméticos y con bajas presiones en el interior, provistos de electrodos entre los IED SAN JOSÉ DE CASTILLA. “UN CAMINO PARA LA CONVIVENCIA Y LA COMUNICACIÓN EN RED CON EL MUNDO” AREA CIENCIAS NATURALES Y EDUCACION AMBIENTAL J. M Docente Stella Vásquez Ávila cuales conecto una fuente de corriente y observo el flujo de rayos que salían de cátodo y se dirigían hacia el ánodo, y los llamo rayos catódicos. A este haz de rayos catódicos posteriormente se les denominaron electrones. Mediante el estudio de los rayos catódicos se demostró que los electrones tienen carga eléctrica y se desplazan en línea recta. Joseph J. Thomson, 1897 estableció la relación carga/masa del electrón y propuso un modelo atómico en el cual la carga positiva era de gran masa y las cargas negativas de muy baja masa; estaban distribuidas como están las uvas pasas en un pastel. Este modelo se caracterizó por explicar la naturaleza eléctrica del átomo y con ellas las relaciones materia y electricidad. En 1909 Milllikan empezo un serie de experimentos que no solo demostraton que las cargas se presentan en multiplos de una unidada elemental e, sino que tambien midio el valos de e con un error del 1%. Para eliminar la evaporcion utilizo gotas de aceite dispersas en aire seco entre las placas de un condensador. Conectando el campo entre las placas, una gota podía hacerse mover hacia arriba o hacia abajo y observar durante varias horas. Admitiendo que la velocidad terminal de la gota era proporcional a la fuerza electrica que actua sobre ella, este experimento dio una evidencia de que la carga siempre se presenta en multiplos de una unidad fundamental e. Las insuficiencias del modelo son: a. b. El atomo no es macizoni compacto como suponía Thomson, es practicamente hueco. El nucleo es muy pequeño comparado con el tamaño del atomo, según demostraría posteriormente Rutherford. Actividad: 1. Observa el siguiente video https://www.youtube.com/watch?v=gvlcnNbxRdo y 2. Realiza una línea del tiempo con lo estudiado hasta el momento. Bibliografía: http://es.wikipedia.org/wiki/Modelo_at%C3%B3mico_de_Dalton http://es.wikipedia.org/wiki/Modelo_at%C3%B3mico_de_Thomson Ciencias interactivas Nivel 3 Mg Graw Hill 2000.