Imidapril, zofenopril EVALUACIÓN una.cdr
Anuncio

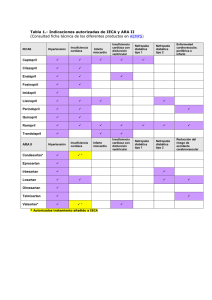
EVALUACIÓN DE NUEVOS MEDICAMENTOS febrero de 2005 ENM 03/05 Imidapril / Zofenopril (Hipertene / Zofenil , Zopranol ) ® ® Código ATC: C09AA16 / C09AA15 ® DDD: sin definir / 30 mg OTROS MEDICAMENTOS DE UN GRUPO FARMACOLÓGICO YA EXISTENTE Aportación Terapéutica: NULA Imidapril y zofenopril, duodécimo y decimotercer IECA comercializados en nuestro país, no ofrecen ventajas clínicamente significativas de eficacia y seguridad respecto a fármacos del mismo o distinto grupo terapéutico, y la evidencia clínica es inferior a la de otros fármacos mejor evaluados en las mismas indicaciones Imidapril y zofenopril son inhibidores de la enzima convertidora de angiotensina (IECA) estructuralmente relacionados con enalapril y captopril, respectivamente. Han sido autorizados por el procedimiento europeo de Reconocimiento Mutuo, siendo Reino Unido, en ambos casos, el país de referencia.1 INDICACIONES Ambos fármacos están indicados en el tratamiento de la hipertensión arterial esencial (HTA).2,3 Zofenopril, además, está indicado para el tratamiento, iniciado dentro de las primeras 24 horas, del infarto agudo de miocardio (IAM) con o sin signos y síntomas de insuficiencia cardíaca (IC), en pacientes hemodinámicamente estables, que no hayan recibido terapia con trombolíticos.3 FARMACOCINÉTICA Tras la administración oral, imidapril y zofenopril se absorben con rapidez en el tubo digestivo. Las comidas ricas en grasa disminuyen significativamente la absorción de imidapril.2 Se trata de dos profármacos que al ser hidrolizados se transforman en imidaprilato y zofenoprilato, metabolitos activos que alcanzan sus concentraciones plasmáticas 2,3 máximas en un plazo de 7 y 1,5 horas, respectivamente. 2,3 Se excretan en orina y heces. La semivida de eliminación es de 1,1-2,5 horas para imidapril y de 5 horas para zofenopril.4,5 POSOLOGÍA La dosis de ambos fármacos debe ajustarse según la respuesta terapéutica del paciente. ◆ Imidapril: el tratamiento debe iniciarse con 5 mg una vez al día. Si no se consigue un control óptimo de la presión arterial después de al menos tres semanas de tratamiento, la dosis diaria debe aumentarse a 10 mg, que es la dosis diaria más eficaz. Puede ser necesario incrementar la dosis diaria a 20 mg (dosis máxima recomendada). Se recomienda tomar los 2 comprimidos 15 minutos antes de una comida. ◆ Zofenopril: el tratamiento de la HTA debe iniciarse con una dosis de 15 mg, la dosis efectiva usual es de 30 mg una vez al día y la dosis máxima de 60 mg. En el tratamiento del IAM la posología debe ser la siguiente: los dos primeros días 7,5 mg/12 horas, los dos siguientes 15 mg/12 horas y a partir del 5º día 30 mg/12 horas; los pacientes deben ser evaluados a las 6 semanas de tratamiento, y el tratamiento debe suspenderse si no hay signos de disfunción ventricular izquierda o IC.3 En pacientes de edad avanzada (65 años o más) la dosis inicial de imidapril debe ser de 2,5 mg una vez al día, siendo la dosis máxima recomendada de 10 mg al día.2 En insuficiencia renal, al igual que otros IECAS, tanto imidapril como zofenopril deben utilizarse con precaución. ◆ Imidapril: se necesitan dosis menores en pacientes con aclaramiento de creatinina de 30-80 mL/min, por lo cual se recomienda iniciar el tratamiento con 2,5 mg. No debe administrarse en pacientes con aclaramiento de creatinina 2 inferior a 30 mL/min. ◆ Zofenopril: en pacientes con aclaramiento de creatinina inferior a 45 mL/min, se deberá administrar la mitad de la 3 dosis terapéutica. En insuficiencia hepática el imidapril debe usarse con precaución y se recomienda iniciar el tratamiento con 2,5 mg una vez al día.2 En insuficiencia hepática grave, zofenopril está contraindicado, y en pacientes con cirrosis, la dosis inicial debe ser la mitad de la dosis recomendada para pacientes con función hepática normal.3 EFICACIA CLÍNICA La eficacia y seguridad clínica de estos dos fármacos ha sido evaluada en diversos ensayos clínicos controlados con placebo y con comparadores activos, del mismo y de distinto grupo terapéutico. Los estudios en HTA emplean como criterios principales de eficacia variables intermedias, como reducción de la presión arterial sistólica y diastólica o porcentaje de pacientes con valores de presión por debajo de los objetivos establecidos, pero en ningún caso se evalúan criterios clínicos de morbimortalidad. IMIDAPRIL Los estudios de búsqueda de dosis que empleaban de 2,5 a 40 mg de imidapril, indican que la dosis diaria óptima es de 10 mg y que dosis más altas no proporcionan mayor eficacia.6 Diversos estudios no muestran diferencias entre el efecto hipotensor de imidapril y el de otros hipotensores con los que se ha comparado. No se ha publicado ningún ensayo clínico comparativo con antagonistas de los receptores de angiotensina II. Un estudio multicéntrico comparó imidapril 5-20 mg/día con hidroclorotiazida 12,5-50 mg/día en 349 pacientes ancianos; tras 24 semanas, los resultados mostraron una reducción de la presión arterial diastólica igual con ambos fármacos (-15,3 mm 7 Hg). En un ensayo clínico de 12 semanas de duración que incluyó 320 pacientes, tampoco hubo diferencias significativas entre imidapril 5-10 mg/día y nifedipino de liberación retardada 2040 mg/12h en los porcentajes de pacientes que responden al 8 tratamiento (63,1% vs 61,3%). Sin embargo, la ausencia de cálculo a priori del número de pacientes a incluir en estos dos ensayos, no permite concluir la 9 equivalencia de los tratamientos comparados. Un estudio de escaso tamaño (57 pacientes) que comparó el tratamiento durante 12 semanas entre imidapril 5-10 mg/24h y captopril 25-50 mg/12h, no halló diferencias significativas en la disminución de la presión arterial diastólica (9,9 mm Hg vs 10 8,8 mm Hg). En un estudio con 231 pacientes y de 12 semanas de duración en el que se comparó imidapril 5-10 mg/día con enalapril 5-10 mg/día, no se encontraron diferencias significativas en el porcentaje de pacientes con efecto antihipertensivo adecuado (71,3% vs 66,1%)11; sin embargo, la validez del estudio podría verse limitada por la medida de resultado utilizada, que califica el efecto antihipertensivo en diversos grados según criterios 9 no validados. En otro estudio comparativo con enalapril a las mismas dosis y con igual duración que el anterior, realizado sobre 352 pacientes, tampoco se encontraron diferencias significativas en la tasa de respuesta (74,9% vs 74,0%), 12 definida como PAD 90 mm Hg o reducción PAD 10 mm Hg. No obstante, la dosis de enalapril utilizada en estos estudios es inferior a la habitualmente empleada como dosis de mantenimiento (20 mg/día). Por tanto, en términos de eficacia, únicamente se ha demostrado equivalencia entre imidapril y enalapril a dosis bajas, y sólo en el efecto sobre cifras tensionales. ZOFENOPRIL En hipertensión arterial En un estudio de búsqueda de dosis con 211 pacientes se observa que, en el rango de 7,5 a 60 mg/día, el efecto antihipertensivo de zofenopril es dosis-dependiente y la diferencia con placebo alcanza significación estadística a 13 partir de la dosis de 15 mg. Sólo se ha publicado de forma completa un ensayo clínico comparativo doble ciego de 12 semanas de duración realizado en 38 pacientes con hipertensión arterial leve a moderada; zofenopril 30-60 mg e hidroclorotiazida 25-50 mg reducen de forma similar las presiones arteriales, con mínimo efecto adicional al incrementar la dosis.14 Una revisión no sistemática indica que diversos estudios comparativos que evalúan el efecto sobre la presión arterial no evidenciaron ninguna ventaja de zofenopril sobre otros antihipertensivos con los que se comparó: enalapril, atenolol y amlodipino.15 En la actualidad no se dispone de datos sobre los efectos de zofenopril en la morbilidad y mortalidad de pacientes hipertensos. ◆ En IAM En un estudio abierto que incluye 204 pacientes con IAM sin terapia trombolítica se comparó el protocolo estándar (atenolol IV 5-10 mg antes de la randomización y aspirina 300 mg diarios) frente al mismo tratamiento con adición de zofenopril 15-30 mg/día en dos dosis, durante 12 meses. No se encontraron diferencias con significación estadística entre los dos grupos de tratamiento en la mortalidad al año (7,8% vs 10,7%).16 Posteriormente se realizaron dos estudios multicéntricos, doble-ciego, uno controlado con placebo (SMILE) y otro comparativo con lisinopril (SMILE-2). En el SMILE se comparó zofenopril 7,5-30 mg dos veces al día frente a placebo en 1556 pacientes con IAM de localización anterior que no fueron sometidos a trombolisis. Al final del tratamiento (6 semanas), la incidencia de la variable combinada de muerte o IC severa se reduce significativamente con zofenopril (7,1% vs 10,6%, p=0,018); consideradas independientemente, sólo la incidencia de IC severa es significativamente menor con zofenopril (2,2% vs 4,1%, p=0,018), no así la mortalidad (6,5% vs 8,3%, p=0,17). Al cabo de un año, la reducción de la mortalidad global es estadísticamente significativa a favor de zofenopril (10,0% vs 14,1%, p=0,011).17 Conviene destacar que este ensayo sólo incluye pacientes con IAM de localización anterior, que generalmente se asocia con un mayor grado de disfunción ventricular y por tanto, mayor sensibilidad a la inhibición de la ECA, lo que puede realzar el impacto terapéutico, y no sometidos a trombolisis, y por ello, con menor riesgo de desarrollar hipotensión severa en respuesta a la inhibición de la ECA.15 Posteriormente, se publicaron diversos subanálisis de los datos del SMILE: ◆ en pacientes sin historia previa y sin signos clínicos de IC al ingreso (n=1146), la prevalencia global de IC, evaluada a las 6 semanas y un año después, fue similar en ambos grupos y la reducción sólo fue significativa para IC severa (1,6% vs 18 2,6% a las 6 semanas y 11,0% vs 24,3% al año). ◆ la reducción del riesgo del desenlace combinado de muerte e IC severa a las 6 semanas y de la mortalidad al año, sólo alcanza significación estadística en el subgrupo de pacientes con historia de hipertensión arterial (n=565), mientras en pacientes normotensos los resultados no fueron significativamente diferentes entre zofenopril y placebo.19 ◆ en la cohorte de pacientes diabéticos (n=303), se reduce significativamente la variable combinada de muerte o IC severa a las seis semanas en el grupo tratado con zofenopril (8,6% vs 18,3%, p=0,019), siendo el efecto superior al observado en la población no diabética; sin embargo, la reducción de la mortalidad al año no alcanza la significación estadística (13,7% vs 16,5%, p=0,52) en población diabética, mientras se reduce significativamente en los pacientes no diabéticos (9,1% vs 13,8%, p=0,01), lo que sugiere que sería necesario el tratamiento a largo plazo para mantener los beneficios de la inhibición de la ECA en 20 pacientes con diabetes. En el SMILE-2 se compara la eficacia y seguridad de zofenopril 30-60 mg/día en dos dosis y lisinopril 5-10 mg/día en dosis única en 1024 pacientes sometidos a terapia trombolítica en la ◆ fase aguda de un IAM, comenzando el tratamiento en las primeras 12 horas después de la trombolisis y manteniéndolo durante 42 días. La variable principal, incidencia de hipotensión severa, resultó similar (10,9% vs 11,7%, p=0,38); únicamente la incidencia de hipotensión severa relacionada con el fármaco se reduce ligeramente con zofenopril, alcanzando la diferencia una significación estadística marginal (6,7% vs 9,8%, p=0,048). No se observó ninguna diferencia significativa entre los grupos a las 6 semanas de tratamiento en términos de mortalidad global (3,2% vs 4,0%, p=0,38) ni de 21 incidencia de IC severa (4,2% vs 3,5%) . Se desconoce cómo el empleo de distintos regímenes de dosificación, dos tomas al día para zofenopril versus una toma al día para lisinopril, puede haber afectado a la incidencia de hipotensión.15 Por tanto, hasta el momento zofenopril no ha demostrado ninguna ventaja en cuanto a eficacia sobre otros medicamentos con los que se ha comparado, en las dos indicaciones para las que se ha autorizado. REACCIONES ADVERSAS El perfil de reacciones adversas de ambos fármacos es similar al de los otros fármacos del grupo; las más frecuentes son: tos, mareos, fatiga, somnolencia, dispepsia y vómitos, y las más importantes: hiperpotasemia, insuficiencia renal e hipotensión. Algunos estudios indican que imidapril puede producir tos con menor frecuencia que otros IECAS, sin embargo esta posibilidad no ha quedado claramente confirmada. En un ensayo clínico de eficacia, la incidencia de tos fue más baja con imidapril (1/108, 0,9%),11 que con enalapril (8/115, 11 7,0%), mientras en otro la proporción de pacientes que experimentan tos fue comparable entre los dos grupos (5/175, 12 2,9% vs 7/177, 4,0%). Un estudio cruzado con 489 pacientes, diseñado específicamente para evaluar la incidencia de tos, concluye que ésta es significativamente más baja con imidapril que con enalapril (32/210, 15,2% vs 85/220, 38,6%);22 importantes sesgos metodológicos en el diseño y desarrollo del estudio, como la ausencia de ciego, las numerosas pérdidas y el hecho de que no precisen las dosis empleadas, limitan la validez de sus resultados.9 Un estudio abierto, no controlado, con pacientes que abandonan un tratamiento con enalapril por tos, muestra que la sustitución por imidapril suprime la tos sólo en algunos pacientes (6 de 15), a pesar de que la ausencia de ciego es un sesgo a priori favorable a imidapril.23 En otro estudio abierto, cruzado, que incluye 60 pacientes con historia de tos seca inducida por IECA, la tos y otros síntomas relacionados recurrieron en el 98,3% de los pacientes (59/60) durante el tratamiento con imidapril.24 Por tanto, no existe evidencia suficiente para confirmar la menor incidencia de tos asociada a imidapril. CONTRAINDICACIONES 2,3 · Hipersensibilidad a imidapril o zofenopril o a cualquier otro IECA. · Antecedentes de edema angioneurótico asociado con tratamiento previo con IECA. · Angioedema hereditario/idiopático. · Embarazo. · Lactancia. Sólo imidapril · Hipertensión renovascular. · Insuficiencia renal con o sin hemodiálisis (aclaramiento de creatinina < 10 mL/min). Sólo zofenopril · Enfermedad hepática grave. · Mujeres en edad fértil, a menos que utilicen un método anticonceptivo eficaz. · Estenosis bilateral de la arteria renal o estenosis unilateral de la arteria renal en casos de riñón único. PRECAUCIONES 2,3 Al igual que otros IECA, pueden provocar un descenso acentuado de la presión arterial, sobre todo tras la primera dosis, más probable en pacientes con deplección de volumen o insuficiencia cardiaca grave con o sin insuficiencia renal asociada. No debe ser iniciado tratamiento con zofenopril en pacientes con IAM si hay riesgo adicional de depresión hemodinámica severa subsiguiente al tratamiento vasodilatador (presión arterial sistólica < 100 mm Hg o con shock cardiogénico). Como ocurre con otros IECA, deben utilizarse con precaución en pacientes con psoriasis, insuficiencia renal, u obstrucción de la vía de salida del ventrículo izquierdo. No existe experiencia sobre la administración de imidapril o zofenopril en pacientes con trasplante de riñón reciente. INTERACCIONES 2,3 El perfil de interacciones es similar al de otros IECAS. El uso simultáneo de diuréticos ahorradores de potasio o suplementos de potasio debe realizarse con precaución, ya que puede aumentar significativamente el potasio sérico. Los pacientes tratados con diuréticos pueden experimentar una reducción excesiva de la presión arterial tras el inicio del tratamiento. Los IECAS pueden potenciar el efecto hipotensor de algunos anestésicos, y puede producirse hipotensión postural en pacientes tratados con narcóticos o antipsicóticos. El alcohol puede potenciar el efecto hipotensor de los IECA. Los fármacos simpaticomiméticos y los AINES pueden reducir su efecto antihipertensivo. Pueden reducir la excreción de litio y aumentar el riesgo de leucopenia en administración concomitante con alopurinol, citostáticos o inmunosupresores, corticoides sistémicos o procainamida. Pueden potenciar la sensibilidad a la insulina, provocando hipoglucemia sintomática en pacientes que reciben insulina o antidiabéticos orales. Los antiácidos pueden inducir una menor biodisponibilidad de los IECA. La administración de rifampicina podría disminuir el efecto antihipertensivo de imidapril, ya que reduce la concentración plasmática de imidaprilato. La administración concomitante de digoxina reduce en aproximadamente un 10% la biodisponibilidad de imidapril, posiblemente por disminuir su absorción gastrointestinal.4 COSTE EVALUACIÓN COMPARADA Para realizar comparaciones de coste entre los principios activos del grupo, se emplea el coste por Dosis Diaria Definida (DDD). En el caso de captopril, enalapril y lisinopril, se considera el precio de referencia, y en el de ramipril y quinapril, el precio de las EFG. COSTE COMPARATIVO IECAS (28 días de tratamiento) Zofenopril 30 mg Trandolapril 2 mg Ramipril 2,5 mg Quinapril 15 mg Perindopril 4 mg Lisinopril 10 mg Imidapril 10 mg Fosinopril 15 mg Espirapril 6 mg Enalapril 10 mg Cilazapril 2,5 mg Captopril 50 mg Benazepril 7,5 mg · Los ensayos clínicos no han demostrado que estos fármacos sean más efectivos que aquellos con los que se han comparado, en cuanto a reducción de presiones arteriales en HTA. Tampoco zofenopril se ha mostrado superior a lisinopril en términos de hipotensión severa, mortalidad o insuficiencia cardiaca severa en la fase aguda del IAM. · No hay datos concluyentes sobre la menor incidencia de tos con imidapril. 15,86 16,71 10,41 12,04 20,45 7,16 12,76 16,80 21,41 · No ofrecen ventajas clínicamente significativas de eficacia y seguridad respecto a fármacos del mismo y de distinto grupo terapéutico, y la evidencia clínica es inferior a la de otros fármacos mejor evaluados en las mismas indicaciones. 3,78 12,21 8,21 16,16 · El coste del tratamiento con imidapril o zofenopril es superior al de los fármacos de referencia de su grupo terapéutico. Fuente PVP Nomenclátor Digitalis octubre 2004 BIBLIOGRAFÍA 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 Información Terapéutica del Sistema Nacional de Salud 2004;28:16-17. Ficha técnica de Hipertene®. BIAL Industrial Farmacéutica, 2004. Ficha técnica de Zofenil®. Menarini, 2004. Imidapril. Drugdex Drug Evaluations. MICROMEDEX (R) Healthcare Series Vol 122 (expires 12/2004). Zofenopril. Drugdex Drug Evaluations. MICROMEDEX (R) Healthcare Series Vol 118 (expires 12/2003). VandenBurg MJ, Mackay EM, Dews I, Pullan T, Brugier S. Dose finding studies with imidapril-a new ACE inhibitor. Br J Clin Pharmacol 1994;37:265-72. Dews I, VandenBurg M. A 24-week dose-titration study of the angiotensin-converting enzyme inhibitor imidapril in the treatment of mild-to-moderate hypertension in the elderly. J Int Res 2001;29:100-7. Van der Does R, Euler R. A randomized, double-blind, parallel group study to compare the antihypertensive effects of imidapril and nifedipine in the treatment of mild-to-moderate essential hypertension. J Int Med Res 2001;29:154-62. Prescrire Rédaction “imidapril et HTA”. Rev Prescr 2000;20:568-70. Huang PJ, Chien KL, Chen MF, Lai LP, Chiang FT. Efficacy and safety of imidapril in patients with essential hypertension: a double-blind comparison with captopril. Cardiology 2001;95:146-50. Saruta T, Omae T, Kuramochi M, Iimura O, Yoshinaga K, Abe K et al. Imidapril hydrocloride in essential hypertension: a double-blind comparative study using enalapril maleate as control. J Hypertens 1995;13:S23-30. Van der Does R, Euler R. Comparison of the antihypertensive effect of imidapril and enalapril in the treatment of mild to moderate essential hypertension: a randomized, doubleblind, parallel group study. Curr Ther Res Clin Exp 2001;62:437-50. Malacco E, Castiglioni G, Corradi L, Cristofari M, Fogari R, Pisani A et al. Dose-response relationship of zofenopril in essential hypertension. Clin Drug Invest 2002;22:9-15. Lacourciere Y, Provencher P. Comparative effects of zofenopril and hydrochlorothiazide on office and ambulatory blood presures in mild to moderate essential hypertension. Br Clin Pharmacol 1989;27:371-6. Borghi C, Ambrosioni E. Zofenopril. A review of the evidence of its benefits in hypertension and acute myocardial infarction. Clin Drug Invest 2000;20:371-84. Ambrosioni E, Borghi C, Magnani B. Early treatment of acute myocardial infarction with angiotensin-converting enzyme inhibition: safety considerations. SMILE pilot study working party. Am J Cardiol 1991;68:101D-10D. Ambrosioni E, Borghi C, Magnani B. The effect of the angiotensin-convertingenzyme inhibitor zofenopril on mortality and morbidity after anterior myocardial infarction. N Engl J Med 1995;332:80-5. Borghi C, Ambrosioni E, Magnani B. Effects of the early administration of zofenopril on onset and progression of congestive heart failure in patients with anterior wall acute myocardial infarction. Am J Cardiol 1996;78:317-22. Borghi C, Bacchelli S, Esposti DD, Bignamini, Magnani B, Ambrosioni E. Effects of the administration of an angiotensin-converting enzyme inhibitor during the acute phase of myocardial infarction in patients with arterial hypertension. Am J Hypertens 1999;12:665-72. Borghi C, Bacchelli S, Esposti DD, Ambrosioni E. Effects of the early ACE inhibition in diabetic nonthrombolyzed patients with anterior acute myocardial infarction. Diabetes Care 2003;26:1862-8. Borghi C, Ambrosioni E. Double-blind comparison between zofenopril and lisinopril in patients with acute myocardial infarction: results of the survival of myocardial infarction longterm evaluation-2 (SMILE-2) study. Am Heart J 2003;145:80-7. Saruta T, Arakawa K, Iimura O, Abe K, Matsuoka H, Nakano T et al. Difference in the incidence of cough induced by angiotensin converting enzyme inhibitors: a comparative study using imidapril hydrochoride and enalapril maleate. Hypertens Res 1999;22:197-202. Nishikawa Y, Ogawa S. Incidence of cough induced by imidapril in patients with hypertension with enalapril-associated cough. Curr Ther Res 1997;58:601-8. Shionoiri H, Takasaki I, Minamisawa K, Ueda S, Kihara M, Shindo K et al. Cough-challenge trial with a new angiotensin-converting enzyme inhibitor, imidapril. J Clin Pharmacol 1998;38:442-6. ÁREA DE EVALUACIÓN DE MEDICAMENTOS - SERVICIO DE FARMACIA DIRECCIÓN GENERAL DE ORGANIZACIÓN DE LAS PRESTACIONES SANITARIAS CONSEJERÍA DE SALUD Y SERVICIOS SANITARIOS C/ General Elorza, 32, 33001 Oviedo · Télf.: 985 106 572 · Fax: 985 106 384 · e-mail: [email protected]