reconocimiento de gl cidos. determinaci n de las
Anuncio

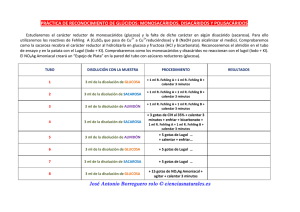
BIOLOGÍA 2º de BACHILLERATO. PRACTICA DE LABORATORIO Nº...... NOMBRE...................................................................... FECHA ..................................... DETERMINACIÓN DE LAS PROPIEDADES QUÍMICAS DE LOS GLÚCIDOS MATERIAL 10 Tubos de ensayo. 2 vasos de precipitado de 250 cm3 Pinzas Trípode Rejilla de amianto. Foco de calor. Rotulador para vidrio 2 Pipetas. Balanza de precisión. Espátula. PRODUCTOS QUÍMICOS. REACTIVOS -Glucosa, fructosa, Reactivo de Fehling A y B maltosa, sacarosa y Lugol almidón. - Agua destilada. - Reactivo de Fehling (A yB). - Lugol. - NaOH al 20% - HCl al 10% PROTOCOLO. 1. Preparar disoluciones diluidas de glucosa, fructosa, sacarosa, maltosa, y almidón (de 3 a 5g/100cm3). 2. Observar la forma en que se disuelve cada una de estas sustancias. Anotar lo observado en el cuadro de resultados final. 3. Con una espátula, que se lavará y se secará cada vez que se utilice, poner un poco de cada producto en la mano, y apreciar si el sabor es dulce o no . Anotar los resultados. 4. Observar el color y aspecto, es decir si a simple vista tiene aspecto de cristalitos o de materia amorfa. Anotar los resultados 5. Comprobar el carácter reductor de las sustancias frente al reactivo de Fehling. Los monosacáridos y algunos disacáridos tienen gran poder reductor; el grupo aldehído o cetona puede oxidarse en contacto con otras sustancias a las que reduce Poner en los tubos de ensayo 2cm3 de las sustancias a investigar. Añadir 2cm3 de mezcla a partes iguales de Fehling A y B. Calentar los tubos para ver el carácter reductor. Dicho carácter se evidencia por la aparición de un precipitado rojo de óxido de cobre. En un primer momento se aprecia un color verdoso, como resultado de la mezcla del color azul del reactivo y del color amarillo del primer producto, luego color amarillo del hidróxido de cobre Cu(OH), y finalmente color rojo del óxido de cobre I(Cu2O. Se realiza una reacción mediante el licor de Fehling y calentando se logra reducir los iones cúpricos (Cu++) a cuprosos (Cu+), quedando el MS oxidado. La reacción química se manifiesta como positiva cuando se produce un cambio de color, de azul a rojo ladrillo. Anotar los resultados. 6. A los tubos que contienen sustancias que no han reducido el reactivo de Fehling, añadir 1cm3 de HCl al 10% para efectuar la hidrólisis de los enlaces glucosídicos. A continuación calentar durante 15 minutos al baño María. Después añadir hidróxido sódico al 20% hasta que el medio se vuelva básico. Se puede comprobar al introducir papelitos indicadores de pH sujetados por una pinza. A continuación repetir la prueba de Fehling, es decir, añadir 2cm3 de Fehling. Anotar los resultados. 7. Comprobar si forman un complejo azul oscuro con el yodo. Para ello poner en los tubos de ensayo 2cm3 de las sustancias a investigar. Añadir unas gotas de lugol (disolución de yodo y yoduro potásico) a cada uno de los tubos. Las moléculas de yodo se concentran al quedarse atrapadas en la hélice de glucosa y, al ser ésta muy larga, quedan reveladas. Anotar los resultados. Glucosa Fructosa Maltosa Sacarosa Almidón Solubilidad Color Aspecto Sabor Fehling Fehling tras la hidrólisis Lugol PREGUNTAS. 1ª ¿Por qué unos glúcidos son muy solubles y otros lo son muy poco? 3ª ¿Por qué unos glúcidos no reducen el reactivo de Fehling y sí lo hacen después de una hidrólisis? 4ª ¿Por qué unos glúcidos se colorean con el yodo y otros no?. 5ª Escribe la reacción de hidrólisis de la sacarosa. 6ª Explica qué se hace en un análisis de orina para detectar el azúcar.