La masa de un vaso vacío es 342 g. Se mide, con una probeta
Anuncio

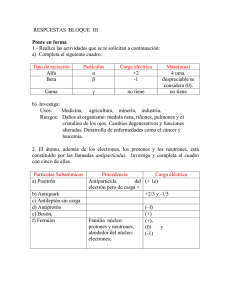
1. La masa de un vaso vacío es 342 g. Se mide, con una probeta graduada, 543 ml de aceite de oliva y se vierten en el vaso. Se pesa el vaso con su contenido, obteniendo un valor de 768 g. ¿Cuál es la densidad del aceite? Exprésala en g / cm 3. 2. Calcular la densidad de 6.89 moles de KClO3 que se encuentran en un recipiente de 19.4 Cm 3 3. Calcula el volumen en litros que tendrán 1.22 kg de Poliestireno expandido (densidad = 0,92 g / cm 3). 4. Convertir a. 5.67 Moles de HNO3 a (Moléculas, Gramos, Átomos) b. 3.01 x 1020 átomos de Calcio a (Moles, Gramos, Moléculas) c. 45.67 g a (Moles, Átomos, Moléculas) 5. Completar la Tabla teniendo en cuenta la formula de la Densidad Masa Hielo 324 Poliestireno expandido 67 Vidrio Agua de Mar Volumen 714 a. b. c. d. varía su volumen. varía su densidad. varía su color. varía su masa. 12. La pipeta es un instrumento para medir: 2.60 1.02 Masa. Densidad. Temperatura de fusión. Solubilidad. Volumen y equivale a 1 litro. Superficie. Longitud. Volumen y equivale a 1000 litros. el máximo volumen que podemos medir con él. el tiempo que tarda antes de romperse. la mínima cantidad que podemos apreciar con él. la resistencia a ser rayado por otros objetos. 9. A igualdad de volumen un material es más denso cuanto: a. mayor sea su masa. 11. Si cogemos una goma y la partimos por la mitad: 13. Una piedra de forma irregular posee una masa de 30 gramos. Se introduce en una probeta con agua y sube el nivel de la misma de 90 ml a 92 ml. ¿Cuál será la densidad de dicho sólido?. 8. La sensibilidad de un instrumento es: a. b. c. d. pesa menos que el agua. pesa más que el agua. es menos denso que el agua. es más denso que el agua. 0.92 7. El metro cúbico es una unidad de: a. b. c. d. a. b. c. d. a. b. c. d. 6. Si queremos identificar una determinada sustancia, ¿qué propiedad de las siguientes no nos serviría para conseguir nuestro objetivo?: a. b. c. d. 10. Un cuerpo flota en el agua porque: Densidad 129 89 b. menor sea su masa. c. no influye la masa. d. ninguna de las anteriores. a. b. c. d. masas. superficies. volúmenes. longitudes. 18 g/ml. 15 g/ml. 15 ml. 20 g/ml. 14. Si calentamos un cuerpo determinado aumenta: a. b. c. d. su densidad. su temperatura y su volumen. su temperatura pero no su volumen. su volumen pero no su temperatura. 15. La densidad de una sustancia A es de 3 g/cm 3, de otra B 3100 Kg/m3 y de una tercera C 2600 g/dm 3. Podemos afirmar que: a. b. c. d. La mayor densidad corresponde a la sustancia A. La mayor densidad corresponde a la sustancia B. La mayor densidad corresponde a la sustancia C. Las tres sustancias tienen la misma densidad. 16. Determinar los valores en porcentaje y en unidad de los elementos que conforman los siguientes compuestos a. H2SO4 (S= 19.8% y S= 0.189) b. KMnO4 (Mn=21.69% y Mn=0.213) c. KClO3 (Cl=24.98% y Cl=0.23) 17. completar la siguiente tabla señalando con una F o una Q según corresponda a la propiedad 22. Colocar F si la afirmación es falsa y V si la afirmación es Verdadera en las siguientes oraciones de los modelos atómicos. Según Dalton Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas átomos. ( ) Según Tomsom La materia es eléctricamente neutra, lo que hace pensar que, además de electrones, debe de haber partículas con cargas positivas.( ) Para Rutherford El átomo esta constituido por una zona central, a la que se le llama núcleo, en la que se encuentra concentrada toda la carga positiva y casi toda la masa del núcleo. ( ) Para Borh Cuando un electrón estaba en uno de estos estados no irradiaba pero cuando cambiaba de estado 18. Elaborar un cuadro comparando los diferentes tipos de separación de mezclas. absorbía o desprendía energía. ( ) 22. Completar 19. En un proceso (A) al someter agua en estado líquido a un aumento fuerte de temperatura hasta ebullición, esta se convierte en gas. En otro proceso (B), las temperaturas por debajo de 0 °C durante el invierno convierten la superficie del agua de un lago en una gruesa capa de hielo. De acuerdo con lo anterior, las moléculas del agua en a. b. c. d. A y B sufren cambios químicos A y B se mantienen constantes A y B sufren cambios físicos A sufre cambio químico y B sufre cambio físico 20. Colocar sobre los espacios las palabras que corresponden (Masa, Peso, Volumen, Impenetrabilidad y dilatabilidad) La __________ y el _________ son dos propiedades diferentes y no deben confundirse. Otra propiedad de la materia es el_______________, porque todo cuerpo ocupa un lugar en el espacio. A partir de las propiedades anteriores surgen, entre otras, propiedades como la _______________ y la ________________. 21. Determine la densidad de una sustancia que pesa 35 gramos en un volumen de 5 litros Cuál será el volumen de una sustancia cuya densidad es de 1,3 g/Cm3 y una masa de 45 gr Qué masa presenta una sustancia cuyo volumen es de a. La tabla periódica se organiza en filas horizontales, que se llaman _____________, y columnas verticales que reciben el nombre de _______________ b. ________________Se transforman fácilmente en iones positivos. Quedan situados a la izquierda y el centro de la tabla c. __________________No forman iones. En condiciones normales, no se combinan con ningún otro elemento químico d. Los elementos están colocados por orden creciente de su ___________________ 23. Relacionar la columna de la izquierda con la derecha colocando dentro del paréntesis la letra correspondiente a. Grupo VIII A b. Grupo VII A c. Grupo VI A d. e. f. g. Grupo 15 Grupo IV A Grupo 13 Grupo 3 al 12 h. Grupo II A i. Grupo 1 3,6 L y su densidad de 2,5g/Cm 3 24. Defina ( )Metales alcalinos ( )Metales alcalinotérreos ( )Metales de transición ( )Terreos ( )Carbonoideos ( )Nitrogenoideos ( )Calcogenos o familia del oxigeno ( )Halógenos ( )Gases nobles a. b. c. d. Enlace químico Enlace iónico y covalente Ley del octeto Orbitales y núcleo Atómico 25. Elabora utilizando la tabla periódica una gráfica que muestre la variación de la electronegatividad en función del número atómico teniendo en cuenta la información de la siguiente tabla A. 1s2 2s2 2p6 3s2 4s2 3p6 4p6 5s2 3d5 B. 1s2 2s2 2p6 2d10 3s2 3p6 4s2 4p3 C. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 D. 1s2 2s2 2p6 3s2 3p6 4s2 3d7 4p6 30. Determinar la masa atómica promedio del siguiente elemento. Isotopo Mg24 Mg25 Mg26 % Abundancia 78.70 10.13 11.17 Masa 23.98504 24.98584 25.98259 31. Hallar la masa molecular de los siguientes compuestos a. H2SO4 b. KClO3 c. KMnO4 32. Determine (e-, p+, n°, Z y A) para el siguiente isótopo del Boro B115, B105 y C126, C136, C146 26. Utilizando la configuración electrónica, determinar los tipos de enlace que se forman con las siguientes parejas de elementos. a. SF6 b. CCl4 c. H2O d. CaS 33. El número de Avogadro, (6,023 x 1023) corresponde al número de átomos o moléculas presentes en 1 mol de sustancia. La tabla indica la masa de 1 mol de dos sustancias X y Z, y una característica física de cada una. 27. Completar la siguiente tabla teniendo en cuenta la información suministrada y determine el elemento al que hace referencia. De acuerdo con la información anterior, el dibujo que mejor representa 1 mol de cada sustancia, X y Z respectivamente es 34. Un átomo cuya configuración electrónica es 1s2 2s2 2p6 3s2 3p6 4s2 tiene: A. El subnivel 2s incompleto B. Incompleto el tercer nivel energético principal C. Incompleto el subnivel 3s. D. incompleto el primer nivel energético. 35. Realizar la configuración electrónica de los siguientes elementos y ubicarlos en la tabla periódica. 28. Determine la configuración electrónica para el elemento D y realice los tipos de configuración (orbitales, común y Kernel) 29. La configuración electrónica correspondiente al elemento (B) es a. Cd cuyo número atómico es 48 b. Ta cuyo número atómico es 73