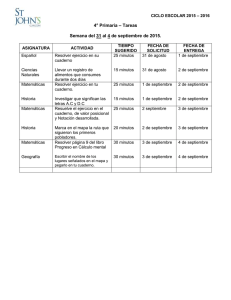
prueba de definición de niveles química
Anuncio

PRUEBA DE DEFINICIÓN DE NIVELES QUÍMICA CUADERNO AUTOINSTRUCTIVO DE PREPARACIÓN PRUEBA DE DEFINICIÓN DE NIVELES DE QUÍMICA. CUADERNO AUTOINSTRUCTIVO DE PREPARACIÓN UNIVERSIDAD PERUANA DE CIENCIAS APLICADAS. Coordinación del Cuaderno Autoinstructivo de Preparación Betty Luz Pérez Zenteno Docente del Área de Ciencias Elaboración del cuaderno María Cañas Cano Leslie Córdova Yamauchi Rosario López Cisneros Mará Pastor Subauste Betty Luz Pérez Zenteno Docentes del Área de Ciencias INTRODUCCIÓN El presente cuaderno autoinstructivo tiene como objetivo brindar al postulante aprobado a la Universidad de Ciencias Aplicadas (UPC) un material de apoyo que le permita rendir con éxito la Prueba de Definición de Niveles de Química. El manual está dividido en doce unidades: fundamentos de la química, estructura atómica y tabla periódica, fuerzas moleculares, lenguaje químico, estequiometria, soluciones, gases, cinética química, equilibrio químico, química orgánica, isómeros y grupos funcionales orgánicos En cada capítulo, luego del desarrollo de los aspectos teóricos, se han incorporado preguntas que le permitirán al alumno autoevaluarse paulatinamente para finalmente resolver una serie de ejercicios que integran todos los aspectos desarrollados en cada capítulo. Consideramos que los conocimientos brindados en este manual le darán al alumno una base sólida para insertarse con éxito en la química universitaria. Deseamos a los usuarios de este manual un feliz encuentro con el fascinante mundo de la Química. Betty L. Pérez Z. INDICE TEMÁTICO I. FUNDAMENTOS DE LA QUÍMICA II. ESTRUCTURA ATÓMICA Y TABLA PERIÓDICA III. FUERZAS MOLECULARES IV. LENGUAJE QUÍMICO V. ESTEQUIOMETRÍA VI. SOLUCIONES VII. GASES VIII. CINÉTICA QUÍMICA IX. EQUILIBRIO QUÍMICO X. QUÍMICA ORGÁNICA XI. ISÓMEROS XII. GRUPOS FUNCIONALES ORGÁNICOS BIBLIOGRAFÍA RESPUESTAS AUTOEVALÚATE Y EJERCICIOS INTEGRADORES I. FUNDAMENTOS DE QUÍMICA 1.1 QUÍMICA 1.2 MATERIA 1.3 CLASIFICACIÓN DE LA MATERIA 1.3.1 Sustancia pura 1.3.2 Mezcla 1.4 ESTADOS FÍSICOS DE LA MATERIA 1.4.1 Estados sólido, líquido y gas 1.4.2 Estado plasmático 1.4.3 Estado condensado de Bose-Einstein 1.4.4 Cambios de estado 1.5 PROPIEDADES DE LA MATERIA 1.5.1 Propiedades generales 1.5.2 Propiedades particulares 1.5.3 Propiedades intensivas y extensivas de la materia 1.6 CAMBIOS QUE SUFRE LA MATERIA 1.6.1 Cambios físicos 1.6.2 Cambios químicos 1.7 MEDICIÓN DE LA MATERIA 1.7.1 Sistema Internacional de Unidades (SI) 1.7.1.1 Unidades básicas 1.7.1.2 Unidades derivadas 1.7.2 Prefijo 1.7.3 Análisis dimensional EJERCICIOS INTEGRADORES Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ I. FUNDAMENTOS DE QUÍMICA 1.1 QUÍMICA Es una ciencia que estudia la materia, sus propiedades físicas y químicas, los cambios que experimenta y las variaciones de energía que acompañan dichos procesos. Algunos historiadores de la ciencia creen que la palabra química deriva del vocablo griego khémeia, que significa "el arte del trabajo de los metales". La química, incluye mucho más que eso; hoy en día es considerada como la ciencia central ya que está relacionada con muchos campos científicos. La tecnología moderna requiere de materiales nuevos con propiedades poco usuales, y los químicos deben diseñar métodos para producirlos. La medicina moderna necesita fármacos formulados para llevar a cabo tareas específicas en el cuerpo humano, y los químicos deben diseñar las estrategias para sintetizar estos fármacos a partir de compuestos iníciales relativamente simples. La sociedad exige mejoras en los métodos de control de la contaminación, sustitutos de las materias primas que escasean, métodos seguros para deshacerse de los residuos tóxicos y modos más eficaces para extraer energía de los combustibles. La química abarca todos esos temas. 1.2 MATERIA Materia es todo aquello que ocupa un lugar en el espacio y tiene una propiedad llamada masa, posee inercia y no necesariamente es sensible a nuestros sentidos. Todos los objetos que vemos a nuestro alrededor son materia, pero algunas sustancias no las podemos ver, como los gases de la atmósfera, que sí son materia, porque ocupan un lugar en el espacio y tienen masa. La luz solar, el calor y la temperatura son ejemplos de cosas que no son consideradas materia. 1.3 CLASIFICACIÓN DE LA MATERIA La materia, de acuerdo con su composición, puede ser una sustancia pura o una mezcla. Figura 1.1 Esquema de clasificación de la materia Unidad 1: Fundamentos de Química 2 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 1.3.1 Sustancia pura Una sustancia pura es aquella materia que tiene propiedades definidas y una composición que no varía de una muestra a otra. Puede encontrarse en diferentes formas o estados físicos. Sustancia pura simple o elemento Son aquellas sustancias que no pueden descomponerse en sustancias más simples. Un elemento es una sustancia formada por un solo tipo de átomos Actualmente, se conocen, aproximadamente, 118 elementos químicos y son representados por símbolos químicos que están ordenados de acuerdo con sus propiedades físicas y químicas en la tabla periódica. Existen elementos que consisten en una colección de átomos idénticos que no se unen entre sí, como, por ejemplo, los gases nobles como el neón (figura 1.2 [a]); otras veces, átomos idénticos se encuentran unidos entre sí formando grupos atómicos llamados moléculas, como, por ejemplo, el gas oxígeno (O2) (figura 1.2 [b]) y también existen ciertos elementos en la que los átomos se encuentran juntos formando redes cristalinas, como, por ejemplo, el carbono y sus formas alotrópicas: grafito, diamante y fulereno (figura 1.2 [c]) Figura 1.2 Sustancias puras Las sustancias puras o elementos tienen una sola clase de átomos y pueden encontrarse formando (a) átomos de un elemento (b) moléculas de un elemento (c) redes cristalinas del carbono. La composición de los elementos de la superficie terrestre y del cuerpo humano se encuentra en las siguientes tablas: Unidad 1: Fundamentos de Química 3 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Tabla 1.1 Distribución de los elementos en la corteza terrestre Elemento Masa (%) 49,20 25,67 7,50 4,71 3,39 2,63 2,40 1,93 0,87 0,58 Oxígeno Silicio Aluminio Hierro Calcio Sodio Potasio Magnesio Hidrógeno Titanio Elemento Cloro Fósforo Manganeso Carbono Azufre Bario Nitrógeno Flúor Todos los demás Masa (%) 0,19 0,11 0,09 0,08 0,06 0,04 0,03 0,03 0,47 Tabla 1.2 Composición elemental media del cuerpo humano Elemento Oxígeno Carbono Hidrógeno Nitrógeno Fósforo Calcio Otros elementos Masa (%) 65 18 10 3,0 2,0 1,0 1,0 Sustancia pura compuesta o compuesto Un compuesto es un tipo de materia que está constituida por dos o más elementos diferentes unidos químicamente, estos elementos pierden completamente sus propiedades cuando forman parte del compuesto. Una característica principal del compuesto es que los elementos se encuentran presentes en proporciones fijas. Los componentes de un compuesto pueden ser separados sólo por medios químicos. Ejemplo: La sacarosa o azúcar de mesa es un compuesto de color blanco y cristalino formado por átomos de carbono, hidrógeno y oxígeno unidos químicamente, C12H22O11, una composición única y específica. Al calentarse, se descompone pasando por una serie compleja de cambios que producen un color pardo. Si se calienta más tiempo a una temperatura suficientemente alta, la sacarosa se convierte por completo en otras dos sustancias: carbono y agua. Si se recoge el agua producida, esta se puede descomponer aún más para producir hidrógeno y oxígeno puros haciendo pasar corriente eléctrica a través de ella; sin embargo, el carbono, hidrógeno y oxígeno obtenidos ya no pueden descomponerse en dos o más sustancias nuevas, ya que son elementos. Por otro lado, las propiedades físicas y químicas que tiene la sacarosa Unidad 1: Fundamentos de Química 4 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ son completamente distintas de las de los elementos que la formaron (véase la tabla 1.3). Tabla 1.3 Comparación de la sacarosa y los elementos que la componen Propiedad Estado Punto de ebullición Densidad Inflamable Sacarosa Carbono Hidrógeno Oxígeno (grafito) Sólido Sólido Gas Gas o o Sublima 186 C -252,88 C -182,96 oC 1,587 g/mL 2,267 g/mL 0,088 g/L 1,33 g/L No No Sí No 1.3.2 Mezcla En el mundo natural, la materia, usualmente, se encuentra en forma de mezclas. Una mezcla está formada por dos o más sustancias (elementos o compuestos) en proporciones variables o no definidas, y sus propiedades, que van a depender de su composición. En una mezcla, los componentes no pierden su identidad ni sus características y pueden ser separados por medios físicos o mecánicos. Por ejemplo, el agua azucarada es una mezcla de agua y sacarosa, dos sustancias puras, que puede contener mucha o poca azúcar. Esta mezcla es incolora como el agua y tiene sabor dulce como la sacarosa. Es decir, la mezcla conserva las propiedades de los componentes; además, estos componentes podrían separarse por evaporación del agua. Dependiendo de la forma en que se distribuyen sus componentes, las mezclas pueden ser de dos tipos. Mezcla homogénea Son mezclas cuya composición y propiedades son uniformes en cualquier parte de una muestra determinada. No tienen fases observables, pues sus componentes se mezclan como átomos individuales, iones o moléculas, lo que hace que sus componentes no se visualicen. Por ejemplo, la salmuera (agua con sal) es una mezcla homogénea, pues las moléculas de agua y las de sal están mezcladas de manera uniforme a nivel molecular. Las mezclas homogéneas pueden existir en cualquiera de los tres estados. Ejemplos: − El agua azucarada es líquida. − El aire (mezcla oxígeno, hidrógeno, nitrógeno y otros) es gaseoso. − El oro blanco (mezcla de oro y paladio) es sólido. En general, ocurre lo mismo en las aleaciones de metales y amalgamas. Unidad 1: Fundamentos de Química 5 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Mezcla heterogénea Son mezclas cuyos componentes se separan en zonas diferenciadas; por lo tanto, la composición, el aspecto y las propiedades físicas varían de una zona a otra de la mezcla. Por ejemplo, muchas rocas, como el granito, son heterogéneas, pues fácilmente se pueden visualizar sus granos y las partículas de los diferentes minerales. En algunos casos, las fases pueden ser observadas solo a nivel microscópico. Autoevalúate 1 1. Para cada una de las siguientes muestras, indica si se trata de un elemento (E), compuesto (C), mezcla homogénea (MHo) o mezcla heterogénea (MHe) a) b) c) d) e) f) Vinagre Agua oxigenada Wolframio Arena Alcohol al 96% Aire puro g) h) i) j) k) l) Ozono Bronce Oro Cloroformo Hielo seco Neón 2. Determina si cada enunciado es verdadero (V) o falso (F) e indica la secuencia correcta. a) El elemento que está en mayor porcentaje en el cuerpo humano es el oxigeno. b) Una mezcla es aquella sustancia formada por dos o más tipos de átomos, unidos químicamente y en proporciones sencillas y definidas c) Una mezcla se separa en sus componentes usando métodos físicos como destilación, filtración o imantación. 1.4 ESTADOS FÍSICOS DE LA MATERIA 1.4.1 Estados sólido, líquido y gas La materia en condiciones ambientales suele encontrarse en tres formas físicas, definidas estados: sólido, líquido y gas; sin embargo, en el universo, se encuentra, además, el plasma y podría darse el caso de encontrar a la materia en un quinto estado denominado el estado condensado de Bose-Einstein. La energía potencial entre las partículas (moléculas, átomos o iones) en la materia resulta de las fuerzas de atracción (Fatracción) y repulsión (Frepulsión), denominadas fuerzas intermoleculares. La interacción de estas fuerzas intermoleculares y la energía cinética de las partículas desarrolla las propiedades en cada estado. La figura 1.3 compara las vistas moleculares del estado gaseoso, líquido y sólido. Unidad 1: Fundamentos de Química 6 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ En un gas, la fuerza de atracción es relativamente pequeña con respecto a la de repulsión; entonces, en promedio, las partículas están alejadas, lo que trae consigo que las partículas del gas se muevan aleatoriamente a través del recipiente y lo llenen. Debido a los grandes espacios intermoleculares que se crean, los gases son altamente compresibles, fluyen y se difunden fácilmente Figura 1.3 Los estados de la materia, visión macroscópica y molecular gas líquido sólido En un líquido, las atracciones son fuertes, porque las partículas están virtualmente en contacto, pero su energía cinética les permite voltearse aleatoriamente y rodearse unas a otras, lo que hace que un líquido adquiera la forma del recipiente, pero tiene su volumen definido. Con un pequeño espacio libre entre sus partículas, los líquidos resisten la aplicación de una fuerza externa; es decir, solo se comprimen levemente. Fluyen y se difunden, pero mucho más lentamente que los gases. . En un sólido, las atracciones dominan el movimiento; las partículas permanecen en una posición y muy cercanas unas a otras, vibrando en su lugar, por lo que un sólido tiene una forma específica prácticamente incompresible y sus partículas no fluyen. En la tabla 1.4, se resumen las principales características del estado sólido, líquido y gas. 1.4.2 Estado plasmático Este estado fue identificado por primera vez por Sir William Crookes en 1879, y fue denominado plasma por Irving Langmuir. A temperaturas muy altas (10 000 oC), los átomos se mueven muy rápidamente y las colisiones entre ellos son lo suficientemente violentas como para liberar sus electrones. La materia se encuentra como un gas ionizado. La materia en estado plasmático conduce la electricidad y se ve fuertemente influida por los campos magnéticos. El Sol y las estrellas están formados por plasma. También lo está la ionosfera, que comienza a unos 70-80 km por encima de la superficie terrestre y resulta muy importante en la naturaleza. Unidad 1: Fundamentos de Química 7 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Tabla 1.4 Principales características de los estados sólido, líquido y gas Sólido Líquido Gas Relación entre fuerzas Fatracción > Frepulsión Fatracción ≅ Frepulsión Fatracción < Frepulsión Atracción entre partículas Intensa Moderada Despreciable Orden de sus partículas Muy ordenada Desordenada Muy desordenada Forma Definida Indefinida Indefinida Volumen Definido Definido Indefinido Espacios intermoleculares Nulos Pequeños Grandes Compresibilidad Casi ninguna Muy baja Compresibles Fluidez Nula Moderada Alta Movimiento Vibratorio Rápido Alta velocidad 1.4.3 Estado condensado de Bose-Einstein Este estado de la materia fue predicho en 1924 por Santyendra Nath Bose y Albert Einstein, y obtenido en 1995 por Eric Cornell, Wolfgang Ketterle y Carl Wieman, quienes fueron galardonados en 2001 con el premio Nobel de Física. En este estado, todos los átomos se unen fuertemente y pierden su identidad; ocupan el mismo lugar y forman una sola onda cuántica de partículas. Este estado es todo lo contrario al plasma, porque sus partículas, en vez de separarse, se condensan. Esto ocurre a bajísimas temperaturas, cercanas al cero absoluto, es decir, a -273 oC. 1.4.4 Cambios de estado Los cambios de estados están también determinados por la interacción entre la energía cinética y las fuerzas intermoleculares. Cuando se incrementa la temperatura, también aumenta la energía cinética (el movimiento), que puede llegar a sobrepasar las atracciones; por el contrario, las bajas temperaturas permiten unir más las partículas, por lo que se mueven lentamente. La figura 1.4 muestra el nombre asociado con cada uno de estos cambios. Unidad 1: Fundamentos de Química 8 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 1.4 Cambios de estado entre los tres estados de la materia y los nombres asociados con ellos Autoevalúate 2 1. Indica que cambio físico se está produciendo en cada uno de los siguientes casos a) b) c) d) e) f) g) h) Se empaña un espejo al respirar sobre él. La ropa tendida se seca. La cera líquida de una vela cuando se enfría y endurece Las nubecillas que salen de nuestra boca cuando exhalamos nuestro aliento en una fría mañana de invierno La cera de la vela cuando se derrite La formación de lava al calentar las rocas por el calor interno de la Tierra Los ambientadores líquidos que se enchufan a la red eléctrica para que dispersen el olor Cuando llega el verano, guardamos la ropa de invierno con un antipolillas (alcanfor, naftalina, etcétera). Al sacarla en otoño, las bolas han disminuido de tamaño o han desaparecido. 1.5 PROPIEDADES DE LA MATERIA Son cualidades, características y atributos que podemos utilizar para distinguir una muestra de materia de otra. Desde el punto de vista cualitativo, las propiedades de la materia pueden ser las que se muestran a continuación. 1.5.1 Propiedades generales Son aquellas propiedades que posee toda materia independientemente de su tamaño o estado físico, tales como masa, peso, inercia, volumen, impenetrabilidad, divisibilidad, etcétera. Unidad 1: Fundamentos de Química 9 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Masa: es la propiedad de un cuerpo que se refiere a la cantidad de materia que posee. Peso: es la propiedad de un cuerpo que indica la fuerza con que la gravedad actúa sobre este. Inercia: es la propiedad de un cuerpo que mide la tendencia de un objeto a permanecer en reposo o en movimiento uniforme. Volumen: es la propiedad de un cuerpo que mide la cantidad de espacio que ocupa. Impenetrabilidad: es la propiedad de la materia que indica la resistencia que opone un cuerpo a que otro ocupe su lugar al mismo tiempo. Divisibilidad: es la propiedad de la materia que indica que esta puede ser dividida en fracciones más pequeñas. 1.5.2 Propiedades particulares Son aquellas propiedades que solo ciertos tipos de materia poseen: dureza, porosidad, maleabilidad, ductibilidad, conductividad eléctrica y térmica, etcétera. Dureza: es la propiedad de la materia que mide la resistencia a ser rayada. Porosidad: es la propiedad que poseen ciertos materiales de absorber líquidos o gases debido a la presencia de espacios vacíos entre las partículas que los forman. Maleabilidad: es la propiedad que tienen ciertos cuerpos de poder transformarse en láminas. Ductibilidad: es la propiedad que tienen ciertos cuerpos de poder transformarse en hilos. Conductividad eléctrica: es la propiedad que tiene los materiales de conducir la electricidad. Conductividad térmica: es la propiedad que tienen los materiales de conducir el calor. 1.5.3 Propiedades intensivas y extensivas de la materia Todas las propiedades generales de la materia que se pueden medir se clasifican en propiedades extensivas y propiedades intensivas. Propiedades intensivas o específicas: son aquellas que no varían con la cantidad de materia considerada, como, por ejemplo, la temperatura de ebullición del agua, la densidad de un líquido, etcétera. Propiedades extensivas: son aquellas cuyo valor depende de la cantidad de materia, como, por ejemplo, masa, peso, volumen. Estas propiedades son aditivas, debido a que dependen de la cantidad de la muestra tomada. Unidad 1: Fundamentos de Química 10 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 1.6 CAMBIOS QUE SUFRE LA MATERIA De acuerdo con la ley de conservación de la materia, esta no se crea ni se destruye; solo se transforma o cambia. En la materia, se pueden producir cambios físicos y cambios químicos. 1.6.1 Cambios físicos Un cambio físico ocurre cuando la materia altera su forma o apariencia —en general, sus propiedades físicas—, pero su composición no se altera. Ejemplos: − Hervir agua (el agua cambia de estado, de líquido a vapor, pero sigue siendo H2O en ambos casos) − Cortar un trozo de papel (el papel solo ha cambiado de tamaño o forma) 1.6.2 Cambios químicos Un cambio químico ocurre cuando la materia se convierte en otra con propiedades químicas y físicas diferentes. Este tipo de cambio es llamado, también, reacción química. Ejemplos: − Electrólisis del agua (el agua se descompone en hidrógeno y oxígeno) − Quemar un trozo de papel (el papel, al quemarse, forma CO2 y H2O) − Encender una cocina a gas (el hidrocarburo, al quemarse, forma CO2 y H2O) Autoevalúate 3 1. Indica si los siguientes procesos corresponden a un cambio físico (F) o cambio químico (Q). a) b) c) d) e) f) g) h) i) j) Encender un fósforo Sancochar un trozo de carne Sublimación del yodo Disolución del zinc en ácido clorhídrico Electrólisis de una solución acuosa de NaCl Dilatación de un metal Evaporación de 10 mL de etanol Rotura de un tubo de ensayo Trituración de una piedra Corrosión de una tubería Unidad 1: Fundamentos de Química 11 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 1.7 MEDICIÓN DE LA MATERIA La materia tiene masa y, por lo tanto, puede ser medida según, por ejemplo, su área, volumen, tamaño, masa, etcétera. En cada caso, esta medición se hace en relación con un estándar particular o unidad, que debe especificarse junto con el valor numérico de la cantidad. Las unidades que se emplean en las mediciones científicas son las del sistema métrico. A lo largo de los años, se han utilizado varios sistemas de unidades. El sistema métrico actual de medidas empezó a ser utilizado en 1790 por la Asamblea Nacional de Francia, la que estableció estándares de unidades consistentes; no obstante, recién en 1960, con otro comité internacional reunido en el mismo país, se estableció el Sistema Internacional de Unidades (SI), que es el aceptado y utilizado hoy por la comunidad científica. 1.7.1 Sistema Internacional de Unidades (SI) En 1960, se llegó a un acuerdo internacional en el que se especificaba un grupo de unidades métricas para emplearse en las mediciones científicas. Las magnitudes físicas se dividen en dos categorías: básicas y derivadas. 1.7.1.1 Unidades básicas Una magnitud básica se define en términos de un estándar, y su correspondiente unidad es la unidad básica. El SI se basa en siete unidades fundamentales o unidades básicas, cada una de las cuales se proporciona en la tabla 1.5. Tabla 1.5 Magnitudes básicas del SI Magnitud física Unidad Abreviatura metro M Masa kilogramo Kg Tiempo segundo S kelvin K mol mol Intensidad de corriente eléctrica amperio A Intensidad luminosa candela Cd Longitud Temperatura Cantidad de sustancia A continuación, se describirán dos de las unidades básicas más usadas en química. Unidad 1: Fundamentos de Química 12 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Masa La masa es la medida de la cantidad de materia que hay en un objeto. En el SI, el patrón de masa es el kilogramo (kg), que es bastante grande para la mayoría de aplicaciones químicas, por lo que, más frecuentemente, utilizamos la unidad gramo (g). El dispositivo habitual para medir la masa de un objeto es la balanza. Temperatura La temperatura es una medida para establecer qué tan fría o caliente es una sustancia en relación con otra. Desde el punto de vista microscópico, la temperatura es una medida del grado de agitación molecular de una sustancia. El instrumento más común para medir la temperatura es el termómetro y las tres escalas de temperatura más importantes son la escala Celsius —antes llamada centígrada (°C)—, la kelvin o absoluta (K) y la Fahrenheit (°F). La unidad básica de temperatura en el SI es el kelvin y es la que se prefiere en todo trabajo científico. Las tres escalas difieren en el tamaño de la unidad o temperatura del punto cero. La figura 1.5 muestra los puntos de congelamiento y ebullición en las tres escalas. Figura 1.5 La temperatura de congelamiento y ebullición del agua en las escalas de temperatura Celsius, kelvin y Fahrenheit 1.7.1.2 Unidades derivadas Una cantidad derivada es toda aquella que se define en términos de las siete cantidades básicas. Por ejemplo, la rapidez se define como la razón entre la distancia recorrida y el tiempo que se toma en viajar dicha distancia. En la tabla 1.6, se mencionan algunas cantidades derivadas con sus respectivas unidades derivadas. Unidad 1: Fundamentos de Química 13 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Tabla 1.6 Magnitudes derivadas del SI Magnitud física Unidad Abreviatura Área metro cuadrado m2 Volumen metro cúbico m3 Densidad kilogramo por metro cúbico kg/m3 Fuerza newton N (kg m s-2) Presión pascal Pa (N m-2) Energía julio J (kg m2 s-2) A continuación, se describen dos de las unidades derivadas más usadas en química. Densidad La densidad (d) de un cuerpo es la razón de su masa y su volumen. La unidad de la densidad según el SI es kg/m3, pero, en química, la densidad es dada comúnmente en g/mL (g/cm3). Tabla 1.7 Comparación de la densidad de algunas sustancias Sustancia Agua Alcohol Mercurio Densidad (20 °C y 1 atm) 0,998 g/mL 1 mililitro pesa 0,998 g 0,789 g/mL 0,789 g 13,534 g/mL 13,534 g La densidad depende de la temperatura, porque el volumen cambia con la temperatura, mientras que la masa permanece constante. Ejemplos: − La densidad del agua a 4 oC es 1,000 g/mL; a 20 oC es 0,9982 g/mL. − La densidad depende, también, del estado de la materia; en general, los sólidos son más densos que líquidos y ambos más densos que los gases. Presión Unidad 1: Fundamentos de Química 14 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ La presión (P) se define como la fuerza ejercida por unidad de área. En unidades del SI, la presión está en unidades de N/m2 o pascal; sin embargo, se suelen utilizar otras unidades como atmósfera (atm), milímetro de mercurio (mmHg) o torricelli (torr). 1,013x105 Pa = 1 atm = 760 mmHg = 760 torr 1.7.2 Prefijo El SI es un sistema decimal y las magnitudes que difieren de la unidad básica, ya sean mayores o menores, en potencias de diez, se indican por medio de prefijos escritos antes de la unidad básica. La tabla 1.8 muestra la mayoría de estos prefijos importantes. Ejemplos: − El prefijo mili representa la fracción 10-3 de una unidad: un miligramo (mg) es 10-3 gramos; un milímetro (mm) es 10-3 metros. − El prefijo kilo representa 103 de una unidad: un kilómetro (km) es 103 metros. Tabla 1.8 Prefijos empleados en el SI Prefijo Exa Abreviatura E Múltiplo 1018 Tera T 1015 Peta P 1012 Giga G 109 Mega M 106 kilo K 103 Hecto h 102 Deca da 10 Deci d 10-1 Centi Mili c m 10-2 10-3 Micro Nano µ n 10-9 Pico p 10-12 Femto f 10-15 Atto a 10-18 10-6 1.7.3 Análisis dimensional Unidad 1: Fundamentos de Química 15 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ El análisis dimensional es una estrategia que nos ayuda a resolver problemas, en la que se utilizan unidades en todos los cálculos; con ello se asegura que las soluciones a los problemas tengan unidades correctas. La clave para usar el análisis dimensional es el empleo correcto de factores de conversión para transformar una unidad en otra. Un factor de conversión es una fracción cuyo numerador y denominador son la misma cantidad expresada en diferentes unidades. Lo utilizamos para eliminar la unidad dada y quedarnos con la unidad solicitada o deseada. En general, se tiene lo siguiente: Unidad dada x Unidad deseada = Unidad deseada Unidad dada Ejemplo: Expresa la cantidad de 20 g/cm3 en kg/m3. 20 g 1 cm3 10-3 kg x x = 20 x 103 kg/m3 cm3 10-6 m3 1g Autoevalúate 4 1. El radio atómico del cobre es de 128 pm. ¿Cuál es su diámetro en nanómetros? 2. La velocidad de la luz en el vacío es 2,998x108 m/s. ¿Cuál es la velocidad en km/h? 3. Los impulsos nerviosos viajan en el cuerpo a 400 ft/s. ¿Cuál es su velocidad en metros por minuto? Unidad 1: Fundamentos de Química 16 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. Indique si es verdadero (V) o falso (F) según corresponda I. La materia es todo aquello que se pueda percibir por nuestros sentidos. II. El agua potable es una mezcla homogénea. III. El nitrógeno del aire es un vapor a) b) c) d) e) FFV VFV VVF VVV FVF 2. En relación con una mezcla, indica verdadero (V) o falso (F). IV. I. II. III. No tiene fórmula. Su composición es definida. Es materia heterogénea. Es una sustancia química. a) b) c) d) e) VVFV VFFF VVFF FVVF VFFV 3. Identifica el número de elementos, el número de compuestos, la mezcla homogénea y la mezcla heterogénea, respectivamente, en las siguientes muestras: agua destilada, estaño, glucosa , amalgama, hidrógeno, mercurio, formol, aire, grafito, agua con mercurio, amoniaco, agua con gasolina, fósforo, etanol, y solución acuosa de azúcar. a) b) c) d) e) 4, 5, 4, 2 4, 4, 4, 3 5, 3, 5, 2 5, 4, 4, 2 5, 2, 4, 4 4. ¿Cuál de las siguientes alternativas solo contiene compuestos químicos? a) b) c) d) e) Cafeína - ácido cítrico - formol Leche - cloruro de sodio - agua Colesterol - acero - bromo Agua - celulosa - dióxido de carbono Gasolina - propano – clorofila Unidad 1: Fundamentos de Química 17 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 5. Dada la propiedad, indica si se refiere al estado sólido (S), líquido (L) o gas (G). I. Estado de agregación en el que las fuerzas de atracción entre partículas son muy débiles II. Estado de agregación con forma definida III. Estado de agregación con forma indefinida, pero con volumen definido a) b) c) d) e) L, S, G L, G, S G, S, L G, L S S, G, L 6. Señala cuáles de estas propiedades caracterizan al estado sólido según la teoría cinética. I. II. III. IV. V. Las partículas se mueven libremente. Las partículas están fijas. Las partículas están unidas débilmente. Las partículas están ordenadas formando una estructura cristalina. Tiene masa y volumen fijos. a) b) c) d) e) I, II, V II, IV, V I, II, IV I, IV, V II, III, V 7. Marque el enunciado incorrecto a) b) c) d) e) El elemento más abundante en el cuerpo humano es el oxígeno. Un compuesto es la combinación de dos o más elementos en proporciones definidas. En un cambio físico no varía la composición de la materia. El aire es un ejemplo de materia. Una mezcla heterogénea consta de una sola fase, llamada solución 8. La densidad del cobre es de 8960 kg/m3. ¿Cuál de las siguientes es la equivalencia correcta a esta cantidad? a) b) c) d) e) 89,6 g/mL 8,96 g/dm3 0,896 mg/L 8,96x10-6 kg/mL 8,96 g/mL Unidad 1: Fundamentos de Química 18 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 9. Indica si ha habido un cambio físico (F) o químico (Q) en los procesos mostrados a continuación. I. La escarcha que se forma al bajar la temperatura en una noche húmeda de invierno. II. El hierro de la chatarra de los coches que, lentamente, forma una frágil costra café rojiza. III. Cortar un leño. IV. Quemar un leño. V. Encender una cocina eléctrica. VI. Encender una cocina a gas. a) b) c) d) e) FFFQFF QFFQFQ QQFQQF FQFQFQ FQQFFQ 10. El etilenglicol, un anticongelante líquido, tiene una densidad de 1,11 g/mL a 20 °C. I. II. a) b) c) d) e) ¿Cuál es la masa en gramos de 450 mL de etilenglicol? ¿Cuál es el volumen en mililitros ocupado por 65,0 g de etilenglicol? 246,7 g; 58,6 mL 405,4 g; 58,6 mL 499,5 g; 72,2 mL 499,5 g; 58,6 mL 405,4 g; 72,2 mL Unidad 1: Fundamentos de Química 19 II. ESTRUCTURA ATÓMICA Y TABLA PERIÓDICA 2.1 ÁTOMOS, PARTICULAS FUNDAMENTALES 2.2 NOTACIÓN ATÓMICA 2.3 MODELOS ATÓMICOS 2.3.1 El átomo de Bohr y la radiación electromagnética 2.4 TEORÍA ATÓMICA MODERNA 2.5 CONFIGURACIÓN ELECTRÓNICA 2.6 LA TABLA PERIÓDICA Y LA CONFIGURACIÓN ELECTRÓNICA 2.7 PROPIEDADES PERIÓDICAS 2.7.1 El tamaño de los átomos 2.7.2 Energía de ionización EJERCICIOS INTEGRADORES Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ II. ESTRUCTURA ATÓMICA 2.1 ÁTOMOS, PARTICULAS FUNDAMENTALES Desde siempre, hubo interés por conocer la naturaleza de la materia. La comprensión a nivel microscópico es la base para entender por qué la materia presenta tantas y tan variadas propiedades físicas y químicas. Ya desde el siglo V a. C., Demócrito denominó átomos a lo que se consideraba que eran las partículas indivisibles más pequeñas que formaban la materia. En 1808, John Dalton describió el átomo como indivisible y formuló la primera teoría atómica que ha soportado el paso del tiempo. Estos son sus postulados: – Cada elemento se compone de partículas extremadamente pequeñas: los átomos. – Todos los átomos de un elemento son idénticos; tienen iguales tamaño, masa, y propiedades físicas y químicas. – En una reacción química, los átomos de un elemento no se transforman en átomos de otro elemento; solo cambian su distribución. – Cuando se combinan átomos de más de un elemento, lo hacen siempre en proporciones de masa definida y constante. Las evidencias e investigaciones experimentales a través del tiempo fueron confirmando estos postulados, y la teoría de Dalton resulta siendo válida hasta nuestros días. Una teoría científica es válida si explica satisfactoriamente las observaciones experimentales, pero nunca es definitiva; siempre se encuentra en permanente revisión. Una serie de investigaciones han ido demostrando que el átomo no es indivisible, sino que está formado por partículas aun más pequeñas denominadas partículas subatómicas. La lista de partículas subatómicas que se conocen actualmente consta de centenares de partículas, formadas por constituyentes más simples llamadas quarks, que interactúan entre ellos. Actualmente se cree que los quarks son los componentes más pequeños y, por tanto, son los considerados como las partículas elementales de la materia. Protones, neutrones y electrones Sin embargo, a pesar de que se sabe que no son «elementales», es usual hablar de protones, neutrones y electrones como partículas elementales debido a que estas son las responsables de las propiedades de los átomos. Las dos primeras se encuentran en el interior del núcleo y los electrones se hallan fuera del núcleo. Un átomo es neutro porque el número de protones es igual al número de electrones. Si observamos en la tabla 2.1, se verá que el protón y el neutrón tienen, aproximadamente, la misma masa, pues la diferencia es tan pequeña que resulta insignificante; sin embargo, la diferencia con la masa del electrón es muy significativa. Unidad 2: Estructura Atómica y Tabla Periódica 21 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Obsérvense las principales características de las partículas subatómicas en la tabla 2.1 Tabla 2.1 Principales características de las partículas subatómicas Partícula Símbolo Masa (g) Electrón Protón Neutrón ep n 9,109x10-28 1,6726x10-24 1,6749x10-24 Carga (unitaria) -1 +1 0 ¿Cuántos electrones serán necesarios para tener una masa equivalente a la masa de un protón o del neutrón? Serían necesarios 1837 electrones para tener una masa equivalente a la masa de un solo protón o neutrón; entonces, la masa de los electrones equivale a una fracción insignificante en relación con la masa de un átomo. Ahora, si analizamos los valores en gramos de las masas de estas partículas subatómicas, notaremos lo pequeñas que son. Dado que las masas son tan pequeñas, en la práctica, resultaría muy engorroso tanto pesar esas cantidades (no existen balanzas capaces de pesar masas tan pequeñas) como manejar esas cantidades, por lo que se trabaja con masas atómicas relativas. Puesto que la masa del electrón es despreciable comparada con la de los protones y neutrones, podemos considerar que la masa de un átomo viene dada por la suma de sus neutrones y protones. En realidad, las partículas que tienen masa (neutrones y protones) se encuentran empaquetadas en el centro del átomo en un núcleo diminuto (de diámetro aproximado 1x10-15 m), mientras que los electrones se mueven alrededor del núcleo en regiones definidas denominadas orbitales (los estudiaremos más adelante) . Ahora bien, ¿cómo será la densidad del átomo respecto de la de su núcleo? Si prácticamente toda la masa se encuentra concentrada en el núcleo, y este representa una parte diminuta del átomo, en consecuencia la densidad del núcleo será extremadamente grande en relación con la del átomo. Para darnos una idea, podemos imaginar el sistema solar, donde el Sol es el núcleo y los planetas serían los electrones que giran alrededor, o podemos pensar en un estadio de fútbol, en el que la pelota colocada en la mitad de la cancha representa al núcleo del átomo. Los átomos son extremadamente pequeños para ser vistos. Recién a mediados de los años 80, se obtuvieron imágenes reales de átomos en la superficie de ciertos materiales. Figura 2.1 Átomo de xenón sobre una superficie metálica La imagen fue tomada con un microscopio especial denominado de efecto túnel. Fuente: http://www.tic3tac.com/cuantica_cap_3.htm (consulta: 7 de julio de 2008) Unidad 2: Estructura Atómica y Tabla Periódica 22 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ El xenón es un elemento químico cuyo símbolo es Xe. Es un gas noble muy pesado e incoloro, presente en la atmósfera terrestre en muy pequeñas cantidades. Autoevalúate 1 Observa los datos en la tabla 2.1 y contesta lo siguiente: 1. Los átomos son eléctricamente neutros; entonces, ¿cómo deberá ser el número de protones respecto del de electrones? 1. Observa el valor de la masa del protón y el del electrón. Determina la relación entre ellos. ¿Cómo es la masa del protón respecto de la del electrón? 2. ¿Cuál será la masa promedio para una especie Y que contiene 12 protones, 13 neutrones y 12 electrones? 2.2 NOTACIÓN ATÓMICA La masa de un átomo depende del número de partículas que contenga. Todos los átomos pueden identificarse por el número de protones en el núcleo: este es su número atómico. Este dato constituye su identidad. Notación atómica A Z X , donde: Z = Número atómico: Nº de protones A = Número de masa: N° de protones + N° de neutrones X = Símbolo del elemento Así, por ejemplo, todos los átomos de oxígeno tienen 8 protones; entonces, el número atómico del oxígeno es 8. No existen cantidades fraccionadas de protones, solo números enteros. En la tabla periódica, los elementos se encuentran ordenados de acuerdo con su número atómico. Por ejemplo, observemos el Li: – ¿Cuál es el número de protones de ese átomo? El número de protones es 3. – Si tiene 4 neutrones, ¿cuál es el número de masa? El número de masa sería el siguiente: p + n = 3+4 = 7 – ¿Cuál es la carga eléctrica del elemento? La carga eléctrica total es cero, puesto que el número de electrones es igual al número de protones. Isótopos En la tabla periódica, cada elemento aparece con un valor de masa que también se conoce como peso atómico, pero esta masa atómica tiene, generalmente, valores con decimales. Lo que sucede es que la masa atómica de un elemento es, en realidad, el promedio de las masas de todos sus isótopos naturales en las proporciones en las que existen en la naturaleza. Unidad 2: Estructura Atómica y Tabla Periódica 23 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Entonces, ¿qué son isótopos? Todos los átomos de un elemento tienen igual número de protones (igual Z), pero no tienen el mismo número de neutrones. Estos átomos que tienen de un mismo elemento que poseen diferentes masas se llaman isótopos. Así, tenemos que el Cu presenta dos isótopos naturales: – – 63 65 Cu con una abundancia de 69,2% y una masa de 62,9296 uma Cu con una abundancia de 30,8% y una masa de 64,9278 uma La mayor parte de elementos tienen varios isótopos. Se trata del mismo elemento, pero con una diferencia mínima en la masa; por lo tanto, las propiedades físicas y químicas serán muy semejantes. Veamos el siguiente caso: ¿las notaciones 167 X y 147 X corresponden al mismo elemento? Difieren en el número de neutrones, pero tienen el mismo número de protones, por lo que corresponden al mismo elemento. En medicina, el uso de isótopos está muy extendido. El Co-60 se emplea en el tratamiento del cáncer por radio terapia; el I-131 se emplea en el tratamiento del cáncer de tiroides y para medir la actividad del hígado; el C-14 se utiliza para datar muestras. Autoevalúate 2 1. Indica el número de neutrones, protones y electrones en cada una de las especies químicas siguientes: 84 38 66 30 Sr 127 53 Zn I 2. Dado un átomo con 10 electrones, 10 protones y un número de masa de 22: a) b) c) d) ¿Cuál es la carga eléctrica del átomo? ¿Cuántos neutrones tiene? ¿Cuál es el número atómico? Representa simbólicamente al elemento. 25 3. Si se tiene un elemento con la representación 12 X y este pierde 2 electrones, ¿cuál será su composición atómica y su representación? 4. ¿Cuál será la representación de la especie X que contiene 24 protones, 26 neutrones y 26 electrones? 5. El Fe-59 radioactivo se usa para medir la rapidez de formación y la duración de los glóbulos rojos. a) Indica el número de protones, neutrones y electrones del elemento. b) Represéntalo en la forma Z A X. 6. En la siguiente relación de elementos, selecciona aquellos que correspondan a isótopos. 10 5 X 118 50 X 11 5 X Unidad 2: Estructura Atómica y Tabla Periódica 119 50 X 10 4 X 118 51 X 24 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 2.3 MODELOS ATÓMICOS El primer modelo de átomo propiamente dicho corresponde a Dalton. Diferentes elementos están formados por distintos átomos, de modo tal que el compuesto químico es la combinación de dos o más elementos. Esa combinación se hace siempre en proporciones fijas de masa. Figura 2.2 Elementos y compuestos según el modelo de Dalton En 1897, con el descubrimiento del electrón, Joseph John Thomson determinó que la materia se componía de una parte positiva (protones) y otra negativa (electrones). Propuso un modelo en el que el átomo se semejaba a un pastel con pasas (un «pudín de pasas»). El número de cargas positivas era igual al de cargas negativas, de modo que, al perder o ganar electrones, el átomo se cargaba ya fuera positiva o negativamente. Este modelo no explicaba la existencia de otro tipo de radiaciones. Figura 2.3 Átomo según el Modelo de Thomson Con los resultados de su experimento en 1911, Ernest Rutherford propuso un modelo en el que los átomos no eran macizos, sino que estaban vacíos en su mayor parte. Postula que la parte positiva se concentra en un núcleo; por lo tanto, este último representa prácticamente la masa de los elementos, mientras que los electrones (en igual número que los protones) giran alrededor del núcleo en órbitas circulares o elípticas. Rutherford predijo la existencia del neutrón en 1920, aunque recién en 1932 J. Chadwick descubre el neutrón, poseedor de una masa muy parecida a la del protón. El átomo de Rutherford aún presentaba muchas incongruencias con los datos experimentales; sobre todo, contradecía las leyes del electromagnetismo, que pronosticaban que una carga eléctrica en movimiento (electrón) debería emitir energía constantemente en forma de radiación, por lo que llegaría un momento en que el electrón caería sobre el núcleo. Unidad 2: Estructura Atómica y Tabla Periódica 25 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Niels Bohr, tomando como punto de partida el átomo de Rutherford, aplica la hipótesis cuántica de Planck y desarrolla la teoría de la cuantización de la energía, cuyos postulados son los siguientes: – Los electrones giran alrededor del núcleo en niveles bien definidos y dichos niveles albergan un número limitado de electrones. – Las órbitas están cuantizadas: tienen determinado valor de energía, que crece según se aleja del núcleo. – Los electrones no irradian energía cuando permanecen en su órbita. – Los electrones pueden saltar de una a otra orbita. Si el salto es de una órbita mayor a una menor, irradia energía; no obstante, si es de menor a mayor nivel, absorbe energía. Figura 2.4 Modelo de Bohr, que muestra los niveles energéticos (órbitas cuantizadas) Orbitas para n = 1,2 y 3 en aumento de tamaño Fotón emitido con E = h υ El modelo de Bohr explica el espectro de emisión del hidrógeno y de átomos con solo un electrón, pero falla cuando se aplica a átomos con más electrones. En 1924, Louis Victor de Broglie propuso la naturaleza ondulatoria de la materia y, luego, en 1926, propone el modelo de átomo actual, en el que los electrones no son esferas que giran alrededor del núcleo; en contraste, se describe a los electrones como una función de onda (función matemática), lo que significa una zona de probabilidad en el espacio o una región delimitada en el espacio, que se conoce como orbital. Entonces, se tiene lo siguiente: Orbital: zona de alta probabilidad en el espacio donde es posible encontrar al electrón. 2.3.1 El átomo de Bohr y la radiación electromagnética Debemos recordar que los electrones, en el átomo, están confinados a determinados niveles de energía y que mientras permanecen en esos niveles ni irradian ni absorben energía. Unidad 2: Estructura Atómica y Tabla Periódica 26 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ El nivel 1 es el de menor cantidad energética ya que es el más próximo al núcleo. Para que los electrones puedan pasar de un nivel a otro se requiere transferir energía. La energía involucrada en esos saltos esta tiene valores determinados (está cuantizada) Mover un electrón de uno a otro nivel implica un valor mínimo de energía o un múltiplo de ese valor de energía. La energía que se transfiere es de naturaleza luminosa, el átomo puede emitir o absorber luz. La luz tiene naturaleza dual (se comporta como partícula y como onda electromagnética). A las unidades o partículas capaces de comportarse de manera dual las llamamos fotones. Puesto que la materia tiene propiedades ondulatorias, todo material emite radiación electromagnética. Ahora bien, ¿qué significa que un fotón se comporte como onda electromagnética?, ¿qué es una onda electromagnética? – Una onda electromagnética es una vibración que se propaga a través del espacio. Sin embargo, a diferencia de las ondas mecánicas —por ejemplo, las que se forman en el agua al caer una piedra—, no requieren un medio material para propagarse. – Las ondas electromagnéticas, que transportan la energía, incluyen velocidad, longitud de onda, amplitud y frecuencia. La distancia entre dos crestas o valles se denomina longitud de onda (λ) y se mide en nanometros, nm, siendo : 1m = 109 nm. La frecuencia (ν) de la onda está determinada por las veces que ella corta la línea de base en la unidad de tiempo (casi siempre medida en segundos), esta frecuencia es tan importante que las propiedades de la radiación dependen de ella y está dada en Hertz (ciclos por segundo). Figura 2.5 Frecuencia y longitud de una onda electromagnética Longitud de onda larga y baja frecuencia. Longitud de onda corta y alta frecuencia. – Si observamos, la radiación electromagnética de alta frecuencia tendrá baja longitud de onda y la de baja frecuencia gran longitud de onda. Las radiaciones con mayor energía; esto es, con mayor frecuencia son de naturaleza ionizante y por tanto más dañinas. Debido a la dualidad onda-partícula, cada fotón (partícula de luz) tiene asociada una energía proporcional a la frecuencia de la onda, dada por la ecuación de Planck. Efotón = h = עhc/ λ Unidad 2: Estructura Atómica y Tabla Periódica 27 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Donde h = 6,625x10-34J s La frecuencia se expresa en ciclos por segundo, que se llaman, también, hertz (Hz). Suelen darse «por segundo», lo que se denota s-1. Mucho de lo que se conoce en la actualidad acerca de la estructura de los átomos proviene del análisis de la luz emitida o absorbida por las sustancias. La energía proveniente de los átomos se transporta a través del espacio a la velocidad de la luz. La ecuación de Planck describe la estrecha relación entre la energía de los fotones y la radiación luminosa correspondiente. Hay muchos tipos de radiación, dependiendo de la longitud de onda. La radiación electromagnética recibe diferentes nombres, desde los rayos gamma, pasando por la luz visible, hasta las ondas de radio. El rango completo de longitudes de onda es el espectro electromagnético. La luz visible corresponde a longitudes de onda entre 400 y 700 nm, de modo tal que es una porción muy pequeña del espectro electromagnético. Nosotros podemos percibir los colores por causa de las reacciones químicas que la luz causa en nuestros ojos. Dentro de la luz visible, el violeta es el que tiene la mayor energía. Figura 2.6 Longitudes de onda de la radiación electromagnética. Distintas regiones del espectro electromagnético Nótese la relación inversamente proporcional entre longitud de onda y la frecuencia de la radiación. A mayor frecuencia, mayor energía, y la radiación es más penetrante o dañina. Así, un fotón de luz UV tiene mayor energía que un fotón de luz roja. Unidad 2: Estructura Atómica y Tabla Periódica 28 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 2.7 Espectro visible El color se puede expresar cuantitativamente por su longitud de onda. Ejemplo: Una lámpara de vapor de sodio que se usa para iluminación pública tiene una longitud de onda de 590 nm. ¿Cuál es la frecuencia de la radiación? Si c = λ ע c = 3x108 m/s = 590 nm × ⇒ 10−9 m ν nm υ = 5, 08 ×1014 s −1 Autoevalúate 3 1. ¿Cuál será la carga de un átomo si perdiera un electrón? 2. Describe cuáles crees que fueron las contribuciones fundamentales de los modelos atómicos de Thomson y Rutherford. 3. ¿Qué se entiende por teoría cuántica? 4. Explica qué significa que la luz tiene comportamiento dual. 5. ¿Cuál es la longitud de onda de una radiación de 1230 Hz? 6. Explica cuál fotón será más energético, aquel con una longitud de onda igual a 780 nm u otro con 460 nm? Deduce a qué región del espectro pertenecen. 7. Explica cuál radiación crees que pueda ser más dañina al ser humano: ¿los rayos infrarrojos o las ondas de radio? 8. ¿Qué color de la luz visible tiene la frecuencia más alta? 9. Indica, en las siguientes transiciones, cuál de ellas emite energía y cuál absorbe. n = 3 a n = 1 y de n = 2 a n = 4. Unidad 2: Estructura Atómica y Tabla Periódica 29 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 2.4 TEORÍA ATÓMICA MODERNA La teoría de De Broglie (propiedades ondulatorias del electrón) y el principio de incertidumbre de Heisenberg prepararon el terreno para la teoría atómica moderna. El resultado es una teoría que describe la energía del electrón con precisión y describe, también, su ubicación en términos de probabilidades: esta es la mecánica cuántica. Una de las limitaciones del modelo de Bohr es que este supone que la ubicación y la energía de un electrón pueden ser conocidas con exactitud en cualquier instante. Esto es falso, debido a que son muy pequeños y están en continuo movimiento .Por esta razón, no es posible determinar la posición y la energía de un electrón al mismo tiempo. Principio de incertidumbre de Heisenberg: es imposible conocer simultáneamente la posición (momentum) del electrón y su posición exacta en el espacio. En 1926, Erwin Schorödinger propuso una ecuación conocida como función de onda, cuya resolución ofrece una forma de visualizar la estructura atómica. Para el caso del átomo de hidrógeno, esta teoría coincide con la de Bohr, pero, en el modelo de la mecánica cuántica, se habla, más bien, de la probabilidad de que el electrón esté en determinada región del espacio en determinado momento. A esta región en el espacio se denomina orbital. La solución de la ecuación de Schorödinger produce el conjunto de funciones que se denominan orbitales. Se debe recordar que cada orbital describe una distribución espacial de densidad electrónica. Figura 2.8 Orbital 1s (la envoltura es una esfera) y X Z La forma de representar la probabilidad (orbital) de encontrar a un electrón se define como densidad electrónica. Así, la distribución para la densidad electrónica en el átomo de hidrógeno corresponde a una esfera. Cada subnivel tiene un número definido de orbitales, donde se encuentran los electrones. Cada orbital puede contener, como máximo, dos electrones. A diferencia del modelo de Bohr —que introdujo un único número cuántico, n, para describir una órbita—, el modelo de mecánica cuántica emplea tres parámetros (números cuánticos n, l y m) para describir un orbital (no puede describir órbitas, pues no es posible medir, con precisión, el movimiento del electrón). Para el nivel n = 3, tenemos, en la figura 2.14, la representación de los orbitales: Unidad 2: Estructura Atómica y Tabla Periódica 30 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 2.9 Distribución de densidad electrónica o representación de orbitales posibles para el nivel 3 Fuente: http://www.uhu.es/quimiorg/imagenes/orbitales.jpg (consulta: 7 de julio de 2008) 2.5 CONFIGURACIÓN ELECTRÓNICA La configuración electrónica expresa la secuencia en que los electrones se ubican en los orbitales de un átomo. A la vez, especifica los niveles y subniveles ocupados, y su número de ocupación. Las propiedades físicas y químicas de los elementos dependen, fundamentalmente, de su configuración electrónica. Para escribir la configuración electrónica de un elemento, se deberán seguir las reglas que se presentan a continuación. Figura 2.10 Energía relativa y orden en el cual se llenan los subniveles según la regla de Aufbau El principio de Aufbau es una regla que permite determinar el orden de llenado de los orbítales. (Se conoce, también, como regla del serrucho). Según esta regla, siguiendo las diagonales de arriba a abajo (véase la figura 2.13), se obtiene el orden de energía de los orbitales y su orden consecutivo. Unidad 2: Estructura Atómica y Tabla Periódica 31 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ La regla de Hund señala que los orbitales de igual energía (orbitales con igual valor de n y l) se llenan de manera que exista el mayor número posible de electrones desapareados. 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d ………….. Menor energía (más cerca del núcleo) Mayor energía (más lejos del núcleo) Ejemplo1: Llénese la configuración electrónica para 3Li. Su configuración electrónica será 1s2 2s1. Dos electrones en el nivel 1s, el orbital está lleno con un par de electrones y un solo electrón en el nivel 2s; el orbital está semilleno. Ejemplo 2: Para llenar la configuración de un elemento: 13X: 1s2 2s2 2p63s2 3p1 1s2 2s2 2p63s2 3p4 16Z: En el caso 16Z, para llenar los orbitales 3p ubicados en el mismo nivel energético: Es correcto: (máximo número de e- desapareados) Es incorrecto: En este caso, tenemos tres niveles; 1, 2 y 3. En el nivel 2 y 3, tendremos dos subniveles o subcapas, s y p. En el primer nivel, hay dos electrones; ocho en el segundo nivel; y seis electrones en el tercer nivel. El último nivel es el llamado nivel de valencia (nivel de energía más externo). Los electrones en este nivel son los electrones de valencia y tienen una gran importancia, pues son los que participan en las reacciones. Dentro de la configuración electrónica, llamamos electrón diferenciador al último electrón de la secuencia. Ejemplo: Para el átomo de azufre, determínese la configuración electrónica, el nivel y los electrones de valencia e indíquese el electrón diferenciador. – Configuración electrónica para 16S: 1s22s22p63s23p4 – Nivel de valencia: último nivel con electrones es 3. Unidad 2: Estructura Atómica y Tabla Periódica 32 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ – Electrones de valencia: en el nivel 3, se cuenta con 6 electrones (2 en orbital s y 4 en orbítales p). – Electrón diferenciador: 4 e- en el último subnivel. Entonces: ↑↓ ↑ ↑ El electrón diferenciador será el encerrado en el círculo. Autoevalúate 4 1. Predice el número de subcapas para n = 3. Además, identifica los orbítales en cada subcapa. 2. El fósforo es un elemento importante en el nivel molecular de la vida. Escribe su configuración electrónica. 3. Respetando la regla de Hund y el principio de Aufbau, escribe la configuración electrónica para los siguientes elementos: 15X, 7Y, 13Z, 19W, 5M, 11R, 6S, 1T, 18U, 4V 4. Selecciona la posibilidad incorrecta. Unidad 2: Estructura Atómica y Tabla Periódica 33 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 2.6 TABLA PERIÓDICA Hacia 1860, la confusión era aún muy grande; no había un consenso y cada uno utilizaba su propia regla para formular y nombrar compuestos. El ruso Mendeleiev, el padre de la «clasificación periódica» de los elementos, presentó su tabla periódica en 1872, con vacíos que se fueron llenando con los elementos faltantes según se descubrían. Una de las primeras observaciones de Mendeleiev fue que el punto de ebullición de los elementos no crecía dependiendo exclusivamente de la masa atómica, sino que lo hacía en ciclos que fluctuaban en relación con los números atómicos. La clave son los niveles exteriores o niveles principales en el átomo, con la numeración más alta y que contenga electrones. Figura 2.11 Temperatura de ebullición de los 10 primeros elementos de la tabla periódica Las propiedades de los elementos del 1 al 20 presentan fluctuaciones periódicas según el número atómico. En la figura, se muestra la temperatura de ebullición frente al número atómico. La tabla periódica es, entonces, un formato en el que se presentan todos los elementos que existen en la naturaleza, tanto naturales como creados artificialmente, ordenados de acuerdo con sus números atómicos. Figura 2.12 Formato de la Tabla periódica Unidad 2: Estructura Atómica y Tabla Periódica 34 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ El resultado es una serie de filas (periodos) y columnas (grupos), pero ¿cuál es su utilidad?, ¿qué significa?, ¿cuál es la estructura de los átomos que hace posible un grupo o familia de estos y que tengan propiedades semejantes? Estas y otras interrogantes serán abordadas a continuación. 2.7 PROPIEDADES PERIÓDICAS A las filas las llamamos periodos; a las columnas, grupos. Hay grupos que tienen sus propios nombres. Ejemplos: – Grupo I: metales alcalinos – Grupo II: metales alcalinos térreos – Grupo VII: halógenos – Grupo VIII: gases nobles La numeración de un grupo puede ser IA o 1A. Como se ve, existen diversas notaciones; utilizaremos la primera. Los elementos que pertenecen al mismo grupo se comportan químicamente de manera similar. De hecho, los elementos de un grupo o familia determinada presentan propiedades muy semejantes, a excepción del hidrógeno y el helio. Por ejemplo, los elementos del grupo IA (metales alcalinos) reaccionan violentamente con el agua, son muy maleables, sus sales son muy solubles en agua, etcétera. Ahora bien, ¿qué es lo que hace que los elementos de un grupo tengan propiedades semejantes? El responsable de las propiedades similares es el llamado electrón diferenciador (último electrón en la secuencia de llenado). Si analizamos el electrón diferenciador en los elementos de un grupo, encontramos ciertas analogías. Así, si examinamos el último electrón de los elementos del grupo IA, encontramos lo siguiente: 1s1 2s1 3s1 4s1 5s1 6s1 para H para Li para Na para K para Rb para Cs En conclusión, en una familia de elementos representativos, los átomos de todos los miembros tienen la misma configuración electrónica en su nivel exterior. Los grupos IA y IIA terminan en orbitales s, los grupos B en orbitales d, los grupos del IIIA al VIIIA en orbitales p y las filas inferiores en orbitales f. Se llama elementos representativos a los grupos A; a los grupos B se les conoce como elementos de transición; por último, los renglones fuera de la tabla, o grupos f, son los elementos de transición interna. Unidad 2: Estructura Atómica y Tabla Periódica 35 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Periódico significa la repetición de algo en forma regular. Así, muchas de las propiedades de los elementos varían periódicamente con sus números atómicos. La tabla periódica organiza los elementos para mostrar sus propiedades periódicas. La configuración electrónica es la base de la organización de la tabla periódica. Al observar los niveles exteriores, familia por familia, se notan las coincidencias. De la misma forma, tal como se describió para el grupo IA, los elementos que pertenecen al mismo grupo o familia tienen igual número de electrones en su último nivel (nivel exterior). Todos los elementos del grupo IA tienen un electrón de valencia: un electrón s. Mientras tanto, todos los elementos del grupo IIA tienen dos electrones de valencia. Los elementos de los grupos IIIA, IVA, VA, VIA, VIIA y VIIIA tienen de uno a seis electrones en el último subnivel p, y lo mismo sucede con los que pertenecen a los bloques d y f. Figura 2.13 Localización en la tabla periódica de los metales, no metales y metaloides Los metales y los no metales están separados en la tabla. La mayoría de elementos son metales. Los grupos IA son los metales alcalinos, IIA los alcalinotérreos, los metales del centro de la tabla se denominan de transición, todos los gases nobles y el grupo de los halógenos (VIIA) son no metales y unos pocos elementos a lo largo de la región entre metales y no metales se conocen como metaloides y tienen propiedades que son parte metálica y parte no metálica. Si se compara la posición en la tabla con la configuración electrónica veremos que el conjunto de elementos del mismo grupo al tener el mismo número de electrones en su último nivel formaran compuestos con formulas similares y por lo tanto tienen al menos algunas propiedades muy semejantes. Así, por ejemplo, se sabe que los metales alcalinos forman compuestos llamados hidróxidos con formula general MOH y todos son sustancias muy cáusticas. De manera similar, todos los halógenos forman compuestos binarios con el H cuya fórmula común es HX (X puede ser F, Cl, Br o I) y que son ácidos muy corrosivos. Unidad 2: Estructura Atómica y Tabla Periódica 36 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 5 1. Sin consultar la tabla periódica, supón la siguiente configuración electrónica: 1s22s22p63s23p63d64s2. a) Explica si se puede saber si se trata de un elemento representativo. b) ¿Cuál es el número de electrones en su nivel exterior y cuántos electrones hay en él? c) ¿El elemento es un metal o un no metal? ¿Cómo puedes saberlo? 2. En el siguiente diagrama, se presenta una sección de la tabla periódica con símbolos hipotéticos, en la que los números representan los valores de Z y A Z Símbolo A a) b) c) d) 7 X 33 8 Y 34 9 Z 35 10 W 36 De los elementos mostrados, ¿cuáles pertenecen a la misma familia o grupo? ¿Qué elementos, si los hay, están en el mismo periodo que W? ¿Cuáles de los elementos son gases nobles? De los elementos representados, ¿cuáles son metales y cuáles no metales? 2.7.1 El tamaño de los átomos El tamaño de un átomo depende de la fuerza con la que el núcleo es capaz de atraer a sus electrones más externos (último nivel de valencia). ¿Qué sucede con el tamaño? ¿En qué sentido aumenta o disminuye en los grupos? Las tendencias en el tamaño atómico se pueden resumir así: dentro de cada grupo, el tamaño aumenta a medida que los electrones ocupan niveles de energía más altos. Sin embargo, el tamaño disminuye a medida que se incluye una mayor cantidad de electrones si se trata de un nivel específico. La explicación es que, según aumenta el número de electrones, lo hace también la carga nuclear (el número de protones en el núcleo); por tanto, una mayor carga positiva atraerá más cerca a la nube electrónica (negativa). Dentro de un grupo: el tamaño atómico aumenta con el número atómico. Dentro de un periodo: el tamaño atómico tiende a disminuir conforme el número atómico aumenta. Figura 2.14 Tendencias generales del tamaño atómico Unidad 2: Estructura Atómica y Tabla Periódica 37 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Los elementos pueden ganar o perder electrones, con lo que pierden su neutralidad, pero sin alterar su identidad. Un ion es un átomo con carga eléctrica. Cuando los átomos ceden electrones, forman iones positivos o cationes; cuando reciben electrones, forman iones negativos o aniones. – Cuando pierden electrones, el radio del ion resultante disminuye considerablemente su tamaño. Analicemos el caso del sodio con 11 protones y once electrones; al perder un electrón, queda una carga nuclear de +11 protones que, ahora, atraerá a sus 10 electrones con mayor fuerza. Na 11 protones (+11) 11 electrones (-11) 0 + Na 11 protones (+11) 10 electrones (-10) +1 – Cuando ganan electrones, el radio del ion resultante aumenta su tamaño; esta vez, la carga positiva en el núcleo es menor que la carga negativa que deberá atraer, por lo que la intensidad con la que los atrae disminuye y el tamaño aumenta considerablemente. Cl 17 protones (+17) 17 electrones (-17) 0 Cl-1 17 protones (+17) 18 electrones (-18) -1 Se denominan iones isoelectrónicos cuando los iones tienen el mismo número total de electrones. Comparemos el tamaño entre un ion Na+ y un ion F-. Ambos tienen 10 electrones, pero el sodio tiene 11 protones en su núcleo, mientras que el F tiene 9; es de esperar que el ion sodio, por su carga, tenga un radio más pequeño en comparación con el ion fluoruro. Se puede hacer la siguiente generalización: En los iones isoelectrónicos, el radio decrece a medida que aumenta la carga nuclear positiva. Ejemplo 1: Compara el tamaño de un ion Cl- con el de un ion potasio K+. Son isoelectrónicos; ambos tienen 18 electrones. Sin embargo, el potasio tiene 19 protones en su núcleo, mientras que el cloro cuenta con 17. Debido a la mayor carga positiva en el núcleo de potasio, es de esperar que este ion resulte el más pequeño. Unidad 2: Estructura Atómica y Tabla Periódica 38 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Ejemplo 2: Determina qué será más grande: el ion de potasio o un átomo de potasio. El potasio, al pertenecer al grupo I, tiene un electrón en su último nivel (4s); tiende a formar cationes, por lo que su ion tendrá una mayor carga positiva en el núcleo y, en consecuencia, el ion tendrá un menor tamaño que el átomo neutro. Autoevalúate 6 1. Ordena los átomos e iones siguientes de mayor a menor tamaño: a) Mg+2, Ca+2 y Ca b) S-2, S y O-2 2. Explica las variaciones siguientes en los radios atómicos o iónicos: a) I- > I > I+ b) Ca+2 > Mg+2 > Be+2 3. De las siguientes series, determina las especies isoelectrónicas: a) 19K + , 20Ca+2 y 37Rb+ b) 16S-2, 34Se-2 y 18Ar c) 26Fe+2, 27Co+3 y 25Mn+2 2.7.2 Energía de ionización Para extraer un electrón de un átomo neutro, es necesario suministrar cierta energía. Definimos a la energía de ionización (EI) como la energía necesaria que debe suministrarse a un átomo para poder arrancar un electrón. X + energía → X+ + 1e- Esta energía se conoce como primera energía de ionización (EI). Se requiere más energía en caso de que se extraigan electrones sucesivos. Esta energía está relacionada con el tamaño del átomo, en general, los átomos más pequeños tendrán mayores energías de ionización. La facilidad con la que los electrones se pueden extraer de un átomo es un indicador importante del comportamiento químico del elemento. Cuanto mayor sea la energía de ionización, es más difícil extraer un electrón. La segunda energía de ionización es la energía requerida para quitar un segundo electrón, y así sucesivamente; entonces, EI(1) < EI(2) < EI(3), etcétera. Conforme nos movemos en la tabla periódica, las tendencias importantes serán las siguientes: – En los periodos, generalmente, aumenta al incrementarse el número atómico. – En los grupos, generalmente, disminuye al incrementarse el número atómico. Unidad 2: Estructura Atómica y Tabla Periódica 39 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ – En general, para los metales de transición, aumentan lentamente de izquierda a derecha, mientras que en el bloque f muestran variaciones muy pequeñas. Figura 2.15 Tendencia periódica de la energía de ionización En forma general, se pueden apreciar las tendencias en el comportamiento de la energía de ionización. Unidad 2: Estructura Atómica y Tabla Periódica 40 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. La afirmación «Al reaccionar dos elementos químicos para formar un compuesto, lo hacen siempre en la misma proporción de masas» corresponde a a) b) c) d) e) la teoría atómica de Dalton. el modelo atómico de Thomson. el modelo atómico de Rutherford. el modelo atómico de Bohr. la teoría atómica moderna. 2. ¿En qué se diferencian los isótopos del oxígeno-16, oxígeno-17 y oxígeno-18? a) b) c) d) e) En el número de protones En el número de neutrones En el número de masa En el número de electrones Ninguna de las anteriores 3. El argón (Ar) de número atómico 18 tiene en su capa externa o nivel de valencia un número de electrones igual a: a) b) c) d) e) 2 electrones 8 electrones 18 electrones 10 electrones Ninguna de las anteriores 4. De las siguientes configuraciones electrónicas, ¿cuál le corresponde al 29Cu? a) 1s22s22p63s23p63d104p1 b) 1s22s22p63s23p63d104s2 c) 1s22s22p63s23p64s104p2 d) 1s22s22p63s23p64s104p2 e) Ninguna de las anteriores 5. ¿Cuál es el color que corresponde a una radiación de 700 nm? a) Rojo b) Violeta c) Azul d) Verde e) Amarillo 6. Dados los elementos A (Z = 5), B (Z = 13) y C (Z = 31), se puede afirmar que a) b) c) d) e) pertenecen al mismo grupo. C pertenece al segundo grupo. A es un metal. pertenecen al mismo periodo. B pertenece al cuarto periodo. Unidad 2: Estructura Atómica y Tabla Periódica 41 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 7. La configuración electrónica de Y+2 es 1s22s22p63s23p6. Respecto a Y, se puede afirmar que a) b) c) d) e) pertenece al periodo 6. tiene dos electrones de valencia. es un gas noble. tiene seis electrones de valencia. ninguna de las anteriores. 8. El elemento Z es un metal alcalino del cuarto periodo, el enunciado verdadero es: a) b) c) d) e) Es un elemento representativo. Es un metal de transición. Tiene mucha facilidad para ganar electrones. Tiene mucha facilidad para formar aniones. Ninguna de las anteriores 9. Analiza la siguiente información y reconoce aquella falsa. a) b) c) d) e) La tabla periódica es un formato ordenado por los números de masa. La configuración electrónica expresa la secuencia en que los electrones se ubican en un átomo. La tabla periódica organiza los elementos de modo que muestra las propiedades periódicas. La mayoría de elementos son metales. Los metales y los no metales están separados en la tabla periódica. 10. Dados los elementos Cl, Cs, Br, Zn, C y Sn, marca la alternativa correcta. a) b) c) d) e) Los elementos Cs, Zn C y Cl tienen tendencia a formar iones positivos. Entre Zn y Cs, existe mayor tendencia a formar iones negativos. Cl y Br tienen facilidad para formar aniones. Cl prefiere formar aniones; por eso, pierde dos electrones. Ninguna de los anteriores Unidad 2: Estructura Atómica y Tabla Periódica 42 III. FUERZAS MOLECULARES 3.1 SIMBOLOGÍA DE LEWIS Y REGLA DEL OCTETO 3.2 ENLACE QUÍMICO 3.2.1 Enlace iónico 3.2.2 Enlace covalente 3.2.3 Enlace metálico 3.3 ELECTRONEGATIVIDAD Y POLARIDAD DE LOS ENLACES 3.4 PROPIEDADES DE LOS COMPUESTOS SEGÚN SUS ENLACES 3.4.1 Propiedades de los compuestos iónicos 3.4.2 Propiedades de los compuestos covalentes 3.4.3 Propiedades de los compuestos con enlace metálico 3.5 FUERZAS INTERMOLECULARES 3.5.1 Dipolaridad 3.5.1.1 Dipolaridad permanente 3.5.1.2 Dipolaridad inducida o instantánea 3.5.2 Fuerzas de dispersión de London 3.5.3 Fuerzas dipolo – dipolo 3.5.4 Puentes de hidrógeno 3.5.5 Interacción ión – dipolo 3.6 FUERZAS INTERMOLECULARES Y PROPIEDADES FÍSICAS 3.6.1 Puntos de ebullición y de fusión 3.6.2 Solubilidad EJERCICIOS INTEGRADORES Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ III. FUERZAS MOLECULARES Actualmente, se conocen alrededor de 109 elementos químicos cuyas propiedades las podemos deducir a partir de la tabla periódica. Pero, si observamos a nuestro alrededor, nosotros estamos rodeados no solo de elementos puros sino también de compuestos o de mezclas de ellos. Así pues, se conocen miles de compuestos inorgánicos y millones de compuestos orgánicos debido a que todos los elementos químicos, con excepción de los gases nobles, tienen a combinarse para formar compuestos estables. Los átomos de diferentes elementos se combinan en proporciones fijas y definidas para formar compuestos. Estos compuestos por lo general presentan propiedades muy diferentes a los elementos de los cuales están formados. Por ejemplo: El flúor en condiciones normales de presión y temperatura, es un gas diatómico (F2), de color amarillo muy reactivo y el sodio es un metal alcalino blando, untuoso, de color plateado, se oxida en presencia de oxigeno y reacciona violentamente con el agua. En cambio, la sal fluoruro de sodio NaF que forman, es un sólido blanco, soluble en agua que es usado para la prevención de caries dentales. Las propiedades de los compuestos dependen de las fuerzas moleculares: – Enlace químico (fuerzas intramoleculares) – Fuerzas intermoleculares El enlace químico explica el mantenimiento de la unidad estructural de un compuesto la cual solo puede ser alterada por un cambio químico. Además de esta fuerza, entre las moléculas se da una serie de interacciones, mucho más débiles (dipolo dipolo, London, puentes de hidrógeno) las que generalmente son responsables de las propiedades físicas de los compuestos. El punto de ebullición, punto de fusión y la solubilidad son las propiedades físicas de especial importancia en nuestro organismo. Figura 3.1 Fuerzas intramoleculares – Fuerzas Intermoleculares Unidad 3: Fuerzas Moleculares 44 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 3.1 SIMBOLOGÍA DE LEWIS y regla del octeto Gilbert Lewis propuso que los átomos se combinan siempre que con ello puedan alcanzar una configuración electrónica estable. La configuración más estable se obtiene cuando los átomos son isoelectrónicos con los gases nobles. Así, Lewis desarrolló una simbología para denotar los electrones de valencia, los cuales se representan por puntos. Figura 3.2 Representación de puntos de Lewis para los diez primeros elementos Nótese que se representa un punto por cada electrón de valencia (electrones en el último nivel). Al transferir los electrones, sea cediendo o ganando, se forman iones con octetos completos. Esta tendencia se conoce como la regla del octeto. Utilizando las configuraciones electrónicas y la simbología de Lewis, es fácil predecir el tipo y la cantidad de enlaces que formarán los átomos. Los electrones de valencia pueden ser transferidos de un átomo a otro con la finalidad de lograr que su capa más externa sea más estable. 3.2 ENLACE QUÍMICO La fuerza de atracción que mantiene unidos dos átomos, sin importar cuál sea su naturaleza, se llama enlace químico (fuerzas intramolecular) Las propiedades de las sustancias dependen de la forma en que los elementos se enlazan; esto es lo que explica, por ejemplo, por qué algunas sustancias pueden disolverse en agua y otras no, por qué algunas conducen la corriente y otras no, etcétera. Recordemos que los metales tienden a perder sus electrones; luego, tienen baja energía de ionización (se ionizan fácilmente) y baja afinidad electrónica. En cambio, los no metales tienden a ganar electrones; por tanto, alta afinidad electrónica y alta energía de ionización. Unidad 3: Fuerzas Moleculares 45 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Los últimos electrones, que se encuentran en el mayor nivel energético (mayor número cuántico), se denominan electrones de valencia. Así, los electrones de valencia son los que participan en la formación de enlaces. 3.2.1 Enlace iónico Como sabemos, hay elementos con una fuerte tendencia a formar cationes y, de igual manera, otros con inclinación a formar aniones. Se denomina fuerza electrostática a la fuerza de atracción que une a dos iones de diferente carga, esto es, entre una positiva y otra negativa. Los compuestos iónicos se forman por la atracción entre un catión y un anión. La fuerza de atracción entre iones de carga opuesta se llama enlace iónico. Por ejemplo, el cloruro de sodio es un compuesto iónico. Los enlaces iónicos se forman por transferencia completa de electrones. Por tanto, debe existir un elemento que tenga facilidad para formar cationes (metales) y otro que tenga facilidad para formar aniones (no metales). ¿Cómo se representa un enlace iónico? Utilizando la simbología de puntos de Lewis, veamos el caso del cloruro de sodio. – El sodio (Na) pertenece al primer grupo IA. Su configuración es 1s22s2 2p6 3s1. Su simbología de puntos catión con carga +1. . Na con un solo electrón en el último nivel formará un – El cloro (Cl) pertenece al grupo VIIA. Su configuración es 1s22s2 2p6 3s2 3p5. .. Su simbología de puntos : Cl : un anión con carga -1. con siete electrones en su último nivel formará . Unidad 3: Fuerzas Moleculares 46 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 3.3 Forma en que se acomodan los átomos en el cloruro de sodio Las cargas opuestas se atraen y se compensan por el principio de electro neutralidad. Así, para formar un compuesto entre Ca y Cl según la ecuación de formación de Lewis, tendremos lo siguiente: Mg pertenece al grupo IIA. Su configuración 1s22s2 2p6 3s23p6 4s2 con dos electrones en su último nivel, o electrones de valencia, formará un catión +2 al perder los dos e-. Cl pertenece al grupo VIIA. Su configuración 1s22s2 2p6 3s2 3p5, de siete electrones de valencia, formará un anión con carga -1 al ganar un electrón. La carga total del compuesto es cero. .. .. +2 Ca: + 2 : Cl : → Ca 2( : Cl: )-1 .. . Se debe cumplir el principio de electro neutralidad; luego, se requiere de dos cloros para un calcio y la formula del compuesto será CaCl2: Una medida de la gran estabilidad que representa la formación de enlaces iónicos viene dada por el valor de la energía de red. Esta energía está relacionada con la carga de las especies involucradas. A mayor carga, mayor será la fuerza de atracción y, por tanto, mayor el punto de fusión. Autoevalúate 1 1. Empleando símbolos de Lewis, predice el ion que probablemente formarán F, O, Al y S. 2. Representa todas las posibles reacciones entre sus iones y predice la fórmula de los compuestos iónicos que se podrán formar. 3. Determina cuál de las especies es un compuesto iónico y explica por qué NH3, NaI, SO2, KCl, MgBr2. 4. Para el compuesto AlCl3, explica en qué consiste el principio de electroneutralidad. Unidad 3: Fuerzas Moleculares 47 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 3.2.2 Enlace covalente El enlace iónico es poco frecuente. Muchas de las sustancias que tratamos diariamente son gases, líquidos o sólidos con bajo punto de fusión. Los átomos, en general, se hallan unidos por fuerzas mucho más intensas, que, incluso, no permiten que puedan disociarse aun después de, por ejemplo, disolver la sustancia en agua. Supongamos lo siguiente: Na2SO4 (s) + H2O → 2Na+ (ac) + SO4 -2 (ac) ¿Qué mantiene unidos a S y O? Los iones pocas veces son átomos sencillos con carga; son, más bien, grupos de átomos que mantienen su unidad y estructura. Lewis intuyó que existe una compartición de electrones. Este tipo de enlace se llama enlace covalente. Las sustancias se conocen como sustancias moleculares y, por lo general, cumplen la teoría del octeto. ¿Por qué comparten electrones? Veamos lo siguiente para la molécula de flúor: + Al compartir, ambos alcanzan la configuración de gas noble. De esta forma, podemos ver que los halógenos (grupo VII) podrán formar un enlace covalente; el O del grupo VI podrá formar hasta dos enlaces covalentes, el nitrógeno del grupo V hasta tres y el carbono (grupo IV) hasta cuatro. Esto quiere decir que no siempre se comparte un único par de electrones; pueden compartirse dos y hasta tres pares. En ese caso, tenemos los enlaces múltiples. Veamos lo siguiente para el oxígeno: + Comparten dos pares de electrones. Observa que ambos oxígenos completan octetos; es decir, adquieren estabilidad. Un enlace múltiple, por su naturaleza, será más corto y, por tanto, más fuerte que un enlace simple. Unidad 3: Fuerzas Moleculares 48 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 2 Reconoce, dentro del conjunto CH3NH2, KBr, SO3, LiF, P2O3, las especies que sean iónicas y aquellas que sean covalentes. 3.2.3 Enlace metálico Las propiedades de los metales hacen que los utilicemos en diversas formas. En general, conocemos sus propiedades porque son las que los hacen útiles al hombre. Los metales en estado sólido son buenos conductores tanto del calor como de la electricidad. Casi todos los metales son maleables (pueden formar hojas delgadas) y dúctiles (se pueden estirar para formar alambres), y, por lo general, su apariencia es brillante. El enlace entre los átomos de los cristales metálicos difiere de los enlaces iónico y covalente descritos. Existen modelos que explican el enlace metálico. Modelo del mar de electrones Se puede representar a los metales como iones metálicos positivos que forman una red tridimensional, mientras que los electrones se desplazan libremente por todo el metal. Los metales cuyos electrones están más débilmente sujetos serán los mejores conductores. Figura 3.4 Red metálica que muestra los iones metálicos positivos inmersos en un «mar de electrones» Los electrones actúan como un pegamento electrostático, puesto que son móviles y mantienen unidos a los cationes. De esta forma, es posible estirarlos sin romper la estructura, ya sea en un solo sentido (hilos) o en las cuatro direcciones (laminas). La conducción del calor y la electricidad se explica en función de la movilidad de los electrones, pues estos últimos llevan la energía a través del metal sin alterar la estructura. Estas propiedades varían de intensidad de acuerdo con el elemento; cuanta más cantidad de electrones, el «pegamento electrostático» será más fuerte. Los átomos se agrupan en forma muy cercana, estableciendo redes tridimensionales muy compactas. Unidad 3: Fuerzas Moleculares 49 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 3.3 ELECTRONEGATIVIDAD Y POLARIDAD DE LOS ENLACES Si los átomos que forman un enlace son iguales, los electrones serán atraídos con la misma intensidad por cualquiera de ellos. No obstante, cuando los átomos enlazados son diferentes, puede ocurrir que los electrones no sean compartidos equitativamente; entonces, serán atraídos con mayor fuerza hacia alguno de los átomos. Electronegatividad es la capacidad que tiene un átomo para atraer hacia sí los electrones. Los elementos de mayor EI tendrán, también, mayor electronegatividad. . Los átomos con alta electronegatividad tienen fuerte atracción por los electrones. Según la escala de Pauling, el elemento más electronegativo es el F y se le asigna un valor de 4; el menos electronegativo es el Cs, que posee el valor de 0,7. Si la diferencia de electronegatividades entre dos elementos es muy grande, estos tienden a formar enlaces iónicos; si la diferencia es pequeña, serán covalentes. Como regla general, se acepta el valor de 1,7 como el límite. Nótese, en la figura 4.3, cómo los elementos más electronegativos se agrupan en el extremo superior derecho de la tabla periódica. Los colores rojo, naranja y amarillo muestran los elementos con mayor valor relativo de electronegatividad. Considérese que, en la tabla, no se muestran los gases nobles. Figura 3.5 Valores relativos de electronegatividad (rojo y naranja mayores valores) Nótese la alta electronegatividad para el flúor, el oxígeno y el nitrógeno. Si los electrones se comparten equitativamente, la molécula será apolar, pero, si uno de los átomos es más electronegativo y no comparten los electrones por igual, la molécula será polar. Se puede indicar la polaridad de un enlace por medio de un vector dirigido hacia el átomo más electronegativo. Véase el caso del HF. Unidad 3: Fuerzas Moleculares 50 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ En general, la polaridad de un enlace covalente aumenta cuando crece la diferencia de electronegatividad entre los átomos enlazados. El momento dipolar es la medida cuantitativa de la polaridad de una molécula. Si el enlace covalente que une a los átomos es polar, la molécula también será polar. Un enlace puede ser, entonces, así: Figura 3.6 Tipos de enlace moleculas apolares molécula polar atracción de iones Enlace covalente Enlace ionico Ejemplo: Para la molécula CO :C ≡ O : Se trata de una molécula lineal, en la que hay un enlace polar entre C y O; el vector momento dipolar se dirige hacia el oxígeno debido a su mayor electronegatividad. La molécula resulta polar. Autoevalúate 3 1. ¿Cómo se relaciona la electronegatividad con el potencial de ionización? Establece la tendencia de electronegatividad en la tabla en los grupos y los periodos. 2. Dados los cinco elementos A, B, C, D y E, determina el tipo de enlace que podrán formar entre ellos. ¿Cuál será la molécula más polar? Elemento Electronegatividad A 3,0 B 2,3 C 1,0 D 2,0 E 0,8 3. Dadas las moléculas FBr, FI y FCl, ¿cuál será la más polar? Representa gráficamente la polaridad. Ordénalas en forma decreciente de polaridad. Además, justifica la respuesta. Unidad 3: Fuerzas Moleculares 51 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 3.4 PROPIEDADES DE LOS COMPUESTOS SEGÚN SUS ENLACES El tipo de unión de los átomos en una molécula determina sus propiedades. Hay una variedad de posibilidades, desde las moléculas totalmente iónicas hasta las moléculas apolares totalmente simétricas. 3.4.1 Propiedades de los compuestos iónicos Debido a la intensidad de la fuerza electrostática (atracción de cargas), los compuestos iónicos tienen las siguientes características: – Son sólidos a temperatura ambiente. – Son duros y quebradizos. La mayor parte de ellos son blancos. – Tienen altos puntos de fusión y ebullición. – En estado sólido, no conducen la corriente. – Se disuelven fácilmente en agua y en otros solventes polares, y la solución resultante sí conduce la corriente, debido a que los iones que forman el enlace se separan. – En estado fundido, sí conducen la corriente, puesto que los iones también se separan al pasar a ese estado. Se trata de electrolitos cuando una sustancia produce iones en un medio acuoso. Por lo tanto, son sustancias iónicas. El cuerpo humano mantiene un balance electrolítico, esto es, una relación entre los iones ingeridos y los eliminados por la orina, las heces y el sudor. En el cuerpo humano, un desequilibrio electrolítico puede producir: – Acumulación tóxica de residuos: insuficiencia renal (el riñón filtra los tóxicos de la sangre y regula el balance electrolítico) – Desequilibrios nutricionales 3.4.2 Propiedades de los compuestos covalentes La mayoría de compuestos no metálicos que se encuentran en la naturaleza son compuestos covalentes. Recuérdese que los electrones son compartidos por varios átomos. Las propiedades más características son las siguientes: – Existen en forma de gases, líquidos o sólidos, pero los sólidos son frágiles y quebradizos o de aspecto céreo. – Generalmente, son insolubles en agua y solubles en compuestos como acetona o gasolina (solventes orgánicos). – Aunque sus puntos de fusión y ebullición varían, no son, por lo general, elevados. – Son malos conductores del calor y la electricidad. Unidad 3: Fuerzas Moleculares 52 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 3.4.3 Propiedades de los compuestos con enlace metálico Los enlaces metálicos tienen las siguientes características: – Son sólidos a temperatura ambiente, excepto el mercurio. – Aunque sus puntos de fusión varían notablemente, son, por lo general, altos. – Presentan brillo metálico. – Tiene alta conductividad térmica y eléctrica. – Pueden emitir electrones cuando reciben energía en forma de calor. 3.5 FUERZAS INTERMOLECULARES Además de los enlaces químicos (fuerzas intramoleculares) se pueden dar entre las moléculas una serie de interacciones, mucho más débiles, pero que generalmente son las responsables de las propiedades físicas de los compuestos. Estrictamente, los tipos de interacciones intermoleculares (dipolo-dipolo, fuerzas de dispersión y puentes de hidrógeno) se refieren sólo a sustancias moleculares. A estas fuerzas le adicionaremos la interacción ión dipolo que se da entre iones y moléculas. Figura 3.7 Tipos de Fuerzas intermoleculares 3.5.1 Dipolaridad Se dice que una molécula es dipolar cuando la distribución de su nube electrónica no es equitativa. La dipolaridad puede ser permanente o instantánea 3.5.1.1 Dipolaridad permanente Se presenta sólo en moléculas con enlace covalente polar. Por ejemplo HCl, H2O, etc Unidad 3: Fuerzas Moleculares 53 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 3.8 Moléculas dipolares con dipolaridad permanente H2O HCl 3.5.1.2 Dipolaridad inducida o instantánea Se presenta en cualquier tipo de molécula sean estas moléculas con enlace covalente polar o no polar. – Dipolaridad inducida o instantánea en moléculas no polares. Las moléculas no polares presentan una distribución equitativa de su nube electrónica por lo cual no presentan extremos parcialmente positivos o parcialmente negativos. Sin embargo, estas moléculas se desplazan y al chocar por instantes los electrones se concentran más en una zona creando polaridad por un periodo muy corto. Figura 3.9 Dipolaridad inducida en moléculas apolares → → – Dipolaridad inducida o instantánea en moléculas polares. En las moléculas polares también ocurre este desplazamiento de la nube electrónica de tal manera que a la dipolaridad permanente se le incrementa la dipolaridad instantánea. Figura 3.10 Dipolaridad inducida en moléculas polares → → 3.5.2 Fuerzas de Dispersión de London Se da en todos los tipos de moléculas. Surge de la interacción entre dipolos inducidos que se generan temporalmente en las moléculas. Cuando una molécula de se acerca a otra, se induce un momento dipolar pequeño y temporal, de manera que los electrones en la molécula que se acerca se desplazarán ligeramente apareciendo una interacción atractiva entre dipolos. Unidad 3: Fuerzas Moleculares 54 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Estos dipolos temporales solo duran una fracción de segundo y cambian continuamente. Esta fuerza de atracción depende del contacto superficial entre las moléculas y por tanto es proporcional al área molecular. Ejemplo: El butano tiene un área superficial mayor que la isobutano por lo que la fuerza de dispersión será mayor en el n-butano que en el isobutano .n-butano isobutano 3.5.3 Fuerzas Dipolo – Dipolo Se da entre moléculas con dipolaridad permanente, esto es en moléculas con enlace covalente polar. Las moléculas pueden girar y orientarse hacia la situación más estable que es en la orientación positivo-negativo. En la siguiente figura se indican las orientaciones de atracción y repulsión de las moléculas polares del clorometano: Figura 3.11 Fuerzas Dipolo Dipolo en moléculas con dipolaridad permanente µ µ µ µ H ++ δ− H +δ+ δ− H ++ δ− H ++ δ− δ δ δ H C Cl H C Cl H C Cl H C Cl H H H H H H H H Cl C H Cl C H Cl C H Cl C H µ H µ H µ H µ H δ+ + δ− δ+ + δ− δ+ + δ− δ+ δ− + A mayor momento dipolar, mayor fuerza dipolo –dipolo. La interacción electrostática al ser entre dipolos permanentes es más fuerte 3.5.4 Puentes de Hidrógeno El puente de hidrógeno es una forma especialmente fuerte de atracción entre dipolos. Un átomo de hidrógeno puede participar en un puente de hidrógeno si éste está unido al oxígeno, nitrógeno o flúor, porque los enlaces O-H, N-H y F-H están muy polarizados dejando al átomo de hidrógeno con una carga parcial positiva. Este átomo de hidrógeno tiene una gran afinidad hacia electrones no compartidos y forma agregados intermoleculares con los electrones no compartidos de los átomos de oxígeno, nitrógeno y flúor. Nótese que esta fuerza intermolecular se da entre moléculas de dipolo permanente tales como el H2O, NH3 y HF Unidad 3: Fuerzas Moleculares 55 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 3.12 Puentes de Hidrógeno El puente de hidrógeno tiene un efecto importante sobre las propiedades físicas de los compuestos orgánicos 3.5.5 Interacción Ion –Dipolo Esta fuerza es el resultado de la interacción eléctrica entre un ión y una molécula con polaridad permanente (enlace covalente polar). Figura 3.13 Interacción Ión Dipolo La fuerza ión-dipolo tiene especial importancia en las disoluciones acuosas de sustancias iónicas, por ejemplo los electrolitos NaCl, KCl disueltos en la sangre. Estas interacciones son moderadas 3.6 FUERZAS INTERMOLECULARES Y PROPIEDADES FÍSICAS Las fuerzas moleculares son las responsables de los estados físicos. Recordemos que los compuestos iónicos son sólidos, mientras que los compuestos covalentes generalmente son líquidos o gases. En algunos casos los compuestos covalentes son sólidos pero sus fuerzas intermoleculares son débiles. Unidad 3: Fuerzas Moleculares 56 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 3.14 Estados físicos y fuerzas intermoleculares Sólido Líquido Energía Pto. Ebullición Pto. Fusión Fuerzas intermoleculares altas. Evitan el desplazamiento de las moléculas Gaseoso Energía Fuerzas intermoleculares debilitas por incremento de energía. Permiten desplazamiento de las moléculas Fuerzas intermoleculares prácticamente inexistentes. Permiten libre movimiento de las moléculas 3.6.1 Puntos de ebullición y de Fusión Para que un compuesto cambie de estado físico (de sólido a líquido o de liquido a vapor) se tiene que vencer las fuerzas intermoleculares. Cuanto mayor sea la fuerza intermolecular mayor será la energía necesaria para apartar las moléculas unas de otras, por lo tanto, la sustancia tendrá mayor punto de fusión y ebullición respectivamente. Figura 3.15 Intensidad de las fuerzas intermoleculares Autoevalúate 4 Indique las fuerzas intermoleculares de las siguientes sustancias, numérelas del 1 al 3 de acuerdo a la intensidad de dichas fuerzas. ¿Qué sustancia tendrá mayor punto de ebullición? Sustancia CH3CH2CH3 Fuerza intermolecular Intensidad CH3Cl CH3CH2OH Unidad 3: Fuerzas Moleculares 57 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 3.6.2 Solubilidad. Además de afectar a los puntos de ebullición y de fusión, las fuerzas intermoleculares determinan la solubilidad de los compuestos orgánicos. La regla general es que LO SEMEJANTE DISUELVE A LO SEMEJANTE. Así tenemos que: − Las sustancias iónicas y las sustancias polares se disuelven en disolventes polares. Ejemplo: NaCl (iónico) en agua (polar) HCl (polar) en agua − Las sustancias no polares se disuelven en disolventes polares. Ejemplo: CH4 (no polar) en benceno C6H6 (no polar). La formación de puentes de hidrógeno favorece la solubilidad Figura 3.16 Interacción soluto - solvente CH4 y C6H6 NaCl – H2O CH4 y H2O HCl – H2O Autoevalúate 5 Indique si la sustancia es polar o no polar. Luego indique si es soluble o insoluble en AGUA Sustancia Iónica/polar/no polar Solubilidad KCl H2S N2 Na2SO4 CCl4 Unidad 3: Fuerzas Moleculares 58 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. Indica qué tipo de enlace predomina en los siguientes compuestos: Cl2, KBr, Na y NH3, respectivamente. a) b) c) d) e) Iónico, covalente polar, covalente apolar, metálico Metálico, covalente polar, covalente apolar iónico Covalente apolar, iónico, metálico, covalente polar Covalente polar, iónico, covalente apolar, metálico Covalente apolar, metálico, iónico, covalente polar 2. Dadas las moléculas SiH4, CO2 y SO2, indica la afirmación correcta. a) b) c) d) e) Todas son sustancias iónicas. Todas son sustancias covalentes. Dos son iónicas y una es covalente. Una es covalente y dos son iónicas. Dos son covalentes y uno metálico. 3. Si se disolviera NaCl en agua, ¿qué resultaría? a) b) c) d) e) Una solución molecular El compuesto no se disuelve. Que se forman dos fases Una solución electrolítica Ninguna de las anteriores 4. La cera de vela funde a baja temperatura, no es conductora de la electricidad y no se disuelve en agua. ¿Cuál es el tipo de enlace presente en la cera? a) b) c) d) e) Covalente polar Covalente no polar Iónico Metálico Ninguno de los anteriores 5. De las siguientes sustancias cuantas son muy solubles en agua: CH4, NaBr, C6H6, MgBr2 , KNO3, KI a) 1 b) 2 c) 3 d) 4 e) 5 6. Es un sólido con brillo plateado, que conduce la corriente eléctrica y no se puede fundir con un mechero de laboratorio. ¿Cuál es el tipo de enlace? a) b) c) d) e) Metálico Covalente polar Covalente no polar Iónico Ninguno de los anteriores Unidad 3: Fuerzas Moleculares 59 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 7. Señala la fórmula del compuesto iónico que se formará entre A (Z = 19) y B (Z = 8). a) b) c) d) e) AB A2B3 AB2 A2B Ninguna de las anteriores 8. ¿Cuál de las siguientes moléculas presentaran únicamente fuerzas de London CO2, H2O, CH4, CH3OH? a) b) c) d) e) CH3Cl H2O CH3OH CH4 Ninguno 9. La siguiente representación corresponde a la mezcla de : a) b) c) d) e) C2H2 en agua N2 en agua KNO3 en agua CH3OH en agua CH4 en benceno 10. Con referencia a la relación de sus puntos de ebullición , marque la relación correcta: a) b) c) d) e) H2O < CH4 HF < H2 CH3CH2CH2CH2CH3 < CH3CH2CH3 C6H6 < H2O HCl < CH3CH3 Unidad 3: Fuerzas Moleculares 60 IV. LENGUAJE QUÍMICO 4.1 CONCEPTOS BÁSICOS 4.1.1 Fórmula química 4.1.2 Estado de oxidación (EO) 4.1.3 Formulación general 4.2. FUNCIÓN QUÍMICA INORGÁNICA 4.2.1 Función óxido 4.2.2 Función Hidróxido 4.2.3 Función ácido 4.2.4 Función sal 4.2.4.1 Formación de iones positivos (cationes) 4.2.4.2 Formación de iones negativos (aniones) 4.2.8 Sal haloidea neutra 4.3 REACCIÓN QUÍMICA 4.3.1 Balance de ecuaciones químicas 4.3.2 Tipos de reacciones químicas EJERCICIOS INTEGRADORES Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ IV. LENGUAJE QUÍMICO En química, al igual que en otras disciplinas, se hace necesario utilizar nombres para poder identificar a las sustancias Cuando la química era una ciencia joven y el número de compuestos conocidos era pequeño, era fácil memorizar todos los nombres. Actualmente, el número de compuestos conocidos sobrepasa los trece millones y se han diseñando sistemas para nombrarlos con reglas que son aceptadas mundialmente, lo que facilita la comunicación y proporciona una forma útil para trabajar con una abrumadora cantidad de compuestos. El aprendizaje de estas reglas proporciona un beneficio para el estudio de la química. 4.1 CONCEPTOS BÁSICOS 4.1.1 Fórmula química Es la forma de expresar la composición de las moléculas y los compuestos iónicos mediante símbolos químicos. Se entiende por composición no solamente especificar los elementos que forman el compuesto, sino la proporción en la cual se combinan los átomos de dichos elementos. Véase el siguiente ejemplo: 4.1.2 Estado de oxidación (EO) Es el número de electrones que un átomo gana, pierde o comparte al unirse a otros átomos para formar las moléculas o compuestos iónicos. Un mismo elemento puede tener uno o más estados de oxidación; esto va a depender del elemento al que se está uniendo para formar algún compuesto. Ejemplo: En el cloruro de magnesio, MgCl2, cada átomo de magnesio pierde dos electrones para convertirse en Mg2+, y cada átomo de cloro gana un electrón para convertirse en Cl-. El Mg está con estado de oxidación 2+ y el Cl con 1-. Reglas prácticas para determinar los estados de oxidación a) Las elementos sin combinarse tienen estado de oxidación 0. b) En los compuestos químicos, – el hidrógeno tiene estado de oxidación 1+, excepto en los hidruros metálicos, en los que tiene estado de oxidación 1-. Unidad 4: Lenguaje Químico 62 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ – el oxígeno tiene estado de oxidación 2-, excepto en los peróxidos, en los que tiene estado de oxidación 1-. – los elementos del grupo IA de la tabla periódica (Li, Na, K, Rb, Cs, Fr) tienen estado de oxidación 1+. – los elementos del grupo IIA de la tabla periódica (Be, Mg, Sr, Ca, Ba, Ra) tienen estado de oxidación 2+. – los elementos del grupo VIIA de la tabla periódica (F, Br, Cl, I) tienen estado de oxidación 1- solo cuando forman compuestos binarios. c) De acuerdo al principio de electro neutralidad, en todo compuesto la suma de los estados de oxidación de los elementos que lo componen es 0. d) En un ion monoatómico, el estado de oxidación es igual a la carga del ion. e) En un ion poliatómico, la suma de los estados de oxidación de cada elemento que lo componen es la carga del ion. En las tablas siguientes, se muestran los estados de oxidación de los elementos más comunes. Tabla 4.1 Estados de oxidación de los principales elementos no metálicos y metálicos Tabla 4.2 Estados de oxidación de elementos que se pueden comportar como metales o no metales Unidad 4: Lenguaje Químico 63 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Ejemplos: Determínese el estado de oxidación del elemento subrayado en los siguientes compuestos. – O2 El EO del oxígeno es 0, pues el oxígeno está en su forma elemental (sin combinarse). – HNO3 H1+NxO32- El EO del nitrógeno es x=5+ pues 1(1+) + x + 3(2-) =0 – K21+SxO42- K2SO4 El EO del azufre es x=6+ pues (2)(1+) + x + 3(2-) =0 Autoevalúate 1 1. Utilizando las reglas prácticas, determina el estado de oxidación del elemento que está subrayado. Cu O: (OH)1-: Fe2O3: Na2B4O7: H2SO4: NaHCO3: H2SO3: ZnO2: 2- (HPO4) : NH3: 4.1.3 Formulación general En general, los compuestos inorgánicos obedecen a la siguiente formulación general: X ba+ A ba Donde: X: especie química positiva que puede ser metal, ion mono o poliatómico positivo con carga +a A: especie negativa que puede ser no metal, ion mono o poliatómico negativo con carga bPor convención, la especie positiva se escribe primero y se nombra al final, mientras que la especie negativa se escribe al último y se nombra al inicio. Ejemplos: – H1+O2- → H2O Unidad 4: Lenguaje Químico - Ca2+ (SO4)2- → Ca2(SO4)2 → CaSO4 64 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 4.2. FUNCIÓN QUÍMICA INORGÁNICA Una función química es un conjunto de compuestos que tienen propiedades químicas muy semejantes, debido a una especie química común llamada grupo funcional. Tenemos los siguientes grupos funcionales inorgánicos: – Óxidos ácidos y básicos Óxidos ácidos Óxidos básicos – Hidróxidos – Sales Haloideas Oxisales – Ácidos Hidrácidos Oxácido – Hidruros 4.2.1 Función óxido Los óxidos son compuestos binarios que poseen el grupo funcional óxido (O2-) formados por la reacción de un elemento con el oxigeno Óxido básico El óxido básico o, simplemente, óxido se forma cuando el elemento que reacciona con el oxígeno es un metal. Se les llama básicos porque, cuando estos óxidos se disuelven en agua, resultan disoluciones básicas. Dependiendo de las características del metal y de sus estados de oxidación, cada uno de estos elementos puede presentar una o más combinaciones distintas con el oxígeno. Se sabe que, en general, M + O2 → M2Ox, donde M: metal y x: EO del metal. Formulación Mx+O2- ⇒ M2Ox Nomenclatura La nomenclatura química es el conjunto de expresiones y reglas que, por convenio internacional, se utilizan para asignar un nombre a un compuesto químico e identificar, inequívocamente, a una sustancia en particular. Actualmente, estas normas son establecidas por la IUPAC (International Union of Pure and Applied Chemistry). Existen tres tipos de nomenclatura: la Tradicional, la de Stock, y la Sistemática o IUPAC. Unidad 4: Lenguaje Químico 65 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Nomenclatura Tradicional En esta nomenclatura, se utilizan una serie de prefijos y sufijos para poder distinguir los estados de oxidación del metal o no metal que forma parte del compuesto. En el caso de que el elemento tenga un único estado de oxidación, se puede omitir. Tabla 4.3 Prefijos y sufijos utilizados en la nomenclatura tradicional Cantidad de EO EO Prefijo … sufijo menor EO mayor EO menor EO segundo EO mayor EO menor EO segundo EO tercer EO mayor EO 2 3 4 … oso … ico Hipo … oso … oso … ico Hipo ... oso … oso … ico Per ... ico Nomenclatura de Stock Cuando el elemento metálico o no metálico tiene más de un estado de oxidación, este se indica al final del nombre con números romanos y entre paréntesis. En el caso de que el elemento tenga un único estado de oxidación, se puede omitir. Nomenclatura Sistemática o IUPAC Utiliza los prefijos numéricos: mono, di, tri, tetra, penta, hexa, etcétera, para indicar el número de átomos que tiene cada elemento del compuesto. Si, en el compuesto, hay un solo átomo del metal o no metal, algunas veces se omite el prefijo mono. Tradicional: Óxido sufijo raíz del elemento prefijo De Stock: Óxido de nombre del metal (EO) IUPAC: Prefijo óxido de prefijo nombre del metal (número de átomos oxigeno) (número de átomos metálicos) Tabla 4.4 Ejemplos de nomenclatura y formulación de óxido básicos Metal +2 Óxido básico Tradicional Nomenclatura de Stock IUPAC Ca CaO Óxido de calcio Óxido de calcio Fe+3 Fe+2 Fe2O3 FeO Óxido férrico Óxido ferroso Óxido de hierro (III) Trióxido de dihierro Óxido de hierro (II) Monóxido de hierro Unidad 4: Lenguaje Químico Monóxido de calcio 66 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Óxido ácido El óxido ácido o, simplemente, anhídrido se forma cuando el elemento que reacciona con el oxígeno es un no metal. Se les llama ácidos porque las disoluciones acuosas son ácidas. Frecuentemente, los elementos no metálicos, como el azufre y el nitrógeno, presentan varios estados de oxidación, lo que da lugar a la existencia de varios óxidos diferentes del mismo elemento. Se sabe que, en general: E + O2 → E2Ox E: no metal x: EO del no metal Formulación Ex+O2- ⇒ E2Ox Nomenclatura Tradicional: Anhidrido sufijo raíz del elemento prefijo De Stock: Óxido de nombre del no metal (EO) IUPAC: Prefijoóxido de prefijo nombre del no metal (número de átomos oxígeno) (número de átomos no metálicos) Tabla 4.5 Ejemplos de nomenclatura y formulación de óxido ácidos No metal 2+ C 4+ C 2+ S 4+ S S6+ 1+ Cl Cl3+ Cl5+ 7+ Cl Óxido ácido CO CO2 SO SO2 SO3 Cl2O Cl2O3 Cl2O5 Cl2O7 Tradicional Anh. carbonoso Anh. carbónico Anh. hiposulfuroso Anh. sulfuroso Anh. sulfúrico Anh. hipocloroso Anh. cloroso Anh. clórico Anh. perclórico Nomenclatura de Stock Óxido de carbono (II) Óxido de carbono (IV) Óxido de azufre (II) Óxido de azufre (IV) Óxido de azufre (VI) Óxido de cloro (I) Óxido de cloro (III) Óxido de cloro (V) Óxido de cloro (VII) IUPAC Monóxido de carbono Dióxido de carbono Monóxido de azufre Dióxido de azufre Trióxido de azufre Monóxido de dicloro Trióxido de dicloro Pentóxido de dicloro Heptóxido de dicloro Autoevalúate 2 1. Escribe la nomenclatura Tradicional, de Stock e IUPAC de los óxidos que se dan a continuación. a) b) c) d) e) f) FeO I2O3 Cu2O P2O5 CaO As2O3 Unidad 4: Lenguaje Químico 67 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 2. Formula los siguientes compuestos: a) b) c) d) e) f) Óxido de sódio (I) Dióxido de carbono Óxido de níquel (III) Anhidrido sulfúrico Óxido cuproso Monóxido de dinitrógeno 4.2.2 Función Hidróxido - Es un compuesto ternario que posee el grupo funcional hidróxido (OH ). Los hidróxidos son bases, porque sus disoluciones acuosas tienen carácter básico y tienen sabor amargo. Se forman así: – Reacción de un metal activo con agua M + H2O → M(OH)x + H2 M: metal x: EO del metal – Reacción de un óxido básico con agua M2Ox + H2O → M(OH)x Formulación Mx+(OH)- ⇒ M(OH)x Nomenclatura Tradicional: hidróxido Raíz del elemento prefijo De Stock: hidróxido de Nombre del metal (E.O) IUPAC: prefijohidróxido de Nombre del metal (número de OH) Tabla 4.6 Ejemplos de nomenclatura y formulación de hidróxidos Metal Hidróxido Nomenclatura Tradicional de Stock IUPAC Na+ NaOH Hidróxido de sodio Hidróxido de sodio Cu1+ Cu2+ CuOH Cu(OH)2 Hidróxido cuproso Hidróxido cúprico Hidróxido de cobre (I) Monohidróxido de cobre Hidróxido de cobre (II) Dihidróxido de cobre Unidad 4: Lenguaje Químico Monohidróxido de sodio 68 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 3 1. Escribe la nomenclatura tradicional, de Stock e IUPAC de los hidróxidos que se dan a continuación. a) b) c) d) e) Fe(OH)2 Al(OH)3 Au(OH)3 Mn(OH)2 Ca(OH)2 2. Formula los siguientes compuestos: a) b) c) d) e) Hidróxido ferroso Hidróxido plúmbico Hidróxido de níquel (III) Hidróxido de bario Tetrahidróxido de titanio 4.2.3 Función ácido Son compuestos que presentan el grupo funcional hidrógeno (H+), poseen sabor agrio, corroen los metales activos y neutralizan los hidróxidos. Los ácidos pueden ser de dos tipos: ácidos oxácidos e hidrácidos. Ácido oxácido Son compuestos ternarios que, estructuralmente, presentan un no metal como átomo central, rodeado de oxígenos, y estos están, a su vez, unidos a uno o más hidrógenos. Los ácidos oxácidos se obtienen por la reacción de anhídridos con agua: Anhídrido + H2O → Ácido oxácido Tabla 4.7 Formulación de ácidos oxácidos según el EO Si el no metal tiene Fórmula del ácido EO impar H E O x +1 EO par H 2E O x + 2 B, P, As Sb H3E O x +3 2 2 2 E: no metal x: EO del no metal E Unidad 4: Lenguaje Químico 69 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Ejemplo: En el ácido nítrico, el nitrógeno está con EO 5+. Impar: entonces, su fórmula será esta: H E O 5+1 → HNO3 2 En el ácido carbónico, el carbono está con EO 4+. Par: entonces, su fórmula será esta: H 2E O 4+2 → H2CO3 2 Nomenclatura Tradicional: Ácido raíz del elemento prefijo Tabla 4.8 Ejemplos de nomenclatura y formulación de oxácidos No metal 1+ Ácido oxácido Nomenclatura Cl 3+ Cl Cl5+ Cl7+ S2+ S4+ 6+ S HClO HClO2 HClO3 HClO4 H2SO2 H2SO3 H2SO4 Ácido hipocloroso Ácido cloroso Ácido clórico Ácido perclórico Ácido hiposulfuroso Ácido sulfuroso Ácido sulfúrico B3+ 5+ P H3BO3 H3PO4 Ácido bórico Ácido fosfórico Ácido hidrácido Son compuestos binarios formados por hidrógeno y no metales del grupo VI A: S, Se o Te (con EO -2) y VII A: F, Cl, Br, I (con EO -1). Se obtienen por la reacción de hidrógeno y cualquiera de los no metales antes mencionados, y el gas resultante es disuelto en agua. Ejemplo: 2O Cl2 (g) + H2 (g) → 2 HCl (g) H→ 2 HCl (ac) Formulación H1+ Ey- ⇒ Hy E E: no metal: F, Cl, Br, I (y=1-) y S, Se, Te (y=2-) Y: EO del no metal Unidad 4: Lenguaje Químico 70 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Nomenclatura Tradicional: ácido raíz del elementohídrico (en disolución acuosa) Raíz del elementouro de hidrógeno (puro) Tabla 4.9 Ejemplos de nomenclatura y formulación de óxido básicos Nomenclatura No Ácido metal hidrácido Tradicional (en disolución acuosa) Tradicional (en estado puro) Cl1Br1- HCl HBr Ácido clorhídrico Ácido bromhídrico Cloruro de hidrógeno Bromuro de hidrógeno S2Te2- H2S H2Te Ácido sulhídrico Ácido telurhídrico Sulfuro de hidrógeno Teleruro de hidrógeno Autoevalúate 4 1. Escribe la nomenclatura tradicional de los ácidos que se dan a continuación. a) b) c) d) e) H2BrO3 HNO2 HI HBr H2CrO4 2. Formula los siguientes compuestos: a) b) c) d) e) Ácido carbônico Ácido clorídrico Ácido fosfórico Ácido sulfuroso Ácido sulfúrico 4.2.4 Función sal Son compuestos iónicos, sólidos a temperatura ambiente y, por lo general, se disuelven en agua. En general, las sales se forman por reacción de un ácido con un hidróxido: Hidróxido + ácido → sal + H2O Estructuralmente, una sal está formada por un catión metálico proveniente del hidróxido y un anión que proviene del ácido, de la manera en que se expone a continuación. Unidad 4: Lenguaje Químico 71 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 4.2.4.1 Formación de iones positivos (cationes) Los iones positivos que conforman la sal provienen del hidróxido: M(OH)a → Ma+ + (OH)1Nomenclatura cationes Los cationes se nombran cambiando la palabra hidróxido por ion. Ejemplos: CuOH → Cu1+ (OH)1- → Cu1+ Hidróxido cuproso Ion cuproso Cu(OH)2 → Cu2+ (OH)1- → Cu2+ Hidróxido cúprico Ion cúprico Fe(OH)2 → Fe2+ (OH)1- → Fe2+ Hidróxido ferroso Ion ferroso Fe(OH)3 → Fe3+ (OH)1- → Fe3+ Hidróxido férrico Ion férrico 4.2.4.2 Formación de iones negativos (aniones) Los iones negativos que conforman la sal provienen del ácido cuando pierden todos sus hidrógenos. Ejemplos: H2SO4 → (SO4)2H3BO3 → (BO3)3Nomenclatura aniones Los aniones se nombran cambiando la palabra ácido por ion y las terminaciones siguientes: oso ico hídrico por por por ito ato uro Ejemplos: HNO3 → H+ (NO3)- → (NO3)Ácido nítrico Ion nitrato H2SO3 → H+2 (SO3 )2- → (SO3 )2Ácido sulfuroso Ion sulfito Unidad 4: Lenguaje Químico 72 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ H2CO3 → H+2 (CO3 )2- → (CO3 )2Ácido carbónico Ion carbonato HI → H+ (I)Ácido yodhídrico → (I)Ion yoduro Según el tipo de ácido que las origina, las sales se clasifican en dos: sal oxisal y sal haloidea. 4.2.4.3 Sal oxisal neutra Son compuestos ternarios que se obtienen a partir de la reacción del ácido oxácido con un hidróxido: Hidróxido + ácido oxácido → sal oxisal + H2O Formulación Catióna+ Aniónb- → Catiónb Anióna Nomenclatura Tradicional: Nombre del anión de nombre del catión Tabla 4.10 Ejemplos de nomenclatura y formulación de sal oxisal Hidróxido Catión Oxoácido Anión Sal oxisal KOH K+ HClO4 (ClO4)1- KClO4 Al(OH)3 Al H2SO2 (SO2) 2- Mg(OH)2 Mg H3PO4 (PO4) 3- 3+ 2+ Al2(SO2)3 Nomenclatura tradicional Perclorato de potasio Hiposulfito de aluminio Mg3(PO4)2 Fosfato de magnésio 4.2.8 Sal haloidea neutra Son compuestos binarios que se obtienen a partir de la reacción de un ácido hidrácido con un hidróxido: Hidróxido + ácido hidrácido → sal haloidea + H2O Formulación Catióna+ E y - → Catióny Ea E: no metal grupo VI y VII A y: E.O grupo VIA (-2), grupo VIIA (-1) Unidad 4: Lenguaje Químico 73 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Nomenclatura Tradicional: Nombre del anión de nombre del catión Tabla 4.11 Ejemplos de nomenclatura y formulación de sal haloidea Hidróxido Catión Ácido Anión hidrácido + NaOH Fe(OH)3 Na 3+ Fe CuOH Ca(OH)2 Cu Ca2+ 1+ 1- Sal haloidea HCl HBr Cl 1Br NaCl FeBr3 H2S H2Te S Te2- 2- Cu2S CaTe Nomenclatura tradicional Cloruro de sodio Bromuro férrico Sulfuro cuproso Teleruro de calcio Autoevalúate 5 1. Nombra, utilizando la nomenclatura tradicional, las sales que se dan a continuación. a) b) c) d) e) KMnO4 KCl Ca3(PO4)2 Al2(SO3)3 CaI2 2. Escribe la fórmula de las siguientes sales: a) b) c) d) e) Bromato de sodio Sulfuro de potasio Carbonato de sodio Fosfato de sodio Nitrato de aluminio Tabla 4.12 Compuestos químicos inorgánicos de uso común Compuesto NaCl CaO Mg(OH)2 H2O2 CO2 HCl CaCO3 NaOH NaClO Nombre comercial Sal común Cal viva Leche de magnesia Agua oxigenada Hielo seco Acido muriático Piedra caliza Soda cáustica Lejía Unidad 4: Lenguaje Químico Uso Saborizante, conservante Manufactura de acero y cemento Antiácido Antiséptico, blanqueador Extintores, bebidas carbonatadas Limpieza Antiácido, manufactura de cemento Limpieza, manufactura de jabones Desinfectante, blanqueador 74 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 4.3 REACCIÓN QUÍMICA Un cambio o reacción química es un proceso en el que una o más sustancias (reactivos o reactantes) se transforman en otras sustancias diferentes (productos de la reacción). Para representar este cambio, se utilizan las ecuaciones químicas. En una ecuación química, los reactivos aparecen sobre la parte izquierda de la ecuación, mientras que los productos se escriben sobre la derecha. En las reacciones químicas, se produce un reordenamiento de los átomos. Sin embargo, estos no se crean ni destruyen, por lo que en estas reacciones se cumple la ley de conservación de la masa. Entonces, en una ecuación química, debe haber el mismo número de átomos de un determinado elemento hacia ambos lados. Además, todos los reactivos y los productos deben ser identificados mediante sus fórmulas y sus estados físicos. Ejemplo: – Cambio químico: «El hidrógeno molecular reacciona con el oxígeno molecular para producir agua»; Ecuación química: H2 (g) + O2 (g) → H2O(g), donde el signo más significa «reacciona con»; la flecha significa «produce»; y la reacción sigue dirección de izquierda hacia derecha, como lo indica la flecha. Por otro lado, notemos que la ecuación no está completa, ya que del lado izquierdo de la flecha hay dos átomos de oxígeno, mientras que del lado derecho solo hay uno. Para cumplir con la ley de la conservación de la masa, debe haber tantos átomos al finalizar la reacción como los que había al inicio de ella. Se puede balancear la ecuación al colocar el número 2 delante del hidrógeno y un 2 delante del agua. Estos números se denominan coeficientes estequiométricos: 2 H2 (g) + O2 (g) → 2 H2 O(g) 4.3.1 Balance de ecuaciones químicas En reacciones en las que intervienen más sustancias, es conveniente seguir ciertos pasos para escribir y llevar a cabo el balance de una ecuación química: a) Se identifican todos los reactivos y productos. b) Se escriben las fórmulas correctas sobre ambos lados de la ecuación: KI + Pb(NO3)2 Ioduro de potasio Nitrato de plomo Da PbI2 + KNO3 Ioduro de plomo Nitrato de potasio c) Se asigna su estado físico y se colocan las flechas o los símbolos respectivos: – (g) para una sustancia gaseosa – (l) para un líquido puro Unidad 4: Lenguaje Químico 75 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ – (s) para un sólido – (ac) disolución acuosa – sustancia disuelta en agua. – da → – Se desprende ↑ – Precipita ↓ – Se calienta ∆ 2 KI(ac) Ioduro de potasio + Pb(NO3)2 (ac) Nitrato de plomo PbI2 (s)↓ → + 2 KNO3 (ac) Ioduro de plomo Nitrato de potasio Para balancear la ecuación, se prueban los diferentes coeficientes, con la finalidad de igualar el número de átomos de cada elemento hacia ambos lados de la ecuación. Se pueden cambiar los coeficientes (los números que anteceden a las fórmulas), pero no los subíndices (los números que forman parte de las fórmulas): – se ajustan los átomos de los metales, con prioridad para los más pesados; – se ajustan los no metales; y – se comprueba el ajuste al contar los hidrógenos y los oxígenos. 4.3.2 Tipos de reacciones químicas Existen varias formas de clasificar reacciones químicas. Estas consideran diferentes aspectos: 1. Según los cambios energéticos, las reacciones químicas pueden ser: – Exotérmicas: aquellas durante cuya reacción se desprende calor: 2H2 (g) + O2 (g) → 2 H2O(g) + 136 kcal – Endotérmicas: aquellas durante cuya reacción se absorbe calor: H2 (g) + I2 (g) + 12,4kcal → 2HI (g) 2. Según la naturaleza de la reacción, tenemos: – Reacciones de descomposición: son reacciones durante las que una sustancia se desdobla en dos sustancias diferentes y más simples: 2HgO(s) → 2 Hg(l) + O2(g) Unidad 4: Lenguaje Químico 76 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ – Reacciones de composición o de síntesis: son reacciones durante las que dos o más sustancias se combinan para formar una nueva: N2 (g) + 2 H2(g) → 2 NH3 (g) – Reacciones de sustitución o desplazamiento simple: durante ellas, un elemento sustituye a otro en una molécula: Fe(s) + CuSO 4 (ac) → FeSO 4 (ac) + Cu (s) – Reacciones de doble desplazamiento o metátesis: 3 BaCl 2 (ac) + 2 Na3PO 4 (ac) → Ba3 (PO4)2 (s) + 6 NaCl (ac) – Reacciones de óxido reducción: son reacciones en las que uno de los compuestos se reduce y el otro se oxida (de ahí su nombre). El reactivo que se oxida pierde electrones que luego adopta aquel que se reduce, de modo que este toma los electrones que el otro ha liberado: Fe + O2 → Fe2O3 Feo → Fé+3 Oxidación O02 → O-2 Reducción El compuesto que se oxida se denomina agente reductor, mientras el que se reduce se denomina agente oxidante. Autoevalúate 6 1. Escribe y ajusta la ecuación para las siguientes reacciones químicas: a) Los cristales de hidróxido de sodio (sosa caústica) reaccionan con el dióxido de carbono del aire para formar un polvo blanco, carbonato de sodio, y un líquido incoloro, agua. b) El cobre metálico reacciona con el ácido sulfúrico concentrado y forma gas dióxido de azufre, solución de sulfato de cobre II y agua líquida. 2. Clasifica las siguientes reacciones químicas: a) b) c) d) e) CuCO 3(s) → CuO(s) + CO 2(g) 2 Kl(ac) + Cl 2(g) →2 KCl(ac) + I 2(g) NaOH(ac) + HCl (ac) → NaCl (ac) + H2O(l) Mg (s) + H2SO4 (ac) → MgSO4 (ac) + H2 (g) 2 HgO(s) + Calor → 2 Hg (l) + O 2 (g) Unidad 4: Lenguaje Químico 77 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. Determina el número de oxidación del fósforo en los compuestos siguientes: PH3 a) b) c) d) e) P2O3 NaH2PO4 3-; 1+; 4+ 3+; 3+; 3+ 3-; 1+; 4+ d) 3-; 3+; 5+ e) 3+; 3+; 5+ 2. Indica la relación fórmula-nombre incorrecta. a) b) c) d) e) CaO CuO SO3 Fe2O3 CO3 óxido de calcio óxido de cobre (II) trióxido de azufre óxido férrico anhídrido carbónico 3. De acuerdo con las funciones químicas que conoces, ¿cuál de los siguientes grupos de elementos no conforma la función respectiva? a) b) c) d) e) H, Ca : hidruro metálico C, O : anhídrido Mn, O : óxido ácido y óxido básico Na, H, O : ácido hidrácido K, H, O : hidróxido 4. ¿Cuáles son las fórmulas del ácido sulfuroso y del ácido sulfhídrico? a) b) c) d) e) 5. H2SO3; H2S (ac) H2SO4; H2S (ac) H3SO2; H2S (g) H3SO3; H2S (ac) H3SO4; H2S (g) Indica el número de óxidos básicos y óxidos ácidos, respectivamente, en la siguiente lista: K2O; a) b) c) d) e) SO2; CaO; Cr O3; Mn2O3; Ca (OH)2 4y1 2y3 3y3 4y2 3y2 Unidad 4: Lenguaje Químico 78 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 6. Señala la relación incorrecta. a) b) c) d) e) HCl (aq) : ácido hidrácido HClO3 : ácido oxoácido NaH : hidruro metálico MgO : óxido básico MnO3 : óxido básico 7. ¿Qué nombre no va acompañado correctamente por su fórmula? a) b) c) d) e) Nitrato cuproso : CuNO3 Sulfito cúprico : CuSO3 Sulfuro cuproso : Cu2S Nitrito de litio : LiNO3 Sulfato de bario : BaSO4 8. Indica la relación incorrecta. a) b) c) d) e) Ag2S : sal haloidea neutra CaCO3 : sal oxisal neutra H3PO4 : ácido oxácido H2S : hidruro metálico Mg(OH)2 : hidróxido 9. La reacción Na2CO3(ac) + Ca(OH)2(ac) → es de doble desplazamiento; por lo tanto, los productos obtenidos son: a) b) c) d) e) Ca2CO3 y Na(OH)2 Ca(CO3)2 y Na(OH)2 Ca(CO3)2 y NaOH CaCO3 y NaOH Ninguna de las anteriores 10. Escribe la ecuación química balanceada correspondiente a la siguiente reacción química: «cuando el trióxido de azufre gaseoso reacciona con el agua, se forma una solución de ácido sulfúrico»: a) b) c) d) e) S3O(g) + 3 H2O → 3 H2SO(ac) SO3(g) + H2O → 2H2SO4 (ac) SO2(g) + H2O → H2SO3 (ac) SO3(g) + H2O → H2SO4 (ac) Ninguna de las anteriores Unidad 4: Lenguaje Químico 79 V. ESTEQUIOMETRÍA 5.1 MASA ATÓMICA 5.1.1 Masa atómica promedio 5.1.2 Masa molecular 5.2 MOL Y EL NÚMERO DE AVOGADRO 5.3 RELACIONES DE MASA EN LOS COMPUESTOS QUÍMICOS 5.3.1 Composición centesimal de los compuestos 5.3.2 Fórmula química de un compuesto 5.4 RELACIÓN MOL - MASA EN UNA REACCIÓN QUÍMICA 5.4.1 Reactivo Limitante 5.4.2 Rendimiento Porcentual Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ V. ESTEQUIOMETRÍA En los capítulos anteriores, nos hemos aproximado a la química básicamente desde el punto de vista cualitativo y se realizaron solo algunos cálculos. Sin embargo, la química es una ciencia no solo cualitativa, sino también cuantitativa. Es necesario, entonces, saber cómo están formados átomos y moléculas, sus masas y los cambios de masa que ocurren cuando se llevan a cabo cambios químicos. 5.1 MASA ATÓMICA Como vimos en la unidad 2, los átomos de un elemento son iguales entre sí, pero diferentes al resto de los elementos, y su masa depende del número de electrones, protones y neutrones que contenga. Por otro lado, los átomos son partículas extremadamente pequeñas. Por ejemplo, el átomo de calcio tiene un radio de 2 por 10-8 cm (para formar una extensión de 1 cm de átomos, habría que colocar en fila unos 50 000 000 de átomos de calcio). Resulta obvio, entonces, que no es posible pesarlos individualmente en una balanza, pues no existe balanza capaz de detectar un solo átomo. Sin embargo, sí existen métodos experimentales que permiten determinar la masa relativa, esto es, la masa de un átomo en relación con la masa de otro átomo que se toma como elemento de referencia. Figura 5.1 Representación del átomo de carbono abierto por la mitad Fuente: http://natachamen_15.nireblog.com/.../04/26/el-atomo (consulta: 26 de julio de 2008 ) Entonces, el primer el primer paso es asignar un valor a la masa de un átomo de un elemento que nos sirva de referencia. Por acuerdo internacional, el elemento elegido fue el C-12 (el isótopo más abundante del carbono, que tiene 6 protones y 6 neutrones). Considerando que el 99,99% de la masa de un átomo se encentra en su núcleo y que ahí se ubican los 6 protones y los 6 neutrones, al carbono se le asignó una masa de 12 uma. Entonces, ¿cómo definimos uma? Es la masa equivalente a la doceava parte de la masa de un átomo de carbono. Unidad 5: Estequiometría 81 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 5.2 Representación del átomo de carbono dividido en 12 partes La masa del carbono -12 se utiliza como referencia para medir la masa atómica de los demás elementos. A la masa atómica de cada elemento expresado en uma también se le suele denominar peso atómico, aunque lo que estamos describiendo aquí es masa y no peso. 5.1.1 Masa atómica promedio Bien, hasta aquí queda claro que la masa (peso atómico) del carbono es 12 uma. Sin embargo, cuando buscamos la masa atómica del carbono en la tabla periódica, se encuentra que su valor no es 12,00 uma, sino 12,01115 uma. La razón de esta diferencia es que en la tabla periódica se reporta la masa atómica media de la mezcla natural de los isótopos del elemento. Como ya vimos en el capítulo 2, la mayor parte de los elementos químicos se encuentran en la naturaleza como mezclas de isótopos (átomos con el mismo número atómico, pero de distinto número másico). El espectrómetro de masas permite medir las masas y la abundancia relativa de cada uno de los isótopos que componen un elemento natural. Las abundancias relativas se expresan como porcentaje en peso. Entonces, para determinar la masa atómica media (denominada, simplemente, masa atómica), es necesario conocer: las masas de cada uno de sus isótopos de forma individual; y los porcentajes atómicos (abundancia relativa isotópicas) en la naturaleza. Ejemplo: En la tabla siguiente se muestran las abundancias relativas y las masas para cada isótopo estable del cloro: Tabla 5.1 Masa atómica de los isótopos del cloro Isótopo Cl - 35 Cl - 37 Masa atómica 34,97 uma 36,97 uma Abundancia 75,53% 24,47% Esto quiere decir que, en el cloro elemental, el 75,53% de los átomos presenta una masa de 34,97 uma, y que el 24,47% tiene una masa de 36,97 uma. Con esta información, podemos calcular la masa atómica promedio del cloro: Masa atómica promedio del cloro = (0,7573) (39,97 uma) + (0,2447) (36,97 uma) Masa atómica promedio del cloro = 35,46 uma Unidad 5: Estequiometría 82 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Obsérvese que, en cálculos que incluyen porcentajes, es necesario convertir los porcentajes a fracciones. Por ejemplo, 75,73% se transforma en 0,7573. Autoevalúate 1 1. El cobre es un elemento químico que se encuentran en pequeñísimas cantidades en los seres vivos, y tanto su ausencia como una concentración por sobre su nivel característico pueden ser perjudiciales para el organismo humano. Las masas atómicas de sus dos isótopos estables, Cu-63 (69,09%) y Cu-65 (30,91%), son 62,93 uma y 64,9278 uma respectivamente. Calcule la masa atómica promedio del cobre. 2. El litio es un elemento químico cuyas sales (particularmente el carbonato de litio y el citrato de litio) se emplean en el tratamiento de manías y depresiones bipolares. Las masas atómicas del Li-6 y Li-7 son 6,0151 uma y 7,0160 uma respectivamente. Calcule la abundancia natural de estos dos isótopos. La masa atómica promedio del Li es 6,941 uma. Nota: La masa molar de todos los elementos se encuentra en la tabla periódica. 5.1.2 Masa molecular Ya sabemos cómo obtener la masa de un átomo de cada elemento (a través de cálculos o directamente de la tabla periódica), así que podemos obtener fácilmente la masa de una molécula de un compuesto. Para hallar la masa molecular de las moléculas (algunas veces denominada peso molecular) solo se suman las masas atómicas de los átomos que forman la molécula. Ejemplo: La masa o peso molecular del agua (H2O) es la siguiente: 2 átomos de H x 1,00 uma = 2,00 uma 1 átomo de O x 16,00 uma = 16,00 uma Masa molecular del H20 es = 18,00 uma De igual modo, podemos calcular el peso molecular de una molécula de glucosa C6H12O6: esta será de 180 uma. Por otro lado, cuando hablamos de sustancias iónicas (como el NaCl), no es apropiado referirse a moléculas (sus átomos generalmente forman redes cristalinas llamadas unidad fórmula, no moléculas), por lo que tampoco debe hablarse de peso molecular. El peso de estas sustancias iónicas se obtiene de la misma forma que para las moléculas con enlaces covalentes, pero el término usado para expresarlo es peso fórmula. Ejemplo: El peso fórmula del cloruro de sodio (NaCl) es el siguiente: 1 átomo de Na x 23 uma = 23,0 uma 1 átomo de Cl x 35,5 uma = 35,5 uma Masa o peso fórmula del NaCl = 58,5 uma Unidad 5: Estequiometría 83 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 2 1. Usando tu tabla periódica, determina la masa molecular o peso fórmula de los siguientes compuestos: a) b) c) d) Propano (C3H8) Sulfato de calcio Cafeína (C8H10N402) 2, 4, 6- trinitrotolueno (TNT), C7H5(N02)3, 5.2 MOL Y EL NÚMERO DE AVOGADRO Ahora bien, debido a que los átomos tienen masas tan pequeñas, es imposible pesarlos de manera individual. Para cualquier situación real, lo que se maneja no son átomos o moléculas individuales, sino una enorme cantidad de ellos, pues aun la porción más pequeña de materia que puede manejarse seguramente contendrá un enorme número de átomos. Debido a ello, se hace necesario disponer de una unidad especial para referirse a esa gran cantidad de partículas elementales, llámense átomos o moléculas. Entonces, ¿cómo se llama aquella unidad? ¿Cuán grande tiene que ser? (Es decir, ¿de cuántas unidades estará formada?). ¿Es suficiente una decena, una centena, un millar…? ¿Cuánta cantidad de muestra de un elemento se debe tomar para obtener una masa en gramos numéricamente igual a sus pesos atómicos en uma? Responder estas interrogantes ha sido objeto de estudio durante al menos un siglo, a lo largo del cual se diseñaron experimentos muy ingeniosos para determinar dicho valor. Finalmente, en 1971, el Sistema Internacional de Unidades (SI) denominó mol a la magnitud física o cantidad de sustancia relacionada con el número de partículas. Asimismo, el SI define una mol como «la cantidad de sustancia que contiene tantas entidades elementales (átomos, moléculas, iones u otras partículas) como átomos hay exactamente en 12 g de carbono-12 puro». Este número se denomina número de Avogadro (NA) y el valor comúnmente aceptado es este: 1 mol = NA = 6,0221367 X 1023 partículas 6,022 x 1023 = 602 000 000 000 000 000 000 000. Para no volver a escribir este número gigantesco, lo sustituiremos por NA, símbolo del número de Avogadro. Con frecuencia, redondearemos el valor de número de Avogadro a 6,022 x 1023 partículas La extensión del NA es tan grande que trasciende la imaginación y obviamente no es un número útil para contar objetos observables a simple vista. Pero si este número extraordinariamente grande se emplea para contar objetos extraordinariamente pequeños, tales como átomos y moléculas, dará entonces como resultado una cantidad de materia fácilmente manejable. La mol es una unidad algo peculiar: al estar basada sobre un conteo de átomos o moléculas, la cantidad de masa total dependerá de cuánta masa tenga cada átomo, molécula o unidad fórmula. En la figura 6.3 tenemos algunos ejemplos. Unidad 5: Estequiometría 84 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 5.3 Masas de una mol de carbono, azufre y mercurio respectivamente Azufre (polvo amarillo), carbono (polvo negro) y mercurio (metal líquido brillante) Tabla 5.2 Masa de un mol de átomos o moléculas Elemento o compuesto Contiene Carbono Nitrógeno Hidrógeno gaseoso Agua 6,02 x 1023 átomos de C 6,02 x 1023 átomos de N 6,02 x 1023 moléculas de H2 6,02 x 1023 moléculas de H2O Masa 12,01 g 14,008 2,014 g 18,00 g Queda claro, entonces, que, cuando se opera con la mol, se debe especificar si se trata de átomos, de moléculas o de unidades fórmula (véase la tabla 6.2). Por otro lado, la masa de 1 mol de átomos, moléculas o unidades fórmula se denomina masa molar (M). Entonces, la masa molar se define como la masa (en gramos) de 1 mol de unidades, y sus unidades son g/mol. Ahora bien, podemos relacionar estos tres conceptos (mol, número de Avogadro y masa molar) para hallar el número de átomos o moles en una muestra pesada de cualquier elemento. Ejemplo 1: ¿Cuántos átomos hay en 0,551 g de potasio (K)? Estrategia: ¿Qué factor de conversión se necesitará para convertir masa a átomos de K? – Mol de átomos de K y número de Avogadro – Mol de átomos de K y masa molar del K Se determina el factor de conversión adecuado a fin de que la masa se cancele y se obtengan los átomos como respuesta. Solución: Factor de conversión: – 1 mol de átomos de K = 6,022 x 1023 átomos K – 1 mol de átomos de K = 39,10 g Unidad 5: Estequiometría 85 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Usamos los factores adecuados: También podemos hallar el número de moles: y, luego, hallamos el número de átomos: N = nNA = 0,0141 x 6,022 x 1023 = 8,49 x 10 21 átomos K De similar modo, podemos relacionar la masa de un compuesto, el número de moles del compuesto y el número de moléculas del compuesto. Ejemplo: El ácido acetilsalicílico C9H804 es el principio activo de la aspirina. ¿Cuál es la masa en gramos de 9,5 x 10 18 moléculas de ácido acetilsalicílico? Solución: Tenemos que: – 1 mol de C9H804 = (12x9) +(1x8)+ (16x4) = 180 g; y – 1 mol de moléculas = 6,022 x 1023 moléculas de aspirina. Entonces, podemos relacionar mol, masa y moléculas de la siguiente forma: Unidad 5: Estequiometría 86 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 5.4 Relación mol, masa molar y moléculas Transformemos: Autoevalúate 3 1. El zinc es un metal plateado que se utiliza para fabricar latón (mezcla de zinc con cobre) y para recubrir hierro con la finalidad de prevenir su corrosión. ¿Cuántos gramos de Zn hay en 0,356 moles de Zn? 2. Calcula el número de milimoles de ácido sulfúrico en 0,147 g de H2S04. 3. El azufre (S) es un elemento no metálico que está presente en el carbón. Cuando el carbón se quema, el azufre se convierte en dióxido de azufre y finalmente en ácido sulfúrico, lo cual ocasiona el fenómeno de la lluvia ácida. ¿Cuántos átomos de S hay en 16,3 g de C? 4. Calcula el número de átomos de hidrógeno en 39,6 g de sulfato de amonio (NH4)2SO4. 5.3 RELACIONES DE MASA EN LOS COMPUESTOS QUÍMICOS Como se ha visto en el capítulo 5, un compuesto químico se representa mediante su fórmula química. Entonces, la fórmula de un compuesto nos indica su composición. Composición representa no solo a los elementos presentes, sino también a la proporción en la cual se combinan los átomos. A partir de esta información, podemos obtener la composición en peso de los elementos que forman parte del compuesto. 5.3.1 Composición centesimal de los compuestos La composición centesimal en masa (composición porcentual) es el porcentaje en masa de cada elemento presente en un compuesto. Unidad 5: Estequiometría 87 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Ejemplo: En una muestra de 200 g de agua, hay 22,38 g de hidrógeno y 177,62 g de oxígeno. Por tanto, los porcentajes de los dos elementos son: %H= Peso de H x 100 Peso del H2O %H= 22,38 x 100 = 11,19% 200 %O= %O= Peso de O x 100 Peso del H2O 177,6 x 100=88,81% 200 Entonces, la composición centesimal del agua es de 11,19% de H y 88,81% de O. Por otro lado, conociendo la fórmula de un compuesto, se pueden calcular los porcentajes en masa de los elementos que lo constituyen. Para los cálculos respectivos, se recomienda comenzar con una mol del compuesto. Ejemplo: El ácido fosfórico H3PO4 es un líquido incoloro y dulce que se utiliza en dentífricos y bebidas gaseosas para realzar el sabor. Calcule la composición centesimal de este compuesto. Solución: Se recomienda dibujar una tabla para determinar la masa de cada elemento. Se asume una mol del H3PO4: Elemento H P O n 3 mol 1 mol 4 mol x x x x M 1,00 30,97 16,00 H3PO4 = = = = = m 3,00 30,97 64,00 97,97 Dado que 97,97 g de H3PO4 contiene 3,00 g de H, 30,97g de P y 64,00 g de O, entonces: %H= Peso de H x 100 Peso del H3PO4 %H= 3,00 x 100= 3,06% 97,97 %O= Peso de O x 100 Peso del H3PO4 %O= 64,00 x 100 = 65,32% 97,97 %P= Peso de P x 100 Peso del H3PO4 %P= 30,97 x 100= 31,62% 97,97 Autoevalúate 4 1. El nitrato de amonio (NH4NO3) se emplea como fertilizante nitrogenado. Calcula los porcentajes de masa de los elementos en el nitrato de amonio. Unidad 5: Estequiometría 88 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 2. Una muestra de 3,87 mg de ácido ascórbico (vitamina C) por combustión genera 5,80 mg de CO2 y 1,58 mg de H2O. ¿Cuál es la composición porcentual de este compuesto? El ácido ascórbico contiene solamente C, H y O. 5.3.2 Fórmula química de un compuesto Como hemos visto, existe una relación directa entre las propiedades de un compuesto y su estructura. Entonces, si se quiere predecir las propiedades físicas y químicas de un compuesto, es esencial conocer su estructura. La estructura de un compuesto está expresada en su fórmula química, y la información que podemos extraer de ella depende del tipo de fórmula. Tenemos cuatro tipos de formulas: – Fórmula empírica – Fórmula verdadera o molecular – Fórmula estructural (revela, cuáles son los elementos que componen la molécula y su número, así como de qué manera están dispuestos y enlazados entre sí) – Fórmula espacial (indica lo mismo que la fórmula estructural, además de la disposición tridimensional de sus átomos) Nota: Las fórmulas estructural y espacial serán detalladas en el siguiente capítulo. Ahora, ampliemos la información sobre las fórmulas empírica y molecular. Fórmula empírica La fórmula más simple o empírica para un compuesto representa la menor relación de números enteros de átomos presentes en una molécula del compuesto. Dado que la masa es expresada en gramos, nos referimos a una mol de molécula y a la mínima relación de moles de átomos que forman el compuesto. Se conoce como fórmula empírica porque es la que se deduce de los experimentos de combustión. Ejemplo: Se tiene un compuesto cuyo análisis por combustión nos indica que contiene un 25,7% de C, un 1,43% de H, 22,8% de O y un 50,0% de Cl en peso. ¿Cuál es su fórmula empírica? Pasos por seguir: – Enlistar los elementos que forman el compuesto – Colocar la masa de cada elemento. Si nos dan el porcentaje, asúmanse 100 g de muestra. – Hallar las moles de átomos de cada elemento – Hallar la relación de moles mediante la división de cada una de las moles obtenidas entre la menor Unidad 5: Estequiometría 89 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ – Debemos obtener números enteros o casi enteros. Redondeemos o multipliquemos por un número para obtener número enteros. Una forma conveniente de resolver estos problemas es insertar los datos en una tabla: Elementos Masa (g) C 25,7 Moles (masa/M*) 25,7 = 2,14 12 1,43 1,43 = 1,43 H 1 22,8 22,8 = 1,43. O 16 50,0 50 = 1,43 Cl 35,5 (*) M = masa de 1 mol de átomos Relación Formula empírica 2,14 = 1,5 1,43 1,43 = 1 1,43 1,43 = 1 1,43 1,43 = 1 1,43 Se ha obtenido 1,5 , entonces todo se multiplica x 2 C3H2O2Cl2 Autoevalúate 5 1. Determina la fórmula de un compuesto que tenga la siguiente composición porcentual en peso: 24.75% K, 34.77% Mn, 40.51% O. Calcule la fórmula empírica para un compuesto con 43.7 g P (fósforo) y 56.3 g de oxígeno. Fórmula molecular La fórmula molecular indica el número real de los átomos presentes en una molécula del compuesto. No confundamos el número de átomos de una molécula con su proporción (fórmula empírica). Así, si tenemos una molécula que contiene 2 átomos de carbono y 4 de hidrógeno, su fórmula molecular sería C2H4, mientras que la empírica sería CH2. La fórmula química de un compuesto obtenida mediante el análisis de sus elementos siempre será la fórmula empírica. Para obtener la fórmula molecular, se deben conocer la masa molar del compuesto y su fórmula empírica. La fórmula molecular de un compuesto es la misma o un múltiplo entero de la fórmula empírica: Fórmula molecular = n x fórmula más simple Así, podemos escribir: Masa molar fórmula verdadera = n x masa molar fórmula empírica La fórmula molecular se obtiene al multiplicar la fórmula empírica por el número entero n: Unidad 5: Estequiometría 90 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Ejemplo: La vitamina C (ácido ascórbico) tiene 40,92% de C, 4,58% de H, y 54,50% de O en masa. La masa molar de este compuesto es de 176 g/mol. ¿Cuál será su fórmula molecular? Solución: Como ya tenemos su masa molar (176 g/mol), lo que nos falta es la fórmula empírica: Elementos Masa (g) C 40,92 H 4,58 O 54,5 Moles (masa/M) 40,92 = 3,407 12 4,58 = 4,58 1 54,5 = 3,406 16 Relación 3,407 = 1 3,407 4,58 = 1,33 3407 54,5 = 1 3407 Formula empírica Se ha obtenido 1,33, entonces todo se multiplica x 3 C3H4O3 Esta es la fórmula empírica para el ácido ascórbico. Pero ¿y la fórmula molecular? Tenemos que la masa molar de este compuesto es de 176 g/mol. ¿Cuál es la masa molar de su fórmula empírica?: (3x12) + (4x1)+ (3x16) = 88 g/mol Entonces: Masa molar = n x masa molar de la fórmula empírica 176 = n x 88 n=2 La fórmula molecular se obtiene al multiplicar la fórmula empírica por el número entero 2: Fórmula molecular del ácido ascórbico = C 6 H 8 O6 Autoevalúate 6 1. Algunas investigaciones indican que el glutamato monosódico (MSG), un potenciador de sabor para alimentos, sería causante del llamado «síndrome del restaurante chino», ya que puede ocasionar dolores de cabeza y de pecho. El MSG tiene la siguiente composición porcentual en masa: 35.51% de C, 4.77% de H, 37,85% de O, 8,29% de N, y 13,60% de Na. Determina su fórmula molecular, si su masa molar es 169 g/mol. 2. La glucosa es un carbohidrato formado por C, H y O. Una muestra de 0,1014 g de glucosa pura se quemó en un tren de combustión de C-H para producir 0,1486 g de Unidad 5: Estequiometría 91 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ CO2 y 0,0609 g de H20. Por otro lado, experimentos muestran que el peso molecular de la glucosa es de 180 uma. Determina su fórmula molecular. 3. El ácido láctico se produce en los músculos cuando se dispone de poco oxígeno, y es el responsable de los calambres musculares cuando se efectúan ejercicios violentos. También ocasiona acidez en derivados lácteos. Un análisis químico muestra que el ácido láctico contiene 39.9% de C, 6.73% de H, y 52.28% de O, en peso. Si su masa molar es 90 g/mol, determina la fórmula molecular del ácido láctico. Hasta aquí, hemos observado las relaciones de masa de los átomos que forman parte de una molécula, esto es, de los elementos que forman parte de un compuesto. Ahora, debemos ver las relaciones de masa de estos compuestos cuando forman parte de un proceso o cambio químico. Dichos cambios se representan mediante ecuaciones químicas. 5.4 RELACIÓN MOL - MASA EN UNA REACCIÓN QUÍMICA Como podemos observar, las ecuaciones químicas constituyen un lenguaje preciso para indicar no solo los aspectos cualitativos de los cambios químicos, sino también los aspectos cuantitativos. Así, pues, las ecuaciones químicas sirven para calcular las cantidades de sustancias que intervienen en las reacciones químicas. Los coeficientes de una ecuación química balanceada se pueden interpretar, tanto como los números relativos de moléculas comprendidas en la reacción (a nivel microscópico) o como los números relativos de moles (a nivel macroscópico). A partir de una ecuación balanceada, podemos deducir una serie de relaciones matemáticas sencillas. A la relación cuantitativa de los elementos que intervienen en una reacción química se la denomina estequiometría. Veamos, entonces, lo siguiente: A nivel microscópico: CH4(g) 1 molécula + 2 O2 (g) 2 moléculas → CO2(g) + 2 H2O 1 molécula 2 moléculas A nivel macroscópico: CH4(g) A nivel de moléculas NA=6,02x1023 moléculas A nivel de moles 6,02x1023 moléculas = 1 mol A nivel de masa 1 mol = 1 masa molar Ley de conservación de la materia Unidad 5: Estequiometría 6,02x1023 + 2 O2 (g) 2 x 6,02x1023 1 mol 2 moles 16 g 2 x 32 g 80 g → CO2(g) + 2 H2O 6,02x1023 2 x 6,02x1023 1 mol 44g 2 moles 2x 18g 80 g 92 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Como vemos, podemos relacionar moles, moléculas, masas de los reactantes y productos que forman parte de una reacción química. Ejemplo 1: El sodio es un metal reactivo que reacciona en forma instantánea al estar en contacto con agua, ante lo que genera gas hidrógeno y una disolución de hidróxido de sodio, NaOH. ¿Cuántos gramos de sodio metálico son necesarios para obtener 7,81 g de hidrógeno, según la siguiente reacción? Solución: 1. Planteamos y balanceamos la ecuación: 2Na(s) + 2 H2 O (l) → 2 NaOH (ac) + H2 (g) 2. Colocamos los datos y las relaciones estequiométricas respectivas: 2 Na(s) + 2 H2 O (l) Dato RE → 2NaOH (ac) Xg 7,81 g 2 moles 46 g 1 mol 2g + H2 (g) 3. Hallamos la cantidad solicitada: 7,81g H2 x 1 mol H2 2 g H2 1 mol H2 x 2 mol Na x 23 g Na = 177,85 g de Na 1 mol Na Ejemplo 2: El amoníaco utilizado en ciertos preparados farmacéuticos se obtiene a partir de la reacción del nitrógeno con el hidrógeno. La ecuación ajustada es esta: N2 (g) + 2 H2(g) → 2 NH3 (g) Determina la masa en gramos de amoníaco, NH3, que se forma cuando reaccionan 1,34 moles de N2: N2 (g) + 2 H2(g) → 2 NH3 (g) Dato: 2,5 moles Xg R. E 1 mol 2 moles 28 g 34 g 1,34 mol N2 x 2 mol NH3 x 17 g NH3 1 mol N2 1 mol NH3 Unidad 5: Estequiometría = 177,85 g de Na 93 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 7 1. La reacción entre el hidróxido de sodio (NaOH) y el ácido sulfúrico (H2SO4) es de neutralización con producción de sulfato de sodio (Na2SO4) y agua. Entonces: a) ¿Cuántos gramos de hidróxido de sodio se necesitan para neutralizar 392,32 g de ácido sulfúrico? b) ¿Cuántas moles de hidróxido de sodio se emplearon? 2. El ácido clorhídrico, HCl, reacciona con el oxígeno a temperaturas altas para formar cloro (Cl2) y agua. Entonces: a) ¿Cuántos gramos de HCl se necesitan para formar 0,6 moles de Cl2? b) ¿Cuántas moles de O2 han reaccionado? c) ¿Cuántas moléculas de agua se han producido? 5.4.1 Reactivo Limitante Está claro que, para poder obtener una determinada cantidad de producto se debe utilizar la cantidad de reactivos que la estequiometría de esa reacción indique. Ejemplo: La reacción siguiente, indica que si se desea obtener 1 mol de CO2 y 2 moles de H2O se deberá poner a reaccionar 1 mol de metano y 2 moles de oxígeno. Los coeficientes estequiométricos de la ecuación química balanceada indican que esas son las cantidades necesarias. CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O(g) Ahora bien, si deseamos obtener 8 moles de agua como producto de la combustión del metano, obviamente tendré que usar 4 moles de CH4 y 8 moles de O2. En este caso todo el metano y el oxigeno reaccionará y ningún reactivo sobrará. Cuando se trabaja de esta manera se dice que estamos trabajando con cantidades estequiométricas. Pero por lo general empleamos una cantidad menor o mayor que la estequiometría me indica sobre todo cuando uno de los reactivos es muy costoso ó difícil de conseguir. Unidad 5: Estequiometría 94 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Para determinar la cantidad de producto que se obtendrá es necesario corroborar si los reactivos están o no en relaciones estequiométricas. Si no lo están es imprescindible identificar el reactivo limitante. Ejemplo 1. ¿Cuántas moles de agua se producirán si mezclamos 200 g de oxigeno y 40 g de hidrogeno? a) Se debe plantear y balancear la ecuación 2H2 (g) + O2 (g) → 2 H2O b) Se coloca los datos 40 g 200 g c) Se coloca las RE correspondientes. 4g 32 g (g) X moles 2 moles d) Se determina el reactivo limitante (RL) y el reactivo en exceso (RE). Se usa un artificio para determinar el Reactivo Limitante Dividir Dato/RE El reactivo que de la MENOR RELACION el Reactivo limitante y el de mayor relación es el reactivo en exceso. e) Finalmente se determina la cantidad de producto usando el reactivo limitante X = 12,5 moles 5.5.2 Rendimiento Porcentual La cantidad de producto que se suele obtener de una reacción química, es menor que la cantidad teórica. Esto depende de varios factores, como la pureza de los reactivos, las reacciones secundarias que puedan tener lugar, perdida de reactantes al operar, etc. La cantidad de producto que obtenemos mediante cálculos basados en la estequiometría de la reacción se denomina rendimiento teórico. La cantidad de producto que realmente (experimentalmente) se obtiene se denomina rendimiento real. Luego, el rendimiento de una reacción se calcula mediante la siguiente fórmula: rendimiento (%) = cantidad real de producto × 100 cantidad ideal de producto Cuando uno de los reactivos está en exceso, el rendimiento deberá calcularse respecto al reactivo limitante. Unidad 5: Estequiometría 95 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. El Cl tiene dos isótopos cuyas masas atómicas relativas son 34,97 y 36,95. Si se sabe que la masa atómica relativa promedio es 35,4545, la abundancia del primer isótopo es: a) b) c) d) e) 10,35 37,31 89,64 62,69 Ninguna de las anteriores 2. El peso molecular del sulfato de cobre pentahidratado es (CuSO4 - 5H2O). En uma, es: Dato: PA en uma Cu = 65.54, S = 32, O =16, H =1 a) 187,54 b) 472,16 c) 161,54 d) 251,54 e) Ninguna de las anteriores 3. ¿Cuál de las siguientes relaciones es incorrecta? a) Reacción de síntesis: ocurre cuando dos sustancias se combinan para formar un solo producto. b) Desplazamiento simple: ocurre cuando un elemento sustituye a otro elemento que forma parte de un compuesto. c) Reacción de descomposición: ocurre cuando un solo reactante formar dos o más productos. d) Reacción de combustión: ocurre cuando se produce un intercambio de iones entre dos compuestos para formar otros productos. e) Reacción endotérmica: ocurre cuando la reacción consume energía. 4. En 0,5 moles de C4H10, ¿cuántos moles de átomos de carbono y cuántos moles de átomos de hidrogeno están presentes? a) 4 y 5 b) 2 y 5 c) 4 y 10 d) 2 y 10 e) 4 y 20 Unidad 5: Estequiometría 96 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 5. La composición centesimal de Fe, S, y O, respectivamente; en el Fe2(SO4)3, es de: Dato: PA en uma Fe = 56, S 32, y O = 16,00 a) 24%, 28%, 48% b) 28%, 24%, 48% c) 33,33%, 16,66%, 50,01% d) 50,01%, 16,66%, 33,33% e) Ninguna de las anteriores 6. ¿Cuántas moléculas de H3PO4 pueden obtenerse a partir de 100 g de P4O10, si la reacción es la mostrada? Dato: PA en uma P = 31, H =1, O =16 P4H10 + 6H2O → 4H3PO4 a) 4 moléculas b) 4,49 x 1023 moléculas c) 17,97 x 1023 moléculas d) 2,40 x 1028 moléculas e) Ninguna de las anteriores 7. El peso molecular del ácido cítrico es 192,13 y el compuesto contiene 37,51% de C, 58.29% de O, y 4,20% de H. Entonces, ¿cuál es la fórmula molecular del ácido cítrico? a) C6H8O7 b) C5H8O7 c) C6H8O8 d) C7H8O8 e) Ninguna de las anteriores 8. El metal sodio reacciona con agua para dar hidróxido de sodio e hidrógeno gaseoso según la ecuación química: Na (s) + H2O (l) → NaOH(aC) + H2 (g) Si 10,0 g de sodio reaccionan con 8,75 g de agua: ¿Cuál es el reactivo limitante? a) Na b) H2O c) NaOH d) H2 e) Ambos se consumen totalmente Unidad 5: Estequiometría 97 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 9. El aluminio reacciona con el azufre gas para dar sulfuro de aluminio. Inicialmente se combinan 1,18 mol de aluminio con 2,25 mol de azufre. ¿Cual es el reactivo limitante? y ¿cuál es el rendimiento porcentual de sulfuro de aluminio?, si se producen 0,45 moles del mismo. a) S; 67,72% b) Al; 76,27% c) S; 76,27% d) Al; 4,27% e) Ninguno 10. Se requiere producir hidrógeno gaseoso mediante la ecuación indicada. Cuántos gramos de hidrógeno se producirán usando 100 g de hidruro de calcio en suficiente cantidad de agua?: Dato: PA en uma Ca = 40, H =1, O =16 CaH2 (s) + H2O(l) → Ca(OH)2(ac) + H2(g) a) 0,053. b) 4,762 c) 0,105. d) 9,524 e) 19,048 Unidad 5: Estequiometría 98 VI. SOLUCIONES 6.1 TIPOS DE SOLUCIONES 6.2 SOLUBILIDAD 6.3 EXPRESIÓN DE LA CONCENTRACIÓN 6.3.1 6.3.2 6.3.3 6.3.4 Concentración porcentual ppm Molaridad Normalidad 6.4 DILUCIÓN EJERCICIOS INTEGRADORES Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ VI. SOLUCIONES 6.1 TIPOS DE SOLUCIONES La mayor parte de gases, líquidos y sólidos en nuestro entorno son mezclas de alguna sustancia disuelta en otra. Los componentes individuales de estas mezclas no se encuentran unidos unos con otros, sino que conservan su propia identidad, por tanto, su proporción en la mezcla puede variar. Hay diferentes tipos de soluciones. En una solución homogénea, no es posible distinguir los componentes, así por ejemplo el agua azucarada es homogénea, el azúcar no se distingue del agua. Sin embargo si al agua azucarada se le exprime limón, se pueden observar los componentes pepas, pulpa y el agua azucarada. Las mezclas homogéneas, conocidas en forma general como dispersiones, pueden presentar algunas características, que dependen del tamaño de las partículas dispersadas. Tabla 6.1 Principales características de las dispersiones Tipo de dispersión Solución Verdadera Tamaño de partícula dispersada(A°) <100 Coloide (Entidad dispersa de Entre 100 y 10 mayor tamaño que la 000 del disolvente) Suspensión (entidad dispersa de > 10 000 gran tamaño o no miscible en el disolvente) Ejemplo Estabilidad - Iones - Covalentes muy Buena, difícil de polares. separar sus componentes - Leche - Crema para Regular, pueden manos precipitar pero no de - Sangre forma espontánea. - Algunos medicamentos - Glóbulo rojo Escasa, sedimentan y se separan en dos fases : plasma y glóbulos rojos Una solución es una mezcla de una o más sustancias llamadas soluto, que es la sustancia presente de la menor cantidad, que se dispersa de forma uniforme en otra llamada dispersante (solvente), presente en mayor cantidad. Puesto que no reaccionan unos con otros se pueden mezclar en diferentes proporciones, será posible tener agua azucarada más o menos dulce, dependiendo de la proporción de azúcar (soluto) en el agua (solvente). Los solutos y solventes pueden ser sólidos, líquidos o gaseosos, pero la solución que forman tiene el mismo estado físico del solvente, así, cuando el azúcar (sólido) se disuelve en agua (liquido) se tiene una solución liquida. En las bebidas carbonatadas (gaseosas) el CO2 es el soluto y el agua el solvente. Unidad 6: Soluciones 100 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Tabla 6.2 Algunos ejemplos de soluciones Tipo de Solución Gaseosa: Gas en gas Ejemplo Aire Líquidas: - Sólido en líquido - Líquido en líquido Tintura de yodo Vinagre Sólidas: - Líquido en sólido - Sólido en sólido Amalgama dental Acero Soluto Oxigeno Solvente Nitrógeno Yodo(s) Acido acético(l) Alcohol (l) Agua (l) Mercurio (l) Carbono (s) Plata (s) Hierro (s) Tipos de soluto y de solventes El agua es considerada como el solvente universal debido a sus propiedades únicas, en una molécula de agua, debido a que el oxigeno es mucho más electronegativo que el hidrogeno y a su forma angular, la molécula resulta muy polar. Los puentes de hidrogeno se forman por la atracción entre le átomo de oxigeno de una molécula de agua y el átomo de hidrogeno de otra molécula Figura 6.1 Puente de hidrogeno entre dos moléculas de agua y entre varias moléculas A pesar de que el puente de hidrógeno es más débil que un enlace, son muchas las moléculas de agua que se encuentran unidas, por lo que juega un papel muy importante en las propiedades del agua. Para formar una solución es necesario que exista atracción entre las moléculas del soluto y las del disolvente. Las características del agua hacen posible que compuestos iónicos, tipo el cloruro de sodio (NaCl) se puedan disolver al entrar en contacto con el agua ya que el átomo de oxigeno del agua, cargado negativamente, atrae a los iones de sodio Na+1 y los de H atraen a los iones Cl-1 y según se van separando, la superficie del sólido va quedando expuesta al agua, que continua separándolos hasta que todos se encuentran en solución. De la misma forma es posible disolver sustancias moleculares (enlaces covalentes) si la molécula tiene un grupo polar, en el caso del etanol (CH3CH2OH), tienen el grupo polar (– OH, forman puente de hidrogeno) que atrae moléculas de agua, lo mismo sucede si la molécula es suficientemente polar. Sin embargo, las moléculas apolares, como por ejemplo Br2 ó aceite requieren sustancias no polares para poder formar una solución. Unidad 6: Soluciones 101 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Las polaridades de un soluto y un disolvente deben ser semejantes para poder formar una solución “Lo semejante disuelve a lo semejante” Una forma para analizar el tipo de soluto presente en una solución es su capacidad para conducir la corriente eléctrica. Hay soluciones electrolíticas y no electrolíticas Soluciones electrolíticas Son electrolitos aquellos solutos que se disuelven en agua y se separan en iones y son capaces de conducir la corriente electrica. Es posible probar esta capacidad conectando un par de electrodos a una bombilla electrica. Dependiendo de la cantidad de iones en solución pueden ser electrolitos fuertes y electrolitos débiles y la bombilla encenderá con mayor o menor intensidad. Un electrolito fuerte se disocia completamente al disolverse en agua, como sucede con las sustancias iónicas como por ejemplo. NaCl(s) H2O Na+1(ac) + → MgSO4(s) H2O → Cl-1(ac) Mg+2(ac) + SO4-2(ac) Un electrolito débil se disuelve primordialmente como moléculas completas, solo una pequeña parte se separan para producir un pequeño número de iones en solución. Tal es el caso de ácidos y bases consideradas débil. HF(g) H2O H+1(ac) + F-1(ac) Soluciones no electrolíticas Las moléculas se disuelven completas, no se separan, simplemente son rodeadas por el agua gracias a las fuerzas intermoleculares que puedan estar presentes. Por ejemplo el azúcar (sacarosa) se disuelve conservando su unidad. Figura 6.2 Moléculas de azúcar (sacarosa) en solución Sacarosa Sacarosa Autoevalúate 1 1. Identifica el soluto y el solvente en los siguientes casos: a) 100 mL de agua y 4 g de azúcar. b) 2 g de I2 y 60 mL de alcohol c) 60 mL de etanol y 10 mL de agua. 2. Indica para cada una de las siguientes sustancias si será más probable que se disuelva en agua o más bien lo hará en tetracloruro de carbono (CCl4) Unidad 6: Soluciones 102 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ a) b) c) d) e) f) NaNO3 Gasolina (no polar) CH2Cl2 CH3OH KCl HCl 3. Clasifica cada soluto como electrolito fuerte, débil o no electrolito. ¿Esperas que la solución contenga iones o moléculas? ¿Esperas que conduzca la corriente? a) b) c) d) CH3CH2OH MgCl2 HClO NaOH 6.2 SOLUBILIDAD Se dice que el azúcar común es soluble en agua. ¿Qué significa soluble? Por nuestra experiencia diaria sabemos que hay un límite en cuanto a la cantidad de azúcar que puede disolverse en cierta cantidad de agua. Al afirmar que algo es soluble por lo general nos referimos a que se puede disolver una buena cantidad de azúcar. Sin embargo esta información no es precisa, podríamos decir “moderadamente soluble”, “ligeramente soluble”, “poco soluble”, etc. El termino solubilidad se refiere científicamente a la medida de cuanto soluto se puede disolver en determinada cantidad de solvente a determinada temperatura. Por ejemplo la solubilidad del cloruro de sodio (NaCl, sal común) es de 36 g por cada 100g de agua a 20°C. Una solución se denomina saturada cuando contiene exactamente la máxima cantidad de soluto que el solvente puede admitir y la llamamos insaturada, si la solución contiene una cantidad menor de soluto disuelto respecto al que podría admitir. Cuando se añade mayor cantidad del soluto del posible de disolver la denominamos sobresaturada y en consecuencia lo que sucede es que cierta cantidad del soluto permanece como tal. Significa que la velocidad en que las partículas son atraídas por el solvente es la misma que la velocidad con que las partículas de soluto se atraen entre si. Figura 6.3 Solubilidad dependiente de la cantidad de soluto. Solvente (agua) Solución insaturada Solución Saturada Solución Sobresatutrada ¿Qué efecto tiene la temperatura sobre la solubilidad? Unidad 6: Soluciones 103 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Como se aprecia en la figura siguiente, para la mayoría de sólidos la solubilidad aumenta con la temperatura, aunque algunas muestran poco cambio en la solubilidad y unas pocas son menos solubles. En cambio, los gases son menos solubles con el aumento de temperatura ya que a temperaturas más altas las moléculas gaseosas tienen mayor energía para escapar de la solución. Eso explica porque la vida acuática no es posible en agua caliente ya que el oxigeno disuelto disminuye considerablemente. Figura 6.4 Solubilidad de sólidos comunes en agua en función de la temperatura Autoevalúate 2 1. Establezca en cada ejemplo si se trata de una solución saturada, insaturada o sobresaturada: a) Un cristal que se agrega a una solución no cambia su tamaño. b) Una cucharadita de azúcar se disuelve completamente al añadirla a una taza de café. c) Se forma una capa de azúcar al fondo de una taza de té según se va añadiendo hielo. 2. Usando la tabla adjunta señala la condición saturada, insaturada o sobresaturada para los siguientes casos: Sustancia KCl NaNO3 C12H22O11 (azúcar) a) b) c) d) Solubilidad (g/100 g de agua) 20°C 50°C 34 42,6 88 114 203,9 260,4 Se añaden 25 g de KCl a 100 g de agua. 300 g de azúcar en 400 mL de agua. Una solución con 60 g de KCl en 200 mL de agua a 50°C se enfría a 20°C. Una solución que contiene 100 g de NaNO3 a 20°C se calienta hasta 50°C Unidad 6: Soluciones 104 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 6.3 EXPRESIÓN DE LA CONCENTRACIÓN Como hemos visto, la cantidad de soluto disuelta en una solución puede variar. La concentración de una solución es la medida de la cantidad de soluto que hay en una cantidad específica de disolvente. Hay varias maneras de expresar la concentración de las soluciones, pero todas especifican la cantidad de soluto en una cantidad dad de solución. Las unidades usadas pueden ser físicas o químicas, las más utilizadas: Unidades físicas Concentración porcentual Unidades químicas Molaridad ppm Normalidad 6.3.1 Concentración porcentual Describe la cantidad del soluto por cada 100 partes de solución. Se utiliza con frecuencia el porcentaje en masa y por lo general cuando se trata de dos líquidos el porcentaje en volumen. Porcentaje en masa Describe la masa de soluto por cada 100 g de la solución. Se emplea mas a menudo cuando se trata de sólidos disueltos en líquidos. Asi 35% (m/m) de HCl significa que hay 35 g de HCl en cada 100g de solución. Se expresa matemáticamente según: Porcentaje en masa = % = masa de soluto x 100 masa total de solución Porcentaje en volumen Si tanto el soluto como el solvente son líquidos, las concentraciones se pueden expresar como porcentaje en volumen. Cuando el frasco de alcohol comercial dice 70% (v/v) se entiende que a 70 mL de alcohol se ha agregado agua hasta completar los 100mL de solución, matemáticamente se expresa: Porcentaje en volumen = %(v/v) = Volumen de soluto Volumen total de solución x 100 Porcentaje masa-volumen Es menos frecuente, pero es posible expresa la concentración como la masa de soluto, respecto al volumen de la solución. Al tener 25%(m/v) de NaCl significa que hay 25 de soluto en cada 100 mL de la solución. Matemáticamente: Porcentaje masa-volumen = %(m/v) = Unidad 6: Soluciones masa de soluto x 100 Volumen total de solución 105 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 6.3.2 ppm Cuando la concentración de soluciones es extremadamente baja (muy diluidas, muy poca cantidad de soluto) suele expresarse en partes por millón. Una concentración de 1ppm significa que hay una parte en un millón de partes, por ejemplo 1g en un millón de gramos de solución, una gota en un millón de gotas, un mililitro en un millón de mililitros, etc. En soluciones acuosas y cuando la densidad de la solución es 1g/mL se puede decir que 1ppm es equivalente a 1mg/L de solución. masa de soluto x 106 masa total de solución ppm = 6.3.3 Molaridad Es el método más común que se utiliza en química para expresar la concentración de soluciones. La molaridad (M) establece el número de moles de soluto en exactamente un litro de solución. Su expresión matemática: Molaridad = M = moles de soluto Litros de solución Por ejemplo si un mol de NaCl se disuelve en suficiente agua para completar un litro de solución la concentración resultante será 1M 6.3.4 Normalidad Es una unidad cada vez mas en desuso, sin embargo en muchos exámenes clínicos y análisis cuantitativo se sigue usando. Se refiere al número de equivalentes gramo de soluto contenido en un litro de solución. Matemáticamente: Normalidad = N = Donde: N° equivalentes-g de soluto Litro de solución Nº eq - g soluto = masa(g) P eq P eq (soluto) = Sustancias Valor de θ Ácidos Depende de H Bases, óxidos, sales Estado de oxidación del catión x n°de átomos del catión + Masa molar Ѳ Ejemplo HCl : 1 H2SO4 : 2 H3PO4 : 3 NaOH : 1 Ca(OH)2 : 2 CaO :2 Al2O3 : 6 Na2CO3: 2 Al2(CO3) 3 : 6 Regla Practica: N = M x θ Unidad 6: Soluciones 106 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Ejemplo 1. ¿Como prepararía 1L de una solución 0,02M de CaCO3 a 20°C ? Si, M = moles L luego, 0,02M = x moles de CaCO3 1L → x = 0,02 moles de CaCO3 0,02 mol CaCO3 x 100g = 2 g de CaCO3 mol El procedimiento a seguir será: a) En un vaso de precipitados se pesan 2 g de CaCO3 b) Se añaden unos 50 mL de agua y se transfiere a la fiola de 1000 mL. c) Se agrega agua suficiente para llenar la fiola o matraz hasta la marca de 1L d) Se tapa y se agita de modo de homogenizar la mezcla. 2. Exprese la concentración de la solución preparada en 1 en %(m/m), %(m/v), ppm y Normalidad si la densidad de la solución es 1,02 g/mL Se trata de una solución acuosa de poca concentración, con la densidad se determina la masa de solución. Por tanto, un litro de solución pesa: 1L x 1000mL x 1,02g = 1020 g L mL Unidad 6: Soluciones 107 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ luego: % (m/m) = 2 g (soluto) x 100 = 0,196 % 1020 g(solución) %(m/v) = ppm = 2 g (soluto) x 100 = 0,2 % 1000 mL(solución) 2 g (soluto) x 106 = 1960 ppm 1020 g(solución) Peso equivalente = 100/2 = 50 N = 0,04 eq –g 1L = 0,04 N N° eq – g = ó bien 2g /50 = 0,04 N = M x θ = 0,02 x 2 = 0,04 N Autoevalúate 3 1. ¿Cómo prepararía 250 mLde una solución acuosa de NaCl al 5%? 2. ¿Cuantos mL de una solución de HCl 12M se deberán emplear para obtener 0,5 moles de HCl? 3. ¿Cuál es el porcentaje en volumen en una solución de alcohol isopropílico que se preparo mezclando 25 mL de alcohol con agua suficiente para completar un volumen de 200 mL de solución? 4. El límite de Zn en el agua potable es de 5 ppm. Exprese esa concentración en g/L y en molaridad. 5. El ácido nítrico concentrado es al 70% ¿Cuántos gramos de ácido hay en 500 g de la solución de acido concentrado? 6.4 DILUCIÓN Con frecuencia se requiere preparar una solución a partir de una solución más concentrada. En el proceso denominado dilución se agrega agua u otro disolvente para tener un volumen mayor y una concentración menor. Se puede preparar una solución de cualquier concentración que se desee, siempre y cuando sea menor de la inicial. De la misma forma que si el café quedo muy dulce se añade agua para bajar la concentración, pero lo que se mantiene igual es la cantidad de azúcar (soluto), de forma análoga para preparar una solución menos concentrada se aumenta solvente, pero se mantiene la cantidad de soluto. El número de moles de soluto en una solución se puede determinar multiplicando el volumen por la molaridad según: N° de moles = Volumen (en L) x moles = moles de soluto en la solución L Unidad 6: Soluciones 108 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Durante la dilución el número de moles de soluto no cambia. Inicial n1 = V1M1 Por tanto: + Final donde n1 = n2 n2 = V2M2 agua V1M1 = V2M2 Las unidades de volumen no deben ser forzosamente litros, pero se deben emplear las mismas unidades para V1 y V2. De modo análogo las concentraciones pueden indicarse en molaridad, porcentaje o cualquier otra unidad siempre que sean las mismas unidades. La ecuación general es: V1C1 = V2C2 Ejemplo ¿Cuántos mililitros de ácido clorhídrico concentrado (12M) se requieren para preparar 400 mL de una solución 2M Inicial V1 = ¿? M1 = 12 M V1x12 = 500 mL x 2 Final V2 = 500 mL M2 = 2 M → V1 = 83,3 mL Se tomaran 83,3 mL de ácido 12M y completar con agua el volumen hasta los 500 mL. Unidad 6: Soluciones 109 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. Si NaCl tiene una solubilidad de 36g /100g de agua a 20ºC Una solución que contiene 75 g de NaCl en 208 g de agua es: a) b) c) d) e) Una solución saturada Una solución sobresaturada. Una solución insaturada. Es un coloide. Es una solución no electrolítica. 2. Al disolver CH3NH2 en suficiente agua: a) b) c) d) e) Se trata de un electrolito fuerte. Se trata de un electrolito débil. La solución podrá conducir la corriente eléctrica. Se trata de una sustancia molecular. Ninguna de las anteriores. 3. En una solución se cumple: a) b) c) d) e) El soluto se encuentra en mayor cantidad. Siempre hay soluto y solvente. Siempre se expresa la concentración en función al solvente. Es una mezcla líquida. El soluto reacciona con el solvente. 4. El KNO3 tiene una solubilidad de 34g/100g agua a 20ºC. Para los siguientes casos determine cual corresponde a una solución sobresaturada: a) b) c) d) e) 36g de KNO3 y 200g de agua. 17 g de KNO3 y 50 g de agua 68 g de KNO3 en 150 g de agua. 25 g de agua y 12 g de KNO3 51 g de KNO3 y 150 g de agua. 5. ¿Cuantos mL de ácido clorhídrico 2M se requieren para que reaccionen con 30 g de Mg(OH)2? 2HCl + Mg(OH) → MgCl2 + 2H2O a) b) c) d) e) 500 mL 123,7 mL 510 mL 255 mL 175,7 mL Unidad 6: Soluciones 110 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 6. ¿Cuántos mL de una solución al 10% (v/v) de alcohol etílico se necesitara para obtener 5 mL de alcohol etílico? a) b) c) d) e) 10 mL 90 mL 100 mL 50 mL 25 mL 7. Una solución 0,34N de KNO3 ¿Qué cantidad de agua deberá agregarse a 50 mL para que 1L de la solución diluida contenga 10,1g a) b) c) d) e) 300 mL 250 mL 294,11 mL 172,5 mL 244,11 mL 8. Se analizó una solución que contiene iones Pb+2 que se hace reaccionar con otra de Na2SO4 0,01M para que se forme el sólido PbSO4. Se usaron 28 mL de Na2SO4. Determine la afirmación verdadera de las siguientes: a) b) c) d) e) Reaccionaron 0,28 moles de Na2SO4 Reaccionaron 2,8x10-2 moles de Na2SO4 La masa de Na2SO4 son iguales a la masa de Pb Reaccionaron 2,8x10-4 moles de Na2SO4 Reaccionaron 2,8x10-3 moles de Na2SO4 9. Las reacciones de neutralización son muy importantes a nivel biológico. Suponga que reaccionan 10 mL de NaOH 0,1N con 20 mL de HCl 0,05M a) b) c) d) e) Las moles de NaOH son mayores a las moles de HCl Las moles de NaOH son el doble de las moles de HCl. Las moles de NaOH son la mitad de las moles de HCl Las moles de NaOH son iguales a las moles de HCl Las moles de NaOH son menores a las moles de HCl. 10. Una concentración se puede expresar en varias unidades. Una solución 500ppm de Na2SO4 es: a) b) c) d) e) 0,5%(m/m) 0,0025 M 0,007 N 0,025%(m/v) 0,035 N Unidad 6: Soluciones 111 VII. GASES 7.1 GASES 7.2 PROPIEDADES DE LOS GASES 7.3 TEORIA CINETICA MOLECULAR DE LOS GASES 7.4 LEYES DE LOS GASES 8.4.1 Ley de Boyle 8.4.2 Ley de Charles 8.4.3 Ley de Avogadro 8.4.4 Ecuación general de los gases ideales 8.5 MEZCLA DE GASES 8.6 EFUSION Y DIFUSION DE GASES 8.7 ESTEQUIOMETRIA DE GASES Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ VIII. GASES 7.1 GASES Los gases son el estado menos compacto y más móvil de los tres estados de la materia. Un gas es un conjunto de átomos o moléculas que se encuentra en este estado a temperatura y presión normal o estándar es decir a 0°C y 1 atm de presión, que se mueven con independencia a través de un volumen que es sobre todo, espacio vacío. Las colisiones de las partículas en movimiento al azar contra las paredes del recipiente ejercen una fuerza por unidad de área que percibimos como presión. Presión (P) = Fuerza (F) Area (A) La unidad del sistema internacional (SI) para la presión es el pascal, pero son de uso más común la atmosfera y el milímetro de mercurio. Según S.I.: Pascal = Pa = N/m2 Otras unidades 1 atm = 760 mmHg = 760 torr 1 atm = 101 325 Pa Presión atmosférica Es la presión que la atmósfera ejerce sobre la superficie de la Tierra. Tabla 7.1 Composición volumétrica de la atmosfera Unidad 7: Gases 113 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Atmósfera La masa que rodea la Tierra. No se conoce el límite exterior de la atmósfera; pero más del 99% de ella queda por debajo de una altura de 32 Km (20 millas) 7.2 PROPIEDADES GENERALES DE LOS GASES − Sus partículas se encuentran relativamente separadas. − Sus partículas son muy móviles. − Los gases toman la forma y ocupan todo el volumen del recipiente que los contiene. − Los gases se comprimen con facilidad. 7.3 TEORIA CINETICO MOLECULAR: Para el estudio de los gases se ha diseñado un gas ideal, este gas es un modelo teórico De acuerdo a la teoría cinética molecular un gas consiste en moléculas en movimiento constante y aleatorio y cumplen con los siguientes postulados: 1. El volumen de las partículas del gas es despreciable en comparación con el volumen total. 2. No hay fuerzas entre las partículas, ni atracción ni de repulsión. 3. Las colisiones de las partículas del gas son elásticas. 4. La energía cinética promedio de las partículas del gas es proporcional a su temperatura absoluta. 5. Un gas que sigue la teoría cinética molecular es un gas ideal. 7.4 LEYES DE LOS GASES A diferencia de los sólidos y líquidos, gases diferentes tienen un comportamiento físico muy similar, sin que importe su constitución química. Por ejemplo, el helio y el flúor, aunque con propiedades químicas muy distintas, son casi idénticos en cuanto a su comportamiento físico. Las propiedades de los gases quedan definidas por cuatro variables: − presión (P), − temperatura (T), − volumen (V), y Unidad 7: Gases 114 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ − moles (n). Las relaciones específicas entre estas cuatro variables se denominan leyes de los gases. 7.4.1 Ley de Boyle Relaciona la presión y el volumen de un gas, manteniendo la temperatura constante. También se le denomina ley de las Isotermas El volumen de un gas varía inversamente con la presión. Es decir V α 1/P o PV = k, a n y T constantes. Figura 7.1 Ley de Boyle Ejemplo Si 4,00 L de gas a 1,04 atm sufren un cambio de presión a 745 mmHg a temperatura constante, ¿Cuál es su volumen final? Datos: V1 = 4,00 L P1 = 1,04 atm P2 =745 mmHg Como: 1 atm => 760 mmHg entonces, P2= 745 mmHg (1 atm / 760mmHg) = 0,98 atm V2 = ? De acuerdo a La ley de Boyle P1V1= P2V2 Aplicando: V2= ((1,04 atm) (4.00L)) / 0,98 atm = 4.25 L Unidad 7: Gases 115 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 7.4.2 Ley de Charles: Relación el volumen y la temperatura de un gas, manteniendo constante la presión. También se le denomina ley de las isobaras. El volumen de un gas varía directamente con su temperatura. Es decir, V α T o V/T = k, a n y P constantes. Figura 7.2 Ley de Charles 7.4.3 Ley de Avogadro Relación entre el volumen y la cantidad de sustancia, manteniendo constante la presión y la temperatura. El volumen de un gas varía directamente con su cantidad de sustancia. Es decir, V α n o V/n = k, a T y P constantes Figura 7.3 Ley de Avogadro Unidad 7: Gases 116 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 7.4.3 Ecuación general de los gases ideales Las tres leyes individuales de los gases se combinan en una sola ley de los gases ideales: PV = nRT Donde R = constante universal de los gases cuyos valores son: R = 0,082 atm L/mol K = 62,4 mmHg L/mol K = 8,314 kPa L /mol K El volumen molar estándar de un gas ideal es de 22,4 L, a temperatura y presión estándar (TPN) es decir temperatura 0°C y presión 1 atm. Ejemplo: El hidrógeno (H2) es un gas incoloro, inodoro. Calcule la presión (en atm) ejercida por 1,82 moles del gas en un recipiente de acero de 5,43 L de volumen a 69,5ºC. Usando la ecuación general de los gases y despejando la presión (P) queda: nRT V (1,82mol) (0,0821L x atm / K xmol) (69,5 + 273 )K P= 5,43L P = 9,42atm P= Autoevalúate 1 1. Una muestra de gas ocupa un volumen de 521 mL a 0,75 atm. Si la temperatura se mantiene constante, ¿Cuál será la nueva presión si el volumen aumenta a 766mL? 2. Una lata de rocío en un volumen de 456 mL contiene 3,18 g de gas propano (C3H8) como propelente. a) b) c) Calcule la presión del gas a 23°C; ¿Qué volumen ocupa el propano a temperatura y presión normal? La etiqueta de la lata indica que la exposición a temperaturas mayores de 130°F podría explosionar. ¿Que presión habría en la lata a esta temperatura? Unidad 7: Gases 117 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 7.5 MEZCLA DE GASES IDEALES Las leyes de los gases se aplican a mezclas gases y a gases puros. De acuerdo con la ley de Dalton de las presiones parciales, la presión total que ejerce una mezcla de gases en un recipiente es igual a la suma de las presiones que ejercería cada gas individual por si solo. Figura 7.4 Ley de Dalton Las presiones parciales de cada uno de los gases que componen la mezcla es igual a la fracción molar multiplicado por la presión total. La fracción molar es igual al número de moles del gas dividido entre el número de moles totales. PA = XA. PT Donde: PA = presión parcial del gas A XA = nA / nT XA = fracción molar del gas nA= numero de moles de A nT= numero de moles totales 7.6 EFUSION Y DIFUSION DE GASES Difusión Debido a su movimiento molecular, los gases exhiben la propiedad de la difusión, que es la capacidad de dos o más gases de mezclarse de manera espontanea hasta formar una mezcla uniforme. Unidad 7: Gases 118 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 7.5 Difusión de gases Efusión La efusión es un proceso mediante el cual las moléculas de gas escapan por un orificio muy pequeño de un recipiente de mayor presión a otro de menor presión. El químico escoses Thomas Graham (1 805 – 1 869) observo que la velocidad de efusión depende de la densidad de los gases. Figura 7.6 Efusión de gases Esta observación condujo a la ley de efusión de Graham: “La velocidad de efusión de dos gases a la misma temperatura y presión es inversamente proporcional a la raíz cuadrada de su densidad o masa molar” va = vb Mb Ma Donde: Va y Vb velocidad de efusión del gas a y b respectivamente Masa molar del gas a, y Mb, masa molar del gas b. Unidad 7: Gases 119 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 2 1. Una mezcla contiene 3,15 g de cada gas: CH4(g), C2H4(g) y C4H10(g), se encuentra en un matraz de 2,00L a 64°C. Calcula las presiones parciales de cada uno de los gases de la mezcla y luego calcula la presión total. 2. Se encuentra que un gas desconocido se difunde a través de una membrana porosa 2,92 veces más lento que el H2. ¿Cuál es la masa molecular del gas? 8.7 ESTEQUIOMETRIA EN GASES Se emplean las relaciones de cantidad (en moles, n) y Volumen reactivos y productos para resolver problemas de estequiometria. (V) de Figura 7.7 Cálculos estequiométricos involucrados en los gases Cantidad de reactivo (gramos o volumen) Unidad 7: Gases Moles de reactivo Moles de producto Cantidad de producto (gramos o volumen) 120 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. La presión externa de un avión de propulsión que vuela a gran altitud es considerablemente menor que la presión atmosférica estándar. Por ello, el aire del interior de la cabina debe presurizarse para proteger a los pasajeros. ¿Cuál es la presión (en atm) en la cabina si la lectura del barómetro es 688 mmHg? a) b) c) d) e) 0,96 atm 1 atm 0,905 atm 1,15 atm 9,6 atm 2. Suponga que tiene un cilindro con un pistón movible. ¿Qué pasaría al volumen del gas del cilindro si la presión disminuye en un 75% con T constante?, indica la proposición verdadera. a) b) c) d) e) Las moléculas del gas ocupan un menor volumen, disminuyendo las colisiones entre ellas. El volumen del gas aumenta debido a que se incrementa la cantidad de moléculas de gas. El volumen del gas se mantiene constante. El volumen del gas aumenta. Las moléculas ocupan mayor volumen, debido al incremento de la presión. 3. Un globo inflado que tiene un volumen de 0,55L a nivel del mar (1 atm) se eleva a una altura de 6,5 km, donde la presión es de 0,40 atm. Suponiendo que la temperatura permanece constante, ¿Cuál es el volumen final del globo? a) b) c) d) e) 0.95L 1,14L 2,0L 1,38L 2,34L 4. Un gas liberado durante la fermentación de glucosa (en la manufactura del vino) tiene un volumen de0, 78 L a 20,1°C y 1 atm. ¿Cuál es el volumen del gas a temperatura de fermentación de 36,5°C y 1 atm de presión? a) b) c) d) e) 1,42L 0,74L 0,82L 0,89L 22,4L Unidad 7: Gases 121 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 5. El volumen de un gas a TPN es de 488 mL. Calcula el volumen a 22,5 atm y 150 °C. a) b) c) d) e) 0,03 L 0,01 L 0,02 L 0,04 L 0,05 L 6. Por descomposición de clorato de potasio puede generarse oxigeno gaseoso según la ecuación siguiente: 2KClO3(s) → 2KCl(s) + 3O2(g) ¿Cuántos litros de oxigeno a condiciones normales de temperatura y presión (TPN) se producirán cuando también se formen 0,525 kg de KCl ? a) b) c) d) e) 67,2 L 236,7L 215,5L 69L 22,4L 7. Se coloca un gas desconocido en un matraz de 1,5 L a presión de 356 mmHg y temperatura de 22,5°C, y se encuentra que pesa 0,9847g. ¿Cuál es la masa molar del gas? a) b) c) d) e) 34 43 33 23 35 8. El oxigeno puro gaseoso se preparo por primera vez por calentamiento del oxido de mercurio (II), HgO: 2HgO(s) →2Hg(l) + O2(g) ¿Qué volumen (en litros) de oxigeno a TPN se libera al calentar 10,57g de HgO? a) b) c) d) e) 22,4 L 1,1 L 1, 6 L 0,5 L 2,0 L Unidad 7: Gases 122 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 9. ¿Cuál es la masa molar de un gas que se difunde a través de una membrana porosa 1,86 veces más rápido que el Xe? a) b) c) d) e) 38 28 35 39 40 10. Suponga que toma un matraz, lo evacua para retirar todo el aire y encuentra que su masa es de 478,1g. Después llena el matraz con argón a una presión de 2,15 atm y lo vuelve a pesar. ¿Cuál sería la lectura en la balanza (en gramos) si el matraz tuviera un volumen de 7,35L y la temperatura fuera de 20°C? a) b) c) d) e) 511 504 520 493 478 Unidad 7: Gases 123 VIII. CINETICA QUIMICA 8.1 CINETICA QUIMICA 8.2 VELOCIDAD DE REACCION 8.3 TEORIAS PARA EXPLICARLA VELOCIDAD DE REACCION 8.1.1 Teoría de las colisiones 8.1.2 Teoría del complejo activado 8.2 FACTORES QUE AFECTAN LA VELOCIDAD DE REACCION 8.2.1 Naturaleza de los reactivos 8.2.2 Temperatura 8.2.3 Concentración de reactivos 8.2.4 Catalizadores 8.3 LEY DE VELOCIDAD Y ORDEN DE REACION 8.3.1 Determinación experimental de la ley de velocidad 8.4 LEY DE VELOCIDAD INTEGRADA 8.4.1 Ley de velocidad integrada para una reacción de orden cero 8.4.2 Ley de velocidad integrada para una reacción de primer orden 8.5 TIEMPO DE VIDA MEDIA 8.5.1 Tiempo de vida media para una reacción de orden cero 8.5.2 Tiempo de vida media para una reacción de primer orden Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ VIII. CINETICA QUIMICA 8.1 CINETICA QUIMICA La cinética química estudia la velocidad con que ocurren las reacciones químicas y los mecanismos de ruptura y formación de nuevos enlaces entre átomos, moléculas ó iones, que conducen a su transformación en nuevos productos. La cinética química es un tema de importancia crucial en cuanto al ambiente, la biología y la economía. Ejemplo − − en la industria química, la rentabilidad de muchos procesos requiere que las reacciones sean rápidas. la síntesis de amoniaco, que se usa como fertilizante, depende de la velocidad a la que el N2 y el H2 gaseoso se convierten en NH3 8.2 VELOCIDAD DE REACCION: Las velocidades de las reacciones químicas difieren mucho. Algunas reacciones, como la combinación de sodio con bromo, ocurren al instante. Otras como la oxidación del hierro, son extremadamente lentas. Para describir en forma cuantitativa la velocidad de una reacción, se debe especificar que tan rápido cambia la concentración de un reactivo por unidad de tiempo. Velocidad = Cambio en la concentración Cambio en el tiempo Velocidad = ∆ [concentración] ∆ tiempo Las unidades más comunes de la velocidad de reacción son concentración molar por segundo (M/s). De manera general, la velocidad de una reacción, es igual a la velocidad de consumo de reactivo o la formación de producto divido entre su coeficiente estequiometrico en la ecuación balanceada. De esta manera, para la reacción: aA + bB → cC Velocidad de desaparición reactivos = Velocidad de aparición del producto V = - 1 ∆ [A] = - 1 ∆[B]= 1 ∆[C] a ∆t b ∆t c ∆t Nótese, que la velocidad de desaparición de los reactivos es negativa, debido a que este se consume para dar paso a la formación del producto. Unidad 8: Cinética Química 125 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 8.1 Trayectoria de una reacción química general Autoevalúate 1 1. Escriba la expresión de velocidad para la siguiente reacción: CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) 2. Considere la reacción: N2(g) + 3H2(g) → 2NH3(g) Suponga que, en cierto momento de la reacción, el hidrogeno molecular reacciona a una velocidad de 0,074 M/s. a) ¿Cuál es la velocidad de formación del amoniaco? b) ¿Cuál es la velocidad a la que reacciona el nitrógeno molecular? 8.3 TEORIAS PARA EXPLICAR LA VELOCIDAD DE REACCION 8.3.1 Teoría de las colisiones Las reacciones químicas ocurren como resultado de los choques entre las moléculas de los reactivos. En función de la teoría de las colisiones se espera que la velocidad de una reacción sea directamente proporcional al número de colisiones moleculares por segundo o a la frecuencia de las colisiones moleculares. Resulta que las colisiones entre las moléculas de reactivos, no son siempre efectivas, para que sean efectivas y ocurra la reacción deben colisionar con la orientación y energía suficiente para producir la ruptura y formación de enlaces. Unidad 8: Cinética Química 126 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 8.2 Tipos de colisiones 8.3.2 Teoría del complejo activado Se postula que para que haya una reacción las moléculas que chocan deben tener una energía cinética total igual o mayor que la energía de activación (Ea), que es la mínima cantidad de energía que se requiere para iniciar una reacción química. Cuando las moléculas chocan forman un complejo activado, una especie formada temporalmente por las moléculas de los reactivos, como resultado de la colisión, antes de formar el producto. En la figura 8,3 se muestran dos perfiles diferentes de energía para la reacción: A + B → C Figura 8.3 Diagrama de perfil de energía ∆H (- (a) Para una reacción exotermica Unidad 8: Cinética Química ∆H (a) Para una reacción endotermica 127 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Si los productos son más estables que los reactivos, entonces la reacción se verá acompañada por una liberación de calor, es decir, la reacción es exotérmica (∆H negativo). Por otra parte, si los productos son menos estables que los reactivos, entonces las mezclas de reacción absorberá calor de los alrededores y se tendrá una reacción endotérmica (∆H positivo). En los dos casos se hace una grafica de energía potencial del sistema y el avance de reacción, tal como se muestra en la figura 8.3 8.4 FACTORES QUE AFECTAN LA VELOCIDAD DE REACCIÓN 8.4.1 Naturaleza de los reactivos Cuando los reactivos tienen diferente estado físico, se tiene una mezcla heterogénea, se considera que a mayor superficie de contacto mayor numero de colisiones. Por lo tanto mayor velocidad de reacción. 8.4.2 Temperatura A temperaturas más altas, las moléculas de los reactivos tienen mayor energía cinética, se mueven más rápido y colisionan con más frecuencia y con mayor energía. Por lo tanto al incrementar la temperatura la velocidad de reacción incrementa, se sabe que por cada 10°C que incrementa la temperatura se duplica la velocidad de reacción. 8.4.3 Concentración de reactivos A medida que se incrementa la concentración de los reactivos también lo hacen la probabilidad de que colisiones las moléculas de los reactivos, por lo tanto la velocidad de reacción se incrementa. 8.4.4 Catalizadores Los catalizadores son sustancias que se añaden en pequeña cantidad para modificar la velocidad de una reacción. Este fenómeno se llama catálisis. Los catalizadores actúan formando complejos de menor energía de activación. Los catalizadores no se consumen en la reacción. Figura 8.4 Diagrama de perfil de energía para una reacción catalizada Unidad 8: Cinética Química 128 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 8.5 LEY DE VELOCIDAD Y ORDEN DE REACCION Se sabe que la velocidad de reacción depende de las concentraciones, planteamos una reacción general para un análisis más detallado: aA + bB → productos Donde A y B son los reactivos, y a y b son coeficientes estequiometricos en la ecuación química balanceada. La dependencia de la velocidad de reacción de la concentración de cada reactivo está dada por una ecuación llamada ley de velocidad. La ley de velocidad se escribe: Velocidad = - ∆[A] = k[A]m[B]n ∆t Donde k es la constante velocidad, los exponentes m y n en la ley de velocidad de reacción indican lo sensible que es la velocidad a los cambios en [A] y [B], mientras que por lo general no se relacionan con los coeficientes a y b. Un exponente de 1 significa que la velocidad depende linealmente de la concentración del reactivo correspondiente. Por ejemplo, si m=1 y [A] se duplica, la velocidad se duplica. Si m=2 y [A] se duplica, la velocidad se incrementa en un factor de 4. En general, la velocidad es proporcional a [A]m. Cuando m es igual a cero, la velocidad es independiente de la concentración de A debido a que cualquier número elevado a un exponente cero es igual a 1. Los valores de los exponentes de m y n determinan el orden de reacción, en relación con A y B, respectivamente. La suma de los exponentes (m + n) definen el orden general de reacción. Así por ejemplo en la ley de velocidad: Velocidad = k[A]2[B] Se dice que la reacción es de segundo orden con respecto a A, de primer orden con respecto a B y de tercer orden en general. Un método para determinar los valores de los exponentes en una ley de velocidad, es a partir de datos experimentales de velocidades y concentraciones. Por ejemplo: la oxidación en el aire del oxido nítrico, uno de los reactivos que contribuye a la formación de la lluvia acida: 2NO (g) + O 2(g) → 2 NO 2(g) En la tabla siguiente se presentan algunos datos de velocidades iniciales: Experimento [NO]inicial [O2] inicial 1 2 3 0,015 7,5 x 10-3 0,015 0,015 0,015 0,030 Unidad 8: Cinética Química Velocidad inicial de formación de NO2 (M/s) 0,048 0,024 0,192 129 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ En los dos primeros experimentos, se reduce a la mitad la concentración de NO de 0,015 a 7,5x10-3, al tiempo que se mantiene constante la concentración de O2. La velocidad inicial se reduce a la mitad, lo que indica que la velocidad depende de la concentración de NO, [NO]1. Cuando [NO] se mantiene constante y [O2] se duplica, la velocidad inicial se incrementa en un factor de 4, lo que indica que la velocidad depende de la concentración de O2 al cuadrado, [O2]2. Por lo tanto la ley de velocidad para la formación de NO2 es: Velocidad = - ∆[NO2] = k[NO]1[O2]2 ∆t De acuerdo con esta ley la velocidad, es de primer orden con respecto al NO, de segundo orden con respecto al O2 y de tercer orden en general. Para determinar el valor de k, se usan los datos de cualquiera de los experimentos de la tabla. Ejemplo: al despejar k en la ley de velocidad de reacción y sustituir la velocidad y las concentraciones iniciales del primer experimento se obtiene lo siguiente: K= Velocidad = 0,048 M/s [NO]1[O2]2 (0,015M)(0,0075M)2 = 5,6x104/ (M2.s) Las unidades de k dependen del número de términos de concentración en la ley de velocidad y de los valores de los exponentes. Autoevalúate 2 1. Considere la reacción: A→B La velocidad de la reacción es 1,6x10-2 M/s cuando la concentración de A es 0,35 M. Calcule la constante de velocidad si la reacción es de primer orden con respecto a A. 2. La reacción del oxido nítrico con hidrogeno a 1 280°C es: 2NO(g) + 2H2(g) → N2(g) + 2H2O(g) A partir de los datos, medidos a dicha temperatura, determine la ley de velocidad y calcule su constante de velocidad. Experimento [NO] [H2] 1 2 3 5,0 x10-3 10,0 x 10-3 10,0 x 10-3 2,0 x 10-3 2,0 x 10-3 4,0 x 10-3 Unidad 8: Cinética Química Velocidad Inicial (M/s) 1,3 x 10-5 5,2 x 10-5 10,4 x 10-5 130 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 8.6 LEY DE VELOCIDAD INTEGRADA Hasta este momento hemos visto la ley de velocidad, una ecuación que describe la forma en que la velocidad de una reacción depende de las concentraciones de los reactivos. Sin embargo, también es de interés la variación de las concentraciones de reactivos y productos con el paso del tiempo. Ejemplo Es importante conocer la velocidad a la que los contaminantes del aire están destruyendo la capa de ozono de la atmosfera, pero también queremos saber cuál será la concentración de ozono en 20 años y cuanto tiempo tomaría que la concentración se redujera en una cantidad dada, digamos 10%. 8.6.1 Ley integrada de primer orden Una reacción de primer orden es una reacción cuya velocidad depende de la concentración del reactivo elevada a la primera potencia. En una reacción de primer orden del tipo: A → producto La velocidad es: Velocidad = - ∆[A] ……….. (1) ∆t A partir de la ley de velocidad, también se sabe que: Velocidad = k[A] …………… (2) Al combinar las ecuaciones (1) y (2), se obtiene - ∆[A] = k[A], a partir de esta ecuación, es posible demostrar que: ∆t ln[A]0 = kt [A] reordenando se tiene: ln[A] = ln[A]o - kt ………… (3) Donde ln es el logaritmo natural, y [A]o y [A] son las concentraciones de A a los tiempos t=0 y t=t, respectivamente. La ecuación (3) tiene la forma de la ecuación de una recta, y = mx + b, en donde m es la pendiente de la recta de la grafica de la ecuación: ln[A] = (-k)(t) + ln[A]o y = mx + b Unidad 8: Cinética Química 131 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Por lo tanto, una grafica de ln[A] contra t es una línea recta con una pendiente negativa de –k. Este análisis grafico permite calcular la constante de velocidad k. En la figura se muestra las características de una reacción de primer orden. Figura 8.5 Grafico para una reacción de primer orden k ln[ A ] 2 − ln[ A]1 = t 2 − t1 Pendiente = k 8.6.2 Ley integrada de orden cero En una reacción de orden cero del tipo A → productos, es aquella que tiene la ley de velocidad: Velocidad = - ∆[A] = k[A]0 = k(1) = k ∆t En el curso de la reacción, la velocidad permanece constante (=k), independiente de las concentraciones del reactivo. La ley de velocidad integrada es: [A] = -kt + [A]o ………………. (4) Esta es otra ecuación de forma y = mx + b, por lo que la grafica de [A] contra el tiempo es una línea recta con pendiente = -k. Figura 8.6 Grafico para una reacción de orden cero Unidad 8: Cinética Química 132 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 8.7 TIEMPO DE VIDA MEDIA La vida media que se simboliza con t1/2, es el tiempo que se requiere para que la concentración del reactivo disminuya a la mitad de su valor inicial. Considere la reacción de primer orden: ln[A] = (-k)(t) + ln[A]o Por la definición de vida media, cuando t = t1/2, [A] = [A]0/2, por lo que: t1/2 = ln2 k ………( 5 ) La ecuación (5) indica que la vida media de una reacción de primer orden es independiente de la concentración inicial del reactivo. Por lo tanto, tarda el mismo tiempo para que la concentración del reactivo disminuya desde 1M hasta 0,5M o que disminuya desde 0,10M hasta 0,05M. Para una reacción de orden cero, considere la reacción: [A] = -kt + [A]o Cuando t = t1/2, [A] = [A]0/2, por lo que: t1/2 = [A] 2k ………( 6 ) Autoevalúate 3 1. En un recipiente de 500 mL se guarda 1,5 moles del isótopo radiactivo “A”. El tiempo de vida media para la desintegración de este isótopo es de 30 minutos. Determine su concentración al cabo de 2 horas, si sabe que la reacción cumple una cinética de primer orden. 2. ¿Cuál es la vida media de un compuesto si 75% de una muestra de este compuesto se descompone en 60 min? Suponga una cinética de primer orden. Unidad 8: Cinética Química 133 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. Indique verdadero (V) o falso (F) en cada una de las siguientes proposiciones: I. II. III. IV. a) b) c) d) e) El catalizador incrementa la velocidad de reacción disminuyendo la Ea. Un incremento de la temperatura, aumenta las colisiones entre las moléculas, por lo tanto incrementa la velocidad de reacción. A mayor superficie de contacto, menor velocidad de reacción. El catalizador se consume en la reacción. VFVV VFFF FVFF VVFF VVVV 2. La reacción de descomposición del pentoxido de dinitrogeno es: 2N2O3 → 4NO2 + O2 A partir de los siguientes valores, determine la ley de la velocidad [N2O3] 0,92 1,84 3,68 a) b) c) d) e) Velocidad(M/s) 0,95 x 10-5 1,9 x 10 -5 3,8 x 10 -5 V = k[N2O3]2 V=k V = k[N2O3]1 V = k[NO2][O2] V = k[NO2]2 3. Considere la reacción: A + B → productos A partir de los siguientes datos, obtenidos a cierta temperatura, determine el orden global de la reacción a) b) c) d) e) [A] [B] 1,5 1,5 3,0 1,5 3,0 1,5 Velocidad (M/s) 3,2 x 10-1 3,2 x 10-1 6,4 x 10-1 Cero 1 2 3 4 Unidad 8: Cinética Química 134 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 4. Con los datos del ejercicio 3, calcula el valor de la constante. a) b) c) d) e) 4,69 s 0,213 Ms-1 4,69 s-1 0,213 s-1 4,69 Ms-1 5. La reacción 2A → B es de primer orden con respecto a A, con una constante de velocidad de 2,8x10-2 s-1 a 80 °C. ¿Cuánto tiempo tomara (en segundo) que A disminuya desde 0,88M hasta 0,14M? a) b) c) d) e) 73,9 74,7 65,6 62,6 N.A 6. La descomposición de etano (C2H6) en radicales metilo es una reacción de primer orden, cuya constante de velocidad es 5,36x10-4 s-1 a 700 °C: C2H6(g) → 2CH3(g) Calcule la vida media en minutos. a) b) c) d) e) 23 22,5 23,5 23 21,5 7. La descomposición de cierto insecticida en agua sigue una cinética de primer orden con una constante de velocidad de 1,45 año-1 a 12 °C. Una cantidad de este insecticida se desecha en un lago el 1 de junio, lo que da lugar a una concentración de 5,0x10-7 g/cm3. Suponga que la temperatura promedio del lago es de 12 °C. Calcula la concentración de insecticida el 1 de junio del siguiente año. a) b) c) d) e) 2,1x10-7g/cm3 3,4 x 10-7M 1,2 x 10-7g/cm3 1,45 x 10-7M 2,1 x 107M 8. A partir de la pregunta (7) calcula el tiempo que se necesitara para que la concentración de insecticida disminuya a 3,0x10-7 g/cm3 a) b) c) d) e) 4 años 0,35 año 3 años ½ año 1 año Unidad 8: Cinética Química 135 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 9. La descomposición de N2O5 ocurre como sigue: 2N2O5(g) → 4NO2(g) + O2(g). La ecuación de velocidad es de primer orden. Si la constante de velocidad es de 4,82x10-4s-1.Calcula la concentración de N2O5 que ha reaccionado luego de 25 min de iniciada la reacción, si la concentración inicial de N2O5 es de 0,0240 M. a) b) c) d) e) 0,024M 0,016M 0,012M 0,015M 0,018M 10. Para una reacción A + B → C cumple con la siguiente ley de velocidad: Velocidad =k[B]2, ¿Cuáles son las unidades de k?. a) b) c) d) e) Ms Ms-1 M-1s-1 M-1s M-2s-1 Unidad 8: Cinética Química 136 EQUILIBRIO QUÍMICO 9.1 CONSTANTE DE EQUILIBRIO 9.2 PRINCIPIO DE LE CHATELIER 9.3 EQUILIBRIO IONICO 9.3.1 Ácidos y bases 9.3.1.1 Teoría de Arrhenius 9.3.1.2 Teoría de Bronsted y Lowry 9.3.1.3 Fuerza de Ácidos y bases 9.3.1.4 Auto ionización del agua 9.3.1.5 Escala de pH 9.4 EQUILIBRIOS EN DISOLUCIONES DE ÁCIDOS Y BASES 9.5 SOLUCIONES AMORTIGUADORAS 9.6 EQUILIBRIOS OXIDO – REDUCCIÓN 9.6.1 Agentes oxidantes y agentes reductores. 9.6.2 Potencial de una reacción redox 9.6.2.1 Potenciales estándar de celda 9.6.2.2 Potenciales de celdas en condición no estándar EJERCICIOS INTEGRADORES Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ IX. EQUILIBRIO QUÍMICO Una reacción química reversible es aquella que puede llevarse a cabo en uno u otro sentido. Por ejemplo la condensación y la evaporación son procesos opuestos y representan un equilibrio dinámico líquido – gas. En el punto de ebullición de la sustancia se establece un equilibrio dinámico cuando la velocidad de evaporación es la misma que la velocidad de condensación. Por tanto se tiene: Reacción directa: A (l) A (g) vd = kd [A] Reacción Inversa: A (g) A (l) vi = ki [A] Estas dos ecuaciones, para una ecuación reversible, se pueden escribir con una sola flecha que apunte en ambas direcciones A C y se dice que se encuentran en equilibrio. Toda reacción química alcanza el equilibrio a temperatura y presión constante en recipientes cerrados, donde no salgan ni entren sustancias. La consecuencia es que, en una reacción en equilibrio siempre hay presentes tanto reactivos como productos, cuyas proporciones varían. Sucede que las concentraciones de los productos pueden ser mucho mayores que las de los reactivos, de modo que el equilibrio se encuentra desplazado hacia la derecha, o bien que los reactivos sean más numerosos, en cuyo caso el equilibrio se encuentra desplazada hacia la izquierda. Una vez que se alcanza el equilibrio las concentraciones ya no cambian. De modo que en un equilibrio o reacción reversible se cumple: - Las velocidades de la reacción directa e inversa son iguales. - Las concentraciones de reactivos y productos permanecen constantes. Figura 9.1 Trayectoria de una reacción t=0 A= C= t1 t2 t3 Reactivo Producto AC vd = vi kd [A] = ki [C] kd ki Unidad 9: Equilibrio Químico = [C] = Keq [A] 138 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 9.1 CONSTANTE DE EQUILIBRIO Al llegar al equilibrio las reacciones opuestas ocurren a la misma velocidad y las concentraciones no cambian, este hecho se pueden usar para establecer una relación entre reactivos y productos que denominamos constante de equilibrio y viene expresada según: Para aA + bB cC + dD Donde los corchetes indican la concentración de las especies expresada en moles/L y el subíndice de Kc que la constante se expresa en función de las concentraciones. Una reacción en equilibrio, donde todas las sustancias se encuentran en el mismo estado es un equilibrio homogéneo. Cuando los reactivos o productos se encuentran en diferentes estados se tiene un equilibrio heterogéneo. En contraste con los gases y las soluciones acuosas, si se trata de líquidos o sólidos las concentraciones son constantes. Por lo tanto si en el equilibrio se encuentran presentes sólidos o líquidos puros, estos, no se incluyen en la expresión de la constante. Cuando se trata de sustancias gaseosas la constante de equilibrio se puede expresar en función de las presiones, denominándose Kp Ejemplo Escribir la constante de equilibrio Kc y Kp para los siguientes casos: a) SO2(g) + ½ O2(g) ↔ SO3(g) b) CaCO3(s) ↔ CaO(s) + CO2(g) Solución: Para a. Para b. Kc = Productos Reactivos [CO2] 1x1 Kc = Kc = [SO3] 1/2 [SO2] [O2] Kp = pSO3 pSO2 p1/2 O2 Kp = pCO2 Las constantes de equilibrio pueden ser muy grandes o muy pequeñas, la magnitud de la constante proporciona información, si una constante es grande (K>>1), al examinar la expresión de la constante, se tendrá gran cantidad de productos, por tanto la reacción esta muy desplazada hacia los productos; si por el contrario la constante es pequeña (K<<1) hay muy pocos productos en relación a los reactivos, lo que significa que el equilibrio se encuentra desplazado hacia los reactivos. Unidad 9: Equilibrio Químico 139 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Productos Reactivos Reactivos Productos K >>1 K<<1 Si tenemos una reacción como C A si Kd = a , Ki = 1/a La magnitud de una constante de equilibrio indica hasta que punto se ha llevado a cabo una reacción y permite predecir la dirección a la cual se lleva a cabo para alcanzar el equilibrio, en consecuencia también permite calcular las concentraciones en el equilibrio de las especies presentes y viceversa. Ejemplo 1 Para la reacción SO2(g) + ½ O2(g) ↔ SO3(g) se sabe que Kc a T =1000K es 2,8x102 ¿cuál es la concentración en el equilibrio de SO3 si se sabe que la concentración de SO2 es 0,03 M y la de O2 es 0,02M? Si KC = 2,8x102 = [SO3] [SO2] [O2]1/2 = [SO3] 0,03 x (0,02)1/2 → [SO3] = 1,18M Ejemplo 2 ¿Cuáles serán las concentraciones en el equilibrio a 1000K cuando las concentraciones iniciales de SO2 y O2 son 0,05M y 0,025M respectivamente? SO2(g) Inicialmente + ½ O2(g) SO3(g) ↔ 0,05 0,025 ------- Lo que reacciona -x -½x -------- Lo que se forma --------- --------- x 0,05 –x 0,025 – ½ x x Lo que queda en equilibrio Como Kc = 2,8x102 = x (0,05 – x)(0,025 – ½ x) → x1 = 0,072 M , x2 = 0,034M Se descarta x2 ya que resulta mayor que la concentración inicial, Por tanto, en el equilibrio: [SO3] = x = 0,034M luego x = 0,034M [SO2] = 0,05 - 0,034 = 0,016M y [O2] = 0,025 - 0,034/2 = 0,008M Unidad 9: Equilibrio Químico 140 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 1 1. Escriba la expresión para la constante de equilibrio Kc para las siguientes reacciones: a) CH4(g) + 2H2S(g) ↔ CS2(g) + 4H2(g) b) 2NO(g) ↔ N2(g) + O2(g) c) 4HCl(g) + O2(g) ↔ 2H2O(l) + 2Cl2(g) 2. Indica para cada caso si se trata de un equilibrio homogéneo u heterogéneo e indique como expresaría la constante de equilibrio Kp a) CO(g) + 2H2(g) ↔ CH3OH(l) b) N2O4(g) ↔ 2NO2(g) c) C(s) + 2H2(g) ↔ CH4(g) 3. Determine el valor de Kc para el siguiente equilibrio a 500ºC. En base al resultado deduzca si se trata de una reacción desplazada hacia los productos o hacia los reactivos. (Nota: No olvide verificar que la reacción este balanceada) N2g) + H2(g) Cuando ↔ NH3(g) [H2] = 0,4M , [N2] = 0,44M y [NH3] = 2,2M 4. Para La reacción de la pregunta 3. ¿Cuales son las concentraciones en el equilibrio si a 300K Keq = 1,55x102 siendo las concentraciones iniciales de N2 y H2 de 0,5M y 1,5M respectivamente? 9.2 PRINCIPIO DE LE CHATELIER Una reacción que se encuentra en equilibrio, lo mantiene siempre y cuando las condiciones se mantengan constantes. Sin embargo cualquier cambio que ocurra en las condiciones de la reacción perturbará el equilibrio. Al modificar alguna de las condiciones, el equilibrio se altera y las velocidades de las reacciones directa e inversa ya no serán iguales, luego el sistema buscara recuperar el equilibrio de forma que el sistema se desplaza de tal manera que pueda contrarrestar la perturbación producida. Por ejemplo, si se tiene una reacción donde una mezcla de gases A(g) + B(g) ↔ C(g) (reactivos y productos) se encuentran en equilibrio y se aumenta la presión del sistema, el equilibrio se desplaza para aliviar la presión, de tal forma que A y B reaccionaran más y así forman más C debido a que así hay menos cantidad de moles gaseosas. Los desplazamientos del equilibrio al aplicar una perturbación se conocen como el principio de Le Chatelier que se puede expresar según: Si se aplica una perturbación en las condiciones de un sistema en equilibrio, el sistema se desplaza en el sentido que alivia la perturbación Unidad 9: Equilibrio Químico 141 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ ¿Cuáles son esos factores que pueden alterar un sistema en equilibrio? Cambios de concentración Una reacción puede representarse por aA + bB ↔ cC + dD Si se aumentara la concentración de A, entonces está reaccionará con cierta cantidad de B, de modo que B disminuye y se incrementan C y D. El equilibrio se esta desplazando hacia la derecha con el objetivo de volver a recuperar el equilibrio, aunque con otras concentraciones se obtiene la constante de equilibrio. Figura 9.2 Efecto en el sistema en equilibrio N2(g) + 3H2(g) ↔ 2NH3 al añadir H2 El equilibrio se restablece con nuevas concentraciones. La mezcla en equilibrio contiene más reactivos y más productos, pero sus nuevas concentraciones en la expresión de equilibrio son nuevamente K. El principio de Le Chatelier indica que la perturbación causada por agregar una sustancia al equilibrio se alivia al desplazar el equilibrio consumiendo lo agregado. Cuando se retira alguna sustancia por tanto se alivia al formar esa sustancia. Ejemplo Para el equilibrio N2(g) + 3H2(g) ↔ 2NH3(g) Si se aumenta la concentración de N2 el equilibrio se desplaza formando más amoniaco, esto es consumiendo la especie agregada. Si se retira el amoniaco, el equilibrio recupera lo perdido es decir se desplaza hacia la derecha, pero si se retira N2 o H2 el equilibrio se desplazara a la izquierda, favoreciendo la reacción inversa. Unidad 9: Equilibrio Químico 142 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Cambio de Temperatura Las reacciones químicas pueden ser exotérmicas (liberan calor al entorno) o endotérmicas (absorben calor del entorno). Si una reacción es exotérmica en un sentido, será endotérmica la reacción inversa. Al cambiar la temperatura de un sistema, cambiamos la constante de equilibrio. Una vez alcanzado el equilibrio si se aumenta la temperatura el equilibrio se opone a dicho aumento desplazándose en el sentido que la reacción absorbe calor, es decir el sentido endotérmico. A Aumenta la temperatura + calor ↔ B A ↔ B K crece + calor K disminuye Se desplaza hacia la derecha (rx endotérmica) Se desplaza hacia la izquierda (rx endotérmica) Ejemplo: Para la reacción N2(g) + O2(g) ↔ 2NO(g) ∆H = 180 kJ Puesto que ∆H>0 , la reacción es endotérmica, luego es posible reescribir la reacción según: N2(g) + O2(g) + calor ↔ 2NO(g) Si T aumenta, K aumenta porque tenemos más producto Kc = Si T disminuye, K disminuye porque tenemos menos producto Kc = [NO]2 [O2] [N2] [NO]2 [O2] [N2] Cambios de Presión Cuando en una reacción participan gases, estos, ejercen presión. Tanto el volumen como la presión puede cambiar, sin embargo el valor de la constante no cambia. Aplicando el principio de Le Chatelier se deduce que si se incrementa la presión, las moléculas se acercan, la respuesta del sistema será desplazarse hacia donde disminuye el número de moles gaseosas. El efecto de reducir el volumen es por lo tanto exactamente el mismo y el sistema responde desplazándose hacia el lado de la reacción que contenga menos moles en estado gas. Ejemplo Para el sistema N2(g) + 3H2(g) ↔ 2NH3(g) Kc = [NH3]2 [H2]3 [N2] Si la mezcla en el equilibrio sufre un incremento de presión (reducción del volumen), como hay cuatro moles gaseosas en el lado izquierdo y dos moles en el lado derecho, al reducir el volumen el sistema responde de manera de poder reducir la presión, esto es se desplazará hacia los productos, donde hay menor cantidad de moles gaseosas. Al aumentar el volumen (reducir la presión) el efecto será el inverso, el sistema responde permitiendo la expansión de gases, esto es, se desplaza hacia los reactivos. Unidad 9: Equilibrio Químico 143 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 2 1. ¿Qué efecto tendrá cada uno de los cambios en la siguiente reacción: 2 CO(g) + O2(g) ↔ CO2(g) + calor a) b) c) d) Enfriar el sistema. Extraer el CO2 que se va formando. Disminuir la presión. Añadir O2 2. Determine si la constante de equilibrio aumenta o disminuye para cada uno de los casos de la pregunta 1. 3. Para una reacción A(g) + B(g) ↔ C (g) se tiene un valor de Kc = 3,75 a T = 300K y de Kc = 37 cuando T = 500K ¿Se trata de una reacción exotérmica o endotérmica? 4. Se desea evitar que ocurra la formación de NO ya que es un alto contaminante. Proponga formas para disminuir su producción, si la reacción es: 4NH3(g) + 5O2(g) ↔ 4NO +6H2O 9.3 EQUILIBRIO IONICO El equilibrio iónico es un tipo especial de equilibrio químico, donde se encuentran presentes sustancias iónicas, por lo tanto se habla de especies en solución acuosa, las cuales producen iones. Como ya se ha visto, una solución puede ser electrolítica (que permite la conducción de la corriente) y no electrolítica. Recordemos que los electrolitos pueden ser fuertes y débiles. Fuertes cuando la disociación en agua es prácticamente completa, es decir la constante de equilibrio es tan grande que tiende al infinito. Se trata de un electrolito débil cuando en solución acuosa la disociación es parcial y por lo tanto se tiene un valor finito para la constante. Hay dos tipos de equilibrios iónicos muy importantes por sus amplias aplicaciones industriales y por su primordial papel biológico, se trata de los equilibrios ácido – base y equilibrios de oxido – reducción. Un electrolito ácido, básico o neutro puede ser fuerte o débil. Veamos que son ácidos y bases. 9.3.1 Ácidos y bases Nos es muy familiar hablar de sustancias ácidas, tienen un sabor agrio, como el limón, el vinagre, en el estomago tenemos ácido clorhídrico que nos ayuda a digerir los alimentos, si el suelo es muy ácido o muy básico algunas plantas no se desarrollan adecuadamente, etc. Aunque la palabra base no resulte tan familiar, comemos y bebemos sustancias que son ácidos y bases, incluso nuestro organismo las produce, el equilibrio ácido – base en el cuerpo humano es delicado, incluso cuestión de vida o muerte. Unidad 9: Equilibrio Químico 144 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ ¿Qué son los ácidos y las bases? Existen varias teorías para responder esa pregunta. Para reconocerlos se toma en cuenta las siguientes características: Tabal 9.1 Características generales de ácidos y bases ¿Cómo reconocerlos? Hay varias teorías. 9.3.1.1 Teoría de Arrhenius Según esta teoría: - Los ácidos liberan iones hidrógeno (H+) cuando se disuelven en agua. - Las bases liberan iones hidroxilo (OH-) al disolverse en agua. Para saber si un compuesto es ácido o base basta colocar papel tornasol o agregar unas gotas de algún indicador de pH en la solución y ver el color que adquiere. En realidad no existen los iones H+ en solución acuosa, sino que la acidez se debe a la presencia de esos iones hidratados, es decir la presencia de H3O+. Algunos ácidos tienen más de un protón que pueden ceder, por ejemplo el acido sulfúrico H2SO4. Se debe considerar que no todas las sustancias que tienen átomos de H son ácidos, por ejemplo CH4 no es un ácido y no podrá donar protones. Los ácidos pueden ser oxácidos e hidrácidos y los llamados ácidos orgánicos o ácidos carboxílicos. HCl H2O H2O CH3COOH NaOH H3O+ + Cl- H2O (Ácido, electrolito fuerte) H3O+ + CH3COONa+ + OH- Unidad 9: Equilibrio Químico (Ácido, electrolito débil, tiene Keq) (Base, electrolito fuerte) 145 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 9.3.1.2 Teoría de Bronsted y Lowry Puesto que se trata de una disolución acuosa de sustancias, Bronsted y Lowry sugirieron definiciones más generales para ácidos y bases: − Un ácido es un donador de protones, dona un ión hidrogeno H+ − Una base es un receptor de protones, acepta un ión hidrogeno H+ En una solución de cualquier ácido (HA) hay una transferencia de un ión H+ al agua, por lo tanto el agua al aceptar el protón estará actuando como una base. Par ácido-base conjugado HA + Acido + (dona H ) H2O → Base + (acepta H ) A- + Solución acida H3O+ Par ácido-base conjugado Todos los ácidos de Arrhenius son también ácidos de Bronsted y Lowry Si se trata de Con una base (B), el agua actuará como un ácido y hay transferencia de un protón del agua hacia la base. Par ácido-base conjugado B Base + (acepta H ) + H2O → Ácido + (dona H ) BH+ + OH- Solución básica Par ácido-base conjugado Las sustancias que actúan como ácidos y como bases se llaman anfóteras. El agua es la sustancia anfótera más común. 9.3.1.3 Fuerza de Ácidos y bases Los ácidos fuertes se ionizan totalmente, por tanto son electrolitos fuertes y donan su protón al agua para formar iones H3O+ solo seis ácidos son fuertes Acido clorhídrico Acido sulfúrico Acido bromhídrico Acido yodhídrico Ácido nítrico Ácido perclórico HCl H 2SO4 HBr HI HNO3 HClO4 Los débiles son los que se ionizan en pequeña proporción. Unidad 9: Equilibrio Químico 146 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Ejemplo: − El ácido acético es un ácido representativo, el vinagre es una solución comercial aproximadamente al 5% de ácido acético, − el ácido carbónico (H2CO3), se forma cuando el CO2 reacciona con el agua y el ácido fosfórico se encuentran en todas las bebidas carbonatadas y en la sangre. En cuanto a las bases, entre las bases fuertes se encuentran todos los hidróxidos de los metales alcalinos (grupo IA), que son muy solubles en agua y tres del grupo IIA; hidróxido de Calcio Ca(OH)2 de estroncio Sr(OH)2 y de Bario Ba(OH)2 . Por otro lado los demás hidróxidos (incluso los de metales de transición son débiles. El amoniaco es otra base débil importante, es un gas a temperatura ambiente, pero se disuelve con facilidad en agua (amoniaco acuoso) y se disocia en aproximadamente 1%, muchos limpiadores domésticos contienen amoniaco. Son bases débiles también todos los derivados del amoniaco. Al observar un equilibrio de disociación de un ácido hay dos bases compitiendo por los protones H2O y A- , Si el agua es una base más fuerte se queda mayoritariamente con los protones, de modo que la disolución contendrá más cantidad de A- y H3O+ , de los contrario habrá más cantidad de HA y H2O. Si se trata de ácidos fuertes: ácido fuerte + base fuerte ácido más débil + base más débil Ejemplo H2SO4(ac) + Acido más fuerte H2CO3(ac) + Acido más débil H2O (l) → base más fuerte H2O (l) → base más débil HSO4- + HSO4- + base más débil base más fuerte H3O+ ácido más débil H3O+ ácido más fuerte Lo mismo sucede en el caso de las bases, es decir cuanto más fuerte sea un ácido más débil será su base conjugada y cuanto más fuerte sea una base, más débil será su ácido conjugado. Tabal 9.2 Algunos pares conjugados y su fuerza Crece fuerza del ácido Ácido perclórico Ácido clorhídrico Acido carbónico Acido cianhídrico Agua Unidad 9: Equilibrio Químico HClO4 HCl H2CO3 HCN H2O Ión perclorato Ión cloruro Ión carbonato Ión cianato Ión hidróxido - ClO4 ClHCO3 CN OH Crece fuerza de la base 147 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 9.3 Disociación en agua de ácido fuerte y ácido débil H3O+ HA A- HA HA H2O H H22O O H3O+ Acido fuerte AA- - Acido débil Autoevalúate 3 1. Para los siguientes compuestos determina si se trata de ácidos o bases. Muestra la teoría que estas aplicando para responder y determina si se trata de un ácido o base fuerte o débil. a) d) HBr KOH b) Al(OH) 3 e) CH3COOH c) f) H2SO3 CH3NH2 2. Reconoce los pares conjugados para los siguientes casos: a) H2O b) H2O c) HClO3 + + CN- HCN H3O+ HI OH- I- + H3O+ + H2O + + ClO3 - 3. Predice si el equilibrio en los siguientes casos se favorece hacia los reactivos o hacia los productos a) b) H3PO4 + H2O NH4 + + H2O ↔ H3O+ ↔ H3O+ + + H2PO4 NH3 4. Considera los siguientes ácidos y su constante de disociación. Reconoce los pares conjugados y determina que ácido será más débil. a) b) HCOOH + H2O ↔ HCOO- + H3O+ H2SO3 + H2O ↔ HSO3 + H3O+ Unidad 9: Equilibrio Químico Ka = 1,8 x10-4 Ka = 1,2 x10-2 148 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 9.3.1.4 Auto ionización del agua La capacidad de funcionar tanto como ácido o como base es una de las propiedades más importantes del agua, por tanto no es sorprendente que una molécula de agua pueda donar un protón a otra molécula de agua. Alrededor de una molécula por cada 500 millones transfiere un protón a otra molécula. Lo podemos representar. H2O ácido + H3O+ H2O base ácido + OH- base Kw = [H3O+] [OH-] = 10-14 Donde a 25°C Que representa el concepto de Bronsted y Lowry para ácidos y bases Entonces en el caso del agua [H3O+] = [OH-] = 10-7 Conforme se agregan iones H3O+ (provenientes de un ácido) van reaccionando con los de OH-, entonces [OH-] disminuye mientras [H3O+] aumenta hasta que el producto de las dos concentraciones es 10-14 Ejemplo: Si el jugo de naranja tiene una [H+] = 0,001M ¿Cuál es la [OH-]? De Kw se tiene [H3O+] [OH-] = 10-14 (0,001) [OH-] = 10-14 [OH-] = 10-14 / 10-3 = 10-11M 9.3.1.5 Escala de pH La mayoría de las concentraciones de iones hidrogeno u oxidrilo en solución acuosa son muy pequeñas. Sorensen, en 1909, propuso utilizar el exponente para expresar la acidez y crea la escala de pH que evita el empleo de potencias negativas (uso el operador matemático “p = - log”) pH = - log [H3O+] Desde entonces, el término "pH" se ha utilizado universalmente por lo práctico que resulta para evitar el manejo de cifras largas y complejas. Ejemplo [H3O+] = 0,0000001 = 1 × 10–7M es simplemente pH = 7 ya que: pH = – log[10–7] = 7 Podemos decir que el pH es una medida de la acidez de una sustancia en solución. Unidad 9: Equilibrio Químico 149 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 9.4 Escala de pH 0 1 2 3 4 5 7 6 8 9 más ácido 10 11 12 13 14 menos ácido (más básica) neutro Un cambio de una unidad en el pH corresponde a un cambio de 10 veces en la concentracion de iones hidrogeno. pH + pOH = 14 El operador matemático “p = - log”, también puede aplicarse a las constantes Ki. Por Ejemplo: Para un ácido de Ka = 1 x 10-5, pKa = 5 (ya que pki = –log[1 x 10-5] = 5) Para el agua Kw = 1 x 10-14 , pKw = 14 Figura 9.5 pH de diferentes líquidos corporales y algunas sustancias Fuente: http://mcgraw-medico.mailxmail.com/ Unidad 9: Equilibrio Químico 150 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Cuando se trata de ácidos o bases fuertes, puesto que la disociación es completa, no hay equilibrio, tenemos. HA(ac) + H2O(l) Al inicio Al final Luego: H3O+(ac) + → a --------- -------a A- (ac) ------a pH = - log [H3O+] = - log a Del mismo modo si se trata de bases fuertes, la disociación es completa. 9.4 EQUILIBRIOS EN DISOLUCIONES DE ÁCIDOS Y BASES Recordemos que mientras un acido o base fuerte están 100% disociados, los débiles se encuentran parcialmente disociados, por tanto como todo equilibrio presentan una constante de disociación o constante de ácido o base, denominada Ka o Kb HA(ac) + H3O+(ac) + H2O(l) A- (ac) Ka = [H3O+] [A-] / [HA] Por tanto a partir de las constantes de equilibrio es posible calcular valores de pH y concentraciones en el equilibrio. Ejemplo 1 Determine la concentración de todas las especies presentes y el valor de pH de una solución de HCN 0,1M si su Ka = 4,9x10-10 inicialmente reacciona se forma en el equilibrio HCN(ac) + H2O(l) 0,1 M -x ----0,1 –x Ka = 4,9x10-10 = [H3O+] [CN-] [HCN] H3O+(ac) + ----------x x ↔ = CN- (ac) ----------x x (x ) (x ) (0,1 – x) Como Ka es muy pequeña se puede anular los términos x que suman o resten. X2 = 0,1x4,9x10-10 Como x = [ H3O+] x = √0,1x4,9x10-10 = 7,0x10-6 pH = – log x = - log (7,0x10-6) = 5,15 Las concentraciones en el equilibrio: [HCN] = 0,1 - 7,0x10-6 = 0,1M aprox [H3O+] = [CN-] = 7,0x10-6 M Unidad 9: Equilibrio Químico 151 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Ejemplo 2 Determine la constante de equilibrio para el amoniaco (NH3) si el valor de pH es 11 y la concentración inicial es 0,055M NH3(ac) + H2O(l) 0,055 M -x ----0,055 –x inicialmente reacciona se forma en el equilibrio Kb = [NH4+] [OH-] [NH3] = ↔ NH4+(ac) + ----------x x OH- (ac) ----------x x (x ) (x ) (0,055 – x) Pero si pH = 11 y puesto que en la reacción aparece OH- , se requiere el valor de pOH, de modo que: pOH = 14 – pH = 3 Kb → [OH-] = 10-3 = x , luego = (x ) (x ) = (10-3) (10-3) = 1,8x10-5 (0,055 – x) 0,055 - 10-3 Autoevalúate 4 1. Determine si las soluciones siguientes son ácidas, básicas o neutras: a) [OH-] = 1,2x10-4 b) [H3O+] = 2,3x10-5 2. Calcule la concentración de [OH-] a partir de [H3O+] ó de [H3O+] partir de [OH-] a) [H3O+] = 3,6x10-10 b) [OH-] = 5,4x10-3 3. Dadas las siguientes concentraciones determine el valor de pH de la solución a) b) c) d) Bicarbonato de sodio con [H3O+] = 1,3x10-8 Limas con [OH-] = 6,25x10-11 Leche humana [OH-] = 2x10-7 Jugo gástrico [H3O+] = 1x10-2 4. Determine el pH de una solución preparada disolviendo 1,2 g de ácido nítrico para obtener 500 mL de solución. (Dato: el acido nítrico es un electrolito fuerte) 5. Escribe la ecuación iónica en equilibrio para las siguientes bases débiles en agua a) C2H5NH2 Unidad 9: Equilibrio Químico b) ClO2- 152 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 9.5 SOLUCIONES AMORTIGUADORAS Cuando un acido reacciona con una cantidad proporcional de base el resultado es la formación de una sal y agua. Este proceso recibe el nombre de neutralización. Se denominan soluciones amortiguadoras reguladoras, tampón o buffer a una disolución de ácido ó base débil y la sal de su base ó ácido conjugados es una mezcla ácido-base muy importante debido a que este tipo de mezclas regulan el valor de pH.. Una solución amortiguadora resiste un cambio de pH cuando se añaden pequeñas cantidades de ácido o base. Un ejemplo son muchos de los procesos biológicos. Por ejemplo la sangre debe mantener un pH entre 7,35 y 7,45, cualquier alteración por arriba o por debajo, si los valores de pH suben o bajan +/- 0,35 incluso pueden causar la muerte. Aun cuando obtenemos constantemente alimentos ácidos y básicos, los amortiguadores en la sangre son suficiente efectivos para mantener el Ph casi inalterable. Los amortiguadores más importantes en la sangre son: ácido carbónico (H3CO3) y bicarbonato de sodio (NaHCO3), el sistema mono-hidrógeno fosfato y dihidrógenofosfato (H2PO4-/ HPO4-2) y las proteínas. Las proteínas contienen iones carboxillato – COO-, que actúan como receptores de protones y además iones -NH3+ que donan protones para neutralizar el exceso de ácido. Para comprender como funciona un amortiguador aplicaremos el principio de Le Chatelier. Veamos para una solución amortiguadora de ácido acético y acetato de sodio. (Un ácido débil y la sal de su base conjugada) La sal se disocia completamente segun: CH3COONa → CH3COO – (ac) + Na+(ac) CH3COOH(ac) + H2O(l) CH3COO-(ac) + H3O+(ac) (**) y tenemos el ácido Al inicio tenemos aM bM Al adicionar ácido (H+(ac)) reaccionara con la base conjugada H+(ac) + CH3COO-(ac) CH3COOH de modo que el equilibrio (**) se desplaza hacia la derecha y se forma nuevamente la base perdida y se mantiene aproximadamente igual el valor de pH. Cuando se añade (OH-(ac)) reacciona con H3O+(ac) para formar agua OH-(ac) + H3O+(ac) H2O(l) y nuevamente se recupera el pH ya que el ácido acetico repone de inmediato los iones hidrogeno. Unidad 9: Equilibrio Químico 153 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ En el caso de una base débil y su ácido conjugado (sal), por ejemplo, amoníaco y cloruro de amonio NH4Cl → NH4+(ac) + Cl– (ac) NH3(ac) + H2O(l) NH4+(ac) + OH -(ac) El funcionamiento de amortiguación es el mismo. Por lo general las concentraciones de las especies acido o base débil y la sal son aproximadamente iguales La ecuación de Henderson-Hasselbach, expresa el pH de una solución amortiguadora formada por un ácido débil y su sal: pH = pka + log [base conjugada] [Ácido] [Base conjugada] = [Sal] Para una base débil y su sal es: pOH = pkb + log [ácido conjugado] [base] [Ácido conjugado] = [Sal] Ejemplo: Se tiene una solución amortiguadora formada por CH3COOH 0,11M / CH3COONa 0,12M ¿Qué pH tendrá la solución amortiguadora? (Ka = CH3COOH = 1,8 x 10-5) CH3COONa → CH3COO– (ac) + Na+(ac) 0,12 M 0,12M Al inicio Reacciona En el equilibrio CH3-COOH (ac) + H2O(l) CH3-COO– (ac) + H3O+(ac) 0,11 0,12 -x x x… 0,11-x 0,12 +x x Aplicando la ecuación de Henderson-Hasselbach pH = pka + log [sal] [ácido] pKa = - log(1,8 x 10-5) = 4,745 log [sal] [ácido] Unidad 9: Equilibrio Químico = log (0,12 +x) (0,11 – x) 154 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Se puede despreciar el valor de x en la suma y la resta pues la constante de equilibrio es muy pequeña y por tanto la cantidad que se disocia es insignificante en valor comparada con las concentraciones iníciales, luego: 0,12 +x) = 0,12 pH = 4,745 +log(0,12/0,11) y 0,11 – x = 0,11 = 4,745 + 0,0378 = 4,812 El pH de un sistema amortiguador depende de la proporción relativa entre la sal y el ácido, pero no de las concentraciones absolutas de estos componentes. Por ejemplo, un sistema amortiguador 0,2 M en sal y 0,1 M en ácido, regula el mismo pH que un sistema amortiguador 0,4 M en sal y 0,2M en ácido, debido a que la relación concentración de sal / concentración de ácido es la misma. Si al buffer anterior se añade un ácido, la ecuación de Henderson-Hasselbach: pH = - log Ka + log [sal - Adición del ácido ] [Ácido + Adición del ácido] Debido a que la sal (base) reacciona con el ácido agregado y se forma más ácido. Autoevalúate 5 1. Determine cuál de las siguientes disoluciones contiene un sistema buffer: a) HClO4 y NaClO4 b) H2CO3 y NaHCO3 2. El ácido hipocloroso presenta un pKa de 7,5. Las lejías comerciales son mezclas de ácido hipocloroso (HClO) y hipoclorito sódico (NaClO). La concentración de ambos componentes es por lo general 0,65M ¿Cuál es el pH de la solución’ 3. Si se desea cambiar el pH de la lejía del problema anterior a 6,5 analice si habría que añadir sal o ácido a la solución. 4. Calcula la concentración de H2CO3 en la sangre (pH de la sangre 7,4) si la concentración de HCO3- es 2,6x10-2 (Ka = 8x10-7) 5. Una solución reguladora de CH3COOH 0,12M (Ka = 1,8x10-5) y CH3COONa 0,1M tiene un pH de 4,74 ¿Cuál será el nuevo valor de pH al añadir 2mL de HCl 1M a 1L de solución? 9.6 EQUILIBRIOS OXIDO – REDUCCIÓN La combustión de combustible por el oxigeno aporta la mayor parte de energía mundial. De la misma forma los organismos vivos dependen de la oxidación de moléculas biológicas (alimentos) para su supervivencia. Los procesos de oxidación – reducción (REDOX) dentro del organismo se producen de manera controlada y más lenta que la quema de combustibles, pero el principio es exactamente el mismo. Unidad 9: Equilibrio Químico 155 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ ¿Cómo aprovechan los organismos las reacciones redox para conseguir energía? ¿Qué son reacciones REDOX? Hemos visto como en los equilibrios acido base se transfieren protones de una especie a otra, en el caso de las reacciones REDOX lo que se transfieren son electrones. Una sustancia dona electrones y la otra acepta electrones, por tanto siempre que se presenta una oxidación hay una reducción presente y viceversa, ambas son simultáneas Históricamente la oxidación se asocia con la ganancia de oxigeno o perdida de hidrogeno. Sin dudarlo el oxigeno es el oxidante más común (oxida a otras), pero su poder oxidante no es excepcional. Entonces ¿Qué se entiende por oxidación y que por reducción? Una pérdida o ganancia de electrones implica un cambio en el estado de oxidación de los elementos Ejemplo Mg(s) + Cl2(g) → MgCl2 El átomo de Mg pierde dos electrones para formar el ión Mg+2. El Mg se oxida Mg → Mg+2 + 2eAl mismo tiempo el cloro gana los dos electrones para formar dos iones cloruro Cl-. El cloro se reduce Cl2 +2e- → 2ClOxidación - Perdida de electrones. - Aumenta el estado de oxidación Reducción - Ganancia de electrones - Disminuye el estado de oxidación En una reacción de oxido-reducción el número de electrones perdidos debe ser igual al número de electrones ganados 9.6.1 Agentes oxidantes y agentes reductores. Como hemos visto la sustancia que se oxida pierde electrones y la sustancia que se reduce gana electrones, luego un agente reductor (A.R, que se oxida) proporciona electrones, mientras un agente oxidante (A.O, que se reduce) los acepta. En el ejemplo anterior: (Oxidación) Mg → Mg+2 + 2e- , de la oxidación resulta la especie oxidada (E.O: Mg+2) A.R (Reducción) Cl2 +2e- → 2Cl- , de la reducción se tiene la especie reducida (E.R: Cl-) A.O Unidad 9: Equilibrio Químico 156 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Luego, la reacción total es: Mg(s) + Cl2(g) A.R A.O → MgCl2 Autoevalúate 6 1. Determina cuales de las siguientes reacciones son de oxido –reducción: a) b) c) BaCl2 + Na2CO3 → BaCO3 + 2NaCl ZnSO4 + Cu → CuSO4 + Zn Ca + 2HCl → CaCl2 + H2 2. En las siguientes reacciones identifica la sustancia que se oxida y la que se reduce. Luego reconoce el agente oxidante y el agente reductor a) b) c) KClO3 + HBr → Br2 + KCl + Fe + Cl2 → FeCl3 C2H6 + O2 → CO2 + H2O H2O 9.6.2 Potencial de una reacción redox Cuando una reacción REDOX ocurre de forma espontanea se transfieren electrones de una especie a otra y la transferencia de electrones genera una energía eléctrica, también sabemos que la energía puede transformarse en diferentes formas de energía, por lo tanto, la energía eléctrica producto de una reacción puede ser transformada, en el caso del cuerpo humano, en energía mecánica (mover músculos, trasladarse, etc.) ¿Cómo aprovechar la energía eléctrica involucrada en una reacción redox? Los componentes de las dos semi reacciones involucradas en una reacción REDOX total se pueden colocar en depósitos separados llamados semi celdas que se conectan mediante un circuito externo de modo que los electrones fluyen de una semi celda a la otra. En cada semi celda hay un metal o material que permite el paso de electrones llamado electrodo y el circuito se completa mediante el denominado puente salino (puede reemplazarse por una lámina porosa), cuyo propósito es proporcionar iones para mantener el balance eléctrico. Figura 9.6 Esquemas de celda galvánica o espontánea Unidad 9: Equilibrio Químico 157 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ ¿Cómo funciona este tipo de celda? En el ánodo se produce la oxidación y se generan los electrones, a través del circuito externo llegan al cátodo, donde se produce la reducción. El puente salino permite que la reacción pueda llevarse a cabo sin interrumpirse ya que suministra las cargas necesarias. La corriente que estas pilas suministran se puede medir con un voltímetro. Los electrones fluyen del ánodo al cátodo debido a la diferencia de potencial que se conoce como potencial de la celda o fuerza electromotriz de la celda (E). Cuanto más positivo sea el valor del potencial de la celda más espontánea es la reacción. 9.6.2.1 Potenciales estándar de celda El potencial de una celda y dependen de la composición de la mezcla de reacción, el potencial estándar de celda E° es el que se mide cuando reactivos y productos se encuentran en sus estados estándar (1M para soluciones, 1atm para gases, sólidos y líquidos en su forma pura) a una temperatura de 25°C y resulta de la suma de los potenciales estándar de las medias celdas E° celda = E° oxidación + E° reducción Considerando la celda H2(g) (Ánodo - oxidación) + Cu+2 (ac) H2(g) 2e- (Cátodo - reducción) + Cu+2 (ac) → → → H+ (ac) 2H+ (ac) Cu(s) + Cu(s) ) + 2e-) E° celda E° ox E° red Se define la media celda de hidrogeno formado por un electrodo de platino en contacto con gas hidrogeno y H+ acuoso a condiciones de 1 atm, 1M y 25°C como electrodo estándar de hidrogeno y se le asigna un potencial de 0V, de modo que: 2H+ (ac,1M) + H2(g,1atm) → 2e- → 2H+ (ac,1M) H2(g,1atm) + 2e- E° = 0V E° = 0V P Con esa elección para el electrodo de referencia, al medir el potencial para la celda, el voltímetro da un valor de E° celda = 0,34V, que por tanto corresponde al potencial de reducción del Cu (E° red). De la misma forma se fueron colocando diferentes medias celdas en el cátodo y se obtuvieron las tablas de potenciales de reducción, que permiten determinar el potencial de cualquier combinación de semi celdas a condiciones estándar. La tabla de potenciales de reducción permite ordenar los agentes oxidantes y reductores por su fuerza creciente y determinar la espontaneidad de miles de reacciones REDOX Describir las celdas con palabras es complicado, se utiliza la notación abreviada de celda para representarlas. Unidad 9: Equilibrio Químico 158 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Ejemplo: Para la celda descrita de hidrogeno – cobre se puede escribir Pt /H2(g) / H+ (ac) // Cu+2 (ac) /Cu(s) Ánodo Cátodo Puente salino En algunas celdas como esta, no puede usarse como electrodo ninguno de los componentes de la semicelda de hidrogeno (por ser gas y acuoso) y por tanto se requiere colocar para que sea posible la transferencia de electrones un electrodo inerte como el platino o el grafito. Tabla 9.3 Potenciales Estándar de reducción Electrodo Li+|Li Proceso catódico de reducción Li + e → Li K+|K K+ + e → K 2+ 2+ -2,925 Ca |Ca a Na+|Na Na+ + e → Na 2+ Mg |Mg Mg Al3+|Al Al 3+ 2+ -2,866 + 2e → Ca 2+ -2,714 -2,363 + 3e → Al -1,662 + 2e → Mg 2+ Mn |Mn Mn H2O| H2(Pt) 2H20 + 2e → H2 + 2OH 2+ Zn |Zn + 2e → Fe 3+ + e → Cr Fe Cr Cd2+|Cd Cd2+ + 2e- → Cd Co 2+ Ni |Ni Ni 2+ - 2+ 2+ -0,763 - Cr3+,Cr2+ | Pt Co |Co -0,828 + 2e → Zn 2+ Fe |Fe 2+ - Zn 2+ -0,44 2+ -0,408 -0,403 -0,277 + 2e→ Co - -0,250 + 2e → Ni Sn2+ + 2e → Sn Sn |Sn 2+ 2+ Pb |Pb Pb 3+ 3+ -0,126 - -0,037 + 2e → Pb Fe H+|H2 (Pt) 2H+ + 2e → H2 + 2+ + 3e → Fe - Cu Cu2+|Cu Cu2+ + 2e → Cu + Cu |Cu 0,000 + Cu ,Cu |Pt + -0,136 - Fe |Fe 2+ -1,179 + 2e → Mn 2+ +0,153 + e → Cu +0,336 - +0,520 Cu + e → Cu I2 | I- (Pt) 3+ I2 + 2e → 2I 2+ +0,535 Fe , Fe |Pt Fe3+ + e → Fe2+ Ag+|Ag Ag + e → Ag + 2+ Hg |Hg Hg Eo(volt) -3,045 2+ +0,770 +0,799 + 2e → Hg + +0,854 O2/H2O (Pt) O2 + 4H + 4e → 2H2O +1,229 Cl2| Cl- (Pt) Cl2 + 2e → 2Cl +1,359 3+ Au3+ + 3e → Au Au |Au MnO4 + + 2+ , H , Mn |Pt Au |Au Unidad 9: Equilibrio Químico + MnO4 +8H + - +1,497 2+ + 5e → Mn Au + e → Au + 4H2O +1,510 +1,691 159 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Al analizar la tabla de potenciales de reducción se aprecia que los halogenos (Cl y I ) son buenos oxidantes por su facilidad para reducirse, mientras los metales como Li y K son muy buenos reductores, por su facilidad para oxidarse. Cabe recordar que una reacción de reducción tendrá el mismo potencial que la de oxidación con el signo cambiado. Asi: Ag+|Ag E° red = + 0,799 + Ag / Ag E°ox = - 0,799 Ag+ + 1 eAg → → Ag Ag+ + 1 e- En conclusión no todas las posibles celdas que se armen serán espontáneas o generaran corriente. Sin embargo algunas combinaciones resultan muy interesantes a nivel industrial sobretodo para la obtención de metales, este tipo de celda se conoce como celda electrolíticas y su potencial resulta negativo, de tal manera que para que puedan suceder se deberá aplicar la energía necesaria 9.6.2.2 Potenciales de celdas en condición no estándar En los organismos vivos interesan las que ocurren es decir las espontáneas o celdas galvánicas, así en los procesos bioquímicos la transferencia de electrones juega un papel primordial. La oxido reducción es el proceso en que se transfiere energía en la cadena respiratoria y conduce a la síntesis del compuesto que permite a las células desarrollar sus funciones; el ATP Moléculas comunes aceptor/donador dentro de las células son : − Dinucleótido de adenina de niconamida (NAD+/NADH) − Fosfato del dinucleótido de adenina de niconamida (NADP+/NADPH). Pero, las reacciones de oxido reducción, sobretodo en el cuerpo humano no suceden a condiciones estándar y por lo general son procesos en equilibrio. Para calcular el potencial de la celda en condiciones diferentes de los valores estándar se emplea la ecuación de Nernst : Supongamos la reacción redox: aA +bB ↔ cC+ dD Donde Ereacción = E°reacción - 0,0592 log [C]c [D]d n [A]a [B]b Cuando se alcanza el equilibrio el Ereacción es igual a 0 y la relación de productos y reactantes se transforma en una constante Q=Kc 0 = E°- 0,0592 log Q n Unidad 9: Equilibrio Químico 160 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Donde: E = potencial de la reacción a condición no estandar n = nº de electrones balanceados en la reacción Q = relación de concentraciones molares de productos y reactivos en equilibri Autoevalúate 7 1. Determina la espontaneidad de las siguientes celdas: a) b) Ni (s) + 2Ag+(ac) Zn (s) + Cl2 (ac) → → 2Ag (s) + Ni+2(ac) 2Cl- (ac) + Zn+2(ac) 2. Para las siguientes celdas en notación abreviada escribe las semireacciones de oxidación y reducción y la reacción global, indica cuantos electrones se transfieren. a) b) Pb (s) / Pb+2(ac) / / Cu+2(ac) /Cu (s Sn (s) / Sn+2(ac) / / Fe+3(ac) ,Fe+2(ac) /C (s) 3. Determina el potencial estándar para las celdas de la pregunta 2. 4. Para una celda galvánica que utiliza la siguiente reacción: 2Ag+(ac) + Sn (s) → 2Ag (s) + Sn+2(ac) Calcula el potencial de la celda cuando [Ag+] = 0,01M y [Sn+2] = 0,02M 5. Elabore un esquema de una de las celdas donde anote el anodo, el cátodo, los electrodos, los electrolitos y el flujo de electrones. Unidad 9: Equilibrio Químico 161 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. Considerando la reacción en equilibrio: 2A2(g) + B2(g) ¿Cuáles de las afirmaciones siguientes son verdaderas. 2A2B(g) + calor i. ii. iii. iv. Si se incrementa B2(g) a la mezcla la constante de equilibrio aumenta. Si se retira calor el equilibrio se desplaza hacia los productos Si se reduce el volumen la constante de equilibrio se reduce. Al retirar A2B(g) el equilibrio se desplaza a la derecha. a) b) c) d) e) i , ii y iii son verdaderas. Solo i y iv son falsas. i, ii y iv son verdaderas. Todas son verdaderas. Ii,iii y iv son verdaderas. 2. Cuál de las siguientes mezclas tendrá un pH básico? a) b) c) d) e) HCl 0,15M y NaOH 0,04M HCN 0,15M y NaOH 0,15M HCl y agua HCN y agua Ninguna de las anteriores 3. Un jugo de manzana recién preparado tiene un pH= 12,7 ¿Cuánto valen [H3O+] y [OH-]? a) b) c) d) e) 2x10-13M, 0,5M 0,02M , 5x10-13M 0,05M, 2x10-13M 2x10-13M, 5x10-4M 2x10-13M, 5x10-2M 4. Uno de los amortiguadores de la sangre es el par H2PO4- / HPO4-2 H2PO4 - + H2O HPO4-2 + H3O+ ¿Que sucede si se le adiciona más H3O+? Marque la opción verdadera . a) b) c) d) e) Incrementa bruscamente su acidez Se vuelve ligeramente más ácido Se vuelve ligeramente más alcalino ó básico. No se afecta. Incrementa bruscamente su constante de equilibrio. Unidad 9: Equilibrio Químico 162 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 5. Para preparar una solución amortiguadora con pH = 5 debe seleccionar la mezcla más apropiada: a) b) c) d) e) NH3/ NH4Cl HCN/NaCN H2CO3 /HCO3CH3COOH/CH3COONa HCl/NaCl Ka HCN 4,9x10-10 Ka H2CO3 4,3x10-7 Ka HCl ------------ Ka CH3COOH 1,8x10-5 Kb NH3 1,8x10-5 6. Los siguientes casos describen una oxidación o una reducción: i. Ni (s) → 2e- + Sn+2(ac) ii. 2Br - (ac) → 2e- + Br2 (l) iii. Fe +3 (ac) + 1e- → Fe+2(ac) a) b) c) d) e) oxidación, oxidación, oxidación reducción, reducción, oxidación oxidación, oxidación, reducción reducción, reducción, reducción. oxidación, reducción, oxidación 7. En la siguiente reacción identifica a la sustancia que se oxida y al agente oxidante. Cr2 O3 (s) + Si (s) → Cr(s) + SiO2 (s) a) b) c) d) e) Cr se oxida, entonces Cr2O3 es el A.O Cr se oxida , entonces Cr2O3 es el A.R Si se oxida , entonces Cr2O3 es el A.O Si se oxida , entonces Cr2O3 es el A.R Si se reduce , entonces Cr2O3 es el A.R 8. ¿Cuál de los metales mencionados puede reducir el Fe+3 a Fe+2 pero no Fe+2 a Fe? a. Ag b. Cu c. Zn d. Mg e. Ninguno 9. Para la siguientes celdas determine serán espontáneas. i. Cu (s) + 2H+(ac) → Cu+2 (ac) + H2 (g) ii. Fe (s) + Ni+2(ac) → Ni (s) + Fe+2(ac) iii. 2Ag (s) + Cu+2(ac) → Cu (s) + 2Ag+ (ac) a) b) c) d) e) no espontánea, espontánea, espontánea no espontánea, no espontánea, espontánea no espontánea, no espontánea, no espontánea espontánea, espontánea, espontánea espontánea, no espontánea, espontánea Unidad 9: Equilibrio Químico 163 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 10. Para elevar el potencial de la siguiente celda en conveniente: 3Na (s) + Al+3(ac) → Al (s) + 3Na+1(ac) a) b) c) d) e) Incrementar la concentración de Al+3 No es posible elevar el potencial. Aumentar la concentración de Na+ Colocar mayor cantidad de Na Colocar mayor cantidad de Al Unidad 9: Equilibrio Químico 164 X. QUÍMICA ORGÁNICA 10.1 CARBONO 10.1.1 Propiedades del carbono 10.1.2 Orbitales Híbridos del Carbono 10.1.3 Carbono primario, secundario, terciario y cuaternario 10.2 FORMULAS DE LAS MOLÉCULAS ORGÁNICAS 10.3 GRUPOS FUNCIONALES EJERCICIOS INTEGRADORES Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ X. QUÍMICA ORGÁNICA Existen millones de compuestos orgánicos y están presentes formando parte de nuestro organismo (lípidos, carbohidratos, proteínas, vitaminas, hormonas, etc.), en la ropa que vestimos, los jabones que usamos, medicinas que tomamos, los utensilios de cocina, la comida, etc. Durante mucho tiempo, las sustancias orgánicas se obtenían exclusivamente a partir de los seres vivos llegándose a pensar que la intervención de la vida era indispensable para llegar a elaborar estos compuestos. En 1828, Friedrich Wöhler, logro sintetizar la urea NH2CONH2 -compuesto orgánico presente en la orina de los mamíferos- a partir de una sustancia inorgánica de acuerdo a la siguiente ecuación: NH4 NCO calor Cianato de amonio O || C NH2 NH2 Urea Hoy se conocen alrededor de 6 millones de compuestos orgánicos de los cuales más del 95 % son sintetizados en los laboratorios. Actualmente, a la química orgánica se le denomina “Química del Carbono” y se encarga de estudiar los compuestos del carbono producidos por los seres vivos o sintetizados en los laboratorios. Sin embargo, existen algunos compuestos que a pesar de tener carbono en su composición, son compuestos inorgánicos: – monóxido de carbono (CO) y dióxido de carbono (CO2). – ácidos carbónico (H2CO3 ) – carbonatos (CO3=) y bicarbonatos (HCO3-), y – cianuros de metales (CN-). Las moléculas orgánicas están formadas fundamentalmente por los átomos no metálicos: carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N), es por esta razón que predominan los enlaces covalentes, a diferencia de los compuestos inorgánicos que poseen enlaces iónicos. Los enlaces covalentes no polares carbono-carbono y carbono-hidrógeno predominan en la gran mayoría de compuestos orgánicos, solo cuando están presentes el oxígeno y el nitrógeno adquieren polaridad. Las temperaturas de fusión y de ebullición en estas moléculas orgánicas son menores que la de los compuestos inorgánicos, porque sus fuerzas intermoleculares son más débiles que la atracción iónica de los compuestos inorgánicos. El estudio de la química orgánica moderna exige un conocimiento claro de las características fundamentales del átomo de carbono y del enlace covalente. . Unidad 10: Química Orgánica 166 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 10.1 CARBONO En la corteza terrestre es el duodécimo elemento en orden de abundancia. En el cuerpo humano es el segundo elemento en orden de abundancia (18%) está formando parte de los lípidos, proteínas, carbohidratos, enzimas, etc. En la tabla periódica se ubica en el segundo periodo del grupo IVA, su tamaño es pequeño y su electronegatividad intermedia. Estas características hacen del carbono un elemento especial, capaz de formar innumerables moléculas. 10.1.1 Propiedades del carbono − Tetravalencia.- capacidad para formar 4 enlaces covalentes, con otros átomos. | | − C − | − C = − C ≡ − Auto saturación.- capacidad que tiene el carbono para unirse con otros átomos de carbono. Esta propiedad y su radio atómico pequeño le posibilita unirse a sí mismo formando largas cadenas lineales o ramificadas con diferentes formas y longitudes. | | | | − C − C = C − C ≡ C − | | | − C − | − Hibridación.- capacidad que tiene el carbono para combinar sus orbitales s y p del nivel de valencia, para poder obtener los orbitales híbridos sp3, sp2 y sp. La forma y características de estos orbitales híbridos le permite obtener la distribución espacial adecuada al formar enlaces simples, dobles o triples. 10.1.2 Orbitales híbridos del carbono El carbono es capaz de combinar sus orbitales s y p para obtener conjuntos de orbitales híbridos, llamados sp3, sp2 y sp1. La forma y las características de estos orbitales híbridos son combinaciones de los orbitales s y p. Híbridos sp3 El carbono puede unirse a cuatro átomos mediante enlaces simples denominados sigma (σ). Su geometría es tetraédrica Unidad 10: Química Orgánica 167 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 10.1 Híbridos sp3 del carbono Ejemplo: Se forma 1 enlace simple C-C y 6 enlaces simples C-H, en total hay 7 enlaces sigma σ Híbridos sp2 El carbono puede unirse a tres átomos (generalmente uno de ellos es otro átomo de carbono). Su geometría es triangular plana. Al doble enlace se le denomina pi (π). Figura 10.2 Híbridos sp2 del carbono Ejemplo: Se forma 1 enlace simple C-C y 4 enlaces simples C-H, en total hay 5 enlaces sigma σ. Se tiene un enlace pi π entre carbono-carbono Unidad 10: Química Orgánica 168 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Híbridos sp1 El carbono puede unirse a dos átomos (uno de ellos es otro átomo de carbono). Se caracteriza por la presencia de dos enlaces pi (π). Su geometría es plana. Figura 10.3 Híbridos sp del carbono Ejemplo: H− C ≡ C − H Se forma 1 enlace simple C-C y 2 enlaces simples C-H, en total hay 3 enlaces sigma σ. Se tiene 2 enlaces pi π entre carbono-carbono Además, es importante tomar en cuenta que los átomos de cada elemento de una molécula orgánica cuenta con un número fijo de enlaces covalentes. Así tenemos: − el nitrógeno (N) puede formar 3 enlaces − el oxígeno (O) puede formar 2 enlaces − el hidrógeno (H) puede formar 1 enlace − los halógenos (X = F,Cl, Br, I) pueden formar 1 enlace − el azufre (S) puede formar 2 enlaces Unidad 10: Química Orgánica 169 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 1 1. Determine el tipo de hibridación de los átomos de carbono indicados (*) en los siguientes compuestos H a) | H | H− C − C | H b) H | * | H | | H H * | | H H | = C − C − H | H 2. H − C − C − H | | H H − C − C | H H ¿Qué cantidad de enlaces sigma (σ) y pi (π) hay en los siguientes compuestos? a) b) CH = CH2 | CH2 = CH − CH − CH2 − CH3 10.1.3 Carbono primario, secundario, terciario y cuaternario Los carbonos cuyos enlaces son simples (sp3) se pueden clasificar en: – Primario: si se encuentra unido a un solo carbono ( − CH3 ) – Secundario: si se encuentra unido a dos carbonos ( − CH2 −) Unidad 10: Química Orgánica 170 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ – Terciario: si se encuentra unido a tres carbonos – Cuaternario: si se encuentra unido a cuatro carbonos Ejemplo: 1ro CH3 CH2 − ro 1 2 do 1ro CH3 | − CH − ro 3 CH3 | 4to CH2 − C 2do | CH3 − CH3 1ro 1ro Autoevalúate 2 1. ¿Cuántos carbonos primarios, secundarios, terciarios y cuaternarios hay en los siguientes compuestos? a) CH3 − CH = b) CH − CH2 CH3 | − C − CH3 | CH3 CH3 CH3 | | CH2 − CH − CH − CH2 − C − CH2 − CH3 | | | CH3 CH3 CH2 − CH2 − CH3 10.2 FORMULAS DE LAS MOLÉCULAS ORGÁNICAS Existen diferentes formulas para representar moléculas orgánicas simples: Fórmula global (molecular) Nos indica la cantidad total de los elementos que forman la molécula. Ejemplos: CH4H10 Unidad 10: Química Orgánica 171 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ CH4H8O Nos sirve para determinar la masa molar pero no nos dice nada sobre la estructura ni el grupo funcional al que pertenece Fórmula desarrollada Llamada también como estructura Kekulé. En esta fórmula se indican de forma explícita todos los elementos con todos los enlaces. Ejemplos: Butano Butanal Butanona Se puede observar que en este tipo de formula queda claro el grupo funcional al que pertenece el compuesto Formula estructural condensada Llamada también formula semidesarrollada. En esta fórmula se representa solo los enlaces entre carbono-carbono. Ejemplos: Butano CH 3 − CH 2 − CH 2 − CH 3 Butanal CH 3 − CH 2 − CH 2 − CHO Butanona CH 3 − CH 2 − CO Unidad 10: Química Orgánica − CH 3 172 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ También se les puede representar de la siguiente forma: CH3 CH2 CH2 CH3 CH3 CH2 CH2 CHO CH3 CH2 CO CH3 Butano Butanal Butanona Algunas veces, solo se desarrolla completamente el grupo funcional que se desea destacar y el resto se presenta de forma semidesarrollada o condensada. Ejemplos: Aldehído Cetona H | CH 3 − CH 2 − CH2 − C = O Butanal O II CH 3 − CH 2 − C − CH 3 Butanona Fórmula gráfica Denominada también formula de líneas. Es una de las formas más empleadas para representar moléculas orgánicas, especialmente aquellas complejas. Se debe considerar lo siguiente: – Se representan los enlaces simples, dobles o triples mediante líneas simples, dobles o triples respectivamente. – Los vértices representan átomos de carbono – No se escriben los hidrógenos unidos al carbono (se sobreentiende que están ahí). – Los demás elementos (como N, O, S y otros) se indican explícitamente. Si a ellos estuviese unido un hidrogeno, este se debe escribir. Ejemplos: CH2 CH | || CH2 CH ciclo buteno Autoevalúate 3 Dibuje la formula global y semidesarrollada del siguiente compuesto: Unidad 10: Química Orgánica 173 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 10.3 GRUPOS FUNCIONALES Al igual que los compuestos inorgánicos, la gran cantidad de compuestos orgánicos requiere una organización. Los compuestos se organizan de acuerdo a sus grupos funcionales. La porción de la molécula orgánica donde se encuentren los enlaces insaturados o átomos no metálicos diferentes de carbono e hidrógeno corresponde a la parte más reactiva de la molécula. Esta porción de la molécula se denomina grupo funcional y es precisamente la responsable de sus funciones o propiedades químicas. Cada grupo funcional corresponde a una familia orgánica. Moléculas diferentes que tienen la misma clase de grupo o grupos funcionales reaccionan de modo semejante. Ejemplo: CH3 − OH CH3 − CH2 − CH2 − OH Metanol 1-Propanol CH3 − (CH2)5 OH | − CH − CH3 2-Octanol Estos compuestos poseen el mismo grupo funcional (alcoholes), por lo tanto sus propiedades químicas serán similares. Estos compuestos tienen 2 partes: Cadena Lateral R CH3 − CH2 − CH2 Grupo funcional − OH Otros ejemplos son: Propanal CH3 − CH2 − CH2 − CHO Ácido propanoico CH3 − CH2 − CH2 − COOH Se les representa así: Aldehído RCHO, y Cetona RCOR′ A continuación, se presenta una Tabla con las funciones químicas orgánicas y sus respectivos grupos funcionales: Unidad 10: Química Orgánica 174 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Tabla 10.1 Familia de Compuestos Orgánicos y sus Grupos Funcionales FAMILIA GRUPO FUNCIONAL FÓRMULA GENERAL EJEMPLO NOMBRE – OH R – OH CH3-CH2-OH ETANOL Oxi –O– R – O – R’ CH3- O - CH3 DIMETIL ETER Carbonilo –C=O R – CHO CH3-CHO ETANAL R – C – R’ CH3-CO-CH3 PROPANONA Nombre Fórmula ALCOHOLES Oxhidrilo ÉTERES ALDEHÍDOS | CETONAS Carbonilo –C=O | ACIDOS Carboxilo || O –C=O CARBOXÍLICOS R – COOH CH3-COOH | ÁCIDO ETANOICO OH SALES Carboxilo ORGÁNICAS ÉSTERES –C=O R – COOM | ONa M = metal R – COO– R’ R NH2 – AMINAS Amina Primaria | –N – Terciaria AMIDAS Amida –C=O | NH2 Unidad 10: Química Orgánica CH3-COO-CH3 ETANOATO DE METILO CH3 N–H N–H H H R CH3 –NH – Secundaria ETANOATO DE SODIO –C=O | O– Carboxilo CH3-COONa N–H R’ METIL AMINA DIMETIL N–H AMINA CH3 R CH3 N – R’’ TRIMETIL N – CH3 R’ CH3 R – CONH2 CH3-CO NH2 AMINA ETANO AMIDA 175 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 4 1. Indique el grupo funcional y la familia a la que pertenecen los siguientes compuestos a) CH3-CH2-CH2-CHO b) CH3- CH2-CH2 -CO-CH3 c) CH3-CH2-CH2 –COO-CH2-CH2-CH3 d) CH3-O-CH2-CH3 e) CH3CH2-NH2 Unidad 10: Química Orgánica 176 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. Respecto a los orbitales híbridos, marque lo correcto: a) b) c) d) e) Los enlaces simples presentan hibridación sp2 Los enlaces dobles presentan hibridación sp3 Los enlaces triples presentan hibridación sp2 Los enlaces simples presentan hibridación sp3 Los enlaces dobles presentan hibridación sp 2. Identifica cuántos carbonos primarios, secundarios, terciarios y cuaternarios presenta la siguiente molécula: a) b) c) d) e) 5,6,2,1 7,6,3,1 2,5,2,1 0,6,7,1 5,7,0,3 3. Indica el número total de enlaces sigma y pi según corresponda: a) b) c) d) e) 22,26,5 18,26,10 22,23,5 18,22,5 21,26,10 4. Identifica y encierra en un círculo todos los grupos funcionales presentes; finalmente, calcula cuáles no se encuentran presentes en la molécula: I. II. III. IV. V. Prostaglandina Ácido Alcohol Amida Cetona Éter O COOH CH3 HO HO a) b) c) d) e) Todos Solo III Solo I Solo III y V Ninguno de los indicados Unidad 10: Química Orgánica 177 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 5. El número de carbonos con hibridación sp3, sp2 y sp en el siguiente compuesto es: a) b) c) d) e) 2,4,3 3,4,2 4,3,2 4,2,3 15,3 6. Escribe la fórmula global de la siguiente molécula: a) b) c) d) e) C9H18O1N1Cl1 C11H17O2NCl C10H22O1N1Cl1 C12H22O2N1Cl1 C12H24O2N1Cl1 NH O O Cl 7. Sobre la siguiente estructura, marque el enunciado falso. a) b) c) d) e) En total tiene 9 carbonos Es un diol Sus alcoholes son secundarios Presenta 2 enlaces pi (π) Presenta 2 carbonos primarios Cl OH OH 8. La fórmula general de un aldehído es: a) R-CO-R b) R-OH c) R-NH3 d) R-CHO e) R-COOH 9. Halle la fórmula global del siguiente compuesto es: a) C10 H19 ClF3 b) C 8H19 ClF3 c) C10 H12 ClF3 d) C 9H19 ClF3 e) C10 H18 ClF3 Unidad 10: Química Orgánica 178 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 10. Señale la proposición correcta con respecto a las siguientes estructuras: a) b) c) d) e) Hay tres grupos carboxilo. Hay un solo grupo ester.. Hay tres grupos cetona. Hay tres grupos alcohol. Hay 2 aminas primarias y una amina secundaria. Unidad 10: Química Orgánica 179 XI. ISÓMEROS 11.1 ISÓMEROS ESTRUCTURALES 11.1.1 Isómeros de cadena 11.1.2 Isómeros de posición 11.2 ESTEREOISÓMEROS 11.2.1 Isómeros geométricos 11.2.2 Isómeros ópticos Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ XI. ISÓMEROS Se llaman isómeros a los compuestos que tienen la misma cantidad y clase de átomos, pero difieren en la manera en que éstos se unen entre sí. Esto es, son compuestos que tienen la misma fórmula molecular (formula global) pero diferente estructura. Poseen la misma masa molar, pero poseen distintas propiedades. La isomería es la razón fundamental por lo que existen tantos compuestos orgánicos. Los distintos casos de isómeros pueden dividirse en dos grandes grupos; isómeros estructurales y estéreo isómeros. Figura 11.1 Tipos de Isómeros 11.1 ISÓMEROS ESTRUCTURALES Son compuestos que tienen igual formula global pero diferente estructura ó formula desarrollada. Tienen la misma masa molar aunque sus elementos estén unidos de distinta manera. Pueden diferir en: 1. La estructura de la cadena. 1. La posición del grupo funcional 2. En el grupo funcional En todos los casos las propiedades físicas (solubilidad, punto de ebullición, viscosidad, punto de fusión) son diferentes. Unidad 11: Isómeros 181 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 11.1.1 Isómeros de cadena Difieren en la forma de la cadena (“esqueleto”). Ejemplo La fórmula C4H10 posee dos isómeros estructurales; el n-butano y el isobutano. Compuestos con mayor número de átomos dan lugar a un mayor número de isómeros. Así por ejemplo el C8H18, posee 18 isómeros de cadena. Los isómeros de cadena, tienen punto de ebullición diferente. A mayor ramificación menor punto de ebullición. 11.1.2 Isómeros de posición Son aquellos que teniendo el mismo esqueleto carbonado, se distinguen por la posición que ocupa el grupo funcional o el enlace insaturado (enlace doble o triple). Ejemplo: Existen dos alquenos que responden a la fórmula C4H10 1-buteno 2-buteno 11.1.3 Isómeros de función Difieren en la función orgánica presente en la molécula. Ejemplo: La fórmula C2H6O puede corresponder al etanol o al dimetil éter. CH3-CH2OH Unidad 11: Isómeros CH3-O-CH3 182 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 11.2 ESTEREOISÓMEROS Son compuestos cuyos átomos se conectan en el mismo orden y con el mismo tipo de enlaces pero se diferencian en la disposición tridimensional de sus átomos en el espacio. Los estereoisómeros se clasifican en: 1. Isómeros geométricos 2. Isómeros ópticos 11.2.1 Isómeros geométricos Estos isómeros resultan de la rigidez de las moléculas y se presentan en solo dos clases de compuestos: en los alquenos y en los alcanos cíclicos. Los compuestos con enlace sigma pueden girar, pero los compuestos con enlace doble no pueden girar sin romper la molécula. Como consecuencia de la rigidez del enlace pi π, los grupos de estos átomos están fijos en el espacio uno respecto al otro. Se dice que los compuestos del mismo lado están en CIS (del latín de este lado) y los grupos de lados opuestos están en TRANS (del latin al otro lado). Ejemplo: La condición para que se de esta isomería geométrica es que cada carbono unido por el enlace pi tenga por lo menos 1 par de grupos iguales. SI tiene isómeros geométricos Unidad 11: Isómeros 183 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ NO tiene isómeros geométricos Los ciclo alcanos también se presenta este tipo de isomería: Estos isómeros tienen propiedades físicas diferentes 11.2.2 Isómeros ópticos Los isómeros ópticos son sustancias con imágenes especulares no superponibles. Se caracterizan por poseer un átomo asimétrico (unido a cuatro grupos distintos) llamado quiral. Cualquier objeto que no pueda ser superpuesto con su imagen especular se denomina QUIRAL (del griego cheir, "mano") Figura 11.2 Objetos con imagen especular QUIRAL NO QUIRAL QUIRAL ¿Cómo identifico un carbono quiral? Un carbono quiral debe tener los 4 grupos DISTINTOS unidos al carbono sp3. Estos isómeros son capaces de desviar el plano de la luz polarizada hacia la izquierda o la derecha. Unidad 11: Isómeros 184 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 11.3 Molécula orgánica con imagen especular Por lo general para transformarse uno en otro no basta con hacer giros sino que es necesario romper y formar enlaces. Si el estereoisómero hace girar la luz del polarímetro hacia la derecha se denomina dextrógiro (D) , y si lo hace girar hacia la izquierda se denomina levógiro (L). Es un misterio porque las principales moléculas biológicas naturales son quirales: − Los aminoácidos, que forman las proteínas y son la base de la vida son L − Los carbohidratos generalmente son D. Los isómeros ópticos presentan las mismas propiedades físicas (punto de fusión, solubilidad) y propiedades químicas, pero tienen diferente propiedad óptica y generalmente diferente propiedad biológica Tabla 11.1 Propiedades de los isómeros ópticos del ácido tartárico Los principios activos de muchos medicamentos están formados por moléculas quirales. Su efecto será distinto para uno D ó L. Uno de los enantiómeros puede ser beneficioso y el otro puede ser inactivo o perjudicial. La síntesis artificial de sustancias aquirales produce mezclas racémicas, (50% D y 50% L) la separación de los enantiómeros D y L exige procesos muy costosos y no siempre sencillos. Unidad 11: Isómeros 185 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 1. Escriba un ejemplo de cada tipo de isómero (diferente a los enunciados anteriormente) a) isomería de función b) isomería de posición c) isomería de cadena 2. Escriba dos isómeros GEOMETRICOS que tengan la formula C6H11Br 3. Nombre el siguiente compuesto y dibuje su isómero geométrico respectivo 4. Dibuje su isómero óptico Unidad 11: Isómeros 186 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. El C6H14 es un __________ que posee _____ isómeros estructurales. a) b) c) d) e) alcano - 5 alqueno - 3 alquino - 5 alcano - 4 alcano - 6 2. Puede tener isómeros geométricos: a) b) c) d) e) 3,3-dimetilbutano 2,3-dimetil-1-buteno 3,3.dimetil-1-buteno 2,3-dimetil-2-buteno 2,3-dimetilpentano 3. Sobre los siguientes compuestos se puede afirmar que: a) b) c) d) e) Son isómeros geométricos Son el mismo compuesto Son isómeros de cadena Son isómeros de posición Son isómeros de función 4. Son isómeros de cadena: I. II. III. IV. dimetilpropano 2-metil-2-penteno neopentano isohexano a) b) c) d) e) I y II I y IV I y III II y IV I, II y iV Unidad 11: Isómeros 187 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 5. Con respecto al hexano marque el enunciado incorrecto: a) b) c) d) e) La formula global de todos sus isómeros es C6H14 Todos sus isomeros tienen el diferente punto de ebullición. Tiene isomeros de cadena. Sus isomeros Cis son muy estables. Todos sus isomeros tienen la mísma masa molar. 6. Sobre los siguientes compuestos se puede afirmar: CH3-CH2 -CH2 -CH2OH a) b) c) d) e) CH3 -CH2 -CH2 -O-CH3 Tienen diferente masa molar Son isomeros de cadena Son isomeros geométricos Son isomeros de función Son isomeros de posición 7. Sobre los siguientes compuestos se puede afirmar: a) b) c) d) e) Son hidrocarburos Son isomeros de cadena Son isomeros geométricos Son isomeros de función Son isomeros de posición 8. Los isómeros ópticos son compuestos que ................................ a) b) c) d) e) tienen diferente masa molar no tiene ningún carbono quiral en realidad no son isómeros son solo formas diferentes de un mismo compuesto tienen propiedades biológicas prácticamente similares tienen imagen especular 9. Cuál de los siguientes compuestos presenta isomería geométrica a) b) c) d) e) (CH3)2C=CBr2 CH3-CH2 -CH2 -CBr2 CH3-CH2 -CH2 -CBr2 CH2 =C(CH3)2 CH3-CH =CH-CH3 Unidad 11: Isómeros 188 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 10. Sobre los siguientes compuestos se puede afirmar: a) b) c) d) e) Son isomeros de cadena Son isomeros geométricos Son isómeros ópticos Son isomeros de función Son isomeros de posición Unidad 11: Isómeros 189 XII. GRUPOS FUNCIONALES ORGANICOS 12.1 HIDROCARBUROS 12.1.1 Clasificación y Nomenclatura 12.1.1.1 Hidrocarburos alifáticos 12.1.1.2 Hidrocarburos aromáticos 12.1.2 Propiedades de hidrocarburos 12.1.2.1 Propiedades Físicas 12.1.2.2 Propiedades Químicas 12.2 ALCOHOLES FENOLES Y ETERES 12.2.1 Alcoholes 12.2.1.1 Nomenclatura de Alcoholes 12.2.1.2 Propiedades físicas de alcoholes 12.2.1.3 Propiedades químicas de alcoholes 12.2.2 Fenoles 12.2.2.1 Nomenclatura de Fenoles 12.2.2.2 Propiedades de Fenoles 12.2.3 Éteres 12.2.3.1 Nomenclatura de éteres 12.2.3.2 Propiedades de éteres 12.3 GRUPO CARBONILO: ALDEHÍDOS Y CETONAS 12.3.1 Nomenclatura de aldehídos y cetonas 12.3.2 Propiedades de Aldehídos y Cetonas 12.3.2.1 Propiedades Físicas de Aldehídos y Cetonas 12.3.2.2 Propiedades Químicas de Aldehídos y Cetonas 12.4 GRUPO CARBOXILO ÁCIDOS CARBOXILICOS Y ESTERES 12.4.1 Ácidos carboxílicos 12.4.1.1 Nomenclatura de Ácidos carboxílicos 12.4.1.2 Propiedades de ácidos carboxílicos 12.4.1.2.1 Propiedades Físicas de ácidos carboxílicos 12.4.1.2.2 Propiedades Químicas de ácidos carboxílicos 12.4.2 Esteres 12.4.2.1 Nomenclatura de ésteres 12.4.2.2 Propiedades de ésteres Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.5 FUNCIONES NITROGENADAS 12.5.1 Aminas 12.5.1.2 Nomenclatura de aminas 12.5.1.2 Propiedades de las aminas 12.5.2 Amidas 12.5.2.2 Nomenclatura de amidas 12.5.2.2 Propiedades de las amidas Unidad 12: Grupos Funcionales Orgánicos 191 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ XII. GRUPOS FUNCIONALES ORGANICOS Al igual que los compuestos inorgánicos, la gran cantidad de compuestos orgánicos requiere una organización. Los compuestos se organizan de acuerdo a sus grupos funcionales en: hidrocarburos, alcoholes, fenoles, éteres, aldehídos, cetonas, ácidos carboxílicos, esteres, aminas y amidas. 12.1HIDROCARBUROS Se conocen como hidrocarburos los compuestos orgánicos que solo contienen carbono e hidrógeno. Se trata de las moléculas orgánicas más sencillas, y sirven como base para el estudio de los demás compuestos. Las propiedades de los hidrocarburos se encuentran determinadas por el tipo de enlace y la presencia de ramificaciones y anillos. 12.1.1 Clasificación y Nomenclatura A lo largo de la historia, las sustancias orgánicas han recibido nombres derivados ya sea de alguna de sus características o propiedades, del nombre de su lugar de origen, del de su descubridor o de situaciones coyunturales. A medida que el número de sustancias y las innumerables combinaciones posibles aumenta, se hace necesario el uso de un sistema de nombres (o nomenclatura) que permita asignarlos de forma sistemática y que refleje las propiedades o estructura de los compuestos. La nomenclatura del sistema IUPAC (International Union of Pure and Applied Chemistry) brinda una serie de reglas, actualizadas periódicamente, que permiten nombrar compuestos químicos de diferentes familias y de diversa complejidad. En lo posible, en este manual seguiremos estas reglas, si bien omitiremos algunas para simplificar determinadas explicaciones. En muchos casos, los nombres comunes se encuentran bastante arraigados, de forma tal que algunos han sido aceptados por la IUPAC. Otros, sencillamente, se usan por costumbre. Varias partes componen el nombre de un compuesto orgánico: PREFIJO RAÍZ SUFIJO Dependiendo de su complejidad, una molécula puede presentar varios prefijos y varios sufijos. La raíz del nombre está compuesta por un prefijo que indica el número de carbonos. Los cuatro primeros prefijos se derivan bien del nombre de la fuente en la que se los encontró inicialmente o bien de un compuesto importante, y su uso ha persistido en el tiempo. A partir del quinto carbono se emplearon prefijos similares a los de la geometría. Unidad 12: Grupos Funcionales Orgánicos 192 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Tabla 12.1 Tabla de prefijos Prefijo met et prop but pent hex hept oct non dec N° C 1 2 3 4 5 6 7 8 9 10 Prefijo undec dodec tridec tetradec pentadec hexadec heptadec octadec nonadec icos N° C 11 12 13 14 15 16 17 18 19 20 Los hidrocarburos pueden clasificarse de acuerdo con diversos criterios: – Según el tipo de enlace: Alifáticos Hidrocarburos Aromáticos Alcanos Solo enlaces simples Alquenos Tienen, al menos, un enlace doble. Alquinos Tienen, al menos, un enlace triple. Enlaces dobles alternados entre otros requisitos – Según su forma: Lineal Por la presencia de ramas Si todos los carbonos están colocados uno después del otro y pueden ser marcados siguiendo una línea sin levantar el lápiz Ramificado Si presenta cadenas unidas a una cadena principal Acíclicos Si se trata de estructuras abiertas Cíclicos Si se trata de estructuras cerradas formando anillos Por la presencia de anillos Unidad 12: Grupos Funcionales Orgánicos 193 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ De esta forma, un hidrocarburo puede ser acíclico lineal, acíclico ramificado, y cíclico lineal o cíclico ramificado. 12.1.1.1 Hidrocarburos alifáticos Alcanos Son hidrocarburos en los cuales todos los enlaces carbono-carbono son covalentes simples. Corresponden a la fórmula general CnH2n+2. Terminan con el sufijo –ano. Alquenos Son hidrocarburos cuyas moléculas contienen por lo menos un par de carbonos unidos por un enlace covalente doble. Corresponden a la fórmula general del alcano, al cual se le resta 2 H por cada enlace doble C=C que se presente CnH2n+2-2(#C=C). Si solo hubiera un enlace doble, la fórmula sería: CnH2n. Terminan con el sufijo –eno. Unidad 12: Grupos Funcionales Orgánicos 194 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Alquinos Son hidrocarburos cuyas moléculas contienen por lo menos un par de carbonos unidos por un enlace covalente triple. Corresponden a la fórmula general del alcano, al cual se le resta 4 H por cada enlace triple CΞC que se presente CnH 2n+2-4(#CΞC). Si solo hubiera un enlace triple la fórmula sería: CnH 2n-2. Terminan con el sufijo –ino. Nomenclatura de hidrocarburos acíclicos lineales Son hidrocarburos de cadena abierta y sin ramificaciones. No necesariamente se encuentran en línea recta: podrían formar líneas sinuosas. Se reconocen porque, al dibujarlos, pueden unirse todos los carbonos con un solo trazo, sin levantar el lapicero. Se nombran al anteponer el prefijo que indica el número total de carbonos y al colocar el sufijo, según se trate de alcanos, alquenos o alquinos. Nomenclatura de hidrocarburos acíclicos ramificados Ramas, sustituyentes o restos alquilo Las ramas o ramificaciones son resultado de extraer un hidrógeno a una pequeña cadena de alcano. Por ello, se les llama restos alquilo. Se nombran cambiando el sufijo -ano de la cadena de origen por –il: CH3 CH2 CH3 CH2 CH2 CH2 CH2 CH2 CH3 Unidad 12: Grupos Funcionales Orgánicos 1C: metano → metil 2C: etano → etil 6C: hexano → hexil 195 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Para nombrar un hidrocarburo acíclico ramificado, se siguen los siguientes pasos: I. Buscar la cadena principal II. Numerar todos los C de esta cadena III. Buscar y nombrar todas las ramificaciones IV. Si los hubiera, buscar los enlaces múltiples y su sufijo V. Escribir el nombre completo de la siguiente manera: #-rama-prefijo_de_N°C_sufijo I. Buscar la cadena principal Para escoger la cadena principal, conviene seguir los siguientes pasos: a) Si se trata de alcanos acíclicos, la cadena principal es la más extensa. b) En otros casos, se considera como cadena principal a la que contenga la más grande cantidad de enlaces múltiples. c) Si hay más de una opción de igual longitud, se escoge la que resulte con más ramificaciones sencillas. Unidad 12: Grupos Funcionales Orgánicos 196 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ II. Numerar todos los carbonos de la cadena principal d) Si no hay enlaces múltiples, se numera la cadena y se otorga el número más bajo a la rama o sustituyente más cercana al extremo de la cadena. e) Si el primer sustituyente es equidistante en ambos extremos, se busca el siguiente hasta encontrar una diferencia. f) Al numerar, se consideran equivalentes todos los restos alquilo, sin importar su tamaño. g) Si se encuentran enlaces múltiples, estos tienen prioridad sobre las ramas, y se les asigna el número más bajo posible. Unidad 12: Grupos Funcionales Orgánicos 197 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ III. Buscar y nombrar todas las ramificaciones h) Se nombran las ramificaciones de la cadena principal al anteponer el número del C en que se encuentra. i) Los restos alquilo se nombran como los alcanos: se cambia el sufijo -ano por -il. j) Los restos alquilo pueden tener ramas. Algunos de ellos tienen nombres propios. Figura 12.1 Restos alquilo con nombre propio Unidad 12: Grupos Funcionales Orgánicos 198 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ k) Los sustituyentes o grupos iguales se agrupan empleando los prefijos di, tri, y tetra adelante del nombre del sustituyente, según haya dos, tres o cuatro grupos iguales. CH2 CH3 3 grupos: etil → trietil 2 grupos: hexil → dihexil CH2 CH2 CH2 CH2 CH2 CH3 l) Ordene los sustituyentes en alfabéticamente siguiendo las siguientes pautas: – Se ignoran los prefijos di-, tri-, tetra-, etcétera. – Se consideran los prefijos iso-, neo- y ciclo-. – Se ignoran los prefijos sec- o tert-. secbutil tert-butil isobutil ciclopropil dimetil neopentil IV. Si los hubiera, buscar los enlaces múltiples y su sufijo m) Se indica el carbono con el enlace doble o triple. 7 H3C CH2 6 5 CH2 3 CH CH2 4 CH 1 CH3 En este caso, los C2 y el C3 están unidos por un enlace doble. Entonces, se indica que está en el C2. 2 n) Para numerar, se da prioridad (es decir, se asigna el número más bajo posible) al enlace múltiple. o) Si solo existe un enlace múltiple en el carbono 1, puede omitirse el número. p) En caso de presentar más de un enlace múltiple, siempre se indica la posición y se añade al sufijo alguno de los prefijos di-, tri-, tetra-, etcétera, según corresponda. q) Los sufijos se colocan según los enlaces que se encuentren presentes: – Si solo hay enlaces simples: - ano – Si hay al menos un enlace doble: - # - eno – Si hay al menos un enlace triple: - # - ino – Si hay al menos un enlace doble y un enlace triple: - # -en-# -ino Unidad 12: Grupos Funcionales Orgánicos 199 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 3 r) Si se encuentran enlaces dobles y triples en la misma molécula, se le asignará el número más bajo a aquel más cercano a un extremo. Si se tiene más de una opción, se dará prioridad al enlace doble. 5-hepten-1-ino 1-hepten-5-ino En este caso, los enlaces doble y triple son equidistantes a uno de los extremos. 2-hepten-5-ino V. Escribir el nombre completo s) Se ordenan los prefijos alfabéticamente según los criterios señalados (12). t) Se separan las ramificaciones de los números con guiones. Para separar dos o más números, se emplean comas. 3-etil-2,3-dimetil-... 2,3-dimetil... u) Siempre debe colocarse un número por cada sustituyente y por cada grupo funcional. 3,3-dietil-... 4,4,5-triisopropil-... Ejemplo: Nombra la siguiente estructura: Unidad 12: Grupos Funcionales Orgánicos 200 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Figura 12.2 Cómo nombrar un hidrocarburo acíclico ramificado IV. Busca el sufijo. Solo enlaces simples C-C → -ano V. Escribe el nombre. 8-butil-10-etil-5-isopropil-3,4-dimetil-tridecano Unidad 12: Grupos Funcionales Orgánicos 201 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.1.1.2 Hidrocarburos aromáticos Se trata de compuestos cíclicos e insaturados con características marcadamente distintas de los compuestos alifáticos, por lo que se agrupan en una nueva categoría. Aunque antiguamente se relacionaban con los aromas, pues algunas de las moléculas de esta familia presentaban aromas agradables, actualmente la aromaticidad se refiere a las propiedades que otorga la presencia de dobles enlaces conjugados en anillos planos. CH CH CHO Cinamaldehído, aroma a canela Las moléculas de hidrocarburos aromáticos con varios anillos fusionados se denominan polinucleares y se los asocia con propiedades cancerígenas. Ejemplo: Naftaleno, antraceno, fenantreno Fenantreno El benceno constituye el compuesto fundamental de toda la serie aromática. Los electrones del benceno son de enlace doble (π) deslocalizados, es decir, no ligados a un solo átomo; por ello, se representa con una circunferencia pequeña que cruza todos los carbonos del anillo. Cuando uno o más átomos de hidrógeno se sustituyen por grupos alquilo, se forman infinidad de compuestos derivados. Nomenclatura IUPAC Los compuestos aromáticos derivados del benceno se nombran al colocar el benceno como cadena principal e indicando la posición de los sustituyentes. Cuando solo hay un sustituyente, le corresponde el número 1, que puede omitirse en el nombre. Unidad 12: Grupos Funcionales Orgánicos 202 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ CH3 Metilbenceno H3C CH3 1,3-dimetilbenceno Cl 1,4-cloro-metilbenceno H3C Cuando existen solo dos sustituyentes, es frecuente indicar la posición de estos mediante los prefijos orto- (o = 1,2 ), meta- (m = 1,3 ) y para- (p=1,4 ). CH3 o-bromometilbenceno → o-bromotolueno Br H3C CH3 m-dimetilbenceno → m-xileno Cl p-cloro-metilbenceno → p-clorotolueno H3C Nomenclatura común Algunos derivados de benceno cuentan con nombres propios que se suelen emplear como base para escribir nombres comunes. Unidad 12: Grupos Funcionales Orgánicos 203 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Autoevalúate 1 Nombre los siguientes compuestos: a) b) c) d) Unidad 12: Grupos Funcionales Orgánicos 204 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.1.2 Propiedades de hidrocarburos 12.1.2.1 Propiedades Físicas Los hidrocarburos son prácticamente considerados como moléculas no polares debido a que los enlaces C-C y C-H presentan una polaridad muy baja. Debido a que sus fuerzas intermoleculares son muy débiles (fuerzas de London), a temperatura ambiente es posible encontrar alcanos en diferentes estados físicos así: − De metano a butano son gaseosos. − De pentano a hexadecano son líquidos − De heptadecano en adelante son sólidos. Solubilidad Los alcanos son moléculas no polares mientras que el agua es polar. La regla de solubilidad es lo similar disuelve a lo similar, por esta razón los hidrocarburos son insolubles en agua, pero solubles en disolventes no polares como la gasolina, éter, benceno, etc . El CH4, es el alcano más soluble en agua, su solubilidad a 25°C es 2 x 10-5 g/mL.. Por lo tanto, si nos encontramos con un compuesto orgánico que en su mayor parte es hidrocarburo es posible predecir que será insoluble en agua. Cuanto mayor sea la "porción hidrocarbonada" en una molécula, menor será su solubilidad. Ejemplo: Si observamos, solo una pequeña porción de la molécula del colesterol es polar (-OH), mientras que un gran porcentaje es no polar. Por lo tanto, será insoluble en agua, esta es la razón por la que el colesterol es capaz de formar depósitos sólidos en los capilares sanguíneos y producir serios trastornos a la salud. Los alquenos y los alquinos, son ligeramente más polares que los alcanos, pero el valor de su solubilidad en agua es tan pequeño que prácticamente se consideran insolubles en ella. Además, son menos densos que el agua por lo que flotan sobre él. Unidad 12: Grupos Funcionales Orgánicos 205 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Punto de ebullición y Punto de fusión El punto de ebullición y el punto de fusión aumentan con el tamaño del alcano porque las fuerzas intermoleculares son más efectivas cuando la molécula presenta mayor superficie de contacto. Por lo tanto, los puntos de fusión y ebullición van a aumentar a medida que se incrementa el número de átomos de carbono. Tabla 12.2 Puntos de ebullición y fusión de alcanos órmula Molecular Nombre Estado Físico a 25 ºC CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 C18H38 Metano Etano Propano Butano Pentano Hexano Heptano Octano Nonano Decano Octadecano Gas Gas Gas Gas Líquido Líquido Líquido Líquido Líquido Líquido Sólido Puntos de Fusión Ebullición en ºC en ºC –182,6 –161,7 –172,0 –88,6 –187,1 –42,2 –135,0 –0,5 –129,7 36,1 –94,0 68,7 –90,5 98,4 –56,8 125,6 –53,7 150,7 –29,7 174 28,0 308,0 En el caso de los alcanos ramificados, éstos presentan un punto de ebullición más bajo que el del los lineales con el mismo número de átomos de carbono. Esta diferencia se debe a que los alcanos ramificados son más compactos, con menos área superficial para las interacciones por fuerzas de London Tabal 12.3 Puntos de ebullición de los isómeros del pentano Isomeros C5H12 CH3 − CH2 − CH2 − CH2 − CH3 CH3 − CH2 − CH − CH3 | CH3 CH3 | CH3 − C − CH3 | CH3 Unidad 12: Grupos Funcionales Orgánicos Puntos de ebullición 36,1 27,8 9,5 206 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Las temperaturas de ebullición y fusión de los alquenos son muy similares a la de los alcanos correspondientes. 12.1.2.2 Propiedades Químicas Propiedades Químicas de Alcanos Los se conocen también como parafinas, debido a su poca reactividad (parafina significa poca afinidad). Las reacciones más importantes son: − Combustión − Halogenación Combustión La combustión es una reacción de oxidación en la cual todos los átomos de carbono del hidrocarburo se convierten en CO2 y los átomos de hidrógeno en H2O. Esta reacción se utiliza como fuente de calor, el calor desprendido al quemar una molécula de alcano se llama calor de combustión (∆ H). CH3 CH2 CH3 (g) + 5 O2 (g) fuego 3 CO2 (g) dioxido de carbono propano ∆H= = −531 kcal/mol − + 4 H2O (g) agua Halogenación La halogenación de los alcanos es una reacción de sustitución. Los alcanos reaccionan con los halógenos (Cl2, Br2, I2), en presencia de luz ultravioleta o a temperaturas elevadas. CH4 + Cl2 luz UV metano CH3Cl + HCl cloruro de metilo Los alcanos superiores también presentan halogenación, produciéndose una mezcla de productos halógenados. Ejemplo: Cl | CH3 CH2 CH3 + propano Cl2 luz UV CH3 CH2 CH2Cl cloruro de propilo Unidad 12: Grupos Funcionales Orgánicos + CH3 CH CH2Cl + HCl cloruro de isopropilo 207 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ El cloruro de etilo (punto de ebullición 12,5°C) es usado como anestésico local. Propiedades Químicas de Alquenos Lo que identifica a los alquenos es la presencia del doble enlace carbono-carbono, este es, por tanto, su grupo funcional y como tal determinará las reacciones químicas características que pueden sufrir estos hidrocarburos. Las reacciones de los alquenos se conocen con el nombre de adición. Una reacción en la que se combinan dos moléculas para producir una sola, se llama reacción de adición. El reactivo simplemente se agrega al alqueno, en contraposición a la reacción de sustitución típica de los alcanos. Las adiciones al doble enlace de los alquenos tienen las siguientes características: C = C + X—Y | | − C − C − | | X Y El doble enlace consiste en un enlace σ fuerte, y en otro π débil; en consecuencia, la reacción implique la ruptura del enlace más débil, formándose en su lugar dos enlaces σ fuertes Reacción de Hidrogenación Reacción de Halogenación Reacción de Hidratación Reacción de hidro-halogenación Unidad 12: Grupos Funcionales Orgánicos 208 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Cuando tanto el reactivo como el alqueno no son simétricos, se producirá una reacción denominada regio específica. El reactivo asimétrico se adicionará selectivamente, de acuerdo a la regla de Markovnikov. Regla de Markonikov: Cuando un reactivo asimétrico del tipo HY se adicionará a un alqueno asimétrico, el hidrógeno se adicionara al carbono que tiene más hidrógenos. Ejemplos: Autoevalúate 2 Identifique el tipo de reacción y complete la ecuación. a) CH3CH=CHCH3 + H2O → b) CH3 (CH2)4CH3 + O2 → c) CH4 + Cl2 Unidad 12: Grupos Funcionales Orgánicos 209 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.2 ALCOHOLES FENOLES Y ETERES Los alcoholes, fenoles y éteres son compuestos orgánicos oxigenados. Estos compuestos se encuentran presentes en moléculas biológicas como carbohidratos, colesterol y algunos aminoácidos. 12.2.1 ALCOHOLES Los alcoholes son compuestos que tienen el grupo hidroxilo -OH unidos covalentemente a átomos de carbono saturado, con hibridación sp3. H | H − C − | H .. O .. − H Los alcoholes están ampliamente distribuidos en la naturaleza. En los seres vivos se encuentra formando parte de carbohidratos, proteínas, lípidos, ácidos nucleídos, etc. De acuerdo con el tipo de carbono al que está unido el grupo OH, los alcoholes se clasifican como: – Alcohol primario: si el grupo oxidrilo se encuentra unido a un carbono primario R − CH2 − OH – Alcohol secundario: si el grupo oxidrilo se encuentra unido a un carbono secundario R − CH − R | OH – Alcohol terciario: si el grupo oxidrilo se encuentra unido a un carbono terciario R | R − C − R | OH Unidad 12: Grupos Funcionales Orgánicos 210 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.2.1.1 Nomenclatura de Alcoholes A los alcoholes se les puede nombrar usando la nomenclatura común o la nomenclatura IUPAC. Nomenclatura común Para nombrarlos se antepone la palabra alcohol y se cambia el sufijo -ano por -ílico y al anteponer la palabra alcohol. CH3- OH CH3-CH2-OH alcohol metilico alcohol etilico Nomenclatura IUPAC Para nombrarlos se siguen las mismas reglas que para nombrar hidrocarburos. Se cambia el sufijo del hidrocarburo -ano por -ol.. El grupo funcional –OH tiene prioridad sobre los enlaces múltiples. Se le asigna el número más bajo posible. Ejemplos: CH3 | CH3 − CH2 − CH2 − OH CH3 − CH − CH3 | OH CH3 − C − CH3 | OH 2-propanol 2 metil-2-propanol sec-propanol ter-butanol 1-propanol Si existen varios grupos –OH, se anteponen los prefijos di-, tri-, tetra-, etcétera. 5-metil-6-octaen-2,6-diol Autoevalúate 3 1. Nombra el siguiente alcohol: 2. Escribe la formula del 3-metil-2 hexanol Unidad 12: Grupos Funcionales Orgánicos 211 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.2.1.2 Propiedades Físicas de Alcoholes El grupo hidroxilo le confiere polaridad a la molécula, la electronegatividad del oxígeno provoca la polarización del enlace O-H y del C-O. Al igual que el agua, los alcoholes pueden formar puentes de hidrógeno, por esta razón las propiedades de los alcoholes son muy distintas de los hidrocarburos respectivos. Solubilidad En cuanto a la solubilidad de los alcoholes en agua, los de bajo peso molecular son solubles en todas proporciones. Esto se debe a la regla de solubilidad: lo similar disuelve a lo similar y a los puentes de hidrógeno entre los alcoholes y el agua. Figura 12.3 Puentes de hidrogeno entre moléculas de alcohol y agua δ− δ+ δ− CH3 − O ……. H − O δ | | + δ δ H ……. O − CH H 3 − + | δ+ H La cadena hidrocarbonada de un alcohol es hidrofóbica, por lo que al aumentar la longitud de ésta, la solubilidad decrece. Figura 12.4 Molécula de agua y molécula de alcohol Unidad 12: Grupos Funcionales Orgánicos 212 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos La ramificación de la molécula, como el incremento de los números de grupos OH aumenta la solubilidad Punto de ebullición y punto de fusión de alcoholes Los puntos de fusión y ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Figura 12.5 Puentes de hidrogeno entre moléculas de alcohol Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones Tabla 12.4 Comparación de propiedades físicas de alcanos y alcoholes Fórmula estructural Nombre CH3OH CH3CH3 CH3CH2OH CH3CH2CH3 CH3CH2CH2OH CH3CH2CH2CH3 CH3CH2CH2CH2OH CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2OH HOCH2CH2CH2CH2OH CH3CH2CH2CH2CH2CH3 metanol etano etanol propano 1-propanol butano 1-butanol pentano 1-pentanol 1,4-butanodiol hexano Masa Molar P.eb. (°C) Solubilidad en agua 32 30 46 44 60 58 74 72 88 90 86 65 -89 78 -42 97 0 117 36 138 230 69 infinita insoluble infinita insoluble infinita insoluble 8 g/100g insoluble 2.3g/100g infinita insoluble Autoevalúate 4 1. ¿Quién tiene mayor punto de ebullición el 1-pentanol o el 1-octanol. Dibuje los alcoholes y justifique su respuesta. 2. ¿Quién tiene es más soluble en agua , el 1-butanol o el 2- metil -2- propanol. Dibuje los alcoholes y justifique su respuesta. Unidad 12: Grupos Funcionales Orgánicos 213 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.2.1.3 Propiedades Químicas de Alcoholes Dos son las propiedades químicas de importancia biológica: − La deshidratación (reacción de eliminación) − La reacción de Oxidación Reacción de deshidratación La deshidratación de los alcoholes es una reacción de eliminación. El alcohol pierde su grupo –OH para dar origen a un alqueno. CH3 − CH2 − OH CH2 = CH2 H SO 24 → etanol eteno La reacción requiere catalizadores como el H2SO4, en el organismo humano la enzima que actúa es el alcohol deshidratasa La facilidad como se deshidratan los alcoholes difiere: 3°>2°>1° Reacción de Oxidación La oxidación implica un aumento del número de enlaces carbono-oxigeno, por acción de sustancias oxidantes como: + + K2Cr2O7 - H - H2O -2 KMnO4 - H - H2O +3 Cr2O7 Cr naranja verde - +2 MnO4 Mn morado marrón [O] Las reacciones requieren catalizadores ácidos o enzimas como las Oxidasas, peroxidasas, deshidrogenasas Los alcoholes primarios se oxidan convirtiéndose en aldehídos. Si la oxidación es enérgica pueden llegar hasta ácidos carboxílicos. Los alcoholes secundarios se transforman en cetonas Los alcoholes terciarios no se oxidan. Unidad 12: Grupos Funcionales Orgánicos 214 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ O || Alcohol primario R − CH2 − OH [O] R − C − H O || [O] R − C − OH Alcohol secundario OH | R − CH O || − R' [O] R − C − R' Alcohol terciario R | − R − C | OH R [O] NO REACCIONA 12.2.2 FENOLES Los fenoles son derivados del benceno donde uno de sus H han sido reemplazados por el grupo hidroxilo (OH) 12.2.2.1 Nomenclatura de Fenoles Se sigue las reglas de nomenclatura para compuestos aromáticos (en lugar de benceno se usa la palabra por fenol) Si existen varios radicales se numeran los átomos de carbono del benceno de modo que les corresponda la numeración más baja posible comenzando por el OH Orto cloro fenol 4-cloro-3,metil fenol Unidad 12: Grupos Funcionales Orgánicos 3,4-dimetil fenol 215 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.2.2.2 Propiedades de Fenoles Los fenoles son sólidos cristalinos de color blanco, de olor muy fuerte. El fenol es un potente fungicida, bactericida, antiséptico y desinfectante. De ser ingerido en altas concentraciones, puede ser toxico (sustancia usada en los campos de concentración nazis en las llamadas "inyecciones letales" - 10 mL de fenol). El fenol es un ácido débil cuya Ka = 1 x 10-10 + H2O + + H Es poco reactivo, el anillo aromático le da una alta estabilidad. Puede ser neutralizado con una base. + NaOH + H2O fenxido de sodio 12.2.3 ETERES Químicamente lo éteres son derivados de hidrocarburos donde uno de los -H ha sido reemplazado por el grupo (OR) CH3 − CH2 − O − CH3 etil metil eter Los éteres se reconocen por el grupo funcional alcoxi -O-, en el cual un oxígeno está unido directamente a dos carbonos. Estos pueden ser parte de una cadena alifática o aromática. 12.2.3.1 Nomenclatura de éteres Nomenclatura común Se forma al ordenar alfabéticamente los nombres de los sustituyentes, seguido de la palabra éter. Unidad 12: Grupos Funcionales Orgánicos 216 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Dietil éter etil fenil éter Nomenclatura IUPAC Se forma al considerar el alquil más grande como cadena principal y el más corto como sustituyente, y cambiando el sufijo -il por -oxi. CH3 − CH2 − O − CH2 − CH2 − 1 2 CH3 3 etoxipropano 2 1 CH3 − CH2 − O − CH2 − | 3 CH2 | 4 CH3 CH3 2-etoxibutano 12.2.3.2 Propiedades de éteres Los éteres son compuestos muy estables, son tan inertes como los alcanos. Los éteres no pueden formar puentes de hidrógeno entre sí , por esta razón sus puntos de ebullición son similares a los de los alcanos y mucho más bajos que los de los alcoholes similares. La solubilidad de los éteres en agua es comparable a la de los alcoholes debido a los puentes de hidrógeno que pueden aceptan del agua. Figura 12.6 Puentes de hidrogeno entre moléculas de éter y agua δ− δ+ δ− R − O ……. H − O δ | | + δ δ H ……. O − R R − + | δ+ Unidad 12: Grupos Funcionales Orgánicos R 217 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Al igual que los alcanos los éteres son químicamente estables. Autoevalúate 5 1. Escriba la nomenclatura IUPAC de siguiente éter: 2. ¿Quién tiene mayor punto de ebullición el pentano, 1-pentanol y etil propil eter? 3. ¿Quién tiene es más soluble en agua, el dietil éter o el butano? 12.3 GRUPO CARBONILO: ALDEHÍDOS Y CETONAS Los compuestos carbonílicos se caracterizan por la presencia de un carbono unido al oxígeno mediante un enlace doble (grupo carbonilo). O || C Se clasifican en aldehídos y cetonas: O || CH3 − C − H O || CH3 − C − CH3 Aldehído Cetona RCHO RCOR΄ Para los aldehídos, el carbono carbonilo siempre es un carbono terminal y se encuentra enlazado a un hidrógeno, mientras que en las cetonas nunca será un carbono terminal ya que debe estar enlazado a otros dos átomos de carbono Los carbonilos se encuentran entre las moléculas de mayor importancia biológica e industrial. Se encuentra presente en una gran variedad de compuestos biológicamente importantes como carbohidratos, proteínas, hormonas, ácidos grasos, aminoácidos, ácidos nucleicos, vitaminas, etc. Unidad 12: Grupos Funcionales Orgánicos 218 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Glucosa Progesterona Paradoxal : Vitamina B6 12.3.1 Nomenclatura de aldehídos y cetonas Nomenclatura de Aldehídos Según la nomenclatura IUPAC, los aldehídos se nombran sustituyendo el sufijo del alcano por –al. El carbono 1 corresponde al carbonilo por lo cual no es necesario escribir el número. 3-metilpentanal CHO Benzaldehído Para los efectos de la nomenclatura, cuando en la cadena existen varios grupos funcionales, la prioridad de dichos grupos es la siguiente: (1) ácidos carboxílicos, (2) aldehídos, (3) cetonas, (4) alcoholes, (5) éteres, (6) alquinos, (7) alquenos. Ejemplos: CH2 = CH − CH2 − CHO 3-butenal o butanal-3-eno 5 etil-6 hepten-1- al Nomenclatura de Cetonas De acuerdo a la nomenclatura IUPAC, para nombrar a las cetonas se debe sustituir el sufijo -ano por -una, indicando la posición del grupo carbonilo. En las cetonas de Unidad 12: Grupos Funcionales Orgánicos 219 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ cadena abierta, el carbono número uno de la cadena principal corresponde al carbono del extremo más cercano al grupo carbonilo. O || Propanona (Acetona) CH3 − C − CH3 O || CH3 − C − CH2 − CH3 2- butanona 2 metil-3-heptanona Autoevalúate 6 1. Escriba la estructura de los compuestos siguientes: a) 3- metilpentanal b) 3,4- dibromopentanona c) 2-metil butanal d) 1,3,5 ciclohexanotriona 12.3.2 Propiedades de Aldehídos y Cetonas La presencia del grupo carbonilo convierte a los aldehídos y cetonas en compuestos polares. Figura 12.6 Polarización del grupo carbonilo .. δ − O : || C Unidad 12: Grupos Funcionales Orgánicos + δ+ 220 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Debido a que el oxígeno es mucho más electronegativo que el carbono existe una dipolaridad permanente, la fuerza intermolecular que prevalece es el dipolo-dipolo. 12.3.2.1 Propiedades Físicas de Aldehídos y Cetonas Punto de Ebullición Debido a la alta polaridad del grupo carbonilo, las fuerzas de atracción dipolo-dipolo en los aldehídos y cetonas son más fuertes que las existentes entre las moléculas de los hidrocarburos y éteres, lo que resulta en puntos de ebullición más elevados (entre 5080o). Sin embargo, debido a que sus moléculas no pueden formar puentes de hidrógeno intermoleculares, los puntos de ebullición de los aldehídos y cetonas son más bajos que los de los alcoholes de pesos moleculares semejantes. Tabla 12.5 Comparación de temperaturas de ebullición de alcanos, Aldehídos, cetonas y alcoholes Formula T.E °C CH3 − CH2 − CH3 − CH2 − CHO O || C CH3 − CH3 − CH3 Propano P.E = - 42,2 °C Propanal P.E = 49 °C Propanona P.E = 56 °C − CH3 Propanal P.E = 97 °C CH2 − CH2OH Solubilidad La presencia de pares de electrones no compartidos en el oxígeno del grupo carbonilo, hace posible que los aldehídos y cetonas puedan formar puentes de hidrógeno con el agua. Por esta razón, los aldehídos y cetonas sencillos (hasta cuatro átomos de carbono) son completamente solubles en agua. Igualmente son solubles en solventes orgánicos. Figura 12.7 Puentes de hidrogeno entre moléculas de compuestos carbonilicos y agua R R − δ− + δ+ − δ− C = O ……. H − O δ δ | + δ H ……. O = C + − δ Unidad 12: Grupos Funcionales Orgánicos + R R 221 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.3.2.2 Propiedades Químicas de Aldehídos y Cetonas El átomo de carbono del grupo carbonilo está unido a otros tres átomos. Uno de ellos es el oxígeno, al cual esta enlazado mediante un enlace sencillo sigma (σ), y un enlace pi. Algunas de las propiedades químicas de los compuestos carbonílicos son similares a la de los alquenos, por ejemplo su tendencia a sufrir reacciones de adición. Sin embargo existen diferencias significativas en cuanto a reactividad debido a que el enlace C = O es muy polar, el oxigeno por su alta electronegatividad polariza el enlace generando carga parcial positiva sobre el carbono y negativa sobre el oxígeno. Esta característica afecta las propiedades químicas del doble enlace carbono-oxígeno, haciéndolas distintas a las propiedades del doble enlace carbono-carbono Las propiedades químicas de los aldehídos y cetonas están determinadas por el grupo carbonilo, C=O, el cual, como ya vimos, proporciona un carbono deficiente en electrones, susceptible a ser atacado por reactivos ricos en electrones o nucleofílicos. Las reacciones típicas de los aldehídos y cetonas son de adición nucleofílica, las cuales son catalizadas tanto por ácidos como por bases. La forma geométrica plana del grupo carbonilo facilita el ataque del reactivo nucleofílico ya sea por arriba o por debajo del plano. Las propiedades químicas de importancia biológica de aldehídos y cetonas son: Unidad 12: Grupos Funcionales Orgánicos 222 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ − Adición de alcohol a aldehídos y cetonas − Reacción de oxidación de aldehídos y cetonas Adición de alcohol a aldehídos y cetonas La adición de una molécula de alcohol a un aldehído o cetona produce un hemiacetal o hemicetal, respectivamente. Estos son productos inestables. Sin embargo, las estructuras cíclicas de los monosacáridos se configuran mediante un enlace hemiacetálico o hemicetálico interno entre el grupo aldehído y un grupo hidroxilo de la molécula. La reacción del acetaldehído y el alcohol etílico para formar el hemiacetal es el siguiente: O || CH3 − C − H + H − O − CH2 − CH3 O − H | CH3 − C − H | O − CH2 − CH3 Hemiacetal La reacción de la acetona y el alcohol etílico para formar el hemicetal es el siguiente: O || CH3 − C − CH3 + H − O − CH2 − CH3 O − H | CH3 − C − CH3 | O − CH2 − CH3 Hemicetal Los hemiacetales y hemicetales, en presencia de catalizadores ácidos reaccionan con una molécula de alcohol para formar acetales y cetales. El acetal formado entre acetaldehído y alcohol etílico y el cetal que resulta de la adición entre acetona y alcohol etílico tienen las siguientes fórmulas: Unidad 12: Grupos Funcionales Orgánicos 223 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ O − CH 2 − CH3 O − CH 2 − CH3 | | CH 3 − C − H CH3 − C − CH 3 | | O − CH 2 − CH3 O − CH 2 − CH3 acetal cetal Reacción de oxidación de aldehídos y cetonas Los aldehídos oxidan fácilmente y se convierten en el ácido carboxílico respectivo, por el contario las cetonas son difíciles de oxidar, en presencia de los agentes oxidantes de gran poder (permanganato de potasio, dicromato de potasio, etc.). La reacción global de oxidación de un aldehído es la siguiente O O || || CH3 − C − H + [O] aldehido CH3 − C − OH Acido carboxílico Por el contrario las cetonas: O || CH3 − C − CH3 + [O] No reacciona cetona Autoevalúate 7 1. Prediga que miembro de cada par tiene el punto de ebullición más alto y explique el porqué de su predicción a) Butanal y butano b) Propanona y propanol c) Hexano y hexanal 2. Prediga que miembro de cada es soluble en agua y explique el porqué de su predicción a) Butanal y butano b) Pentanal y octanol c) Hexano y hexanal Unidad 12: Grupos Funcionales Orgánicos 224 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 3. Escriba la estructura del hemiacetal que se generan el equilibrio cuando están presentes los siguientes pares de compuestos a) Etanal y etanol b) 2-Butanona y metanol 4. Examine cada estructura para determinar si es un hemicetal, hemiacetal, ó ninguno de ellos. Si lo es, identifique el átomo de carbono del carbonilo del aldehído ó cetona original . Unidad 12: Grupos Funcionales Orgánicos 225 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.4 GRUPO CARBOXILO ÁCIDOS CARBOXILICOS Y ESTERES Entre los compuestos que poseen el grupo carboxilo están los ácidos carboxílicos y esteres 12.4.1 Ácidos carboxílicos Cuando el grupo O está unido a un H se trata de un ácido carboxílico O || C R OH RCOOH En los seres vivos, los ácidos carboxílicos son los principales intermediarios en el metabolismo de los carbohidratos, lípidos y proteínas. Algunos ácidos se encuentran formando parte de las soluciones reguladoras del pH. 12.4.1.1 Nomenclatura de Ácidos carboxílicos De acuerdo a la nomenclatura IUPAC, para nombrarlos se antepone la palabra ácido a la raíz numeral con el sufijo -oico. El carbono del grupo carboxilo es siempre el 1, por lo que puede omitirse este número. ácido 4-cloro hexanoico Unidad 12: Grupos Funcionales Orgánicos 226 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Sin embargo, los ácidos grasos de entre 10 y 20 carbonos, y en número par, tienen tanta relevancia biológica que usualmente se los llama solo por su nombre común, que se deriva de los productos en los que estos ácidos grasos se encuentran. Tabla 12.6 Nomenclatura común y IUPAC para algunos ácidos carboxílicos comunes. Estructura Nombre IUPAC Nombre común HCOOH CH3COOH ácido metanoico ácido fórmico acido etanoico ácido acético CH3CH2COOH ácido propanoico ácido propiónico CH3(CH2)2COOH ácido butanoico ácido butírico CH3(CH2)3COOH ácido pentanoico ácido valérico CH3(CH2)4COOH ácido hexanoico ácido caproico CH3(CH2)6COOH ácido octanoico ácido caprílico CH3(CH2)8COOH ácido decanoico ácido cáprico CH3(CH2)10COOH ácido dodecanoico ácido láurico CH3(CH2)12COOH ácido tetradecanoico ácido mirístico 12.4.1.2 Propiedades de ácidos carboxílicos Los ácidos carboxílicos son compuestos muy reactivos debido a su gran polaridad. 12.4.1.2.1 Propiedades Físicas de ácidos carboxílicos Punto de fusión y punto de ebullición Los ácidos carboxílicos, al igual que los alcoholes pueden formar puentes de hidrógeno, por lo tanto su punto de ebullición y de fusión tiene valores elevados. El punto de ebullición de los ácidos es mayor que la de los alcoholes con masa molar comparables debido a la formación de dímeros. Un dímero se forma por la combinación de dos moléculas del mismo ácido, el anillo de ocho miembros con dos puentes de Hidrógeno, que prácticamente “dobla” el peso molecular de las moléculas Unidad 12: Grupos Funcionales Orgánicos 227 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Solubilidad Los ácidos carboxílicos más pequeños son solubles en agua. Conforme aumente la cadena (porción no polar) su solubilidad disminuye. Esta solubilidad se debe la formación de puentes de hidrógeno con el agua. Acidez Los ácidos carboxílicos son ácidos débiles de Bronsted, pueden establecer sistemas en equilibrio: CH3 − COOH(ac) + H2O CH3 − COO - Ka = - (ac) + H + (ac) + [CH3 COO ] [H ] CH 3- COOH La mayoría de los valores de Ka de los ácidos son pequeños, están en el orden de 1x10 -5, lo que nos indica el bajo porcentaje de ionización (menos del 5%) Unidad 12: Grupos Funcionales Orgánicos 228 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.4.1.2.2 Propiedades químicas de ácidos carboxílicos Las propiedades químicas de los ácidos carboxílicos se deben a la resonancia del ion carboxilato. Reacción de neutralización Los ácidos carboxílicos sencillos son ácidos débiles que al reaccionar con bases fuertes, como el hidróxido de sodio, originan sales estables que son sólidos solubles en agua y se hallan completamente disociadas en solución. Son sales iónicas Esta reacción es muy importante al nivel molecular de la vida, debido a que los ácidos carboxílicos que se producen normalmente por el metabolismo deben neutralizarse. De lo contrario, el pH de los fluidos corporales, como la sangre, bajaría en exceso (y sobrevendría la muerte). La reacción de neutralización del caprico (ácido decanoico) con hidróxido de sodio es la siguiente: CH3 (CH2) 8 COOH + NaOH ácido decanoico insoluble en agua CH3 (CH2) 8 COONa + H2O ión decanoato muy soluble en agua Los iones carboxilato son más solubles en agua que sus ácidos precursores. A las sales orgánicas se les nombra de la misma manera que a las sales inorgánicas. Al nombre del anión orgánico le sigue el nombre del catión. El nombre del anión se obtiene eliminando la terminación “ico” de los ácidos y reemplazándola por la terminación “ato”. Formación de esteres Los ácidos carboxílicos son los compuestos precursores de los esteres y de las amidas, dos grupos funcionales de mucha importancia biológica. La esterificación se produce al calentar una solución de un ácido carboxílico con un alcohol, en presencia de un catalizador ácido fuerte. Unidad 12: Grupos Funcionales Orgánicos 229 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Ejemplo: CH3 − COOH + H − O − CH3 ácido etanoico H+ metanol CH3 − COO − CH3 + H2O etanoato de metilo Autoevalúate 8 1. Escribe la fórmula del Ácido propanodioico 2. Nombre el siguiente compuesto: 3. Ordene de acuerdo al valor ascendente de sus temperaturas de ebullición y su solubilidad en agua a los siguientes compuestos: a) b) c) d) HO 2 CCO 2H CH3(CH2)4 COOH CH 3 CO 2H CH3 CH 2 CO 2 H 4. Prediga que miembro de cada par tiene el punto de ebullición más alto y explique el porqué de su predicción a) b) c) d) Butano y ácido butanoico Acido etanoico y ácido pentanoico Etanol y ácido etanoico Propanona y acido propanoico 5. Escriba la reacción de hidróxido de potasio con los siguientes compuestos: a) ácido pentanodioico. b) ácido 2,3 di-metil butanoico 6. ¿Cuál es el producto de la esterificación del ácido oxálico (HOOC – COOH) con alcohol propílico? Unidad 12: Grupos Funcionales Orgánicos 230 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.4.2 Esteres Se forman por reacción de los ácidos carboxílicos con alcoholes. 12.4.2.1 Nomenclatura de Ésteres Para nombrar un ester, primero se identifican y nombran al ácido carboxílico y al alcohol que los originan. El nombre nace al colocar el nombre del ácido y cambiando -oico por -oato, y el sufijo del alcohol -ílico por -ilo. Pentanoato de metilo Butanoato de propilo 12.4.2.2 Propiedades de Ésteres El grupo ester es polar pero no puede formar puentes de hidrógeno entre moléculas similares. Es por esta razón que sus temperaturas de ebullición es menor que la de los alcoholes. Sin embargo, el grupo éster, puede aceptar puentes de hidrogeno con el agua, por lo que los más pequeños son solubles en agua. Los ésteres se hidrolizan al entrar en contacto con el agua regenerando sus ácidos y alcoholes originales. Generalmente se usa un catalizador ácido fuerte. (En el cuerpo, el catalizadores una enzima.) CH3 CH2 CH2 CH2 COO CH3 + H2O H+ pentanoato de metilo Unidad 12: Grupos Funcionales Orgánicos CH3 CH2 CH2 CH2 COOH acido pentanoico + OH- CH3 metanol 231 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.5 FUNCIONES NITROGENADAS Se tratarán los principales grupos funcionales que contienen nitrógeno. En todas estas estructuras neutras cada nitrógeno presenta tres enlaces covalentes. 12.5.1 Aminas Las aminas son compuestos nitrogenados derivados del amoniaco (NH3) en el que alquilo o arilo N Las aminas se pueden clasificar según el número de grupos alquilo que están unidos al nitrógeno. Si sólo hay uno, la amina es primaria. Si hay dos grupos, la amina es secundaria y si hay tres es terciaria. Tabla 12.7 Clasificación de amina Tipo de Amina R − NH2 Ejemplo amina primaria CH3 CH2 CH2 NH2 CH3 CH2 R N − H amina secundaria R' CH3 CH2 R CH3 CH2 N − R'' amina secundaria N − H N − CH2 CH2 CH3 CH3 CH2 R' 12.5.1.1 Nomenclatura de amina De acuerdo a la nomenclatura IUPAC , as aminas primarias se nombran empleando el sufijo -amina. La posición del grupo amino se indica explícitamente y solo se omite si está en el primer carbono. CH3 CH2 CH2 NH2 propanamina Unidad 12: Grupos Funcionales Orgánicos 232 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ CH3 CH2 CH2 CH NH2 | CH3 2-pentanamina CH3 NH2 3- metil-2 hexanamina El grupo amino es prioritario sobre los enlaces dobles y triples, y en general sobre cualquier grupo alquilo. Se le asigna el número más bajo posible. Las aminas secundarias y terciarias se nombran los alquilos unidos al nitrogeno con la terminación –amina: CH3 CH2 CH2 CH2 NH CH2 CH3 butil etilamina CH3 | CH3 CH2 CH2 N CH2 CH3 etil metil propilamina Propiedades butil etil metilamina 12.5.1.2 Propiedades de las aminas Propiedades físicas La propiedad más característica de las aminas es su olor a pescado descompuesto. Algunas diaminas son especialmente pestilentes y sus nombres comunes describen correctamente sus olores. Putrescina 1,4-butanodiamina Cadaverina 1,5-pentanodiamina Unidad 12: Grupos Funcionales Orgánicos 233 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Por otro lado, las aminas son muy polares debido a los electrones libres del nitrógeno. Las aminas aminas primarias y secundarias tienen enlaces N-H que les permiten formar puentes de hidrógeno entre moléculas iguales o con el agua. Figura 12.8 Aminas primaria y secundaria donadora y aceptora de puentes de Hidrógenos Puentes de hidrogeno entre moleculas iguales Puentes de hidrógeno con moléculas de agua Las aminas terciarias, como no tienen enlace N-H, no pueden formar este tipo de enlaces entre moléculas iguales pero si acepta puentes de hidrógeno con el agua. Figura 12.9 Aminas terciaria aceptora de puentes de Hidrógenos Puentes de hidrógeno con moléculas de agua Punto de fusión y ebullición Dado que el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H está menos polar que e ─O-H de los alcoholes. Por lo tanto, sus puntos de ebullición serán menores que los de los alcoholes análogos. Unidad 12: Grupos Funcionales Orgánicos 234 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ Las aminas terciarias, que no pueden formar puentes de hidrógeno, tienen puntos de ebullición más bajos que los de las aminas primarias o secundarias de pesos moleculares semejantes. Tabla 12.8 Puntos de ebullición de aminas, alcoholes y éteres de pesos moleculares semejantes Compuesto Masa Molar Grupo funcional P. E. (°C) (CH3)3N amina terciaria 59 3 CH3-NH-CH2CH3 amina secundaria 59 37 CH3CH2CH2-NH2 amina primaria 60 47 CH3-O-CH2CH3 éter 61 8 CH3CH2CH2-OH alcohol 61 97 Solubilidad Todas las aminas, incluso las terciarias, forman puentes de hidrógeno con el agua. Por esta razón, las aminas de bajo peso molecular (hasta 6 carbonos) son solubles en agua. Propiedades Químicas Las aminas son bases débiles, aunque en los sistemas biológicos se les considera como base fuerte. Estas participan en reacciones biológicas ácido-base. La amina funciona como base de Bronsted−Lowry aceptando el protón de un ácido de acuerdo a la siguiente reacción: R − NH2 + + H2O R − NH3 + OH ─ - Kb = + [ R −NH3 ] [OH ] [R-NH2] Los valores de Kb para la mayoría de las aminas son del orden de 10-3 . 12.5.2 Amidas Se forman por reacción de los ácidos carboxílicos con amoníaco. Se les llama también amidas no sustituidas. O C NH2 Unidad 12: Grupos Funcionales Orgánicos 235 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 12.5.2.1 Nomenclatura de amidas Para nombrarlas, se identifica y nombra al ácido carboxílico y se sustituye -oico por amida. Si la amida tiene sustituyentes alquílos en el átomo de nitrógeno, se indica su posición con el prefijo N-. 3-metilbutanamida N-etil-3-butanamida N,N-dimetilbutanamida 12.5.2.2 Propiedades de las aminas El grupo amida es polar y, a diferencia de las aminas, las amidas son moléculas neutras. El par de electrones no compartido no se localiza sobre el átomo de nitrógeno, sino que se encuentra deslocalizado, por resonancia, en el átomo de oxígeno del grupo carbonilo Salvo la formamida, que es líquida, todas las amidas primarias son sólidas y casi todas son incoloras e inodoras. Los miembros inferiores de la serie son solubles en agua y en alcohol, la solubilidad en agua disminuye conforme aumenta la masa molecular Las amidas poseen puntos de fusión y ebullición anormalmente altos. Este fenómeno, al igual que la solubilidad en agua de las amidas, se debe a la naturaleza polar del grupo amida y a la formación de enlaces de hidrógeno. Por tanto, la combinación de fuerzas electrostáticas y enlaces de hidrógeno explican las atracciones intermoleculares tan fuertes que se observan en las amidas. Las amidas son comunes en la naturaleza y se encuentran en sustancias como los aminoácidos, las proteínas, el ADN y el ARN, hormonas, vitaminas. Es utilizada por el cuerpo para la excreción del amoniaco ( NH3) Unidad 12: Grupos Funcionales Orgánicos 236 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ La Hidrólisis de las amidas produce ácidos carboxílicos y aminas. El organismo la usa como fuente de aminas Autoevalúate 9 1. Identifica cuál estructura corresponde a una amina, primaria, secundaria o terciaria (CH3)3N H2NCH2CH2CH2CH2NH2 NH2 NH CH3 2. Nombre las siguientes estructuras: a) CH3(CH2)6CH2NH2 b) CH3CONHCH2CH3 c) CH3CH2CH2N(CH3) CH2CH3 3. Disponga los compuestos siguientes en orden de punto de ebullición creciente: a) b) c) d) CH3CH2NH2, CH3NHCH3 CH3CH2CH3 CH3CH2OH 4. Prediga el producto de las siguientes reacciones: O CH3CH2C NHCH3 + H2 O → O CH3C OH ácido acético + NH2 calor anilina Unidad 12: Grupos Funcionales Orgánicos 237 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ EJERCICIOS INTEGRADORES 1. En el siguiente compuesto, indica que grupo funcional está presente a) b) c) d) e) Amida Éter Cetona Ácido carboxílico Éster NH O O Cl 2. Nombra la siguiente estructura: a) b) c) d) e) 4,7-dietil-5-isopropil-3,8-dimetil-undecano 3,8-dimetil-4,7-dietil-5-isopropil-undecano 2,3,6-trimetil-4-isopropil-2-propil-octano 5,8-dietil-7-isopropil-9-metil-undecano 2,3,6-trietil-4-isopropil-decano 3. Dibuja la siguiente molécula e indica su fórmula molecular: 3-metil-4,5dodecadieno: a) b) c) d) e) C12H22 C12H26 C13H24 C16H30 C13H22 4. Marque el enunciado verdadero a) b) c) d) e) Los ácidos carboxílicos de importancia biológica tienen número impar de carbonos Al unir un ácido con una amina se obtiene una amida simple. Un éster resulta de la unión de un alcohol con un éter. Los cetonas se oxidan con facilidad Los alcoholes terciarios se oxidan transformándose en cetonas 5. Sobre la siguiente estructura, marque el enunciado correcto: a) b) c) d) e) Tiene nueve carbonos en total. Presenta solo alcoholes primarios Su punto de ebullición es menor que el nonano Es soluble en agua Al oxidarse se obtiene un aldehído Unidad 12: Grupos Funcionales Orgánicos 238 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 6. Con respecto a la amoxicilina marque el enunciado verdadero. a) b) c) d) e) Tiene 2 compuestos carboxílicos Tiene 2 cetonas Hay un ciclo hexanol Hay 3 aminas Ninguna es verdadera 7. El orden creciente de la solubilidad en agua de las siguientes sustancias es: A: propanol a) b) c) d) e) B: metil propil éter C: acido propanoico D: propanal C, A,B,D A,D,C,B B,D,A,C D,B,A,C A,C,D,B 8. Sobre CH3-(CH2)5-CHO marque verdadero o falso: I. Por oxidación se transforma en 1-heptanol II. Forma un espejo de plata con el reactivo de Tollens III. Es un compuesto carboxílico a) b) c) d) e) VVF VVV FFF FFV FVF 9. La reacción entre la propanona y el etanol forma un: a) b) c) d) e) Alcohol Acido carboxílico Hemiacetal Hemicetal Alqueno Unidad 12: Grupos Funcionales Orgánicos 239 Cuaderno Autoinstructivo para la Definición de Niveles de Química _____________________________________________________________________ 10. Sobre el siguiente compuesto indique el enunciado falso H2N a) b) c) d) e) OH Tienen una amina y un alcohol Por oxidación de su grupo funcional alcohol se puede obtener una cetona El alcohol es primario Su grupo funcional amina puede reaccionar con un ácido carboxílico y formar una amida Es soluble en agua porque puede formar puentes de hidrógeno. Unidad 12: Grupos Funcionales Orgánicos 240 Bibliografía BAILEY, Christina y BAILEY, Philip (1995) Química orgánica. Principios y aplicaciones. 5ª ed. México: Prentice Hall Hispanoamericana. BROWN, Theodore, LEMAY, Eugene y BURDGE, Julia (2004) Química: la ciencia central. 9ª ed. México: Pearson Educación. HART, H. (1997) Química Orgánica. 9ª ed. México: Mc Graw Hill. HOLUM, John (2006) Química general, orgánica y bioquímica para ciencias de la salud. México: Limusa Wiley. MASTERTON, Willian y HURLEY, Cecile (2001) Química. Principios y reacciones. 4ª ed. Madrid: Thomson. PETRUCCI, Ralph, HARWOOD, William y HERRING, Geoffrey (2002) Química general. Madrid: Prentice Hall. WHITTEN, Kennet, DAVIS, Raymond y PECK, Larry (1998) Química general. 5ª ed. Madrid: Mc Graw Hill. CANO, María, CÓRDOVA, Leslie, LÓPEZ, Rosario y PÉREZ, Betty (2009) Cuaderno Autoinstructivo de Preparación para la Prueba de definición de Niveles de Química Universidad Peruana de Ciencias Aplicadas. 241 RESPUESTAS AUTOEVALÚATE CAPÍTULO 1 Autoevalúate 1 Autoevalúate 2 Autoevalúate 3 Autoevalúate 4 1. 2 1a. 1b. 1c. 1d. 1e. 1f. 1g. 1h. 1. 1. 2. 3. MHo –Mho–E–Mhe–Mho–Mho–E-MHo– E–C– C- E VVFV Condensación Vaporización Solidificación Condensación Fusión Fusión Vaporización Sublimación Q-Q-F-Q-Q-F-F-F-F-Q 0,256 nm 1,7928 x 109 7263 m/min 1. 2. 3 1. 2. Iguales mp/ me = 1836,2 4,175x10-23 46n, 38 p, 38 e22 X 0 – 12 – 10 - 10 3. 12,10,13 y 4. 5a. 5b. 50 24 33, 26, 26 6. 10 5 1. 5. 6. 7. 8. 9. 1. 2. 4. 1a. 1b. +1 2,439x105m 460 nm, visible El infrarrojo Rojo Verde Dos subcapas: s, p y d 1s22s22p63s23p3 La primera Es representativo. Nivel exterior: 2 e-. Total: 26 eMetal. Termina en el s2, pertenece a la columna IIA de los metales alcalinos. Cada columna es un grupo. X, Y y Z W Todos son no metales. CAPÍTULO 2 Autoevalúate 1 Autoevalúate 2 Autoevalúate 3 Autoevalúate 4 1c. Autoevalúate 5 2a. 2b. 2c. 2e. 59 26 25 12 X +2 X X X y 11 5 X, 118 50 X y 119 50 X 242 Autoevalúate 6 1a 1b. 3a. 3b 3c. Ca, Ca+2,Mg+2 S-2 , S, O-2 + +2 19K y 20Ca -2 16S , y 18Ar +2 y 27Co+3 26Fe 1. 2. 3. 4. 1a 1b. 1. 2. 3. F- , O-2, Al+3, S-2 AlF3, Al3O2 , Al2S3 KCl y MgBr2. Unión de un metal con un no metal. AlCl3 , la carga total es 0 KBr y LiF CH3NH2, P2O3 SO3 A mayor electronegatividad, mayor potencial de ionización. AE y AC son iónicos; el resto covalente; BE más polar FI > FBr > FCl CH3CH2CH3 – London CH3Cl – London,Dipolo-dipolo CH3CH2OH – London, Dipolo-dipolo, puente de hidrógeno El CH3CH2OH es el que tiene mayor punto de ebullición Iónica: KCl, Na2SO4 - Polar: N2, CCl4 - No Polar: H2S Soluble en agua: los compuestos iónicos y los polares. CAPÍTULO 3 Autoevalúate 1 Autoevalúate 2 Autoevalúate 3 Autoevalúate 4 1. Autoevalúate 5 1. CAPÍTULO 4 Autoevalúate 1 Autoevalúate 2 1 1a 1b. 1c. 1d. 1e. 1f. 2a. 2b. 2c. 2d. 2e. 2f. 1a 1b. Autoevalúate 3 1c. 1d. 1e. 2a. 2b. 2c. 2+, 3+, 6+, 4+, 5+, 2-,3+,4+,1-,3-. Óxido ferroso, óxido de hierro (II), monóxido de hierro Anhidrido yodoso, óxido de yodo (III), trióxido de diyodo Óxido cuproso, óxido de cobre (I), monóxido de dicobre Anh. fosfórico, óxido de fósforo (V), pentóxido de difósforo Óxido de calcio, óxido de calcio, monóxido de calcio Anh. arsenioso, óx. de arsénico (III), trióxido de diarsénico Na2O CO2 Ni2O3 SO3 CuO N2O Hidróxido ferroso, hidróxido de hierro (II), dihidróxido de hierro Hidróxido de alumínio, hidróxido de aluminio, monohidróxido de aluminio Hidróxido aúrico, hidróxido de oro (III), trihidróxido de oro Hidroxido de manganeso, dihidroxido de manganeso. Hidróxido de calcio, hidróxido de calcio, dihidróxido de calcio Fe(OH)2 Pb(OH)4 Ni(OH)3 243 Autoevalúate 4 Autoevalúate 5 Autoevalúate 6 2d. 2e. 1a 1b. 1c. 1d. 1e. 2a. 2b. 2c. 2d. 2e. 1a 1b. 1c. 1d. 1e. 2a. 2b. 2c. 2d. 2e. 1a Ba(OH)2 Ti(OH)4 Ácido brómico Ácido nitroso Ácido yodhídrico Ácido bromhídrico Ácido crómico H2CO3 HCl H3PO4 H2SO3 H2SO4 Permanganato de potasio Cloruro de potasio Fosfato de calcio Sulfito de aluminio Yoduro de calcio NaBrO3 K2S Na2CO3 Na3PO4 Al(NO3)3 1b. 2a. 2b. 2c. 2d. 2e. Reacción de descomposición Reacción de simple desplazamiento Reacción de doble desplazamiento Reacción de simple desplazamiento Reacción de descomposición 1. 2. 1a 1b. 1c. 1d. 1. 2. 3. 4. 1. 2. 1. 1. 2. 3. 1a 1b. Masa atómica del cobre = 63,55 uma Li-6: 7,42% y Li-7: 92,58% 44g/mol 136g/mol 227,133 g/mol 166g/mol 23,3 g de Zn 1,5 mmol de H2SO4 3,06 X 1023 átomos de S 1,44 x ,1024 átomos H N = 35 %, H = 5%, O = 60% C= 40,82%, H= 4,57%, O= 54,51% KMnO4 C5H8NNaO4 C6H1206 C3O3H6 320,0 g 8 moles CAPÍTULO 5 Autoevalúate 1 Autoevalúate 2 Autoevalúate 3 Autoevalúate 4 Autoevalúate 5 Autoevalúate 6 Autoevalúate 7 244 2a. 2b. 2c. 43,8 g de HCl 0,6 moles de O2 3,61×1024 moléculas 1a. 1b. 1c 2a. 2b. 2c. 2d. 2e. 2f. 3a. 3b. 3c. 3d. 1a 1b. 1c. 2a. 2b. 2c. 2d. 1. 2. 3. 4. solvente: agua, soluto: azúcar. solvente: alcohol, soluto: yodo solvente: alcohol, soluto: agua agua tetracloruro tetracloruro agua agua agua débil, molecular fuerte, iones débil, iones fuerte, iones Saturada Insaturada Sobresaturada. insaturada insaturada insaturada insaturada Pesar 12,5 g de sal y agregar agua hasta completar 250 mL 41,61 mL 12,5% 0,005 g/L y 7,46x10-5 M 1. 2a. 2b. 2c. 1. 2. P = 0,51 atm 3,73 atm 1,57 L 3,61 atm PCH4 = 2,6 atm PC2H4 = 1,5 atm PC4H10 = 0,7 atm PT = 4,8 atm Masa molar = 17 1. 2a 2b. 1. V= -∆[CH4]/∆t= -∆[O2]/2∆t=∆[CO2]/∆t = ∆[H2O]/2∆t ∆[NH3]/∆t = 0,148M/s -∆[N2]/∆t = 0,07M/s K = 0,0457 s-1 CAPÍTULO 6 Autoevalúate 1 Autoevalúate 2 Autoevalúate 3 CAPÍTULO 7 Autoevalúate 1 Autoevalúate 2 CAPÍTULO 8 Autoevalúate 1 Autoevalúate 2 245 Autoevalúate 3 2. 1. 2. K = 1,3 M-2s-1 [A]= 0,19M T1/2=144,56 min 1a. [CS2] [H2]4 [CH4] [H2S]2 1b. [N2] [O2] [NO]2 1c [Cl2]2 [O2] [HCl]4 CAPÍTULO 9 Autoevalúate 1 2a. 2b. 2c. 3. 4. 1a 1b. 1c. Autoevalúate 2 1d. 2. 3. 4. 1a 1b. 1c. 1d. 1e. 1f. Autoevalúate 3 2a. 2b. 2c. Autoevalúate 4 3a. 3b. 4. 1a 1b. 2a. 2b. 3a. 3b. 3c. 3d. Heterogénea, Kp = 1/pCO.p2H2 Homogénea , Kp = p2NO2/pN2O4 Heterogénea, Kp = PCH4/p2H2 171,87, desplazado hacia los productos [H2] = 1,11M [N2] = 0,37M [NH3] = 0,26M → → ← → aumenta - aumenta - disminuye - aumenta Endotérmica Disminuir concentración de reactivos o incrementar la presión Ácido de Arrhenius y Bronsted y Lowry Base de Arrhenius Ácido de Arrhenius y Bronsted y Lowry Base de Arrhenius Acido de Arrhenius y Bronsted y Lowry. Base de Bronsted y Lowry. H2O y OH – ácido y base conjugada. CN– y HCN base y ácido conjugado. H2O y H3O+ base y ácido conjugado. HI y I– ácido y base conjugada. HClO3 y ClO3 – ácido y base conjugada. H2O y H3O+ base y ácido conjugado. Hacia los reactivos Hacia los productos HCOOH es un ácido mas débil, Ka más pequeña. Base Ácido 2,7x10-3 1,6x10-12 7,88 3,79 7,3 2 246 Autoevalúate 5 Autoevalúate 6 1. 2. 3. 4. 5. 1. 2. 1. 2a. Autoevalúate 7 2b. 3. 4. 5. B pH = 7,5 Agregar más ácido 0,051M 4,66 byc A.O A.R E. O KClO3 Br-1 Br2 Cl2 Fe Fe+3 O2 C2H6 CO2 Ambas son espontáneas E°>0 Cu2+ + 2e- → Cu Pb → Pb2+ + 2eCu2+ + Pb → Pb2+ + Cu Fe+3 + e- → Fe+2 Sn → Sn2+ + 2eFe3+ + Sn → Fe2+ + Sn2+ E° a = 0,49V y E° b = 0,9v E = 0,94V E.R KCl Cl-1 H2O CAPÍTULO 10 Autoevalúate 1 Autoevalúate 2 Autoevalúate 3 Autoevalúate 4 1a. 1b. 2a. 2b. 1a. 1b. 1 sp3 sp2 σ C-C = 8, σ C-H = 14, π=3 σ C-C = 6, σ C-H = 12, π=2 1°=4, 2°=1, 3°=0, 4°=1 1°=6, 2°=5, 3°=2, 4°=1 C17H16 1a 1b. 1c. 1d. 1e. Aldehído – grupo carbonilo Cetona – grupo carbonilo Ester – grupo carboxílico Éter – grupo oxi Amina – grupo nitrogenados 1a. 1b. CH3CH2OCH3 y CH3CH2CH2OH CH3CHOHCH3 y CH3CH2CH2OH CAPÍTULO 11 Autoevalúate 1 1c. 247 2. 3. 2-penteno 4. CAPÍTULO 11 Autoevalúate 1 Autoevalúate 2 Autoevalúate 3 1a. 1b. 1c. 1d. 1a. 1b. 1c. 1. 2. 1. Autoevalúate 4 2. Autoevalúate 5 3,4,6.trimetil.6-etilnonano 2-metil-3-etil-1-penten-4-ino 2,4-hexaieno p-dimetilbenceno CH3CH=CHCH3 + H2O → CH3CH2—CHOHCH3 2CH3 (CH2)4CH3 + 25 O2 →8CO2 + 9H2O CH4 + Cl2 CH3Cl + HCl 5-metil-2-hexanol 1. 2. 3. El pentanol, porque a mayor longitud de la cadena mayor punto de ebullición El 2- metil -2- propanol, porque a menor longitud de la porción hidrofóbica, mayor será su solubilidad en agua. 2-etoxi pentano El 1-pentanol, porque puede formar puentes de hidrógeno El dietil éter 1a. 1b. Autoevalúate 6 1c. 1d. 248 1a. 1b. 1c. 2a. 2b. Autoevalúate 7 2c. Butanal, porque sus fuerzas moleculares son dipolo-dipolo, mientras que el butano solo tiene London Octanol, porque sus fuerzas moleculares son puentes de hidrógeno mientras que el pentanal solo tiene dipolo-dipolo Hexanal, porque sus fuerzas moleculares son dipolo-dipolo, mientras que el hexano solo tiene London Butanal, porque forma puentes de hidrógeno con el agua Pentanal, porque aunque ambos pueden formar puentes de hidrógeno con el agua, el pentanol es más pequeño que el octanol. Hexanal, porque forma puentes de hidrógeno con el agua 3a. 3b. 1. 2. 3. 4a. 4b. Autoevalúate 8 4c. 4d. 5a HOOC-CH2-COOH Ácido-3,5,7-trimetil octanoico Punto de ebullición c<a<d<b Solubilidad b<d<c<a Ácido butanoico, porque puede formar doble puente de hidrógeno entre sus moléculas Ácido pentanoico, porque tiene mayor longitud de la cadena Ácido etanoico, porque puede formar doble puente de hidrógeno entre sus moléculas Ácido propanoico, porque puede formar doble puente de hidrógeno entre sus moléculas CH3(CH2)3COOH + KOH → CH3(CH2)3COOK + H2O 5b Autoevalúate 9 6. 1. 2a. 2b. 2c. 3. 4a. CH3CH2CH2OOC-COOCH2CH2CH3 Primaria-primaria-secundaria-terciaria octil amina N-etil etanoamida Metil etil propil amina Punto de ebullición c<b<a<d CH3CH2COOH + H2NCH3 4b. 4c. CH3CONHCH2CH3 249 RESPUESTAS EJERCICIOS INTEGRADORES Unidad /Pregunta 1 2 3 4 5 6 7 8 9 10 Unidad 1 C B B D C B E D D E Unidad 2 A B B E A A C A A C Unidad 3 C B D B D A D D B D Unidad 4 D E D A A E D D D D Unidad 5 C D D B B C A A B D Unidad 6 A B B C D E C D D C Unidad 7 C D D C A B A D A B Unidad 8 D A B D C E C B C C Unidad 9 D B E D D C C B A A Unidad 10 D B A D B D D D E B Unidad 11 A D C C D D E E E C Unidad 12 E B E B D E C E D B 250