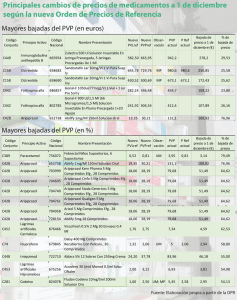
Descargar en pdf - Sociedad Española de Psiquiatría
Anuncio

ISSN: 1888-9891 REVISTA DE PSIQUIATRÍA Y SALUD MENTAL Revista de Psiquiatría y Salud Mental Órgano Oficial de la Sociedad Española de Psiquiatría y de la Sociedad Española de Psiquiatría Biológica Volumen 8, Número 4. Octubre-Diciembre 2015 EDITORIAL Un tratamiento integral para el trastorno por déficit de atención e hiperactividad en toda Europa ORIGINALES Escala Abreviada de Personalidad y Acontecimientos Vitales para la detección de los intentos de suicidio Ver ficha técnica en páginaV< La carga de la enfermedad en España 2010: trastornos neurológicos, mentales y re: trastornos neurológicos, mentales y relacionados con el consumo de sustancias Curso de la enfermedad y calidad de vida en pacientes mexicanos con psicosis Riesgo de suicidio de hombres internos con condena en centros penitenciarios REVISIÓN Comorbilidad entre el trastorno bipolar y los trastornos de la conducta alimentaria CARTAS AL DIRECTOR Delírium en la versión en español del DSM-5: ¿más confusión? La psicosis, una presentación inusual de la tiroiditis de Hashimoto Las voluntades anticipadas en salud mental: hechos y valores OCTUBRE-DICIEMBRE 2015 - VOLUMEN 8 - NUMERO 4 Un nuevo método de valoración de la enfermedad psiquiátrica postraumática Necesidad de mejora en la gestión estadística y proceso de comunicación de los casos de suicidio identificados AGENDA Factor de impacto 2014: 1.622 www.elsevier.es/saludmental Indexada en Index Medicus/Medline, SCI/SSCI/JCR (Science Citation Index / Social Science Citation Index / Journal of Citation Reports) A lcanzando Metas Único antipsicótico agonista parcial de la dopamina y la serotonina de administración mensual1 t Abilify Maintena® ha demostrado eficacia en síntomas positivos y negativos.1,2 tAbilify Maintena® reduce las recaídas y las rehospitalizaciones.1,2,3 tAbilify Maintena® tiene un perfil de tolerabilidad similar a aripiprazol oral.1 tAbilify Maintena® mejora significativamente el nivel de funcionalidad y los síntomas clínicos del paciente medidos por la escala QLS (escala de calidad de vida).4 Simplificando el tratamiento de la esquizofrenia DOSIS RECOMENDADA5 Bibliografía: 1. Fleischhacker WW, Aripiprazole once-monthly for treatment of schizophrenia: double-blind, randomised, non-inferiority study. Br J Psychiatry. 2014;205(2):135-44. 2. Kane JM, Sanchez R, Perry PP, et al. Aripiprazole intramuscular depot as maintenance treatment in patients with schizophrenia: a 52-week, multicenter, randomized, double-blind, placebo-controlled study. J Clin Psychiatry. 2012;73(5):617-624. 3. Kane JM, Sanchez R, Zhao J, et al. Hospitalisation rates in patients switched from oral anti-psychotics to aripiprazole once-monthly for the management of schizophrenia. J Med Econ. 2013;16(7):917-925. 4. Kane JM, et al. Effects of Aripiprazole Once-monthly on Functioning in Patients with Schizophrenia. Poster presented at: 27th annual European College of Neuropsychopharmacology congress; October 18-21, 2014; Berlin, Germany. 5. Ficha Técnica de Abilify Maintena® OPSA/0215/MTN/1076 Ver ficha técnica en páginaV\ VHUILFKDWpFQLFDHQSiJLQDV\ 400mg Revista de Psiquiatría y Salud Mental Órgano Oficial de la Sociedad Española de Psiquiatría y de la Sociedad Española de Psiquiatría Biológica www.sepsiq.org www.sepb.es Sociedad Española de Psiquiatría Sociedad Española de Psiquiatría Biológica Junta Directiva Junta Directiva Presidente: M. Gutiérrez Fraile Presidente: M. Bernardo Arroyo Vicepresidente: J. Bobes García Vicepresidenta: A. González-Pinto Arrillaga Secretario: J.I. Eguiluz Uruchurtu Secretario: M. Urretavizcaya Sarachaga Vicesecretaria: M.P. García-Portilla González Vicesecretaria: M.J. Parellada Redondo Vocales: M. Torrens Melich J. Sáiz Ruiz M. Páramo Fernández D. Palao Vidal J. Cano Valero L. Caballero Martínez Vocal Expresidentes: C. Leal Cercós Vocal Investigadores de Referencia: B. Arranz Martí Vocal Jóvenes Investigadores Acreditados: M. Arrojo Romero Vocal Asamblea General: E. Aguilar García-Iturrospe Edición y publicidad: ELSEVIER ESPAÑA, S.L.U. Avda. Josep Tarradellas 20, 1. 08029 Barcelona - Teléfono 932 000 711. Fax: 932 091 136 Zurbano, 76, 4º izda. 28010 Madrid (España) - Teléfono 914 021 212. Fax: 914 250 423 Indexada en Index Medicus/Medline, IBECS, Science Citation Index/Social Science Citation Index® Journal Citation Reports/Social Science Edition Current Contents®/Social and Behavioral Sciences REVISTA DE PSIQUIATRÍA Y SALUD MENTAL es el órgano oficial de expresión de la Sociedad Española de Psiquiatría y de la Sociedad Española de Psiquiatría Biológica. Publicación trimestral. Copyright 2015 Elsevier España, S.L.U. Reservados todos los derechos. Copyright 2015 Sociedad Española de Psiquiatría y Sociedad Española de Psiquiatría Biológica. Reservados todos los derechos. El contenido de la presente publicación no puede ser reproducido, ni transmitido por ningún procedimiento electrónico o mecánico, incluyendo fotocopia, grabación magnética, ni registrado por ningún sistema de recuperación de información, en ninguna forma, ni por ningún medio, sin la previa autorización por escrito del titular de los derechos de explotación de la misma. ELSEVIER ESPAÑA, a los efectos previstos en el artículo 32.1 párrafo segundo del vigente TRLPI, se opone de forma expresa al uso parcial o total de las páginas de REVISTA DE PSIQUIATRÍA Y SALUD MENTAL con el propósito de elaborar resúmenes de prensa con fines comerciales. Cualquier forma de reproducción, distribución, comunicación pública o transformación de esta obra sólo puede ser realizada con la autorización de sus titulares, salvo excepción prevista por la ley. Diríjase a CEDRO (Centro Español de Derechos Reprográficos, www.cedro.org) si necesita fotocopiar o escanear algún fragmento de esta obra. Ni Elsevier ni la Sociedad Española de Psiquiatría ni la Sociedad Española de Psiquiatría Biológica tendrán responsabilidad alguna por las lesiones y/o daños sobre personas o bienes que sean el resultado de presuntas declaraciones difamatorias, violaciones de derechos de propiedad intelectual, industrial o privacidad, responsabilidad por producto o negligencia. Tampoco asumirán responsabilidad alguna por la aplicación o utilización de los métodos, productos, instrucciones o ideas descritos en el presente material. En particular, se recomienda realizar una verificación independiente de los diagnósticos y de las dosis farmacológicas. Aunque el material publicitario se ajusta a los estándares éticos (médicos), su inclusión en esta publicación no constituye garantía ni refrendo alguno de la calidad o valor de dicho producto, ni de las afirmaciones realizadas por su fabricante. Tarifa de suscrición anual Profesionales 131,39 € Instituciones 332,63 € (IVA incluido. Precios válidos sólo para España) Suscripciones y atención al cliente Elsevier España, S.L.U. Avda. Josep Tarradellas 20, 1 08029 Barcelona Tel.: 902 888 740 Correo electrónico: [email protected] Protección de datos: Elsevier España, S.L.U. declara cumplir lo dispuesto por la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal. REVISTA DE PSIQUIATRÍA Y SALUD MENTAL se distribuye exclusivamente entre los profesionales de la medicina. Impreso en España. Depósito Legal: B-28877-2008 ISSN: 1888-9891 Revista de Psiquiatría y Salud Mental Órgano Oficial de la Sociedad Española de Psiquiatría y de la Sociedad Española de Psiquiatría Biológica COMITÉ EDITORIAL Director: J. Bobes Universidad de Oviedo. CIBERSAM. Oviedo Editores Asociados: C. Arango M. Bernardo J.M. Menchón Mª P. García-Portilla González Hospital Gregorio Marañón. CIBERSAM. Madrid. Hospital Clínic, Universidad de Barcelona IDIBAPS. CIBERSAM. Barcelona Hospital Universitari de Bellvitge. CIBERSAM. Barcelona. Universidad de Oviedo CIBERSAM.Oviedo. A. Mª González-Pinto Arrillaga A. Ibáñez Cuadrado J. Sáiz E. Vieta Hospital Santiago Apóstol, Universidad del País Vasco CIBERSAM, Vitoria Hospital Universitario Ramón y Cajal CIBERSAM, Madrid Hospital Universitario Ramón y Cajal.. CIBERSAM. Madrid. Hospital Clínic, Universidad de Barcelona, IDIBAPS. CIBERSAM. Barcelona CONSEJO EDITORIAL R. Alarcón J. Fernández J. Licinio Mayo Clinic. Rochester, MN (USA) Universidad Autónoma de Madrid. Madrid (Spain) M. Alegría Center for Multicultural Mental Health Research. Somerville, MA Boston (USA) F. Artigas J. García-Sevilla The South Australian Health and Medical Research Institute, Flinders University, Adelaida (Australia) Universitat de les Illes Balears. Palma de Mallorca, Illes Balears (Spain) J. Lieberman J. Garrabé de Lara New York State Psychiatric Institute. New York (USA) Institut d’Investigacions Biomédiques de Barcelona. Barcelona (Spain) Fondation Henry Ey. Perpignan (France) A. Lobo J.L. Ayuso Gutiérrez C. Gastó Hospital Clínico. Universitario. Zaragoza (Spain) Universidad Complutense de Madrid. Madrid (Spain) Hospital Clínico de Barcelona. Barcelona (Spain) M. Maj J.L. Ayuso M. Gaviria University of Naples SUN. Naples (Italy) Hospital Universitario de La Princesa. Madrid (Spain) University of Illinois. Chicago (USA) J. Mann E. Baca J. Gibert-Rahola New York State Psychiatric Institute. New York (USA) Universidad Autónoma de Madrid. Madrid (Spain) Universidad de Cádiz. Cádiz (Spain) J.E. Mezzich P. Bech J. Giner International Center for Mental health. New York (USA) Universidad de Sevilla. Sevilla (Spain) H.J. Möller T.E. Goldberg Psychiatry of the University of Munich (LMU). München (Germany) Zucker Hillside Hospital. Glen Oaks, NY (USA) M. Oquendo G. Goodwin Warneford Hospital. Oxford (UK) Division of Molecular Imaging and Neuropathology. Columbia University. New York (USA) P. Gorwood T. Palomo Hopital Louis Mourier. Paris (France) Hospital Doce de Octubre. Madrid (Spain) J. Guimón L. Rojo Universidad del País Vasco. Bilbao (Spain) Hospital Universitario La Fe. Valencia (Spain) M. Gutiérrez F. Rubia Universidad del País Vasco. Vitoria (Spain) Universidad Complutense de Madrid. Madrid (Spain) M. Hammon P. Ruiz Faculty du Medicine Pierre et Marie Curie Faculty Pitié-Salpétrière. Paris (France) University of Texas-Houston Medical School. Houston, TX (USA) E. Hollander D. Stein Mount Sinai School of Medicine. New York (USA) MRC Unit on Anxiety Disorders. Cape Town (South Africa) Hospital Universitari Vall d’Hebron. Barcelona (Spain) E. Ibáñez M. Trujillo F.X. Castellanos Universidad de Valencia. Valencia (Spain) New York University School of Medicine. New York (USA) NYU Child Study Center. New York (USA) B. Kirkpatrick J. Van Os P. Delgado Medical College of Georgia. Augusta, GA (USA) School for Mental Health and Neuroscience. Maastricht (Nederland) Cleveland (USA) A. Labad J. Vallejo J.M. Delgado HPU Institut Pere Mata. Tarragona (Spain) Universidad Central de Barcelona. Barcelona (Spain) Universidad Pablo de Olavide. Sevilla (Spain) C. Leal J.L. Vázquez-Barquero J. Escobar Hospital Clínico Universitario. Valencia (Spain) Hospital Universitario Marqués de Valdecilla. Santander (Spain) Robert Wood Johnson Medical School Clinical Academic Building. New Brunswick, NJ (USA) J. de León M. Weisman Eastern State Hospital. Lexington, KY (USA) NYS Psychiatric Institute. New York (USA) Frederiksborg General Hospital. Hillerød (Denmark) G. Berrios University of Cambridge Fellow Vitalicio, Robinson College. Cambridge (UK) A. Blanco Universidad de Sevilla. Sevilla (Spain) C. Blanco New York State Psychiatric Institute. New York (USA) A. Bulbena Hospital del Mar. Institut d’Atenció Psiquiàtrica. Barcelona (Spain) J. M. Cañive University of New Mexico. Albuquerque, NM (USA) W. Carpenter University of Maryland School of Medicine. Baltimore, MD (USA) M. Casas COMITÉ DE EXPERTOS L. Agüera (Madrid) E.J. Aguilar (Valencia) C. Álamo (Madrid) S. Al-Halabí Díaz (Oviedo) M. Alonso (Barcelona) E. Álvarez (Barcelona) F. Arias (Madrid) B. Arias (Barcelona) B. Arranz (Barcelona) M. Arrojo (Santiago Compostela) E. Baca (Madrid) M.I. Baeza (Barcelona) V. Balanzá (Valencia) J. Ballesteros (Bilbao) A. Benabarre (Barcelona) M. Bioque (Barcelona) J. Blanch (Barcelona) C. Blanco (Nueva York, EEUU) H. Blasco (Madrid) M. Bousoño (Oviedo) B. Cabrera (Barcelona) M. Camacho (Sevilla) J. Cano (Cádiz) F. Cañellas (Palma de Mallorca) N. Cardoner (Barcelona) J.L. Carrasco (Madrid) J. Castro (Barcelona) J. Cervilla (Granada) A. Ceverino (Madrid) I. Corripio (Barcelona) J.M. Crespo (Barcelona) B. Crespo (Santander) F.J. De Diego (Barcelona) C. De Dios (Madrid) R. de Frutos (Valencia) J.M. de la Fuente (Lannemezan, France) C. de las Cuevas (Tenerife) M. Desco (Madrid) M.C. Díaz (Madrid) M. Díaz-Marsá (Madrid) M. Domínguez (Londres) J.I. Eguiluz (Bilbao) E. Elizagárate (Vitoria) L. Fañanás (Barcelona) M. Farré (Barcelona) E. Fernández (Cambridge, UK) J. Fernández (Madrid) M. Ferrer (Barcelona) G. Flórez (Ourense) D. Fraguas (Albacete) M.D. Franco (Sevilla) C. García (Barcelona) M. García (Palma de Mallorca) J. García (Zaragoza) M.P. García-Portilla (Oviedo) M. Gili Planas (Palma Mallorca) L. Giner (Sevilla) J.M. Goikolea (Barcelona) T. González (Madrid) M. González (Bilbao) A.M. González-Pinto (Vitoria) I. Grande (Barcelona) M. Gurpegui (Granada) L. Gutiérrez (Granada) B. Gutiérrez (Granada) J.M. Haro (Barcelona) A. Ibáñez (Madrid) C. Iglesias (Langreo, Asturias) J.A. Ramos (Barcelona) J. Janssen (Madrid) M.A. Jiménez-Arriero (Madrid) A. Labad (Reus-Barcelona) G. Lahera (Madrid) F. Lana (Barcelona) C. López (Medellín, Colombia) P. López (Madrid) M. López (Vitoria) J. López (Madrid) P. López (Navarra) M. Roca (Palma de Mallorca) I. Madariaga (Mondragón, Guipúzcoa) A. Mané (Barcelona) J. Martí (Barcelona) M. Martín (Pamplona) A. Martínez (Barcelona) M. Martínez (Vitoria) C. Martínez (Madrid) I. Mata (Santander) F. Mayoral (Málaga) J. Meana (Bilbao) I. Menéndez (Oviedo) J. Merchán (Madrid) J.A. Micó (Cádiz) M. Miret (Madrid) R. Molina (Mallorca) V. Molina (Salamanca) A.L. Montejo (Salamanca) J.M. Montes (Madrid) M.J. Moreno (Córdoba) D. Moreno (Madrid) C.Moreno (Madrid) B. Morera (San Sebastián) M. Mur (Lleida) V. Navarro (Barcelona) R. Navinés (Barcelona) E. Ochoa (Madrid) N. Ojeda (Bilbao) J.M. Olivares (Vigo) F. Ortuño (Pamplona) D.J. Palao (Barcelona) M. Páramo (Santiago Compostela) M. Parellada (Madrid) J.C. Pascual (Barcelona) A. Pazos (Santander) A. Pérez (Salamanca) V. Pérez (Barcelona) R. Pérez (Santander) J. Pifarré (Lleida) L. Pina (Madrid) E. Pomarol (Barcelona) I. Querejeta (San Sebastián) C. Roncero (Barcelona) V. Rubio (Zaragoza) G. Rubio (Madrid) G. Safont (Tarrasa, Barcelona) P.A. Sáiz (Oviedo) M.D. Sáiz (Madrid) L. Salvador (Barcelona) L. San (Barcelona) P. Sánchez (Vitoria) J. Sanjuán (Valencia) F. Sarramea (Córdoba) R. Segarra (Bilbao) M. Serrano (A Coruña) P. Sierra (Valencia) C. Soutullo (Pamplona) R. Tabares (Valencia) M. Torrens (Barcelona) M. Urretavizcaya (Barcelona) M. Valdés (Barcelona) M. Valentí (Barcelona) F. Vaz (Badajoz) E. Vilella (Reus, Tarragona) I. Zorrilla (Vitoria) Rápida eficacia hacia una remisión completa en trastorno bipolar I “The SYCREST® trademark is used under license from N.V. Organon, a subsidiary of Merck & Co., Inc., Whitehouse Station, NJ, USA” F_2218_PREMSA_21x28_ok+5.indd 1 VER FICHA TÉCNICA EN PÁGINAS 4 Y 5 Sycrest®, el primer antipsicótico tetracíclico 04/02/15 10:14 1. NOMBRE DEL MEDICAMENTO Sycrest® 5 mg comprimidos sublinguales Sycrest® 10 mg comprimidos sublinguales 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sycrest® 5 mg: Cada comprimido sublingual contiene 5 mg de asenapina (como maleato). Sycrest® 10 mg: Cada comprimido sublingual contiene 10 mg de asenapina (como maleato). Para consultar la lista completa de excipientes, ver sección 6.1. 3. FORMA FARMACÉUTICA Sycrest® 5 mg: Comprimido sublingual Comprimidos sublinguales redondos, de blanco a blanquecino, con “5” grabado en una de las caras. Sycrest® 10 mg: Comprimido sublingual Comprimidos sublinguales redondos, de blanco a blanquecino, con “10” grabado en una de las caras. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Sycrest® está indicado para el tratamiento de los episodios maníacos de moderados a graves, asociados con el trastorno bipolar I en adultos. 4.2 Posología y forma de administración Posología La dosis de inicio recomendada de Sycrest® en monoterapia es de 10 mg dos veces al día. Se debe tomar una dosis por la mañana y otra dosis por la noche. La dosis puede reducirse a 5 mg dos veces al día según valoración clínica. Para terapia de combinación, se recomienda una dosis de inicio de 5 mg dos veces al día. Dependiendo de la respuesta clínica y tolerabilidad de cada paciente individual, la dosis puede aumentarse a 10 mg dos veces al día. Poblaciones especiales Pacientes de edad avanzada Sycrest® debe ser usado con cuidado en pacientes de edad avanzada. Se dispone de datos limitados de eficacia en pacientes mayores de 65 años. Los datos farmacocinéticos disponibles se describen en la sección 5.2. Pacientes con insuficiencia renal No se requiere ajuste de dosis en pacientes con insuficiencia renal. No hay experiencia con asenapina en pacientes con insuficiencia renal grave que tienen un aclaramiento de creatinina menor a 15 ml/min. Pacientes con insuficiencia hepática No se requiere ajuste de dosis para pacientes con insuficiencia hepática leve. No puede excluirse la posibilidad de un aumento de los niveles de asenapina en plasma en algunos pacientes con insuficiencia hepática moderada (Clasificación B de Child-Pugh) y se aconseja precaución. En sujetos con insuficiencia hepática grave (Clasificación C de Child-Pugh), la exposición a asenapina aumentó 7 veces. Por lo tanto, Sycrest® no se recomienda en pacientes con insuficiencia hepática grave. Población pediátrica Se realizó un estudio de farmacocinética y un estudio a corto plazo de la eficacia y seguridad en una población pediátrica (edades comprendidas entre 10 y 17 años) con episodios maníacos o mixtos asociados a trastorno bipolar tipo I. No se ha establecido la seguridad a largo plazo de Sycrest® en pacientes menores de 18 años. Existen datos limitados de seguridad con Sycrest® en pacientes pediátricos. Los datos disponibles actualmente están descritos en las secciones 4.8, 5.1 y 5.2, pero no se puede hacer una recomendación posológica. Forma de administración El comprimido no debe extraerse del blister hasta el momento de la toma. Siempre manipular el comprimido con las manos secas. No se debe presionar el comprimido contra el blister, ni tampoco cortar o romper el blister. Despegar la lengüeta coloreada y extraer el comprimido con cuidado. El comprimido no debe aplastarse. Para asegurar una óptima absorción, el comprimido sublingual de Sycrest® debe situarse bajo la lengua y dejar que se disuelva completamente. El comprimido se disolverá en la saliva en unos segundos. Los comprimidos sublinguales de Sycrest® no deben masticarse ni tragarse. Se debe evitar comer y beber 10 minutos después de la administración. Cuando se administre en combinación con otros medicamentos, Sycrest® debe tomarse el último. No se aconseja el tratamiento con Sycrest® en pacientes incapaces de cumplir con esta forma de administración, por la baja biodisponibilidad de asenapina ingerida (<2 % con una formulación oral en comprimidos). 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. 4.4 Advertencias y precauciones especiales de empleo Pacientes de edad avanzada con psicosis asociada a demencia Los pacientes de edad avanzada con psicosis asociada a demencia, tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte. Sycrest® no está aprobado para el tratamiento de pacientes con psicosis asociada a demencia y no se recomienda su uso en este particular grupo de pacientes. Síndrome neuroléptico maligno Con el uso de antipsicóticos, incluyendo asenapina, se ha notificado síndrome neuroléptico maligno (SNM), caracterizado por hipertermia, rigidez muscular, inestabilidad del sistema nervioso autónomo, conciencia alterada y elevados niveles de creatina fosfoquinasa en suero. Otros signos pueden ser mioglobinuria (rabdomiolisis) y fallo renal agudo. Si un paciente desarrolla signos y síntomas indicativos de SNM se debe suspender el tratamiento con Sycrest®. Convulsiones En ensayos clínicos, se notificaron esporádicamente casos de convulsiones durante el tratamiento con asenapina. Por lo tanto, Sycrest® debe ser utilizado con precaución en pacientes que tengan antecedentes de trastornos convulsivos o que tengan enfermedades asociadas a convulsiones. Suicidio La posibilidad de intento de suicidio es inherente a las enfermedades psicóticas y al trastorno bipolar, por lo que el tratamiento de los pacientes de alto riesgo debe acompañarse de una estrecha supervisión. Hipotensión ortostática Asenapina puede inducir hipotensión ortostática y síncope, especialmente al inicio del tratamiento, que refleja probablemente sus propiedades antagonistas α1 adrenérgicas. Los pacientes de edad avanzada tienen especialmente un alto riesgo de sufrir hipotensión ortostática (ver sección 4.8). En ensayos clínicos, durante el tratamiento con Sycrest® fueron notificados esporádicamente casos de síncope. Sycrest® debe ser utilizado con precaución en pacientes de edad avanzada y en pacientes con enfermedad cardiovascular conocida (por ej., fallo cardíaco, infarto de miocardio o isquemia, defectos en la conducción), enfermedad cerebrovascular o enfermedades que predispongan al paciente a la hipotensión (por ej., deshidratación e hipovolemia). Discinesia tardía La inducción a discinesia tardía se ha asociado con medicamentos con propiedades antagonistas de los receptores de dopamina. La discinesia tardía se caracteriza por movimientos rítmicos involuntarios, predominantemente de la lengua y/o la cara. En ensayos clínicos, se notificaron esporádicamente casos de discinesia tardía durante el tratamiento con asenapina. La aparición de síntomas extrapiramidales es un factor de riesgo para la discinesia tardía. Si aparecen los signos y síntomas de la discinesia tardía en un paciente en tratamiento con Sycrest®, debe considerarse la interrupción del tratamiento. Hiperprolactinemia Se observaron aumentos de los niveles de prolactina en algunos pacientes tratados con Sycrest®. En ensayos clínicos, fueron notificadas pocas reacciones adversas relacionadas con niveles anormales de prolactina. Intervalo QT La prolongación clínicamente relevante del intervalo QT no parece estar asociada con asenapina. Se debe actuar con precaución cuando Sycrest® se prescribe a pacientes con enfermedad cardiovascular conocida o historia familiar de prolongación del intervalo QT, y en uso concomitante con otros medicamentos que pueden prolongar el intervalo QT. Hiperglucemia y diabetes mellitus Se ha notificado ocasionalmente hiperglucemia o exacerbación de una diabetes preexistente durante el tratamiento con asenapina. La valoración de la relación entre el uso de antipsicóticos atípicos y niveles anormales de glucosa se complica por la posibilidad de un incremento de base del riesgo de diabetes mellitus en pacientes con esquizofrenia o trastorno bipolar y un aumento de la incidencia de diabetes mellitus en la población general. Se aconseja el seguimiento clínico apropiado en pacientes diabéticos y en pacientes con factores de riesgo para el desarrollo de diabetes mellitus. Disfagia Se han asociado dismotilidad esofágica y aspiración con el tratamiento antipsicótico. Se notificaron esporádicamente casos de disfagia en pacientes tratados con Sycrest®. Regulación de la temperatura corporal Se ha atribuido a los medicamentos antipsicóticos un trastorno de la capacidad del cuerpo para reducir la temperatura corporal. A partir de los ensayos clínicos, se concluye que asenapina no parece asociarse a una alteración clínicamente relevante de la regulación de la temperatura corporal. Cuando se prescriba Sycrest®, se aconseja la asistencia adecuada en aquellos pacientes que se encuentren en situaciones que pueden contribuir a un aumento de la temperatura corporal, es decir, hacer ejercicio enérgicamente, exposición a calor extremo, que reciban a la vez medicamentos con actividad anticolinérgica o que sean susceptibles de sufrir deshidratación. Pacientes con insuficiencia hepática grave La exposición a asenapina aumenta 7 veces en pacientes con insuficiencia hepática grave (Clasificación C de Child-Pugh). Por lo tanto, Sycrest® no está recomendado en tales pacientes. Enfermedad de Parkinson y demencia con cuerpos de Lewy Los psiquiatras deben valorar los riesgos frente a los beneficios cuando prescriben Sycrest® a pacientes con enfermedad de Parkinson o demencia con cuerpos de Lewy (DCL), ya que en ambos grupos se puede incrementar el riesgo de síndrome neuroléptico maligno, así como presentar una mayor sensibilidad a los antipsicóticos. Este aumento de sensibilidad puede manifestarse como confusión, embotamiento, inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales. 4.5 Interacción con otros medicamentos y otras formas de interacción Dados los efectos principales de asenapina en el sistema nervioso central (SNC) (ver sección 4.8), se debe utilizar con precaución cuando se toma en combinación con otros medicamentos que actúan a nivel central. Se debe avisar a los pacientes que eviten el alcohol mientras estén tomando Sycrest®. Potencial de que otros medicamentos afecten a Sycrest® Asenapina se elimina fundamentalmente mediante glucuronidación directa por UGT1A4 y metabolismo oxidativo a través las isoenzimas del citocromo P450 (predominantemente CYP1A2). Se estudiaron los efectos potenciales de los inhibidores y un inductor de varias de estas rutas enzimáticas sobre la farmacocinética de asenapina, concretamente fluvoxamina (inhibidor del CYP1A2), paroxetina (inhibidor del CYP2D6), imipramina (inhibidor del CYP1A2/2C19/3A4), cimetidina (inhibidor del CYP3A4/2D6/1A2), carbamacepina (inductor del CYP3A4/1A2) y valproato (inhibidor de las UGT). Excepto para fluvoxamina, ninguno de los medicamentos que interaccionan causó alteraciones clínicamente relevantes en la farmacocinética de asenapina. Durante la administración combinada con una dosis única de asenapina 5 mg y fluvoxamina 25 mg dos veces al día se produjo un aumento del 29% en el área bajo la curva de asenapina. Es de esperar que la dosis terapéutica completa de fluvoxamina produzca un aumento mayor en las concentraciones de asenapina en plasma. Por lo tanto, la administración concomitante de asenapina y fluvoxamina debe abordarse con precaución. Potencial de que Sycrest® afecte a otros medicamentos Sycrest® puede aumentar los efectos de ciertos agentes antihipertensivos a causa de su antagonismo α1 adrenérgico, con posibilidad de inducir hipotensión ortostática (ver sección 4.4). Asenapina puede antagonizar el efecto de levodopa y de agonistas dopaminérgicos. Si esta combinación se considera necesaria, debe prescribirse la menor dosis eficaz de cada tratamiento. Estudios in vitro indican que asenapina inhibe débilmente el CYP2D6. Se obtuvieron los siguientes resultados de estudios clínicos de interacciones de medicamentos, que investigaron los efectos de la inhibición del CYP2D6 por asenapina: - Tras la administración concomitante de dextrometorfano y asenapina en individuos sanos, se midió la proporción de dextrorfano/dextrometorfano (DX/DM) como indicador la actividad del CYP2D6. El tratamiento con asenapina 5 mg dos veces al día resultó en una disminución mínima de la proporción DX/DM a 0,43, lo que es indicativo de la inhibición del CYP2D6. En el mismo estudio, el tratamiento con paroxetina 20 mg al día disminuyó la proporción DX/DM a 0,032. - En otro estudio, la administración conjunta de una dosis única de 75 mg de imipramina con una dosis única de 5 mg de asenapina no afectó las concentraciones plasmáticas del metabolito desipramina (un sustrato del CYP2D6). - La administración conjunta de una dosis única de 20 mg de paroxetina (sustrato e inhibidor del CYP2D6) durante el tratamiento con 5 mg de asenapina dos veces al día en 15 individuos varones sanos causó un aumento en la exposición a paroxetina de casi 2 veces. In vivo, asenapina parece ser como máximo un inhibidor débil del CYP2D6. Sin embargo, la asenapina puede aumentar los efectos inhibitorios de la paroxetina sobre su propio metabolismo. Por lo tanto, Sycrest® en asociación debe administrarse con precaución con medicamentos que sean sustratos e inhibidores del CYP2D6. 4.6 Fertilidad, embarazo y lactancia Embarazo No hay suficientes datos sobre el uso de Sycrest® en mujeres embarazadas. Asenapina no fue teratogénico en estudios en animales. Se encontraron efectos tóxicos embrionarios y maternales en estudios con animales (ver sección 5.3). Los recién nacidos expuestos a antipsicóticos (como Sycrest®) durante el tercer trimestre de embarazo están en peligro de sufrir reacciones adversas como síntomas extrapiramidales y/o síndromes de abstinencia que pueden variar en gravedad y duración tras la exposición. Se han notificado casos de síntomas de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o alteraciones alimenticias en recién nacidos. Por consiguiente, se debe vigilar estrechamente a los recién nacidos. Sycrest® no debe usarse durante el embarazo a menos que la situación clínica de la mujer requiera tratamiento con asenapina y solo si el beneficio potencial es mayor que el posible riesgo para el feto. Lactancia Asenapina se excretó en la leche de las ratas durante la lactancia. Se desconoce si asenapina o sus metabolitos se excretan en la leche materna. La lactancia debe ser interrumpida durante el tratamiento con Sycrest®. Fertilidad No se han observado alteraciones de la fertilidad en ensayos preclínicos (ver sección 5.3) 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas Asenapina puede causar somnolencia y sedación. Por la tanto, los pacientes deben ser prevenidos sobre la conducción y el uso de máquinas hasta que estén razonablemente seguros de que Sycrest® no les afecta de forma negativa. 4.8 Reacciones adversas Resumen del perfil de seguridad Las reacciones adversas notificadas más frecuentemente durante el tratamiento con asenapina fueron somnolencia y ansiedad. Lista tabulada de reacciones adversas La incidencia de reacciones adversas al fármaco asociadas al tratamiento con asenapina se tabula seguidamente. La tabla se basa en reacciones adversas notificadas durante ensayos clínicos y/o uso post-comercialización. Todas las reacciones adversas se enumeran por órganos y sistemas y por frecuencia; muy frecuentes (≥ 1/10), frecuentes (≥ 1/100 a < 1/10), poco frecuentes (≥ 1/1.000 a < 1/100), raras (≥ 1/10.000 a < 1/1.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). En cada grupo de frecuencia, las reacciones adversas se presentan en orden decreciente de gravedad. No se puede determinar la frecuencia de las reacciones adversas notificadas durante el uso postcomercialización ya que provienen de notificaciones espontáneas. Por consiguiente, la frecuencia de estas reacciones adversas se clasifica como “no conocida”. Clasificación por órganos y sistemas Trastornos de la sangre y del sistema linfático Trastornos del sistema inmunológico Muy frecuentes Trastornos del sistema nervioso Poco frecuentes Peso aumentado Apetito aumentado Hiperglucemia Distonía Acatisia Discinesia Parkinsonismo Sedación Mareo Disgeusia Síncope Crisis Trastorno extrapiramidal Disartria Raras Neutropenia Ansiedad Somnolencia Trastornos oculares Síndrome neuroléptico maligno Síndrome de la pierna inquieta Trastorno de la acomodación Bradicardia sinusal Bloqueo de rama Intervalo QT del electrocardiograma prolongado Taquicardia sinusal Hipotensión ortostática Hipotensión Trastornos cardíacos Trastornos vasculares Trastornos respiratorios, torácicos y mediastínicos Embolia pulmonar Trastornos gastrointestinales Hipoestesia oral Trastornos hepatobiliares Alanina aminotransferasa elevada Trastornos músculo esqueléticos y del tejido conjuntivo Rigidez muscular Lengua hinchada Disfagia Glosodinia Parestesia oral Náuseas Lesiones de la mucosa oral (ulceraciones, vesiculación e inflamación) Hipersecreción salival Rabdomiolisis Embarazo, puerperio y enfermedades perinatales Disfunción sexual Amenorrea Trastornos del aparato reproductor y de la mama Trastornos generales y alteraciones en el lugar de administración Frecuencia no conocida Reacciones alérgicas Trastornos del metabolismo y de la nutrición Trastornos psiquiátricos Frecuentes Fatiga Ginecomastia Galactorrea Síndrome de abstinencia neonatal (ver 4.6) Descripción de reacciones adversas seleccionadas Síntomas extrapiramidales (SEP) En ensayos clínicos, la incidencia de síntomas extrapiramidales en pacientes tratados con asenapina fue mayor que con placebo (15,4 % frente a 11,0 %). A partir de los ensayos de esquizofrenia a corto plazo (6 semanas) parece haber una relación dosis-respuesta para la acatisia en pacientes tratados con asenapina, y para el parkinsonismo hubo una tendencia al aumento con dosis altas. Basado en un estudio farmacocinético reducido, los pacientes pediátricos parecían ser más sensibles a la distonía con la administración inicial de asenapina cuando no se siguió una pauta de aumento gradual de la dosis (ver sección 5.2). La incidencia de distonía en ensayos clínicos pediátricos, utilizando un aumento gradual de la dosis, fue similar a la observada en ensayos con adultos. Aumento de peso En los ensayos combinados a corto y largo plazo de esquizofrenia y trastorno bipolar en adultos, el cambio promedio en el peso corporal fue de 0,8 kg. En los ensayos a corto plazo de esquizofrenia, la proporción de sujetos con aumento de peso clínicamente significativo fue del 5,3 % para asenapina comparado con el 2,3 % para placebo (aumento de peso ≥ 7 % desde el inicio al final del estudio). En los ensayos a corto plazo de manía bipolar, la proporción de sujetos con aumento de peso clínicamente significativo fue del 6,5 % para asenapina comparado con el 0,6 % para placebo (aumento de peso ≥ 7 % desde el inicio al final del estudio). En un ensayo de seguridad y eficacia de 3 semanas, a dosis fijas, aleatorizado y controlado con placebo en pacientes pediátricos de 10 a 17 años con trastorno bipolar I, el cambio promedio en el peso desde el inicio al final del estudio para placebo y asenapina 2,5 mg, 5 mg, y 10 mg, dos veces al día, fue de 0,48, 1,72, 1,62 y 1,44 kg, respectivamente. La proporción de sujetos con un aumento de peso clínicamente significativo (aumento de peso ≥ 7 % desde el inicio al final del estudio) fue del 14,1 % para asenapina 2,5 mg dos veces al día, del 8,9 % para asenapina 5 mg dos veces al día, y del 9,2 % para asenapina 10 mg dos veces al día, en comparación al 1,1 % para el placebo. Hipotensión ortostática La incidencia de hipotensión ortostática en pacientes de edad avanzada fue del 4,1 % comparado con un 0,3 % en la población combinada de los ensayos fase 2-3. Encimas hepáticas Se han visto frecuentemente aumentos transitorios y asintomáticos de transaminasas hepáticas, alanino transferasa (ALT) y aspartato transferasa (AST), especialmente al comienzo del tratamiento. Otros efectos Se han notificado eventos cerebrovasculares en pacientes tratados con asenapina, pero no hay evidencia de incidencia por encima de lo esperado en adultos entre 18 y 65 años. Asenapina tiene propiedades anestésicas. Tras la administración pueden producirse hipoestesia oral y parestesia oral y normalmente se resuelven en 1 hora. Tras la comercialización se han notificado reacciones graves de hipersensibilidad en pacientes tratados con asenapina, incluyendo reacciones anafilácticas/anafilactoides, angioedema, lengua hinchada e hinchazón de garganta (edema faríngeo). Población pediátrica La asenapina no está indicada para el tratamiento de niños y adolescentes menores de 18 años (ver sección 4.2). Las experiencias adversas clínicamente relevantes identificadas en los ensayos de esquizofrenia y bipolares en pacientes pediátricos fueron similares a las observadas en los ensayos de esquizofrenia y bipolares en adultos. Las reacciones adversas más frecuentes (≥ 5 % y al menos el doble de la tasa con placebo) notificadas en pacientes pediátricos con trastorno bipolar I fueron somnolencia, sedación, mareos, disgeusia, hipoestesia oral, parestesia oral, náuseas, aumento del apetito, fatiga y aumento de peso. Las reacciones adversas más frecuentes (una proporción de pacientes ≥ 5 % y al menos el doble que con el placebo) notificadas en pacientes pediátricos con esquizofrenia fueron somnolencia, sedación, acatisia, mareo e hipoestesia oral. Hubo una mayor incidencia estadísticamente significativa de pacientes con aumento de peso ≥ 7 % (desde el inicio hasta el final del estudio) en comparación con placebo (3,1 %) en el caso de Sycrest® 2,5 mg dos veces al día (9,5 %) y Sycrest® 5 mg dos veces al día (13,1 %). Notificación de sospechas de reacciones adversas Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es. 4.9 Sobredosis En el programa de asenapina fueron notificados pocos casos de sobredosis. Las dosis estimadas notificadas fueron entre 15 y 400 mg. En la mayoría de los casos no se aclaró si asenapina se tomó sublingual. Las reacciones adversas relacionadas con el tratamiento fueron agitación y confusión, acatisia, distonía orofacial, sedación y datos asintomáticos de ECG (bradicardia, complejos supraventriculares, retraso de la conducción intraventricular). No hay información específica disponible acerca del tratamiento de la sobredosis con Sycrest®, ni un antídoto específico. Debe considerarse la posibilidad de implicación de múltiples medicamentos. Es necesaria la monitorización cardiovascular para detectar posibles arritmias, y el control de la sobredosis debe concentrarse en el tratamiento de apoyo que mantiene una adecuada oxigenación y ventilación así como el control de los síntomas. La hipotensión y el colapso circulatorio deben tratarse con las medidas apropiadas, como fluidos intravenosos y/o agentes simpaticomiméticos (no deben utilizarse epinefrina y dopamina, ya que una estimulación beta puede empeorar la hipotensión en el contexto del bloqueo alfa inducido por Sycrest®). En caso de síntomas extrapiramidales graves, se deben administrar medicamentos anticolinérgicos, y continuar con una estrecha supervisión y seguimiento hasta que el paciente se recupere. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: psicolépticos, antipsicóticos, código ATC: N05AH05 Mecanismo de acción El mecanismo de acción de asenapina no se conoce completamente. Sin embargo, basándose en su farmacología de receptores se considera que la eficacia de asenapina está mediada por la combinación de la actividad antagonista sobre los receptores D2 y 5-HT2A. Las acciones a nivel de otros receptores como el 5-HT1A, 5-HT1B, 5-HT2C, 5-HT6, 5-HT7, D3 y receptores α2-adrenergicos, también pueden contribuir a los efectos clínicos de asenapina. Efectos farmacodinámicos La asenapina tiene alta afinidad por los receptores de serotonina 5-HT1A, 5-HT1B, 5-HT2A, 5-HT2B, 5-HT2C, 5-HT5, 5-HT6 y 5-HT7, por los receptores de dopamina D2, D3, D4 y D1, por los receptores α1 y α2-adrenérgicos, y por los receptores de histamina H1, y afinidad moderada por los receptores H2. En ensayos in vitro, la asenapina actúa como un antagonista de estos receptores. La asenapina no tiene afinidad apreciable por los receptores colinérgicos muscarínicos. Eficacia clínica Eficacia clínica en el trastorno bipolar tipo I La eficacia de asenapina en el tratamiento de episodios maníacos o mixtos, con o sin características psicóticas, del trastorno bipolar tipo I del manual diagnóstico y estadístico de los trastornos mentales (DSM-IV), se evaluó en dos ensayos de 3 semanas diseñados de forma similar, aleatorizados, doble ciego, controlados con placebo y fármaco activo en monoterapia (olanzapina), en los que participaron 488 y 489 pacientes respectivamente. Todos los pacientes cumplieron los criterios diagnósticos del trastorno bipolar tipo I, episodio maníaco actual (DSM-IV 296.4x) o episodios mixtos (DSM-IV 296.6x) de la 4ª Edición del Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-IV), y presentaron un resultado ≥ 20 en la Escala de Young para la Valoración de la Manía (Y-MRS) en la fase de cribado y al inicio. Los pacientes con oscilaciones rápidas fueron excluidos de estos estudios. Asenapina demostró una eficacia superior al placebo en la reducción de los síntomas de la manía en 3 semanas. Los puntos estimados [IC del 95 %] para el cambio desde el inicio hasta el final del estudio en la Escala de Young para la Valoración de la Manía (Y-MRS) usando el análisis LOCF en los dos estudios fue el siguiente: -11,5 [-13,00; -10,0] para asenapina frente a -7,8 [-10,0; -5,6] para el placebo y -10,8 [-12,3; -9,3] para asenapina frente a -5,5 [-7,5; -3,5] para el placebo. Desde el día 2 se observó una diferencia estadísticamente significativa entre asenapina y placebo. Los pacientes de los dos ensayos principales de 3 semanas se estudiaron durante 9 semanas más, en un ensayo de ampliación. En este ensayo se demostró el mantenimiento del efecto durante el episodio tras 12 semanas de tratamiento aleatorizado. En un ensayo de 12 semanas controlado con placebo, en el que participaron 326 pacientes con manía o episodios mixtos de trastorno bipolar I con o sin características psicóticas, parcialmente no-respondedores al tratamiento durante 2 semanas con litio o valproato en monoterapia, con niveles terapéuticos en suero, la adición de asenapina como terapia adyuvante mostró una mayor eficacia que litio o valproato a la semana 3 (estimación de puntos [IC del 95 %] para el cambio desde el inicio hasta el final del estudio en la Y-MRS usando el análisis de LOCF fue -10,3 [-11,9; -8,8] para asenapina y -7,9 [-9,4; -6,4] para placebo) y a la semana 12 (-12,7 [-14,5; -10,9] para asenapina y -9,3 [-11,8; -7,6] para placebo) en la reducción de los síntomas de manía. Población pediátrica Asenapina no está indicada para el tratamiento de niños y adolescentes menores de 18 años (ver sección 4.2). La seguridad y eficacia de Sycrest® se evaluó en 403 pacientes pediátricos con trastorno bipolar tipo I que participaron en un único ensayo de 3 semanas, controlado con placebo y doble ciego, de los cuales 302 pacientes recibieron Sycrest® a dosis fijas que oscilaban entre 2,5 mg y 10 mg dos veces al día. Los resultados del estudio mostraron una superioridad estadísticamente significativa de las tres dosis de Sycrest® en cuanto a la mejoría de la puntuación total en la Escala de Young para la Valoración de la Manía (Y-MRS), medida por el cambio observado desde el estado basal hasta el día 21, en comparación con placebo. Sin embargo, no se ha establecido la relevancia clínica de los datos de eficacia. No están disponibles datos a largo plazo relativos a la eficacia y la seguridad de asenapina en esta población. La eficacia de Sycrest® no fue demostrada en un ensayo de 8 semanas, controlado con placebo, doble ciego, aleatorizado y a dosis fijas en 306 pacientes adolescentes de 12 a 17 años con esquizofrenia a dosis de 2,5 mg y 5 mg dos veces al día. Los estudios pediátricos con Sycrest® se llevaron a cabo utilizando comprimidos sublinguales con sabor añadido. La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Sycrest® en uno o más grupos de la población pediátrica en trastorno bipolar I (ver sección 4.2 para consultar la información sobre el uso en población pediátrica). 5.2 Propiedades farmacocinéticas Absorción Tras la administración sublingual, asenapina se absorbe rápidamente con concentraciones plasmáticas máximas entre 0,5 y 1,5 horas. La biodisponibilidad absoluta de 5 mg de asenapina sublingual es del 35 %. La biodisponibilidad absoluta de asenapina cuando se traga es más baja (<2 % con formulación en comprimido oral). La toma de agua después de varios minutos (2 ó 5) tras la administración de asenapina, causó una disminución de la exposición a asenapina (19 % y 10 % respectivamente). Por lo tanto, se debe evitar comer y beber 10 minutos después de la administración (ver sección 4.2). Distribución Asenapina se distribuye rápidamente y tiene un gran volumen de distribución (aproximadamente 20-25 l/kg), que es indicativo de una extensa distribución extravascular. Asenapina tiene una alta unión a proteínas plasmáticas (95 %), como la albúmina y la α1-glicoproteína ácida. Biotransformación Asenapina se metaboliza ampliamente en el hígado. Las principales rutas metabólicas de asenapina son la glucuronidación directa (mediada por UGT1A4) y la oxidación y desmetilación mediada por el citocromo P450 (principalmente CYP1A2, con participación del 2D6 y 3A4). En un estudio in vivo en humanos con asenapina marcada-radiactivamente, el metabolito predominante relacionado con el fármaco fue asenapina N+-glucurónido; otros fueron N-desmetilasenapina, N-desmetilasenapina N-carbamoil glucoronido y asenapina inalterada en pequeñas cantidades. La actividad de Sycrest® es debida principalmente al compuesto original. Asenapina es un inhibidor débil del CYP2D6. Asenapina no produce inducción de las actividades metabólicas del CYP1A2 o del CYP3A4 en los cultivos de hepatocitos humanos. La administración concomitante de asenapina con inhibidores, inductores o sustratos conocidos de estas rutas metabólicas, se han estudiado en varios estudios de interacción fármaco-fármaco (ver sección 4.5). Eliminación Asenapina es un compuesto de alto aclaramiento, siendo este de 52 l/h tras la administración intravenosa. En un estudio de balance de masas, la mayoría de la dosis radioactiva se recogió en orina (sobre el 50 %) y heces (sobre el 40 %), con solo una pequeña cantidad de compuesto inalterado excretado en heces (5-16 %). Tras una fase inicial de distribución más rápida, la vida media final de asenapina es aproximadamente 24 h. Linealidad/No linealidad El aumento de dosis de 5 a 10 mg dos veces al día (aumento del doble) causó un aumento de menos del doble (1,7 veces) en el grado de exposición y la concentración máxima. Con la dosis menor, este aumento inferior al proporcional de Cmax y del área bajo la curva puede atribuirse a limitaciones en la capacidad de absorción a través de la mucosa oral tras la administración sublingual. Tomando una dosis de dos veces al día, el estado estacionario se alcanza en 3 días. En general, la farmacocinética de asenapina en el estado estacionario es similar a la farmacocinética de una dosis única. Farmacocinética en poblaciones especiales Insuficiencia hepática La farmacocinética de asenapina fue similar entre sujetos con una insuficiencia hepática leve (clasificación A de Child-Pugh) o moderada (clasificación B de Child-Pugh) y sujetos con función hepática normal. En sujetos con insuficiencia hepática grave (clasificación C de Child-Pugh) se observó que la exposición a asenapina aumentó 7 veces (ver sección 4.2). Insuficiencia renal La farmacocinética de asenapina tras una dosis única de 5 mg de asenapina, fue similar entre sujetos con diversos grados de insuficiencia renal y sujetos con función renal normal. No hay experiencia con asenapina en pacientes con insuficiencia renal grave con aclaramiento de creatinina menor de 15 ml/min. Pacientes de edad avanzada En pacientes de edad avanzada (entre 65 y 85 años), la exposición a asenapina es aproximadamente un 30 % mayor que en adultos más jóvenes. Población pediátrica (niños y adolescentes) En un estudio farmacocinético utilizando comprimidos sublinguales sin sabor añadido, a un nivel de dosis de 5 mg dos veces al día, la farmacocinética de asenapina en pacientes adolescentes (de 12 a 17 años ambos incluidos) es similar a la observada en adultos. En adolescentes, la dosis de 10 mg dos veces al día no causó un aumento de la exposición comparado con 5 mg dos veces al día. En un segundo estudio farmacocinético utilizando comprimidos sublinguales con sabor añadido, a los niveles de dosis de 5 mg y 10 mg dos veces al día, la farmacocinética de asenapina en una población pediátrica (de 10 a 17 años, ambos incluidos) es similar a la observada en adultos. La dosis de 10 mg dos veces al día provocó un aumento de la exposición a asenapina aproximadamente proporcional a la dosis en comparación con 5 mg dos veces al día. Sexo Un análisis farmacocinético de población indicó que no hay evidencias de diferencias relacionadas con el sexo en la farmacocinética de asenapina. Raza En un análisis farmacocinético de población, no se encontraron efectos clínicos relevantes de la raza en la farmacocinética de asenapina. Tabaquismo Un análisis farmacocinético de población indicó que fumar, que induce el CYP1A2, no tiene efecto sobre el aclaramiento de asenapina. En un estudio realizado a tal efecto, no se observó efecto del tabaco durante la administración sublingual de una dosis única de 5 mg en la farmacocinética de asenapina. 5.3 Datos preclínicos sobre seguridad Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad. Estudios de toxicidad a dosis repetidas en ratas y perros, mostraron los efectos farmacológicos relacionados con la dosis, como la sedación. Además, se observaron efectos en las glándulas mamarias mediados por la prolactina y trastornos en el ciclo estral. Altas dosis orales producen hepatotoxicidad en perros, cosa que no se observó tras la administración crónica intravenosa. Asenapina tiene afinidad por los tejidos que contienen melanina. Sin embargo, cuando se analizó in vitro carecía de fototoxicidad. Además, el examen histopatológico de los ojos de los perros tratados crónicamente con asenapina, no reveló signos de toxicidad ocular, demostrando la ausencia de riesgo de fototoxicidad. Asenapina no fue genotóxico en una serie de análisis. En estudios de carcinogenicidad subcutánea en ratas y ratones, no se observó aumento en la incidencia de tumores. Se observaron efectos en estudios preclínicos solo a exposiciones consideradas suficientemente excesivas respecto a la exposición máxima en humanos, que indica una relevancia reducida en el uso clínico. Asenapina no afectó la fertilidad en ratas y no fue teratogénico en ratas ni conejos. Se encontró embriotoxicidad en estudios toxicológicos en la reproducción en ratas y conejos. Asenapina produjo una leve toxicidad materna y un leve retardo en el desarrollo del esqueleto fetal. Tras la administración oral a conejas preñadas durante el periodo de organogénesis, asenapina afectó negativamente el peso corporal a la dosis alta de 15 mg.kg -1 dos veces al día. A esta dosis, el peso fetal disminuyó. Cuando asenapina se administró vía intravenosa a conejas preñadas, no se observaron signos de embriotoxicidad. En ratas se observó toxicidad embriofetal (aumento de las pérdidas post-implantación, disminución del peso fetal y retraso en la osificación) tras la administración oral o intravenosa durante la organogénesis o durante toda la gestación. Se observó aumento de la mortalidad neonatal entre las crías de ratas hembra tratadas durante la gestación y la lactancia. A partir de un estudio de adopción, se concluyó que asenapina indujo las pérdidas peri y post natales causadas por discapacidad de las crías más que por un comportamiento alterado de las madres. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Gelatina, Manitol (E421). 6.2 Incompatibilidades No procede. 6.3 Periodo de validez 3 años. 6.4 Precauciones especiales de conservación Conservar en el embalaje original para protegerlo de la luz y la humedad. Este medicamento no requiere ninguna temperatura especial de conservación. 6.5 Naturaleza y contenido del envase Blíster de aluminio/aluminio despegable en envases de 20, 60 ó 100 comprimidos sublinguales por envase. Puede que solamente estén comercializados algunos tamaños de envases. 6.6 Precauciones especiales de eliminación La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN N.V. Organon, Kloosterstraat 6, NL-5349 AB Oss, Holanda. 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN Sycrest® 5 mg: EU/1/10/640/002, Sycrest® 10 mg: EU/1/10/640/005. 9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Sycrest® 5 mg: Fecha de la primera autorización 1 de Septiembre de 2010, Sycrest® 5 mg: Fecha de la última renovación 5 de Mayo de 2015, Sycrest® 10 mg: Fecha de la primera autorización 1 de Septiembre de 2010, Sycrest® 10 mg: Fecha de la última renovación 5 de Mayo de 2015. 10. PRESENTACIÓN Y PRECIO PVP (IVA) Sycrest® 5 mg 60 comprimidos sublinguales: P.V.P. 150,31 €, P.V.P. I.V.A. 156,32 €, Sycrest® 10 mg 60 comprimidos sublinguales: P.V.P. 150,31 €, P.V.P. I.V.A. 156,32 €. 11. CONDICIONES DE DISPENSACIÓN POR LA SEGURIDAD SOCIAL Con receta médica. Financiado por la Seguridad Social con aportación reducida. 12. FECHA DE LA REVISIÓN DEL TEXTO 05/2015 La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu. Aripiprazol Kern Pharma EFG La nueva salida de Kern Pharma para la esquizofrenia y el trastorno bipolar Olanzapina Quetiapina Ziprasidona Risperidona Kern Pharma EFG Kern Pharma EFG salud m Aripiprazol Kern Pharma EFG SIN Gluten Sacarosa Lactosa SIN Gluten Sacarosa Kern Pharma con la esquizofrenia y el trastorno bipolar: • Olanzapina Kern Pharma EFG • Ziprasidona Kern Pharma EFG • Quetiapina Kern Pharma EFG • Quetiapina comprimidos de liberación prolongada Kern Pharma EFG • Risperidona Kern Pharma EFG Empresa nacional AAFF_pmsa210x280_Aripiprazol_KERN_020215.indd 1 Fabricación propia VER FICHA TÉCNICA EN PÁGINAS 8, 9 y 10 l en con a Kern Pharma EFG pro mi tal m so co Kern Pharma EFG Vademecum adaptado a precio menor 02/02/15 15:43 1. NOMBRE DEL MEDICAMENTO Aripiprazol Kern Pharma 5 mg comprimidos EFG Aripiprazol Kern Pharma 10 mg comprimidos EFG Aripiprazol Kern Pharma 15 mg comprimidos EFG Aripiprazol Kern Pharma 30 mg comprimidos EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Aripiprazol Kern Pharma 5 mg comprimidos: Cada comprimido contiene 5 mg de aripiprazol. Excipiente con efecto conocido: Cada comprimido contiene 66,20 mg de lactosa monohidrato. Aripiprazol Kern Pharma 10 mg comprimidos: Cada comprimido contiene 10 mg de aripiprazol. Excipiente con efecto conocido: Cada comprimido contiene 132,40 mg de lactosa monohidrato. Aripiprazol Kern Pharma 15 mg comprimidos: Cada comprimido contiene 15 mg de aripiprazol. Excipiente con efecto conocido: Cada comprimido contiene 198,60 mg de lactosa monohidrato. Aripiprazol Kern Pharma 30 mg comprimidos: Cada comprimido contiene 30 mg de aripiprazol.Excipiente con efecto conocido: Cada comprimido contiene 397,20 mg de lactosa monohidrato. Para consultar la lista completa de excipientes ver sección 5.1. 3. FORMA FARMACÉUTICA Comprimido. Aripiprazol Kern Pharma 5 mg comprimidos: Comprimidos redondos de color azul, biconvexos y grabados con un “5” en una cara. Aripiprazol Kern Pharma 10 mg comprimidos: Comprimidos redondos de color rosa, biconvexos y grabados con un “10” en una cara. Aripiprazol Kern Pharma 15 mg comprimidos: Comprimidos redondos de color amarillo, biconvexos y grabados con un “15” en una cara. Aripiprazol Kern Pharma 30 mg comprimidos: Comprimidos redondos de color rosa, biconvexos y con ranura en una de las caras. El comprimido se puede dividir en dosis iguales. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Aripiprazol está indicado en el tratamiento de la esquizofrenia en adultos y adolescentes de 15 años o más. ● Aripiprazol está indicado para el tratamiento de los episodios maníacos moderados o severos en pacientes con trastorno bipolar I y en la prevención de nuevos episodios maníacos en adultos que presentaron episodios predominantemente maníacos y que respondieron al tratamiento con aripiprazol. ● Aripiprazol está indicado para el tratamiento hasta 12 semanas de los episodios maníacos moderados o severos del Trastorno Bipolar I en adolescentes de 13 años o más. 4.2 Posología y forma de administración Posología Adultos Esquizofrenia: la dosis recomendada de inicio de aripiprazol es de 10 ó 15 mg/día con una dosis de mantenimiento de 15 mg/día administrada como una única dosis diaria independientemente de las comidas. Aripiprazol es eficaz en un rango de dosis de 10 a 30 mg/día. No se ha demostrado un aumento de la eficacia con dosis mayores a la dosis diaria de 15 mg, aunque algunos pacientes pueden beneficiarse de dosis mayores. La dosis máxima diaria no deberá exceder 30 mg/día. Episodios maníacos en Trastorno Bipolar I: la dosis de inicio recomendada de aripiprazol es de 15 mg administrada como una única dosis diaria independientemente de las comidas en monoterapia o terapia combinada. Algunos pacientes podrían beneficiarse de dosis mayores. La dosis máxima diaria no deberá exceder 30 mg. Prevención de recaídas de episodios maníacos en trastorno bipolar I: para prevenir las recaídas de episodios maníacos en pacientes que han estado tomando aripiprazol en monoterapia o terapia combinada, continuar con la misma dosis. Se deben considerar ajustes de la posología diaria, incluyendo reducción de la dosis, según el estado clínico. Población pediátrica Esquizofrenia en adolescentes de 15 años y más: la dosis recomendada para aripiprazol es 10 mg/día administrada como una única dosis diaria independientemente de las comidas. El tratamiento debería ser iniciado con 2 mg (usando aripiprazol solución oral 1 mg/ml) durante 2 días, incrementado a 5 mg durante 2 días adicionales para alcanzar la dosis recomendada diaria de 10 mg. En caso necesario, aumentos de dosis posteriores deberían ser administrados en incrementos de 5 de mg sin exceder la dosis máxima diaria de 30 mg. Aripiprazol es eficaz en un rango de dosis de 10 a 30 mg/día. No se ha demostrado un aumento de la eficacia con dosis mayores a la dosis diaria de 10 mg, aunque algunos pacientes pueden beneficiarse de dosis mayores. Aripiprazol no está recomendado en pacientes con esquizofrenia menores de 15 años, debido a datos insuficientes sobre seguridad y eficacia (ver la sección 4.8). Episodios maníacos en Trastorno Bipolar I en adolescentes de 13 años o más: la dosis recomendada para aripiprazol es 10 mg/día administrada una vez al día independientemente de las comidas. Se debe iniciar el tratamiento con 2 mg (usando aripiprazol 1 mg/ml solución oral) durante 2 días, valorando utilizar 5 mg durante 2 días adicionales para alcanzar la dosis diaria recomendada de 10 mg. La duración del tratamiento debe ser la mínima necesaria para el control de los síntomas y no debe exceder de 12 semanas. No se ha demostrado un aumento de la eficacia con dosis superiores a la dosis diaria de 10 mg, y una dosis diaria de 30 mg se asocia con una incidencia sustancialmente mayor de efectos adversos significativos incluyendo eventos relacionados con SEP, somnolencia, fatiga y aumento de peso (ver sección 4.8). Por lo tanto, dosis superiores de 10 mg/día se deben usar en casos excepcionales y con una estrecha monitorización clínica (ver secciones 4.4 y 4.8). Los pacientes más jóvenes tienen un mayor riesgo de sufrir efectos adversos asociados con aripiprazol. Por ello, no se recomienda el uso de aripiprazol en pacientes menores de 13 años (ver sección 4.8). Irritabilidad asociada con el trastorno autista: no se ha establecido todavía la seguridad y eficacia de aripiprazol en niños y adolescentes menores de 18 años. No se puede hacer una recomendación de la posología. Tics asociados con el trastorno de Tourette: no se ha establecido todavía la seguridad y eficacia de aripiprazol en niños y adolescentes entre 6 y 18 años. No se puede hacer una recomendación posológica. Pacientes con insuficiencia hepática No es necesario un ajuste de dosis en pacientes que presentan insuficiencia hepática leve a moderada. En pacientes que presentan insuficiencia hepática grave, los datos disponibles son insuficientes para establecer recomendaciones. En estos pacientes debe ajustarse la dosis cuidadosamente. Sin embargo, se debe utilizar la dosis máxima de 30 mg/día con precaución en pacientes que presentan insuficiencia hepática grave. Pacientes con insuficiencia renal No es necesario un ajuste de dosis en pacientes que presentan insuficiencia renal. Pacientes de edad avanzada La eficacia de aripiprazol en el tratamiento de esquizofrenia y trastorno bipolar I en pacientes de 65 años y más no ha sido establecida. Debido a una mayor sensibilidad en esta población se debe considerar una dosis inicial menor si lo justifican los factores clínicos (ver sección 4.4). Sexo No es necesario ajustar la dosis en función del sexo. Fumadores No es necesario un ajuste de dosis en pacientes fumadores debido al metabolismo de aripiprazol (ver sección 4.5). Ajuste de la dosis debido a interacciones Cuando se administra conjuntamente aripiprazol con potentes inhibidores de CYP3A4 o CYP2D6, debe reducirse la dosis de aripiprazol. Cuando se deje el tratamiento conjunto con inhibidores de CYP3A4 ó CYP2D6, la dosis de aripiprazol debe ser aumentada (ver sección 4.5). Cuando se administra conjuntamente aripiprazol con potentes inductores de CYP3A4, la dosis de aripiprazol debe aumentarse. Cuando se deje el tratamiento combinado con inductores de CYP3A4 la dosis de aripiprazol debe entonces reducirse a la dosis recomendada (ver sección 4.5). Forma de administración: Los comprimidos de aripiprazol se administran por vía oral. 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 5.1. 4.4 Advertencias y precauciones especiales de empleo La mejoría clínica del paciente durante el tratamiento antipsicótico, puede tardar entre varios días a algunas semanas. Los pacientes deber estar estrechamente controlados durante este periodo. Tendencias suicidas: La aparición de comportamiento suicida es inherente a las patologías psicóticas y trastornos del estado de ánimo y en algunos casos ha sido notificado temprano tras la administración inicial o cambio de terapias antipsicóticas, incluyendo el tratamiento con aripiprazol (ver sección 4.8). Debe realizarse una supervisión estrecha de los pacientes de alto riesgo cuando son tratados con antipsicóticos. Los resultados de un estudio epidemiológico han sugerido que no se incrementó el riesgo de suicidio con aripiprazol comparado con otros antipsicóticos entre pacientes adultos con esquizofrenia o trastorno bipolar. Los datos en pediatría son insuficientes para evaluar este riesgo en pacientes más jóvenes (por debajo de 18 años de edad), pero existen pruebas de que el riesgo de suicidio persiste más allá de las 4 primeras semanas de tratamiento con antipsicóticos atípicos, incluyendo aripiprazol. Alteraciones cardiovasculares: Aripiprazol debe ser utilizado con precaución en pacientes que presentan enfermedad cardiovascular conocida (historia de infarto de miocardio o enfermedad isquémica cardiaca, fallo cardíaco, o anormalidades de la conducción), enfermedad cerebrovascular, condiciones en las que puede predisponerse a pacientes a la hipotensión (deshidratación, hipovolemia, y tratamiento con medicamentos antihipertensivos) o hipertensión, incluyendo acelerada o maligna. Se han notificado casos de tromboembolismo venoso (TEV) con medicamentos antipsicóticos. Dado que los pacientes tratados con antipsicóticos presentan a menudo factores de riesgo adquiridos para el TEV, se deben identificar todos los posibles factores de riesgo de TEV antes y durante el tratamiento con aripiprazol, así como tomarse las correspondientes medidas preventivas. Anormalidades de la conducción: En ensayos clínicos de aripiprazol, la incidencia de la prolongación del intervalo QT fue comparable al placebo. Como con otros antipsicóticos, aripiprazol debe ser utilizado con precaución en pacientes con historia familiar de prolongación del intervalo QT. Discinesia tardía: En ensayos clínicos de hasta un año de duración, se han notificado casos poco frecuentes de discinesia durante el tratamiento con aripiprazol. Si aparecen signos y síntomas de discinesia tardía en un paciente tratado con aripiprazol, se debe considerar una reducción de dosis o la interrupción del tratamiento. Estos síntomas pueden empeorar temporalmente o incluso pueden manifestarse después de la interrupción del tratamiento. Otros síntomas extrapiramidales: En ensayos clínicos pediátricos de aripiprazol se observó acatisia y parkinsonismo. Si aparecen signos y síntomas de otros SEP en un paciente tratado con aripiprazol, se debe considerar una reducción de dosis y una estrecha monitorización clínica. Síndrome Neuroléptico Maligno (SNM): SNM es un complejo de síntomas potencialmente mortal asociado con fármacos antipsicóticos. En ensayos clínicos se han notificado casos raros de SNM durante el tratamiento con aripiprazol. Las manifestaciones clínicas del SNM son hipertermia, rigidez muscular, estado mental alterado y evidencia de inestabilidad autonómica (pulso o presión sanguínea irregular, taquicardia, diaforesis y disritmia cardíaca). Los signos adicionales pueden incluir un aumento de creatina fosfoquinasa, mioglobinuria (rabdomiólisis), e insuficiencia renal aguda. También se han notificado elevaciones de la creatina fosfoquinasa y rabdomiólisis no necesariamente asociadas con el SNM. Si un paciente desarrolla signos y síntomas indicativos de SNM, o presenta una fiebre alta inexplicable sin manifestaciones clínicas adicionales de SNM, todos los medicamentos antipsicóticos, incluyendo aripiprazol deben ser interrumpidos. Convulsiones: En ensayos clínicos se han notificado casos poco frecuentes de convulsiones durante el tratamiento con aripiprazol. Por lo tanto, se debe utilizar aripiprazol con precaución en pacientes epilépticos o con historia de convulsiones. Pacientes de edad avanzada con psicosis relacionada con demencia: Aumento de mortalidad En tres ensayos controlados con placebo (n= 938; edad media: 82,4 años; rango: 56-99 años) de aripiprazol en pacientes de edad avanzada con psicosis asociada a la enfermedad de Alzheimer, los pacientes tratados con aripiprazol presentaron mayor riesgo de muerte comparado con placebo. El porcentaje de muerte en pacientes tratados con aripiprazol fue del 3,5% comparado con el 1,7% del grupo placebo. Aunque las causas de muerte fueron variadas, la mayoría de las muertes parecieron ser de naturaleza cardiovascular (por ejemplo, fallo cardíaco, muerte súbita) o infecciosa (por ejemplo, pneumonía). Reacciones adversas cerebrovasculares En los mismos ensayos, se notificaron reacciones adversas cerebrovasculares (por ejemplo ictus, crisis isquémica transitoria), incluyendo casos con desenlace fatal (media de edad: 84 años; rango: 78-88 años). En total, en estos ensayos, un 1,3% de los pacientes tratados con aripiprazol notificaron reacciones adversas cerebrovasculares en comparación con un 0,6% de los pacientes tratados con placebo. Esta diferencia no fue estadísticamente significativa. Sin embargo, en uno de estos ensayos, un ensayo de dosis fijas, hubo una relación dosis respuesta significativa para las reacciones adversas cerebrovasculares en pacientes tratados con aripiprazol. Aripiprazol no está indicado para el tratamiento de la psicosis relacionada con demencia. Hiperglucemia y diabetes mellitus: Se ha notificado hiperglucemia, en algunos casos extrema y asociada con cetoacidosis o coma hiperosmolar o muerte, en pacientes tratados con antipsicóticos atípicos, incluyendo aripiprazol. Los factores de riesgo que pueden predisponer a los pacientes a padecer complicaciones graves incluyen la obesidad y la historia familiar de diabetes. En los ensayos clínicos con aripiprazol, no hubo diferencias significativas en la tasa de incidencia de reacciones adversas hiperglucémicas (incluyendo diabetes) en los valores clínicos anómalos de glucemia en comparación con placebo. No se dispone de la valoración del riesgo exacto de reacciones adversas hiperglucémicas que permita la comparación directa entre pacientes tratados con aripiprazol y pacientes tratados con otros antipsicóticos atípicos. Se debe prestar atención a los signos y síntomas de hiperglucemia (como polidipsia, poliuria, polifagia y debilidad), en pacientes tratados con antipsicóticos, incluyendo aripiprazol, y se debe monitorizar regularmente en pacientes con diabetes mellitus o con factores de riesgo de diabetes mellitus por el empeoramiento del control de glucosa. Hipersensibilidad: Al igual que otros medicamentos pueden aparecer reacciones de hipersensibilidad con aripiprazol, caracterizadas por síntomas alérgicos (ver sección 4.8). Aumento de peso: El aumento de peso se ve comúnmente en pacientes con esquizofrenia y manía bipolar debido a la co-morbilidad, uso de antipsicóticos conocidos que causan aumento de peso, estilo de vida poco saludable, y puede conducir a complicaciones graves. El aumento de peso ha sido notificado en la postcomercialización entre pacientes a los que se les prescribe aripiprazol. Cuando se han visto, han sido habitualmente en aquellos con factores significativos de riesgo tales como historia de diabetes, alteraciones tiroideas o adenoma de la pituitaria. En ensayos clínicos con aripiprazol no se ha mostrado que induzcan a aumento de peso clínicamente relevante en adultos. En ensayos clínicos de pacientes adolescentes con trastorno bipolar, aripiprazol ha mostrado que está relacionado con un aumento de peso después de 4 semanas de tratamiento. El aumento de peso debe ser monitorizado en pacientes adolescentes con trastorno bipolar. Si el aumento de peso es clínicamente significativo, debe considerarse la reducción de dosis (ver sección 4.8). Disfagia: Dismotilidad esofágica y aspiración han sido asociadas con el tratamiento de antipsicóticos incluyendo aripiprazol. Aripiprazol y otros medicamentos antipsicóticos deben ser utilizados con precaución en pacientes con riesgo de neumonía por aspiración. Adicción al juego: Se han notificado casos post-comercialización de adicción al juego entre pacientes tratados con aripiprazol, independientemente de si estos pacientes tenían antecedentes. El riesgo puede ser mayor en pacientes con antecedentes de adicción al juego y deben ser controlados cuidadosamente (ver sección 4.8). Los pacientes con co-morbilidad asociada al TDAH: A pesar de la alta frecuencia de co-morbilidad asociada al Trastorno Bipolar I y al TDAH, los datos de seguridad sobre el uso concomitante de aripiprazol y estimulantes son muy escasos; por lo tanto, debe tenerse extrema precaución cuando estos medicamentos son co-administrados. Lactosa: Aripiprazol Kern Pharma comprimidos contiene lactosa. Los pacientes con problemas hereditarios poco frecuentes de intolerancia a la galactosa, insuficiencia de lactasa o malabsorción de glucosagalactosa no deben tomar este medicamento. 4.5 Interacción con otros medicamentos y otras formas de interacción Debido al antagonismo del receptor α1-adrenérgico, aripiprazol puede aumentar los efectos de ciertos agentes antihipertensivos. Debido a la acción principal de aripiprazol en el SNC, se debe utilizar aripiprazol con precaución cuando se utilice en combinación con alcohol u otros medicamentos de acción central, ya que se solapan las reacciones adversas como sedación (ver sección 4.8). Debe utilizarse con precaución la administración concomitante de aripiprazol con otros medicamentos que produzcan prolongación del intervalo QT o trastornos electrolíticos. Interacción de otros medicamentos con aripiprazol Famotidina, antagonista H2, bloqueante de los ácidos gástricos, reduce la tasa de absorción de aripiprazol, pero se considera que este efecto no es clínicamente significativo. Aripiprazol se metaboliza por múltiples vías involucrando los enzimas CYP2D6 y CYP3A4 pero no el enzima CYP1A. Por lo tanto, no es necesario un ajuste de dosis en fumadores. Quinidina y otros inhibidores de CYP2D6: En un ensayo clínico en sujetos sanos, un potente inhibidor de CYP2D6 (quinidina) aumentó el AUC de aripiprazol en 107%, mientras que la Cmax no varió. El AUC y la Cmax de dehidro-aripiprazol, el metabolito activo, disminuyeron un 32% y un 47%, respectivamente. La dosis de aripiprazol se debe reducir a la mitad de la dosis prescrita si se administra aripiprazol conjuntamente con quinidina. Otros potentes inhibidores de CYP2D6, como fluoxetina o paroxetina, posiblemente tengan efectos similares y se deben administrar, por lo tanto, reducciones similares de dosis. Ketoconazol y otros inhibidores de CYP3A4: En un ensayo clínico en sujetos sanos, un potente inhibidor de CYP3A4 (ketoconazol) aumentó el AUC y la Cmax de aripiprazol en 63% y 37%, respectivamente. Aumentó el AUC y la Cmax de dehidro-aripiprazol en 77% y 43%, respectivamente. En metabolizadores lentos de CYP2D6, el uso concomitante de potentes inhibidores de CYP3A4 puede aumentar las concentraciones plasmáticas de aripiprazol comparado con metabolizadores rápidos de CYP2D6. Cuando se considere la administración concomitante de ketoconazol u otro potente inhibidor CYP3A4 con aripiprazol el posible beneficio debe estar por encima del posible riesgo para el paciente. Si se administra ketoconazol junto con aripiprazol, la dosis de aripiprazol se debe reducir a la mitad de la dosis prescrita. Con otros potentes inhibidores de CYP3A4 como itraconazol e inhibidores de la proteasa VIH, se pueden esperar efectos similares y se deben administrar, por lo tanto, reducciones similares de dosis. En caso de interrupción del inhibidor CYP2D6 ó 3A4, se debe aumentar la dosis de aripiprazol hasta el nivel anterior a la iniciación del tratamiento concomitante. Se pueden esperar pequeños aumentos de las concentraciones de aripiprazol cuando se utiliza de forma concomitante con inhibidores débiles del CYP3A4 (por ejemplo, diltiazem o escitalopram) o del CYP2D6. Carbamazepina y otros inductores de CYP3A4: Después de una administración concomitante con carbamazepina, un potente inductor de CYP3A4, las medias geométricas de Cmax y AUC para aripiprazol fueron 68% y 73% más bajas, respectivamente, si se compara con la administración de aripiprazol (30 mg) sólo. Del mismo modo, las medias geométricas de Cmax y AUC para dehidroaripiprazol después de la co-administración de carbamazepina fueron 69% y 71% más bajas, respectivamente, que las de un tratamiento con aripiprazol sólo. La dosis de aripiprazol debe ser duplicada cuando se administra conjuntamente con carbamazepina. De otros potentes inductores de CYP3A4 (tales como rifampicina, rifabutina, fenitoina, fenobarbital, primidona, efavirenz, nevirapina y Hierba de San Juan (Hypericum perforatum) se deben esperar efectos similares y se deben administrar, por lo tanto, aumentos similares de dosis. En cuanto se suspendan los inductores potentes de CYP3A4 la dosis de aripiprazol debe ser reducida a la dosis recomendada. Valproato y litio: No se han encontrado cambios clínicamente significativos si se administra conjuntamente aripiprazol con valproato o litio. Síndrome serotoninérgico: Se han notificado casos de síndrome serotoninérgico en pacientes en tratamiento con aripiprazol, especialmente en casos de tratamiento concomitante con otros medicamentos serotoninérgicos como ISRS/IRSN, o con medicamentos conocidos por aumentar las concentraciones de aripiprazol (ver sección 4.8). Interacción de aripiprazol con otros medicamentos En ensayos clínicos, dosis de aripiprazol de 10-30 mg/día no tuvieron efectos significativos sobre el metabolismo de los substratos CYP2D6 (índice dextrometorfano/3-metoximorfinano), CYP2C9 (warfarina), CYP2C9 (omeprazol) y CYP3A4 (dextrometorfano). Además aripiprazol y dehidro-aripiprazol no modifican el metabolismo mediado por CYP1A2, in vitro. Por lo tanto, es improbable que aripiprazol provoque interacciones medicamentosas clínicamente importantes mediadas por estos enzimas. Cuando se administra aripiprazol conjuntamente con valproato, litio o lamotrigina, no se han encontrado cambios clínicamente significativos en las concentraciones de valproato, litio o lamotrigina. 4.6 Fertilidad, embarazo y lactancia Embarazo: No hay ensayos en mujeres embarazadas bien controlados y adecuados con aripiprazol. Se han notificado anomalías congénitas; sin embargo, no se ha podido establecer una relación causal con aripiprazol. Los estudios realizados en animales, no pueden excluir el desarrollo potencial de toxicidad. Las pacientes deben comunicar a su médico si están embarazadas o tienen intención de quedarse embarazadas durante el tratamiento con aripiprazol. Debido a información de seguridad insuficiente en humanos y datos inciertos en estudios de reproducción animal, este medicamento no debe utilizarse en el embarazo, a menos que el beneficio esperado justifique claramente un riesgo potencial en el feto. Los recién nacidos expuestos a antipsicóticos (como aripiprazol) durante el tercer trimestre de embarazo están en peligro de sufrir reacciones adversas como síntomas extrapiramidales y/o síndromes de abstinencia que pueden variar en gravedad y duración tras la exposición. Se han notificado casos de síntomas de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o alteraciones alimenticias. Por consiguiente, se debe vigilar estrechamente a los recién nacidos. Lactancia: Aripiprazol se excreta en la leche materna humana. Se debe advertir a las pacientes que no den el pecho si están tomando aripiprazol. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas Al igual que con otros antipsicóticos, los pacientes deben tener cuidado al utilizar máquinas peligrosas, incluyendo vehículos a motor, hasta que tengan la certeza de que aripiprazol no les afecta negativamente. Algunos pacientes pediátricos con Trastorno Bipolar I tienen una mayor incidencia de somnolencia y fatiga (ver sección 4.8). 4.8 Reacciones adversas Resumen del perfil de seguridad: Las reacciones adversas notificadas con más frecuencia en los ensayos controlados con placebo son acatisia y náuseas manifestándose cada una en más del 3% de los pacientes tratados con aripiprazol oral. Tabla de reacciones adversas Las siguientes reacciones adversas se producen con más frecuencia (≥ 1/100) que con placebo, o fueron identificadas como reacciones adversas de posible relevancia médica (*). La frecuencia de reacciones adversas listadas a continuación se definen siguiendo la siguiente clasificación: frecuentes (≥ 1/100 a < 1/10) y poco frecuentes (≥ 1/1.000 a < 1/100). Trastornos psiquiátricos: Frecuentes: agitación, insomnio, ansiedad Poco frecuentes: depresión* Trastornos del sistema nervioso: Frecuentes: trastorno extrapiramidal, acatisia, temblor, vértigo, somnolencia, sedación, cefalea Trastornos oculares: Frecuentes: visión borrosa Trastornos cardíacos: Poco frecuentes: taquicardia* Trastornos vasculares: Poco frecuentes: hipotensión ortostática* Trastornos gastrointestinales: Frecuentes: dispepsia, vómitos, náuseas, estreñimiento, hipersecreción salivar Trastornos generales y alteraciones en el lugar de administración: Frecuentes: fatiga Descripción de reacciones adversas seleccionadas Síntomas extrapiramidales (SEP) Esquizofrenia: en un ensayo controlado a AAFF_pmsa210x280_Aripiprazol_KERN_020215.indd 2 02/02/15 15:43 largo plazo de 52 semanas, los pacientes tratados con aripiprazol tuvieron una incidencia global menor (25,8%) de SEP incluyendo parkinsonismo, acatisia, distonía y discinesia, comparados con aquellos tratados con haloperidol (57,3%). En un ensayo controlado con placebo a largo plazo, de 26 semanas, la incidencia de SEP fue de 19% para pacientes tratados con aripiprazol y 13,1% para pacientes tratados con placebo. En otro ensayo controlado a largo plazo de 26 semanas, la incidencia de SEP fue de 14,8% para pacientes tratados con aripiprazol y 15,1% para pacientes tratados con olanzapina. Episodios maníacos en Trastorno Bipolar I - en un ensayo controlado de 12 semanas de duración, la incidencia de SEP fue de 23,5% en pacientes tratados con aripiprazol y de 53,3% en pacientes tratados con haloperidol. En otro ensayo, también de 12 semanas de duración, la incidencia de SEP fue de 26,6% en pacientes tratados con aripiprazol y de 17,6% para aquellos tratados con litio. En la fase de mantenimiento a largo plazo de 26 semanas de duración de un ensayo controlado con placebo, la incidencia de SEP fue de 18,2% en pacientes tratados con aripiprazol y de 15,7% en pacientes tratados con placebo. Acatisia En ensayos controlados con placebo, la incidencia de acatisia en pacientes con trastorno bipolar fue de 12,1% en los tratados con aripiprazol y de 3,2% en aquellos que recibieron placebo. En pacientes con esquizofrenia la incidencia de acatisia fue de 6,2% para aripiprazol y de 3,0% para placebo. Distonía Efecto de clase: en individuos susceptibles y durante los primeros días de tratamiento pueden producirse los síntomas de distonía, contracciones prolongadas anormales de grupos de músculos. Los síntomas de distonía incluyen: espasmo de los músculos del cuello, progresando a veces a contracción de la garganta, dificultad para tragar, dificultad para respirar, y/o protrusión de la lengua. Aunque estos síntomas pueden producirse a bajas dosis, ocurren más frecuentemente y con mayor gravedad con fármacos antipsicóticos de primera generación de alta potencia y a mayores dosis. Se observa un elevado riesgo de distonía en los grupos de varones y edades más jóvenes. La comparación entre aripiprazol y placebo en aquella proporción de pacientes que experimentan potencialmente cambios clínicamente significativos en los parámetros lipídicos y rutinarios de laboratorio no revelan ninguna diferencia médica importante. Se observaron aumentos de CPK (Creatina Fosfoquinasa), generalmente transitorios y asintomáticos, en el 3,5% de pacientes tratados con aripiprazol en comparación al 2,0% de pacientes que recibieron placebo. Otros hallazgos Se han notificado reacciones adversas durante el tratamiento con aripiprazol que son conocidos en asociación con la terapia antipsicótica, incluyendo el síndrome neuroléptico maligno, discinesia tardía, convulsiones, reacciones adversas cerebrovasculares y aumento de mortalidad en pacientes de edad avanzada con demencia, hiperglucemia y diabetes mellitus (ver sección 4.4). Población pediátrica Esquizofrenia en adolescentes de 15 años o más: En un ensayo controlado con placebo a corto plazo en 302 adolescentes (13-17 años) con esquizofrenia, la frecuencia y el tipo de efectos indeseables fueron similares a los de los adultos, excepto las siguientes reacciones que se manifestaron con más frecuencia en adolescentes que en los adultos que recibieron aripiprazol (y con más frecuencia que con placebo): somnolencia/sedación y trastorno extrapiramidal fueron notificadas como muy frecuentes (≥ 1/10), y sequedad de boca, aumento del apetito, e hipotensión ortostática fueron notificados como frecuentes (≥ 1/100 a < 1/10). El perfil de seguridad en un ensayo abierto de 26 semanas fue similar al del ensayo controlado con placebo a corto plazo. En la población de adolescentes con esquizofrenia (13-17 años) con exposición de hasta 2 años, la incidencia de niveles séricos de prolactina bajos en mujeres (< 3 ng/ml) y en hombres (< 2 ng/ml) fue 29,5% y 48,3%, respectivamente. En la población adolescente con esquizofrenia (13-17 años) con exposición al aripiprazol de 5 a 30 mg hasta por 72 meses, la incidencia de bajos niveles de prolactina en suero en mujeres (< 3 ng/ml) y hombres (< 2 ng/ml) fue de 25,6 % y 45,0 %, respectivamente. Episodios maníacos en Trastorno Bipolar I en adolescentes de 13 años o más: La frecuencia y el tipo de efectos indeseables en adolescentes con Trastorno Bipolar I fueron similares a los de los adultos excepto por las siguientes reacciones: muy frecuentes (≥ 1/10) somnolencia (23,0%), trastorno extrapiramidal (18,4%), acatisia (16,0%), y fatiga (11,8%); y frecuentes (≥ 1/100, <1/10) dolor abdominal superior, aumento de la frecuencia cardíaca, aumento de peso, aumento del apetito, fasciculaciones musculares y disquinesia. Los siguientes efectos indeseables tuvieron una posible relación de dosis respuesta; trastorno extrapiramidal (las incidencias con 10 mg fueron 9,1%, con 30 mg 28,8%, con placebo 1,7%); y acatisia (las incidencias con 10 mg fueron 12,1%, con 30 mg 20,3%, con placebo 1,7%). Los cambios medios de peso en adolescentes con Trastorno Bipolar I a las 12 y 30 semanas con aripiprazol fueron 2,4 kg y 5,8 kg, y con placebo 0,2 kg y 2,3 kg respectivamente. En la población pediátrica la somnolencia y fatiga se observaron con mayor frecuencia en pacientes con trastorno bipolar que en pacientes con esquizofrenia. En la población pediátrica bipolar (10-17 años) con exposición de hasta 30 semanas, la incidencia de niveles séricos de prolactina bajos en mujeres (< 3 ng/ml) y en hombres (< 2 ng/ml) fue 28,0% y 53,3%, respectivamente. Post-comercialización Se han notificado las siguientes reacciones adversas durante la vigilancia post-comercialización. Se desconoce la frecuencia de estas reacciones (no se puede estimar a partir de los datos disponibles). Trastornos de la sangre y del sistema linfático: leucopenia, neutropenia, trombocitopenia Trastornos del sistema inmunológico: reacciones alérgicas (por ejemplo, reacción anafiláctica, angioedema con inflamación de la lengua, edema en la lengua, edema en la cara, prurito, o urticaria Trastornos endocrinos: hiperglicemia, diabetes mellitus, cetoacidosis diabética, coma diabético hiperosmolar Trastornos del metabolismo y de la nutrición: aumento de peso, pérdida de peso, anorexia, hiponatremia Trastornos psiquiátricos: agitación, nerviosismo, adicción al juego; intento de suicido, ideación suicida y suicido consumado (ver sección 4.4) Trastornos del sistema nervioso: trastornos del lenguaje, síndrome neuroléptico maligno (SNM), convulsiones tonicoclónicas generalizadas, síndrome serotoninérgico Trastornos cardiacos: prolongación del intervalo QT, arritmia ventricular, muerte súbita inexplicada, paro cardíaco, torsades de pointes, bradicardia Trastornos vasculares: síncope, hipertensión, tromboembolismo venoso (incluyendo embolia pulmonar y trombosis venosa profunda) Trastornos respiratorios, torácicos y mediastínicos: espasmo orofaríngeo, laringoespasmo, neumonía de aspiración Trastornos gastrointestinales: pancreatitis, disfagia, molestia abdominal, malestar de estómago, diarrea Trastornos hepatobiliares: fallo hepático, ictericia, hepatitis, aumento de alanina aminotransferasa (ALT), aumento de la gamma glutamil transferasa (GGT), aumento de la fosfatasa alcalina Trastorno de la piel y del tejido subcutáneo: erupción cutánea, reacción de fotosensibilidad, alopecia, hiperhidrosis Trastornos musculoesqueléticos y del tejido conjuntivo: rabdomiólisis, mialgia, rigidez Trastornos renales y urinarios: incontinencia urinaria, retención urinaria Embarazo, puerperio y enfermedades perinatales: síndrome de abstinencia neonatal (ver sección 4.6) Trastornos del aparato reproductor y de la mama: priapismo Trastornos generales y alteraciones en el lugar de administración: trastorno de la regulación de la temperatura (por ejemplo, hipotermia, pirexia), dolor torácico, edema periférico Exploraciones complementarias: aumento de la creatina fosfoquinasa, aumento de los niveles de glucosa en sangre, fluctuación de los niveles de glucosa en sangre, aumento de la hemoglobina glicosilada Notificación de sospechas de reacciones adversas Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. 4.9 Sobredosis Signos y síntomas En ensayos clínicos y durante la experiencia post-comercialización se ha identificado sobredosis aguda involuntaria o voluntaria con solo aripiprazol, en pacientes adultos con dosis notificadas estimadas de hasta 1260 mg sin ningún desenlace fatal. Los signos y síntomas de potencial importancia clínica observados incluyeron letargia, aumento de la presión sanguínea, somnolencia, taquicardia, náuseas, vómitos, y diarrea Además, se han recibido informes de sobredosis involuntaria accidental con solo aripiprazol (hasta 195 mg) en niños sin ningún desenlace fatal. Los signos y síntomas médicos potencialmente graves notificados incluyeron somnolencia, pérdida del conocimiento transitorio y síntomas extrapiramidales. Manejo de una sobredosis El tratamiento de la sobredosis debe concentrarse en una terapia de sostén, manteniendo una adecuada aireación, oxigenación y ventilación, y tratamiento sintomático. Se debe considerar la posibilidad de múltiples medicamentos implicados. Entonces, se debe empezar inmediatamente la monitorización cardiovascular y se debe incluir la monitorización electrocardiográfica continua para detectar posibles arritmias. En cualquier confirmación o sospecha de sobredosis con aripiprazol, la monitorización y supervisión médica debe continuar hasta la recuperación del paciente. Carbón activado (50 g) administrado una hora después de aripiprazol, disminuyó la Cmax en 41% y el AUC de aripiprazol en el 51%, esto sugiere que el carbón puede ser eficaz en el tratamiento de la sobredosis. Hemodiálisis: Aunque no hay información sobre los efectos de la hemodiálisis al tratar una sobredosis de aripiprazol, es improbable que sea útil en el tratamiento de la sobredosis dado que aripiprazol presenta una fuerte unión a proteínas plasmáticas. 5. DATOS FARMACÉUTICOS 5.1 Lista de excipientes Aripiprazol Kern Pharma 5 mg comprimidos: Lactosa monohidrato, croscarmelosa sódica, celulosa microcristalina silicificada, estearato de magnesio y carmín de índigo azul (E-132) Aripiprazol Kern Pharma 10 mg comprimidos: Lactosa monohidrato, croscarmelosa sódica, celulosa microcristalina silicificada, estearato de magnesio y óxido de hierro rojo (E-172) Aripiprazol Kern Pharma 15 mg comprimidos: Lactosa monohidrato, croscarmelosa sódica, celulosa microcristalina silicificada, estearato de magnesio y óxido de hierro amarillo (E-172) Aripiprazol Kern Pharma 30 mg comprimidos: Lactosa monohidrato, croscarmelosa sódica, celulosa microcristalina silicificada, estearato de magnesio y óxido de hierro rojo (E-172) 5.2 Incompatibilidades No procede 5.3 Periodo de validez 3 años (para las dosis de 5, 10 y 15 mg); 18 meses (para la dosis de 30 mg) 5.4 Precauciones especiales de conservación No requiere condiciones especiales de conservación. 5.5 Naturaleza y contenido del envase Los comprimidos se acondicionan en blisters de PVC/PVDC/Al. Tamaños de envase: Se presenta en envases normales de 28 comprimidos y en envases clínicos de 100 comprimidos. Puede que solamente estén comercializados algunos tamaños de envases. 5. 6 Precauciones especiales de eliminación y otras manipulaciones La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 6. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN KERN PHARMA, S.L. Venus, 72 - Pol. Ind. Colón II 08228 Terrassa - Barcelona – España 7. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN Aripiprazol Kern Pharma 5 mg comprimidos EFG, nº reg. 79.150 Aripiprazol Kern Pharma 10 mg comprimidos EFG, nº reg. 79.151 Aripiprazol Kern Pharma 15 mg comprimidos EFG, nº reg. 79.152 Aripiprazol Kern Pharma 15 mg comprimidos EFG, nº reg. 79.153 8. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Octubre 2014 FECHA DE LA REVISIÓN DEL TEXTO Octubre 2014 PRESENTACIONES DEL PRODUCTO Y PRECIO RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN Medicamento sujeto a prescripción médica. Aportación reducida Visado de inspección en mayores de 75 años. Incluido en la oferta del SNS. Para más información, consultar la Ficha Técnica completa del producto. NOMBRE DEL MEDICAMENTO Aripiprazol Kern Pharma 10 mg comprimidos bucodispersables EFG Aripiprazol Kern Pharma 15 mg comprimidos bucodispersables EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Aripiprazol Kern Pharma 10 mg comprimidos bucodispersables: Cada comprimido contiene 10 mg de aripiprazol. Excipiente con efecto conocido: Cada comprimido contiene 2 mg de aspartamo (E-951). Aripiprazol Kern Pharma 15 mg comprimidos bucodispersables: Cada comprimido contiene 15 mg de aripiprazol. Excipiente con efecto conocido: Cada comprimido contiene 3 mg de aspartamo (E-951). Para consultar la lista completa de excipientes ver sección “5.1”. 3. FORMA FARMACÉUTICA Comprimido bucodispersable. Aripiprazol Kern Pharma 10 mg comprimidos bucodispersables: Comprimidos bucodispersables de color rosa, redondos y biconvexos. Aripiprazol Kern Pharma 15 mg comprimidos bucodispersables: Comprimidos bucodispersables de color amarillo, redondos y biconvexos. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Aripiprazol está indicado en el tratamiento de la esquizofrenia en adultos y adolescentes de 15 años o más. Aripiprazol está indicado para el tratamiento de los episodios maníacos moderados o severos en pacientes con trastorno bipolar I y en la prevención de nuevos episodios maníacos en adultos que presentaron episodios predominantemente maníacos y que respondieron al tratamiento con aripiprazol. Aripiprazol está indicado para el tratamiento hasta 12 semanas de los episodios maníacos moderados o severos del Trastorno Bipolar I en adolescentes de 13 años o más. 4.2 Posología y forma de administración Posología Adultos Esquizofrenia: la dosis recomendada de inicio de aripiprazol es de 10 ó 15 mg/día con una dosis de mantenimiento de 15 mg/día administrada como una única dosis diaria independientemente de las comidas. Aripiprazol es eficaz en un rango de dosis de 10 a 30 mg/día. No se ha demostrado un aumento de la eficacia con dosis mayores a la dosis diaria de 15 mg, aunque algunos pacientes pueden beneficiarse de dosis mayores. La dosis máxima diaria no deberá exceder 30 mg/día. Episodios maníacos en Trastorno Bipolar I: la dosis de inicio recomendada de aripiprazol es de 15 mg administrada como una única dosis diaria independientemente de las comidas en monoterapia o terapia combinada. Algunos pacientes podrían beneficiarse de dosis mayores. La dosis máxima diaria no debe exceder 30 mg. Prevención de recaídas de episodios maníacos en trastorno bipolar I: para prevenir las recaídas de episodios maníacos en pacientes que han estado tomando aripiprazol en monoterapia o terapia combinada, continuar con la misma dosis. Se deben considerar ajustes de la posología diaria, incluyendo reducción de la dosis, según el estado clínico. Población pediátrica Esquizofrenia en adolescentes de 15 años y más: la dosis recomendada de aripiprazol es 10 mg/día administrada como una única dosis diaria independientemente de las comidas. El tratamiento debe ser iniciado con 2 mg (usando aripiprazol solución oral 1 mg/ml) durante 2 días, incrementado a 5 mg durante 2 días adicionales para alcanzar la dosis recomendada diaria de 10 mg. En caso necesario, aumentos de dosis posteriores deben ser administrados en incrementos de 5 mg sin exceder la dosis máxima diaria de 30 mg. Aripiprazol es eficaz en un rango de dosis de 10 a 30 mg/día. No se ha demostrado un aumento de la eficacia con dosis mayores a la dosis diaria de 10 mg, aunque algunos pacientes pueden beneficiarse de dosis mayores. Aripiprazol no está recomendado en pacientes con esquizofrenia menores de 15 años debido a datos insuficientes sobre seguridad y eficacia (ver la sección 4.8). Episodios maníacos en Trastorno Bipolar I en adolescentes de 13 años o más: la dosis recomendada de aripiprazol es 10 mg/día administrada una vez al día independientemente de las comidas. Se debe iniciar el tratamiento con 2 mg (usando aripiprazol 1 mg/ml solución oral) durante 2 días, valorando utilizar 5 mg durante 2 días adicionales para alcanzar la dosis diaria recomendada de 10 mg. La duración del tratamiento debe ser la mínima necesaria para el control de los síntomas y no debe exceder de 12 semanas. No se ha demostrado un aumento de la eficacia con dosis superiores a la dosis diaria de 10 mg, y una dosis diaria de 30 mg se asocia con una incidencia sustancialmente mayor de efectos adversos significativos incluyendo eventos relacionados con SEP, somnolencia, fatiga y aumento de peso (ver sección 4.8). Por lo tanto, dosis superiores de 10 mg/día se deben usar en casos excepcionales y con una estrecha monitorización clínica (ver secciones 4.4 y 4.8). Los pacientes más jóvenes tienen un mayor riesgo de sufrir efectos adversos asociados con aripiprazol. Por ello, no se recomienda el uso de aripiprazol en pacientes menores de 13 años (ver sección 4.8). Irritabilidad asociada con el trastorno autista: no se ha establecido todavía la seguridad y eficacia de aripiprazol en niños y adolescentes menores de 18 años. No se puede hacer una recomendación posológica. Tics asociados con el trastorno de Tourette: no se ha establecido todavía la seguridad y eficacia de aripiprazol en niños y adolescentes entre 6 y 18 años. No se puede hacer una recomendación posológica. Pacientes con insuficiencia hepática No es necesario un ajuste de dosis en pacientes que presentan insuficiencia hepática leve a moderada. En pacientes que presentan insuficiencia hepática grave, los datos disponibles son insuficientes para establecer recomendaciones. En estos pacientes debe ajustarse la dosis cuidadosamente. Sin embargo, se debe utilizar la dosis máxima de 30 mg/día con precaución en pacientes que presentan insuficiencia hepática grave. Pacientes con insuficiencia renal No es necesario un ajuste de dosis en pacientes que presentan insuficiencia renal. Pacientes de edad avanzada La eficacia de aripiprazol en el tratamiento de esquizofrenia y trastorno bipolar I en pacientes de 65 años y más no ha sido establecida. Debido a una mayor sensibilidad en esta población se debe considerar una dosis inicial menor si lo justifican los factores clínicos (ver sección 4.4). Sexo No es necesario ajustar la dosis en función del sexo. Fumadores No es necesario un ajuste de dosis en pacientes fumadores debido al metabolismo de aripiprazol (ver sección 4.5). Ajuste de la dosis debido a interacciones Cuando se administra conjuntamente aripiprazol con potentes inhibidores de CYP3A4 o CYP2D6, debe reducirse la dosis de aripiprazol. Cuando se deje el tratamiento conjunto con inhibidores de CYP3A4 ó CYP2D6, la dosis de aripiprazol debe ser aumentada (ver sección 4.5). Cuando se administra conjuntamente aripiprazol con potentes inductores de CYP3A4, la dosis de aripiprazol debe aumentarse. Cuando se deje el tratamiento combinado con inductores de CYP3A4 la dosis de aripiprazol debe entonces reducirse a la dosis recomendada (ver sección 4.5). Forma de administración: Los comprimidos bucodispersables de aripiprazol se administran por vía oral. El comprimido bucodispersable se debe introducir en la boca, sobre la lengua, donde rápidamente se dispersará con la saliva. Se puede tomar con o sin líquido. Es difícil retirar el comprimido bucodispersable intacto de la boca. Como el comprimido bucodispersable es frágil, se debe tomar inmediatamente una vez abierto el blíster. Otra posibilidad es disolver el comprimido en agua y beber la suspensión resultante. Se deben tomar los comprimidos bucodispersables como una alternativa a aripiprazol comprimidos en pacientes que tengan dificultad para tragar aripiprazol comprimidos. 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 5.1. 4.4 Advertencias y precauciones especiales de empleo La mejoría clínica del paciente durante el tratamiento antipsicótico, puede tardar entre varios días a algunas semanas. Los pacientes deben estar estrechamente controlados durante este periodo. Tendencias suicidas: La aparición de comportamiento suicida es inherente a las patologías psicóticas y trastornos del estado de ánimo y en algunos casos ha sido notificado temprano tras la administración inicial o cambio de terapias antipsicóticas, incluyendo el tratamiento con aripiprazol (ver sección 4.8). Debe realizarse una supervisión estrecha de los pacientes de alto riesgo cuando son tratados con antipsicóticos. Los resultados de un estudio epidemiológico han sugerido que no se incrementó el riesgo de suicidio con aripiprazol comparado con otros antipsicóticos entre pacientes adultos con esquizofrenia o trastorno bipolar. Los datos en pediatría son insuficientes para evaluar este riesgo en pacientes más jóvenes (por debajo de 18 años de edad), pero existen pruebas de que el riesgo de suicidio persiste más allá de las 4 primeras semanas de tratamiento con antipsicóticos atípicos, incluyendo aripiprazol. Alteraciones cardiovasculares: Aripiprazol debe ser utilizado con precaución en pacientes que presentan enfermedad cardiovascular conocida (historia de infarto de miocardio o enfermedad isquémica cardiaca, fallo cardíaco, o anormalidades de la conducción), enfermedad cerebrovascular, condiciones en las que puede predisponerse a pacientes a la hipotensión (deshidratación, hipovolemia, y tratamiento con medicamentos antihipertensivos) o hipertensión, incluyendo acelerada o maligna. Se han notificado casos de tromboembolismo venoso (TEV) con medicamentos antipsicóticos. Dado que los pacientes tratados con antipsicóticos presentan a menudo factores de riesgo adquiridos para el TEV, se deben identificar todos los posibles factores de riesgo de TEV antes y durante el tratamiento con aripiprazol, así como tomarse las correspondientes medidas preventivas. Anormalidades de la conducción: En ensayos clínicos de aripiprazol, la incidencia de la prolongación del intervalo QT fue comparable al placebo. Como con otros antipsicóticos, aripiprazol debería ser utilizado con precaución en pacientes con historia familiar de prolongación del intervalo QT. Discinesia tardía: En ensayos clínicos de hasta un año de duración, se han notificado casos poco frecuentes de discinesia durante el tratamiento con aripiprazol. Si aparecen signos y síntomas de discinesia tardía en un paciente tratado con aripiprazol, se debe considerar una reducción de dosis o la interrupción del tratamiento. Estos síntomas pueden empeorar temporalmente o incluso pueden manifestarse después de la interrupción del tratamiento. Otros síntomas extrapiramidales: En ensayos clínicos pediátricos de aripiprazol se observó acatisia y parkinsonismo. Si aparecen signos y síntomas de otros SEP en un paciente tratado con aripiprazol, se debe considerar una reducción de dosis y una estrecha monitorización clínica. Síndrome Neuroléptico Maligno (SNM): SNM es un complejo de síntomas potencialmente mortal asociado con fármacos antipsicóticos. En ensayos clínicos se han notificado casos raros de SNM durante el tratamiento con aripiprazol. Las manifestaciones clínicas del SNM son hipertermia, rigidez muscular, estado mental alterado y evidencia de inestabilidad autonómica (pulso o presión sanguínea irregular, taquicardia, diaforesis y disritmia cardíaca). Los signos adicionales pueden incluir un aumento de creatina fosfoquinasa, mioglobinuria (rabdomiólisis), e insuficiencia renal aguda. También se han notificado elevaciones de la creatina fosfoquinasa y rabdomiólisis no necesariamente asociadas con el SNM. Si un paciente desarrolla signos y síntomas indicativos de SNM, o presenta una fiebre alta inexplicable sin manifestaciones clínicas adicionales de SNM, todos los medicamentos antipsicóticos, incluyendo aripiprazol, deben ser interrumpidos. Convulsiones: En ensayos clínicos se han notificado casos poco frecuentes de convulsiones durante el tratamiento con aripiprazol. Por lo tanto, se debe utilizar aripiprazol con precaución en pacientes epilépticos o con historia de convulsiones. Pacientes de edad avanzada con psicosis relacionada con demencia: Aumento de mortalidad En tres ensayos controlados con placebo (n= 938; edad media: 82,4 años; rango: 56-99 años) de aripiprazol en pacientes de edad avanzada con psicosis asociada a la enfermedad de Alzheimer, los pacientes tratados con aripiprazol presentaron mayor riesgo de muerte comparado con placebo. El porcentaje de muerte en pacientes tratados con aripiprazol fue del 3,5% comparado con el 1,7% del grupo placebo. Aunque las causas de muerte fueron AAFF_pmsa210x280_Aripiprazol_KERN_020215.indd 3 02/02/15 15:43 variadas, la mayoría de las muertes parecieron ser de naturaleza cardiovascular (por ejemplo, fallo cardíaco, muerte súbita) o infecciosa (por ejemplo, pneumonía). Reacciones adversas cerebrovasculares En los mismos ensayos, se notificaron reacciones adversas cerebrovasculares (por ejemplo ictus, crisis isquémica transitoria), incluyendo casos con desenlace fatal (media de edad: 84 años; rango: 78-88 años). En total, en estos ensayos, un 1,3% de los pacientes tratados con aripiprazol notificaron reacciones adversas cerebrovasculares en comparación con un 0,6% de los pacientes tratados con placebo. Esta diferencia no fue estadísticamente significativa. Sin embargo, en uno de estos ensayos, un ensayo de dosis fijas, hubo una relación dosis respuesta significativa para las reacciones adversas cerebrovasculares en pacientes tratados con aripiprazol. Aripiprazol no está indicado para el tratamiento de la psicosis relacionada con demencia. Hiperglucemia y diabetes mellitus: Se ha notificado hiperglucemia, en algunos casos extrema y asociada con cetoacidosis o coma hiperosmolar o muerte, en pacientes tratados con antipsicóticos atípicos, incluyendo aripiprazol. Los factores de riesgo que pueden predisponer a los pacientes a padecer complicaciones graves incluyen la obesidad y la historia familiar de diabetes. En los ensayos clínicos con aripiprazol, no hubo diferencias significativas en la tasa de incidencia de reacciones adversas hiperglucémicas (incluyendo diabetes) en los valores clínicos anómalos de glucemia en comparación con placebo. No se dispone de la valoración del riesgo exacto de reacciones adversas hiperglucémcias que permita la comparación directa entre pacientes tratados con aripiprazol y pacientes tratados con otros antipsicóticos atípicos. Se debe prestar atención a los signos y síntomas de hiperglucemia (como polidipsia, poliuria, polifagia y debilidad), en pacientes tratados con antipsicóticos, incluyendo aripiprazol, y se debe monitorizar regularmente en pacientes con diabetes mellitus o con factores de riesgo de diabetes mellitus por el empeoramiento del control de glucosa. Hipersensibilidad: Al igual que otros medicamentos pueden aparecer reacciones de hipersensibilidad con aripiprazol, caracterizadas por síntomas alérgicos (ver sección 4.8). Aumento de peso: El aumento de peso se ve comúnmente en pacientes con esquizofrenia y manía bipolar debido a la co-morbilidad, uso de antipsicóticos conocidos que causan aumento de peso, estilo de vida poco saludable, y puede conducir a complicaciones graves. El aumento de peso ha sido notificado en la post- comercialización entre pacientes a los que se les prescribe aripiprazol. Cuando se han visto, han sido habitualmente en aquellos con factores significativos de riesgo tales como historia de diabetes, alteraciones tiroideas o adenoma de la pituitaria. En ensayos clínicos con aripiprazol no se ha mostrado que induzcan a aumento de peso clínicamente relevante en adultos. En ensayos clínicos de pacientes adolescentes con trastorno bipolar, aripiprazol ha mostrado que está relacionado con un aumento de peso después de 4 semanas de tratamiento. El aumento de peso debe ser monitorizado en pacientes adolescentes con trastorno bipolar. Si el aumento de peso es clínicamente significativo, debe considerarse la reducción de dosis (ver sección 4.8). Disfagia: Dismotilidad esofágica y aspiración han sido asociadas con el tratamiento de antipsicóticos incluyendo aripiprazol. Aripiprazol y otros medicamentos antipsicóticos deben ser utilizados con precaución en pacientes con riesgo de neumonía por aspiración. Adicción al juego: Se han notificado casos post-comercialización de adicción al juego entre pacientes tratados con aripiprazol, independientemente de si estos pacientes tenían antecedentes. El riesgo puede ser mayor en pacientes con antecedentes de adicción al juego y deben ser controlados cuidadosamente (ver sección 4.8). Los pacientes con co-morbilidad asociada al TDAH: A pesar de la alta frecuencia de co-morbilidad asociada al Trastorno Bipolar I y al TDAH, los datos de seguridad sobre el uso concomitante de aripiprazol y estimulantes son muy escasos; por lo tanto, debe tenerse extrema precaución cuando estos medicamentos son co-administrados. Aspartamo: Este medicamento puede ser perjudicial para personas con fenilcetonuria porque contiene aspartamo que es una fuente de fenilalanina. 4.5 Interacción con otros medicamentos y otras formas de interacción Debido al antagonismo del receptor α1-adrenérgico, aripiprazol puede aumentar los efectos de ciertos agentes antihipertensivos. Debido a la acción principal de aripiprazol en el SNC, se deben utilizar aripiprazol con precaución cuando se utilice en combinación con alcohol u otros medicamentos de acción central, ya que se solapan las reacciones adversas como sedación (ver sección 4.8). Debe utilizarse con precaución la administración concomitante de aripiprazol con otros medicamentos que produzcan prolongación del intervalo QT o trastornos electrolíticos. Interacción de otros medicamentos con aripiprazol Famotidina, antagonista H2, bloqueante de los ácidos gástricos, reduce la tasa de absorción de aripiprazol, pero se considera que este efecto no es clínicamente significativo. Aripiprazol se metaboliza por múltiples vías involucrando los enzimas CYP2D6 y CYP3A4 pero no el enzima CYP1A. Por lo tanto, no es necesario un ajuste de dosis en fumadores. Quinidina y otros inhibidores de CYP2D6: En un ensayo clínico en sujetos sanos, un potente inhibidor de CYP2D6 (quinidina) aumentó el AUC de aripiprazol en 107%, mientras que la Cmax no varió. El AUC y la Cmax de dehidro-aripiprazol, el metabolito activo, disminuyeron un 32% y un 47%, respectivamente. La dosis de aripiprazol se debe reducir a la mitad de la dosis prescrita si se administra aripiprazol conjuntamente con quinidina. Otros potentes inhibidores de CYP2D6, como fluoxetina o paroxetina, posiblemente tengan efectos similares y se deben administrar, por lo tanto, reducciones similares de dosis. Ketoconazol y otros inhibidores de CYP3A4: En un ensayo clínico en sujetos sanos, un potente inhibidor de CYP3A4 (ketoconazol) aumentó el AUC y la Cmax de aripiprazol en 63% y 37%, respectivamente. Aumentó el AUC y la Cmax de dehidro‑aripiprazol en 77% y 43%, respectivamente. En metabolizadores lentos de CYP2D6, el uso concomitante de potentes inhibidores de CYP3A4 puede aumentar las concentraciones plasmáticas de aripiprazol comparado con metabolizadores rápidos de CYP2D6. Cuando se considere la administración concomitante de ketoconazol u otro potente inhibidor CYP3A4 con aripiprazol el posible beneficio debe estar por encima del posible riesgo para el paciente. Si se administra ketoconazol junto con aripiprazol, la dosis de aripiprazol se debe reducir a la mitad de la dosis prescrita. Con otros potentes inhibidores de CYP3A4 como itraconazol e inhibidores de la proteasa VIH, se pueden esperar efectos similares y se deben administrar, por lo tanto, reducciones similares de dosis. En caso de interrupción del inhibidor CYP2D6 ó 3A4, se debe aumentar la dosis de aripiprazol hasta el nivel anterior a la iniciación del tratamiento concomitante. Se pueden esperar pequeños aumentos de las concentraciones de aripiprazol cuando se utiliza de forma concomitante con inhibidores débiles del CYP3A4 (por ejemplo, diltiazem o escitalopram) o del CYP2D6. Carbamazepina y otros inhibidores de CYP3A4: Después de una administración concomitante con carbamazepina, un potente inductor de CYP3A4, las medias geométricas de Cmax y AUC para aripiprazol fueron 68% y 73% más bajas, respectivamente, si se compara con la administración de aripiprazol (30 mg) sólo. Del mismo modo, las medias geométricas de Cmax y AUC para dehidro-aripiprazol después de la co-administración de carbamazepina fueron 69% y 71% más bajas, respectivamente, que las de un tratamiento con aripiprazol sólo. La dosis de aripiprazol debe ser duplicada cuando se administra conjuntamente con carbamazepina. De otros potentes inductores de CYP3A4 (tales como rifampicina, rifabutina, fenitoina, fenobarbital, primidona, efavirenz, nevirapina y Hierba de San Juan (Hypericum perforatum) se deben esperar efectos similares y se deben administrar, por lo tanto, aumentos similares de dosis. En cuanto se suspendan los inductores potentes de CYP3A4 la dosis de aripiprazol debe ser reducida a la dosis recomendada. Valproato y litio: No se han encontrado cambios clínicamente significativos si se administra conjuntamente aripiprazol con valproato o litio. Síndrome serotoninérgico: Se han notificado casos de síndrome serotoninérgico en pacientes en tratamiento con aripiprazol, especialmente en casos de tratamiento concomitante con otros medicamentos serotoninérgicos como ISRS/IRSN, o con medicamentos conocidos por aumentar las concentraciones de aripiprazol (ver sección 4.8). Interacción de aripiprazol con otros medicamentos En ensayos clínicos, dosis de aripiprazol de 10-30 mg/día no tuvieron efectos significativos sobre el metabolismo de los substratos CYP2D6 (índice dextrometorfano/3-metoximorfinano), CYP2C9 (warfarina), CYP2C19 (omeprazol) y CYP3A4 (dextrometorfano). Además aripiprazol y dehidro-aripiprazol no modifican el metabolismo mediado por CYP1A2, in vitro. Por lo tanto, es improbable que aripiprazol provoque interacciones medicamentosas clínicamente importantes mediadas por estos enzimas. Cuando se administra aripiprazol conjuntamente con valproato, litio o lamotrigina, no se han encontrado cambios clínicamente significativos en las concentraciones de valproato, litio o lamotrigina. 4.6 Fertilidad, embarazo y lactancia Embarazo: No hay ensayos en mujeres embarazadas bien controlados y adecuados con aripiprazol. Se han notificado anomalías congénitas; sin embargo, no se ha podido establecer una relación causal con aripiprazol. Los estudios realizados en animales, no pueden excluir el desarrollo potencial de toxicidad. Las pacientes deben comunicar a su médico si están embarazadas o tienen intención de quedarse embarazadas durante el tratamiento con aripiprazol. Debido a información de seguridad insuficiente en humanos y datos inciertos en estudios de reproducción animal, este medicamento no debe utilizarse en el embarazo, a menos que el beneficio esperado justifique claramente un riesgo potencial en el feto. Los recién nacidos expuestos a antipsicóticos (como aripiprazol) durante el tercer trimestre de embarazo están en peligro de sufrir reacciones adversas como síntomas extrapiramidales y/o síndromes de abstinencia que pueden variar en gravedad y duración tras la exposición. Se han notificado casos de síntomas de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o alteraciones alimenticias. Por consiguiente, se debe vigilar estrechamente a los recién nacidos. Lactancia: Aripiprazol se excreta en la leche materna humana. Se debe advertir a las pacientes que no den el pecho si están tomando aripiprazol. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas Al igual que otros antipsicóticos, los pacientes deben tener cuidado al utilizar máquinas peligrosas, incluyendo vehículos a motor, hasta que tengan la certeza de que aripiprazol no les afecta negativamente. Algunos pacientes pediátricos con Trastorno Bipolar I tienen una mayor incidencia de somnolencia y fatiga (ver sección 4.8). 4.8 Reacciones adversas Resumen del perfil de seguridad: Las reacciones adversas notificadas con más frecuencia en los ensayos controlados con placebo son acatisia y náuseas manifestándose cada una en más del 3% de los pacientes tratados con aripiprazol oral. Tabla de reacciones adversas Las siguientes reacciones adversas se producen con más frecuencia (≥ 1/100) que con placebo, o fueron identificadas como reacciones adversas de posible relevancia médica (*). La frecuencia de reacciones adversas listadas a continuación se definen siguiendo la siguiente clasificación: frecuentes (≥ 1/100 a < 1/10) y poco frecuentes (≥ 1/1.000 a < 1/100). Trastornos psiquiátricos: Frecuentes: agitación, insomnio, ansiedad Poco frecuentes: depresión* Trastornos del sistema nervioso: Frecuentes: trastorno extrapiramidal, acatisia, temblor, vértigo, somnolencia, sedación, cefalea Trastornos oculares: Frecuentes: visión borrosa Trastornos cardíacos: Poco frecuentes: taquicardia* Trastornos vasculares: Poco frecuentes: hipotensión ortostática* Trastornos gastrointestinales Frecuentes: dispepsia, vómitos, náuseas, estreñimiento, hipersecreción salivar Trastornos generales y alteraciones en el lugar de administración: Frecuentes: fatiga Descripción de reacciones adversas seleccionadas Síntomas extrapiramidales (SEP) Esquizofrenia: en un ensayo controlado a largo plazo de 52 semanas, los pacientes tratados con aripiprazol tuvieron una incidencia global menor (25,8%) de SEP incluyendo parkinsonismo, acatisia, distonía y discinesia, comparados con aquellos tratados con haloperidol (57,3%). En un ensayo controlado con placebo a largo plazo, de 26 semanas, la incidencia de SEP fue de 19% para pacientes tratados con aripiprazol y 13,1% para pacientes tratados con placebo. En otro ensayo controlado a largo plazo de 26 semanas, la incidencia de SEP fue de 14,8% para pacientes tratados con aripiprazol y 15,1% para pacientes tratados con olanzapina. Episodios maníacos en Trastorno Bipolar I: en un ensayo controlado de 12 semanas de duración, la incidencia de SEP fue de 23,5% en pacientes tratados con aripiprazol y de 53,3% en pacientes tratados con haloperidol. En otro ensayo, también de 12 semanas de duración, la incidencia de SEP fue de 26,6% en pacientes tratados con aripiprazol y de 17,6% para aquellos tratados con litio. En la fase de mantenimiento a largo plazo de 26 semanas de duración de un ensayo controlado con placebo, la incidencia de SEP fue de 18,2% en pacientes tratados con aripiprazol y de 15,7% en pacientes tratados con placebo. Acatisia En ensayos controlados con placebo, la incidencia de acatisia en pacientes con trastorno bipolar fue de 12,1% en los tratados con aripiprazol y de 3,2% en aquellos que recibieron placebo. En pacientes con esquizofrenia la incidencia de acatisia fue de 6,2% para aripiprazol y de 3,0% para placebo. Distonía Efecto de clase: en individuos susceptibles y durante los primeros días de tratamiento pueden producirse los síntomas de distonía, contracciones prolongadas anormales de grupos de músculos. Los síntomas de distonía incluyen: espasmo de los músculos del cuello, progresando a veces a contracción de la garganta, dificultad para tragar, dificultad para respirar, y/o protrusión de la lengua. Aunque estos síntomas pueden producirse a bajas dosis, ocurren más frecuentemente y con mayor gravedad con fármacos antipsicóticos de primera generación de alta potencia y a mayores dosis. Se observa un elevado riesgo de distonía en los grupos de varones y edades más jóvenes. La comparación entre aripiprazol y placebo en aquella proporción de pacientes que experimentan potencialmente cambios clínicamente significativos en los parámetros lipídicos y rutinarios de laboratorio no revelan ninguna diferencia médica importante. Se observaron aumentos de CPK (Creatina Fosfoquinasa), generalmente transitorios y asintomáticos, en el 3,5% de pacientes tratados con aripiprazol en comparación al 2,0% de pacientes que recibieron placebo. Otros hallazgos Se han notificado reacciones adversas durante el tratamiento con aripiprazol que son conocidos en asociación con la terapia antipsicótica, incluyendo el síndrome neuroléptico maligno, discinesia tardía, convulsiones, reacciones adversas cerebrovasculares y aumento de mortalidad en pacientes ancianos con demencia, hiperglucemia y diabetes mellitus (ver sección 4.4). Población pediátrica Esquizofrenia en adolescentes de 15 años o más En un ensayo controlado con placebo a corto plazo en 302 adolescentes (13-17 años) con esquizofrenia, la frecuencia y el tipo de efectos indeseables fueron similares a los de los adultos, excepto las siguientes reacciones que se manifestaron con más frecuencia en adolescentes que en los adultos que recibieron aripiprazol (y con más frecuencia que con placebo): somnolencia/sedación y trastorno extrapiramidal fueron notificadas como muy frecuentes (≥ 1/10), y sequedad de boca, aumento del apetito, e hipotensión ortostática fueron notificados como frecuentes (≥ 1/100 a < 1/10). El perfil de seguridad en un ensayo abierto de 26 semanas fue similar al del ensayo controlado con placebo a corto plazo. En la población de adolescentes con esquizofrenia (13-17 años) con exposición de hasta 2 años, la incidencia de niveles séricos de prolactina bajos en mujeres (< 3 ng/ml) y en hombres (< 2 ng/ml) fue 29,5% y 48,3%, respectivamente. En la población adolescente con esquizofrenia (13-17 años) con exposición al aripiprazol de 5 a 30 mg hasta por 72 meses, la incidencia de bajos niveles de prolactina en suero en mujeres (< 3 ng/ml) y hombres (< 2 ng/ml) fue de 25,6 % y 45,0 %, respectivamente. Episodios maníacos en el Trastorno Bipolar I en adolescentes de 13 años o más: La frecuencia y el tipo de efectos indeseables en adolescentes con Trastorno Bipolar I fueron similares a los de los adultos excepto por las siguientes reacciones: muy frecuentes (≥ 1/10) somnolencia (23,0%), trastorno extrapiramidal (18,4%), acatisia (16,0%), y fatiga (11,8%); y frecuentes (≥ 1/100, < 1/10) dolor abdominal superior, aumento de la frecuencia cardíaca, aumento de peso, aumento del apetito, fasciculaciones musculares y disquinesia. Los siguientes efectos indeseables tuvieron una posible relación de dosis respuesta; trastorno extrapiramidal (las incidencias con 10 mg fueron 9,1%, con 30 mg 28,8%, con placebo 1,7%); y acatisia (las incidencias con 10 mg fueron 12,1%, con 30 mg 20,3%, con placebo 1,7%). Los cambios medios de peso en adolescentes con Trastorno Bipolar I a las 12 y 30 semanas con aripiprazol fueron 2,4 kg y 5,8 kg, y con placebo 0,2 kg y 2,3 kg respectivamente. En la población pediátrica la somnolencia y fatiga se observaron con mayor frecuencia en pacientes con trastorno bipolar que en pacientes con esquizofrenia. En la población pediátrica bipolar (10-17 años) con exposición de hasta 30 semanas, la incidencia de niveles séricos de prolactina bajos en mujeres (< 3 ng/ml) y en hombres (< 2 ng/ml) fue 28,0% y 53,3%, respectivamente. Post-comercialización Se han notificado las siguientes reacciones adversas durante la vigilancia post-comercialización. Se desconoce la frecuencia de estos efectos (no se puede estimar a partir de los datos disponibles). Trastornos de la sangre y del sistema linfático: leucopenia, neutropenia, trombocitopenia Trastornos del sistema inmunológico: reacciones alérgicas (por ejemplo, reacción anafiláctica, angioedema con inflamación de la lengua, edema en la lengua, edema en la cara, prurito, o urticaria) Trastornos endrocrinos: hiperglicemia, diabetes mellitus, cetoacidosis diabética, coma diabético hiperosmolar Trastornos del metabolismo y de la nutrición: aumento de peso, pérdida de peso, anorexia, hiponatremia Trastornos psiquiátricos: agitación, nerviosismo, adicción al juego; intento de suicidio, ideación suicida y suicidio consumado (ver sección 4.4) Trastornos del sistema nervioso: trastornos del lenguaje, síndrome neuroléptico maligno (SNM), convulsiones tonicoclónicas generalizadas, síndrome serotoninérgico Trastornos cardiacos: prolongación del intervalo QT, arritmia ventricular, muerte súbita inexplicada, paro cardíaco, torsades de pointes, bradicardia Trastornos vasculares: síncope, hipertensión, tromboembolismo venoso (incluyendo embolia pulmonar y trombosis venosa profunda) Trastornos respiratorios, torácicos y mediastínicos: espasmo orofaríngeo, laringoespasmo, neumonía de aspiración Trastornos gastrointestinales: pancreatitis, disfagia, molestia abdominal, malestar de estómago, diarrea Trastornos hepatobiliares: fallo hepático, ictericia, hepatitis, aumento de alanina aminotransferasa (ALT), aumento de aspartato aminotransferasa (AST), aumento de la gamma glutamil transferasa (GGT), aumento de la fosfatasa alcalina Trastornos de la piel y del tejido subcutáneo: erupción cutánea, reacción de fotosensibilidad, alopecia, hiperhidrosis Trastornos musculoesqueléticos y del tejido conjuntivo: rabdomiólisis, mialgia, rigidez Embarazo, puerperio y enfermedades perinatales: síndrome de abstinencia neonatal (ver sección 4.6) Trastornos renales y urinarios: incontinencia urinaria, retención urinaria Trastornos del aparato reproductor y de la mama: priapismo Trastornos generales y alteraciones en el lugar de administración: trastorno de la regulación de la temperatura (por ejemplo, hipetermia, pirexia), dolor torácico, edema periférico Exploraciones complementarias: aumento de la creatina fosfoquinasa, aumento de los niveles de glucosa en sangre, fluctuación de los niveles de glucosa en sangre, aumento de la hemoglobina glicosilada Notificación de sospechas de reacciones adversas Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es. 4.9 Sobredosis Signos y síntomas En ensayos clínicos y durante la experiencia post-comercialización se ha identificado sobredosis aguda involuntaria o voluntaria con solo aripiprazol, en pacientes adultos con dosis notificadas estimadas de hasta 1260 mg sin ningún desenlace fatal. Los signos y síntomas de potencial importancia clínica observados incluyeron letargia, aumento de la presión sanguínea, somnolencia, taquicardia, náuseas, vómitos y diarrea. Además, se han recibido informes de sobredosis involuntaria accidental con solo aripiprazol (hasta 195 mg) en niños sin ningún desenlace fatal. Los signos y síntomas médicos potencialmente graves notificados incluyeron somnolencia, pérdida del conocimiento transitorio y síntomas extrapiramidales. Manejo de una sobredosis El tratamiento de la sobredosis debe concentrarse en una terapia de sostén, manteniendo una adecuada aireación, oxigenación y ventilación, y tratamiento sintomático. Se debe considerar la posibilidad de múltiples medicamentos implicados. Entonces, se debe empezar inmediatamente la monitorización cardiovascular y se debe incluir la monitorización electrocardiográfica continua para detectar posibles arritmias. En cualquier confirmación o sospecha de sobredosis con aripiprazol, la monitorización y supervisión médica debe continuar hasta la recuperación del paciente. Carbón activado (50 g) administrado una hora después de aripiprazol, disminuyó la Cmax en 41% y el AUC de aripiprazol en el 51%, esto sugiere que el carbón puede ser eficaz en el tratamiento de la sobredosis. Hemodiálisis: Aunque no hay información sobre los efectos de la hemodiálisis al tratar una sobredosis de aripiprazol, es improbable que sea útil en el tratamiento de la sobredosis dado que aripiprazol presenta una fuerte unión a proteínas plasmáticas. 5. DATOS FARMACÉUTICOS 5.1 Lista de excipientes Aripiprazol Kern Pharma 10 mg comprimidos bucodispersables: Xilitol (E-967), carmelosa sódica, celulosa microcristalina silicificada, croscarmelosa sódica, ácido tartárico (E-334), aspartamo (E-951), aroma de vainilla (contiene maltodextrina y goma arábiga), estearato de magnesio y óxido de hierro rojo (E-172) Aripiprazol Kern Pharma 15 mg comprimidos bucodispersables: Xilitol (E-967), carmelosa sódica, celulosa microcristalina silicificada, croscarmelosa sódica, ácido tartárico (E-334), aspartamo (E-951), aroma de vainilla (contiene maltodextrina y goma arábiga), estearato de magnesio y óxido de hierro amarillo (E-172) 5.2 Incompatibilidades No procede. 5.3 Periodo de validez 30 meses 5.4 Precauciones especiales de conservación No requiere condiciones especiales de conservación. 5.5 Naturaleza y contenido del envase Los comprimidos se acondicionan en blísters de aluminio/aluminio. Tamaños de envase: Se presenta en envases normales de 28 comprimidos. Y en envases clínicos de 100 comprimidos. Puede que solamente estén comercializados algunos tamaños de envases. 5.6 Precauciones especiales de eliminación La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN KERN PHARMA, S.L. Venus, 72 - Pol. Ind. Colón II 08228 Terrassa - Barcelona - España NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN Aripiprazol Kern Pharma 10 mg comprimidos bucodispersables EFG, nº reg. 79.154 Aripiprazol Kern Pharma 15 mg comprimidos bucodispersables EFG, nº reg. 79.155 FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Octubre 2014 FECHA DE LA REVISIÓN DEL TEXTO Octubre 20014 PRESENTACIONES DEL PRODUCTO Y PRECIO RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN Medicamento sujeto a prescripción médica. Aportación reducida Visado de inspección en mayores de 75 años. Incluido en la oferta del SNS. Para más información, consultar la Ficha Técnica completa del producto. AAFF_pmsa210x280_Aripiprazol_KERN_020215.indd 4 02/02/15 15:43 Sumario Volumen 8, Número 4/2015 EDITORIAL 197 Un tratamiento integral para el trastorno por déficit de atención e hiperactividad en toda Europa C. Arango ORIGINALES 199 Escala Abreviada de Personalidad y Acontecimientos Vitales para la detección de los intentos de suicidio P. Artieda-Urrutia, D. Delgado-Gómez, D. Ruiz-Hernández, J.M. García-Vega, N. Berenguer, M.A. Oquendo e H. Blasco-Fontecilla 207 La carga de la enfermedad en España 2010: trastornos neurológicos, mentales y re: trastornos neurológicos, mentales y relacionados con el consumo de sustancias E. Lara, N. Garin, A.J. Ferrari, S. Tyrovolas, B. Olaya, L. Sànchez-Riera, H.A. Whiteford y J.M. Haro 218 Curso de la enfermedad y calidad de vida en pacientes mexicanos con psicosis L. Gómez-de-Regil 224 Riesgo de suicidio de hombres internos con condena en centros penitenciarios J. Saavedra y M. López REVISIÓN 232 Comorbilidad entre el trastorno bipolar y los trastornos de la conducta alimentaria E.M. Álvarez Ruiz y L. Gutiérrez-Rojas CARTAS AL DIRECTOR 242 Delírium en la versión en español del DSM-5: ¿más confusión? E. Sepulveda y J.G. Franco 243 La psicosis, una presentación inusual de la tiroiditis de Hashimoto M. Robles-Martínez, A.M. Candil-Cano, E. Valmisa-Gómez de Lara, N. Rodríguez-Fernández, B. López y T. Sánchez-Araña 244 Las voluntades anticipadas en salud mental: hechos y valores S. Ramos Pozón 245 Un nuevo método de valoración de la enfermedad psiquiátrica postraumática J.A. Guija, A. Medina, L. Giner, C. Lledó, A. Marín, J.J. Arechederra y J. Giner 250 Necesidad de mejora en la gestión estadística y proceso de comunicación de los casos de suicidio identificados L. Giner y J.A. Guija AGENDA 252 Agenda Octubre-Diciembre 2015 1. NOMBRE DEL MEDICAMENTO: ADASUVE 9,1 mg polvo para inhalación (unidosis). 2.COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada inhalador de dosis única contiene 10 mg de loxapina y dispensa 9,1 mg de loxapina. 3.FORMA FARMACÉUTICA: Polvo para inhalación (unidosis) (polvo para inhalación). Dispositivo blanco con una boquilla en un extremo y una pestaña que sobresale en el otro extremo. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas: ADASUVE está indicado para el control rápido de la agitación de leve a moderada en pacientes adultos con esquizofrenia o trastorno bipolar. Los pacientes deben recibir tratamiento regular inmediatamente después de controlar los síntomas de agitación aguda. 4.2 Posología y forma de administración: ADASUVE sólo se administrará en un contexto hospitalario y bajo la supervisión de un profesional sanitario. Se deberá disponer de tratamiento broncodilatador con beta-agonistas de acción rápida para tratar posibles efectos adversos respiratorios graves (broncoespasmo). Posología: La dosis inicial recomendada de ADASUVE es 9,1 mg. En caso necesario, se puede administrar una segunda dosis a las 2 horas de la primera. No se administrarán más de dos dosis. Se puede administrar una dosis menor, de 4,5 mg, si el paciente no toleró la primera dosis de 9,1 mg o si el médico decide que una dosis menor es más adecuada. El paciente debe estar en observación durante la primera hora después de cada dosis para detectar los posibles signos y síntomas del broncoespasmo. Ancianos: No se ha establecido la seguridad y eficacia de ADASUVE en pacientes mayores de 65 años de edad. No se dispone de datos. Insuficiencia renal y/o hepática: ADASUVE no se ha estudiado en pacientes con insuficiencia renal o hepática. No se dispone de datos. Población pediátrica: No se ha establecido la seguridad y eficacia de ADASUVE en niños (menores de 18 años de edad). No se dispone de datos. Forma de administración: Vía inhalatoria. El producto está envasado en una bolsa sellada. Importante: No se sacará el producto de la bolsa hasta que se vaya a usar. Cuando sea necesario, se extraerá el producto de la bolsa. Una vez retirada la pestaña aparecerá una luz verde, que indica que el producto está listo para usar (Nota: una vez retirada la pestaña, el producto debe utilizarse en un plazo de 15 minutos). Para administrar el medicamento, el paciente inhala a través de una boquilla con una inspiración profunda y continuada. Una vez realizada la inhalación, se retirará la boquilla de la boca y se contendrá la respiración unos segundos. El medicamento se habrá administrado cuando la luz verde se apague. Es posible que el dispositivo exterior se caliente durante el uso. Esto es normal. Las instrucciones completas sobre el uso de ADASUVE se encuentran en la sección de información para el profesional sanitario del prospecto. 4.3 Contraindicaciones: Hipersensibilidad al principio activo o a la amoxapina. Pacientes con signos/síntomas respiratorios agudos (p.ej., sibilancias) o con enfermedad activa de las vías respiratorias (como asma o enfermedad pulmonar obstructiva crónica [EPOC] (ver la sección 4.4.) 4.4 Advertencias y precauciones especiales de empleo: Es importante un uso correcto del inhalador ADASUVE para la administración de la dosis completa de loxapina. Los profesionales sanitarios se asegurarán de que el paciente utiliza el inhalador adecuadamente. ADASUVE puede tener una eficacia limitada en los pacientes que están tomando medicamentos concomitantes, principalmente otros antipsicóticos. Broncoespasmo: En ensayos clínicos controlados con placebo realizados en pacientes con asma o EPOC, se ha observado broncoespasmo con mucha frecuencia. Cuando se produjo, normalmente se notificó en los 25 minutos posteriores a la dosis. En consecuencia, se vigilará convenientemente a los pacientes tratados con ADASUVE tras la administración de la dosis. ADASUVE no se ha estudiado en pacientes con otras formas de enfermedad pulmonar. Si se produce broncoespasmo tras el tratamiento con ADASUVE, se puede tratar con un broncodilatador beta-agonista de acción rápida, por ejemplo salbutamol (ver las secciones 4.2 y 4.8). ADASUVE no se volverá a administrar a pacientes que hayan desarrollado algún signo/síntoma respiratorio (ver la sección 4.3). Hipoventilación: Dados los efectos sobre el sistema nervioso central (SNC) de la loxapina, ADASUVE se usará con precaución en los pacientes con afectación respiratoria, como por ejemplo los pacientes con descenso en el nivel de consciencia o pacientes con depresión del SNC por alcoholismo u otros medicamentos de acción central, por ejemplo ansiolíticos, la mayoría de los antipsicóticos, hipnóticos, opiáceos etc. (ver la sección 4.5). Pacientes ancianos con psicosis relacionada con demencia: ADASUVE no se ha estudiado en pacientes ancianos, incluidos los pacientes con psicosis relacionada con demencia. En los estudios clínicos realizados con medicamentos antipsicóticos atípicos y convencionales se ha demostrado que los pacientes ancianos con psicosis relacionada con demencia presentan un mayor riesgo de muerte frente a los tratados con placebo. ADASUVE no está indicado para el tratamiento de pacientes con psicosis relacionada con demencia. Síntomas extrapiramidales: Los síntomas extrapiramidales (como la distonía aguda) son efectos de clase conocidos de los antipsicóticos. ADASUVE se utilizará con precaución en pacientes con historial conocido de síntomas extrapiramidales. Discinesia tardía: Si aparecen signos y síntomas de discinesia tardía en un paciente en tratamiento con loxapina debe considerarse la interrupción del mismo. Estos síntomas pueden empeorar temporalmente o incluso aparecer tras la interrupción del tratamiento. Síndrome neuroléptico maligno (SNM): Las manifestaciones clínicas del SNM son hiperpirexia, rigidez muscular, estado mental alterado y signos de inestabilidad autónoma (pulso o tensión arterial irregulares, taquicardia, diaforesis y disritmia cardíaca). Otros signos pueden incluir niveles elevados de creatinina fosfoquinasa, mioglobinuria (rabdomiolisis) e insuficiencia renal aguda. Si un paciente desarrolla signos y síntomas indicativos de SNM o presenta fiebre alta sin razón aparente sin otras manifestaciones clínicas de SNM, se debe suspender el tratamiento con ADASUVE. Hipotensión: Se ha referido hipotensión leve en ensayos clínicos de corta duración (24 horas) y controlados con placebo en pacientes agitados tratados con ADASUVE. Si se requiere la administración de vasopresores, se prefiere utilizar noradrenalina o fenilefrina. No se recomienda el uso de adrenalina, ya que la estimulación de los beta-adrenoceptores puede empeorar la hipotensión en el contexto de un bloqueo parcial de los alfa-adrenoceptores inducido por loxapina (ver la sección 4.5.). Cardiovasculares: No se dispone de datos sobre el uso de ADASUVE en pacientes con enfermedades cardiovasculares subyacentes. No se recomienda su uso en pacientes con enfermedad cardiovascular conocida (antecedentes de infarto de miocardio o cardiopatía isquémica, insuficiencia cardíaca o anomalías de la conducción), enfermedad cerebrovascular o afecciones que predispondrían a los pacientes a sufrir hipotensión (deshidratación, hipovolemia y tratamiento con medicamentos antihipertensores). Intervalo QT: La prolongación clínicamente relevante del intervalo QT no parece estar asociada a dosis únicas o repetidas de ADASUVE. Se debe actuar con precaución cuando ADASUVE se administra a pacientes con enfermedad cardiovascular conocida o historia familiar de prolongación del intervalo QT, y en uso concomitante con otros medicamentos que pueden prolongar el intervalo QT. Se desconoce el posible riesgo de prolongación de QTc debido a la interacción con medicamentos que se sabe que pueden prolongar el intervalo QTc. Crisis/Convulsiones: La loxapina se utilizará con precaución en pacientes con historial conocido de convulsiones, ya que disminuye el umbral de las convulsiones. Se han referido crisis en pacientes tratados con loxapina oral a niveles de dosis antipsicóticas y se pueden producir en pacientes epilépticos,incluso aunque se mantenga la terapia con fármacos anticonvulsivos de rutina (ver la sección 4.5). Actividad anticolinérgica: Dada la acción anticolinérgica, ADASUVE se administrará con precaución en pacientes con glaucoma o tendencia a retención de orina, en particular con la administración concomitante de medicamentos antiparkinsonianos de tipo anticolinérgico. Intoxicación o enfermedad física (delirio): No se ha evaluado la seguridad y eficacia de ADASUVE en pacientes con agitación por intoxicación o enfermedad física (delirio). ADASUVE se utilizará con precaución en pacientesintoxicados o con delirio (ver la sección 4.5). 4.5 Interacción con otros medicamentos y otras formas de interacción: La administración concomitante de benzodiacepinas u otros hipnosedantes o depresores respiratorios se puede asociar a una sedación excesiva y a depresión o fallo respiratorio. Si se considera necesario administrar benzodiacepinas además de loxapina, se debe monitorizar que no se produzca una sedación excesiva o hipotensión ortostática en los pacientes. Un estudio de loxapina inhalada y 1 mg de lorazepam intramuscular en combinación mostró efectos no significativos en la frecuencia respiratoria, la oximetría de pulso, la presión arterial o la frecuencia cardíaca comparado con cualquiera de los dos medicamentos administrados individualmente. No se han estudiado dosis superiores de lorazepam. Los efectos de la combinación en la sedación parecen ser aditivos. Potencial de que ADASUVE afecte a otros medicamentos .No cabe esperar que la loxapina produzca interacciones farmacocinéticas clínicamente importantes con medicamentos que o bien se metabolizan a través de isoenzimas del citocromo P450 (CYP450) o son glucoronizados por las uridin 5’-difosfoglucoronosil transferasas humanas (UGTs).Se recomienda actuar con precaución si se combina loxapina con otros medicamentos que se sabe que disminuyen el umbral de las convulsiones, por ejemplo fenotiazinas o butirofenonas, clozapina, antidepresivos tricíclicos o inhibidores selectivos de la recaptación de serotonina (ISRS), tramadol, mefloquina (ver la sección 4.4). En estudios in vitro se ha indicado que loxapina no es sustrato de la glicoproteína P (P-gp), pero sí la inhibe. No obstante, a concentraciones terapéuticas no se cree que inhiba el transporte mediado por la P-gp de otros medicamentos de un modo clínicamente significativo. Dado que los principales efectos de loxapina son sobre el SNC, ADASUVE se utilizará con precaución en combinación con alcohol u otros medicamentos de acción central, por ejemplo ansiolíticos, la mayoría de los antipsicóticos, hipnóticos, opiáceos etc. El uso de loxapina en pacientes con intoxicación por alcohol o medicamentos (prescritos o ilícitos) no se ha evaluado. La loxapina puede producir depresión respiratoria grave si se combina con otros depresores del SNC (ver la sección 4.4). Potencial de que otros medicamentos afecten a ADASUVE. La loxapina es un sustrato de las monooxigenasas que contienen flavina (FMO) y de varias isoenzimas del citocromo CYP450. Por tanto, el riesgo de interacciones metabólicas causadas por un efecto sobre una isoforma individual es limitado. Se debe actuar con precaución en pacientes en tratamiento concomitante con otros medicamentos inhibidores o inductores de estas enzimas, en concreto si se sabe que el medicamento concomitante inhibe o induce varias de las enzimas implicadas en el metabolismo de la loxapina. Dichos medicamentos pueden modificar la eficacia y la seguridad de ADASUVE de un modo irregular. Si es posible, se evitará el uso concomitante de inhibidores de CYP1A2 (p. ej., fluvoxamina, ciprofloxacino, enoxacino, propranolol y refecoxib) Adrenalina La administración conjunta de loxapina y adrenalina puede dar lugar a un empeoramiento de la hipotensión (ver la sección 4.4) 4.6 Fertilidad, embarazo y lactancia: Embarazo: Los recién nacidos expuestos repetidamente a antipsicóticos durante el tercer trimestre del embarazo presentan riesgo de reacciones adversas, incluyendo síntomas extrapiramidales y/o de abstinencia de gravedad y duración variable tras el parto. Se han notificado casos de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o alteraciones alimenticias. Por consiguiente, se debe considerar vigilar estrechamente a los recién nacidos. ADASUVE solo se usará durante el embarazo si el beneficio potencial justifica el posible riesgo para el feto. Lactancia: Se desconoce la magnitud de la excreción de loxapina o sus metabolitos en la leche materna. No obstante, se ha demostrado que loxapina y sus metabolitos son transportados en la leche de perras lactantes. Se recomienda que las mujeres no amamanten durante un periodo de 48 horas tras la administración de loxapina y que desechen la leche producida durante ese periodo. Fertilidad: No se dispone de datos específicos sobre la fertilidad en seres humanos. Se sabe que en seres humanos, el tratamiento prolongado con antipsicóticos puede conducir a pérdida de la libido y amenorrea. En ratas hembra se han observado efectos sobre la reproducción (ver la sección 5.3). 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas: No se han realizado estudios de los efectos de loxapina sobre la capacidad de conducir y utilizar máquinas. Dado que puede causar somnolencia / sedación, fatiga o mareos, los pacientes no deberán manejar maquinaria peligrosa,incluidos vehículos a motor, hasta que estén razonablemente seguros de que la loxapina no les afecta de forma negativa (ver la sección 4.8.). La influencia de ADASUVE sobre la capacidad para conducir y utilizar máquinas es muy grande. 4.8 Reacciones adversas: Resumen del perfil de seguridad: La evaluación de las reacciones adversas a partir de datos de estudios clínicos se basa en dos ensayos clínicos de fase 3 y uno de fase 2A de corta duración (24 horas) y controlados con placebo, que reclutaron 524 pacientes adultos con agitación asociada a esquizofrenia (incluyendo 27 pacientes con trastorno esquizoafectivo) o trastorno bipolar, tratados con ADASUVE 4,5 mg (265 pacientes) o ADASUVE 9,1 mg (259 pacientes). En estudios con pacientes agitados se notificó broncoespasmo como una reacción adversa infrecuente pero grave, mientras que en pacientes con enfermedad activa de las vías respiratorias, fue frecuente y a menudo requirió tratamiento con un broncodilatador beta-agonista de acción rápida. Las reacciones adversas notificadas más frecuentemente durante el tratamiento con ADASUVE fueron disgeusia, sedación/somnolencia y mareos (los mareos fueron más habituales tras el tratamiento con placebo que con loxapina). Lista tabulada de reacciones adversas: Las reacciones adversas indicadas a continuación se clasifican usando la convención siguiente: muy frecuentes (≥1/10), frecuentes (≥1/100 a <1/10), poco frecuentes (≥1/1.000 a <1/100), raras (≥1/10.000 a <1/1.000), muy raras (<1/10.000). Tabla 1: Reacciones adversas: Clasificación MedDRA por órganos y sistemas: Trastornos del sistema nervioso. Muy frecuentes: sedación /somnolencia. Frecuentes: mareos. Poco frecuentes: distonía, discinesia, oculogiria, temblor, acatisia/inquietud. Trastornos vasculares: Poco frecuentes: hipotensión. Trastornos respiratorios, torácicos y mediastínicos. Frecuentes: irritación de garganta. Poco frecuentes: broncoespasmo(incluida disnea). Trastornos gastrointestinales: Muy frecuentes: disgeusia. Frecuentes: sequedad de boca. Trastornos generales y alteraciones en el lugar de administración. Frecuentes: fatiga. Descripción de reacciones adversas seleccionadas: Broncoespasmo: En ensayos clínicos de corta duración (24 horas) y controlados con placebo en pacientes con agitación asociada a esquizofrenia o trastorno bipolar sin enfermedad activa de las vías respiratorias el broncoespasmo (que incluye notificaciones de sibilancias, disnea o tos) fue poco frecuente en los pacientes tratados con ADASUVE. No obstante, en los ensayos clínicos controlados con placebo en pacientes con asma persistente de leve a moderada o con EPOC de moderada a grave, las reacciones adversas de broncoespasmo fueron muy frecuentes. La mayoría de estos acontecimientos se produjo en los 25 minutos posteriores a la dosis, fueron de gravedad leve a moderada y se pudieron aliviar con un broncodilatador inhalado. Reacciones adversas observadas con el uso de loxapina oral crónica. Con la administración oral crónica de loxapina se notificaron reacciones adversas entre las que se incluyen sedación y somnolencia, síntomas extrapiramidales (p. ej., temblor, acatisia, rigidez y distonía), efectos cardiovasculares (p. ej., taquicardia, hipotensión, hipertensión, hipotensión ortostática, mareos y síncope) y efectos anticolinérgicos (p. ej., xeroftalmia, visión borrosa y retención urinaria). 4.9 Sobredosis: No se han notificado casos de sobredosis con ADASUVE en los estudios clínicos. En caso de sobredosis accidental, los signos y síntomas dependerán del número de unidades tomadas y de la tolerabilidad de cada paciente. Como cabría esperar a partir de las acciones farmacológicas de la loxapina, los hallazgos clínicos pueden variar desde depresión leve del SNC y del sistema cardiovascular a hipotensión profunda, depresión respiratoria e inconsciencia (ver la sección 4.4). Debe tenerse en cuenta la posibilidad de que aparezcan síntomas extrapiramidales y/o crisis convulsivas También se ha notificado insuficiencia renal tras sobredosis de loxapina oral. El tratamiento de la sobredosis es esencialmente sintomático y de apoyo. La hipotensión grave podría responder a la administración de noradrenalina o fenilefrina. No se debe usar adrenalina, ya que su uso en pacientes con bloqueo adrenérgico parcial puede reducir más la presión arterial (ver las secciones 4.4 y 4.5.). Las reacciones extrapiramidales graves se tratan con agentes antiparkinsonianos anticolinérgicos o con difenhidramina clorhidrato y se iniciará terapia con anticonvulsivos según esté indicado. Otras medidas incluyen oxígeno y fluidos intravenosos. 5. PROPIEDADES FARMACOLÓGICAS (Ver ficha técnica completa) 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes: Ninguno 6.2 Incompatibilidades: No procede. 6.3 Periodo de validez: 3 años. 6.4 Precauciones especiales de conservación: Conservar en el embalaje original hasta que se vaya a usar con el fin protegerlo de la luz y la humedad.Este medicamento no requiere ninguna temperatura especial de conservación. 6.5 Naturaleza y contenido del envase: ADASUVE se presenta en una bolsa de aluminio multilaminada sellada. ADASUVE 9,1 mg se presenta en una caja de 1 unidad. El inhalador blanco (carcasa) está formado mediante moldeado con policarbonato de calidad médica. 6.6 Precauciones especiales de eliminación: La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN: Alexza UK, Limited, 10 Station Road, Henley-RG91AY Reino Unido 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN: EU/1/13/823/004 9. FECHA DE LA PRIMERA AUTORIZACIÓN /RENOVACIÓN DE LA AUTORIZACIÓN: Fecha de la primera autorización: 20 de febrero de 2013 10. FECHA DE LA REVISIÓN DEL TEXTO: 10/2014. La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu. 11. CON RECETA MÉDICA. Uso Hospitalario. 12. PVL (IVA): 72,8€ ADASUVE® CONTROLA RÁPIDAMENTE LA AGITACIÓN 1-3 3 min. 4 min. 5 min. 6 min. 7 min. 8 min. 9 min. 10 min. Indicado para el tratamiento rápido de la agitación leve-moderada en adultos con esquizofrenia o trastorno bipolar1 minutos Rápido inicio, liberación Tratamiento no invasivo, Fácil de administrar, rápida y fiable1 sin agujas activado por inhalación1 www.ferrerfarma.com VER FICHA TÉCNICA EN PÁGINA 12 1 min. 2 min. Contents Volume 8, Number 4/2015 EDITORIAL 197 A integral treatment for attention deficit hyperactivity disorder in Europe C. Arango ORIGINAL ARTICLES 199 Short Personality and Life Event scale for detection of suicide attempters P. Artieda-Urrutia, D. Delgado-Gómez, D. Ruiz-Hernández, J.M. García-Vega, N. Berenguer, M.A. Oquendo and H. Blasco-Fontecilla 207 The Spanish Burden of Disease 2010: Neurological, mental and substance use disorders E. Lara, N. Garin, A.J. Ferrari, S. Tyrovolas, B. Olaya, L. Sànchez-Riera, H.A. Whiteford and J.M. Haro 218 Illness course and quality of life in Mexican patients with psychosis L. Gómez-de-Regil 224 Risk of suicide in male prison inmates J. Saavedra and M. López REVIEW ARTICLE 232 Comorbidity of bipolar disorder and eating disorders E.M. Álvarez Ruiz and L. Gutiérrez-Rojas LETTERS TO THE EDITOR 242 Delirium in the Spanish version of the DSM-5: More confusion? E. Sepulveda and J.G. Franco 243 Psychosis, an unusual presentation of Hashimoto’s thyroiditis M. Robles-Martínez, A.M. Candil-Cano, E. Valmisa-Gómez de Lara, N. Rodríguez-Fernández, B. López and T. Sánchez-Araña 244 Advance directives in mental health: Facts and values S. Ramos Pozón 245 A new assessment method of posttraumatic psychiatric pathology J.A. Guija, A. Medina, L. Giner, C. Lledó, A. Marín, J.J. Arechederra and J. Giner 250 The necessity of Improvement Statistical Management and Communication of identified suicides L. Giner and J.A. Guija CALENDAR 252 Calendar October–December 2015 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas. 1. NOMBRE DEL MEDICAMENTO Selincro 18 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 18,06 mg de nalmefeno (como dihidrato de hidrocloruro). Excipiente con efecto conocido: cada comprimido recubierto con película contiene 60,68 mg de lactosa. Para consultar la lista completa de excipientes, ver sección 6.1. 3. FORMA FARMACÉUTICA Comprimido recubierto con película (comprimido). Comprimido recubierto con película de color blanco, ovalado, biconvexo, de 6,0 x 8,75 mm y grabado con “S” en una cara. 4. Datos clínicos 4.1 Indicaciones terapéuticas Selincro está indicado para la reducción del consumo de alcohol en pacientes adultos con dependencia del alcohol que presentan un nivel de consumo de alcohol de alto riesgo (NCR) [ver sección 5.1], sin síntomas de abstinencia físicos y que no requieran una desintoxicación inmediata. Selincro solo se debe prescribir junto con apoyo psicosocial mantenido dirigido a incrementar la adherencia al tratamiento y a reducir el consumo de alcohol. El tratamiento con Selincro se debe iniciar únicamente en los pacientes que mantienen un NCR alto dos semanas después de la evaluación inicial. 4.2 Posología y forma de administración Posología En la visita inicial, se deben evaluar el estado clínico, la dependencia del alcohol y el nivel de consumo de alcohol del paciente (según el paciente). Por lo tanto, se debe solicitar al paciente que registre su consumo de alcohol durante aproximadamente dos semanas. En la siguiente visita, se puede iniciar el tratamiento con Selincro en los pacientes que mantienen un NCR alto, (ver sección 5.1) durante este periodo de dos semanas, junto con una intervención psicosocial dirigida a incrementar la adherencia al tratamiento y a reducir el consumo de alcohol. Durante los ensayos clínicos pivotales la principal mejoría se observó durante las 4 primeras semanas. Se debe evaluar la respuesta del paciente al tratamiento y la necesidad de mantener farmacoterapia con regularidad (p. ej., mensualmente) (ver sección 5.1). El médico debe seguir evaluando la evolución del paciente en cuanto a la reducción del consumo de alcohol, el funcionamiento general, la adherencia al tratamiento y los posibles efectos adversos. Se dispone de datos clínicos para el uso de Selincro en condiciones controladas y aleatorizadas para un periodo de 6 a 12 meses. Se recomienda precaución al prescribir Selincro durante más de 1 año. Selincro se toma a demanda: cada día que el paciente perciba un riesgo anticipado de consumo de alcohol debe tomar un comprimido, preferiblemente 1-2 horas antes del momento de consumo. Si el paciente ha empezado a beber alcohol sin haber tomado Selincro, el paciente debería tomar un comprimido lo antes posible. La dosis máxima de Selincro es un comprimido al día. Selincro se puede tomar con o sin alimentos (ver sección 5.2). Poblaciones especiales Población de edad avanzada (≥ 65 años de edad) No se recomienda el ajuste de la dosis para este grupo de pacientes (ver secciones 4.4 y 5.2). Insuficiencia renal No se recomienda el ajuste de la dosis para los pacientes con insuficiencia renal leve o moderada (ver secciones 4.4 y 5.2). Insuficiencia hepática No se recomienda el ajuste de la dosis para los pacientes con insuficiencia hepática leve o moderada (ver secciones 4.4 y 5.2). Población pediátrica No se ha establecido la seguridad y eficacia de Selincro en niños y adolescentes de < 18 años. No se dispone de datos (ver sección 5.1). Forma de administración Selincro es un medicamento que se administra por vía oral. El comprimido recubierto con película se debe tragar entero. El comprimido recubierto con película no se debe dividir ni aplastar porque el nalmefeno puede provocar sensibilización cutánea en contacto directo con la piel (ver sección 5.3). 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Pacientes en tratamiento con agonistas opioides (como analgésicos opioides, opioides para terapia de sustitución con agonistas opioides (por ejemplo metadona) o agonistas parciales (por ejemplo buprenorfina)) (ver sección 4.4). Pacientes con una actual o reciente adicción a opiáceos. Pacientes con síntomas agudos de abstinencia de opiáceos. Pacientes con sospecha de uso reciente de opiáceos. Pacientes con insuficiencia hepática grave (clasificación de Child-Pugh). Pacientes con insuficiencia renal grave (eGFR < 30 ml/min por 1,73 m2). Pacientes con historia reciente de síndrome de abstinencia del alcohol agudo (incluyendo alucinaciones, convulsiones y delirium tremens). 4.4 Advertencias y precauciones especiales de empleo Selincro no está indicado en pacientes cuyo objetivo terapéutico sea la abstinencia inmediata. La reducción del consumo de alcohol es un objetivo intermedio en el camino hacia la abstinencia. Administración de opiáceos En una situación de urgencia en la que se deban administrar opiáceos a un paciente que toma Selincro, la cantidad de opiáceo requerida para lograr el efecto deseado puede ser superior a la habitual. El paciente se debe someter a un estricto control para detectar síntomas de depresión respiratoria como consecuencia de la administración de opiáceos, así como otras reacciones adversas. Si se precisan opiáceos en una urgencia, la dosis siempre se debe ajustar de forma individual. Si se requieren dosis excepcionalmente altas, será necesaria una estrecha observación. El tratamiento con Selincro se debe interrumpir temporalmente 1 semana antes del uso previsto de opiáceos (p. ej., cuando se vayan a utilizar analgésicos opioides en una intervención quirúrgica programada). El médico prescriptor deberá advertir a los pacientes de la importancia de informar a su médico de la última toma de Selincro en caso de que sea necesario el uso de opiáceos. Se debe tener precaución cuando se utilicen medicamentos que contengan opiáceos (p. ej., antitusígenos, analgésicos opioides (ver sección 4.5)). Comorbilidad Trastornos psiquiátricos Se han registrado efectos psiquiátricos en estudios clínicos (ver sección 4.8). Si los pacientes presentan síntomas psiquiátricos no asociados al inicio del tratamiento con Selincro, y/o que no son transitorios, el médico prescriptor deberá considerar otras causas de los síntomas y valorar la necesidad de continuar el tratamiento con Selincro. Selincro no se ha investigado en pacientes con enfermedad psiquiátrica inestable. Se debe proceder con precaución al prescribir Selincro a pacientes con comorbilidad psiquiátrica presente como el trastorno depresivo mayor. Trastornos convulsivos Se dispone de experiencia limitada en pacientes con antecedentes de trastornos convulsivos, incluidas las convulsiones por abstinencia de alcohol. Se recomienda precaución si se inicia un tratamiento para reducir el consumo de alcohol en estos pacientes. Insuficiencia renal o hepática Selincro se metaboliza principalmente en el hígado y se elimina predominantemente por la orina. Por lo tanto, se debe tener precaución cuando se prescriba Selincro a pacientes con insuficiencia renal o hepática leve o moderada, por ejemplo, realizando controles más frecuentes. Se debe proceder con precaución al prescribir Selincro a pacientes con valores altos de ALAT o ASAT (> 3 veces el LSN), ya que estos pacientes fueron excluidos del programa de desarrollo clínico. Pacientes de edad avanzada (≥ 65 años de edad) Se dispone de datos clínicos limitados sobre el uso de Selincro en pacientes ≥ 65 años de edad con dependencia del alcohol. Se debe tener precaución al prescribir Selincro a pacientes ≥ 65 años de edad (ver secciones 4.2 y 5.2). Otras Se recomienda precaución si Selincro se administra conjuntamente con un inhibidor potente de la enzima UGT2B7 (ver sección 4.5). Lactosa Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o problemas de malabsorción de glucosa o galactosa no deben tomar este medicamento. 4.5 Interacción con otros medicamentos y otras formas de interacción No se han llevado a cabo estudios de interacción farmacológica in vivo. Según estudios in vitro, no se prevén interacciones clínicamente relevantes entre el nalmefeno, o sus metabolitos, y medicamentos administrados simultáneamente metabolizados por las enzimas más comunes CYP450 y UGT o transportadores de membrana. La administración conjunta con medicamentos que sean inhibidores potentes de la enzima UGT2B7 (p. ej., diclofenaco, fluconazol, acetato de medroxiprogesterona, ácido meclofenámico) puede aumentar significativamente la exposición a nalmefeno. Es improbable que esto suponga un problema con el uso ocasional, pero si se inicia un tratamiento a largo plazo simultáneo con un inhibidor potente de la UGT2B7, no se puede descartar la posibilidad de un aumento en la exposición a nalmefeno (ver sección 4.4). Por el contrario, la administración conjunta con un inductor de la UGT (p. ej., dexametasona, fenobarbital, rifampicina, omeprazol) puede dar lugar a concentraciones plasmáticas subterapéuticas de nalmefeno. Si se toma Selincro de manera simultánea con agonistas opioides (p. ej., algunos tipos de antitusígenos y antigripales, determinados antidiarreicos, y analgésicos opioides), puede que el paciente no se beneficie del agonista opioide. No existe ninguna interacción farmacocinética clínicamente relevante entre el nalmefeno y el alcohol. Se produce un pequeño deterioro en la función cognitiva y psicomotora tras la administración de nalmefeno. No obstante, el efecto de la combinación de nalmefeno y alcohol no superó la suma de los efectos de cada uno de ellos por separado. El consumo simultáneo de alcohol y Selincro no previene los efectos de la intoxicación del alcohol. 4.6 Fertilidad, embarazo y lactancia Embarazo No hay datos o estos son limitados (menos de 300 resultados en embarazos) relativos al uso de nalmefeno en mujeres embarazadas. Los estudios en animales han mostrado toxicidad en la reproducción (ver sección 5.3). No se recomienda Selincro durante el embarazo. Lactancia Los datos farmacodinámicos/toxicológicos disponibles en animales muestran que nalmefeno/ metabolitos se excretan en la leche (ver sección 5.3). Se desconoce si nalmefeno se excreta en la leche materna. No se puede excluir el riesgo en recién nacidos/lactantes. Se debe decidir si es necesario interrumpir la lactancia o interrumpir/abstenerse de iniciar el tratamiento con Selincro tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre. Fertilidad En estudios de fertilidad en ratas, no se observaron efectos de nalmefeno sobre la fertilidad, el apareamiento, el embarazo o los parámetros espermáticos. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas No se ha estudiado la influencia de nalmefeno sobre la capacidad para conducir y utilizar máquinas. Selincro puede provocar reacciones adversas como náuseas, mareo, insomnio y cefalea. La mayoría de estas reacciones fueron leves o moderadas, relacionadas con el inicio del tratamiento y tuvieron una corta duración. La influencia de Selincro sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. 4.8 Reacciones adversas Resumen del perfil de seguridad Más de 3.000 pacientes han sido expuestos a nalmefeno en estudios clínicos. En general, el perfil de seguridad concuerda en todos los estudios clínicos realizados. Las frecuencias de las reacciones adversas en la Tabla 1 se calcularon basándose en tres estudios aleatorizados, a doble ciego y controlados con placebo en pacientes con dependencia del alcohol (1.144 pacientes expuestos a Selincro a demanda y 797 expuestos a placebo a demanda). Las reacciones adversas más frecuentes fueron náuseas, mareo, insomnio y cefalea. La mayoría de estas reacciones fueron leves o moderadas, estuvieron relacionadas con el inicio del tratamiento y tuvieron una corta duración. En los estudios clínicos se comunicaron estados confusionales y, en raras ocasiones, alucinaciones y disociación. La mayoría de estas reacciones fueron leves o moderadas, estuvieron relacionadas con el inicio del tratamiento y tuvieron una corta duración (de unas pocas horas a unos pocos días). La mayoría de estas reacciones adversas se resolvieron con el tratamiento continuo y no recurrieron con la administración repetida. Si bien estos acontecimientos tuvieron generalmente una corta duración, podrían tratarse de psicosis alcohólica, síndrome de abstinencia alcohólica o enfermedad psiquiátrica comórbida. Tabla de reacciones adversas Las frecuencias se definen como: muy frecuentes (≥1/10), frecuentes (≥1/100 a <1/10), poco frecuentes (≥1/1.000 a <1/100), raras (≥1/10.000 a <1/1.000), muy raras (<1/10.000) o frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Notificación de sospechas de reacciones adversas Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es. 4.9 Sobredosis En un estudio en pacientes diagnosticados de ludopatía, se investigaron dosis de nalmefeno de hasta 90 mg/día durante 16 semanas. En un estudio en pacientes con cistitis intersticial, 20 pacientes recibieron 108 mg/día de nalmefeno durante más de 2 años. Se ha registrado la toma de una dosis única de 450 mg de nalmefeno sin cambios en la tensión arterial, la frecuencia cardiaca y respiratoria o la temperatura corporal. No se ha observado un patrón atípico de reacciones adversas en estos contextos, si bien la experiencia es limitada. En caso de sobredosis, se recomienda realizar un tratamiento sintomático y someter al paciente a observación. 5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas Grupo farmacoterapéutico: Otros fármacos del sistema nervioso utilizados en la dependencia del alcohol. Código ATC: N07BB05 Mecanismo de acción El nalmefeno es un modulador del sistema opioide con un perfil definido de receptores μ, δ y κ. - Estudios in vitro han demostrado que el nalmefeno es un ligando selectivo de los receptores opioides con actividad antagonista en los receptores μ y δ y actividad agonista parcial en el receptor κ. - Estudios in vivo han demostrado que el nalmefeno reduce el consumo de alcohol, posiblemente como resultado de la modulación de las funciones corticomesolímbicas. Los datos de estudios no clínicos, estudios clínicos y literatura médica no indican ninguna forma de posible dependencia o abuso de Selincro. Eficacia clínica y seguridad En dos estudios de eficacia se evaluó la eficacia de Selincro en la reducción del consumo de alcohol en pacientes con dependencia del alcohol (DSM-IV). Se excluyó a los pacientes con antecedentes de delirium tremens, alucinaciones, convulsiones, comorbilidad psiquiátrica significativa, o alteraciones significativas de la función hepática así como a aquellos que presentaban síntomas de abstinencia físicos apreciables en la selección o la aleatorización. La mayoría (80%) de los pacientes incluidos tenían un NCR alto o muy alto (consumo de alcohol > 60 g/día en hombres y > 40 g/día en mujeres según los NCR de alcohol de la OMS) en la selección, y de estos el 65% mantuvieron un NCR alto o muy alto entre la selección y la aleatorización. Ambos estudios fueron aleatorizados, a doble ciego, con grupos paralelos y controlados con placebo, y al cabo de 6 meses de tratamiento, los pacientes que recibieron Selincro se volvieron a aleatorizar para recibir placebo o Selincro durante un periodo de lavado final de 1 mes. La eficacia de Selincro también se evaluó en un estudio aleatorizado, a doble ciego, con grupos paralelos, controlado con placebo y de 1 año de duración. En conjunto, en los estudios participaron 1.941 pacientes, de los cuales 1.144 fueron tratados con Selincro 18 mg a demanda. En la visita inicial se evaluaron el estado clínico, la situación social y el patrón de consumo de alcohol de los pacientes (según la información del paciente). En la visita de aleatorización, que tuvo lugar al cabo de 1 a 2 semanas se reevaluó el NCR, y se inició el tratamiento con Selincro junto con una intervención psicosocial (BRENDA) dirigida a incrementar la adherencia al tratamiento y a reducir el consumo de alcohol. Selincro se prescribió a demanda, y los pacientes lo tomaron, de promedio, aproximadamente la mitad de los días. La eficacia de Selincro se evaluó utilizando dos criterios de valoración principales: el cambio desde la visita basal al mes 6 en el número de días de consumo excesivo de alcohol (DCE) al mes y el cambio desde la visita basal al mes 6 en el consumo de alcohol total diario (CAT). Un DCE se definió como un día con un consumo ≥ 60 g de alcohol puro en hombres y ≥ 40 g en mujeres. Se produjo una reducción significativa del número de DCE y CAT en algunos pacientes en el periodo entre la visita inicial (selección) y la aleatorización debido a efectos no farmacológicos. En los estudios 1 (n = 579) y (n = 655) 2, el 18% y el 33% de la población total, respectivamente, redujeron considerablemente su consumo de alcohol en el periodo comprendido entre la selección y la aleatorización. Con respecto a los pacientes con un NCR alto o muy alto en la visita basal, el 35% de los pacientes experimentaron mejorías debido a los efectos no farmacológicos en el período entre la visita inicial (selección) y la aleatorización. En la aleatorización, estos pacientes consumían una cantidad tan baja de alcohol que era poco el margen para seguir mejorando (efecto suelo). Por lo tanto, los pacientes que mantuvieron un NCR alto o muy alto en la aleatorización se definieron a posteriori como la población objetivo. En esta población post hoc, el efecto terapéutico fue mayor en comparación con el de la población total. La eficacia y relevancia clínicas de Selincro se analizaron en pacientes con un NCR alto o muy alto en la selección y la aleatorización. En la visita basal, los pacientes tenían, de promedio, 23 DCE al mes (11% de los pacientes tenían menos de 14 DCE al mes) y consumían 106 g/día. La mayoría de los pacientes tenían una dependencia del alcohol baja (55% con una puntuación de 0 a 13) o intermedia (36% con una puntuación de 14 a 21) según la Escala de Dependencia de Alcohol. Análisis post-hoc de la eficacia en pacientes que mantuvieron un NCR alto o muy alto en la AAFF_SELINCRO_FTA4_110615.indd 1 11/06/15 16:37 Tabla 1: Frecuencias de las reacciones adversas aleatorización En el estudio 1, el porcentaje de abandonos fue más elevado en el grupo de Selincro que en el grupo de placebo (50% frente a 32%, respectivamente). En cuanto a los DCE, se registraron 23 días/mes en la visita basal en el grupo de Selincro (n = 171) y 23 días/mes en la visita basal en el Trastornos del metabolismo y de la nutrición Frecuente Apetito disminuido grupo de placebo (n = 167). Respecto a los pacientes que continuaron en el Trastornos psiquiátricos Muy frecuente Insomnio estudio y proporcionaron datos de eficacia en el mes 6, el número de DCE fue Frecuente Trastorno del sueño de 9 días/mes en el grupo de Selincro (n = 85) y 14 días/mes en el grupo de Estado confusional placebo (n = 114). El CAT fue de 102 g/día en la visita basal en el grupo de Selincro (n = 171) y 99 g/día en la visita basal en el grupo de placebo (n = Inquietud 167). Respecto a los pacientes que continuaron en el estudio y proporcionaron Libido disminuida (incluida la pérdida de líbido) datos de eficacia en el mes 6, el CAT fue de 40 g/día en el grupo de Selincro No conocida Alucinación (incluidas alucinaciones auditivas, alucinaciones (n = 85) y 57 g/día en el grupo de placebo (n = 114). En el estudio 2, el táctiles, alucinaciones visuales y alucinaciones somáticas) porcentaje de abandonos fue superior en el grupo de Selincro que en el grupo Disociación de placebo (30% frente a 28%, respectivamente). En cuanto a los DCE, se Trastornos del sistema nervioso Muy frecuente Mareo registraron 23 días/mes en la visita basal en el grupo de Selincro (n = 148) y 22 días/mes en la visita basal en el grupo de placebo (n = 155). Respecto a Cefalea los pacientes que continuaron en el estudio y proporcionaron datos de Frecuente Somnolencia eficacia en el mes 6, el número de DCE fue de 10 días/mes en el grupo de Temblor Selincro (n = 103) y 12 días/mes en el grupo de placebo (n = 111). El CAT fue de 113 g/día en la visita basal en el grupo de Selincro (n = 148) y 108 g/ Alteración de la atención día en la visita basal en el grupo de placebo (n = 155). Respecto a los Parestesia pacientes que continuaron en el estudio y proporcionaron datos de eficacia Hipoestesia en el mes 6, el CAT fue de 44 g/día en el grupo de Selincro (n = 103) y 52 g/ Trastornos cardiacos Frecuente Taquicardia día en el grupo de placebo (n = 111). Los análisis de respondedores con los datos agrupados de los dos estudios se incluyen en la Tabla 2. Se dispone de Palpitaciones datos limitados sobre Selincro en el periodo de lavado final de 1 mes. Estudio Trastornos gastrointestinales Muy frecuente Náuseas de 1 año En este estudio participaron un total de 665 pacientes: 52% de ellos Frecuente Vómitos tenían un NCR alto o muy alto en la visita basal, y de estos el 52% (que Boca seca representan el 27% de la población total) siguieron teniendo un NCR alto o muy alto en la aleatorización. En esta población objetivo post-hoc, Trastornos de la piel y del tejido subcutáneo Frecuente Hiperhidrosis abandonaron más pacientes que recibían nalmefeno (45%) que aquellos que Trastornos musculoesqueléticos y del tejido conjuntivo Frecuente Espasmos musculares recibían placebo (31%). En cuanto a los DCE, se registraron 19 días/mes en Trastornos generales y alteraciones en el lugar de Frecuente Fatiga la visita basal en el grupo de Selincro (n = 141) y 19 días/mes en la visita administración Astenia basal en el grupo de placebo (n = 42). Respecto a los pacientes que continuaron en el estudio y proporcionaron datos de eficacia al cabo de 1 Malestar general año, el número de DCE fue de 5 días/mes en el grupo de Selincro (n = 78) y Sensación anormal 10 días/mes en el grupo de placebo (n = 29) E l CAT fue de 100 g/día en la Exploraciones complementarias Frecuente Peso disminuido visita basal en el grupo de Selincro (n = 141) y 101 g/día en la visita basal en el grupo de placebo (n = 42). Respecto a los pacientes que continuaron en el estudio y proporcionaron datos de eficacia al cabo de un año, el CAT fue de 24 g/día en el grupo de Selincro (n = 78) y 47 g/día en el grupo de placebo (n = 29). Población pediátrica La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Selincro en los diferentes grupos de la población pediátrica en el tratamiento de la dependencia del alcohol (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica). 5.2 Propiedades farmacocinéticas Absorción El nalmefeno se absorbe rápidamente tras una única administración oral de 18,06 mg, con una concentración máxima (Cmax) de 16,5 ng/ml al cabo de aproximadamente 1,5 horas, y una exposición (AUC) de 131 ng*h/ml. La biodisponibilidad oral absoluta de nalmefeno es del 41%. La administración de alimentos ricos en grasas aumenta la exposición total (AUC) en un 30% y la concentración máxima (Cmax) en un 50%; el tiempo hasta la concentración máxima (tmax) se retrasa 30 minutos (tmax es de 1,5 horas). Se considera poco probable que este cambio tenga relevancia clínica. Distribución La fracción media de nalmefeno unida a proteínas en plasma es de aproximadamente el 30%. El volumen de distribución (Vd/F) estimado es de aproximadamente 3200 l. Los datos de ocupación obtenidos en un estudio PET tras la administración diaria única y repetida de 18,06 mg de nalmefeno muestran un 94-100% de ocupación de los receptores 3 horas después de la administración, lo que indica que el nalmefeno atraviesa fácilmente la barrera hematoencefálica. Biotransformación Tras la administración oral, el nalmefeno sufre un extenso y rápido metabolismo para formar su principal metabolito, el nalmefeno-3-O-glucurónido, siendo la enzima UGT2B7 la principal responsable de la conversión, y con las enzimas UGT1A3 y UGT1A8 como factores contribuyentes secundarios. Un pequeño porcentaje de nalmefeno se convierte en nalmefeno-3-O-sulfato por sulfatación y en nornalmefeno por CYP3A4/5. El nornalmefeno se convierte posteriormente en nornalmefeno 3 O glucurónido y nornalmefeno-3-O-sulfato. Se considera que los metabolitos no contribuyen con un efecto farmacológico significativo sobre los receptores opioides en humanos, salvo en el caso de nalmefeno-3-O-sulfato, que posee una potencia Tabla 2: Resultados de los análisis de respondedores con datos agrupados de pacientes con un NCR alto o muy alto en la comparable a la de nalmefeno. No obstante, el nalmefeno-3-O-sulfato está selección y la aleatorización presente a concentraciones inferiores al 10% de la de nalmefeno, por lo que es muy poco probable que constituya un factor contribuyente principal en el efecto Respuestaa Placebo Nalmefeno Odds ratio (IC del 95%) Valor p farmacológico de nalmefeno. Eliminación El metabolismo por conjugación del 19,9% 25,4% 1,44 (0,97; 2,13) 0,067 CAT R70b glucurónido es el principal mecanismo de aclaramiento de nalmefeno, y la excreción renal es la principal vía de eliminación de nalmefeno y sus metabolitos. 16,8% 22,3% 1,54 (1,02; 2,35) 0,040 0-4 DCEc El 54% de la dosis total se elimina por la orina en forma de nalmefeno-3-Oa En el análisis se trata a los pacientes que abandonaron como no respondedores glucurónido, mientras que el nalmefeno y sus otros metabolitos están presentes b Reducción del CAT ≥ 70% respecto al valor basal en el mes 6 (periodo de 28 días) en la orina en cantidades inferiores al 3% cada uno. Se calcula que el c De 0 a 4 DCE/mes en el mes 6 (periodo de 28 días) aclaramiento oral de nalmefeno (CL/F) es de 169 l/h y la semivida de eliminación de 12,5 horas. De los datos de distribución, metabolismo y eliminación se desprende que el nalmefeno tiene un coeficiente de extracción hepática elevado. Linealidad/No linealidad El nalmefeno muestra un perfil farmacocinético lineal independiente de la dosis en el intervalo de dosis de 18,06 mg a 72,24 mg, con un aumento de 4,4 veces en la Cmax y un aumento de 4,3 veces en el AUC0-tau (en estado estacionario o casi). El nalmefeno no muestra diferencias farmacocinéticas importantes entre sexos, entre jóvenes y ancianos, o entre diferentes grupos étnicos. Sin embargo, el tamaño corporal parece afectar mínimamente al aclaramiento de nalmefeno (el aclaramiento aumenta cuanto mayor es el tamaño corporal), si bien se considera poco probable que tenga relevancia clínica. Insuficiencia renal No se dispone de datos tras la administración oral en pacientes con insuficiencia renal. La administración IV de 1 mg de nalmefeno en pacientes con insuficiencia renal grave produjo una exposición 1,6 veces mayor (AUCinf ajustada por dosis), y una menor Cmax (en un factor de aproximadamente 2,1 a 4,6) que en voluntarios sanos. La semivida de eliminación (26 horas) fue más larga que la de los voluntarios sanos (10 horas) (ver secciones 4.3 y 4.4). Insuficiencia hepática La administración de una dosis única de 18,06 mg de nalmefeno a los pacientes con insuficiencia hepática leve o moderada aumentó la exposición respecto a la de los voluntarios sanos. En pacientes con insuficiencia hepática leve, la exposición aumentó 1,5 veces y el aclaramiento oral se redujo en aproximadamente un 35%. En pacientes con insuficiencia hepática moderada, la exposición aumentó 2,9 veces para el AUC y 1,7 veces para la Cmax, mientras que el aclaramiento oral se redujo en cerca del 60%. No se observaron cambios clínicamente relevantes en el tmax o la semivida de eliminación en ninguno de los grupos. No se dispone de datos farmacocinéticos tras la administración oral de nalmefeno a pacientes con insuficiencia hepática grave (ver secciones 4.3 y 4.4). Pacientes de edad avanzada No se ha realizado ningún estudio específico con administración oral en pacientes de ≥ 65 años. Un estudio con administración IV indicó que no existen cambios relevantes en la farmacocinética en pacientes de edad avanzada en comparación con adultos más jóvenes (ver secciones 4.2 y 4.4). 5.3 Datos preclínicos sobre seguridad El nalmefeno ha mostrado potencial de sensibilización cutánea en el ensayo de ganglio linfático local en ratones tras la aplicación tópica. Los estudios en animales no sugieren efectos perjudiciales directos con respecto a la fertilidad, el embarazo, el desarrollo embrionario o fetal, el parto o el desarrollo posnatal. En un estudio de toxicidad para el desarrollo realizado en conejos, se observaron efectos en los fetos en términos de reducción de peso fetal y retraso en la osificación, pero no anomalías graves. La AUC a dosis máximas sin efecto adverso observado (NOAEL), para estos efectos fue inferior a la exposición en humanos a la dosis clínica recomendada. Se observó un aumento de la viabilidad natal y una disminución de la viabilidad posnatal de las crías en estudios de toxicidad prenatal y posnatal en ratas. Este efecto se consideró un efecto indirecto relacionado con la toxicidad materna. Los estudios en ratas han mostrado excreción de nalmefeno o sus metabolitos en leche. Los datos no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad o potencial carcinogénico. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Núcleo del comprimido Celulosa microcristalina Lactosa anhidra Crospovidona, tipo A Estearato de magnesio Recubrimiento del comprimido Hipromelosa Macrogol 400 Dióxido de titanio (E171) 6.2 Incompatibilidades No procede. 6.3 Periodo de validez 3 años. 6.4 Precauciones especiales de conservación Este medicamento no requiere condiciones especiales de conservación. 6.5 Naturaleza y contenido del envase Blísters transparentes de PVC/PVdC/ aluminio en cajas de cartón. Tamaños de envases de 7, 14, 28, 42, 49 y 98 comprimidos recubiertos con película. Puede que solamente estén comercializados algunos tamaños de envases. 6.6 Precauciones especiales de eliminación La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN H. Lundbeck A/S Ottiliavej 9 DK-2500 Valby Dinamarca 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN EU/1/12/815/001 7 comprimidos EU/1/12/815/002 14 comprimidos EU/1/12/815/003 28 comprimidos EU/1/12/815/004 42 comprimidos EU/1/12/815/005 98 comprimidos EU/1/12/815/006 49 comprimidos EU/1/12/815/007 14 comprimidos, tarjeta EU/1/12/815/008 28 comprimidos, tarjeta 9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Fecha de la primera autorización: 25 de Febrero de 2013 10. PRESENTACIÓN Y PRECIO PVP (IVA) Selincro 18 mg, envase con 14 comprimidos. P.V.P 63,04 € P.V.P iva 65,57 € 11. CONDICIONES DE DISPENSACIÓN POR LA SEGURIDAD SOCIAL Con receta médica. Especialidad reembolsable por el Sistema Nacional de Salud. Con visado de inspección. Cícero de aportación reducida. 12. FECHA DE LA REVISIÓN DEL TEXTO: Mayo 2015 La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/. Sistema de clasificación de órganos AAFF_SELINCRO_FTA4_110615.indd 2 Frecuencia Reacción adversa 11/06/15 16:37 Rev Psiquiatr Salud Ment (Barc.). 2015;8(4):197---198 www.elsevier.es/saludmental EDITORIAL Un tratamiento integral para el trastorno por déficit de atención e hiperactividad en toda Europa A integral treatment for attention deficit hyperactivity disorder in Europe Celso Arango Child and Adolescent Psychiatry Department, Hospital General Universitario Gregorio Marañón, IiSGM, School of Medicine, Complutense University, CIBERSAM, Madrid, España El trastorno por déficit de atención e hiperactividad (TDAH) es un trastorno del neurodesarrollo que afecta aproximadamente al 5% de los niños, y que se puede cronificar en la adolescencia y adultez1 . La falta de tratamiento favorece no solo la cronificación del trastorno, sino también el desarrollo de comorbilidad y criminalidad empeorando el pronóstico2 . En los últimos años ha habido un interés creciente en Europa por este trastorno con aumento del número de casos detectados, y el uso de fármacos como estimulantes en menores, incluido nuestro país (España)3 . La Asamblea del Consejo de Europa acaba de aprobar por unanimidad una resolución que solicita a sus estados miembros que garanticen el tratamiento integral de los niños con TDAH4 . El documento de la resolución, promovido por Silvia Bonet del Departamento de Sanidad de Andorra y en cuya elaboración ha participado el Centro de Investigación Biomédica en Red de Salud Mental (CIBERSAM) del Instituto de Salud Carlos III como asesor, pide criterios más rigurosos de clasificación de este trastorno para evitar el sobrediagnóstico. Se solicita también una mejor formación de los profesionales para acabar con el infradiagnóstico. Ambas solicitudes reducirán errores diagnósticos que son comunes en enfermedades complejas como el TDAH, en especial cuando no existe formación específica en muchos profesionales de diversas áreas de conocimiento que atienden a estas personas (p. ej., pediatría o medicina de familia). Se propone en dicha resolución que el tratamiento farmacológico no sea el primer recurso en Correo electrónico: [email protected] casos leves y que siempre vaya acompañado de la combinación con otras actuaciones psicoeducativas y de mejora del comportamiento. Aunque los tratamientos farmacológicos han demostrado no tan solo ser eficaces a corto plazo sino también coste-eficientes5 , no deberían ser tratamiento de indicación para formas leves del trastorno, ni deberían ser administrados como única intervención terapéutica en cualquier caso, independientemente de la gravedad del TDAH. En esta resolución también se insta a los Estados miembros del Consejo de Europa a que se favorezca la investigación en factores de riesgo para el TDAH, la evaluación empírica de intervenciones psicosociales que incluyan aspectos educativos, y estudios a largo plazo de seguridad y tolerabilidad de los fármacos utilizados para el tratamiento de este trastorno. Por otra parte, se solicita a los Estados miembros que favorezcan las intervenciones multimodales que se centren no solo en los síntomas del TDAH, sino también en las dificultades asociadas como problemas escolares, disfunción familiar, baja autoestima y demás enfermedad comórbida. Esta enfermedad que afecta a más de 3 millones de niños en Europa necesita de un esfuerzo coordinado de los distintos Estados por lo que esta resolución será sin duda de gran ayuda para todas las personas con TDAH y sus familias en Europa. El que esta resolución se traduzca ahora en un mejora del diagnóstico y tratamiento en Europa de esta enfermedad prevalente y discapacitante, más aún si no se actúa pronto y bien, depende de la adopción y desarrollo de las recomendaciones en cada uno de los países. Nos va en ello nuestra salud mental. http://dx.doi.org/10.1016/j.rpsm.2015.04.004 1888-9891/© 2015 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. 198 Conflicto de intereses El Dr. Arango ha sido consultor o ha recibido honorarios o becas de Abbot, AMGEN, AstraZeneca, Bristol-Myers Squibb, Caja Navarra, CIBERSAM, Fundación Alicia Koplowitz, Instituto de Salud Carlos III, Janssen Cilag, Lundbeck, Merck, Ministerio de Ciencia e Innovación, Ministerio de Sanidad, Ministerio de Economía y Competitividad, Mutua Madrileña, Otsuka, Pfizer, Roche, Servier, Shire, Schering Plough and Takeda. Bibliografía 1. Vidal R, Barrau V, Casas M, Caballero-Correa M, MartínezJiménez P, Ramos-Quiroga JA. Prevalence of attention deficit/hyperactivity disorder symptoms in outpatient adolescents and young adults with other psychiatric disorders refractory to previous treatments. Rev Psiquiatr Salud Ment. 2014;7: 104---12. C. Arango 2. Gunter TD, Arndt S, Riggins-Caspers K, Wenman G, Cadoret RJ. Adult outcomes of attention deficit hyperactivity disorder and conduct disorder: Are the risks independent or additive? Ann Clin Psychiatry. 2006;18:233---7. 3. Treceno C, Martín Arias LH, Sainz M, Salado I, García Ortega P, Velasco V, et al. Trends in the consumption of attention deficit hyperactivity disorder medications in Castilla y León (Spain): Changes in the consumption pattern following the introduction of extended release methylphenidate. Pharmacoepidemiol Drug Saf. 2012;21:435---41. 4. Ensuring comprehensive treatment for children with attention problems. Committee on Social Affairs, Health and Sustainable Development. Council of Europe Report Doc 13712, 12 February 2015 [consultado 6 Abr 2015]. Disponible en: http:// assembly.coe.int/nw/xml/XRef/Xref-XML2HTML-en.asp?fileid= 21596&lang=en 5. Catalá-López F, Ridao M, Sanfélix-Gimeno G, Peiró S. Costeffectiveness of pharmacological treatment of attention deficit hyperactivity disorder in children and adolescents: Qualitative synthesis of scientific evidence. Rev Psiquiatr Salud Ment. 2013;6:168---77. Rev Psiquiatr Salud Ment (Barc.). 2015;8(4):199---206 www.elsevier.es/saludmental ORIGINAL Escala Abreviada de Personalidad y Acontecimientos Vitales para la detección de los intentos de suicidio Paula Artieda-Urrutia a , David Delgado-Gómez b , Diego Ruiz-Hernández c , Juan Manuel García-Vega a , Nuria Berenguer a , Maria A. Oquendo d e Hilario Blasco-Fontecilla a,e,∗ a Department of Psychiatry, IDIPHIM, Puerta de Hierro University Hospital, Majadahonda, Madrid, España Department of Statistics, Universidad Carlos III, Leganés, Madrid, España c Department of Quantitative Methods, CUNEF, Madrid, España d Molecular Imaging and Neuropathology Division, New York State Psychiatric Institute, Columbia University, New York, Estados Unidos e Autonoma University, CIBERSAM, Madrid, España b Recibido el 26 de enero de 2015; aceptado el 20 de febrero de 2015 Disponible en Internet el 27 de mayo de 2015 PALABRAS CLAVE Personas que intentan suicidarse; Personalidad; Acontecimientos vitales; Sensación de vacío ∗ Resumen Objetivo: Desarrollar una escala breve y fiable para identificar a las personas en riesgo de conducta suicida. Método: Diseño: estudio de caso-control. Muestra y centro: 182 individuos (61 personas que intentaron suicidarse, 57 controles psiquiátricos y 64 controles sanos) con una edad de 18 años o más, admitidos en la Unidad de Urgencias del Hospital Universitario Puerta de Hierro de Madrid, España. Mediciones: todos los participantes rellenaron un formulario que incluía sus características sociodemográficas y clínicas, y la Escala de Personalidad y Acontecimientos Vitales (27 cuestiones). Para evaluar los diagnósticos del Eje I, a todos los pacientes psiquiátricos (incluyendo a las personas que intentaron suicidarse) se les realizó la Entrevista Neuropsiquiátrica Internacional. Análisis estadístico: se aplicó estadística descriptiva para los factores sociodemográficos. Además, se aplicaron las pruebas de independencia de 2 para evaluar las diferencias de las variables sociodemográficas y clínicas, y de la Escala de Personalidad y Acontecimientos Vitales entre grupos. Se llevó a cabo una regresión lineal escalonada con selección de variable retrospectiva para elaborar la escala abreviada de Personalidad y Acontecimientos Vitales (S-PLE). A fin de evaluar la precisión se realizó un análisis de ROC. Se evaluó la fiabilidad interna utilizando la ␣ de Cronbach, y la fiabilidad externa mediante un procedimiento de prueba-reprueba. Resultados: La escala S-PLE, que se compone únicamente de 6 cuestiones, reflejó un buen desempeño al discriminar los controles sanos, los controles psiquiátricos y los intentos de suicidio en una muestra independiente. Por ejemplo, la escala S-PLE discriminó a las personas que Autor para correspondencia. Correos electrónicos: [email protected], [email protected] (H. Blasco-Fontecilla). http://dx.doi.org/10.1016/j.rpsm.2015.02.004 1888-9891/© 2015 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. 200 P. Artieda-Urrutia et al. intentaron suicidarse y a las que no lo hicieron en el pasado, con una sensibilidad del 80% y una especificidad del 75%. El área bajo la curva ROC fue del 88%. Un análisis factorial extrajo solamente un factor, lo que revela la dimensión única de la escala S-PLE. Además, la escala S-PLE aporta valores de fiabilidad interna y externa que se incluyen dentro de los rangos débil (prueba-reprueba: 0,55) y aceptable (␣ de Cronbach: 0,65). El tiempo de realización es de alrededor de un minuto. Conclusiones: La escala S-PLE es un instrumento útil y preciso para calcular el riesgo de conducta suicida en centros asistenciales donde escasea el tiempo. © 2015 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. KEYWORDS Suicide attempters; Personality; Life events; Emptiness Short Personality and Life Event scale for detection of suicide attempters Abstract Objective: To develop a brief and reliable psychometric scale to identify individuals at risk for suicidal behaviour. Method: Design: Case-control study. Sample and setting: 182 individuals (61 suicide attempters, 57 psychiatric controls, and 64 psychiatrically healthy controls) aged 18 or older, admitted to the Emergency Department at Puerta de Hierro University Hospital in Madrid, Spain. Measures: All participants completed a form including their socio-demographic and clinical characteristics, and the Personality and Life Events scale (27 items). To assess Axis I diagnoses, all psychiatric patients (including suicide attempters) were administered the Mini International Neuropsychiatric Interview. Statistical analysis: Descriptive statistics were computed for the socio-demographic factors. Additionally, 2 independence tests were applied to evaluate differences in socio-demographic and clinical variables, and the Personality and Life Events scale between groups. A stepwise linear regression with backward variable selection was conducted to build the Short Personality Life Event (S-PLE) scale. In order to evaluate the accuracy, a ROC analysis was conducted. The internal reliability was assessed using Cronbach’s ␣, and the external reliability was evaluated using a test-retest procedure. Results: The S-PLE scale, composed of just 6 items, showed good performance in discriminating between medical controls, psychiatric controls and suicide attempters in an independent sample. For instance, the S-PLE scale discriminated between past suicide and past non-suicide attempters with sensitivity of 80% and specificity of 75%. The area under the ROC curve was 88%. A factor analysis extracted only one factor, revealing a single dimension of the S-PLE scale. Furthermore, the S-PLE scale provides values of internal and external reliability between poor (test-retest: 0.55) and acceptable (Cronbach’s ␣: 0.65) ranges. Administration time is about one minute. Conclusions: The S-PLE scale is a useful and accurate instrument for estimating the risk of suicidal behaviour in settings where the time is scarce. © 2015 SEP y SEPB. Published by Elsevier España, S.L.U. All rights reserved. Introducción La prevención del suicidio constituye un motivo de gran preocupación en la salud pública1---3 . Con arreglo a la Organización Mundial de la Salud, el suicidio representa aproximadamente el 1,4% de la carga global de enfermedad4 . Se calcula que un millón y medio de personas cometerán suicidio cada año, y al menos de 10 a 20 veces más realizarán intentos no letales para el año 20205 . Además, solo en EE. UU., los costes económicos anuales y estimados del suicidio representan alrededor de 33 billones de dólares al año6 . A pesar de estas cifras tan impactantes, es posible prevenir parcialmente la conducta suicida con intervenciones específicas en poblaciones de alto riesgo7,8 . Por ejemplo, algunos investigadores han señalado que el acceso al tratamiento adecuado podría reducir los índices de suicidio hasta en un 25%9 . Más recientemente, Hampton10 reportó una reducción de los índices de suicidio del 75% mediante la introducción de un programa de cuidados en los casos de depresión. Una de las tareas más difíciles en la prevención del suicidio es la detección de las personas en riesgo11 . Entre los motivos que se hallan tras este problema se encuentra el hecho de que la mayoría de las personas que intentan suicidarse no revelan sus pensamientos y planes suicidas a sus médicos12,13 . Además, aunque diversos factores de riesgo incrementan la posibilidad de suicidio ---como es el caso de la depresión mayor14 , la tentativa de suicidio previa15 o los acontecimientos vitales recientes16 ---, los esfuerzos previos Escala Abreviada de Personalidad y Acontecimientos Vitales para la detección de los intentos de suicidio para encontrar una herramienta que identifique a las personas en riesgo de conducta suicida deben reportar aún unos buenos resultados17,18 . Por ejemplo, Bolton et al.19 realizaron un estudio en el que la escala SAD PERSONS no pudo predecir con precisión los intentos de suicidio entre las personas que requerían servicios psiquiátricos en las unidades de urgencias. En otro estudio, la Escala de Intento de Suicidio no fue capaz de predecir qué personas con conducta autolesiva morirían finalmente por cometer suicidio20 . Estos hallazgos subrayan la importancia de desarrollar herramientas precisas que identifiquen y prevengan la conducta suicida. Con este fin, Blasco-Fontecilla et al.21 desarrollaron la escala Personality and Life Events (PLE, «Personalidad y Acontecimientos Vitales»). La escala PLE consiste en 27 cuestiones de entre las más discriminativas de una serie de cuestionarios que se emplean normalmente en la evaluación de la conducta suicida. Las 27 cuestiones fueron seleccionadas utilizando el algoritmo de Larsen22 . La escala PLE reflejó unos excelentes resultados de precisión (86,4%), sensibilidad (80,8%) y especificidad (89,6%) para clasificar a las personas que intentan suicidarse21 . El objetivo de este artículo es desarrollar y probar una versión reducida de la escala PLE que pueda utilizarse en procesos analíticos cuando se dispone de poco tiempo, como en los servicios de urgencias y los centros ambulatorios saturados. Además, también es relevante el desarrollo de esta escala abreviada dado el incremento de las aplicaciones sobre salud en Internet: hoy en día, tanto los investigadores como los profesionales médicos recolectan los datos de los pacientes mediante las aplicaciones de los teléfonos móviles23 . La disponibilidad de escalas abreviadas es esencial, considerando que el arrepentimiento es uno de los principales problemas a los que nos enfrentamos al recolectar este tipo de datos24 . Nuestra hipótesis es que la versión abreviada de la escala PLE (S-PLE) puede identificar con precisión a las personas en riesgo de conducta suicida. Material y métodos Muestras y procedimiento Los participantes no recibieron incentivo alguno. Inicialmente, incorporamos a 236 personas, pero excluimos de nuestros análisis a 54 de ellas (22,5%) debido a la falta de valores. La muestra final de este estudio consistió en 182 personas (61 que habían intentado suicidarse, 57 controles psiquiátricos y 64 controles psiquiátricamente sanos) con edad de 18 años o más, admitidos en la Unidad de Urgencias del Hospital Universitario Puerta de Hierro de Madrid, España, entre el 1 de junio y el 1 de diciembre de 2013. Todos los participantes fueron evaluados dentro de las primeras 24 h posteriores a su ingreso. Las valoraciones fueron realizadas por los residentes en Psiquiatría, con formación específica para evaluar los intentos de suicidio. El grupo de personas con tentativa de suicidio incluyó a 18 varones y 43 mujeres. El grupo de control psiquiátrico comprendía a 21 varones y 36 mujeres que se habían presentado en el Servicio de Urgencias por cualquier motivo psiquiátrico diferente a la conducta suicida. Dichas personas negaron una historia previa de intento de suicidio. Los controles psiquiátricamente sanos (en adelante 201 denominados, simplemente, los controles sanos) incluían a 26 varones y 38 mujeres, que se presentaron en el Servicio de Urgencias debido a un motivo médico (no psiquiátrico). Los controles sanos se hallaban libres de situaciones psiquiátricas. En los 3 grupos se excluyó a las personas incapaces de decidir o comprender la escala PLE por cualquier motivo. Todos los pacientes incluidos aportaron un consentimiento informado escrito para participar en el estudio. El Comité de Ética del Hospital Universitario Puerta de Hierro aprobó el estudio. Mediciones Todos los participantes rellenaron un formulario que recogía sus características sociodemográficas y clínicas. A fin de facilitar el uso de la escala PLE, se dicotomizaron todas las cuestiones (sí/no). Para valorar los diagnósticos del Eje I, a todos los pacientes psiquiátricos (incluyendo los que trataron de suicidarse) se les realizó la Entrevista Neuropsiquiátrica Internacional25 , que es una entrevista diagnóstica estructurada eficaz, breve y fácil de realizar21,25 . Se determinó que los controles sanos no tuvieran una historia personal de enfermedad psiquiátrica, lo que se verificó mediante preguntas directas y revisión de su historia médica electrónica. Análisis estadístico Se aplicó estadística descriptiva para los factores sociodemográficos. Además, se aplicaron las pruebas de independencia de 2 para evaluar las diferencias de las variables sociodemográficas y clínicas entre los grupos. También se realizó la prueba de independencia de 2 para evaluar la fortaleza de la relación entre cada cuestión de la escala PLE y el tipo de individuo (intento de suicidio, control psiquiátrico o control sano). Se llevó a cabo una regresión lineal escalonada con selección de variable retrospectiva para elaborar la escala abreviada. A fin de evaluar la precisión de la escala desarrollada, se realizó un análisis de la característica operativa del receptor (ROC). Normalmente, los trabajos publicados en las áreas de psicología y psiquiatría realizan este análisis utilizando los mismos datos para ambas disciplinas, así como la estimación de los parámetros de los clasificadores y la evaluación de la precisión. La consecuencia de esta práctica es que los resultados reportados tienden a ser mejores que la observación en la práctica. Por ejemplo, las máquinas de vectores de soporte son capaces de lograr una clasificación perfecta en un conjunto dado. Sin embargo, siempre que este clasificador se aplica a un conjunto de datos diferente, su rendimiento disminuye drásticamente. Este fenómeno se conoce como sobreajuste. A fin de evitar este problema, se realizó el análisis utilizando una curva ROC, de acuerdo con la práctica habitual en la comunidad de reconocimiento del patrón, es decir, se separaron los datos en 2 conjuntos inconexos, denominados conjuntos de práctica y prueba. El conjunto de práctica se utiliza para calcular los parámetros de la regresión lineal, y el conjunto de prueba se utiliza para calcular las curvas ROC. A fin de obtener resultados más relevantes, se realizaron 100 validaciones cruzadas. En cada una de ellas, el conjunto de práctica incluyó a 32 controles 202 P. Artieda-Urrutia et al. Tabla 1 Comparación de los intentos de suicidio, los controles psiquiátricos y los controles sanos con las variables sociodemográficas Variable Intento de suicidio (n = 61),n (%) Control psiquiátrico (n = 57), n (%) Control sano (n = 64), n (%) Estadísticasa Marco de datos p Edad (años) Sexo (mujer) Años de educación <8 9-12 > 12 Estatus socioeconómico (euros) Bajo (< 500) y bajo-medio (500-1.500) Medio (1.500-2.000) Medio-alto (> 2.000) Modo de convivencia Familia de origen Familia propia Solo y otros Raza Caucásica Hispana Otra raza 36,9 (DE 11,83) 43 (70,5) 44,1 (DE 13,48) 36 (63,2) 41,1 (DE15,19) 38 (59,4) 4,18 1,727 8,472 2; 179 2 4 0,02 0,42 0,08 4 (6,6%) 37 (60,6%) 20 (32,8%) 10 (19,6%) 22 (43,1%) 19 (37,3%) 5 (7,8%) 30 (46,9%) 29 (45,3%) 4,986 4 0,29 10,82 4 0,03 4,210 4 0,38 a 33 (62,3) 26 (59,1) 28 (47,5) 11 (20,8) 9 (16,9) 6 (13,6) 12 (27,3) 11 (18,6) 20 (33,9) 22 (36,1) 31 (50,8) 8 (13,1) 10 (17,5) 37 (64,9) 10 (17,6) 9 (14,1) 47 (73,4) 8 (12,5) 53 (86,9) 7 (11,5) 1 (1,6) 53 (93,0) 3 (5,3) 1 (1,8) 55 (85,9) 5 (7,8) 4 (6,2) La prueba de 2 se aplicó a todas las comparaciones excepto a la edad (ANOVA). sanos, 29 controles psiquiátricos y 31 intentos de suicidio, seleccionados de nuestra base de datos, al azar. Las personas restantes (32 controles sanos, 28 controles psiquiátricos y 30 intentos de suicidio) fueron incluidas en el conjunto de prueba. Por último, una vez evaluado el desempeño de la escala propuesta, se realizó un análisis factorial con la rotación varimax, calculándose la fiabilidad interna y externa a fin de esclarecer las propiedades psicométricas de la escala propuesta. Se valoró la fiabilidad interna utilizando una ␣ de Cronbach, y la fiabilidad externa mediante un procedimiento prueba-reprueba, así como el coeficiente de correlación intraclase. El intervalo de la prueba-reprueba osciló entre 3 y 6 meses. Básicamente, a los 3-6 meses de la entrevista inicial todos los participantes habían sido contactados telefónicamente, solicitándoles que volvieran a responder a la escala PLE. Debido al rechazo a participar en la reprueba, la imposibilidad de contactar con la persona, o la escasez de tiempo transcurrido desde la primera entrevista (inferior a los 3 meses programados), utilizamos una submuestra de 85 individuos (47%) para realizar los análisis prueba-reprueba. controles psiquiátricos en la escala Entrevista Neuropsiquiátrica Internacional. Se hallaron diferencias estadísticamente insignificantes en los trastornos del Eje I, al comparar los intentos de suicidio y los controles psiquiátricos. Pruebas de independencia de 2 La prueba de 2 evaluó la relación entre cada cuestión y la pertenencia al grupo (véase la tabla 3). Las cuestiones «Llegada de un nuevo miembro a la familia», «Lesión o enfermedad personal», «Planifico la seguridad laboral» o «Agresión armada a otros» no se relacionaron con la situación de intento de suicidio. De igual modo, las cuestiones «Tengo pocas o nulas ganas de mantener sexo con alguien» y «Gasto o cargo más dinero del que gano» reflejaron una relación débil con la situación de intento de suicidio. Estos resultados apoyan la idea de recortar la escala PLE. Selección de la cuestión retrospectiva escalonada Resultados Características de la muestra La tabla 1 refleja los datos sociodemográficos. Aparte de la edad y el modo de convivencia, se produjeron diferencias estadísticamente insignificantes entre los grupos, en términos de datos sociodemográficos. La tabla 2 muestra la comparación entre las puntuaciones obtenidas por las personas que intentaron suicidarse y los Se llevó a cabo un análisis de regresión retrospectiva para seleccionar las cuestiones más adecuadas a incluir en la escala S-PLE. El resultado de este análisis fue la selección de las 6 cuestiones siguientes: «A menudo siento un vacío interior», «Autolesión adulta», «Tengo rabietas o explosiones de coraje», «He sido víctima de ataques injustos hacia mi carácter o reputación», «No puedo decidir el tipo de persona que quiero ser» y «Creo que mi esposo/a (o amante) puede serme infiel». Escala Abreviada de Personalidad y Acontecimientos Vitales para la detección de los intentos de suicidio Tabla 2 203 Comparación de los intentos de suicidio y los controles psiquiátricos con los trastornos psiquiátricos (escala MINI) MINI Intentos de suicidio (n = 61), n (%) Episodio depresivo mayor (actual) Episodio depresivo mayor (pasado) Distimia Trastorno de pánico (actual) Trastorno de pánico con agorafobia Dependencia del alcohol Drogodependencia Trastorno de ansiedad generalizada Trastorno psicótico (real) 45/60 21/58 7/60 6/59 1/59 12/58 4/59 24/58 2/59 (75,0) (36,2) (11,7) (10,2) (1,7) (20,7) (6,8) (41,4) (3,4) Controles psiquiátricos (n = 57), n (%) 39/57 19/57 3/57 5/57 4/57 8/58 3/57 22/57 2/57 (68,4) (33,3) (5,3) (8,8) (7,0) (13,8) (5,3) (38,6) (3,5) Prueba 2 (p) 0,42 0,75 0,22 0,79 0,16 0,34 0,73 0,76 0,97 Las celdas de las primeras 2 columnas muestran la ratio de casos con el atributo en relación con los datos disponibles. La ausencia de datos corresponde a la no respuesta a cada cuestión particular. controles psiquiátricos e intentos de suicidio, obtendría la matriz de confusión reflejada en la tabla 4. 1 0,9 0,8 Propiedades psicométricas Sensibilidad 0,7 0,6 0,5 0,4 0,3 Control sano frente a control psiquiátrico (AUC:0,914) 0,2 Intento frente a no intento de suicidio (AUC:0,877) Control sano frente a intento de suicidio (AUC:0,983) 0,1 Control psiquiátrico frente a intento de suicidio (AUC:0,756) Situación mental frente a controles sanos 0 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 1-Especificidad Figura 1 Curvas ROC de la escala S-PLE para discriminación de diferentes comparaciones pareadas. El análisis factorial con rotación varimax, aplicado a las cuestiones seleccionadas, extrajo únicamente un factor. Esto refleja la unidimensionalidad de la escala S-PLE. El factor extraído (con valor de Eigen superior a uno) explicó el 36,9% de la varianza. La primera columna de la tabla 5 refleja las cargas factoriales tras la rotación. La contribución de las cuestiones seleccionadas a este factor es muy similar. En cuanto a la consistencia interna, la ␣ de Cronbach fue de 0,65, mientras que la fiabilidad prueba-reprueba fue de 0,55 (calculada sobre la base de los 85 individuos que participaron en la reprueba), y el coeficiente de correlación intraclases fue de 0,53. Escala propuesta Análisis de la característica operativa del receptor Una vez identificadas las cuestiones relevantes, el análisis ROC evaluó la capacidad de estas para clasificar correctamente a las personas. Los resultados correspondientes se reflejan en la figura 1. Dicha figura muestra las ROC medias para las 100 simulaciones mencionadas anteriormente, junto con su área media bajo la curva. La escala propuesta discriminó con precisión a los controles sanos y los controles psiquiátricos (línea rayada), logrando una sensibilidad cercana al 90%, con una especificidad del 75%. Por tanto, la escala S-PLE podría utilizarse como un buen instrumento para la detección de enfermedades mentales en los centros de atención primaria. Dependiendo del tipo de servicio (urgencias, atención sin turno previo, etc.) podrían asignarse diferentes valores a los parámetros predictivos (es decir, sensibilidad, especificidad). Por ejemplo, un centro médico que fije umbrales de sensibilidad del 90% para discriminar a controles sanos y psiquiátricos, y una especificidad del 70% para discriminar a Por último, se calcularon las ponderaciones de la escala propuesta utilizando el conjunto completo de datos. Dichas ponderaciones se reflejan en la última columna de la tabla 5. La puntuación total de la escala S-PLE para un individuo dado se obtiene mediante la suma de las ponderaciones de las cuestiones que recibieron una respuesta afirmativa de dicho individuo, y de la constante. Por ejemplo, un individuo que siente «a menudo un vacío interior» y tiene historia de «autolesión adulta» recibiría una puntuación de 2,27 (0,66 [vaciedad] + 0,46 [autolesión adulta] + 1,15 [constante]) (véanse las ponderaciones en la tabla 5). Se plantean 2 umbrales para diferenciar los 3 tipos de individuos: aquellos con una puntuación inferior a 1,70 se consideran mentalmente sanos; los individuos con una puntuación superior a 2,46 se consideran en riesgo de tentativa de suicidio; y finalmente, los que obtienen puntuaciones comprendidas entre estos 2 valores son clasificados como individuos con un posible trastorno mental. Los valores asignados a estos umbrales son aquellos que maximizan la precisión de la clasificación. 204 P. Artieda-Urrutia et al. Tabla 3 PLE Comparación de los intentos de suicidio, los controles psiquiátricos y los controles sanos con las cuestiones de la escala Cuestión de la escala PLE 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 22 23 24 25 26 27 a Cambio de la frecuencia de los argumentos Cambio de los hábitos personales Separación matrimonial A menudo siento vacío interior Llegada de un nuevo miembro a la familia Autolesión adulta Lesión o enfermedad personal Me preocupa estar solo y tener que cuidar de mí mismo Tengo rabietas o explosiones de coraje He sido víctima de ataques injustos hacia mi carácter o reputación No puedo decidir el tipo de persona que quiero ser Creo que mi esposo/a (o amante) puede serme infiel Normalmente me siento incómodo o indefenso cuando estoy solo No me relacionaré con las personas hasta estar seguro de que les gusto Tengo pocas o nulas ganas de mantener sexo con alguien Gasto o cargo más dinero del que gano La gente piensa que soy raro o excéntrico Voy al extremo para evitar que las personas se alejen de mí Mis sentimientos son como el tiempo: siempre cambiantes Actúo por impulsos Tengo autocontrol Planifico los viajes con la suficiente antelación Planifico la seguridad laboral Las personas tienen una elevada opinión sobre mí Normalmente obtengo diversión y entretenimiento de la vida Agresión armada a otros Intentos de suicidio (n = 61), n (%) Control psiquiátrico (n = 57), n (%) Control sano (n = 64), n (%) Prueba 2 (p) 41 (67,2) 31 (54,4) 11 (17,2) 0,00 39 18 55 6 30 7 37 7 17 0 5 10 (26,6) (0,0) (7,8) (15,6) 0,00 0,00 0,00 0,61a (63,9) (29,5) (90,2) (9,8) (52,6) (12,3) (64,9) (12,3) 21 (34,4) 5 (8,2) 34 (55,7) 3 (5,3) 4 (7) 38 (66,7) 0 (0,0) 6 (9,4) 12 (18,8) 0,00 0,89a 0,00 44 (72,1) 33 (57,9) 12 (18,8) 0,00 42 (68,9) 35 (61,4) 5 (7,8) 0,00 33 (54,1) 22 (38,6) 4 (6,3) 0,00 21 (34,4) 6 (10,5) 4 (6,3) 0,00 23 (37,7) 28 (49,1) 4 (6,3) 0,00 27 (44,3) 27 (47,4) 7 (10,9) 0,00 25 (41,0) 23 (40,4) 13 (20,3) 0,02 20 (32,8) 14 (24,6) 9 (14,1) 0,04 27 (44,3) 19 (33,3) 8 (12,5) 0,00 28 (45,9) 12 (21,1) 1 (1,6) 0,00 32 (52,5) 31 (54,4) 3 (4,7) 0,00 47 (77) 28 (45,9) 34 (55,7) 31 (54,4) 32 (56,1) 35 (61,4) 13 (20,3) 59 (92,2) 52 (81,3) 0,00 0,00 0,01 45 (73,8) 39 (63,9) 44 (77,2) 42 (73,7) 55 (85,9) 60 (93,8) 0,22a 0,00 29 (47,5) 33 (57,9) 60 (93,8) 0,00 0 (0,0) 0 (0,0) 0 (0,0) 1,00a Relaciones estadísticamente no significativas. Discusión Reportamos el desarrollo y la prueba de una escala abreviada de PLE. La escala S-PLE ha demostrado ser un instrumento fiable para clasificar a los individuos con o sin intentos de suicidio pasados. Nuestros resultados han reflejado también que la escala S-PLE ha sido capaz de distinguir entre individuos con situaciones mentales ---bien controles psiquiátricos, bien con intentos de suicidio--- y controles sanos. El desempeño de la escala S-PLE disminuye cuando se trata de separar los controles psiquiátricos de los intentos de suicidio. Esto no es sorprendente, dado que los diagnósticos Escala Abreviada de Personalidad y Acontecimientos Vitales para la detección de los intentos de suicidio Tabla 4 205 Matriz de confusióna Real Predicho Control sano Control psiquiátrico Intento de suicidio Control sano (n = 32) Control psiquiátrico (n = 28) Intento de suicidio (n = 30) 27,79 (2,04) 4,19 (2,05) 0,02 (0,20) 4,97 (2,89) 13,64 (3,69) 9,39 (2,55) 1,35 (0,92) 8,17 (3,07) 20,48 (2,98) Datos expresados como desviación media y estándar del número de casos sobre 100 simulaciones. a El desempeño de un modelo dado de clasificación puede evaluarse mediante una matriz de confusión. Dicha matriz refleja la precisión de las predicciones realizadas por el modelo. Por tanto, la diagonal refleja el número de clasificaciones correctas realizadas para cada clase (es decir, intentos de suicidio, controles psiquiátricos o controles sanos), reflejándose los errores realizados fuera de la diagonal. Por ejemplo, de las 32 pruebas de controles sanos, casi 28 (27,79) fueron correctamente clasificadas como controles sanos, y alrededor de 4 (4,19) y 0 (0,02) personas fueron incorrectamente clasificadas como controles psiquiátricos e intentos de suicidio, respectivamente. Tabla 5 PLE 1 2 3 4 5 6 Análisis factorial y ponderaciones de la escala S- Cuestión Cargas factoriales (tras la rotación) Ponderaciones A menudo siento un vacío interior Autolesión adulta He sido víctima de ataques injustos hacia mi carácter o reputación Creo que mi esposo/a (o amante) puede serme infiel No puedo decidir el tipo de persona que quiero ser Tengo rabietas o explosiones de coraje Constante 0,64 0,66 0,70 0,60 0,46 0,40 0,87 0,36 0,67 0,24 0,57 0,19 1,15 psiquiátricos constituyen en sí mismos factores de riesgo de la conducta suicida. En cualquier caso, el área bajo la curva ROC que comparó los controles psiquiátricos y los intentos de suicidio resultó bastante aceptable (0,756). El estudio se completó con la evaluación de la fiabilidad interna y externa. En esta valoración, la ␣ de Cronbach adoptó un valor de 0,65, que se aproxima al valor de referencia indicado por Nunnaly en 197826 . En cuanto a la fiabilidad externa, la correlación prueba-reprueba fue de 0,55. Esta baja correlación estaba prevista, ya que algunas de las cuestiones incluidas en la escala S-PLE (es decir, «Tengo rabietas o explosiones de coraje») miden la situación del individuo, y no sus rasgos. Además, el hecho de que esta escala esté compuesta únicamente por 6 cuestiones la hace particularmente útil en centros en los que escasea el tiempo. Otra gran fortaleza de la escala S-PLE es que puede evaluar indirectamente el riesgo de conducta suicida. Las cuestiones que componen la escala S-PLE evalúan el modo en que el examinado se siente con respecto a sí mismo y a su entorno social, laboral y afectivo. Esto es importante porque muchas personas que intentan suicidarse, y las que lo consiguen, no exhiben una ideación suicida en las citas previas con sus médicos12 , lo que dificulta la prevención de la conducta suicida. En un estudio realizado en Finlandia, solo el 22% de los suicidas reportaron un intento de suicidio al profesional de atención sanitaria13 . Sin estigmatizar, la hospitalización o el truncamiento de sus planes podrían explicar la falta de comunicación12,13 . En este contexto, la escala S-PLE podría ser particularmente interesante ya que, a excepción de la autolesión adulta, esta escala no plantea cuestiones directas acerca de la tentativa de suicidio. En consecuencia, la escala S-PLE podría ser particularmente útil para pacientes que pudieran desear ocultar esta información. La escala S-PLE se compone de 6 cuestiones referidas al trastorno de la personalidad y un historial de autolesión previa. Las cuestiones más discriminativas fueron «A menudo siento un vacío interior» y «Autolesión adulta». Estos resultados concuerdan con la literatura. Por ejemplo, en una revisión reciente, hallamos que la vaciedad podría tener un poder más predictivo que la impulsividad en relación con la conducta suicida, y podría constituir uno de los factores clínicos más estrechamente asociados a la repetición de la tentativa de suicidio27---29 , y a la adicción a la conducta suicida29,30 . Además, el historial de autolesión y la inestabilidad afectiva constituyen factores de riesgo de una conducta suicida bien reconocidos31,32 . Una limitación del presente estudio es que el conjunto resultante de 6 cuestiones debe compararse aún con las escalas específicas que evalúan la conducta suicida. Asimismo, la escala S-PLE no ha sido probada todavía de modo prospectivo. Sin embargo, resulta útil la capacidad de esta escala para identificar a aquellas personas con probabilidad de padecer una situación psiquiátrica, y a aquellas con probabilidad de tentativa de suicidio pasado, en un minuto. Conclusiones La escala S-PLE ha reflejado propiedades psicométricas aceptables, constituyendo un instrumento valioso de detección para evaluar el riesgo de conducta suicida. Esta escala aúna 2 características importantes: mide indirectamente el riesgo de suicidio y puede responderse con rapidez dentro de un breve periodo de tiempo. Por ello, la escala S-PLE 206 P. Artieda-Urrutia et al. podría constituir una herramienta interesante en los centros de atención primaria o en los servicios de urgencias. 13. Financiación 14. Este artículo recibió el apoyo de CIBERSAM (http://www.cibersam.es/cibersam) para el desarrollo de una escala capaz de predecir las conductas suicidas (PLE). La escala abreviada S-PLE se incluirá en el Banco de Instrumentos de CIBERSAM. Paula ArtiedaUrrutia ha obtenido financiación competitiva de IDIPHIM (http://www.investigacionpuertadehierro.com/). Conflicto de intereses En los últimos 3 años, el Dr. Hilario Blasco-Fontecilla ha percibido honorarios por impartición de conferencias de Eli Lilly, AB-Biotics, Janssen, Rovi y Shire. Maria A. Oquendo percibió royalties por el uso comercial de C-SSRS, y su familia posee participaciones de Bristol-Myers Squibb. El resto de los autores declara no tener conflicto de intereses alguno. Agradecimientos Monica Fernández-Rodriguez, Isabel González-Villalobos, Cesar Rodriguez-Lomas, Maria Martin-Garcia y Rocio BlancoFernández prestaron su ayuda para la incorporación de ciertas personas a nuestro estudio. El Dr. Iruela-Cuadrado nos autorizó a realizar este estudio en el Hospital Universitario Puerta de Hierro. 15. 16. 17. 18. 19. 20. 21. 22. 23. Bibliografía 24. 1. Nock MK, Borges G, Bromet EJ, Alonso J, Angermeyer M, Beautrais A, et al. Cross-national prevalence and risk factors for suicidal ideation, plans and attempts. Br J Psychiatry. 2008;192:98---105. 2. Saiz PA, Bobes J. Suicide prevention in Spain: An uncovered clinical need. Rev Psiquiatr Salud Ment. 2014;7:1---4. 3. Giner L, Guija JA. [Number of sucides in Spain: Differences between data from the Spanish Statistical Office and the Institutes of Legal Medicine] Spanish. Rev Psiquiatr Salud Ment. 2014;7:139---46. 4. World Health Organization. World report on violence and health. Geneva (Switzerland): WHO; 2002. 5. World Health Organization. Figures and facts about suicide. Geneva (Switzerland): WHO; 1999. 6. Coreil J, Bryant CA, Henderson JN. Social and behavioral foundations of Public Health. Sage Publications; 2001. 7. Van der Feltz-Cornelis CM, Sarchiapone M, Postuvan V, Volker D, Roskar S, Grum AT, et al. Best practice elements of multilevel suicide prevention strategies: A review of systematic reviews. Crisis. 2011;32:319---33. 8. Jamison KR. Suicide and bipolar disorder. J Clin Psychiatry. 2000;61:47---51. 9. Isacsson G. Suicide prevention–A medical breakthrough? Acta Psychiatr Scand. 2000;102:113---7. 10. Hampton T. Depression care effort brings dramatic drop in large HMO population’s suicide rate. JAMA. 2010;303:1903---5. 11. Davis AT, Schrueder C. The prediction of suicide. Med J Aust. 1990;153:552---4. 12. Smith EG, Kim HM, Ganoczy D, Stano C, Pfeiffer PN, Valenstein M. Suicide risk assessment received prior to suicide death 25. 26. 27. 28. 29. 30. 31. 32. by Veterans Health Administration patients with a history of depression. J Clin Psychiatry. 2013;74:226---32. Isometsä ET, Heikkinen ME, Marttunen MJ, Henriksson MM, Aro HM, Lönnqvist JK. The last appointment before suicide: Is suicide intent communicated? Am J Psychiatry. 1995;152:919---22. Mann JJ, Waternaux C, Haas GL, Malone KM. Toward a clinical model of suicidal behavior in psychiatric patients. Am J Psychiatry. 1999;156:181---9. Oquendo MA, Currier D, Mann JJ. Prospective studies of suicidal behavior in major depressive and bipolar disorders: What is the evidence for predictive risk factors? Acta Psychiatr Scand. 2006;114:151---8. Kolves K, Varnik A, Schneider B, Fritze J, Allik J. Recent life events and suicide: A case-control study in Tallinn and Frankfurt. Soc Sci Med. 2006;62:2887---96. Hendin H, Al Jurdi RK, Houck PR, Hughes S, Turner JB. Evidence for significant improvement in prediction of acute risk for suicidal behavior. J Nerv Ment Dis. 2010;198:604---5. Pokorny A. Prediction of suicide in psychiatric patients: Report of a prospective study. Arch Gen Psychiatry. 1983;40:249---57. Bolton JM, Spiwak R, Sareen J. Predicting suicide attempts with the SAD PERSONS scale: A longitudinal analysis. J Clin Psychiatry. 2012;73:e735---41. Harriss L, Hawton K. Suicidal intent in deliberate self-harm and the risk of suicide: The predictive power of the Suicide Intent Scale. J Affect Disord. 2005;86:225---33. Blasco-Fontecilla H, Delgado-Gomez D, Ruiz-Hernandez D, Aguado D, Baca-Garcia E, Lopez-Castroman J. Combining scales to assess suicide risk. J Psychiatr Res. 2012;46:1272---7. Delgado-Gomez D, Blasco-Fontecilla H, Sukno F, RamosPlasencia MS, Baca-Garcia E. Suicide attempters classification: Toward predictive models of suicidal behavior. Neurocomputing. 2012;92:3---8. Myin-Germeys I, Oorschot M, Collip D, Lataster J, Delespaul P, van Os J. Experience sampling research in psychopathology: Opening the black box of daily life. Psychol Med. 2009;39:1533---47. Eysenbach G. The law of attrition. J Med Internet Res. 2005;7:e11. Sheehan DV, Lecrubier Y, Sheehan KH, Amorim P, Janavs J, Weiller E, et al. The Mini-International Neuropsychiatric Interview (M.I.N.I.): The development and validation of a structured diagnostic psychiatric interview for DSM-IV and ICD-10. J Clin Psychiatry. 1998;59 Suppl 20:22---33. Nunnally JC. Psychometric theory. New York: McGraw-Hill; 1978. Blasco-Fontecilla H, de León-Martínez V, Delgado-Gomez D, Giner L, Guillaume S, Courtet P. Emptiness and suicidal behavior: An exploratory review. SOL. 2013;4:21---32. Blasco-Fontecilla H, Jaussent I, Olie E, et al. A cross-sectional study of major repeaters: A distinct phenotype of suicidal behavior. Prim Care Companion CNS Disord. 2014;16. Blasco-Fontecilla H, Baca-García E, Courtet P, García-Nieto R, de Leon J. Horror vacui: Emptiness might distinguish between major suicide repeaters and nonmajor suicide repeaters: A pilot study. Psychother Psychosom. 2015;84:117---9, http://dx.doi.org/10.1159/000369937. Blasco-Fontecilla H, Artieda-Urrutia P, Berenguer-Elias N, Garcia-Vega JM, Fernandez-Rodriguez M, Rodriguez-Lomas C, et al. Are major repeater patients addicted to suicidal behavior? Adicciones. 2014;26:321---33. Palmier-Claus JE, Taylor PJ, Varese F, Pratt D. Does unstable mood increase risk of suicide? Theory, research and practice. J Affect Disord. 2012;143:5---15. McGirr A, Alda M, Seguin M, Cabot S, Lesage A, Turecki G. Familial aggregation of suicide explained by cluster B traits: A three-group family study of suicide controlling for major depressive disorder. Am J Psychiatry. 2009;166:1124---34. Rev Psiquiatr Salud Ment (Barc.). 2015;8(4):207---217 www.elsevier.es/saludmental ORIGINAL La carga de la enfermedad en España 2010: trastornos neurológicos, mentales y re: trastornos neurológicos, mentales y relacionados con el consumo de sustancias Elvira Lara a,b , Noé Garin a,b , Alize J. Ferrari c,d,e , Stefanos Tyrovolas a,b , Beatriz Olaya a,b , Lidia Sànchez-Riera f , Harvey A. Whiteford c,d,e y Josep Maria Haro a,b,∗ a Parc Sanitari Sant Joan de Déu, Universitat de Barcelona, Sant Boi de Llobregat, Barcelona, España Instituto de Salud Carlos III, Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM, Madrid, España c School of Population Health, University of Queensland, Herston, Queensland, Australia d Queensland Centre for Mental Health Research, Wacol, Queensland, Australia e University of Washington, Institute for Health Metrics and Evaluation, Seattle, Washington, EE. UU. f Institut d’Investigació Biomèdica de Bellvitge, Universitat de Barcelona, L’Hospitalet de Llobregat, Barcelona, España b Recibido el 17 de julio de 2014; aceptado el 26 de septiembre de 2014 Disponible en Internet el 27 de noviembre de 2014 PALABRAS CLAVE Carga de la enfermedad; Enfermedades neurológicas; Enfermedades mentales; Enfermedades por consumo de sustancias; Años de vida ajustados por discapacidad; España ∗ Resumen Introducción: Se analizaron los datos españoles relacionados con los trastornos neurológicos, mentales y por consumo de sustancias procedentes del estudio Global Burden of Diseases (GBD 2010), Injuries and Risk Factors. Materiales y métodos: Se calcularon los años de vida ajustados por discapacidad (AVAD), que son el resultado de la combinación de los años de vida perdidos por mortalidad prematura (AVP) y los años vividos con discapacidad (AVD). Los AVAD se ajustaron por comorbilidad y se estimaron con intervalos de confianza del 95%. Resultados: La carga de los trastornos neuropsiquiátricos supuso el 18,4% del total de AVAD generados en España en 2010. Dentro de este grupo, las 5 causas principales de AVAD fueron: depresión, enfermedad de Alzheimer, migrañas, trastornos por consumo de sustancias y trastornos de ansiedad, que representaron el 70,9% del total de los trastornos neuropsiquiátricos. Los trastornos neurológicos supusieron el 5,03% del total de AVP, mientras que los trastornos mentales y por consumo de sustancias representaron el 0,8%. Los trastornos mentales y por consumo de sustancias constituyeron el 22,4% del total de AVD, siendo la depresión la enfermedad más incapacitante. Por otra parte, los trastornos neurológicos sumaron el 8,3% del total de AVD. Autor para correspondencia. Correos electrónicos: [email protected], [email protected] (J.M. Haro). http://dx.doi.org/10.1016/j.rpsm.2014.09.001 1888-9891/© 2014 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. 208 E. Lara et al. Conclusiones: Los trastornos neuropsiquiátricos fueron en España una de las principales causas de discapacidad en 2010. Este estudio contribuye al entendimiento de la carga que suponen dichos trastornos en la población española y pone de manifiesto la necesidad de dar prioridad a los trastornos neuropsiquiátricos en la sanidad pública española. © 2014 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. KEYWORDS Burden of disease; Neurological disorders; Mental disorders; Substance use disorders; Disability-adjusted life-years; Spain The Spanish Burden of Disease 2010: Neurological, mental and substance use disorders Abstract Introduction: We used data from the Global Burden of Disease, Injuries, and Risk Factors Study 2010 to report on the burden of neuropsychiatric disorders in Spain. Materials and methods: The summary measure of burden used in the study was the disabilityadjusted life-year (DALY), which sums of the years of life lost due to premature mortality (YLLs) and the years lived with disability (YLDs). DALYs were adjusted for comorbidity and estimated with 95% uncertainty intervals. Results: The burden of neuropsychiatric disorders accounted for 18.4% of total all-cause DALYs generated in Spain for 2010. Within this group, the top five leading causes of DALYs were: depressive disorders, Alzheimer’s disease, migraine, substance-use disorders, and anxiety disorder, which accounted for 70.9% of all DALYs due to neuropsychiatric disorders. Neurological disorders represented 5.03% of total all cause YLLs, whereas mental and substance-use disorders accounted for 0.8%. Mental and substance-use disorders accounted for 22.4% of total YLDs, with depression being the most disabling disorder. Neurological disorders represented 8.3% of total YLDs. Conclusions: Neuropsychiatric disorders were one of the leading causes of disability in 2010. This finding contributes to our understanding of the burden of neuropsychiatric disorders in the Spanish population and highlights the importance of prioritising neuropsychiatric disorders in the Spanish public health system. © 2014 SEP y SEPB. Published by Elsevier España, S.L.U. All rights reserved. Introducción El Global Burden of Disease, Injuries, and Risk Factors Study (estudio GBD), dirigido por Murray y Lopez, fue realizado por primera vez en 19901 . Dicho estudio supuso el primer esfuerzo sistemático y a gran escala para aportar una evaluación comparable de la pérdida de la vida a causa de enfermedades y lesiones, tanto a nivel regional como global. En el marco del GBD, la medición que resume la carga de la enfermedad son los años de vida ajustados por discapacidad (AVAD), que engloban los años de vida perdidos por mortalidad prematura (AVP) y los años vividos con discapacidad (AVD), a causa de una enfermedad específica2 . Un AVAD representa la pérdida de un año de salud plena. Combinando AVP y AVD, los AVAD aportaron la comparación de la carga de las enfermedades y las lesiones que originan la muerte prematura, así como aquellas que causan discapacidad, un enfoque que ha sido pionero en cuanto a que pudo resaltar por primera vez los trastornos neuropsiquiátricos (una categoría de enfermedades que incluye a los trastornos neurológicos, mentales y por consumo de sustancias) como causas destacadas de la carga de la enfermedad. El hallazgo más notable del estudio de 1990 fue que los trastornos neuropsiquiátricos representaban más del 25% de los AVP mundiales, incluyendo a 5 de las 10 causas principales de discapacidad dentro de la categoría neuropsiquiátrica (depresión mayor unipolar, consumo de alcohol, trastorno bipolar, esquizofrenia y trastorno obsesivocompulsivo). La depresión fue la causa más importante de los AVD, y la demencia se asoció a unos índices elevados de AVD y AVP3-6 . Las investigaciones sobre la prevalencia en Europa destacan también a los trastornos mentales y neurológicos como un grupo de trastornos con un elevado impacto7-10 . Por ejemplo, en España, los datos del estudio EseMed reportaron una prevalencia vitalicia de los trastornos mentales del 19,5%7 . Con arreglo al Instituto Nacional de Estadística11 , los trastornos neurológicos supusieron la cuarta causa de muerte en España en 2012. Murray y Lopez4 en 1997 estimaron que, para 2020, la proporción general de trastornos neuropsiquiátricos supondrá el 14,7% a nivel mundial. De igual modo, la Organización Mundial de la Salud estimó un incremento del 15%12 , aunque en ambos casos los cálculos se realizaron utilizando proyecciones de datos de los años anteriores. En 2007 se realizó un nuevo estudio Global Burden of Disease (GBD 2010), que se publicó a finales de 2012. Se introdujeron grandes mejoras metodológicas para superar las limitaciones del estudio anterior de 1990, tales como el uso de encuestas basadas en población para calcular las ponderaciones de discapacidad, que se habían calculado La carga de la enfermedad en España 2010 previamente a partir de un consenso experto, y la estimación del 95% de confianza alrededor de todos los cálculos sobre cargas13 . El GBD 2010 amplió también el conjunto de trastornos neuropsiquiátricos investigados. Se incluyeron nuevas categorías (tales como los trastornos generalizados del desarrollo y los trastornos del comportamiento en la infancia), y se ampliaron las categorías existentes (la depresión unipolar se dividió entre depresión mayor y distimia; los trastornos por consumo de drogas se dividieron en: dependencia de cocaína, cannabis, opiáceos y anfetaminas). Los cambios metodológicos entre el estudio GBD de 1990 y su versión más reciente (GBD 2010) se resumen con más detalle en otra parte del documento6,14,15 . Como dichos cambios metodológicos invalidaron cualquier comparación de los cálculos de la carga entre los 2 estudios, el GBD 2010 estimó dichas cargas para 1990 y 2010, a fin de facilitar la investigación sobre la carga a lo largo del tiempo16 . Los hallazgos del GBD 2010 subrayaron que 9 de las 20 causas principales de discapacidad estaban incluidas en la categoría neuropsiquiátrica (es decir, depresión, trastornos de ansiedad, migraña, trastornos por consumo de drogas). Los cambios relativos al crecimiento y envejecimiento de la población debidos a los incrementos de la esperanza de vida significaron también que la mayoría de la población mundial vivía hasta los años en los que existía más prevalencia de trastornos neuropsiquiátricos14,17 . Aunque los hallazgos mundiales del GBD 2010 en cuanto a los trastornos neuropsiquiátricos han sido previamente reportados6,14 , también es importante presentar una de las tendencias de las cargas, a nivel nacional. También es necesario conocer las diferentes cargas a nivel nacional para establecer prioridades en las agendas nacionales de salud, y para desarrollar políticas sanitarias que aborden las tendencias específicas de la edad, el sexo y el año en relación a la carga, así como su impacto sobre los sistemas nacionales de salud. En este documento, nuestro objetivo es reportar la carga de los trastornos neuropsiquiátricos en España para los años 1990 y 2010. A nuestro saber y entender, se trata del primer estudio que reporta la carga de los trastornos neuropsiquiátricos en España utilizando los datos del estudio GBD 2010. Materiales y métodos El estudio GBD 2010 incluyó una amplia evaluación de la carga de 291 enfermedades y lesiones, y 67 factores de riesgo para 20 grupos de edad en 187 países, distribuidos en 21 regiones mundiales2,13-15 . La carga se valoró en términos de AVP, AVD y AVAD. Aquí resumimos brevemente las definiciones y métodos del estudio GBD 2010, según han sido descritos con detalle en otras publicaciones13-15 . En este documento se presentan los resultados para España con relación a los trastornos neuropsiquiátricos. Dichos trastornos incluyen a los trastornos neurológicos, mentales y por consumo de sustancias, definidos utilizando el Manual Diagnóstico y Estadístico de Trastornos Mentales18 y la Clasificación Internacional de Enfermedades19 . Más específicamente, los trastornos neurológicos incluyeron: enfermedad de Alzheimer y otras demencias, enfermedad de Parkinson, epilepsia, esclerosis múltiple, migraña y cefalea tensional. Los trastornos mentales y por consumo de sustancias incluyeron: esquizofrenia, dependencia de 209 alcohol, opiáceos, cocaína, anfetamina, y cannabis, trastornos depresivos (depresión mayor y distimia), trastorno bipolar, trastornos de ansiedad, trastornos alimentarios, trastornos generalizados del desarrollo (autismo, síndrome de Asperger), trastornos del comportamiento en la infancia (trastornos de hiperactividad con déficit de atención, trastornos de la conducta) y discapacidad intelectual idiopática, incluyéndose 3 grupos residuales de otros trastornos neuropsiquiátricos para los trastornos sin datos suficientes para una evaluación individual14 . Años perdidos por mortalidad prematura Los AVP se calcularon multiplicando el número de muertes atribuibles a una enfermedad determinada por la esperanza estándar de vida para la edad de la muerte, en la población española. La información sobre la esperanza estándar de vida se recogió del modelo estándar de las tablas de vida, calculadas específicamente para el GBD 201012 . Las estimaciones de muerte se recogieron de las amplias revisiones de los registros civiles, autopsias verbales, bases de datos de supervisión de mortalidad y otras fuentes desde 1980, para cada uno de los 187 países incluidos en el GBD 2010. Las muertes podían atribuirse únicamente a los trastornos neuropsiquiátricos, cuando el trastorno era considerado como causa directa de la muerte, conforme a las directrices ICD1015,16,20 . Basándonos en lo anterior, las muertes y los AVP se presentaron específicamente para esquizofrenia, trastornos por consumo de alcohol, trastornos por consumo de drogas, anorexia nerviosa, enfermedad de Alzheimer, enfermedad de Parkinson, esclerosis múltiple, epilepsia y los grupos residuales de otros trastornos neuropsiquiátricos. Años vividos con discapacidad Se realizaron revisiones sistemáticas de la literatura publicada y no publicada para determinar la prevalencia, incidencia, remisión y exceso de mortalidad asociados a cada trastorno a nivel mundial16 . La definición del caso para cada trastorno siguió los criterios propuestos por el Manual Diagnóstico y Estadístico de Trastornos Mentales (DSM-IV)18 o la Clasificación Internacional de Enfermedades (ICD-10)19 . Se incluyeron los trastornos neuropsiquiátricos en el estudio cuando existió suficiente información epidemiológica para generar unas estimaciones epidemiológicas defendibles y representativas a nivel nacional por edad, sexo y año. Aunque se disponía de datos sobre la prevalencia de los trastornos neuropsiquiátricos para muchos países, normalmente estaban incompletos (es decir, no estratificados por edad, sexo o año), existiendo pocos datos sobre incidencia, remisión y exceso de mortalidad de dichos trastornos. Por dicho motivo, se utilizó DisMod-MR (Disease Modelling MetaRegression), una herramienta bayesiana de meta-regresión, para reproducir cada trastorno a partir de los datos epidemiológicos puros disponibles, y las estimaciones consistentes sobre prevalencia, incidencia, remisión y exceso de mortalidad para todos los grupos de edad, sexo, país y año14,16 . También se reprodujeron los intervalos de confianza (IC) en los resultados modelados finales, a partir de los cálculos epidemiológicos puros21 . 210 Los AVD se computaron como la prevalencia de un trastorno específico multiplicado por la ponderación de la discapacidad media de dicho trastorno. En el GBD 2010 se incluyó un total de 1.160 secuelas para capturar los resultados clínicos asociados a las enfermedades y lesiones específicas, que finalmente se asociaron a 220 situaciones sanitarias diferentes. Se calcularon las ponderaciones de discapacidad para cada situación sanitaria para medir el grado de la discapacidad asociada14 . Se calcularon las ponderaciones de las nuevas discapacidades para el GBD 2010 utilizando los datos recolectados durante las entrevistas personales (en Perú, Bangladesh, Indonesia y Tanzania), entrevistas telefónicas (en EE. UU.) y las encuestas de acceso abierto a Internet. Dichos esfuerzos trataron de cuantificar la severidad de las pérdidas de salud sostenidas por 220 situaciones sanitarias en un rango de 0 a 1, donde 0 representaba la «salud perfecta», y 1, la pérdida de salud proporcional a la muerte13,22,23 . Como ciertos trastornos neuropsiquiátricos se componen de más de una situación sanitaria, se estimaron las ponderaciones de las discapacidades múltiples. Esto se realizó para acomodar mejor las diferencias de las discapacidades en el curso del trastorno. Cuando este fue el caso, se utilizaron entonces los datos de la encuesta que reportan la distribución de dichas situaciones sanitarias en la población, para agregar proporcionalmente las ponderaciones de la discapacidad individual a la ponderación media de la discapacidad14 . También se ajustaron las ponderaciones de la discapacidad por comorbilidad entre las enfermedades, utilizando métodos de microsimulación14 . De igual modo, se reprodujeron la confianza del resultado de la prevalencia DisMod-MR, las ponderaciones de discapacidad y las estadísticas de muerte en las estimaciones finales de la carga. Este método se describe con más detalle en otro lugar del documento6,14,15 . Por último, los años de vida ajustados por discapacidad (AVAD) se expresaron como la suma de los AVP y los AVD15 . Resultados Años de vida ajustados por discapacidad Carga absoluta En general, las enfermedades y lesiones incluidas en el GBD 2010 generaron 1.102.694 AVAD en España en 2010. Los trastornos neuropsiquiátricos fueron responsables del 18,4% de esta carga, donde 73.724 (IC 95%: 61.275-86.664) AVAD se debieron a trastornos neurológicos y 129.172 AVAD (IC 95%: 106.306-154.324) se debieron a trastornos mentales y relacionados con el consumo de sustancias. La tabla 1 refleja el número de AVAD en 1990 y 2010 en España debidos a cada trastorno neuropsiquiátrico. La proporción de AVAD atribuibles a trastornos mentales y por consumo de sustancias fue casi el doble en comparación con la de los trastornos neurológicos (11,7% frente al 6,7%, respectivamente). Entre 1990 y 2010 los valores absolutos de AVAD reflejaron un incremento del 4,3 al 6,7% para los trastornos neurológicos, y del 10 al 11,7% para los trastornos mentales y por consumo de sustancias. Dentro de los trastornos neuropsiquiátricos, las 5 principales causas de los AVAD en 2010 fueron: trastornos depresivos, enfermedad de Alzheimer, E. Lara et al. migraña, trastornos por consumo de sustancias y trastornos de ansiedad, lo que representa el 70,9% de todos los trastornos neuropsiquiátricos. Estos hallazgos sobre AVAD para 2010 son similares a los obtenidos en 1990, excepto para la enfermedad de Alzheimer (tabla 1). Tendencias en cuanto a sexo y edad En cuanto a las diferencias de sexo, los AVAD para la enfermedad de Alzheimer, migraña, trastornos depresivos, trastornos de ansiedad y trastornos alimentarios fueron superiores en mujeres. En comparación, los AVAD debidos a trastornos por consumo de sustancias, trastornos generalizados del desarrollo y trastornos del comportamiento en la infancia fueron superiores en varones (tabla 1). En general, los varones representaron el 45,5% de los AVAD totales para trastornos neuropsiquiátricos, mientras que las mujeres representaron el 54,5%. La figura 1a refleja la distribución de los AVAD debidos a trastornos mentales y por consumo de sustancias (como grupo) por edad y sexo. Los AVAD máximos se sitúan entre los 25 y los 44 años, lo que representa el 44,7% de los AVAD. Hasta los 44 años, los varones justificaron una proporción superior de AVAD en cuanto a trastornos mentales y por consumo de sustancias, mientras que de los 44 años en adelante este efecto se reservó a las mujeres, que justificaron una proporción superior de AVAD. La figura 1b refleja la distribución de los AVAD debidos a trastornos neurológicos (como grupo) por edad y sexo. Los AVAD se incrementaron sustancialmente a lo largo de la vida, debido a la contribución de los trastornos tales como la demencia, que son más prevalentes en los ancianos. También se produjo una proporción mayor de AVAD entre las mujeres en comparación con los varones, especialmente en los ancianos. La figura 2a ilustra la distribución de los AVD atribuibles a cada trastorno mental y por consumo de sustancias, por edad. Los trastornos depresivos justificaron la mayor proporción de AVAD a lo largo de todo el abanico vital, que representa el 26% de todos los AVAD. La carga asociada a los trastornos por consumo de sustancias se incrementó durante la adolescencia, con un máximo entre los 20-34 años. También se ha observado un curso similar al de los trastornos por consumo de drogas en los trastornos por consumo de alcohol, que representa el 20,5% de la carga entre los individuos más jóvenes (edades de 15 a 29 años) y el 58% entre los adultos (edades de 30 a 55 años), que va disminuyendo con el transcurso de los años. Los trastornos mentales menos comunes, tales como el trastorno bipolar o la esquizofrenia, tuvieron una aparición más tardía, aunque tendieron a ser más crónicos. Representaron la mayor proporción de la carga de los 25 a los 55 años. Los AVAD debidos a otros trastornos tales como los trastornos alimentarios, los trastornos de ansiedad y los trastornos del comportamiento en la infancia fueron superiores en la infancia y la adolescencia, y en el caso de los trastornos de ansiedad, la carga permaneció estable en todas las edades. La figura 2b ilustra la distribución de los AVAD debidos a los trastornos neurológicos por edad, que refleja un patrón diferente en comparación con los trastornos mentales y por consumo de sustancias. La distribución de los AVAD se inclinó hacia la derecha (es, decir, un número superior de AVAD en los grupos de mayor edad), aportando la enfermedad de Alzheimer la mayor contribución a la carga (47,7%) de todos los Comparación de los AVAD debidos a trastornos neurológicos, mentales y por consumo de sustancias en España, para 1990 y 2010 (con un 95% de confianza) Total trastornos mentales y por consumo de sustancias Esquizofrenia Consumo de alcohol Consumo de drogas Depresión Trastorno bipolar Trastornos de ansiedad Trastornos alimentarios Trastorno generalizado del desarrollo Trastorno del comportamiento en la infancia Incapacidad intelectual idiopática Otros trastornos mentales AVAD 1990 (ambos sexos) 105.287 (86.005-127.164) AVAD 1990 (varones) 52.865 (42.151-65.322) AVAD 1990 (mujeres) 52.421 (41.628-65.109) 7.816 79.700 18.735 40.111 6.961 121.360 2.987 3.998 4.345 6.695 13.449 14.982 3.151 4.138 90 3.080 3.471 1.275 5.285 25.129 3.811 7.998 2.978 9.180 (4.536-11.539) (48.240-125.770) (13.910-24.165) (28.297-53.956) (4.251-10.510) (8.269-167.390) (1.746-4.793) (2.694-5.782) (2.329-7.010) (3.812-11.058) (9.804-17.658) (10.411-21.090) (1.890-4.931) (2.812-5.846) (50-230) (2.032-4.489) (1.838-5.509) (6.240-2.225) (3.737-7.170) (17.424-34.770) (2.242-5.856) (5.345-11.123) (1.731-4.779) (596-13.280) 2.918 (1.713-4.509) 2.109 (1.224-3.376) 809 (466-1.237) 9.200 (5.350-14.250) 5.650 (2.930-9.230) 356 (148-626) 7.340 (4.480-11.220) 3.420 (2.070-5.280) 392 (237-611) Total trastornos 45.810 (37.891-54.819) neurológicos 14.339 (11.384-17.543) Enfermedad de Alzheimer y otras demencias Enfermedad de Parkinson 23.040 (18.080-30.080) Epilepsia 3.994 (3.201-4.919) Esclerosis múltiple 8.210 (6.760-9.890) Migraña 18.935 (11.981-27.311) Cefalea tensional 1.171 (658-1.880) Otros trastornos 4.245 (3.361-5.671) neurológicos 1.046.159 Causas totales 18.296 (15.073-21.812) 27.514 (22.139-34.151) 5.127 (3.980-6.276) 9.213 (7.039-11.854) 1.172 2.162 3.310 6.688 5.170 2.298 (852-17.300) (1.701-2.714) (2.640-4.020) (4.049-9.884) (2.880-8.560) (1.659-3.432) 578.200 1.132 1.831 491 12.246 654 1.947 (835-1.548) (143-2.333) (376-626) (7.516-18.392) (353-1.069) (1.349-2.830) 467.958 AVAD 2010 (ambos sexos) 12.917,2 (10.630,6-15.432,4) 10.747 8.821 20.760 53.081 835.3 13.311 574.6 452,2 (6.068-16.141) (5.148-13.854) (15.361-26.775) (39.109-70.258) (510.6-1.251,2) (9.068-18.564) (339,7-929,5) (302,8-648,9) 209.7 (120,2-323,4) AVAD 2010 (varones) 62.705 (50.596-76.759) AVAD 2010 (mujeres) 66.467 (53.656-81.242) 6.090 7.291 15.129 20.086 3.887 4.292 180 3.506 4.657 1.529 5.631 32.995 4.466 9.019 5.728 1.016 (3.188-9.734) (3.932-12.092) (11.058-19.923) (13.836-28.017) (2.288-6.065) (2.931-5.992) (60-280) (2.331-5.150) (2.427-7.519) (838-2.668) (4.002-7.360) (22.819-45.937) (2.607-6.769) (6.038-12.871) (3.377-9.275) (678-1.449) 1.511 (846-2.398) 586 (349-924) 74.1 (38-123,4) 433 (197-762) 308 (110-569) 99,2 (60,1-152,2) 463 (284-720) 529 (318-798) 73.724 (61.275-86.664) 3.518 (2.707,8-4.334,5) 390 432,1 109 21.460 144,1 633,1 (290,8-496,1) (343-538,1) (86.3-133,8) (13.397-31.019) (82,7-233,9) (480,2-802,4) 1.102.694 29.713 (24.942-34.886) 44.010 (35.016-53.923) 13.136 (10.243-17.135) 22.043 (15.091-28.724) 2.046 2.304 408 7.751 654 3.414 (1.393-2.804) (1.792-2.908) (302-516) (4.807-11.971) (370-1.085) (2.381-4.781) 587.225 1.855 2.017 682 13.709 787 2.917 La carga de la enfermedad en España 2010 Tabla 1 (1.225-2.523) (1.503-2.611) (510-871) (7.898-20.779) (435-1.335) (1.874-3.960) 515.469 211 212 E. Lara et al. A 900 800 DALYs (hundreds) 700 600 500 400 300 200 100 0 <1 1-4 5-9 1014 1519 2024 2529 3034 3539 4044 4549 5054 5559 6064 6569 5054 5559 6064 7074 7579 >80 Age Group B 1800 1600 DALYs (hundreds) 1400 1200 1000 800 600 400 200 0 <1 1-4 5-9 1014 1519 2024 2529 3034 3539 4044 4549 6569 7074 7579 >80 Age Group Male Female Figura 1 A) AVAD en España, en 2010, para todos los trastornos mentales y relacionados con el consumo de sustancias, por sexo y edad. B) AVAD en España, en 2010, para todos los trastornos neurológicos, por sexo y edad. trastornos neurológicos. La migraña constituyó la segunda causa principal de los AVAD en cuanto a trastornos neurológicos (29%), siendo superior entre aquellos con edades comprendidas entre 30 y 50 años. La carga de la epilepsia comenzó en la infancia, se incrementó en la edad adulta y permaneció estable en la edad anciana. Los AVAD debidos a la enfermedad de Parkinson fueron también superiores en la ancianidad. Sin embargo, la migraña y los trastornos por consumo de sustancias permanecieron en la misma posición en 1990 y 2010, aunque reflejaron un incremento en términos de AVAD absolutos entre los 2 puntos cronológicos (11% para trastornos por consumo de sustancias y 13% para migraña). Clasificación de la carga La figura 3 resume las 26 causas principales de AVAD en España, en 1990 y 2010. Esto se calculó utilizando las clasificaciones de la carga elaboradas por el GBD 201015 . La cardiopatía isquémica mantuvo su posición como causa primaria de los AVAD tanto en 1990 como en 2010, aunque una serie de trastornos neuropsiquiátricos ascendieron en la clasificación entre 1990 y 2010. Cuatro de las 20 causas principales de AVAD en 2010 fueron trastornos neuropsiquiátricos (tales como trastornos depresivos, enfermedad de Alzheimer, trastornos por consumo de drogas y migraña). En 1990, los trastornos depresivos fueron clasificados como sexta causa principal de AVAD, aunque se situaron en la cuarta posición en 2010, lo que representa un incremento del 35%. El cambio más notable se observó en la enfermedad de Alzheimer, con un incremento del 145%, que ascendió de la decimoctava posición en 1990 a la vigésima en 2010. La tabla 2 refleja los AVD y los AVP debidos a los trastornos neuropsiquiátricos en España, en 1990 y 2010. En general, las enfermedades y lesiones incluidas en el GBD 2010 generaron 557.066 AVD. Los trastornos mentales y por consumo de sustancias aportaron una importante contribución, representando el 22,4% de todos los AVD en 2010. La depresión supuso la enfermedad más incapacitante (53.081, IC 95%: 39.109-70.258), y representa el 42,6% de los trastornos mentales y por consumo de sustancias. La carga atribuible a la depresión en 1990 fue inferior (39,4%). Los trastornos por consumo de drogas y los trastornos de ansiedad representaron el 14,3 y el 10,7% de los AVD debidos a trastornos mentales y por consumo de sustancias, respectivamente. Las causas principales de los AVD entre los trastornos neurológicos fueron la migraña y la enfermedad de Alzheimer, que representan más del 80% de los AVD debidos a trastornos neurológicos. En comparación a 1990, la enfermedad de Años vividos con discapacidad Comparación de los AVP y los AVD para trastornos neurológicos, mentales y por consumo de sustancias en España para 1990 y 2010 (con un 95% de confianza) 1990 AVD Total trastornos mentales y por consumo de sustancias Esquizofrenia Consumo de alcohol Consumo de drogas Depresión Trastorno bipolar Trastornos de ansiedad Trastornos alimentarios Trastorno generalizado del desarrollo Trastorno del comportamiento en la infancia Incapacidad intelectual idiopática Otros trastornos mentales Total trastornos neurológicos Enfermedad de Alzheimer y otras demencias Enfermedad de Parkinson Epilepsia Esclerosis múltiple Migraña Cefalea tensional Otros trastornos neurológicos Causas totales * 2010 AVD 101.772 7.711 6.910 16.447 40.111 6.961 12.136 2.964 3.998 2.918 920 695 (82.473-123.257) (4.431-11.443) (3.812-11.564) (11.765-21.561) (28.297-53.956) (4.251-10.510) (8.269-16.739) (1.715-4.768) (2.694-5.782) (1.713-4.509) (535-1.425) (410-1.082) 124.641 10.522 7.571 17.845 53.081 8.353 13.311 5.701 4.522 2.097 741 897 34.070 8.583 718 2.920 377 18.935 1.171 1.367 (26.319-43.219) (6.127-11.360) (460-1.143) (2.153-3.811) (265-510) (11.981-27.311) (658-1.880) (1.027-1.762) 46.279 16.407 1.157 3.240 545 21.460 1.441 2.028 443.168 557.066 1990 AVP (101.708-150.323) (5.839-15.914) (4.012-12.358) (12.776-23.345) (39.109-70.258) (5.106-12.512) (9.068-18.564) (3.342-9.249) (3.028-6.489) (1.202-3.234) (380-1.234) (520-1.435) (36.163-58.045) (11.850-21.968) (729-1.890) (2.429-4.252) (373-741) (13.397-31.019) (827-2.339) (1.537-2.617) 35.153 1.056 10.599 2.288 2010 AVP (18.914-47.548) (855-1.476) (5.537-18.836) (8.418-31.842) 45.307 2.253 12.499 29.152 * * * * * * 226 (150-439) 453 (204-656) * * * * * * 392 (244-837) 117.402 57.569 15.863 10.737 4.448 (99.094-14.354) (42.265-78.489) (12.032-22.462) (8.605-14.031) (3.582-5.674) 950 (394-1.428) 274.450 187.724 27.427 10.812 5.454 * * * * 28.785 (19.941-43.024) 602.990 (32.304-79.796) (1.228-2.990) (7.751-26.019) (16.561-58.806) La carga de la enfermedad en España 2010 Tabla 2 (209.235-342.372) (125.343-249.100) (18.802-36.669) (7.725-12.715) (3.984-7.000) 43.033 (27.835-59.329) 545.628 Datos no disponibles. 213 214 E. Lara et al. A Other mental disorders 1750 Idiopathic intellectual disability DALYs (hundreds) 1500 Childhood behavioural disorders Pervasive developmental disorders 1250 Eating disorders 1000 Anxiety disorder 750 Bipolar disorder Depressive disorders 500 Drug use disorders 250 Alcohol use disorders Schizophrenia 0 <1 1-4 5-9 1014 1519 2024 2529 3034 3539 4044 4549 5054 5559 6064 6569 7074 75- >80 79 Age Group B 2500 Other neurological disorders 2250 DALYs (hundreds) 2000 Tension-type headache 1750 Migraine 1500 Multiple sclerosis 1250 1000 Epilepsy 750 Parkinson's disease 500 Alzheimer's disease and other dementias 250 0 <1 1-4 5-9 1014 1519 2024 2529 3034 3539 4044 4549 5054 5559 6064 65- 7069 74 75- >80 79 Age Group Figura 2 A) AVAD en España, en 2010, para cada trastorno mental y relacionados con el consumo de sustancias, por edad. B) AVAD en España, en 2010, para cada trastorno neurológico, por edad. Alzheimer incrementó su contribución a los AVD del 25,2 al 35,5%. Años perdidos por mortalidad prematura En general, las enfermedades y lesiones incluidas en el GBD 2010 generaron 545.628 AVP en 2010. Los trastornos neurológicos representaron 274.450 AVP (IC 95%: 209.235-342.372), equivalentes al 5,03% de los AVP totales. Dentro de este grupo la enfermedad de Alzheimer fue la causa principal de mortalidad, representando el 58,7% de los AVP debidos a trastornos neurológicos. Los trastornos mentales y los trastornos por consumo de sustancias representaron 45.307 AVP (IC 95%: 32.304-79.796), equivalentes al 0,8% de los AVP totales. Dentro de este grupo, los trastornos por consumo de sustancias fueron la principal causa de mortalidad, representando el 64,34% de los AVP debidos a trastornos mentales y por consumo de sustancias (tabla 2). Discusión A pesar de la baja contribución de los trastornos neuropsiquiátricos a los AVP globales, este grupo de trastornos fue el más incapacitante, representando el 30,7% de los AVP totales en España en 2010. En general, la carga de la mayoría de los trastornos neuropsiquiátricos se incrementó entre 1990 y 2010. Este incremento fue impulsado por los cambios en el crecimiento y el envejecimiento de la población y, en ciertos casos (trastornos por consumo de sustancias), incrementos en la tasa de prevalencia. Los trastornos depresivos fueron la causa más incapacitante de los trastornos neuropsiquiátricos debido a la elevada prevalencia y ponderación de la discapacidad asociada a la depresión mayor6 . Sin embargo, es importante destacar que, según lo ilustrado por Whiteford et al. (2013), otros trastornos neuropsiquiátricos tales como la esquizofrenia y la enfermedad de Parkinson fueron clasificados con una elevada ponderación de discapacidad en el GBD 2010, aunque representaron un porcentaje menor de AVD y AVAD debido a que sus prevalencias fueron menores6,24 . La carga de los trastornos neuropsiquiátricos varió a lo largo del abanico vital. La carga fue elevada en jóvenes adultos y ancianos. La elevada proporción de carga debida a los trastornos neuropsiquiátricos en jóvenes adultos podría explicarse en ciertos casos por la aparición temprana de los trastornos asociados a una elevada prevalencia, tales como los trastornos por consumo de sustancias, los trastornos de ansiedad y los trastornos depresivos. Los resultados reflejaron una elevada proporción de carga debido a los trastornos neurológicos en la ancianidad. Esto se explica ampliamente por el incremento de la prevalencia de los trastornos neurológicos altamente incapacitantes, tales como la enfermedad de Alzheimer o la enfermedad de Parkinson. Como la La carga de la enfermedad en España 2010 215 1990 Mean Rank 2010 Mean Rank Median % change 1 Ischemic heart disease 1 Ischemic heart disease -12% 2 Stroke 2 Low back pain 26% 3 Road injury 3 Stroke -27% 4 Low back pain 4 Major depressive disorder 35% 5 Diabetes 5 Diabetes 13% 6 Major depressive disorder 6 Falls 53% 7 Lung cancer 7 Lung cancer 22% 8 Chronic obstructive pulmonary disease 8 Alzheimer´s disease 9 Neck pain 9 Other musculoskeletal 33% 10 Other musculoskeletal 10 Neck pain 23% 11 Falls 11 Chronic obstructive pulmonary disease -4% 12 Cirrhosis 12 Road injury -42% 13 Drug use disorders 13 Colorectal cancer 46% 14 Other cardio & circulatory 14 Drug use disorders 11% 15 Migraine 15 Migraine 13% 16 Colorectal cancer 16 Cirrhosis -25% 17 Breast cancer 17 Other cardio & circulatory -1% 18 Alzheimer´s disease 18 Chronic kidney disease 16% 19 Stomach cancer 19 Breast cancer -2% 20 Lower respiratory infections 20 Osteoarthritis 33% 21 Chronic kidney disease 22 Lower respiratory infections -8% 26 Osteoarthritis 24 Stomach cancer -30% Figura 3 145% Clasificación de las 26 causas principales de AVAD en España, para 1990 y 2010. población envejece debido al incremento de la esperanza de vida, se prevé que también se incremente la carga de las enfermedades que se producen en los ancianos, lo que convierte a los trastornos neuropsiquiátricos en un importante objetivo de la salud actual y futura de la población española25 . Se encontraron diferencias considerables al comparar los datos de España con los resultados globales. En 2010, los trastornos neuropsiquiátricos representaron el 10,4% de todos los AVAD a nivel mundial, y el 15,4% en los países desarrollados15 , mientras que en la población española la cifra fue del 18,4%. Aunque las tendencias son similares en España y en el mundo durante los diferentes años, los trastornos neuropsiquiátricos aportan una mayor contribución a la carga de la enfermedad en España. 216 En relación con la carga de la enfermedad en otros países europeos, observamos que, en general, la carga atribuible a los trastornos neuropsiquiátricos fue también similar. Todas las enfermedades neuropsiquiátricas incluidas en las 20 causas principales de AVAD incrementaron su contribución porcentual desde 1990. De hecho, la depresión fue el trastorno más incapacitante entre los trastornos neuropsiquiátricos en países como Francia, Reino Unido, Alemania e Italia, clasificándose entre la tercera y la séptima posición en términos de AVAD absolutos. Otros trastornos, situados también entre las 20 causas principales de AVAD en Francia, Reino Unido, Alemania e Italia, fueron la enfermedad de Alzheimer, el trastorno por consumo de drogas, la migraña, los trastornos de ansiedad o el trastorno por consumo de alcohol, con porcentajes variables26-29 . Los hallazgos del GBD 2010 están en línea con los hallazgos de los estudios epidemiológicos previos que demostraron el elevado impacto de los trastornos neuropsiquiátricos en la población8,10 . Por ejemplo, el estudio ESEMeD reportó una elevada prevalencia de los trastornos mentales en España, particularmente la depresión7 . Los análisis separados de la carga en España han subrayado también el impacto de los trastornos neuropsiquiátricos, aunque existieron diferencias en cuanto a la metodología utilizada para calcular la carga. Dichos estudios también destacaron a los trastornos neuropsiquiátricos como principales contribuidores a los AVAD totales, especialmente en mujeres y en edades comprendidas entre los 15 y los 30 años30,31 . De igual modo, la demencia fue también destacada como gran contribuidora a la carga de la enfermedad en los ancianos32 . La investigación centrada en las regiones españolas de Valencia y Andalucía obtuvo resultados comparables33,34 . A pesar de estos hallazgos, los costes directos e indirectos de los trastornos neuropsiquiátricos no están debidamente cubiertos en muchos países35 . El presupuesto fijado para los trastornos neuropsiquiátricos en España representa menos del 10% del gasto público sanitario36 , no estando en línea con nuestros resultados, que destacan a los trastornos neuropsiquiátricos como los principales contribuidores a la discapacidad. Nuestros hallazgos subrayan la importancia de priorizar los trastornos neuropsiquiátricos en las políticas sanitarias nacionales, asignando recursos para su prevención y gestión. E. Lara et al. la enfermedad deberá explorar el modo en que los cambios recientes en dichas directrices (por ejemplo, los cambios propuestos en la última versión de DSM) tienen un impacto sobre la carga estimada de los trastornos neuropsiquiátricos en España. En tercer lugar, los trastornos neuropsiquiátricos contribuyeron en una proporción menor a los AVP en comparación a los AVD. Las directrices ICD-10 utilizadas en las asignaciones de las causas de muerte en el GBD 2010 pueden atribuir únicamente las muertes a una causa directa (en lugar de subyacente). Por ello, las muertes debidas a los trastornos neuropsiquiátricos fueron asignadas a otras causas en el GBD 2010 (es decir, muertes por suicidio debidas a trastornos mentales que se asignaron a lesiones)9,22,37 . En cuarto lugar se encuentra la no inclusión de las consecuencias sociales en la estimación de las ponderaciones de la discapacidad. No se incluyó el impacto de los trastornos neuropsiquiátricos en la funcionalidad y en la sociedad a la larga, aun habiendo sido divulgado38,39 . Por último, aunque se presentaron intervalos de confianza del 95% para todos los hallazgos de alto nivel en el GBD 2010, dada la falta de datos disponibles sobre la epidemiología de los trastornos neuropsiquiátricos, dichos intervalos fueron a menudo grandes y superpuestos. Esto debe considerarse a la hora de interpretar los hallazgos. Con una investigación epidemiológica continua, y actualizaciones de los cálculos del GBD, confiamos en poder reducir las fuentes de confianza inexplicadas que se sitúan alrededor de los cálculos de la carga de los trastornos neuropsiquiátricos. Conclusiones Este estudio contribuye a la comprensión de la carga de los trastornos neuropsiquiátricos en España, demostrando que deben considerarse como un componente integral del sistema sanitario público. Los hallazgos subrayan la urgente necesidad de que la política sanitaria se centre en el desarrollo de enfoques efectivos y razonables para reducir la carga existente de los trastornos neuropsiquiátricos en España, así como de programas de prevención para reducir los casos incidentales de estos trastornos en la población. Dicho esto, se precisa más investigación para una mejor comprensión de la carga. Los estudios futuros deberán considerar también la contribución de los determinantes sociales y económicos a la carga de los trastornos neuropsiquiátricos. Limitaciones Financiación A pesar del progreso realizado en comparación con los estudios GBD previos, a la hora de interpretar los hallazgos debemos considerar las limitaciones asociadas al GBD 2010. En primer lugar, como el número de trastornos incluidos fue limitado, la carga de los trastornos neuropsiquiátricos puede haberse subestimado. Los trastornos se incluyeron cuando existieron datos suficientes para derivar unos cálculos de la carga defendibles. Por tanto, no se incluyeron los trastornos tales como los de personalidad, trastornos somatoformes y abuso de sustancias. En segundo lugar, los trastornos neuropsiquiátricos fueron definidos con arreglo a las directrices DSM e ICD, que pueden no capturar todas las presentaciones de los mismos. Sin embargo, ello fue necesario para facilitar la comparación de los datos epidemiológicos y los cálculos de las cargas entre los diferentes centros. El trabajo futuro sobre la carga de Este estudio fue financiado por la Fundación Bill & Melinda Gates. Fue realizado como parte del GBD 2010.Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses. ASgradecimientos Nos gustaría expresar nuestro agradecimiento a todos los miembros que han aportado su contribución al estudio Global Burden of Disease Study 2010 (GBD 2010). En especial, nos gustaría agradecer su contribución al Grupo Experto en Trastornos Neurológicos, Mentales y por Consumo de Sustancias y Drogas Ilícitas del GBD 2010. También nos gustaría expresar nuestro más profundo agradecimiento a todos los participantes españoles en el estudio. La carga de la enfermedad en España 2010 217 Bibliografía 1. Das P, Samarasekera U. The story of GBD 2010: A ‘super-human’ effort. Lancet. 2012;380:2067---70. 2. Lim SS, Vos T, Flaxman AD, Danaei G, Shibuya K, Adair-Rohani H, et al. A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions, 1990-2010: A systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380:2224---60. 3. Murray CJ, Lopez AD. Global mortality, disability, and the contribution of risk factors: Global Burden of Disease Study. Lancet. 1997;349:1436---42. 4. Murray CJL, Lopez AD. Alternative projections of mortality and disability by cause 1990-2020: Global Burden of Disease Study. Lancet. 1997;349:1498---504. 5. López A, Murray C. The global burden of disease, 1990-2020. Nat Med. 1998;4:1241---3. 6. Whiteford HA, Degenhardt L, Rehm J, Baxter AJ, Ferrari AJ, Erskine HE, et al. Global burden of disease attributable to mental and substance use disorders: Findings from the Global Burden of Disease Study 2010. Lancet. 2013;382:1575---86. 7. Haro JM, Palacín C, Vilagut G, Martínez M, Bernal M, Luque I, et al. Prevalencia de los trastornos mentales y factores asociados: Resultados del estudio ESEMeD-España. Med Clin (Barc). 2006;126:445---51. 8. Kessler R. Prevalence, Severity, and Unmet Need for Treatment of Mental Disorders in the World Health Organization World Mental Health Surveys. Am Med Assoc. 2004;291:2581---90. 9. Moussavi S, Chatterji S, Verdes E, Tandon A, Patel V, Ustun B. Depression, chronic diseases, and decrements in health: Results from the World Health Surveys. Lancet. 2007;370: 851---8. 10. King M, Nazareth I, Levy G, Walker C, Morris R, Weich S, et al. Prevalence of common mental disorders in general practice attendees across Europe. Br J Psychiatry. 2008;192:362---7. 11. Instituto Nacional de Estadística. Defunción según causa de muerte; 2012. p. 1---14. 12. Reynols EH. Brain and mind: A challenge for WHO. Lancet. 2003;361:3---4. 13. Murray CJL, Ezzati M, Flaxman AD, Lim S, Lozano R, Michaud C, et al. GBD 2010: Design, definitions, and metrics. Lancet. 2012;380:2063---6. 14. Vos T, Flaxman AD, Naghavi M, Lozano R, Michaud C, Ezzati M, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: A systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380:2163---96. 15. Murray CJL, Vos T, Lozano R, Naghavi M, Flaxman AD, Michaud C, et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: A systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380:2197---223. 16. Whiteford HA, Ferrari AJ, Baxter AJ, Charlson FJ, Degenhardt L. How did we arrive at burden of disease estimates for mental and illicit drug use disorders in the Global Burden of Disease Study 2010. Curr Opin Psychiatry. 2013;26:376---83. 17. Horton R. GBD 2010: Understanding disease, injury, and risk. Lancet. 2012;380:2053---4. 18. American Psychiatric Association. Diagnostic and statistical manual of mental disorders (DSM-IV-TR). 4th text revision edition Washington, DC: American Psychiatric Association; 2000. 19. WHO. The ICD-10 classification of mental and behavioural disorders: Diagnostic criteria for research. Geneva: World Health Organization; 1993. 20. Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: A systematic 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380:2095---128. Murray CJ, Richards MA, Newton JN, Fenton KA, Anderson HR, Atkinson C, et al. UK health performance: findings of the Global Burden of Disease Study 2010. Lancet. 2013;381:997---1020. Salomon JA, Vos T, Hogan DR, Gagnon M, Naghavi M, Mokdad A, et al. Common values in assessing health outcomes from disease and injury: Disability weights measurement study for the Global Burden of Disease Study 2010. Lancet. 2012;380:2129---43. Murray CJL, Acharya AK. Understanding DALYs. J Health Econ. 1997;16:703---30. Rössler W, Salize HJ, van Os J, Riecher-Rössler A. Size of burden of schizophrenia and psychotic disorders. Eur Neuropsychopharmacol. 2005;15:399---409. Salomon Ja, Wang H, Freeman MK, Vos T, Flaxman AD, Lopez AD, et al. Healthy life expectancy for 187 countries, 1990-2010: A systematic analysis for the Global Burden Disease Study 2010. Lancet. 2012;380:2144---62. Institute for Health Metrics and Evaluation. GBD profile: France [consultado 20 Feb 2014]. Disponible en: http://www. healthdata.org/sites/default/files/files/country profiles/GBD/ ihme gbd country report france.pdf Institute for Health Metrics and Evaluation. GBD profile: United Kingdom [consultado 20 Feb 2014]. Disponible en: http://www.healthdata.org/sites/default/files/files/country profiles/GBD/ihme gbd country report united kingdom.pdf Institute for Health Metrics and Evaluation. GBD profile: Germany [consultado 20 Feb 2014]. Disponible en: http://www. healthdata.org/sites/default/files/files/country profiles/GBD/ ihme gbd country report germany.pdf Institute for Health Metrics and Evaluation. GBD profile: Italy [consultado 20 Feb 2014]. Disponible en: http://www. healthdata.org/sites/default/files/files/country profiles/GBD/ ihme gbd country report italy.pdf Genova-Maleras R, Alvarez-Martin E, Morant-Ginestar C, de Larrea-Baz NF, Catala-Lopez F. Measuring the burden of disease and injury in Spain using disability- adjusted life years. Public Health. 2012;126:1024---31. Catalá-López F, Gènova-Maleras R, Álvarez-Martín E. Carga de enfermedad en adolescentes y jóvenes en España. Rev Psiquiatr Salud Ment (Barc). 2013;6:80---5. Gènova-Maleras R, Álvarez-Martín E, Catalá-López F, Fernández de Larrea-Baz N, Morant-Ginestar C. Burden of disease in the elderly population in Spain. Gac Sanit. 2011;25 Suppl 2:47---50. Catalá-López F, Gènova-Maleras R, Ridao M, Álvarez E, SanfélixGimeno G, Morant C, et al. Burden of disease assessment with summary measures of population health for the Region of Valencia, Spain: A population-based study. Med Clin (Barc). 2012;140:343---50. Junta de Andalucía, Consejería de Salud. La carga de enfermedad en Andalucía en el año; 2008:1-9. Olesen J, Gustavsson A, Svensson M, Wittchen H-U, Jönsson B. The economic cost of brain disorders in Europe. Eur J Neurol. 2012;19:155---62. McDaid D, Knapp M, Curran C, MHEEN Group. Financing Arrangements for Mental Health in Western Europe. Mental Health Economics European Network. Phase 1. Final Report to the European Commission. Luxembourg: European Commission; 2004. Rehm J, Mathers C, Popova S, Thavorncharoensap M, Teerawattananon Y, Patra J. Global burden of disease and injury and economic cost attributable to alcohol use and alcohol-use disorders. Lancet. 2009;373:2223---33. Marmot M. Public Health Social determinants of health inequalities. Lancet. 2005;365:1099---104. Gustavsson A, Svensson M, Jacobi F, Allgulander C, Alonso J, Beghi E, et al. Cost of disorders of the brain in Europe 2010. Eur Neuropsychopharmacol. 2011;21:718---79. Rev Psiquiatr Salud Ment (Barc.). 2015;8(4):218---223 www.elsevier.es/saludmental ORIGINAL BREVE Curso de la enfermedad y calidad de vida en pacientes mexicanos con psicosis Lizzette Gómez-de-Regil Unidad de Investigación, Hospital Regional de Alta Especialidad de la Península de Yucatán, Mérida, Yucatán, México Recibido el 6 de agosto de 2013; aceptado el 14 de diciembre de 2013 Disponible en Internet el 13 de marzo de 2014 PALABRAS CLAVE Curso de la enfermedad; Calidad de vida; Mexicanos; Psicosis; Esquizofrenia KEYWORDS Illness course; Quality of life; Mexican; Psychosis; Schizophrenia Resumen Objetivo: Analizar las diferencias en la calidad de vida de pacientes con psicosis comparados de acuerdo con el curso de la enfermedad. Método: Se usaron las historias clínicas y la SCID-I para establecer el curso de la enfermedad, que se clasificó conforme a 3 criterios: a) recaídas, b) síntomas residuales y c) diagnóstico clínico primario. La calidad de vida subjetiva se evaluó con el cuestionario Sevilla. Resultados: Participaron 61 pacientes (el 56% mujeres) que, en general, refirieron un nivel de calidad de vida adecuado. El curso de la enfermedad, caracterizado por la presencia de síntomas residuales, más que por la experiencia de recaídas o la evolución de un primer episodio de psicosis a esquizofrenia, reveló un efecto negativo sobre la calidad de vida percibida por los pacientes. Conclusiones: Los servicios clínicos ofrecidos a los pacientes con psicosis han de enfocarse no solo en la remisión de los síntomas y prevención de las recaídas sino también en la obtención del restablecimiento con una calidad de vida satisfactoria. Puesto que se han identificado los síntomas residuales como un factor esencial que afecta de modo negativo a la calidad de vida, los médicos han de valorarlos cuidadosamente a fin de lograr el mayor grado posible de restablecimiento del paciente. © 2013 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. Illness course and quality of life in Mexican patients with psychosis Abstract Objective: To analyze the differences in the quality of life of patients with psychosis according to the course of the illness. Method: Clinical records and SCID-I interviews were used to establish the course of the illness and to categorize it according to 3 criteria: a) relapses, b) residual symptoms, and c) clinical diagnosis. Subjective quality of life was assessed with the Seville Questionnaire. Correo electrónico: [email protected] 1888-9891/$ – see front matter © 2013 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. http://dx.doi.org/10.1016/j.rpsm.2013.12.001 Curso de la enfermedad y calidad de vida en pacientes mexicanos con psicosis 219 Results: Sixty one patients (56% women) participated, reporting a mostly adequate quality of life. An illness course characterized by the presence of residual symptoms, rather than by the occurrence of any relapse or the progression of a first-episode psychosis into schizophrenia, showed a negative effect on the perceived quality of life of patients. Conclusions: The clinical services provided to patients with psychosis should focus not only on symptoms remission and relapse prevention, but also achieving a recovery with a satisfactory quality of life. Having identified residual symptoms as a crucial factor negatively affecting quality of life, clinicians must carefully assess them and treat them, in order to achieve the best possible recovery. © 2013 SEP y SEPB. Published by Elsevier España, S.L.U. All rights reserved. Introducción En la actualidad los expertos han alcanzado un consenso general acerca de que las psicosis del espectro de la esquizofrenia ya no significan un curso inexorable hacia el deterioro y que un primer episodio de psicosis puede seguir cursos muy diversos −desde el restablecimiento íntegro del paciente hasta una cronificación1 . Además, las pruebas sugieren que, si acontecen, el deterioro y/o las recidivas, son más probables en los 3-5 primeros años tras el inicio de la psicosis (el «período crítico»); más adelante, la enfermedad parece estabilizarse2,3 . Por lo tanto, el curso de la psicosis puede estabilizarse en los primeros años y no todos los casos evolucionarán en una psicosis persistente o devastadora. Con respecto al diagnóstico, después de alrededor de 6 meses de evolución, la psicosis puede clasificarse como una esquizofrenia u otro tipo de psicosis no afectiva4 . Otros criterios usados para valorar su curso son la presencia de síntomas residuales5 y la incidencia de recidivas posteriores5,6 . En el tratamiento de salud mental, con las perspectivas actuales, el objetivo no solo es obtener la remisión (desaparición o atenuación de la presencia y la gravedad de los síntomas básicos de la enfermedad) sino también el restablecimiento, que comprende la remisión, unos desenlaces funcionales y psicosociales adecuados y una calidad de vida satisfactoria7 . La investigación y la política de salud pública y los programas de medicina han adoptado el concepto de calidad de vida relacionada con la salud para valorar los efectos de las enfermedades crónicas (p. ej., la esquizofrenia) sobre el funcionamiento diario de los pacientes, su satisfacción con la vida y cómo se relaciona con diversos índices de salud (entre otros, demográficos, sociales, económicos, accesibilidad y cobertura). Con respecto al curso diagnóstico, aunque la investigación indica que los pacientes con esquizofrenia experimentan una calidad de vida significativamente más desfavorable8 , no parecen más afectados comparados con pacientes con otros tipos de psicosis9 . Un curso recurrente10 y la psicopatología residual11 también se han relacionado con una disminución de la calidad de vida. Esta es una variable tan importante como compleja, y la investigación ha proporcionado pruebas de cómo puede estar influida por diversos factores sociodemográficos, clínicos, sociales y terapéuticos8,9 . Se han propuesto diversos parámetros o escalas para su valoración8 . Es indudable que la calidad de vida corre el riesgo de experimentar una afectación negativa cuando el paciente manifiesta un episodio psicótico, pero, puesto que el curso de la enfermedad es muy variable, es necesario investigar las diferencias en la calidad de vida de pacientes con psicosis cuando se comparan de acuerdo con el curso de su enfermedad, lo que constituye el objetivo del presente estudio. Los conocimientos del efecto individual del curso diagnóstico, recurrente o sintomático de la psicosis sobre la calidad de vida facilitarían la identificación de los pacientes que necesitan más apoyo y recursos para obtener un restablecimiento satisfactorio. Métodos El presente estudio se efectuó en un hospital psiquiátrico público de México una vez obtenida la autorización formal y la aprobación ética del comité de investigación del hospital. Se revisaron las historias clínicas en la búsqueda de pacientes que cumplieran los siguientes criterios de inclusión: a) incidencia de un primer episodio de psicosis 5-11 años atrás (de modo que todos los pacientes hubieran superado el período crítico); b) edad de inicio: 16-45 años; c)diagnóstico actual primario de esquizofrenia u otro trastorno psicótico en función de los criterios del Manual diagnóstico y estadístico de los trastornos mentales (Diagnostic and Statistical Manual of Mental Disorders [DSM-IV-TR])4 ; y d) habitante de la ciudad de Mérida, donde se localiza el hospital. Los criterios de exclusión fueron: a) psicosis de tipo afectivo, orgánico o tóxico4 , b) un trastorno intelectual evidente y c) información de contacto insuficiente. De los 103 pacientes con los que contactamos, 5 no pudieron participar debido a la acusada gravedad de los síntomas. De los restantes, 61 (62,2%) estuvieron de acuerdo en ser entrevistados, firmando un formulario de consentimiento informado y sin que mediara una compensación económica. En el momento de la valoración de los pacientes se utilizaron las historias clínicas y entrevistas structured clinical interview for DSM disorders (SCID-I)12 para establecer el curso de la enfermedad y para clasificarlo de acuerdo con 3 criterios: a) recidivas, b) síntomas residuales y c) diagnóstico clínico primario. Los síntomas residuales son los signos del trastorno manifestados por: (i) solo síntomas negativos o (ii) 2 o más síntomas característicos (delirios, alucinaciones, lenguaje desorganizado e incoherencia, comportamiento claramente desorganizado o catatónico, 220 L. Gómez-de-Regil Tabla 1 Estadística descriptiva para la calidad de vida (n = 61) Subescalas de calidad de vida Media (DE) Mediana Puntuación total por encima de la mediaa (%) Favorables Satisfacción vital Autoestima Armonía Desfavorables Falta de percepción cognitiva Falta de energía Falta de control interno Dificultades de expresión emocional Dificultades de expresión cognitiva Excentricidades Miedo a perder el control Hostilidad contenida Automatismos 2,8 3,2 2,9 3,1 1,7 1,6 1,8 1,8 1,8 1,7 1,7 1,5 1,5 1,6 3,1 3,2 3,0 3,3 1,6 1,6 1,7 1,6 1,8 1,4 1,5 1,3 1,3 1,3 70,5 82,0 73,8 78,7 13,1 9,8 18,0 21,3 19,7 21,3 9,8 8,2 6,6 14,8 a (0,6) (0,7) (0,7) (0,8) (0,6) (0,6) (0,7) (0,8) (0,8) (0,7) (0,8) (0,6) (0,6) (0,7) Los ítems Individuales pudieron puntuar desde 1 a 4; por lo tanto, el valor de la puntuación media es 2,5. y síntomas negativos), presentes de una forma atenuada (subumbrales) (p. ej., pensamientos o creencias extraños o experiencias perceptivas insólitas)4 . Una recidiva (episodio psicótico posterior) se define como «la incidencia de cualquier modificación mayor pertinente del cuadro psicopatológico, lo que propicia que el paciente sea derivado a un centro psiquiátrico o aumentar la dosis de la medicación antipsicótica, o ser ingresado en el hospital»6 . Una recidiva podría haber ocurrido como un cambio desde (1) un estado de restablecimiento completo (ausencia de síntomas psicóticos) hasta la reaparición de síntomas psicóticos, o (2) un estado de restablecimiento parcial (estado estable de síntomas persistentes) hasta una exacerbación clara de los síntomas psicóticos5 . La calidad subjetiva de vida se evaluó con el cuestionario Sevilla13 , un cuestionario autoevaluado con escalas de Likert, de 59 ítems, formulado para pacientes con esquizofrenia. Este cuestionario consta de una escala de aspectos favorables y otra de aspectos desfavorables, con 3 y 9 subescalas, respectivamente (tabla 1). En primer lugar, se analizó la calidad de vida referida por la muestra total, obteniendo medias, desviaciones estándar y medianas para las puntuaciones conseguidas en la escala total y las subescalas. Además, se obtuvo el porcentaje de participantes cuya puntuación (total y por subescala) obtenida fue mayor que la media (es decir de 2,5 en un intervalo de 1 a 4). Acto seguido, los pacientes fueron asignados a uno de 2 grupos según si habían experimentado o no una recidiva, y las puntuaciones medias de calidad de vida conseguidas se compararon con una prueba de la t para muestras independientes, estableciendo un nivel de significación de p = 0,05. Se siguió el mismo proceso para clasificar a los pacientes que presentaron o no síntomas residuales en el momento de la valoración y, por último, para clasificar a los pacientes de acuerdo con el diagnóstico de esquizofrenia u otro tipo de psicosis. Todos los análisis estadísticos se procesaron con un programa informático SPSS versión 19. Resultados En el momento de la valoración, ningún participante estaba hospitalizado; sin embargo, el 50,8% habían sido hospitalizados, como mínimo, en una ocasión, y el 34,4% habían sido hospitalizados cuando tuvo lugar el primer episodio de psicosis. El curso medio de la enfermedad era de 6,7 años (DE = 1,9; límites 3,8---11,2). La edad media actual era de 35,9 años (DE = 10) y la edad media al inicio de la psicosis fue de 29,1 años (DE = 9,8). La mayoría de los participantes (un 49,2%) eran solteros; el 42,6% estaban casados/tenían pareja; y el 8,2% estaban divorciados/separados. La mayoría seguían viviendo con sus padres (un 54,1%) y su nivel de estudios era de ≤ 9 años (un 55,7%). Con respecto a la ocupación, el 34,4% refirió que era responsable de las tareas domésticas; el 44,3% trabajaba por cuenta propia, mientras que el 21,3% carecía de ocupación formal. Las mujeres representaron el 56% de la muestra; no se identificaron diferencias significativas de sexo para las 3 variables mencionadas previamente. La tabla 1 presenta la estadística descriptiva correspondiente a la calidad de vida. No se detectaron diferencias significativas de sexo para ninguna subescala. Los participantes refirieron en su mayor parte una calidad de vida adecuada: para todas las medias de la dimensión favorable obtuvieron puntuaciones de más de 3 y para todas las medias de la dimensión desfavorable obtuvieron puntuaciones de menos de 2. Estos resultados positivos se confirman cuando se observan las puntuaciones medianas y el porcentaje de participantes con puntuaciones por encima y por debajo de la puntuación media (2,5) en las dimensiones favorable y desfavorable, respectivamente. La tabla 2 presenta la distribución de casos de acuerdo con los 3 criterios y las diferencias del curso de la enfermedad cuando se comparan las puntuaciones de calidad de vida entre grupos. Con respecto a las distribuciones del curso de la enfermedad, el 39,3% experimentó recidivas, mientras que un 60,7% solo experimentó un episodio de psicosis; en Diferencias en la calidad de vida de acuerdo con el curso de la enfermedad (n = 61) Subescalas de calidad de vida, media (DE) Recidivas Síntomas residuales Diagnóstico Cualquier recidiva n = 37 Episodio aislado n = 24 t(59) p Presentes n = 30 Ausentes n = 31 t(59) p Esquizofrenia n = 41 Otras psicosis n = 20 Favorables Satisfacción vital Autoestima Armonía 2,7 3,0 2,8 3,0 (0,6) (0,8) (0,7) (0,9) 2,9 3,3 3,0 3,3 (0,6) (0,7) (0,8) (0,6) −1,25 −1,34 −0,59 −1,66 0,22 0,19 0,56 0,10 2,6 2,9 2,6 2,9 (0,7) (0,8) (0,8) (0,8) 3,0 3,4 3,2 3,3 (0,5) (0,6) (0,6) (0,7) −3,00a −2,64a −3,18b −2,23a 0,00 0,01 0,00 0,03 2,7 3,1 2,8 2,9 (0,7) (0,8) (0,8) (0,8) 3,0 3,3 3,0 3,4 (0,5) (0,7) (0,6) (0,5) −1,59 −1,40 −0,83 −2,05a 0,12 0,17 0,41 0,05 Desfavorables Falta de percepción cognitiva Falta de energía Falta de control interno Dificultades de expresión emocional Dificultades de expresión cognitiva Excentricidades Miedo a perder el control Hostilidad contenida Automatismos 1,8 1,7 1,9 1,9 1,9 1,8 1,7 1,6 1,5 1,7 (0,6) (0,6) (0,7) (0,7) (0,8) (0,7) (0,8) (0,7) (0,6) (0,8) 1,6 1,5 1,7 1,7 1,8 1,4 1,7 1,3 1,4 1,4 (0,5) (0,5) (0,7) (0,8) (0,8) (0,5) (0,9) (0,4) (0,6) (0,6) 1,34 1,42 0,81 1,30 0,40 2,14* −0,12 2,11* 0,44 1,69 0,19 0,16 0,42 0,20 0,69 0,04 0,91 0,04 0,66 0,10 1,9 1,6 2,1 2,1 2,1 1,9 1,9 1,7 1,7 1,8 (0,7) (0,6) (0,8) (0,8) (0,8) (0,7) (0,9) (0,8) (0,8) (0,8) 1,5 1,6 1,6 1,6 1,6 1,5 1,5 1,2 1,2 1,4 (0,5) (0,6) (0,5) (0,6) (0,6) (0,6) (0,7) (0,3) (0,3) (0,6) 2,93a 0,51 3,13a 2,36a 2,89a 2,50a 1,57a 3,25b 3,33b 1,97a 0,01 0,61 0,00 0,02 0,01 0,02 0,12 0,00 0,00 0,05 1,7 1,6 1,8 1,8 1,8 1,7 1,7 1,5 1,4 1,6 (0,6) (0,6) (0,7) (0,8 (0,8) (0,7) (0,8) (0,6) (0,5) (0,7) 1,7 1,6 1,8 1,8 2,0 1,6 1,8 1,5 1,6 1,6 (0,6) (0,6) (0,8) (0,8) (0,7) (0,6) (1,0) (0,7) (0,8) (0,8) −0,70 −0,36 −0,14 0,09 −0,72 0,87 −0,40 0,08 −1,06 0,13 0,94 0,72 0,89 0,93 0,48 0,39 0,69 0,94 0,29 0,90 t(59) p Curso de la enfermedad y calidad de vida en pacientes mexicanos con psicosis Tabla 2 Resultados significativos (p ≤ 0,05) en negrita. a Tamaño medio del efecto (≥ 0,5). b Tamaño grande del efecto (≥ 0,8). 221 222 el momento de la valoración, el 50,8% se encontraba libre de síntomas residuales; el 67,2% presentó esquizofrenia (14 paranoide, 2 desorganizada y 25 residual) y el 32,8% restante otros tipos de psicosis (8 esquizoafectiva, 7 delirante, 2 esquizofreniforme, 2 breve y una no especificada de otro modo). Si se consideran las puntuaciones globales, puede observarse (tabla 2) que el criterio de síntomas residuales fue el único que mostró diferencias significativas entre grupos y, en ambas escalas, favorable y desfavorable. Además, los pacientes sin síntomas residuales obtuvieron una puntuación más favorable en 11 (10 de ellas estadísticamente significativas) de las 12 subescalas de calidad de vida, mientras que los criterios de recidivas y diagnóstico solo detectaron 2 y una diferencia significativa, respectivamente. En resumen, el criterio de síntomas residuales, más que el de diagnóstico o recidivas, reveló diferencias firmes y principalmente significativas en la mayoría de las dimensiones de calidad de vida, refiriendo los pacientes con síntomas residuales una peor calidad de vida, en comparación con aquellos libres de estos síntomas. Discusión Con independencia del curso de la enfermedad, y coincidiendo con los estudios previos efectuados en muestras de individuos de origen hispanoamericano14 , los participantes apenas refirieron una afectación de la calidad de vida. Esta evidencia no solo respalda una visión más optimista de la psicosis cuando se alcanza el restablecimiento y que es posible una calidad de vida satisfactoria sino que también formula la pregunta de por qué los pacientes de los países desarrollados refieren una peor calidad de vida en comparación con los demás. Se ha propuesto que los contextos sociales y culturales con un entorno menos competitivo y unas exigencias de vida más moderadas, como los países hispanoamericanos, podrían ser influencias clave en este fenómeno14 . La psicopatología residual se ha relacionado con una peor calidad de vida11 ; además, estos resultados sugieren que un curso de la enfermedad caracterizado por síntomas residuales, más que por la incidencia de una recidiva o la evolución de un primer episodio de psicosis en esquizofrenia, produce un efecto negativo sobre la calidad de vida percibida de los pacientes. Los síntomas residuales, relacionados o no con posibles efectos adversos del tratamiento, pueden influir en el bienestar subjetivo indirectamente a través de su intromisión en la enfermedad, afectando al funcionamiento social del individuo, las percepciones sobre la salud general y limitando el papel desempeñado por la persona debido a problemas emocionales15 , lo que no solo disminuye los desenlaces de refuerzo positivo derivados de actividades apreciadas sino también la sensación de control personal; por consiguiente, limita la capacidad de obtener desenlaces positivos y/o evitar los negativos16 . Debido al diseño del presente estudio, no se analizó apropiadamente la información sobre prescripción terapéutica y adhesión al tratamiento; por lo tanto, no pueden proporcionarse con precisión interpretaciones más detalladas de los factores que son la base de los síntomas residuales. Además, una valoración en mayor profundidad de la L. Gómez-de-Regil psicopatología y de la funcionalidad abriría la posibilidad de hacer interpretaciones adicionales y más precisas. La calidad de vida es un desenlace tanto importante como complejo, influido por una serie de factores psicológicos y ambientales. Para la investigación futura, es preciso considerar su registro más riguroso y objetivo, al igual que el de otros datos pertinentes desde el inicio (o más precozmente) durante los años siguientes. Aparte de estas limitaciones, el presente estudio proporciona algunos hallazgos interesantes con respecto a una posible asociación entre el curso de la enfermedad (recidivas, síntomas residuales y diagnóstico) y la calidad de vida; no obstante, es preciso reconocer que un diseño prospectivo permitiría un registro más preciso y extenso de la información, en particular si se tiene en cuenta que la psicosis es una enfermedad de probable variación con el tiempo y, por esta razón, también puede variar la manera en la que el paciente percibe su calidad de vida. Además, una muestra a mayor escala, evaluada en repetidas visitas con el tiempo (es decir, en diferentes puntos de evolución), permitiría un análisis en mayor profundidad por diagnóstico y perfil clínico, lo que mejoraría la posibilidad de generalizar los resultados del presente estudio. En los servicios clínicos proveídos a los pacientes con psicosis no solo se debe prestar atención a la remisión de los síntomas y a la prevención de las recidivas sino que el objetivo debe ser la provisión de un restablecimiento de los pacientes asociado a una calidad de vida satisfactoria. Al haber identificado los síntomas residuales como un factor decisivo que afecta de modo negativo a la calidad de vida, es preciso que los médicos valoren cuidadosamente estos síntomas y los traten para obtener un restablecimiento hasta el mayor grado posible. Responsabilidades éticas Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales. Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes. Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes. Conflicto de intereses Los autores declaran que no existe ningún conflicto de intereses. Agradecimientos Los autores desean expresar su agradecimiento al Consejo Nacional de Ciencia y Tecnología (CONACyT), México, por la concesión de una beca doctoral (187498), al Hospital Psiquiátrico Yucatán por su apoyo, al igual que a todos los participantes incluidos en el estudio. Curso de la enfermedad y calidad de vida en pacientes mexicanos con psicosis Bibliografía 1. Jablensky A, Sartorius N, Ernberg G, Anker M. Schizophrenia: Manifestations, incidence and course in different cultures. A World Health Organization ten-country study. Psychol Med Monogr Suppl. 1992;20:1---97. 2. Srihari VH, Shah J, Keshavan MS. Is early intervention for psychosis feasible and effective? Psychiatr Clin North Am. 2012;35:613---31. 3. Tandon R, Nasrallah HA, Keshavan MS. Schizophrenia, «Just the facts» 4. Clinical features and conceptualization. Schizophr Res. 2009;110:1---23. 4. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 4th ed., text revision Washington, DC: Author; 2000. 5. Rosen K, Garety P. Predicting recovery from schizophrenia: A retrospective comparison of characteristics at onset of people with single and multiple episodes. Schizophr Bull. 2005;31:735---50. 6. Altamura AC, Bassetti R, Sassella F, Salvadori D, Mundo E. Duration of untreated psychosis as a predictor of outcome in first-episode schizophrenia: A retrospective study. Schizophr Res. 2001;52:29---36. 7. Ciudad A, Bobes J, Álvarez E, San L, Novick D, Gilaberte I. Resultados clínicos relevantes en esquizofrenia: remisión y recuperación. Rev Psiquiatr Salud Ment. 2011;4:53---65. 8. Pinikahana J, Happell B, Hope J, Keks NA. Quality of life in schizophrenia: A review of the literature from 1995 to 2000. Int J Ment Health Nurs. 2002;11:103---11. 223 9. Ritsner M, Kurs R, Gibel A, Hirschmann S, Shinkarenko E, Ratner Y. Predictors of quality of life in major psychoses: A naturalistic follow-up study. J Clin Psychiatry. 2003;64: 308---15. 10. Nasrallah HA, Lasser R. Improving patient outcomes in schizophrenia: Achieving remission. J Psychopharmacol. 2006;20: 57---61. 11. Theodore K, Johnson S, Chalmers-Brown A, Doherty R, Harrop C, Ellett L. Quality of life and illness beliefs in individuals with early psychosis. Soc Psychiatry Psychiatr Epidemiol. 2012;47:545---51. 12. First MB, Spitzer RL, Gibbon M, Williams JBW. Structured clinical interview for the DSM-IV axis I disorders (SCID). New York: New York State Psychiatric Institute, Biometrics Research; 1995. 13. Giner J, Ibañez E, Baca E, Bobes J, Leal C, Cervera S. Desarrollo del Cuestionario Sevilla de Calidad de Vida (CSCV). Actas LusoEsp Neurol Psiquiatr. 1997;25 Supl. 2:11---23. 14. Caqueo-Urízar A, Gutiérrez-Maldonado J, Ferrer-García M, Fernández-Dávila P. Calidad de vida en pacientes con esquizofrenia de ascendencia étnica Aymara en el norte de Chile. Rev Psiquiatr Salud Ment. 2012;5:121---6. 15. Zouari L, Thabet JB, Elloumi Z, Elleuch M, Zouari N, Maâlej M. Quality of life in patients with schizophrenia: A study of 100 cases. Encephale. 2012;38:111---7. 16. Devins GM. Using the Illness Intrusiveness Ratings Scale to understand health-related quality of life in chronic disease. J Psychosom Res. 2010;68:591---602. Rev Psiquiatr Salud Ment (Barc.). 2015;8(4):224---231 www.elsevier.es/saludmental ORIGINAL Riesgo de suicidio de hombres internos con condena en centros penitenciarios Javier Saavedra a,∗ y Marcelino López b a Departamento de Psicología Experimental, Universidad de Sevilla, Sevilla, España Departamento de Evaluación y Programas, Fundación Andaluza Pública para la Integración Social de las Personas con Enfermedad Mental, Sevilla, España b Recibido el 3 de abril de 2013; aceptado el 15 de julio de 2013 Disponible en Internet el 14 de septiembre de 2013 PALABRAS CLAVE Suicidio; Prisiones; Factores de riesgo; Trastornos mentales; Salud en hombres ∗ Resumen Objetivos: Numerosas investigaciones muestran que el riesgo de suicidio en los centros penitenciarios es superior al de la población general. Los objetivos del trabajo son primero explorar el riesgo de suicidio de internos condenados masculinos en centros penitenciarios andaluces; y segundo, estudiar los factores sociodemográficos, penales y, especialmente, psicopatológicos, asociados a este riesgo. Métodos: Fueron evaluados 472 internos con condena de 2 centros penitenciarios andaluces aplicándose una entrevista sociodemográfica, el cuestionario de trastornos de personalidad IPDE, la entrevista diagnóstica SCID-I (DSMIV) y el cuestionario de riesgo suicida Plutchick. Los evaluadores fueron psicólogos clínicos entrenados con experiencia en el medio penitenciario. Se calcularon los OR crudos y ajustados por medio de la ejecución de una regresión logística. Resultados: El 33,5% de la muestra se encuentra en situación de riesgo de cometer suicidio. Los diagnósticos (prevalencia vida) de trastorno afectivo (OR ajustado 3.329), por dependencia (OR ajustado 2.733), un trastorno de personalidad (OR ajustado 3.115) y trastorno de ansiedad (OR ajustado 1.650) junto con los antecedentes psiquiátricos familiares (OR ajustado 1.650) fueron las variables predictivas que resistieron como factores de riesgo el análisis de regresión. Ninguna variable sociodemográfica con OR crudos significativos resistió el análisis de regresión. Conclusiones: Las variables psicopatológicas son esenciales y las más potentes para explicar el riesgo suicida en el medio penitenciario. Un correcto y exhaustivo diagnóstico, seguido del adecuado tratamiento por profesionales de salud mental durante los internamientos penitenciarios son esenciales para prevenir el riesgo de suicidio. © 2013 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. Autor para correspondencia. Correo electrónico: [email protected] (J. Saavedra). 1888-9891/$ – see front matter © 2013 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. http://dx.doi.org/10.1016/j.rpsm.2013.07.004 Riesgo de suicidio de hombres internos con condena en centros penitenciarios KEYWORDS Suicide; Prisons; Risk factors; Mental disorders; Male health 225 Risk of suicide in male prison inmates Abstract Aims: Many studies have demonstrated that the risk of suicide in prison is higher than in the general population. This study has two aims. First, to explore the risk of suicide in men sentenced in Andalusian prisons. And second, to study the sociodemographic, criminal and, especially, psychopathological factors associated with this risk. Methods: An assessment was made of 472 sentenced inmates in two Andalusian prisons, and included a sociodemographic interview, the IPDE personality disorders questionnaire, the SCID-I diagnostic interview (DSMIV), and the Plutchick suicide risk questionnaire. The interviewers were experienced clinical psychologists with training in prison environments. Adjusted ORs were calculated using a logistic regression. Results: A risk of committing suicide was detected in 33.5% of the sample. The diagnoses (lifetime prevalence) of affective disorder (adjusted OR 3329), substance dependence disorders (adjusted OR 2733), personality disorders (adjusted OR 3115) and anxiety disorder (adjusted OR 1650), as well as a family psychiatric history (adjusted OR 1650), were the predictors that remained as risk factors after the regression analysis. No socio-demographic risk factor was significant in the regression analysis. Conclusions: The psychopathological variables are essential and the most powerful factors to explain suicide risk in prisons. A correct and systematic diagnosis, and an appropriate treatment by mental health professionals during the imprisonment are essential to prevent the risk of suicide. © 2013 SEP y SEPB. Published by Elsevier España, S.L.U. All rights reserved. Introducción La tasa de suicidios en los centros penitenciarios es significativamente mayor que la tasa en la población general tanto en España como en el mundo1---4 . En España la tasa del año 2006 en los centros penitenciarios fue 0,46 por 1.000, superior a la tasa de la población normal de ese año que fue de un 0,11 en hombres y un 0,03 en mujeres5 . No obstante, hay que señalar que a partir de la implementación del Programa Marco de Prevención de Suicidios en los Centros Penitenciarios, programa regulado por la instrucción 14/2005, se ha producido una reducción de la tasa de suicidios en la última década. En concreto, de acuerdo con datos de instituciones penitenciarias, la tasa de suicidios ha descendido de 0,54 a 0,41 suicidios por 1.000 desde el año 2000-20096 . Debido a la relevancia de la cuestión algunas investigaciones nacionales e internacionales han intentado determinar cuáles son los factores que se encuentran asociados al riesgo de cometer suicido en el medio penitenciario. Por ejemplo, Blaauw, Kerhof, Lindsay y Hayes mediante un análisis de 95 casos de suicidio en cárceles holandesas determinaron que una combinación de 2 variables demográficas (edad sobre 40 años y falta de hogar), 2 variables legales (encarcelamiento previo y delito violento) y 2 variables relacionadas con trastornos psicológicos (historia de tratamiento psiquiátrico y de abuso de drogas) podían predecir el 82% de las víctimas de suicidio en la población penitenciaria holandesa con 0,82 de especificidad2 . Estos mismos autores advierten de las dificultades de relacionar la conducta suicida (ideación, intentos y suicidios cometidos) con distintos trastornos psiquiátricos debido a la dificultad de identificar y diagnosticar de forma rigurosa correctamente a los internos en el medio penitenciario. El padecimiento de un trastorno psiquiátrico es un factor de riesgo muy importante relacionado claramente con el riesgo de suicidio6---8 . Los trastornos psiquiátricos más habituales en la población penitenciaria con riesgo suicida son la dependencia a sustancias psicoactivas, los trastornos afectivos y los trastornos psicóticos9 . Al respecto de los trastornos psicóticos algunos autores nos advierten de la importancia de considerar los síntomas positivos y no solo el simple diagnóstico10 . Más recientemente, Negredo, Melis y Herrero estudiaron la conducta suicida de 29 internos en del Hospital Psiquiátrico Penitenciario de Foncalent, 11 internas del mismo centro y 6 hombres control. Estos autores remarcan en sus conclusiones que además de la psicopatología de corte depresivo y los trastornos relacionados con el consumo de tóxicos es necesario tener muy en cuenta los rasgos de personalidad desinhibida, antisocial y agresiva. Este hecho nos lleva a considerar los trastornos de personalidad (eje II del DSM) en el estudio de la conducta suicida en la población penitenciaria6 . Aparte de los factores psicopatológicos, han sido señalados otras variables sociodemográficas y legales para explicar la conducta suicida. Por ejemplo, presentan mayor riesgo de una conducta suicida (ideación, intento y suicidio) ser hombre, ser preventivo, el no disfrutar de pareja o el aislamiento social11 , haber tenido una condena previa12 , los delitos violentos5 , cumplir condena en el país de origen y tener más de 40 años6 . Respecto a la edad existen investigaciones que señalan que ser joven es un factor de riesgo13 . También, recientes investigaciones han hallado que estar casado se comporta como un factor de riesgo, aunque pequeño14 , lo cual contradice la consideración de no tener pareja como factor de riesgo. En el resto de variables consideradas como factores de riesgo existe poco o ningún debate respecto a su influencia en la conducta suicida en el ámbito penitenciario. Los objetivos del presente estudio son hallar el riesgo de suicidio de hombres con condena en los centros 226 penitenciarios andaluces y estudiar la asociación de este riesgo con un conjunto de variables socio-demográficas, judiciales y psiquiátricas. Método Participantes Se seleccionaron aleatoriamente 500 hombres internos condenados en prisiones andaluzas a partir de los datos facilitados por la dirección 2 centros. Un número de 250 internos procedían del centro penitenciario de Albolote (Granada) y 250 de Morón (Sevilla). Morón y Albolote son de los centros penitenciarios con mayor número de internos en Andalucía. En concreto, el centro de Morón recluía en el momento de seleccionar a los internos a 1.712 internos y Albolote 1.754. Debido a la gran población de estos centros, la gran movilidad de la población penitenciaria y a la inexistencia de perfiles de ingreso diferentes en las cárceles andaluzas consideramos que estos centros eran representativos de los centros penitenciarios andaluces. Para ser incluidos los internos debían tener un dominio suficiente de la lengua española (capacidad de comprender las preguntas de los entrevistadores y de responder adecuadamente), no padecer ninguna enfermedad neurológica y tener más de 6 meses de condena restante. Se contactó con 500 internos de los cuales fueron evaluados finalmente 472, un número de 247 internos en el centro de Morón (52,33%) y 225 en Albolote (47,67%). El número de internos que rehusaron participar y firmar el consentimiento informado fue de 18 (3,6%) y hubo 3 datos perdidos. La gran mayoría de los internos que rehusaron firmar el consentimiento pertenecían a grupos organizados de carácter político o religioso. El resto de internos no fue incluido en la muestra por no cumplir los criterios de inclusión. Los internos seleccionados inicialmente que no pudieron encontrarse en los centros penitenciarios debido a que, por ejemplo, habían cambiado de cárcel o habían sido liberados, fueron sustituidos por aquellos incluidos en una lista de reservas también aleatorizados por módulos. La muestra final fue representativa para una población penitenciaria de 15.000 internos en Andalucía con una precisión de un 2%, un nivel de confianza del 95% con un valor del parámetro que deseamos medir de 0,5. Todos los internos firmaron un consentimiento informado, al tiempo que se les dotó de un código para que se pudiera trabajar sin que en ningún momento pudieran ser identificados. La selección y ejecución del estudio fue aprobado por las direcciones de los centros e instituciones penitenciarias. Una comisión de la Fundación Andaluza Pública para la Integración del Enfermo Mental (FAISEM) y las direcciones de los centros supervisaron el desarrollo del proyecto con el objetivo del cumplimiento de los requerimientos éticos. La tabla 1 describe la muestra de nuestro estudio. Se puede observar que la media de edad está ligeramente por debajo de los 40 años, los internos disponen de un nivel educativo muy bajo, la mayoría no tiene pareja, un 18% son inmigrantes, prácticamente la mitad ha sufrido encarcelamientos previos y padecen una prevalencia vida de trastornos psicológicos muy alta. J. Saavedra, M. López Procedimiento Un equipo de 8 psicólogos clínicos con experiencia en el ámbito penitenciario, divididos en grupos de 4 en cada centro penitenciario, diagnosticó mediante una batería de instrumentos a los internos seleccionados. Los entrevistadores fueron entrenados previamente en los instrumentos de evaluación, especialmente en la aplicación de la entrevista diagnóstica SCID-I. El entrenamiento en este instrumento se llevó a cabo mediante el uso de casos clínicos aportados por el coordinador del proyecto hasta alcanzar una fiabilidad aceptable entre los entrevistadores. Al final del periodo de entrenamiento los 8 entrevistadores alcanzaron al menos un 80% de acuerdo en los diagnósticos de los casos clínicos. Una vez al mes se celebraban seminarios con cada equipo para analizar y supervisar los diagnósticos de los internos en los que hubiera dudas y se determinaba, en el caso que fuera necesario, un diagnóstico de forma grupal con al menos el 75% de acuerdo entre los 4 entrevistadores y el coordinador. El diseño, el contacto con los centros penitenciarios y la realización de los diagnósticos se llevó a cabo entre los años 2010-2011. Entre los años 2011-2012 2 psicólogos entrenados en los instrumentos utilizados introdujeron los resultados de la evaluación en la tabla de datos y depuraron posibles errores, finalmente, fueron realizados los análisis. Instrumentos y análisis Los datos sociodemográficos, penales y el historial clínico familiar fueron obtenidos mediantes entrevistas sociodemográficas. Cuando fue necesario los datos obtenidos en las entrevistas se confirmaron mediante la información disponible por los centros penitenciarios. La versión clínica de la reconocida Structures Clinical Interview for Diagnostic and Statistical Manual of Mental Disorders, cuarta edición (DSM-IV) fue usada para el diagnóstico de los trastornos del eje I. El cuestionario asociado al International Personality Disorder Examination (IPDE) fue aplicado para explorar los trastornos de personalidad. El cuestionario IPDE se compone de 59 ítems que miden los 59 criterios del total de los 9 trastornos de personalidad15 . Algunos autores han encontrado con población adicta a opiáceos y un punto de corte 2/3 una sensibilidad entre los trastornos de personalidad de 100-88% y una especificidad de 98-37%. En nuestro caso utilizaremos el punto de corte más conservador de 4 o más de respuestas no esperadas16 . El riesgo suicidio se exploró mediante la versión española de la escala de riesgo suicida de Plutchik17 . Su objetivo es diferenciar entre individuos normales y los que están en riesgo de cometer suicidio mediante la respuesta a 15 preguntas a las que se responde con «Sí» o «No». El punto de corte para considerar el riesgo es de 6 puntos. Con este punto de corte se consigue una sensibilidad de 74% y especificidad de 95% para distinguir entre controles y pacientes. En la validación española el alfa de Crombach fue de 0,90 y la fiabilidad tras 72 horas era de 0,89 test-retest18 . El alfa de Crombach de nuestra muestra fue de 0,8. Aunque esta escala puede aplicarse de forma autoaplicada, los entrevistadores exploraron las respuestas de los internos para cerciorarse de que las preguntas se comprendían y para profundizar Riesgo de suicidio de hombres internos con condena en centros penitenciarios Tabla 1 227 Descripción de la muestra y riesgo asociado de suicidio (OR crudos) Variables sociodemográficas y psicopatológicas Riesgo % (n) 33,5% (157) No riesgo % (n) 66,5% (312) 2 Chi-cuadrado/T student Edad media años 37,15 37,27 NS Nivel educativo Sin terminar-primarios ESO-Formación profesional básica COU-Formación profesional superior Universidad 52,9 35 11,5 0,6 46 31,8 19,9 2,3% Estado civil-pareja Casado-pareja de hecho Sin pareja Origen Inmigrante Español NS (83) (55) (18) (1) 24,8 (39) 75,2 (118) 7 (11) 93 (146) (143) (99) (62) (7) 34,4 (107) 65,6 (204) 2 : 4.446, p: 0,022 Riesgo: 0,630 Int. Conf IC: 0,409-0,970 23,7 (74) 76,3 (238) 2 : 19.657, p: < 0,001 Riesgo: 0,242 IC: 0,124-0,472 2 : 14.839, p: < 0,001 Riesgo: 2.169 IC: 1.458-3.227 Encarcelamiento previo Sí No 65,6 (103) 34,4 (54) 46,8 (146) 53,2 (166) Delito violento Sí No 24,8 (39) 75,2 (118) 24 (75) 76 (237) Condena restante (media en meses) Condena transcurrido (media meses) 39,96 47,46 NS 41,10 41,234 NS NS Antecedentes penales familiares Sí No 54,1 (85) 45,9 (72) 37,5 (117) 62,5 (195) 2 : 11.794, p: < 0,001 Riesgo: 1.968 IC: 1.334-2.902 Enfermedades graves crónicas Sí No 62,4 (98) 37,6 (59) 44,2 (138) 55,8 (174) 2 : 13.823, p: < 0,001 Riesgo: 2.094 IC: 1.414-3.102 Antecedentes psiquiátricos familiares Sí No 41,1 (60) 58,9 (86) 21 (65) 73,9 (244) 2 : 20.025, p: < 0,001 Riesgo: 2.619 IC: 1.706-4.020 17,9 (56) 72,1 (256) 2 : 28.555, p: < 0,001 Riesgo: 3.146 IC: 2.046-4.836 20,5 (64) 79,5 (248) 2 : 34.102, p: < 0,001 Riesgo: 3.368 IC: 2.219-5.110 32,4 (101) 67,6 (211) 2 : 25.625, p: < 0,001 Riesgo: 2.734 IC: 1.842-4.058 Trastornos psicóticos (prev. vida) Sí No Trastorno depresivo (prev. vida) Sí No Trastornos de ansiedad (prev. vida) Sí No 40,8 (64) 59,2 (93) 46,5 (73) 53,5 (84) 56,7 (89) 43,3 (68) Trastornos afectivos (prev. vida) Sí No 65,6 (103) 34,4 (54) 29,2 (91) 71,8 (221) 2 : 57.176, p: < 0,001 Riesgo: 4.632 IC: 3.074-6.979 Trastornos por dependencia Sí No 85,4 (134) 14,6 (23) 56,1 (175) 43,1 (134) 2 : 39.785, p: < 0,001 Riesgo: 4.561 IC: 2.778-7.487 Trastornos de personalidad Sí No 93 (146) 7 (11) 73,5 (228) 26,5 (82) 2 : 24.709, p: < 0,001 Riesgo: 4.774 IC: 2.460-9.261 74,4 (232) 25,6 (80) 2 : 45.702, p: < 0,001 Riesgo: 53.793 IC: 7.408-390.620 Algún trastorno psicológico (Eje I) Sí No 99,4 (156) 0,6 (1) 228 Tabla 2 J. Saavedra, M. López Resultado análisis de regresión logística (OR ajustados) Wald Estado civil-pareja Ingreso previo en prisión Antecedentes psiquiátricos familiares Origen Trastorno psicótico Trastorno afectivo Trastorno ansiedad Trastorno Dependencia Trastorno personalidad Trastornos orgánicos crónicos 0,511 1.056 3.970 0,433 2.372 25.701 6.527 10.678 9.503 2.313 en algunas respuestas positivas, por ejemplo, al ítem que explora los intentos de suicidio. Aparte de los instrumentos descritos cuyos resultados hemos utilizado en el presente estudio, la batería de instrumentos seleccionada incluía 2 cuestionarios de uso de servicios socio-sanitarios (último año de condena y un año antes de ingreso en prisión), el cuestionario de clima organizacional en prisiones de Moors, test de inteligencia Toni II y un cuestionario de salud general. En primer lugar aplicamos la prueba de Chi Cuadrado y hallamos los odds ratios (OR) crudos de superar el punto de corte en la escala de riesgo de suicido para las variables categóricas dicotómicas (0,1) con un intervalo de confianza del 95%. Para las variables cuantitativas solo aplicamos la T de Student de contraste de medias. De acuerdo con la literatura al respecto estudiamos los factores sociodemográficos y penales siguientes: edad, nivel educativo, estado civil-pareja (casado- pareja de hecho, sin pareja), origen geográfico (español, inmigrante), encarcelamiento previo, cumplimiento de pena por delito violento, tiempo de condena restante, tiempo condena transcurrido, antecedentes penales familiares y antecedentes de enfermedades orgánicas crónicas. Consideramos solo las enfermedades graves de carácter crónico o de larga duración como cáncer, HIV, sida, hepatitis, trastornos cardiovasculares, asma, enfisema pulmonar etc. Respecto a las variables psicopatológicas consideramos la existencia o no de los diagnósticos (prevalencia vida): antecedentes psiquiátricos familiares, trastornos psicóticos, trastorno depresivo, trastornos de ansiedad, trastornos afectivos, trastornos por dependencias, trastornos de personalidad y algún trastorno psicológico (eje I). Debido a la alta comorbilidad existente, finalmente, para estudiar el comportamiento conjunto y hallar los OR ajustados, aplicamos una regresión logística binaria (método «Enter») considerando solo como variables predictoras aquellas significativas en nuestro primer análisis. Para ello usamos el paquete estadístico SPSS20. Resultados Un tercio de la muestra se encuentra en situación de riesgo de acuerdo con el instrumento elegido y el punto de corte 6. Si analizamos la respuesta al ítem 13 y 15 que exploran Sig. ns ns 0,046 ns ns 0,000 0,011 0,001 0,002 ns OR ajustado IC 95% Inferior Superior 1.650 1.008 2.701 3.329 1.834 2.733 3.115 2.091 1.152 1.495 1.513 5.299 2.921 4.995 6.416 respectivamente ideación suicida y la historia de intentos de suicidio el 34,2% de los internos ha pensado en suicidarse alguna vez y el 22,5% de los internos entrevistados han cometido al menos un intento de suicido en su vida. Como se puede observar en la tabla 1, los datos muestran que padecer algún trastorno psiquiátrico es un factor de riesgo extremo de superar el punto de corte 6, y por lo tanto susceptible de cometer suicido. Aunque hay que advertir que el gran intervalo de confianza de este factor no permite una interpretación rigurosa ni incluir esta variable en el análisis de regresión. Si prestamos atención a los grupos de trastornos específicos, observamos que son especialmente significativos los trastornos afectivos, que incluyen el trastorno depresivo y los trastornos bipolares, los trastornos por dependencia de sustancias y los trastornos por personalidad, todos los cuales presentan OR mayores de 4. El haber padecido un trastorno psicótico presenta un OR crudo de 3.146. También los antecedentes psiquiátricos familiares funcionan como un factor considerable de riesgo. Tanto la existencia de antecedentes penales familiares como los encarcelamientos previos duplican el riesgo de superar el punto de corte 6. Otros factores de tipo penal no son significativos. Es interesante señalar que padecer una enfermedad crónica orgánica presenta un OR de 2, con lo cual se convierte en un factor de riesgo importante. Los únicos factores de protección encontrados son ser inmigrante y tener pareja. En la tabla 2 mostramos los resultados de la regresión logística al introducir las variables predictivas significativas en el análisis anterior exceptuando la variable trastornos del eje I ya que se confunde con el resto de diagnósticos específicos y la variable trastorno de depresión ya que este diagnóstico se encuentra incluido en la variable trastornos afectivos. Puede observarse que todas las variables sociodemográficas o de carácter penal pierden su significación cuando se analizan conjuntamente con el resto de variables. Incluso la variable trastornos psicóticos deja de ser significativa. El resto de variables de trastornos psicopatológicos continúan comportándose como factores de riesgo. Especialmente las variables trastorno afectivo y de personalidad muestran OR ajustados de más de 3 puntos. De la misma forma, el haber padecido algún trastorno por dependencia dobla el riesgo de superar el punto de corte 6. Finalmente, el factor trastornos psiquiátricos familiares resiste el análisis de regresión Riesgo de suicidio de hombres internos con condena en centros penitenciarios y conserva su significación con un OR ajustado pequeño pero significativo. Los intervalos de confianza de las variables significativas en el análisis de regresión son pequeños. El porcentaje de casos pronosticado correctamente por la ecuación resultante fue del 75%, con una sensibilidad del 54% y una especificidad del 86%. La R cuadrado de Nagelkerke, la cual nos informa de la bondad de ajuste del sistema, nos arroja un valor de 0,343, un porcentaje de variable explicada considerable. La falta de significación de la prueba de Hosmer y Lesmerhow indica, del mismo modo, un buen ajuste del modelo. Discusión Analizamos en esta sección los datos del primer estudio sobre el riesgo suicida en la población penitenciaria andaluza de estas características metodológicas. Podemos decir, en primer lugar, que tanto el porcentaje de ideación suicida y de tentativa superan en 7,5 y 15 veces la prevalencia en España de los mismos halladas por el European Study on the Epidemology of Mental Disorders19 . En concreto, en el citado informe la prevalencia de ideación y de intento suicida en España fue de 4,4 y 1,5%. Así, de acuerdo con nuestros resultados un tercio de la muestra se encuentre en situación de riesgo al haber superado el criterio de corte. Aunque nosotros estamos analizando riesgo suicida y no mortalidad por suicido, nuestros resultados son compatibles con la existencia de una tasa de mortalidad por suicidio que multiplica por 8 la de la población general hallada por Bedoya et al. en el año 2009 en centros penitenciarios catalanes1 . Nuestros datos superan con creces el 3% de internos que habían cometido un intento de suicido el año previo de ingreso en prisión y el 2,7 el último año en prisión en España según un estudio de la Dirección General de Instituciones Penitenciarias20 . En este estudio se obtuvieron los resultados mediante la cumplimentación de los datos de cada interno a partir de sus historias clínicas por los médicos de prisión en el año 2006. Aunque nosotros obtuvimos la prevalencia vida de los intentos de suicidio, lo cual creemos necesario para valorar adecuadamente el riesgo, la diferencia con los resultados anteriores es considerable. Además, estimamos que en nuestra investigación se produce una mejora metodológica ya que entrevistamos y diagnosticamos personalmente a los internos. Nuestros OR crudos vienen a verificar la importancia de algunas variables legales y sociodemográfica como la existencia de historia de ingreso previo o el disfrute de relaciones sentimentales11,12 . Sin embargo, otras variables destacadas por otras investigaciones no han resultado significativas, por ejemplo la edad o la existencia de delitos violentos6,13 . Respecto a este último factor, hay que señalar que nosotros hemos incluido entre los delitos violentos no solo los homicidios, asesinatos y agresiones sexuales, sino también las tentativas de los mismos, los robos con fuerza y las lesiones. Es posible que distintas categorizaciones, teniendo en cuenta también los distintos ordenamientos jurídicos entre países diferentes, estén dificultando la comparación de resultados6 . Al igual que disfrutar de pareja, el ser inmigrante funcionan como factor de protección. Aunque en nuestro estudio los inmigrantes con un uso deficiente de la lengua española no han sido incluidos, no podemos descartar la posible subestimación del riesgo 229 suicida en la población inmigrante debido a problemas idiomáticos y a diferencias culturales. Además, hay que considerar que al excluir de la muestras los inmigrantes que no hablan español, precisamente aquellos que probablemente se encuentran más aislados, estamos excluyendo a los más vulnerables y quizás en mayor situación de riesgo. En cualquier caso, otros estudios han hallado resultados similares a al nuestro10,21,22 , incluso por una revisión sistemática14 , por lo que debemos profundizar y buscar explicaciones alternativas a los posibles errores metodológicos. De hecho, relacionado con este dato, nuestro equipo ha intentado explicar resultados obtenidos en otra investigación que muestra que ser inmigrante también es un factor de protección de padecer alguna psicosis en las cárceles andaluzas23 . El padecimiento de algún trastorno orgánico, que duplica el riesgo, hay que considerarlo puesto que, aunque algunas investigaciones lo han tenido en cuenta10 , normalmente este factor no es ni siquiera incluido en los diseños de investigación. No debemos dejar que otras variables más específicas del ámbito penitenciario invisibilicen este factor ya que el padecimiento de enfermedad somática incapacitante funciona como un factor claro de riesgo en la población general6,8 . El análisis de regresión muestra la potencia de las variables psicopatológicas para explicar el riesgo suicida. Las variables legales y sociodemográficas no resisten un análisis conjunto. Tan solo los antecedentes psiquiátricos familiares conservan la significación. Esto no implica que haya que ignorar los OR crudos de las variables que desaparecen sino que existe confusión entre el conjunto de variables y que son las variables psicopatológicas las más potentes para explicar el riesgo suicida. Entre estas variables, especialmente la prevalencia vida de algún trastorno afectivo y el trastorno de personalidad conservan un riesgo muy elevado. Tampoco hay que olvidar los trastornos por dependencia, especialmente relevante en el medio penitenciario, y los trastornos de ansiedad. Entre estos diagnósticos se encuentra el núcleo del riesgo de suicidio. El padecer un diagnóstico de trastorno psicótico deja de ser un factor de riesgo en el análisis de regresión. En los últimos años se ha intentado establecer el perfil psicopatológico de los pacientes diagnosticados con esquizofrenia en riesgo de cometer suicidio. Aunque algunos autores sugieren que los síntomas positivos10 , especialmente en fase aguda, son claros factores de riesgo de suicidio, otros autores han encontrado que son los síntomas afectivos, desesperanza y depresión, los que mejor explican el riesgo de suicido en los pacientes con esquizofrenia24,25 . En este sentido, probablemente la existencia de una alta comorbilidad entre los diagnósticos haya provocado que el efecto de esta variable, trastornos psicóticos, se confunda con los trastornos psicopatológicos, más potentes, antes comentados. Nuestros resultados son compatibles con resultados de investigaciones internacionales que han analizado suicidio consumado, las cuales apuntan la importancia de los diagnósticos psiquiátricos como factores de riesgo4,14,21,22,26 y ofrecen OR similares a los nuestros. Todo ello guardando la necesaria cautela debido a las diferencias metodológicas entre estos, por ejemplo en los procedimientos de avaluación de los diagnósticos y la forma de agrupar estos. Precisamente en este aspecto consideramos que reside uno de los aspectos positivos de nuestro estudio: un riguroso 230 diagnóstico clínico in situ de una amplia muestra de internos en centros penitenciarios andaluces. A este respecto, sin querer profundizar en resultados y análisis que van más allá de muestro objetivo, nuestros datos arrojan una prevalencia vida muy alta de algún trastorno psiquiátrico del eje I y de algún trastorno de personalidad, respectivamente el 82 y el 79% de la muestra. A continuación apuntamos las limitaciones de nuestro trabajo. El cuestionario de riesgo suicida de Plutchik es autoaplicado y aunque los entrevistadores han accedido individualmente a los internos y han podido profundizar y verificar las respuestas de estos, no es descartable que por ejemplo, la prevalencia de intentos de suicidio y en consecuencia la prevalencia de riesgo se haya sobreestimado al incluir como intentos de suicidios lo que no eran más que autoagresiones. Sin lugar a dudas, una entrevista personal y sistemática que explore el historial de intentos suicidas y la ideación suicida, así como un seguimiento posterior de una cohorte de internos, mejoraría nuestro estudio. Algunas investigaciones han discutido la utilidad del cuestionario IPDE en población penitenciaria recomendando en cualquier caso, un punto de corte 4 como hacemos nosotros27 . En nuestro estudio analizamos el riesgo de cometer suicidio y no el suicidio efectivo, ello impide la comparación directa con otros estudios. En conclusión, la potencia de las variables psicopatológicas y su prevalencia en la población penitenciaria28 nos señalan la necesidad de un correcto y exhaustivo diagnóstico durante los internamientos en los centros penitenciarios para prevenir el suicidio. Los diagnósticos e información clínica previos son útiles sin dudas pero insuficientes. Así mismo, es imprescindible el tratamiento de los trastornos psicopatológicos por equipos profesionales de salud mental durante los internamientos. Responsabilidades éticas Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales. Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio. Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia. Financiación Los datos analizados en el presente trabajo proceden del proyecto Prevalencia de los trastornos mentales en la población penitenciaria andaluza (PRECA-II) que fue financiado por la Fundación Pública Andaluza para la Integración Social del Enfermo Mental y aprobado por la Consejería de Igualdad y Bienestar Social de la Junta de Andalucía en acuerdo con el J. Saavedra, M. López Ministerio del Interior del Gobierno de España (BOE-A-2006, 10957). Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Agradecimientos Los autores del trabajo agradecen a los entrevistadores de Sevilla y Granada su trabajo. Del mismo modo agradecemos a los directores, equipo técnico y funcionarios de los Centros Penitenciarios de Morón y Albolote su colaboración y disposición a la realización de la investigación. Sin todos ellos esta investigación hubiera sido imposible. Al tiempo agradecemos a los colegas del Hospital San Juan de Dios de Barcelona iniciadores del proyecto PRECA-I su colaboración y apoyo en los inicios de la investigación. Bibliografía 1. Bedoya A, Martínez-Carpio PA, Humet V, Leal MJ, Leopart N. Incidencia del suicidio en las prisiones de Cataluña: análisis descriptivo y comparado. Rev Esp Sanid Penit. 2009;11: 37---41. 2. Blaauw E, Kerkhof FM, Hayes LM. Demographic, Criminal, and Psychiatric Factors Related to Inmate Suicide. Suicide Life Threat Behav. 2005;35:63---74. 3. García-Guerrero J, Vera-Remartínez EJ, Manuel V. Planelles Ramos. Causas y tendencia de la mortalidad en una prisión española (1994-2009). Rev Esp Salud Pública. 2011;85: 245---55. 4. Fazel S, Grann M, Kling B, Hawton K. Prison suicide in 12 countries: an ecological study of 861 suicides during 2003-2007. Soc Psychiatry Psychiatr Epidemiol. 2011;46:191---5. 5. Ayuso-Mateos JL, Baca-García E, Bobes J, Giner J, Giner L, Pérez V, et al. Recomendaciones preventivas y manejo del comportamiento suicida en España. Rev Psiquiatr Salud Ment. 2012;5:8---23. 6. Negredo L, Melis F, Herrero O. Factores de riesgo de la conducta suicida en internos con trastorno mental grave. Madrid: Ministerio del Interior; 2011. p. 126. 7. Arsenault-Lapierre G, Kim C, Turecki G. Psychiatric diagnoses in 3275 suicides: A metaanalysis. BMC Psychiatry. 2004;4:37, 23. 8. Ruiz-Pérez I, de Labry-Lima AO. El Suicidio en la España de Hoy. Gac Sanit. 2006;20 Supl 1:25---31. 9. Baxter D, Appleby L. Case register study of suicide risk in mental disorders. Br J Psychiatry. 1999;175:322---6. 10. Way BB, Miraglia R, Sawyer DA, Beer R, Eddy J. Factor related to suicide in New York state prisons. Int J Law Psychiatry. 2005;28:207---21. 11. Lohner J, Konrad N. Risk factors for self-injurious behaviour in custody: Problems of definition and prediction. Int J Prison Health. 2007;3:135---61. 12. Marcus PD, Alcabes PD. Characteristics of suicides by inmates in an urban city jail. Hosp Community Psychiatry. 1993;44:121---7. 13. Sherman LG, Morschauser PM. Screening for suicide risk in inmates. Psychiatric Quarterly. 1989;60:119---38. 14. Fazel S, Cartwright J, Norman-Nott A, Hawton K. Suicide in prisoners: A systematic review of risk factors. J Clin Psychiatry. 2008;4:1---11. 15. Lorange AW, Janca A, Sartorius N. The ICD-10 International personality Disorder Examination. Cambridge: Cambridge University Press; 1997. p. 226. Riesgo de suicidio de hombres internos con condena en centros penitenciarios 16. San Narciso GI, Gutiérrez E, Sáiz PA. Evaluación de trastornos de la personalidad en pacientes heroinómanos mediante el International Personality Disorders Examination (IPDE). Adicciones V 12. 2000:43---56. 17. Plutchik R, van Praga HM, Conte HR, Picard S. Correlates of suicide and violence risk: The suicide risk measure. Compr Psychiatry. 1989;30:296---302. 18. Rubio G, Montero I, Jáuregui J, Villanueva R, Casado MA, Marín JJ, et al. Validación de la escala de riesgo suicida de Plutchik en población española. Arch Neurobiol. 1998;61: 143---52. 19. Bernal M, Haro JM, Bernert S, Brugha T, de Graaf R, Bruffaerts R, et al. Risk factors for suicidality in Europe: Results from the ESEMED study. J Affect Disord. 2007;101:27---34. 20. Dirección General de Instituciones Penitenciarias. Estrategia global de actuación en Salud Mental. 2007: Madrid. Documento no publicado. 21. Baillargeon J, Penn JV, Thomas CR, Temple JR, Baillargeon G, Owen J, et al. Psychiatric disorders and suicide in the nation’s largest state prison system. J Am Acad Psychiatry Law. 2009;37:188---93. 22. Fazel S, Baillargeon J. The health of prisioners. Lancet. 2011;377:956---65. 231 23. Saavedra J, Alvarez ML. Association between traumatic experiences and psychosis among incarcerated men. J Nerv Ment Dis. 2013;201:773---9. 24. Acosta Artiles F, Aguilar García-Iturrospe E, Cejas Méndez M, Gracia Marco R, Caballero Hidalgo A, Siris S. Estudio prospectivo de las variables psicopatológicas asociadas a tentativas de suicidio en pacientes esquizofrénicos. Actas Esp Psiquiatr. 2009;37:42---8. 25. Esperanza L, Gómez-Duran EL, Martin-Fumado C, Hurtado-Ruiz G. Clinical and epidemiological aspects of suicide in patients with schizophrenia. Actas Esp Psiquiatr. 2012;40: 333---45. 26. Humbre N, Webb R, Piper M, Appleby L, Shaw J. A national case-control study of risk factors among prisoners in England and Wales. Soc Psychiatry Psychiatr Epidemiol. 2013;48: 1177---85. 27. Álvaro-Brun E, Vegue-González M. Validez del Cuestionario International Personality Disorder Examination (IPDE) en una muestra de población penitenciaria. Rev Esp Sanid Penit. 2008;10:35---40. 28. Vicens E, Tort V, Dueñas RM, Muro A, Pérez-Arnau F, Arroyo JM, et al. The prevalence of mental disorders in Spanish prisons. Criminal Behav Ment Health. 2011;5:321---32. Rev Psiquiatr Salud Ment (Barc.). 2015;8(4):232---241 www.elsevier.es/saludmental REVISIÓN Comorbilidad entre el trastorno bipolar y los trastornos de la conducta alimentaria Eva M. Álvarez Ruiz a y Luis Gutiérrez-Rojas b,c,∗ a Facultad de Psicología, Universidad de Granada, Granada, España Grupo de investigación en Psiquiatría y Neurociencias (CTS-549), Instituto de Neurociencias, Universidad de Granada, Granada, España c Hospital Clínico San Cecilio, Servicio Andaluz de Salud, Granada, España b Recibido el 10 de julio de 2014; aceptado el 22 de diciembre de 2014 Disponible en Internet el 3 de marzo de 2015 PALABRAS CLAVE Trastorno bipolar; Trastornos de la conducta alimentaria; Comorbilidad KEYWORDS Bipolar disorder; Eating disorder; Comorbidity ∗ Resumen Introducción: La comorbilidad entre el trastorno bipolar y los trastornos de la conducta alimentaria no está todavía bien estudiada. La aparición de ambos trastornos conlleva una serie de implicaciones clínicas muy importantes. Material y métodos: Se realizó una revisión sistemática de la literatura mediante una búsqueda bibliográfica en MEDLINE actualizada a septiembre de 2013 analizando todos los artículos que estudiaban la comorbilidad entre ambas condiciones (trastorno bipolar y trastornos de la conducta alimentaria), así como los trabajos que han estudiado la eficacia de tratamientos farmacológicos y de psicoterapia para mejorar ambos trastornos. Resultados: En esta revisión hemos encontrado una alta comorbilidad entre el trastorno bipolar y los trastornos de la conducta alimentaria, sobre todo la bulimia nerviosa y el trastorno por atracón. Los estudios muestran que el litio y el topiramato son algunos de los agentes farmacológicos con más efecto en el tratamiento de ambos trastornos. Conclusión: A pesar de que hay una variedad de estudios, es necesaria más investigación tanto para el tratamiento cuando ambos trastornos coexisten como para la evaluación, además del estudio de la relación biopsicológica para determinar su etiología comórbida. © 2014 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. Comorbidity of bipolar disorder and eating disorders Abstract Introduction: The comorbidity of bipolar disorder and eating disorders has not been studied in depth. In addition, clinical implications involved in the appearance of both disorders are very important. Autor para correspondencia. Correo electrónico: [email protected] (L. Gutiérrez-Rojas). http://dx.doi.org/10.1016/j.rpsm.2014.12.001 1888-9891/© 2014 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. Comorbilidad entre el trastorno bipolar y los trastornos de la conducta alimentaria 233 Material and methods: A systematic literature review of MEDLINE published up to September 2013 was performed, analyzing all the articles that studied the comorbidity of both conditions (bipolar disorder and eating disorders) and others research that studied the efficacy of pharmacological treatment and psychotherapy to improve these illnesses. Results: In this review we found a high comorbidity of bipolar disorder and eating disorders, especially of bulimia nervosa and binge eating disorder. Studies show that lithium and topiramate are 2 of the more effective pharmacological agents in the treatment of both disorders. Conclusion: There are a lot of studies that show evidence of comorbidity of bipolar disorder and eating disorders. However, further research is needed on assessment and treatment when these conditions co-exist, as well as study into the biopsychological aspects to determine the comorbid aetiology. © 2014 SEP y SEPB. Published by Elsevier España, S.L.U. All rights reserved. Introducción Antes de comenzar a hablar de comorbilidad es importante conocer los trastornos a los que se hace referencia en esta revisión. Por un lado, se tratan los trastornos de la conducta alimentaria (TCA), que se dividen en 3 tipos: la anorexia nerviosa (AN), que se define por un rechazo a mantener un peso normal para la estatura y la edad (normalmente menos del 85% del peso esperado) y un miedo intenso a ganar peso; la bulimia nerviosa (BN), cuyo síntoma principal es la presencia de atracones seguidos de conductas compensatorias para prevenir la ganancia de peso, y por último, el trastorno por atracón (TA), en el que también se dan atracones, pero sin conductas compensatorias, lo que suele llevar a padecer obesidad. Por otro lado, hablamos de trastorno bipolar (TB), que hace referencia a un trastorno del estado de ánimo en el que las personas alternan entre periodos con episodios maníacos y depresivos, con etapas eutímicas entre episodios. Se divide en tipo i (episodios maníacos o mixtos) y tipo ii (episodios hipomaníacos y depresivos)1 . La comorbilidad hace referencia a la presencia de 2 o más dolencias médicas, no relacionadas, en el mismo paciente. Conocer la comorbilidad entre 2 trastornos puede ayudar a explicar la aparición de ambos en un mismo paciente y proporcionar información a los profesionales para la realización de las evaluaciones y las decisiones para la intervención. Este es el caso del TB y los TCA, cuya comorbilidad está siendo cada vez más estudiada por distintas razones: 1) si los TCA son más frecuentes en población bipolar, se hace necesaria la evaluación de los mismos en los pacientes con TB, sobre todo al proponer la intervención; 2) el tratamiento de un trastorno puede empeorar el curso evolutivo del otro; es necesario evaluar qué efectos tiene la intervención de uno sobre el otro y si hay terapia farmacológica o psicológica efectiva para ambos, cuando se dan por separado y cuando coexisten; 3) por lo general, cuando existe comorbilidad entre 2 trastornos pueden darse otras comorbilidades asociadas a cada uno por separado, que se incrementan al ocurrir conjuntamente; en el caso de estos 2 trastornos, muchos estudios2---6 muestran que los desórdenes de ansiedad, de alcohol o de drogadicción coexisten en tasas elevadas con los TB y los TCA por separado. Los objetivos de esta revisión sistemática son 2: en primer lugar, mostrar la evidencia existente acerca de la comorbilidad entre los TCA y el TB y sus implicaciones clínicas, y en segundo lugar, examinar la eficacia de los tratamientos psicológicos y farmacológicos que se han usado cuando ambas enfermedades aparecen de manera comórbida. Método Se ha realizado una revisión en MEDLINE/PubMed de los artículos publicados hasta septiembre de 2013, seleccionando los más recientes, puesto que ya existe una publicación en 20054 muy completa, para examinar la comorbilidad entre ambos trastornos. Tras la búsqueda bibliográfica principal realizada en MEDLINE (fig. 1), y habiendo analizado los documentos, se procedió a la búsqueda más exhaustiva basada en los documentos seleccionados con las siguientes palabras. 1. Para examinar la evidencia de la utilidad de los tratamientos usados en ambos trastornos: bipolar disorder treatment, eating disorder treatment, olanzapine, antipsychotic, lamotrigine, antidepressive, lithium, sibutramine, topiramate, zonisamide, atomoxetine AND eating disorder. 2. Para analizar la comorbilidad en otros TCA: obesity AND bipolar disorder, binge eating disorder; binge eating disorder; eating disorder («review»); bipolar disorder («review»); Bipolar Eating Disorder Scale. Los criterios de inclusión de los artículos fueron: estar escritos en inglés o castellano, cumplir criterios diagnósticos de las 2 enfermedades estudiadas (TCA y TB), tener suficiente poder estadístico y que estuviera adecuadamente descrita la muestra del estudio, mientras que entre los criterios de exclusión, estuvieron: que la muestra incluyera pacientes con otras enfermedades, falta de poder estadístico, que las conclusiones del trabajo no fueran congruentes con los resultados del trabajo, incluir solo poblaciones especiales (como adolescentes o embarazadas) y que los objetivos del trabajo no estuvieran correctamente definidos al comienzo. 234 E.M. Álvarez Ruiz, L. Gutiérrez-Rojas Documentos potencialmente relevantes recuperados con la búsqueda: bipolar disorder and eating disorder. n=364 Documentos recuperados para una evaluación más detallada (limitado a estudios humanos y cuyas palabras se encuentren el título/abstract): n=196 Criterios de descarte de documentos: -Conclusiones incongruentes con los resultados -Los participantes debían cumplir criterios diagnósticos -Falta de evidencia o de calidad -Artículo centrado en poblaciones específicas (adolescentes, embarazadas) -Idiomas que no sean inglés/español Documentos relevantes: n = 93 Figura 1 Diagrama de flujo de la búsqueda bibliográfica. Comorbilidad de los trastornos de la conducta alimentaria y el trastorno bipolar En general, la presencia comórbida de trastornos del eje i en pacientes con TB es elevada. McElroy et al.3 observaron una alta comorbilidad entre el TB y los trastornos del eje i en los pacientes de su estudio, siendo el abuso de sustancias y la ansiedad los trastornos más comunes3,6 , seguidos de los TCA (6% a lo largo de la vida y 1% actual)3 . La comorbilidad entre los TB y trastornos del eje i estaba asociada con una mayor gravedad7 . De acuerdo con el trabajo de McElroy et al.4 , cuando se hace una exploración amplia y profunda y se tienen en cuenta los trastornos subumbral (condiciones del «espectro» del trastorno) de ambos grupos (TB y TCA) surgen una serie de analogías en cuando a fenomenología, curso, historia familiar, biología y respuesta al tratamiento. Trastornos de la conducta alimentaria en el trastorno bipolar Las tasas de prevalencia de los TCA en los TB son muy diferentes según los estudios de los últimos años, desde un 5,3%8 hasta un 31%9 . Un estudio encontró una tasa del 1% de TCA actual en el TB3 . (ver tabla 1 como resumen). Los TA son, en los estudios revisados, los TCA más comunes entre la población bipolar, por lo que se han hecho estudios específicos acerca de esta comorbilidad10,11 . McElroy encontró en un estudio que el 9,5% de los pacientes con TB tenía TA11 . La BN es el segundo trastorno alimenticio más común en el TB, y por último, la AN, cuya prevalencia es incierta5,8,12 . En cuanto al orden de aparición, un estudio5 muestra que el TB suele darse antes que el TCA en el 55,7% de los casos, el TCA aparece antes en un 34,3%, y la aparición conjunta ocurre en un 10% de los pacientes. Sin embargo, otro estudio indica que hay más pacientes que presentan un inicio al mismo tiempo que los que presentaban antes el TCA13 . Uno de los pocos trabajos que analizan los estudios con muestras compuestas por menores es el de McElroy et al.14 . En uno de los estudios se comenta que el 9% de los sujetos con hipomanía o trastorno depresivo mayor y el 8% de las personas con manía habían tenido TCA en algún momento de su vida. La posibilidad o riesgo de padecer un TCA fue significativamente mayor en los individuos con hipomanía o trastorno depresivo mayor que en la muestra general, pero no en las personas con manía15 . En otro estudio16 se observó que no había diferencias significativas entre los 3 grupos de TCA en las tasas de TB, pero cuando se incluyó el TB subumbral aparecieron unas tasas de comorbilidad significativamente elevadas con los grupos de síndrome completo (26%) y parcial (22%) comparado con el grupo no-TCA (4%). Parece que la probabilidad de tener un TCA en pacientes con TB está asociada con: 1. Gravedad del TB: inicio del TB más temprano (sobre todo en AN)9 , más episodios anímicos (predominantemente depresión2,5,6,17 ) y más sintomáticos (sobre todo con TA)3,5,9 . 2. Posibilidad aumentada de suicidio: la conducta suicida es común a ambos trastornos y hay una asociación entre la presencia de TCA y la severidad del TB2 , por lo que el riesgo de suicidio se ve incrementado2,5 . Los trastornos del estado de ánimo son las alteraciones con más conductas suicidas, tanto en población general (35,8%) como en población psiquiátrica internalizada (20,8%)18 . 3. Correlación negativa con el número de participantes masculinos y con los participantes que tienen pareja8 . 4. Aumento del número de comorbilidades (especialmente con TA), sobre todo con el consumo de sustancias y los trastornos de ansiedad2,5 . 5. Hiperactividad entre los síntomas hipomaníacos19 en pacientes con trastorno del espectro bipolar con obesidad mórbida. 6. El riesgo de ser bipolar se ve incrementado cuando se diagnostica BN comórbida y aumenta cuando se usan las definiciones más amplias de la bipolaridad17 . Influencia del ciclo menstrual Los pacientes con TB pueden presentar atracones o pérdida del control de la comida en algún momento de su vida; Comorbilidad entre el trastorno bipolar y los trastornos de la conducta alimentaria Tabla 1 235 Estudios de trastornos alimenticios en pacientes con trastorno bipolar Estudio Pacientes Evaluación/criterios diagnósticos Resultados trastornos de la alimentación Krüger et al.90 , 1996 61 pacientes externos (38 mujeres) eutímicos con TB-I (n = 43) o TB-II (n = 18) 64 personas con TB-I (n = 44) o TB-II (n = 11) de un registro de TB 129 pacientes externos con TB-I (76 mujeres) 139 pacientes externos con TB-I o TB-II (94 mujeres) 288 pacientes externos con TB-I o TB-II (162 mujeres) 175 pacientes ambulatorios con TB-I 2.548 pacientes SCID; DSM-IV 8 (13,1%) tenían TA; 23 (37,7%) tenían episodios actuales de atracones 4 (7,3%) tenían un TCA de las categorías de DSM-IV Edmonds et al.91 , 1998 Vieta et al.92 , 2001 MacQueen et al.93 , 2003 McElroy et al.3 , 2001 Fagiolini et al.94 , 2003 Wittchen et al.15 , 2003 DIGS; DSM-IV SCID; DSM-IV 3 (2,3%) tenían BN SCID; DSM-IV 21 (15%) tenían un TCA; AN (n = 4), BN (n = 9) y/o TA (n = 12) 17 (5,9%) tenían AN (n = 6) o BN (n = 11) 62 (35,4%) tenían obesidad SCID; DSM-III-R DSM-IV Lewinsohn et al.16 , 2004 1.710 sujetos, seguimiento de 810 mujeres DSM-III-R Ramacciotti et al.13 , 2005 SCID, BEDCI Wildes et al.6 , 2007 51 pacientes (22 mujeres) con TB 83 sujetos obesos, 89% con TB; TB-I (1,2%), TB-II (42,2%), TBNE (25,3%) o hipomanía pura (20,5%) 72 pacientes con TB Wildes et al.12 , 2008 81 pacientes con TB Lunde et al.17 , 2009 201 sujetos (139 mujeres) con TB (n = 87) o TDM (n = 114) DSM-IV Fornaro et al.9 , 2010 148 mujeres con TB-I, TB-II o ciclotimia SCID, DSM IV-TR, EDE-Q, YMRS McElroy et al.5 , 2011 875 (493 mujeres) pacientes con TB-I o TB-II SCID Schoofs et al.20 , 2011 Seixas et al.8 , 2012 52 mujeres con TB; TB-I (n = 23) o TB-II (n = 29) 356 pacientes con TB McElroy et al.11 , 2013 717 pacientes con TB Alciati et al.19 , 2007 SCID Un 9% de pacientes con hipomanía o TDM y un 8% de pacientes con manía habían tenido TCA en algún momento No diferencias significativas en TB. En pacientes con TB parcial, 26% tenían TCA completo y 22% tenían TCA parcial 14 tenían TCA; TA (n = 9) o BN (n = 5) Un 13,3% tenían TA y un 12% tenían TA parcial 26 tenían TCA completo (n = 17) o parcial (n = 9). De los TCA completo, 4 tenían AN, 4 BN, 6 TA y 4 múltiples TCA 21,6% tenían TCA; TA (11,1%; 6 TA completo, 5 TA parcial), BN (8,6%) o AN (7,4%) 33 (16,4%) pacientes tenían TCA; AN (n = 12), BN (n = 11) o ambos (n = 10) 46 (31%) tenían o habían tenido TCA; 15,5% AN (n = 23), 14,2% TA (n = 21) y 5,4% BN (n = 8), también múltiples TCA (n = 6) Un 14,3% tenían TCA; 8,8% tenían TA, 4,8% tenían BN, 3,1% tenían AN y 2,2% tenían al menos 2 TCA 15 tenían TA 19 (5,3%) pacientes tenían TCA; 57,9% BN y 42,1% AN. No evalúa TA Un 9,5% de los pacientes tenía TA AN: anorexia nerviosa; BN: bulimia nerviosa; TA: trastorno por atracón; TB: trastorno bipolar; SCID: Diagnostic Clinical Interview for DSM Disorders; DSM: Diagnostic and Statistical Manual of Mental Disorders; DIGS: Diagnostic Interview Scale; BEDCI: Binge Eating Disorder Clinical Interview; EDE-Q: Eating Disorder Examination Questionnaire; YMRS: Young Mania Reating Scale. 236 además, pueden llevar a cabo conductas compensatorias12 . Varios estudios muestran que el ciclo menstrual influye en la frecuencia y la intensidad de los atracones antes y durante la menstruación, y que estos cambios se dan en pacientes con TB, con TA o ambos. Todas las participantes con TA y TB (18/52) de un estudio20 indicaron que la semana anterior y durante la menstruación los episodios de atracones se incrementaron en frecuencia y gravedad. La mayor parte de las participantes que no tenían ningún TCA vieron un incremento mayor de dicha impulsividad solo durante los episodios depresivos, una menor cantidad de sujetos observaron este incremento solo en los episodios maníacos, y unos pocos indicaron dicho impulso solo en la fase eutímica. Trastorno bipolar en los trastornos de la conducta alimentaria McElroy et al.4 , tras la revisión de varios estudios, observaron que había un rango de TB en los TCA desde la ausencia de los mismos21---24 hasta un 63,6%25 (ver tabla 2 como resumen). El número de estudios que evalúan específicamente los TB en la población que presenta TCA es mucho menor en los últimos años que el de aquellos que evalúan lo contrario. Para determinar la prevalencia de la hipomanía en personas con TA y TA subumbral se realizó una evaluación mediante la Hypomania Checklist-32, controlando los rasgos de personalidad como variables de confusión potenciales. Los sujetos con TA tenían puntuaciones más bajas en autodirección y cooperatividad y puntuaciones más elevadas en la Hypomania Checklist-32 que las personas con un TA subumbral. Además, se observó una asociación significativa entre el diagnóstico de TA y el sexo femenino, la cooperatividad y el Hypomania Checklist-32. Los pacientes con TA tenían puntuaciones más elevadas en hipomanía, independientes de los rasgos de personalidad10 . En otro estudio, con una muestra de 78 mujeres con TCA, se encontró que un 15% de la misma tuvo TB-II (hipomanía) y ninguna persona presentaba TB tipo i26 . La prevalencia en estudios con poblaciones de distintos países fue muy diferente. En un estudio realizado en Suecia27 , el 57% de los pacientes con AN tenían un trastorno depresivo, y solo 3 de 51 pacientes tenían TB. En otro trabajo, realizado en Japón28 , en el que no se evaluaron los TA, un pequeño número de sujetos había tenido TB-II a lo largo de la vida (3%) o trastorno hipomaníaco (1%). Las tasas eran aún más bajas en población brasileña23 , en las que no se encuentra ningún paciente con TB con TA, pero sí en personas obesas sin TA (3%). En un estudio menos riguroso29 , una chica de 15 años con AN presentó un episodio maníaco tras un mes de tratamiento con antidepresivos. La paciente presentaba irritabilidad en contextos alimentarios, ideación paranoide, periodos breves de euforia y sentimientos de grandiosidad con otros de aislamiento, tristeza y abatimiento en los 2 años previos. Incluso después de recuperar peso y tras el uso de 3 estabilizadores del estado de ánimo, la paciente sigue presentando inestabilidad emocional. Es posible que la sintomatología no afectiva temprana (baja autoestima, pérdida de contacto social, irritabilidad, cambios del estado de ánimo e insomnio) represente un precursor del trastorno afectivo. E.M. Álvarez Ruiz, L. Gutiérrez-Rojas Discusión (implicaciones clínicas y abordaje farmacológico) Evaluación de la comorbilidad entre trastornos de la conducta alimentaria y trastorno bipolar Debido a la cantidad de estudios que demuestran que existe una alta comorbilidad entre los TCA y el TB, se creó una escala para determinar la intensidad y la frecuencia de las alteraciones alimenticias en la población bipolar, denominada Barcelona Bipolar Eating Disorder Scale. Consiste en una escala de 10 ítems cuyo tiempo medio de cumplimentación es de 1 min y 21 s. Se administró la escala a un grupo control sano para evaluar la factibilidad y para determinar el punto de corte, que se preestableció en 1330 . La Barcelona Bipolar Eating Disorder Scale muestra unas propiedades psicométricas adecuadas para evaluar alteraciones alimenticias en pacientes bipolares en la práctica clínica y la investigación30,31 ; como se puede comprobar en un estudio de 200831 , la escala mostró una factibilidad, fiabilidad, validez discriminativa (de los pacientes con respecto a los controles) y sensibilidad adecuadas. El único estudio encontrado que evalúa a sus pacientes con la Barcelona Bipolar Eating Disorder Scale halló que las puntuaciones medias de la escala eran significativamente mayores en pacientes con TB que en los controles. Sorprendentemente, un 65,9% de los pacientes con TB tenían TCA, siendo el TA el más prevalente32 . Abordaje terapéutico de la comorbilidad Como se ha podido observar, parece haber una alta comorbilidad entre los TB y los TCA, por lo que en el momento de seleccionar un tratamiento para uno de los trastornos hay que tener en cuenta que es posible que coexista el otro, y la intervención debe ir enfocada hacia ambos. Además, el tratamiento de uno puede empeorar los síntomas del otro, como el litio, que muestra una asociación con la ganancia de peso en pacientes bipolares7 . Es por esto que la obesidad de los pacientes con TB puede ser causada por el tratamiento o por un TCA comórbido. A continuación se resumen los principales grupos farmacológicos (analizando los principios activos más importantes) que se han usado a la hora de abordar el tratamiento de ambas enfermedades. Estabilizadores del estado de ánimo Litio. El litio está considerado un agente eficaz como estabilizador del estado de ánimo a largo plazo, sobre todo para la manía. Distintas revisiones14,33,34 han encontrado que también es un fármaco eficaz para el tratamiento o la mejoría de los pacientes con AN y/o BN, pero no parece haber estudios que muestren eficacia para el TA con el uso monoterapéutico de litio, quizás porque la ganancia de peso es uno de sus efectos secundarios7 , una característica asociada a este TCA. En un estudio controlado con placebo, 16 personas con AN35 fueron repartidas en 2 grupos: con litio o placebo. Los pacientes tratados con litio mostraron una mayor ganancia Comorbilidad entre el trastorno bipolar y los trastornos de la conducta alimentaria Tabla 2 237 Estudios de trastornos bipolares en pacientes con trastornos alimenticios Estudio Pacientes Evaluación/criterios diagnósticos Resultados trastornos de la alimentación Halmi et al.95 , 1991 62 mujeres con AN y 62 controles DIS; DSM-III-R Simpson et al.25 , 1992 22 pacientes hospitalizados con AN (n = 7) o con BN (n = 15) SADS; DSM-III-R Bushnell et al.22 , 1994 25 pacientes mujeres con BN, 20 mujeres de la población general con BN y 777 controles DIS; DSM-IV Ivarsson et al.27 , 2000 51 adolescentes con AN y 51 controles (por sexo y edad) SCID; DSM-III-R McElroy et al.70 , 2003 Fontenelle et al.23 , 2003 61 pacientes con TCA 32 pacientes brasileños con TCA 103 personas obesas; con TA completo (n = 44) o parcial (n = 59) 78 mujeres con TCA SCID; DSM-IV SCID; DSM-IV 10 (16,1%) pacientes con AN tenían TB, ninguno de los controles tenían TB 14 (63,6%) tenían TB; uno (4,5%) tenía TB-I y 13 (59%) tenían TB-II Ninguna persona del grupo clínico ni del grupo de población general con BN tenían manía. Una persona (0,1%) tenía manía en la población general 3 (5,9%) chicas con AN y uno (2,0%) de los controles tenían TB 6 (9,8%) tenían TB Ninguno con TB Amianto et al.10 , 2011 Nagata et al.26 , 2013 DSM-IV-TR; BES SCID Un 15% tenían TB-II y ninguno tenía TB-I AN: anorexia nerviosa; BN: bulimia nerviosa; TA: trastorno por atracón; TB: trastorno bipolar; DIS: Diagnostic Interview Schedule; SCID: Diagnostic Clinical Interview for DSM Disorders; DSM: Diagnostic and Statistical Manual of Mental Disorders; BES: Binge Eating Scale; SADS: Schedule for Affective Disorders and Schizophrenia. de peso tras 3 y 4 semanas de tratamiento, además de una mejora del insight. Evidencias menos rigurosas extraídas de casos clínicos36---38 indican que las pacientes con AN tratadas con litio muestran resultados positivos en cuanto a la mejoría de los síntomas del trastorno y la ganancia de peso (con una variabilidad de 9 a 15 de aumento de peso), algunos junto con el tratamiento con otro fármaco, como la carbamazepina37 . Además, los resultados se mantienen a medio plazo. En cuanto a la eficacia del litio para la BN, hay distintas conclusiones. En un estudio controlado con placebo39 , los resultados fueron similares para el grupo del litio y el del placebo en cuanto a la reducción de los atracones. En otro estudio40 se obtuvieron mejores resultados en el grupo tratado con litio comparado con el de placebo, pero las personas del grupo del litio experimentaron un aumento de peso. El litio mejoró moderada o notablemente los episodios bulímicos en 12 de 14 mujeres en un ensayo clínico abierto41 . En otro ensayo del mismo autor, 11 de 17 pacientes mostraron una reducción del 75% o más de los episodios bulímicos, combinando el tratamiento farmacológico con terapia cognitivo-conductual42 . El litio se ha usado también como potenciador del efecto de otros fármacos como el topiramato, un agente anticonvulsivo, para el TA. En un estudio43 se añadió litio a la medicación de los pacientes que estaban tomando topiramato. La mayoría de los enfermos mostraron mejoras en los síntomas afectivos, así como una disminución de los síntomas del TA, del peso y de la frecuencia de los atracones tras la adición de litio. Aunque el litio ha mostrado ser eficaz tanto para el tratamiento de los TB como para la AN y la BN, sobre todo, hay que considerar los efectos secundarios que se pueden dar en los pacientes. En un estudio de Vestergaard et al.44 se evaluaron 237 pacientes tratados con litio acerca de los efectos secundarios. Una cuarta parte de los pacientes tenían 3 o más quejas, entre las que destacaban los temblores en las manos, la sed, la ganancia de más de 10 kg de peso, la diarrea y los edemas en las piernas y la cara. Otros. En varias revisiones14,33,45,46 , fármacos como la olanzapina o la risperidona, el valproato, la carbamazepina, los antipsicóticos atípicos o la quetiapina también muestran resultados positivos en el tratamiento de los TCA, fármacos también usados, en algunas ocasiones, para el TB. El valproato muestra eficacia para disminuir los síntomas bulímicos y afectivos en un paciente con TB y BN47 , pero de forma general parece aumentar la conducta compulsiva de comer en pacientes con TA y TB comórbidos48 , en la BN33 y el TB49 . En cuanto a la AN, parece que los antipsicóticos atípicos, la olanzapina, la quetiapina y la risperidona son, en general, seguros, y muestran eficacia para tratar la depresión, la ansiedad y los síntomas de la AN (disminuyen el miedo a engordar, la dificultad para comer, la distorsión de la imagen corporal y el insight)45,50---58 , pero no ayudan a ganar peso46 , uno de los objetivos primordiales en el tratamiento de la AN. 238 Anticonvulsivos Los anticonvulsivos se empezaron a estudiar como agentes para el tratamiento de los TCA, sobre todo en TA y BN, por su efecto adelgazante en personas con epilepsia. De hecho, actualmente es uno de los agentes más estudiados para el tratamiento de los TCA que presentan atracones, sobre todo el TA14,33,45,59---63 , cuando se presentan sin la coexistencia de otros trastornos o con TB comórbido; además, es un tratamiento también eficaz para este. La eficacia de topiramato y zonisamida ha sido estudiada para tratar la BN y el TA62,64 . Varios estudios, aleatorizados con grupo placebo, se han publicado acerca del tratamiento con topiramato en pacientes con BN65,66 . Los resultados muestran que el grupo de topiramato mejoró en áreas como la ingesta excesiva e incontrolable de comida, la insatisfacción corporal, la obsesión por la delgadez y la preocupación por la comida y la dieta65 . Además, con este fármaco se produce una reducción de los atracones, las purgas y del peso corporal, entre otros factores67,68 . Los estudios con topiramato también se centran en el TA. En un estudio realizado con pacientes obesos con TA68 , el grupo que tomaba topiramato mostró una mayor reducción de los atracones que el grupo placebo. La eficacia de topiramato en el tratamiento de personas con TA y obesidad ha sido demostrada por diversos estudios69---72 . Otros estudios, en los que se evalúan pacientes con TA sin obesidad48 , muestran la eficacia de topiramato en la reducción de peso y de la frecuencia de los atracones. Los efectos secundarios más comunes son las náuseas, la parestesia, la infección del tracto respiratorio superior, la somnolencia y el dolor de cabeza, aunque, por lo general, los efectos secundarios no suelen ser más frecuentes que con el uso de placebo. Muchos estudios señalan que es muy beneficiosa la combinación de litio con topiramato. Kotwal et al.43 escogieron a 12 personas obesas, con TA y TB comórbidos. Estos pacientes, que estaban siendo tratados con topiramato para el TA, recibieron litio cuando presentaban inestabilidad del estado de ánimo. Dicha adición se asoció con una mejora en los síntomas del estado de ánimo y hubo diferencias numéricas, aunque no estadísticamente significativas, en cuanto a la disminución de los atracones y la pérdida de peso, si comparamos los pre y posadición de litio. Aunque topiramato es uno de los fármacos anticonvulsivos más estudiados para el tratamiento de los TCA, zonisamida también puede tener un papel importante. McElroy et al.73 cogieron una muestra de 60 pacientes ambulatorios con TA y obesidad, 30 de los cuales recibieron zonisamida, y el resto, un placebo. Comparada con el placebo, zonisamida se asoció con una tasa significativamente mayor en la reducción de la frecuencia de los atracones, el peso corporal y el índice de masa corporal (IMC). Idini et al.74 informan acerca de un estudio realizado con 17 mujeres con TA o BN, 10 de las cuales concluyeron los 12 meses de seguimiento con un tratamiento con zonisamida (no se suspendía ninguna medicación previa). Se observó una reducción del IMC en un 5,72%, y una disminución de los atracones y de los episodios autolesivos. Otros anticonvulsivos como carbamazepina o lamotrigina muestran una buena tolerancia y eficacia para el tratamiento34,75 . E.M. Álvarez Ruiz, L. Gutiérrez-Rojas Antidepresivos Los antidepresivos se usan generalmente junto con los estabilizadores del estado de ánimo en el tratamiento de la depresión bipolar, a pesar de que puede incrementar los episodios maníacos/hipomaníacos. Han mostrado también bastante eficacia en el tratamiento de los TCA, sobre todo para la BN y el TA, ya que parecen reducir los atracones14,34,45,59---61,76,77 . La eficacia para la AN es muy reducida, pero se usa como tratamiento de este trastorno por los distintos estudios que sí obtienen resultados positivos y la escasez de tratamiento farmacológico34,46,77 . La desipramina78 , la fluvoxamina79 y la fluoxetina80 mostraron eficacia para el tratamiento de la BN y el TA y para la prevención de las recaídas. En un estudio37 , 9 pacientes con AN fueron tratadas con antidepresivos. Siete pacientes mostraron una mejora significativa o moderada en el peso y en otros síntomas de AN y BN; las 2 restantes tuvieron una mejora grande o moderada en los síntomas bulímicos, pero no ganaron peso. Otros fármacos Algunas revisiones indican que la atomoxetina61,81 , usada para el tratamiento del trastorno por déficit de atención e hiperactividad, puede ser eficaz para tratar el TA y se asocia, comparada con el placebo, con una mayor reducción de los atracones, del peso corporal y del IMC. En un estudio de caso único con metilfenidato82 , también usado para el trastorno por déficit de atención e hiperactividad, se consigue una remisión completa de los síntomas de la BN a medio plazo. En diversos estudios usando sibutramina como tratamiento para la obesidad en personas con TA se observaron mejoras en la mayoría de los pacientes en distintas variables. En la mayoría de los casos hubo una remisión del TA; además, una gran parte de los sujetos experimentaron una reducción del peso, del IMC y de los atracones83---86 . Tratamiento psicológico --- Terapia cognitivo-conductual: eficaz en pacientes con TA. Se centra, entre otras cosas, en la reducción y el control de los atracones, la mejora de la imagen corporal, el énfasis y la enseñanza de patrones estructurados de la ingesta de alimentos y la reestructuración cognitiva acerca del peso, la forma, la imagen corporal y la comida en general87,88 . --- Terapia interpersonal con formato grupal: suponen que los afectos negativos asociados a los problemas interpersonales conducirían al atracón87 . --- Terapia conductual: utiliza estrategias conductuales tradicionales orientadas a modificar los hábitos de ingesta y de ejercicio físico con el fin de fomentar la pérdida de peso. Técnicas: control de estímulos y conductas alternativas al atracón87 . La terapia cognitivo-conductual y la interpersonal parecen dar resultados positivos también en el TB, pero es muy recomendable la psicoeducación89 . Como en todo trabajo de revisión, cabe resaltar como limitación que a pesar del gran número de trabajos encontrados y de que solo se hayan seleccionado aquellos que cumplen determinados criterios de calidad, en ocasiones Comorbilidad entre el trastorno bipolar y los trastornos de la conducta alimentaria las muestras de los pacientes estudiados son propias de unidades hospitalarias o de determinados centros clínicos ambulatorios con muestras especiales de pacientes, por lo que las conclusiones pueden no ser extrapolables a los pacientes que se tratan en la práctica clínica habitual. Así mismo, falta realizar más y mejores ensayos clínicos aleatorizados en esta población específica de pacientes (que padecen TB y TCA de forma comórbida) para evaluar la eficacia de los psicofármacos y los tratamientos psicológicos que se emplean en ellos. Conclusiones Se ha observado una gran correlación entre los TCA y los TB que se asocia a una mayor severidad en el TB y a un infrarreconocimiento de los TCA en pacientes con TB medicados, ya que uno de los efectos secundarios de algunos fármacos es el aumento de la ingesta13 . Además, se ha visto que la presencia de episodios depresivos se relaciona con un deterioro global. La farmacoterapia tiene una alta eficacia para el tratamiento de los TCA y los TB, tanto cuando son comórbidos como cuando se dan de forma independiente. Sin embargo, es importante añadir que la comorbilidad debe ser tenida en cuenta, ya que la farmacología eficaz para uno de los trastornos puede empeorar los síntomas del otro44 . El tratamiento óptimo debería beneficiar a ambos trastornos, estabilizando cualquier alteración afectiva sin disminuir el efecto en los TCA. Es necesaria más investigación acerca de los posibles efectos secundarios del tratamiento farmacológico de un trastorno sobre el otro, y para conocer en profundidad qué mecanismos, tanto psicológicos como biológicos, pueden determinar dicha comorbilidad. Conflicto de intereses El Dr L. Gutiérrez-Rojas declara haber impartido conferencias o recibido ayuda para asistir a congresos de Janssen, Astra Zeneca, Rovi, Lundbeck, Otsuka, GSK y Pfizer. E. Alvarez Ruiz declara no tener ningún conflicto de intereses. Bibliografía 1. American Psychiatric Association. Diagnostic and Statistical Manual of Mental disorders, 4th edition, text revision (DSM-IVTR). Washington, D. C.: American Psychiatric Press; 2000. 2. Brietzke E, Moreira CL, Toniolo RA, Lafer B. Clinical correlates of eating disorder comorbidity in women with bipolar disorder type i. J Affect Disord. 2011;130:162---5. 3. McElroy SL, Altshuler LL, Suppes T, Keck PE Jr, Frye MA, Denicoff KD, et al. Axis I psychiatric comorbidity and its relationship to historical illness variables in 288 patients with bipolar disorder. Am J Psychiatry. 2001;158:420---6. 4. McElroy SL, Kotwal R, Keck PE Jr, Akiskal HS. Comorbidity of bipolar and eating disorders: Distinct or related disorders with shared dysregulations? J Affect Disord. 2005;86:107---27. 5. McElroy SL, Frye MA, Hellemann G, Altshuler L, Leverich GS, Suppes T, et al. Prevalence and correlates of eating disorders in 875 patients with bipolar disorder. J Affect Disord. 2011;128:191---8. 239 6. Wildes JE, Marcus MD, Fagiolini A. Eating disorders and illness burden in patients with bipolar spectrum disorders. Compr Psychiatry. 2007;48:516---21. 7. Krishnan KR. Psychiatric and medical comorbidities of bipolar disorder. Psychosom Med. 2005;67:1---8. 8. Seixas C, Miranda-Scippa Â, Nery-Fernandes F, AndradeNascimiento M, Quarantini LC, Kapczinski F, et al. Prevalence and clinical impact of eating disorders in bipolar patients. Rev Bras Psiquiatr. 2012;34:66---70. 9. Fornaro M, Perugi G, Gabrielli F, Prestia D, Mattei C, Vinciguerra V, et al. Lifetime co-morbidity with different subtypes of eating disorders in 148 females with bipolar disorders. J Affect Disord. 2010;121:147---51. 10. Amianto F, Lavagnino L, Leombruni P, Gastaldi F, Daga GA, Fassino S. Hypomania across the binge eating spectrum. A study on hypomanic symptoms in full criteria and sub-threshold binge eating subjects. J Affect Disord. 2011;133:580---3. 11. McElroy SL, Crow S, Biernacka JM, Winham S, Geske J, Cuellar Barboza AB, et al. Clinical phenotype of bipolar disorder with comorbid binge eating disorder. J Affect Disord. 2013;150:981---6. 12. Wildes JE, Marcus MD, Fagiolini A. Prevalence and correlates of eating disorder co-morbidity in patients with bipolar disorder. Psychiatry Res. 2008;161:51---8. 13. Ramacciotti CE, Paoli RA, Marcacci G, Piccinni A, Burgalassi A, Dell’Osso L, et al. Relationship between bipolar illness and binge-eating disorders. Psychiatry Res. 2005;135:165---70. 14. McElroy SL, Kotwal R, Keck PE Jr. Comorbidity of eating disorders with bipolar disorder and treatment implications. Bipolar Disord. 2006;8:686---95. 15. Wittchen HU, Muhlig S, Pezawas L. Natural course and burden of bipolar disorders. Int J Neuropsychopharmacol. 2003;6: 145---54. 16. Lewinsohn PM, Shankman SA, Gau JM. The prevalence and comorbidity of subthreshold psychiatric conditions. Psychol Med. 2004;34:613---22. 17. Lunde AV, Fasmer OB, Akiskal KK, Akiskal HS, Oedegaard KJ. The relationship of bulimia and anorexia nervosa with bipolar disorder and its temperamental foundations. J Affect Disord. 2009;115:309---14. 18. Bertolote JM, Fleischmann A. Suicide and psychiatric diagnosis: A worldwide perspective. World Psychiatry. 2002;1:181---5. 19. Alciati A, D’Ambrosio A, Foschi D, Corsi F, Mellado C, Angst J. Bipolar spectrum disorders in severely obese patients seeking surgical treatment. J Affect Disord. 2007;101:131---8. 20. Schoofs N, Chen F, Bräunig P, Stamm T, Krüger S. Binge eating disorder and menstrual cycle in unmedicated women with bipolar disorder. J Affect Disord. 2011;129:75---8. 21. Bellodi L, Cavallini MC, Bertelli S, Chiapparino D, Riboldi C, Smeraldi E. Morbidity risk for obsessive-compulsive spectrum disorders in first-degree relatives of patients with eating disorders. Am J Psychiatry. 2001;158:563---9. 22. Bushnell JA, Wells JE, McKenzie JM, Hornblow AR, OakleyBrowne MA, Joyce PR. Bulimia comorbidity in the general population and in the clinic. Psychol Med. 1994;24:605---11. 23. Fontenelle LF, VltorMendlowicz M, de Menezes GB, Papelbaum M, Freitas SR, Godoy-Matos A, et al. Psychiatric comorbidity in a Brazilian sample of patients with binge-eating disorder. Psychiatry Res. 2003;119:189---94. 24. Specker S, de Zwaan M, Raymond N, Mitchell J. Psychopathology in subgroups of obese women with and without binge eating disorder. Compr Psychiatry. 1994;35:185---90. 25. Simpson SG, al-Mufti R, Andersen AE, DePaulo JR Jr. Bipolar II affective disorder in eating disorder inpatients. J Nerv Ment Dis. 1992;180:719---22. 26. Nagata T, Yamada H, Teo AR, Yoshimura C, Kodama Y, van Vliet I. Using the mood disorder questionnaire and bipolar spectrum diagnostic scale to detect bipolar disorder and borderline 240 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. 47. E.M. Álvarez Ruiz, L. Gutiérrez-Rojas personality disorder among eating disorder patients. BMC Psychiatry. 2013;13:69. Ivarsson T, Råstam M, Wentz E, Gillberg IC, Gillberg C. Depressive disorders in teenage-onset anorexia nervosa: A controlled longitudinal, partly community-based study. Compr Psychiatry. 2000;41:398---403. Iwasaki Y, Matsunaga H, Kiriike N, Tanaka H, Matsui T. Comorbidity of axis i disorders among eating-disordered subjects in Japan. Compr Psychiatry. 2000;41:454---60. Moya T, Cordás TA, Lafer Y. Comorbidity of anorexia nervosa and bipolar disorder in early adolescence. Bipolar Disord. 2004;6:442---3. Torrent C, Vieta E, Crespo JA, Gonzalez-Pinto A, del Valle J, Olivares JM, et al. Barcelona Bipolar Eating Disorder Scale (BEDS): A self-administered scale for eating disturbances in bipolar patients. Actas Esp Psiquiatr. 2004;32:127---31. Torrent C, Vieta E, Garcia-Garcia M. Validation of the Barcelona Bipolar Eating Disorder Scale for bipolar patients with eating disturbances. Psychopathology. 2008;41:379---87. Molykhia T, Ibrahim S. Comorbidity of eating disorders among patients with bipolar disorders. Egypt J Psychiatry. 2009;29:35---42. Brewerton TD, Shannon M. Possible clozapine exacerbation of bulimia nervosa. Am J Psychiatry. 1992;149:1408---9. Tolstoi LG. The role of pharmacotherapy in anorexia nervosa and bulimia. J Am Diet Assoc. 1989;89:1640---6. Gross HA, Ebert MH, Faden VB, Goldberg SC, Nee LE, Kaye WH. A double-blind controlled trial of lithium carbonate primary anorexia nervosa. J Clin Psychopharmacol. 1981;1: 376---81. Barcai A. Lithium in adult anorexia nervosa. A pilot report on two patients. Acta Psychiatr Scand. 1977;55:97---101. Hudson JI, Pope HG Jr, Jonas JM, Yurgelun-Todd D. Treatment of anorexia nervosa with antidepressants. J Clin Psychopharmacol. 1985;5:17---23. Stein GS, Hartshorn S, Jones J, Steinberg D. Lithium in a case of severe anorexia nervosa. Br J Psychiatry. 1982;140:526---8. Hsu LK, Clement L, Santhouse R, Ju ES. Treatment of bulimia nervosa with lithium carbonate. A controlled study. J Nerv Ment Dis. 1991;179:351---5. Bowden CL, Calabrese JR, McElroy SL, Gyulai L, Wassef A, Petty F, et al. A randomized, placebo-controlled 12-month trial of divalproex and lithium in treatment of outpatients with bipolar i disorder. Divalproex Maintenance Study Group. Arch Gen Psychiatry. 2000;57:481---9. Hsu LK. Treatment of bulimia with lithium. Am J Psychiatry. 1984;141:1260---2. Hsu LK, Clement L, Santhouse R. Treatment of bulimia with lithium: A preliminary study. Psychopharmacol Bull. 1987;23:45---8. Kotwal R, Guerdjikova A, McElroy SL, Keck PE Jr. Lithium augmentation of topiramate for bipolar disorder with comorbid binge eating disorder and obesity. Hum Psychopharmacol. 2006;21:425---31. Vestergaard P, Amdisen A, Schou M. Clinically significant side effects of lithium treatment. A survey of 237 patients in long-term treatment. Acta Psychiatr Scand. 1980;62: 193---200. Aigner M, Treasure J, Kaye W, Kasper S. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the pharmacological treatment of eating disorders. World J Biol Psychiatry. 2011;12:400---43. Greetfeld M, Cuntz U, Voderholzer U. Pharmacotherapy for anorexia nervosa and bulimia nervosa. Fortschr Neurol Psychiatr. 2012;80:9---16. Herridge PL, Pope HG Jr. Treatment of bulimia and rapid cycling bipolar disorder with sodium valproate. J Clin Psychopharmacol. 1985;5:229---30. 48. Shapira NA, Goldsmith TD, McElroy SL. Treatment of bingeeating disorder with topiramate: A clinical case series. J Clin Psychiatry. 2000;61:368---72. 49. Paquet V, Strul J, Servais L, Pelc I, Fossion P. Sleep-related eating disorder induced by olanzapine. J Clin Psychiatry. 2002;63:597. 50. Brewerton TD. Antipsychotic agents in the treatment of anorexia nervosa: Neuropsychopharmacologic rationale and evidence from controlled trials. Curr Psychiatry Rep. 2012;14: 398---405. 51. McKnight RF, Park RJ. Atypical antipsychotics and anorexia nervosa: A review. Eur Eat Disord Rev. 2010;18:10---21. 52. Boachie A, Goldfield GS, Spettigue W. Olanzapine use as an adjunctive treatment for hospitalized children with anorexia nervosa: Case reports. Int J Eat Disord. 2002;33:98---103. 53. Hansen L. Olanzapine in the treatment of anorexia nervosa. Br J Psychiatry. 1999;175:592. 54. Jensen VS, Mejlhede A. Anorexia nervosa: Treatment with olanzapine. Br J Psychiatry. 2000;177:87. 55. Malina A, Gaskill J, McConaha C, Frank GK, LaVia M, Scholar L, et al. Olanzapine treatment of anorexia nervosa: A retrospective study. Int J Eat Disord. 2003;33:234---7. 56. Mehler C, Wewetzer CH, Schulze U, Warnke A, Theisen F, Dittmann RW. Olanzapine in children and adolescents with chronic anorexia. A study of five cases. Eur Child Adolesc Psychiatry. 2001;10:151---7. 57. Newman-Toker J. Risperidone in anorexia nervosa. J Am Acad Child Adolesc Psychiatry. 2000;39:941---2. 58. Powers PS, Santana CA, Bannon YS. Olanzapine in the treatment of anorexia nervosa: An open-label trial. Int J Eat Disord. 2002;32:146---52. 59. Appolinario JC, McElroy SL. Pharmacological approaches in the treatment of binge eating disorder. Curr Drug Targets. 2004;5:301---7. 60. Marazziti D, Rossi L, Baroni S, Consoli G, Hollander E, CatenaDell’Osso M. Novel treatment options of binge eating disorder. Curr Med Chem. 2011;18:5159---64. 61. McElroy SL, Guerdjikova AI, Mori N, O’Melia AM. Current pharmacotherapy options for bulimia nervosa and binge eating disorder. Expert Opin Pharmacother. 2012;13:2015---26. 62. Arbaizar B, Gómez-Acebo I, Llorca J. Efficacy of topiramate in bulimia nervosa and binge-eating disorder: A systematic review. Gen Hosp Psychiatry. 2008;30:471---5. 63. Marazziti D, Corsi M, Baroni S, Consoli G, Catena-Dell’Osso M. Latest advancements in the pharmacological treatment of binge eating disorder. Eur Rev Med Pharmacol Sci. 2012;16:2102---7. 64. Reas DL, Grilo CM. Review and meta-analysis of pharmacotherapy for binge-eating disorder. Obesity (Silver Spring). 2008;16:2024---38. 65. Hedges DW, Reimherr FW, Hoopes SP, Rosenthal NR, Kamin M, Karim R, et al. Treatment of bulimia nervosa with topiramate in a randomized, double-blind, placebo-controlled trial, part 2: Improvement in psychiatric measures. J Clin Psychiatry. 2003;64:1449---54. 66. Hoopes SP, Reimherr FW, Hedges DW, Rosenthal NR, Kamin M, Karim R, et al. Treatment of bulimia nervosa with topiramate in a randomized, double-blind, placebo-controlled trial, part 1: Improvement in binge and purge measures. J Clin Psychiatry. 2003;64:1335---41. 67. Nickel C, Tritt K, Muehlbacher M, Pedrosa Gil F, Mitterlehner FO, Kaplan P, et al. Topiramate treatment in bulimia nervosa patients: A randomized, double-blind, placebo-controlled trial. Int J Eat Disord. 2005;38:295---300. 68. Claudino AM, de Oliveira IR, Appolinario JC, Cordás TA, Duchesne M, Sichieri R, et al. Double-blind, randomized, placebo-controlled trial of topiramate plus cognitivebehavior therapy in binge-eating disorder. J Clin Psychiatry. 2007;68:1324---32. Comorbilidad entre el trastorno bipolar y los trastornos de la conducta alimentaria 69. McElroy SL, Hudson JI, Capece JA, Beyers K, Fisher AC, Rosenthal NR, et al. Topiramate for the treatment of binge eating disorder associated with obesity: A placebo-controlled study. Biol Psychiatry. 2007;61:1039---48. 70. McElroy SL, Arnold LM, Shapira NA, Keck PE Jr, Rosenthal NR, Karim MR, et al. Topiramate in the treatment of binge eating disorder associated with obesity: A randomized, placebocontrolled trial. Am J Psychiatry. 2003;160:255---61. 71. McElroy SL, Shapira NA, Arnold LM, Keck PE, Rosenthal NR, Wu SC, et al. Topiramate in the long-term treatment of bingeeating disorder associated with obesity. J Clin Psychiatry. 2004;65:1463---9. 72. Rubio MÁ. Topiramato en el tratamiento a largo plazo del trastorno por atracón asociado a la obesidad. Rev Esp Obes. 2009;7:402---8. 73. McElroy SL, Kotwal R, Guerdjikova AI, Welge JA, Nelson EB, Lake KA, et al. Zonisamide in the treatment of binge eating disorder with obesity: A randomized controlled trial. J Clin Psychiatry. 2006;67:1897---906. 74. Idini E, Buj-Alvarez I, Pifarre-Paradero J, Rodriguez-Picasso S, Castan-Campanera E. Patients with eating disorders (ED) treated with Zonisamide. Rev Bras Psiquiatr. 2011;33:418---9. 75. Yamamoto T, Kanahara N, Hirai A, Watanabe H, Lyo M. Lamotrigine in binge-eating disorder associated with bipolar ii depression and treatment-resistant type 2 diabetes mellitus: A case report. Clin Neuropharmacol. 2013;36:34---5. 76. Mitchell JE, Roerig J, Steffen K. Biological therapies for eating disorders. Int J Eat Disord. 2013;46:470---7. 77. Steffen KJ, Roerig JL, Mitchell JE, Uppala S. Emerging drugs for eating disorder treatment. Expert Opin Emerg Drugs. 2006;11:315---36. 78. Walsh BT, Hadigan CM, Devlin MJ, Gladis M, Roose SP. Long-term outcome of antidepressant treatment for bulimia nervosa. Am J Psychiatry. 1991;148:1206---12. 79. Fichter MM, Leibl C, Kruger R, Rief W. Effects of fluvoxamine on depression, anxiety, and other areas of general psychopathology in bulimia nervosa. Pharmacopsychiatry. 1997;30: 85---92. 80. Romano SJ, Halmi KA, Sarkar NP, Koke SC, Lee JS. A placebo controlled study of fluoxetine in continued treatment of bulimia nervosa after successful acute fluoxetine treatment. Am J Psychiatry. 2002;159:96---102. 81. McElroy SL, Guerdjikova A, Kotwal R, Welge JA, Nelson EB, Lake KA, et al. Atomoxetine in the treatment of binge-eating disorder: A randomized placebo-controlled trial. J Clin Psychiatry. 2007;68:390---8. 241 82. Guerdjikova AI, McElroy SL. Adjunctive methylphenidate in the treatment of bulimia nervosa co-occurring with bipolar disorder and substance dependence. Innov Clin Neurosci. 2013;10:30---3. 83. Appolinario JC, Godoy-Matos A, Fontenelle LF, Carraro L, Cabral M, Vieira A, et al. An open-label trial of sibutramine in obese patients with binge-eating disorder. J Clin Psychiatry. 2002;63:28---30. 84. Appolinario JC, Bacaltchuk J, Sichieri R, Claudino AM, GodoyMatos A, Morgan C, et al. A randomized, double-blind, placebocontrolled study of sibutramine in the treatment of binge-eating disorder. Arch Gen Psychiatry. 2003;60:1109---16. 85. Milano W, Petrella C, Casella A, Capasso A, Carrino S, Milano L. Use of sibutramine, an inhibitor of the reuptake of serotonin and noradrenaline, in the treatment of binge eating disorder: A placebo-controlled study. Adv Ther. 2005;22:25---31. 86. Wilfley DE, Crow SJ, Hudson JI, Mitchell JE, Berkowitz RI, Blakesley V, et al. Efficacy of sibutramine for the treatment of binge eating disorder: A randomized multicenter placebocontrolled double-blind study. Am J Psychiatry. 2008;165:51---8. 87. Planell LS, Mar F-VR. Trastorno por atracón y obesidad. Form Contin Nutr Obes. 2002;5:314---24. 88. Stankovic A, Potenza MN. Obesity and binge eating disorder. En: Le Moal M, Koob GF, Thompson RF, editores. Encyclopedia of Behavioral Neuroscience. Elsevier; 2010. p. 477---83. 89. Becoña E, Lorenzo MC. Tratamientos psicológicos eficaces para el trastorno bipolar. Psicothema. 2001;13:511---22. 90. Krüger S, Shugar G, Cooke RG. Comorbidity of binge eating disorder and the partial binge eating syndrome with bipolar disorder. Int J Eat Disord. 1996;19:45---52. 91. Edmonds LK, Mosley BJ, Admiraal AJ, Olds RJ, Romans SE, Silverstone T, et al. Familial bipolar disorder: Preliminary results from the Otago Familial Bipolar Genetic Study. Aust N Z J Psychiatry. 1998;32:823---9. 92. Vieta E, Colom F, Corbella B, Martínez-Arán A, Reinares M, Benabarre A, et al. Clinical correlates of psychiatric comorbidity in bipolar i patients. Bipolar Disord. 2001;3:253---8. 93. MacQueen GM, Marriott M, Begin H, Robb J, Joffe RT, Young LT. Subsyndromal symptoms assessed in longitudinal, prospective follow-up of a cohort of patients with bipolar disorder. Bipolar Disord. 2003;5:349---55. 94. Fagiolini A, Kupfer DJ, Houck PR, Novick DM, Frank E. Obesity as a correlate of outcome in patients with bipolar i disorder. Am J Psychiatry. 2003;160:112---7. 95. Halmi KA, Eckert E, Marchi P, Sampugnaro V, Apple R, Cohen J. Comorbidity of psychiatric diagnoses in anorexia nervosa. Arch Gen Psychiatry. 1991;48:712---8. Rev Psiquiatr Salud Ment (Barc.). 2015;8(4):242---251 www.elsevier.es/saludmental CARTAS AL DIRECTOR Delírium en la versión en español del DSM-5: ¿más confusión? Delirium in the Spanish version of the DSM-5: More confusion? Sr. Director: En mayo de 2013 fue publicada la quinta edición del Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-5), lo que conllevó cambios en algunos criterios diagnósticos con respecto a la edición previa, unos más profundos que otros1 . Las modificaciones más importantes respecto al delírium fueron: --- Centrar el ítem A en la atención (attention, awareness), que según datos empíricos es la más importante de las características nucleares del trastorno2 . Con este fin se dejó atrás el término complejo consciousness («conciencia») utilizado en el ítem A del DSM-IV-TR. --- Incluir un ítem específico sobre el diagnóstico diferencial con otros trastornos neurocognitivos como la enfermedad de Alzheimer o con un estado de estimulación extremadamente reducido (p. ej., coma). Estos cambios, especialmente los relacionados con el ítem A, fueron recibidos positivamente por expertos en América y Europa3 . Los 3 ítems restantes, que involucran la presencia de alteraciones en otras funciones cognitivas (p. ej., en la memoria), el inicio agudo-fluctuación de los síntomas y la necesidad de identificar posibles etiologías, fueron poco modificados. En la versión en español de estos nuevos criterios para el diagnóstico de delírium (2014)4 , se traduce la palabra awareness (presente en el nuevo ítem A) como «conciencia» (cuando dicha palabra aparecía en versiones anteriores del manual, se tradujo como «atención al entorno», preservando así la intencionalidad de los autores). El uso erróneo del término complejo y poco operativo «conciencia» por awareness en el ítem principal de los nuevos criterios podría reducir la concordancia entre evaluadores y entorpecer las decisiones terapéuticas. Además, es posible que disminuya la validez internacional de los estudios llevados a cabo con la versión castellana del DSM-5. El DSM-5 en español también desconcierta al denominar «síndrome confusional» al trastorno. Aunque esa denominación se relaciona con el concepto francés del siglo XIX, Confusion Mentale Primitive (que tuvo que ver con la consolidación del constructo actual del síndrome)5 , la mayoría de los hispanoparlantes prefieren el vocablo delírium6 . Dicho vocablo fue rescatado a partir de los primeros criterios operativos específicos publicados en el DSM-III, buscando preservar la coherencia histórica con el término introducido por Celsus (c. 25 a.C-c. 50 d.C)7 . Delírium es también el nombre usado en la otra clasificación vigente en español, la 10.a versión de la Clasificación Internacional de las Enfermedades. La falta de consenso en la designación de un trastorno sobre el que deben intervenir profesionales de diversas áreas dificulta la comunicación y podría llevar a situaciones en las que distintos especialistas piensan que están afrontando varios diagnósticos en lugar de uno. Los editores de la Revista de Psiquiatría y Salud Mental nos informaron que el equipo traductor del DSM-5 recibió de la American Psychiatric Association un glosario de términos en español que debía usar. Dicha indicación llevó a que la versión en nuestro idioma de diversos criterios diagnósticos no sea tan ajustada a las particularidades linguísticas como el equipo hubiese querido, por lo que está atento a perfeccionarlos en una próxima revisión. Reed y Ayuso-Mateos8 , en referencia a la esperada Clasificación Internacional de Enfermedades 11.a edición, sostienen que durante el desarrollo de cualquier clasificación diagnóstica es importante tener en cuenta las peculiaridades de los diferentes lenguajes en los que será editada, con el fin de optimizar su utilidad. En este mismo sentido, Tohen9 señala que se debe procurar que el lenguaje, como eje vertebrador de la psiquiatría, facilite la colaboración entre profesionales de habla hispana. En nuestra opinión, al utilizar el DSM-5 en español para diagnosticar el delírium se debe tener en cuenta que el ítem A de la versión original en inglés se refiere a alteraciones en la atención3 . Además, delírium es el nombre actual y el más aceptado en el mundo para el síndrome que nos ocupa6 , por lo cual abogamos por su uso en lugar de otros términos que proliferan entre diferentes especialistas. 1888-9891/© 2015 SEP y SEPB. Publicado por Elsevier España, S.L.U. Todos los derechos reservados. CARTAS AL DIRECTOR Bibliografía 1. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders (DSM-5TM ). Arlington, VA: American Psychiatric Publishing; 2013. 2. Franco JG, Trzepacz P, Meagher DJ, Kean J, Lee Y, Kim JL, et al. Three core domains of delirium validated using exploratory and confirmatory factor analyses. Psychosomatics. 2013;54:227---38. 3. European Delirium Association. American Delirium Society. The DSM-5 criteria, level of arousal and delirium diagnosis: Inclusiveness is safer. BMC Med. 2014;12:141. 4. American Psychiatric Association. DSM-5. Manual Diagnóstico y Estadístico de los Trastornos Mentales. 5.a ed. Arlington, VA: Editorial Médica Panamericana; 2014. 5. Chaslin P. Elementos de semiología y clínica mentales. Buenos Aires: Polemos; 2010. 6. Morandi A, Pandharipande P, Trabucchi M, Rozzini R, Mistraletti G, Trompeo AC, et al. Understanding international differences in terminology for delirium and other types of acute brain dysfunction in critically ill patients. Intensive Care Med. 2008;34:1907---15. La psicosis, una presentación inusual de la tiroiditis de Hashimoto Psychosis, an unusual presentation of Hashimoto’s thyroiditis Sr. Director: La tiroiditis de Hashimoto es una entidad descrita por Hashimoto en 1912. Se caracteriza por títulos elevados de anticuerpos antitiroideos e inflamación linfocitaria de la glándula tiroidea. En 1966, Brain et al. relacionan la tiroiditis y la encefalopatía de Hashimoto1 . En este caso el inicio es gradual, el curso recurrente y con títulos elevados de anticuerpos2 . La prevalencia es de 2,1/100.000, predominante en mujeres (5:1). De ellos, un 20-44% se presenta antes de los 18 años3 . De etiología desconocida se adscribe al grupo de los trastornos autoinmunes, y se asocia a entidades como el lupus eritematoso, el síndrome de Sjögren y la diabetes mellitus tipo 13 . Su patogenia es desconocida ya que no existe una relación directa entre la enfermedad tiroidea y la encefalitis. La función tiroidea está conservada en la mayoría de los casos, en otros, cursa con hipertiroidismo, y en el menor de los casos se manifiesta con hipotiroidismo. Todos los casos de encefalitis de Hashimoto presentan una clínica de encefalopatía aguda o subaguda que puede cursar con síntomas neuropsiquiátricos4 . La forma de evolución más común es con recaídas y remisiones (50%), y gradual e insidiosa (40%)5 . Las pruebas complementarias son anodinas. La analítica suele ser normal salvo los casos de asociación de encefalopatía y tiroiditis de Hashimoto, que detectan marcadores de enfermedad autoinmune. Entre los anticuerpos antitiroideos, los antimicrosómicos y antiperoxidasa a títulos superiores a 100 veces lo normal son los más específicos y 243 7. Lipowski ZJ. Delirium: How its concept has developed. Int Psychogeriatr. 1991;3:115---20. 8. Reed GM, Ayuso-Mateos JL. Hacia una clasificación Internacional de los Trastornos Mentales de la OMS de mayor utilidad clínica. Rev Psiquiatr Salud Ment (Barc). 2011;4:113---6. 9. Tohen M. Psychiatric collaborations in the Hispanic world. Rev Psiquiatr Salud Ment (Barc). 2014;7:155---6. Esteban Sepulveda a,∗ y José G. Franco a,b a Hospital Psiquiatric Universitari Institut Pere Mata, IISPV, Universitat Rovira i Virgili, Reus, Tarragona, España b Universidad Pontificia Bolivariana, Facultad de Medicina, Grupo de Investigación en Psiquiatría de Enlace, Medellín, Colombia ∗ Autor para correspondencia. Correo electrónico: esteban [email protected] (E. Sepulveda). http://dx.doi.org/10.1016/j.rpsm.2015.05.002 están presentes en el 100% de los casos6 ; los anticuerpos antitiroglobulina se hallan en un 70% de estos3 . El EEG más frecuente muestra ondas lentas, ondas trifásicas o trastornos epilépticos7 . Las pruebas de neuroimagen resultan inespecíficas. El diagnóstico se realiza por exclusión, una vez que se han descartado las causas más frecuentes de encefalopatía y se detectan los anticuerpos antitiroideos. El tratamiento es con corticoides intravenosos y orales durante 4-6 semanas hasta obtener mejoría; a partir de entonces se realiza una pauta descendente hasta su retirada6,8 . Además es necesario un tratamiento sintomático con medidas de hidratación, analgesia, medicación antipsicótica y antiepiléptica. Presentamos el caso de un varón de 44 años, soltero, con buen apoyo sociolaboral. Sin antecedentes psiquiátricos. Como antecedentes somáticos, clínica hipertiroidea de 4 meses de evolución, con ansiedad manifiesta, insomnio y pérdida ponderal de 23 kg. Como hábitos tóxicos destaca enolismo de larga evolución, consumo esporádico de cocaína y consumo excesivo de tabaco. La clínica se caracteriza por excitación psicomotriz, desorganización conductual, perplejidad, ideación delirante de tipo paranoide, religioso y megaloide con fluctuación de la temática según el estado afectivo. Al inicio del cuadro, esto se asocia a crisis convulsivas en las que sufre traumatismos craneo-encefálicos. En la exploración física está hemodinámicamente estable, sin fetor enólico. En la exploración neurológica hallamos bradipsiquia, somnolencia diurna y temblor intencional en miembros superiores. Analítica general, normal. Tóxicos negativos. En las pruebas complementarias destaca una elevación de hormonas tiroideas, T3: 0,51 ng/dl; T4: 1,94 ng/dl, una elevación de Ac. microsomales: 159,8 UI/ml y de Ac. anti-tiroglobulina: 420,7 UI/ml. En la TAC torácica se objetiva una imagen sugestiva de hiperplasia tímica. La glándula tiroides presenta aumento difuso de la región del istmo. En la eco-Doppler de tronco supraaórtico y en la ecografía de cuello se constata bocio difuso del tiroides. La TAC 244 craneal y la RMN son normales. En el EEG se observa una actividad discretamente enlentecida. En pequeña proporción ondas lentas de baja amplitud asociado a ondas agudas en región centro-parieto-temporal de predominio centrotemporal derecha con tendencia a la difusión con diferentes estímulos. Se le pauta tratamiento etiológico con antitiroideos (5 mg de carbimazol) y corticoides (5 bolos de metilprednisolona iv y una pauta de corticoides oral) y tratamiento sintomático con antipsicóticos (9 ml de risperidona y 1,5 mg de clonazepam). Con este tratamiento se consigue una remisión completa de la sintomatología psicótica. Por todo ello, consideramos importante recalcar la importancia de que los trastornos somáticos pueden comenzar con clínica neuropsiquiátrica, se han descrito múltiples síntomas psiquiátricos como parte de la sintomatología prodrómica de algunas enfermedades somáticas9,10 . Es por esto que ante un episodio psicótico agudo sin antecedentes psiquiátricos o enfermedades somáticas conocidas, se debe realizar un despistaje orgánico exhaustivo. Para concluir, afirmamos que los trastornos relacionados con el tiroides producen síntomas neuropsiquiátricos; la clínica psicótica acompañante es conocida desde hace años, pero está estudiada poco desde el punto de vista psiquiátrico. El diagnóstico de psicosis aguda debido a una enfermedad médica, posibilita un tratamiento etiológico y la curación del trastorno. Bibliografía 1. Brain L, Jellinek EH, Ball K. Hashimoto’s disease and encephalopathy. Lancet. 1966;2:512---4. 2. Zamora Elson M, Labarta Monzón L, Mallor Bonet T, Villacampa Clavér V, Avellanas Chavala M, Seron Arbeloa C. Encefalitis de Hashimoto, a propósito de un caso. Med Intensiva. 2014;38:5223. 3. Mocellin R, Walterfang M, Velakoulis D. Hashimoto’s encephalopathy: Epidemiology, pathogenesis and management. CNS Drugs. 2007;21:799---811. Las voluntades anticipadas en salud mental: hechos y valores夽 Advance directives in mental health: Facts and values Sr. Director: Frecuentemente apelamos a principios bioéticos para los conflictos éticos. El respeto por la autonomía se ejemplifica en el consentimiento informado y el documento de voluntades anticipadas (DVA). En salud mental hemos de partir de que los pacientes quieren y pueden participar en las decisiones sanitarias1,2 . En ocasiones rechazan tratamientos eficaces porque no están bien informados. En 夽 Este artículo forma parte del proyecto becado por la Fundació Víctor Grífols i Lucas sobre bioética (2013-2014). CARTAS AL DIRECTOR 4. Brownlie BEW, Rae AM, Walshe WB, Wells JE. Psychoses associated with thyrotoxicosis - ‘‘thyrotoxic psychosis’’. A report of 18 cases, with statistical analysis of incidence. Eur J Endocrinol. 2000;142:438---44. 5. Tamagno G, Federspil G, Murialdo G. Clinical and diagnostic aspects of encephalopathy associated with autoimmune thyroid disease (or Hashimoto’s encephalopathy). Intern Emerg Med. 2006;1:15---23. 6. Mijajlovic M, Mirkovic M, Dackovic J, Zidverc-Trajkovic J, Sternic N. Clinical Manifestations diagnostic criteria and teraphy of Hashimoto’s encephalopathy: Report of two cases. J Neurol Sci. 2010;288:194---6. 7. Sporis D, Habek M, Mubrin Z, Poljakoviæ Z, Hajnsek S, Bence-Zigman Z. Psychosis and EEG abnormalities as manifestations of Hashimoto encephalopathy. Cogn Behav Neurol. 2007;20:138---40. 8. Grommes C, Griffin C, Downes KA, Lerner AJ. Steroid-responsive encephalopathy associated with autoimmune thyroiditis presenting with diffusion MR imaging changes. AJNR Am J Neuroradiol. 2008;29:1550---1. 9. Ferraci F, Carnevale A. The neurological disorder associated with thyroid autoimmunity. J Neurol. 2006;253:975. 10. Galdeano Mondragón A, Oliván Roldán C, Barbadillo izquierdo L. Clínica psiquiátrica en la encefalitis de Hashimoto. Archivos de Psiquiatria. 2010;73:7. María Robles-Martínez a,∗ , Ana M. Candil-Cano b , Eulalio Valmisa-Gómez de Lara b , Nuria Rodríguez-Fernández b , Begoña López b y Tomás Sánchez-Araña a a Unidad de Gestión Clínica de Salud Mental, Hospital Universitario Puerta del Mar, Cádiz, España b Unidad de Gestión Clínica de Neurociencias, Hospital Universitario Puerto Real, Cádiz, España ∗ Autor para correspondencia. Correo electrónico: [email protected] (M. Robles-Martínez). http://dx.doi.org/10.1016/j.rpsm.2015.05.001 ese caso, los profesionales tienen la obligación moral de «hacerles autónomos y competentes» informándoles. En casos de incompetencia, el representante ha de mantener un diálogo con los profesionales para que se respete, en lo posible, al paciente. En ese diálogo también se constata la no-maleficencia, que es la obligación de no dañar intencionadamente. Hemos de evitar actitudes violentas mediante contención (farmacológica, mecánica, etc.). Pero también, privar, injustificadamente, del derecho a la autonomía supone un daño moral, pues se impide que se lleve a cabo sus intereses. Además, resulta un daño el paternalismo injustificado que infantiliza a los pacientes, estigmatizando y discriminándolos. Es necesario buscar su mayor beneficio. El DVA comporta repercusiones positivas en su recuperación3---7 . Finalmente, las decisiones justas pueden permitir ahorrar en gasto sanitario si los pacientes piden que no se les prolongue la vida más allá de lo razonable. Los que padecen demencia pueden responder a ese perfil. CARTAS AL DIRECTOR 245 Estos principios quedan ejemplificados en el contenido y utilidad del DVA. Wilder et al.8 y Srebnik et al.9 muestran que las personas con enfermedades mentales aceptan mejor los neuromoduladores y los antipsicóticos atípicos, rechazando con más frecuencia antipsicóticos clásicos y litio. Muchos profesionales creen que los pacientes rechazarán todos los fármacos; sin embargo, este hecho no suele darse8 . Las razones de rechazo farmacológico son: efectos negativos, sentirse dopados e incapacidad para realizar las actividades de la vida cotidiana9 . En cualquier caso, la libre elección del tratamiento, el conocimiento de sus contraindicaciones y la importancia de su seguimiento tienen una mejora en la adherencia farmacológica, lo cual reduce el número de recidivas, pues supone una motivación para su seguimiento9 . Es también motivo de elección o rechazo decisiones sobre la hospitalización o personas de contacto mientras esté ingresado10 . El uso del DVAP reduce el empleo de medidas coercitivas al haber una confianza entre equipo médico y paciente. Por otro lado, si deja anotado un representante hay más posibilidad de respeto por la voluntad del paciente y con ello que la persona se sienta empoderada. Por todo ello, conseguimos un respeto por la persona (autonomía), buscamos mayor beneficio (mayor adherencia farmacológica, etc.) y evitamos futuros daños (recidivas, medidas coercitivas. . .). La libre elección de tratamiento puede contribuir a una reducción de la aplicación de tratamientos no deseados, lo cual es de justicia que ocurra. 2. Hamann J, Cohen R, Diplich S. Why do some patients with schizophrenia want to be engaged in medical making and others do not? J Clin Psychiatry. 2011;72:1636---43. 3. La Fond J, Srebnik D. The impact of mental health advance directives on patient perceptions of coercion in civil commitment and treatment decisions. Int J Law Psychiatry. 2002;25:537---55. 4. Srebnik D, Rutherford L, Peto T, Russo J, Zick E, Jaffe C, et al. The content and clinical utility of psychiatric advance directives. Psychiatr Serv. 2005;56:592---8. 5. Rittmannsberger H, Pachinger T, Keppelmüller P, Wancata J. Medication adherence among psychotic patients before admission to inpatient treatment. Psiquiatr Serv. 2004;55: 174---9. 6. Hamann J, Cohen R, Leucht S, Busch R, Kissling R. Do patients with schizophrenia wish to be involved in decisions about their medical treatment? Am J Psychiatry. 2005;162:2382---4. 7. Swanson J, Swartz M, Elbogen E, van Dorn R, Ferron J, Wagner H, et al. Facilitated psychiatric advance directives: A randomized trial of an intervention to foster advance treatment planning among persons with severe mental illness. Am J Psychiatry. 2006;163:1943---51. 8. Wilder Ch, Elbogen E, Moser L, Swanson J, Swartz M. Medication preferences and adherence among individuals with severe mental illness and psychiatric advance directives. Psychiatr Serv. 2010;61:380---5. 9. Srebnik DS, Rutherford LT, Peto T, Russo J, Zick E, Jaffe C, et al. The content and clinical utility of psychiatric advance directives. Psychiatr Serv. 2005;56:592---8. 10. Srebnik D, la Fond J. Advance directives for mental health treatment. Psychiatr Serv. 1999;50:919---25. Bibliografía Sergio Ramos Pozón 1. El-Wakeel, Taylor G, Tate J. What do patients really want to know in an informed consent procedure? A questionnairebased survey of patients in the Bath Area, UK. J Med Ethics. 2006;32:121---8. Un nuevo método de valoración de la enfermedad psiquiátrica postraumática A new assessment method of posttraumatic psychiatric pathology Sr. Director: En 2011 se produjeron 94.920 faltas de lesiones, 136.907 delitos contra la vida, integridad y libertad de las personas1 , 11.347 heridos graves y 104.280 heridos leves producidos por accidentes de tráfico2 . Por tanto, 347.454 personas presentaron lesiones físicas y/o psíquicas. La enfermedad psíquica postraumática (EPP) es aquella desencadenada por un agente externo (de naturaleza física o psíquica) que puede conllevar repercusiones legales y económicas. Para la valoración jurídica de la EPP se necesita conocer el tipo de lesión, su gravedad, los distintos tratamientos recibidos, la evolución, los tiempos requeridos para su curación Fundació Víctor Grífols i Lucas, Barcelona, España Correo electrónico: [email protected] http://dx.doi.org/10.1016/j.rpsm.2015.04.001 y, principalmente, la funcionalidad del sujeto una vez llegue a la «estabilización lesional», es decir, aquella situación en la que no existe posibilidad de mejora al haberse aplicado todos los tratamientos aceptados científicamente. Lo anterior implica que el informe pericial, también el psiquiátrico, debe centrarse en el diagnóstico, en su gravedad y en la repercusión que la discapacidad provoca en la vida del sujeto. La EPP presenta determinadas peculiaridades3 : 1) se puede producir con o sin lesión cerebral; 2) la vivencia del trauma puede desencadenar o agravar sintomatología, y 3) puede existir desproporción entre trauma, sintomatología y funcionalidad. Con idea de homogeneizar los parámetros utilizados en la valoración del daño se ha ido imponiendo el uso de baremos, que aunque puedan resultar imperfectos e incompletos para la cuantificación de los daños personales4 , se han acercado a la funcionalidad tratando de separarse de la sintomatología5 . En los países de la Unión Europea, hasta 1995 solo Bélgica, España, Grecia y Portugal aplicaban baremos oficiales de clasificación o cuantificación del daño corporal derivados de accidentes de circulación6 . El resto 246 de los países utilizaba baremos no oficiales, como el baremo francés de Louis Mélennec7 , la Clasificación Internacional del Funcionamiento, de la Discapacidad y de la Salud8 o la guía de «menoscabo permanente» publicada por la American Medical Association9 . En España, en la actualidad, los denominados síndromes psiquiátricos, así como su puntuación, se recogen en el baremo de la Ley 34/2003 de modificación y adaptación a la normativa comunitaria de la legislación de seguros privados10 , así como en el Real Decreto Legislativo 8/2004, de 29 de octubre, por el que se aprueba el texto refundido de la Ley sobre responsabilidad civil y seguro en la circulación de vehículos a motor11 . Existen varias dificultades a la hora de aplicar dicho baremo. La primera es que la terminología empleada no se ajusta a las clasificaciones psiquiátricas actuales (CIE-10 o DSM-512,13 ). La segunda es que no se especifica cuál es el procedimiento a seguir para concretar una puntuación del rango (salvo en el trastorno orgánico de la personalidad). La tercera es la existencia de estrechos márgenes y escasa puntuación en los que se mueven las secuelas psíquicas14 (salvo, de nuevo, en el trastorno orgánico de la personalidad). Por todo lo anterior, una misma secuela puede ser puntuada de diferente modo en función de la experiencia y conocimiento de quien realiza el reconocimiento del paciente. Por todo lo anterior, se presenta un procedimiento para la baremación de la EPP que adapta el actual baremo a la nosología de la CIE-1012 y especifica un método de valoración que homogeneiza la puntuación de las EPP. Este procedimiento no implica una modificación del baremo actual, sino un uso más claro y homogéneo del mismo. Metodología Se estableció un grupo de trabajo que fue constituido por un conjunto de expertos (2 magistrados nombrados por el Consejo General del Poder Judicial y 4 psiquiatras nombrados por la Fundación Española de Psiquiatría y Salud Mental, de los cuales 2 son, además, forenses). Este grupo se encargó de realizar un borrador inicial de un procedimiento que se presentó a discusión ante diferentes foros de profesionales. Así ocurrió en Documentos Córdoba 2011, reunión de profesionales del Derecho (jueces, fiscales y abogados) y psiquiatras, publicada por la Fundación Española de Psiquiatría y Salud Mental15 . Se presentaron varias ponencias acerca de la necesidad jurídica y psiquiátrica de homogeneizar la puntuación del baremo de tráfico, discutiéndose la propuesta que presentaba el grupo de trabajo. Fue unánimemente aceptada, y se incorporó una mínima modificación jurídica. Posteriormente, y siguiendo la misma metodología, se presentó en el XV Congreso Nacional de Psiquiatría (Oviedo, 2011), en una reunión monográfica (Sevilla, 2011), en colaboración con el Centro para la Excelencia de la Investigación Forense de Andalucía, sobre el tema con 25 médicos forenses de diferentes comunidades autónomas de España. Fueron expuestas las razones del procedimiento por parte de sus autores (magistrados, psiquiatras y psiquiatras-médicos forenses) y, finalmente, en el XVI Congreso Nacional de Psiquiatría (Bilbao, 2012). CARTAS AL DIRECTOR Procedimiento Valoración previa a la baremación La valoración pericial debe realizarse a partir de la «estabilización lesional», momento en el que la lesión o trastorno psíquico no evoluciona positivamente a pesar del tratamiento prescrito. La sintomatología psiquiátrica que pueda ser observada en las edades infantiles es necesario que sea enmarcada, para su valoración, en la actitud global de sus padres ante los hechos traumáticos causales. Diagnóstico: concordancia con el baremo actual Como se ha indicado anteriormente, se vinculan los diagnósticos de la CIE-1012 referentes a las enfermedades mentales con los síndromes psiquiátricos incluidos en el baremo oficial. Para ello, los subapartados del baremo se cambiarían por los diagnósticos actuales (tabla 1). Para poderse aplicar, el diagnóstico deberá cumplir los mismos criterios que los recogidos en la CIE-1012 . En el caso de que el diagnóstico como secuela psíquica ya se padeciese previamente, se consignará como agravamiento, y el cálculo de la intensidad sintomática y el grado de discapacidad será la diferencia resultante de las mismas antes y después del evento traumático. Indicación de la gravedad de la sintomatología La gravedad del padecimiento postraumático se evaluará en función del número e intensidad (frecuencia temporal) de los síntomas presentes que se constaten en la anamnesis y exploración, siempre sobre la base de la descripción nosográfica criterial establecida para cada entidad en la clasificación internacional de la CIE-1012 . Para efectuar diagnósticos con esta clasificación el sujeto evaluado ha de cumplir los criterios mínimos que en cada entidad se especifican. A partir de estos mínimos, el tipo de gravedad se indicará en los gradientes siguientes: - Moderada: hasta 40 puntos. Cumple el número mínimo de criterios exigidos establecidos en la CIE-10 para poder ser diagnosticado. - Intensa: hasta 60 puntos. Excede la sintomatología un 20% sobre los mínimos requeridos para ese diagnóstico. - Muy intensa: hasta 80 puntos. Excede la sintomatología un 40% sobre los mínimos requeridos para ese diagnóstico y/o alguno de ellos es extremadamente grave. - Extrema: 100 puntos. Reúne el máximo de los síntomas que se describen para ese diagnóstico y/o varios de ellos son extremadamente graves. La categoría «leve» quedaría anulada, ya que supone la existencia de sintomatología psicopatológica aislada y/o malestares psíquicos indeterminados y difusos que no ocasionan una disminución de sus capacidades funcionales, conservando la actividad habitual. CARTAS AL DIRECTOR Tabla 1 el BOE 247 Propuesta de clasificación de los trastornos CIE-10 según la ordenación de síndromes psiquiátricos establecidos por Síndromes psiquiátricos establecidos por el BOE Enfermedades según la CIE-10 a incluir Trastornos de la personalidad Síndrome posconmocional Trastornos orgánicos F04 Síndrome amnésico orgánico no inducido por alcohol u otras sustancias psicotropas F07.0 Trastorno orgánico de la personalidad F07.2 Síndrome posconmocional Trastorno orgánico de la personalidad Otros F06.0 F06.1 F06.2 F06.3 F06.4 F06.5 F06.6 F06.7 Alucinosis orgánica Trastorno catatónico orgánico Trastorno esquizofreniforme orgánico Trastorno del humor orgánico Trastorno de ansiedad orgánico Trastorno disociativo orgánico Trastorno de labilidad emocional orgánico Trastorno cognoscitivo leve Trastorno del humor Trastorno del humor F32 Episodios depresivos F33 Trastorno depresivo recurrente F34.1 Distimia F34.8 Otros trastornos del humor (afectivos) persistentes F34.9 Trastorno del humor (afectivo) persistente sin especificación F38 Otros trastornos del humor (afectivos) F39 Trastorno del humor (afectivo) sin especificación Trastornos neuróticos Trastornos ansiosos F40 Trastornos de ansiedad fóbica F41 Otros trastornos de ansiedad F43 Reacciones a estrés grave y trastornos de adaptación F44 Trastornos disociativos (de conversión) F45 Trastornos somatomorfos F48 Otros trastornos neuróticos F50.4 Hiperfagia en otras alteraciones psicológicas F50.5 Vómitos en otras alteraciones psicológicas F51 Trastornos no orgánicos del sueño F52 Disfunción sexual no orgánica F54 Factores psicológicos y del comportamiento en trastornos o enfermedades clasificados en otro lugar F59 Trastornos del comportamiento asociados a disfunciones fisiológicas y a factores somáticos sin especificación F62 Transformación persistente de la personalidad no atribuible a lesión o enfermedad cerebral F68 Otros trastornos de la personalidad y del comportamiento del adulto F69 Trastorno de la personalidad y del comportamiento del adulto sin especificación F91 Trastornos disociales F92 Trastornos disociales y de las emociones mixtos F93 Trastornos de las emociones de comienzo habitual en la infancia F94.8 Otros trastornos del comportamiento social en la infancia y adolescencia F94.9 Trastorno del comportamiento social en la infancia y adolescencia sin especificación F95.1 Trastorno de tics crónicos motores o fonatorios F95.9 Trastorno de tics sin especificación F98 Otros trastornos de las emociones y del comportamiento de comienzo habitual en la infancia y adolescencia F99 Trastorno mental sin especificación 248 Tabla 1 CARTAS AL DIRECTOR (continuación) Síndromes psiquiátricos establecidos por el BOE Enfermedades según la CIE-10 a incluir Agravaciones F00 Demencia en la enfermedad de Alzheimer F02 Demencia en enfermedades clasificadas en otro lugar F03 Demencia sin especificación F05 Delirium no inducido por alcohol u otras sustancias psicotropas F10 Trastornos mentales y del comportamiento debidos al consumo de alcohol F11 Trastornos mentales y del comportamiento debidos al consumo de opioides F12 Trastornos mentales y del comportamiento debidos al consumo de cannabinoides F13 Trastornos mentales y del comportamiento debidos al consumo de sedantes o hipnóticos F14 Trastornos mentales y del comportamiento debidos al consumo de cocaína F15 Trastornos mentales y del comportamiento debidos al consumo de otros estimulantes (incluyendo la cafeína) F16 Trastornos mentales y del comportamiento debidos al consumo de alucinógenos F17 Trastornos mentales y del comportamiento debidos al consumo de tabaco F18 Trastornos mentales y del comportamiento debidos al consumo de disolventes volátiles F19 Trastornos mentales y del comportamiento debidos al consumo de múltiples drogas o de sustancias psicotropas F20 Esquizofrenia F21 Trastorno esquizotípico F22 Trastorno de ideas delirantes persistentes F24 Trastorno de ideas delirantes inducidas F25 Trastornos esquizoafectivos F28 Otros trastornos psicóticos no orgánicos F29 Psicosis no orgánica sin especificación F30 Episodio maníaco F31 Trastorno bipolar F33 Trastorno depresivo recurrente F34 Trastornos del humor (afectivos) persistentes F38 Otros trastornos del humor (afectivos) F42 Trastorno obsesivo-compulsivo F50.0 Anorexia nerviosa F50.1 Anorexia nerviosa atípica F50.2 Bulimia nerviosa F50.3 Bulimia nerviosa atípica F53 Trastornos mentales y del comportamiento en el puerperio no clasificados en otro lugar F55 Abuso de sustancias que no producen dependencia F60 Trastornos específicos de la personalidad F61 Trastornos mixtos y otros trastornos de la personalidad F63 Trastornos de los hábitos y del control de los impulsos F64 Trastornos de la identidad sexual F65 Trastornos de la inclinación sexual F66 Trastornos psicológicos y del comportamiento del desarrollo y orientación sexuales F70 Retraso mental leve F71 Retraso mental moderado F72 Retraso mental grave F73 Retraso mental profundo F78 Otro retraso mental F79 Retraso mental sin especificación F80 Trastornos específicos del desarrollo del habla y del lenguaje F81 Trastornos específicos del desarrollo del aprendizaje escolar F82 Trastorno específico del desarrollo psicomotor F83 Trastorno específico del desarrollo mixto F84 Trastornos generalizados del desarrollo F88 Otros trastornos del desarrollo psicológico CARTAS AL DIRECTOR Tabla 1 249 (continuación) Síndromes psiquiátricos establecidos por el BOE Enfermedades según la CIE-10 a incluir F89 Trastorno del desarrollo psicológico sin especificación F90 Trastornos hipercinéticos F94.0 Mutismo selectivo F94.1 Trastorno de vinculación en la infancia reactivo F94.2 Trastorno de vinculación en la infancia desinhibido F95.2 Trastorno de tics múltiples motores y fonatorios combinados (síndrome de Gilles de la Tourette) F95.8 Otros trastornos de tics Fuente: Boletín Oficial del Estado10,11 y Organización Mundial de la Salud12 . Grado de discapacidad que produce la sintomatología presente que se propone, así como la diferencia que pudiera existir con la forma actual de evaluar el daño psíquico. La discapacidad implica las dificultades para una vida autónoma y/o las repercusiones negativas en su vida laboral16 . En este apartado se asume lo publicado en el Real Decreto 1971/1999, de 23 de diciembre, de procedimiento para el reconocimiento, declaración y calificación del grado de minusvalía17 , y su posterior corrección18 . Financiación El trabajo presentado ha sido financiado por la Fundación Española de Psiquiatría y Salud Mental y por el Consorcio para la Excelencia de la Investigación Forense de Andalucía. Agradecimientos Sufrimiento psiquiátrico Se incorpora al baremo el concepto de sufrimiento psiquiátrico, que de acuerdo con el grupo de consenso, debe tener en cuenta tanto la gravedad de la secuela como el grado de discapacidad que a esa persona le implica el padecimiento de la enfermedad producida o agravada. Por tanto, el sufrimiento psiquiátrico sería el resultado de sumar las puntuaciones de intensidad sintomática y de discapacidad y dividir ambas por 2 (SP = [pG + pD] / 2, donde SP es el sufrimiento psiquiátrico, pG, los puntos de gravedad del trastorno, y pD, los puntos de discapacidad). En los agravamientos postraumáticos de enfermedades psíquicas preexistentes hay que obtener la diferencia de ambas puntuaciones, del periodo previo al posterior al trauma. La máxima puntuación en el sufrimiento psiquiátrico es de 100, por lo que tendremos que adaptarla a los intervalos que indica el baremo actual en cada uno de los síndromes referenciados, teniendo en cuenta las puntuaciones máximas y mínimas. Así, pB = pBm + (SP [pBM − pBm] / 100), donde pB son los puntos del baremo, SP, el sufrimiento psiquiátrico, pBM, la puntuación máxima del baremo aplicado al trastorno, y pBm, la puntuación mínima del baremo aplicada al trastorno. Limitaciones La presente propuesta ha sido establecida mediante una serie de expertos que han consensuado el procedimiento con otros profesionales. Este método lleva implícita la subjetividad de los implicados en su elaboración. Se requieren trabajos posteriores en que se evalúe la validez del procedimiento Además de a las entidades que han financiado este trabajo, mencionadas en el apartado anterior, queremos agradecer el apoyo científico y de facilitación ofrecido por la Fundación Española de Psiquiatría y Salud Mental y por el Consejo General del Poder Judicial. También a Antonia Rodríguez y Samuel Aidan Kelly, por su lectura crítica. Bibliografía 1. Instituto Nacional de Estadística. Anuario estadístico de España 2013. Seguridad y justicia. INE; 2013 [anuario] [consultado 25 Ene 2014]. Disponible en: http://www.ine.es/ prodyser/pubweb/anuario13/anu13 06justi.pdf 2. Dirección General de Tráfico. Anuario estadístico de accidentes 2012. Madrid: Dirección General de Tráfico; 2013 [anuario] [consultado 21 Ene 2014]. Disponible en: http://www.dgt.es/Galerias/seguridad-vial/estadisticas-eindicadores/publicaciones/anuario-estadistico-de-accidentes/ anuario estadistico018.pdf 3. Dionot T. Évaluation du dommage psychiatrique. EMC - Psychiatrie. 1998;9:1---10. Article 37-909-A-10. 4. Hernández C. Valoración médica del daño corporal. Barcelona: Masson; 1996. p. 1---3. 5. Winters NC, Collett BR, Myers KM. Ten-year review of rating scales, VII: Scales assessing functional impairment. J Am Acad Child Adolesc Psychiatry. 2005;44:309---38. 6. García-Blázquez Pérez M, García-Blázquez Pérez CM. Nuevo manual de valoración y baremación del daño corporal. Granada: Editorial Comares, S. L.; 2010. 7. Mélennec L. Valoración de las discapacidades y del daño corporal. Baremo internacional de invalideces. Barcelona: Elsevier Masson; 2011. 8. Organización Mundial de la Salud. Clasificacioń Internacional del Funcionamiento, de la Discapacidad y de la Salud: CIF. Madrid: Ministerio de Trabajo y Asuntos Sociales. Secretariá de Estado de 250 9. 10. 11. 12. 13. 14. 15. 16. CARTAS AL DIRECTOR Servicios Sociales, Familias y Discapacidad. Instituto de Mayoresy Servicios Sociales (IMSERSO); 2001. American Medical Association. Guías para la evaluación de las deficiencias permanentes. Madrid: Instituto Nacional de Servicios Sociales. Ministerio de Asuntos Sociales; 1997. p. 297---308. Boletín Oficial del Estado. Ley 34/2003, de 4 de noviembre, de modificación y adaptación a la normativa comunitaria de la legislación de seguros privados. BOE núm. 265 de 5 de noviembre de 2003. p. 39190-220. Boletín Oficial del Estado. Real Decreto Legislativo 8/2004, de 29 de octubre, por el que se aprueba el texto refundido de la Ley sobre responsabilidad civil y seguro en la circulacioń de vehićulos a motor. BOE nuḿ. 267 de 5 de noviembre de 2004. p. 36662-95. Organización Mundial de la Salud. CIE-10: Trastornos mentales y del comportamiento. Descripciones clínicas y pautas para el diagnóstico. Madrid: MEDITOR; 1992. American Psychiatric Association. DSM-IV: breviario. Criterios diagnósticos. Barcelona: Masson; 1995. Marín Fernández A. Justificación jurídica de un método de valoración para el sufrimiento psiquiátrico postraumático. En: Medina A, Moreno MJ, Lillo R, Guija JA, editores. Patología psiquiátrica postraumática: valoración psiquiátrica y judicial. Madrid: Fundación Española de Psiquiatría y Salud Mental; 2012. p. 57---97. Medina A, Moreno MJ, Lillo R, Guija JA. Patología psiquiátrica postraumática: valoración psiquiátrica y judicial. Madrid: Fundación Española de Psiquiatría y Salud Mental; 2012. Organización Mundial de la Salud. Informe mundial sobre la discapacidad [consultado 15 Ene 2014]. Disponible en: http://www.who.int/disabilities/world report/2011/report/ en/index.html Necesidad de mejora en la gestión estadística y proceso de comunicación de los casos de suicidio identificados The necessity of Improvement Statistical Management and Communication of identified suicides Sr. Director: Se han publicado recientemente dos cartas1,2 sobre el artículo que elaboramos y se publicó en su revista3 , queríamos aclarar una serie de aspectos a los que alude. Lo primero que queremos expresar es que las discrepancias encontradas no indican que los suicidios diagnosticados en los Institutos de Medicina Legal (IML) sean poco fiables, en ningún caso ponemos esa labor en tela de juicio. Otra cuestión es la gestión de los datos en los distintos IML. Nos consta la profesionalidad de los forenses y entendemos las dificultades médicas para llegar a un diagnóstico, y más en España, donde no se contempla el registro de la muerte como indeterminada. Lo que sí queremos resaltar es que la dificultad de conocer la magnitud del problema del suicidio debería ser la propia del diagnóstico de suicidio, como 17. Boletín Oficial del Estado. Real Decreto 1971/1999, de 23 de diciembre, de procedimiento para el reconocimiento, declaración y calificación del grado de minusvalía. BOE núm. 22, de 26 de enero de 2000. p. 3317-410. 18. Boletín Oficial del Estado. Corrección de errores del Real Decreto 1971/1999, de 23 de diciembre, de procedimiento para el reconocimiento, declaración y calificación del grado de minusvalía. BOE núm. 62 de 13 de marzo de 2000. p. 10297-304. Julio A. Guija a,b,∗ , Antonio Medina c , Lucas Giner b , Carlos Lledó d , Antonio Marín e , Juan José Arechederra f y José Giner b a Instituto de Medicina Legal de Sevilla, Consejería de Justicia e Interior, Junta de Andalucía, Sevilla, España b Departamento de Psiquiatría, Facultad de Medicina, Universidad de Sevilla, Sevilla, España c Departamento de Psiquiatría, Facultad de Medicina, Universidad de Córdoba, Córdoba, España d Audiencia Provincial de Sevilla, Sección cuarta, Sevilla, España e Audiencia Provincial de Cádiz, Sección segunda, Cádiz, España f Instituto de Investigaciones Neuropsiquiátricas Dr. López Ibor, Madrid, España ∗ Autor para correspondencia. Correo electrónico: [email protected] (J.A. Guija). http://dx.doi.org/10.1016/j.rpsm.2015.03.002 indicaba Farmer4 y en la que se prima una mayor especificidad a pesar de sacrificar algo de sensibilidad. Resulta que a esa dificultad intrínseca del diagnóstico se añaden problemas burocráticos, de comunicación y gestión. En ambas cartas1,2 se señalan varias opciones, no excluyentes, para explicar esta discrepancia. En primer lugar, indican el periodo de tiempo que transcurre entre la parte inicial del proceso (complejidad documental y de circuito, primeros resultados de la autopsia, la inscripción de la defunción en el registro civil y la formalización del documento estadístico) y la última, con el informe definitivo de autopsia. Hay casos en los que el diagnóstico etiológico no será definitivo hasta que así lo indique el médico forense. Por tanto, entendemos que es fundamental que exista una comunicación bidireccional entre los IML y el Instituto Nacional de Estadística (INE) con idea de que estos casos, e incluso otros en que se haya modificado la etiología de muerte, no queden registrados de forma definitiva y que puedan modificarse a petición del forense. Este proceso no implicaría un retraso en el acceso a los datos ofrecidos por el INE, que los presenta tras un periodo de 2 años5 . Este error se advierte y asume en la sección de limitaciones, donde se indica «que las cifras mayores por provincia y año sean de casos existentes». En segundo lugar, se señala que la información del INE sobre mortalidad viene recogida por lugar de residencia del fallecido. A este respecto, debemos advertir que el INE ofrece la opción de obtener las cifras de suicidio por CARTAS AL DIRECTOR provincia de defunción (opciones 8.4, 8.5 y 8.6)5 y fue la usada para el artículo original. Además de esto, se comenta que el incluir a los no residentes puede alterar la tasa de suicidio calculada. Sin embargo, las tasas de suicidio publicadas por el INE5 y por organismos oficiales de países de nuestro entorno, como Reino Unido6 , así como en estudios epidemiológicos españoles7 y extranjeros8 , incluyen los suicidios de no residentes en el numerador. Esto tiene sentido al querer identificar el problema en un lugar, tal y como ocurre en los accidentes de tráfico. Por otro lado, el trabajo que reseñan ----sobre cambios en la causa de muerte definitiva frente a la indicada inicialmente9 ---- viene a confirmar la necesidad de que el boletín estadístico de defunción con intervención judicial sea rellenado por el forense que realiza el informe de la autopsia, tal y como señalábamos como posible solución, ya que es el forense quien tiene «la capacidad y los conocimientos necesarios acerca de todo lo acontecido en la muerte de una persona» y se transmitirían «desde el origen (IML) al INE, a través del Juzgado de instrucción o directamente». En definitiva, el objeto del artículo era poner de manifiesto que las cifras oficiales del INE infravaloran la cifra real de suicidios y son estas cifras las que se usan habitualmente para comprobar la magnitud del problema. En teoría, el número de suicidios obtenido por el INE debía ser idéntico al de los IML al tratarse en ambos casos de los suicidios ocurridos en una provincia y tras un tiempo razonable para que se comuniquen los casos de forma definitiva. En cada año del periodo estudiado (2006-2010) se observó un mayor número de casos en los datos de los IML frente a los del INE en todos los años (específicamente: 233, 410, 349, 245 y 445 casos). Sin embargo, y al contrario de lo esperado, este mayor número de suicidios de los IML no estaba en todos los casos y en muchas provincias las diferencias eran abultadas. Por tanto, se trató de explicar esa situación e incluir los datos que podían resultar más fiables. Entendemos que la primera explicación, en la que muertes sin informe definitivo eran inscritas, podía explicar algunos casos. No obstante, pensamos que también puede influir en gran medida la gestión de los datos (no de la identificación de los forenses en ningún caso) por parte de los IML, dado que a pesar de haberles solicitado a todos las cifras del periodo estudiado, algunos no pudieron facilitarlas por no disponer de la misma. 251 Bibliografía 1. Gispert R, Gallo B, Barberia E, Puigdefabregas A, Ribas G, Medallo J. Comentarios sobre las diferencias en el número de muertes por suicidio en España. Rev Psiquiatr Salud Ment. 2014;7:208---9. 2. Xifro A, Suelves JM, Martin-Fumado C, Gomez-Duran EL. Suicidios y fuentes médico-forenses en España. Rev Psiquiatr Salud Ment. 2015;8:46---7. 3. Giner L, Guija JA. Número de suicidios en España: diferencias entre los datos del Instituto Nacional de Estadística y los aportados por los Institutos de Medicina Legal. Rev Psiquiatr Salud Ment. 2014;7:139---46. 4. Farmer RD. Assessing the epidemiology of suicide and parasuicide. Br J Psychiatry. 1988;153:16---20. 5. Instituto Nacional de Estadística. Defunciones según la causa de muerte 2012 [página web]. 2015 [consultado 4 Feb 2015].Disponible en: http://www.ine.es/jaxi/menu.do?type=pcaxis& path=/t15/p417/a2012/&file=pcaxis 6. Office for National Statistics. Suicides in the United Kingdom, 2012 Registrations [documento web]. 2014 [consultado 4 feb 2015]. Disponible en: http://www.ons.gov.uk/ons/ dcp171778 351100.pdf 7. Alvaro-Meca A, Kneib T, Gil-Prieto R, Gil de Miguel A. Epidemiology of suicide in Spain, 1981-2008: A spatiotemporal analysis. Public Health. 2013;127:380---5. 8. Abell WD, James K, Bridgelal-Nagassar R, Holder-Nevins D, Eldemire H, Thompson E, et al. The epidemiology of suicide in Jamaica 2002-2010: Rates and patterns. West Indian Med J. 2012;61:509---15. 9. Puigdefàbregas A, Freitas A, Molina P, Gibert A, Zaragoza S, Ribas G, et al. Estadístiques de mortalitat a Catalunya i l’Estat español. Impacte del canvi de documents i circuits per comunicar les defuncions. Butlletí Epidemiológic de Catalunya. 2013;34:1---6. Lucas Giner a,∗ y Julio A. Guija a,b a Departamento de Psiquiatría, Facultad de Medicina, Universidad de Sevilla, Sevilla, España b Instituto de Medicina Legal de Sevilla, Consejería de Justicia de Andalucía, Departamento de Psiquiatría, Facultad de Medicina, Universidad de Sevilla, Sevilla, España ∗ Autor para correspondencia. Correo electrónico: [email protected] (L. Giner). http://dx.doi.org/10.1016/j.rpsm.2015.02.001 Rev Psiquiatr Salud Ment (Barc.) 2015;8(4):252 www.elsevier.es/saludmental AGENDA 2015 XI Encuentros Jurídico Psiquiátricos – Documentos Córdoba: “Impulsividad y Trastorno del control de los impulsos: Aspectos jurídicos y psiquiátricos”. 33rd Congreso Brasileiro de Psiquiatría Florianopolis, Brasil, 4–7 noviembre http://www.cbpabp.org.br/hotsite/ Córdoba, 2–3 de octubre IASR/AFSP International Summit on Suicide Research. Nueva York, 11–14 de octubre http://suicideresearchsummit.org/ APSA Asociación de Psiquiatras Argentinos. 22–25 de octubre http://www.apsa.org.ar/ DGPPN (La Asociación Alemana de Psiquiatría, Psicoterapia y Psicosomática) Congreso. Berlín, 25–28 de noviembre http://www.dgppn.de/english- versión%20/%20congress2015.html 16ª Escuela de Otoño de Socidrogalcohol. 15th International Forum on Mood and Anxiety Disorders (IFMAD 2015). Madrid, 5–7 de noviembre http://www.socidrogalcohol.org/ Praga, 2–4 de diciembre http://www.ifmad.org/2015/ doi:10.1016/j.rpsm.2015.10.001 1. NOMBRE DEL MEDICAMENTO. Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada inyectable. Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada inyec‑ table. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada vial contiene 300 mg de aripiprazol (Abilify Maintena 300 mg) o 400 mg de aripiprazol (Abilify Maintena 400 mg). Después de reconstituir, cada ml de suspensión contiene 200 mg de aripiprazol. Para consultar la lista completa de excipientes, ver sección 6.1. 3. FORMA FARMACÉUTICA. Polvo y disolvente para suspensión de liberación prolongada inyectable. Polvo: blanco a blanquecino. Disolvente: solución transparente. 4. DATOS CLÍNICOS. 4.1 Indicaciones terapéuticas. Abilify Maintena está indicado para el tratamiento de mantenimiento de la esquizofrenia en pacientes adultos estabilizados con aripipra‑ zol oral. 4.2 Posología y forma de administración. Posología. En pacientes que nunca han tomado aripiprazol, se debe comprobar la tolerabilidad con aripiprazol oral antes de iniciar el tratamiento con Abilify Maintena. La dosis inicial y de mantenimiento recomendada de Abilify Maintena es de 400 mg. No es necesario el ajuste de la dosis de este medicamento. Abilify Maintena se debe administrar una vez al mes como inyección única (no antes de 26 días después de la inyección previa). Después de la primera inyección, se debe continuar el tratamiento con 10 a 20 mg de aripiprazol oral durante 14 días consecutivos para mantener las concentraciones terapéuticas de aripiprazol durante el inicio del tratamiento. Si se presentan reacciones adversas con la dosis de 400 mg una vez al mes, se debe considerar una reducción de dosis a 300 mg. Dosis omitidas. Si la 2a o 3 a dosis es omitida y el período desde la última inyección es > 4 semanas y < 5 semanas: Se debe administrar la inyección lo antes posible y luego retomar el programa mensual de inyecciones. Si la 2a o 3 a dosis es omitida y el período desde la última inyección es > 5 semanas: Se debe recomenzar aripiprazol oral concomitante durante 14 días con la siguiente inyección administrada y luego reiniciar el programa de inyecciones mensuales. Si la 4a dosis o las siguientes son omitidas (ej. después de lograr un estado estacionario) y el período desde de la última inyección es > 4 semanas y < 6 semanas: La inyección debe administrarse lo antes posible y luego reiniciar el programa de inyecciones mensuales. Si la 4a dosis o las siguientes son omitidas (ej. después de lograr un estado estacionario) y el período desde de la última inyección es > 6 semanas: Se debe reiniciar el aripiprazol oral concomitantemente durante 14 días, con la siguiente inyección y, posteriormente, reanudar el tratamiento de inyecciones mensuales. Poblaciones especiales. Pacientes de edad avanzada. No se ha establecido la seguridad y eficacia de Abilify Maintena para el tratamiento de la esquizofrenia en pacientes de 65 años de edad o mayores de 65 años (ver sección 4.4). Insuficiencia Renal. No es necesario ajustar la dosis en pacientes con insuficiencia renal (ver la sección 5.2). Insufi‑ ciencia hepática. No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. En pacientes que presentan insuficiencia hepática grave, los datos disponibles son insuficientes para establecer reco‑ mendaciones. En estos pacientes, que precisan una dosificación cuidadosa, es preferible utilizar la formulación oral (ver sección 5.2). Metabolizadores lentos de la CYP2D6 conocidos. En pacientes que se sabe que son metabo‑ lizadores lentos de la CYP2D6, la dosis de inicio y mantenimiento debe ser de 300 mg. Cuando se emplea concomitantemente con inhibidores potentes de la CYP3A4, debe reducirse la dosis a 200 mg (ver sección 4.5). Ajuste de la dosis por interacciones. Los ajustes de dosis deben hacerse en pacientes que estén tomando concomitantemente inhibidores potentes de la CYP3A4 o inhibidores potentes de la CYP2D6 durante más de 14 días. Si el in‑ hibidor de la CYP3A4 o la CYP2D6 se suspende, es posible que la dosis deba ser aumentada a la dosis anterior (ver sección 4.5). Si se producen reacciones adversas a pesar del ajuste de la dosis de Abilify Maintena, se debe reconsiderar la necesidad de utilizar inhibidores de la CYP2D6 o la CYP3A4. Se debe evitar el empleo de inductores de la CYP3A4 al mismo tiempo que Abilify Maintena durante más de 14 días, porque los niveles sanguíneos de aripiprazol están disminuidos y pueden estar por debajo del nivel en que son efectivos (ver sección 4.5). Ajuste de la dosis de Abilify Maintena en pacientes en tratamiento concomitante con inhibidores potentes de la CYP2D6, inhibidores potentes de la CYP3A4 y/o inductores de la CYP3A4 durante más de 14 días. Pacientes en tratamiento con 400 mg de Abilify Maintena. Inhibidores potentes de la CYP2D6 o de la CYP3A4: Dosis ajustada 300 mg. Inhibidores potentes de la CYP2D6 y de la CYP3A4: Dosis ajustada 200 mg. Inductores de la CYP3A4: Evite su empleo. Pacientes en tratamiento con 300 mg de Abilify Maintena. Inhibidores potentes de la CYP2D6 o de la CYP3A4: Dosis ajustada 200 mg. Inhibidores potentes de la CYP2D6 y de la CYP3A4: Dosis ajustada 160 mg. Inductores de la CYP3A4: Evite su empleo. Población pediátrica. No se ha establecido la seguridad y la eficacia de Abilify Maintena en niños y adolescentes entre 0‑17 años de edad. No se dispone de datos. Forma de administración. Abilify Maintena está destinado para ser administrado únicamente por vía intramuscular, no por vía intravenosa ni subcutánea. Debe ser administrado por un profesional sanitario. La suspensión se debe inyectar inmediatamente después de ser reconstituida, pero puede conservarse en el vial a una temperatura inferior a 25 °C durante 4 horas. La suspensión debe inyectarse lentamente en el glúteo o el deltoides, en una única administración (la dosis no debe dividirse). Se debe tener cuidado y evitar inyectarla por error en un vaso sanguíneo. Se deben rotar los lugares de inyección entre ambos glúteos o deltoides. La aguja recomendada para la administración en el glúteo es de 38 mm (1,5 pulgadas), aguja hipodérmica de seguridad de calibre 22. Para pacientes obesos (índice de masa corporal > 28 kg/m2) se debe emplear una aguja hipodérmica de seguridad de 50 mm (2 pulgadas) de calibre 21. La aguja recomendada para la administración en el deltoides es una aguja hipodérmica de seguridad de 25 mm (1 pulgada) de calibre 23. Para pacientes obesos se debe emplear una aguja hipodérmica de seguridad de 38 mm (1,5 pulgadas) de calibre 22 (ver sección 6.6). Los viales con el polvo y el disolvente son de un solo uso. Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6. 4.3 Contraindicaciones. Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sec‑ ción 6.1. 4.4 Advertencias y precauciones especiales de empleo. La mejoría clínica del paciente durante el tratamiento antipsicótico puede tardar desde varios días a algunas semanas. Los pacientes deben estar estre‑ chamente controlados durante este periodo. Tendencias suicidas. La aparición de comportamiento suicida es inherente a las enfermedades psicóticas y en algunos casos se han notificado al poco tiempo del inicio o el cambio de tratamiento antipsicótico, incluyendo el tratamiento con aripiprazol (ver sección 4.8). El tratamiento con antipsicóticos en pacientes de alto riesgo debe ir acompañado de una estrecha supervisión. Trastornos cardiovasculares. Abilify Maintena debe ser empleado con precaución en pacientes que presentan enfermedad cardiovascular conocida (antecedentes de infarto de miocardio o enfermedad isquémica cardiaca, fallo cardíaco, o anomalías de la conducción), enfermedad cerebrovascular, enfermedades que pueden predisponer a la hipotensión (deshidratación, hipovolemia, y tratamiento con medicamentos antihipertensivos) o a la hipertensión, incluyendo hipertensión acelerada o maligna. Se han notificado casos de tromboembolismo venoso (TEV) con medicamentos antipsicóticos. Dado que los pacientes tratados con antipsicóticos presentan a menudo factores de riesgo adquiridos para el TEV, se deben identificar todos los posibles factores de riesgo de TEV antes y durante el tratamiento con Abilify Maintena, así como tomar las correspondientes medidas preventivas (ver sección 4.8). Prolongación del intervalo QT. En estudios clínicos de tratamiento con aripiprazol oral, la incidencia de prolongación del intervalo QT fue comparable a placebo. Aripiprazol debe ser empleado con precaución en pacientes con antecedentes familiares de prolongación del intervalo QT (ver sección 4.8). Discinesia tardía. En ensayos clínicos de hasta un año de duración, se han notificado casos poco frecuentes de discinesia durante el tratamiento con aripiprazol. Si aparecen signos y síntomas de discinesia tardía en un paciente tratado con Abilify Maintena, se debe considerar una reducción de dosis o la interrupción del tratamiento (ver sección 4.8). Estos síntomas pueden empeorar temporalmente o in‑ cluso pueden manifestarse después de la interrupción del tratamiento. Síndrome Neuroléptico Maligno (SNM). El SNM es un complejo de síntomas potencialmente mortal asociado al tratamiento con fármacos antipsicóticos. En ensayos clínicos se han notificado casos raros de SNM durante el tratamiento con aripiprazol. Las manifestaciones clínicas del SNM son hipertermia, rigidez muscular, estado mental alterado y evidencia de inestabilidad autóno‑ ma (pulso o presión sanguínea irregular, taquicardia, diaforesis y disritmia cardíaca). Los signos adicionales pueden incluir una elevación de creatina fosfoquinasa, mioglobinuria (rabdomiólisis), e insuficiencia renal aguda. También se han notificado elevaciones de la creatina fosfoquinasa y rabdomiólisis no necesariamente asociadas con el SNM. Si un paciente desarrolla signos y síntomas indicativos de SNM, o presenta fiebre alta inexplicable sin manifestaciones clínicas adicionales de SNM, todos los medicamentos antipsicóticos, incluyendo aripiprazol, deben ser interrumpidos (ver sección 4.8). Convulsiones. En ensayos clínicos se han notificado casos poco frecuentes de convulsiones durante el tratamiento con aripiprazol. Por lo tanto, se debe emplear aripiprazol con precaución en pacientes epilépticos o con historia de convulsiones (ver sección 4.8). Pacientes de edad avanzada con psicosis relacionada con demencia. Aumento de mortalidad. En tres estudios controlados con placebo, con aripiprazol oral, en pacientes de edad avanzada con psicosis asociada a la enfermedad de Alzheimer (n = 938; media de edad: 82,4 años; rango: 56‑99 años), los pacientes tratados con aripiprazol tienen un mayor riesgo de muerte en comparación con placebo. La tasa de muerte en pacientes tratados con aripiprazol oral fue del 3,5% en comparación con el 1,7% en el grupo placebo. Aunque las causas de muerte fueron variadas, la mayoría de las muertes parecieron ser de origen cardiovascular (ej. insuficiencia cardiaca, muerte súbita) o infecciosa (ej. neumonía) (ver sec‑ ción 4.8). Reacciones adversas cerebrovasculares. En los mismos estudios con aripiprazol oral, se notificaron reacciones adversas cerebrovasculares (ej. ictus, crisis isquémica transitoria), incluyendo fallecimiento (media de edad: 84 años; rango: 78‑88 años). En total en estos estudios, en un 1,3% de los pacientes tratados con aripiprazol oral se notificaron reacciones cerebrovasculares adversas en comparación con el 0,6% de los pacientes tratados con placebo. Esta diferencia no fue estadísticamente significativa. Sin embargo, en uno de estos ensayos, un estudio a dosis fijas, hubo una relación dosis respuesta significativa para las reacciones adversas cerebrovasculares, en pacientes tratados con aripiprazol (ver sección 4.8). Abilify Maintena no está indicado para el tratamiento de pacientes con psicosis relacionada con demencia. Hiperglucemia y diabetes mellitus. En algunos casos se ha noti‑ ficado hiperglucemia extrema y asociada con cetoacidosis o coma hiperosmolar o muerte en pacientes tratados con medicamentos antipsicóticos atípicos, incluyendo aripiprazol. Entre los factores de riesgo que pueden predis‑ poner a los pacientes a padecer complicaciones graves se incluye la obesidad y los antecedentes familiares de diabetes. En los ensayos clínicos con aripiprazol, no hubo diferencias significativas en la tasa de incidencia de re‑ acciones adversas hiperglucémicas (incluyendo diabetes) o en los valores de glucemia alterados, en comparación con placebo. No se dispone de datos precisos del riesgo de reacciones adversas relacionadas con la hiperglucemia en pacientes tratados con aripiprazol y con otros medicamentos antipsicóticos atípicos, que permitan establecer comparaciones directas. Los pacientes tratados con medicamentos antipsicóticos, incluyendo ari‑ piprazol, deben ser observados para detectar posibles signos y síntomas de hiperglucemia (como polidipsia, poliuria, polifagia y debilidad), y los pacientes con diabetes mellitus o con factores de riesgo de diabetes mellitus deben ser controlados de forma regular, para detectar un posible empeoramiento del control de la glucosa (ver sección 4.8). Hipersensibilidad. Se pueden producir reacciones de hipersensibilidad con aripiprazol, caracterizadas por síntomas alérgicos. Aumento de peso. El aumento de peso se suele dar en pacientes esquizofrénicos en tratamiento con antipsicóticos que se sabe causan aumento de peso, comorbilidades, estilo de vida poco saludable, y puede conducir a complicaciones graves. El aumento de peso ha sido notificado después de la comercialización, en pacientes a los que se les ha prescrito aripiprazol oral. Cuando ha ocurrido, ha sido habitualmente en aquellos pacientes con factores de riesgo significativos como antecedentes de diabetes, alteraciones tiroideas o adenoma pituitario. En estudios clínicos no se ha observado que aripiprazol haya inducido un aumento de peso clínicamen‑ te significativo (ver sección 4.8). Disfagia. La dismotilidad esofágica y la aspiración se han asociado al uso de medicamentos antipsicóticos, incluyendo aripiprazol. El aripiprazol debe utilizarse con precaución en pacientes con riesgo de neumonía por aspiración. Adicción patológica al juego. Se han notificado informes postcomercialización de adicción patológica al juego en pacientes tratados con aripiprazol oral, independientemente de si estos pa‑ cientes tenían antecedentes previos de adicción al juego o no. El riesgo puede ser mayor en pacientes con antecedentes de adicción al juego y por este motivo deben ser controlados cuidadosamente (ver sección 4.8). 4.5 Interacción con otros medicamentos y otras formas de interacción. No se han realizado estudios de interacciones con Abilify Maintena. La siguiente información fue obtenida a partir de estudios con aripiprazol oral. Dado su antagonismo al receptor α1 adrenérgico, aripiprazol tiene la capacidad de aumentar el efecto de ciertos medicamentos antihipertensivos. Dados los efectos primarios del aripiprazol sobre el SNC, se debe tener precaución al administrar aripiprazol en combinación con alcohol u otros medicamentos del SNC con efectos adversos que se solapan, como la sedación (ver sección 4.8). Se debe tener precaución cuando se administre de forma concomi‑ tante aripiprazol con otros medicamentos que produzcan prolongación del intervalo QT o trastornos electrolíticos. Interacción de otros medicamentos con Abilify Maintena. Aripiprazol se metaboliza por múltiples vías, involucran‑ do las enzimas CYP2D6 y CYP3A4 pero no la enzima CYP1A. Por lo tanto, no es necesario un ajuste de dosis en fumadores. Quinidina y otros inhibidores potentes de la CYP2D6. En un estudio clínico de aripiprazol oral en suje‑ tos sanos, un inhibidor potente de la CYP2D6 (quinidina) aumentó el AUC en un 107%, mientras que no produjo cambios en la Cmax. El AUC y la Cmax del dehidroaripiprazol, el metabolito activo, disminuyeron en un 32% y 47%, respectivamente. Es esperable que otros inhibidores potentes de la CYP2D6, como la fluoxetina y la paroxetina, tengan efectos similares y por lo tanto se debe aplicar una reducción de dosis considerando dichas disminuciones (ver sección 4.2). Ketoconazol y otros inhibidores potentes de la CYP3A4. En un estudio clínico de aripiprazol oral en sujetos sanos, un inhibidor potente de la CYP3A4 (ketoconazol) elevó el AUC del aripiprazol y la Cmax en un 63% y 37%, respectivamente; y aumentó el AUC y la Cmax del dehidroaripiprazol en un 77% y 43%, respectivamente. En metabolizadores lentos de la CYP2D6, el empleo concomitante de inhibidores potentes de la CYP3A4 puede dar lugar a concentraciones plasmáticas más altas de aripiprazol, en comparación con los metabolizadores rápidos de la CYP2D6 (ver sección 4.2). Cuando se considere la administración concomitante de ketoconazol u otros inhibidores potentes de la CYP3A4 con aripiprazol, los posibles beneficios deberán ser mayores que los posibles riesgos para el paciente. Cabe esperar que otros inhibidores potentes de la CYP3A4, como itraconazol y los inhibidores de la proteasa VIH, tengan efectos similares y, por lo tanto, se debe aplicar una reducción de dosis acorde con los datos anteriores (ver sección 4.2). Cuando se interrumpe el inhibidor de la CYP2D6 o la CYP3A4, se debe aumentar la dosis de Abilify Maintena a la dosis previa al inicio del tratamiento concomitante. Cuando se emplean inhibidores débiles de la CYP3A4 (ej. diltiazem) o de la CYP2D6 (ej. escitalopram) de forma concomitante con este medicamento, es esperable que se produzcan pequeños aumentos de la concentración plasmática de aripiprazol. Carbamezapina y otros inductores de la CYP3A4. Después de la administración concomitante de car‑ bamezapina, un inductor potente de la CYP3A4, y aripiprazol oral, a pacientes con esquizofrenia o trastorno esquizoafectivo, las medias geométricas de la Cmax y el AUC para aripiprazol fueron un 68% y 73% más bajos respec‑ tivamente, en comparación con la administración de aripiprazol oral (30 mg) en monoterapia. Asimismo, las medias geométricas de la Cmax y el AUC para el dehidroaripiprazol, después de la administración concomitante de carbamazepina, fueron un 69% y 71% más bajos respectivamente, que los obtenidos después del tratamiento con aripiprazol oral en monoterapia. Cabe esperar que la administración concomitante de Abilify Maintena y otros inductores de la CYP3A4 (como rifampicina, rifabutina, fenitoína, fenobarbital, primidona, efavirenz, nevirapina y la hierba de San Juan) tengan efectos similares. Se debe evitar el empleo concomitante de inductores de la CYP3A4 con Abilify Maintena, debido a que los niveles de aripiprazol en sangre disminuyen y pueden caer por debajo de los niveles efectivos. Valproato y litio. La administración de valproato o litio de forma concomitante con aripiprazol, no produjo cambios clínicamente significativos en las concentraciones de aripiprazol, y por lo tanto no es necesario ajustar la dosis cuando se administra valproato o litio con Abilify Maintena. Interacción de Abilify Maintena con otros medicamentos. En estudios clínicos, dosis orales de 10‑30 mg/día de aripiprazol no tuvieron efectos significativos sobre el metabolismo de los sustratos de la CYP2D6 (índice dextrometorfano/3‑metoximorfinan) 2C9 (warfarina), 2C19 (omeprazol) y 3A4 (dextrometorfano). Además, aripiprazol y dehidroaripiprazol no parecen modificar el metabolismo mediado por la CYP1A2, según estudios in vitro. Por lo tanto, es poco probable que Abilify Maintena cause interacciones medicamentosas clínicamente importantes mediadas por estas enzimas. La administración de aripiprazol de forma concomitante con lamotrigina, dextrometorfano, warfarina, omeprazol, escitalo‑ pram o venlafaxina, no produjo cambios clínicamente significativos en la concentración de estos medicamentos. Por lo tanto, no es necesario ajustar la dosis de estos medicamentos cuando se administran concomitantemente con Abilify Maintena. Síndrome serotoninérgico. Se han notificado casos de síndrome serotoninérgico en pacientes en tratamiento con aripiprazol, se pueden producir signos y síntomas de esta alteración especialmente con el empleo concomitante con otros medicamentos serotoninérgicos, como ISRS/ISRN o con medicamentos que se sabe que aumentan la concentración de aripiprazol (ver sección 4.8). 4.6 Fertilidad, embarazo y lactancia. Embarazo. No hay estudios bien controlados y adecuados con aripiprazol en mujeres embarazadas. Aunque se han notificado anomalías congénitas, no se ha podido establecer una relación causal con aripiprazol. Los estudios realizados en animales, no pudieron excluir el potencial de toxicidad en el desarrollo (ver sección 5.3). Se aconseja a las pacientes notificar a sus médicos si están embarazadas o tienen intención de quedarse embarazadas durante el tratamiento con Abilify Maintena. Debido a la insuficiente información de seguridad en humanos y los problemas identificados en estudios de reproducción animal, este medicamento no debe utilizarse en el embarazo, a menos que el beneficio esperado justifique claramente el riesgo potencial para el feto. Los prescriptores deben ser conscientes de las propiedades de la acción prolongada de Abilify Maintena. Los recién nacidos expuestos a antipsicóticos (incluyendo aripiprazol) durante el tercer trimestre del embarazo, corren el riesgo de sufrir reacciones adversas entre las que se incluyen síntomas extrapiramidales y/o síndrome de abstinencia, que pueden variar en gravedad y duración después del nacimiento. Se han notificado casos de síntomas de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o trastornos alimentarios. Por lo tanto, los recién nacidos deben estar cuidadosamente controlados (ver sección 4.8). Lactancia. Aripiprazol se excreta en la leche materna. Se debe tomar la decisión de interrumpir la lactancia o de interrumpir/abstenerse del tratamiento con Abilify Maintena, teniendo en cuenta el beneficio de la lactancia para el niño y el beneficio del tratamiento para la mujer. Fertilidad. Aripiprazol no afectó a la fertilidad, según los datos de estudios de toxicidad reproductiva. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas. La influencia de Abilify Maintena sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada, debido a sus posibles efectos sobre el sistema ner‑ vioso o visual, como sedación, somnolencia, síncope, visión borrosa (ver sección 4.8). Por lo tanto, se debe aconsejar a los pacientes no conducir o manejar máquinas hasta que se conozca la susceptibilidad individual a este medicamento. 4.8 Reacciones adversas. Resumen del perfil de seguridad. Las reacciones adversas medicamentosas (RAM) observadas con mayor frecuencia, notificadas en ≥ 5% de los pacientes, en dos estudios clínicos controlados, doble ciego, con Abilify Maintena fueron: aumento de peso (9,0%), acatisia (7,9%), insomnio (5,8%) y dolor en el lugar de la inyección (5,1%). Tabla de reacciones adversas. La incidencia de reacciones adversas medicamentosas (RAM) asociadas con el tratamiento con aripiprazol aparecen en la tabla siguiente. Esta tabla está basada en acontecimientos adversos notificados durante los ensayos clínicos y/o la utilización postcomerciali‑ zación. Todas las RAM están incluidas según el sistema de clasificación de órganos, frecuencias: muy frecuentes (≥ 1/10), frecuentes (≥ 1/100 a <1/10), poco frecuentes (≥ 1/1.000 a < 1/100), raras (≥ 1/10.000 a < 1/1.000), muy raras (<1/10.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Dentro de cada grupo de frecuencias, las reacciones adversas se presentan en orden decreciente de gravedad. La frecuen‑ cia de las reacciones adversas notificadas durante el uso después de la comercialización no puede ser determinada ya que se derivan de notificaciones espontáneas. Por lo tanto, la frecuencia de estos efectos adversos se ca‑ lifica como “no conocida”. Trastornos de la sangre y del sistema linfático. Poco frecuentes: Neutropenia; Anemia; Trombocitopenia; Recuento disminuido de neutrófilos; Recuento disminuido de glóbulos blancos. Frecuencia no conocida: Leucopenia. Trastornos del sistema inmunológico. Poco frecuentes: Hipersensibilidad. Frecuencia no conocida: Reacción alérgica (ej. reacción anafiláctica, angioedema, incluyendo inflamación de la lengua, edema de la lengua, edema del rostro, prurito o urticaria). Trastornos endocrinos. Poco frecuentes: Prolactina disminuida en sangre. Frecuencia no conocida: Coma diabético hiperosmolar; Cetoacidosis diabética. Trastornos del metabolis‑ mo y de la nutrición. Frecuentes: Peso aumentado; Diabetes mellitus; Peso disminuido. Poco frecuentes: Hiperglucemia; Hipercolesterolemia; Hiperinsulinemia; Hiperlipidemia; Hipertrigliceridemia; Trastorno del apetito. Frecuen‑ cia no conocida: Anorexia; Hiponatremia. Trastornos psiquiátricos. Frecuentes: Agitación; Ansiedad; Inquietud; Insomnio. Poco frecuentes: Ideación suicida; Trastorno psicótico; Alucinación; Trastorno delirante; Hipersexualidad; Reacción de pánico; Depresión; Labilidad afectiva; Apatía; Disforia; Trastorno del sueño; Bruxismo; Libido disminuida; Alteración del humor. Frecuencia no conocida: Suicidio consumado; Intento de suicidio; Juego patológico; Nerviosismo. Trastornos del sistema nervioso. Frecuentes: Trastorno extrapiramidal; Acatisia; Temblor; Discinesia: Sedación; Somnolencia; Mareo; Cefalea. Poco frecuentes: Distonia; Discinesia tardía; Parkinsonismo; Trastorno del movimiento; Hiperactividad psicomotora; Síndrome de piernas inquietas; Rigidez en rueda dentada; Hipertonía; Bradicinesia; Babeo; Disgeusia; Parosmia. Frecuencia no conocida: Síndrome neuroléptico maligno; Convulsión del gran mal; Síndrome serotoninérgico; Trastornos del habla. Trastornos oculares. Poco frecuentes: Crisis oculogira; Visión borrosa, Dolor ocular. Trastornos cardíacos. Poco frecuentes: Extrasístoles ventriculares; Bradicardia; Taquicardia; Disminución de la amplitud de la onda T en el electrocardiograma; Electrocardiograma anormal; Inversión de la onda T del electrocardiograma. Frecuencia no conocida: Muerte súbita inexplicable; Parada cardiaca; Torsades de pointes; Arritmia ventricular; Prolongación del intervalo QT. Trastornos vasculares. Poco frecuentes: Hipertensión; Hipotensión ortostática; Presión arterial aumentada. Frecuencia no conocida: Síncope; Tromboembo‑ lismo venoso (incluyendo embolismo pulmonar y trombosis venosa profunda). Trastornos respiratorios, torácicos y mediastínicos. Poco frecuentes: Tos. Frecuencia no conocida: Espasmo orofaríngeo; Laringoespasmo; Neumonía por aspiración. Trastornos gastrointestinales. Frecuentes: Boca seca. Poco frecuentes: Enfermedad por reflujo gastroesofágico; Dispepsia; Vómitos; Diarrea; Náuseas; Dolor abdominal superior; Molestia abdominal; Estreñimien‑ to; Movimientos intestinales frecuentes; Hipersecreción salival. Frecuencia no conocida: Pancreatitis; Disfagia. Trastornos hepatobiliares. Poco frecuentes: Prueba anormal de función hepática; Enzimas hepáticos aumentados; Alanina aminotransferasa elevada; Gamma glutamil transferasa elevada; Bilirrubina elevada en sangre; Aspartato aminotransferasa elevada. Frecuencia no conocida: Insuficiencia hepática; Ictericia; Hepatitis; Fosfatasa alcalina elevada. Trastornos de la piel y del tejido subcutáneo. Poco frecuentes: Alopecia; Acné; Rosácea; Eczema; Induración de la piel. Frecuencia no conocida: Erupción; Reacción de fotosensibilidad; Hiperhidrosis. Trastornos muscu‑ loesqueléticos y del tejido conjuntivo. Frecuentes: Rigidez musculoesquelética. Poco frecuentes: Rigidez muscular; Espasmos musculares; Sacudidas musculares; Tirantez muscular; Mialgia; Dolor en una extremidad; Artralgia; Dolor de espalda; Limitación de la movilidad de la articulación; Rigidez de nuca; Trismo. Frecuencia no conocida: Rabdomiolisis. Trastornos renales y urinarios. Poco frecuentes: Nefrolitiasis; Glucosuria. Frecuencia no conocida: Retención urinaria; Incontinencia urinaria. Embarazo, puerperio y enfermedades perinatales. Frecuencia no conocida: Síndrome de abstinencia de fármacos en neonatos (ver sección 4.6). Trastornos del aparato reproductor y de la mama. Frecuentes: Disfunción eréctil. Poco frecuentes: Galactorrea; Ginecomastia; Dolor mamario a la palpación; Sequedad vulvovaginal. Frecuencia no conocida: Priapismo. Trastornos generales y alteraciones en el lugar de administración. Frecuentes: Dolor en la zona de inyección; Induración de la zona de inyección; Fatiga. Poco frecuentes: Pirexia; Astenia; Alteración de la marcha; Malestar torácico; Reacción en la zona de inyección; Eritema en la zona de inyección; Hinchazón en la zona de inyección; Molestia en la zona de inyección; Prurito en la zona de inyección; Sed; Lentitud de movimiento. Frecuencia no conocida: Alteración de la regulación de la temperatura (ej. hipotermia, pirexia); Dolor torácico; Edema periférico. Exploraciones complementarias. Frecuentes: Creatinfosfoquinasa en sangre elevada. Poco frecuentes: Glucosa elevada en sangre; Glucosa disminuida en sangre; Hemoglo‑ bina glicosilada aumentada; Perímetro abdominal aumentado; Colesterol disminuido en sangre; Triglicéridos disminuidos en sangre. Frecuencia no conocida: Fluctuación de la glucosa en sangre. Descripción de reacciones ad‑ versas seleccionadas. Reacciones en el lugar de la inyección. Durante las fases controladas de doble ciego de ambos estudios, se observaron reacciones en el lugar de la inyección; que en general fueron de gravedad leve a moderada y se resolvieron con el tiempo. El dolor en el lugar de la inyección (incidencia 5,1%) tiene una media de aparición en el día 2 después de la inyección y una mediana de duración de 4 días. En un estudio abierto que comparaba la biodisponibilidad de Abilify Maintena inyectado en el glúteo o el deltoides, las reacciones relacionadas con el lugar de la inyección fueron ligeramente más frecuentes en el deltoides. La mayoría fueron leves y mejoraron en las inyecciones posteriores. Cuando se compara con los estudios en los que Abilify Maintena se inyecta en el glúteo, la reaparición del dolor en el lugar de la inyección es más frecuente en el deltoides. Leucopenia. Se ha notificado neutropenia en los ensayos clínicos con Abilify Maintena que generalmente se inicia alrededor del día 16 después de la primera inyección, y dura una media de 18 días. Síntomas extrapiramidales (SEP). En estudios en pacientes estables con esquizofrenia, Abilify Maintena se asoció con una frecuencia más alta de SEP (18,4%) en comparación con el tratamiento oral con aripiprazol (11,7%). La acatisia fue el síntoma observado con mayor frecuencia (8,2%), generalmente se inicia alrededor del día 10 después de la primera inyección, y dura una mediana de 56 días. Los sujetos con acatisia se suelen tratar con medicamentos anticolinérgicos, principalmen‑ te mesilato de benzatropina y trihexifenidilo; y con menor frecuencia, con medicamentos como propranolol y benzodiacepinas (clonazepam y diazepam), para controlar la acatisia. El parkinsonismo fue el siguiente acontecimien‑ to observado con mayor frecuencia (6,9% en el grupo tratado con Abilify Maintena, 4,5% en el grupo tratado con comprimidos orales de 10‑30 mg de aripiprazol y 3,0% en el grupo placebo, respectivamente). Distonía. Efecto de clase: En individuos susceptibles y durante los primeros días del tratamiento pueden producirse síntomas de distonía, contracciones anormales prolongadas de los músculos. Entre los síntomas de distonía se incluyen: espas‑ mo de los músculos del cuello, progresando a veces a contracción de la garganta, dificultad para la deglución, dificultad para respirar, y/o protrusión de la lengua. Aunque estos síntomas pueden ocurrir a dosis bajas, ocurren con mayor frecuencia y son más graves, en los tratamientos con medicamentos antipsicóticos de primera generación de alta potencia, y a dosis más altas. Se ha observado un riesgo elevado de distonía aguda en los varones y en grupos de menor edad. Peso. Durante la fase doble ciego, con control activo del estudio de 38 semanas, la incidencia de aumento de peso ≥ 7% desde el inicio, hasta la última visita, fue del 9,5% en el grupo de Abilify Maintena y del 11,7% en el grupo tratado con comprimidos orales de 10‑30 mg de aripiprazol. La incidencia de pérdida de peso ≥ 7% desde el inicio hasta la última visita fue del 10,2% en el grupo de Abilify Maintena y del 4,5% en el grupo tratado con comprimidos orales de 10‑30 mg de aripiprazol. Durante la fase doble ciego, controlada con placebo, del estudio de 52 semanas, la incidencia de aumento de peso ≥ 7% desde el inicio hasta la última visita fue del 6,4% en el grupo de Abilify Maintena y del 5,2% en el grupo placebo. La incidencia de pérdida de peso ≥ 7% desde el inicio hasta la última visita fue del 6,4% en el grupo de Abilify Maintena y del 6,7% en el grupo placebo. Durante el tratamiento a doble ciego, el cambio medio en el peso corporal desde el inicio hasta la última visita fue de ‑0,2 kg en el grupo de Abilify Maintena y ‑0,4 kg en el grupo placebo (p = 0,812). Prolac‑ tina. En la fase doble ciego, con control activo, del estudio de 38 semanas, desde el inicio hasta la última visita, hubo una disminución media en los niveles de prolactina en el grupo de Abilify Maintena (‑0,33 ng/ml) comparado con una elevación media en el grupo tratado con comprimidos orales de 10‑30 mg de aripiprazol (0,79 n/ml; p < 0,01). La incidencia de pacientes tratados con Abilify Maintena, con niveles de prolactina > 1 vez el nivel tope del rango normal (ULN) en cualquier evaluación, fue del 5,4%; en comparación con el 3,5% de los pacientes tratados con comprimidos orales de 10‑30 mg de aripiprazol. Los pacientes,hombres en general, presentaron una incidencia más alta que las pacientes mujeres en cada grupo de tratamiento. En la fase de doble ciego controlado con placebo del estudio de 52 semanas, desde el inicio hasta la última visita, hubo una disminución media en los niveles de prolactina en el grupo con Abilify Maintena (‑0,38 ng/ml) en comparación con una elevación media en el grupo con placebo (1,67 ng/ml). La incidencia de los pacientes tratados con Abilify Maintena, con niveles de prolactina > 1 vez el nivel tope del rango normal (ULN), fue del 1,9%; en comparación con el 7,1% en los pacientes con placebo. Notificación de sospechas de reacciones adversas. Es importante notificar sospechas de re‑ acciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es. 4.9 Sobredosis. No se notificaron casos de reacciones adversas asociadas con sobredosis en estudios clínicos con Abilify Maintena. Se debe tener cuidado de no inyectar este medicamento por error en un vaso sanguíneo. Después de cualquier administración intravenosa involuntaria/accidental de una sobredosis confirmada o sospechada, es necesario un control estrecho del paciente y, si surge cualquier signo o síntoma potencialmente grave, es necesario realizar una monitorización que incluirá la realización de un electrocardiograma de forma continuada. La supervisión médica y la monitorización deben continuarse hasta que el paciente se recupere. Una simulación de descarga rápida demostró que la media esperada de la concentración de aripiprazol, alcanza un pico de 4500 ng/ml o aproximadamente 9 veces el rango terapéutico superior. En el caso de descarga rápida de la dosis, se espera que las concentraciones de aripiprazol disminuyan rápidamente al límite superior de la venta‑ na terapéutica, después de alrededor de 3 días. El día 7, la mediana de las concentraciones de aripiprazol disminuye aún más hasta alcanzar concentraciones similares a las que se alcanzan después de la administración de una dosis IM sin descarga rápida. Mientras las sobredosis son menos probables con medicamentos parenterales que con medicamentos orales, a continuación se muestra información relativa a sobredosis con aripiprazol oral. Signos y síntomas. En estudios clínicos y experiencias post comercialización, se identificaron sobredosis agudas accidentales o intencionadas con aripiprazol sólo, en pacientes adultos, y a dosis estimadas, según notificación, de hasta 1.260 mg (41 veces mayor que la dosis diaria más alta recomendada para aripiprazol) sin que se produjeran fallecimientos. Los signos y síntomas de potencial importancia clínica observados incluyeron: letargia, elevación de la presión sanguínea, somnolencia, taquicardia, náuseas, vómitos y diarrea. Además, se han recibido notificaciones de sobredosis accidental con aripiprazol sólo (hasta 195 mg) en niños, sin que se produjera ningún desenlace mortal. Los signos y síntomas médicos potencialmente graves notificados incluyeron: somnolencia, pérdida transitoria del conocimiento y síntomas extrapiramidales. Manejo de la sobredosis. El tratamiento de la sobredosis debe concentrarse en una terapia de soporte, manteniendo una vía aérea adecuada, oxigenación y ventilación, y tratamiento sintomático. Se debe considerar la posibilidad de que haya múltiples medicamentos implicados. A continua‑ ción, se debe empezar de forma inmediata la monitorización cardiovascular y realizar una monitorización electrocardiográfica contínua para detectar posibles arritmias. Después de una sobredosis con aripiprazol, sospechada o confirmada, se debe seguir una estrecha monitorización y supervisión médica hasta la recuperación del paciente. Hemodiálisis. Aunque no hay información sobre los efectos de la hemodiálisis para tratar una sobredosis de aripiprazol, es improbable que sea útil para dicho tratamiento, dado que aripiprazol presenta una amplia unión a proteínas plasmáticas. 5. PROPIEDADES FARMACOLÓGICAS. Ver Ficha Técnica completa. 6. DATOS FARMACÉUTICOS. 6.1 Lista de excipientes. Polvo. Carmelosa sódica. Manitol. Fosfato deshidrogenado de sodio monohidrato. Hidróxido de sodio. Disolvente. Agua para preparaciones inyectables. 6.2 Incompatibilidades. No pro‑ cede. 6.3 Periodo de validez. 3 años. Después de la reconstitución: Se ha demostrado estabilidad química y física durante 4 horas a 25 °C. Desde el punto de vista microbiológico, a menos que el método para abrir/reconsti‑ tuir descarte el riesgo de contaminación microbiana, el producto debe emplearse de inmediato. Si no se utiliza de inmediato, el tiempo y las condiciones de conservación para utilizarlo son responsabilidad del usuario. Agitar el vial vigorosamente durante al menos 60 segundos para garantizar la resuspensión antes de la inyección. No conserve la suspensión reconstituida en la jeringa. 6.4 Precauciones especiales de conservación. No congelar. Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3. 6.5 Naturaleza y contenido del envase. Polvo 300 mg (Abilify Maintena 300 mg) o 400 mg (Abilify Maintena 400 mg):. Vial de vidrio tipo I, con tapón de caucho laminado y sellado con una tapa de aluminio tipo “flip‑off”. Disolvente:. Vial de 2 ml de vidrio tipo I con tapón de caucho laminado y sellado con una tapa de aluminio tipo “flip‑off”. Envase indi‑ vidual. Cada envase individual contiene un vial con polvo, un vial de 2 ml con disolvente, una jeringa de 3 ml con luer‑lock con una aguja hipodérmica de seguridad ya colocada, de 38 mm (1,5 pulgadas), calibre 21, con un dispositivo de protección de la aguja, una jeringa desechable de 3 ml con punta luer‑lock, un adaptador de vial, y tres agujas hipodérmicas de seguridad: una de 25 mm (1 pulgada) y calibre 23, una de 38 mm (1,5 pulgadas) y calibre 22, y una de 50 mm (2 pulgadas) y calibre 21. Envase múltiple. Lote de 3 envases individuales. Puede que solamente estén comercializados algunos tamaños de envases. 6.6 Precauciones especiales de eliminación y otras manipulaciones. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local. Paso 1: Preparación antes de reconstituir el polvo. Saque todos los componentes del envase y confirme que están todos los que se indican en la siguiente lista: ‑ Prospecto de Abilify Maintena e instrucciones para profesionales sanitarios. ‑ Vial con polvo. ‑ Vial con 2 ml de disolvente. Importante: el vial con el disolvente contiene una cantidad adicional de disolvente. ‑ Una jeringa luer‑lock de 3 ml con aguja hipodérmica de seguridad de 38 mm (1,5 pulgadas) calibre 21, ya colocada, con un dispositivo de protección para la aguja. ‑ Una jeringa desechable con punta luer‑lock de 3 ml. ‑ Un adaptador del vial. ‑ Una aguja hipodérmica de seguridad de 25 mm (1 pulgada) calibre 23 con dispositivo de protección para la aguja. ‑ Una aguja hipodérmica de seguridad de 38 mm (1,5 pulgadas) calibre 22 con dispositivo de protección para la aguja. ‑ Una aguja hipodérmica de seguridad de 50 mm (2 pulgadas) calibre 21 con dispositivo de pro‑ tección para la aguja. ‑ Instrucciones para la aguja y la jeringa. Paso 2: Reconstitución del polvo. a) Quite la tapa del vial con polvo y la del vial con disolvente y limpie el tapón de ambos viales con un hisopo estéril impregnado en alcohol. b) Utilizando la jeringa con la aguja ya colocada, extraiga el volumen de disolvente predeterminado del vial correspondiente, volcando el disolvente hacia la jeringa. Vial de 300 mg (Abilify Maintena 300 mg): Añada 1,5 ml de disolvente para reconstituir el polvo. Vial de 400 mg (Abilify Maintena 400 mg): Añada 1,9 ml de disolvente para reconstituir el polvo. Quedará una pequeña cantidad de disolvente residual en el vial después de la ex‑ tracción. Cualquier exceso debe ser eliminado. c) Inyecte lentamente el disolvente en el vial que contiene el polvo. d) Saque el aire para igualar la presión en el vial tirando del émbolo levemente hacia atrás. e) Posteriormente, saque la jeringa del vial. Proceda a encajar el dispositivo de seguridad de la aguja utilizando la técnica de una mano. Presione suavemente la funda contra una superficie plana hasta que la aguja quede encajada firmemente en la funda de protección de la aguja. Compruebe visualmente que la aguja ha encajado perfectamente en la funda de protección de la aguja y deseche la jeringa. f) Agite el vial vigorosamente durante 30 segundos hasta que la suspensión se vea uniforme. g) Inspeccione visualmente la suspensión reconstituida por si hubiera partículas y decoloración antes de la administración. El medicamento reconstituido es una suspensión líquida de color blanco o blanquecino. No utilice la suspensión reconstituida si contiene partículas o presenta decoloración. h) Si no se administra la inyección inmediatamente después de la reconstitución, puede mantener el vial hasta 4 horas a una temperatura inferior a 25 °C y agitarlo vigorosamente, durante al menos 60 segundos, para garantizar la resuspensión antes de inyectarla. i) No conserve la suspensión reconstituida en la jeringa. Paso 3: Preparación antes de la inyección. a) Retire la cubierta del envase protector del adaptador del vial, pero no extraiga el adaptador del vial del envase protector. b) Sujete el envase protector del adaptador del vial, y fije la jeringa luer‑lock insertándola en el adaptador del vial y girándola a continuación. c) Emplee la jeringa luer‑lock para extraer el adaptador del vial del envase protector y deseche el envase protector del adaptador del vial. No toque la punta del adaptador del vial en ningún momento. d) Determine el volumen recomendado para la inyección. Abilify Maintena vial de 300 mg (Dosis/ Volumen a inyectar): 300 mg/ 1,5 ml; 200 mg/1,0 ml; 160 mg/ 0,8 ml. Abilify Maintena vial de 400 mg (Dosis/ Volumen a inyectar): 400 mg/ 2,0 ml; 300 mg/1,5 ml; 200 mg/1,0 ml; 160 mg/0,8 ml. e) Limpie la tapa del vial con la suspensión reconstituida con un hisopo estéril impregnado en alcohol. f) Coloque y sujete el vial con la suspensión reconstituida sobre una superficie dura. Encaje el adaptador del vial sujetando la parte externa del adaptador del vial y empujando la punta del adaptador del vial firmemente, a través del tapón de caucho, hasta que encaje en su lugar. g) Extraiga lentamente el volumen recomendado del vial con la jeringa luer‑lock para poder inyectarlo. En el vial quedará una pequeña cantidad, un exceso de la suspensión. Paso 4: Procedimiento de inyección. a) Saque la jeringa luer‑lock que contiene el volumen recomendado de la suspensión reconstituida de Abilify Maintena del vial. b) Seleccione una de las agujas hipodérmicas de seguridad descritas a continuación, en función del lugar de inyección y del peso del paciente, y una la aguja hipodérmica a la jeringa luer‑lock que contiene la suspensión para inyectar. Asegúrese de que la aguja hipodérmica está firmemente unida al dispositivo protector de la aguja, presionando y girando en el sentido de las agujas del reloj, luego retire la cubierta de la aguja inmediatamente. Tipo morfológico: No obesos. Lugar de la inyección: Deltoides. Tamaño de la aguja: 25 mm (1 pulgada) calibre 23. Lugar de la inyección: Glúteo. Tamaño de la aguja: 38 mm (1,5 pulgadas) calibre 22. Tipo morfológico: Obesos. Lugar de la inyección: Deltoides. Tamaño de la aguja: 38 mm (1,5 pulgadas) calibre 22. Lugar de la inyección: Glúteo. Tamaño de la aguja: 50 mm (2 pulgadas) calibre 21. c) Inyecte lentamente el volumen recomendado mediante una inyección intramuscular de una única dosis en el glúteo o el deltoides. No masa‑ jee el sitio de la inyección. Se debe tener cuidado y evitar inyectarla por error en un vaso sanguíneo. No inyecte en zonas con signos de inflamación, piel dañada, hinchazón y/o hematomas. Sólo para inyección profunda en el glúteo o el deltoides. Recuerde rotar los sitios de inyección en ambos glúteos. Busque signos o síntomas de administración intravenosa involuntaria. Paso 5: Procedimientos después de la inyección. a) Encaje el dispositivo de seguridad de la aguja como se describe en el Paso 2 e). Deseche los viales, adaptador, agujas y jeringa, de forma adecuada, después de la inyección. Los viales con polvo y disolvente son para un solo uso. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN. Otsuka Pharmaceutical Europe Ltd. Gallions, Wexham Springs, Framewood Road,. Wexham, SL3 6PJ ‑ Reino Unido. 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN. Abilify Maintena vial de 300 mg: EU/1/13/882/001; EU/1/13/882/003. Abilify Maintena vial de 400 mg: EU/1/13/882/002; EU/1/13/882/004. 9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN. Fecha de la primera autorización: 15/noviembre/2013. 10. FECHA DE LA REVISIÓN DEL TEXTO. 04/2015. 11. CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN. Medicamento sujeto a prescripción médica. 12. CONDICIONES DE PRESTACIÓN DEL SISTEMA NACIONAL DE SALUD. Reembolsable por el Sistema Nacional de Salud. Medicamento de aportación reducida. 13. PRESENTACIONES Y PVP. Abilify Maintena 300 mg polvo y disolvente para suspensión de liberación prolongada 1 vial + 1 vial de disolvente PVP IVA 315,49 €. Abilify Maintena 400 mg polvo y disolvente para suspensión de liberación prolongada 1 vial + 1 vial de disolvente PVP IVA 315,49 €. La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu. La forma más rápida de enviar sus artículos a Revista de Psiquiatría y Salud Mental Con EES los autores pueden ISSN: 1888-9891 REVISTA DE PSIQUIATRÍA Y SALUD MENTAL Revista de Psiquiatría y Salud Mental Órgano Oficial de la Sociedad Española de Psiquiatría y de la Sociedad Española de Psiquiatría Biológica Volumen 8, Número 2. Dignificando una terapia electroconvulsiva basada en la evidencia ORIGINALES Los costos y consumo de recursos sanitarios asociados a episodios maníacos en la práctica clínica diaria: el estudio MANACOR Desarrollo profesional en investigación traslacional en neurociencias y salud mental: educación y formación dentro del Centro de Investigación Biomédica en Red en Salud Mental Utilidad clínica e implicaciones económicas de la terapia electroconvulsiva de continuación/mantenimiento en un hospital público del Sistema Nacional de Salud español: serie de casos Eficacia de un programa de intervención familiar en la prevención de hospitalización en pacientes esquizofrénicos. Un estudio multicéntrico, controlado y aleatorizado en España Ver cha técnica en página 2 Abril-Junio 2015 EDITORIAL ORIGINAL BREVE ψ Variables reproductivas y uso de consulta ginecológica en pacientes con trastorno delirante ARTÍCULO ESPECIAL ABRIL-JUNIO 2015 - VOLUMEN 8 - NUMERO 2 Efectos de los inductores antiepilépticos en la neuropsicofarmacología: una cuestión ignorada. Parte I: Resumen para los clínicos de la situación actual AGENDA Factor de impacto 2013: 1.044 www.elsevier.es/saludmental 1 Indexada en Index Medicus/Medline, SSCI/JCR (Social Science Citation Index / Journal of Citation Reports) Envíe y controle el estado de sus manuscritos a través de Internet con Elsevier Editorial System (EES). 3 Fiable y Eficaz Enviar sus manuscritos online, desde cualquier lugar del mundo, las 24 horas. Seguir su progreso durante la revisión por pares, hasta la aceptación y posterior publicación. Realizar modificaciones, gestionar las diferentes versiones de los manuscritos y recibir comunicados de los editores. Los revisores y los editores ganan en agilidad 1 En la revisión y seguimiento online de los manuscritos. 2 En el envío y la automatización de tareas. 3 En el acceso a las grandes bases de datos de investigación biomédica que facilitan su trabajo: Acceso directo a Medline + 30 días de acceso libre a Scopus y ScienceDirect al aceptar una invitación. Para enviar sus manuscritos a Revista de Psiquiatría y Salud Mental acceda a http://ees.elsevier.com/rpsm FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO. Nemea 200 mg comprimidos. Nemea puede producir agranulocitosis. Su uso debe limitarse a pacientes: • con esquizofrenia que no respondan o no toleren el tratamiento con antipsicóticos, o con psicosis en enfermedad de Parkinson cuando hayan fallado otros tratamientos (ver 4.1) • que inicialmente presenten valores normales de leucocitos (recuento leucocitario ≥3.500/mm3 (3,5x109/L), y recuento absoluto de neutrófilos, ≥2.000/ mm3 (2,0x109/L)), y • a los que se les pueda realizar regularmente recuentos leucocitarios y recuentos absolutos de neutrófilos como se indica a continuación: semanalmente durante las primeras 18 semanas de tratamiento y al menos una vez cada 4 semanas durante el tiempo que continúe el tratamiento. Los controles han de continuar durante todo el tratamiento y durante 4 semanas tras la interrupción completa del mismo. Los médicos prescriptores deben cumplir con todas las medidas de seguridad establecidas. En cada visita debe recordarse al paciente en tratamiento con Nemea que contacte con su médico de inmediato si empieza a desarrollar cualquier tipo de infección. Debe prestarse especial atención a síntomas de tipo gripal tales como fiebre o dolor de garganta y a cualquier evidencia de infección que pueda ser indicativa de neutropenia. Nemea debe dispensarse bajo estricto control médico de acuerdo con las recomendaciones oficiales. Miocarditis: El uso de Clozapina está asociado con un aumento del riesgo de miocarditis, que en casos raros ha tenido un desenlace fatal. El aumento del riesgo de miocarditis es mayor durante los 2 primeros meses de tratamiento. Raramente también se han comunicado casos fatales de cardiomiopatía. Debe sospecharse la aparición de miocarditis o cardiomiopatía en pacientes que experimentan taquicardia persistente en reposo, especialmente en los primeros dos meses de tratamiento y/o palpitaciones, arritmias, dolor torácico y otros signos y síntomas de insuficiencia cardíaca (p.ej., fatiga sin causa aparente, disnea, taquipnea) o síntomas similares a los de infarto de miocardio. Si se sospecha la aparición de miocarditis o cardiomiopatía, el tratamiento con Nemea debe interrumpirse rápidamente y remitir al paciente inmediatamente al cardiólogo. Los pacientes que presenten miocarditis o cardiomiopatía inducidas por Clozapina no deben ser reexpuestos al fármaco. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada comprimido de Nemea 200 mg contiene 200 mg de Clozapina. Excipientes: Cada comprimido de Nemea 200 mg contiene 259,52 mg de lactosa monohidrato. Para consultar la lista completa de excipientes, ver sección 6.1. 3. FORMA FARMACÉUTICA. Comprimido. Los comprimidos de Nemea 200 mg son comprimidos amarillos, ovalados, con marca “200” en un lado y ranura en el otro lado. 4. DATOS CLÍNICOS. 4.1 Indicaciones terapéuticas. Nemea está indicado en pacientes esquizofrénicos resistentes a tratamiento y en pacientes esquizofrénicos que presenten reacciones adversas neurológicas graves y no tratables con otros fármacos antipsicóticos, incluyendo los antipsicóticos atípicos. La resistencia al tratamiento se define como la ausencia de mejoría clínica satisfactoria a pesar de haber utilizado como mínimo dos tratamientos diferentes con antipsicóticos, incluyendo un antipsicótico atípico, a las dosis adecuadas y durante el tiempo adecuado. Nemea está también indicado en trastornos psicóticos que aparecen en el curso de la enfermedad de Parkinson, en los casos en los que haya fallado el tratamiento estándar. 4.2 Posología y forma de administración. La dosis debe ajustarse individualmente. Para cada paciente debe utilizarse la dosis mínima eficaz. Para dosis no factibles con esta presentación, existen otras presentaciones disponibles de este medicamento. El inicio del tratamiento con Nemea se restringirá a aquellos pacientes con recuento leucocitario ≥3.500/mm3 (3,5x109/L) y un recuento absoluto de neutrófilos ≥2.000/mm3 (2,0x109/L) dentro de los límites normales estandarizados. Deberá ajustarse la dosis en pacientes que reciban simultáneamente fármacos que presentan interacciones farmacodinámicas y farmacocinéticas con Nemea, tales como benzodiazepinas o inhibidores selectivos de la recaptación de serotonina (ver sección 4.5 Interacción con otros medicamentos y otras formas de interacción). Se recomiendan las dosis siguientes: Pacientes esquizofrénicos resistentes al tratamiento. Inicio del tratamiento. 12,5 mg una o dos veces el primer día, seguido de uno o dos comprimidos de 25 mg el segundo día. Si se tolera bien, la dosis diaria puede entonces aumentarse lentamente en incrementos de 25 mg a 50 mg con el fin de alcanzar una dosis de hasta 300 mg/día en 2 ó 3 semanas. A continuación, si es necesario, la dosis diaria puede aumentarse en incrementos de 50 mg a 100 mg cada media semana o preferiblemente a intervalos semanales. Uso en pacientes de edad avanzada. Se recomienda iniciar el tratamiento a una dosis particularmente baja (12,5 mg administrados en una sola toma el primer día) y restringir los posteriores incrementos de dosis a 25 mg/día. Uso en niños. No se ha establecido la seguridad ni la eficacia de Nemea en niños menores de 16 años. No debe utilizarse en este grupo de edad hasta que se disponga de más datos. Rango de dosis terapéutico. En la mayoría de los pacientes, puede esperarse eficacia antipsicótica con una dosis de 200 a 450 mg/día administrados en tomas divididas. La dosis total diaria puede ser fraccionada de forma no uniforme, administrándose la dosis mayor al acostarse. Para la dosis de mantenimiento, ver más adelante. Dosis máxima. Para obtener el beneficio terapéutico óptimo, algunos pacientes pueden necesitar dosis superiores; en estos casos son permisibles aumentos prudenciales (es decir, sin exceder los 100 mg) hasta una dosis máxima de 900 mg/día. Debe tenerse en cuenta que, a dosis superiores a 450 mg/día, aumenta la posibilidad de que aparezcan reacciones adversas (en particular convulsiones). Dosis de mantenimiento. Después de alcanzar el beneficio terapéutico máximo, muchos pacientes pueden mantenerse de modo efectivo con dosis inferiores. Por tanto, se recomienda un ajuste descendente cauteloso. El tratamiento deberá mantenerse como mínimo 6 meses. Si la dosis diaria no excede de 200 mg, puede ser factible una única administración por la noche. Finalización del tratamiento. En caso de haber decidido finalizar el tratamiento con Nemea, se recomienda una reducción gradual de la dosis durante un periodo de 1 a 2 semanas. Si es necesaria una interrupción brusca, se deberá vigilar estrechamente al paciente en relación a la aparición de reacciones por retirada (ver sección 4.4 Advertencias y Precauciones especiales de empleo). Reinicio del tratamiento. En pacientes en los que el intervalo desde la última dosis de Nemea exceda de 2 días, debe reiniciarse el tratamiento con 12,5 mg administrados una o dos veces el primer día. Si esta dosis es bien tolerada, es posible ajustar la dosis al nivel terapéutico más rápidamente que lo recomendado para el tratamiento inicial. Sin embargo, en aquellos pacientes que hubieran experimentado previamente un paro respiratorio o cardíaco con la dosificación inicial (ver sección 4.4 Advertencias y Precauciones especiales de empleo) pero que después fueron dosificados con éxito hasta una dosis terapéutica, el reajuste de dosis debe realizarse con extrema precaución. Cambio de un tratamiento antipsicótico previo a Nemea. En general, se recomienda que Nemea no se utilice en combinación con otros antipsicóticos. Cuando el tratamiento con Nemea va a instaurarse en un paciente que recibe terapia antipsicótica oral, se recomienda retirar primero este tratamiento mediante reducción progresiva de la dosis. Trastornos psicóticos que aparecen en el curso de la enfermedad de Parkinson, en los casos en los que haya fallado el tratamiento estándar. La dosis inicial no debe superar los 12,5 mg/día, tomados por la noche. Posteriormente, la dosis se aumentará en incrementos de 12,5 mg, con un máximo de dos incrementos a la semana hasta un máximo de 50 mg, dosis que no debe alcanzarse hasta el final de la segunda semana. La cantidad diaria total deberá tomarse en una única dosis, preferiblemente por la noche. La dosis media efectiva se encuentra entre 25 mg y 37,5 mg/día. En caso de que el tratamiento durante al menos una semana con una dosis de 50 mg no proporcionara una respuesta terapéutica satisfactoria, la dosis puede aumentarse con cuidado mediante incrementos de 12,5 mg/semana. La dosis de 50 mg/día sólo deberá sobrepasarse en casos excepcionales y nunca debe excederse la dosis máxima de 100 mg/día. Si aparece hipotensión ortostática, sedación intensa o confusión, deberán limitarse o retrasarse los aumentos de dosis. Durante las primeras semanas de tratamiento deberá controlarse la presión arterial. Cuando los síntomas psicóticos hayan desaparecido completamente durante al menos dos semanas, es posible aumentar la medicación antiparkinsoniana si así lo permite el estado motor del paciente. Si esto provoca la reaparición de los síntomas psicóticos, puede aumentarse la dosis de Nemea con incrementos de 12,5 mg/semana hasta un máximo de 100 mg/día tomados en una o dos dosis (ver arriba). Finalización del tratamiento: se recomienda una reducción gradual de la dosis, en fracciones de 12,5 mg durante un periodo de al menos una semana (preferiblemente dos semanas). El tratamiento ha de interrumpirse inmediatamente en caso de neutropenia o agranulocitosis, tal como se indica en la sección 4.4 (Advertencias y precauciones especiales de empleo). En este caso, es esencial un cuidadoso control psiquiátrico del paciente, ya que los síntomas pueden reaparecer rápidamente. 4.3 Contraindicaciones. • Hipersensibilidad al principio activo o a alguno de los excipientes. • Pacientes a los que no se les pueda realizar análisis sanguíneos periódicamente. •Antecedentes de granulocitopenia/agranulocitosis tóxica o idiosincrásica (con la excepción de granulocitopenia/agranulocitosis producida por quimioterapia previa). • Antecedentes de agranulocitosis inducida por Clozapina. • Función alterada de la médula ósea. • Epilepsia no controlada. • Psicosis alcohólica u otras psicosis tóxicas, intoxicación por fármacos, estados comatosos. • Colapso circulatorio y/o depresión del SNC de cualquier etiología. • Trastornos renales o cardíacos severos (p.ej., miocarditis). • Enfermedad hepática activa asociada a náuseas, anorexia o ictericia; enfermedad hepática progresiva, insuficiencia hepática. • Ileo paralítico. • El tratamiento con Nemea no deberá iniciarse concomitantemente con fármacos de los que se conoce que tienen potencial importante para causar agranulocitosis; debe evitarse el uso concomitante con antipsicóticos depot. 4.4 Advertencias y precauciones especiales de empleo. Nemea puede causar agranulocitosis. La incidencia de agranulocitosis y la tasa de mortalidad en aquellos pacientes que hayan desarrollado agranulocitosis han disminuido de forma clara desde la instauración de los recuentos leucocitarios y de los recuentos absolutos de neutrófilos. Las siguientes medidas de precaución son, por tanto, obligatorias y deberán realizarse de acuerdo con las AF_publi_ficha_tecnica.indd 1 recomendaciones oficiales. Debido a los riesgos asociados con Nemea, su uso está limitado a pacientes en los que el tratamiento esté indicado como se especifica en la sección 4.1 (Indicaciones terapéuticas) y: • que hayan tenido inicialmente un recuento de leucocitos normal (recuento leucocitario ≥3.500/mm3 (3,5x109/L) y un recuento absoluto de neutrófilos ≥2.000/mm3 (2,0x109/L)) y, • a los que se les pueda realizar regularmente recuentos leucocitarios y recuentos absolutos de neutrófilos semanalmente durante las primeras 18 semanas de tratamiento y como mínimo a intervalos de 4 semanas posteriormente. Los controles han de continuar durante todo el tratamiento con Clozapina y durante 4 semanas tras la interrupción completa del mismo. Antes de iniciar el tratamiento con Clozapina, debe realizarse un análisis de sangre (ver “agranulocitosis”), una historia clínica completa y un examen médico. Los pacientes con antecedentes de enfermedad cardíaca o en los que se detecten hallazgos cardíacos anormales durante el examen médico, deben ser remitidos a un especialista para que se le realicen otras exploraciones, entre ellas un ECG, y sólo se tratará al paciente si los beneficios esperados superan claramente los riesgos (ver sección 4.3 Contraindicaciones). El médico que instaure el tratamiento deberá valorar la realización de un ECG antes del tratamiento. Los médicos prescriptores deben cumplir con la totalidad de las medidas de seguridad establecidas. Antes de iniciar el tratamiento, el médico ha de asegurarse de que el paciente no ha experimentado previamente una reacción hematológica adversa a Clozapina que necesitara la interrupción del tratamiento. Las prescripciones no deben realizarse para periodos superiores al intervalo entre dos análisis de sangre. La interrupción inmediata del tratamiento con Nemea es obligada si el recuento leucocitario es menor de 3.000/mm3 (3,0x109/L) o el recuento absoluto de neutrófilos es menor de 1.500/mm3 (1,5x109/L) en cualquier momento durante el tratamiento con Nemea. Los pacientes a los que se les haya interrumpido el tratamiento con Nemea como resultado de alteraciones en el recuento leucocitario o en el recuento absoluto de neutrófilos, no deberán ser re-expuestos a Nemea. En cada consulta médica debe recordarse al paciente en tratamiento con Nemea que contacte con su médico de inmediato si empieza a desarrollar cualquier tipo de infección. Debe prestarse especial atención a síntomas de tipo gripal tales como fiebre o dolor de garganta, y a cualquier otra evidencia de infección que pueda ser indicativa de neutropenia. Los pacientes y sus cuidadores deberán ser informados de que en caso de que se produzcan estos síntomas, debe realizarse un análisis de sangre inmediatamente. Los prescriptores deberán mantener un registro de los resultados de estos análisis de los pacientes y tomar las medidas necesarias para evitar que en el futuro sean re-expuestos de forma inadvertida. Los pacientes con antecedentes de trastornos primarios de la médula ósea deberán ser tratados sólo si los beneficios superan los riesgos. Estos pacientes deben ser examinados exhaustivamente por un hematólogo antes de iniciar el tratamiento con Nemea. Se debe prestar especial atención a los pacientes que presentan recuentos leucocitarios bajos debido a neutropenia étnica benigna. El tratamiento con Nemea puede iniciarse sólo si la decisión es refrendada por el hematólogo. Control del recuento leucocitario y del recuento absoluto de neutrófilos. Antes de iniciar el tratamiento con Nemea, debe realizarse un recuento leucocitario y fórmula hemática diferencial en los 10 días previos, para asegurar que solamente reciban el fármaco los pacientes con recuento leucocitario normal y recuento absoluto de neutrófilos normal (recuento leucocitario ≥3.500/mm3 (3,5x109/L) y recuento absoluto de neutrófilos ≥2.000/ mm3 (2,0x109/L)). Después del inicio del tratamiento con Nemea, deben monitorizarse semanalmente el recuento leucocitario y el recuento absoluto de neutrófilos, durante las primeras 18 semanas, y a continuación, al menos a intervalos de 4 semanas. El control debe continuar durante todo el tratamiento y durante 4 semanas tras la interrupción completa de Nemea o hasta que se haya producido la recuperación hematológica (ver más adelante Recuento leucocitario o recuento absoluto de neutrófilos bajo). En cada consulta debe recordarse al paciente que contacte inmediatamente con el médico que le trata si empieza a desarrollar cualquier tipo de infección, fiebre, dolor de garganta u otros síntomas similares a los de la gripe. Deberá realizarse inmediatamente un recuento leucocitario y una fórmula hemática diferencial si se producen signos o síntomas de infección. Recuento leucocitario o recuento absoluto de neutrófilos bajos. Si durante el tratamiento con Nemea el recuento leucocitario disminuye a valores entre 3.500/mm3 (3,5x109/L) y 3.000/mm3 (3,0x109/L) o el recuento absoluto de neutrófilos disminuye entre 2.000/mm3 (2,0x109/L) y 1.500/mm3 (1,5x109/L), se realizarán controles hematológicos al menos dos veces a la semana hasta que el recuento leucocitario y el recuento absoluto de neutrófilos se normalicen al menos dentro del rango de 3.000-3.500/mm3 (3,0-3,5x109/L) y 1.500-2.000/mm3 (1,5-2,0x109/L), respectivamente, o más altos. Es obligada la interrupción inmediata del tratamiento con Nemea si el recuento leucocitario es inferior a 3.000/mm3 (3,0x109/L) o el recuento absoluto de neutrófilos es menor de 1.500/mm3 (1,5x109/L) durante el tratamiento. Se deberán realizar entonces diariamente recuentos leucocitarios y fórmulas hemáticas diferenciales, y los pacientes deberán ser estrechamente controlados en lo que se refiere a síntomas gripales u otros síntomas que pudieran ser indicativos de infección. Se recomienda la confirmación de estos valores realizando dos recuentos hemáticos en dos días consecutivos. Sin embargo, se interrumpirá el tratamiento con Nemea tras el primer recuento hemático. Tras la interrupción del tratamiento con Nemea, se requiere un control hematológico hasta que se produzca la normalización de los valores hemáticos. Tabla 1 Acción requerida Recuento hematológico Recuento leucocitario/mm3 (/L) Recuento absoluto de neutrófilos/ mm3 (/L) ≥3.500 (≥3,5x109) ≥2.000 (≥2,0x109) 3.000-3.500 (3,0x109-3,5x109) 1.500-2.000 (1,5x109 – 2,0x109) <3.000 (<3,0x109) <1.500 (<1,5x109) Continuar el tratamiento con Nemea. Continuar el tratamiento con Nemea, toma de análisis bisemanal hasta que el recuento se estabilice o aumente. Interrumpir inmediatamente el tratamiento con Nemea, análisis diario hasta que se resuelva la anormalidad hemática, controlar una posible infección. No reexponer al paciente. Si se ha suspendido el tratamiento con Nemea y se produce un descenso posterior del recuento leucocitario por debajo de 2.000/mm3 (2,0x109/L) o el recuento absoluto de neutrófilos desciende por debajo de 1.000/ mm3 (1,0x109/L), el manejo de esta incidencia debe ser supervisado por un hematólogo experimentado. Interrupción del tratamiento por razones hematológicas. Los pacientes a los que se les haya interrumpido el tratamiento con Nemea como resultado de alteraciones en el recuento leucocitario o en el recuento absoluto de neutrófilos (ver anterior) no deben ser reexpuestos a Nemea. Los prescriptores deberán mantener un registro de los resultados y tomar las medidas necesarias para evitar que estos pacientes sean re-expuestos en el futuro de forma inadvertida. Interrupción del tratamiento por otras razones. A los pacientes que hayan sido tratados con Nemea durante más de 18 semanas y que hayan interrumpido el tratamiento durante más de 3 días pero menos de 4 semanas, se les debe realizar un recuento leucocitario y un recuento absoluto de neutrófilos semanalmente durante 6 semanas adicionales. Si no se producen anormalidades hematológicas, deben reanudarse los controles a intervalos no superiores a 4 semanas. Si el tratamiento con Nemea se ha interrumpido durante 4 semanas o más, se requiere un control semanal durante las siguientes 18 semanas de tratamiento y debe reajustarse la dosis (ver sección 4.2 Posología y forma de administración). Otras precauciones. Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia), malabsorción de glucosa o galactosa no deben tomar este medicamento. En caso de que se produzca eosinofilia, se recomienda interrumpir el tratamiento con Nemea si el recuento de eosinófilos aumenta por encima de 3.000/mm3 (3,0x109/L); la terapia sólo debe reiniciarse si el recuento de eosinófilos disminuye por debajo de 1.000/mm3 (1,0x109 /L). En caso de que se produzca trombocitopenia, se recomienda interrumpir el tratamiento con Nemea si el recuento de plaquetas disminuye por debajo de 50.000/mm3 (50x109/L). Durante el tratamiento con Nemea puede presentarse hipotensión ortostática, con o sin síncope. Raramente, el colapso puede ser profundo y puede ir acompañado de paro cardíaco y/o respiratorio. Es más probable que estos sucesos ocurran con el uso concomitante de benzodiazepinas u otros fármacos antipsicóticos (ver sección 4.5 Interacción con otros medicamentos y otras formas de interacción), y durante el ajuste inicial asociado a una escalada rápida de la dosis; en ocasiones muy raras, puede ocurrir incluso tras la primera dosis. Por tanto, los pacientes que inician el tratamiento con Nemea precisan una estrecha supervisión médica. Es necesario el control de la presión sanguínea en bipedestación y posición supina durante las primeras semanas de tratamiento en pacientes con enfermedad de Parkinson. El análisis de las bases de datos de seguridad sugieren que el uso de Nemea está asociado con un aumento del riesgo de miocarditis, especialmente (pero no sólo) durante los dos primeros meses de tratamiento. Algunos casos de miocarditis han tenido desenlace mortal. También se han comunicado casos de pericarditis, efusión pericárdica y cardiomiopatía en asociación con el uso de Nemea, algunos de ellos con desenlace mortal. Debe sospecharse la presencia de miocarditis o cardiomiopatía en pacientes que desarrollen taquicardia persistente en reposo, especialmente en los dos primeros meses de tratamiento, y/o palpitaciones, arritmias, dolor torácico y otros signos y síntomas de insuficiencia cardíaca (p.ej., 16/01/13 16:46 fatiga sin causa aparente, disnea, taquipnea), o síntomas similares a los de infarto de miocardio. Otros síntomas que pueden presentarse además de los anteriores incluyen síntomas similares a la gripe. Si se sospecha la aparición de miocarditis o cardiomiopatía, el tratamiento con Nemea debe interrumpirse rápidamente y remitir al paciente inmediatamente al cardiólogo. Los pacientes con miocarditis o cardiomiopatía inducidas por Clozapina no deben ser re-expuestos a Nemea. Los pacientes con antecedentes de epilepsia deben ser estrechamente observados durante el tratamiento con Nemea, dado que se han encontrado casos de convulsiones relacionadas con la dosis. En tales casos, deberá reducirse la dosis (ver sección 4.2 Posología y forma de administración) y, si es necesario, deberá iniciarse un tratamiento anticonvulsivante. Los pacientes con trastornos hepáticos estables pre-existentes pueden ser tratados con Nemea, pero requieren controles regulares de la función hepática. Si durante el tratamiento con Nemea aparecen síntomas de una posible disfunción hepática, tales como náuseas, vómitos, y/o anorexia, deberán realizarse pruebas de función hepática. Si el aumento de los valores es clínicamente relevante (más de 3 veces el UNL) o si se aparecen síntomas de ictericia, se interrumpirá el tratamiento con Nemea. Podrá reanudarse el tratamiento (ver “Reinicio del tratamiento” en la sección 4.2) sólo si los resultados de las pruebas de función hepática son normales. En tales casos, la función hepática deberá controlarse estrechamente tras la reintroducción de Clozapina. Nemea posee actividad anticolinérgica, que puede producir diversos efectos indeseables. Se recomienda una supervisión cuidadosa si el paciente presenta hipertrofia de próstata o glaucoma de ángulo estrecho. Debido probablemente a sus propiedades anticolinérgicas, se ha asociado a Clozapina con diversos grados de alteraciones de la peristalsis intestinal, desde estreñimiento a obstrucción intestinal, compactación fecal e íleo paralítico (ver sección 4.8 Reacciones adversas). En raras ocasiones estos casos han tenido un desenlace mortal. Se requiere precaución especial en pacientes que reciban medicaciones concomitantes que puedan provocar estreñimiento (especialmente aquéllos con propiedades anticolinérgicas como algunos antipsicóticos, antidepresivos y tratamientos antiparkinsonianos), tengan antecedentes de enfermedad de colon o antecedentes de cirugía abdominal baja, ya que pueden exacerbar la situación. Es de vital importancia diagnosticar y tratar adecuadamente el estreñimiento. Durante el tratamiento con Nemea los pacientes pueden experimentar elevaciones de temperatura transitorias por encima de los 38 ºC con una mayor frecuencia durante las tres primeras semanas de tratamiento. Esta fiebre es generalmente benigna. En ocasiones, puede ir asociada con un aumento o descenso del recuento leucocitario. Los pacientes con fiebre deben ser evaluados minuciosamente para descartar la posibilidad de una infección subyacente o el desarrollo de agranulocitosis. En presencia de fiebre elevada debe considerarse la posibilidad de un síndrome neuroléptico maligno (SNM). Durante el tratamiento con Clozapina se ha comunicado, en raras ocasiones, una alteración de la tolerancia a la glucosa y/o desarrollo o exacerbación de una diabetes mellitus. No se ha determinado todavía el mecanismo para esta posible asociación. Muy raramente se han descrito casos de hiperglucemia grave con cetoacidosis o coma hiperosmolar en pacientes sin antecedentes previos de hiperglucemia, algunos de ellos con desenlace mortal. En la mayoría de los casos en los que se disponía de datos de seguimiento, la alteración de intolerancia a la glucosa se resolvió tras la interrupción del tratamiento, y la reinstauración del tratamiento con Clozapina provocó una recaída. Se deberá valorar la interrupción del tratamiento en pacientes en los que haya fallado el manejo médico activo de la hiperglucemia. Se han descrito casos de tromboembolismo venoso (VTE) tras el tratamiento con medicamentos antipsicóticos. Dado que los pacientes tratados con antipsicóticos presentan a menudo factores de riesgo para VTE adquiridos, deberían identificarse todos los posibles factores de riesgo para VTE antes y durante el tratamiento con Clozapina, y tomar medidas preventivas. Dado que Nemea puede estar asociado con tromboembolismo, debería evitarse la inmovilización del paciente. Tras el cese brusco del tratamiento con Clozapina, se han descrito reacciones agudas. Por ello, se recomienda una interrupción gradual del tratamiento. Si es necesaria una interrupción brusca (p.ej., debido a leucopenia), se deberá vigilar estrechamente al paciente en relación a la recurrencia de los síntomas psicóticos y de los síntomas relacionados con el efecto rebote de tipo colinérgico como sudoración excesiva, cefaleas, náuseas, vómitos y diarrea. Con algunos antipsicóticos atípicos, en ensayos clínicos randomizados controlados frente a placebo en población demente, se ha encontrado un incremento de aproximadamente tres veces del riesgo de episodios adversos cerebrovasculares. El mecanismo de este incremento de riesgo es desconocido. No se puede excluir un incremento de riesgo para otros antipsicóticos en otras poblaciones de pacientes. Clozapina debería ser utilizada con precaución en pacientes con factores de riesgo de infarto. El uso de Clozapina no ha sido estudiado en pacientes con demencia y, por tanto, no se recomienda su uso en esta población de pacientes. Como con otros antipsicóticos, debe aconsejarse precaución en pacientes con enfermedad cardiovascular conocida o antecedentes familiares de prolongación en el intervalo QT. Como con otros antipsicóticos, deben tomarse precauciones cuando se prescribe Clozapina con medicamentos que incrementan el intervalo QTc. Advertencias sobre excipientes: Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en cierta poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben tomar este medicamento. Uso en pacientes de edad avanzada. Se recomienda iniciar el tratamiento con una dosis baja (ver sección 4.2 Posología y forma de administración). Durante el tratamiento con Clozapina puede producirse hipotensión ortostática, y se han comunicado algunos casos de taquicardia en ocasiones continuada. Los pacientes de edad avanzada, particularmente aquéllos con función cardiovascular comprometida, pueden ser más susceptibles a estos efectos. Los pacientes de edad avanzada pueden ser también particularmente susceptibles a los efectos anticolinérgicos de Nemea, tales como retención urinaria y estreñimiento. 4.5 Interacción con otros medicamentos y otras formas de interacción. Contraindicaciones de uso concomitante. No deben utilizarse concomitantemente con Nemea fármacos con potencial importante para deprimir la función de la médula ósea (ver 4.3 Contraindicaciones). No deberían utilizarse concomitantemente con Nemea los fármacos antipsicóticos depot de larga duración (con potencial mielosupresor), ya que pueden no ser eliminados rápidamente del organismo en situaciones en las que pudiera ser necesario, p.ej., neutropenia (ver sección 4.3 Contraindicaciones). No debe tomarse alcohol concomitantemente con Nemea debido a la posible potenciación del efecto sedante. Precauciones que incluyen ajuste de dosis. Nemea puede aumentar los efectos centrales de los depresores del SNC tales como narcóticos, antihistamínicos y benzodiazepinas. Se aconseja especial precaución cuando se inicie el tratamiento con Nemea en pacientes que estén tomando una benzodiazepina o cualquier otro fármaco psicótropo. Estos pacientes pueden presentar un mayor riesgo de colapso circulatorio, que en raras ocasiones puede ser profundo y puede conducir a paro cardíaco y/o respiratorio. Se desconoce si el colapso cardíaco o circulatorio puede prevenirse mediante un ajuste de la dosis. Debido a la posibilidad de efectos aditivos, deberá tenerse precaución con la administración concomitante de fármacos con propiedades anticolinérgicas, hipotensoras o depresoras del sistema respiratorio. Debido a sus propiedades anti-α-adrenérgicas, Nemea puede reducir el efecto hipertensor de la norepinefrina u otros fármacos predominantemente α-adrenérgicos y revertir el efecto presor de la epinefrina. La administración concomitante de fármacos conocidos como inhibidores de la actividad de algunos de los isoenzimas del citocromo P450 puede aumentar los niveles plasmáticos de Clozapina, y puede ser necesario reducir la dosis de Clozapina para prevenir la aparición de efectos adversos. Esto es más importante para los inhibidores del CYP 1A2 como cafeína (ver más adelante) y los inhibidores selectivos de la recaptación de serotonina fluvoxamina y paroxetina (este último más controvertido). Algunos de los otros inhibidores de la recaptación de serotonina como fluoxetina y sertralina son inhibidores del CYP 2D6 y, consecuentemente, es menos probable una interacción farmacocinética relevante con Clozapina. De forma similar, las interacciones farmacocinéticas con inhibidores del CYP 3A4 como los antimicóticos azólicos, cimetidina, eritromicina, e inhibidores de la proteasa son poco probables, aunque se han comunicado algunos casos. Debido a que la cafeína aumenta la concentración plasmática de Clozapina y disminuye en aproximadamente un 50% tras 5 días sin ingesta de cafeína, pueden ser necesarios cambios en la dosis de Clozapina cuando haya un cambio en los hábitos de ingesta de cafeína. En casos de interrupción brusca del hábito de fumar, puede aumentar la concentración plasmática de Clozapina, lo que provocaría un aumento de las reacciones adversas. La administración concomitante de fármacos conocidos como inductores de los enzimas del citocromo P450 puede disminuir los niveles plasmáticos de Clozapina, lo que puede llevar a una disminución de su eficacia. Fármacos conocidos como inductores de la actividad de los enzimas del citocromo P450 y de los que se han comunicado interacciones con Clozapina, incluyen, por ejemplo, carbamazepina (no debe utilizarse concomitantemente con Clozapina, debido a su potencial mielosupresor), fenitoína y rifampicina. Los inductores conocidos del citocromo CYP1A2, como por ejemplo el omeprazol, pueden conllevar la disminución de los niveles de Clozapina. Cuando se utilice en combinación con éstos fármacos, ha de tenerse en cuenta, por tanto, la capacidad que tienen para reducir la eficacia de la Clozapina. Otros. El uso concomitante de litio u otros agentes activos del SNC pueden aumentar el riesgo de aparición de un síndrome neuroléptico maligno (SNM). Se han descrito casos raros pero graves de crisis epilépticas, inclusive en pacientes no epilépticos, y casos aislados de delirio cuando se administró Clozapina conjuntamente con ácido valproico. Estos efectos son probablemente debidos a una interacción farmacodinámica cuyo mecanismo no ha sido determinado. Se recomienda precaución en pacientes que reciban tratamiento concomitante con otros fármacos inhibidores o inductores de los isoenzimas del citocromo P450. No se han observado hasta la fecha interacciones clínicamente relevantes con antidepresivos tricíclicos, fenotiazinas y antiarrítmicos tipo IC, fármacos todos ellos con afinidad por el citocromo P450 2D6. Como con otros antipsicóticos, deben tomarse precauciones cuando se prescribe Nemea con medicamentos que incrementan el intervalo QTc o causan desequilibrio electrolítico. Una descripción de las interacciones farmacológicas con Nemea que se consideran más importantes se indican en la Tabla 2. No es una lista exhaustiva. AF_publi_ficha_tecnica.indd 2 Tabla 2: Referencia a las interacciones farmacológicas más relevantes Fármaco Interacciones Comentarios Supresores de la médula ósea (p.ej., carbamazepina, cloranfenicol, sulfonamidas (p.ej., cotrimoxazol), analgésicos pirazolónicos (p.ej., fenilbutazona), penicilamina, agentes citotóxicos y antipsicóticos inyectables depot de larga duración Interactúan aumentando el riesgo y/o la gravedad de la supresión de la médula ósea. Nemea no debe utilizarse concomitantemente con otros fármacos de los que se conoce que poseen potencial para suprimir la función de la médula ósea (ver Sección 4.3 Contraindicaciones). Benzodiazepinas El uso concomitante puede aumentar el riesgo de colapso circulatorio, que puede llevar a paro cardíaco y/o respiratorio. A pesar de que su ocurrencia es rara, se recomienda precaución cuando se usen estos fármacos juntos. Las notificaciones sugieren que es más probable que la depresión respiratoria y el colapso ocurran al inicio del tratamiento con esta combinación o cuando Nemea se añade a un tratamiento ya establecido con benzodiazepinas. Anticolinérgicos Nemea potencia la acción de estos fármacos por adición de actividad anticolinérgica. Observar al paciente por si aparecen efectos adversos anticolinérgicos como estreñimiento, especialmente cuando se utiliza para ayudar a controlar la hipersalivación. Antihipertensivos Nemea pueden potenciar el efecto hipotensor de estos fármacos debido a que antagoniza sus efectos simpaticomiméticos. Se recomienda precaución si se utiliza Nemea de forma concomitante con fármacos antihipertensores. Los pacientes deben ser advertidos del riesgo de hipotensión, especialmente durante el periodo inicial de titulación de dosis. Alcohol, IMAOs, depresores del SNC, incluyendo narcóticos y benzodiazepinas Aumento de los efectos centrales. Depresión aditiva del SNC e interferencia del comportamiento cognitivo y motor cuando se usa en combinación con éstos fármacos. Se recomienda precaución cuando se utilice Nemea en combinación con otros fármacos activos sobre el SNC. Advertir al paciente de los posibles efectos sedantes aditivos y recomendar no conducir ni manejar maquinaria. Fármacos con elevada unión a proteínas (p.ej., warfarina, digoxina) Nemea puede provocar un aumento en las concentraciones plasmáticas de estos fármacos debido a su desplazamiento de las proteínas plasmáticas. Los pacientes deben ser controlados por si se producen efectos adversos asociados con estos fármacos y si es necesario, ajustar la dosis de los mismos. Fenitoína La adición de fenitoína al tratamiento con Nemea puede provocar una disminución en las concentraciones plasmáticas de Clozapina. Si ha de usarse fenitoína, deberá controlarse estrechamente al paciente por si se produce un empeoramiento de los síntomas psicóticos. Litio El uso concomitante puede aumentar el riesgo de desarrollar un síndrome neuroléptico maligno (SNM). Observar al paciente por si aparecen signos y síntomas de SNM. Sustancias inductoras de CYP1A2 (p. ej., omeprazol) El uso concomitante puede disminuir los niveles de Nemea. Debe considerarse el potencial reductor de la eficacia de Nemea. Sustancias inhibidoras de CYP1A2 (p. ej., fluvoxamina, cafeína, ciprofloxacino) El uso concomitante puede incrementar los niveles de Nemea. Potencial incremento de reacciones adversas. Se requiere tomar cuidado también al cese de la medicación inhibidora de CYP1A2 concomitante, porque produciría una caída en los niveles de Nemea. 4.6 Fertilidad, embarazo y lactancia. Embarazo. Existen sólo limitados datos clínicos de embarazos durante el tratamiento con Clozapina. Los estudios en animales no indican ni directa ni indirectamente efectos nocivos en lo que respecta a embarazo, desarrollo embrional/fetal, parto o desarrollo postnatal (ver sección 5.3 Datos preclínicos sobre seguridad). Se recomienda precaución cuando se prescriba a mujeres embarazadas. Lactancia. Los estudios en animales sugieren que Clozapina se excreta a través de la leche materna y tiene efecto en el lactante; por ello, las madres que reciban Nemea, no deben amamantar a sus hijos. Los recién nacidos que han estado expuestos a medicamentos antipsicóticos (como Clozapina) durante el tercer trimestre de embarazo pueden presentar reacciones extrapiramidales y/o síntomas de abstinencia que pueden variar en severidad y duración después del parto, por lo que se aconseja un cuidadoso control. Se han notificado casos de agitación, hipotonía, temblor, somnolencia, dificultad respiratoria y trastornos alimenticios. Mujeres en edad fértil. Puede producirse el retorno a la menstruación normal como resultado del cambio de otro antipsicótico a Nemea. Deben tomarse medidas anticonceptivas adecuadas en mujeres en edad fértil. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas. Nemea actúa sobre el sistema nervioso central y puede producir: somnolencia, mareos, alteraciones visuales y disminución de la capacidad de reacción. Estos efectos, así como la propia enfermedad, hacen que sea recomendable tener precaución a la hora de conducir vehículos o manejar maquinaria peligrosa, especialmente mientras no se haya establecido la sensibilidad particular de cada paciente al medicamento. 4.8 Reacciones adversas. En gran parte, el perfil de reacciones adversas de Nemea es predecible a partir de sus propiedades farmacológicas. Una excepción importante es su propensión a causar agranulocitosis (ver sección 4.4 Advertencias y precauciones especiales de empleo). Debido a este riesgo, su uso se restringe a esquizofrenia resistente al tratamiento y a psicosis que ocurran durante la enfermedad de Parkinson en los casos en los que haya fallado el tratamiento estándar. Mientras que el control sanguíneo es una parte esencial del cuidado de los pacientes que reciben Clozapina, el médico debe conocer otras reacciones raras pero graves. Una observación cuidadosa del paciente y una adecuada anamnesis hacen que estas reacciones adversas puedan ser diagnosticadas precozmente, previniendo así su morbilidad y mortalidad. Sangre y sistema linfático. El desarrollo de granulocitopenia y agranulocitosis es un riesgo inherente al tratamiento con Nemea. Aunque resulta generalmente reversible al retirar el fármaco, la agranulocitosis puede provocar una sepsis y conducir a la muerte. Debido a que es necesaria la inmediata retirada del fármaco para prevenir el desarrollo de agranulocitosis que ponga en peligro la vida, es obligada la monitorización del recuento leucocitario (ver 4.4 Advertencias y precauciones especiales de empleo). La Tabla 3 resume la incidencia estimada de agranulocitosis en cada periodo de tratamiento con Clozapina. Tabla 3: Incidencia estimada de agranulocitosis1 Periodo de tratamiento Incidencia de agranulocitosis per 100.000 personas semana2 de observación semana 0-18 32,0 semana 19-52 2,3 semana 53 y en adelante 1,8 16/01/13 16:46 1. De la experiencia del registro “UK Clozaril Patient Monitoring Service” (Programa de Seguimiento del Reino Unido) entre 1989 - 2001. 2. Persona-tiempo es la suma de las unidades de tiempo individuales que los pacientes en el registro han estado expuestos a Clozapina antes de experimentar agranulocitosis. Por ejemplo, se pudieron observar 100.000 personas-semana en 1.000 pacientes que estuvieron en el registro durante 100 semanas (100*1000 = 100.000), o en 200 pacientes que estuvieron en el registro durante 500 semanas (200*500 = 100.000) antes de experimentar agranulocitosis. La incidencia acumulada de agranulocitosis en la experiencia desde el inicio del registro del UK Clozaril Patient Monitoring Service (0 - 11,6 años entre 1989 y 2001) es de 0,78%. La mayoría de los casos (aproximadamente el 70%) ocurrieron durante las primeras 18 semanas de tratamiento. Trastornos metabólicos y nutricionales. Raramente se ha comunicado alteración de la tolerancia a la glucosa y/o desarrollo o exacerbación de diabetes mellitus durante el tratamiento con Clozapina. En muy raras ocasiones, se ha comunicado hiperglucemia grave, provocando algunas veces cetoacidosis/coma hiperosmolar, en pacientes tratados con Clozapina sin antecedentes previos de hiperglucemia. Los niveles de glucosa se normalizaron en la mayoría de los pacientes tras la interrupción del tratamiento con Clozapina y en algunos casos reapareció la hiperglucemia al reiniciar el tratamiento. Aunque la mayoría de los pacientes presentaban factores de riesgo de diabetes mellitus no insulina dependientes, se han documentado también casos en pacientes sin factores de riesgo conocidos (ver sección 4.4 Advertencias y precauciones especiales de empleo). Trastornos del Sistema Nervioso Central. Los efectos adversos más frecuentes observados incluyen somnolencia/sedación y mareos. Nemea puede producir cambios en el EEG, incluyendo la aparición de picos y ondas complejas. Disminuye el umbral convulsivo de forma dosis dependiente y puede provocar espasmos mioclónicos o convulsiones generalizadas. Es más probable que estos síntomas aparezcan con el incremento rápido de la dosis y en pacientes con epilepsia pre-existente. En caso de que aparezcan, debe reducirse la dosis y, si es necesario, iniciar un tratamiento anticonvulsivante. Debe evitarse el uso de carbamazepina debido a su potencial para deprimir la función de la médula ósea y tener en cuenta la posibilidad de interacción farmacocinética con otros fármacos anticonvulsivantes. En casos raros, pacientes tratados con Nemea pueden sufrir delirio. Muy raramente, se han descrito casos de discinesia tardía en pacientes tratados con Clozapina que habían sido tratados con otros fármacos antipsicóticos. Los pacientes en los que la discinesia tardía se desarrolló con otros antipsicóticos, mejoraron con Clozapina. Trastornos cardíacos. Puede presentarse taquicardia e hipotensión ortostática con o sin síncope, especialmente en las primeras semanas de tratamiento. La prevalencia y la gravedad de la hipotensión están influidas por la tasa y la magnitud del ajuste de la dosis. Se han comunicado casos de colapso circulatorio como resultado de la hipotensión profunda, en particular relacionado con un ajuste agresivo del fármaco, con posibles complicaciones graves de paro cardíaco o respiratorio. Una minoría de los pacientes tratados con Clozapina experimentó cambios en el ECG similares a los observados con otros fármacos antipsicóticos, incluyendo depresión del segmento S-T y aplanamiento o inversión de las ondas T, que se normalizaron tras la interrupción del tratamiento. La significación clínica de estos cambios no está clara. Sin embargo, debe tenerse presente que estas anormalidades se han observado en pacientes con miocarditis. Se han observado casos aislados de arritmias cardíacas, pericarditis/efusión pericárdica y miocarditis, algunos de ellos con desenlace mortal. La mayoría de los casos de miocarditis ocurrieron durante los dos primeros meses de iniciación del tratamiento con Clozapina. Los casos de cardiomiopatía aparecieron generalmente en fases más tardías de tratamiento. En algunos casos de miocarditis (aproximadamente 14%) y de pericarditis/ efusión pericárdica se comunicó también eosinofilia; sin embargo, se desconoce si la eosinofilia puede predecir de forma fiable la aparición de carditis. Los signos y síntomas de miocarditis o cardiomiopatía incluyen taquicardia persistente en reposo, palpitaciones, arritmias, dolor torácico y otros signos y síntomas de insuficiencia cardíaca (tales como fatiga sin causa aparente, disnea, taquipnea), o síntomas similares a los de infarto de miocardio. Otros síntomas que pueden presentarse además de los anteriores incluyen síntomas similares a la gripe. Muertes súbitas y no explicables ocurren entre pacientes psiquiátricos que reciben medicación convencional antipsicótica y también en pacientes psiquiátricos no tratados. Tales muertes se han comunicado muy raramente en pacientes en tratamiento con Clozapina. Trastornos vasculares. Raramente se han descrito casos raros de tromboembolismo. Se han descrito con antipsicóticos casos de tromboembolismo venoso, incluyendo casos de embolismo pulmonar y casos de trombosis de venas profundas. Su frecuencia es desconocida. Sistema respiratorio. Muy raramente, se ha producido depresión o paro respiratorio con o sin colapso circulatorio (ver 4.4 Advertencias y precauciones especiales de empleo y 4.5 Interacción con otros medicamentos y otras formas de interacción). Sistema gastrointestinal. Muy frecuentemente se ha observado estreñimiento e hipersalivación, y frecuentemente náuseas y vómitos. Muy raramente puede producirse íleo paralítico (ver 4.4 Advertencias y precauciones especiales de empleo). En raras ocasiones, se ha asociado el tratamiento con Clozapina con disfagia. Puede producirse aspiración de alimentos ingeridos en pacientes que presenten disfagia o como consecuencia de una sobredosis aguda. Trastornos hepatobiliares. Pueden producirse elevaciones transitorias y asintomáticas de los enzimas hepáticos, y raramente hepatitis e ictericia colestásica. Se ha comunicado muy raramente necrosis hepática fulminante. Si se desarrolla ictericia, debe interrumpirse el tratamiento con Nemea (ver 4.4 Advertencias y precauciones especiales de empleo). En casos raros, se ha comunicado pancreatitis aguda. Trastornos renales. Se han comunicado casos aislados de nefritis intersticial aguda asociada al tratamiento con Clozapina. Trastornos reproductores y de las mamas. Se han recibido casos muy raros de priapismo. Embarazo, puerperio y enfermedades perinatales. Frecuencia desconocida: Síndrome de abstinencia neonatal (ver sección 4.6). Trastornos generales. Se han comunicado casos de síndrome neuroléptico maligno (SNM) en pacientes en tratamiento con Clozapina sola o en combinación con litio u otros fármacos activos sobre el SNC. Se han descrito reacciones agudas por retirada (ver 4.4 Advertencias y Precauciones especiales de empleo). La Tabla 4 resume las reacciones adversas recogidas a través de notificaciones espontáneas y durante los ensayos clínicos. Tabla 4: Estimación de frecuencia de reacciones adversas aparecidas con el tratamiento, procedentes de notificaciones espontáneas y de ensayos clínicos. Las reacciones adversas están clasificadas bajo títulos de frecuencia, utilizando la siguiente convención: Muy frecuentes (≥1/10), frecuentes (≥1/100, <1/10), poco frecuentes (≥1/1.000, <1/100), raras (≥1/10.000, <1/1.000), muy raras (<1/10.000), incluyendo casos aislados. Investigaciones Raros Aumento de las CPK Trastornos cardíacos Muy frecuentes: Frecuentes: Raros: Taquicardia Cambios en el ECG Colapso circulatorio, arritmias, miocarditis, pericarditis/efusión pericárdica Cardiomiopatía, paro cardíaco Muy raros: Trastornos sanguíneos y del sistema linfático Frecuentes: Leucopenia/disminución del recuento leucocitario/ neutropenia, eosinofilia, leucocitosis Agranulocitosis Anemia Trombocitopenia, trombocitemia Poco frecuentes: Raros: Muy raros: Trastornos del sistema nervioso Muy frecuentes: Frecuentes: Somnolencia/sedación, mareo Visión borrosa, cefalea, temblor, rigidez, acatisia, síntomas extrapiramidales, crisis epilépticas/ convulsiones/espasmos mioclónicos Confusión, delirio Discinesia tardía. Raros: Muy raros: Trastornos respiratorios, mediastínicos Raros: Muy raros: torácicos y Trastornos gastrointestinales Muy frecuentes: Frecuentes: Raros: Muy raros: Trastornos renales y urinarios Frecuentes: Muy raros: Aspiración de alimentos ingeridos Depresión respiratoria/colapso respiratorio Estreñimiento, hipersalivación Náuseas, vómitos, anorexia, sequedad de boca Disfagia Crecimiento de la glándula parotídea, obstrucción intestinal/íleo paralítico/compactación fecal Trastornos metabólicos y nutricionales Frecuentes: Raros: Muy raros: Trastornos vasculares Frecuentes: Raros: No conocidos: Trastornos generales Frecuentes Aumento de peso Alteración de la tolerancia a la glucosa, diabetes mellitus Cetoacidosis, coma hiperosmolar, hiperglucemia grave, hipertrigliciridemia, hipercolesterolemia Hipertensión, hipotensión postural, síncope Tromboembolismo Tromboembolismo venoso (incluyendo embolismo pulmonar y trombosis de venas profundas) Poco frecuentes Muy raros Fatiga, fiebre, hipertermia benigna, trastornos de la sudoración/regulación de la temperatura Síndrome Neuroléptico Maligno Muerte súbita inexplicable Trastornos hepatobiliares Frecuentes Raros Muy raros Aumento de los enzimas hepáticos Hepatitis, ictericia colestásica, pancreatitis Necrosis hepática fulminante Trastornos del sistema reproductor Muy raros Priapismo Trastornos psiquiátricos Raros Inquietud, agitación Se han descrito episodios muy raros de prolongación de QT que pueden estar asociados con Torsades de Pointes, aunque no hay una relación causal concluyente con el uso de este medicamento. 4.9 Sobredosis. En casos de sobredosis agudas intencionadas o accidentales con Clozapina, se ha estimado una mortalidad de un 12% a través de los casos notificados que disponían de información sobre el desenlace. La mayoría de las muertes estaban asociadas a insuficiencia cardíaca o neumonía causada por aspiración tras ingerir dosis superiores a 2.000 mg. También ha habido informes de pacientes que se han recuperado de sobredosificaciones superiores a 10.000 mg. Sin embargo, en algunos adultos, principalmente en aquéllos no expuestos previamente a Clozapina, la ingestión de dosis de 400 mg provocó estados comatosos con peligro de muerte y un caso de muerte. En niños, la ingesta de 50 mg a 200 mg provocó sedación profunda o coma sin llegar a ser letal. Signos y síntomas. Somnolencia, letargo, arreflexia, coma, confusión, alucinaciones, agitación, delirio, síntomas extrapiramidales, hiperreflexia, convulsiones; hipersalivación, midriasis, visión borrosa; termolabilidad; hipotensión, colapso, taquicardia, arritmias cardíacas; neumonía por aspiración, disnea, depresión o insuficiencia respiratoria. Tratamiento. Durante las primeras 6 horas tras la ingestión del fármaco, deberá realizarse un lavado gástrico y/o la administración de carbón activado. La diálisis peritoneal y la hemodiálisis no son muy efectivas. Tratamiento sintomático bajo monitorización cardíaca continua, vigilancia de la respiración, monitorización de los electrolitos y del equilibrio ácido-base. Deberá evitarse el uso de epinefrina en el tratamiento de la hipotensión debido a la posibilidad de un efecto paradójico (efecto inverso) al de la epinefrina. Es necesaria una estrecha supervisión médica durante al menos 5 días debido a la posibilidad de reacciones retardadas. 5. PROPIEDADES FARMACOLÓGICAS. 5.1 Propiedades farmacodinámicas. Grupo farmacoterapéutico: Antipsicóticos. Diazepinas, oxazepinas y triazepinas. Código ATC: N05AH02. Clozapina ha demostrado ser un fármaco antipsicótico diferente de los antipsicóticos clásicos. En estudios farmacológicos, Clozapina no induce catalepsia ni inhibe el comportamiento estereotipado inducido por apomorfina o anfetamina. Posee una acción bloqueante débil sobre los receptores dopaminérgicos (D1, D2, D3 y D5), pero muestra potentes efectos sobre el receptor D4, además de un potente efecto anti-α-adrenérgico, anticolinérgico, antihistamínico y de disminución del nivel de vigilia (“arousal”). También ha demostrado poseer propiedades antiserotoninérgicas. Clínicamente, Clozapina produce una rápida y notable sedación y posee un potente efecto antipsicótico en pacientes esquizofrénicos resistentes a otros tratamientos. En estos casos, Clozapina ha mostrado ser efectivo mejorando tanto los síntomas positivos como negativos de la esquizofrenia principalmente en ensayos a corto plazo. En un ensayo clínico abierto realizado en 319 pacientes resistentes al tratamiento tratados durante 12 meses, se observó una mejoría clínicamente relevante en el 37% de los pacientes durante la primera semana de tratamiento y en un 44% al final de los 12 meses. La mejoría se definió como aproximadamente un 20% de reducción desde el nivel basal en la Brief Psychiatric Rating Scale Score. Además, se han descrito mejorías en algunos aspectos de la disfunción cognitiva. Comparado con los antipsicóticos clásicos, Clozapina produce menos reacciones extrapiramidales mayores, tales como distonía aguda, efectos adversos de tipo parkinsoniano y acatisia. En contraste con los antipsicóticos clásicos, Clozapina no produce aumento de los niveles de prolactina o los aumenta mínimamente evitando así efectos adversos tales como ginecomastia, amenorrea, galactorrea o impotencia. Una reacción adversa potencialmente grave del tratamiento con Clozapina es la granulocitopenia y agranulocitosis con una incidencia estimada del 3% y 0,7% respectivamente. Teniendo en cuenta este riesgo, el uso de Nemea debe limitarse a pacientes resistentes al tratamiento o pacientes con psicosis en el curso de la enfermedad de Parkinson cuando hayan fallado otras terapias (ver sección 4.1 Indicaciones terapéuticas) y a los cuales se les pueda realizar exámenes hematológicos regulares (ver secciones 4.4 Advertencias y precauciones especiales de empleo y 4.8 Reacciones adversas). 5.2 Propiedades farmacocinéticas. La absorción de Clozapina administrado por vía oral es del 90-95%; los alimentos no influyen ni en la velocidad ni en el grado de absorción. Clozapina está sometida a un metabolismo de primer paso moderado, lo que se traduce en una biodisponibilidad absoluta del 50-60%. En estado estacionario, cuando se administra dos veces al día, los niveles plasmáticos máximos se alcanzan en término medio a las 2,1 horas (intervalo de 0,4 a 4,2 horas), y el volumen de distribución es de 1,6 l/kg. Clozapina se une a proteínas plasmáticas en aproximadamente un 95%. Su eliminación es bifásica, con una semivida de eliminación terminal media de 12 horas (intervalo de 6 a 26 horas). Después de dosis únicas de 75 mg, la semivida de eliminación terminal media fue de 7,9 horas, aumentando hasta 14,2 horas cuando se alcanzan condiciones de estado estacionario por administración de dosis diarias de 75 mg durante como mínimo 7 días. En el estado estacionario, aumentos de dosis de 37,5 hasta 75 y 150 mg administrados dos veces al día resultaron en aumentos lineales proporcionales a la dosis en el área bajo la curva de concentración plasmática/tiempo (AUC) y en el pico, y mínimas concentraciones plasmáticas. Clozapina se metaboliza de forma prácticamente completa antes de su excreción. De los metabolitos principales, solamente el metabolito desmetilo es activo. Sus acciones farmacológicas recuerdan a las de la Clozapina, pero son considerablemente más débiles y de menor duración. Solamente se detectan trazas de fármaco inalterado en orina y heces, excretándose aproximadamente el 50% de la dosis administrada en orina y el 30% en heces. 5.3 Datos preclínicos sobre seguridad. Los datos preclínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales sobre farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad y potencial carcinogénico (para toxicidad reproductiva, ver sección 4.6). 6. DATOS FARMACÉUTICOS. 6.1 Lista de excipientes. Lactosa monohidrato. Celulosa microcristalina. Povidona. Almidón glicolato sódico tipo A de patata. Estearato magnésico. 6.2 Incompatibilidades. No aplicable. 6.3 Periodo de validez. 4 años. 6.4 Precauciones especiales de conservación. No se precisan condiciones especiales de conservación. 6.5 Naturaleza y contenido del envase. Comprimidos de 200 mg de Clozapina. Envase blíster de PVC/PVDC/aluminio. Cada envase contiene 40 comprimidos. Envase frasco de polietileno de alta densidad. Cada envase contiene 40 comprimidos. 6.6 Precauciones especiales de eliminación. Ninguna especial. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN. Adamed Laboratorios, S.L.U. c/ Golondrina, 26. 28023 Aravaca. Madrid (España). Tfno.: 91 357 11 25. Fax: 91 307 09 70. e-mail: [email protected]. 8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN. Nemea 200 mg comprimidos: Nº 75.901. 9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN. Marzo de 2012. 10. PRESENTACIONES. Nemea 200 mg comprimidos, 40 comprimidos. 11. CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN. Con receta ordinaria. Cupón precinto diferenciado Especial Control Médico. 12. CONDICIONES DE LA PRESTACIÓN FARMACÉUTICA DEL SNS. Financiado por el SNS, aportación reducida. 13. FECHA DE LA REVISIÓN DEL TEXTO. Junio de 2012. Ficha Técnica Nemea 25 mg / 100 mg y planes de farmacovigilancia disponibles en: www.adamedfarma.es Incontinencia urinaria, retención urinaria Nefritis intersticial Trastornos cutáneos y de los tejidos subcutáneos Muy raros: Reacciones cutáneas AF_publi_ficha_tecnica.indd 3 16/01/13 16:46