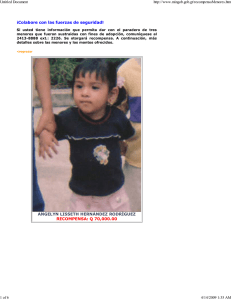
Manual de Urología
Anuncio

Manual de Urología Manual de Urología Introducción Dr. Carlos Martínez S. Exploración clínica urológica Dr. Pedro Martínez S. Exploración del aparato genitourinario por imágenes Dr. Pedro Martínez S. Malformaciones congénitas del aparato urogenital Dr. Pedro Martínez S. Infección urinaria en el adulto Dr. Javier Dominguez C. Infecciones urinarias en pediatría Dr. Paulina Baquedano D. Hiperplasia benigna de la próstata Dr. Carlos Martínez S. Tratamientos invasivos de la hiperplasia benigna de la próstata Dr. Fernando del Campo S. Cirugía de la estenosis uretral Dr. Carlos Martínez S. Las sondas y la urología Dr. Carlos Martínez S. Litasis urinaria (cristalografía) Dr. Cristián Trucco B. Litasis urinaria Dr. Cristián Trucco B. Litasis en pediatría Dra. Paulina Baquedano D. Tumores renales Dr. Norman Zambrano A. Tumores testiculares Dr. Alfredo Velasco P. Cáncer de la próstata Dr. Luis Martínez V. Patología y cirugía de las glándulas adrenales Dr. Pedro Martínez S. Biología molecular y cánceres urólogicos Dr. Alfredo Velasco P. Urgencias urológicas Dr. Pablo Troncoso C. Urología femenina Dr. Fernando del Campo S. Transplante renal Dr. Pablo Troncoso C. Patología de genitales externos en pediatría Dra. Paulina Baquedano D. Disfunciones sexuales Dr. Carlos Martínez S. Enfermedades de transmisión sexual en el varón Dres. Carlos Martínez S. - Sergio Guzman K. Reflujo vésico-ureteral Dra. Paulina Baquedano D. Cirugía laparoscópica en urología Dr. Arturo Dell´oro C. http://escuela.med.puc.cl/publ/manualUrologia/Default.html[9/7/2009 3:08:15 PM] Untitled Document Introduccion Este manual de Urología, presentado por el Departamento de Urología de la Pontificia Universidad Católica de Chile, representa el esfuerzo colectivo de sus docentes y es muy bien recibido por la comunidad urológica. En forma clara y didáctica, Urología Esencial aborda una veintena de los grandes de los grandes temas de la Urología, aquellos de mayor relevancia. Lo interesante de este Manual es el desarrollo casi coloquial de cada tema. En él los capítulos no pretenden ser una erudita puesta al día ni tampoco una recopilación bibliográfica, sino más bien lo que cada autor les diría a sus alumnos en una clase. Esto le da un valor enorme pues detrás de cada párrafo está la experiencia vivida y la visión personal. Sin duda los capítulos están asignados bajo esa intención y casi se podría adivinar por anticipado el autor de cada tema. Creo que este es el principal valor de este proyecto, pues las bibliotecas están repletas de magníficos libros y tratados - la mayoría extranjeros -, pero hay muy pocos manuales como éste en el cual un experto le cuenta al alumno lo que ha aprendido del tema a lo largo de los años, como si estuvieran en la sala de clases o pasando visitas. Y lo bueno es que este enfoque colonial no le resta para nada peso académico, pues cada capítulo es un excelente resumen de lo esencial del tema. Es lo que necesita saber el interno para aprobar el pregrado o mejor dicho lo que ese mismo interno agradecerá saber en su práctica cotidiana cuando sea médico general. Como bien apunta el Editor, este Manual tiene además la valiosa ventaja de ser chileno. Es nuestra realidad, es lo que nosotros vemos, es como nosotros resolvemos los problemas. Todos hemos tenido la incómoda experiencia de no encontrar en los textos extranjeros a nuestro alcance las respuestas que tanto necesitamos. En cuanto a la presentación, concuerdo plenamente con el Editor respecto del valor de las imágenes e ilustraciones y este Manual las contiene en abundancia. Además, su edición en disco compacto es otra atractiva novedad acorde con la era informática actual. En suma. Es un agrado recibir, leer y compartir este Manual de Urología que contiene lo esencial de nuestra especialidad. Como Presidente de la Sociedad Chilena de Urología felicito a sus autores por esta magnífica iniciativa. http://escuela.med.puc.cl/publ/manualUrologia/Introduccion.html[9/7/2009 3:09:10 PM] Untitled Document Anamnesis Figura 1: Observación de escroto. La anamnesis debe obtener el relato espontáneo, jerarquizado de los síntomas y su aparición en el tiempo. Sin embargo, en muchos casos el paciente puede olvidar u omitir algunos hechos y por ello siempre debe agregarse un interrogatorio dirigido en que se pasa revista a hechos específicos. También en esta revisión se pueden vencer inhibiciones o prejuicios que involuntariamente ocultan hechos claros y desorientan en la historia clínica. Muchos de los síndromes urológicos son de instalación lenta y el paciente se adapta fisiológica y psicológicamente a hechos que, de haber aparecido en forma abrupta, causarían extraordinaria alarma. También ocurre que el sentido natural del pudor esté exacerbado y lleve a ocultar síntomas o signos que el paciente admite y detalla si se le pregunta en forma directa. Es importante establecer si la historia es la de una enfermedad aguda o crónica, pero también si es recurrente sobre un fondo crónico. Estado General Figura 2: Colocación de manos para examen testicular. El estado general del paciente puede presentar un compromiso mayor o menor de acuerdo al proceso patológico. Debe tenerse claro que las personas de edad presentan otros cuadros concomitantes con frecuencia, como: anorexia, mala dentadura que no les permite alimentarse bien; cuadros depresivos crónicos que quitan el deseo de comer; diabetes, enfermedad muy prevalente que muchas veces es desconocida por el paciente y en otras éste no toma conciencia de la importancia que tiene; en todos estos casos se compromete el estado general, por causas coadyuvantes o ajenas a la enfermedad de fondo. Los pacientes portadores de pielonefritis crónica, durante los períodos de reagudización, presentan con frecuencia astenia y fatigabilidad fácil que se manifiesta hacia el fin del día y que si bien no impide el desarrollo de la actividad habitual implica un mayor desgaste para el paciente. Figura 3: Fijación del testículo entre los dedos permite palpar con pocas molestias para el paciente. El enfermo urológico con gran frecuencia puede tener manifestaciones de otras patologías: hipertensión arterial, insuficiencia coronaria, trastornos del ritmo, insuficiencia cardíaca, que se asocian con cuadros de uropatía obstructiva. Es clásica la facilidad con que un paciente con valvulopatía aórtica se descompensa a causa de uropatía obstructiva. El enfisema pulmonar, bronquitis crónica, asma bronquial y otra patología pulmonar pueden complicar al paciente urológico y deben ser investigados cuadros de esta naturaleza. Síndrome Febril Los cuadros infecciosos urinarios pueden evolucionar con o sin fiebre. La mayoría de las infecciones urinarias bajas evolucionan sin alza térmica. A la inversa, las infecciones urinarias altas, pielonefritis agudas, evolucionan casi siempre con gran alza térmica (39-40°C), generalmente precedidas de calofríos. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Figura 4: Trombo tumoral en vena cava. La fiebre se caracteriza por ser remitente, con fluctuaciones importantes en el curso del día o en horas. Las infecciones agudas de la próstata y el del epidídimo dan el mismo tipo de fiebre en sus comienzos, que se hace después continua. A raíz de maniobras uretrales, no es infrecuente que haya calofríos y alza térmica, debidos a bacteremias por la absorción de gérmenes en la mucosa uretral. Pueden originarse así septicemias gravísimas. También es cierto que la infección urinaria alta puede evolucionar en forma afebril, lo que caracteriza a la etapas crónicas de la pielonefritis. Los lactantes y preescolares pueden tener, como única manifestación de infección urinaria alta, retraso pondoestatural. En clínica pediátrica, el diagnóstico de infección urinaria debiera ser planteado con mayor frecuencia y comprobado con los exámenes de laboratorio. Esto permitiría diagnosticar a tiempo y recuperar muchos cuadros patológicos que, ignorados, evolucionan hacia la atrofia y pérdida del riñón. El hipernefroma es una de las causas de fiebre inexplicada, cuando esta se presenta como único síntoma de esta enfermedad. Dolor Renal Se debe a la distensión relativamente brusca de la cápsula renal y obedece a causas inflamatorias y/u obstructivas. Se lo refiere a la región costomuscular a la altura de la décima costilla y se irradia hacia la fosa lumbar e hipocondrio. Su carácter es sordo y constante, el paciente lo relata como fatigante, mas tolerable, que permite una actividad limitada, pero del cual se tiene conciencia en forma permanente. Es característico de las hidronefrosis agudas y subagudas. Otros cuadros obstructivos o que distienden la cápsula pueden ser: litiasis obstructiva, pielonefritis aguda, tumores renales, etc. Cólico Renal Corresponde a un complejo en el cual intervienen diferentes factores: dolor de fondo, referido al área renal, permanente y que corresponde a la distensión de las cavidades pielocalicilares y de la cápsula, al cual se agrega dolor cólico generado por las contracciones de la musculatura lisa ureteral de los segmentos proximales a la obstrucción existente. Este segundo componente puede alcanzar extraordinaria intensidad y se irradia desde el ángulo costovertebral hacia el flanco y fosa ilíaca correspondientes. Llega hasta la raíz del pene y escroto en el hombre y a los labios mayores en la mujer, y a la raíz del miembro inferior. Es característico del cólico renal el no sobrepasar la línea media del abdomen, hecho que tiene gran valor para el diagnóstico diferencial. El cuadro doloroso se acompaña de gran excitación psicomotora del paciente, que no permanece en reposo o en posición determinada, sino que cambia permanentemente del decúbito a la marcha y a la posición sentada, acompañado de toda clase de manifestaciones de dolor. El paciente relata fluctuaciones en el dolor que varían entre lo tolerable y lo paroxístico. La duración del cólico renal es variable y depende del factor etiológico y de la capacidad de la vía urinaria para expulsar el agente obstructivo: litiasis, coágulos sanguíneos, grumos de pus y, más raramente tejidos necróticos esfacelados desde el riñón. Dura desde algunos minutos hasta varios días. Se acompaña de estado nauseoso importante y vómito escaso. En el curso de la horas hay distensión abdominal e íleo paralítico. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document El clínico puede orientarse sobre la localización de la obstrucción ureteral. Así, en el hombre el dolor irradiado al testículo o al labio mayor en la mujer es propio de obstáculo a nivel de la pelvis renal y del uréter alto. El uréter medio da dolor referido a la fosa ilíaca (punto de Mac Burney), lo que explica confusiones con apendicitis aguda en los casos de ubicación derecha y con diverticulitis a izquierda. Cuando un cálculo se ubica a nivel del uréter terminal aparece pujo y tenesmo vesical, con poliaquiuria. Dolor Vesical La inflamación vesical, cualquiera que sea su origen, se caracteriza por dos formas dolorosas: pujo y tenesmo. El primero es la sensación de contracción dolorosa de la vejiga, producida por el espasmo del cuello y trígono vesical. El tenesmo es la sensación de repleción y urgente necesidad de evacuación vesical que persiste una vez terminada la micción. Ambas sensaciones son referidas a la uretra posterior y tienen su mayor intensidad al iniciar y al terminar la micción. La retención urinaria aguda produce dolor angustiante referido a la región suprapúbica. En cambio, el retencionista crónico puede llegar a tener grandes volúmenes de orina en su vejiga, sin molestia dolorosa alguna. Dolor Genital Los cuadros dolorosos agudos, por lo general, son referidos a la gónada y presentan irradiación inguinal, siguiendo el trayecto del cordón espermático. Los procesos traumáticos o los inflamatorios comprometen en forma preferencial al epidídimo. En los cuadros inflamatorios el dolor, tolerable en un comienzo, puede adquirir intensidad invalidante a medida que progresa. El dolor es permanente, pero el paciente puede referir cambios en la intensidad en relación a cambios de posición: aumenta al ponerse de pie o disminuye al efectuar la suspensión del testículo. Esto se explica por la tracción y elongación del cordón. En los casos de torsión del cordón espermático o de la hidátide pediculada, es característica la aparición súbita de un intenso dolor, en un individuo hasta ese momento sano, generalmente en relación a un esfuerzo físico violento o a excitación sexual. El dolor testicular sordo, pesado, tolerable, está en relación a la tracción sostenida del cordón espermático. Se le encuentra en el hidrocele o varicocele y tiene un claro aumento en la posición de pie, y disminuye o desaparece en el decúbito. Los tumores testiculares se caracterizan por no producir dolor, salvo en aquellas ocasiones en que la albugínea testicular es distendida bruscamente por hemorragias intratumorales. Dolor referido al pene se encuentra en algunas condiciones raras: priapismo, que es la erección patológica y sostenida de los cuerpos cavernosos del pene, sin relación a estimulación sexual; enfermedad de Peyronie, que es la fibrosis patológica de los cuerpos cavernosos, que incurva el pene durante la erección. El dolor referido a la uretra está en relación con procesos inflamatorios de origen infeccioso y en raras ocasiones con cuerpos extraños (niños). Tiene carácter de ardor o quemadura, durante y al terminar la micción y se acompaña de pujo y tenesmo vesical si hay compromiso del cuello vesical. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Dolor Prostático Una causa frecuente de consulta es el dolor referido a la región sacra o perineal profunda o rectal profunda. De carácter sordo, permanente, puede asumir el carácter de molestia u opresión. Unido al antecedente de uretritis o infección urinaria hace plantear el diagnóstico de prostatitis. A la inversa, cuando el paciente manifiesta tener dolor a la próstata, generalmente está encubriendo otro motivo de consulta de la esfera sexual que no se atreve a relatar. En estos casos el interrogatorio directo hecho por el médico alivia la angustia del paciente y aclara la situación. Dolor Lumbar Es una causa muy frecuente de consulta y su origen más común es el lumbago. El paciente atribuye su dolor habitualmente a causa renal y así lo expresa claramente. El interrogatorio rápidamente pone de manifiesto la bilateralidad del dolor, su ubicación a nivel de la región lumbar baja y su clara relación con las posiciones y decúbitos determinados. También aclara el diagnóstico la relación existente entre el dolor y esfuerzos físicos o actitudes de trabajo determinadas, agacharse, pararse, etc. Hematuria Es uno de los síntomas más alarmantes para el paciente, que lo induce a consultar de inmediato. Existen grados diferentes de hematurias. En general, las enfermedades urológicas producen gran hematuria, y el paciente relata orinar "sangre roja" acompañada de coágulos. Aquí no se plantean dudas sobre la autenticidad de la hematuria. En cambio, es muy frecuente que los enfermos relaten tener "orinas coloradas". Esto puede ir desde la orina concentrada, propia de un cuadro febril, hasta la hematuria moderada. Es útil ofrecer comparaciones al paciente: té cargado, para las hematurias antiguas (a diferenciar de coluria y hemoglobinuria), agua de lavado de carne para las hematurias médicas, etc. También debe interrogarse sobre la ingestión de sustancias capaces de colorear la orina, como las betarragas, vitamina B12, Pyridium, etc. Conviene precisar si la hematuria se presenta por primera vez o si es recidivante. Si se asocia a otra sintomatología, como cólico renal o infección urinaria, o si, por el contrario, es "silenciosa" o monosintomática. Esto último puede observarse en tumores renales, litiasis coraliforme, hidronefrosis, quiste renal, tumores vesicales. Debe precisarse si la hematuria se extiende a toda micción o a una parte de ella; así se pueden distinguir: Hematuria total, que tiene su origen en la vejiga o por encima de ella, causada por litiasis, tumores o tuberculosis, etc. Hematuria inicial, que se observa en las uretritis y estenosis uretrales o meatales (niños). Hematuria terminal, que generalmente proviene de la uretra posterior, cuello vesical o trígono y es causada por uretritis posterior, pólipos, tumores del cuello vesical y cistitis. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Debe tenerse presente que basta una escasa cantidad de sangre para teñir de rojo toda la orina. La experiencia enseña que los enfermos tienden a magnificar la intensidad de la hematuria. Uretrorragia Es un síntoma que no debe ser confundido con hematuria y que se encuentra casi siempre en relación con traumatismos uretrales. A diferencia de la hematuria, la uretrorragia es la pérdida de sangre por la uretra, independientemente de la micción. Es un síntoma muy importante en los traumatismos pelvianos, en que ha habido ruptura de la uretra. Se asocia con imposibilidad de orinar, cuando hay sección total del conducto. Alteraciones de la Micción Por lo general, no se presta atención a esta función fisiológica, y sólo se tiene conciencia de los cambios bruscos de ella. De ahí la importancia que tiene el interrogatorio dirigido por el médico, averiguando aquellos cambios que pueden orientar en el diagnóstico. La capacidad vesical en el hombre es de 400 ml, y puede ser algo mayor en la mujer. Fórmula miccional es la relación entre el número de micciones diurnas y nocturnas. En el hombre es de 3 a 5 micciones en el día y de 1 o ninguna en la noche. En la mujer es de 2 a 3 en el día y de 1 a ninguna en la noche. Al decir "día" nos referimos al período de vigilia y al decir noche al período durante el cual el individuo duerme. Esto significa que la mayoría de los individuos adultos sanos no interrumpen el sueño por la necesidad de vaciar su vejiga, o bien, lo hacen una sola vez durante el sueño. Sin embargo, al ser interrogado el paciente, generalmente coloca su última micción del período de vigilia en el grupo "noche". Si esto no se aclara en forma dirigida por el médico, induce a error. Es importante precisar también la fórmula miccional en condiciones de comida y bebida normales, y compararlas con los posibles trastornos que sufren en el momento de la consulta. Cualquier persona puede precisar, con mucha exactitud, cuál es su hábito miccional nocturno. Por este motivo, las alteraciones en el hábito miccional se notan primero en el período "noche" y se relatan en forma más precisa. La presencia de micciones nocturnas, de frecuencia superior a lo señalado más arriba, se llama nicturia. En el hombre de edad pueden existir variaciones discretas en la fórmula miccional. Esto sólo traduce cambios subclínicos, producidos por la hipertrofia de la próstata propia de la edad. La mujer, en general, tiene una capacidad vesical algo mayor que el hombre. Ello explica en parte que pueda tener una fórmula miccional tan baja como una o dos micciones en 24 horas. Contribuye a esto la costumbre de ingerir poco líquido y la comprensible desconfianza que ella tiene por los desaseados servicios higiénicos públicos. El aumento de la frecuencia miccional se llama polaquiuria. Este concepto implica aumento en la frecuencia, pero con volumen bajo. Es más notorio durante la noche (nicturia). Cualquier trastorno irritativo de la vejiga trae consigo polaquiuria. En forma independiente, o bien asociada a la polaquiuria, pueden existir el pujo y/o tenesmo vesical. En algunos casos de inflamación http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document vesical aguda, la polaquiuria puede alcanzar tal magnitud que el paciente orina cada 5 ó 10 minutos y se la confunda con incontinencia urinaria: pseudoincontinencia. Por poliuria se entiende el aumento de volumen total de orina en 24 horas. Puede ser consecuencia de una mayor ingesta de líquidos: diabetes mellitus, diabetes insípida, etc., determinada por enfermedad o por trastornos de carácter neurótico. Se llama disuria cualquier trastorno de la micción. Esta palabra por sí sola significa poco y debe adjetivarse, señalando si se trata de disuria de esfuerzo o de disuria dolorosa. También debe precisarse si la disuria es inicial, o sea, del comienzo de la micción, si es total o terminal. La disuria de esfuerzo corresponde a procesos obstructivos de la vía urinaria, a partir del cuello vesical, la fimosis, etc. En el hombre adulto: el adenoma prostático, la enfermedad del cuello vesical, el cáncer prostático, las estenosis uretrales de causa traumática e inflamatorias. En la mujer, la estenosis inflamatoria de la uretra y la propagación de procesos tumorales infiltrantes de origen ginecológico. La disuria de esfuerzo es de instalación progresiva, solapada, y el paciente generalmente no tiene conciencia de su condición en forma clara. Es útil inducirlo a comparar con la forma de orinar que tenía algún tiempo antes. En la disuria de esfuerzo la micción va precedida por un período de latencia que el paciente puede reconocer claramente y que puede alargarse hasta varios minutos, y se recurre a la contracción de la prensa abdominal para vencer el obstáculo. La disuria dolorosa habitualmente es de tipo inicial o terminal, está en relación a los fenómenos inflamatorios del cuello vesical y trígono. El dolor es referido a la uretra posterior y, por lo general, asociado a pujo y tenesmo. En los casos de disuria de esfuerzo es frecuente que haya un componente doloroso asociado, que generalmente es terminal. Durante la micción puede ocurrir la interrupción brusca del chorro que, tras algunos momentos, y después de efectuar algún movimiento o maniobras de comprensión del hipogastrio, se reanuda nuevamente con las mismas características anteriores. Esto se conoce como micción interrumpida o en dos tiempos, y es propia de la presencia de cuerpos extraños en la vejiga: litiasis, tumores pediculados, coágulos. Continencia es la capacidad de controlar la micción por el esfínter vesical. El niño comienza su aprendizaje a los 18 meses y lo termina entre los 36 y 48 meses, cuando alcanza un control diurno y nocturno perfecto. La incontinencia nocturna se llama enuresis. Esta puede ser primaria, generalmente ligada a incompleta maduración del sistema nervioso central, o secundaria, reactiva a conflictos de orden psicológico, o bien, obedece a una causa orgánica en que la enuresis es una manifestación de una uropatía obstructiva: válvulas uretrales, estenosis uretral, infección urinaria, diabetes, etc. En las niñitas existe una alteración especial de la continencia que consiste, fundamentalmente, en la sensación de micción imperiosa y en la pérdida de algunas gotas de orina que las hace mantener el "calzón húmedo". En ellas la madre puede relatar, si se la interroga dirigidamente, que el chorro miccional es vacilante y a veces tiene muecas de dolor o escalofríos durante la micción. Este cuadro es producido por una estenosis funcional del esfínter estriado y favorece la infección y el reflujo vesicoureteral. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Las incontinencias urinarias pueden ser parciales o totales, permanentes o transitorias. Una de las principales causas reside en las lesiones neurológicas: fractura de columna, tumores medulares, metástasis infiltrantes a nivel medular, denervación a raíz de intervenciones pelvianas, polineuritis diabética, etc. Serán parciales o totales y definitivas o transitorias, según el grado de compromiso neurológico. En la mujer es frecuente encontrar incontinencia parcial de esfuerzo, dada por la natural debilidad del esfínter estriado y por los traumatismos del parto. Estos últimos deterioran o hacen desaparecer el ángulo uretrovesical posterior, llevando a la vejiga a la etapa de premicción permanente, en que toda la continencia está a cargo del esfínter estriado, el cual no puede controlar bruscos aumentos de presión abdominal, produciéndose escape vesical. En ciertos casos de irritabilidad exagerada de la pared de la vejiga (algunas cistitis), se hace imposible controlar el deseo de micción imperiosa, perdiéndose orina en forma involuntaria. Esta situación anormal desaparece al eliminarse la causa de la inflamación vesical. En los casos de fístulas del uréter o de la vejiga hacia la vagina, se observa la pérdida de orina por una vía absolutamente patológica. En estos casos, siempre existe el antecedente anamnéstico de una intervención quirúrgica pelviana efectuada algunos días antes. Existe también la pérdida urinaria parcial, pero permanente, cuando por defecto del desarrollo un uréter desemboca distal al esfínter urinario. En la uropatía obstructiva se puede llegar a incontinencia paradójica en la exageración de la micción por rebosamiento. Existe retención de orina y el paciente consulta por "incontinencia". Este paciente es portador de un obstáculo que le hace evacuar en forma incompleta su vejiga, dejando cada vez un residuo más importante. La polaquiuria puede llegar a tener una frecuencia tal, que remeda una incontinencia urinaria. La misma situación se encuentra en las retracciones cicatriciales de la vejiga secundaria a tuberculosis, en que la vejiga retraída es tan pequeña, que contiene un volumen de orina también pequeño, y a ello se suma la irritabilidad exagerada de la vejiga, lo que simula una incontinencia por la alta frecuencia de las micciones, que pueden invalidar totalmente al paciente. Retención Urinaria Es la imposibilidad de expulsar la orina acumulada en la vejiga. Se puede presentar en forma aguda, condición frecuente en el postoperatorio de algunas intervenciones, provocada por el uso de analgésicos y espasmolíticos. La mayoría de las veces no tiene mayor trascendencia. En otros casos puede ser la primera manifestación de una uropatía obstructiva que ha sido desconocida hasta ese momento. Es frecuente que este accidente agudo esté en relación a transgresiones etílicas o al frío. También puede ser causado por malas indicaciones terapéuticas, como el uso de diuréticos en un urópata obstructivo. En estos casos, el alcohol y los diuréticos son responsables de alterar el equilibrio, aumentando la producción de orina y la distensión vesical, con pérdida de la capacidad contráctil, de una vejiga ya distendida por la presencia de obstrucción, hasta ese momento compensada. El edema del cuello vesical producido por la infección o el frío puede ser responsable de una retención total. Las retenciones agudas se acompañan de gran malestar, con dolor angustiante referido a la región hipogástrica. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Por el contrario, el retencionista crónico puede llegar a la retención total y en quien esta condición se repite en el curso de los días siguientes, llega a temer en tal forma estos episodios, que deja de beber, con lo cual agrega deshidratación, y un factor prerrenal a la anuria obstructiva. En los traumatismos pelvianos o en los pacientes politraumatizados, la retención urinaria puede corresponder a sección total de la uretra, la que habitualmente se acompaña de uretrorragia. También los traumatismos cerrados abdominales con vejiga llena pueden llevar al estallido vesical y a un falso cuadro de retención urinaria, o anuria, en que la orina se acumula en la cavidad peritoneal. Neumaturia Es la expulsión de gas por el chorro urinario. Produce un ruido característico que recuerda el de una llave abierta cuando existe aire en la cañería. Se la encuentra con posterioridad a un examen endoscópico y corresponde al aire que penetró durante él y que es expulsado. En ausencia de maniobras de ese tipo es un síntoma que delata la existencia de una fístula digestivo-urinaria. Esta se encuentra secundariamente a procesos de diverticulitis del colon perforado a vejiga, y más raramente en cáncer de colon. Pueden acompañarse de expulsión de material intestinal. También puede ser causada por infecciones urinarias, producidas por gérmenes anaerobios que generan gas; suele complicar la diabetes. Trastornos de la Esfera Sexual Hematosperma es la eyaculación con sangre. Puede tratarse de sangre fresca, roja o bien color ladrillo o salmón, que corresponde a sangre más antigua. Puede ir asociada a la eyaculación dolorosa. Es un síntoma que alarma al hombre y que corresponde a procesos de prostatitis o uretritis posterior que deberán ser diagnosticados. El paciente que consulta por trastornos sexuales, lo hace bajo gran tensión y angustia. Generalmente evita mencionar la causa verdadera de la consulta y la oculta bajo malestares imprecisos que atribuye a la próstata. El médico debe reconocer a este tipo de paciente y ayudarlo, interrogándolo directamente, con tacto y paciencia. Las causas de consultas más frecuentes son: eyaculación precoz, entre los jóvenes, que revela situaciones de angustia o bien desinformación; erección imperfecta, impotencia, pérdida de la libido. En los hombres adultos, la diabetes es causa frecuente de impotencia orgánica. Patología Genital Algunos de estos cuadros son más propios del hombre joven: tumores testiculares, varicocele, hernias, fimosis, etc., y otros, del hombre maduro o senil: hidrocele, epididimitis, etc. La causa de consulta puede ser hallazgo fortuito de una tumoración testicular, que pasó inadvertida por largo tiempo y sólo se reconoció debido a un microtraumatismo. Esto es válido para los tumores testiculares, hidrocele, varicoceles pequeños y para los procesos epididimarios crónicos (TBC). http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Debe tratarse de precisar el tiempo de evolución, cosa en general difícil, pues es increíble lo poco observador que es el hombre en lo que atañe a su patología genital. Coadyuva la lentitud de estos procesos y su evolución indolora. La consulta por patología dolorosa referida al área genital fue revisada ya a propósito del dolor. La presencia de fimosis (incapacidad de descubrir el glande) es relatada como estrechez del prepucio. En el caso de individuos adultos que consultan por esta causa, debe interrogarse sobre antecedentes sugerentes de diabetes mellitus, ya que esta es, a veces, la primera manifestación de esta enfermedad. Otra causa de fimosis adquirida es el uso de sonda vesical por períodos prolongados. En la mujer debe investigarse la presencia de leucorrea (secreción vaginal), la cual puede explicar piurias que no corresponden a infección urinaria. En la niña pueden existir también leucorreas (micóticas, trichomoniásicas), que deben ser investigadas mediante interrogatorio adecuado a la madre. Criptorquidia es la anomalía de posición del testículo, en que este, ausente del escroto, se encuentra en cualquier punto de su trayecto normal (puede ser así intraabdominal, lumbar, ilíaco o pelviano). Debe ser diferenciado de un cuadro frecuente en el niño que es el testículo retráctil o en ascensor, en que la glándula está en el escroto la mayor parte del tiempo, pero es llevado fuera de él por la contracción del cremáster, hacia el conducto inguinal. Ectopia testicular es la ausencia de un testículo del escroto y su presencia en un sitio que no corresponde a su trayecto normal. Examen Físico Conciencia La conciencia se compromete en el síndrome urémico avanzado. Este compromiso es más manifiesto en los cuadros agudos, mientras que en los crónicos se puede llegar a etapas bastante avanzadas, sin deterioro de la conciencia. Los pacientes de edad avanzada suelen presentar signos de deterioro psíquico, el que puede acentuarse en forma grave a raíz de anestesia general e hipotensión. Se puede llegar a niveles confusionales, con excitación psicomotora que pone en peligro el resultado de una intervención quirúrgica o la vida del paciente, también puede contraindicar algunos procedimientos quirúrgicos Posición y Decúbito La gran excitación psicomotora es casi patognomónica del cólico renal. Durante los paroxismos de dolor el paciente cambia de posición y decúbito, y a menudo opta por la marcha. A diferencia del cólico renal, los cuadros inflamatorios renales o perirrenales obligan al paciente a adoptar posiciones antiálgicas. Estas se caracterizan por la escoliosis de concavidad hacia el lado comprometido y porque el paciente prefiere el decúbito lateral hacia el lado opuesto a la lesión. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Hipo o Singulto Se le observa con frecuencia en el síndrome urémico avanzado, debido a la irritación gástrica. Acompaña muy frecuentemente a los procesos peritoneales y su presencia debe hacerlos sospechar. Puede estar presente también en la sepsis. Aquellos pacientes sometidos a una anestesia general, que ha sido difícil, con relajación inadecuada y en quienes se ha establecido una lucha con el anestesista, presentan con frecuencia hipo en el postoperatorio. Piel y Mucosas En el niño y en especial en el lactante el turgor y la elasticidad de la piel son de gran valor para apreciar el estado de hidratación. En los pacientes adultos es más útil el estado de las axilas, que deben de estar húmedas en un individuo bien hidratado. Este índice es mucho más fiel que el estado de la lengua y mucosa bucal, las que pueden estar secas en pacientes que respiran por la boca. En el paciente urémico avanzado, la lengua está seca e incluso alcanza aspecto costroso: lengua de loro. Sin embargo, esto no se aprecia cuando las cifras de uremia son sólo moderadamente altas. El paciente urópata obstructivo bajo (adenoma de la próstata, enfermedad de cuello vesical, estenosis uretral), que presenta retenciones urinarias en forma subintrante, llega a tener tal temor a ellas, que deja de ingerir líquidos y puede consultar en avanzado estado de deshidratación. Por el contrario, aquellos enfermos que progresan hasta la oliguria extrema o la anuria por obstrucción ureteral bilateral (cáncer prostático, cáncer cervicouterino, etc.) no presentan las molestias propias de la retención urinaria vesical. Por lo tanto, continúan la ingestión de líquidos aun en la etapa de anuria. Este tipo de paciente consulta frecuentemente con edemas o en estado de anasarca, producto de la retención hídrica crónica. Examen de la Región Lumbar Forma parte del examen de columna y dorso; sin embargo, conviene destacar algunos detalles en relación con el aparato urogenital. Es conveniente efectuarlo en posición de pie y también sentado. De pie son visibles los defectos de la columna. Escoliosis de concavidad del lado de la lesión en los procesos inflamatorios renales o perirrenales. Contracción de las masas musculares que pretenden inmovilizar la zona dolorosa. Edema inflamatorio de la piel en los procesos perirrenales. Es posible pesquisar la presencia de tumoración a nivel sacro, propio del meningocele (vejiga neurogénica). Posteriormente, pueden observarse o acentuarse estos mismos signos en la posición sentado. En esta postura se efectúa la percusión de la fosa lumbar, para lo cual se solicita al paciente que incline el dorso hacia adelante, flectándolo, y cruce los brazos sobre el pecho. Se percute con el puño cerrado, utilizando el borde hipotenar. Debe advertirse previamente al paciente de lo que se va a hacer y efectuarlo primero muy suavemente y luego con más fuerza, percutiendo primero sobre el lado sano, de manera de dar un patrón de comparación con el lado enfermo. El paciente reconoce perfectamente la percusión sobre la fosa lumbar sana como golpe que no causa dolor. En cambio, en los procesos inflamatorios del riñón (pielonefritis) o de la celda perirrenal (flegmón) el dolor es inmediato y, como norma, intenso. Lo mismo ocurre en los casos de distensión brusca de las cavidades: cólico renal, hidronefrosis. Examen Renal http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Las masas renales sólo son visibles cuando alcanzan gran tamaño y abomban la región lumbar e hipocondrio y flanco. No es infrecuente que esto ocurra en el lactante y preescolar (tumor de Wilms e hidronefrosis). En los adultos, los grandes riñones poliquísticos pueden ser percibidos a simple vista. Antes de efectuar la palpación renal, es imprescindible efectuar la palpación del abdomen, lo que permite tener una información sobre la pared, hernias o eventraciones y otros procesos patológicos abdominales. Esto da confianza al enfermo y le permite relajarse. La palpación renal se hace con el paciente en decúbito dorsal, con la cabeza apoyada en una almohada y los brazos extendidos a lo largo del cuerpo. El paciente debe respirar tranquilamente y no hablar para no contraer la musculatura abdominal. Examen Vesical La inspección es una parte del examen clínico, que desgraciadamente es omitida con frecuencia. Orienta en los casos de persistencia del uraco, en el niño, donde fluye orina por el ombligo. Tanto en el niño como en el adulto con retención urinaria, la inspección permite reparar en aumentos de volumen circunscritos al hipogastrio (globo vesical). La palpación permite precisar la forma ovoidea de un globo vesical. Este puede ser biloculado, en los casos de grandes divertículos vesicales. La percusión permite delimitar matidez de límite superior convexo, no desplazable, propio del globo vesical. Cuando persiste la duda sobre el origen de una masa hipogástrica, es necesario efectuar cateterismo uretral y repetir el examen luego de extracción de orina: embarazo, mioma uterino, quiste ovárico, etc. Examen Genital Forma parte del examen físico general; a través de él se diagnostican precozmente lesiones locales: tumor testicular, cáncer de pene, etc., o bien, se reconocen alteraciones generales que hasta el momento no hayan dado otras manifestaciones: diabetes mellitus, tuberculosis. Debe ser efectuado siempre, cualquiera que sea la especialidad del médico. Su omisión lo hace responsable de las consecuencias que esta pueda acarrear. Examen de la Región Inguinal La inspección puede demostrar aumento de volumen, el que debe ser explorado palpatoriamente, a fin de precisar si corresponde a hernia inguinal, quiste del cordón, testículo ectópico, hidrocele, etc. En las hernias, el aumento de volumen se hace más notorio y se palpa pulsátil, cuando el paciente, en posición de pies, contrae bruscamente la prensa abdominal (se pide al paciente que tosa). Esto no ocurre en quistes del cordón, testículo ectópico, hidrocele, etc. El conducto inguinal tiene su orificio superficial a 1.5 cm por encima y lateral a la espina del pubis. El orificio profundo se encuentra a 1.5 cm por sobre el punto medio del ligamento inguinal de Poupart. Las masas ubicadas a nivel del orificio inguinal profundo, que el examinador puede delimitar palpatoriamente en su límites superior y laterales, con gran probabilidad no corresponden a hernias. Las hernias crurales, cuadros más frecuentes en la mujer, se palpan por debajo del ligamento de Poupart y pueden ser confundidas con un testículo ectópico o adenitis. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Examen del Escroto La inspección revela la presencia o ausencia del testículo en el escroto. La piel de esta zona se caracteriza por ser extraordinariamente elástica y contráctil, gracias a la presencia de un músculo bajo ella: Dartos. Puede presentarse retraída, a causa de frío o dolor, y laxa, por el calor, o como ocurre en el individuo senil. Es importante extenderla, de modo de examinar toda la superficie, donde se pueden ocultar procesos fistulosos o cicatrices entre los pliegues. No es infrecuente que el escroto sea asiento de quistes sebáceos, susceptibles de infectarse. Cuando existe un proceso inflamatorio subyacente, la piel pierde su elasticidad, los pliegues desaparecen y el edema la hace adoptar el aspecto característico de "piel de naranja", en la cual los poros se hacen muy evidentes. En los traumatismos uretrales y peneanos se producen equimosis escrotales por el deslizamiento al máximo decúbito de la hemorragia. El contenido escrotal está formado por: el testículo, el epidídimo y sus anexos, el conducto deferente y el cordón espermático. También deben considerarse las túnicas que envuelven al testículo y que pueden ser asiento de procesos patológicos. Ante la ausencia de un testículo en el escroto, debe investigarse acuciosamente su ubicación. El testículo termina de descender al escroto al fin del octavo mes de desarrollo intrauterino. Al nacer, un 3% de los niños tienen ausencia del testículo en el escroto. En el momento de la pubertad, un 1% de los adolescentes presentan la misma condición. La gran mayoría de los testículos ectópicos se localizan próximos al orificio inguinal superficial. Una vez reconocido por la palpación, se comprobará si es posible descenderlo al escroto, traccionándolo y empujándolo, a la vez, suavemente. Si el testículo desciende satisfactoriamente, se trata de un "testículo en ascensor", o retráctil, cuadro provocado por la contracción del cremáster y la laxitud del "gubernaculum testis", que permiten la migración del órgano fuera de la bolsa. Este cuadro es provocado por el temor al examen, el frío (manos del examinador) o esfuerzos físicos, y debe ser diferenciado de la verdadera ectopia, en que el testículo está permanentemente fuera del escroto. Ante esta segunda eventualidad, se investigará palpatoriamente la presencia del testículo en su trayecto normal, criptorquidia; o en zonas de ubicación anormal. Zonas de ectopia: Región inguinal. Región pubiana. Región perineal. Triángulo de Scarpa Si el testículo no es localizado mediante la palpación en las zonas ectópicas o en el trayecto de su descenso, conducto inguinal, debe tenerse presente que puede estar en la región lumbar, ilíaca o pelviana, inaccesible al examen físico, retroperitoneal; criptorquídea. El testículo ectópico y el criptorquídico son asiento de enfermedades con mayor frecuencia que el que ha descendido. Frecuentemente es hipotrófico y presenta degeneración maligna con mayor frecuencia que el testículo normal. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document El escroto puede estar distendido por hidrocele, esto es, aumento patológico del líquido contenido en la membrana vaginal que rodea al testículo. Es frecuente encontrarlo en los individuos de edad, de moderado volumen y baja tensión, por lo general idiopático. En individuos más jóvenes, generalmente es secundario a cuadros inflamatorios, puede alcanzar gran volumen y estar a tensión. En el niño recién nacido, el hidrocele es muy frecuente, bilateral, y desaparece espontáneamente dentro de los primeros meses. La inspección demuestra el aumento de volumen del hemiescroto afectado, que toma conformación esferoideal, regular e indolora a la palpación. Varicocele La piel del escroto puede presentar aumento de volumen mal delimitado, que la palpación identifica de carácter cordonal, blando y que desaparece o se desplaza con la presión digital. Esto corresponde a dilataciones varicosas de la venas del cordón espermático: varicocele. Puede ser de tamaño discreto y se lo evidencia colocando al paciente de pie durante algunos minutos. Característicamente, se observa en individuos jóvenes y al lado izquierdo (desembocadura de la vena espermática en la vena renal izquierda). Cuando aparece en forma aguda debe hacer sospechar la presencia de un hipernefroma, y es secundario a trombosis de causa tumoral de la vena renal. Testículo Para examinar el testículo se le fija suavemente, usando los dedos cuarto y tercero de ambas manos, que pinzan la piel del escroto. Así, mientras los índices y pulgares lo exploran, contribuyen también los dedos medios. La separación entre el testículo y el epidídimo está situada en posición lateral externa y algo posterior con respecto al testículo. En él puede distinguirse un abultamiento a nivel de su extremidad superior, que se conoce como cabeza del epidídimo. Lo sigue una porción de diámetro uniforme, que constituye el cuerpo del epidídimo, el que imperceptiblemente termina en la cola; o bien, esta última se presenta como un engrosamiento menor. Desde la cola del epidídimo nace el deferente, que asciende para tomar el conducto inguinal. La palpación del deferente es similar a un cable eléctrico de superficie lisa, firme e indolora, y se efectúa tomándolo entre el índice y pulgar. El examen del testículo se efectúa recorriendo su superficie con los tres dedos señalados de cada mano, en forma indicada más arriba. Así se obtiene una idea de su tamaño (hipotrofia o atrofia), de su consistencia, que debe ser firme y elástica, lisa y homogénea y de escasa sensibilidad. El desarrollo de una masa policíclica, dura, nodular, sin caracteres inflamatorios y que ocupa una parte o la totalidad de la glándula, debe hacer sospechar un tumor testicular. También puede palparse un nódulo en profundidad. Los tumores testiculares se caracterizan por ser pesados. Quizás sea este uno de los hechos que más orientan en su diagnóstico. El testículo puede presentar una disminución de la consistencia en los casos de hipotrofia y en el hombre anciano. El epidídimo puede ser asiento de inflamaciones agudas o traumáticas. Las primeras obligan a investigar infección urinaria, uretritis o prostatitis. La piel http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document del escroto se inflama, presentándose edematosa y enrojecida. El examen palpatorio debe hacerse con gran cautela, pues el epidídimo se torna extraordinariamente sensible. Es muy difícil poder diferenciar la masa epididimaria inflamada, del testículo. Es muy útil levantar suavemente el escroto, suspendiéndolo. Con esta maniobra se evita la tracción sobre el cordón espermático, y significa un alivio inmediato del dolor. El cuadro de epididimitis aguda puede ser indiferenciable del de torsión de cordón espermático, pero en este último la suspensión del escroto aumenta el dolor, ya que significa la elongación del cordón espermático que se encuentra acortado por el efecto de la torsión. Este es un caso en que el diagnóstico diferencial es semiológico. Si está bien y oportunamente hecho, hará la diferencia entre un testículo salvado o perdido. Las inflamaciones crónicas del epidídimo se caracterizan más bien por el aumento de volumen, generalmente lobulado, nodular, indoloro o discretamente sensible. Pueden ser de etiología inespecífica (infección urinaria), o bien, de etiología tuberculosa. Semiológicamente, pueden ser indiferenciables de un tumor testicular. Tanto las epididimitis agudas como las crónicas reagudizadas pueden evolucionar hacia la abscedación y fistulación. Las de etiología tuberculosa pueden ir también hacia la abscedación, pero en este caso no hay componente inflamatorio importante (absceso frío). Durante el examen del epidídimo es frecuente advertir junto a la cabeza una pequeña formación ovoidea de 2 a 3 mm de diámetro, unida ella por un pequeño pedículo más o menos diferenciable. Corresponde a la hidátide de Morgagni pediculada. Su torsión provoca en el niño un cuadro indiferenciable del de la torsión del cordón. La torsión crónica en el adulto provoca dolor y aumento de volumen palpable. A nivel de la cabeza del epidídimo pueden palparse formaciones quísticas que hacen cuerpo con el órgano. Son de dos orígenes: quistes de tipo seroso, o bien dilatación quística del conducto epididimario, espermatocele. La diferencia entre uno y otro no puede ser asegurada semiológicamente. Con alguna frecuencia, es posible palpar un cálculo de libre desplazamiento en la cavidad vaginal. Pene Durante el examen físico se lo encontrará normalmente en estado de flacidez. Puede, sin embargo, encontrarse en estado de erección patológica o priapismo. En estos casos, la inspección revela la erección de los cuerpos cavernosos, sin erección del glande. La inspección revela las anomalías de la uretra. Hipospadias en que existe desembocadura anormal de la uretra en la cara ventral del pene, generalmente próximo a la región balánica, pero también puede tener ubicación perineal; en estos casos, los niños deben orinar sentados. El defecto inverso es la epispadia, en que, por malformación en el desarrollo peneano, la uretra se abre sobre la cara dorsal del pene. Su grado máximo es la extrofia vesical, en que existe una falta de la cara anterior del abdomen y vejiga, con malformación del anillo óseo pelviano. La inspección, para que sea bien efectuada, debe incluir la retracción del prepucio, de modo de inspeccionar completamente el glande, la región balánica y el prepucio. Con posterioridad al examen se debe cuidar que el prepucio vuelva a su posición normal, por el riesgo de parafimosis. Al retraer el prepucio se descubrirán los casos de fimosis, diagnóstico que se efectúa al constatar la dificultad o incapacidad de descubrir el glande por estrechez del prepucio. En http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document los niños, la fimosis obedece a causas congénitas, y en el adulto se agregan, además, causas secundarias, como las balanopostitis a repetición, el uso de sonda a permanencia por períodos prolongados y la diabetes. Esta última puede ser descubierta a raíz de una consulta por fimosis adquirida. Se pueden encontrar también úlceras crónicas, indoloras, que son muy sospechosas de corresponder a cáncer del pene, el chancro luético, que se caracteriza por ser indoloroso, de bordes indurados, y se acompaña por una adenopatía inguinal satélite. Se pueden encontrar lesiones herpéticas, condilomas acuminados (virales) o planos (luéticos). Sirve para demostrar la existencia de secreción uretral, la brevedad del frenillo, que puede haber sufrido rupturas y cicatrización patológica, estrechez del meato uretral, etc. Los pacientes que son portadores de fimosis pueden vencer la estrechez del prepucio, con lo cual el anillo fimótico queda por detrás del glande, a nivel del surco balano-prepucial. Esto significa edema, que exacerba la dificultad para retornar el prepucio a su posición normal. El cuadro se autoperpetúa y puede llegar a la necrosis isquémica. En estos casos, la inspección revela el glande descubierto y erecto. El prepucio forma aumento de volumen edematoso por detrás del glande; este cuadro se conoce como parafimosis. La piel del prepucio pierde sus características de fineza y elasticidad por los procesos de balanopostitis a repetición, haciéndose acartonada, rígida y fibrosa (diabetes). Cuando se sospecha la presencia de uretritis o se desea tomar una muestra de la secreción uretral, conviene pedir al paciente que no orine hasta después de haberla tomado. Para esto, es útil hacer la expresión de la uretra deslizando los tres dedos medios, de una mano, por la cara inferior del pene desde el periné hacia adelante. El examen palpatorio de la región peneana puede revelar la presencia de placas de fibrosis sobre el dorso del pene generalmente próximo a su base y en la línea media. Es la enfermedad de la Peyronie. Uroscopia: Examen de la Orina Es una parte del examen físico extraordinariamente útil, que si se complementa con la inspección de la micción informará sobre innumerables hechos de importancia. Lo más práctico es efectuarlo al final del examen, cuando ya se ha establecido alguna confianza en el paciente. Se le proporciona un vaso de vidrio liso, transparente e incoloro. Se le solicitará que pase al baño o detrás de un biombo. Se le debe instruir de modo que avise en el momento en que comience a orinar, y así será posible observar y comprobar los caracteres de la micción, tal como se señalaron, a propósito de la anamnesis. En general, mientras más problemas de orden urológico tenga el paciente, menos inhibiciones tendrá para orinar, siempre que se respeten las condiciones señaladas más arriba. El examen al trasluz de la orina demuestra la presencia de turbidez, reconocible como piuria en algunos casos, hematuria macroscópica, filamentos en los casos de uretritis crónica, etc. Dada la gran subjetividad de la sintomatología que afecta a la micción, la uroscopia, examen simplísimo, puede aclarar una historia difícil o confirmar algunos hechos. Tacto Rectal http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Forma parte del examen físico general y tiene especial importancia en patología urogenital y proctológica. Se hace al final del examen físico, y el médico debe advertir al paciente en qué consiste y las razones que lo justifican. Debe ser hecho con la vejiga vacía, pues de lo contrario se alterará su interpretación. El examen será efectuado en privado o protegido por un biombo si se hace en la sala de hospitalización. Se realiza en alguna de las siguientes posiciones: posición genupectoral, que es muy cómoda para el examinador, ya que expone toda la región perianal. De este modo, se pueden reconocer: eritema y signos de grataje, fisura (grieta en las comisuras anales), orificios fistulosos perianales, procesos inflamatorios con aumento de volumen (abscesos perianales), hemorroides externos o prolapsados, prolapso rectal. Los procesos inflamatorios agudos y las fístulas pueden contraindicar el tacto rectal, por ser extraordinariamente doloroso. En las restantes posiciones, la inspección no puede ser realizada con la misma facilidad: paciente en decúbito lateral, con la extremidad superior flectada y la inferior extendida. Paciente en decúbito dorsal, con ambas extremidades inferiores semiflectadas, o bien, abrazadas sobre el pecho por el paciente. Esta posición tiene la ventaja de permitir el tacto bimanual, palpando con el dedo índice de una mano a través del recto y con la otra retropúbicamente, lo que permite palpar el lóbulo medio de la próstata. El tacto rectal, propiamente tal, se efectúa con el dedo índice protegido por el guante que debe estar convenientemente lubricado. Se presiona suavemente sobre el esfínter, de modo que el paciente se relaje, y suavemente se introduce, reconociendo si la ampolla rectal está vacía u ocupada (fecalomas), si existe infiltración de la mucosa rectal o estenosis de ella (cáncer rectal), cáncer vesical invasor, cáncer de próstata. Puede también palparse un tumor que protruya hacia el lumen rectal. Luego se palpa la cara anterior o ventral, donde puede reconocerse la próstata, que tiene el tamaño de una castaña, con el vértice que apunta hacia la uretra. Su consistencia es firme, pero elástica, y su examen no debe producir dolor. Se la puede delimitar en forma neta y la mucosa rectal se desliza fácilmente sobre ella. En los casos de adenoma prostático, su tamaño se valora en cuatro grados, según la protusión, apreciada en centímetros, que haga hacia el lumen rectal. Así, un adenoma prostático grado 1 protruye un centímetro hacia el recto, y un grado 3 lo hace tres centímetros. Debe tenerse presente que el tacto rectal informa solamente sobre el estado de los lóbulos laterales de la próstata y no lo hace sobre el lóbulo medio y el anterior. De modo que con un tacto rectal que demuestra un próstata aparentemente normal, puede existir un adenoma obstructivo o un cáncer no detectable. En los casos de cáncer prostático, la palpación demuestra que la glándula ha perdido sus límites netos, tiene una dureza pétrea y respeta la mucosa rectal, salvo en los casos muy avanzados en que puede estar comprometida. La palpación de una próstata que ha estado expuesta a procesos de prostatitis crónica puede ser indiferenciable de la del cáncer prostático. En condiciones normales, las vesículas seminales no se palpan, salvo cuando están en estado de repleción. En los casos de espermatocistitis puede doler en los ángulos superiores de la próstata. El examen prostático produce malestar e incomodidad, pero no es de suyo doloroso, salvo cuando existen procesos inflamatorios agudos: prostatitis aguda o abscesos prostáticos. En este último caso se puede palpar el abombamiento del fondo de saco rectal, e incluso fluctuación de la próstata abscedada. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Para terminar este tópico, traemos a reflexión que el médico será sometido a crítica y juicio por el paciente de acuerdo a la forma como procedió durante el examen rectal. Así, se puede crear desconfianza y miedo si el examen fue brusco e, incluso, rechazar terapéuticas que, aunque bien indicadas, se identifican con el temor producido por el tacto rectal. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionClinica.html[9/7/2009 3:10:16 PM] Untitled Document Radiología Simple Efectuada con una buena preparación: régimen pobre en alimentos flatulentos y con el uso de lavado intestinal o laxante, puede informar de varios hechos: la situación de los riñones a ambos lados de la columna con el eje mayor divergente hacia abajo. El contorno de los riñones a veces bien preciso y otras oculto parcialmente por gas y deposiciones del colon. La grasa perirrenal da el contraste necesario para ver masas de origen renal que deforman su contorno. La imagen de los psoas debe ser simétrica. El borramiento de una de ellas habla de un proceso inflamatorio perirrenal. También pueden encontrarse calcificaciones en relación a diferentes órganos del abdomen con gran frecuencia: "flebolitos", que son trombos calcificados en venas pelvianas, visibles como formaciones esferoidales muy regulares y con el centro menos denso. Generalmente se ubican en posición más externa que el trayecto del uréter de ese nivel. Los cálculos de la vesícula biliar se calcifican con mucho menor frecuencia que los cálculos urinarios. Cuando lo hacen generalmente son laminados y polifacetados y múltiples. Los cálculos urinarios varían entre el coraliforme total calcificado y el de un cáliz o cálices moldeados con su aspecto característico. Los cálculos en la pelvis y uréter son suficientemente radiopacos como para verse en una buena placa simple de abdomen en el 90% de los casos. También es posible apreciar calcificaciones de ganglios mesentéricos, páncreas, aorta y arterias ilíacas y aneurismas de la aorta. En el área renal pueden encontrarse calcificaciones de adenocarcinoma renal. En el hígado pueden haber calcificaciones de un quiste hidatídico; con alguna frecuencia se delinean calcificaciones de arterias viscerales: renales, esplénicas, celíacas, etc., pudiendo reconocerse aneurismas calcificados. Urografía Intravenosa o de Eliminación La placa de abdomen simple o renal simple constituye la primera etapa de una urografía intravenosa. Este examen junto a la ecotomografía constituye uno de los primeros pasos en el estudio de patologías renales. Se utiliza la inyección intravenosa de un medio de contraste yodado no ionizable que se excreta casi por completo por filtración glomerular. Al minuto de la inyección ya hay suficiente medio de contraste para dar una imagen de impregnación parenquimatosa conocida como nefrograma, que permite observar la forma y tamaño de los riñones. El eje mayor del riñón mide 3,7 veces la altura del cuerpo de la segunda vértebra lumbar del paciente. A continuación se observarán cálices, pelvis, uréter y vejiga, ya desde algunos minutos luego de la inyección hasta veinte a treinta minutos de ella. Después de este tiempo las imágenes se hacen cada vez más débiles y comienza a contrastarse la vejiga. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionAparatoGenito.html[9/7/2009 3:10:33 PM] Untitled Document La densidad del medio de contraste en el sistema colector disminuye si hay obstrucción ureteral; también habrá un retardo en la aparición de suficiente contraste y se deberán tomar placas más tardías. Esto significa que el urograma intravenoso (U.I.V.) debe ser controlado por el radiólogo, quien indicará el momento de obtener nuevas placas conforme el desarrollo de cada examen. Los medios yodados intravenosos pueden agravar una insuficiencia renal y en este caso se cambiará la U.I.V. por TAC sin contraste o U.P.R. En los niños la presencia de infección urinaria comprobada con pus en la orina deberá ser estudiada siempre con U.I.V. y cistografía de relleno (colocando el medio de contraste en vejiga con un catéter y llenando la vejiga), para determinar la existencia de una obstrucción congénita o reflujo vesicoureteral. Ureteropielografía Retrógrada En otras ocasiones se utilizará la uretero- pielografía retrógada (U.P.R.), en la cual a través de una cistoscopia se cateteriza el uréter y se inyecta el medio de contraste en la vía urinaria. Su indicación es para conocer bien la anatomía del uréter y pelvis renal insuficientemente contrastados en la U.I.V. Habitualmente se la efectúa como procedimiento preoperatorio inmediato en la sala de operaciones, bajo anestesia, con lo cual se evitan las molestias al paciente y se obtiene un buen diagnóstico morfológico. Pielografía Directa o Anterógrada También se puede recurrir a la pielografía anterógrada inyectando el medio de contraste en la pelvis por punción. Estos procedimientos se utilizan cuando no es posible obtener representación del sistema colector por la inyección intravenosa. También pueden tener su indicación cuando hay intolerancia o reacciones adversas al medio de contraste intravenoso; especialmente válida es la U.P.R. en estos casos. En ausencia de representación de un riñón se debe usar la ecotomografía para obtener la información renal necesaria. Ecotomografía Se basa en la emisión de un rayo de ondas ultrasónicas que son transmitidas por tejidos sonolúcidos. Una parte del rayo de ondas es reflejado hacia atrás cuando se encuentra con una interfase dada por un tejido o estructura de diferentes características acústicas. El tiempo que demora en volver este eco localiza la distancia de la interfase que lo refleja. El resto del rayo emitido continúa pasando diferentes interfases hasta que finalmente es absorbido por completo. Cuando el rayo ultrasónico encuentra una estructura rellena de líquido pasa de largo y se refleja en la pared opuesta (quistes). La onda ultrasónica es bien transmitida a través de cualquier fluido, pero no es transmitida por el hueso, aire y bario. El rayo ultrasónico es producido en pulsos con intervalos de silencio que se usan para que el mismo aparato capte los ecos. Los ecos son convertidos electrónicamente en una imagen visual en un monitor. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionAparatoGenito.html[9/7/2009 3:10:33 PM] Untitled Document La ecotomografía requiere de transductores de sensibilidad apropiada que se apoyan sobre la piel cubierta con un gel que elimina el aire. Es un método "operador dependiente" ya que va íntimamente asociado a la habilidad e imaginación de la persona que lo ejecuta. Es inocuo y no invasor y no requiere de medios de contraste. Su principal limitación está dada por la abundancia de tejidos grasos en personas obesas. Visualiza muy bien los órganos sólidos intraabdominales: hígado, riñones, bazo, adrenales. Es la mejor forma de diagnosticar la patología biliar litiásica. Visualiza las cavidades renales y puede usarse para seguir el uréter y muchas veces visualiza un cálculo en la vía urinaria. Sin embargo la presencia de gas, como el meteorismo en el cólico renal, limita su utilización. Cuando se examina la pelvis se recurre a la distensión vesical con la orina, que rechaza asas intestinales y actúa como interfase con otros órganos como la próstata que puede ser muy bien estudiada en sus diferentes diámetros, permitiendo valorar su volumen, como también la evacuación vesical a través del residuo postmiccional. La ecotomografía se puede aplicar al estudio de la próstata usando un transductor transrectal, que permite valorar la densidad ultrasónica de la próstata y situar biopsias prostáticas a voluntad incluso en zonas no identificables en otra forma, zona de transición. La ecotomografía es el gran método para estudiar las masas testiculares ya que diferencia el líquido (hidrocele y quistes) de lo sólido, tumores testiculares. También es capaz de delinear la existencia de una red de vasos venosos propia del varicocele. Permite el diagnóstico preciso de los traumatismos testiculares, en cuanto diferencia las rupturas de albugínea de tratamiento quirúrgico urgente de otros que serán de tratamiento médico o quirúrgico diferido. La Uretrocistografía Retrógrada y Miccional La vejiga se opacifica y representa en el curso de la urografía intravenosa. Así se pueden demostrar defectos de llenamientos producidos por cáncer vesical, crecimiento prostático, cálculos, etc. Sin embargo, muchas veces es necesario estudiar la uretra y su relación con la vejiga, lo que se consigue inyectando medio de contraste a través de la uretra (uretrocistografía retrógrada) y viendo su paso a la vejiga. Examen utilísimo y prioritario en el estudio de los traumatismos pelvianos y del paciente politraumatizado con uretrorragia, para reconocer las rupturas uretrales y/o de la vejiga. La presencia de extravasación del medio de contraste dará el diagnóstico de ruptura uretral completa o incompleta y también informará de posibles rupturas vesicales. La repleción vesical permite estudiar la existencia de reflujo vesicoureteral valorado de grado I a V según su extensión. También una vez obtenida la repleción vesical se pasa a tomar placas de vaciamiento, lo que puede completar muy bien la situación de la vejiga y uretra, descubriendo patología obstructiva por crecimiento prostático, estrechez uretral, presencia de divertículos que no se vacían, reflujo de alta presión, etc. Tomografía Computada (TC) http://escuela.med.puc.cl/publ/manualUrologia/ExploracionAparatoGenito.html[9/7/2009 3:10:33 PM] Untitled Document Debe tenerse presente que la mayoría de las veces la TC será un procedimiento complementario de clarificación para problemas específicos y no el primer examen a efectuar. Usualmente se utiliza la posición de decúbito dorsal, por comodidad por el paciente, pero también puede ser efectuado en decúbito ventral o laterales. La TC heliocoidal con nuevos aparatos permite que el examen sea rápido. Al igual que todos los exámenes en que se usa una radiación ionizante, no deben hacerse durante el embarazo. En estos casos la utilización de la ecotomografía es el procedimiento de elección. Para el caso del estudio gastrointestinal se utiliza medio de contraste oral. Para el aparato urinario, medio de contraste hidrosoluble intravenoso que contraste los territorios irrigados por arterias, capilares, fase nefrográfica y finalmente venas. Los medios de contraste que se eliminan por filtración glomerular enriquecen la vía urinaria y muestran su ubicación, trastornos, desplazamientos por estructuras vecinas, etc. La TAC abdominal se efectúa transaxialmente con cortes cada 1 ó 2 cm. En cada caso el radiólogo determinará la conveniencia de hacer cortes más seguidos. Al examinar una TAC debe recordarse que el observador mira desde los pies del paciente, por lo cual el hígado aparece situado a la izquierda del observador y del mismo modo todos los otros puntos de reparo. Mientras más obeso es el paciente mejor contraste de interfase proporciona el tejido graso. En enfermos muy delgados o emaciados puede haber problemas de delimitación de órganos. La TC obtiene una excelente representación de adrenales, retroperitoneo con los grandes vasos, glanglios periaórticos, páncreas, hígado, bazo, riñones, etc. Además puede centrarse la atención en la vía urinaria efectuando la llamada Pielo TAC. Los cortes transaxiales deben ser reconstruidos mentalmente por el observador para obtener una interpretación longitudinal. Las reconstrucciones verticales gráficas no tienen la definición ni el valor de las imágenes transaxiales. Es aquí donde se produce una complementación entre TC y ecotomografía. Resonancia Nuclear Magnética En urología no tiene mejores resultados que la TAC. Puede ayudar en definir algunas imágenes del retroperitoneo. Cintigrafía El uso de medios de contraste marcados con un elemento radiactivo pesquisable por un contador Geiger especializado tiene gran aplicación, midiendo comparativamente la fase de perfusión, concentración y excreción del riñón, lo que permite valorar funcionalidad. Usando marcadores específicos como monoyododibencilguanidina (MBI) se obtiene representación del tejido medular suprarrenal de mucho valor en tumores adrenales, feocromocitoma o extradrenales, paragangliomas y sus metástasis. A nivel óseo, el tecnesio, marcador afín al hueso, se capta donde hay actividad ósea importante; así se detectan las metástasis osteogénicas del cáncer http://escuela.med.puc.cl/publ/manualUrologia/ExploracionAparatoGenito.html[9/7/2009 3:10:33 PM] Untitled Document prostático, pero también fenómenos inflamatorios o reparativos. Este examen es de gran valor para etapificar los estadios avanzados D2 con compromiso óseo del cáncer prostático. Arteriografías Se efectuaron por punción femoral inyectando a gran presión medio de contraste yodado de alta concentración. Su carácter invasor hace que hoy día no se utilice, salvo excepciones. En cambio se usa la arteriografía por sustracción con medio de contraste vía intravenosa, que permite estudiar la anatomía vascular renal en detalle. La unión de cintigrafía y arteriografía a nivel pulmonar permite diagnosticar embolia pulmonar. La falta de captación del marcador radiactivo en un segmento del pulmón es muy fuerte sospecha de embolia, comprobable y tratable con la arteriografía pulmonar que permite colocar urokinasa que digiere el coágulo repermeabilizando el vaso. Cavografía y Eco-Doppler Los grandes vasos venosos: femorales, ilíacos y cava pueden ser estudiados con la combinación Eco-Doppler, exploración ultrasónica y la cavografía que inyecta medio de contraste radiopaco en la cava, vía ilíaca. Endoscopia La vía urinaria puede ser explorada bajo visión directa a través de la uretra. Las endoscopias modernas se basan en transmitir la luz por fibras ópticas desde una fuente externa. Opticas de gran resolución permiten visualizar diferentes segmentos de la vía urinaria. Hay endoscopios rígidos y flexibles. Cada uno presenta ventajas y limitaciones. Según su uso se llaman ureteroscopio, cistoscopio, ureterorrenoscopio, etc. Son instrumentos valiosísimos para el urólogo, pues dan la mejor exploración posible para segmentos como la uretra, próstata y la vejiga, uréter y aparato pielocaliciliar. Para ello se utilizan instrumentos de calibre adecuado desde 8-9 Charrière o F. (3 mm) hasta 24 Charrière o F. (8 mm). Estos endoscopios pueden tener un canal operatorio por el cual se pasa una pinza para extraer un cálculo o tomar biopsia, un litotritor electrohidráulico o ultrasónico, un cepillo para obtener citología u otros. También permiten colocar catéteres para U.P.R. o para drenaje reno-ureterovesical. Estos procedimientos endoscópicos son efectuados algunos con anestesia especial y control radioscópico y otros con anestesia local en forma ambulatoria. Se requiere de algunas condiciones generales como: compatibilidad del calibre uretral y el endoscopio, distensibilidad de la vía urinaria y vejiga, lo que se consigue instilando solución fisiológica y un medio óptico transparente, lo que significa limitación de estos procedimientos cuando hay hematuria importante. La exploración mediante catéteres de la uretra permite valorar su calibre y proceder a dilatación de zonas estenóticas cuando es necesario. Para ello hay http://escuela.med.puc.cl/publ/manualUrologia/ExploracionAparatoGenito.html[9/7/2009 3:10:33 PM] Untitled Document una amplia gama de catéteres de diferentes calibres y formas que permiten reconocer al tacto indirecto una obstrucción y salvarla. Estos procedimientos se efectúan con anestesia local para contar con la colaboración y guía del paciente. Por último, el gran método para confirmar la sospecha de diagnóstico de cáncer prostático es la biopsia seriada transrectal. En ella se complementan la ultrasonografía transrectal y el tacto digital que guían la aguja a zonas específicas y situando las muestras de modo que tengan el máximo de representatividad. Flujometría Urinaria Examen no invasor, simple, que cuando se instruye bien al paciente permite valorar la existencia de uropatía obstructiva a través de la medición de flujo urinario en ml por segundo. Laboratorio y Otros Procedimientos Especializados Constituyen un valiosísimo aporte al estudio, diagnóstico y control del paciente urológico. Todos los exámenes pueden ser muy importantes según el caso. Deben destacarse el examen de orina químico y microscópico, la creatininemia y el clearance de creatinina, la citología urinaria, el espermiograma, la anatomía patológica de biopsias y piezas quirúrgicas, etc. http://escuela.med.puc.cl/publ/manualUrologia/ExploracionAparatoGenito.html[9/7/2009 3:10:33 PM] Untitled Document Introducción Las malformaciones congénitas del aparato genitourinario son las más frecuentes en el ser humano. Si bien se producen durante la vida intrauterina, muchas de ellas no se expresan hasta la vida adulta o son ignoradas por completo. Se conoce su existencia cuando por la gravedad o magnitud comprometen la vida o cuando se complican de infección, litiasis, hematuria o deterioro de la función renal; esto puede ocurrir en cualquier etapa de la vida. Muchas de ellas no tienen tratamiento o sólo puede buscarse el alivio sintomático, pero otras pueden ser corregidas si se las busca y diagnostica en el período antenatal, neonatal, en la infancia, juventud y en el adulto. Para ello es fundamental conocerlas ya que los medios de diagnóstico por imágenes actuales permiten una exploración precisa en la mayoría de los casos. Agenesia Figura 1: Ectopia renal cruzada. La agenesia renal bilateral es incompatible con la vida extrauterina. Los riñones aparecen en la 5ª semana, de modo que su ausencia se debería a una falla ocurrida a esas alturas del desarrollo. Para Potter se daría en 1 de 4.800 nacidos, para Campbell 1 de 2.500 autopsias con predominio masculino 3 a 1. La agenesia unilateral es muy difícil de determinar al ser perfectamente compatible con la vida (monorreno congénito) y se debe considerar en el politraumatizado constatando la existencia de otro riñón antes de efectuar nefrectomía. Se estima en 1 de cada 1.000 nacimientos y en 1 de cada 1.500 urografías intravenosas, Lang y Thomson. También hay predominio masculino 2 a 1. Anomalías de Posición y Forma Figura 2: Riñón pélvico. Ectopia renal, con posición abdominal baja permanente, a diferencia de la ptosis que es el descenso renal por laxitud de su medio de fijación y longitud de su pedículo. Las posiciones ectópicas ilíaca y pelviana tienen importancia al detectarse como masa abdominal palpable y por ser causa de distocia pelviana en la mujer embarazada. Situación enteramente similar a lo que ocurre luego del trasplante renal. En algunas raras ocasiones la posición de un riñón puede ser intratorácico que, siendo normal, es un hallazgo de radiografía de tórax. También el esbozo renal y ureteral puede cruzarse de la línea media durante el desarrollo embriológico, dando lugar a ectopias renales cruzadas en que el riñón se encuentra en el lado contralateral, pero el uréter cruza la línea media y desemboca en el hemitrígono correcto. Asociado a una ectopia renal cruzada, se pueden dar anomalías de fusión http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document variadas: en L, en torta, en disco, etc., que no tienen mayor trascendencia, salvo el hallazgo palpatorio, dilucidado por los medios de imagen. Una forma especial de fusión es el riñón en herradura, en que ambos riñones están unidos por un istmo por delante de la aorta. La vascularización del riñón en herradura se hace por múltiples ramas provenientes de la aorta. Hacia los polos inferiores unidos por el istmo existe un cáliz supernumerario, a cada lado habitualmente mal drenado por posición alta de la unión pieloureteral. Puede complicarse de hidronefrosis, litiasis e infección, en todas ellas interviene el mal vaciamiento de la pelvis renal. De no haber complicaciones, no requiere tratamiento. Su frecuencia sería de 1:5.000 individuos. Figura 3: Riñón en torta Como hallazgo de los medios de imágenes con alguna frecuencia puede observarse lobulación renal que es un resto del desarrollo, sin significado; hallazgo de medios de imagen a considerar en el diagnóstico diferencial de tumor y de pirámide supernumeraria. Displasia e Hipoplasia renal En ellas hay una zona renal limitada o difusa de todo el riñón, en que no se produjo la diferenciación metanéfrica y persisten estructuras del riñón primitivo. Su diagnóstico es histológico al encontrar epitelio columnar y tejido fibromuscular que recuerda al conducto de Wolf y gran desorden arquitectural. Se produciría por algún factor que afecta el desarrollo entre la 8ª y 10ª semana y según diferentes autores tendría un origen vascular o de obstrucción del brote ureteral. Figura 4: Riñón en herradura Según sea la gravedad de la malformación puede ser un riñón aplásico que no es funcionante, por lo cual si es bilateral, incompatible con la vida. Una forma es el riñón multicístico (Potter). También puede adoptar la forma de displasia focal o segmentaria con función renal de zonas sanas, asociada a trisomía D y E. En los casos de displasia parcial, generalmente del polo superior, se asocia siempre a duplicidad ureteral, hecho importante, por ser la enfermedad local corregible al eliminar el tejido displásico y su vía urinaria. La displasia cortical quística (Potter IV) aparece cuando hay uropatía obstructiva baja, ya en la vida intrauterina: válvulas uretrales. Se trata de quistes subcapsulares formados a partir de los espacios de Bowmann, con cavidades renales normales o dilatadas; se asocia a oligohidramnios. Algunos creen posible la recuperabilidad en el caso de desobstrucción precoz. Riñón Poliquístico Infantil Figura 5: Riñón Poliquístico El riñón poliquístico infantil (Potter I) sería un caso de gigantismo tubular conectado a la vía urinaria; en forma casi constante se asocia a quistes hepáticos y más infrecuente a quistes del pulmón y páncreas. Tiene un origen http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document Infantil autosómico recesivo. Se asocia a hipertensión arterial y su evolución es al deterioro progresivo de la función renal. Tratamiento dirigido al control de la hipertensión, infección e insuficiencia renal. Riñón Poliquístico del Adulto Riñón Poliquístico del Adulto La forma adulta del riñón poliquístico (Potter III) es una enfermedad autosómica dominante. Habría una falta de unión entre el metanefros y las yemas ureterales; también se lo atribuye a una falta de involución de los nefrones primitivos y formación de quistes. Se asocia a quistes hepáticos 56%, pancreáticos 10%, bazo, tiroides y ovario. En un 15% hay aneurismas de las arterias cerebrales. En un 96% son bilaterales aunque generalmente asimétricos. La sintomatología más frecuente es el dolor sordo y aumento de volumen renal; puede acompañarse de hematuria por rotura quística a la vía urinaria. En un 50% hay hipertensión arterial y puede presentar infección y litiasis. El curso es benigno y en general la insuficiencia renal se presenta hacia los 50 años de edad. En casos juveniles hacia los 10 años. Se puede manifestar asociado a fibrosis hepática portal que comanda el cuadro. Quistes Renales Simples Diferentes son los quistes renales simples o de retención que se encuentran con frecuencia en el adulto como hallazgo de medios de imagen. Pueden ser únicos o múltiples, a veces multiloculados, sin comunicación a la vía urinaria y sin parénquima renal en los tabiques. Excepcionalmente dan síntomas como hematuria, dolor o masa palpable y esto sólo cuando son muy grandes. En la medida que sean uniloculares y asintomáticos su tratamiento es el simple control ecográfico. El tratamiento quirúrgico se indica en aquellos quistes con imagen multilocular sospechosa de coexistir con carcinoma, y para los muy grandes y sintomáticos, en que se reseca la calota del quiste. Su crecimiento lento produce atrofia renal. Quistes Renal Simples Riñón en Esponja En estos casos lo esencial es la ectasia y dilatación de los tubos colectores de las pirámides renales, se le conoce como enfermedad de Cacci-Ricci. Habitualmente se encuentra en adultos a raíz de una U.I.V, con una imagen característica en pincel en los cálices, que son quistes y dilataciones de los túbulos colectores de Bellini próximos al fornix calciliar. Con frecuencia hay microlitiasis múltiple de calcio (apatita) que suele desprenderse al cáliz produciendo cólicos renales a repetición. A veces se asocia a acidosis tubular leve y también pueden infectarse. El tratamiento será sintomático por lo general y quirúrgico en casos muy focalizados de litiasis o infección. Estenosis Pieloureteral- Hidronefrosis Figura 8: Estenosis ureteropiélica congénita. Es una malformación relativamente frecuente. Puede diagnosticarse ya en la vida intrauterina y un cierto número importante de casos se reconocen en el período neonatal o en el primer año de vida. Sin embargo, como muchas otras malformaciones, puede mantenerse asintomática u oligosintomática y aparecer en cualquier edad. Es algo más http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document frecuente en hombres que en mujeres y tiene una predominancia leve por el riñón izquierdo. Entre un 5% y un 20% puede ser bilateral. La obstrucción a nivel pieloureteral condiciona una hiperpresión y dificultad de vaciamiento piélico que se traduce en mayor o menor dilatación de cálices y pelvis y atrofia del parénquima renal variable. Las causas pueden agruparse en: Figura 9: Vaso aberrante. a) Intrínsecas: Derivadas de que el uréter en su desarrollo pasaría por una fase sólida, con posterior recanalización, que en este caso sería fallida. También puede existir una mala arquitectura de las fibras musculares lisas que tienen una disposición circular en vez de helicoidal, con lo que la propulsión del bolo urinario es fallido. Puede haber hipoplasia del músculo liso y reemplazo por tejido fibroso, con igual falla del peristaltismo. En algunos casos se puede reconocer un mecanismo valvular por pliegues e hipertrofia de la mucosa. b) Extrínsecas: La presencia de vasos aberrantes o vasos polares que cruzan la unión pieloureteral por detrás son responsables de una compresión que al igual que las bandas fibrosas angulan la unión. Pueden sumarse a factores intrínsecos. Figura: Estenosis pielouretral. c) Funcionales: Con frecuencia en el acto quirúrgico y en el estudio patológico no se encuentra una causa que explique la hidronefrosis. Todo apunta a un factor funcional sin una base anatómica manifiesta. La sintomatología difiere según edad: en el lactante se puede descubrir por la palpación de una masa abdominal. En niños mayores y adultos por dolor sordo, náuseas y vómito. Rara vez como cólico nefrítico; en algunos casos la infección urinaria con o sin fiebre descubre el cuadro; también puede presentarse hematuria monosintomática. La litiasis piélica es una asociación frecuente. La hipertensión arterial es rara. La exploración pasa hoy día por la ecotomografía abdominal, por su carácter inocuo y no invasor; en la vida intrauterina y a partir de la 22ª semana el acierto diagnóstico es de 95%. La U.I.V. es el examen de elección, que en muchos casos debe ser complementado con U.P.R., sea por el mal contraste renal y/o para conocer en detalle la unión pieloureteral y el uréter en toda su extensión, pues puede asociarse a patología del uréter y unión uretrovesical. Figura 11: Duplicidad uretral completa El tratamiento consiste en extirpar el segmento pieloureteral y restablecer un buen paso urinario sin hiperpresión. Debe intentarse aun en casos de función renal de 15% en ese riñón. Con un buen riñón contralateral y una función mala, especialmente en personas mayores, la indicación puede ser nefrectomía. Reparación Quirúrgica El resultado de la operación debe ser valorado al mes con urocultivo, a los tres meses repetido junto a U.I.V. que valora el pasaje del medio de contraste por la unión pieloureteral. Debe tenerse presente que las imágenes de la U.I.V. pueden ser muy parecidas a las preoperatorias y que demoran entre 1 y 2 años en mejorar. La función renal se puede valorar con el renograma radioisotópico. Los criterios de mejoría serán: mejoría de la función renal, buen vaciamiento piélico, ausencia de dolor, ausencia de infección. Estos criterios se cumplen en el 85 a 90% de los casos. El fracaso debe hacer seguir el caso y plantear una http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document reintervención precoz o nefrectomía. Figura 12: Duplicidad uréter ectópico Figura 13: Debilidad de pared vesical Debe tenerse presente que hay casos de hidronefrosis intermitente en que la crisis de dolor orienta a ese diagnóstico. Pueden hacerse evidentes haciendo U.I.V. con una sobrecarga de agua por vía intravenosa y uso de diurético. La existencia de una estenosis infundíbulo caliciliar leve da hidrocalectasia, con iguales manifestaciones y consecuencias en forma localizada. El tratamiento puede ser conservador o de resección, según el caso, del segmento comprometido. La cirugía conservadora rara vez puede plantearse, dado el carácter intrarrenal de la lesión. Malformaciones Ureterales La duplicidad ureteral incompleta o en Y en autopsias es de 0,2% la completa y 0,4% la incompleta. En la urografía intravenosa se encuentra entre un 1 y 3% de los exámenes urográficos intravenosos. El riñón propiamente tal es uno solo. El uréter superior drena el cáliz superior sin que haya una pelvis propiamente tal. El uréter inferior drena la pelvis a la cual confluyen los cálices medios e inferiores. El uréter terminal es normal por lo general, pero puede tener las mismas anomalías que cualquier uréter. Existe la posibilidad de reflujo ureteroureteral, es decir de un sistema al otro, en especial si hubiera infección, que debe ser bien establecida y tratada. De persistir el problema podría eliminarse el segmento renoureteral afectado. En la gran mayoría de los casos esta duplicidad incompleta no representa problema y no requiere ningún tratamiento. Figura 14: Ureterocelehidronefrosis La duplicidad ureteral completa significa desembocaduras ureterales en vejiga independientes. En este caso se encuentra que un 50% presenta reflujo del sistema inferior, con más frecuencia, un 13% ureterocele. Además puede presentarse estenosis pieloureteral (sistema inferior) y megauréter sistema superior. El uréter que drena el sistema superior desemboca en el trígono en posición más caudal. El uréter que drena el sistema inferior desemboca en el trígono en posición más cefálica. Todo ello es producto de la reabsorción del conducto de Wolff por el alantoides. El tratamiento es el mismo que cuando cualquiera de las patologías ureterales que veremos a continuación se presenta en un uréter único. Uréter Ectópico Figura 15: Megauréter El uréter puede desembocar en forma ectópica en un 7%, ya sea en trígono o cuello vesical, pero también en uretra posterior, conducto eyaculador y vesícula http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document congénito. seminal y deferente en el hombre y en uretra, vagina, cuello uterino y útero en la mujer. En todos los casos en que la desembocadura ureteral es distal al esfínter habrá escape urinario permanente e independiente de posición y esfuerzos; como no hay participación del esfínter se trata de una pseudoincontinencia Ureterocele: Es una dilatación quística del segmento de uréter terminal que queda obstruida por un defecto en la reabsorción de membranas. Figura 16: Extrofia vesical Hay formas adultas en las que el ureterocele no produce dilatación del uréter. En cambio en formas infantiles en que el ureterocele es de base ancha puede dar lugar a megauréter secundario e hidronefrosis. Cuando el ureterocele es muy grande puede prolapsarse al cuello vesical y ser causa de uropatía obstructiva. La U.I.V. mostrará muy bien el ureterocele con la imagen quística en cabeza de cobra, característica. En los casos de ureterocele con duplicidad ureteral e hidronefrosis puede ser necesaria la nefroureterectomía del segmento enfermo y reimplante del uréter sano. Los ureteroceles únicos que se resecan abriéndose por vía endoscópica son reluyentes, por ello no soy partidario del tratamiento endoscópico de simple apertura, salvo excepcionalmente, sino del reimplante ureteral en vejiga. Figura 17: Epispadia Megauréter Debe distinguirse del hidrouréter o uréter dilatado. Por megauréter se entiende a una dilatación parcial o total del uréter debida a mal funcionamiento de su segmento terminal; en él hay una zona que no se relaja e impide el flujo normal de la orina a la vejiga. El cuadro se debe a una falla en el desarrollo de las fibras musculares de orientación longitudinal del uréter terminal, por el contrario el desarrollo de fibras musculares circulares sería anormal. También se agrega un aumento del tejido fibroso. En síntesis, se trata de un segmento del uréter terminal que no conduce las ondas peristálticas, produciendo ureterectasia por arriba de ella, con elongación y acodaduras y dolicomegauréter. El megauréter puede asociarse a estenosis pieloureteral, reflujo vesicoureteral del lado opuesto, etc. La sintomatología deriva de la infección urinaria que complica el cuadro obstructivo. En dos tercios de los casos se diagnostica en la infancia. Puede ser bilateral 25-30%. Figura 18: Hipospadia escrotal. También en adolescente y adulto. Es un número variable, 10-15% es hallazgo de examen en U.I.V. y asintomático. Malformaciones Vesicales y Uretrales Son infrecuentes y debe tenerse presente que existe una variedad amplia que sólo mencionaremos: Duplicidad vesical, con un uréter en cada vejiga. Tabiques completos e incompletos. Vejiga en reloj de arena. También la persistencia del uraco puede dar origen a divertículos, quiste y fístula de origen uracal. En todos ellos se sitúan a nivel de la cúpula de la vejiga y llegan al ombligo. Todas estas anomalías tienen en común la falta de obliteración del uraco. http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document Figura 19: Hipospadia. Figura 20: Válvulas uretrales Cada 40.000 nacimientos y en proporción de 3 mujeres para un hombre se presenta la extrofia vesical, en que la vejiga y uretra están totalmente abiertas y fusionadas con la piel de la pared abdominal anterior, que compromete también a la pelvis ósea que presenta falta de fusión del pubis a nivel de la sínfisis. Puede haber otras malformaciones asociadas de genitales, imperforación anal, espina bífida y duplicación uterina. Existe falta de esfínter vesical. La corrección de esta malformación es un desafío muy complejo y hay diferentes pasos a cumplir. La uretra masculina es también asiento de fallas en el desarrollo: epispadias en que falta el techo de la uretra y tiene un origen similar a la extrofia vesical, menor en su magnitud. Hipospadia mucho más frecuente, en la cual la uretra desemboca en la cara ventral a diferentes niveles: perineal, escrotal, Figura 21: formas de fimosis penescrotal, mesopeneano, siendo las más frecuentes las subcoronales y del glande. En todas ellas el meato uretral está insinuado y ciego. El meato hipospádico es estenótico y entre él y el glande hay una cuerda que dobla el pene con incurvación ventral. El niño debe orinar sentado en las formas más acentuadas, por ello es necesaria la corrección del defecto antes de la edad escolar. La hipospadia no corregida puede ser causa de infertilidad. El tratamiento es quirúrgico y busca corregir la incurvación del pene y llevar la uretra hasta lo más próximo al glande, para lo cual se usan diferentes técnicas de cirugía plástica que utilizan piel o mucosas para formar la neouretra. Muchas veces se requiere de varios tiempos operatorios. Figura 22: Ubicaciones del testículo ectópico La uretra puede ser asiento de válvulas que son repliegues semilunares o diafragmáticos que obstruyen el paso de la orina generando hiperpresión sobre vejiga, uréter y riñón. Con frecuencia ignoradas y se complican de infección y grave daño renal. Hoy día el tratamiento de elección es la resección endoscópica del velo valvular, debiendo explorarse la uretra en previsión de otras lesiones. La existencia de complicaciones como infección y hidroureteronefrosis implica el tratamiento de estas condiciones, lo que a veces obliga a derivación urinaria compleja y prolongada para la recuperación de la función. La uretra femenina puede ser asiento de múltiples malformaciones existiendo: divertículos, quistes parauretrales, desembocadura de uretra y vagina común en un seno urogenital, etc. Malformaciones Peneanas Figura 23: Ubicación de testículo criptorquídico De ellas la más frecuente es la fimosis, definida como la dificultad o imposibilidad de retraer el prepucio por detrás del glande. Al nacer, existen adherencias balanoprepuciales que impiden la retracción del prepucio. En la gran mayoría de los niños éstas se reabsorben a los 2 años de edad (90%). En la pubertad no más de un 1% tiene una verdadera fimosis. Esta puede ser http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document puntiforme, entonces la micción se hace hacia una bolsa prepucial que se vacía por un orificio muy fino. Suele haber episodios inflamatorios y también puede ser causa de infección urinaria. La corrección es mediante circuncisión temprana. También existe una forma anular que no dificulta la micción pero puede ser asiento de parafimosis, por maniobras de autoexploración genital del niño, al retraer un anillo fimótico apretado. Se produce edema que tiende a agravarse y la compresión vascular puede producir gangrena del glande. En etapa aguda debe reducirse manualmente el anillo fimótico, lo que generalmente es factible; en alguna ocasión es necesaria una incisión dorsal, que permite reducir el prepucio, seguida de circuncisión mediata. La corrección de la fimosis anular debe ser hecha en edad temprana, idealmente alrededor de los cuatro años de edad y ciertamente antes de la pubertad, para evitar la parafimosis. El pene puede ser asiento de otras patologías: incurvaciones, que se perciben en la erección y generan gran angustia. Su corrección es quirúrgica y postpuberal. A veces la inserción escrotal es defectuosa y da origen al pene palmeado o pene oculto. La corrección será con cirugía plástica del escroto. Es frecuente la consulta por falta de desarrollo peneano en niños obesos. Se trata de un exceso de desarrollo del celular subcutáneo pubiano. El tratamiento será el llevar a su peso normal al niño y esperar su desarrollo, tranquilizando a los padres. El micropene es un pene de morfología normal que por falta de estímulo hormonal se detiene en su desarrollo. El tratamiento es el estímulo hormonal con testosterona en los primeros meses de vida por un corto período, lo que da un desarrollo normal y que permanece. Testículo y escroto Anorquia es la ausencia bilateral del testículo, por algún accidente en el desarrollo, en esos casos existe deferente y vasos espermáticos. Se estima que ocurre en 1:20.000 individuos. Hay que distinguir del testículo criptorquídico, intraabdominal y ectópico. La ausencia de testículo bilateral puede ser por una criptorquidia por falla del estímulo hormonal; en estos casos se justifica el estímulo hormonal con gonadotrofinas. El tratamiento debe hacerse entre 1 y 2 años de edad, si no hay respuesta en forma rápida 3 ó 4 meses, el tratamiento es quirúrgico. El testículo se forma en el retroperitoneo próximo al riñón, desde allí inicia su descenso y sale del abdomen al escroto a través del conducto inguinal. Al nacer sólo un 3% de los niños presenta criptorquidia, cifra que es mayor en el prematuro. Al año de vida un 1% presenta criptorquidia; y en la edad adulta un 0,7%. Entre la edad de 1 y 3 años ya no hay descenso testicular, por lo cual no se justifica esperar más. La situación del testículo fuera del escroto permanentemente eleva su temperatura en 2 a 3 grados, lo que significa alterar el desarrollo de los túbulos seminíferos en el niño, lo que se constata al microscopio ya a los dos años. A los cuatro años hay franca disminución en el número de espermatogonias y luego aparición de fibrosis tubular y hialinización, hechos http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document irreversibles. Las células de Leydig en cambio permanecen intactas. El testículo migra a partir del tercer mes y el gubernaculum testis parece servir de guía al testículo acortándose bajo la acción de la testosterona. Las causas de criptorquidia son múltiples y complejas; entre ellas mencionaremos: longitud insuficiente de los vasos espermáticos, anillo inguinal estrecho, antecedentes de criptorquidia familiar, asociación a malformaciones genitales, tabique anormal en el ostium escrotal, asociación a hernia inguinal, lo que ocurre en un tercio de los casos. Las consecuencias de la criptorquidia apuntan a: alteración de la fertilidad, repercusión psicológica, torsión de cordón en la infancia y pérdida del testículo, malignización del testículo, con frecuencia estimada entre 35 y 50 veces que en la gónada ortotópica. La exploración física permite palpar el 90% de los testículos criptorquídicos a nivel inguinal, próximos al orificio inguinal externo, o del ostium escrotal. Sólo un 5 a 10% serían intraabdominales. Gran ayuda son la ecotomografía y en ocasiones el TAC. Ectopia testicular es la localización del testículo en un lugar fuera del camino normal de su descenso. Puede situarse en forma superficial, pero por arriba y fuera del orificio inguinal superficial, también en posición perineal, prepubiana, en el triángulo de Scarpa y región crural y en el hemiescroto contralateral. Todas regiones accesibles a la exploración palpatoria. Tanto las criptorquidias como las ectopias testiculares son de tratamiento quirúrgico precoz, idealmente desde los 2 años de edad. En los casos de asociación a hernia inguinal se efectuará la corrección de ella también. El descenso del testículo al escroto y su fijación en él es simple en el 85% de los casos. En otros puede ser muy complejo y requerir de diferentes maniobras quirúrgicas para lograr descenderlo. En un 3 a 5% el descenso puede resultar imposible y por ello es conveniente prevenir a los padres para en caso de testículo contralateral normal se considere la extirpación. Diferente a criptorquidia y ectopia es el cuadro de testículo retráctil o en ascensor, en que la acción poderosa del cremáster con un gubernaculum laxo permite ascender a la gónada ocultándose por sobre el escroto. Esto ocurre como parte del reflejo cremasteriano exagerado que desencadena el temor, un estímulo sobre el abdomen, el frío y el llanto. El examen clínico con el niño en reposo será fundamental para diferenciarlo de criptorquidia. Los testículos retráctiles son sanos y el peligro está en la torsión del cordón. El tratamiento es la fijación de la gónada al fondo escrotal. Epidídimo y deferente Puede haber anomalías en el desarrollo de ellos desde su hipoplasia a agenesia, que darán infertilidad. El examen clínico acucioso permite sospechar con alta probabilidad su ocurrencia. Escroto Las anomalías del desarrollo de escroto más frecuentes son el escroto bífido asociado a hipospadias, la hipoplasia escrotal, con un escroto liso sin pliegues, asociado a criptorquidia bilateral y anorquia. http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document Otras Patologías Genitales Varicocele Es la dilatación de los plexos venosos pampiniformes del cordón por encima del testículo. Estas venas drenan a la vena espermática interna que a la derecha desembocará en la vena cava y a la izquierda en la vena renal del mismo lado en ángulo recto. Las válvulas incompetentes son más frecuentes en el lado izquierdo, la longitud de la vena es mayor, por lo que el factor gravedad influye más. Aproximadamente un 10% de los hombres jóvenes lo presentan y puede producir dolor sordo en el testículo y cara interna del muslo. La mayor parte de las veces es asintomático y hallazgo de examen físico. En los menos casos la consulta es por infertilidad masculina. Los cordones venosos se hacen aparentes en posición de pie y con la maniobra de Valsalva. Disminuyen en tamaño en el decúbito dorsal, pudiendo desaparecer. Se les objetiva también en la ecotomografía testicular, siendo discutible el significado de los pequeños varicoceles con Valsalvas. La aparición de varicocele en un hombre mayor corresponde a veces a una manifestación tardía de un tumor renal avanzado que invade la vena renal. El 70% de los individuos con varicocele presentan una disminución en el recuento y en la motilidad del espermiograma. En ello influye la elevación de temperatura del testículo, por una red vascular que lo aproxima a los 37°C de la sangre y no a los 34°C necesarios para la espermatogénesis. Sin embargo, la presencia del varicocele actúa sobre el testículo contralateral de igual forma, lo que afirma la existencia de factores humorales mal drenados, en el deterioro de la espermatogénesis y calidad fecundante del semen. Con frecuencia esto es causa de infertilidad que puede revertirse con ligadura de las venas espermáticas internas. Hidrocele Es el aumento del líquido vaginal entre las dos hojas de la membrana vaginal que envuelve al testículo; en ocasiones puede comprometer a parte del cordón espermático. En niños suele asociarse a una comunicación pequeña entre la cavidad vaginal y la cavidad peritoneal a través de una persistencia del conducto peritoneo vaginal. Entonces el hidrocele puede ser caprichoso en aparecer y desaparecer. También se asocia a hernia inguinal congénita. Se produce hidrocele agudo luego de una lesión local, radioterapia y epididimitis aguda u orquitis. Puede ser una complicación de una neoplasia testicular. En este caso hay mayor producción de líquido vaginal. En hombres ya en quinta y sexta década de la vida es frecuente encontrar hidrocele de baja tensión que tiende a progresar lentamente, puede llegar a tener aspecto quístico y muy tenso y de gran volumen. Hidrocele idiopático: en que hay producción normal de líquido y falta en la reabsorción. El hidrocele habitualmente es indoloro y la causa de consulta es el aumento de volumen y el peso. Esta masa transilumina al poner una luz y mirar por un tubo. La ecotomografía da el diagnóstico en forma muy clara. http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document Existen hidroceles secundarios a anasarca, hipoproteinemia, insuficiencia cardíaca no compensada, cirrosis hepática. Los hidroceles idiopáticos y secundarios a una causa local se tratan quirúrgicamente realizando la resección y eversión de la hoja vaginal externa. Torsión del Cordón Espermático Es una afección infrecuente que ocurre de preferencia en adolescentes. Produce la estrangulación del flujo sanguíneo al testículo y debe ser tratada con urgencia en un plazo de 4 a 6 horas. El testículo criptorquídico y el testículo retráctil son candidatos potenciales a torsión del cordón. El factor inicial parece ser la contracción espasmódica del cremáster, que se inserta en forma oblicua en el cordón. El testículo izquierdo rota en contra de los punteros del reloj y el derecho a favor de los punteros de reloj; todo esto mirando al paciente desde los pies. Muchas torsiones ocurren durante el sueño o en relación a excitación sexual. Al examen, el testículo aparece con aumento de volumen, muy sensible, enrojecido y elevado. Se asocia a gran dolor, náusea y vómito. La elevación del testículo causa aumento del dolor, a diferencia de lo que ocurre en las epididimitis donde la suspensión produce alivio. El diagnóstico diferencial debe ser hecho rápidamente. En los casos de epididimitis puede haber secreción uretral o disuria dolorosa y el antecedente anamnéstico de relación sexual reciente. El Eco-Doppler puede ser una ayuda, pero la necesidad de resolver pronto una emergencia como la torsión del cordón obliga a tomar decisiones sin esperar este examen. Más vale operar de más una epididimitis aguda que dejar pasar la oportunidad de recuperar una torsión del cordón. El tratamiento es quirúrgico, recordando que puede haber torsión extravaginal. Torsión de la Hidátide Pediculada Es un cuadro similar pero mucho más atenuado. Generalmente se presenta en niños y puede palparse una formación esferoide muy dolorosa. La hidátide hace una reacción inflamatoria aguda y luego va a la necrosis. El tratamiento es quirúrgico, fundamentalmente para hacer el diagnóstico diferencial con torsión de cordón y además permite extirpar la hidátide torcida. En las primeras horas es posible hacer el diagnóstico clínico y un tratamiento médico. http://escuela.med.puc.cl/publ/manualUrologia/MalformacionesCongenitas.html[9/7/2009 3:10:53 PM] Untitled Document Introducción La infección urinaria en el adulto es extremadamente frecuente. Se estima que en el curso de la vida la mayoría de las mujeres tendrán al menos una infección urinaria. Figura 1: Absceso renal A pesar de la alta frecuencia, la mayoría de las infecciones urinarias no traen consecuencias graves para el paciente y no acarrean el riesgo de producir un daño renal definitivo. A diferencia de lo que ocurre en los niños, sólo en grupos bien definidos de pacientes la infección urinaria tiene la potencialidad de producir un daño renal definitivo. En general, esto ocurre cuando junto a la infección urinaria hay alteraciones anatómicas (malformaciones congénitas), funcionales (vejiga neurogénica), cuerpos extraños (sondas, litiasis, catéteres, etc.) o hay condiciones del huésped que favorecen la infección (inmuno comprometidos, diabéticos). La prevalencia de la ITU en las distintas edades se aprecia en la tabla siguiente: Edad Figura 2: Hidropionefrosis con colección perinefrítica Neonatos Preescolares Escolares Edad reproductiva 654 a 70 a;os Más de 80 años Institucionalizados Prevalencia 1 2-3 1-2 2,5 20 30 30 Relacion HombreMuje 1,5/1 1/10 1/30 1/50 1/10 1/2 1/1 Etiopatogenia Figura 3: Litiasis como causa inicial Las ITU se producen en casi el 99% de los casos por vía ascendente; es decir, por la migración de enterobacterias que habitualmente habitan el intestino grueso al tracto urinario, por la uretra. Es así como se ha establecido que la colonización de la mucosa vaginal en la mujer y probablemente del prepucio en el hombre precede a las infecciones urinarias. Por razones que revisaremos a continuación estas bacterias ascienden a la próstata, vejiga o vía urinaria superior, desarrollándose ahí y produciendo la infección. Otras vías de acceso de los gérmenes al tracto urinario son la hematógena (tuberculosis, abscesos renales y perirrenales) y por extensión directa de procesos inflamatorios abdominales o pelvianos. http://escuela.med.puc.cl/publ/manualUrologia/InfeccionUrinariaAdulto.html[9/7/2009 3:11:23 PM] Untitled Document Gérmenes más frecuentes de observar en las ITU son: Figura 4: Destrucción renal. Se observa zona de la colección perinefrítica -Gramnegativos • Escherichia coli (>90%) • Enterobacter sp • Klebsiella sp • Proteus mirabilis (cálculos coraliformes) • Pseudomona sp, citrobacter sp, acinetobacter sp (intrahospitalarios) -Grampositivos • Streptococcus fecalis (enterococo) • Staphylococcus aureus y epidermidis. Factores Predisponentes Generales Figura 5: Causas de obstrucción de la vía urinaria. Deben buscarse en aquellos casos en que la infección no responde o se repite. Una micción eficiente y frecuente es determinante en prevenir la proliferación de gérmenes en el tracto urinario. En la mujer se ha determinado que el ascenso de gérmenes desde el vestíbulo vaginal a la vejiga se favorece por la actividad sexual, las manipulaciones uretrales y el embarazo. Bacterianos Las bacterias capaces de producir ITU, a diferencia de en la flora rectal habitual, presentan habitualmente pili o fimbrias. Estas tienen una especial afinidad por receptores celulares (glicoesfingolípidos de membrana). Más aun, la presencia del pili P es mucho más frecuente en bacterias causantes de pielonefritis aguda que cistitis aguda. Factores extrínsecos Las mujeres con ITU recurrente tienen una mayor capacidad de adherencia bacteriana a las células vaginales, especialmente a bacterias portadoras del pili P. A su vez, en el prepucio de neonatos se ha determinado una mayor adherencia a bacterias portadoras de pili P (esto se ha usado como argumento a favor de la circuncisión neonatal, de hecho en los bebés circuncidados la incidencia de ITU es menor). Factores intrínsecos Además de los factores generales del huésped en cuanto a su susceptibilidad a infecciones, factores locales uretrales (divertículos), vesicales (residuo elevado, uropatía obstructiva, vejiga neurogénica, litiasis, catéteres y cuerpos extraños), ureterales (litiasis, reflujo, megauréter, alteraciones de la motilidad ureteral) o renales (litiasis, cuerpos extraños, hidronefrosis) son claramente importantes en favorecer la proliferación bacteriana. http://escuela.med.puc.cl/publ/manualUrologia/InfeccionUrinariaAdulto.html[9/7/2009 3:11:23 PM] Untitled Document Diagnóstico Los exámenes claves para el diagnóstico de la infección urinaria son el sedimento urinario y el urocultivo. La presencia de piuria con bacterias abundantes en el sedimento es altamente sugerente de ITU y un urocultivo en el cual aparecen más de 105 col./ml de bacterias confirma el diagnóstico. Sin embargo, hay varias consideraciones que deben tomarse: - Alrededor del 20% de las mujeres con orina estéril (objetivada por punción suprapúbica) pueden tener recuentos de bacterias de hasta 104 col./ml. - Sólo el 50% de las mujeres con ITU sintomática tiene desarrollo de más de 105 col./ml. - La presencia de piuria se correlaciona mal con la ITU. En efecto, la lista de patologías que pueden producir piuria aséptica es amplia (TBC, litiasis, uretritis, prostatitis, glomerulopatías, etc.). Localización La historia y el examen físico no son capaces de discriminar en el 100% de los casos si estamos en presencia de una infección alta (ej. pielonefritis aguda) o baja (ej. cistitis aguda). La ubicación de la infección tiene importancia básicamente relacionada al pronóstico, la gravedad del cuadro y el tiempo de tratamiento. Se han desarrollado una serie de métodos diagnósticos para intentar establecer la ubicación de la infección urinaria (alta o baja); sin embargo, aquellos más precisos son invasivos (punciones renales o suprapúbicas, cateterismos) y los no invasivos (proteína C reactiva, anticuerpos séricos o urinarios, etc.) son poco confiables. Clasificación Primera infección: Probabilidad de reinfección de 25% en los próximos años. Bacteriuria no resuelta: La orina no se logra esterilizar durante el tratamiento. Causas (en orden de frecuencia) - Resistencia bacteriana al antibiótico Falta de adherencia al tratamiento Rápido desarrollo de resistencia al antibiótico Reinfección rápida por una nueva bacteria Insuficiencia renal Necrosis papilar asociada a abuso de analgésicos Cálculos coraliformes Infección autoinferida. Persistencia bacteriana: La orina se esteriliza durante el tratamiento pero http://escuela.med.puc.cl/publ/manualUrologia/InfeccionUrinariaAdulto.html[9/7/2009 3:11:23 PM] Untitled Document rápidamente reaparece un cultivo positivo.Causas (habitualmente corregibles quirúrgicamente): - Cálculos infectados Prostatitis crónica bacteriana Riñón atrófico infectado Fístulas vesicovaginales o vesicoenterales Uropatía obstructiva alta o baja Cuerpos extraños Divertículos uretrales. Riñón en esponja medular Muñón uretral postnefrectomía infectado Necrosis papilar Quiste del uraco infectado Divertículos calificares. Reinfección Aparición de un cultivo positivo luego de un tiempo de curada la infección. Sobre el 95% de las ITU recurrentes en mujeres son reinfecciones. Cuadros Clínicos Bacteriuria Asintomática (BA) Presencia de bacteriuria en un paciente sin síntomas de infección, asociada o no a piuria. En un tercio de estos pacientes la bacteriuria desaparece, en otro persiste asintomática y sólo en un tercio aparece una infección sintomática al cabo de un año. Tratamiento. Se justifica por lo tanto el tratamiento de esta condición en un subgrupo de pacientes con factores de riesgo asociado, en los cuales las consecuencias de una infección pudieran ser graves (diabéticos, monorrenos, pacientes con malformaciones, valvulopatías, etc.). En el resto, el seguimiento criterioso o el tratamiento son conductas aceptables. Mención aparte son las mujeres embarazadas, en las cuales se ha demostrado que la BA lleva en un porcentaje alto de las pacientes a una pielonefritis aguda y se asocia a prematuridad y mortalidad perinatal, por lo que no sólo deben ser tratadas sino que también recibir profilaxis durante el embarazo. Cistitis Aguda (CA) Infección localizada en la vejiga caracterizada por síntomas irritativos vesicales; disuria dolorosa, poliaquiuria, pujo y tenesmo vesical asociado a malestar pelviano vago con orinas habitualmente de mal olor y turbias. Con cierta frecuencia también aparece hematuria macroscópica. Al examen físico la paciente está afebril (la presencia de fiebre debe hacer sospechar una infección alta) y puede o no tener sensibilidad hipogástrica. El diagnóstico es clínico y debe confirmarse con un sedimento urinario y cultivo. Sin embargo, dado que la gran mayoría de las CA son por enterobacterias sensibles a varios antibióticos, el tratamiento puede iniciarse empíricamente con antibióticos habituales y luego ajustarse según el antibiograma. Como ya mencionamos, un urocultivo con menos de 100.000 col./ml no descarta una ITU, por lo que en una paciente sintomática debe ser tratada. Está establecido que para estas infecciones no complicadas un curso de antibióticos de 3 días es tan efectivo como 10-14 días (>95% de curación). http://escuela.med.puc.cl/publ/manualUrologia/InfeccionUrinariaAdulto.html[9/7/2009 3:11:23 PM] Untitled Document Alternativas de tratamiento: - Cotrimoxazol Forte (Sulfametoxazol / Trimetoprim) c/12 hrs. - Nitrofurantoína (idealmente micronizada) 50-100 mg c/8-12 hrs. - Cefalosporina 1 generación Cefradina 500 mg c/6-8 hrs. - Cefadroxilo 1 gr día. El uso de anticolinérgicos o analgésicos urinarios (fenazopiridina) habitualmente no es necesario. Al cabo de 10 días de terminado el tratamiento debe confirmarse la curación de la ITU con sedimento y urocultivo. Las CA no dejan secuelas y no se asocian a aparición de daño renal crónico. Prostatitis Esta entidad está tratada con detalle en otro capítulo. Pielonefritis Aguda (PA) Infección principalmente localizada en el tracto urinario superior (pelvis y riñón). El origen al igual que la mayoría de las ITU es por vía ascendente, por lo tanto debe existir la presencia de bacterias en la vejiga. Clínicamente se caracteriza por la aparición brusca de fiebre y calofríos (calofrío solemne), dolor lumbar habitualmente unilateral con o sin síntomas de cistitis aguda. Pueden existir síntomas gastrointestinales asociados (náuseas, vómitos e incluso diarrea). Al examen físico se observa un paciente febril, intoxicado, taquicárdico. En el examen abdominal existe sensibilidad en el flanco con dificultad para examinar la fosa renal y característicamente la presencia de puño percusión positiva en la fosa lumbar. Los exámenes de laboratorio son compatibles con una infección sistémica. El diagnóstico diferencial debe hacerse con neumopatías, infecciones intraabdominales, pancreatitis aguda, y sobre todo con abscesos renales o perirrenales, etc. El diagnóstico es clínico y, dependiendo de la edad y factores mórbidos asociados, requerirá de hospitalización, ya que en enfermos jóvenes sin evidencias de bacteremia significativa y sin factores predisponentes o comorbilidad el tratamiento puede ser ambulatorio. Ante la sospecha se debe tomar el sedimento y urocultivo e iniciar tratamiento empírico para gérmenes gramnegativos de inmediato (aminoglucósidos, cefalosporinas de 1- 3 generación o quinolonas, asociadas o no a ampicilina, para cubrir el enterococo). El paciente debe permanecer en reposo, con hidratación abundante. Con un tratamiento adecuado la fiebre usualmente cede a las 48-72 horas, si esto no ocurre o si el paciente se agrava se debe estudiar al paciente con ecografía renal o tomografía axial computada de abdomen según la gravedad, en búsqueda de factores de persistencia o de bacteriuria no resuelta según sea http://escuela.med.puc.cl/publ/manualUrologia/InfeccionUrinariaAdulto.html[9/7/2009 3:11:23 PM] Untitled Document el caso. Complicaciones. El shock séptico secundario a la PA puede ser mortal, incluso en pacientes sin patología subyacente; sin embargo, la mayoría de los enfermos no complicados responden al tratamiento y no quedan con secuelas permanentes. Pielonefritis Crónica Esta entidad no representa a una infección urinaria propiamente tal, sino a las secuelas renales de ITU que han ocurrido en la infancia antes de los 4 años, dada la especial susceptibilidad de estos riñones en desarrollo. En estos pacientes se observa que los riñones tienen grados variables de atrofia, adelgazamiento cortical, aplanamiento de los cálices y fibrosis. Tienen mayor predisposición a nuevas ITU y dependiendo de la magnitud pueden llevar a una IRC. Absceso Renal Según su etiopatogenia, se pueden distinguir dos tipos de abscesos renales: - Absceso cortical por diseminación hematógena de una infección habitualmente cutánea y por lo tanto con gérmenes grampositivos como causantes. - Absceso corticomedular causado por un proceso infeccioso primariamente urinario alto habitualmente asociado a patología obstructiva urinaria (litiasis, malformaciones congénitas, reflujo, vejiga neurogénica). Habitualmente son causados por gérmenes gramnegativos. Estas entidades pueden eventualmente romper la cápsula renal y transformarse en absceso perinefrítico. El cuadro clínico es inespecífico y simula una pielonefritis aguda, por lo que debe existir un alto índice de sospecha para lograr el diagnóstico. Habitualmente se presenta en pacientes inmunocomprometidos (diabéticos), hay fiebre alta, calofríos, dolor lumbar muchas veces sin evidencias de síntomas urinarios. El paciente se ve intoxicado o incluso presentarse con un shock séptico. Los exámenes de laboratorio apuntan a un cuadro séptico, e incluso los exámenes de orina pueden ser normales si no hay comunicación del absceso con la vía urinaria (especialmente en los corticales). Ante un enfermo de estas características o en aquel en que se sospeche una pielonefritis aguda y su evolución ha sido tórpida debe descartarse la presencia de un absceso. El examen de elección en este caso es la TAC abdominal que además del diagnóstico da una clara idea de la viabilidad, funcionamiento y presencia de patología renal concomitante. El ultrasonido, si bien puede orientar al diagnóstico, puede incluso ser absolutamente normal al comienzo del cuadro. El tratamiento se basa en el uso de antibióticos de amplio espectro, con cobertura para Gram(+) y Gram(-), cloxacilina + aminoglucósidos; cefalosporinas de 2-3 generación y el drenaje. En casos en los cuales el absceso es pequeño, el paciente está estable y no tiene patología renal asociada, el tratamiento antibiótico prolongado por 4-6 semanas puede ser suficiente. Ultimamente se ha obtenido éxito utilizando técnicas de radiología intervencional para el drenaje percutáneo del absceso, aunque la cirugía http://escuela.med.puc.cl/publ/manualUrologia/InfeccionUrinariaAdulto.html[9/7/2009 3:11:23 PM] Untitled Document (drenaje o eventual nefrectomía) no debe postergarse en caso de mala respuesta o cuando exista patología renal concomitante que perpetúe el cuadro. Absceso Perinefrítico Absceso localizado en el tejido graso perirrenal por dentro de la fascia de Gerota, secundario en la mayoría de los casos a la ruptura de un absceso renal. Desde la celda renal el absceso puede extenderse por el retroperitoneo comprometiendo el músculo psoas o incluso drenando a través del escroto. La mala irrigación del tejido graso perirrenal impide lograr una adecuada respuesta del organismo y dificulta lograr concentraciones antibióticas óptimas. La etiología del absceso perinefrítico ha cambiado con el tiempo. Hace más de 30 años sobre el 70% eran por gérmenes Gram(+) de origen en un foco cutáneo; sin embargo, en la actualidad la mayoría son por Gram(-) en pacientes con alteraciones urológicas concomitantes. En alrededor del 30% de los casos se cultiva más de un germen y no es infrecuente la presencia de anaerobios. El cuadro clínico puede ser abigarrado e inespecífico, por lo que se debe sospechar su presencia en síndromes febriles prolongados, PA de evolución tórpida, pacientes inmunocomprometidos, etc. La mayoría de los pacientes ingresa con un diagnóstico distinto al hospital después de algunos días de síntomas inespecíficos. La fiebre es la regla; habitualmente hay dolor en la fosa lumbar con la presencia de una masa palpable. El abombamiento y edema de la fosa renal son altamente sugerentes del absceso. Si hay compromiso de psoas puede haber dolor y dificultad para movilizar la cadera. Dado lo difícil del diagnóstico clínico muchas veces los pacientes llevan días o semanas sintomáticos y presentan en los exámenes anemias y grados variables de desnutrición proteica, además de los hallazgos típicos de un cuadro infeccioso. El examen de orina es normal en el 30% de los casos y el urocultivo negativo en el 40%. Una vez sospechado el diagnóstico el examen de elección es el TAC que da información sobre la extensión de este y sobre el compromiso del riñón. Ante la sospecha debe iniciarse tratamiento con antibióticos de efectividad conocida para Gram(-) y anaerobios como cefalosporinas de tercera generación y metronidazol. El tratamiento es esencialmente quirúrgico. Si bien se ha descrito con éxito el drenaje percutáneo de colecciones perirrenales, el gran tamaño de estos abscesos y el hecho de ser multiloculados y anfractuosos lo hacen en general poco recomendable, salvo en situaciones extremas, en que la gravedad del enfermo impida una cirugía o en lesiones pequeñas y localizadas. Por otro lado, debe plantearse la necesidad de nefrectomía cuando la destrucción renal es importante o la patología asociada la hace recomendable. ITU Recurrente Se define como la presencia de más de 3-6 ITU/año. En más del 95% de los casos son reinfecciones y sin compromiso del tracto urinario superior. En las mujeres esta es una situación relativamente frecuente, que causa gran angustia por temor al daño renal definitivo. Está demostrado que las ITU en el http://escuela.med.puc.cl/publ/manualUrologia/InfeccionUrinariaAdulto.html[9/7/2009 3:11:23 PM] Untitled Document adulto y en ausencia de patologia renal asociada no dejan como secuelas daño renal, por lo que estos temores son infundados. Una vez establecido que se trata de reinfecciones se debe tranquilizar a la paciente, explicar la etiopatogenia de la enfermedad y enseñar medidas básicas de prevención, como asegurar una adecuada frecuencia miccional, desincentivar los aseos genitales profusos y repetidos. La mayoría de estas pacientes no requieren mayor estudio, pero como una forma de reasegurarlas una ecografía renal que descarte una eventual patología concomitante puede ser útil. El tratamiento se basa en la administración de antibióticos profilácticos en dosis única diaria que impida la proliferación bacteriana en el tracto urinario. Dado que hay una clara asociación entre la actividad sexual y la aparición de ITU en algunas mujeres los antibióticos pueden indicarse como profilaxis postcoital. Los antibióticos más usados son: - Cotrimoxazol (Sulfametoxazol/Trimetoprim) Nitrofurantoína (idealmente micronizada) 50-100 mg Cefalosporina 1 generación Cefradina 250-500 mg Con estos tratamientos se logra bajar la frecuencia de ITU a menos de 1 año.En pacientes muy motivadas y educadas es posible indicar autotratamiento en caso de aparición de síntomas, con la salvedad de que deben consultar en caso de mala respuesta e idealmente comprobar con urocultivo la curación de la infección. Indicaciones para Estudiar una ITU - Hombres (dada la baja frecuencia de ITU en el hombre estas siempre deben estudiarse) - Sospecha de persistencia bacteriana - Sepsis grave - Mala respuesta a tratamiento - Diabéticos - Antecedentes de litiasis, malformaciones, vejiga neurogénica - Aparición de gérmenes atípicos (Pseudomona, Proteus)El estudio debe enfocarse a buscar factores predisponentes. Idealmente debieran incluir estudios por imágenes como ecografía y/o pielografía y eventualmente una cistoscopia. Tuberculosis Genitourinaria El bacilo de Koch llega al tracto urinario por vía hematógena. Los sitios primarios de llegada son el riñón, la próstata y el epidídimo. El compromiso ureteral y vesical es descendente, al igual que el del conducto deferente. El testículo se envuelve por vecindad desde el epidídimo. En el riñón la lesión primaria es glomerular y si progresa compromete un cáliz con ulceración y destrucción (apolillamiento de los cálices) de este y del infundíbulo, llevando a fibrosis y dilatación secundaria de este. El compromiso de la pelvis produce fibrosis y retracción de esta (riñón en margarita). Finalmente el riñón se transforma en una masa abscedada de material caseoso (riñón mastik). Al avanzar la enfermedad hay compromiso del uréter con fibrosis, engrosamiento y estenosis, lo que produce hidronefrosis y finalmente http://escuela.med.puc.cl/publ/manualUrologia/InfeccionUrinariaAdulto.html[9/7/2009 3:11:23 PM] Untitled Document compromiso vesical por fibrosis y retracción. La enfermedad puede ser asintomática por largos períodos. Muchas veces la consulta ocurre cuando ya hay secuelas importantes y los síntomas son derivados de ellas. La mayoría de los enfermos tienen molestias vesicales, compromiso del estado general y fiebre baja. Dadas las múltiples alteraciones, los síntomas y signos pueden ser múltiples. Debe sospecharse la TBC en las siguientes situaciones: - Cistitis repetidas que no responden a terapias adecuadas. - Piuria aséptica. - Hematuria macro o microscópica. - Epidídimo engrosado indoloro con un "deferente arrosariado". - Fístula escrotal crónica. - Induración y nodulación de la próstata con vesículas engrosadas. Los exámenes de laboratorio muestran las alteraciones propias de una enfermedad crónica. El diagnóstico se basa en la identificación del bacilo de Koch en la orina. Las baciloscopias urinarias no son 100% confiables por la presencia de bacilos ácido alcohol resistentes en el prepucio y los genitales femeninos (solo un 30% de las baciloscopias son positivas), por lo que el cultivo es fundamental a pesar del largo tiempo necesario para obtener resultados. El diagnóstico por imágenes implica la identificación de las lesiones clásicas de la pielografía (cáliz apolillado, ausencia de cálices, dilatación de cálices, riñón en margarita, estenosis ureterales). Los esquemas de tratamiento antibiótico y quimioterápico son similares a los de otras localizaciones de la tuberculosis. Se realizan en las centrales de tratamiento y generalmente son gratuitos. Los tratamientos acortados asociados son efectivos en la eliminación del bacilo. Sin embargo, el mayor desafío es el manejo de las secuelas (estenosis ureterales, hidronefrosis, retracción vesical etc.) que pueden requerir de múltiples tratamientos. Lamentablemente muchos pacientes terminan con destrucción significativa e irreversible del tracto urinario y caen en insuficiencia renal, representando un problema de difícil solución si son candidatos a trasplante renal. http://escuela.med.puc.cl/publ/manualUrologia/InfeccionUrinariaAdulto.html[9/7/2009 3:11:23 PM] Untitled Document Introducción Como causa de disfunción urinaria, la hiperplasia benigna de la próstata es conocida desde hace siglos. Es mencionada en escritura egipcia 1.500 años antes de nuestra era y ya fue estudiada por Hipócrates 1.000 después. Figura 1: Acción de hormonas Los nombres médicos de esta patología han variado con los años. El más conocido ha sido el de adenoma de la próstata, cuando en realidad no es adenoma ni es de la próstata. Sin embargo, se sigue usando por lo fácil que es el término y ha empezado a ser reemplazado por la sigla HBP imitando el BPH de los sajones. Tampoco es correcto decir hipertrofia benigna porque no existe hipertrofia sino que es una hiperplasia que se inicia después de los 35 años y consiste en nódulos de estroma alrededor de las glándulas periuretrales. El proceso toma años, predominando a veces en los nódulos los elementos glandulares o los fibromusculares y en ocasiones mixtos. En la aparición de esta patología no existen incidencias ambientales o genéticas. Su incidencia aumenta con la edad y todos los varones la padecerán si viven lo suficiente. Etiología Figura 2: Nódulo comprime ureta. La etiología no está clara y se han propuesto cambios histológicos, hormonales y otros relacionados con el envejecimiento. Se requieren dos factores para que se presente: - La presencia de dihidrotestosterona, DHT - Envejecimiento Hay personas con deficiencia congénita de la 5alfa reductasa, que permite la conversión de testosterona en DHT. Estas personas nacen con genitales ambiguos, pero posteriormente la testosterona permite el desarrollo, la erección e incluso la eyaculación. Sin embargo, los bajos niveles de DHT producen un vestigio de próstata, que nunca desarrolla HBP. Figura3: Tacto rectal La acción de los andrógenos en la HBP todavía no es bien comprendida y tampoco su relación con los estrógenos. La castración antes de la pubertad evita la HBP. Los trastornos congénitos de la función androgénica producen escaso crecimiento de la próstata. Sin embargo, la castración en pacientes con HBP no produce atrofia posterior. La función de los estrógenos sería producir la hipertrofia del estroma que a su vez produce la hiperplasia epitelial. Desde el punto de vista histológico, se distinguen 5 tipos de hiperplasia benigna de la próstata: estromal, fibromuscular, muscular, fibroadenomatosa y fibromio-adenomatosa. Existen algunos factores de crecimiento identificados que actúan sinérgicamente. Además hay otros conocidos hace poco como es el factor del plasma testicular y epididimario, que están en el líquido seminal. La exposición http://escuela.med.puc.cl/publ/manualUrologia/HiperplasiaBenignaProstata.html[9/7/2009 3:11:42 PM] Untitled Document Figura 4: Flujo normal ocasional del tejido prostático a estos mitógenos (crecimiento glandular) influye en la HBP. Fisiopatología de los Síntomas Figura 5: Flujo plano. Los síntomas pueden considerarse como de naturaleza irritativa y obstructiva. En 1977, Boyarsky y cols. elaboraron un cuestionario para cuantificar en números la gravedad de los síntomas. Posteriormente, en 1993 la AUA desarrolló una nueva calificación que da mejores resultados en los controles realizados. Hoy se piensa que el criterio único más importante para el tratamiento es la calificación de los síntomas. En el esquema de la AUA hay 7 preguntas que se califican de 1 a 5, siendo el máximo 35. En una población de control, el 83% tenía calificación de 0 a 7, y sólo un 15% de los que tenían esta calificación requirieron tratamiento. Los hombres con calificaciones moderadas (8 a 20) y graves (+ de 20) necesitan tratamiento para evitar complicaciones. Entre los síntomas obstructivos, la disminución de la fuerza y calibre del chorro de orina debida a la compresión uretral es una característica temprana y constante de la HBP. El retardo ocurre porque el detrusor demora más tiempo en aumentar la presión para vencer la resistencia uretral. La intermitencia es debida a que el músculo es incapaz de mantener la presión durante toda la micción. Es la misma razón por la que hay goteo terminal y vaciamiento incompleto. En esto también puede influir la presencia de tejido prostático a nivel del cuello, haciendo el efecto de válvula esférica. Figura 6: Zonas de la próstata Figura 7: Zonas de la próstata y relaciones. Menos A. Sintomas de 1 Urinarios por (Criterios Nunca cada para cinco clasificación veces de síntomas) 1. Vaciamiento incompleto Durante el mes pasado, ¿cuántas veces tuvo la 0 1 sensación de no poder vaciar la vejiga por comleto después de terminar de orinar? Menos de la mitad de las veces Alrededor de la Más de la mitad mitad de de las veces las veces 2 2. Frecuencia Durante el http://escuela.med.puc.cl/publ/manualUrologia/HiperplasiaBenignaProstata.html[9/7/2009 3:11:42 PM] 3 4 Casi siempre 5 Untitled Document último mes, ¿cuántas veces ha tenido que orinar de nuevo en menos de dos horas después de la micción anterior? 0 1 2 3 4 5 3. Intermitencia Durante el último mes, ¿cuántas veces 0 1 2 3 4 5 4. Urgencia Durante el último mes, ¿cuántas veces le ha sido difícil posponer la micción? 0 1 2 3 4 5 5. Chorro débil Durante el último mes ¿ cuántas veces ha sentido disminución en el chorro de la orina? 0 1 2 3 4 5 6. Esfuerzo Durante el último mes ¿cuantas veces ha tenido que esforzarse o pujar para iniciar la micción? 0 1 2 3 4 5 4 veces 5ó más veces para nada 1 vez 2 veces 3 veces 7. Nicturia Durante el último mes, http://escuela.med.puc.cl/publ/manualUrologia/HiperplasiaBenignaProstata.html[9/7/2009 3:11:42 PM] Untitled Document ¿cuántas veces se para habitualmente al baño entre que se acuesta y se levanta? 0 1 2 3 4 5 Clasificación de síntomas AAU=suma de las preguntas de A1 a A7= Síntomas irritativos como la nicturia y la urgencia aparecen debido al vaciamiento incompleto de la vejiga, lo que lleva a la necesidad de mayor frecuencia de micciones. La presencia de una próstata agrandada provoca la respuesta de vaciamiento de la vejiga, en especial cuando el crecimiento es hacia el interior comprometiendo su volumen. Influyen también el aumento de la excitabilidad del músculo hipertrofiado incluso con cambios mínimos de volumen y de irritabilidad de la vejiga. La polaquiuria es más pronunciada en la noche, debido a que disminuye la inhibición cortical y el tono de la uretra y del esfínter se reducen durante el sueño. La urgencia y la disuria se deben a varios factores, entre ellos la incapacidad de vaciar bien la vejiga, inestabilidad del detrusor porque sus contracciones no se coordinan con la relajación esfinteriana y la presencia de infecciones y litiasis vesical. Los síntomas obstructivos son comunes cuando hay una próstata muy crecida. El predominio de los irritativos hacen pensar en disfunción de la micción más que HBP. La incontinencia urinaria no es síntoma común de la HBP, pero cuando la enfermedad avanza la gran cantidad de orina residual debilita el esfínter que se abre y permite la salida de pequeños volúmenes de orina, similares a los que entran y encuentran la vejiga poco distensible y llena. Las alteraciones del detrusor y del sistema antirreflujo llevan a la dilatación del sistema superior, lo que lleva al daño de la función renal. La retención urinaria aguda se presenta por crecimiento prostático, pero también influyen ello los infartos prostáticos, las bajas temperaturas, el alcohol, agentes anticolinérgicos, agentes adrenérgicos alfa, fármacos psicotrópicos y el ignorar el primer deseo miccional. Existen síntomas sistémicos provocados por las vías urinarias como malestar abdominal alto y dolores en el flanco. Se deben al reflujo persistente y a la transmisión de la presión vesical elevada. La insuficiencia renal lleva a la fatiga crónica, pérdida de apetito y somnolencia. Existen otros síntomas no relacionados con la vía urinaria como las hernias y los hemorroides. Son manifestaciones de aumento de la presión abdominal para orinar. Una próstata muy grande también puede causar dificultad para defecar y disminución del tamaño de las heces. Existen síntomas relacionados con las complicaciones como la infección urinaria baja, las pielonefritis. Esto se acentúa con la presencia de litiasis vesical produciéndose obstrucción intermitente y debido a la fragilidad de la próstata es frecuente la hematuria. Cuadro Clínico Hoy día, cada vez son menos frecuentes los casos en que consultan con http://escuela.med.puc.cl/publ/manualUrologia/HiperplasiaBenignaProstata.html[9/7/2009 3:11:42 PM] Untitled Document manifestaciones de la insuficiencia renal obstructiva. La palidez, hipertensión arterial, pulso rápido y respiración acelarada por acidosis son elementos tan evidentes como excepcionales. Se trata de llegar mucho antes al diagnóstico y evitar estas complicaciones tardías. Lo frecuente es que el paciente sólo revele síntomas y no existan grandes hallazgos en el examen físico. El globo vesical crónico puede ser un hallazgo, pero, en general, se ha sospechado por las pseudoincontinencia. En ocasiones es posible palpar globos pequeños, manifestación de residuos elevados. Los demás hallazgos están en el tacto rectal. Este es un examen que debe ser bimanual, en que la mano hipogástrica permite palpar el lóbulo medio de crecimiento intravesical y a la vez permite una mejor palpación de los lóbulos laterales. El tacto rectal es falseado por la presencia de globo vesical. Pierde gran parte de su valor. De existir el globo, es preferible vaciarlo antes de darle valor a un examen rectal. En el examen rectal es importante apreciar la magnitud del crecimiento prostático. Esto tiene gran importancia ya que tamaños sobre 80 cc pueden cambiar la vía de abordaje. A la vez, un crecimiento endovesical puede falsear el tamaño, aunque los medios por imagen evitan errores en este aspecto. La palpación de nódulos, induraciones localizadas o sectores con consistencia alterada hacen plantear otros diagnósticos como prostatitis crónica, litiasis prostática y cáncer de la próstata. En pacientes muy obesos y que no cooperan con el examen, éste puede ser imposible de practicar. El dedo examinador no alcanza a llegar al ápex prostático. No debe olvidarse que el examen rectal permite diagnosticar la mayoría de los cánceres de recto, que se ven a esta edad. Pruebas Diagnósticas Para un paciente que consulta por síntomas compatibles con uropatía obstructiva son indispensables exámenes que permitan confirmar las diversas manifestaciones clínicas, a la vez que evaluar el grado de alteraciones en la función miccional. También es obligatorio descartar por medio del antígeno prostático específico la presencia de un cáncer prostático. Este puede asociarse a la HBP sin aportar síntomas ni signos, por lo que debe aprovecharse esta oportunidad para chequear adecuadamente a los pacientes, en especial a los menores de 70 años. Nuestra recomendación es el empleo de la ecotomografía abdominal y pelviana con medición del volumen prostático y del residuo postmiccional acompañada de la flujometría. Con estos dos elementos es posible corroborar la presencia de obstrucción o sólo de síntomas irritativos. Flujos menores a los 15 cc por segundo indican la presencia de problemas. Flujos menores de 10 cc por segundo indican la presencia de obstrucción en el 90% de los casos. La existencia de residuos mayores a los 60-70 cc hacen pensar en obstrucción si no existen otras causas. Frente a la presencia de síntomas o signos de infección, se debe proceder a identificar el germen y a tratar la complicación. La presencia de hematuria persistente sin infección urinaria hace necesaria una cistoscopia para descartar la presencia de un cáncer vesical. Los otros medios por imágenes sólo deben emplearse cuando la ecotomografía plantea la sospecha de otro tipo de lesiones. La edad a la que se presenta la HBP es la misma a la que se presentan los tumores renales y de urotelio, por lo que frente a cualquier sospecha deben descartarse. http://escuela.med.puc.cl/publ/manualUrologia/HiperplasiaBenignaProstata.html[9/7/2009 3:11:42 PM] Untitled Document Diagnósticos Diferenciales Deben plantearse otras patologías que provocan obstrucción al vaciamiento vesical. La estenosis de cuello, las dis-sinergias esfínter detrusor y las estenosis uretrales son las más frecuentes. Una calibración uretral y la uretrocistoscopias hacen el diagnóstico. La presencia de muchos síntomas irritativos, sin hallazgos obstructivos, debe hacer plantear otras patologías como cistitis intersticial, parkinson. El empleo de la urodinamia con mediciones de flujo contra presión son exámenes de excepción para aquellos casos en que se sospeche alguna de estas patologías. Tratamiento Un hombre de 50 años tiene un 25 a 30% de posibilidades de necesitar una extirpación prostática. Se debe ser estricto en recomendar la cirugía a aquellos pacientes con uropatía obstructiva. Aquellos pacientes en que predominan los síntomas irritativos pueden llegar a mejorar hasta en un 30% sin tratamiento y es en ellos donde tienen un mejor resultado sintomático los tratamientos médicos. http://escuela.med.puc.cl/publ/manualUrologia/HiperplasiaBenignaProstata.html[9/7/2009 3:11:42 PM] Untitled Document El crecimiento benigno de la glándula prostática es una condición patológica que acompaña al individuo de sexo masculino con el aumento de la edad. Este fenómeno natural determina síntomas urinarios de intensidad variable en alrededor de dos tercios de los hombres, los que en oportunidades requieren de los tratamientos llamados invasivos, dado que el médico de alguna forma penetra en el organismo enfermo con cirugía tradicional, endoscópica o la llamada telecirugía, a través de calor, microondas u otras formas de energía computacionalmente controlada. Para entrar en el tema y comprender la evolución de los tratamientos invasivos es indispensable hacer un poco de historia reciente, de los últimos cuarenta o cincuenta años. De otra forma no se entendería el porqué de las indicaciones actuales, de la evolución tecnológica y del desarrollo de una fuerte corriente de medios no invasivos para tratar esta entidad patológica. Para comprender esta historia hay que considerar algunos aspectos relevantes de los últimos cincuenta años: Figura 1: Microtalla vesical - Aumento de las expectativas de vida de la población general. - Desarrollo tecnológico importante y creciente de los últimos años. - Aumento de las exigencias de los pacientes por calidad de vida. - Reducción significativa de la morbimortalidad de los tratamientos quirúrgicos. Me ha tocado vivir alrededor de treinta años de esta evolución, de tal forma que lo que que a continuación se describe es una visión propia, cuyo único mérito es el de haber sido vivida personalmente. Figura 2 Arriba, extirpación transvesical de HBP. Abajo, extirpación vía retropública o Millin. Como interno me tocó presenciar y llevar la evolución de enfermos sometidos a la prostatectomía a cielo abierto y en dos tiempos. ¿De qué se trataba esto? La condición en que los pacientes llegaban a consultar imponía este método de tratamiento quirúrgico. Probablemente, y salvo la sepsis urinaria y la insuficiencia renal, la retención completa de orina es la complicación más dramática del crecimiento benigno de la glándula prostática. Este acontecimiento agudo produce gran dolor y desesperación, llevando a los pacientes en ocasiones a intentar introducirse cualquier objeto por la uretra para vaciar su vejiga. En estas condiciones consultaba la mayor parte de los pacientes de los años cincuenta y sesenta. Ante esta situación se les practicaba una talla vesical, o comunicación de la vejiga al exterior, a fin de vaciar la orina y prepararlos para la operación, que no sería realizada sino después de algunas semanas. El tratamiento quirúrgico consistía en la apertura de la pared abdominal, en forma extraperitoneal, y de la vejiga, para acceder a la próstata a través de ella. La glándula era extirpada digitalmente, sin verla, sólo al tacto, y en oportunidades un enfermo la levantaba empujándola por el recto. Terminada la extirpación, la logia prostática (hueco que queda al sacar la glándula) se rellenaba con gasas. Esto interponía un obstáculo entre la vejiga y el exterior y por ello la utilidad de la http://escuela.med.puc.cl/publ/manualUrologia/TratamientosInvasivos.html[9/7/2009 3:11:57 PM] Untitled Document talla vesical previa. Figura 3: Resección transuretral. Como se puede ver, la cirugía se hacía en grandes adenomas, ya que la consulta se hacía tardíamente, a ciegas, con una hemostasia primitiva y en condiciones de contaminación por la talla previa, en una era de incipiente desarrollo antibiótico y de medidas antiséptica. Los resultados eran una alta morbilidad, que incluía infecciones de la herida operatoria, fístulas urinarias de largo y difícil manejo e infecciones generalizadas y una nada de despreciable mortalidad. Estas condiciones hacen perfectamente comprensible que la consulta fuera tardía y que los urólogos no fueran muy proclives a tratar a pacientes con poca sintomatología o signología. En resumen, el paciente con una retención completa por un problema prostático en las décadas de los cincuenta y sesenta enfrentaba una intervención de alto riesgo y con una hospitalización que podía durar varios meses. Esto ocurría en nuestro país. En USA y en Europa ya se desarrollaba con cierta timidez la resección transuretral (RTU). Sin embargo, sólo la aparición de la fibra óptica y el progreso en los lentes le dieron éxito a los abordajes endoscópicos. Figura 4: Técnica retropública. Durante los años setenta, en nuestro país y en particular en nuestro hospital, se dominaron las técnicas de cirugía abierta que significaron adelantos. Se introdujeron la cirugía con control visual y la hemostasia indirecta, pero vaso a vaso. Las sondas del tipo Foley hicieron innecesaria la talla vesical previa, y, finalmente, la aparición de una amplia gama de antibióticos y de cuidados antisépticos hicieron caer las complicaciones, la mortalidad y la estadía intrahospitalaria. ¿Qué sucedía en un hospital público como el Sótero del Río? Figura 5: Resectoscopio: Modalidad de corte con asa eléctrica. Figura 6: Aspectos de RTU prostática El treinta por ciento de los pacientes consultaba en retención urinaria o con una infección. La mortalidad postoperatoria era del 5%, las infecciones de la herida operatoria alcanzaban al 70% y las fístula al 30%. La estadía promedio era de 30 días. Mejores resultados se tenían en el Hospital Clínico de Universidad Católica, pero en rangos similares. Con este panorama, que hoy en día sería inaceptable, se aumentaron las indicaciones de cirugía, ya que no sólo se operaban los pacientes en retención completa, con grave infección urinaria o peligro de insuficiencia renal, sino también aquellos que estaban incómodos por una intensa polaquiuria, nicturia o urgencia miccional. Se comenzó a hablar de la importancia del residuo postmiccional como factor a considerar para las indicaciones quirúrgicas y que más de 50 ml de residuo postmiccional es una indicación de cirugía sobre el adenoma prostático. A comienzos de la década de los setenta hubo un franco progreso en los elementos que utiliza el aparato llamado resectoscopio, que permite realizar la RTU, lo que en mi concepto es uno de los mayores avances en el tratamiento de la patología prostática. Aparece la fibra óptica para el uso médico, que permite una excelente transmisión de la luz, se mejoran los aparatos de electrocoagulación y se hacen eficientes para actuar bajo agua, condición http://escuela.med.puc.cl/publ/manualUrologia/TratamientosInvasivos.html[9/7/2009 3:11:57 PM] Untitled Document obviamente indispensable en la RTU. Finalmente, se perfeccionan los sistemas de visión endoscópica. Sin uno o varios de estos tres elementos, y esto lo conoce visceralmente cualquier urólogo, la cirugía endoscópica fracasa. En Chile se inicia este tipo de operaciones en el curso de los setenta. Sin embargo, las condiciones propias de esa época hacían difícil adquirir esta tecnología, fundamentalmente por su alto costo. Hacia fines de la década se impuso esta técnica, no sin antes haber sufrido el costo de un aprendizaje muy particular: la operación es hecha sólo por un cirujano. Nadie vigilaba en esa época lo que realizaba el cirujano en formación. En los tiempos actuales la televisión permite enseñar con perfecto control por parte del más conocedor lo que opera el principiante. Fisiopatología del síndrome de resección transuretral. Estamos ya en la década de los ochenta. Pocos urólogos discuten la eficacia de la RTU y, lo más importante, los pacientes y el público en general conocen de sus resultados. Ya en estos años la gente conoce de medicina por revistas comunes y corrientes. Para un candidato a RTU sus posibilidades son una estadía de más o menos 5 a 6 días, mortalidad cercana a cero y morbilidad inferior a la mayoría de las operaciones de un centro hospitalario. El menor riesgo, la menor permanencia hospitalaria y la ausencia de una molesta herida operatoria influyen claramente en el incremento de las indicaciones y por ello del número de operaciones. A comienzos de los noventa, y considerando el aumento de las operaciones y el incremento de las expectativas de vida de la población, la industria biomédica ve en esta enfermedad un campo de alto interés. La frase anterior corresponde a una opinión personal, la que, sin embargo, es compartida por otros urólogos. Curiosamente, a veces la población general accede simultáneamente o antes que el cuerpo médico a los adelantos tecnológicos que significan tal o cual aparato nuevo para resolver los problemas derivados del crecimiento de la próstata. A veces las nuevas tecnologías no han pasado aún el filtro riguroso de la ciencia y ya son conocidas por el público que pregunta y exige. Personalmente nos ha sido difícil marginarnos del vendaval tecnológico con resultados discutibles. Los grandes argumentos para las nuevas técnicas están en la esfera sexual, como la mantención de la eyaculación en pacientes jóvenes, menor estadía intrahospitalaria, reducción del sangrado postoperatorio y en general ampliando las indicaciones de cirugía y del tipo de pacientes. Algunas de las nuevas técnicas quirúrgicas permiten operar enfermos fuera del alcance de las tradicionales. Muchas de ellas son fácilmente repetibles, lo que es un argumento de doble filo. Las últimas tecnologías se refieren en general a aparatos que emiten calor y de esa forma destruyen o pretenden reducir de tamaño la glándula prostática o son tutores que se colocan en la región de la uretra prostática obstruida. El objetivo común a conseguir es la facilitación del vaciamiento de la vejiga. Tratamientos Actuales Habiendo revisado la historia reciente de los llamados tratamientos invasivos del adenoma prostático o hiperplasia nodular de la próstata entraré en materia describiendo en forma somera cada técnica, sus complicaciones, resultados, indicaciones y, en fin, lo que determina que un urólogo indique o se incline por un determinado tratamiento, lo que el médico general debe conocer para http://escuela.med.puc.cl/publ/manualUrologia/TratamientosInvasivos.html[9/7/2009 3:11:57 PM] Untitled Document aconsejar a su paciente. Soy un convencido de la gran utilidad de que el paciente se informe por su médico de cabecera y no a través de la prensa no especializada. Como norma general se puede decir que mientras menos invasivos son los métodos para tratar los problemas derivados del crecimiento prostático benigno, menos eficaces son. Así, a grandes rasgos, la cirugía abierta alcanza sobre el 95% de éxito, la RTU bordea el 90% y los otros que describiremos más adelante alcanzan el 70%. Cuando se analizan los resultados debe tenerse presente un factor de la mayor importancia: el cuadro clínico y sus síntomas regresan espontáneamente en alrededor de un tercio de los pacientes, si éste es leve a moderado. No así una retención completa, la que tiene más de un noventa por ciento de probabilidad de repetirse. Indicaciones generales de los procedimientos invasivos Existen indicaciones que difícilmente se discuten, como las infecciones urinarias, la sepsis de origen obstructivo urinario bajo, la obstrucción que causa hidronefrosis, la retención urinaria completa, la litiasis vesical de origen obstructivo y la presencia de sintomatología que conlleva una mala calidad de vida (polaquiuria, nicturia e insomnio, urgencia e incontinencia urinaria). El desarrollo de la tecnología ha permitido detectar con facilidad otras indicaciones que habitualmente preceden a las mencionadas en el párrafo anterior, como es la presencia de residuo urinario elevado postmiccional (mayor de 50 a 60 ml) y el descenso del flujo urinario medido con el flujómetro. Existe además una puntuación o score desarrollado por la Asociación Americana de Urología y por otros, que no corresponde más que a la sintomatología clásica con valores numéricos y de la cual el médico puede prescindir. Cirugía abierta En la actualidad su indicación radica la mayor parte de las veces en la imposibilidad de efectuar la RTU, ya sea por el tamaño del adenoma prostático, por patología concomitante como un cálculo mediano o grande o simplemente por no contar con la tecnología para realizarla. Su frecuencia es variable por las condiciones antes expuestas; sin embargo, las cifras en hospitales desarrollados tecnológicamente deben estar en alrededor del cinco o diez por ciento y en descenso. En este tipo de operaciones obviamente existe una apertura de la piel, aponeurosis y planos musculares. Todo es extraperitoneal. Si hay herida operatoria hay posibilidad de infección de ella, de futuras hernias, de dolor y de necesidad de una cicatrización que, todos sabemos, no se concluye firmemente hasta cuarenta a sesenta días. El retorno a la vida laboral se hace pasado el mes o antes, dependiendo del trabajo a realizar. Las formas de extirpar la próstata por cirugía abierta son tres, pero la vía perineal está en franco desuso. En general, dependiendo de la escuela quirúrgica, se usa la vía transvesical, es decir abriendo la vejiga, o la vía retropúbica, que llega a la próstata a través de su cápsula o pared anterior. Si se comparan la incidencia de complicaciones fistulosas, el retiro de la sonda y el alta hospitalaria, la vía retropúbica sale favorecida. Nosotros utilizamos la vía retropúbica o de Millin, con adenomas superiores a http://escuela.med.puc.cl/publ/manualUrologia/TratamientosInvasivos.html[9/7/2009 3:11:57 PM] Untitled Document 60 g, ya que, como veremos más adelante, en estos casos la RTU es riesgosa. Practicamos la vía transvesical en casos de patología concomitante que hace necesario abrir, revisar u operar la vejiga, como podría ser el caso de divertículos vesicales, cálculos u otras entidades menos frecuentes. En la mayoría de los casos la estadía hospitalaria es de 7 a 10 días, tiempo en que el paciente permanece con una sonda uretrovesical. Las complicaciones más frecuentes son la infección de la herida operatoria (1 a 2%) y las hematurias que requieren transfusión o instrumentalización (2 a 5%). Infrecuentemente vemos fístulas, probablemente por los mejores materiales de sutura y la condición de los pacientes. La mortalidad es cercana a cero y el resultado desde el punto del alivio sintomático es excelente. En una interpretación personal, pienso que estos mejores resultados se alcanzan porque, a raíz del tamaño de su próstata, estos pacientes son mucho más sintomáticos que aquellos que se someten a una RTU con un pequeño y poco sintomático adenoma. Así, al hacer el balance comparativo pre y postoperatorio, el paciente muy sintomático hace una mejor evaluación que aquel que se operó por sintomatología leve. Resección transuretral En mi opinión, la cirugía endoscópica es aún la regla de oro, a pesar de los embates de otras tecnologías. Su principal inconveniente radicaba en la dificultad de enseñarla; sin embargo, como se mencionó en párrafos anteriores, eso se resolvió con el acoplamiento de minicámaras de televisión al endoscopio. Sus límites, en cuanto al tamaño a operar, están en directa relación a la habilidad del cirujano, y esto no por un preciosismo, sino porque el tiempo quirúrgico no debe sobrepasar los 60 a 80 minutos. De esta manera, si un cirujano reseca 1 gramo por minuto, sólo puede operar adenomas de hasta 60 gramos por esta vía. Si su habilidad o instrucción le permiten menos, debe restringirse a ello. La gran razón para establecer un tiempo máximo de la cirugía radica en la necesidad de ejecutar el procedimiento con un asa de corte eléctrica en un medio acuoso. Si hay conducción de la electricidad, no hay corte de tejido. Por ello no puede usarse suero fisiológico. También el medio acuoso debe ser transparente y las soluciones de coloides isotónicas no lo son. Por todas estas razones se emplea un medio hipotónico respecto del plasma. En el curso de una RTU mientras más tiempo transcurra, más posibilidades de absorción de un medio hipotónico existen. Debe recordarse que la vejiga no es indiferente al intercambio de agua y electrólitos y que en el desarrollo de una de estas operaciones pueden romperse vasos venosos con paso directo de la solución irrigante a la sangre. Ocurrido el hecho y si el volumen que pasa al intravascular es importante (un litro o más) se tiende a la hiponatremia, la que a su vez origina los síntomas del llamado Síndrome de RTU: tendencia al compromiso de conciencia, náuseas y vómitos por edema cerebral. La hemólisis de los glóbulos rojos puede comprometer la función renal. El tratamiento de este síndrome es preventivo, resecando lo que se es capaz, infundiendo la solución irrigante a baja presión. Instalado el cuadro, debe haber una rápida y muchas veces masiva reposición de cloruro de sodio y debe recurrirse al uso de diuréticos para eliminar agua. Con alguna experiencia (se dice que sobre las cien RTU se sabe ya operar) y con criterio, esta situación no debe producirse. En nuestro hospital, que es en esencia docente, tenemos especial cuidado durante los meses de mayo y junio, cuando los residentes http://escuela.med.puc.cl/publ/manualUrologia/TratamientosInvasivos.html[9/7/2009 3:11:57 PM] Untitled Document inician su entrenamiento. De regla, la anestesia regional porque, entre otras ventajas clásicas, nos permite observar el estado de conciencia del paciente, precaución que, aparte de otras que tomamos dentro de la sala de operaciones, nos avisa de la posibilidad de un síndrome de RTU. Terminada la operación, el paciente va por un período corto a una sala de recuperación anestésica, y luego a su pieza donde permanece con sonda por 3 a 4 días. Retirada la sonda, el alta se lleva a cabo en 24 horas. El reintegro al trabajo se produce en lapsos variables, según el tipo de éste, en siete a catorce días. El dolor es leve y sólo depende del uso de una sonda; el paciente se levanta a las 24 horas y su alimentación es libre desde ese momento. Las complicaciones más frecuentes son la hematuria, que sólo ocasionalmente requiere de instrumentalización o de transfusiones. A más largo plazo puede desarrollarse estenosis de meato urinario (5%) o de cuello vesical, menos frecuentemente. Con relación a la esfera sexual, la impotencia es rara si no había fallas previas, pero la eyaculación retrógrada es bastante usual. Esto debe ser advertido, toda vez que se están operando enfermos jóvenes que quizás deseen mantener su fertilidad. La satisfacción de los pacientes operados bordea el 90%, aun cuando algunos mantienen una polaquiuria más allá de dos o tres meses, lo cual es razonable para esta operación hecha "interiormente". Recalco este hecho, porque la ausencia de herida y cicatriz operatoria hace inconscientemente menospreciar la cirugía y resalta molestias que son menores y transitorias. Cirugía endoscópica con láser De gran similitud a la RTU, tiene sobre ella ventajas y desventajas. El aporte del láser radica en la posibilidad de evitar al máximo las hemorragias y con ello teóricamente reducir el tiempo de sonda y por ende la hospitalización. Las desventajas son las de ser extremadamente lento en comparación con el corte por corriente de alto voltaje que se ocupa en la RTU, por lo que se le reserva para adenomas pequeños. Permite operar enfermos de alto riesgo quirúrgico e incluso a aquellos que reciben tratamiento anticoagulante. Por razones que desconocemos, los pacientes operados con láser tienen mayor disuria y por más largo tiempo que los sometidos a RTU, lo que hace necesario un tiempo mayor o similar de sonda que la cirugía endoscópica clásica. La gran complicación en el largo plazo es, en mi opinión, la necesidad de repetir el procedimiento por insuficiente. Con este tipo de cirugía sobre la glándula prostática y con las que se describen a continuación no se obtienen muestras para biopsia. Es posible entonces no diagnosticar un cáncer prostático. Debe recordarse que existen cánceres de la próstata con antígeno prostático específico normal. En el futuro, el progreso en las asas o puntas que entrega la energía láser podría revertir las desventajas actuales de esta interesante tecnología. Electrovaporización endoscópica Muy similar a la RTU, se diferencia de ella en que se usa corriente 5 a 6 veces más potente. Reservada, por razones similares al láser, a adenomas pequeños o medianos, ha caído en desuso por las claras ventajas que sobre ella tiene la RTU. Al igual que el láser, permitiría un alta más precoz. En nuestro hospital la dejamos de hacer por no encontrar ninguna ventaja clara sobre la RTU. Tratamientos por calentamiento prostático http://escuela.med.puc.cl/publ/manualUrologia/TratamientosInvasivos.html[9/7/2009 3:11:57 PM] Untitled Document Existen diferentes aparatos que producen una elevación de la temperatura de la próstata a cifras que fluctúan entre 40 y 50° C mediante diferentes fuentes de energía. El tratamiento es ambulatorio, anestesia y con poca analgesia. Su utilidad está cada día en mayor discusión y sus resultados llegarían estadísticamente a alrededor del 60%. En nuestra experiencia los resultados fueron inferiores, y por ello y al cabo de treinta a cuarenta procedimientos dejamos de usarlo y no lo aconsejamos. Uso de tutores o stents Corresponden a tubos de diferentes materiales y duración, que modelan la uretra obstruida por el adenoma prostático alrededor de ellos. Nuestra experiencia es reducida, porque inicialmente su costo era muy alto y porque su futuro es incierto. Los hemos reservado para unos pocos casos de enfermos que muy difícilmente tolerarían cualquier otro tipo de solución quirúrgica. Dilataciones con balones Están en franco desuso, por sus malos resultados en el mediano plazo. Fisiopatológicamente, su acción de dilatar una zona, como la próstata, de por sí elástica, no resiste muchas explicaciones. Hay estudios doble ciego que comprueban que sus resultados son los mismos que una cistoscopia. Finalmente quisiéramos decir que los tratamientos no invasivos, en particular algunas drogas, tienen un claro espacio que se ha creado en desmedro de aquellos tratamientos invasivos con resultados poco alentadores. http://escuela.med.puc.cl/publ/manualUrologia/TratamientosInvasivos.html[9/7/2009 3:11:57 PM] Untitled Document Cirugía de la Estenosis Uretral Dr. Carlos Martínez Sanz En un gran número se practica vía endoscópica. La cirugía abierta de colgajos queda reservada para casos seleccionados, en especial secundarios a trauma uretral. Figura1: Uretrocistografía muestra estenosis severa. La estenosis secundaria a la uretritis gonocócica sigue siendo frecuente. Han aumentado las secundarias a instrumentación, cirugía endoscópica y a sondeos prolongados. La estenosis queda abierta, pero al incindirse tejido sano se reinicia el proceso cicatrizal. Es por esto que las estenosis reaparecen luego de meses. Los resultados de esta cirugía dependen del seguimiento de los pacientes. Inicialmente el 90% queda muy bien, pero si se los sigue los resultados bajan al 50% o menos. Sin embargo, la repetición del procedimiento es ambulatoria, con buenos resultados y con escasa morbilidad. La cirugía de colgajo o la término terminal para las estenosis de cualquier tipo tiene un alto porcentaje de fracasos y una mayor morbilidad. Figura2: Guía metálica introducida por zona estenótica hasta la vejiga. A la izquierda se ve el orificio de la falsa vía. Figura 3: Con cuchillo frío se inicia corte de la estenosis a las 12 http://escuela.med.puc.cl/publ/manualUrologia/CirugiaEstenosisUretral.html[9/7/2009 3:12:20 PM] Untitled Document Figura 4: Apertura de la estenosis a diámetro 20 Fr., lo que permite el paso de la camisa del uretrótomo a la vejiga. http://escuela.med.puc.cl/publ/manualUrologia/CirugiaEstenosisUretral.html[9/7/2009 3:12:20 PM] Untitled Document La historia de los avances de la urología está muy ligada a los progresos tecnológicos que han permitido confeccionar sondas y catéteres cada vez más sofisticados. Muchas de las dificultades que presentaban diversas técnicas quirúrgicas han desaparecido gracias al diseño de catéteres especiales y también a materiales, como la silicona. Este material ha permitido eliminar los problemas de las incrustaciones calcáreas que sufrían las sondas de goma. Además del diseño y fabricación de elementos cada vez más finos y precisos a la vez más satisfactorios. El progreso en el desarrollo de estos insumos urológicos ha sido casi tan importante como el desarrollo de la fibra óptica y de los lentes de alta resolución. Sondas Nélaton Figura: Bujías y filiformes Son las más simples, usadas en diversas alternativas, muy útiles para los autosondeos uretrovesicales. Hay algunas en materiales blandos que producen poco trauma y hay confeccionadas expresamente con materiales semirígidos. Son útiles para vencer obstáculos en la vía urinaria, pero deben ser empleadas SOLO por personas muy entrenadas en el tema. La dureza de las sondas rígidas las hace temibles en manos no expertas. Con gran facilidad crean falsas vías en la uretra, que es muy frágil. El sondeo vesical en pacientes con dificultad para vaciar la vejiga en un postoperatorio debe ser hecho con sondas 16 ó 18 Fr y blandas. Las sondas más finas dañan más la uretra. Sondas Foley Figuras 2: Sondas Foley de 2 y 3 vías. Figura 3: Tipos de doble J. Es una nelaton, pero que la tecnología le agregó un balón, un conducto fino y una válvula que permite inflar este balón y hacer de autocontención en la vejiga. Es la más empleada en nuestra especialidad e imprescindible cuando se desea dejarla por un tiempo prolongado. Los materiales han variado y existe la de goma corriente para los usos poco prolongados hasta las de siliconas que permiten que permanezca sin necesidad de cambio hasta 8 semanas. También las hay en materiales semirrígidos para aquellos casos en que haya dificultad en el pasaje o para casos en que se quiera extraer coágulos sin que la sonda se colapse. Existe otro modelo muy usado en que se agrega otra vía, una tercera, que permite irrigar la vejiga con suero fisiológico. Muy utilizada en la cirugía prostática, existiendo variedades con balones de 15 cc, 30 cc y hasta 100 cc para casos extremos. Su utilidad está en irrigar la vejiga impidiendo que la sangre coagule y obstruya la sonda. En casos en que hay coágulos en el interior es peligrosa porque se obstruye la salida pero no la entrada y el paciente sufre las consecuencias de enormes globos vesicales, con dolor y aumento de la hemorragia. Para que sea útil, deben vaciarse los coágulos http://escuela.med.puc.cl/publ/manualUrologia/SondasUrologia.html[9/7/2009 3:12:46 PM] Untitled Document primero y luego colocar la irrigación. En un tiempo fue usada para aclarar orinas purulentas. Hoy en día su uso se ha restringido, entre otras cosas porque un globo vesical por obstrucción de la sonda permite el pasaje muy importante de gérmenes al torrente sanguíneo y puede ser la causa del agregado de sepsis urinaria. Catéteres Ureterales De desarrollo muy antiguo, ha disminuido algo su uso por la aparición de nuevos medios de imágenes. Muy útiles para realizar ureteropielografías retrógradas (UPR), se los ha confeccionado con una oliva en la punta para disminuir el escape del medio de contraste (chevaseaux). Figura 4: Cistostomía Los hay de distintos diámetros y materiales, llevando todos marcas cada centímetro para permitir conocer bajo visión del cistoscopio cuántos centímetros han sido avanzados en el uréter. Catéteres Doble J (pigtail) También de uso ureteral, permiten ser dejados puestos y al incurvarse ambos extremos hace muy difícil que sean expulsados por la contractilidad de la vía urinaria. Imprescindibles en las plastias pieloureterales, son muy útiles en todos los tratamientos de la litiasis urinaria, tanto LEC con endourológico o cielo abierto. Los materiales han permitido dejarlos puestos largas semanas sin riesgo y muchos pacientes los usan en forma permanente con cambios regulares. Figura 5: Stent uretral. Soluciona uropatía obstructiva Catéter J Más largos que los anteriores, se curvan sólo en un extremo. Muy útiles en las neo-vejigas con intestino. Su objetivo es llevar la orina desde el riñón al exterior, manteniendo seca la zona de la cirugía, permitiendo una mejor cicatrización. Instrumentos Metálicos Ha disminuido su utilización como dilatadores en estrecheces uretrales, gracias a los uretrótomos con visión directa. Sin embargo, son indispensables en todo centro que realice cirugía urológica. El uso en manos experimentadas permite solucionar problemas serios, imposibles de manejar en otra forma. La endourología exigió el desarrollo de diversos tipos de sondas de uso muy especializado. Entre ellas las sondas de dormia o con canastillo, que permitían extraer cálculos uretrales, las de Davis que servían en el mismo fin. Catéteres con cepillos que permitían obtener muestras para citología urinaria. Sondas rígidas para la fragmentación de cálculos por medio del ultrasonido y catéteres blandos para el mismo fin por medio de golpes electrohidráulicos. Otros catéteres metálicos han sido desarrollados para fragmentar cálculos por medio de golpes directos. La tecnología ha permitido desarrollar estos mismos equipos, pero para ureteroscopios flexibles. Ello permite llegar al riñón con un mínimo de trauma y con una máxima visión al curvarse el instrumento en todas las direcciones. Son equipos de alto costo, frágiles y de uso muy limitado y en manos muy expertas. http://escuela.med.puc.cl/publ/manualUrologia/SondasUrologia.html[9/7/2009 3:12:46 PM] Untitled Document Cistostomías El procedimiento quirúrgico ha quedado con un uso ocasional dentro de otro tipo de operaciones. Cuando no es posible o no se desea invadir la uretra, es preferible colocar una sonda intravesical por punción suprapúbica. Para ello sólo se requiere de anestesia local, la presencia de globo vesical importante y un trócar de punción universal. A través de este trócar se puede introducir una sonda nelaton, con múltiples orificios, la que luego se fija a la piel. La tecnología ha desarrollado equipos de punción que traen todos los elementos preparados y que tienen un gran filo, lo que hace fácil la punción. Sin embargo, es necesario recordar que existen trócares universales y sondas nelaton en todos los hospitales de Chile. Son de bajo costo y solucionan problemas serios como retenciones de orina imposibles de sondear, en forma ambulatoria y con mínimas complicaciones. Stents Uretrales Son una novedad tecnológica aplicable en aquellos pacientes en condiciones psicoorgánicas deterioradas que no toleran una anestesia. La idea es colocarlos con anestesia local. Son de alto costo y con un porcentaje alto de fracasos. No pueden ser reutilizados, por lo que adquirir una experiencia por medio de la curva de aprendizaje normal no es financiable con nuestros recursos. Al envejecer nuestra población, tarde o temprano serán necesarios, a la vez que su costo debe bajar. http://escuela.med.puc.cl/publ/manualUrologia/SondasUrologia.html[9/7/2009 3:12:46 PM] Untitled Document Cristalografía Cálculo de oxalato cálcico-monohidrato, finamente granuloso, formado por muy pequeños cristales, no identificables con el microscopio óptico. Figura 1 Cálculo de triamterene con su color característico amarillo ligeramente verdoso, que se compara con el de la mostaza. Figura2 Figura 1 Arriba, cristal de weddellita e, inmediatamente por debajo, una copa de whewellita. Se aprecia perfectamente el típico color azul claro de las capas de tipo aspidínico. Lo que parece un tono más oscuro es el fosfato cálcico esferolitico, que es isótropo. Figura 3 Aspecto de la superficie de sección de un cálculo de ácido úrico, obsrvada con la lupa binocular (10x.) Figura 4. Figura 2 Aspecto característico del fosfato cálcico tipo "aspidínico", correspondiente en este caso a una lámina delgada de un cálculo compuesto, en parte, por unidades de lechada de cal (luz polarizada). Figura 5 Cristales de oxalato cálcico. Sólo Ca en EDAX, pero grado de hidratación desconocido (MEB, 2500 X). Figura 6 Figura 3 Figura 4 http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria1.html[9/7/2009 3:13:37 PM] Untitled Document Figura 5 Figura 6 http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria1.html[9/7/2009 3:13:37 PM] Untitled Document Introducción Corresponde a la presencia de concreciones minerales y de matriz orgánica en vía urinaria. Representan un trastorno metabólico complejo, multifactorial, cuya expresión más evidente y final es la formación de un cálculo en la vía urinaria, con sus consecuencias determinadas por la obstrucción de ésta. Afecta una alta proporción de la población, llegando a una frecuencia de 5% entre las mujeres y 10% en los hombres, entre los 15 y 45 años de edad. Esta alta frecuencia, en población laboralmente activa, la convierten en un problema de salud pública, que es aún más significativo si se considera su alta recurrencia, que llega hasta un 67% a los 8 años. Por esto, ocupa una porción importante del trabajo de los urólogos. Durante estas últimas dos décadas se asiste a un acelerado cambio en la identificación de las causas de la urolitiasis y de su tratamiento tanto médico como quirúrgico, en especial desde 1984, con el advenimiento de Litotricia extracorpórea (LEC), que ha significado un gran beneficio a los pacientes; sin embargo aún se asiste a una alta tasa de recurrencia. Figura 1 : Ureteroscopia Extracción de cálculo. Aunque falta mucho por conocer respecto del origen y crecimiento de los cálculos en el riñón, hay un acuerdo general en tres teorías que explican satisfactoriamente la mayor parte de los problemas. Todas pasan por la saturación y sobresaturación de solutos en orina, que dependen del pH y la temperatura. Esta sobresaturación lleva a la nucleación, cristalización y crecimiento del cálculo, hasta lograr dimensiones clínicamente significativas. En este proceso complejo no solo participan los solutos (calcio, oxalato, ácido úrico, cistina) sino también diversas sustancias que se encuentran en orina e inhiben la cristalización, como el citrato, magnesio y fosfato. Otro aspecto importante lo constituye la matriz orgánica que compone entre el 2 al 10% del peso de un cálculo. Se estima que puede constituir un nido de agregación de cristales, aunque su rol definitivo no está determinado. Figura 2: Nefrolitectomía percutánea Por otra parte, se han logrado identificar características epidemiológicas asociadas a los pacientes portadores de urolitiasis, como, por ejemplo, aspectos genéticos que explicarían una mayor frecuencia entre los familiares de los portadores de cálculos. En este aspecto hasta un 60% de pacientes con urolitiasis idiopática tiene antecedentes familiares de litiasis; también se observa una notoria menor frecuencia entre los negros y aborígenes. Esto es más claro aun en los pacientes con enfermedades congénitas como la hiperoxaluria primaria tipo I, cistinuria, acidosis tubular renal, síndrome de Lesch-Nyhan. Otros factores intrínsecos explicarían su clara mayor frecuencia entre los http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document varones, doblando la de las mujeres, especialmente entre los 15 y 45 años. Figura 3: Pielografía de obstrucción muestra hidroefrosis del sistema superior e inferior debido a la obstrucción provocada por el cálculo Entre los factores ambientales asociados a urolitiasis están el clima y la dieta. En las zonas con clima mediterráneo y desértico se ve una mayor incidencia, que disminuye en las áreas tropicales. La dieta rica en proteínas y sal aumenta el riesgo de urolitiasis, situación especialmente importante en nuestro país, dado el reciente incremento del poder adquisitivo de nuestra población y la consecuente mayor ingesta proteica. Etiología y Profilaxis Urolitiasis Cálcica Representan el 80% de todos los cálculos, son radiopacos en distintas magnitudes. Sus causas pueden dividirse en: Figura 4: Caso clínico de litiasis coraliforme con hidronefrosis secundaria. En foto se observa la litiasis extraída por nefrolitotomía. Figura 5: Litiasis vesical secundaria a sutura transfixiante de vejiga. Figura 6: Punto en base de cálculo a) Hipercalciuria Absortiva La ingesta diaria de calcio en la dieta normal es de aproximadamente 1 gr. Sin embargo, la mayor parte se pierde por el tubo digestivo, absorbiéndose solo un tercio. La excreción urinaria normal corresponde a 4 mg por kilo de peso por día o cercana a los 200 mg. En las variedades de hipercalciuria absortiva, se observa un incremento de la absorción de calcio intestinal por distintas causas. Hipercalciuria Absortiva Tipo I. En ella los pacientes presentan una mayor absorción de calcio intestinal primaria, independiente de la dieta y que no disminuye al restringir el calcio en la dieta. Esta causa se observa en el 15% de los pacientes con urolitiasis. Su tratamiento se basa en disminuir el calcio intestinal con fosfato de celulosa oral, que usado a largo plazo es caro y mal tolerado, por lo que se recomienda su uso en forma intercalada con tiazidas, que disminuyen la calciuria al favorecer la reabsorción tubular de calcio. Hipercalciuria Absortiva Tipo II. Es la alteración más frecuente de reconocer, observándose en el 50% de los pacientes con urolitiasis. Es dependiente del aporte oral de calcio y habitualmente de menor severidad que la Tipo I. Su tratamiento es la restricción del calcio en la dieta a 500 mg por día, con lo que se logra normalizar la calciuria. Hipercalciuria Absortiva Tipo III. Se presenta en el 5% de los pacientes con urolitiasis y es secundaria a una pérdida renal de fosfato, lo que estimula una mayor síntesis de vitamina D dihidroxilada; esto permite un incremento de la absorción de calcio preferentemente en el yeyuno y luego un aumento del calcio en plasma y secundariamente en orina. El ortofosfato administrado por vía oral aumenta la disponibilidad de fosfato bloqueando el estímulo para la mayor síntesis de vitamina D. b) Hipercalciuria Resortiva http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document Es secundaria a la mayor producción de paratormona por un Adenoma de alguna de las glándulas paratiroides. Representa menos del 5% de la urolitiasis. Por un mayor nivel PTH, hay hipercalcemia y fosfaturia e hipercalciuria secundaria. El riñón puede presentar alteraciones en la acidificación de la orina, lo que puede llegar a constituir aparte de la nefrolitiasis una nefrocalcinosis. El tratamiento consiste en remover el adenoma paratiroideo, evitando la hipercalcemia y recurrencia de urolitiasis. c) Hipercalciuria Renal Se debe a una falla intrínseca tubular renal, que determina una mayor pérdida de calcio. Secundariamente se asiste a un incremento de PTH para estabilizar la calcemia. El tratamiento se basa en el uso de tiazidas, cuyo efecto es estable a diferencia de la hipercalciuria absortiva Tipo I. d) Litiasis Cálcica por Hiperuricosuria Se debe a un aumento del ácido úrico en orina (mayor a 350 mg/día), ya sea por mayor ingesta o producción endógena de purinas. Estos pacientes tienen pH en orina mayor a 5.5, lo que los diferencia de aquellos por ácido úrico puro. Se tratan restringiendo la dieta en purinas y eventualmente con Alopurinol, con lo que disminuiría su recurrencia. e) Nefrolitiasis Cálcica por Hiperoxaluria El oxalato corresponde a un metabolito de desecho, excretado primariamente en la orina. Puede contribuir en la formación de cálculos por la relativa baja solubilidad que tiene la sal de oxalato de calcio. Su excreción normal es de 40 mg por día y esta puede incrementarse por una mayor absorción entérica o menos frecuentemente por un aumento de síntesis endógena (oxidación de glicolato y conversión de ácido ascórbico a triptófano) Habitualmente una fracción menor al 5% del oxalato ingerido (vegetales, maní, nueces, chocolate) se absorbe en el intestino. Sin embargo en pacientes con mala absorción intestinal (Enf. de Crohn, colitis ulcerosa, síndrome de intestino corto, insuficiencia pancreática, enfermedad celíaca), el oxalato en el lumen intestinal no se une al calcio, difunde y se absorbe en mayor cantidad. Esto determina una mayor excreción urinaria de oxalato asociado a deshidratación, acidosis e hipocitraturia, situaciones que contribuyen en la litogénesis. En estos pacientes, la hidratación y el aporte oral de calcio, asociados al tratamiento de la enfermedad gastrointestinal, constituyen la base del tratamiento para prevenir su recurrencia. http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document La hiperoxaluria primaria tipos I y II son una enfermedad hereditaria rara, determinada por la ausencia de una enzima en el metabolismo del oxalato, que determina, tempranamente, nefrolitiasis, Nefrocalcinosis y falla renal. No hay un tratamiento médico efectivo para esta enfermedad, que habitualmente termina con la muerte del paciente. Se ha planteado recientemente en ellos la conveniencia del trasplante de hígado y luego renal. f) Nefrolitiasis Cálcica por Hipocitraturia El citrato constituye el anión mensurable más abundante en orina (>300 mg/día). Al unirse al calcio disminuye la concentración urinaria de éste y su capacidad de cristalización. La hipocitraturia frecuentemente se asocia con acidosis tubular renal tipo I, terapia con tiazidas, diarrea crónica y deshidratación, como también se observa en pacientes con ITU recurrente por un consumo bacteriano del citrato. El tratamiento preventivo consiste en aportar citrato de K, 20 a 30 mEq en tres dosis diarias. Urolitiasis no Cálcica a) Litiasis de Fosfato de Amonio Magnesiano o Coraliforme Se ve con mayor frecuencia en mujeres, pacientes con catéteres urinarios de uso prolongado y en pacientes con derivaciones urinarias, por su mayor frecuencia de infecciones de orina. Corresponde a cálculos de infección, asociados a gérmenes desdobladores de la urea, lo que determina un aumento del amonio urinario y por esta vía una alcalinización de la misma y precipitación de los cristales de fosfato de amonio magnesiano. Entre estas bacterias se encuentran el Proteus mirabilis, pseudomona, Klebsiella y estafilococo. Mediante el tratamiento antibiótico específico no es posible esterilizarlos, de tal manera que la remoción completa del cálculo es la única terapia eficaz. Sin embargo, presenta una alta tasa de recidiva que llega hasta el 35% a 5 años. El seguimiento y la profilaxis de ITU se han demostrado útiles en disminuir la frecuencia de falla renal a largo plazo. b) Litiasis por Acido Urico Puro Corresponde a menos del 5% de los cálculos, siendo más frecuente entre los varones, quienes presentan como factor de riesgo mayor la imposibilidad de alcalinizar su orina. Frecuentemente tienen un pH menor a 5.5 mEq/lt de orina, condición en la que el ácido úrico se mantiene no disociado, disminuyendo notoriamente su solubilidad, precipitando y formando cálculos radiolúcidos de ácido úrico puros. Muchos de ellos no tienen hiperuricosuria. El tratamiento preventivo se orienta a alcalinizar la orina con bicarbonato, citrato de K e hidratación, para obtener diuresis mayor a 2 lt. Así se obtiene una dilución de los cálculos en pacientes que se adhieren al tratamiento. Adicionalmente se puede restringir la ingesta de purinas y utilizar Alopurinol. http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document c) Urolitiasis por Cistina Lo presentan menos del 1% de los pacientes y se debe a un error congénito, en la absorción intestinal y renal tubular de aminoácidos dibásicos, incluyendo cistina, ornitina, lisina y anginina. La precipitación de cristales de cistina es su única expresión clínica. Se puede presentar frecuentemente asociado a litiasis cálcica, ya sea en forma de litiasis única, múltiple e incluso coraliforme. Constituye cálculos frecuentemente radiopacos, de bordes romos. No existen inhibidores de la cristalización de cistina; sin embargo, su solubilidad aumenta al alcalinizar la orina y promover diuresis mayor a 3 lt/d. Son cálculos frecuentemente duros a LEC, por lo que la extracción de ellos por técnicas mínimamente invasivas son óptimas, considerando su habitual recurrencia. Otros cálculos urinarios muy poco frecuentes: - Xantina, que se originan por un déficit congénito de la enzima Xantin oxidasa, cuyo tratamiento lo constituyen la desobstrucción urinaria, hidratación, alcalinización y a veces la remoción del cálculo. - Sílice (abuso de antiácidos), Triamterene y otros, constituyen ejemplos de urolitiasis por drogas. Su tratamiento es quirúrgico y suprimir la droga. Tabla1 Resumen de Presentación de Urolitiasis Tipo de Cálculos Cálcios (80%) No Cálcios (20%) Factor de Riesgo Hipercalciuria Hiperuricosuria Hiperoxaluria Hipocitraturia ITU pH orina bajo Cistinuria % de Condición Presentación a Rx 70 % Rx + Rx + Rx + 10 % Rx + 10 -15 % <5% <1% Rx +/Rx Rx - Presentación Clínica El cólico renal es el dolor característico de la obstrucción de la vía urinaria y corresponde a la forma más frecuente, en que los pacientes reconocen por primera vez esta enfermedad. Se debe al incremento de presión intraluminal y la distinción de terminaciones nerviosas de la vía urinaria proximal, desencadenada por la obstrucción. También este dolor se puede manifestar en forma no cólica, por distensión de la cápsula renal. Es de inicio abrupto y frecuentemente muy intenso, que logra despertar al paciente. Se acompaña de intranquilidad sicomotora, distensión abdominal y vómitos sin náuseas. La magnitud del cálculo no se asocia a la intensidad del http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document dolor, sin embargo su ubicación se proyecta a los dermátomos y raíces nerviosas correspondientes. Es así como en los cálculos renales, piélicos y del uréter alto se produce un dolor en fosa lumbar, por debajo de la duodécima costilla y lateral a la musculatura paravertebral. Se puede irradiar al flanco y cuadrante del abdomen superior del mismo lado. En cálculos del uréter medio y bajo el dolor se desplaza hacia el hipogastrio y área inguinoscrotal o del labio mayor ipsilateral. Frecuentemente si el cálculo se ubica en el uréter intramural se asocia a disuria dolorosa, polaquiuria y urgencia. En esta situación también puede presentarse hematuria. Diagnóstico Diferencial del Cólico Renal - Litiasis piélica y de uréter proximal • Cólico biliar • Colecistitis aguda • Pancreatitis aguda • Ulcera péptica gástrica o duodenal - Litiasis del uréter distal • Diverticulitis • Apendicitis aguda • Torsión testicular o epididimitis aguda • Enfermedad inflamatoria pelviana • Quiste ovárico complicado El dolor cólico habitualmente es prolongado debido a la vasodilatación y aumento del flujo renal que se observa por varias horas después de una obstrucción completa del uréter. Algunas horas después se inicia una vasoconstricción del mismo lado que disminuye el flujo renal, con lo que baja la filtración, contribuyendo junto al reflujo pielovenoso a disminuir la presión dentro del sistema. Por ambos mecanismos se explica que el dolor ceda espontáneamente después de algunas horas. Junto al dolor el paciente puede presentar hematuria pesquisable sólo con el sedimento de orina y sólo en ocasiones es macroscópica. La infección que acompaña habitualmente a los cálculos de fosfato de Amonio magnesiano generalmente es asintomática; sin embargo, si se asocia a obstrucción ureteral se puede desencadenar una pionefrosis y sepsis grave cuyo tratamiento incluye medidas habituales de sepsis, antibióticos específicos, descompresión y drenaje de la vía urinaria. Frecuentemente una nefrostomía percutánea o el ascenso de un catéter ureteral en doble J, por vía endoscópica si las condiciones del paciente lo permiten. Reconocer los síntomas y signos de infección como fiebre, taquicardia, vasodilatación e hipotensión precozmente es fundamental para entregar un tratamiento oportuno de esta complicación. Estudio Diagnóstico por Imágenes La Pielografía endovenosa (PIV) continúa siendo el examen radiológico que usamos con mayor frecuencia en los pacientes con sospecha clínica clara de urolitiasis. Nos entrega información anatómica del riñón y la vía urinaria. Indica el nivel de obstrucción, su repercusión e hidronefrosis y nos señala frecuentemente la situación del uréter distal a la obstrucción. También permite evaluar http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document las características de la vejiga y su vaciamiento, por último nos muestra la composición aproximada del cálculo (radiolúcido o radiopaco). Con estos antecedentes se puede elegir la mejor opción terapéutica para cada paciente. Finalmente, es un examen disponible en la mayor parte de los centros de atención médica. Requiere de una preparación intestinal para remover el aire del tubo digestivo y una función renal suficiente (creatinemia < 2 mg/dl o clearance de Cr >30 ml/min.), que permita concentrar el contraste y brindar una imagen satisfactoria de la anatomía. No debe realizarse en pacientes alérgicos al medio de contraste endovenoso iodado. La radiografía renal y vesical simple, asociada a la ecotomografía, puede ser un método útil en pacientes con sospecha clínica dudosa o en quienes tienen deterioro de la función renal o alergia al medio de contraste. La Rx renal simple puede detectar con alta sensibilidad cálculos mayores de 3 mm, sin embargo también requiere de preparación intestinal. La ecotomografía es un método operador dependiente, que permite evaluar el parénquima renal y la presencia de hidroureteronefrosis, visualizando pequeños cálculos con alta sensibilidad, tanto renales como del uréter proximal y yuxtavesical. Aporta en el diagnóstico diferencial con otras patologías abdominales y pelvianas. Sin embargo, la hidronefrosis o dilatación del sistema, sólo se manifiesta después de aproximadamente 6 horas de iniciada la obstrucción completa del uréter, de tal forma que la ausencia de dilatación ecográfica no descarta la litiasis en los pacientes con cólico renal. Tampoco es útil en la visualización del uréter lumbar y puede tener falsos positivos (pérdida de especificidad) en pacientes con pelvis extrarrenal y patología quística del riñón. Recientemente la implementación de la Tomografía Axial Computada Helicoidal, sin contraste intravenoso, de abdomen y pelvis llamada Pielo TAC, permite detectar leves hidronefrosis y pequeños cálculos incluyendo los radiolúcidos desde el riñón y a lo largo de todo el uréter en un procedimiento rápido (minutos), operador independiente y que no requiere de contraste ni función renal mínima. Su gran ventaja respecto de la PIV es que aporta en el diagnóstico diferencial, señalando la verdadera causa del dolor abdominal con una sensibilidad y especificidad reportada superior al 95%. Esto lo hace un examen atractivo para su uso en atención de urgencia de un paciente con dolor abdominal de causa no clara. Sin embargo, en aquellos pacientes que demuestran una litiasis como causa del dolor, frecuentemente no nos informa de la composición del mismo ni la anatomía del uréter distal, elementos fundamentales en la elección del tratamiento. La Pielografía Retrógrada o Ascendente (UPR) se usa ocasionalmente en el estudio de los pacientes con hidronefrosis sin causa clara por los exámenes anteriores. Tratamiento Frente a un paciente con cólico renal, lo primero es reconocer semiológicamente el cuadro y aliviar el dolor. En este sentido, dada la intensidad del dolor, preferimos el uso de analgésicos puros por vía parenteral, http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document sin anticolinérgicos, por los síntomas cardiovasculares y digestivos asociados a su empleo. Si no hay respuesta, pueden emplearse opiáceos. Si el dolor cede y el paciente se recupera satisfactoriamente, no es necesario hospitalizarlo, indicándosele control por urólogo, realizando su estudio en forma ambulatoria ( PIV). Habitualmente la mayor parte de los cálculos (90%) migran espontáneamente, dependiendo del diámetro y la ubicación de éste al diagnóstico. En efecto, aquellos menores a 5 mm y del tercio distal habitualmente son expulsados antes de los 10 días. Si miden entre 5 y 10 mm, la migración espontánea del cálculo es menos frecuente y la indicación de intervenir estará dada por la presencia de dolor recurrente especialmente si no hay progresión del cálculo o se asocia a hidronefrosis. En cálculos de mayor tamaño (mayor a 10 mm), la expulsión espontánea es muy infrecuente. Si a la obstrucción producida por la litiasis se asocia infección de la vía urinaria, independiente al tipo, tamaño y ubicación del cálculo, se debe considerar drenar la vía urinaria con urgencia, por la vía que el urólogo estime más conveniente, además del tratamiento antibiótico. Esta urgencia está determinada tanto por la grave repercusión sistémica de la infección (sepsis) como por el acelerado daño que ocurre en la unidad renal comprometida por la obstrucción e infección simultáneas. Esto es especialmente grave en pacientes monorrenos o entre quienes presentan deterioro previo de su función renal, situación que no es infrecuente entre los litiásicos, por su alta recurrencia. Tratamiento Quirúrgico Litotricia Extracorpórea (LEC) En la actualidad, constituye la alternativa con la que se tratan más del 95% de los pacientes que requieren de tratamiento quirúrgico. Corresponde a una forma de fragmentación de los cálculos, no invasiva, en que por medio de ondas acústicas supersónicas pulsadas determinan presiones entre 500 y 1.500 bar al focalizarlas en el cálculo, quebrándolo por su falta de elasticidad. Los fragmentos son eliminados espontáneamente por la vía urinaria. Los aparatos de litotricia se distinguen por la forma en que generan esta energía (electrohidráulicos, electromagnéticos, piezoeléctricos), por su sistema de focalización del cálculo (ecográfico y/o radiológico) y por el sistema de acoplamiento entre la unidad generadora y el paciente. Si el paciente se mueve o el cálculo se desplaza durante el tratamiento, este se debe volver a ubicar en el punto focal. En este sentido es muy importante la analgesia, dado que en general se produce dolor de magnitud variable, entre los 2.000 a 4.000 golpes o tiros que necesite el tratamiento. En la medida que el área de acoplamiento sea mayor y la densidad de energía por cm2 de piel sea menor, menor es el grado de analgesia requerida. Algunos aparatos permiten utilizar sedación endovenosa, otros requieren de anestesia formal. El éxito del tratamiento depende del volumen del cálculo, su conformación y ubicación. También es imprescindible que el paciente pueda expulsar los fragmentos. Dureza y fragmentación en orden decreciente: - Cistina http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document - Fosfato de calcio Acido úrico Oxalato de calcio Fosfato de amonio magnesiano El gran éxito en la fragmentación y la mínima tasa de complicaciones, asociado a su condición no invasiva y frecuentemente ambulatoria, explican que la LEC haya desplazado actualmente por lejos a todas las otras alternativas terapéuticas en la litiasis urinaria. Las complicaciones que se pueden observar son infección y/o sepsis en menos del 1% de los tratados, calle de piedra entre 1 a 5% (fragmentos impactados en uréter distal) y hematoma subcapsular, subclínico en 0,6%. Ocasionalmente se pueden ver otras complicaciones como pancreatitis y neumonitis, especialmente en niños. De lo anterior se entiende por qué está contraindicado su empleo en pacientes con obstrucción distal, infección y coagulopatía no tratadas. Así también está contraindicado durante el embarazo y en pacientes con calcificaciones aórticas y arterias renales cercanas al cálculo. Cirugía Endoscópica a) Ureterorrenoscopia (URN) Corresponde a un procedimiento en que por vía endoscópica se aborda el uréter desde el meato ureteral en vejiga, utilizando un instrumento rígido o flexible por donde se logra visualizar el cálculo y, si es necesario, fragmentarlo (láser, ultrasonido, electrohidráulico) extrayéndolo completo o por fragmentos. Generalmente se realiza con anestesia regional o general y ayudado por radioscopia intraoperatoria. Requiere una hospitalización de alrededor de 3 días. Precozmente los pacientes pueden reintegrarse a su trabajo (1 semana). Actualmente este procedimiento se reserva como una alternativa a la LEC en la litiasis del uréter distal o cuando esta ha fallado. Tiene una eficacia cercana al 100%. La morbilidad asociada (5%) es de baja frecuencia y se debe a bacteremias, hematuria y tromboflebitis. Menos frecuentes son la lesión y falsas vías del uréter. b) Nefrolitectomía Percutánea (NPC) Corresponde al abordaje renal directo por vía percutánea lumbar. Requiere de la realización de una punción renal, habitualmente de los cálices inferiores, bajo control radioscópico y dilatación del trayecto percutáneo, por medio del nefroscopio y con visualización directa de la pelvis renal, los cálices y de la unión ureteropiélica. Es un procedimiento complejo que requiere de anestesia general y radioscopia intraoperatoria, cuya morbilidad es semejante a la cirugía abierta. Sin embargo, le ofrece al paciente una recuperación con menos dolor, hospitalización de 4 a 5 días y una reincorporación a su trabajo más precoz. Por esta vía se pueden extraer y/o fragmentar cálculos piélicos, calicilares o del uréter proximal que no se logran tratar con LEC. También se ha planteado esta técnica para los cálculos coraliformes parciales en forma combinada a la LEC para extraer los fragmentos residuales. http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document Cirugía Abierta de la Urolitiasis Hasta hace 20 años, esta era la alternativa más frecuente para resolver los cálculos a cualquier nivel. Hoy representa a menos del 20% de los procedimientos por litiasis y en general se reserva para los casos en que ha fallado la LEC o la cirugía endoscópica. También corresponde a la alternativa que con mayor eficacia resuelve una emergencia secundaria a una litiasis (piohidronefrosis). Requiere una implementación en pabellón, de menor complejidad, y por lo tanto se puede realizar en una mayor cantidad de centros. Le ofrece al paciente la mayor tasa de éxito, cercana al 100%, pero el postoperatorio es más largo, con una reinserción laboral más tardía. La cirugía abierta de riñón permite extraer cálculos de la pelvis por pielotomía como también por nefrotomía. En el caso de los cálculos coraliformes, frecuentemente se realiza una apertura renal a través del parénquima, por la convexidad, abriéndolo como un libro en lo que se ha denominado nefrolitomía anatrófica o bivalva. Por esta vía se logra extraer grandes y complejos cálculos que se desarrollan, rellenando los cálices y la pelvis renal como un coral. Esta técnica requiere el clampeo de la arteria renal e isquemia transitoria, incisión y sutura de parénquima, vasos intrarrenales y cálices. Si a lo anterior se suma la infección y daño renal que habitualmente acompañan a estos pacientes se entenderá lo complejo y riesgoso del procedimiento. Este es el procedimiento que entrega mayor eficacia en remover todos los cálculos y fragmentos en una sola operación. La estadía postoperatoria es de 8 a 9 días y requiere reposo postoperatorio de aproximadamente 4 a 6 semanas. La morbilidad de la nefrolitectomía Anatrófica está determinada por hematuria, sangrado y filtración de orina perirrenal, infección urinaria y de herida operatoria, además de las complicaciones propias de la cirugía general. Se asiste a un deterioro de la función renal entre el 7 a 12% de los casos y una recidiva a 5 años, cercana al 30%. Tabla 2 Resumen Comparativo de Resultados en el Tratamiento de Litiasis Coraliforme Mayor de 3 CM Libre Morbilidad Mortalidad Recurrencia N° Cálculo % % % Proced. % NPC + LEC C. anatrófica LEC 80 24 0,002 2,8 81 11 0,006 12 1,0 50 30 0,087 5,8 2,1 La Cirugía Abierta del Uréter Cada día es menos frecuente, especialmente en el uréter distal, donde la han desplazado la LEC y la cirugía endoscópica. Sin embargo, en uréter lumbar y en cálculos mayores de 2 cm, que no se logran ubicar radioscópicamente por sobre proyección de vértebras, ala sacra o ilíaca, tiene una eficacia cercana al 100%, con una estadía hospitalaria de 4 días y reposo postoperatorio de 4 http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document semanas. Tabla 3 Comparativo de Resultados en el Tratamiento de Uréter Alto y Bajo LEC NPC C. abierta LEC URN C. abierta Litiasis de Uréter Alto Libre Cálculo Morbilidad N° % % Proced. 82 4 1.32 86 9 1.02 97 8 1 Litiasis de Uréter Bajo Libre Cálculo Morbilidad N° % % Proced. 86 3 1.24 90 9 1.04 87 8 1.01 Litiasis de Vejiga Esta era la ubicación más frecuente reportada en el siglo pasado, especialmente en niños asociados a desnutrición y pobreza. Sin embargo, hoy gracias a la mejoría en nutrición su incidencia ha disminuido. Actualmente se presenta con mayor frecuencia en hombres mayores de 50 años con uropatía obstructiva baja e infección urinaria por distintas causas: hiperplasia benigna de próstata, estenosis de cuello vesical, estenoisis de uretra, disfunción neuropática de vejiga con mal vaciamiento y divertículos de vejiga. Otros cálculos se forman por cuerpos extraños intravesicales como suturas, catéteres o fragmentos de ellos. Por estas razones, la litiasis por estruvita es relativamente más frecuente en esta localización. Estos pacientes presentan síntomas propios de la patología predisponente y/o de infección urinaria. Generalmente presentan disuria dolorosa, micción interumpida por obstrucción y hematuria. Es típico que el paciente note mejoría en su micción en posición lateral. El diagnóstico se realiza con ecotomografía vesicoprostática, Rx. vesical simple y se confirma con cistoscopia. En su tratamiento se debe considerar por una parte tratar la uropatía obstructiva que generalmente los acompaña y, por otra, la remoción del cálculo, en forma simultánea. El urólogo, de acuerdo al diagnóstico y las http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document condiciones del paciente, planteará la alternativa más conveniente. Bibliografía Recomendada Spirnack P. and Resnick M.: Urinary Stones en: Smith General Urology: Appleton & Lange, 1988. Urinary Lithiasis en Campbell’s Urology, sixth edition, pág. 2083, 1992. González G. and Pak C.: Nephrolithiasis, en: Clinical Nephrology Dialysis and Transplantation: Dustri-Verlag,1999. Resnick M.: Urolithiasis, en Urologic Clinics of North America: Vol 24, 1997. Bengió R y Martínez C.: Análisis clínico y de costo beneficio de las alternativas terapéuticas de la litiasis urinaria. Rev. Chil. Urol. 62: 31, 1997. Martínez C., Guzmán S, Marzari A. et al: Estado actual de la cirugía de la urolitiasis en la Universidad Católica, años 1996-1997. Rev. Chil. Urol. 64: 223, 1999. Zambrano N., Dell´Oro A, Santa Cruz G. et al: Tratamiento quirúrgico de la litiasis coraliforme. Evaluación a largo plazo. Rev. Chil. Urol. 62: 77, 1997. http://escuela.med.puc.cl/publ/manualUrologia/LitiasisUrinaria.html[9/7/2009 3:13:49 PM] Untitled Document Generalidades Las litiasis en el tracto urinario son menos frecuentes en la población pediátrica que en los adultos. La forma de presentación más frecuente es la infección urinaria y la hematuria. El cólico renal se presenta en menos del 50% de los niños, especialmente en los escolares y adolescentes. Con respecto a su etiología, las causas metabólicas conforman un 52% de las urolitiasis en pediatría, las infecciones urinarias un 13.4% y las condiciones idiopáticas un 18.7% (Tabla 1). Tabla 1 Causas de Urolitiasis en niños Infección urinaria Hipercalciuria Acido úrico Hiperoxaluria Cistinuria Idiopáticas otras 13.4% 42.0% 3.6% 2.7% 4.5% 18.7% 15.1% Diagnóstico En la evaluación inicial es importante consignar el antecedente de infecciones urinarias previas, malformaciones del tracto urinario y el antecedente familiar de litiasis. Además la historia de excesos y deficiencias en la dieta alimentaria, ingesta de vitaminas y medicamentos, etc. En el examen físico deben consignarse el crecimiento y desarrollo pondoestatural y la presión arterial. Dentro del sedimento de orina debe buscarse la presencia de cristaluria. Los niveles normales se demuestran en la Tabla 2. Tabla 2 Valores normales de cristales urinarios en niños Calcio Acido úrico http://escuela.med.puc.cl/publ/manualUrologia/LitiasisPediatria.html[9/7/2009 3:14:06 PM] <4 mg/kg/día <0.56 mg/dl GFR Untitled Document Oxalato Cistina Citrato Volumen <50 mg/1.73 m2/día <60 mg/1.73 m2/día >400 mg/g creatinina >20 ml/kg/día El estudio clínico debe comprender un urocultivo, el estudio metabólico especialmente dirigido al diagnóstico de hipercalciuria y el estudio radiológico, este último para detectar la localización, el tamaño y las características del cálculo, como también sus consecuencias y eventuales factores predisponentes como malformaciones del tracto urinario. El estudio radiológico inicial en pediatría comprende una ultrasonografía renal y vesical asociada a una radiografía renal simple o un pieloscanner. La pielografía de eliminación solo se reserva para aquellos pacientes en que se va a realizar algún procedimiento quirúrgico. Siempre que sea posible la evaluación debe comprender el estudio del cálculo (Tabla 3). Tabla 3 Composición de los cálculos en pacientes pediátricos Componentes Oxalato de calcio Fosfato de calcio Struvita Cistina Acido úrico mixto % 45-65 14-29 13 5 4 4 Hipercalciuria La hipercalciuria es la causa más frecuente de urolitiasis en niños (42%). Las condiciones más frecuentemente asociadas a hipercalciuria en pediatría son la terapia con furosemida, prednisona, ACTH y acidosis tubular aguda. La hipercalciuria idiopática se define como hipercalciuria sin hipercalcemia o causa conocida. El diagnóstico de excreción anormal de calcio se hace por una elevada relación entre el calcio y la creatinina urinaria, cuyo valor depende de la edad del niño (Tabla 4) y una excreción de calcio en 24 horas > 4 mg/kg. Tabla 4 Valor normal de la relación entre calcio y creatinina urinaria según edad Edad 0-6 meses 7-12 meses >2 años Calcio/creatinina mg/mg <0.8 <0.6 <0.2 El tratamiento de la hipercalciuria consiste en aumentar la ingesta de líquidos, http://escuela.med.puc.cl/publ/manualUrologia/LitiasisPediatria.html[9/7/2009 3:14:06 PM] Untitled Document restricción moderada de sodio y escasa restricción de calcio en la dieta, indispensable en el desarrollo óseo de los pacientes pediátricos. También se ha usado como terapia la hidroclorotiazida (1-2 mg/kg/día) en los casos de hipercalciuria requiriendo esta de un monitoreo estricto para diagnosticar los efectos adversos de hipokalemia y hiperlipidemia propios de esta terapia. Infección Urinaria En los casos de urolitiasis secundaria a infección urinaria, además del estudio habitual de la litiasis, el estudio radiológico debe comprender una ultrasonografía renal y vesical y una uretrocistografía miccional seriada para descartar la presencia de una malformación urinaria como causal. El tratamiento va orientado principalmente a la corrección quirúrgica de la anomalía. Tratamiento Con la incorporación de métodos menos invasivos en el tratamiento de la urolitiasis, la cirugía abierta queda reservada para los casos de malformaciones urológicas asociadas, los cálculos coraliformes o la falla de otras terapias menos invasivas. La litotripsia extracorpórea (ESWL) es ampliamente usada en pediatría sin haber sido demostrado que esta altere la función renal ni el crecimiento renal. En pediatría es un procedimiento bajo anestesia general, cuyas contraindicaciones son las malformaciones del tracto urinario, alteraciones de coagulación e hipertensión arterial. Una limitación técnica puede ser la talla del niño para evitar lesiones pulmonares; en general las indicaciones bajo los dos años son excepcionales. El resultado con la ESWL en pediatría varía desde un 50-100%, dependiendo del tamaño del cálculo, la localización, composición y el tipo de máquina usada. Los procedimientos endoscópicos y percutáneos son de utilidad en la población pediátrica, con el inconveniente de las limitaciones en cuanto a instrumental disponible. La conducta terapéutica depende fundamentalmente de la localización del cálculo (Tabla 5). La cirugía abierta se plantea de entrada en los niños con malformaciones congénitas asociadas. Tabla 5 Opción de Tratamineto de la Urolitiasis en Pediatría Según su Localización Ubicación Renal Uréter Proximal Uréter distal mujer Uréter distal varón Terapia Opción 1° Terapia Opción 2° ESWL Percutáneo o cirugía ESWL Percutáneo o cirugía Endóscopio cirugía ESWL cirugía http://escuela.med.puc.cl/publ/manualUrologia/LitiasisPediatria.html[9/7/2009 3:14:06 PM] Untitled Document http://escuela.med.puc.cl/publ/manualUrologia/LitiasisPediatria.html[9/7/2009 3:14:06 PM] Untitled Document Introducción Existen distintas clasificaciones de tumores renales, sin embargo, prácticamente ninguna de ellas ofrece una manera simple y sistemática de agruparlos. Figura 1: Distribución por frecuencia de los tumores renales. Una manera sencilla de agrupar los tumores renales es de acuerdo al origen de éstos. Así tenemos: - Tumores derivados del epitelio tubular: • benignos • malignos - Tumores derivados del estroma: • benignos (fibroma, lipoma, leiomiosarcoma, etc.) • malignos (fibrosarcoma, liposarcoma, rabdomiosarcoma, etc.) - Tumores derivados del urotelio: • Carcinoma de células transicionales • Carcinoma escamoso (epidermoide) • Adenocarcinoma Figura 2: Grados I, II y III del adenocarcinoma renal. Los tumores derivados del epitelio tubular son los que deben concentrar nuestra atención, por su frecuencia e implicancias clínicas. Clasificación de los Tumores Renales (derivados del epitelio) - Malignos: • (Carcinoma de células renales) • Convencional o común (células claras): • Papilar - Cromófobo • De túbulo colector • No clasificable Figura 3 Ecotomografía con la presencia de masa renal asintomática. 70-80% 10-15% 5-10% 1% 5% - Benignos: • Adenoma papilar • Oncocitoma • Adenoma metanéfrico http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document Carcinoma de Células Renales Epidemiología Figura 4 : Tomografía computada de adenocarcicoma ranal, hallazgo de ecotomografía realizada por dolor abdominal. Aproximadamente 28.800 casos nuevos de carcinoma renal son diagnosticados anualmente en los EE.UU. y son causa de más de 11.300 muertes al año. El cáncer renal aparece a una edad promedio de 65 años y los hombres se afectan aproximadamente dos veces más frecuente que las mujeres. Un número importante de factores ambientales han sido implicados en la etiología del cáncer renal, incluyendo el tabaco, obesidad, exposición a cadmio, asbesto y productos petroquímicos. Este tumor, así como el de mama, colon y próstata, se puede presentar en forma hereditaria o esporádica (no hereditaria). Ejemplos de cáncer renal hereditario son: Figura 5 Nefrectomía parcial del mismo tumor en paciente de 45 años. Los márgenes fueron negativos. - Asociado a la enfermedad de Von Hippel-Lindau (VHL) [mutación del gen VHL (3p)] - Asociado a translocación t(3;8), t(3;6) o t(2;3) - Cáncer renal papilar hereditario [mutación del gen met (7q)] Patología El cáncer renal convencional (células claras) está compuesto, predominantemente, por células con citoplasma claro (por su alto contenido de lípidos y glicógeno), pudiendo coexistir áreas de células granulares. La arquitectura es habitualmente sólida, con algunas áreas quísticas y, ocasionalmente, alguna estructura papilar. Transformación sarcomatosa ocurre hasta en un 5% de estos tumores. Se presume que este tumor se origina del epitelio tubular proximal. La lesión se origina en la corteza y tiende a crecer hacia el tejido perinefrítico. No posee cápsula propia, pero frecuentemente se constituye una pseudocápsula compuesta por parénquima renal comprimido, tejido fibroso e infiltrado inflamatorio. Calcificaciones intratumorales son características de este tumor. Figura 6 : Preparación para la extirpación de tumor renal con compromiso de vena renal y cava. Patogenia Son tumores hipervascularizados que tienden a invadir el tejido perinefrítico, órganos adyacentes y a extenderse directamente a la vena renal y a la vena cava inferior (VCI). Aproximadamente el 40% de los pacientes tienen una enfermedad ya diseminada al momento del diagnóstico, siendo el pulmón el sitio a distancia más frecuentemente comprometido. Otros sitios frecuentes son hígado, hueso, ganglios linfáticos, suprarrenal y riñón contralateral. Etapificación Una correcta etapificación permite tomar una conducta terapéutica http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document Figura 7: Extirpación de tumor renal con trombo tumoral de vena renal y cava. determinada y establecer un pronóstico. Para ello se requiere de una historia clínica completa, examen físico, exámenes de laboratorio (HMG+VHS, perfil bioquímico, orina completa), radiografía de tórax (ocasionalmente TAC de tórax), TAC abdominal y rara vez de una cintigrafía ósea. Las dos clasificaciones más usadas son la de Robson y la TNM (de la UICC y AJCC). Esta última es más acuciosa en evaluar la extensión de la enfermedad y, por ende, en establecer un pronóstico más certero. Clasificación de Robson Figura 8: Ecotomografía con hallazgo de masa renal asistomática Figura 9 la tomografía confirma presencia de masa que por su densidad es considerada angiomiolipoma Etapa I: Tumor confinado al parénquima renal. Etapa II: El tumor invade la grasa perinefrítica, pero está confinado al interior de la fascia de Gerota (incluyendo suprarrenal). Etapa IIIA: El tumor afecta la vena renal principal o la vena cava inferior. Etapa IIIB: El tumor invade ganglios linfáticos regionales. Etapa IIIC: El tumor afecta vasos locales y ganglios linfáticos regionales. Etapa IVA: El tumor invade órganos vecinos (colon, páncreas, etc.). Etapa IVB: Metástasis a sitios distantes. Clasificación TNM (1997) Tumor primario (T)(Toda magnitud referida al diámetro mayor):TX: Tumor primario no puede ser evaluado. T0: Sin evidencia de tumor primario. T1: Tumor de 7,0 cm o menos, confinado a riñón. T2: Tumor mayor 7,0 cm, confinado a riñón. T3: Tumor se extiende a venas principales, glándula suprarrenal o tejido perirrenal, pero confinado a la fascia de Gerota. T3a: Tumor invade glándula suprarrenal o tejidos perirrenales, confinado a la fascia de Gerota. T3b: El tumor visiblemente invade una o ambas venas renales o la vena cava, por debajo del diafragma. T3c: El tumor visiblemente invade una o ambas venas renales o la vena cava, por encima del diafragma. T4: El tumor invade más allá de la fascia de Gerota. Ganglios linfáticos regionales (N):NX: No se pueden evaluar los ganglios linfáticos regionales. NO: No hay metástasis a ganglios regionales. N1: Metástasis a un solo ganglio linfático regional. N2: Metástasis a más de un ganglio linfático regional. Metástasis a distancia (M):MX: No es posible evaluar metástasis a distancia. M0: No hay metástasis a distancia. M1: Metástasis a distancia. http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document Agrupamiento por etapas: Etapa I: T1 N0 M0 Etapa II: T2 N0 M0 Etapa III: T1 N1 M0 T2 N1 M0 T3a N0,N1 M0 T3b N0,N1 M0 T3c N0,N1 M0 Etapa IV: T4 cualquier N M0 Cualquier T N2 M0 Cualquier T cualquier N M1 Clínica a) Síntomas y signos - Tríada clásica: hematuria, dolor lumbar y masa palpable. Sólo presente en 10-15% de los pacientes. Generalmente indica enfermedad avanzada. Figura 10: Aspecto cistoscópico de forma de tumores vesicales. • Hematuria (Micro o macroscópica): 60% • Dolor: 41% • Masa palpable: 24% - Síntomas derivados de enfermedad metastásica (disuria, tos, dolor óseo, etc.): puede ser el síntoma inicial en hasta 30% de los enfermos. Actualmente, con el uso frecuente de métodos de diagnóstico por imágenes (especialmente la ecografía), el diagnóstico incidental de un tumor renal puede llegar hasta el 50% (asintomáticos). b) Síndromes paraneoplásicos - eritrocitosis : 3 -10% - hipercalcemia : 3 -13% - hipertensión : hasta 40% - disfunción hepática (síndrome de Stanffer): elevación de fosfatasas alcalinas e hiperbilirrubinemia, hipo albuminemia, prolongación del tiempo protrombina de hipergamaglobulinemia. c) Laboratorio - Es frecuente encontrar anemia, hematuria y VHS elevadas. - Estas alteraciones son inespecíficas y su normalidad no descarta el diagnóstico. d) Radiología - Ecografía:Método sencillo, rápido, no costoso; sin embargo, operador dependiente. Ha permitido el diagnóstico precoz e incidental de un alto porcentaje de tumores renales. - Ecografía Doppler:Permite evaluar extensión de compromiso vascular (V. Renal y VCI). http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document - Pielografía de eliminación:Es el estudio diagnóstico inicial de un paciente con hematuria. No logra pesquisar tumores de la corteza que no deformen la vía urinaria, y que no sean exofíticos. - TAC: • Método diagnóstico y de etapificación de elección. • Masa sólida, heterogénea, con calcificaciones, que capta medio de contraste. • Permite evaluar compromiso y extensión local, ganglios regionales, compromiso de vena renal y VCI, metástasis intraabdominales. En casos de duda en radiografía de tórax: TAC de tórax. Si existe sospecha de compromiso de SNC: TAC de cerebro. - Arteriografía: • Uso excepcional, actualmente desplazada por la TAC. • Util en algunos casos de cirugía conservadora. - Resonancia Nuclear Magnética: • No es superior a TComputada en el diagnóstico. • Permite evaluar extensión de compromiso vascular (V. Renal y VCI) • No irradia y no requiere de medio de contraste. Tratamiento Enfermedad Localizada El tratamiento quirúrgico es el único tratamiento curativo para el cáncer renal, hasta el momento. Una adecuada etapificación es indispensable para decidir la terapia más apropiada. La nefrectomía radical es el tratamiento estándar en esta etapa. El rol de la linfadenectomía es controversial; sin embargo, tiene utilidad para establecer un pronóstico más preciso, pero no tendría un rol terapéutico. En pacientes con tumores bilaterales, riñón único, enfermedad renal previa o insuficiencia renal, se plantea un tratamiento más conservador, preservando tejido renal, como la nefrectomía parcial o la tumorectomía. En tumores menores o iguales a 4 cm de diámetro, aun con riñón contralateral normal, debiera intentarse una cirugía conservadora. La recurrencia y las tasas de sobrevida son comparables a los obtenidos con la cirugía radical. Cirugía en casos con extensión local de la enfermedad. Enfermedad Diseminada En esta etapa (metástasis a distancia), la nefrectomía está indicada solamente como tratamiento paliativo, en cuadros de dolor intratable, hematuria persistente significativa, presencia de síndrome paraneoplásico, o como medida previa al uso de inmunoterapia. - Radioterapia: No es efectiva en el tratamiento del cáncer renal. Eventualmente, se indica como terapia paliativa (alivio del dolor) en lesiones metastásicas óseas. http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document - Hormonoterapia: El uso de progestágenos, andrógenos y antiestrogénicos no han demostrado una mejoría en la sobrevida. Las respuestas no son mayores al 1-2%. - Quimioterapia: Este tipo de tumores no responde a quimioterapia .- Inmunoterapia: • Diversos agentes y esquemas han sido utilizados en el tratamiento de estos tumores, sin embargo, los resultados no son muy alentadores. Estos incluyen, por ejemplo, el uso de interferón, células asesinas activadas por linfoquinas (LAK), linfocitos activados infiltrantes de tumores (TIL), interleukina 2 (IL-2), y otros. • La respuesta global de estos agentes moduladores de la inmunidad no va más allá de un 15-25%, con una duración media de aproximadamente 12 meses. • El agente más utilizado es la IL-2. En pacientes altamente seleccionados, las respuestas pueden llegar hasta aproximadamente 35%. • Todas estas terapias son de alto costo y con morbimortalidad considerable. Seguimiento No existe consenso con respecto a la frecuencia de controles que debieran tener los pacientes tratados por un cáncer renal. Pacientes sometidos a nefrectomía radical debieran controlarse cada 3 a 4 meses durante el primer año, cada 6 meses durante los siguientes 2 años y posteriormente, 1 vez al año, al menos por 10 años. En cada control debiera realizarse una historia y examen físico completo, radiografía de tórax, HMG + VHS, exámenes de función renal y hepática. Estudio por imágenes de la cavidad abdominal debiera solicitarse 2 veces al año los primeros 3 años y luego, anualmente. Pronóstico La sobrevida a 5 años de pacientes sometidos a nefrectomía radical depende de la etapa en que se encuentre el tumor. Etapa Etapa Etapa Etapa I: II : III : IV : 60-82% 47-80% 35-51% 5% a 1 año Estudios más recientes reportan sobrevidas a 5 años de: TI : T2-T3 a : http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] 88-100% 60% Untitled Document T3b : M1 : 15-20% 0-20% (Estos resultados consideran la clasificación TNM previa a 1997, en donde los T1 son tumores < 2,5 cm, confinados al riñón; T2: >2,5 cm, confinado al riñón; T3a: compromiso suprarrenal o tejido perinefrítico, pero confinado a fascia de Gerota y T3b: compromiso de vena renal o vena cava inferior). Oncocitoma Renal Tumor que se origina del túbulo distal; se presume de las células intercaladas del túbulo distal. El clásico oncocitoma es, por definición, un tumor benigno, sin potencial metastásico y constituye un 3-5% de los tumores renales. Está compuesto, predominantemente, por células grandes eosinofílicas, en forma de nidos celulares. Su citoplasma se caracteriza por su alto contenido de mitocondrias, como lo demuestra la microscopia electrónica. Macroscópicamente, es un tumor rodeado de una cápsula fibrosa bien definida y que, rara vez, compromete la grasa perirrenal y el parénquima renal. De color café claro al corte, posee una cicatríz estrellada en el centro, especialmente en tumores grandes. Clínica No existen diferencias clínicas significativas con el cáncer renal y su diagnóstico se basa, predominantemente, en la anatomía patológica. El estudio radiológico rara vez puede sugerir su diagnóstico, por lo cual el manejo es similar al de un tumor sólido renal. Tratamiento Debe manejarse como todo tumor sólido renal.La biopsia por punción es poco confiable, por lo cual la nefrectomía radical o parcial, dependiendo del tamaño del tumor, es el tratamiento de elección. Angiomiolipoma Tumor benigno raro, considerado un hamartoma renal, está compuesto por 3 elementos histológicos mayores: células adiposas maduras, músculo liso y vasos sanguíneos. Este tumor se presenta en un 45-80% de pacientes con esclerosis tuberosa, siendo habitualmente bilateral y asintomático. En pacientes sin esta enfermedad, el tumor tiende a ser unilateral y de mayor tamaño, pudiendo extenderse a la grasa perinefrítica. Hasta en un 25% de los casos se puede presentar como ruptura espontánea y hemorragia retroperitoneal. Radiología http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document La ecografía y la TAC permiten hacer el diagnóstico en aquellos tumores con alto contenido de tejido adiposo. Ecografía: imagen con alta intensidad de ecos (grasa). TAC: el tejido graso tiene una densidad negativa (-20 a -80 unidades de Hounsfield), lo cual es patognomónico de un angiomiolipoma, si es que esta imagen se presenta como un tumor sólido en el riñón. Tratamiento Lesiones aisladas de hasta 4 cm pueden observarse y controlarse periódicamente con ecografía o TAC. Lesiones mayores de 4 cm tienen un riesgo de ruptura más elevado, por lo cual debieran resecarse o embolizarse. Algunos autores plantean que si las lesiones son asintomáticas, éstas pudieran observarse, con control, al menos cada 6 meses. Tumores del Urotelio Los tumores de urotelio se originan de la mucosa que recubre toda la vía urinaria: alta (cálices, pelvis y uréter) y baja (vejiga y uretra). Centraremos nuestra atención en los más frecuentes, es decir, en el cáncer de vejiga y de pelvis renal. Cáncer Vesical Epidemiología El cáncer de vejiga es el segundo cáncer más frecuente del tracto genitourinario. Es más frecuente en el hombre que en la mujer (2,7:1) y la edad promedio de presentación es de 65 años. Al momento del diagnóstico, aproximadamente el 85% de estos tumores están confinados a la vejiga y 15% ya están diseminados. Etiología y Patogenia: Varios factores etiopatogénicos han sido identificados en esta neoplasia, como el tabaco, que sería responsable del 50% de los tumores en el hombre y del 30% en las mujeres. Así también, la exposición a ciertos agentes químicos, pinturas, tinturas, cuero y goma han sido relacionados con el cáncer de vejiga. Se mencionan también el uso de ciclofosfamida y el trauma físico crónico al urotelio, inducido por infección, instrumentación y cálculos. Alteraciones genéticas son frecuentes en este tumor. La pérdida del brazo largo del cromosoma 9 (9q) ocurre en prácticamente todos los cánceres vesicales, por lo cual este es un evento precoz en el desarrollo de este tumor. Cambios tardíos serían pérdida de material genético en el brazo corto de los cromosomas 11 y 17 (11p y 17p), eventos que han sido relacionados con la progresión del tumor. El gen p53 se ubica en el brazo corto del cromosoma 17 http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document (17p), cuya mutación es frecuente en tumores vesicales. Etapificación La clasificación más usada, actualmente, es la propuesta por la Union Internationale Contra le Cancer (UICC) y la American Joint Committee on Cancer (AJCC), que utilizan el sistema TNM. Clasificación TNM (1997) Tumor primario (T): TX: Tumor primario no puede ser evaluado. T0: Sin evidencia de tumor primario. Ta: Carcinoma papilar no invasor (compromete sólo mucosa). Tis: Carcinoma in situ: tumor plano. T1: Tumor invade tejido conectivo subepitelial. T2: Tumor invade músculo (detrusor) T2a: Tumor invade mitad superficial de músculo. T2b: Tumor invade mitad profunda de músculo. T3: Tumor invade tejido perivesical T3a: Microscópicamente. T3b: Macroscópicamente (masa extravesical). T4: Tumor invade tejidos u órganos adyacentes. T4a: Tumor invade próstata, útero o vagina. T4b: Tumor invade pared pelviana o abdominal. Ganglios linfáticos regionales (N): NX: No se pueden evaluar los ganglios regionales. N0: Sin metástasis a ganglios regionales. N1: Metástasis a un solo ganglio de 2 cm o menos. N2: Metástasis a un solo ganglio entre 2 y 5 cm, o múltiples ganglios, ninguno mayor de 5 cm de diámetro mayor. N3: Metástasis a ganglio mayor de 5 cm. Metástasis a distancia (M): MX: No es posible evaluar metástasis. M0: Sin metástasis a distancia. M1: Metástasis a distancia. Agrupamiento por etapas: Etapa 0a: Ta N0 M0 Etapa 0is: Tis N0 M0 Etapa I: T1 N0 M0 Etapa II: T2a N0 M0 T2b N0 M0 Etapa III: T3a N0 M0 T3b N0 M0 T4a N0 M0 Etapa IV: T4b N0 M0 Cualquier T N1 M0 Cualquier T N2 M0 http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document Cualquier T N3 M0 Cualquier T cualquier N M1Al comparar la etapificación clínica (examen físico y estudio por imágenes) con la etapificación patológica (pieza operatoria), se aprecia una diferencia significativa, siendo la subetapificación clínica muy frecuente, la cual puede llegar a un 50%. Histopatología 1. Papiloma: - Tumor papilar, constituído por células epiteliales que cubren tronco fibrovascular. Son raros; menos del 2% de los tumores vesicales. -16% pueden progresar un cáncer de mayor grado. 2. Carcinoma de células transicionales: - 90% de los cánceres de vejiga. - Habitualmente, lesión papilar, que crece hacia el interior de la vejiga - Carcinoma in situ (CIS): lesión plana, multifocal, que habitualmente acompaña a un tumor papilar. Su evolución es muy variable, pero su tendencia es a recurrir y progresar (invasión). 3. Carcinoma epidermoide o escamoso: - 5-10% de los cánceres vesicales. - Generalmente asociado a infección crónica, cálculo vesical, uso de sonda a permanencia, infección por Schistosoma hematobium. - Invasión es frecuente al momento del diagnóstico. 4. Adenocarcinoma: - Menos del 2% de cánceres de vejiga. - Pueden originarse en el piso de la vejiga o en el techo (derivados del uraco). - Invasión de la muscular es frecuente. - Sobrevida menor de 40% a 5 años, a pesar de tratamiento agresivo. Clínica a) Síntomas y signos: - Hematuria: 85-90%. Habitualmente silenciosa e intermitente. - Síntomas irritativos: urgencia, polaquiuria y disuria pueden estar presentes, aunque no son frecuentes (más frecuente en CIS). - Síntomas derivados de enfermedad metastásica o localmente avanzada. - Ocasionalmente, masa palpable en examen bimanual bajo anestesia. b) Laboratorio: - Hematuria - Citología urinaria:Requiere de patólogo entrenado.Sensible en tumor de alto grado, infiltrantres (hasta 80% de sensibilidad). Tumor superficial y de bajo grado pueden no ser diagnosticado (sensibilidad no mayor de 60%). - Marcadores biológicos:Una amplia gama de marcadores tumorales han sido desarrollados, con el objeto de obtener un diagnóstico rápido y sencillo, sin mayor invasión. Así, tenemos por ejemplo: BTA-Statt, NMP-22, hemostick, actividad telomérica, etc. Este último parecería ser el más sensible y específico, sin embargo, su efectividad en clínica está aún por comprobarse. http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document c) Estudio por imágenes:Tumores vesicales pueden detectarse por varios métodos radiológicos. - Pielografía de eliminación:Constituye el método más usado en el estudio de hematuria.·En la vejiga se reconocen por un defecto de llenamiento en el lumen vesical y, en tumores infiltrantes, por fijación y/o aplanamiento de la pared vesical, con o sin crecimiento intravesical. Permite, además, la evaluación del tracto urinario superior. - Ecotomografía vesical:Lesión proliferante hacia el lumen vesical.Baja sensibilidad en tumores pequeños .- TAC y resonancia nuclear magnética (MRI):Precisión diagnóstica entre 40- 85% para TAC y 50 - 90% para MRI. - MRI sería superior a TAC. Ninguno de estos métodos sería capaz de distinguir entre Ta y T1, o entre T2a y T3b. Principal ventaja: serían capaces de distinguir entre enfermedad confinada a vejiga y enfermedad extravesical. - Cistoscopia y resección transuretral (RTU) de la lesión: Permiten el diagnóstico y etapificación inicial: una vez sospechado el diagnóstico por su estudio por imágenes, se procede a RTU de la lesión. Se realiza bajo anestesia. Los objetivos de la RTU son: • Obtener diagnóstico histológico y el grado de diferenciación. • Determinar la profundidad de la lesión (invasión). • Resección completa del tumor cuando es posible. Historia Natural de la Enfermedad: Al momento del diagnóstico: 50-70%: superficiales (Tis-Ta) 28%: T1 25% : T2 en adelante (invasores)15% metástasis regional o a distancia. La gran mayoría de los pacientes metastásicos fallecen antes de 2 años. Estos tumores tienden a recurrir en forma muy frecuente (70-80%), y en franca menor proporción a progresar (hacerse invasores o desarrollar metástasis). Tanto la recurrencia como la progresión dependen estrechamente del grado de diferenciación del tumor (G), del grado de profundidad (T), del tamaño de la lesión y de la multicentricidad. El compromiso ganglionar depende, entre otros factores, de la profundidad del tumor, siendo bajo (5%) en los superficiales y pudiendo llegar hasta 35-64% en tumores extravesicales (T3-T4). La progresión tumoral aparece en menos del 6% de los tumores que comprometen sólo la mucosa (Ta), pero puede llegar a un 45% en los T1 http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document (submucosa), especialmente los de alto grado. Tratamiento El tratamiento depende del estadio de la enfermedad (profundidad y grado de diferenciación). 1) Tis: Resección transuretral (RTU) completa (en lo posible) + BCG intravesical. 2) Ta: bajo grado (GI), único, no recurrente: RTU completa + observación. 3) Ta: alto grado, múltiple o recurrente: RTU + BCG o quimioterapia intravesical. 4) T1: RTU + BCG o quimioterapia intravesical. 5) T2 — T4: Cistectomía radical. Quimioterapia (QMT) neoadyuvante + cistectomía radical. Cistectomía radical + QMT adyuvante. QMT neoadyuvante + radioterapia (RDT). 6) N(+) o M(+): QMT, con o sin cirugía o RDT selectivas. Agentes Intravesicales El principal objetivo de este tratamiento es reducir el alto porcentaje de recurrencia de estos tumores. También sería útil para eliminar tumor residual, después de una RTU incompleta. Existe controversia en cuanto a la utilidad de esta terapia para disminuir la progresión de la enfermedad. Los agentes más usados son: - Mitomicina C Thiotepa Doxorrubicina (Adriamicina) BCG BCG es, hasta el momento, el agente más eficaz en la disminución de la recurrencia y en el tratamiento del tumor residual. También es la droga de elección en el tratamiento del carcinoma in situ (Cis). El uso de BCG post RTU disminuye la recurrencia a un 11-27%, versus 70 80% con RTU sola. Los esquemas y dosis de BCG son variados, sin embargo, una fase de inducción con una instilación semanal por 6 semanas, más un esquema de mantención de 1 ó 2 años (ya sea mensual o refuerzos periódicos), es lo más utilizado. Nuestro esquema propuesto consiste en una instilación semanal por 6 semanas, seguido por refuerzos de una instilación semanal por 3 semanas a los 3, 6 y 12 meses. Cistectomía Radical Indicada en tumores infiltrantes que comprometen la pared vesical (T2a y T2b) o la atraviesan (T3). http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document En pacientes con tumores que invaden la submucosa (T1), de alto grado, multifocales o que recurren precozmente, a pesar de uso de terapia intravesical, debe considerarse la cirugía radical, dada la alta probabilidad de progresión de la enfermedad. Para pacientes con tumores localmente avanzados (T4) se plantea terapia neoadyuvante, generalmente con QMT, y luego la cistectomía radical, si las condiciones del paciente lo permiten y no hay evidencias de diseminación de la enfermedad. Radioterapia RDT externa (5.000-7.000 cGy) ha sido utilizada como alternativa a la cirugía radical. Los resultados, sin embargo, son peores que con la cirugía. Además, el índice de recurrencias puede llegar a 33-68% y más del 15% puede sufrir de complicaciones derivadas de la radiación (rectales, intestinales, vesicales). Quimioterapia Aproximadamente un 15% de los pacientes ya tienen enfermedad diseminada al momento del diagnóstico y un 30-40% de los pacientes con cistectomía radical desarrollan metástasis. Estos pacientes con enfermedad metastásica, así como aquellos con tumores extravesicales (T3-T4) y/o con ganglios positivos (N+), se benefician de QMT sistémica, especialmente de QMT combinada. Distintos esquemas han sido utilizados, siendo los más frecuentes: - MVAC (Metotrexate, Vinblastina, Adriamicina y Ciclosfosfamida) - CMV (Ciclofosfamida, Metotrexate, Vinblastina) - CISCA (Cisplatino, Ciclofosfamida, Adriamicina) Las respuestas a la QMT van desde un 13% a un 35%; sin embargo, la sobrevida media es de alrededor de 1 año y la sobrevida mantenida no alcanza más allá de un 20-25%. Terapia Combinada Recientemente se han diseñado esquemas de tratamiento que pretenden conservar la vejiga en tumores invasores. Estos combinan una RTU lo más completa posible, seguida de QMT + RDT concomitantemente o en forma alternada. En casos altamente seleccionados hasta un 58% de los pacientes se mantienen sin enfermedad detectable; aunque los estudios aún no permiten considerar esta alternativa como una terapia factible para la mayoría de los enfermos con tumores infiltrantes. Pronóstico Tumor superficial: excelente sobrevida: 78-81% sobrevida global a 5 años (no cáncer específico): T2 : 65-82% a 5 años (series recientes) T3 : 37-61% a 5 años (series recientes) T4 : 25% a 5 años Ganglios (+): 15-35% a 5 años, con cirugía radical más linfadenectomía. http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document Recurrencia pelviana: 10-20% postcirugía; 50-70% con RTU o QMT sola o combinada. Seguimiento Después de RTU (con o sin BCG):- Cistoscopia (idealmente, más citología urinaria obtenida por lavado vesical): • Cada 3 meses los primeros 2 años • Cada 6 meses desde los 2 a los 5 años • Anual, en adelante - Radiografía de tórax: • 1 vez al año en tumores superficiales - Pielografía de eliminación: • 1 vez al año por los primeros 5 años Postcistectomía radical: - Radiografía de tórax: • Cada 3 ó 4 meses en los primeros 2 años - Exámenes de función renal: • A los 3, 6 y 12 meses; luego, anual - TAC abdomen y pelvis: • 1 vez al año por 3 años El uso de pielografía intravenosa en el seguimiento de pacientes con cáncer vesical es controversial, ya que la frecuencia de tumores de urotelio alto, en el seguimiento de éstos, es baja (2-4%). Cáncer de Pelvis Renal y de Uréter Son tumores poco frecuentes; no constituyen más del 4% de todos los cánceres de urotelio.Son más frecuentes en el hombre (2-4:1) y la edad promedio de presentación es de 65 años. La enfermedad del urotelio es global. Estudios recientes revelan que existiría una predisposición genética de la mucosa (alteraciones cromosómicas), que se han visto en pacientes con cáncer de células transicionales, tanto en tejido sano como tumoral. De hecho, la posibilidad de desarrollar un tumor de vejiga, después de un tumor de urotelio alto, es de un 30-75%. No obstante, el riesgo de presentar un tumor de urotelio alto en pacientes con cáncer de vejiga no es más del 2%4%. Etiología Similar al cáncer de vejiga. También se ha visto asociado al uso excesivo de analgésicos, a la nefropatía de los Balcanes y al uso de Ciclosfosfamida. - 90% de los tumores de pelvis renal: carcinoma de células http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document transicionales - 10% de los tumores de pelvis renal: carcinoma escamoso (asociado a PATOLOGIA: inflamación crónica por infección o cálculo) - 97% de los tumores de uréter: carcinoma de células transicionales Sólo un 50% de estos tumores son únicos (habitualmente múltiples) y la gran mayoría están localizados al momento de diagnóstico. Tumores bilaterales (sincrónicos o metacrónicos) no son comunes: 2-5%. Sitios comunes de metástasis son a ganglios regionales, pulmón y hueso. Tumores benignos son raros; habitualmente, de origen mesodérmico: - Pólipo fibropitelial: es el más frecuente y se presenta, generalmente, en adulto joven. Radiográficamente, se caracteriza por defecto de llenamiento predominante largo, de superficie regular, bien definida. - Leiomioma - Angioma Etapificación La clasificación usada actualmente es la TNM, propuesta por la Union Internationale Contra le Cancer (UICC) y la American Joint Committee on Cancer (AJCC) de 1997. Clasificación TNM (1997) Tumor primario (T): TX: No es posible evaluar tumor primario. T0: Sin evidencia de tumor primario. Ta: Carcinoma papilar no invasor. Tis: Carcinoma in situ. T1: Tumor invade tejido conectivo subepitelial. T2: Tumor invade la muscular. T3: (Sólo para pelvis) Tumor sobrepasa la muscular e invade la grasa peripélvica o el parénquima renal. T3: (Sólo para uréter) Tumor sobrepasa la muscular e invade la grasa periureteral. T4: Tumor invade órganos adyacentes o a través del riñón, la grasa perinefrítica. Ganglios linfáticos regionales (N): NX: No se pueden evaluar los ganglios regionales. N0: Sin metástasis a ganglios regionales. N1: Metástasis a un solo ganglio de 2 cm o menos. N2: Metástasis a un solo ganglio entre 2 y 5 cm, o múltiples ganglios, ninguno mayor de 5 cm de diámetro mayor. N3: Metástasis a ganglio mayor de 5 cm. Metástasis a distancia (M): MX: No es posible evaluar metástasis. M0: Sin metástasis a distancia. M1: Metástasis a distancia. http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document Agrupamiento por etapas: Etapa 0a: Ta N0 M0 Etapa 0is: Tis N0 M0 Etapa I: T1 N0 M0 Etapa II: T2 N0 M0 Etapa III: T3 N0 M0 Etapa IV: T4 N0 M0 Cualquier T N1 M0 Cualquier T N2 M0 Cualquier T N3 M0 Cualquier T cualquier N M1 Clínica Síntomas y Signos: - Hematuria: 70-90% - Cólico renal o dolor lumbar: 8-50% (por obstrucción ureteral por coágulos o fragmentos tumorales, obstrucción renal o pieloureteral por tumor). - Síntomas irritativos vesicales: 5-10% - Secundarios a enfermedad avanzada localmente o metástasis (baja de peso, anorexia, letargo, decaimiento, etc.). Estudio por Imágenes - Pielografía de eliminación: • • • • Lo más frecuente: defecto de llenamiento intraluminal Amputación de vía urinaria (cálices, infundíbulo, etc.) Hidronefrosis o hidroureteronefrosis Dg. diferencial en defecto de llenamiento ureteral: cálculo radiolúcido coágulo necrosis papilar ureteritis quística infección micótica TBC Tu benigno (fibroepitelioma) - Ureteropielografía retrógrada (UPR): • Necesaria en toda duda diagnóstica. • Permite tomar muestras lateralizadas para citología, por lavado o cepillado. - TAC y MRI: Util en tumor de pelvis renal. Ureteroscopia Consiste en la visualización directa del uréter, pelvis y cálices, en forma retrógrada. Actualmente, es un procedimiento más común, gracias al desarrollo http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document de instrumentos flexibles. Permite visión directa, toma de biopsia y citología. Con fines terapéuticos, permite la resección, fulguración, vaporización con láser. Tratamiento Terapia estándar para tumores ureterales altos o de pelvis renal: - Nefroureterectomía con resección de vejiga, en zona de orificio ureteral ipsilateral. En uréter distal: - Ureterectomía distal (con pastilla de vejiga) más reimplante ureteral. Tratamiento conservador: Endoscópico o abierto (resección sólo de la lesión, en forma local). Debe considerarse en pacientes monorrenos, en aquellos con función renal límite o en tumores bilaterales. En pacientes con ambos riñones funcionantes, el tratamiento conservador está reservado solamente para tumores de bajo grado y superficiales. Estos pacientes deben seguir en control estricto, por la alta frecuencia de recurrencias. Pronóstico Sobrevida: 60-90% a 5 años en tumores de bajo grado, superficiales. 0-33% en tumores de alto grado o infiltrantes (T2-T4) Frecuencia de metástasis regionales a distancia: - En T2 : 40% - En T4 : 75% - La sobrevida en estos pacientes va desde 0 a 23% a 5 años. http://escuela.med.puc.cl/publ/manualUrologia/TumoresRenales.html[9/7/2009 3:14:31 PM] Untitled Document Generalidades Figura 1: la palpación demuestra masa dura en testículos. Se Aprecia diferencia de tamaño con el normal Figura 2: La ecografía muestra casi todo el tejido testicular reemplazado por tumor. Queda sólo una corteza de tejido normal. Figura 3: Aspecto del testículo en la exploración Las neoplasias testiculares son tumores relativamente poco frecuentes, con una incidencia aproximada de 1-2 por cada 100.000 habitantes; sin embargo, en nuestro país tienen una mayor incidencia calculándose según trabajos cooperativos que esta puede ser de 6-7 por 100.000 habitantes, siendo sólo superado por los países escandinavos. El 95% de las neoplasias testiculares son tumores derivados del parénquima (línea germinal), seminomas y no seminomas, el resto corresponde a tumores derivados de la línea no germinal (células de Leydig, Sertoli y gonadoblastomas). Se calcula que en global corresponden al 5% de los cánceres genitourinarios en el hombre. La mayoría se diagnostica entre los 20 y 40 años (es el tumor más común después de leucemia y linfoma en los hombres jóvenes). Su alta incidencia en población joven hace que su impacto social y epidemiológico sea considerable; sin embargo, los grandes avances en su manejo y la introducción de quimioterapia efectiva hacen que este tumor tenga hoy día una alta expectativa de sobrevida. Es así como la sobrevida global ha aumentado del 78% a 5 años de la década del 70 a más del 92% en la última década. Aunque la causa de estos tumores es desconocida se han planteado factores congénitos y adquiridos. Existe una historia familiar en el cáncer testicular hasta en un 16% de los casos. Los estrógenos durante la gestación aparecen como un factor de riesgo conocido de criptorquidea, la cual aumenta el riesgo potencial de desarrollar esta neoplasia, así también el trauma y la infección han sido señalados como factores adquiridos, aunque no se han logrado demostrar (Tabla I). En general, son discretamente más frecuentes en el testículo derecho y en los pacientes con testículos no descendidos. La corrección quirúrgica de la criptorquidea no los hace menos susceptibles, ya que el riesgo potencial ya se ha adquirido; sin embargo, la cirugía (además de los beneficios desde el punto de vista de la fertilidad) permite que el testículo pueda ser examinado rutinariamente. El riesgo calculado para el desarrollo de tumores es directamente proporcional a la ubicación de éste, así de los testículos intraabdominales el riesgo es 1/80 y de los inguinales es 1/20. Los hallazgos del examen testicular no guardan una relación directa con el tipo histológico ni con grado de diseminación ya que a pesar de estar ampliamente diseminado el tumor primario puede no ser palpable en el testículo. Figura 3A: Aspecto macróscópico de la lesión La forma de presentación patológica en más del 40% de los casos es de histología mixta. Las metástasis pueden cambiar la histología del tumor primario (generalmente a formas más malignas). La presencia de tumores bilaterales sincrónicos o asincrónicos es poco frecuente; sin embargo, ésta puede ser del 1-2% de los pacientes con tumores http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document testiculares, siendo también mayor el riesgo en pacientes con testículos no descendidos. La presentación bilateral es más frecuente en los seminomas. Es importante tener presente que los tumores de células germinales también pueden originarse en otros tejidos, en su forma extratesticular, especialmente retroperitoneo y en sitios de línea media (área sacrocoxígea, mediastino anterior y región pineal). Figura 4: Otro caso de lesión pequeña no palpable. Hallazgo de ecotomogafía escrotal realizada por orquialgia La vía de diseminación habitual es linfática, y su diseminación local es infrecuente ya que la túnica albugínea constituye una barrera natural para la diseminación tumoral. El antecedente de cirugía inguinal o cuando el tumor compromete la vaginal, es importante ya que altera la vía de diseminación linfática habitual (diseminación inguinal). En los últimos años una serie de publicaciones sugieren que la presencia de microcalcificaciones testiculares son un factor de riesgo y predisponente a la aparición de tumores posteriores; sin embargo, con el seguimiento actual todavía no hay argumentación ni evidencia sólida a este respecto, por ahora se recomienda a los individuos que tienen microcalcificaciones hacerse un examen clínico y ecográfico de rutina, así como recalcar el valor que puede tener en estos individuos el autoexamen testicular. Figura 5: Aspecto normal del testículo al examen físico Tabla I Etiologías Posibles en los Tumores Testiculares CONGENITAS. Criptorquidea. AMBIENTALES Trauma, hormonal, atrofia. PREDISPONENTES ¿Microcalcificaciones? Figura 6: Al incindir el testículo extirpado se observa el pequeño tumor rodeado de tejido normal. A. patológica : Coriocarcinoma. La aparición de esta neoplasia, aunque puede ser a cualquier edad, tiene alguna variación en relación con el tipo histológico, así es más frecuente encontrar un seminoma entre los 35 y 39 años, al teratocarcinoma y carcinoma embrionario entre los 25-35 y el coriocarcinoma entre los 20-30 años. El teratoma benigno es más frecuente en niños pero asociado con elementos celulares germinales del adulto. En general, los tumores testiculares pueden dividirse en tres categorías (Tabla II) según su origen. Tabla II Clasificación de los tumores testiculares y frecuencia de presentación Figura 7: Incisión inguinal, aislamiento y clampeo precoz del cordón espermático. 1. Tumores de células germinales (96%). I) Seminoma 35-50% II) Carcinoma embrionario 25% Compuesto de células epiteliales primitivas. http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document III) Teratoma 5% Compuesto de tejidos derivados de las 2 ó 3 capas primitivas del embrión. IV) Coriocarcinoma. Compuesto por citotrofoblasto y sinciciotrofoblasto. Metástasis vía hematógena. Figura 8: Testículo abierto en que se ve el tumor y el cordón extirpado 2. Tumores del estroma gonadal (2%) I) Tumor de Leydig. II) Tumor de Sertoli. III) Gonadoblastoma. 3. Metástasis Clasificación Figura 9: Area de disección ganglionar para tumor no seminoma derecho. Numerosas clasificaciones se han propuesto, pero la más adecuada parece la propuesta por Dixon y Moore, la cual es una clasificación histológica y a la vez pronóstica, ya que aquellos tumores tipo I tienen un mejor pronóstico que los tipo V.Clasificación de Dixon y Moore. (Histológica y Pronóstico) I) Seminoma. II) Carcinoma embrionario, solo o con seminoma. III) Teratoma, solo o con seminoma. IV) Teratoma con carcinoma embrionario o con teratocarcinoma con o sin seminoma. V) Coriocarcinoma solo o con seminoma o carcinoma embrionario o ambos. Patología Seminoma Figura 10: Disección ganglionar reducida para tumor no seminoma izquierdo Es el tumor más frecuente, ya sea como seminoma puro (35%) o acompañando a otros tumores. En general se encuentra en pacientes en la cuarta década de la vida. Son muy radiosensibles. Un 36% tiene con metástasis al momento del diagnóstico. Carcinoma embrionario Hay dos presentaciones, la del adulto o carcinoma embrionario y la infantil o tumor del Saco de Yolk (tumor del saco vitelino o también tumor del seno endodérmico). La forma infantil es el más frecuente tumor testicular en los niños. Cuando se presenta en adultos habitualmente no lo hace en forma pura y acompaña a otros tumores. No es infrecuente que presente hemorragia intratumoral y necrosis. Un 59% se presenta con metástasis al momento del diagnóstico. Figura 11: Disección ganglionar reducida para Teratoma http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document tumor testicular derecho Se presenta en adultos y niños. Presenta más de una capa embrionaria, en diferentes estados de maduración. La forma madura contiene restos de las tres capas embrionarias (ecto, meso y endodermo), su forma inmadura contiene elementos celulares primitivos indiferenciados. Es un tumor radio y quimiorresistente. Un 15% tiene metástasis al momento del diagnóstico; las metástasis se tratan quirúrgicamente, mediante resección, ya que es la única alternativa de tratamiento. Coriocarcinoma Gráfico Esquema de Tratsmiento Planteado para Seminomas Afortunadamente son los más infrecuentes (<1%), tienden a ser lesiones únicas y pequeñas, con centro hemorrágico. Puede visualizarse sincicio y citotrofoblasto. Su diseminación es rápida y por vía hematógena habitualmente. Casi un 100% de metástasis al momento del diagnóstico. Carcinoma in situ El cáncer in situ o neoplasia intraepitelial tiene como significado la presencia de células tumorales malignas dentro del tubo seminífero. Estas han sido identificadas en biopsias por infertilidad en el testículo atrófico en un 1%. En criptorquidea en un 2-8% y en el testículo sano contra- lateral al tumor testicular en un 1%. Su significado y evolución posterior no se conocen, sólo se sabe que pueden evolucionar hacia un tumor invasor en un 50% a 5 años (seminoma o no seminoma). Por ahora en orquidectomía por cáncer testicular no se justifica hacer biopsia contralateral. Sólo observación cuidadosa. Clínica El síntoma más frecuente del tumor testicular es el aumento de volumen indoloro, irregular y duro del testículo. Este aumento habitualmente es gradual y progresivo. Esta masa indolora no se transilumina, y con frecuencia produce la sensación de peso. Es infrecuente la consulta por dolor testicular y cuando esta aparece (10%) se debe a hemorragia intratesticular o necrosis. Habitualmente se trata de un individuo sano que tuvo este hallazgo de masa indolora y que el paciente relaciona con algún evento traumático reciente, sin embargo no guarda ninguna relación y éste fue sólo lo que motivó el autoexamen testicular y el hallazgo. En algunos casos de tumores avanzados las manifestaciones pueden ser derivadas de la diseminación extratesticular como retroperitoneo, con dolor lumbar o hemorragia digestiva alta cuando hay infiltración duodenal o del intestino delgado. La hemoptisis puede ser una manifestación secundaria cuando existe compromiso pulmonar metastásico. Un 14% presenta síntomas derivados del tumor metastásico (32% de los pacientes tienen metástasis al momento del diagnóstico). En el examen físico destaca una masa no sensible, firme e indurada, con un epidídimo sano habitualmente y no comprometido por tumor. En algunos casos (15%) los tumores testiculares se acompañan de un hidrocele. Es importante el examen físico general buscando adenopatías inguinales y supraclaviculares, así como la presencia de masas abdominales. En los tumores derivados del mesénquima es frecuente encontrar signos de virilización. Estudio Clínico y de Laboratorio http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document Ecografía Testicular Hoy día la ecografía forma parte importante del examen testicular; si bien el diagnóstico es eminentemente clínico, este examen permite la detección de neoplasias intratesticulares muchas veces no sospechadas por el examen clínico. En las masas testiculares clínicamente evidentes también es importante ya que permite la confirmación de la masa testicular y descartar otras patologías que constituyen el diagnóstico diferencial como las patologías de origen inflamatorio o traumático. Por último, muchas veces la presencia de un hidrocele dificulta el examen clínico, por lo que este examen es de gran utilidad. Otra ventaja de la ecografía es permitir el examen simultáneo del testículo contralateral y pesquisar precozmente otra neoplasia sincrónica, así como la presencia de microcalcificaciones. Marcadores Tumorales Los marcadores testiculares son un elemento muy útil tanto como elemento diagnóstico, de etapificación potencial, de seguimiento o monitorización y por último como índice pronóstico en los tumores testiculares. Estos marcadores son la gonadotrofina coriónica humana (GCH) que tiene un peso molecular de 38.000 dalton y una vida media corta de 24 a 36 horas. Es producida por los elementos trofoblásticos del tumor. La alfafetoproteína (aFP) que tiene un peso molecular de 70.000 dalton y una vida media de 5 a 7 días. Se la relaciona al componente extraembrionario del saco vitelino. Por último, la deshidrogenasa láctica (LDH) es una enzima con un peso molecular de 134.000 dalton, que como sabemos tiene 5 isoenzimas y su elevación si bien es bastante inespecífica es un índice indirecto del grado de diseminación. Los marcadores por lo tanto son útiles en el: 1. Diagnóstico, ya que se alteran precozmente con 103 células tumorales y para que un tumor sea detectable con un método de imágenes se requieren 105 células. También pueden orientar el tipo celular ya que permite demostrar la presencia de elementos no seminomatosos en los seminomas puros (elevación de la afeto proteína. Así también en el caso de los coriocarcinomas siempre tienen elevados la gonadotrofina coriónica y en valores habitualmente altos. 2. Etapificación, un 90% de los estadios avanzados tienen marcadores positivos y solo un 10% son negativos en un estadio III. Después de la orquidectomía niveles altos sugieren tumor residual. 3. Monitorización del tratamiento ya que permite evaluar recidivas, ante la elevación de marcadores que se habían negativizado. 4. Indice pronóstico. La LDH está aumentada en un 7% de los estadios I, 38% de los estadios II y 81% de los estadios III. http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document Tabla III Marcadores tumorales, según el tipo histológico Seminoma: GCH (+) 25% aFP (- ) Carcinoma Embrionario: GCH (+) 80% aFP (+) 75% Teratoma: GCH (+) 25% aFP (+) 37% Coriocarcinoma: GCH (+) 100% aFP (- ) Como se desprende de lo señalado, los marcadores deben ser tomados previos a la cirugía, pues su vida media en el caso de GCH no es largo y debemos tenerlos como patrón de comparación posterior. Estudio de Imágenes Además de la ecografía hay otros métodos de imágenes que son importantes en el estudio de los tumores testiculares. La radiografía de tórax es importante en la búsqueda de metástasis en este tipo de tumores, que presentan un patrón de diseminación ordenado que incluye al pulmón una vez que existe compromiso retroperitoneal. En casos seleccionados en que existe duda es aconsejable un scanner de tórax. En todo paciente que va a ser sometido a una orquidectomía por tumor testicular es fundamental tener un estudio de imágenes del retroperitoneo, para determinar, aunque no siempre de modo exacto, la extensión de la enfermedad, lo que permite planificar la evolución posterior del paciente y la necesidad de tratamientos futuros complementarios. Si bien la sensibilidad del scanner es alta y permite detectar la presencia de nódulos o ganglios retroperitoneales mayores a 1 cm, su especificidad es baja, ya que no permite definir si estos son tumorales o no. Sin embargo, es de gran utilidad en los casos de metástasis mayores o en presencia de masas retroperitoneales. La linfografía, que fuera por años el pilar del estudio de diseminación retroperitoneal, ha perdido vigencia ya que tiene 15 a 30% de falsos negativos, sí es útil aún en la planificacion de la radioterapia pues permite marcar los campos. La biopsia testicular preoperatoria no está indicada en el estudio del tumor testicular, ni guiada por ecografía o scanner. La biopsia debe ser la extirpación del testículo en block, previo clampeo del cordón para evitar diseminación tumoral durante la manipulación. El abordaje debe ser inguinal para ligar lo http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document más lejos posible los elementos del cordón y deferente. Tratamiento Inicial, Primera Etapa El tratamiento inicial del tumor testicular es la orquidectomía radical (extracción del testículo en block), con todos los elementos del cordón y lo más cercano posible al anillo inguinal profundo. Una vez completada la orquidectomía, se envía el material a biopsia lenta, para definir las alternativas terapéuticas complementarias que serán variadas dependiendo del tipo tumoral así como del estadio clínico del tumor. Puede existir sospecha preoperatoria en base a los hallazgos de los marcadores tumorales, pero se debe tener la biopsia completa de la pieza operatoria para definir la conducta adecuada. Diseminación de los Tumores Testiculares La diseminación es básicamente por vía linfática, de ahí la importancia del estudio de imágenes del retroperitoneo. Primaria: Linfática (excepto coriocarcinoma) a ganglios entre T1 y L4, pero se concentran bajo los pedículos renales, posteriormente a los ilíacos comunes y externos ipsilaterales. Secundaria: Hematógena (pulmón, hígado, cerebro, riñón y huesos). En general, los tumores derechos dan metástasis ganglionares retroperitoneales a los dos lados de la aorta, los izquierdos al lado izquierdo, por ello la diseminación ganglionar dependerá del testículo afectado. Diagnóstico Diferencial El diagnóstico diferencial de los tumores testiculares es amplio, aunque en general la clínica y el examen físico permiten fácilmente su diagnóstico certero. Los métodos de imágenes, principalmente la ecografía, tienen una alta sensibilidad y especificidad, que hacen difícil errar en el diagnóstico. Sin embargo, todo proceso intraescrotal está entre los diagnósticos diferenciales, los más frecuentes de ellos se detallan en la tabla IV. Tabla IV Diagnósticos diferenciales más frecuentes de tumor testicular Masas escrotales Epididimitis. Orquiepididimitis. Hidrocele. Quiste epidídimo o espermatocele. Hernias. Goma sifilítica Etapificación La etapificación de los tumores testiculares es clínica y de laboratorio, http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document complementada por imágenes como el scanner; sin embargo, dependiendo del tipo histológico la etapificación, puede ser también quirúrgica (tumores no seminomatosos). Tabla V. Tabla V Etapificación clínica de los tumores testiculares Estadio I Tumor limitado al testículo. Sin compromiso linfático. Estadio II Cualquier tumor testicular con: IIA) Ganglios retroperitoneales < 2 cm. IIB) Ganglios retroperitoneales >2 cm - <5 cm IIC) Ganglios retroperitoneales >5 cm. Estadio III Ganglios a ambos lados del diafragma o elevación persistente de marcadores tumorales (sin elevación previa a orquidectomía). Estadio IV Metástasis a distancia. Tratamiento El tratamiento de los tumores testiculares depende de la etapificación clínica que se haga de ellos, por eso es importante contar con un estudio de imágenes adecuado, principalmente del retroperitoneo que es la vía de diseminación habitual. Para efectos del tratamiento los tumores testiculares se dividen en tumores tipo seminoma o no seminoma. Seminomas. 60-65% Cuando se trata de un tumor tipo seminoma, estamos tratando un seminoma puro, que no tiene ningún otro componente en la biopsia. Dentro de los seminomas existen tres subgrupos, el clásico (85%), anaplástico (5-10%) y espermatocítico. Los tres se tratan en forma similar y su diferenciación es puramente histológica, con pequeñas variaciones en cuanto a pronostico. En seminomas puros, por lo tanto, no hay elevación de aFP, si hay elevación de aFP no es seminoma puro y se debe revisar si hay elementos no seminomatosos en la biopsia. Seminoma en Estadios Clínicos I, IIA El seminoma en estadio I tiene una tasa de curación de más de 95%. Opciones de tratamiento: http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document A) Estándar: - Orquiectomía vía inguinal radical, seguida de radioterapia profiláctica de los ganglios linfáticos inguinales retroperitoneales e ipsilaterales. - Sólo se requieren dosis moderadas de radiación. Los ganglios retroperitoneales se irradian profilácticamente inclusive con un linfangiograma negativo y/o con una tomografía axial computarizada (scanner) normal, debido a que aproximadamente 15% presentará propagación ganglionar oculta, que puede curarse con irradiación. - Los tumores con invasión vascular del cordón parecen tener mayor riesgo de metástasis ganglionares. - La radioterapia utilizada es con 2.500-3.000 cGy, con sobreimpresión de 500-1.000 cGy. Esta alternativa de tratamiento también es válida en los estadios IIA. En los estadios I no se justifica la radioterapia supradiafragmática, del mediastino ni del cuello. La radiación de los ganglios inguinales no es necesaria de rutina, a no ser que haya habido daño al escroto que ponga los ganglios inguinales en riesgo. El tratamiento de los ganglios linfáticos ilíacos puede ser innecesario. B) Alternativa bajo evaluación clínica: - Orquiectomía inguinal radical sin irradiación posterior de ganglios retroperitoneales seguida por la determinación frecuente de marcadores séricos, radiografías del tórax y tomografías computarizadas (vigilancia). Esta alternativa implica necesariamente un seguimiento estricto y meticuloso, ante la posibilidad de recidiva tumoral, que se calcula en un 15%. Tratamiento propuesto Nuestro grupo propone como alternativa de tratamiento el uso de radioterapia profiláctica en el caso de tumores seminoma estadios I y IIA, ya que existe una tasa de recidiva tardía (15%) y una baja adhesividad al tratamiento expectante, el que también tiene un costo importante para el paciente. La morbilidad asociada hoy día a este tratamiento es baja, creemos que se justifica la alternativa de observación sólo en casos de fertilidad inmediata deseada. Seminoma en Estadio Clínico IIB y Superiores El seminoma en estadio II está dividido en enfermedad voluminosa (IIC) y no voluminosa (IIA, IIB) con el fin de facilitar la planificación de los tratamientos y la expresión del pronóstico. La enfermedad voluminosa presenta tumores de más de 5 centímetros en una tomografía axial computarizada. Opciones de tratamiento: Estándar: Para pacientes con tumor no voluminoso la alternativa terapéutica es similar a la de los tumores en estadio clínico I, es decir, radioterapia. Para pacientes con masas de tumor voluminoso (IIC): Orquiectomía inguinal radical debe estar seguida de quimioterapia combinada (con un régimen a base de cisplatino). El esquema http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document propuesto es BEP, bleomicina, etoposido, cisplastino, si existe remisión debe hacerse seguimiento, de no haber regresión puede insistirse en quimioterapia de 2da línea (VIP, vimblastina, ifosfamida, cisplatino) o exploración retroperitoneal quirúrgica. La biopsia por punción no está indicada ya que la muestra puede ser no representativa. Esta es una terapia eficaz para los seminomas voluminosos. Es común que queden anormalidades radiológicas residuales después que se termine la quimioterapia. Muchas de estas anormalidades se reducen gradualmente en un período de 6 meses. Es importante recordar que los tumores tipo seminoma son muy radiosensibles aunque también son muy quimiosensibles, pero como la morbilidad agregada de la radioterapia hoy día es menor, en los estadios I y IIA (y IIB dependiendo del centro) se trata primero con radioterapia. El seguimiento debe ser clínico con scanner y marcadores tumorales pues existe buena respuesta a quimioterapia de rescate en caso de falla. Un 30-40% de los pacientes que mueren de un tumor seminomatoso resultan tener elementos no seminomatosos en la autopsia, por lo que los tumores fueron mal etapificados y por lo tanto mal tratados. En el tratamiento de los tumores Estadios IIB y superiores en que existe masa residual > de 3 cm, posterior a la quimioterapia, hay tumor viable en estas masas en un 30%, el resto es necrosis tumoral o fibrosis, pero justifica su extirpación por la posibilidad de enfermedad persistente postquimioterapia. El tratamiento es la disección retroperitoneal y resección de las masas. No seminomas En un 65% de los casos se reconocen como metastásicos al momento del diagnóstico. En este subtipo de tumores el tratamiento propuesto es variable de centro a centro y depende también de las características personales del paciente, así como de sus posibilidades de seguimiento y tratamiento. Esta variabilidad hace que sea difícil uniformar un criterio, pero a grandes rasgos presentaremos las diferentes alternativas y cuál es nuestra conducta como grupo urológico. No Seminoma en Estadios Clínicos I y IIA El no seminoma en estadio I es curable en casi un 95% de los casos. Este estadio clínico presupone que el tumor se encuentra confinado al testículo, y por lo tanto sin compromiso linfático retroperitoneal en el scanner de etapificación. Opciones de tratamiento: A) Estándar: La extracción del testículo por vía inguinal y la disección planificada posterior (en otra cirugía programada) de los ganglios linfáticos retroperitoneales (LALA) en un segundo tiempo. Esta alternativa de tratamiento tiene la finalidad de etapificar correctamente al enfermo y saber si realmente se trata de un tumor http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document estadio I o tiene metástasis ganglionares. Es requisito para plantear esta alternativa terapéutica que el enfermo negativice sus marcadores tumorales posterior a la orquidectomía, ya que de persistir positivos significa enfermedad persistente o metastásica y por lo tanto no se trata de un tumor estadio I, sino de un tumor metastásico y por lo tanto el tratamiento es la quimioterapia. En el caso que la etapificación quirúrgica muestre que existe compromiso retroperitoneal se definirán las distintas alternativas de tratamiento complementario según sea el grado y extensión de la enfermedad. La etapificación quirúrgica es particularmente atractiva, ya que no sólo es diagnóstica sino también terapéutica en muchos casos, y permite reservar la quimioterapia en caso de compromiso ganglionar masivo o para la recaida futura, si se presenta. El no realizar quimioterapia inmediata es una alternativa también en los pacientes que presentan menos de 6 ganglios positivos después de la disección retroperitoneal de los ganglios linfáticos. Dichos pacientes tienen una tasa de recaída del 20%-30%. La mayoría pueden ser curados con quimioterapia estándar si llegan a recaer. Si existe recidiva posterior esta ocurre usualmente entre los 12-18 meses. Los pacientes cuyos marcadores no regresan a la normalidad después de la remoción de los ganglios linfáticos retroperitoneales deberán ser tratados con quimioterapia, ya que presupone la presencia de enfermedad sistémica residual no detectada. Si la LALA es positiva, con metástasis macroscópicas o hay más de 6 focos con metástasis microscópicas el tratamiento siguiente es quimioterapia. Esta cirugía fue la base fundamental del tratamiento de los tumores testiculares previo a la introducción de los esquemas actuales de quimioterapia. La LALA puede ser extendida con disección completa del retroperitoneo, lo que conlleva necesariamente la pérdida de la eyaculación. Esta modalidad esta justificada cuando no están disponibles esquemas de quimioterapia adecuados o cuando el tumor testicular tiene un componente de teratoma, que no es sensible a ningún esquema de quimio o radioterapia, por lo tanto su única alternativa terapéutica es la cirugía extendida. Como alternativa a la LALA extendida está la LALA modificada, que es un muestreo de los ganglios del retroperitoneo y que pretende etapificar al enfermo, conservando los nervios eyaculadores y previniendo la pérdida de la eyaculación, tan importante en pacientes jóvenes En la LALA que se realiza hoy en día (modificada) no se extirpan todos los ganglios del retroperitoneo sino que sólo muestras representativas de cada región ganglionar (cava, aorta, paraaórticas, bolsillos renales). Así de los tumores clínicamente estadio I (es decir, confinado al testículo), un 25% resultan tener compromiso linfático retroperitoneal, con metástasis. La cirugía deberá ser seguida por la determinación trimestral de los marcadores séricos, radiografía del tórax y scanner durante el primer año y determinaciones cada 6 meses después del segundo año. Frente a esta alternativa terapéutica destacaremos cuáles son sus principales ventajas y desventajas que motivan tomar este camino. http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document ¿Por qué no realizarla? 1. En el 75% de las linfadenectomías no se encuentran metástasis. 2. Se obtiene una buena respuesta con quimioterapia en aquellos con ganglios (+) cercana al 100%. 3. La sobrevida de los estadios I con y sin LALA es la misma. 4. Existe una morbilidad agregada inherente a cualquier cirugía y además está la posibilidad de tener como morbilidad asociada una eyaculación retrógrada. ¿Por qué sí realizarla? 1. Solo 1/4 de los pacientes con recurrencia tienen marcadores (+), por lo tanto no se pueden seguir a todos los enfermos con marcadores como único criterio y no son 100% confiables. 2. La recurrencia puede ocurrir hasta 5 años después de orquidectomía, período en el cual la mayoría de los enfermos abandonan el seguimiento. 3. Con la modificación de la linfadenectomía se puede prevenir la eyaculación retrógrada, y esta no es mayor de un 5%. 4. La recurrencia usualmente se produce en el retroperitoneo, donde es difícil detección de enfermedad mínima, aun con scanner (ganglios < de 1cm). 5. Los estadios I tratados con orquidectomía sola tienen un 30% de falla (un 80% de ellas por metástasis retroperitoneales y un 20% por metástasis extralinfáticas. 6. Un 25% de los pacientes catalogados clínicamente y por imágenes como estadio I resultan ser después de la linfadenectomía un estadio IIA B) Alternativa bajo evaluación clínica: Orquiectomía inguinal radical sin LALA, y observación posterior mediante la determinación frecuente de marcadores séricos, radiografías de tórax y tomografías computarizadas (vigilancia). La orquiectomía inguinal radical, sin disección de los ganglios retroperitoneales, debe ser seguida de la determinación mensual de los marcadores séricos, radiografía de tórax y tomografías computarizadas (scanner) abdominales, durante el primer año (vigilancia). Un seguimiento cuidadoso es importante, puesto que se han reportado recaídas más de 5 años después de orquiectomía en los pacientes que no fueron sometidos a disección retroperitoneal. Esta opción deberá considerarse solo si se cumplen las siguientes condiciones: a. La tomografía axial computarizada (scanner) y los marcadores séricos son negativos. b. El paciente y el médico aceptan la necesidad de repetir las tomografías computarizadas según la necesidad para continuar la observación períodica de los ganglios linfáticos retroperitoneales. c. El paciente seguirá en forma oportuna y ordenada un programa de exámenes mensuales durante 5 años, el cual incluye exámenes http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document físicos, radiografías del tórax, tomografía axial computada, abdominales y la determinación de los marcadores séricos. d. El médico acepta la responsabilidad de supervisar que el programa de seguimiento se mantenga según lo determinado por 5 años y luego en forma periódica más allá de los 5 años. Existen datos que sugieren que las tasas de recaída pueden ser inadmisiblemente altas en los pacientes con evidencia histológica de invasión linfática o venosa en el cordón inguinal. Algunos investigadores han reportado tasas de recaída mayores en los pacientes con carcinoma embrionario y recomiendan LALA de rutina para estos pacientes. Además, algunos recomiendan LALA en los pacientes con una AFP normal antes de la orquiectomía ya que ellos creen que el marcador no puede usarse como un indicador de recaída durante el seguimiento. C) Terapia adyuvante profiláctica: Esta tercera alternativa consiste de dos ciclos de cisplatino, bleomicina y etoposido administrados a pacientes con enfermedad en estadio clínico I considerados con alto riesgo de recidiva (presencia de invasión vascular y tipo histológico). Los índices de recidiva después de la quimioterapia son menores al 5%, en comparación con alrededor de 50% en las series históricas de pacientes de alto riesgo seguidos sin quimioterapia adyuvante. Sin embargo, en las series históricas, los índices de curación han sido de 95% y mayores después de quimioterapia para las recidivas. Tratamiento Propuesto En nuestro grupo el tratamiento propuesto es la LALA de rutina considerando el costo del tratamiento expectante, la angustia generada en el paciente, así como la ruralidad propia de nuestro país que muchas veces hace imposible un seguimiento adecuado. Sin embargo, esta alternativa de seguimiento debe ser planteable de caso a caso, según sean las condiciones del paciente. La morbilidad de la LALA hoy día es menor, reportándose menos de un 5% de eyaculación retrógrada. La LALA deja de ser una alternativa más cuando en el tumor primario se encuentra un componente de teratoma importante, ya que este no tiene la posibilidad de respuesta posterior a quimioterpia, y su tratamiento es solo quirúrgico, y en estos casos está justificada una LALA extendida sin preservación nerviosa. Cualquiera sea la alternativa tomada, el seguimiento de los enfermos debe ser permanente y apoyado en marcadores tumorales e imágenes (scanner), esto mas seguido en la alternativa de la observación. No Seminoma en Estadios Clínicos IIB, IIC, III y IV Estos estadios se consideran enfermedad diseminada y por lo tanto el tratamiento debe ser sistémico con quimioterapia. Esta quimioterapia combinada puede disminuir o erradicar masas tumorales retroperitoneales. De persistir enfermedad residual postquimioterapia es necesario hacer cirugía sobre las masas residuales, lo que agrega un 20% de respuesta a la quimioterapia. El 80% de la masa residual es tejido necrótico y fibrótico. Los agentes quimioterápicos más usados son el cisplatino, vinblastina, http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document bleomicina, actinomicina D, doxorrubicina y ciclofosfamida. La radioterapia no tiene buenos resultados para los tumores no seminomas, por las altas dosis que se requieren y por un índice de recidiva del 61% a 5 años. Pronóstico El pronóstico depende como es de esperar del tipo de tumor y su estadio, aunque en globo su sobrevida es alta y la quimioterapia de primera y de segunda línea permite rescatar un número importante de enfermos. Por lo tanto: El pronóstico depende del tipo histológico, la etapa de la enfermedad y la selección del tratamiento apropiado. Los pacientes con tumores no seminomatosos que optan por el seguimiento y no por la LALA deben hacerse marcadores tumorales y Rx de tórax cada 3 meses durante el primer año y cada 3 meses durante el segundo año y el scanner cada 3 meses los 2 primeros años, este seguimiento debe ser mínimo por 5 años y lo recomendable es por 10 años. Tabla VI Sobrevida libre de enfermedad a 5 años en tumores testiculares Estadio No Seminoma Seminoma I IIA IIB III y IV 95% 92% 75% 70% 98% 94% 80-85% 80% Complicaciones Cirugía: - Eyaculación retrógrada (infertilidad) por disección sobre el promontorio bajo bifurcación aórtica. - Impotencia eréctil ocurre rara vez, probablemente por disección sobre los pedículos renales. Radioterapia: - Disminuye espermatogénesis, es reversible, produce esterilidad transitoria por 1 a 2 años. - Vasculitis actínica y enteritis actínica más rara se ve en grandes dosis, con equipos antiguos. Quimioterapia: http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document - La toxicidad es transitoria y aceptable (leucopenia, anemia, náuseas, alopecia, neumonitis, baja de peso). La nefrotoxicidad es importante y asociado al uso de cisplatino, pero es evitable con una buena hidratación. Bleomicina produce neumonitis por fibrosis pulmonar. Tumores del Estroma Gonadal Corresponden al 2-3% de los tumores testiculares. Debido a su escasa frecuencia no existen grandes series publicadas y su tratamiento es homologable al de los tumores no seminomatosos derivados del parénquima. 1. Tumores de las células de Leydig: Sólo un 10% son malignos, es difícil hacer el diagnóstico diferencial entre lesiones malignas o benignas aun mediante el estudio histológico y el único elemento objetivo es la presencia de metástasis. Son los más frecuentes entre los del estroma gonadal y son más frecuentes entre los 30 y 50 años. Presentan compromiso bilateral más frecuentemente (5-10%). En niños produce pubertad precoz y en adultos ginecomastia. El tratamiento es la orquidectomía radical y LALA en tumores diseminados, no hay experiencia por lo escaso con la quimioterapia sin LALA. En el examen anatomopatológico tiene cristales de Reinke’s (patognomónico). El diagnóstico diferencial se debe hacer desórdenes adrenocorticales funcionantes, síndrome de Klinefelter’s y desórdenes testiculares fulminantes. 2. Tumor de las células de Sertoli: Son el 1% de los tumores testiculares. Produce ginecomastia. Un 10% son malignas y el diagnóstico diferencial es difícil. 3. Gonadoblastoma: Son exclusivos de pacientes con otros desórdenes gonadales, con caracteres sexuales secundarios anómalos. Los tumores de Leydig y los de Sertoli tienen GCH y aFP normales, pero los primeros tienen elevación de los 17 ketoesteroides en sangre y orina que aumenta hasta 30 veces en tumores metastásicos. Tratamiento Orquidectomía radical En enfermedad metastásica (ganglios linfáticos, pulmón, hígado y hueso) el tratamiento es con quimioterapia. Tumores Extragonadales Son aún más infrecuentes y representan 2 a 3%. Se ubican en retroperitoneomediastino, región sacrococígea y glándula pineal. Hay 2 hipótesis planteadas: que se trate de células totipotenciales que http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document desarrollan un tumor gonadal o que se trate de restos embrionarios producidos durante la migración testicular, esta última es la más aceptada. El tratamiento es la extirpación quirúrgica radical y el uso de quimioterapia convencional (BEP) como tratamiento habitual. http://escuela.med.puc.cl/publ/manualUrologia/TumoresTesticulares.html[9/7/2009 3:14:48 PM] Untitled Document En nuestro país el cáncer de la próstata constituye la tercera causa de muerte por enfermedad neoplásica en la población masculina, ubicándose detrás del cáncer de estómago y del pulmonar. Las tasas de defunción de esta enfermedad han crecido sostenidamente hasta alcanzar la cifra de 1.035 muertes en 1996 (Tabla 1). No disponemos de estadísticas nacionales de incidencia y por ello citamos las cifras de Estados Unidos. En ese país la incidencia alcanzó en 1992 a 185.8 nuevos casos por 100.000 hombres, para disminuir por primera vez a 135.3 nuevos casos por 100.000 hombres en 1994. La elevada cantidad de muertes debidas a esta enfermedad la sitúa en un verdadero problema de salud pública. El cáncer de próstata rara vez se ve en el hombre menor de 50 años; la incidencia aumenta rápidamente en cada década posterior. Podemos suponer entonces que con el envejecimiento de la población este problema será cada vez mayor. Figura 1: Grados de Gleason en cáncer de la próstata Los hombres con historia familiar de cáncer prostático tienen un riesgo aumentado de enfermedad comparado con hombres sin esta historia. Así en familiares de primer, segundo y tercer grados, el riesgo relativo de desarrollar este cáncer aumenta un 18%, 11% y 2.5%, respectivamente. La genética, por lo tanto, debe ser considerada como un factor etiológico de este cáncer. Sin embargo, su rol sería menor comparado con el factor ambiental, donde probablemente la dieta tendría un papel más importante. Hoy está razonablemente establecido que el consumo de grasa en la dieta contribuiría en el desarrollo de cáncer prostático. Tabla 1 Mortalidad por Cáncer Prostático en Chile * Defunciones Tasa por 100.000 hombres Figura 2: Biopsia prostática controlada bajo ecotomografía 1960 214 5,6 1970 264 5,6 1990 700 7,2 1996 1.035 14,6 * Tomado de Cáncer diagnóstico y tratamiento, Ed. Arraztoa. Santiago:Publicaciones Técnicas Mediterráneo, pp. 84-100, 1998 Anatomía Patológica La próstata se divide en cuatro zonas. La zona anterior, que ocupa el 30% de la glándula y está constituida principalmente por tejido muscular liso; la zona periférica, la más grande y donde se origina la mayoría de los cánceres; la zona central que está en relación con los conductos eyaculadores y corresponde a un 20% del tejido glandular, y la zona de transición, que rodea la uretra y de donde se origina la hiperplasia benigna prostática. La mayoría de los cánceres prostáticos son adenocarcinomas, con gran http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document Figura 3: Drenaje linfático de la próstata. A un plazo de 5 años en un 50 % de los pacientes con PIN de alto grado se demostrará un cancér prostático. frecuencia polifocales. La diferenciación celular y arquitectura tumoral se ha clasificado por el sistema descrito por Gleason, recibiendo un puntaje de 1 a 5 según sea más o menos diferenciado. El patrón histológico se determina eligiendo los dos tipos más frecuentes que, sumados, forman el score de Gleason y que va de 2 a 10. Se han definido como bien diferenciados los score de 2 a 4, moderadamente diferenciados los score de 5 a 7 y pobremente diferenciados los 8 a 10. (Fig. 1). Habitualmente la progresión de la enfermedad ocurre desde la próstata hacia los ganglios linfáticos regionales (ganglios ilíacos y obturadores), otros ganglios linfáticos, luego hacia los huesos y finalmente otras estructuras como pulmones, hígado, etc. El compromiso visceral es tardío y signo de mal pronóstico. La extensión anatómica de la enfermedad es un importante factor pronóstico. La etapificación clínica actualmente en uso fue descrita en 1992 y modificada en 1998 por el American Joint Committee on Cancer y reemplazó al sistema descrito por Whitmore-Jewett. Un resumen de esta clasificación se presenta en la Tabla 2. Figura N°4: Algoritmo: conducta frente a pacientes. Figura 4: Preservación del esfínter uretral estirado. Figura 5: Conservación de haces neurovasculares. La clasificación patológica se designa anteponiendo la letra p; así tenemos las categorías pT, pN y pM que corresponden a la T, N y M. No existe categoría pT1, porque no hay suficiente tejido para afirmar la categoría pT más alta. El Tumor Clínicamente Significativo Como consecuencia del elevado número de cánceres prostáticos que se encuentran en necropsias y corresponden a casos sin importancia clínica, se han tratado de definir las características del tumor que es clínicamente significativo por representar una real amenaza para quien lo tiene La forma más simple de definirlo es aquel que tiene un volumen tumoral igual o mayor a 0,5 ml, cuando el paciente tiene 70 años o menos, o bien, una expectativa de vida mayor de 10 años. Una forma más precisa de determinar la significación de un cáncer prostático deriva del preciso conocimiento del volumen tumoral, de la velocidad de duplicación tumoral y de las expectativas de vida. Sabemos que se considera rápida una velocidad de duplicación de 2 años o menos y lenta de 6 años. Si estimamos velocidades promedios para edades de 50 a 75 años, serían significativos volúmenes de 0,2 a 3,9 ml según edad. Todo esto es una reflexión teórica, ya que hoy el volumen tumoral es imposible de determinar en clínica y sólo se conoce después de examinar la pieza quirúrgica. Por otra parte, la velocidad de duplicación muchas veces es imposible de precisar. No obstante todas estas consideraciones, como resultado de varios estudios podemos afirmar que más del 95% de los cánceres prostáticos detectados por medición del APE corresponden a tumores clínicamente significativos y que, por lo tanto deben ser tratados. Tabla 2 Clasificación TNM 1968 Tumor Primario Ganglios linfáticos Regionales Metástasis (M) TX Tumor no puede ser evaluado NX Ganglios no MX http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document pueden ser evaluados. TO Sin Evidencia de tumor T1 Tumor no palpable Figura 6: Prostatectomía-Zona extirpada. T1a Hallazgo histológico incidental en < 5% del tejido resecado T1b Hallazgo histológico incidental en > 5% del tejido resecado T1c Tumor identificado por biopsia (Ej. por APE elevado) Figura 7: Prostatectomía radicalReconstrucción de la vía urinaria. N0 No hay evidencia de Metástasis ganglionares N1 Metástasis regional linfática Metástasis a distancia no pueden ser evaluadas M0 Sin Metástasis a distancia M1 Metástasis a distancia M1a compromiso linfático no rgional M1b metástasis Óseas M1c metástasis en otros sitios T2 Confinado a la próstata (1) T2a compromete 1 1óbuloo menos T2b compromete ambos lóbulos T3 Tumor se extiende a través de la cápsula prostática (2) T3a ompromiso unilateral o bilateral T3b compromiso de vesículas seminales T4 Tumor fijo o compromiso de estructuras vecinas - compromiso de cuello vesical, esfinter externo o recto -tumor fijo a la pared pelviana o músculos elevadores del ano. 1. Tumores no palpables o visibles en ecografía transrectal pero encontrados en uno o ambos lóbulos por biopsia son clasificados como T1c 2. Tumor con invasión de la cápsula prostática pero sin traspasarla es clasificado como T2. http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document Tamizaje o Screening El tamizaje es la evaluación masiva de sujetos asintomáticos antes que ellos consulten espontáneamente. Este procedimiento se justifica cuando la enfermedad en cuestión es de alta prevalencia, afecta significativamente la vida, tiene un tratamiento efectivo y existe un método diagnóstico eficiente. La controversia sobre el valor del tamizaje en el cáncer de próstata nace de que todavía no hay suficiente evidencia sobre si este tamizaje reduce efectivamente la mortalidad por cáncer prostático sumado a los costos económicos, de morbilidad y mortalidad derivados de los procedimientos. A favor del tamizaje están los argumentos de la reducción en la mortalidad por cáncer de próstata observada en USA después de la introducción de los métodos de screening en ese país y las recomendaciones dadas por las sociedades científicas: Asociación Americana de Urología y Sociedad Americana de Cáncer. En nuestra opinión aconsejamos el control periódico anual con Antígeno Prostático Específico (APE) y Tacto Rectal a todo hombre susceptible de riesgo, que no esté demasiado viejo o enfermo para beneficiarse con la investigación. Los métodos de imágenes actualmente disponibles: ecografía, tomografía axial computarizada y resonancia nuclear magnética no son eficientes para tamizaje de cáncer prostático . Clínica y Detección Precoz Después de la introducción masiva del APE en clínica, a un alto porcentaje de los pacientes se les diagnostica el cáncer prostático estando asintomáticos. La etapificación clínica y patológica de estos casos generalmente corresponde a tumores localizados. Por el contrario, cuando el cáncer prostático da síntomas, éste se encuentra en etapas avanzadas. Las manifestaciones de estos casos están asociada a metástasis (ej.: dolor óseo, compromiso del estado general, anemia, etc.) o bien, a progresión local (ej.: hematuria, uropatía obstructiva baja, hidroureteronefrosis, etc.). Una situación particular es el paciente que consulta con síntomas obstructivos bajos y tiene un tacto rectal sugerente de crecimiento prostático benigno. La biopsia de la pieza quirúrgica de esos casos sometidos a una resección transuretral (RTU) puede revelar hasta un 10% de ellos; la presencia de un cáncer clínicamente no evidente. Estos pacientes se etapifican en Estadio T1a o T1b. Tacto Rectal La próstata puede ser examinada directamente mediante el tacto rectal. Son signos sugerentes de neoplasia la palpación de un nódulo que puede ocupar uno o ambos lóbulos, la asimetría de estos lóbulos y la fijeza de la glándula a las estructuras vecinas. El examen rectal tiene las grandes ventajas de su simplicidad y costo despreciable. Sus desventajas son su dependencia de la habilidad del operador y la habitual resistencia de los pacientes. Como método de detección de cáncer prostático, se le asigna una sensibilidad del 55 a 69%, especificidad de 89 a 97%, valor predictivo positivo de 11 a 26% y valor predictivo negativo de 85 a 96%. Antígeno Prostático Específico (APE) http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document Es una glicoproteína producida por las células glandulares y ductales prostáticas. Su función es lisar el coágulo de semen. Normalmente circula en concentraciones plasmáticas muy bajas, con una vida media de 2,2 a 3,2 días. En el suero se detecta por técnicas de anticuerpos monoclonales con una variabilidad menor al 10%. En la confiabilidad del marcador intervienen principalmente variables preanalíticas y analíticas. Entre las primeras mencionaremos que no presenta ritmo circadiano, tiene una variabilidad biológica baja cercana al 10%. Entre las modificaciones iatrogénicas que pueden modificar su titulación, la más importante es la biopsia prostática que induce un significativo aumento en APE, que persiste por más de dos semanas. El tacto rectal no produce cambios significativos, sin embargo, se recomienda un intervalo mayor de 2 horas entre ambos exámenes. Para la ecotomografía transrectal y el masaje prostático el intervalo recomendado es mayor de 24 horas. Entre las variables analíticas mencionaremos las relacionadas con la estandarización del método y el tipo de ensayo utilizado. Esta condición es especialmente crítica cuando se está interesado en saber si hay o no APE detectable, por ejemplo, después de una prostatectomía radical. Para el sistema analítico que nosotros usamos actualmente (Abbott Axsym) la mínima cantidad que el método detecta es 0.02 ng/ml. En resumen, las recomendaciones son evitar cualquier manipulación prostática previa a la toma de la muestra y realizar las determinaciones seriadas con un mismo método. Desde su introducción en clínica como un detector de riesgo de cáncer prostático, el APE se ha convertido en el marcador tumoral más eficiente que existe en medicina. No obstante hoy día, incluso sus más fervientes partidarios lamentan su especificidad todavía baja. Se estima que la sensibilidad de APE está en el rango del 70% y el valor predictivo positivo entre 26 y 52%. Los métodos más recomendados para mejorar la especificidad de APE son: ajuste a la edad, velocidad de APE y % de APE libre. La cifra de corte usada para indicar biopsia prostática es 4.0 ng/ml. El descenso de esta cifra de corte se acompaña de un aumento sustantivo en la detección de cánceres localizados, asociado con una alta proporción de biopsias negativas, que equivale a una disminución en la especificidad que ya era criticable al usar 4.0. El ajuste de APE con la edad consiste en variar la cifra de corte de acuerdo con la edad del paciente. Los límites de normalidad aconsejados al emplear este método son los siguientes: para 40 a 49 años 0 a 2.5 ng/ml, 50 a 59 años 0 a 3.5 ng/ml, 60 a 69 años 0 a 4.9 ng/ml y 70 a 79 años 0 a 5.8 ng/ml. Cuando se dispone de 2 o más determinaciones de APE, es posible conocer la velocidad de APE. Aumentos mayores de 0.75 ng/ml en un año son sospechosos de cáncer y aconsejan realizar una biopsia, aunque la cifra total no sobrepase los valores considerados normales. Aquí debe señalarse que la prostatitis aguda puede acompañarse de elevaciones importantes en el APE, lo que hará que el clínico deba emplear su buen criterio para evaluar esta condición. El APE es proporcional al volumen del cáncer prostático. Un gramo de cáncer produce en promedio una elevación de 3.5 ng/ml de APE (método Yang). De http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document este modo los cambios en APE en pacientes no tratados debieran reflejar la tasa de crecimiento tumoral. Mediante determinaciones seriadas de APE durante al menos un período de 12 meses se puede calcular el tiempo de duplicación. Una alta proporción de los cánceres prostáticos tiene un tiempo de duplicación lento de 3 o más de 4 años. Los altos grados de Gleason se asocian a tiempos de duplicación más rápidos. Antígeno Prostático Libre En el último tiempo ha ganado importancia la determinación de la fracción libre de APE y su proporción con el valor total. Un % menor del 22% de fracción libre es sospechoso de cáncer. Esta medida puede ser una ayuda especialmente en la llamada zona gris de APE, con valores entre 4 y 10 ng/ml y mejorar la especificidad del examen, con el consecuente ahorro de biopsias innecesarias. Ecografía Transrectal Los estudios de imágenes más comúnmente utilizados en próstata son la ecotomografia pelviana o transabdominal y la ecotomografia transrectal. Esta última destaca por su precisión para medir próstata y proporcionar imágenes de buena calidad. La detección de una zona hipoecogénica intraprostática ha sido definida como característica de las neoplasias, sin embargo, la especificidad de este hallazgo no supera el 20%. Por ello la ecografía, como examen aislado, ha sido descartada como método de screening en cáncer prostático. Su gran valor está hoy día en servir de orientación durante la toma de biopsias prostáticas transrectales. Biopsia Prostática Transrectal Cada vez que se sospecha un cáncer prostático y se desea tomar una decisión terapéutica, está indicado realizar una biopsia prostática. La técnica más usada actualmente es la biopsia transrectal, idealmente guiada por ecotomografía (ver Figura 2). Se toma un mínimo de 6 muestras, una por cada sextante, agregando otras por cada región sospechosa al tacto o la ecografía. El procedimiento requiere una preparación simple que incluya antibióticos profilácticos y un lavado rectal mecánico. El índice de complicaciones es menor, en torno al 2%. Las más frecuentes son: infección urinaria y retención urinaria aguda. En ocasiones puede haber bacteremias que requieran un régimen antibiótico más enérgico y rara vez hospitalización. El informe del patólogo puede ser adenocarcinoma de próstata, en cuyo caso nos interesará conocer el grado de Gleason. La lectura de una biopsia prostática es un trabajo especializado que en ocasiones puede requerir de gran experiencia. Algunas afecciones pueden ser confundidas con cáncer, entre ellas están la hiperplasia de células basales, la Adenosis, la atrofia, la prostatitis granulomatosa y la neoplasia intraepitelial o PIN. El PIN de alto grado es una alteración morfológica de especial interés por ser vecina a un cáncer o constituir un precursor de éste. Una biopsia prostática negativa para cáncer no descarta absolutamente su presencia. La toma de las muestras puede haber caído en zonas sanas y no ser http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document representativa de lo que realmente existe en ese momento en la glándula. De allí que el paciente con sospecha de cáncer deba ser controlado periódicamente, dejando abierta la posibilidad de repetir la biopsia en futuras ocasiones. En la Figura 3 se señalan las recomendaciones usadas actualmente en la detección precoz del cáncer de próstata. Etapificación Clínica y Patológica Entre los diversos factores pronósticos, se han mencionado: la proporción de tumor Gleason 4 ó 5, el volumen tumoral, la invasión vascular intraprostática y, por supuesto, la etapificación, es decir, el grado de progresión local o a distancia que tiene el tumor en el momento de su diagnóstico. Anteriormente se describió la clasificación TNM y pTNM. Discutiremos cómo se precisan ellas en la práctica diaria y sus limitaciones. Las herramientas de evaluación del grado de extensión local de enfermedad más usadas son: el tacto rectal y la ecotomografía prostática. Ambas tienen la limitación de que en la mayoría de los casos la extensión es microscópica y, por lo tanto, imposible de determinar con esos métodos. El nivel de APE se correlaciona con los diferentes estadios de la enfermedad, pero en el caso individual la correlación es pobre. Finalmente la Tomografia Axial Computarizada (TAC) también tiene escaso valor para precisar la extensión local. Se ha podido determinar un error por sub-evaluación de hasta un 40 a 50% en la etapificación clínica con los métodos antes descritos. Una proposición interesante es la formulada por las tablas estadísticas que estiman con grados de certeza variable la etapa de un tumor cuando se conocen el tacto rectal, el grado de Gleason de la biopsia prequirúrgica y el APE. Entre ellas están las tablas formuladas por Partin y colaboradores, validadas también por la Clínica Mayo y nuestra Universidad. Un ejemplo del uso de las tablas de Partin es el siguiente: un paciente con un tumor T2a, APE de 4 ng/ml o menos y un score de Gleason 4 o menos, tiene con un 80% de posibilidades enfermedad confinada a la próstata y casi nula de tener metástasis linfáticas. El mismo caso con tumor T2a, pero con APE de 20 ng/ml y score de Gleason 8 o más, las posibilidades de tener enfermedad confinada se reducen al 5% y la metástasis linfática aumenta en riesgo al 20%. La mejor forma de evaluar el compromiso ganglionar linfático o progresión regional es mediante la resección quirúrgica de esos ganglios. Esto puede ser realizado durante el mismo acto quirúrgico destinado a resecar la próstata, o bien, como un procedimiento laparoscópico independiente. La TAC tiene las limitaciones ya descritas. La extensión sistémica de la enfermedad se estudia observando el compromiso óseo, ya que es excepcional la metástasis visceral sin la ocurrencia previa de metástasis ósea. El esqueleto se evalúa mediante la cintigrafía ósea con Tc99, que si bien es poco específica para cáncer de próstata, ayuda por la distribución de las lesiones y por concentrar la atención en una zona que requiera mayor estudio. Tratamiento por Etapas El tratamiento óptimo del cáncer prostático continúa siendo motivo de debate. http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document La difícil solución de esta discusión deriva tanto de características propias de la enfermedad, como de los individuos que la padecen y de la carencia de estudios clínicos "randomizados" (Tabla 3). Observación Si a un paciente se le diagnostica un cáncer prostático localizado y no se somete a ningún tratamiento, las posibilidades de que fallezca por esa causa durante los próximos 10 años son bajas. Esta observación y una conocida experiencia sueca, que reportó baja mortalidad en pacientes tratados conservadoramente, han sido argumentos para plantear esta conducta. Sin embargo, estos datos tienen que ser evaluados en su verdadero contexto, ya que no son extrapolables a los pacientes con expectativa de vida mayor de 10 años, ni tampoco a los casos de tumores moderadamente o pobremente diferenciados SEER USA Las estadísticas de SEER de USA muestran que en 1983 no se trataba un 50% de los pacientes a quienes se les diagnosticaba cáncer prostático. En 1992 esas cifras han disminuido a un 23%. En Chile seguramente la proporción de cánceres prostáticos que no se tratan debe ser menor, obedeciendo a la presión del paciente o familiar a tener una posición más activa ante un diagnóstico que suena muy amenazante. La conducta práctica que se puede aconsejar hoy es limitar la observación al paciente con expectativa de vida menor de 10 años, con cáncer bien diferenciado y de bajo estadio, encontrado en una RTU por hiperplasia benigna (T1a). Tabla N° 3 Tratamiento del Cáncer Prostático Recomendado por Etapas y Condiciones Específicas Etapa / Condición T1a Expectativa de vida < 10 años Expectativa de vida >10 años T1b, T1c, T2a y T2b Expectativa de vida < 10 años Expectativa de vida >10 años Márgenes quirúrgicos positivos Focal y bien o moderadamente diferenciado Difusos y moderadamente o pobremente diferenciados http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Tratamiento Observación Prostatectomía radical, Radioterapia, Observación Radioterapia, Homonoterapia. Prostatectomía radical, Radioterapía Hormonoterapia Observación Radioterapia, Hormonoterapia Untitled Document Metástasis Linfáticas (detectadas en prostatectomía radical) Hormonoterapia precoz Recurrencia post-prostatectomía radical sin metástasis con metástasis Radioterapia Recurrencia postradioterpaia Hormonoterapia T3 Terapia combinada (Prostatectomia radical + hormonoterapia, Radioterapia + hormonoterapia) o sólo hormonoterapia Enfermedad diseminada Hormonoterapia Enfermedad hormono - resistente Hormonoterapia de 2a línea (Ketoconazol + Gc), Quimioterapia Terapia de soporte Hormonoterapia Prostatectomía Radical Cuando el objetivo es erradicar la enfermedad, porque ella constituye una verdadera amenaza, la prostatectomía radical adquiere su mayor significado. En esta intervención se extirpan completamente la próstata, las vesículas seminales y se restituye la vía urinaria mediante anastomosis vesicouretral. Generalmente se asocia la linfadenectomía de ganglios ilíacos internos . Su principal indicación es el cáncer prostático localizado (T2a, T2b), aunque también puede ser beneficiosa en tumores con compromiso local (T3) o incluso con extensión linfática si se realiza terapia complementaria (hormonoterapia o radioterapia adyuvante). La enorme popularidad que ha alcanzado se refleja en las estadísticas de SEER que muestran que en 1983 solo un 10% de los cánceres prostáticos se trataban con Prostatectomía Radical, aumentando en 1992 al 37%. Por mucho tiempo fue una operación de gran morbilidad e, incluso, mortalidad. Actualmente el avance en las técnicas permite que casi no tenga mortalidad (0.2%) y tenga bajo índice de morbilidad. Las principales complicaciones son: Incontinencia Urinaria (2 al 7%), Impotencia Sexual (20 a 100%), Estenosis Uretrovesical (1 a 3%), Linfocele (1 a 3%), Tromboembolismo (1 a 5%). La disfunción eréctil que puede ocurrir después de esta operación puede ser evitada al respetar los haces neurovasculares localizados en hojas de la fascia pélvica lateral y que están muy vecinos a la glándula prostática (Ver Figura 4). El mejor predictor de conservación de la potencia sexual es la edad del http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document paciente. La preservación de ambas bandeletas se acompaña de conservación de la erección en la mayoría de los casos. Se entiende por margen quirúrgico positivo la presencia de tumor en el borde entintado de la pieza quirúrgica. Esta es una situación relativamente frecuente derivada en parte de la ubicación periférica del cáncer. Es reconocido como un factor de pronóstico adverso, sin que se pueda precisar su valor real. Consideramos que no existe enfermedad residual después de la cirugía cuando el APE desciende al cabo de algunas semanas a cifras indetectables (<0.02 ng/ml). Por el contrario, el APE que se mantiene detectable o el APE en sostenido ascenso son indicadores de recidiva tumoral o recidiva bioquímica. Los excelentes resultados de control de la enfermedad a largo plazo, con una baja morbilidad, convierten a esta cirugía radical en una terapéutica de elección cuando el objetivo es erradicar la enfermedad en el paciente menor de 70 años con enfermedad localizada. Radioterapia Por largos años la radioterapia y la cirugía radical han sido considerados los tratamientos que pueden ser curativos del cáncer prostático. Las modalidades que se emplean son: la radioterapia externa y la radioterapia intersticial. Esta última consiste en la aplicación de semillas radioactivas que se implantan en la glándula. El método es muy antiguo, pero ha visto renovado su interés con la aparición de nuevas semillas de Iodo-125 y Paladio-102. La radioterapia externa ha probado su eficiencia con resultados que son similares a la cirugía al tratar tumores relativamente pequeños, confinados a la próstata. Cuando la masa prostática es muy grande, las dosis estándares de radiación pueden ser insuficientes para erradicar todas las células cancerosas y las dosis elevadas podrían ser excesivamente tóxicas para las estructuras vecinas a la próstata. La braquiterapia o radioterapia intersticial también aparecen efectivas como la radioterapia externa y la cirugía radical al tratar tumores de bajo estadio (T1 o T2) con score de Gleason de 6 o menos. No sucede lo mismo con los tumores de score más alto, siendo totalmente ineficiente en los Gleason 8 o más. Una técnica relativamente nueva es la "conformal radiation", en la que el campo se diseña individualmente de acuerdo al volumen del tejido tratado. El método incluye la reconstrucción computarizada tridimensional de la próstata, con lo que se consigue aumentar la dosis y reducir la morbilidad. Estudios en animales han demostrado que la hormonoterapia previa o simultánea con la radioterapia aumentan la sensibilidad del cáncer de próstata a la radiación. Esta modalidad tiene grandes posibilidades de mejorar los resultados de radioterapia en clínica y ya han aparecido las primeras experiencias en ese sentido. Recidiva Bioquímica El APE es un excelente método para controlar la evolución de un paciente sometido a tratamiento de un cáncer prostático. Se considera que no hay enfermedad residual cuando a las pocas semanas de una prostatectomía radical el APE desciende a cifras indetectables (<0.02 ng/ml para el método Abbott). En el caso de la radioterapia la situación es más polémica, ya que a lo http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document largo del tiempo el valor nadir ha cambiado de 1.5 ng/ml a 1.0 ng/ml y ahora más recientemente a 0.5 ng/ml. Estas dificultades derivan de la presencia de la próstata en esta última situación. Cuando un paciente con cáncer prostático tratado con criterio curativo tiene APE detectable o no logra descender al valor nadir, estamos frente a una recidiva bioquímica. La mayor dificultad de esta condición es la localización de la recidiva, especialmente si el tacto rectal es negativo. Hay quienes realizan biopsias sistemáticas de la zona de anastomosis uretrovesical, cuando se ha realizado cirugía. Sin embargo, esta práctica es discutida por cuanto una biopsia negativa no descarta la enfermedad local. Tanto la cintigrafía ósea como el TAC abdominal y pelviano tienen un valor muy reducido en estas circunstancias, por tratarse de poblaciones celulares muy pequeñas. Finalmente el Prostacint, que es una técnica que combina la cintigrafía con el empleo de un marcador anticuerpo de APE, no ha tenido los resultados esperados. Ante esta carencia de métodos, que demuestren la localización de la recidiva, se ha recurrido a presunciones basadas en probabilidad estadística. Se señala que la aparición temprana de la recidiva, antes del año de tratamiento, el escore alto de Gleason (8 a 10) y el tiempo de duplicación tumoral rápido menor de 10 meses, están asociados a recidiva sistémica cuando el APE se eleva después de una prostatectomía. Algunas cifras sobre este problema son las siguientes: un tercio de los pacientes sometidos a cirugía radical desarrollarán metástasis durante los primeros 10 años. Desde la recurrencia del APE la mediana de tiempo de aparición de metástasis es de 8 años. Una vez que se desarrolló la enfermedad metastásica, la mediana de tiempo hasta el fallecimiento es de 5 años. Hormonoterapia El cáncer prostático requiere para su desarrollo del estímulo hormonal androgénico. Su deprivación produce retardo en su crecimiento e, incluso, una involución que puede durar años. Este hallazgo mereció en su oportunidad que los investigadores involucrados obtuvieran el Premio Nobel de Medicina. Actualmente 60 años después, la hormonoterapia continúa siendo usada como una forma de tratar pacientes con cánceres en estadios avanzados, o con expectativas de vida menores a 10 años, o con recurrencias, o como complemento de otro tratamiento en estadios intermedios (neoadyuvante o adyuvante). La forma más simple de emplear hormonoterapia es mediante la castración quirúrgica, que cuando se realiza respetando la albugínea en nuestro medio la denominamos resección subalbugínea. La castración también puede efectuarse con métodos farmacológicos, siendo los más difundidos el uso de agonistas de LHRH y los bloqueadores androgénicos, como la flutamida. Los estrógenos actuando en el eje hipotálamo-hipófisis y el ketoconazol (antimicótico) como antiandrógeno, también son otras posibles modalidades de hormonoterapia en cáncer de próstata . Inicialmente se creyó que el empleo de dos métodos diversos de hormonoterapia podrían hacerla más efectiva. Se usaron, por ejemplo, agonistas de LHRH más flutamida constituyendo el llamado bloqueo hormonal completo. Hoy se sabe que las terapias simples tienen el mismo resultado y el uso de flutamida aparece cuestionado. Desde que se iniciara la hormonoterapia en cáncer prostático los resultados no han variado mucho. Un 10% de los pacientes con enfermedad sistémica http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document fallecerán durante los primeros 6 meses, otro 10% sobrevivirá 10 años, el 50% no vivirá más de 3 años. La sobrevida a 5 años de ese estadio es del 25%. ¿Por qué ese comportamiento diferente? Una probable respuesta tiene que ver con la diversa proporción de células cancerosas hormonosensibles. Se ha discutido sobre la oportunidad de iniciar la hormonoterapia, de inmediato apenas se tiene el diagnóstico de enfermedad diseminada versus tardíamente, cuando aparezcan los síntomas. Los datos actuales indican que la hormonoterapia temprana podría aumentar la sobrevida de estos pacientes. Con el interés de disminuir los efectos colaterales del tratamiento antiandrogénico se ha propuesto realizar tratamientos intermitentes. La utilidad de estos esquemas está en discusión. Quimioterapia Cuando los tratamientos previos han fallado, una de las alternativas utilizable es la quimioterapia. Desgraciadamente, no disponemos de drogas de alta efectividad y los resultados son respuestas parciales que se observan entre un 20 y un 30%. Los agentes más usados son: vimblastina, estramustina, etopósido y taxol. Tratamientos Complementarios El cáncer prostático avanzado puede requerir tratamiento paliativo para controlar sus efectos locales o bien sistémicos. El compromiso regional pelviano puede traducirse en obstrucción urinaria baja (a nivel de cuello vesical) o alta (a nivel de orificios ureterales). En esos casos la resección transuretral o la derivación urinaria alta pueden ser útiles. La cistoprostatectomía radical es un procedimiento de salvataje que puede indicarse excepcionalmente. Los efectos sistémicos de la enfermedad metastásica más frecuentes y temibles son los derivados del compromiso esquelético, entre ellos el dolor óseo y la fractura patológica. Para combatir el dolor se ha usado radioterapia sobre el foco metastásico. Otra medida es el empleo de sustancias radiactivas (samario y estroncio) que se fijan en la lesión ósea y producen un efecto analgésico. Tabla de Sobrevida Experiencia del Departamento de Urología Pontificia Universidad Católica de Chile Sobrevida Cáncer Específica según Estudio Patológico en Cáncer de Prostata tratado con Prostatectomía Radical http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document Pontificia Universidad Católica de Chile El Futuro La alta prevalencia del cáncer prostático lo mantendrá en los futuros años como objeto preferencial de investigación clínica. Se puede predecir que habrá especial preocupación por los aspectos dietéticos: grasas, fibras, vitaminas, antioxidantes serán analizados en su rol de contribuir al desarrollo de este cáncer. Otros puntos de atracción serán los diversos métodos para mejorar la detección y los métodos por imágenes que permitan una etapificación más exacta. También parece crucial el desarrollo de sistemas que definan la agresividad tumoral, ya que está suficientemente demostrado que no todos los cánceres de próstata entrañan el mismo peligro. Finalmente, en el plano terapéutico se pueden avizorar promisorios avances en la reducción de la morbilidad, tanto de la cirugía como de la radioterapia. Queda por definir qué tratamiento o combinación de ellos ofrecen los mejores resultados a largo plazo. Un buen número de genes y proteínas se están evaluando como marcadores de virulencia tumoral. Algunas de estas sustancias podrían ser blancos de terapia. Otra posibilidad es la terapia génica, aunque la obtención de medidas aplicables en la práctica clínica puede demorar bastante tiempo. Una de las novedosas ideas que han surgido es la entrega de genes que codifican sustancias tóxicas a la célula. Si se logra que ellos operen solamente en la célula cancerosa, se habría conseguido un arma terapéutica selectivamente eficiente. Ciertamente hay mucho por hacer. http://escuela.med.puc.cl/publ/manualUrologia/CancerProstata.html[9/7/2009 3:15:11 PM] Untitled Document Patología y Cirugía de las Glandulas Adrenales Dr. Pedro Martínez Sanz PUC Figura 1: anatomía de las glándulas adrenales y relaciones de vecindad La historia de la cirugía de las glándulas suprarrenales es uno de los capítulos más interesantes de la urología moderna. Ya en 1756, Cook estableció la relación entre un tumor de la glándula suprarrenal y ciertas manifestaciones clínicas de tipo hormonal. Se atribuye a Thorton, en 1889, la primera extirpación de un tumor suprarrenal. Roux, en Lausanne, en febrero de 1926, y Charles Mayo, en Rochester en octubre del mismo año, efectuaron por primera vez la extirpación de un feocromocitoma. En ambos casos se desconocía el diagnóstico antes de la operación. En 1929 Pincoff y Shipley efectuaron correctamente el diagnóstico de feocromocitoma, operándolo con éxito. A partir de entonces, las indicaciones quirúrgicas para las diferentes enfermedades de las glándulas adrenales se han ido aclarando. Así, hoy se indica cirugía para tumores malignos de las glándulas adrenales, trastornos funcionales de la médula y corteza y en los nódulos tumorales hallados en ecotomografías o tomografías axiales computarizadas efectuadas en el estudio de otras enfermedades abdominales. Anatomía de las Glándulas Adrenales Figura 2: Relaciones posteriores de las glándulas adrenales Su peso varía de 3 a 5 gramos y su tamaño fluctúa de 40 a 60 mm de longitud, 20 a 30 mm de ancho y 2 a 8 mm de grosor. Su irrigación arterial está sujeta a múltiples variantes, pero usualmente la forman ramas de tres orígenes diferentes: de la arteria diafragmática, de la aorta y de la arteria renal. El drenaje venoso habitualmente es a izquierda por una gran vena que drena a la vena renal y a derecha por una vena que llega a la cava inferior. Pueden existir otras venas accesorias, de menor importancia, que drenan a la cava inferior a izquierda y a la vena renal a derecha. Mayor importancia parece tener el sistema porta de la glándula suprarrenal, que proporciona sangre rica en gluco-corticoides a la médula. Se favorece así la acción de la enzima feniletanolamina-N-metil-transferasa, responsable de la metilación de la norepinefrina para formar epinefrina. Debido a esto, el 95% de la epinefrina se genera en la médula suprarrenal. Figura 3: Ecotomografía muestra tumor en glándula adrenal Las glándulas suprarrenales son muy frágiles, especialmente la médula. Este hecho debe tenerse en cuenta en toda cirugía, ya que la adrenalectomía parcial efectiva es muy díficil de efectuar en forma controlada. Las glándulas adrenales son órganos endocrinos en que se suman dos orígenes embriológicos; un componente ectodérmico (médula) con secreción de catecolaminas (noradrenalina y adrenalina) y un componente mesodérmico (corteza) en que se reconocen las tres líneas de corticoides especializados: http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document glucocorticoides, mineralocorticoides y esteroides sexuales producidas en las zonas glomerular, fascicular y reticular de la corteza. La hormona ACT H gobierna a la corteza, mientras que la médula tiene una conexión nerviosa simpática importante y también con el sistema renina angiotensina. Las alteraciones en este gobierno complejo pueden dar origen a cuadros de desajustes hormonales graves. Figura 4: Tomografía computarizada muestra feocrocitoma adrenal La situación de las glándulas adrenales profundamente en el retroperitoneo y en la porción superior y posterior del riñón, junto a su tamaño con un eje principal no mayor de 5 cm, las hacen de difícil acceso al examen físico y requieren de medios de exploración más sofisticados. Hoy por hoy existen dos formas de examen para las glándulas adrenales: 1. El aspecto morfológico: que es muy bien informado por los medios de imágenes: a) Ecotomografía renal y abdominal, que permiten detectar aumentos de volumen, y Figura 5: Cintigrafía con yodo dibencilguanidina. b) Otras características de la glándula. Con frecuencia el estudio con ecotomografía abdominal descubre masas adrenales ignoradas. c) El uso de tomografía axial computarizada da una mayor precisión y permite establecer muy bien las relaciones con los otros órganos vecinos: riñón, cava, arterias, etc. Permite también explorar la región aórtica, interilíaca y pelviana para revisar posibles localizaciones heterotópicas de estos tejidos d) La resonancia nuclear magnética puede dar información muy similar al TAC. Figura 6: Tomografía computarizada de feocromocitoma e) Existen exámenes de funcionalidad y captación específica de elementos radioactivos como monoyodo dibencilguanidina que tiene afinidad especial por el tejido cromafín retratando en la cámara de conteo a la masa captadora. 2. Desde el punto de vista funcional las glándulas adrenales pueden ser estudiadas gracias a la dosificación de las hormonas que producen y de sus acciones en el organismo por hiper o hipofunción. Figura 7: Feocromocitoma De este modo el estudio morfológico y funcional de las glándulas adrenales está bien reglado y permite diagnósticos seguros y tratamientos exitosos, entre los cuales la cirugía ocupa un lugar importante. Así, hoy día se indica cirugía en tumores malignos de estas glándulas, en trastornos funcionales de la médula y de la corteza suprarrenal y en nódulos tumorales adrenales diagnosticados como hallazgos de ecotomografías o TAC, realizadas por estudio de otras enfermedades abdominales. Basado en la experiencia adquirida en nuestro hospital a lo largo de 30 años, entre enero de 1969 y diciembre 2000, revisamos retrospectivamente la experiencia adquirida. Nuestra serie fue reclutada en 30 años entre 1969 y 2000 con 111 pacientes http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document Figura 8: Masa Adrenal cuya edad promedio fue de 45,4 años (9-78). La distribución por sexo fue de 42 hombres (39,6%) y 63 mujeres (69,4%). De este total 68 pacientes (64,8%) presentaron clínica y/o laboratorio propios de algunas de las patologías adrenales primarias. Destacamos también que 37 (35,2%) se presentaron como un nódulo adrenal no funcionante, condición definida como la de un paciente portador de una masa adrenal no sintomática con un estudio bioquímico y endocrinológico negativo para alteraciones específicas de las enfermedades de las glándulas adrenales. Figura 9: Pieza quirúrgica En esta tabla se ve que el feocromocitoma fue la patología más frecuente, 42 casos (37,4%); en segundo lugar el hiperaldosteronismo primario 20 casos (19,04%); en tercer lugar el hipercortisolismo 16 casos (15,23%), y cuarto lugar el cáncer adrenal: primario o metastático con 15 casos (15,23%). Además se detallan otras patologías menos frecuentes (14,3%). Tabla 1 Patologia Adrenal 1969 - 2000 Total % Feocromocitoma 42 37,14 Hiperaldosteronismo 20 19,04 Hipercortisolismo 16 15,23 Cáncer suprarrenal 10(7) 9,52(6,66) Metástasis 5 5,71 Adenoma cortical 4 3,60 Hiperplasia cortical 3 2,86 linfagioma quística 3 2,86 Hematoma 2 1,90 Angiomielolipoma 2 1,90 Lipoma periadrenal 1 0,95 Tuberculosis SR 1 0,95 Mesotelioma 1 0,95 Quiste hiatídico Sr. 1 0,95 Ganglioneuroma 1 0,95 Funcionantes 33 20 16 2 1 0 0 0 0 0 0 0 0 0 0 No Funcionantes 7 0 0 8 (**) 5 3 3 3 2 2 1 1 1 1 1 Totales 111 100 71 (64%) 38 (34 %) Nota: (*) No funcionantes del punto de vista endocrino. (**) De los Cánceres SR. tres son funcionantes: dos Sd. Cushing´s están tabulados como hipercorticolismo y un feocromocitoma maligno. Feocromocitoma La patología de la médula adrenal incluye los feocromocitomas, neoplasias cromafines bien diferenciadas y de comportamiento benigno y los http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document neuroblastomas indiferenciados y casi siempre malignos. El feocromocitoma la mayor parte de las veces es sospechado por su clínica. Los síntomas y signos del feocromocitoma son causados por la liberación de catecolaminas al torrente circulatorio desde el tumor. La HTA es el signo más frecuente (84%) y hasta en un 37% de curso crónico. Las crisis hipertensivas muestran gran variedad en frecuencia y duración. En 34 (82%) casos presentaron clínica sugerente. La mayoría de estos casos se estudiaron en el contexto de una HTA secundaria en pacientes jóvenes. Algunos pacientes no presentan HTA, pero son estudiados en relación a crisis de taquicardia y sudoración. Por otro lado, 7 (18,4%) pacientes se presentaron como masas adrenales no funcionantes. Estos fueron detectados como hallazgos en exámenes de imágenes (ecografía y TAC) solicitados por dolor abdominal, masa abdominal palpable o control por otras patologías abdominales. También se detectó un caso por hallazgo intraoperatorio de una masa en el polo superior del riñón derecho. Los síndromes familiares asociados a feocromocitoma son el NEM IIa-IIb en los cuales son comunes los feocromocitomas bilaterales y displasias neuroctodérmicas que incluyen a la neurofibromatosis, esclerosis tuberosa y síndrome de Von Hippel Lindau, en las cuales lo habitual es el feocromocitoma unilateral. Dos pacientes presentan feocromocitomas unilaterales asociados a enfermedad de Von Hippel Lindau (padre e hijo). Tres pacientes presentaron un feocromocitoma bilateral asociado a un síndrome de NEM II; uno de ellos falleció a los 7 meses por metástasis múltiples de un cáncer medular de tiroides. Estos pacientes con síndromes familiares requieren un seguimiento cercano y una vigilancia periódica de feocromocitoma especialmente antes de cualquier cirugía electiva. Una vez establecida la sospecha diagnóstica, se requiere documentar el exceso de catecolaminas secretadas por el tumor (diagnóstico de laboratorio), a través de su medición en plasma o en orina de 24 horas. La presencia de catecolaminas urinarias elevadas es el examen bioquímico más sensible. La medición de catecolaminas plasmáticas presenta buena sensibilidad cuando se miden durante las crisis hipertensivas, pero sus niveles se pueden superponer con los de HTA esencial, perdiendo especificidad. En relación a la localización del feocromocitoma, este se presenta en situación extradrenal en 10-15% y en un 9% son bilaterales. En la serie, el 95,5% de los tumores fueron localizados a través de métodos de imágenes. Detectándose 34 feocromocitomas unilaterales (82%), 3 bilaterales (7,7%) y 4 extradrenales (10,25%). La TAC fue el método de imágenes con mayor rendimiento en la localización del feocromocitoma en nuestra serie (100%) y se recomienda como método de imágenes inicial (14-26). El cintigrama con MIBG permite rastrear tejido cromafín, presentando una sensibilidad del 87,4% y una especificidad del 99%. Util para el rastreo de feocromocitoma residual o maligno (16-27). Nosotros lo hemos utilizado en 16 pacientes, a partir de 1990, con una sensibilidad del 88% y una especificidad del 100% (incluye una lesión bilateral y dos extradrenales en el órgano de Zuckerkandl). En un paciente sintomático se localizó un feocromocitoma microscópico extradrenal en la laparotomía mediante la palpación paraaórtica realizándose una linfadenectomía con resección del tejido cromafín y curación. El tratamiento del feocromocitoma es la resección quirúrgica (adrenalectomía o resección del tumor extradrenal), permitiendo la mejoría de los pacientes. http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document Debido a la labilidad cardiovascular de estos pacientes el manejo preoperatorio requiere del uso de alfa y betabloqueadores, para disminuir las crisis hipertensivas y las arritmias complejas durante la cirugía. El alfa bloqueo con terazosina o doxazocina produce vasodilatación expandiendo el volumen plasmático, sin bloquear completamente la respuesta presora al manipular el tumor. Esto último es importante en la localización intraoperatoria de tumores pequeños, como sucedió en uno de nuestros enfermos. Si se ha obtenido una buena expansión de la volemia con un alfa bloqueo eficiente en el preoperatorio, no deben producirse hipotensiones riesgosas en el postoperatorio. Más del 50% de los pacientes que presentaron crisis hipertensivas severas durante la cirugía recibieron un alfa o beta bloqueo menor de tres días o con dosis subterapéuticas. Se requiere de un alfa bloqueo adecuado tanto en dosis como en tiempo, asociado a una buena reposición de volumen y sodio en el curso de varios días para disminuir la incidencia de crisis hipertensivas durante la cirugía. El beta bloqueo (en base a derivados del propanol) es un tema más controversial no utilizado por todos los centros y pretende disminuir la frecuencia cardíaca máxima para evitar las taquiarritmias complejas durante la cirugía. Si se utiliza el beta bloqueo, debe lograrse primero un adecuado alfa bloqueo, porque si no se puede bloquear la vasodilatación inducida por los alfa bloqueadores. La vía de abordaje en el feocromocitoma era clásicamente la anterior, para una completa exploración de ambas adrenales y toda la cadena de tejido cromafín. Actualmente con el uso de TAC y el cintigrama con MIBG ha sido posible una localización precisa y segura del tumor permitiendo el abordaje por lumbotomía en 11 feocromocitomas adrenales unilaterales, ofreciendo un excelente abordaje que simplifica la cirugía y el postoperatorio, reduciendo la morbilidad asociada. El abordaje anterior en la actualidad se restringe a los casos de bilaterales y de localización extradrenal. La cirugía del feocromocitoma consiste en la extirpación del tumor. La manipulación debe ser mínima hasta lograr la exclusión vascular venosa, de modo de evitar la liberación de catecolaminas al torrente circulatorio para evitar las crisis hipertensivas y las taquiarritmias. No hubo mortalidad operatoria ni perioperatoria y hubo morbilidad en 7 casos (17,9%) manejada satisfactoriamente. La serie tiene un caso recidivado y reoperado con éxito a 8 meses. Creemos que el diagnóstico de feocromocitoma se puede hacer con bastante certeza en el preoperatorio basado en la sospecha clínica y con la confirmación del laboratorio bioquímico. La TAC es el método de imágenes de mayor rendimiento en el estudio para la localización del tumor. El manejo preoperatorio adecuado con alfa o alfa y beta bloqueo es importante para reducir las complicaciones intraoperatorias. El tratamiento quirúrgico curativo se puede realizar con baja morbilidad. Aun en los casos de siembra extradrenal única suceptible de resecar completa. Hipercortisolismo El síndrome de Cushing corresponde al cuadro clínico de exceso de glucocorticoides, descrito por primera vez por Harver Cushing en 1932. El origen exógeno es hoy día el más frecuente, en relación a ingesta de glucocorticoides en dosis suprafisiológicas. Nos referiremos al hipercortisolismo de causa endógena. La regulación de la secreción de cortisol involucra circuitos de retroalimentación negativos entre la corteza adrenal y el hipotálamo e hipófisis. Aproximadamente en 70% de los hipercortisolismos, la secreción primaria y autónoma de cortisol está determinada por la corteza adrenal, lo http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document que corresponde al 10-20% de los casos de síndrome de Cushing. Entre las causas subyacentes destacan: el adenoma cortical (50-60%), carcinoma adrenal (10-20%) e hiperplasia cortical multinodular bilateral (20-30%). El 70-80% de los hipercortisolismos son por una hiperplasia adrenal secundaria a una hiperestimulación de ACTH (enfermedad de Cushing). La causa adrenal de un síndrome de ACTH ectópico, como un síndrome para neoplásico de un cáncer bronquial, pancreático o timona maligno. El hipercortisolismo adrenal corresponde habitualmente a un adenoma hiperfuncionante más frecuente en mujeres. Meador describe una hiperplasia multinodular autónoma con características similares a un adenoma. En un 10% la causa del hipercortisolismo es un cáncer adrenal cortical funcionante. Tuvimos tres casos de hiperplasia nodular autónoma, un caso de síndrome ACTH ectópico a primario desconocido y dos carcinomas adrenales hiperfuncionantes. El 81,25% de los hipercortisolismo ocurrió en mujeres. En el hipercortisolismo hay cortisol plasmático elevado y alteración del ciclo circadiano. El test de supresión de Liddle con 2 y 8 mg de dexametasona diferencia el origen hipofisiario o adrenal del hipercortisolismo. En los pacientes en que se practicó fue bastante certero. Actualmente estamos utilizando el test de Tirrel con 8 mg de dexametasona para el mismo objetivo, pero es técnicamente más sencillo por medir el cortisol plasmático y no los 17 OH urinarios. La enfermedad de Cushing se trata con hipofisectomía transesfenoidal con 10% de recurrencia. Si fracasa se requiere de adrenalectomía bilateral. El síndrome de Cushing adrenal unilateral se trata con adrenalectomía generalmente por vía lumbar. La cirugía, a la larga, es el mejor tratamiento. Los pacientes no operados presentan un 50% de mortalidad a 5 años. El síndrome de ACTH ectópico requiere del manejo del tumor primario, pero en situación de un primario desconocido se realiza adrenalectomía bilateral. El ketoconazol bloquea la esteroidogénesis y es útil para lograr reducir la obesidad que ofrece dificultades técnicas al operar estos pacientes (25,30). Hemos utilizado esta droga en 12 (75%) pacientes con buena respuesta clínica, sólo en 2 pacientes debió suspenderse por alteraciones de las pruebas hepáticas. Esta serie está compuesta por 13 (81,25%) mujeres y 3 (18,75%) hombres. La edad promedio es 42,1 (23-69) años. Tabla 2 Hipercortisolismo (Hospital Clínico Pontificia Universidad Católica de Chile) Descripción de la serie Años Enero 1969-Julio 1998 Número 16 pacientes Promedio edad 42,1 (23-69) años Hombres 3 (18,75%) Mujeres 13(81,25%) Todos (100%) presentaron un cuadro clínico florido sugerente de síndrome de Cushing (obesidad centrípeta, facies característica, hipertensión arterial, acné, estías violáceas, alteraciones menstruales e hirsutismo en mujeres), que motivó el estudio. http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document En el laboratorio endocrino presentaron cortisol plasmático elevado los 11 pacientes en que este se midió. En 13 pacientes se utilizó el test de Nugent (cortisol plasmático postfrenación con 1 mg de dexametasona) evidenciando en todos ellos cortisol elevado. El test de Liddle con 2 mg de dexametasona se realizó en 12 pacientes, en 9 de ellos no se produjo frenación de los 17 OH urinarios. El conjunto de exámenes confirmó el síndrome de Cushing en el 100%. Tabla 3 Hipercortisolismo Estudio Clínico (Hospital Clínico Pontificia Universidad Católica de Chile) N Sexo Edad Radiología ° 1 M 24 Diagnóstico Tamaño(cm) Postoperatorio Enfermedad de Cushing 2 Enfermedad de Cushing M 3 43 30 4 F 65 5 F 40 6 F 38 7 F 43 8 F 45 9 F 31 Laboratorio Endocrino 17 Ohu (e) Liddle 2 mg (-) 17 Ohu (e) cortisol (e) Liddle 2 mg (-) Liddle 8 mg (-) 17 Ohu (e) Liddle 2mg (-) Liddle 8 mg (-) UIV/venografía 17 Ohu (e) cortisol (e) Liddle 2 mg (-) Liddle 8 mg (-) TAC Nugent(e) Cortisol (e) Liddle 2 mg (-) Liddle 8 mg (-) TAC Liddle 2 mg (-) Liddle 8 mg (-) ECO/TAC Nugent(e) Cortisol (e) Liddle 2 mg (-) Liddle 8 mg (-) TAC Nugent(e) Liddle 2 mg (-) Liddle 8 mg (-) TAC 17 Ohue(e) cortisol(e) Nugent(e) Liddle 2 mg(+) Liddle http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] - Adenoma izquierdo 3x3 Carcicoma derecho 10x6 Adenoma izquierdo 2x2 Adenoma izquierdo 6x5 Adenoma derecho 4x5 Hiperplasia cortical bilateral Adenoma pigmentario izquierdo 25x3 Untitled Document 10 F 35 TAC 11 F 23 TAC 12 F 66 ECO/TAC 13 F 40 TAC 14 F 35 TAC 15 M 69 TAC 16 F 38 TAC 8mg(+) 17 Ohue(e) cortisol(e) Nugent(e) Liddle 2 mg(-) Liddle 8mg(+) 17 Ohue(e) cortisol(e) Nugent(e) Liddle 2 mg(+) Liddle 8mg(+) 17 Ohue(e) cortisol(e) Nugent(e) Liddle 2 mg(+) Liddle 8mg(+) Nugent(e) cortisol(e) Liddle 8mg() Cortisol (e) Nugent (e) Liddle 8 mg (-) Cortisol (e) Nugent (e) Tirrel 8 mg (-) ACTH (e) Ectopico? Cortisol (e) Nugent (e) Tirrel 8 mg (-) ACTH (baja) Hiperplasia multinodular cortical bilateral Adenoma pigmentario derecho 15x1 Hiperplasia multinodular cortical bilateral Adenoma cortical Carcicoma cortical derecho 12x11 Hiperplasia cortical bilateral Adenoma cortical izquierdo Una vez confirmado el síndrome de Cushing, en 9 de los 13 pacientes se realizó el test de Liddle con 8 mg de dexametasona, no se evidenció frenación de los 17 OH urinarios. Tres pacientes se realizaron un test de Tirrel con 8 mg de dexametasona no demostrando frenación del cortisol plasmático en todos ellos. Ambos exámenes sugirieron un origen adrenal o ectópico en 12 casos. Sólo en dos pacientes se midió ACTH, muy elevada en un caso de síndrome ACTH ectópico y suprimida en un adenoma adrenal (Tabla 2). El TAC tuvo un 100% de rendimiento en la localización y en la diferenciación entre adenoma e hiperplasia adrenal en los 12 últimos casos (antes no disponible). En dos pacientes la localización se hizo con ecografía y confirmada con la TAC (Tabla 2). De los 16 pacientes con síndrome de Cushing, en 12 se utilizó ketoconazol (200-400 mg/día) en el manejo preoperatorio, con bloqueo en la síntesis de cortisol adrenal y baja de peso. También mejora el acné cutáneo, con lo que contribuye a disminuir infecciones. Sólo en dos casos debió interrumpirse por alteración de las pruebas hepáticas. La cirugía fue la adrenalectomía unilateral http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document por lumbotomía en 10 casos y bilateral por vía anterior en 6 pacientes con hiperplasia autónoma suprarrenal bilateral o enfermedad de Cushing. La cirugía consistió en la adrenalectomía de las suprarrenales afectadas. La histología demostró: 8 adenomas corticales, 2 hiperplasias multinodular bilateral autónoma, 2 carcinomas adrenales funcionantes y 2 enfermedades de Cushing, y 2 hiperplasias bilaterales secundarias a síndrome ATCH ectópico. Un paciente se reexploró meses después por una TAC con masas en la raíz del mesenterio evidenciando un tumor carcinoide (síndrome ectópico) No hay mortalidad en la serie, 4 (25%) pacientes presentaron morbilidad de tipo infecciosa: un absceso subfrénico, una atelectasia pulmonar y dos infecciones de herida operatoria, manejadas satisfactoriamente. Hiperaldosteronismo Primario Es el síndrome que resulta de la hipersecreción autónoma o semiautónoma de aldosterona. Las principales manifestaciones son HTA, hipopotasemia y supresión del eje renino-angiotensina. Es responsable del 0,5 a 1% de los casos de HTA. y equivale al 5-10% de los casos HTA. tratables quirúrgicamente. Generalmente afecta a personas jóvenes. Este síndrome fue descrito por Conn en 1955 y se debería en un 20% de los casos a una hiperplasia cortical adrenal y en un 70 a 80% a un adenoma cortical. Sin embargo, para el patólogo suele ser muy difícil poder hacer la diferencia en muchas ocasiones. También pueden producir mayor secreción de aldosterona el carcinoma adrenal cortical y algunos tumores ováricos productores de aldosterona. De 111 pacientes operados por patología adrenal entre 1969 y 1999, 20 pacientes tenían un hiperaldosteronismo primario. La serie está compuesta por 11 (55%) mujeres y 9 (45%) hombres. La edad promedio es de 44.5 (25-74) años. Descripción de la serie Años Número Promedio edad Hombres Mujeres Enero 1969-Julio 1998 20 pacientes 44,5 (25-74) años 9 (45%) 11(55%) El hiperaldosteronismo primario es causado en la mayor parte de los casos (+/70%) por un adenoma cortical. En un 15 a 20% se debe a una hiperplasia cortical y en mucho menor frecuencia un carcinoma SR o tumores ováricos productores de aldosterona. El exceso de aldosterona explica las manifestaciones como la hipokalemia y alcalosis. El principal problema en el diagnóstico del HAP se debe a que todos los signos y síntomas son moderados e inespecíficos, favoreciendo el subdiagnóstico de esta patología. Los síntomas más frecuentes son cefalea, fatiga, polidipsia, poliuria y nicturia. Estos son secundarios a la hipokalemia y la supresión del eje renina-angiotensina. Debido a la retención de sodio aumentada por el exceso de aldosterona, se produce una expansión del volumen intravascular que lleva http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document a la HTA. La HTA moderada está casi siempre presente; más del 70% presenta presión arterial diastólica menor de 120 mmHg. Todos nuestros pacientes presentaron HTA y síntomas asociados a la hipokalemia, que permitieron plantear la sospecha diagnóstica de HAP. Ante la sospecha clínica de HAP, debemos confirmar una hipokalemia menor de 3,5 meq/lt, previa suspensión de estrógenos, diuréticos por 2 semanas (6 semanas en el caso de espironolactona) bajo una dieta de sobrecarga de sodio (6-12 grs/día NaCI), se debe demostrar la supresión del eje reninaangiotensina a través de la medición de la actividad de renina plasmática (APR<1, 0ng/kg/hr) y el aumento de la aldosterona plasmática y/o urinaria (>14 mg/día). Por lo tanto, el diagnóstico bioquímico de HAP se establece frente a aldosterona elevada y supresión del eje renina-angiotensina. Frente a casos con valores límites o como examen confirmatorio, se puede realizar el test de supresión con 25 mg de Captopril, midiendo aldosterona plasmática y ARP. En HAP la aldosterona no disminuye; la ARP sigue suprimida. Debe determinarse si la hipersecreción proviene de un adenoma o una hiperplasia de la corteza adrenal, dado que el tratamiento del primero es quirúrgico (adrenalectomía) y el del segundo es médico con espironolactona. Las pruebas endocrinas posturales o de respuesta a la espironolactona permiten sospechar el origen del HAP debido a que la supresión de la renina es más radical en el caso del adenoma que de la hiperplasia. En nuestra serie se realizó estudio endocrino en 17 (85%) pacientes, confirmándose el HAP en todos ellos (100%). Sólo en 3 pacientes se efectuaron pruebas orientadas a diferenciar adenoma de hiperplasia que sugirieron adenoma. Tabla 4 Estudio Clínico en Pacientes con Hiperaldosteronismo N a Sexo Edad Radiología Laboratorio Histología Tamaño (cm) Adenoma 1 F 35 venografía ALDu 2x2 cortical Adenoma 2 F 49 venografía ALDu ARP 15x1 cortical venografía Adenoma 3 M 61 Tac ALDu ARP cortical 2x2 suprimida venografía Hiperplasia 4 M 30 Tac ALDu ARP cortical suprimida Hiperplasia 5 M 38 venografía cortical Adenoma 6 F 63 TAC 3x2 arteriografía cortical Adenoma ALDu ARP cortical Suprimida postural 3x2 7 F 25 TAC (APA) Captopril (APA) ARP Hiperplasia http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document Suprimida Captopril (APA) ALDu suprimida ALDu ARP suprimida Postural (APA) Captopril (APA) ALDu ARP suprimida 8 F 37 TAC 9 M 44 TAC ECO 10 F 30 TAC 11 M 41 TAC ECO 12 F 40 TAC 13 M 44 TAC ECO ALDu 14 M 45 TAC ALDu ARP suprimida 15 M 63 TAC ALDu 16 F 41 TAC ECO RNM ARP suprimida 17 F 74 TAC ECO ALDu alta 18 M 48 TAC RNM ALDu alta Captopril 19 F 40 TAC ECO ALDu alta 20 F 43 TAC ECO ALDu alta cortical Adenoma cortical Adenoma cortical Adenoma cortical Adenoma cortical Adenoma cortical Hiperplasia cortical Hiperplasia cortical Adenoma cortical Adenoma cortical Adenoma cortical Adenoma cortical 4x8 2 15x1 12x7 6x5 1x1 3,5x4 3,3x4 1,5 El tercer paso en el diagnóstico requiere la localización de la masa adrenal. La TAC permite localizar esta masa y diferenciar entre adenoma e hiperplasia cortical adrenal en la mayoría de los casos, constituyéndose en el examen diagnóstico de elección. En esta serie el rendimiento del TAC fue del 100%, sugiriendo adenoma en todos ellos. La venografía presenta menor rendimiento que la TAC; puede presentar serias complicaciones como infartos de la glándula. Actualmente no se utiliza. En los primeros 5 pacientes de la serie tuvo un 80% de rendimiento. En los adenomas siempre debe hacerse tratamiento médico con espironolactona por plazo +/— de 1 a 3 meses previo a la cirugía. Esto permite normalizar la presión arterial, la kalemia y favorecer la recuperación de la renina evitando un hipoaldosteronismo hiporeninémico al extirpar el tumor y dejar la otra glándula crónicamente frenada y atrofiada. Dado que habitualmente el HAP está dado por un adenoma unilateral (75%) localizado por la TAC, esto permite un abordaje por vía lumbar con excelente campo y seguridad. La cirugía consiste en la resección de la adrenal afectada. En esta serie 17 (85%) se abordaron por vía anterior. En 2 casos se utilizó una lumbotomía mínima video-asistida. No ha habido mortalidad, con mínima mortalidad en relación a la herida operatoria. Existe controversia y dificultad en el diagnóstico histológico de adenoma cortical e hiperplasia cortical productora de aldosterona. Muchos de los aspectos microscópicos del adenoma se repiten en menor tamaño en los casos diagnosticados como hiperplasias. http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document Cáncer Adrenal De los 15 casos de cáncer adrenal, sólo 2 se estudiaron por presentar clínica de hipercortisolismo, los 13 restantes se presentaron como nódulo adrenal no funcionante diagnosticados por estudios de imágenes (Eco y/o TAC) solicitados por: dolor lumbar en 2 casos, masa abdominal palpable en 3 casos, estudio de imágenes de control en cáncer renal operado en 4 casos, hallazgo intraoperatorio en 1 caso y como hallazgo de imágenes pedidos por otras enfermedades abdominales en 3 casos. De los 15 casos de cáncer adrenal, 10 son primarios (8 no funcionantes, incluyendo 1 de los feocromocitomas malignos bilateral y 7 carcinomas adrenales) y 5 metastásicos no funcionantes (4 metástasis de carcinoma renal y 1 cáncer de tiroides). También metastizan en las adrenales el cáncer bronquial, de mama y páncreas. El tamaño de las lesiones malignas varió entre 2,8 y 15 cm (promedio = 6,4 cm). De los 37 pacientes que presentaron masas adrenales no funcionantes, 22 (59,5%) fueron hallazgo de la ecografía y/o TAC solicitadas por otro motivo, 5 casos se estudiaron por masa abdominal palpable, 8 casos por dolor abdominal, 1 caso por hematuria y 1 caso fue hallazgo intraoperatorio en una colecistectomía. En este grupo se encontraron 13 (86,6%) de los 15 cánceres adrenales. La mayoría de estos cánceres (7 casos, 54%) presentaron masas con un diámetro mayor de 6 cm. El resto de las lesiones varió entre 2,8 y 4,5 cm, con un promedio de 3,5 cm. La combinación de la clínica, laboratorio endocrino-bioquímico y los diferentes métodos de imágenes permitieron el hallazgo y/o confirmación diagnóstica de todas las lesiones. La TAC, como método de imágenes individual, fue la más efectiva en la localización (92% en 83 casos en que se utilizó) de masas adrenales. Un total 15 casos presenta cánceres adrenales primarios o metastásicos. Sólo el 13,3% (2 casos ) eran funcionantes (síndrome de Cushing). La mayoría son no funcionantes (86,7%). El diámetro promedio fue de 6,4 cm. La literatura refiere que los nódulos adrenales de menor tamaño pueden corresponder a lesiones involutivas secundarias a cambios cíclicos en el trofismo de la glándula adrenal, que incluso protruyen fuera de ésta (33). En nuestra serie no detectamos ninguna de estas lesiones y si hubiéramos considerado el tamaño en la indicación quirúrgica habríamos no resecado 3 lesiones metastásicas de 2,8 y 3 cm (2 en cáncer, renal y 1 en cáncer tiroides). Actualmente a los pacientes con lesiones menores de 3 cm los seguimos con TAC seriada (3-6 meses) y si estas crecen se indica cirugía. Las masas adrenales no funcionantes se diagnostican cada vez con más frecuencia por el uso generalizado de métodos de imágenes como ecografía y TAC. La ecografía tiene un rol de pesquisa dado su bajo costo y alta sensibilidad. La TAC presenta entre un 0,6-1,3% de incidentalomas. La probabilidad de malignización de una masa adrenal incidental menor de 3 cm es menor de 0,006% (46). De nuestros pacientes con masas suprarrenales no funcionantes un 35,1% (13 casos) presenta cánceres adrenales primarios o metastásicos y un 18,9% (7 casos) presentan feocromocitoma, ambas patologías de resolución quirúrgica. La mayoría de los cánceres adrenales presentan lesiones mayores de 6 cm de diámetro (60%). A pesar de ello, 3 http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Untitled Document casos tenían metástasis en lesiones de 3 cm. Dado que las imágenes no permiten determinar la naturaleza maligna o benigna de las lesiones adrenales con certeza, pensamos que el diagnóstico lo da la histología. Las imágenes permiten localizar la lesión y orientar el abordaje; a nuestro parecer, este es la lumbotomía por su excelente campo y mejor postoperatorio. Tabla 5 Cáncer Adrenal - Características Funcionante Primarios 10 Metastásicos 5 Total 15 2 0 Primarios 6 Carcicoma cortical Carcicoma indiferenciado Carcicoma medular Feocromocitoma maligno Metastásicos Cáncer renal Cáncer de tiroides No funcionante 8 5 2 1 1 4 1 15 Vía de Elección para la Cirugía Adrenal La existencia de la glándula adrenal en ambos lados del cuerpo plantea escoger una vía de acceso para cada patología. La precisión topográfica que se obtiene mediante los medios de imágenes, en especial la TAC, junto a la precisión de los diagnósticos funcionales, permiten hoy día elegir vías de acceso preferenciales para determinadas patologías y para cada paciente de acuerdo a sus características particulares. La vía anterior mediante laparotomía media o transversa subcostal se utilizará para patologías bilaterales. Estos son los casos de feocromocitomas bilaterales asociados a NEM II, los feocromocitomas extraadrenales o paragangliomas que requieren de una exploración y disección muy amplias. También en los casos de adrenalectomía bilateral en los hipercortisolismos por hiperplasia bilateral autónoma o en casos del síndrome de ACTH ectópico sin primario conocido. En los casos de lesiones unilaterales incluyendo feocromocitomas, adenomas corticales y en tumores adrenales no funcionantes, hemos preferido la lumbotomía, por proporcionar un excelente acceso directo sin las dificultades de la vía transperitoneal y procedimiento quirúrgico de breve duración. También en los nódulos adrenales no funcionantes unilaterales hemos utilizado con éxito el método de lumbotomía mínima y adrenalectomía endoscópica video-asistida extraperitoneal. Este método presenta todas las ventajas de no comprometer mayormente la pared abdominal. Debe usarse para casos muy bien seleccionados en que las condiciones locales y el entrenamiento del equipo quirúrgico lo permitan. N http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] Diam Untitled Document ° Edad Sexo Prsentación Estudio Rx 1 40 M 2 3 4 5 6 7 58 73 34 45 38 60 F F F M F M 8 67 M 9 63 M 10 66 M 11 59 F 12 66 M 13 55 M 14 62 F 15 63 F 16 62 M Sida TBC (hallazgo) Masa Op. Masa Abd. Dolor Abd. Masa Abd. Masa Abd. Masa Abd. Ca. Renal Control Ca. Renal Control Ca. Renal Control Ca. Renal Control Nod. (hallazgo) Dolor Lumbar Masa Abd. HTA (hallazgo) Hematuria 17 66 F Hallazgo 18 58 M Hallazgo 19 49 F Hallazgo 20 54 F Hallazgo 21 61 F Dolor Lumbar 22 30 F Hallazgo 23 35 M Hallazgo 24 34 F Hallazgo 25 58 M 26 64 M 27 50 28 14 M M 29 35 F 30 69 F Hallazgo Dolor Lumbar Hallazgo Hallazgo Dolor Lumbar Dolor Lumbar Tac (+) (cm) 10 Lado Diagnóstico Izq. Feocromocitoma Tac (+) Tac (+) Eco Tac (+) Angio (-) Angio (+) 3,6x6 8 6 10 15 10 Eco (-) Tac (+) Eco (-) Tac (+) 7,1 Der. Met. Ca. Renal 2,8 Izq. Met. Ca. Renal 3 Der. Met. Ca. Renal 1 Izq. Hiperplasia nodular 3 Izq. Met. Ca. Tiroides Eco (-) Tac (+) Eco (-) Tac (+) Eco (-) Angio (+) Bilat. Der. Izq. Izq. Feocromocitoma Feocromocitoma Feocromocitoma Ca. medular Ca. Cortical Izq. Ca. indiferenciado 5,5 Izq. Hematoma 10 Der. TBC SR 8 Der. Adenoma cortical Urv Tac (+) 7 Tac (-) Eco 2 (+) Tac (+) 3,5 Eco (+) Tac 3 (-) Eco (+) Tac 2,2 (-) Tac(+)MIGB(- 3 ) Eco (+) Tac 8 (-) Eco (+) Tac 4,2 (-) Eco (+) Tac 4 (-) Tac (-) 6 Der. Angiomelipoma Eco (+) Izq. Lipoma adrenal Tac Tac Eco (-) Eco (-) (+) (+) (+) Tac (+) Tac http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] 4 4 6,5 5 Izq. Adenoma cortical Izq. Adenoma cortical Der. Hiperplasia nodular Der. Hiperplasia nodular Izq. Linfongiomaquístico Izq. Linfongiomaquístico Izq. Hematoma Der. Feocromocitoma Der. Feocromocitoma Izq. Ca. indiferenciado Der. Feocromocitoma Izq. Linfangiomaquístico Izq. Ca. Sr. Renal Untitled Document Tac (+) 4,7 M F Ca. Renal Control Hallazgo Hallazgo Tac (+) Tac (+) 34 69 F Hallazgo Tac (+) 14,5 Der. Ganglioneuroma 15 Izq. Ca. Sr. Cortical 9 Izq. Mesotelioma pa. Sr. 35 48 M 36 63 M 37 54 M Dolor Lumbar Dolor Lumbar Hallazgo Eco (+) Tac (+) Tac (+)Rnm(+) Tac (+) 31 53 M 32 11 33 74 Izq. Met. Ca. Renal 9 Izq. Quiste Hiatídico Sr. 8 Der. Ca. Sr. Cortical 8,6 Izq. Mielolipoma No hemos utilizado la vía laparoscópica que está descrita como posible; pero queda por demostrarse sus ventajas en especial por la necesidad de desplazamientos de órganos intraperitoneales como colon, duodeno, riñón etc. El tiempo operatorio y las preferencias del cirujano frente a cada caso son también factores muy importantes a considerar. La elección de la vía de acceso a la(s) glándulas adrenal(es) es una decisión del cirujano frente a cada caso particular considerando que hay patologías en que la bilateralidad, la presencia de tumores funcionantes heterotópicos, la necesidad de una disección extensa hacen ya necesario un abordaje amplio y seguro. La utilización de estos criterios de elección ha contribuido a que experiencia de 111 pacientes intervenidos a lo largo de 30 años mortalidad operatoria ni perioperatoria, que los resultados de la sido óptimos y que el número de complicaciones haya sido bajo todos con éxito. http://escuela.med.puc.cl/publ/manualUrologia/PatologiaCirugiaGlandulas.html[9/7/2009 3:15:32 PM] en esta no haya cirugía hayan y siempre Untitled Document Introducción Figura 1: Mutuaciones más frecuente en el gen de VHL. El cáncer es el resultado del daño del DNA y la consecuente alteración del código genético, que lleva a una célula a crecer en forma desordenada y sin control. El DNA de la célula cancerosa es inestable, y cualquier alteración cromosómica que ocurra tiende a acumularse y a perpetuarse en el tiempo, disminuyendo la respuesta normal de la célula a las señales de regulación intra y extracelulares, con el consiguiente crecimiento del tumor y progresión a estados más indiferenciados. En el cáncer las células malignas proliferan y producen una progenie también maligna; estudios de marcadores genéticos demuestran que las células malignas derivan de un solo precursor celular común o clon. Sin embargo, el origen clonal de los tumores no implica homogeneidad en las células tumorales debido a los cambios genéticos sucesivos que va sufriendo cada célula tumoral, por los distintos estímulos microambientales que influyen en su crecimiento (1, 2). Las características biológicas de los tumores les permiten crecer, proliferar y metastizar; todo este proceso es consecuencia de los cambios en el genoma (mutaciones), que pueden ser mutaciones puntuales, delecciones, inserciones, traslocaciones y amplificaciones. Existen hechos concretos que demuestran que son las mutaciones las que causan el cáncer. Tabla 1. Figura 2: Mecanismo de acción de VHL. Tabla 1 Evidencia que las mutaciones causan cáncer Cáncer mutaciones - Muchos carcinógenos son mutagénicos. - Defectos en la reparación de genes aumentan la posibilidad de desarrollar cáncer. - Inestabilidad cromosómica y génica es frecuente en muchos cánceres. - Muchos cánceres pueden ser hereditarios. - Los tumores malignos son clonales. - Algunos tumores tienen oncogenes mutados. - Algunos tumores han perdido o tienen mutado un gen supresor de tumores. Figura 3: Cromosoma 1 y localización de HPC1 El cáncer es una enfermedad genética, que requiere para su iniciación de dos o más mutaciones en la "stem cell". Pero el desarrollo y mantención posterior del tumor dependen de las características de proliferación celular y de numerosos factores del huésped, como la presencia de factores de crecimiento y de resistencia, propios de cada individuo. Ciertos cánceres, como retinoblastoma o el tumor de Wilms, se desarrollan http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document y HPC2 Figura 4 Figura 5: Pasos propuestos en la transformación de la célula prostática. dependiendo de los cambios genéticos heredados y de posteriores alteraciones genéticas somáticas en un locus específico, mientras otros cánceres, como el cáncer esporádico de pulmón, vejiga y colon, son el resultado de anormalidades genéticas adquiridas en múltiples genes, debidas a la exposición a factores medio-ambientales. (3) Como se puede ver, el cáncer es una enfermedad compleja y un gran número de cambios genéticos están implicados en su desarrollo. El proceso de carcinogénesis involucra múltiples pasos, que se traducen finalmente en cambios genotípicos y fenotípicos. Los cambios genéticos incluyen mutaciones de los genes supresores de tumores, alteración de la expresión de protooncogenes, de los factores de crecimiento, y de genes que facilitan el desarrollo de las metástasis. Los genes supresores de tumores y los proto-oncogenes son los principales blancos del daño genético. Los genes supresores de tumores son los encargados de regular el crecimiento celular e impedir la formación de tumores; el más característico es p53, conocido también como el guardián del genoma humano, ya que está encargado de reparar el daño genético o inducir apoptosis (o muerte celular) en varios puntos del ciclo celular, cuando detecta errores en el material genético (DNA). (3,4) Este no es el único gen supresor y existen varios perfectamente identificados, como VHL, hMSH2, APC, RET entre otros (Tabla 2). Cuando se pierde la función de estos genes se facilita el desarrollo de los tumores. Para impedir su acción reguladora en el crecimiento e inhibición de la formación de tumores, se necesita de la inactivación de ambas copias del gen. La inactivación de una copia habitualmente ocurre por pérdida del gen, lo que se conoce como pérdida de heterocigocidad (LOH), y la pérdida de la segunda copia del gen se produce habitualmente por inactivación, ya sea por mutación o mutilación. Los proto-oncogenes son genes que regulan los factores de crecimiento y sus receptores resultando primordiales para la sustentación de la célula. Además contienen información para la síntesis de proteínas que regulan y controlan la proliferación celular y su diferenciación. Mutaciones, amplificaciones y defectos en estos genes hacen que su función se transforme en la de un oncogen, cuyo producto induce la transformación de la célula normal a una tumoral (4, 5) Tabla 3. Ciclo Celular y Cáncer Gran parte de los eventos del ciclo celular están regulados por las ciclinas, cdk (Cyclin Dependent Kinase) e inhibidores de CDK. Las ciclinas son proteínas cuya concentración y actividad varía en cada etapa del ciclo celular. Las CDK y sus inhibidores, que pueden ser de la familia de los KIP (Kinase Inhibitor Protein) o INK (inhibitor of CDK4), se encuentran en un nivel constante a lo largo del ciclo celular. Las ciclinas se unen a las CDK, produciendo su activación; una vez activadas estas cumplen funciones específicas actuando sobre otras proteínas nucleares, lo que condiciona la progresión de la célula a otros estadios del ciclo celular. Diferentes cíclicas están envueltas en distintas fases del ciclo y se sabe que todas ellas pueden ser blancos de cambios genéticos o pueden ser alteradas en el proceso de ontogénesis, como veremos más adelante. La pérdida de la sensibilidad a la inhibición del proceso de crecimiento es el resultado de la pérdida del control positivo de las cíclicas o pérdida de la función de los inhibidores de CDK. Así también la inestabilidad génica, http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document determinada por la habilidad de la célula tumoral de saltarse los mecanismos de restricción presentes al inicio de la fase S (fase de síntesis) del ciclo celular, conduce a la perpetración de una línea celular con DNA defectuoso. La sobreexpresión de ciclinas ha sido demostrada en cánceres como el de colon y mama, donde está desregulada la expresión de la cíclica E. (5) Tabla 2 Ejemplos de Genes Superiores, su Ubicación y Patología Asociada Tumor Suppressor Chomosomal Gene Location hMSH2a 2p22-21 FHIT hMLHTa 3p14.2 3p21.3 - p23 VHL 3p25-p26 APC CDKN2 5q21 9p21 RET 10q11.2 PTEN/MMACT WT-1 10q23.3 11p13 MEN1 11q13 BRCA1 13q12-13 RB1 13q14 p53 17q12-13 NF-1 17q12-22 BRCA1 17q21 Smad4/DPC4 MADR2 NF-2 18q21.1 18q21 22q12.2 Malgnancy Hereditary nonpolyposis colarectal cancer (HNPCC) Various tumor types HNPCC Von Hippel-Lindau disease Familial polyposis Familial melanoma Multiple endocrine neoplasia 2 Various tumor types Wilms´tumor Multiple endocrine neoplasia 1 Familial breast cancer (early onset) Retinoblastoma Li-Fraumensi syndrome, many tumor types Neurofibromatosis 1 Familial breast and ovarian cancer Pancreatic cancer Colorectal cancer Neurofibromatosis 2 a Mismarch repair genes. Tabla 3 Ejemplos de Oncogenes y su Acción Específica Oncogene Function Growth Factors http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document int-1 int-2 sis Growth - Factors receptors erbB-1 fms kit met neu/erbB-2 matrix protein fibroblast growth factor-related protein Platelet-derived growth factor ros TrkA Epidermal growth factor receptor CSF-1 receptor Stem-cell growth factor receptor Hepatic growth factor receptor Heregulin receptor Glial cell derived enurotrophic factor receptor Unknown ligand Nerve growth factor receptor G. proteins H-ras K-ras N-ras GTPase GTPase GTPase Cytoplasmic kinases bcr-abl fes-fps fgr hck Ick pim src yes raf/mil mos Tyrosine kinase Tyrosine kinase Tyrosine kinase Tyrosine kinase Tyrosine kinase Tyrosine kinase Tyrosine kinase Tyrosine kinase Serine - theonine kinase Serine - theonine kinase Other cytoplasmic proteins bcl-2 Anti - apoptosis Nuclear proteins erbA ets fos jun L-myc IyI-1 myc N-myc Tyroid hormone receptor Transcription factor Transcription factor Transcription factor Transcription factor Transcription factor Transcription factor Transcription factor ret http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document reI ski tal-1 Transcription factor Transcription factor Transcription factor Cánceres Urológicos Los cánceres urológicos tienen un comportamiento similar a los lineamientos generales ya descritos; trataremos brevemente de ver los procesos moleculares más importantes que se encuentran involucrados en los cánceres urológicos más frecuentes, tanto en su génesis como en su crecimiento y maduración. Cáncer Renal Cromosomas y Genes El cáncer renal se puede presentar, como casi todos los cánceres, con una forma hereditaria y otra no hereditaria o esporádica, constituyendo estos últimos la gran mayoría (95%). Un 85% de los cánceres esporádicos son carcinomas de células claras, 5-10% son cánceres papilares y el resto constituye variantes poco frecuentes, como los cromófobos y los carcinomas de los tubos colectores. La caracterización de algunos cánceres hereditarios ha permitido la identificación de los genes involucrados en el proceso de carcinogénesis renal, así como de sus diferentes expresiones genotípicas dependiendo del daño genético encontrado. Si bien no todas las mutaciones se encuentran presentes en todos los cánceres renales, las más comunes constituyen la base actual del conocimiento de esta entidad. El mejor caracterizado de los cánceres renales hereditarios es el que acompaña al síndrome de Von Hippel Lindau (VHL); los individuos con este síndrome tienen la capacidad de desarrollar tumores en variados órganos, incluyendo riñones, cerebelo, espina dorsal, ojos, glándulas adrenales, oído interno y páncreas. El gen de VHL es un gen supresor de tumores que se encuentra en el brazo corto del cromosoma 3 (3p); este gen tiene 3 exones que codifican para una proteína de 213 aminoácidos. Ambas copias del gen se encuentran inactivas en los tumores de pacientes con VHL: mutación en el alelo heredado y pérdida del otro alelo (wild type allele). La inactivación de ambas copias del gen del VHL es uno de los primeros eventos en el desarrollo de los cánceres renales de células claras, y en un alto porcentaje se ha encontrado LOH del cromosoma 3p. Sin embargo, el gen de VHL no se encuentra mutado ni tampoco se halla LOH en los cánceres renales del tipo papilar (Figura 1). El gen supresor de tumores VHL forma un complejo trimolecular estable con dos subunidades de transcripción (Elongin SIII). Elongin a su vez está compuesto de otras tres subunidades A, B, C. La elongin A es necesaria para inhibir el proceso de replicación de la RNA polimerasa II, elongin B favorece la unión de elongin C con elongin A, y las tres se unen con VHL. En los cánceres renales esporádicos y en los pacientes que tienen el síndrome, se encuentran frecuentes mutaciones en el tercer exon del gen de VHL, lo que se traduce en la incapacidad del gen VHL de unirse a elongin B y C, con la consiguiente pérdida de función del gen, permitiendo el desarrollo de tumores (Figura 2). http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document (6,7) Otros cambios moleculares encontrados en los cánceres renales esporádicos de células claras es su alto grado de neoangiogénesis, con una elevada expresión del factor de crecimiento vascular endotelial (VEGF), el que in vitro puede ser revertido con la introducción de un "wild" VHL gen, lo que demuestra el rol regulador que también tiene este gen en el proceso de angiogénesis que acompaña a los cánceres. La pérdida de heterocigocidad o pérdida de un alelo se ha documentado hasta en un 98% de los casos, y el otro alelo se encuentra mutado en más de un 50% de los casos. Más frecuentemente un alelo se encuentra mutado y el otro metilado como evento primario en el desarrollo de este tumor. En estadios más avanzados o cuando existe progresión del tumor, aparecen eventos genéticos agregados como aumentos en la expresión del factor de transformación y crecimiento (TGF), alteraciones en el cromosoma 5 (5p22), 17p13 (p53) entre otros, los que condicionan un peor pronóstico. Los cánceres esporádicos tipo papilar, aunque en menor frecuencia que los de células claras, pueden presentar anormalidades genéticas manifiestas, entre ellas se han descrito las trisomías (45 a 69%) de los cromosomas 7, 10 y 17 y recientemente algunas translocaciones no bien caracterizadas entre el cromosoma 1 y el X. Los cánceres papilares hereditarios (HPRC) son otros síndromes heredables con un patrón autonómico dominante. Los individuos que lo padecen tienen un alto riesgo de desarrollar un cáncer papilar multifocal. Recientemente se ha logrado describir en las líneas germinales de las familias afectadas un protooncogen, cmet (7q31.1-34), como el posible responsable debido a una mutación tipo "missense" en una tirosina kinasa dominante del gen. Así también otras anormalidades similares a las descritas en los tumores papilares esporádicos se pueden encontrar en estos tumores. Los tumores cromófobos, aunque infrecuentes, también presentan patrones de anormalidad genética y molecular como monosomías de los cromosomas 1, 2, 6, 10, 13 y 17. La pérdida de heterocigocidad (LOH) no es un patrón común en estos tumores, encontrándose presente en un 20% de los casos. En resumen, el análisis de la mutación del gen de VHL forma parte integral del diagnóstico de cáncer renal, así como el screening de los individuos asintomáticos en las familias portadoras del síndrome. Pacientes con un cáncer renal avanzado tienen una expectativa de sobrevida de 8 a 10% a dos años; sin embargo, esta puede ser del 95% a 5 años en los casos de cánceres diagnosticados en etapas precoces, por lo que la detección precoz de la inactivación del gen de VHL puede ser un elemento importante para su pesquisa precoz. Son muchos los genes descritos en la génesis de los distintos subtipos de cáncer renal, lo que abre una gran puerta a la investigación, tanto de su función especifica como sus interacciones (8). Antígenos y Proteínas El cáncer renal es quizás uno de los cánceres que tiene como característica la elevada expresión de anfígenos de superficie, lo que lo cataloga como un tumor inmunogénico por su capacidad para generar respuesta en el sistema inmune (linfocitos T). http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document El listado de antígenos, que pueden estar presentes en el cáncer renal, puede ser interminable, por lo que nos centraremos en quizás el más promisorio: MN/CA9. (HLA A2.1). Este antígeno se encuentra presente en el núcleo y la membrana plasmática en más un 85% de los cánceres renales y no es expresado por los tejidos renales no tumorales. La expresión de MN/CA9 en las células resulta en alteraciones morfológicas y de los patrones de crecimiento, lo que permite plantear que MN tiene un rol importante en la regulación de la síntesis de proteínas y proliferación celular (9, 10). La selectividad de expresión de algunos anfígenos en las células tumorales permite pensar en estrategias de tratamientos selectivos para el cáncer renal, mediante la activación del sistema inmune contra anfígenos determinados como MN/C9. Los linfocitos T pueden generar esta respuesta inmune contra estos anfígenos determinados, seleccionando clones con respuesta específica. A su vez las células dendríticas (célula presentadora de anfígenos) pueden ser inducidas a expresar los distintos anfígenos, de manera de lograr, al ponerlos en contacto con linfocitos T, que generen el clon específico capaz de atacar selectivamente a las células tumorales que expresan el anfígeno en cuestión (9, 10, 11). Esta línea de tratamiento selectivo para los cánceres renales puede ser una forma de tratamiento con insospechadas proyecciones a futuro y está basada en la detección, caracterización y secuenciación de los distintos antígenos que expresan las células tumorales. Cáncer Prostático Como en otras neoplasias, el cáncer de próstata está acompañado de cambios genómicos que incluyen deleciones, amplificaciones y mutaciones puntuales. El cáncer prostático tiene un componente hereditario, donde existen uno o más genes autosómicos dominantes que predisponen a su desarrollo; la evidencia se puede basar en hechos concretos. (Tabla 4). Tabla 4 Evidencias del patrón hereditario en cáncer prostático Cáncer de próstata hereditario - Hay familias con tres o más miembros afectados. - Pueden existir individuos afectados en tres o más generaciones, tanto de la rama materna como paterna. - Los individuos afectados con antecedentes familiares pueden presentar cáncer antes de los 55 años. Existen también evidencias que hay una forma hereditaria recesiva ligada al cromosoma X, ya que el riesgo relativo de desarrollar cáncer es 2,6 veces más alto entre hermanos con cáncer prostático que en los hijos de individuos afectados, en los cuales es 1,7 veces más alto respecto a la población normal (13). Sin embargo, sólo un 5 a 10% de los cánceres prostáticos son hereditarios y su causa es poligénica, como en muchos otros tumores sólidos. El polimorfismo existente en los múltiples genes que regulan el funcionamiento de la próstata, http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document como el gen del receptor androgénito o de la 5 alfa reductasa, hace difícil dilucidar la génesis del proceso oncogénico en este cáncer (13). El estudio de grupos familiares seleccionados con cáncer de próstata, como gemelos mono o dicigóticos, muestra una concordancia en el desarrollo de cáncer prostático del 28 y 7% respectivamente; estos estudios indicarían que los genes encargados de su desarrollo se encuentran en los cromosomas 1 y X (14). El reconocimiento de que una predisposición al cáncer de próstata puede heredarse ha llevado a la búsqueda de genes específicos asociados con la enfermedad. A través de los otros estudios de familias con tres o más integrantes de primer grado afectados con cáncer de próstata, se ha identificado una región en el brazo largo del cromosoma 1 (1q 24-25), que tentativamente contiene un gen (HPC1) (Human Prostate Cancer) y el HPC2, relacionados con el desarrollo de cáncer prostático. Figura 3. La confirmación de este hallazgo y la demostración de herencia familiar son hechos a considerar en el screening de familias con alto riesgo. Así, en familiares de primer, segundo y tercer grados el riesgo relativo de desarrollar un cáncer de próstata aumenta en 18, 11 y 2,5% respectivamente con relación a la población general. Esta forma de cáncer familiar, asociada con la transmisión de este gen dominante de alta penetrancia, aumenta la probabilidad de desarrollar cáncer de próstata en individuos menores de 45 años, con un riesgo estadístico que alcanza al 88% a los 85 años (15). Otro gen recesivo ligado al cromosoma X ha sido considerado también como factor hereditario, así como la inactivación de genes supresores, los que son importantes en cánceres esporádicos. Un número cada vez mayor de cambios genéticos han sido documentados en el cáncer de próstata: como la pérdida de un alelo, mutaciones puntuales y metilaciones. Sin embargo, y a pesar de la alta frecuencia de esta patología, aún es poco lo que se sabe de los genes involucrados en su desarrollo. Estudios citogenéticos y moleculares muestran que las deleciones más frecuentemente involucran los cromosomas 7q, 8p, 10q, 13q, 16q, 17p y el cromosoma Y. Polisomías se han demostrado también asociadas a peor pronóstico en estos pacientes. Metilación del DNA Un evento temprano en la carcinogénesis de los tumores sólidos parece ser una alteración en la metilación del DNA, y en cáncer de próstata esta no es la excepción. La hipermetilación de áreas genómicas ricas en nucleótidos CpG ha sido asociada con la inactivación génica. Entre otro de los eventos importantes propuestos en el cáncer de próstata está la metilación del gen GSPT, que codifica para la formación de la glutation transferasa, que cataliza la conjugación del glutation reducido, encargado de la protección y defensa contra los factores medioambientales y los carcinógenos encógenos. La glutation S transferasa clase 1 (GSTP1) cumple una función defensiva contra las hidroperoxidasas, evitando el daño al material genético. Mediante inmunohistoquímica se ha logrado demostrar que GSTP1 se encuentra presente en las células normales prostáticas, pero está ausente en los cánceres prostáticos. La hipermetilación de este gen se encuentra presente no sólo en los cánceres, sino que también en más de un 70% de las neoplasias de alto grado (PIN3). Estos hallazgos permiten plantear que la inactivación de GSTP1 es uno de los primeros cambios que promueven la inestabilidad y transformación neoplásica de la célula prostática (16). http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document Las neoplasias intraepiteliales de alto grado se caracterizan por un aumento global de la fracción de proliferación y división celular, y se presupone que esta es la lesión precursora de los cánceres prostáticos. Así como ocurre en los carcinomas de cuello uterino, este aumento de la proliferación celular se traduce en una displasia, que pudiera ser un estado precanceroso en la glándula prostática, donde existe una desorganización espacial y desregulación de la expresión génica en la célula basal de la glándula. Sin embargo, los mecanismos y consecuencias de los cambios experimentados en las neoplasias intraepiteliales aún no están completamente dilucidados. Por otro lado, toda la diferenciación, maduración y proliferación prostática son controladas por el estímulo androgénico. El polimorfismo existente en el receptor androgénico es muy importante y puede asociarse a inestabilidad genomita. El gen que codifica para este receptor androgénico se encuentra en el cromosoma Xq11-q12 y tiene una secuencia polimórfica en el exon 3 (CAG) que se asocia en forma inversamente proporcional al riesgo de desarrollar cáncer prostático. Mientras mayor sea el largo de esta secuencia menor es la posibilidad de desarrollar cáncer, así claramente se ha demostrado en la población afro-americana, que tiene una secuencia significativamente más corta, con un mayor riesgo de desarrollar cáncer (17). La secuenciación de este gen, específicamente en el exon 3, permite predecir el riesgo relativo de desarrollar cáncer de próstata. Hoy día sólo tres factores de riesgo claros han sido identificados en la génesis del cáncer de próstata; estos son: edad, antecedentes familiares y grupo étnico. Las variaciones en los factores genéticos pueden explicar diferencias entre los distintos grupos raciales en las diferentes áreas geográficas. Así también el polimorfismo genético, para aquellos genes que codifican para la enzima 5 alfa reductasa, el receptor de andrógenos o la vitamina D, se ha asociado con diferencias en el riesgo de desarrollar cáncer de próstata. Así la evidencia actual sugiere que la asociación familiar en el cáncer de próstata está principalmente relacionada con la herencia y no con los distintos estilos de vida. Se ha estimado que aproximadamente un 9% de casos de cáncer prostático es el resultado de la herencia de genes mutados. Existen pocos datos acerca de diferencias clínicas entre individuos afectados con cáncer de próstata hereditario y aquellos que ocurren en la población general (esporádicos). Globalmente los individuos que presentan mutación de HPC1 demuestran que la edad al momento del diagnóstico es menor, los tumores son de más alto grado de malignidad y más avanzados que en los individuos sin antecedentes familiares. Esto conlleva a que los individuos con susceptibilidad genética (antecedentes familiares) deban tener un control clínico más temprano que la población normal. De acuerdo con la American Urological Association, se recomienda iniciar el control a los 40 años y no a los 50 como en la población sin historia familiar. Genes Supresores de Tumores y Oncogenes La pérdida de algunos potenciales genes supresores de tumor ha sido demostrada como un evento tardío en la transformación de células prostáticas. Pérdida de la heterocigocidad se ha asociado con deleciones en algunos cromosomas: 8p, 10q, 13q y 18q. Aproximadamente un 70% de los pacientes con cáncer de próstata clínicamente localizado pueden mostrar deleciones en el cromosoma 8p 22. Así también un 36% de los pacientes con enfermedad http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document localizada y 60% de pacientes con tumores metastásicos demuestran deleciones en el cromosoma 16q, sitio supuesto del gen supresor de tumor E caderin. E cederin es una molécula de superficie celular que media en la interacción y adhesión epitelial célula-célula. La pérdida de la expresión de esta molécula conlleva un aumento del potencial invasivo (18). La pérdida de una copia del gen de retinoblastoma (Rb) es común, así como también la mutación del p53. El primero aparece como un elemento inicial en el desarrollo de la enfermedad cancerosa prostática y el segundo más bien uno tardío. Sin embargo, la inespecificidad de ambos las hace mutaciones poco atractivas como marcadores tumorales. Fenómenos de resistencia androgénica o de capacidad metastásica están asociados a la expresión de bcl/2, p53 y bax, por lo tanto, reguladas por genes de la apoptosis, los cuales deben mantener un estrecho equilibrio que permita su autorregulación y expresión. Los genes que regulan el proceso de carcinogénesis aún no están claramente identificados, por lo que debemos mantener la investigación tanto para el cáncer familiar como para el esporádico. La identificación de cambios genéticos moleculares específicos en el carcinoma de la próstata podría ser útil en el diagnóstico precoz, transformándose en una herramienta clínica y terapéutica a futuro. Cánceres de Urotelio Los cánceres de urotelio, ya sea del tracto superior (pelvis y uréter) como los del tracto inferior (vejiga), tienen factores ambientales claramente relacionados con su génesis y entre los más identificados están el cigarrillo, la exposición a químicos ambientales, ingestión de endulzantes y analgésicos, café, infecciones parasitarias, cálculos y un largo listado. Sin embargo, estos pueden ser los agentes iniciadores del proceso carcinogénico, pero la promoción y progresión de este fenómeno están a cargo de oncogenes y genes supresores de tumores y las distintas mutaciones que puedan influir en la perpetuación de la estirpe celular defectuosa. Mismatch Repair Así como en los cánceres renales y de próstata, también existen casos de cánceres de urotelio familiares como HNPCC (Hereditary Nonpolyposis Colorectal Cancer), que corresponde a un síndrome que tiene como característica la alta frecuencia de tumores en el colon, páncreas, endometrio y estómago, así como la aparición de cánceres de urotelio en el tracto urinario superior. En este cáncer hereditario se ha detectado inestabilidad microsatélite, debida a las deficiencias en el sistema de reparación de genes (mismatch repair system). Este sistema está formado por un grupo de genes encargados de corregir los defectos en el DNA; el prototipo de este gen es el gen supresor de tumores hMSH2 (2p16) y hMLH1 (3p21) (19). Ambos genes codifican para proteínas nucleares y hMSH2 codifica específicamente para una proteína de expresión nuclear de 97 kD, la cual tiene 16 exones, encontrándose delecciones (homozigous deletion) en los últimos exones, en los cánceres vesicales superficiales de alto grado y los cánceres invasores (20). Esta mutación lamentablemente es con frecuencia un evento tardío en los cánceres vesicales, por lo que más bien puede ser utilizada como elemento http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document pronóstico más que diagnóstico. Genes Supresores y Oncogenes Los genes supresores de tumores más frecuentemente encontrados en los cánceres vesicales son p53 (17p), retinoblastoma —Rb— (13q) y genes del cromosoma 9 (9p21), donde se encuentran los genes que codifican para la síntesis de p15 y p16. El p53 es el gen más frecuentemente afectado en los cánceres sólidos; como ya señalamos, su función específica es resguardar el DNA impidiendo que la célula con material genético defectuoso se perpetúe, ya sea mediante la reparación del DNA o la inducción de apoptosis. Por esto no es de extrañar que en los cánceres de vejiga, en los que existe anormalidad de p53, sean en general más agresivos e indiferenciados, ya que han perdido parte de los mecanismos normales de reparación (21). La detección inmunohistoquímica de p53 es posible, ya que se expresa como una proteína nuclear, por lo que se le puede utilizar incluso como factor pronóstico en cáncer vesical. La mutación de p53 aparece como un evento temprano en cánceres vesicales de alto grado e invasores, confirmando su índice pronóstico (22). El gen del retinoblastoma codifica para una proteína —pRb—, la cual es fosforilada por cdk presentes en el núcleo celular. Normalmente pRb forma un complejo estable con otra proteína nuclear E2F (factor de transcripción); sin embargo, al encontrarse libre E2F, ya sea por fosforilación de pRb o por pérdida de pRb (pérdida del gen), esta se une a regiones promotoras de algunos genes permitiendo la activación del ciclo celular y paso de fase G1 a S (23). El complejo balance entre cdk y Rb permite a la célula regular su crecimiento, manteniendo un complejo estable con E2F. Al perderse la acción del gen supresor Rb, E2F queda libre para actuar y la célula puede progresar en el ciclo celular escapando de muchos de los puntos de chequeo presentes al inicio de la Fase S, permitiendo una vez más la perpetuación de líneas celulares con material genético defectuoso. Otros genes involucrados en el proceso de regulación celular son los que codifican para p16 y p17 (9p), los que forman complejos con las cdk 4 y 6 manteniendo el complejo equilibrio con pRb. Como se puede ver, el complejo mecanismo regulatorio en el ciclo celular está afectado en los cánceres de urotelio; sin embargo, estos eventos muchas veces necesitan de un factor iniciador medioambiental como los que ya fueron mencionados. Los oncogenes también tienen un rol importante en la génesis de los cánceres vesicales, su rol es importante en el proceso de iniciación (c-jum) y de manutención, siendo muchas veces los culpables de las recurrencias y progresión a estadios avanzados en los cánceres vesicales (ras y c-myc). El oncogen c-jum tiene importancia en la formación del complejo de transcripción AP-L, importante en la regulación del crecimiento celular. La hipometilacion de c-myc permite la proliferación celular indiscriminada; así cada oncogen se puede encontrar en diferentes estadios del cáncer vesical, desarrollando diferentes acciones específicas (24). Para finalizar la detección de algunas trisomías como la del cromosoma 7 son frecuentemente encontradas en los cánceres vesicales, particularmente en los más agresivos. En el cromosoma 7 se encuentra el gen que codifica para http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document algunos factores de crecimiento y de receptores de crecimiento (TGF, VEGF). La sobreexpresión de algunos factores de crecimiento le permite a la célula tumoral tomar ventaja respecto a una célula normal aumentando su expresión. El listado de cambios genéticos y moleculares descritos en cáncer de vejiga puede ser muy largo, entre ellos erb-2, bax y bcl/2; sin embargo, nos hemos centrado en los más frecuentes y con mayor relevancia clínica actual. Lamentablemente casi todos los eventos moleculares descritos se asocian a tumores de alto grado, invasores y avanzados, por lo que es fundamental actuar médicamente sobre los eventos ambientales que son los que pueden gatillar el proceso oncogénico. Bibliografía 1. Smith ML, Chen IT, Zhan Q, O’Connor PM, Fornace AJ Jr. Involvement of the p53 tumor suppressor in repair of u.v.-type DNA damage. Oncogene 1995, 16;10(6):1053-9. 2. Chromosomal aberrations in soft tissue tumors. Relevance to diagnosis, classification, and molecular mechanisms. Sreekantaiah C, Ladanyi M, Rodríguez E, Chaganti RS. Am J Pathol 1994, 144(6):1121-34. 3. Weinberg RA.The retinoblastoma protein and cell cycle control Cell 1995, 5;81(3):323-30. 4. Varmus H. Retroviruses. Science 1988, 10;240(4858):1427-35. 5. A new acquaintance for erbB3 and erbB4: a role for receptor heterodimerization in growth signaling. Carraway KL 3rd, Cantley LC. Cell 1994, 15;78(1):5-8. 6. Identification of the von Hippel-Lindau (VHL) gene. Its role in renal cancer. Linehan WM, Lerman MI, Zbar B. JAMA 1995, 15;273(7):564-70. 7. Duplication of two distinct regions on chromosome 5q in non-papillary renalcell carcinomas. Bugert P, Von Knobloch R, Kovacs G. Int J Cancer 1998, 4;76(3):337-40. 8. Thrasher JB. Molecular markers in renal cell carcinoma: not quite ready for "prime time". Cancer 1999, 1;86 (11):2195-7. 9. Uemura H, Nakagawa Y, Yoshida K, Saga S, Yoshikawa K, Hirao Y, Oosterwijk E. MN/CA IX/G250 as a potential target for immunotherapy of renal cell carcinomas. Br J Cancer 1999, 81(4):741-6. 10. Vissers JL, De Vries IJ, Schreurs MW, Engelen LP, Oosterwijk E, Figdor CG, Adema GJ. The renal cell carcinoma-associated antigen G250 encodes a human leukocyte antigen (HLA)-A2.1-restricted epitope recognized by cytotoxic T lymphocytes. Cancer Res 1999, 1;59(21):5554-9. 11. Brasanac D, Markovic-Lipkovski J, Hadzi-Djokic J, Muller GA, Muller CA. Immunohistochemical analysis of HLA class II antigens and tumor infiltrating mononuclear cells in renal cell carcinoma: correlation with clinical and histopathological data. Neoplasma 1999;46(3):173-8. 12. Establishment and characterization of seven Dunning rat prostatic cancer http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document cell lines and their use in developing methods for predicting metastatic abilities of prostatic cancers. Isaacs JT, Isaacs WB, Feitz WF, Scheres J. Prostate 1986, 9(3):261-81. 13. Coffey, Donald. A selection of 21 frontiers for the 21st century in prostate cancer research to enhance the understanding and control of abnormal growth of the prostate. Presented at the American Association for the cancer research meeting on prostate cancer. California, 1998. 14. Ahlbom A, Lichtenstein P, Malmstrom H, Feychting M, Hemminki K, Pedersen NL. Cancer in twins: genetic and nongenetic familial risk factors. J Natl Cancer Inst 1997, 19;89(4):287-93. 15. Narod S. Genetic epidemiology of prostate cancer. Biochim Biophys Acta 1999, 29;1423(1):F1-13. 16. Millar DS, Ow KK, Paul CL, Russell PJ, Molloy PL, Clark SJ. Detailed methylation analysis of the glutathione S-transferase pi (GSTP1) gene in prostate cancer. Oncogene 1999, 11;18(6):1313-24. 17. JL Stanford et al., Polymorphic receptor in the androgen receptor gene: molecular markers of prostate cancer risk. Cancer Res 2000, 15;60(2):499. 18. Padalecki SS, Troyer DA, Hansen MF, Saric T, Schneider BG, O’Connell P, Leach RJ. Identification of two distinct regions of allelic imbalance on chromosome 18q in metastatic prostate cancer. Int J Cancer 2000, 85(5):654658. 19. Jin TX, Furihata M, Yamasaki I, Kamada M, Liang SB, Ohtsuki Y, Shuin T. Human mismatch repair gene (hMSH2) product expression in relation to recurrence of transitional cell carcinoma of the urinary bladder. Cancer 1999, 15;85(2):478-84. 20. Christensen M, Jensen MA, Wolf H, Orntoft TF. Pronounced microsatellite instability in transitional cell carcinomas from young patients with bladder cancer. Int J Cancer 1998, 21;79(4):396-401. 21. Rabbani F, Cordon-Cardo C. Mutation of cell cycle regulators and their impact on superficial bladder cancer. Urol Clin North Am 2000 Feb;27(1):83102, IX. 22. Miyake H, Hara I, Yamanaka K, Arakawa S, Kamidono S. Synergistic enhancement of resistance to cisplatin in human bladder cancer cells by overexpression of mutant-type p53 and Bcl-2. J Urol, 162(6):2176-81. 23. Christoph F, Schmidt B, Schmitz-Drager BJ, Schulz WA. Over expression and amplification of the c-myc gene in human urothelial carcinoma. Int J Cancer 1999, 20;84(2):169-73. 24. Keegan PE, Lunec J, Neal DE. p53 and p53-regulated genes in bladder cancer. Br J Urol 1998, 82(5):710-20. http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document http://escuela.med.puc.cl/publ/manualUrologia/BiologiaMolecular.html[9/7/2009 3:15:51 PM] Untitled Document Al final del seminario el alumno deberá ser capaz de: Describir en que situaciones se debe considerar la posibilidad de un traumatismo genitourinario y que aspectos se deben tener en cuenta al evaluar la magnitud potencial del daño. Describir los tipos de traumatismo renal y la conducta terapéutica general en cada uno de estos. Señalar los tipos de traumatismos vesicales y su manejo general Señalar los tipos de traumatismos de uretra y su manejo general Explicar como se estudia el traumatismo testicular y cuando se indica cirugía. Describir las características clínicas del cólico renal, su evaluación diagnóstica y manejo. Mencionar en que condiciones es recomendable hospitalizar a un paciente con cólico renal Describir los cuadros más comunes de disuria, su evaluación diagnóstica y aspectos generales de tratamiento. Explicar la diferencia entre retención urinaria aguda y anuria obstructiva alta y aspectos generales de su manejo Describir las causas mas habituales y el manejo general de la hematuria macroscópica Explicar en que consiste los cuadros de balanitis, fimosis y parafimosis y cuales son las recomendaciones de tratamiento en cada caso Describir las características clínicas de la epididimitis aguda, su evaluación diagnostica y aspectos generales de su tratamiento Describir las características clínicas de la torsión testicular, su evaluación diagnóstica y su tratamiento Explicar en que consiste el cuadro de priapismo y aspectos generales de su tratamiento. Caso clinico Traumatismo Genitourinario El tracto genitourinario con excepción de los genitales externos en el hombre se encuentra bien protegido del traumatismo externo ya que como consecuencia de su situación anatómica está rodeado de otras vísceras y estructuras musculoesqueléticas. Por esta razón las lesiones se presentan con mayor frecuencia en el paciente politraumatizado, describiéndose hasta en un 10 a 15% de todos los casos de trauma abdominal.Evaluación diagnóstica y manejo inicial: Figura 1: Las imágnes grafican los distintos tipos de lesiones por trauma renal cerrado. Van desde la contusión al riñon fragmentado. Es importante diferenciar si se trata de un traumatismo aislado de la vía genitourinaria (raro) o asociado a un politraumatismo. La evaluación y manejo inicial en el paciente politraumatizado es común y ha sido descrita como el ABC del trauma. Estas prioridades están destinadas a identificar y tratar condiciones de riesgo vital: A: control y mantención de la vía áerea y columna cervical B: establecer una ventilación adecuada C: acceso circulatorio para reemplazo de fluidos y control de la hemorragia http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document Figura 2: Nefrectomía parcial en lesión traumática del polo inferior del riñon. Tratada la situación de emergencia, es necesario obtener información detallada del traumatismo que permitan establecer su mecanismo, magnitud y potenciales órganos o sistemas comprometidos. El examen físico puede orientar acerca del área traumatizada. El compromiso genitourinario hay que considerarlo en particular en: - pacientes con traumatismo en áreas topográficas relacionadas al tracto urinario o genital y especialmente cuando se producen fracturas costales bajas o de los huesos pelvianos. - la presencia de sangre en el meato urinario externo o uretrorragia. - la aparición de hematuria macro o microscópica en cualquier paciente con traumatismo abdominal. Figura 3: Reparación de uréter sobre tutor doble J. Algunos conceptos que es conveniente tener en cuenta en esta evaluación son: - la magnitud del traumatismo no siempre se relaciona a la magnitud del daño. Por ejemplo, traumatismos mínimos pueden causar lesiones graves en riñones con condiciones patológicas preexistentes (hidronefrosis, tumores). - la magnitud de la hematuria no se relaciona directamente con la gravedad de la lesión. Traumas mayores pueden verse con hematurias leves o microscópicas. - la ausencia de hematuria no excluye la posibilidad de un traumatismo de la vía urinaria. Hasta un 30% de los casos con lesiones vasculares mayores del riñón no se asocian a hematuria. Etapificación Figura 4: Una de las alternativas de manejo de la urgencia por un especialista. Un concepto muy importante en trauma es la etapificación del traumatismo o staging y consiste en evaluar clinica y radiológicamente la magnitud del daño y las lesiones asociadas para decidir el tratamiento más adecuado. En este sentido resulta práctico clasificar a estos pacientes en dos grupos de acuerdo al tipo de traumatismo: 1. Traumatismo penetrante, habitualmente causado por armas de fuego u objetos cortopunzantes. En este último caso el traumatismo es con frecuencia directo y es posible predecir el compromiso del aparato genitourinario de acuerdo a la localización del trauma externo. Por el contrario, los proyectiles de armas de fuego pueden tener trayectos curvos o circulares por efecto de "rebote" y comprometer órganos alejados del sitio de entrada. Figura 5: Equimosis cutánea secundaria a fractura de pene Los pacientes con traumatismo penetrante, generalmente, requieren estudio radiológico urgente y/o tienen indicación quirúrgica para completar la etapificación o efectuar un tratamiento. 2. Traumatismo cerrado: corresponden generalmente a golpes directos o traumatismos por desaceleración. Son comunes en accidentes del tránsito o caídas de altura. Con frecuencia se acompañan de hematomas o equimosis en áreas topográficas relacionadas al tracto urinario. Rara vez son quirúrgicos y generalmente es posible etapificarlos en forma radiológica. Evaluación radiológica En la Tabla 1 se resumen los estudios radiológicos más apropiados en diferentes niveles de la vía urinaria. http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document TAC abdominal y/o pelviana: Figura 6: Ecotomografía muestra lesión de albugínea del cuerpo cavernoso con salida de sangre. Es el examen más utilizado, especialmente en el paciente politraumatizado o con traumatismos penetrantes. Particularmente útil en evaluar lesiones asociadas. Es muy efectivo en diferentes niveles de la vía urinaria y puede detectar extravasaciones menores del medio de contraste. Se puede efectuar en el paciente inestable y sin preparación Tabla 1 Evaluación Radiológica en Traumatismo Genitourinario Figura 7: Reparación de fractura del pene. Figura 8 En la imagen de la ecografía se observa ruptura de la albugínea con hematocele. Via urinaria Genitales externos baja - trauma - Trauma penetrante penetrante o cerrado lumbar o o cerrado - hematoma o aumento de pelvis, flanco de volumen escrotal abdomen bajo o periné Indicaciones - trauma por - sangre en para el desaceleración el meato estudio uretral o uretrorragia - dificultad -hematuria en macro o instalación microscópia de sonda vesical Via urinaria alta - TAC Evaluación diagnóstica -pielografía -UPR - arteriografía - cintigrafía uretrografía - cistpgrafía - ecografía escrotal Pielografía eliminación:Examen clásico en la evaluación de la vía urinaria http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document Figura 9: Estallido testicular no reparable. Aspecto del testículo extripado. alta. Generalmente, se utiliza en pacientes estables que pueden ser preparados para un examen de rutina. Aquellos que requieren una evaluación de emergencia o se encuentran inestables es recomendable una TAC abdominal. Una alternativa cuando no se cuenta con TAC es una pielografía de infusión, que consiste en la inyección de un bolo de medio de contraste y la obtención de radiografías seriadas durante la administración de fluidos en el período inicial de resucitación. También puede realizarse mientras el paciente se encuentra en el pabellón quirúrgico. Ureteropielografía retrógada (UPR):Este examen consiste en la inyección de medio de contraste en el uréter en forma retrógrada a través del meato ureteral. Requiere un paciente estable y se utiliza como complemento en el estudio de las lesiones de la vía urinaria alta. Figura 10: Zonas de irradación del dolor por cólico uretral según localización de la litiasis Figura 11: Pielografía de eliminación demuestra extravasación del medio de contraste secundario a cólico renal. Arteriografía:Indicada cuando se quiere evaluar el daño vascular renal. También permite la embolización selectiva de los vasos comprometidos en fístulas arteriovenosas traumáticas o en hemorragias persistentes. Uretrografía:La presencia de sangre en el meato urinario externo o uretrorragia son sugerentes de trauma uretral. En estos casos no se debe intentar pasar una sonda vesical. Es recomendable efectuar primero un estudio radiológico de la uretra. La uretrografía consiste en infundir medio de contraste hidrosoluble directamente o mediante una sonda Foley en el meato externo bajo visión de radioscopia. Este examen permite evaluar en forma rápida la gravedad de la lesión uretral y la presencia de extravasaciones de la vía urinaria baja. En algunos casos, también puede guiar el paso de una sonda vesical a través de la uretra. Cistografía:Se efectúa en casos de sospecha de ruptura vesical. Después de instalar una sonda en la vejiga, ésta se rellena con medio de contraste y se toman radiografías durante la distensión y después del vaciamiento vesical. Se busca la presencia de extravasación. También puede realizarse durante y como complemento de un TAC pelviano. Ecografía:Es un método rápido, no invasivo y de fácil acceso. Su valor está en la evaluación inicial de lesiones renales o traumatismos testiculares. Cintigrafía renal:Examen de uso ocasional en el estudio de fístulas o extravasaciones urinarias. Traumatismo de la Vía Urinaria Figura 12: Radiografía simple muestra ubicación de la litiasis Traumatismo renal Es el traumatismo más común de la vía urinaria. Etiología: http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document - traumatismo cerrado: se presenta en un 80 a 85% de los casos. Es causado por accidentes automovilísticos, caídas o golpes. Se incluyen en este grupo los traumatismos por desaceleración brusca, producidos en choques o caídas a alta velocidad, los cuales se asocian a dos tipos únicos de lesiones: a) daño del pedículo o grandes vasos renales por tracción de la íntima y b) avulsión de la unión ureteropiélica que se produce por un efecto de hiperextensión de la columna lumbar. Es más común en niños. Figura 13: Pielo-TAC muestra medio el constraste fuera del uréter - Traumatismo abierto: es causado por armas de fuego o cortopunzantes. Generalmente está asociado a compromiso de otras vísceras abdominales. Clasificación: Figura 14: Aspecto del epidídimo y del testículo al abrir escroto. De acuerdo al compromiso renal y de la vía urinaria se clasifican en: a) menores: son los más frecuentes e incluyen contusiones renales, hematomas subcapsulares y laceraciones corticales superficiales; b) mayores: incluyen laceraciones corticomedulares profundas con o sin compromiso de la vía urinaria. Habitualmente se asocian a grandes hematomas perirrenales y retroperitoneales. También se incluyen en este grupo las lesiones del pedículo vascular y la unión ureteropiélica. Tratamiento: Determinado por la condición general del paciente, las lesiones asociadas y la etapificación de la lesión (Figura 1). Antes de cualquier decisión debe establecerse la presencia de dos unidades renales (monorreno congénito 1:1500). En la mayor parte de los centros de trauma que atienden pacientes con traumatismos múltiples el estudio radiológico de elección para etapificar es la TAC. La arteriografía se reserva para los casos en que la TAC sugiere compromiso vascular o para el estudio de lesiones preexistentes en el riñón. - Traumatismo Cerrado: Figura 15: Muestra el infarto de testículo y epidídimo • generalmente no requiere operación. La hemorragia se detiene en forma espontánea con hidratación y reposo. Considerar tratamiento quirúrgico en: hemorragia persistente, extravasación urinaria, evidencia de un área significativa de parénquima renal no viable y traumatismos del pedículo renal. También en complicaciones tardías como: urinomas o hematomas infectados perirrenales, deformidades pieloureterales, hipertensión secundaria. - Traumatismo Abierto: Figura 16: Pexia del testículo contralateral • A diferencia del anterior tiene indicación quirúrgica, especialmente por la presencia de lesiones viscerales asociadas. La operación se considera parte de la etapificación en este tipo de traumatismos. Traumatismo Ureteral Poco frecuente ya que el uréter se encuentra bien "protegido" por su localización y movilidad. El diagnóstico requiere un alto índice de sospecha, orientado por el tipo de traumatismo y los estudios radiológicos. El pronóstico de este tipo de lesiones es muy bueno si el diagnóstico y la reparación se efectúan precozmente. Con frecuencia, sin embargo, se reconocen en forma tardía. Etiología: http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document - traumatismo externo: a) cerrado: traumatismo por desaceleración brusca que compromete la unión pieloureteral; b) abierto: más común que el anterior, producido por heridas de armas de fuego o cortopunzantes - traumatismo quirúrgico: es la causa más común de trauma ureteral, como complicación en cirugía ginecológica, oncológica, vascular retroperitoneal o pelviana y manipulación endoscópica del uréter. Evaluación diagnóstica:Pielografía, TAC, ureteropielografía retrógrada y ocasionalmente cintigrafía renal. Tratamiento: Quirúrgico. La técnica depende de las lesiones asociadas, la gravedad del daño ureteral, el nivel comprometido y la precocidad del diagnóstico (Figura 2). En las lesiones diagnosticadas precozmente es posible una reparación inmediata. Por el contrario, en las lesiones reconocidas tardíamente lo más común es tratar el cuadro séptico local (drenaje) y proceder a un tratamiento definitivo en un segundo tiempo. De acuerdo al nivel de la lesión las alternativas de reparación pueden ser diferentes: a) uréter inferior es posible en la mayoría de los casos proceder a un reimplante ureteral directo o movilizando y fijando la vejiga al psoas (vejiga psoica). b) uréter medio se puede reparar efectuando anastomosis uréteroureteral directa con resección del segmento dañado o mediante transposición al uréter sano. c) uréter alto las soluciones incluyen la pielo-ureteroanastómosis o la anastomosis urétero-ureteral. En la mayoría de las reparaciones se incluirá también la instalación de un catéter ureteral tipo doble J o una nefrostomía percutánea para derivación proximal. En algunos casos seleccionados puede ser recomendable proceder a la nefrectomía en forma inmediata o a soluciones más complejas, como el reemplazo ureteral por segmentos intestinales o el autotrasplante renal. Traumatismo vesical Generalmente causado por traumatismo cerrado y con frecuencia asociado a lesiones pelvianas. También puede ser iatrogénico en cirugía ginecobstétrica, pelviana o endoscópica urológica. Contusión vesical: traumatismo sin pérdida de continuidad parietal: hematomas vesicales y perivesicales. http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document Roturas vesicales: frecuente en fracturas de huesos pelvianos. Hasta un 15% de las fracturas de pelvis se asocian a traumatismo vesical o uretral. Se clasifican en: a) rotura extraperitoneal (75%): causada por fracturas pelvianas en accidentes automovilísticos o pedestres. Fragmentos óseos en el sitio de fractura pueden perforar la vejiga en la cara anterior baja (extraperitoneal) y b) rotura intraperitoneal (25%): puede verse en ausencia de fractura pelviana. Mecanismo común: golpe directo en abdomen bajo con vejiga distendida. Evaluación diagnóstica:Cistografía o TAC en los casos indicados. Considerar también el estudio de las lesiones asociadas.Tratamiento:- manejo del shock y la hemorragia frecuentemente asociada a la fractura de pelvis. - reparación quirúrgica precoz de la rotura vesical. - en caso de contusión vesical o rotura extraperitoneal mínima se puede considerar el uso de sonda vesical por tiempo prolongado. Traumatismo uretral Poco frecuente, generalmente por traumatismo cerrado y en hombres. Excepcionalmente en mujeres. Etiología: - traumatismo de uretra posterior, en 95% de los casos asociada a fractura pelviana. Proximal al diafragma urogenital. Hematoma inicialmente puede no ser evidente. Próstata desplazada al examen rectal. - traumatismo de uretra anterior, causada por traumatismo del periné (caída a horcajadas) o instrumentación uretral (cistoscopía, cateterismo vesical). Distal al diafragma urogenital. Hematoma perineal y de genitales externos. Próstata no desplazada al examen rectal. Evaluación diagnóstica:Uretrografía: indicada ante la presencia de uretrorragia, sangre en el meato uretral, o dificultad en instalar sonda vesical en paciente con trauma perineal o pelviano. Tratamiento:- manejo inicial del shock y la hemorragia. - no insistir en instalar sonda vesical. - derivación urinaria por cistostomía suprapúbica. - el especialista decidirá si es conveniente la reparación uretral inmediata o diferida.Complicaciones: Complicaciones propias de esta lesión o su tratamiento son: estrechez uretral secundaria, impotencia e incontinencia. Reparación en agudo de sección completa de uretra membranosa. Traumatismo de Genitales Externos Masculinos http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document Fractura peneana Mecanismo: rotura de la túnica albugínea de los cuerpos cavernosos por traumatismo directo con pene en erección. Se produce durante la relación sexual o con más frecuencia durante maniobras masturbatorias. Al examen el pene se encuentra en flaccidez (por escape de cuerpos cavernosos), su eje puede encontrarse desviado, con un hematoma local y ocasionalmente se puede palpar el sitio de fractura. Evaluación diagnóstica: El diagnóstico es clínico. En algunos casos se recomienda efectuar uretrografía ya que hasta en un 20% hay traumatismo uretral asociado. La ecotomografía puede ayudar a localizar la zona donde se ha producido la fractura del cuerpo cavernoso. Ello facilita la cirugía reparadora. Tratamiento: Quirúrgico y precoz: sutura de la túnica albugínea de los cuerpos cavernosos. Traumatismo testicular Generalmente por traumatismo cerrado del escroto. Con frecuencia se producen grandes equimosis y hematomas escrotales haciendo el examen testicular difícil. El objetivo en la urgencia es determinar si existe rotura de la albugínea testicular. Evaluación diagnóstica: El estudio más útil es la ecografía escrotal. Tratamiento: - traumatismo sin rotura de la albugínea: reposo, suspensión testicular y analgésicos-antiinflamatorios. - si existe rotura testicular el tratamiento es quirúrgico. Cuadros de Urgencia Específicos Cólico renal Síntoma de la obstrucción aguda de la vía urinaria alta y la manifestación más común de la litiasis urinaria. Es un dolor intenso, localizado en la fosa lumbar y flanco que puede irradiarse al cuadrante inferior del abdomen y genitales externos ipsilaterales. Con frecuencia se presentan náuseas y vómitos y, ocasionalmente, hematuria macroscópica. La localización e intensidad del dolor dependen de la localización y rapidez de la obstrucción. Aunque el cólico renal se asocia a la presencia de cálculos en la vía urinaria también puede verse en otras causas (hematuria, tumores, compresión extrínseca ureteral, infartos renales). Por otro lado, la litiasis urinaria puede presentarse sin cólicos. Alrededor del 90% de todos los cálculos urinarios se expulsan en forma espontánea, dependiendo del tamaño y localización inicial. Cálculos < 5 milímetros tienen un 50% de posibilidades de expulsión. En contraste, cálculos > http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document 6 milímetros tienen sólo menos del 5% de paso espontáneo. Estas medidas no son absolutas y también dependen de la localización inicial y las características de la vía urinaria. Como regla general mientras más proximal se encuentre el cálculo al momento del diagnóstico menor será la posibilidad de expulsión espontánea. Cualquiera sea el caso, en general el tamaño del cálculo no se relaciona directamente con la intensidad del cuadro. Cálculos pequeños pueden ser muy sintomáticos y grandes cálculos renales puede dar muy pocas molestias. Es muy característico del cólico renal: - la presencia de agitación psicomotora con un paciente que se mueve constantemente en un intento por aliviar el dolor. - el dolor provocado en la fosa renal correspondiente a la puñopercusión. - a diferencia de otros dolores cólicos abdominales, el cólico renal es relativamente constante. Evaluación diagnóstica: En más de un 90% de los casos lo más característico de los exámenes de laboratorio es la microhematuria en el sedimento urinario; los exámenes de función renal son generalmente normales. La pielografía es el estudio de elección y permite localizar la obstrucción y determinar el tamaño del cálculo. Estos dos elementos permiten decidir el tratamiento más adecuado. La pielografía se recomienda como examen diferido durante las primeras 48 hrs, ya que en el período más doloroso no es posible realizar una preparación adecuada y además, ocasionalmente, puede presentarse exclusión renal. Como cualquier estudio donde se utiliza medio de contraste endovenoso se recomienda no indicarlo en pacientes con función renal deteriorada, mieloma múltiple o historia conocida de alergia a medios yodados. La radiografía simple efectuada como examen aislado es de poco rendimiento y en general se utiliza sólo como control. Actualmente, se recomienda en algunos centros la pielografía-TAC helicoidal, que no requiere preparación. Tiene un costo más elevado y es útil en la evaluación de cálculos radiotrasparentes, ya que todos los cálculos son visibles en este examen. Es, sin embargo, un método poco efectivo en la evaluación de cálculos ureterales pequeños y no permite diferenciar cálculos radioopacos de los que no lo son. La ecografía tiene un rendimiento bajo en la detección de cálculos. Se utiliza más en cuadros dudosos como examen para diagnóstico diferencial (especialmente patología biliar). Tratamiento de la crisis dolorosa: El tratamiento inicial incluye analgesia e hidratación. Medidas físicas de analgesia: los baños en tina caliente o el calor local son útiles pero engorrosos y de beneficio transitorio. Analgésicos no narcóticos: efectivos como tratamiento de la crisis dolorosa en uso parenteral y en menor cuantía por vía oral. Son la primera línea de analgesia. No existen grandes diferencias entre ellos. Los más usados son: ketoprofeno, diclofenaco, ketorolaco y metamizol o combinaciones. Se recomiendan en general por períodos de tiempo limitado por sus efectos nefrotóxicos y gastrointestinales. Antiespasmódicos: efectivos por vía parenteral y oral (Buscapina‚ Baralgina, Valpín). No deben administrarse en pacientes con glaucoma y utilizarse con precaución en los casos de hipertrofia prostática benigna ya que pueden precipitar una retención urinaria aguda. Su uso está limitado por sus efectos gastrointestinales, http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document especialmente distensión abdominal por íleo paralítico. Por su efecto sobre la musculatura lisa ureteral teóricamente podrían retardar la expulsión espontánea de un cálculo. Se recomiendan en forma aislada y alternada con analgésicos no narcóticos. Analgésicos narcóticos: en general reservados para el paciente hospitalizado. Se utilizan morfina o meperidina en pequeños bolos endovenosos. Uso limitado por depresión respiratoria. Muy ocasionalmente si no hay respuesta al uso de narcóticos y el diagnóstico ya se ha establecido, es posible plantear analgesia peridural como medida preoperatoria. En la mayoría de los casos el manejo del cólico renal es ambulatorio. El especialista decidirá el tratamiento definitivo y la prevención en cada caso en particular. Entre las indicaciones de hospitalización se consideran: - dolor o cuadro general refractario a manejo habitual. infección urinaria asociada. hematuria macroscópica con coágulos. paciente con cólico renal y anuria (monorreno congénito). insuficiencia renal. Disuria Dolorosa Corresponde a la micción dolorosa y es referida como sensación urente en la uretra (Tabla 2). Es una causa muy común de consulta de urgencia y está relacionada a la inflamación aguda de la vejiga, uretra o próstata. Aunque generalmente es asociada a infección también puede aparecer en cuadros no infecciosos como litiasis o traumatismos de la vía urinaria baja. Las causas infecciosas se distribuyen en forma diferente en hombres y mujeres. En los hombres jóvenes (excluyendo los niños) la causa más frecuente es la uretritis. A su vez en los viejos y las mujeres la infección del tracto urinario representa el cuadro más común. Tabla 2 Evaluación de Causas Comunes de Disuria Ev. diagnóstica - ex secreción hombre - disuria intensa desde uretral. - cultivo inicio de gonococo, micción. clamidia - descarga uretral. antecedentes contacto sexual. Historia Uretritis Prostatitis hombre - dolor pelviano o perineal. http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Tratamiento penicilina ceftriaxona ciprofloxacino doxiciclina antibióticos para -urocultivo. gram negativos - masaje prostático no Untitled Document - disuria, fiebre. - ex rectal próstata inflamada y dolorosa. recomendable en cuadro agudo. - disuria acentuada al final de la micción, urgencia y - sedimiento poliquiuria. Infección mujer y orina. - orina urinaria hombre sanguinolenta - urocultivo y mal olor - puede haber fiebre, dolor lumbar o hipogástrico antibióticos para gram negativos Sindrome mujer uretral - disuria y urgencia. - puede haber descarga uretral. - sedimiento sintomático orina. - ex secreción doxiciclina uretral. Vaginitis - disuria, leucorrea dispareunia. -ex cultivo de antimicóticos secreción metronidazol vaginal. mujer Evaluación diagnóstica: En la evaluación del paciente con disuria la historia puede orientar el diagnóstico. Se debe interrogar por la presencia de descarga uretral o vaginal, fiebre, dolor lumbar, orinas de mal olor y otros síntomas "irritativos" vesicales. Examen de secreción uretral o genital: Una tinción de gram de una muestra de secreción permite una rápida aproximación diagnóstica en los casos de uretritis o vaginitis. En el caso de descarga uretral, la presencia de > 5 leucocitos por campo establece el diagnóstico. Si se identifican además diplococos gram- negativos intracelulares probablemente se trata de gonorrea. También permite distinguir vaginitis micóticas, parasitarias o inespecíficas. Sedimento de orina: Muy útil en la urgencia para orientar el diagnóstico de infección del tracto urinario por la presencia de piocitos, placas piocitarias y bacterias. Asociado a masaje prostático ha sido de valor en el estudio de las prostatitis.Cultivos:Orientan el tratamiento antibiótico y permiten identificar el germen causal. http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document Anuria obstructiva y retención urinaria La disminución o ausencia de emisión de orina tiene varias causas. Se tratarán aquí sólo las causas obstructivas o postrenales. a) Obstrucción de la vía urinaria alta: La obstrucción de la vía urinaria alta ocasionalmente es causa de anuria. En estos casos se requiere que exista una obstrucción bilateral. La etiología más frecuente es la infiltración tumoral del trígono por cáncer pelviano avanzado (próstata, vejiga, cuello uterino). Una excepción es el paciente que se presenta con cólico renal unilateral y anuria en el cual se debe considerar la posibilidad de un monorreno congénito (incidencia reportada 1:1.500). Tratamiento: En los casos que lo requieran incluye la derivación urinaria interna (catéter ureteral) o externa (nefrostomía percutánea, ureterostomía). La decisión de derivación en el paciente con cáncer es generalmente difícil y depende de lo avanzado de la enfermedad y la posibilidad de tratamiento adicional. b) Obstrucción de la vía urinaria baja: Es el cuadro más común de anuria obstructiva. Entre las causas más frecuentes en el paciente adulto se encuentran: hipertrofia benigna o cáncer de próstata, vejiga neurogénica, cálculos o tumores vesicales, estrechez uretral, hematuria macroscópica con coágulos y la disfunción vesical por drogas. En la mayoría es posible obtener historia o antecedentes previos que permitan orientar el diagnóstico etiológico. Cuando la obstrucción ocurre en forma brusca se denomina retención urinaria aguda. El diagnóstico se confirma al palpar o percutir la vejiga distendida (globo vesical). En los casos difíciles como en el paciente obeso se puede demostrar la distensión vesical con ecografía. Tratamiento: El manejo inicial está orientado al vaciamiento vesical. Se debe tratar de pasar una sonda vesical en forma estéril y atraumática. Las recomendaciones son: - explicar al paciente lo que se va a realizar de manera que pueda cooperar en el procedimiento. - usar abundante lubricación local con vaselina o glicerina estériles sola o en combinación con lidocaína. También pueden ser útiles los geles preparados para uso uretral con anestésico local (Endogel, Instillagel). - en el caso de hematuria con coágulos es recomendable proceder inicialmente extracción de la sangre coagulada y el lavado vesical con una sonda nelaton gruesa y posteriormente pasar una sonda de triple lumen para irrigación vesical continua. - vaciamiento lento del globo vesical si se sospecha retención urinaria crónica (evitar la hematuria por vacío). En la mayoría de los casos será recomendable mantener la sonda vesical hasta que el paciente pueda ser evaluado por el especialista. Si no se puede pasar una sonda vesical ¡no insistir! y considerar la http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document microtalla por punción. Para este efecto existen equipos preparados que contienen todo lo necesario para la punción y la instalación de un catéter suprapúbico permanente. Si se palpa claramente un globo vesical el procedimiento puede efectuarse con anestesia local y en la camilla de urgencia o la cama del enfermo. En los casos difíciles se recomienda efectuarlo bajo ecografía o en pabellón. Hematuria macroscópica no traumática La hematuria es una manifestación mayor que debe ser estudiada. Ocasionalmente la orina puede presentarse rojiza debido a la ingesta de sustancias capaces de colorear la orina como algunos laxantes (fenoftaleína) o colorantes comunes en los jugos artificiales (rodamina B). Estos casos se descartan por la ausencia de glóbulos rojos en el sedimento urinario. Menos frecuente es la presencia de hemoglobinuria como manifestación de una hemólisis. a) Hematuria macroscópica asociada a otros síntomas: El caso más típico es el dolor cólico. Esto representa casi siempre la presencia de una litiasis urinaria, aunque un coágulo ureteral proveniente de un tumor renal puede provocar un dolor similar. Cuando la hematuria se asocia a síntomas irritativos vesicales y/o fiebre, generalmente corresponde a una infección urinaria, en especial en mujeres jóvenes donde las manifestaciones pueden ser muy intensas. b) Hematuria sin otros síntomas o hematuria silente: Debe ser considereda como manifestación de un tumor de la vía urinaria hasta demostrar lo contrario. Evaluación diagnóstica: Corresponde al especialista determinar es estudio más adecuado. La intensidad del color y la relación de la hematuria a la micción puede ocasionalmente orientar la localización de la hemorragia. Las hematurias totales de color café rojizo y opaco orientan a un origen renal. Las hematurias con sangre fresca iniciales orientan a la uretra y las de fin de micción a la vejiga. Tratamiento: - el manejo general incluye el reposo en cama y una hidratación abundante. Esto último permite mantener la sangre diluida y evitar la formación de mas coágulos en la vía urinaria. - en los pacientes que estén tomando antiagregantes plaquetarios se deben suspender. - un caso especial lo constituye el paciente en tratamiento anticoagulante formal. Se debe considerar suspender temporalmente la anticoagulación. - ocasionalmente se utilizan medicamentos que facilitan la coagulación (Espercil ‚), sin embargo su utilidad real no ha sido demostrada. - cuando la hematuria se asocia a una infección urinaria deben indicarse los antibióticos adecuados. http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document En la mayoría de los casos es posible manejar una hematuria macroscópica sin instalar una sonda vesical y en forma ambulatoria. El cateterismo vesical solo está indicado en los casos en que se presenta retención urinaria por coágulos donde después de efectuar un lavado vesical y extracción de coágulos se instala una sonda de triple lumen para irrigación vesical continua. Estos pacientes necesitan ser hospitalizados. Balanitis, Fimosis y Parafimosis a) Balanitis: Infección superficial del área del glande y prepucio. Se presenta con frecuencia como complicación de: - traumatismo local - fimosis (que dificulta un aseo adecuado) - en pacientes diabéticos (favorecida por la glucosuria) Tratamiento: incluye aseo frecuente y cremas antibacterianas o antimicóticas locales b) Fimosis: Es la constricción anular y generalmente fibrosa del prepucio. La manifestación más común es la dificultad en exponer completamente el glande y frecuentemente la presencia de balanitis que también empeoran la estrechez . Es una complicación frecuente en el paciente diabético como consecuencia de balanitis a repetición. La fimosis puede ser indicación de circuncisión electiva pero no es una urgencia. c) Parafimosis: Se produce por atascamiento prepucial por detrás del surco balánico en un paciente con fimosis previa. El pene distal al anillo esta edematoso y doloroso y en el caso extremo puede gangrenarse. Con frecuencia se presenta también retención urinaria. Tratamiento: Debe intentarse primero la reducción manual: - expresión del glande por 10 a 15 minutos para reducir su tamaño - mover el prepucio distalmente al mismo tiempo que se empuja el glande proximalmente hasta lograr la reducción completa del anillo estenótico. Si la reducción manual no es exitosa el siguiente paso es la incisión dorsal del prepucio. Esta puede efectuarse con anestesia local y consiste en seccionar el anillo fimótico lo que permite su reducción y solucionar la urgencia. En los casos que lo requiera se puede efectuar posteriormente una circuncisión formal que no es aconsejable en el caso agudo por el edema y la infección asociados. Epididimitis aguda Correponde a la inflamación aguda del epidídimo y se caracteriza por dolor intenso referido al área afectada que puede irradiarse a la región inguinal o flanco ipsilateral. Generalmente se presenta con fiebre y síntomas asociados de infección urinaria o uretritis. Al examen es característico el edema y eritema escrotal y un significativo aumento de volumen del epidídimo y el cordón espermático del lado afectado. El tacto rectal puede mostrar elementos http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document sugerentes de prostatitis aguda. No es recomendable efectuar masaje prostático por el riesgo de bacteremia o empeorar el cuadro epididimario. La epididimitis de acuerdo a su origen puede clasificarse en: a) asociadas a enfermedades de trasmisión sexual como gonorrea o uretritis no gonocócica b) asociadas a infección urinaria, con frecuencia en pacientes con sonda vesical c) asociadas a diseminación hematógena de cuadros infecciosos generales: brucelosis, sepsis d) otras: traumáticas, reflujo uretro-deferencial, posoperatorias, etc. Evaluación diagnóstica: El diagnóstico es generalmente clínico y puede confirmarse con ecografía escrotal. El sedimento de orina y los cultivos pueden mostrar elementos de uretritis o infección urinaria. Tratamiento: - reposo en cama - analgésicos, antiinflamatorios - suspensión testicular - antibióticos específicos de acuerdo al origen demostrado o sospechado - abstenerse de actividad sexual hasta la resolución de los elementos inflamatorios. - en los pacientes con sonda vesical a permanencia debe considerarse la vasectomía como prevención de nuevos episodios. Complicaciones: Generalmente se resuelve lentamente y sin complicaciones. En ocasiones puede abscedarse y comprometer el testículo. En estos casos requiere drenaje quirúrgico y potencialmente orquiectomía. Hay que tener en cuenta que este cuadro puede ser particularmente grave y séptico en pacientes ancianos o diabéticos que deben manejarse hospitalizados. Torsión testicular Constituye una de las pocas urgencias reales en Urología. El factor predisponente más común es el descenso tardío o criptorquídea del testículo. Con frecuencia se presentan también anomalías congénitas en el cordón espermático o en la fijación del testículo a la túnica vaginal. La interrupción del flujo sanguíneo es la causa del dolor de tipo isquémico. Si la irrigación no se restablece en un lapso de pocas horas se produce infarto testicular. El paciente característico es un niño ó adolescente que presenta un dolor localizado a uno de los testículos de inicio brusco, intenso, que aparece generalmente mientras está durmiendo. Pueden existir o no antecedentes de dolores testiculares previos. Evaluación diagnóstica: En la tabla 3 se describen otros cuadros a considerar en el diagnóstico diferencial. http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document Cuando el diagnóstico o el examen físico no es claro, la evaluación puede incluir: - examen con anestesia del cordón espermático el cual se infiltra a nivel del anillo inguinal externo. Un elemento clave es la posición del testículo y el epidídimo (en algunos casos se puede identificar anteriormente). - ecografía doppler color muestra ausencia de flujo arterial. Por el contrario la hipervascularidad sugiere lesiones inflamatorias testiculares o epididimarias. - cintigrafía testicular con 99mTc-pertecnetato, permite un diagnóstico certero en más del 90% de los casos. Muy útil en niños donde puede ser difícil el examen o conseguir una historia adecuada. - en la mayoría de los casos dudosos la mejor evaluación diagnóstica es la exploración quirúrgica,especialmente si se considera que el período de tiempo en que el testículo puede rescatarse es limitado (4 a 6 hrs). Tratamiento: Cirugía de urgencia: - destorsión y pexia (fijación) testicular si el testículo es viable - orquiectomía en caso de infarto testicular - en ambos casos se recomienda la pexia del testículo contralateral Priapismo: Erección prolongada (varias horas o días), dolorosa y no relacionada a estimulación sexual. El cuerpo cavernoso se encuentra ingurgitado y sin retorno venoso. Al examen es característico la tumefacción de los cuerpos cavernosos con flaccidez del glande y cuerpo esponjoso. En la mayoría de los casos es primario o ideopático. Priapismo secundario se puede presentar en pacientes con enfermedades como: leucemia, infección pelviana y hemoglobinopatías (sickle cell). También se ha descrito en relación a medicamentos antipsicóticos (clorpromazina) o como complicación de tratamientos intracavernosos de la disfunción eréctil (papaverina, prostaglandina). El priapismo no tratado o refractario al tratamiento produce impotencia por daño isquémico irreversible del tejido eréctil. Tratamiento: Debe ser precoz para evitar el daño del cuerpo cavernoso: - es recomendable hospitalizar a estos pacientes o facilitar un estricto control ambulatorio, ya que la recurrencia precoz es común - sedación y analgesia - inyección de simpaticomiméticos diluidos (epinefrina, efedrina) intracavernosos. Solo útil si se usa muy precoz y no recomendable en pacientes con antecedentes cardiovasculares. - si no hay respuesta a las medidas descritas el tratamiento es http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document quirúrgico. La operación consiste en procedimientos de shunt (por punción o abiertos) que permiten derivar la sangre acumulada en los cuerpos cavernosos al cuerpo esponjoso o vena safena. Historia Orquitis viral inicio gradual, síntomas de infección viral o parotiditis, niños o adolescentes Examen físico (*) Laboratorio dolor y sedimento orina aumento de normal, volumen ecografía testicular uni o doppler: > flujo bilateral. arterial testicular , epidídimo serología viral normal Tratamiento reposo, suspensión testicular, analgésicos, ocasionalmente esteroides Hernia inguinal historia de ruidos incarcerada hernia inguinal , hidroaéreos en inicio gradual, escroto, dolor cólico distensión abdominal, abdominal, cualquier edad testículo de consistencia normal sedimento de Quirúrgico orina normal, en casos dudosos ecografia inguinal, Rx simple c/s signos de ileo Epididimitis aguda inicio gradual, historia de uretritis o infección urinaria, adultos o viejos epidídimo y cordón doloroso y engrosado, testículo inicialmente normal, alivio del dolor al suspender el escroto (s. de Prent). sedimento orina: leucocitos y bacterias, urocultivo o cultivo secreción uretral positivos, ecografía: aumento de volúmen epididimario, cintigrafía: captación epidídimo Torsión testicular inicio brusco, algunas veces historia de cuadros previos de dolor testicular, niños y hombres jóvenes testículo doppler y doloroso, cintigrama unilateral, anormales elevado y horizontal. muy útil examen con anest de cordón Torsión de hidátide inicio brusco nódulo firme y niños y jóvenes doloroso en polo superior del testículo ecografía puede mostrar área engrosada en polo superior reposo y suspensión escrotal, analgésicos. Antibióticos Destorsión y pexia quirúrgica reposo, suspensión escrotal y analgésicos, resección quirúrgica en algunos casos (*) Se consignan los exámenes mas usados aunque el diagnóstico es generalmente clínico http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document http://escuela.med.puc.cl/publ/manualUrologia/UrgenciasUrologicas.html[9/7/2009 3:16:11 PM] Untitled Document Generalidades El presente capítulo se refiere a enfermedades que comprometen el aparato urinario femenino, si no en exclusividad, con una gran frecuencia y particularidades propias. Ellas están generadas por las características anatómicas y funcionales de la vía urinaria de la mujer. Figura 1: Catéter para urodinamia En general, el sexo femenino tiene menos patología tumoral maligna urológica. La mayor parte de la llamada urología femenina se refiere a enfermedades que no amenazan la vida, sino más bien localidad de vida. Como veremos en el curso del desarrollo de algunos temas, la mujer está gravemente limitada en su actividad social, física y sexual, por la pérdida de orina involuntaria en los cuadros de incontinencia urinaria. Esto daña a la mujer en lo personal. Además, hay que tener en cuenta la magnitud del problema. Solamente la incontinencia urinaria afecta a un 20 a 30% de la población femenina adulta y los datos de otros países revelan que el 50% de los pacientes ancianos internados padece de ella. Figura 2: Tipos de alteraciones de vejiga y esfínter uretral Como se dijo en párrafos anteriores, gran parte de los problemas de la mujer, con relación a la urología, se deben a características anatómicas y funcionales del aparato urinario bajo y especialmente en lo que dice relación a la micción. Revisaremos en este capítulo nociones generales de anatomía de la vejiga y uretra, su relación con los órganos vecinos. Veremos también las alteraciones del funcionamiento de la vejiga. Consideraciones Anatomo-fisiológicas Figura 3: Registro de flujo normal La vejiga es un órgano hueco, ubicado en forma extraperitoneal, en la excavación pelviana, formado por varias capas de tejido muscular liso orientado en diferentes direcciones, dos capas longitudinales, interna y externa, y una media en forma circular. La orientación de estas capas musculares va cambiando en la medida que se acercan a la parte interna o proximal de la uretra, conducto de salida de la orina, convergiendo para formar el cuello vesical, al que les corresponde la función de esfínter interno. La vejiga femenina tiene íntimas relaciones con el aparato femenino y por ello la mujer tiene patología urológica propia: parte del soporte del órgano en situación normal depende de la integridad del útero y de sus anexos. Esto en lo anatómico, en el aspecto funcional, las hormonas femeninas son fundamentales en el trofismo de las vías urinarias bajas y por esto existe un incremento de la patología urológica femenina con el correr de los años. Figura 4: Curva de cistomanometría normal, presión vesical es estable hasta volumen alto. El complejo esfinteriano está compuesto de un llamado esfínter interno, originado en la mencionada convergencia de fibras musculares lisas, involuntario, y un esfínter externo compuesto por fibras musculares estriadas lentas y voluntarias, ubicado entre las capas del diafragma urogenital. Este esfínter externo mantiene un tono constante, responsable de la continencia en http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document reposo, el que es potenciado en el curso de los esfuerzos por la contracción de los músculos estriados del piso pelviano. Por ello la alteración de la relación vejiga-piso pelviano es de especial importancia en la comprensión y tratamiento de la Incontinencia Urinaria de Esfuerzos. Figura 5: Método de cistocervicopexia vía abdominal. Finalmente es importante considerar la unión urétero-vesical, que por la disposición anatómica actúa como esfínter funcional, impidiendo el reflujo de orina hacia el riñón. Este tema frecuente en las mujeres, en la niñez será tratado en otro capítulo. Desde el punto de vista funcional el acto de la micción es particularmente especial; la vejiga, órgano de musculatura lisa e involuntaria, está bajo el control cerebral voluntario. La alteración de esta condición origina una patología frecuente, cual es la Vejiga Inestable con incontinencia urinaria por urgencia o en grados menores, polaquiuria. Esta situación aparece en algunos niños por falta de maduración del sistema nervioso y en algunos ancianos por deterioro de él. Esto nos lleva a considerar y a tratar de construir un modelo comprensible de la relación sistema nervioso-vejiga. La vejiga puede diferenciarse esquemáticamente en un músculo liso, el detrusor, y un complejo esfinteriano. En la primera predominan los receptores colinérgicos excitatorios y en el segundo los alfa adrenérgicos. Además del sistema autonómico, las vías urinarias bajas reciben inervación somática aferente y eferente. El parasimpático se origina en los segmentos sacros (S2S4) y el plexo pélvico, emergen las fibras postganglionares colinérgicas a la vejiga y esfínteres. Los nervios simpáticos nacen de D10 a S2, dirigiéndose las postganglionares nor- adrenérgicas, del plexo pélvico o hipogástrico, fundamentalmente al complejo esfinteriano. La inervación somática va al esfínter externo vía nervio pudendo y se origina en segmento S2 y S3. Las vías aferentes de la vejiga y de la uretra son somáticas y viscerales y llevan la información a los centros nerviosos responsables del control de la micción. Figura 6: Cistocervicopexia vía original Estos centros tienen una diferente jerarquía en el manejo del reflejo miccional; así el centro medular sacro que recibe la información desde los receptores de la pared muscular y mucosa de la vejiga podría y de hecho sucede, si está aislado del SNC por alguna lesión, desencadenar el reflejo primitivamente; sin embargo, la información asciende hacia el centro miccional de la protuberancia, el que fundamentalmente coordina la micción: contracción del detrusor y relajación simultánea del complejo esfinteriano. Se entiende de esta forma que una lesión medular que corte la comunicación de ambos centros (sección medular completa) produzca una micción descoordinada, con contracción del detrusor y esfínter parcial o totalmente cerrado. Esto genera micción entrecortada, reflujo, residuo postmiccional importante, infecciones urinarias, reflujo vesicoureteral, daño renal y eventualmente la muerte del individuo. Si el reflejo de la micción terminara aquí, el resultado sería el de una micción sin control voluntario, frecuente, urgente y las más de las veces súbita. El ascenso a niveles corticales de la información desde la protuberancia permite modular el reflejo, haciendo que voluntariamente el individuo lo inicie o lo posponga. Ejemplo de una lesión de este mecanismo es el deterioro psicoorgánico. Habiendo descrito los componentes involucrados en la micción, estamos en condiciones de describir la secuencia de eventos involucrados durante el período de almacenamiento de la orina en la vejiga y momento de la micción propiamente tal. Durante el almacenamiento, la orina es propulsada a la vejiga a razón de http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document alrededor de 1 cc por minuto, llenando lenta y progresivamente la vejiga. Alrededor de los 200 cc, los receptores de distensión en la vejiga informan al centro medular sacro del primer deseo miccional, el que envía esta información a la protuberancia, donde se coordina el reflejo, aumentándose el tono del esfínter interno y suprimiendo la actividad parasimpática. Esta parte del reflejo es función del sistema autónomo; sin embargo, las áreas corticales facilitan o inhiben el reflejo voluntariamente. Habiéndose alcanzado un nivel de orina en la vejiga, que varía según la edad y los hábitos adquiridos durante la vida, entre 350 y 600 cc, se produce igual fenómeno que el descrito a los 200 cc. En esta oportunidad la respuesta cortical voluntaria es la de iniciar la micción, produciéndose una descarga de noradrenalina en el esfínter interno, con una relajación voluntaria del esfínter externo y como resultante global, la emisión de un volumen de orina durante un tiempo determinado y con una eficiencia que permite vaciar en su casi totalidad la vejiga. Urodinamia Muchos de estos fenómenos son mensurables, simulando condiciones fisiólogicas, en la llamada urodinamia. La cistomanometría mide las fases de llenado y contracción del detrusor; el flujo mide el volumen orinado en el tiempo; la electromiografía y el perfil uretral miden características del esfínter en actividad y reposo y finalmente es posible darle valor numérico al residuo postmiccional. De esta forma es posible objetivar el reflejo de la micción y así comparar lo anormal, con lo descrito anteriormente. A continuación haremos una breve descripción de algunos exámenes urodinámicos de uso frecuente, para dar a conocer lo que se puede obtener de ellos y cuándo deban solicitarse. La medición urodinámica más sencilla no es urodinámica, sino parte del examen físico o de la anamnesis. Por obvia y sencilla tiende a omitirse. Me refiero a la llamada cartilla miccional o registro de las micciones y de sus volúmenes en 24 o 48 horas. Nadie que estudia una enfermedad infecciosa omite pedirles a los pacientes un registro de sus temperaturas o a los cuántos metros claudica un portador de patología arterial de extremidades inferiores. La medicina actual tiende a objetivar los síntomas y signos. Todos nuestros alumnos son capaces de ponerle números al dolor; sin embargo, rara vez son capaces de diferenciar una poliuria de una polaquiuria. Este simple registro permite diferenciar los síntomas antes mencionados, aclarar si existen factores de los llamados tensionales o por stress (sólo polaquiuria diurna), conocer si la ingesta de líquidos es sub, supra o normal, en fin, si la reducción de capacidad vesical es estable (anatómica) o variable (funcional). Debe ser hecha cada vez que la anamnesis sea insuficiente en proporcionar datos seguros sobre los volúmenes y la frecuencia miccionales. Cistomanometría En este examen averiguamos sobre la fase de llenado de la vejiga fundamentalmente. El examen termina con el deseo inminente de orinar, con o sin la contracción del detrusor evidenciable. Nos da a conocer la capacidad de la vejiga, la aparición del primer deseo miccional (alrededor de los 200 cc.) y nos informa la elasticidad vesical, característica propia de la vejiga que determina que con ascensos del volumen no se modifique la presión dentro de ella. Se realiza infundiendo líquido a la vejiga a través de una vía de una sonda Foley y midiendo las presiones por la otra vía. La infusión es a vólumenes de 50 a 100 cc/ por minuto y por lo tanto es un examen no estrictamente fisiológico. http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document Estudios gráficos del esfínter Son probablemente los más deficitarios en información, en circunstancias que del esfínter derivan los más serios y frecuentes problemas. Son deficitarios porque el perfil muestra al esfínter en reposo o como estructura anatómica y porque la electromiografía (funcional) es engorrosa de realizar, ya que debe registrarse la actividad del esfínter externo de difícil punción y no la del piso perineal, con electrodos de superficie, como habitualmente se hace. La ubicación anatómica del esfínter con el perfil uretral es útil cuando se sospecha daño de él (incontinencia post-RTU de próstata o postcirugía radical de ella) o cuando se quiere comparar presiones del esfínter versus vejiga con los esfuerzos, en el curso del estudio de una Incontinencia de Esfuerzos. Estudios de flujo urinario Corresponden a estudios dinámicos de la resultante de todo el reflejo de micción y en especial del período de vaciamiento. Existen diferentes modalidades que dan mayor información en la medida que son más invasivos. Lo menos invasivo es la determinación del flujo (volumen en cc / tiempo en segundos) sin determinar presiones durante la micción y sin conocer el volumen inicial. Por el contrario, conocer el volumen inicial infundido permite conocer la efectividad del vaciamiento vesical y el residuo. Midiendo presiones durante la micción, sabemos si un flujo anormal se debe a una obstrucción (alta presión) o a un daño muscular vesical (baja presión). Este examen objetiva el síntoma "disminución de potencia del chorro" y por ello es útil en todos los trastornos obstructivos y neurogénicos. Es probablemente, además, el más fisiológico de las mediciones urodinámicas, si se consigue en condiciones fisiológicas. La urología femenina ha terminado por constituirse en una subespecialidad dentro de la urología. Ello por la gran frecuencia y complejidad de los problemas que afectan a la mujer. Las mayores expectativas de vida han hecho necesario realizar estudios más profundos en el comportamiento de la vejiga femenina. En ello, la urodinamia ha hecho aportes esenciales para una mayor comprensión de la fisiopatología de estas afecciones. Ha quedado atrás la época en que todas estas enfermedades que alteran la calidad de vida eran consideradas problemas de tipo neurótico y derivadas a psiquiatras. Por una falta de conocimiento y de investigación miles de mujeres vieron limitada su calidad de vida a extremos insoportables. El escape urinario, la urgencia, el dolor hipogástrico, etc., hoy día son a lo menos aliviados por la acción del urólogo. Esperamos que el esfuerzo de la Asociación de Mujeres para el Estudio de la Cistitis Intersticial de USA dé frutos en sus esfuerzos al recolectar fondos y destinarlos a la investigación de esta enfermedad. Cada día se conoce más de ella, pero aún no es posible conocer su etiología y, por lo tanto, los tratamientos seguirán siendo insuficientes. Medición del residuo postmicción Parece obvia su utilidad por presentar la efectividad final del reflejo miccional. Se mide desde hace muchos años, con técnicas que han ido variando con el desarrollo de la tecnología. En décadas anteriores se usó el sondeo vesical, el que ha sido paulatinamente reemplazado por los métodos por imagen (ecografía). Su valor debe ser inferior a 50 cc. http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document Para terminar, debemos decir que estos exámenes son, como cualquier otro, complementarios. Por ello, deben ser solicitados en casos de dudas de una anamnesis hecha por un profesional, eso sí calificado, y deben ser interpretados a la luz del resto de los antecedentes clínicos. Enfermedades Urológicas Frecuentes de las Mujeres Incontinencia urinaria Se entiende que bajo este título caen en un variado grupo de enfermedades, que tienen en común la pérdida o escape de orina en forma involuntaria. En algunas la incontinencia es lo fundamental y en otras un síntoma accesorio. Frecuente y erróneamente, se asocia la pérdida de orina involuntaria a la Incontinencia Urinaria de Esfuerzos, probablemente por su alta frecuencia (80%) como causante. Este error impide la corrección de causales sencillas, como veremos en el desarrollo de este tema y colabora a un cierto porcentaje de fallas en los tratamientos quirúrgicos de la Incontinencia Urinaria de Esfuerzos (IOE). A continuación daremos un listado de cuadros que originan Incontinencia Urinaria femenina y analizaremos cada uno de ellos, siguiendo un orden de menor a mayor frecuencia de presentación: 1. Confusión sintomática femenina: como se verá de la descripción de este cuadro, realmente no corresponde a una incontinencia urinaria. Se da en estratos socio-económico culturales bajos y debido en gran medida al desconocimiento, de mujeres de este sector, de la disposición anatómica de los genitales externos y de las vías de eliminación de la orina. Se confunden líquidos perdidos que producen humedad en la región de los genitales externos. El examen físico cuidadoso puede demostrar una abundante leucorrea mal interpretada como pérdida de orina y viceversa. Su tratamiento depende, entonces, de la causa que produce la humedad. 2. Malformaciones génito-urinarias: tradicionalmente se ha incluido en este grupo a la desembocadura anómala del uréter, que como llega a la vejiga distal al esfínter, se evidencia con un goteo permanente de orina en niñas, desde una muy temprana edad. Existen, también, malformaciones más complejas y de menor frecuencia, como el seno urogenital común, entidad en la que la vagina y la uretra son comunes. El diagnóstico debe ser sospechado por la pérdida permanente de orina, en el primer caso, confirmándose con la endoscopia uretro-vesical. El conducto común vagino-uretral es raro y puede presentarse con continencia urinaria. Se lo diagnostica con un examen ginecológico cuidadoso y se asocia a otras malformaciones genitales. El tratamiento de ambos cuadros es quirúrgico con reimplante ureteral en el uréter de desembocadura anómala y con complejas reconstrucciones genitourinarias en el seno urogenital común. 3. Cuadros con reducción de la capacidad vesical: la pérdida de orina en estas situaciones depende de un escasa capacidad vesical. El síntoma fundamental es la polaquiuria, pero con alguna http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document frecuencia, hay escape urinario. Hay reducciones anatómicas, como la cistitis retráctil post-TBC o la cistopatía secundaria a radioterapia y otros en los que el componente funcional suele ser importante como la cistitis intersticial sin reducción anatómica. La anamnesis y el uso de la cartilla miccional son muy importantes en evidenciar esta reducción de capacidad vesical, los que asociados a los antecedentes de TBC o radioterapia permiten indicar una cistoscopía. Este examen asociado o no a una biopsia vesical corroboran la sospecha clínica. Si bien la TBC urogenital es menos frecuente que en décadas anteriores, la radioterapia es más frecuente y cuando daña la vejiga muestra a la endoscopia un aspecto típico de áreas vesicales pálidas y otras muy vascularizadas y hemorrágicas. Esto debido a la vasculitis que se produce. La cistitis intersticial es una enfermedad vesical de origen desconocido, que afecta preferentemente a mujeres (90%), y cuyos síntomas y signos se asemejan a los de una infección urinaria, pero que a diferencia de ella tiene orina estéril y dolor suprapúbico importante. Su examen endoscópico bajo anestesia, ya que no toleran la distensión vesical sin ella, da imágenes características: petequias, sangramiento y llegando a la ruptura de la mucosa, las que junto al estudio histológico permiten realizar el diagnóstico. El tratamiento de estas patologías es variable según su origen: plastia vesical quirúrgica para las cistitis retráctiles TBC y tratamiento sintomático, en caso de daño por radioterapia o cistitis intersticial. 4. Incontinencias por Iatrogenia: se deben a un acto médico que lesiona el aparato esfinteriano u origina una comunicación entre la vía urinaria y territorio ginecológico. Los primeros son infrecuentes en la mujer e importantes en el hombre. Las fístulas vésico-vaginales o vesico- uterinas son comunicaciones epitelizadas entre la vagina o útero y la vejiga. Como tales, no cierran espontáneamente, sino que requieren de tratamiento quirúrgico. El cierre espontáneo se puede alcanzar si la comunicación no está epitelizada, o sea, corresponde a una filtración urinaria. Si la lesión es distal al esfínter (fístulas uretro vaginales), no hay pérdida de orina. El escape de orina en las fístulas es permanente y claramente asociado al antecedente de un acto quirúrgico. El diagnóstico lo confirma la endoscopia, aun cuando ciertas pruebas, como la del azul de metileno, son altamente sugerentes. En éstas se coloca en la vagina una gasa que se tiñe. El cierre quirúrgico de fístulas vesicovaginales puede ser hecho por vía vaginal o abdominal, cuando el trayecto fistuloso está constituido. Aunque por obvio no se mencione, lo fundamental en estos casos es el tratamiento preventivo o el reconocimiento de la lesión quirúrgica, en el curso de la operación para permitir su corrección inmediata. Establecida la lesión, la paciente debe esperar, mojándose permanentemente, que el trayecto fistuloso se constituya, para su reparación definitiva y exitosa. 5. Lesiones neurológicas: la participación del sistema nervioso central y periférico, en la micción, fue explicada anteriormente. Su indemnidad es indispensable para la continencia urinaria. Típicamente, estas pacientes tienen además de la incontinencia un déficit neurológico reconocible, pudiendo éste ser motor, sensitivo u originado en daño del encéfalo. A este último grupo pertenecen las incontinencias del paciente con enfermedad de Parkinson y de los ancianos con deterioro psicoorgánico. En ello, no hay inhibición http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document central a la micción, dando como resultado incontinencia urinaria, con una frecuencia, como se mencionó antes, de hasta el 50% de los que están internados. El diagnóstico se hace considerando el déficit neurológico y con la ayuda de la urodinamia, que hace evidente la falla en la micción: la cistomanometría muestra contracción de la vejiga, de alta intensidad, precedida por un escaso tiempo de una sensación inminente de micción El flujo es normal pero de escaso volumen. Su tratamiento es variable, dependiendo de la causa neurológica subyacente. En los casos de daño encefálico, suelen ser útiles los anticolinérgicos; sin embargo, medidas simples como el conocimiento y la accesibilidad a un baño mejoran en gran medida este problema grave de los ancianos. Con relación a este grupo etario de pacientes, debe recordarse que en ellos, tal como se reduce la capacidad cardiovascular, respiratoria y otras, se reduce también la capacidad vesical, de tal modo que un aumento de la frecuencia miccional es normal. Los otros cuadros, originados por lesiones neurológicas, tienen tratamientos variados que escapan al objetivo del presente capítulo. 6. Incontinencias por rebalse: son llamadas también falsas incontinencias, debido a que en ellas la falla es una obstrucción o daño muscular vesical, que da como resultado una sobredistensión vesical y pérdida de orina por rebalse vesical. En menor grado, pero con un mecanismo similar, es posible encontrar incontinencias por malos hábitos miccionales. En estas pacientes existe una mala costumbre, por razones de diferente índole, que conduce a través del contener la micción, a una vejiga habituada a mantener grandes volúmenes en su interior. La anamnesis y la cartilla miccional lo corroboran. Simplemente hay que corregir el mal hábito. Las patologías que más frecuentemente producen obstrucción en la mujer son las estenosis uretrales, cuyo origen está en los traumatismos del parto o gineco-urológicos y en déficit de estimulación estrogénico, en la postmenopausia. Los estrógenos son responsables del trofismo de los genitales y de la uretra. La uretritis senil es el más claro ejemplo de estenosis uretral por falta de hormonas femeninas. Las estenosis uretrales se diagnostican con la exploración de la uretra, habiendo sido sospechadas por un mal flujo urinario. La presencia de un globo vesical es de gran ayuda y aclara el origen, por rebalse, de la incontinencia. El tratamiento de la obstrucción urinaria baja femenina se basa en la dilatación de la uretra y el uso de estrógenos locales, en caso de deficiencia de ellos. La falla miogénica del detrusor vesical es un cuadro de origen incierto y que puede corresponder a una falla neurológica no evidenciable o a un daño muscular propiamente tal. De cualquier forma, el resultado es una vejiga que se contrae y vacía mal, en ausencia de obstrucción. Por ello, también, existe un mal flujo, pero no hay disminución del lumen uretral. El diagnóstico debe considerar estos últimos factores. Su tratamiento, al igual que el de la Vejiga Hiporrefléxica Neurogénica, es el autocateterismo limpio. Esta técnica, descrita por Lapides en la década del 70, se basa en el principio de que las infecciones urinarias se evitan con un vaciamiento periódico y completo de la vejiga. Su realización sólo requiere de elementos limpios, no estériles y de una adecuada capacidad visual y mínima manual. En la mujer debe ser hecho con la ayuda de un espejo. En ciertos casos este cuadro se produce temporalmente y es precisamente en esta situación cuando el http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document autocateterismo tiene su máxima utilidad, al permitirnos darnos cuenta de la recuperación de la micción. Con el uso de la sonda permanente no es posible. La indicación de cerrar o clampear una sonda para estimular la recuperación de la micción es peligrosa, ya que la eventual contracción del detrusor, sin poder eliminar la orina, sólo conduce al reflujo urinario al riñón, con orina generalmente infectada, por el uso de una sonda permanente. 7. Vejiga inestable: esta entidad clínica, segunda en frecuencia como causante de pérdida de orina involuntaria, es en realidad un síndrome, que como tal responde a un cierto número de causas. La define y caracteriza su mecanismo de producción: una contracción brusca del detrusor, en el curso del llene vesical o, menos frecuentemente, una relajación en las mismas circunstancias, del esfínter, en ausencia de afección neurológica alguna. Estas contracciones súbitas se llaman contracciones no inhibidas y se caracterizan por superar los 15 centímetros de agua en el gráfico de una cistomanometría. Visto el fenómeno de esta forma, aparece como una entidad clara y definida; sin embargo, desde el punto de vista clínico, no lo es tanto y con bastante frecuencia se confunde con la Incontinencia Urinaria de Esfuerzo. La manifestación de la contracción brusca del detrusor es el escape urinario, precedida por escaso margen de tiempo, por la sensación inminente de orinar. Para complicar más el diagnóstico, estas contracciones no inhibidas pueden ser gatilladas por un esfuerzo o maniobra de Valsalva como la risa. La pérdida de orina es habitualmente de magnitud importante, ya que lo que sucede realmente es que se desencadenó una micción, la que sólo puede ser contrarrestada por la acción voluntaria del esfínter. Las causas de este síndrome han sido separadas en sensitivas, si se originan en alteraciones anatómicas de la vejiga, o motoras, si no existe causal evidente. Estas últimas probablemente corresponden a una alteración neurológica funcional desconocida. Esto último es comprensible, si se recuerda que la tensión nerviosa o stress es capaz de ocasionar polaquiuria en un individuo normal. Las causas sensitivas son variadas y van desde alteraciones vesicales comunes, como infección urinaria, lesiones graves de la vejiga como el cáncer vesical y enfermedades de la esfera ginecológica, como las inflamaciones infecciosas o químicas de los genitales externos. Para dar una justa medida hay que aclarar que la frecuencia con que un cáncer vesical se manifiesta como vejiga inestable es claramente inferior en relación a una infección urinaria, donde la polaquiuria y la urgencia miccional son habituales. Lo distintivo, en clínica, es entonces la urgencia miccional, la polaquiuria, cuando existe un cierto control, o la pérdida de orina cuando no existe éste. Es básico descartar las causas sensitivas eliminando como causales la infección, la litiasis, las vulvovaginitis y el cáncer vesical con la clínica y eventualmente con exámenes de laboratorio, imágenes y endoscopia. La confirmación diagnóstica se hace con pruebas urodinámicas, como la cistomanometría, que muestra las clásicas contracciones no inhibidas. La comprobación de la relajación anormal del esfínter es más complicada y depende de estudios electromiográficos, que como se dijo al comienzo de este capítulo deben ser realizados con mucha precisión, analizando el comportamiento del complejo esfinteriano y no del piso pelviano muscular. Finalmente, debemos precisar, que como cualquier http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document examen complementario, la urodinamia no invalida, en caso de resultados discordantes con la clínica, a ésta. Esto significa que un diagnóstico clínico de vejiga inestable no se invalida por una cistomanometría con estabilidad vesical. Baste con recordar que los exámenes urodinámicos se realizan en condiciones que sólo remedan lo fisiológico. En síntesis, la vejiga inestable es un síndrome que clínicamente se manifiesta por urgencia miccional, polaquiuria, pérdida involuntaria de orina, muchas veces con el antecedente de enuresis en la edad temprana y con una urodinamia característica. Su tratamiento, habiéndose excluido clínicamente o con exámenes complementarios las causas sensitivas, es el uso de anticolinérgicos en forma permanente o transitoria, según la respuesta que se obtenga. El porqué algunas vejigas inestables persisten estables, después de suspendidos los anticolinérgicos, no está claro, pero probablemente tiene que ver con la desaparición de la tensión emocional, al lograr una buena continencia y con ello una mejor reinserción social. Como veremos al tratar el siguiente cuadro, la Incontinencia de Esfuerzo, las diferencias son claras en la descripción teórica. En la práctica hay bastante sobreposición de síntomas y signos o coexistencia de inestabilidad vesical e Incontinencia de Esfuerzo. 8. Incontinencia Urinaria de Esfuerzo: es la causante de la mayor parte de las incontinencias urinarias femeninas. Es una patología casi exclusivamente femenina y sólo se produce en el hombre como complicación ocasional de ciertas cirugías, como la prostatectomía radical. Se debe a la pérdida del soporte de la musculatura y del aparato ligamentoso pelviano, que ocasiona una hipermovilidad vesico-uretral. El mecanismo de la micción, en sus diferentes aspectos funcionales y anatómicos de la vejiga y del aparato esfinteriano, está indemne. Es por ello que la reconstrucción con cirugía o el fortalecimiento del piso pelviano con kinesiterapia restablece la continencia. Su frecuencia en la mujer adulta es alta, estimándose por algunos en 30%. Es más, la definición de la IOE dice de ésta "que es la pérdida de orina en forma involuntaria y en ausencia de contracción del detrusor, socialmente embarazosa". Este último párrafo tiene la connotación de excluir aquellos accidentes de pérdida de orina, extremadamente frecuentes en mujeres, pero que por lo ocasional no las comprometen en su relación social. En condiciones normales, las maniobras de Valsalva no generan una pérdida de orina, debido a que el aumento de presión intravesical, por transmisión de la presión intraabdominal a la vejiga, se opone una elevación de la presión intraesfinteriana, que supera a la intravesical. La contracción del diafragma y la elevación de presión intravesical es precedida en el tiempo por una contracción de la musculatura del piso pelviano, la que potencia el efecto del esfínter que se encuentra dentro de esta musculatura. Si se altera la posición de la vejiga y de su aparato esfinteriano, con relación a la musculatura del piso pelviano (zona del esfínter fuera de la musculatura pelviana), no hay potenciación del efecto esfinteriano de continencia y por lo tanto la presión dentro de la vejiga es superior a la del esfínter y consecuentemente hay pérdida de orina. Hay que hacer notar que esto ocurre con un esfínter anatómica y fisiológicamente normal. Sólo en las llamadas IOE tipo III, las http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document menos frecuentes, hay daño del esfínter. Las relaciones de posición de la vejiga con la pelvis ósea se han usado para el diagnóstico de una IOE; sin embargo, existen IOE, sin alteración radiológica del ángulo entre uretra y vejiga y alteraciones de éste, sin IOE. Como el esfínter es normal, sólo está mal ubicado, el perfil uretral es normal o con descensos menores de sus presiones y la longitud de la zona esfinteriana se mantiene. Al comparar las presiones que se generan en el esfínter y en la vejiga con los esfuerzos de la tos (presión de cierre máxima), se demuestra que este valor es bajo o a veces nulo. En condiciones normales y en decúbito dorsal, la diferencial de presiones es favorable al esfínter, en más de 50 cm de H2O. Los estudios urodinámicos que emplean el perfil uretral en el diagnóstico de la IOE están en desuso por algunos grupos, argumentando la dificultad de reproducirlos y porque informarían de algunos artefactos. Sin embargo, entre nosotros con más de 4.000 estudios hechos, no hemos detectado un número de falsos negativos y falsos positivos que invaliden de la comparación de las presiones del esfínter y de la vejiga con los esfuerzos. No tenemos casos con diferencial de presiones normal con IOE ni IOE con diferencial normal. Otra medición urodinámica usada en el diagnóstico de la IOE es el llamado Punto de Presión Abdominal de Escape ( Abdominal Leak Point Pressure en literatura anglosajona) y se define como la presión abdominal a vejiga llena, a la que se produce el escape de orina. En la IOE genuina está por sobre los 85 cm H2O, a diferencia de las incontinencias tipo III o por daño esfinteriano, donde se ubica por debajo de los 30 cm H2O. Llamará la atención que entreguemos tanta información sobre los aspectos urodinámicos de este cuadro; sin embargo, lo hace necesario la dificultad que a veces ofrece el diagnóstico clínico. Este se fundamenta en el escape de orina (volúmenes pequeños) con relación a esfuerzos. Si el cuadro es puro y claro, sólo con el riesgo de perder una IOE tipo III, se podría emplear sólo la clínica. En un número importante la IOE se asocia la inestabilidad vesical (20 a #0%), debido a vulvo-vaginitis química (dermatitis amoniacal de los genitales) o por la tensión emocional que significa la pérdida de orina. Con frecuencia existe polaquiuria, por las razones anteriores y porque la mujer portadora de IOE orina con mayor frecuencia para evitar la vergüenza de humedecerse. Por otra parte, la mayoría de las pacientes, en nuestra experiencia, son capaces de distinguir entre la pérdida de orina por esfuerzos de la por urgencia sólo después que le hemos explicado en detalle sus diferencias. La anamnesis espontánea no discrimina entre ambos síntomas. Por ello y porque existe una tendencia actualmente en la medicina a graficar u objetivar de alguna manera los síntomas, se usa la urodinamia, para confirmar el diagnóstico de IOE. Sin embargo, son útiles, también, la prueba de Marshall Marchetti, que consiste en hacer toser a la paciente observando el escape urinario y su corrección al elevar la unión uretro-vesical y la prueba de Boney, que demuestra la hipermovilidad de la uretra. El tratamiento de esta patología considera la kinesiterapia para fortalecer el piso pelviano con éxito en IOE leves y medianas. En nuestra experiencia, los ejercicios deben mantenerse en el tiempo, de lo contrario la pérdida de orina reaparecerá. La cirugía tiene resultados positivos con diferentes técnicas que tienden a colocar el http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document aparato vesico-uretral en posición correcta. Como podrá observarse, la inestabilidad vesical y la IOE pueden ser confundidas, teniendo tratamientos diferentes. Por ello damos a continuación un cuadro resumen que pretende aclarar el diagnóstico diferencial. Diagnóstico Diferencial Antecedentes Polaquiuria Urgencia Escape Ex. Físico Prueba Marshall M. Prueba de Boney Cistomanometría IOE Vejiga inestable multiparidad enuresis no siempre casi siempre secundarios primario "chorritos" volumen importante alteración normal o poco ginecológica alterado (+) (-) (+) (-) Sin contracc. No Contracciones no inhib. inhibidas. Cirugía de la Incontinencia Urinaria El objetivo es devolver la uretra a la cavadidad abdominal. Recuperar el ángulo uretrovesical. En casos especiales ocluir la uretra (sling) Técnicas Vía Abdominal Fijación del cuello vesical al pubis (Marshall-Marchetti-Krantz). Fijación al ligamento de Cooper (Burch) Técnicas Vía Vaginal Suspensión del cuello vesical traccionando desde fascia endopélvica (PereyraStamey-Raz) Creando anilo rígido que levanta uretra (TVT). http://escuela.med.puc.cl/publ/manualUrologia/UrologiaFemenina.html[9/7/2009 3:16:27 PM] Untitled Document Al final del seminario el alumno deberá ser capaz de: 1. Explicar los beneficios del trasplante renal en comparación con diálisis 2. Señalar las condiciones necesarias y contraindicaciones más importantes para recibir un trasplante renal 3. Señalar los resultados generales en sobrevida de los trasplantes renales 4. Describir la diferencia entre el número de pacientes en diálisis, y el número de trasplantes renales efectivos realizados anualmente en el país. 5. Señalar cuales podrían ser las causas de estas diferencias 6. Explicar aspectos generales del sistema nacional de trasplante de órganos 7. Conocer aspectos generales de la ley chilena de trasplantes de órganos 8. Señalar conducta de médico general en relación a donantes de órganos 9. Explicar aspectos generales de inmunosupresión en trasplante renal Historia El trasplante de órganos está representado en la literatura mítica de numerosas culturas como un símbolo de renovación y cura de enfermedades. Figura 1: Pacientes en HD y Transplante. El registro histórico más antiguo está en una leyenda de la India del siglo XII (a.C.) que relata el poder de Shiva, un dios hindú que trasplantó la cabeza de un elefante en su propio hijo creando a Ganesha, el dios de la sabiduría. Ocho siglos más tarde en China, Pieu Chi’ao relata el intercambio de los corazones de dos pacientes afectados por un desequilibrio de energías. Según la leyenda después del trasplante administró a los receptores una infusión de poderosas yerbas para promover la aceptación de los injertos. En la cultura occidental el primer "trasplante" está consignado en la Leggenda Aurea de Jacobo de Varagine que describe el milagro de los santos Cosme y Damián que reemplazaron la pierna gangrenada de un sacristán por la de un gladiador etiope muerto en la arena. La era moderna de trasplante de órganos, sin embargo, comenzó a principios del siglo XX gracias al descubrimiento de nuevas técnicas de suturas. En particular los aportes de Ullman (1902) y Carrel (1914) permitieron establecer las bases de las anastomosis vasculares. En 1933 se efectuó el primer trasplante renal de humano a humano por el cirujano ucraniano Yu Yu Voronoy. El injerto nunca funcionó y el receptor falleció a los pocos días de la operación. Desde esa época varios intentos fracasaron desalentando el interés por este tipo de operaciones. En 1947 Hume realizó un trasplante renal ex vivo en una paciente con insuficiencia renal postparto, anastomosando los vasos de un riñón de cadáver a los vasos braquiales del receptor. Este injerto funcionó transitoriamente y la paciente sobrevivió, lo que impulsó nuevamente el trabajo en esta área por los cirujanos de la época. El hecho más sobresaliente se produce en 1954 en Boston cuando Murray documentó la sobrevida permanente de un trasplante renal entre hermanos gemelos. Después de esto numerosos centros de trasplante comenzaron a http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document formarse en todo el mundo. Durante este mismo período se introdujo la azatioprina como inmunosupresor, lo que permitió el desarrollo del trasplante donante cadavérico. En 1963 se efectuó el primer trasplante de hígado y en 1967 el de corazón. Muy importante en el período posterior fue la introducción de Ciclosporina en 1980, lo cual mejoró significativamente la sobrevida de los injertos e impulsó decisivamente el trasplante de varios otros órganos. Durante un siglo de desarrollo la tecnología de trasplante de órganos permitió transferir la mitología a una realidad terapéutica efectiva para los pacientes con insuficiencia orgánica terminal. Resultados Actuales en Trasplante Renal El trasplante renal es el tratamiento de elección para la mayoría de los pacientes con insuficiencia renal terminal. La principal indicación es la mejoría significativa en la calidad de vida, especialmente en los pacientes jóvenes. A diferencia de otros órganos vitales los pacientes que no se trasplantan pueden permanecer en alguna forma de diálisis. Evidencia actual ha demostrado que el trasplante renal se relaciona también a un aumento en la sobrevida de estos pacientes. Una buena referencia para conocer los resultados a largo plazo de trasplante renal lo constituye el informe periódico de la red de trasplantes de Estados Unidos (UNOS). En un informe reciente que incluyó a más de 80.000 pacientes trasplantados la sobrevida global del injerto a 1 y 5 años fue de 89 y 60% para receptores de donante cadavérico y 95 y 80%, respectivamente, para receptores de donante vivo. En el caso de la sobrevida de los pacientes, ésta es mayor en los receptores de donante vivo de 98 y 90% a 1 y 5 años, comparada con 94 y 80%, respectivamente, para receptores de donante cadavérico (OPTN/SRTR, Reporte anual 2006). Las cifras locales están representadas en el informe anual del Instituto de Salud Pública de Chile. En el anuario 2006 se registra una sobrevida actuarial del injerto a 1 y 5 años de 85 y 77% para receptores de donante cadavérico y de 92 y 84% para receptores de riñón provenientes de donante vivo. Evaluación del Potencial Receptor Teniendo en cuenta el limitado número de órganos versus el gran número de pacientes en diálisis se recomienda en general considerar activamente como candidatos a trasplantar a los pacientes con expectativas de vida de al menos > 5 años. Estimaciones señalan que alrededor de un 30% de los pacientes en un programa de diálisis crónica cumplen con estos requisitos. Las principales contraindicaciones médicas para trasplantar son las enfermedades crónicas, la infección y el cáncer. La inmunosupresión puede acelerar el crecimiento tumoral y afectar negativamente la historia natural de la enfermedad. Los pacientes con una infección activa no deben ser trasplantados por el riesgo de un cuadro séptico postoperatorio. Los pacientes con HIV positivo continúan siendo en la mayoría de los centros una contraindicación para recibir un trasplante renal. Todos los potenciales candidatos deben ser evaluados completamente antes de ingresar a la lista de espera de trasplantes para determinar el estado general del paciente y tratar potenciales problemas antes de la operación (Tabla 1). http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document La nefrectomía de riñones nativos en general no es un requisito necesario antes del trasplante. Se considera en casos de: infección crónica del parénquima con o sin reflujo vesicoureteral, cálculos infectados, riñones poliquísticos gigantes o complicados, proteinuria masiva e hipertensión renovascular no controlada. Tabla 1 Evaluación de Receptores para Transplante Renal Historia y Ex. Físico: - Dental - Pulmonar - Corazón - Gastrointestinal - Genitourinario - vascular Laboratorio: - Calcio - Hemograma - Perfil bioquímico y nutricional - Pruebas hepáticas - Amilasa - Serología Psicológico Inmunológico Previsión Evaluación completa incluyendo desfocaciones y extracciones. Rx Tórax, espirometría si es necesario. ECG, test de esfuerzo y/o ecocardiograma, angiografía y revascularización Ecografía abdominal, endoscopía, test de sangre oculta en deposiciones, otros estudios si es necesario. Tratar litiasis biliar previo al transplante. Cistoscopia o uretrocistografía. Considerar nefrectomía de riñones nativos si está indicado. Examen vascular completo. Eco doppler extremidades inferiores si está indicado. Hipercalcemía grave considerar paratiroidectomía pretrasplante. Tratar la anemia con eritropoyetina y fierro Tratar deficiencias encontradas. Eco o TAC hepatobiliar, biopsia si está indicado. TAC páncreas si está elevada Citomegalovirus, HIV, hepatitis B y C, Epstein Barr, toxoplasma, chagas. Evaluación por psiquiatria si está indicado. Grupo ABO, estudio HLA, PRA. Costos de transplante, inmunosupresión, etc. Complejo mayor de histocompatibilidad Constituye un grupo de antígenos de la superficie celular que definen la http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document naturaleza propia o alogeneica de las células, tejidos u órganos trasplantados. Estos antígenos son generalmente los responsables de generar la respuesta inmune en trasplante. La concentración de estos antígenos es especialmente alta en los linfocitos y por esta razón se utilizan estas células para identificar las distintas especificidades. Es por esta razón también que se conoce a estos antígenos como el sistema antigénico del linfocito humano (HLA). Este sistema está codificado por una serie de genes localizados en el brazo corto del cromosoma 6. Estos genes son heredados típicamente en forma mendeliana como un bloque o haplotipo desde cada uno de los cromosomas del padre y de la madre y se expresan en codominancia, constituyendo el perfil HLA de cada individuo. Por este motivo el estudio del HLA se utilizó como prueba de paternidad antes del desarrollo de las técnicas de DNA. Por definición, un hijo comparte un haplotipo de cada uno de sus padres. Los hermanos pueden compartir dos haplotipos, un haplotipo o ninguno. Los cromosomas de los padres también pueden entregar otros determinantes menores que aún no han sido completamente identificados. En el caso de individuos no relacionados genéticamente como en el donante cadavérico no es posible identificar haplotipos y se habla de match de determinantes individuales. En trasplante clínico los más estudiados e importantes son los antígenos A, B y DR, pudiendo existir una compatibilidad perfecta de seis match (raro), diferentes grados de compatibilidad o nula compatibilidad en el caso de cero match. En términos generales, a mejor compatibilidad es mejor también la sobrevida esperada del trasplante. La función normal de los antígenos HLA propios es presentar antígenos extraños al linfocito T e iniciar de este modo la respuesta inmune. Crossmatch con linfocitos El crossmatch sirve para detectar anticuerpos anti-HLA preformados contra las células del donante en el suero del potencial receptor. Es equivalente a las pruebas cruzadas para transfusión de sangre. El resultado de un trasplante o una transfusión con crossmatch positivo es similar: lisis celular o rechazo hiperagudo con pérdida fulminante del injerto. El crossmatch es un examen de rutina y absolutamente necesario en trasplante renal. Para esto se puede utilizar el test NHI descrito previamente donde los linfocitos del donante sirven como blanco para el suero del receptor potencial. En la actualidad se han desarrollado también métodos más sensibles que el crossmatch standard. Estas son las técnicas de citometría de flujo y el crossmatch antiglobulina, las cuales permiten detectar niveles muy bajos de anticuerpos circulantes, permitiendo seleccionar aún más las mejores combinaciones de donante y receptor. Aunque son pruebas muy sensibles su alto costo no permite todavía su uso rutinario. Anticuerpos reactivos a panel de linfocitos (PRA) Este es un examen que se realiza periódicamente a los pacientes en lista de espera para trasplante y que monitoriza la presencia de anticuerpos citotóxicos anti-HLA. Utiliza las pruebas serológicas de microlinfocitotoxicidad exponiendo suero del receptor a un panel de linfocitos T y B que expresan HLA representativos de la población. http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document El resultado de este examen se expresa en porcentaje de reactividad siendo el máximo de un 100%. En términos generales mientras mayor es el porcentaje de PRA, más sensibilizado se encuentra el paciente y son menores las probabilidades de tener un crossmatch negativo con un donante potencial. Las causas más comunes de sensibilización son las transfusiones de sangre, el embarazo y parto y un trasplante previo. Selección de Donantes Al éxito del trasplante contribuye decisivamente la identificación y preparación apropiada del donante. Como requisito mínimo necesario para trasplantar en el caso de riñón se requiere compatibilidad de grupo sanguíneo ABO y crossmatch negativo entre receptor y donante. Los donantes pueden ser cadavéricos o donantes vivos. Los donantes vivos son usados en aproximadamente el 25% de todos los trasplantes renales realizados en Estados Unidos y un número importante de centros de trasplantes los considera como la modalidad de elección a pesar de la morbilidad potencialmente asociada. Un hecho que contribuye a esto es el limitado número de donantes cadavéricos que ha permanecido relativamente estable en el tiempo. En el Gráfico 1 se muestra el número de pacientes trasplantados en Chile en los últimos años. Como se puede apreciar, existe una gran diferencia al compararlos con los pacientes en hemodiálisis crónica, incluso si se considera que un 30% de éstos es potencialmente trasplantable. El impacto inevitable de esta diferencia es un aumento sustancial en los tiempos de espera para trasplante de donante cadavérico, el cual puede medirse generalmente en años. Donante Vivo Generalmente incluye familiares relacionados genéticamente que se seleccionan por su compatibilidad HLA. El estudio del donante vivo considera una rigurosa evaluación general, excluyéndose cualquier persona con riesgo de hipertensión o enfermedad renal en el futuro. También se incluyen la serología para enfermedades infecciosas y un estudio radiológico para definir la anatomía vascular renal. El uso de donante vivo ofrece varias ventajas para el receptor: a) Disminuye el riesgo de insuficiencia renal aguda postrasplante como consecuencia de un menor tiempo de isquemia. b) Mejor compatibilidad HLA, lo que permite usar menos inmunosupresión y disminuir los riesgos relacionados a ésta. c) Permite iniciar el tratamiento inmunosupresor antes del trasplante, disminuyendo el riesgo de rechazo. d) Permite disminuir el tiempo en lista de espera del receptor y convierte el procedimiento en una operación electiva. e) Facilita el trasplantar antes del inicio de diálisis (pre-emptive), lo que es deseable en niños y pacientes jóvenes o diabéticos. http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document f) Presenta una excelente sobrevida del injerto al largo plazo, lo que puede superar los 20 años. También muy deseable en niños y pacientes jóvenes. Sin embargo, la nefrectomía expone al donante —una persona previamente sana — a los riesgos de la operación sin ningún beneficio físico propio y a una mortalidad reportada de <0,05%. Por otro lado existe el riesgo potencial de deterioro de la función del riñón remanente en el curso de los años como consecuencia de la hiperfiltración. Aunque se estima que este riesgo es bajo y que la sobrevida de estos pacientes es equivalente a la de la población general es indispensable considerar caso a caso y entregar la información necesaria para que el donante exprese su decisión voluntaria. Donante Cadavérico Aproximadamente al 75% de los trasplantes renales efectuados en el país corresponden a riñones provenientes donantes cadavéricos. Aunque en el número de donantes ha mostrado un aumento durante la última década continúa siendo insuficiente si se considera la gran cantidad de pacientes que ingresan anualmente a programas de diálisis (figura 1). Actualmente en Chile todos los donantes cadavéricos de órganos sólidos son pacientes en muerte cerebral y la mayoría son víctimas de traumatismos o accidentes vasculares cerebrales. Se aceptan como donantes potenciales pacientes entre 2 y 70 años, aunque no existen límites estrictos de edad. Entre las contraindicaciones absolutas para considerar un paciente como potencial donante cadavérico en Chile están: - serología positiva para HIV y hepatitis B. - antecedentes de cáncer con potencial de metástasis, a excepción de tumores cerebrales primarios no operados y carcinoma basocelular de la piel. - sepsis. - enfermedad renal crónica o hipertensión severa El donante cadavérico en la ley chilena sobre trasplantes Las normas actuales sobre trasplante y donación de órganos están descritos en la ley número 19.451 y su reglamento respectivo de 1996. La legislación señala varios aspectos importantes a considerar en el caso de un donante cadavérico. Establece que es obligación del médico de turno de la unidad respectiva notificar al centro de trasplantes más próximo la presencia de cualquier persona en estado potencial de muerte cerebral. El diagnóstico de muerte cerebral debe ser realizado por dos médicos independientes del equipo de trasplantes y al menos uno debe ser un neurólogo o neurocirujano. El diagnóstico es clínico y debe señalar la causa de la muerte (traumatismo, accidente vascular cerebral, etc). Deberá excluirse toda circunstancia que pueda restar validez o interferir el examen clínico y en casos especiales se consideran también algunos exámenes complementarios que deben confirmar el diagnóstico. La ley establece también la calidad de donante legal, en todo caso en que se sospeche que la muerte de la persona fue el resultado de un delito o ha sido provocada por vehículos en la vía pública, o que el fallecimiento dé lugar a un proceso criminal. En estos casos deberá requerirse adicionalmente la autorización http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document del Director del Servicio Médico Legal o del médico en quien éste haya delegado esta atribución. Se establecen en la ley también varias modalidades para donar los órganos en vida en la eventualidad de muerte cerebral: - declaración jurada ante notario efectuada en forma voluntaria por cualquier persona considerada plenamente capaz; - en la obtención o renovación de la cédula de identidad, manifestando el deseo por escrito de ser donante de órganos ante el funcionario del registro civil; - mediante el mismo procedimiento en el caso de la licencia de conductor de vehículos motorizados, y - en cualquier momento al internarse en un establecimiento hospitalario. Aunque cualquiera de estos sistemas es útil, es una práctica permanente de los equipos de trasplante solicitar el consentimiento de donación directamente a los familiares en todos los casos de un donante en muerte cerebral con el interés de mantener la confianza de la opinión pública. La real utilidad de la donación en vida es discutir en el seno familiar el interés de donar y facilitar así la decisión de los familiares en un momento tan difícil. Sistema Nacional de Trasplante de Órganos En Chile funciona actualmente un sistema unificado de procuramiento y distribución de órganos DC. Los pacientes en espera de trasplante de órganos cadavéricos deben estar inscritos por los centros trasplantadores en una lista nacional única que administra el Instituto de Salud Pública de Chile (ISP). En el ISP se mantiene un registro actualizado de los potenciales receptores, de manera que cuando se produce un donante en cualquier parte del país, los órganos respectivos son asignados en forma idónea y de acuerdo a un determinado puntaje. En esta puntuación se considera, entre otras variables, el grado de compatibilidad HLA que comparten donante y receptor, el tiempo de permanencia en la lista de espera y la urgencia médica de cada caso en particular. Cuando se trata de órganos pares el equipo procurador puede disponer de uno de los órganos para los pacientes de su centro manteniendo las normativas señaladas por el ISP. Este tipo de distribución centralizado está destinado a evitar discriminaciones en la asignación de injertos. En forma paralela trabaja también la Corporación de Trasplantes de Chile. Esta es una entidad privada y sin fines de lucro que organiza a los centros trasplantadores del país. Entre sus objetivos está el apoyar a los médicos en el proceso de donación, procuramiento y preservación de órganos. En los centros donde no existen equipos de trasplante la Corporación es la entidad que se debe contactar ante un eventual donante cadavérico. Rol del Médico ante el Eventual Donante Cadavérico http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document El proceso de donación de órganos requiere los esfuerzos de numerosas personas, incluyendo al equipo médico tratante, neurólogos, coordinadores de trasplante, tecnólogos de histocompatibilidad y cirujanos de procuramiento. El personal médico de las unidades de tratamiento intensivo o de los servicios de urgencia se verá enfrentado con frecuencia a un paciente en muerte cerebral y deberá considerarlo como un donante potencial. La ley establece la obligatoriedad de referir estos casos a la unidad de trasplante más cercana. En el sistema nacional esta referencia puede efectuarse a la Corporación de Trasplantes. Las diversas etapas en la obtención de los órganos son realizadas por los coordinadores de trasplante locales o de la Corporación. No obstante es necesario que el médico tratante participe o colabore en algunas de ellas (Tabla 2). Tabla 2 Etapas en el proceso de Donación 1. Identificación de un donante potencial. 2. Referencia a coordinadores locales o de la Corporación de Transplante. 3. Evaluación del donante por coordinadores y declaración de la muerte cerebral. 4. Consentimiento familiar 5. Autorización del médico legista en caso necesario. 6. Mantención del donante. 7. Procuramiento. 8. Disposición del cadáver a los familiares o al Instituto Médico Legal en los casos necesarios. 9. Estudios de histocompatibilidad. El proceso comienza con la identificación de un donante potencial, generalmente un paciente grave en coma profundo o con sospecha de muerte cerebral. En todos estos casos es recomendable la comunicación a los coordinadores de trasplante. Una referencia precoz, incluso antes de la declaración de la muerte cerebral, permite a los coordinadores entregar una mayor asistencia al equipo tratante, poder evaluar la factibilidad de la donación y solicitar los exámenes de laboratorio pertinentes. En muchos casos la mantención del donante potencial será realizada por el equipo local de la unidad de tratamiento intensivo o urgencia según corresponda. Es trabajo de los coordinadores contactar a los equipos quirúrgicos y organizar el proceso de procuramiento Después de la declaración de la muerte cerebral, la participación del médico tratante es muy importante en la aproximación a la familia y plantear la opción de la donación. La mayoría de las veces le corresponde al médico tratante informar a los familiares el fallecimiento. Esta es una situación especialmente dolorosa y se debe actuar con delicadeza y caridad cristiana. A continuación del informe del fallecimiento y eligiendo el momento menos inoportuno se puede plantear la http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document posibilidad de donación. Desacoplar la discusión de la muerte y la donación aumenta la probabilidad de obtener el consentimiento familiar. Es mucho más probable que los familiares accedan a la donación si se les da el tiempo suficiente para aceptar que su ser querido está en muerte cerebral antes de discutir una donación potencial. La mayor parte de las organizaciones de trasplante en el mundo tienen personas especialmente preparadas sólo para entrevistar a los familiares en estas circunstancias y plantear la donación. En algunas ocasiones son los mismos familiares los que expresan espontáneamente el deseo de donación, generalmente cuando ha existido alguna manifestación en vida del fallecido. El consentimiento de donación debe ser efectuado por los familiares directos y por escrito en un formulario ad hoc. De acuerdo a cifras recientes de la Corporación de Trasplantes de Chile alrededor de un 40% de los casos los familiares niegan finalmente la donación. La negativa de donación es una opción garantizada en la legislación y no es apropiado insistir. Procedimiento Quirúrgico de Trasplante Renal En el paciente pediátrico < 10 kg el acceso habitualmente es transperitoneal y los vasos renales se anastomosan a la aorta y vena cava del receptor. En el paciente adulto el riñón se implanta en alguna de las fosas ilíacas y extraperitoneal (Figura 2). Los vasos renales se anastomosan a los vasos ilíacos del receptor. Se efectúa una incisión ilíaca que permite desplazar el peritoneo medialmente y exponer y clampear adecuadamente los vasos ilíacos comunes y/o sus ramas. La arteria renal se anastomosa de preferencia a la arteria hipogástrica terminoterminal o a la arteria ilíaca común terminolateral. En esta última situación se prefiere conservar un parche de aorta en la arteria del riñón donante utilizando la técnica descrita por Carrel. La vena renal se anastomosa a la vena ilíaca común o externa terminolateral. En la mayoría de los casos el uréter del riñón donante se reimplanta en la vejiga utilizando la técnica extravesical de Lich y con menor frecuencia mediante la técnica intravesical de Politano. En ambos casos se utiliza un sistema antirreflujo. Tratamiento Inmunosupresor En los primeros años clínicos de trasplante renal el tratamiento inmunosupresor incluyó dosis subletales de radiación corporal total y químicos no selectivos en un intento por destruir el sistema inmunológico del receptor. Sin embargo, estas modalidades de tratamiento se abandonaron al corto plazo por su alta morbimortalidad. En la década de 1960 comienza la era moderna de terapia farmacológica para trasplante de órganos con la introducción de la azathioprina (AZA). La asociación de esteroides y AZA (AZA-PRED) fue el tratamiento inmunosupresor standard en trasplante renal por casi 20 años hasta la introducción de la Ciclosporina (CyA) en 1980. Con el esquema AZA-PRED, la sobrevida a un año de los riñones trasplantados alcanzó un 75 a 90% para donante vivo relacionado y un 50 a 70% para donante cadavérico. La introducción de la CyA permitió aumentar estas cifras aproximadamente en un 15%, alcanzando para riñón cadavérico una sobrevida http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document igual o superior al 85% al año. Actualmente existen varios inmunosupresores para uso clínico que permiten un manejo más específico, aunque no exento de riesgos. Algunos conceptos del tratamiento inmunosupresor en trasplante renal que conviene tener en cuenta son: - No existe un tratamiento inmunosupresor ideal. La tendencia actual es utilizar agentes progresivamente más selectivos que permitan suprimir la respuesta al injerto y preservar las funciones globales del sistema inmunológico. - El tratamiento es permanente y debe mantenerse al menos por el tiempo en que el injerto continúe funcionando. Incluso cuando el riñón trasplantado ha sufrido un daño irrecuperable en su función no es conveniente suspenderlo en forma brusca ya que se puede desencadenar el fenómeno inflamatorio local y sistémico del rechazo agudo. - Todos los pacientes necesitan tratamiento inmunosupresor. La única excepción es el trasplante entre gemelos idénticos que pueden requerir tratamiento por un período corto de tiempo. - No todos los pacientes necesitan el mismo tratamiento y éste debe individualizarse considerando los riesgos de toxicidad de los distintos agentes y la reactividad inmunológica del receptor. - En la actualidad el tratamiento incluye en general la asociación de dos o más drogas, las que pueden modificarse en el curso del tiempo. Esta estrategia permite dosis más bajas de los diferentes agentes, con lo cual el riesgo de toxicidad también es menor. Por otro lado los mecanismos de acción de las diferentes drogas son también diversos, con lo que se consigue bloquear la respuesta inmune en diferentes niveles potenciando el efecto inmunosupresor. - La aparición de episodios de rechazo no significa necesariamente la pérdida del injerto. La gran mayoría de las veces responde al tratamiento. Matriz clínica de inmunosupresión en trasplante renal Aunque existen actualmente numerosos agentes disponibles para uso clínico los protocolos usados en trasplante son con frecuencia específicos de cada centro y están basados más en experiencias locales que en argumentos científicos reales. Desafortunadamente los centros de trasplante tienden a usar regímenes uniformes a pesar que no todos los pacientes tienen el mismo riesgo de rechazo o toxicidad. Desde un punto de vista descriptivo el tratamiento inmunosupresor puede dividirse en varias etapas 1. Inducción El objetivo de esta etapa es establecer un nivel adecuado de http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document inmunosupresión lo más rápido posible. En este período se utilizan dosis altas, existiendo mayor probabilidad de observar efectos colaterales de los agentes utilizados, que no todos los pacientes están en condiciones de tolerar. En nuestra unidad esta etapa es considerada la más importante en la decisión del régimen inmunosupresor. Por este motivo los pacientes son estratificados de acuerdo a dos riesgos claves en este período inicial: rechazo y nefrotoxicidad (Tabla 3). Tabla 3 Protocolos de Inmunosupresión y Dosis de Agentes Usados en Inducción en Trasplante Renal (Unidad Trasplante Renal U. Católica) Primer esquema biasociado: trasplante Riesgo CsA 8-10mg/kg/día PRA<10% standard Pred 12-15mg/kg/1a semana >0-match HLA (*) receptor adulto T isquemia > Inducción secuencial: 24 hrs ATG 1,25mg/kg/día (***) mala perfusión riesgo de Categ. Pred 12-15mg/kg/1a semana donante de riesgo NTA pediátrico (*) (**) donante límite CsA con Cr<3mg% nefrotox x CsA Esquema triasociado: Retrasplante CsA 8-10mg/kg/día PRA>30% Riesgo de 0-match Pred 12-15mg/kg/1 a semana rechazo (*) receptor Micofenolato 1,5-2gr/día pediátrico o inducción secuencial (*) Esteroides calculados en dosis equivalentes a Prednisona para la 1a semana (**) Se consideran al menos alguna de estas tres categorías: riesgo standard, riesgo de recuperación tardía de la función renal (NTA=necrosis tubular aguda) y riesgo de rechazo. (***) ATG, Timoglobulina. CsA, Ciclosporina-Neoral. 2. Terapia de mantención La mayoría de los regímenes de mantención actuales para trasplante renal están basados en CyA en combinación sólo con corticoides o con un tercer agente, generalmente AZA o Micofenolato. Este período se caracteriza por dosis decreciente de los diferentes agentes en la medida que la etapa de mayor riesgo de rechazo (primeros 3 meses) se aleja. Después del año el tratamiento sufre pocas modificaciones tratando de evitar las complicaciones a largo plazo de los distintos agentes (dosis baja de cortocoides, monitorización estricta de CyA). 3. Tratamiento antirrechazo El rechazo continúa siendo una causa frecuente de pérdida del http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document trasplante. La mayoría de los centros prefiere en estas circunstancias un diagnóstico histológico por biopsia del injerto antes de comenzar un tratamiento específico. Esto es particularmente importante si se consideran los riesgos relacionados al exceso de inmunosupresión. Para rechazos leves a moderados el tratamiento standard incluye bolos de altas dosis de cortocoides. La efectividad de este tratamiento supera el 80% de los episodios de rechazo agudo celular. Para rechazos graves o resistentes a esteroides se emplean con frecuencia anticuerpos antilinfocíticos, generalmente OKT-3, que es efectivo hasta en un 90% adicional. En los pacientes que presentan rechazo agudo refractario a estos tratamientos el injerto generalmente está destinado a perderse http://escuela.med.puc.cl/publ/manualUrologia/TransplanteRenal.html[9/7/2009 3:16:54 PM] Untitled Document Fimosis Es la estrechez prepucial que determina dificultad o incapacidad para retraer manualmente el prepucio por detrás del surco balanoprepucial y descubrir totalmente el glande. Puede ser completa o filiforme, parcial o anular. Esta condición es considerada fisiológica en los menores de 2 años (80% de los recién nacidos); en este período el prepucio se encuentra protegiendo el glande y el meato de las ulceraciones amoniacales. Figura 1: Balanitis Xerótica esclerosante cuyo tratamiento es quirúrgico. Durante los primeros años el acúmulo de smegma (descamación celular con secreción sebácea) en el surco coronal, las erecciones y el crecimiento peneano resuelven la fimosis y las adherencias prepuciales de manera espontánea en un alto porcentaje de los niños. El acúmulo de smegma que se observa por transparencia, como quistes amarillentos, no ocasionan problema a menos que se comuniquen al exterior, si esto ocurre deben desprenderse como parte del aseo diario. Las adherencias prepuciales no deben liberarse forzadamente, ya que se reproducen en un alto porcentaje, especialmente en el niño menor. Estas se resuelven totalmente en forma espontánea al llegar a la pubertad. Al cabo de los tres años la incidencia de fimosis es sólo de un 10% y a los 17 años es del 1%. Figura 2: Parafimosis La mayoría de las fimosis en mayores de tres años es consecuencia de una retracción temprana forzada, no recomendada, que provoca fisuras radiales del prepucio, lo que determina una fimosis cicatricial iatrogénica. Existe, además, otra forma de fimosis adquirida, por una reacción dermatológica del prepucio, de etiología desconocida. La fimosis predispone a infecciones balanoprepuciales o balanopostitis, infecciones urinarias, obstrucción o micción dificultosa (en "globito") y parafimosis. Figura 3: Torsión testicular. La balanitis o balanopostitis es un aumento de volumen doloroso con secreción purulenta balanoprepucial, principalmente en pacientes con fimosis y mala higiene. El aseo local y la antibioterapia local u oral, según el origen y la severidad del cuadro clínico, son la base del tratamiento. La parafimosis es una emergencia urológica en que una fimosis, por una maniobra de reducción indebida, se atasca por detrás del surco balanoprepucial, con estrangulación progresiva del prepucio. Es necesario una reducción manual o quirúrgica de urgencia. Figura 4: Hidrocele. La circuncisión está reservada para aquellos niños mayores de tres años con fimosis o con antecedente de balanitis, parafimosis o infecciones urinarias, o por motivos religiosos o raciales. Deben estudiarse previamente otras causales http://escuela.med.puc.cl/publ/manualUrologia/PatologiaGenitalesExternos.html[9/7/2009 3:17:11 PM] Untitled Document de infección urinaria antes de plantear la circuncisión en estos casos. Además, en los recién nacidos y lactantes menores no circuncidados la incidencia de infección urinaria es 20 veces mayor que en los circuncidados. A pesar de las ventajas, la circuncisión tiene sus indicaciones precisas, ya que el prepucio es una estructura anatómica de protección y una zona erógena necesaria. La circuncisión no está exenta de complicaciones (0.1% a 3,5%). La más temida es la meatitis estenótica, con su consecuente estenosis de meato de difícil tratamiento. Es conocida la baja incidencia de cáncer de pene en pacientes circuncidado, pero en el caso de pacientes no circuncidado el mayor factor de riesgo es el mal aseo. Criptorquidia La criptorquidia es la falta de descenso testicular permanente desde el retroperitoneo al escroto en su trayecto de descenso normal. Si el testículo se localiza fuera de este trayecto se le denomina testículo ectópico. Ambas condiciones se conocen como testículo no descendido. Si el testículo está ascendido pero desciende fácilmente al escroto durante el examen y permanece en él, es llamado testículo retráctil o en ascensor; esta condición es frecuente en niños entre los 6 meses y los 13 años (80%), por un reflejo cremasteriano presente, más acentuado entre los 2 y 7 años, período donde los testículos retráctiles se confunden fácilmente con la criptorquidia. Después de la pubertad este reflejo está ausente en casi todos. La incidencia de criptorquidia en recién nacidos de pretérmino es del 30% y en los detérmino es del 3.4%. Durante el primer año de vida, especialmente los primeros seis meses, los testículos descienden en el 95% de los prematuros y en el 75% de los detérminos, por un elevado nivel de andrógenos plasmáticos. A partir del primer año y hasta la vida adulta, la incidencia de criptorquidia es de un 0.8% a 1%. Los casos bilaterales son 10% a 20% y en un 20% se presentan como testículos no palpables. La incidencia de monorquia o ausencia testicular unilateral es de un 3% a 5% de todos los testículos no descendidos. La causa de la criptorquidia generalmente es multifactorial: por persistencia del canal peritoneovaginal (50% a 90%), mala implantación del gubernáculum testis, vasos espermáticos cortos, anomalías epidídimo-testiculares (23% a 86%) o alteraciones del eje hipotálamo-hipofisiario-testicular. Los testículos no descendidos se clasifican según su localización en intraabdominales, canaliculares, ectópicos (perineal, femoral, inguinal superficial, suprapúbico o escrotal contralateral) y no palpables. El diagnóstico de criptorquidia es clínico, mediante un examen físico en adecuadas condiciones de tranquilidad y temperatura. Sin embargo, en el caso de testículo no palpable el ultrasonido inguinal permite destacar la presencia de tejido testicular bajo el anillo inguinal interno, lo que corresponde al 50% de los testículos no palpables. Con la incorporación de la laparoscopia, este es el examen de elección para la ubicación de los testículos intraabdominales, siendo esta la localización que se asocia con la más alta incidencia al cáncer testicular. En el caso de testículos no palpables bilaterales, el estudio comienza con un http://escuela.med.puc.cl/publ/manualUrologia/PatologiaGenitalesExternos.html[9/7/2009 3:17:11 PM] Untitled Document examen cromosómico y endocrinológico, para descartar la anorquia o ausencia testicular bilateral. La indicación quirúrgica se debe a razones de fertilidad, psicológicas y cosméticas como también a hacer accesible el testículo para el autoexamen, fundamental en la pesquisa precoz de un cáncer testicular, más que disminuir el riesgo de degeneración maligna. La criptorquidia aumenta 35 a 48 veces la incidencia de cáncer testicular, especialmente en la localización intraabdominal. La criptorquidia predispone además a la torsión y al traumatismo testicular. El tratamiento de elección es la corrección quirúrgica y ya que las alteraciones en la línea germinativa en una criptorquidia comienzan después del segundo año de vida y existe un descenso espontáneo durante los primeros meses, la edad actual de la indicación quirúrgica es entre los 12 y 18 meses. En el caso de criptorquidia postpuberal, atrofia testicular severa y testículos disgenéticos en estados de intersexo la indicación es la orquidectomía. En el caso de testículos no palpables, en el mismo acto quirúrgico se realiza la laparoscopia y el eventual descenso testicular. El tratamiento hormonal con HCG, GnRH o terapia combinada está reservado para las criptorquidias bilaterales con fines diagnóstico y terapéutico, y ha de realizarse antes de los 18 meses de vida. El éxito de este tipo de tratamiento no supera el 35%. Los testículos retráctiles no requieren tratamiento, sólo seguimiento. El pronóstico de la criptorquidia depende de la localización, de las malformaciones epidídimo-testicular asociadas, de la prontitud del tratamiento y del seguimiento. Síndrome Testicular Agudo El síndrome de testículo agudo consiste en la tríada: aumento de volumen, dolor e inicio brusco, en ocaciones asociado a síntomas generales como fiebre, vómitos y molestias urinarias. Esto puede deberse a: 1. un origen vascular por una torsión testicular, torsión de la hidátide de Morgagni o una hernia inguinal atascada; 2. un origen inflamatorio como una epididimitis u orquiepididimitis aguda y edema escrotal idiopático; 3. un origen traumático, o 4. a tumores, hidrocele, hematocele, púrpura de Schönlein-Henoch, etc. Las causas más frecuentes son la torsión de hidátide de Morgagni, la epididimitis y la torsión testicular. La diferencia clínica entre estos cuadros es muy difícil y cualquier examen complementario que demore el tratamiento más de 6 horas de iniciado el cuadro clínico puede determinar un daño irreversible. Luego, si no se puede descartar el compromiso vascular con la clínica o con la ecotomografía testicular Doppler Color se debe intervenir inmediatamente. La torsión testicular ocurre por una incompleta fijación testicular, esto puede presentarse a cualquier edad, siendo más frecuente en dos períodos: la vida intrauterina (torsión extravaginal, 5% de los casos) a partir de la semana 28 de gestación, y la pubertad (torsión intravaginal) entre los 8 y los 18 años. Esta torsión es dos veces más frecuente a izquierda. http://escuela.med.puc.cl/publ/manualUrologia/PatologiaGenitalesExternos.html[9/7/2009 3:17:11 PM] Untitled Document Entre los factores predisponentes están el traumatismo (20%), la criptorquidia, los tumores testiculares y el antecedente de torsión testicular contralateral previa (30% torsión bilateral asincrónica). El diagnóstico es clínico con inicio brusco, aumento de volumen, signos inflamatorios locales y reflejo cremasteriano abolido. Si el cuadro es de larga data y tiene compromiso vascular avanzado, el testículo aparece de consistencia dura e indoloro. La ecotomografía testicular con Doppler Color y los estudios de perfusión nuclear son de utilidad, pero de difícil disponibilidad y no descarta en un 100% el diagnóstico de torsión testicular. Por las gravísimas consecuencias, ante la sospecha clínica y para no retardar el tratamiento, la exploración quirúrgica es obligatoria. Esta consiste en confirmar el diagnóstico, destorsión y fijación testicular bilateral. En el caso de daño testicular irreversible se realiza la orquidectomía y fijación testicular contralateral. El pronóstico depende de la precocidad de la consulta, la sospecha diagnóstica y el tratamiento oportuno. El daño vascular aparece después de 6 horas de iniciada la torsión. En la práctica clínica sólo el 25% de los casos de torsión testicular es tratado a tiempo. La torsión de hidátide de Morgagni u otro resto embrionario derivado de los conductos de Müller, que penden de los polos testiculares o del epidídimo, son la causa más frecuente de testículo agudo en menores de 14 años. Se presenta como dolor testicular localizado en el polo superior asociado a una masa redondeada de 2 a 3 mm azulada visible a trasluz. El diagnóstico es fácil en las primeras horas antes que el escroto se edematice haciendo imposible diferenciarlo de una torsión testicular. Si se sospecha, la ecotomografía testicular con Doppler Color permite certificar un flujo sanguíneo testicular normal. Si existe la certeza se puede esperar la resolución espontánea, pero ante la duda la exploración quirúrigca de urgencia es obligatoria. La epididimitis aguda es menos frecuente y de curso lento; se presenta con dolor, enrojecimiento y aumento de volumen del epidídimo; puede extenderse al testículo, al escroto y tejidos vecinos. Se asocia a fiebre, síntomas generales o urinarios. Puede ser secundario a una infección urinaria especialmente en niños con malformaciones del tracto urinario, instrumentación uretral, reflujo uretro-vesículo-deferencial o con una implantación ureteral ectópica en la vía espermática. La ecotomografía testicular Doppler Color permite ver aumento del flujo sanguíneo en el testículo y el epidídimo. Siempre en caso de duda se justifica la exploración quirúrgica. El tratamiento es médico con medidas generales (reposo, analgésico, antiinflamatorio y suspensión escrotal) y la antibioterapia está reservada a los pacientes con infección urinaria. En estos pacientes es indispensable el estudio de imágenes para descartar una malformación urológica. Varicocele Es una várice formada por el plexopampiniforme supraescrotal debido a un reflujo venoso desde la vena espermática al testículo. Esta es una causa frecuente de infertilidad masculina. http://escuela.med.puc.cl/publ/manualUrologia/PatologiaGenitalesExternos.html[9/7/2009 3:17:11 PM] Untitled Document Se presenta como el hallazgo de una masa indolora depués de los 9 años. Su incidencia es de un 15% entre los 10 y 15 años. Menos del 2% son bilaterales. La masa se evidencia en posición de pie y se reduce notablemente en decúbito. Sólo las de gran volumen pueden producir algunas molestias vagas. En el 90% de los casos es del lado izquierdo. Es muy importante consignar el tamaño testicular y compararlo con el contralateral. Existe un test de estimulación Gn-RH para LH y FSH que está alterado en jóvenes con evidencia temprana de daño testicular. En adultos NO debe realizarse espermiograma. No tiene sentido hacer evidente un problema de difícil solución con años de anticipación a que se presente la infertilidad, que constituye un problema de pareja. Cuando la dilatación es muy importante, el varicocele es bilateral y el testículo presenta de menor tamaño que el contralateral, está indicada la ligadura retroperitoneal o suprainguinal de las venas espermáticas. Todas estas técnicas quirúrgicas tienen aproximadamente un 15% de fracasos. La gran mayoría de los varicoceles no cumple con los criterios para la cirugía y deben controlarse cada 6-12 meses. Patología del Proceso Peritoneo-Vaginal A partir de la semana 28 de gestación el testículo desciende por el proceso vaginal o conducto peritoneo-vaginal hasta el escroto, sobre la guía del gubernáculum testis, la presión intraabdominal y la acción de la dihidrotestosterona, cerrándose posteriormente antes o inmediatamente después del parto. La persistencia de este conducto puede ser variable, dando origen a diferentes presentaciones clínicas. La hernia inguinal indirecta corresponde al 98% de las hernias inguinales del niño y se debe a una amplia persistencia del conducto peritoneo-vaginal. La incidencia de hernias inguinales en los niños es de un 1.5%, siendo más frecuente en varones y un 65% corresponde al lado derecho. En un 15% son bilaterales. Los prematuros tienen 2 a 3 veces más incidencia de hernias inguinales indirectas. Esta se presenta como un aumento de volumen inguinal o inguinoescrotal fluctuante, que puede aparecer posteriormente a un cuadro bronquial obstructivo, constipación o aumento de la presión intraabdominal. Puede asociarse a irritabilidad y llanto por tracción del meso o compresión visceral. El diagnóstico es clínico, siendo muy importante el dato aportado por los padres. Generalmente, luego de maniobras que aumentan la presión intraabdominal, se palpa el contenido herniario o sólo se palpa el saco (signo de la seda) deslizando los dedos sobre el anillo inguinal superficial. El cordón espermático o el ligamento redondo en la mujer están más engrosados que el contralateral. El diagnóstico diferencial se hace con adenopatías inguinales, criptorquidia o testículo en ascensor. Es importante diferenciar en las mujeres un ovario herniado de un ganglio inguinal. Las hernias inguinales complicadas ocurren en el 5% de las hernias inguinales, frecuentemente en menores de 1 año. Si el contenido herniario no se puede reducir se habla de hernia inguinal atascada, cuando no hay signos objetivos http://escuela.med.puc.cl/publ/manualUrologia/PatologiaGenitalesExternos.html[9/7/2009 3:17:11 PM] Untitled Document de compromiso vascular, a diferencia de la hernia inguinal estrangulada. Cuando el contenido de la hernia inguinal complicada es intestinal ésta puede presentarse como una obstrucción intestinal. La hernia inguinal se opera cuando se diagnostica, previa evaluación preoperatoria. Sólo se puede diferir transitoriamente la cirugía por un cuadro médico concomitante, si la hernia es reductible. La hernia atascada con más de 6 horas de evolución y la hernia estrangulada son de resorte quirúrgico de urgencia. Es importante en la exploración verificar la indemnidad intestinal y testicular. La exploración contralateral en lactantes es de rutina en niñas, prematuros o cuando la hernia es izquierda, por la alta probabilidad de un proceso peritoneovaginal presente al lado derecho. El hidrocele del testículo es acúmulo de líquido peritoneal a nivel de la vaginal testicular por una fina persistencia del canal peritoneo-vaginal; su presentación es aumento de volumen fluctuante a nivel escrotal, siendo de mayor tamaño durante el transcurso del día; es por eso que recibe el nombre de hidrocele comunicante. Si el hidrocele aparece de manera brusca puede confundirse con una hernia complicada. Signos como consistencia renitente, transiluminación, color azuloso, ausencia de dolor y de signos inflamatorios locales y el ultrasonido permiten hacer el diagnóstico diferencial. El tratamiento es conservador, con cierre espóntaneo del proceso vaginal, especialmente durante el primer año de vida (95%). Cuando el cierre ocurre, el hidrocele deja de ser fluctuante y se transforma en hidrocele no comunicante, signo de buen pronóstico de una resolución espóntanea. Si persiste el hidrocele o aparece después del año de vida tiene indicación operatoria, que consiste en el cierre del canal peritoneo-vaginal persistente. El hidrocele del cordón o quiste del cordón en hombres, o quiste de Nuck en mujeres, corresponde a una persistencia del canal peritoneo-vaginal a nivel del cordón con cierre proximal y distal de éste. En general son asintomáticos y también se tratan en forma expectante, operándose sólo en niños mayores de un año. Las hernias inguinales directas o crurales corresponden sólo al 2% de las hernias inguinales en los niños; esto ocurre por un déficit de la pared posterior del conducto inguinal a nivel de la fascia transversalis y del anillo crural medial a la vena femoral, respectivamente. Se presentan como aumento de volumen, que en el caso de la hernia directa es medial al anillo inguinal profundo, y en el caso de la hernia crural bajo la arcada crural. Esta última es más frecuente en mujeres. Estas hernias son siempre de tratamiento quirúrgico y la cirugía consiste en tratar el saco herniario y reforzar la pared posterior y el anillo crural. Estas hernias pueden recidivar a diferencia de las hernias inguinales indirectas. http://escuela.med.puc.cl/publ/manualUrologia/PatologiaGenitalesExternos.html[9/7/2009 3:17:11 PM] Untitled Document Mecanismo de la Erección del Pene Basándose en disecciones en cadáveres, Conti en 1952 describió lo que llamó los esfínteres de Conti, los que situados en las arterias y venas regularían la erección. Esta teoría fue rebatida en 1980 por Newmann y Tchertkoff, los que no pudieron encontrarlos en recién nacidos. Luego Benson y cols., en 1980, quienes piensan que lo descrito por Conti no corresponde a esfínteres, sino a arterioesclerosis. Figura 1: Irrigación del pene. Figura 2: Rigidscam. Estudia erecciones nocturnas. Estudiando el cuerpo cavernoso en erección y flacidez es posible examinar las modificaciones que ocurren en la anatomía. Esto se ha hecho en perros y monos. El tono intrínseco del músculo liso y la descarga tónico-adrenérgica conservan la contracción de los músculos lisos en estado de flacidez. Esta resistencia periférica alta distribuida en la totalidad de las sinusoides contraídas y tortuosas permite que penetre a los espacios sinusoidales un flujo mínimo. Cuando se relajan los músculos lisos por la liberación de neurotransmisores o inyección de adrenérgicos alfa o relajantes del músculo liso, aumenta la adaptabilidad de los espacios sinusoidales y del árbol arterial y cae al mínimo la resistencia al ingreso de flujo. El atrapamiento de sangre por el incremento de la aceptabilidad de todo el sistema sinusoidal causa un aumento de la longitud y ancho del pene hasta alcanzar la capacidad de la túnica albugínea. Mientras tanto, la expansión de las paredes sinusoidales entre sí y contra la túnica albugínea causa compresión del plexo venoso subtunical. Una siguiente expansión estira la túnica albugínea, estrangula las venas emisarias y reduce el flujo venoso al mínimo. Hormonas Figura 3: Inyección intracavernosa. Los andrógenos son esenciales para la madurez sexual masculina. La testosterona regula la secreción de gonadotrifinas y el desarrollo muscular. La dihidrotestosterona media el crecimiento del vello, acné, calvicie, tipo masculino y espermatogénesis. Las hormonas pueden modular la transmisión sináptica, incluyendo síntesis, almacenamiento y liberación de neurotransmisores y también la sensibilidad de los receptores. En adultos, la pérdida de los andrógenos provoca pérdida en el interés sexual y deterioro de la emisión seminal. Se reducen la frecuencia, magnitud y latencia de las erecciones nocturnas. Sin embargo, los andrógenos parecen estimular, pero no serían esenciales para la erección en sujetos hipo-gonadales frente a la estimulación visual. Después de la séptima década se produce una declinación progresiva de la testosterona. Esto sería de causa testicular o por disfunción hipotálamo-hipófisis. La testosterona exógena aumentaría el interés sexual en algunos individuos. Neurotransmisores y farmacología de la erección El control neurológico de la erección peneana comprende la acción de los http://escuela.med.puc.cl/publ/manualUrologia/DisfuncionesSexuales.html[9/7/2009 3:17:25 PM] Untitled Document sistemas neuroefectores adrenérgico, colinérgico y no adrenérgico y no colinérgico (NANC). Los nervios adrenérgicos median la contracción del músculo liso intracavernoso, lo que causa la detumescencia del pene erecto. Los nervios colinérgicos contribuyen a la relajación del músculo liso y a la erección del pene mediante: Figura 4: aparato de vacío. - La inhibición de los nervios adrenérgicos a través de las interneuronas inhibitorias. - La liberación del factor relajador derivado del endotelio. Gracias a la acetilcolina que se libera en las terminaciones nerviosas colinérgicas. Figura 5: Prótesis semirrígida Estudios recientes demuestran que el sistema NANC puede ser el elemento principal en la erección peneana. Esto sobre la base de que la atropina intracavernosa no es capaz de bloquear la erección. En 1993, Trigo-Rocha y cols. mostraron que la vía NO-GMPc es el mecanismo principal de la erección canina. Es posible que además participen en la erección sustancias secretadas por el endotelio que cubre los espacios sinusoidales, como las prostaglandinas, el factor de contracción derivado del endotelio. Algunos piensan que las endotelinas 1, 2 y 3 son el factor de contracción del endotelio. Estos conocimientos aquí resumidos y la inyección de sustancias vasoactivas en los cuerpos cavernosos han cambiado el enfoque diagnóstico y terapéutico de la disfunción erectil. Disfunción Sexual Masculina Disfunción eréctil Figura 6: Prótesis infable Es la imposibilidad de lograr una erección firme o conservarla el tiempo adecuado. Los pacientes deben buscar asesoría si esto se repite en forma constante o parcial en un período de 6 meses. Disfunción eyaculatoria Aquí se divide el problema en la eyaculación precoz, cuando la emisión de semen se produce a poco de haber penetrado en la vagina. Retraso de la eyaculación y eyaculación retrógrada en que ésta se produce hacia la vejiga por incompetencia del cuello vesical. También existe la falta de eyaculación frecuente en los diabéticos y en pacientes sometidos a linfadenectomía lumboaórtica extensa con daño del simpático. Estudio de la Disfunción Eréctil Con el mejor conocimiento de los mecanismos de la erección el estudio se ha visto considerablemente simplificado. Han quedado fuera de uso el rigid scan para estudiar las erecciones nocturnas y la cavernosometría y cavernosografía realizada con punciones para el estudio de presiones intracavernosas. Estos exámenes se desprestigiaron por la ausencia de un examen normal bien conocido. Por otro lado, los estudios arteriales y de escape venoso se han visto limitados por los escasos resultados de la cirugía arterial y venosa. http://escuela.med.puc.cl/publ/manualUrologia/DisfuncionesSexuales.html[9/7/2009 3:17:25 PM] Untitled Document En la actualidad se ha llegado a la convicción de que la disfunción eréctil no tiene una sola causa. Es una sumación de causas. La anamnesis debe detectar problemas en la pareja, en especial dispareumia y frigidez, que lleva a la mujer a evitar la relación sexual o a tratar de disminuirla pasando a ser su participación excesivamente pasiva. En la edad en que las disfunciones masculinas se manifiestan es cuando es más necesaria la colaboración de la pareja para lograr una buena relación sexual. Cuando esto no ocurre, se agregan todos los factores que producen la frustración, la sensación de fracaso y la depresión secundaria. Es por esto que deben explorarse los problemas femeninos. La falta de una adecuada lubricación y la incontinencia de esfuerzos son factores que deben ser considerados. Las drogas empleadas en distintos tratamientos juegan un papel fundamental. La lista de drogas que pueden afectar la erección es mucho más larga que la lista de las que no la afectan. Los hipotensores, vasodilatadores, diuréticos encabezan esta lista. Los médicos que tratan esta patología deben tomar conciencia que los tratamientos prolongados son los que llevan a problemas. Hoy se aconseja variar los tratamientos, en especial los hipotensores, cada 12 meses empleando otros con distinto mecanismo de acción para atenuar los efectos secundarios. Ya no es aceptable el mantener un tratamiento, tomando como necesario el precio de la disfunción eréctil. La diabetes contribuye con un gran número de problemas. Esto en especial en la tipo I donde a corta edad se instala la disfunción. En la tipo II, debe advertirse al paciente sobre las consecuencias de un mal control. El estudio básico se centra en la historia de los meses previos, buscando la fecha de la última erección adecuada. Si han pasado más de 6 meses, puede hablarse de un cuadro de disfunción eréctil. Con este plazo se eliminan causas circunstanciales y de corta evolución, como los trastornos emocionales, la convalecencia de enfermedades o accidentes. El segundo paso es el estudio de la indemnidad del sistema de erección. Ello se logra fácilmente con la inyección de prostaglandina E1 intracavernosa. La respuesta con erección firme y de duración adecuada afirma un sistema intrapeneano arterial, venoso y nervioso indemne. La falta de respuesta obliga a estudios vasculares por medio del EcoDoppler. Se ha dejado de usar el estudio doppler rutinario, entre otras cosas por la falta de parámetros normales y por los efectos inhibitorios que provoca la situación en que se realiza el examen. Inmediatamente de hecho este test debe irse a la terapia. Esta es una enfermedad de calidad de vida en que el paciente no tiene gran interés por conocer la causa precisa, como que se lo devuelva a una vida sexual normal. Tratamientos Se ha simplificado la elección de tratamientos. Debe respetarse el orden mencionado a continuación, yendo de lo más simple a lo más complejo. Terapia oral Principalmente el uso de sildenafil, droga que facilita la erección. Debe ser usada acompañada de una adecuada estimulación psicológica y física. La dosis es de 100 mgs, 45 minutos a 1 hora antes. Se recomienda que se hagan a lo menos 4 intentos y que la ingesta sea con estómago vacío antes de considerarla poco efectiva. http://escuela.med.puc.cl/publ/manualUrologia/DisfuncionesSexuales.html[9/7/2009 3:17:25 PM] Untitled Document No debe repetirse la droga antes de transcurridas 24 horas y está contraindicada en aquellos pacientes que emplean nitritos como vasodilatadores coronarios. Su mecanismo es bloquear la fosfodiesterasa 5 con lo que aumenta el GMPc. Provoca una mejoría de la erección o una mantención de ella en el tiempo. Tiene poco efecto en diabéticos con daño vascular y en la disfunción secundaria a prostatectomía radical. Los efectos tóxicos son la cefalea y en el abuso de la droga, las alteraciones visuales. Existen otras terapias orales, menos usadas y con resultados insuficientes. Terapia intracavernosa La más empleada es la prostaglandina E1. Debe colocarse por inyección en dosis de 10 a 15 gamas. Si los efectos son prolongados, se puede disminuir la dosis. Por esto se aconseja que la primera dosis se coloque bajo control médico. La complicación más temida es la erección prolongada y el priapismo, si no se trata en forma adecuada. Esto se ve en un porcentaje muy escaso. Los resultados son positivos en un 95%. Sin embargo, la gran limitación está en la inyección, que no es bien aceptada por los pacientes. No más allá de un 40% llega a usarla como tratamiento. Aparatos de Vacío Dan resultado en el 100% de los casos. Sin embargo, son costosos y complicados para la adaptación del paciente. Antes del sildenafil, fueron los más empleados por los pacientes. La tecnología los ha mejorados y la adición de motores eléctricos pequeños para provocar el vacío y la erección facilitan las cosas. El paciente debe verlos en videos antes de hacer la inversión en ellos. Requieren una elevada capacidad de adaptación para emplearlos. No impide que se use en forma combinada con la terapia oral o inyectable. Prótesis Intracavernosas Diseñadas desde hace muchos años, mejoraron su tecnología y los tipos van desde las rígidas hasta las inflables. Representan el final del camino, ya que son irreversibles. Cuando la colocación es exitosa el paciente puede conservarla por años. Las inflables imitan la fisiología normal, pero aumenta el porcentaje de fallas por fatiga de material o falla de las válvulas. Son de alto costo al igual que la cirugía y la infección es el principal riesgo. Son muy empleadas en los diabéticos. El paciente debe estar muy consciente de lo que significa. Debe conocer la posibilidad de un fracaso o de la falla a la adaptación tanto masculina como femenina. Ha sido criticada por producir una erección fría. http://escuela.med.puc.cl/publ/manualUrologia/DisfuncionesSexuales.html[9/7/2009 3:17:25 PM] Untitled Document Introducción En el siglo XX, como en ningún otro, se produjo una revolución sexual que permitió la perpetuación de infecciones clásicas que se transmiten por contacto sexual y la aparición de nuevos cuadros clínicos de muy complejo manejo. Figura 1: Diagnóstico de gonorrea. Hallazgo de diplococos gram negativos intracelulares. Figura 2: Chancro sifilítico llamnado "duro" Estas enfermedades conforman un enorme grupo de cuadros clínicos. Su frecuencia varía según el país, la edad de la población y su situación socioeconómica y cultural. Es conocido que la infección por VIH es muy alta en algunos países africanos. Sin embargo, no lo es tanto en otros. En Estados Unidos, la infección por clamydia, el herpes genital y la infección por virus papiloma constituyen las tres enfermedades de transmisión sexual más frecuentes. En Chile, la sífilis, la uretritis gonocócica y la tricomoniasis están muy difundidas, lo que probablemente es un artefacto que surge de la toma rutinaria de exámenes en el control prenatal. Es difícil conocer cuál es la extensión de la infección por clamydia; suponemos que debe ser importante. Además, el herpes genital ha presentado un aumento notable. Las secuelas de estas infecciones pueden ser muy graves y afectar también a los contactos. El conocimiento de estas secuelas (estenosis uretrales, obstrucciones epididimarias con infertilidad, infección de la pareja con aumento en la incidencia, neoplasias) son algunos de los aspectos que deben ser inculcados en los pacientes, para hacerlos conscientes de su conducta de riesgo. Algunas de estas enfermedades son de alto riesgo de contagio, por lo que el médico debe estar preparado para aconsejar al paciente y su pareja para notificar a los servicios de salud correspondientes y para tomar él mismo las medidas que eviten poner en riesgo su vida, al mismo tiempo evitando discriminar a su paciente por el solo hecho de estar enfermo. Figura 3: Aspecto de la secreción al exprimir la uretra. Siempre se debe tener presente que, ante la exposición al riesgo, el paciente puede contagiarse con más de una de estas patologías, por lo que frente un diagnóstico específico deben descartarse obligatoriamente las demás enfermedades. Infecciones Clásicas a) Uretritis gonocócica Enfermedad causada por neisseria gonorreae, diplococo gram negativo intracelular. Figura 4: Aspecto de las tricomonas al microscopio. En la literatura norteamericana se considera que tuvo su máxima frecuencia en 1975, esto debido al particular problema de la guerra de Vietnam. En todos los países en que se desarrolla una guerra, esta enfermedad aumenta. El sitio más http://escuela.med.puc.cl/publ/manualUrologia/EnfermedadesTransmision.html[9/7/2009 3:17:48 PM] Untitled Document usual de infección es la uretra, pero existe un 7% de infección faríngea en heterosexuales y en homosexuales un 40% de infección faríngea y un 25% de infección rectal. Un coito con una mujer infectada implica alrededor de un 20% de posibilidades de adquirirla. Un coito de un varón infectado infecta a la mujer en el 80% de los casos. Figura 5: Condilomas acuminados bálaño prepuciales. Manifestaciones: El período de incubación va entre 3 y 10 días, aunque el rango va de 12 horas a 3 meses. En un 40% de los casos puede ser asintomática. Esto explica que, pese a la buena respuesta al tratamiento, el germen siga presente en la población. La presentación habitual se inicia con prurito y malestar uretral para luego instalarse una abundante secreción uretral color amarillo verdoso. Puede haber edema y eritema del meato. Complicaciones: La presencia de abscesos periuretrales lleva a la fibrosis y a la temida estenosis uretral. Al ascender la enfermedad, puede comprometer el epidídimo y llevar a la obstrucción con infertilidad. Otras complicaciones, como la diseminación, la artritis, sinovitis, son menos frecuentes. Laboratorio: La forma más fácil de confirmar la enfermedad es la obtención de muestra de secreción con una tórula fina, varias horas después de una micción y haciendo un extendido en portaobjeto de vidrio. Hecha la Tinción de Gram, la presencia de diplococos gram negativos intracelulares confirma la enfermedad. Si sólo son extracelulares, la información puede ser equívoca. La sensibilidad del examen es de un 100% y la especificidad de un 95%. El cultivo no siempre es necesario, pero permite ajustar el tratamiento según sensibilidad. Prevención: Es evidente que evitar las conductas de riesgo significa una baja posibilidad de infección. El uso de preservativos, correctamente usados, puede disminuir el riego de infección. Tratamiento: Estos han variado, desde la penicilina, a la que los gérmenes se han ido haciendo resistente, hasta las tetraciclinas y ciprofloxacino usado en la actualidad. Es necesario conocer cuál es la resistencia del germen. Fue clásica la selección ocurrida en el sudeste asiático donde para tratarla son necesarios 4 ó 5 drogas simultáneas. Recomedado: Ciprofloxacino 500 mg oral por una vez asociado a Doxiciclina 100 mg c/12 horas por 7 días, debido a que existe un 10 a 35% de coinfección por clamydia que debe ser tratada. Secuelas: La estenosis uretral es bastante frecuente. Aun representa un problema serio cuando se asocia a la uropatía obstructiva por hiperplasia benigna de la próstata. Para que la estenosis sea sintomática se necesita una extrema reducción del lumen uretral. Hoy día la uretrotomía interna bajo visión es el tratamiento de elección de esta secuela. Sin embargo, la cirugía abierta está aumentando en frecuencia para el manejo la estenosis recidivante. b) Sífilis Enfermedad causada por el treponema pallidum, una espiroqueta que infecta a través de la piel o de cualquier mucosa. También puede transmitirse por vía http://escuela.med.puc.cl/publ/manualUrologia/EnfermedadesTransmision.html[9/7/2009 3:17:48 PM] Untitled Document transplacentaria. Manifestaciones: El período de incubación es de 21 días en promedio (9-90). Sífilis Primaria: Aparece unas 3 semanas después del contacto una pápula indolora de bordes netos llamada chancro duro. Esta lesión aparece en cualquier sitio expuesto al contacto, más frecuentemente el glande o el prepucio. A veces puede pasar inadvertida. Luego hay un discreto aumento de volumen de los ganglios regionales (inguinales). Sífilis Secundaria (alrededor de 9 semanas después del contacto): Se manifiesta por compromiso del estado general, linfadenopatía generalizada y esplenomegalia, asociado a la aparición de un exantema máculo-papular generalizado que compromete las palmas y plantas de los pies. Posteriormente aparecen lesiones perianales altamente contagiosas (condilomata lata). Período de latencia: Desaparecen las manifestaciones clínicas, persisten las reacciones serológicas y hay bacteremia ocasional, por lo que el contagio transplacentario puede ser posible. Sífilis Terciaria (alrededor de 2 a 5 años después de la infección): Hay compromiso inflamatorio, "sifilides" de la piel y órganos internos. Aparecen pneumonía, hepatitis, orquitis, mesoaortitis, con formación de aneurismas, y gomas. 20 a 25 años después de la infección puede aparecer la neurolúes con parálisis progresiva y tabes dorsalis. Laboratorio: El diagnóstico se puede realizar por examen en campo oscuro de una muestra de la lesión cutánea. Una a tres semanas después de la aparición del chancro se hacen positivas las pruebas serológicas que son "no-treponémicas" (VRDL, RPR) o "treponémicas" (FTA-ABS). Las pruebas "no-treponémicas" son un buen indicador de "actividad" infecciosa. Tratamiento: La sífilis continúa siendo extraordinariamente sensible al tratamiento con penicilina. En caso de alergia puede usarse doxaciclina, eritromicina o tetraciclina. Recomendado: Sífilis de menos de un año de duración, penicilina benzatina 2,4 mill U intramuscular por una vez. Sífilis de más de un año o complicada, penicilina benzatina 2,4 mill U intramuscular a la semana por 3 semanas. Secuelas: El pronóstico en general es excelente, sin secuelas permanentes si es tratada a tiempo. c) Chancroide (chancro blando) Enfermedad causada por hemophilus ducreyi, cocobacilo gram negativo anaerobio facultativo. En un 10% de los casos se asocia a sífilis y a herpes virus. Además es un cofactor para el contagio por VIH. http://escuela.med.puc.cl/publ/manualUrologia/EnfermedadesTransmision.html[9/7/2009 3:17:48 PM] Untitled Document Manifestaciones: El período de incubación es de 3 a 10 días. Aparece primero una pápula que luego se transforma en una lesión sucia, dolorosa, que puede ser múltiple, llamada chancro blando, generalmente ubicada junto al meato uretral, al frenillo o cara mucosa prepucial. Hay compromiso ganglionar regional y en ocasiones fiebre. Complicaciones: En relación con obstrucción linfática puede haber elefantiasis genital y en relación con sobreinfección de las úlceras puede haber gran destrucción tisular. Laboratorio: Tinción de Gramm muestra cocobacilos gramm negativos. Cultivo. La biopsia es siempre diagnóstica. Tratamiento: El aseo genital precoz después del contacto sexual previene el contagio. Recomendado: Azitromicina 1gr oral por una vez o ceftriaxona 250 mg intramuscular por una vez. d) Linfogranuloma venéreo Enfermedad causada por clamydia trachomatis inmunotipos L1, L2 y L3. Manifestaciones: Período de incubación de 5 a 21 días, luego de los que aparece una lesión cutánea genital, a veces una vesícula o sólo una erosión, que desaparece rápidamente. Después aparecen grandes adenopatías inguinales que evolucionan a la supuración (bubos), en relación a estos aparecen síntomas generales como fiebre, artralgias, etc. Complicaciones: Obstrucción linfática con elefantiasis genital. Estenosis del canal anal. Laboratorio: Cultivo para clamydia del aspirado de los linfonodos. Pruebas inmunológicas para clamydia. Tratamiento: Recomendado: Doxiciclina 100 mg. cada 12 horas por 3 semanas. e) Granuloma inguinal (Donovanosis) Enfermedad causada por calymmatobacterium granulomatis, germen relacionado inmunológicamente con la klebsiella sp. Manifestaciones: Período de incubación de 1 a 12 semanas. Primero aparece una pápula y luego una úlcera no dolorosa de base eritematosa y sangrante. Frecuentemente rodeada de pequeñas lesiones satélites producidas por autoinoculación. Se acompaña de un aumento de volumen inguinal (pseudobubo) por un proceso granulomatorio del tejido subcutáneo. Complicaciones: Elefantiasis genital, pérdida de tejido. Laboratorio: El examen microscópico muestra los cuerpos de Donovan, que son la etapa intracelular de la C. granulomatis en los monocitos. Tratamiento: El uso de preservativo no previene el contagio. http://escuela.med.puc.cl/publ/manualUrologia/EnfermedadesTransmision.html[9/7/2009 3:17:48 PM] Untitled Document Recomendado: Tetraciclina 500 mg. cada 6 horas o cotrimexazol forte 1 cada 12 horas hasta obtener curación completa de la lesión (3 a 5 semanas). Otras Enfermedades de Transmisión Sexual a) Uretritis no gonocósica Enfermedad causada por cualquier otro germen no-gonococo. La clamydia trachomatis de serotipos D-K, un parásito intracelular obligado del epitelio, es la más peligrosa. La otra de importancia es el ureaplasma urealyticum. A pesar de todo, entre un 20 y 30% de las uretritis son negativas para gonococo, para clamydia y para ureaplasma. El virus del herpes simple, el citomegalovirus, las tricomonas y otros microorganismos no se han relacionado en forma convincente con estos casos. Manifestaciones: Corresponde a alrededor del 50% de las uretritis. En general no se notifica y los contactos no son examinados. El cuadro clínico no puede diferenciarse del de la uretritis gonocósica. El período de incubación es de 7 a 21 días. La uretrorrea suele ser escasa. Complicaciones: La clamydia es la principal causa de epididimitis en menores de 35 años. También se ha relacionado con prostatitis crónica abacteriana. Laboratorio: Descartar gonococo. El cepillado ("swab") uretral puede mostrar el germen. Cultivo. Pruebas inmunológicas para clamydia. Tratamiento: En general estas uretritis responden a las tetraciclinas. Debe tratarse a los contactos en forma adecuada. Recomendado: Doxixiclina 100 mg cada 12 horas por 7 días. b) Tricomoniasis Enfermedad causada por el protozoo tricomonas urogenitalis. Manifestaciones: Muy frecuente en la mujer (3 al 10% están infectadas), aunque el varón es el que hace de portador. Está presente en el 18% de los casos de uretritis gonocósica. Las pocas veces en que el varón hace el cuadro clínico de uretritis es alarmante, por lo abundante de la secreción. A diferencia de la gonorrea, la secreción es amarilla, pero no tiene el tono pardo verdoso. Complicaciones: Infección ascendente, prostatitis, infertilidad. Laboratorio: Examen microscópico de la secreción mezclada con 2 ml de suero fisiológico, de bajo rendimiento en hombres. Cultivo. Tratamiento: Está indicado el tratamiento de la pareja. Recomendado: Metronidazol 2 grs oral en dosis única. c) Enfermedades de origen viral http://escuela.med.puc.cl/publ/manualUrologia/EnfermedadesTransmision.html[9/7/2009 3:17:48 PM] Untitled Document • Herpes Genital Enfermedad causada por el virus herpes simplex. El virus es DNA de doble filamento y las infecciones se deben principalmente al tipo 2, aunque el tipo 1 está en aumento. Esta enfermedad provoca una gran preocupación a pacientes y médicos. Su frecuencia va en aumento, existiendo gran riesgo de transmisión a parejas sexuales y de morbilidad y mortalidad en lactantes. En estudiantes norteamericanos es 10 veces más frecuente que la lúes o la gonorrea. Existe una posible relación con el cáncer cérvico-uterino, no existiendo un tratamiento curativo eficaz. Manifestaciones: El período de incubación es de 4 a 21 días. Las lesiones son vesículas agrupadas hipersensibles al tacto, con una base eritematosa. En general, la primoinfección es un cuadro de mayor gravedad. Se acompañan síntomas constitucionales y linfadenopatías regionales; hay disuria en un 40% de los casos. Complicaciones: Autoinoculación satélite, riesgo obstétrico de inoculación al lactante. Laboratorio: Hoy día es posible cultivar el virus, pero es de alto costo. Pueden usarse pruebas inmunológicas. Ninguna de las pruebas es útil para diferenciar el tipo 1 del tipo 2. Tratamiento: No es posible erradicar el virus. Se emplea el aciclovir, aunque los resultados son discutibles. Para muchos, no cambia la evolución de la lesión. Aparentemente, los resultados serían mejores si se trata en forma precoz y con altas dosis. También se afirma que el tratamiento haría disminuir la recidiva, aunque esta enfermedad no es lógica, existiendo largas remisiones inexplicables, que pueden no estar relacionadas con el tratamiento. Recomendado: Acyclovir 200 mg oral 5 veces al día por 7 a 10 días. • Condilomas Genitales Enfermedad causada por el virus papiloma humano (HPV) tipos 6 y 11. Manifestaciones: Presenta períodos de incubación prolongados y variables. Son lesiones múltiples, hiperescamosas que parecen una "coliflor". Se presenta con mayor frecuencia en el surco bálanoprepucial. De fácil diagnóstico en el hombre al ser muy visibles, pero de difícil diagnóstico en la mujer al localizarse en vagina, donde sólo un examen muy cuidadoso permite detectarla. Complicaciones: Se la ha asociado con lesiones del cuello uterino. No es infrecuente que se asocie a cáncer de pene, cuando se trata de pacientes con malos hábitos de higiene. Laboratorio: La biopsia. Si no es disponible, se puede usar ácido acético al 5% sobre el área sospechosa y la hiperqueratosis de la lesión la hará destacar en un tono blanquecino. Tratamientos: Son poco específicos, siendo los más utilizados la destrucción química con la podofilina, la electrocoagulación, la http://escuela.med.puc.cl/publ/manualUrologia/EnfermedadesTransmision.html[9/7/2009 3:17:48 PM] Untitled Document vaporización por láser y la congelación. Se logran buenos resultados en su erradicación. En ocasiones requiere de tratamientos repetidos, en especial cuando el paciente llega con lesiones de gran tamaño. • Virus de Inmunodeficiencia Humana (VIH) Enfermedad causada por el Virus de Inmunodeficiencia Humana (VIH 1 y 2). En 1981 se comunicó por primera vez el Síndrome de Inmunodeficiencia Adquirida (SIDA). Este virus se transmite por contacto sexual, generalmente homo o bisexual, por contaminación de agujas en drogadictos endovenosos, en hemofílicos. Hoy, dado que se examinan los productos derivados de la sangre y los pacientes son sometidos a exámenes más frecuentes, es muy poco probable el contagio por transfusión o por una pinchadura accidental con material contaminado (el contagio se estima en 1 por 200 pinchazos infectados). Manifestaciones: Las manifestaciones son variables, hay pacientes que son "VIH positivos" y completamente asintomáticos, otros presentan el "Complejo Asociado al SIDA" con síntomas constitucionales que simulan una mononucleosis y otros presentan el SIDA con su característica inmunodepresión, infecciones oportunistas y tumores. La mayoría de los VIH positivos hacen síntomas en un período de 6 meses a 12 años desde la seroconversión. Laboratorio: Para tamizaje el ELISA para VIH. Para confirmación el WESTERNBLOT, prueba de anticuerpos monovalente para proteína viral específica, o PCR (Polymerase Chain Reaction). Para el seguimiento, se estudian las subpoblaciones de linfocitos T. Tratamiento: La terapia actual es supresiva, pero no erradica el virus. Hay evidencia creciente para el uso de tratamientos antivirales como el Azidothymidina (AZT) en forma profiláctica. Una vez declarado el SIDA sobre el tratamiento antiviral combinado, se agrega la profilaxis y el tratamiento de cada complicación específica. • Hepatitis Virales Estas enfermedades son hoy consideradas de transmisión sexual y son importantes por la alta contagiosidad en los grupos de riesgo. Hepatitis A: Período de incubación de 2 a 6 semanas, transmisión por vía oral-fecal. Ha aumentado su prevalencia en la población homosexual. Cuadro frecuentemente asintomático, nunca avanza a la cronicidad, ocasionalmente su presentación es fulminante y de riesgo vital. Hepatitis B: Período de incubación de 1 a 6 meses. Transmisión a través de la sangre, productos sanguíneos, secreciones corporales (transmisión sexual) y transplacentarios. Un tercio es secundario a contacto homosexual. Es importantemente más contagiosa que el VIH y es un riesgo ocupacional de consideración para el personal de salud. Evolución: 5 a 10% de cronicidad, en recién nacidos 100%. 20 al 30% de las hepatitis crónicas evolucionan a cirrosis biliar. Hepatitis C: (previamente No A- No B): Período de incubación de 2 a 10 semanas. Transmisión a través de la sangre y sus derivados, no existe evidencia suficiente para asegurar la transmisión por http://escuela.med.puc.cl/publ/manualUrologia/EnfermedadesTransmision.html[9/7/2009 3:17:48 PM] Untitled Document contacto sexual. • ParásitosTambién son consideradas enfermedades de transmisión sexual algunas parasitosis en las que el contacto sexual aumenta la exposición de la pareja para contraerla por cercanía, sin implicar contacto de fluidos corporales; éstas son las causadas por pediculus pubis y la escabiosis, causada por el sarcoptes scabiei. http://escuela.med.puc.cl/publ/manualUrologia/EnfermedadesTransmision.html[9/7/2009 3:17:48 PM] Untitled Document El Reflujo vésico-ureteral (RVU) se define como el paso retrógrado, contra corriente, de la orina de la vejiga al uréter. Este fenómeno patológico se previene con una unión ureterovesical normal, predestinada genéticamente, salvo temporalmente durante la prematurez. La prevalencia del RVU en la población normal es de 0.5% a 2%. Un 0.4% a 1.8% de los niños sin historia de infección urinaria tiene RVU y en el grupo con infección urinaria la incidencia es de un 30% a 50%. La incidencia de RVU es mayor en mujeres excepto en el grupo de recién nacidos. En las series clínicas de RVU el 50% son menores de 3 años. Figura 1: Unión urétero vesical La presentación clínica del RVU es variada, desde una hidronefrosis diagnosticada por ecografía antenatal, un episodio de infección urinaria, el estudio de hermanos de pacientes con RVU o el estudio de otras malformaciones renales o extrarrenales como ano imperforado, síndrome de Vacterl, etc. En el 5% a 10% de los casos el RVU será detectado con ocasión del estudio de otra patología urinaria, como hematuria, litiasis, enuresis, insuficiencia renal, etc. El reflujo tiene una tendencia familiar, encontrándose en un 30% a 35% en el estudio de hermanos con RVU, aumentando a un 50% en los hermanos menores de un año. En este grupo sólo un 5% presenta daño renal al momento del diagnóstico. Además presenta RVU cerca del 60% de los hijos de padres con reflujo, especialmente en el caso de las madres con RVU. El reflujo vésico-ureteral es más frecuente en la población blanca. Todo esto apoya la teoría de una transmisión genética ligada al cromosoma X, en forma autosómica, de expresión variable. Figura 2: Desembocadura de uréter. Las condiciones anatómicas que previenen normalmente la aparición de un reflujo son una unión uretero-vesical con su dispositivo antirreflujo (Figura N° 1). El uréter entra a la vejiga en un trayecto oblicuo intramural y luego submucoso para desembocar en el ángulo del trígono. A nivel del hiato ureteral, las fibras del detrusor se fijan a la adventicia del uréter amarrando así el uréter a la entrada de la vejiga de manera laxa. El detrusor ofrece al uréter intravesical un sostén posterior sólido y fijo. La longitud del trayecto submucoso del uréter crece con la edad, triplicándose entre el nacimiento y los 12 años. Según Paquin, la relación normal entre la longitud del uréter intravesical y su diámetro debe ser 4 a 5 por 1. Durante el llenado la presión intravesical no aumenta prácticamente nada y el vaciamiento ureteral se efectúan por una presión ureteral superior a la de la vejiga; en cambio, en la micción la contracción activa del trígono desciende el meato y lo coloca contra la pared muscular, el hiato ureteral se cierra por contracción del detrusor y el trígono y la presión intra-vesical comprimen el http://escuela.med.puc.cl/publ/manualUrologia/ReflujoVesicoUreteral.html[9/7/2009 3:18:05 PM] Untitled Document uréter submucoso. Figura 3: Reflujo vesicoureteral bilateral a la uretrocistografía miccional seriada Cualquier cambio en la posición y forma del uréter en su trayecto intravesical altera este mecanismo antirreflujo. Hay diferentes tipos de reflujo vésico-ureteral: 1. Reflujo primario o idiopático, anomalía congénita de la unión vésico-ureteral producida por una laxitud del trígono, una deficiencia de las fibras musculares del uréter distal o un trayecto submucoso muy corto secundario a una ectopía del meato. Esto sería consecuencia de una alteración en la posición de la yema ureteral, en la vida intrauterina. 2. Reflujo secundario, es aquel asociado a una lesión anatómica producido por: Figura 4: Reflujo vesicoureteral en la cistografía isotópica a) Destrucción quirúrgica de los mecanismos valvulares. b) Esclerosis del detrusor en tuberculosis, radioterapia, cistitis intersticial o cáustica. c) Vejiga neurogénica con parálisis parcial o total del detrusor y el trígono, vaciamiento incompleto de la vejiga y esclerosis del detrusor. d) Anomalías congénitas de la implantación uretrovesical como: ureterocele, uréter ectópico de implantación extravesical, divertículo paraureteral de Hutch y extrofia vesical. Figura 5: Nefropatía de reflujo en la cintigrafía renal estática con Tc99m DMSA e) Obstrucción cervicouretral, aumento de la presión intravesical y alteraciones de la musculatura vesical propia de la vejiga de lucha, como en las valvas uretrales, síndrome de Prune Belly, estenosis uretral y pólipos vesicales. El reflujo primario puede desaparecer espontáneamente con el crecimiento, especialmente en los primeros años de vida, por maduración de la unión uretero-vesical y crecimiento en la longitud del uréter intravesical. La evolución del reflujo secundario depende de la causa de origen. Las consecuencias del reflujo sobre el riñón y la vía excretora son: 1. Infección urinaria: sigue siendo la forma más frecuente de presentación del RVU. La infección urinaria es favorecida en estos casos, ya que el reflujo impide un vaciamiento vesical regular y completo. 2. Dilatación de la vía excretora: mecanismo puramente mecánico, http://escuela.med.puc.cl/publ/manualUrologia/ReflujoVesicoUreteral.html[9/7/2009 3:18:05 PM] Untitled Document Figura 6: Técnica de reimplante con antirreflujo al aumentar el trabajo ureteral de propulsar varias veces la misma orina y por una hiperpresión retrógrada, llegando a dilatar el uréter, la pelvis y los cálices. Si hay una gran dilatación de todo el tracto urinario superior en forma persistente, incluso en la etapa de llenado vesical, se denomina megauréter refluyente. 3. Nefropatía de reflujo: son lesiones parenquimatosas renales asociadas a RVU se presentan especialmente en los casos severos de reflujo y/o asociados a infección urinaria. Se localizan predominantemente en los polos y se acompañan frecuentemente de atrofia cortical segmentaria. A veces la atrofia renal es global comprometiendo el tamaño renal y la función renal relativa. La nefropatía de reflujo corresponde histológicamente a dos tipos de lesiones: Figura 7: Daño renal bilateral por reflujo grado V lleva a insuficiencia renal. 1. Pielonefritis crónica como consecuencia de un reflujo vésicoureteral infectado, especialmente en aquellos con reflujo intrarenal. Cuando la papila es cóncava, como ocurre en los polos del riñón, la desembocadura de los túbulos colectores ocurre en forma perpendicular, permitiendo el paso de orina y la invasión del parénquima por orina infectada. El daño renal está presente en un 60% de los niños con reflujo y este puede ocurrir a cualquier edad, siendo mayor en menores de 5 años. El daño renal es más severo en varones, independiente del grado del reflujo, a pesar que las mujeres presentan más infección urinaria recurrente. El factor más importante en el daño renal adquirido en el RVU es la presencia de infección urinaria. Existen evidencias clínicas y experimentales de daño renal en ausencia de infección urinaria, especialmente si hay un reflujo intrarrenal, por transmisión de la presión intravesical al riñón, por la vía excretora. 2. Displasia renal es el daño congénito asociado a RVU; correspondería a una anomalía embriológica en el desarrollo, por una alteración en la yema ureteral con un inadecuado desarrollo del metanefro, caracterizado por la presencia de elementos displásticos en las papilas y una desorganización de la arquitectura en la corteza renal. En la población chilena de niños con insuficiencia renal terminal el reflujo vésico-ureteral es la causa en el 13%. En un 38% de hipertensos mayores de 15 años con daño renal existe el antecedente de reflujo vésico-ureteral, principalmente aquellos que presentan daño renal bilateral. El diagnóstico de reflujo vésico-ureteral se hace con una uretrocistografía miccional seriada (Figura 2), procedimiento ambulatorio sin anestesia, realizado con un catéter fino colocado en vejiga vía uretra, que permite visualizar la vejiga en etapa de llene y vaciado, descartar la presencia de reflujo vésicoureteral y mostrar la uretra durante la micción. Es un examen dinámico, que para el diagnóstico de reflujo las placas más importantes son las miccionales y las postmiccionales. Permite descartar también malformaciones vesicouretrales asociadas, propia de los reflujos vésico-ureterales secundarios. Hay que diferenciar los reflujos pasivos presentes sólo durante el llenado vesical y los reflujos activos visualizados durante la micción; este último es el reflujo patológico de alta presión. Es indispensable realizar dos llenados vesicales durante este examen y así disminuir la posibilidad de falsos negativos, existiendo siempre un porcentaje no despreciable de reflujos vésico- http://escuela.med.puc.cl/publ/manualUrologia/ReflujoVesicoUreteral.html[9/7/2009 3:18:05 PM] Untitled Document ureterales que no se visualizan a la uretrocistografía miccional. La clasificación del Comité Internacional de estudio de reflujo (Figura 3), es la más usada en la actualidad; esta clasifica el reflujo vésico-ureteral en 5 grados: Grado I reflujo alcanza solo el uréter, Grado II compromete uréter y sistema colector superior sin dilatarlo, Grado III con dilatación leve a moderada del uréter y la pelvis; Grado IV tortuosidad del uréter con dilatación de la pelvis y los cálices, eversión de los cálices y atrofia parenquimatosa, y Grado V reflujo masivo con gran tortuosidad ureteral o la presencia de reflujo intrarrenal o impresión papilar del reflujo. La cistografía isotópica es un estudio de imágenes con más baja irradiación a gónadas y un menor porcentaje de falsos negativos que la uretrocistografía miccional radiológíca convencional, pero no da información anatómica ni de la vejiga ni de la uretra, indispensable en el estudio de varones y muy útil en la evaluación de mujeres, ni permite graduar el reflujo; sólo lo clasifica en leve (I), moderado (II) o severo (III). (Figura 4). La clasificación del reflujo es uno de los más importantes factores en el pronóstico y la toma de decisiones terapéutica, motivo por el cual es indispensable realizar inicialmente la uretrocistografía miccional seriada en todos los casos y reservar la cistografía isotópica sólo para el seguimiento de estos pacientes y el estudio de hermanos de niños con RVU. Actualmente se evalúa la efectividad de realizar también el diagnóstico de reflujo por ultrasonido con instilación vesical de una albúmina ionizada. En el 30% de los niños con reflujo vésico-ureteral la ultrasonografía convencional es normal, incluso en grados moderados y severos. La cistoscopia permite observar la longitud del trayecto submucoso del uréter, que normalmente mide 5 mm en los recién nacidos y 14 mm en los adultos. Además la cistoscopia determina el aspecto del meato ureteral, la posición del orificio ureteral y la musculatura perimeatal (divertículo paraureteral o de Hutch). Siendo un examen válido para definir la anomalía en la unión vésicoureteral presente en el RVU y en algunos casos definir el pronóstico favorable a la resolución espontánea de este, es de poca utilidad en la clínica, ya que requiere de una anestesia general. La cintigrafía renal estática con Tc-99m DMSA determina en los pacientes con RVU el tamaño renal, la presencia de lesiones agudas del parénquima y/o cicatrices y el porcentaje de función renal relativa del riñón afectado. Debe realizarse en todos los pacientes con reflujo en su evaluación inicial, ya que el daño renal es un factor importante en la consideración terapéutica (Figura 5). La urodinamia debe reservarse para aquellos pacientes con la sospecha clínica o radiológica de una disfunción vesical y en aquellos con falla al tratamiento quirúrgico. La base del tratamiento del RVU primario es el tratamiento médico, consistente en la profilaxis antibiótica (nitrofurantoína 2-3 mg/kg/día o cefadroxilo 15 mg/kg/día), con el objeto de mantener la orina estéril, en espera de la resolución espontánea del reflujo. Esto debe acompañarse de un buen manejo de factores que condicionan la persistencia del RVU y la presencia de infecciones urinarias recurrentes como son la constipación, la disfunción vesical y la micción infrecuente, lo que actualmente se denomina el síndrome de mala eliminación. El tratamiento médico debe incluir exámenes bacteriológicos de orina periódicos o frente a la sospecha clínica de una infección urinaria. El tratamiento médico se mantiene durante un año, evaluando al cabo de este http://escuela.med.puc.cl/publ/manualUrologia/ReflujoVesicoUreteral.html[9/7/2009 3:18:05 PM] Untitled Document plazo con una nueva uretrocistografía miccional seriada y cintigrafía renal estática con Tc-99m DMSA. Si resuelve el reflujo se suspende la profilaxis, o si al cabo de este tiempo el reflujo persiste de grado igual o menor al inicial y no hay evidencias de nuevas cicatrices a la cintigrafía renal estática con Tc-99m DMSA continuamos un segundo y último año de tratamiento médico. Por las características de nuestra población y su sistema de salud, el tratamiento médico no lo extendemos más allá de dos años, salvo excepciones, ya que el abandono al tratamiento y especialmente al seguimiento es muy alto. La resolución espontanea está relacionada a la severidad del reflujo; los reflujos grado IV o V tienen una resolución de cerca del 15% a 25% en 4 años, el grado III un 40% de resolución y los grados I a II una resolución del 80% en 5 años. La resolución para los grados leve a moderado es de un 30% a 35% por año, siendo mayor en menores de un año, especialmente en varones. La resolución espontánea disminuye considerablemente después de los seis años y en general es más frecuente en mujeres. En el caso de RVU en adolescentes, en los varones sin daño renal y asintomáticos no es obligatoria la corrección quirúrgica, ya que este no trae consecuencias en el futuro. En cambio, en mujeres la cirugía antirreflujo disminuye la incidencia de pielonefritis aguda durante el embarazo y sus consecuencias en la morbimortalidad perinatal, especialmente en aquellas con el antecedente de infecciones urinarias recurrentes. Además evita los riesgos de preeclampsia e hipertensión en mujeres con daño renal preexistente. El tratamiento quirúrgico lo indicamos en mayores de 6 años, en reflujos de alto grado (IV y V) o en pacientes con falla al tratamiento médico (infección urinaria recurrente, mala tolerancia al medicamento o falta de adhesividad al tratamiento). En ocasiones se indica una corrección quirúrgica como primera alternativa terapéutica a reflujos de bajo grado (III o menos) con importante daño renal (función renal relativa <de 35% o insuficiencia renal) o en monorrenos. La presencia de un doble sistema pielocalicial (el reflujo del sistema inferior) o de un divertículo paraureteral de Hutch no son indicaciones perentorias de tratamiento quirúrgico, a pesar que la probabilidad de resolución espontánea es menor, especialmente asociado a divertículo paraureteral. El tratamiento quirúrgico del reflujo vésico-ureteral consiste en: 1. Reimplante vésico-ureteral consistente en la reconstitución de un trayecto ureteral submucoso suficiente, de una longitud al menos 4 a 5 veces el diámetro ureteral, según la regla de Paquin, con un buen apoyo muscular posterior al detrusor y una amarra sólida del uréter distal al trígono. Si el uréter está muy dilatado, debe ser remodelado (disminución de calibre) en su porción intramural, para cumplir con la regla de Paquin, ya sea por una resección o una plicatura de sus paredes, lo que permite disminuir el calibre del uréter. Existen múltiples técnicas de reimplante vésico-ureteral; éstas se pueden clasificar en extravesicales o intravesicales; las más frecuentes son la técnica de Cohen, la técnica de Gregoir-Linch y la técnica de Politano-Leadbetter. La más usada es la técnica intravesical de Cohen que mantiene el orificio externo de entrada a la vejiga o hiato ureteral nativo y sólo prolonga el trayecto ureteral a través de un túnel submucoso hacia la cara contra lateral de la vejiga, colocando el meato ureteral sobre el del otro lado. En el http://escuela.med.puc.cl/publ/manualUrologia/ReflujoVesicoUreteral.html[9/7/2009 3:18:05 PM] Untitled Document caso de una duplicación pielocalicial el reimplante se realiza en ambos uréteres juntos en cañón de fusil, ya que generalmente comparten una pared e irrigación común. 2. Ureterostomía cutánea o vesicostomía; se utilizan estas derivaciones urinarias para reflujo vésico-ureteral severo unilateral o bilateral respectivamente; en el caso de menores de doce meses con reflujo masivo, sepsis urinaria, monorrenos o insuficientes renales, ya que la cirugía del reimplante vésico-ureteral no es aconsejable en este grupo etario, para evitar un daño vesical permanente. Además la derivación urinaria en caso de RVU permite en grandes megauréteres refluyentes disminuir el calibre ureteral y así evitar muchos remodelajes del uréter, procedimiento que expone la vascularización ureteral, aumentando la incidencia de estenosis postoperatoria. 3. Nefroureterectomía total en el caso de destrucción total del parénquima renal por pielonefritis crónica o en una exclusión total por displasia renal. El éxito de la cirugía antirreflujo es superior a un 95%, en la mayoría de las series. El resultado se evalúa a los seis meses con una nueva uretrocistografía miccional seriada o cistografía isotópica, manteniendo la profilaxis de antibiótico hasta certificar la resolución del reflujo. Si persiste el reflujo deben esperarse seis meses más para una nuevo control antes de plantear una reintervención quirúrgica. Las complicaciones de la cirugía antirreflujo son: la persistencia del reflujo (2.5%) y la obstrucción ureteral (4.2%); esta última es la más temida y requiere de intervención quirúrgica una vez realizado el diagnóstico; las técnicas extravesicales, las técnicas intravesicales con la confección de un nuevo hiato y toda técnica que requiera de un remodelaje ureteral tiene mayor porcentaje de obstrucción ureteral postoperatoria. Existe un 10% a 15 % de reflujo vésico-ureteral contralateral en el postoperatorio de una cirugía antirreflujo, que en casi la totalidad se resuelve espontáneamente, en el plazo de un año poscirugía. Un 38% de los pacientes en tratamiento médico presenta recurrencia de su infección urinaria, al igual que el 39% de pacientes operados una vez que han suspendido su profilaxis. La presencia de nuevas cicatrices (20%) es equivalente en ambas modalidades terapéuticas, pero la incidencia de pielonefritis aguda es significativamente mayor en el grupo con tratamiento médico (21%) que con tratamiento quirúrgico (10%). Otra alternativa terapéutica actual para el RVU es el tratamiento endoscópico por la inyección submucosa, bajo el meato ureteral para reforzar el piso, de algún material como teflón, colágeno, bioplástico, condrocitos, etc. No existe aún en el mercado farmacéutico el material ideal para este procedimiento, ya que el teflón ha demostrado buenos resultados, pero evidencias de migración de partículas a tejidos como sistema nervioso central y pulmón, sin consecuencias clínicas. En cambio, el colágeno no tiene efectos adversos como el teflón, pero es menos durable en el tiempo. La línea de investigación clínica más prometedora es el implante de condrocitos, producto de un cultivo celular in vitro. Este tratamiento endoscópico del reflujo debe considerarse una alternativa al tratamiento médico, ya que sus mejores resultados son en reflujos leves a moderados y por su variable permanencia en el tiempo, es una forma http://escuela.med.puc.cl/publ/manualUrologia/ReflujoVesicoUreteral.html[9/7/2009 3:18:05 PM] Untitled Document alternativa a la resolución espontánea. La resolución del reflujo es del orden del 75%, con una falla en la técnica de inyección del 4.5% y una recurrencia del reflujo en dos años de seguimiento del 2.8%. El tratamiento del RVU secundario corresponde a la etiología de base. Aproximadamente un 10% de las hidronefrosis antenatal corresponde a reflujo vésico-ureteral; este reflujo antenatal tiene características clínicas diferente. El 80% corresponde a varones y dos tercios son reflujo vésico-ureteral bilateral. El 80% de la series de reflujo antenatal son reflujos grado III o más y más de la mitad de estos pacientes presenta, al nacer, daño renal congénito o displasia, previo a una infección urinaria. Aproximadamente el 20% de los grados severos se resuelven antes de los dos años y el 25% de los niños va a presentar infecciones urinarias recurrentes, a pesar de la profilaxis, durante los dos primeros años. Se plantea en los niños menores de un año de edad el beneficio de una circuncisión, período de la vida donde habría una directa relación entre fimosis e infección urinaria. http://escuela.med.puc.cl/publ/manualUrologia/ReflujoVesicoUreteral.html[9/7/2009 3:18:05 PM] Untitled Document Historia Figura 1: Posición de trócares La historia de la cirugía laparoscópica se remonta a comienzos del siglo XX, cuando en 1901 el alemán G. Kelling explora la cavidad abdominal de un perro con un cistoscopio y Jacobaeus, en 1910, realiza la primera laparoscopia en un abdomen humano. Gunning (1977) desarrolló el laparoscopio basado en el concepto del cistoscopio. Inicialmente centró el interés de los ginecólogos, quienes fueron considerados pioneros de esta técnica. Pero sólo con posterioridad a la aceptación mundial de la colecistectomía laparoscópica realizada por F. Dubois en Francia en 1988, otras especialidades comenzaron a explorar las potencialidades de la laparoscopía. Figura 2: Cirujano trabajando. Los comienzos de la laparoscopia urológica datan del año 1976. Cortessi evaluó a un paciente con testículo no palpable mediante una laparoscopia. Los primeros años estuvieron marcados por concepto de "Laparoscopía diagnóstica". Hasta ese momento no generó gran interés entre los urólogos desarrollar esta técnica. La posterior mejoría de los sistemas ópticos y la miniaturización de los instrumentos quirúrgicos permitieron llevar a cabo cirugías mínimamente invasivas en forma tan efectiva como la cirugía abierta. Luego de los trabajos de Schuessler (1989) en linfadenectomía pelviana laparoscópica en cáncer de próstata y las primeras nefrectomías laparoscópicas realizadas por R. Clayman (1990), otros urólogos volvieron a interesarse en desarrollar esta técnica. El interés por la laparoscopia radica en su carácter mínimamente invasivo, generando una menor reacción inflamatoria de respuesta al stress quirúrgico, implicando un menor requerimiento de analgésicos, una rápida recuperación, hospitalizaciones más abreviadas, un rápido reintegro a la vida laboral y finalmente un mejor resultado estético. Figura 3: Cierre de orificios de trócares. En los últimos 10 años, en la literatura se han reportado un número significativo de experiencias en diferentes técnicas urológicas por vía laparoscópica, incluyendo linfadenectomía pelviana y lumboaórtica de etapificación del cáncer prostático y testicular, cirugía de la glándula suprarrenal, nefrectomía simple por patología benigna y radical por cáncer renal, nefrectomía parcial, cirugía ureteral por litiasis, prostatectomía radical por cáncer de próstata, cirugía para la corrección de incontinencia de orina de esfuerzo, etc. La necesidad de la urología laparoscópica actual es demostrar con series prospectivas y randomizadas no sólo que es posible ser realizada, sino en cuáles de estos procedimientos se justifica realizarlos por vía laparoscópica, considerando la morbimortalidad asociada, la curva de aprendizaje y beneficio real para el paciente en comparación con la cirugía abierta. Es claro que la laparoscopia en urología llegó para quedarse, y sino la desarrollan los propios urólogos, vamos a lamentar que otras especialidades lo http://escuela.med.puc.cl/publ/manualUrologia/CirugiaLaparoscopica.html[9/7/2009 3:18:29 PM] Untitled Document hagan por nosotros, restringiendo nuestra especialidad por no haber tenido la visión de futuro necesaria. Conceptos Básicos de la Técnica laparoscópica 1ª Etapa Con el paciente bajo anestesia general y en posición de decúbito dorsal o lateral, se punciona la cavidad peritoneal a nivel umbilical o pararrectal con la aguja de Verres insuflando CO2, generando un neumoperitoneo de entre 12 a 15 cm H20. 2ª Etapa Una vez conseguido el neumoperitoneo, se instalan los trocares de trabajo de 5,10 o 12 mm de diámetro. La punción del primer trocar es a ciegas y por lo tanto un momento crítico por el riego de una potencial lesión vascular o gastrointestinal. Otra alternativa es instalar el primer trocar bajo visión directa del peritoneo haciendo una minilaparotomía para no lesionar las estructuras e utilizar el trocar de Hassan que permite evitar la fuga del neumoperitoneo, sellando el peritoneo con puntos a la piel. Los restantes trócares se colocan bajo visión laparoscópica. 3ª Etapa Durante ésta se lleva acabo el procedimiento quirúrgico propiamente tal (laparoscopia diagnóstica, biopsia, cirugía resectiva o reconstructiva), para lo cual se pueden utilizar ópticas de 0° a 30°, diferentes instrumentos que permiten la disección y resección (como pinzas, tijeras, separadores, aspiradores), y variados métodos para mantener la hemostasia (como electrocoaguladores monopolares, bipolares, bisturí armónico, clips metálicos y suturas mecánicas). 4ª Etapa Una vez terminada la cirugía programada, se debe revisar la hemostasia bajando la presión del neumoperitoneo a niveles de 6-8 cm de H20, permitiendo visualizar sangramiento venoso; las piezas quirúrgicas se extraen dentro de una bolsa plástica resistente y hermética ampliando la incisión utilizada de uno de los trocares de trabajo, evitando el riego de diseminación de células tumorales. Sólo se deben cerrar la aponeurosis de los trocares de mayor diámetro (12mm ) y aquellos que se ampliaron para extraer las piezas quirúrgicas. 5° Etapa El postoperatorio es la etapa más interesante de la laparoscópica. Debido a que esta cirugía es una agresión menor, la recuperación de los pacientes es más rápida, permitiendo una deambulación y realimentación precoz. Al mismo tiempo disminuye el período de hospitalización y de reintegración completa a sus actividades cotidianas. Técnicas Urológicas laparoscópicas http://escuela.med.puc.cl/publ/manualUrologia/CirugiaLaparoscopica.html[9/7/2009 3:18:29 PM] Untitled Document Varicocele La ligadura de la vena espermática por vía laparoscópica es una técnica simple. El abordaje es transperitoneal, por encima del orificio inguinal profundo, permitiendo una sección segura y rápida, evitando el daño a la arteria testicular, el conducto deferente, vasos linfáticos. Permite disminuir la incidencia de hidrocele secundario. Las series actuales revelan resultados similares en cuanto a eficacia, morbilidad, tiempo operatorio y estadía hospitalizados en comparación con las técnicas abiertas. Hace una década llegó a ser bastante difundida, pero actualmente su uso se ha restringido, debido a que se considera más invasivo y costoso que las técnicas abiertas. Sólo se justificaría en casos de varicocele bilateral. Cirugía adrenal La cirugía de las glándulas adrenales es uno de los campos en que la laparoscopia ha logrado mostrar sus ventajas comparativas con respecto a las técnicas abiertas. Como técnica mínimamente invasiva es eficaz y se asocia a menor morbilidad. Si bien el tiempo quirúrgico es levemente mayor, sus ventajas incluyen una disminución en el sangrado intraoperatorio, rápida recuperación, menor requerimiento de analgésicos, hospitalización abreviada, mejor resultado estético y una reincorporación laboral más rápida. El abordaje laparoscópico puede ser por vía trans peritoneal o retroperitoneal. La indicación actual incluye lesiones funcionantes y no funcionantes hasta 8 cm de diámetro, excluyendo cualquier masa en que se sospeche un carcinoma suprarrenal. Cada vez más son los centros urológicos que integran este abordaje para la cirugía adrenal. Cirugía renal laparoscópica La nefrectomía simple o la nefroureterectomía por patología benigna lleva más de 10 años de utilización y está ampliamente aceptada como una alternativa terapéutica debido a las ventajas derivadas de ser mínimamente invasiva. Gradualmente ha aumentado su uso entre los equipos urológicos, inicialmente restringido a casos seleccionados. La utilización de la laparoscopia para el tratamiento del carcinoma renal es un tema aún en controversia. Existen publicaciones que muestran que es una técnica compleja pero igualmente eficaz, con todas las ventajas ya mencionadas de la cirugía mínimamente invasiva. Pero falta tener mayor tiempo de seguimiento de estos pacientes para poder asegurarlo; actualmente las series con mayor seguimiento promedio superan los 2 años y no han mostrado diferencias en la sobreviva y recurrencia tumoral en comparación a la cirugía abierta. Uno de los aspectos puestos en duda sería la posibilidad de diseminación tumoral a través de los sitios de punción de los trocares y el riesgo de metástasis tardías. Hasta la actualidad no existen datos que avalen esta opinión, pero se requiere de mayor seguimiento para esclarecer esta interrogante. Cirugía laparoscópica en incontinencia de orina En la incontinencia de orina de esfuerzo, las técnicas más eficaces corresponden a las colposuspensiones del tipo de Burch y las correcciones del tipo Sling. En la búsqueda de técnicas menos invasiva se desarrolló la técnica de la colposuspensión tipo Burch por vía laparoscópica con excelentes resultados iniciales, pero su seguimiento a 5 años demostró mayor recidiva de http://escuela.med.puc.cl/publ/manualUrologia/CirugiaLaparoscopica.html[9/7/2009 3:18:29 PM] Untitled Document la incontinencia que las técnicas abiertas, por lo que ha quedado en desuso. Linfadenectomía laparoscópica de etapificación en cáncer Tanto en el cáncer de próstata como en el cáncer testicular, la laparoscopia encontró un sitio fructífero para su desarrollo. Desde comienzos de los años noventas comenzaron las series con lifadenectomía pelviana para el Ca. próstata. Esta técnica rápida y eficaz permite etapificar el paciente con un CaP clínicamente localizado orientando el tratamiento a seguir. Su utilidad ha disminuido en la actualidad dado que el uso generalizado del APE ha permitido diagnosticar el Ca. próstata en estadios más localizados y a disminuido ostensiblemente la incidencia de ganglios positivos para tumor durante una linfadenectomía. Hoy en día es infrecuente que la linfadenectomía modifique el tratamiento escogido. Por el contrario, en el Ca. testicular del tipo no seminoma etapa I, la linfadenectomia lumboaórtica laparoscópica de etapificación ha sido un aporte significativo, permitiendo etapificar adecuadamente estos casos, logrando un muestreo ganglionar significativo del retro peritoneo, evitando una gran incisión en un grupo de pacientes jóvenes y permitiendo una convalecencia mucho más breve con una rápida reinserción laboral Laparoscopia en cáncer de próstata Esta es un área urológica de gran desarrollo en la actualidad. Desde hace ya tres años, por lo menos cuatro centros urológicos europeos (principalmente franceses) han estado desarrollando esta técnica con resultados muy buenos en su fase inicial de seguimiento. Actualmente hay más 500 pacientes operados en la experiencia francesa con un seguimiento promedio mayor de 18 meses, quedando como tareas pendientes el seguimiento oncológico a largo plazo y demostrar si sus ventajas respecto de la cirugía abierta justifican su implementación. Futuro e investigación en laparoscopia urológica La laparoscopia urológica necesita demostrar a través de trabajos clínicos prospectivos y randomizados en qué patologías se justifica este abordaje con relación a morbimortalidad, costos y calidad de vida para los pacientes. Debe ser en el ámbito de los centros de formación universitarios donde se concentren los esfuerzos para desarrollar esta técnica, mediante la implementación de laboratorios experimentales utilizando modelos animales y aplicándolos gradualmente en clínica para disminuir la curva de aprendizaje y determinar si su aplicación es un verdadero aporte a la especialidad. Actualmente a nivel experimental, el desarrollo tecnológico ha permitido el uso de laparoscopios con visión tridimensional, la implementación de brazos mecánicos robotizados comandados por mando vocal o controlados a distancia permitiendo la telecirugía laparoscópica. También otras líneas de investigación están desarrollado la aplicación de los diferentes tipos de energías por vía laparoscópica para la disección y ablación de tejidos tumorales (crioterapia, radiofrecuencia, termoterapia, etc.). http://escuela.med.puc.cl/publ/manualUrologia/CirugiaLaparoscopica.html[9/7/2009 3:18:29 PM] Untitled Document http://escuela.med.puc.cl/publ/manualUrologia/CirugiaLaparoscopica.html[9/7/2009 3:18:29 PM]