ESTUDIANTE: CURSO: Fecha:
Anuncio
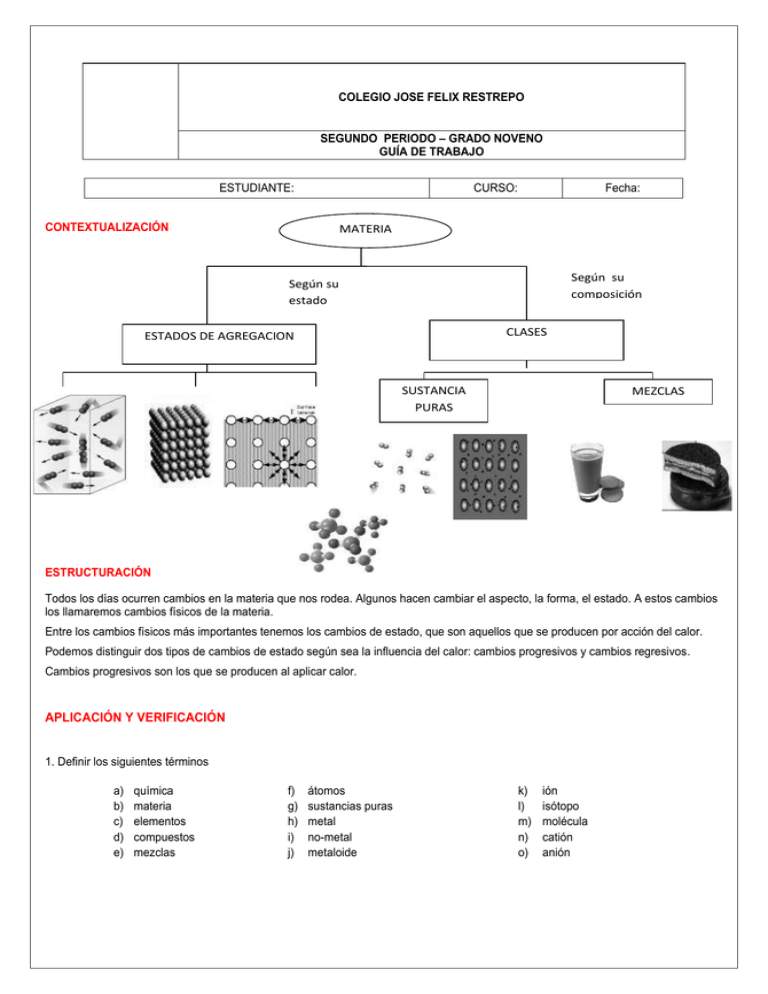
COLEGIO JOSE FELIX RESTREPO SEGUNDO PERIODO – GRADO NOVENO GUÍA DE TRABAJO ESTUDIANTE: CURSO: CONTEXTUALIZACIÓN Fecha: MATERIA Según su composición Según su estado CLASES ESTADOS DE AGREGACION SUSTANCIA PURAS MEZCLAS ESTRUCTURACIÓN Todos los días ocurren cambios en la materia que nos rodea. Algunos hacen cambiar el aspecto, la forma, el estado. A estos cambios los llamaremos cambios físicos de la materia. Entre los cambios físicos más importantes tenemos los cambios de estado, que son aquellos que se producen por acción del calor. Podemos distinguir dos tipos de cambios de estado según sea la influencia del calor: cambios progresivos y cambios regresivos. Cambios progresivos son los que se producen al aplicar calor. APLICACIÓN Y VERIFICACIÓN 1. Definir los siguientes términos a) b) c) d) e) química materia elementos compuestos mezclas f) g) h) i) j) átomos sustancias puras metal no-metal metaloide k) l) m) n) o) ión isótopo molécula catión anión 2. Describir y comparar los estados de la materia. Dar ejemplos 3. Diferenciar entre y dar ejemplos de: a) b) c) d) e) sustancias puras y mezclas mezclas homogéneas y heterogéneas propiedades químicas y físicas propiedades intensivas y extensivas metal, no-metal y metaloides 4. Definir, dar ejemplos y comparar entre cambios físicos y cambios químicos que sufre la materia. 5. Marcar con una cruz en el recuadro en cuál de las casillas clasificarían al material indicado. Lista de materiales Clasificación de los materiales Elemento Compuesto Mezcla agua pura óxido de hierro Aire Zinc Amoníaco diluido agua de la canilla Azufre Leche óxido de nitrógeno cal viva Hidróxido de sodio EXPERIENCIA ACCIÓN Consulta las siguientes páginas http://www.ucm.es/info/diciex/programas/quimica/html/mezcla.htm http://wwwquimikblog.blogspot.com/ Busca todo lo relacionado con la separación de mezclas y presenta un informe donde se incluya una demostración de uno de estos métodos. CONTEXTO Consultar la página http://www.cespro.com/Materias/MatContenidos/Contquimica/QUIMICA_INORGANICA/modelos_atomicos.htm Y con base en la información resolver la actividad ACTIVIDAD N° 2 1 2 3 4 5 6 8 9 10 11 7 HORIZONTALES VERTICALES 4. El primero que comprobó experimentalmente que el átomo 1.Descubridor de los electrones y de su relación carga/masa estaba prácticamente vacío 2.Sueco que da el nombre a la constante en la fórmula de 6. Nombre de una serie del espectro del átomo de hidrógeno Balmer 8 Primer modelo atómico cuantizado 10. Descubridor de la carga del electrón 11. Nombre de una serie del espectro del átomo de hidrógeno 3.Nombre de una de las series del espectro del átomo de hidrógeno 5.Le dieron el Premio Nobel por explicar el efecto fotoeléctrico 7. Nombre de una serie del espectro del átomo de hidrógeno 9. Científico que introdujo el concepto de cuantización 11. Nombre de una serie del espectro del átomo de hidrógeno 2. Según http://www.icarito.cl/vgn/images/portal/FOTO042005/151842926atomos-57k.jpg Defina molécula, átomo, núcleo, protón, neutrón y electrón Consultar http://blog.educastur.es/eureka/2%C2%BA-bac-quim/estructura-de-la-materia/ http://blog.educastur.es/eureka/2%C2%BA-bac-quim/07-distribucion-electronica-y-tabla-periodica/ EVALUACION 1. Los átomos de un mismo elemento químico tienen todos en su núcleo el mismo número de _________ 2. Un átomo tiene 12 protones, 13 neutrones y 12 electrones. ¿Cuál es su número atómico? 3. Los isótopos oxígeno-16, oxígeno-17 y oxígeno-18, se diferencian en: 4. Un átomo de volframio (W) tiene 74 protones y 108 neutrones. ¿Cuál es su representación adecuada? 5. Señala las afirmaciones correctas: a. b. c. d. e. El número másico de un átomo es la suma del número de protones, neutrones y electrones Todos los átomos de un mismo elemento químico tienen el mismo número de neutrones Los isótopos de un elemento químico tienen el mismo número atómico Los isótopos de un elemento químico tienen el mismo número másico Los isótopos de un elemento químico tienen distinto número de neutrones 6. Cuántos electrones poseen los átomos de argón (Ar), de número atómico 18, en su capa o nivel de energía más externo?: a. 2 electrones b. 6 electrones c. 8 electrones d. 18 electrones 7. ¿Cuál de las siguientes configuraciones electrónicas corresponde al átomo de cobre (Cu), de número atómico 29? (En la notación se indican los niveles por números colocados como coeficientes y los índices de las letras indican el número de electrones en ese subnivel): a. b. c. d. 1s2 2s2 2p6 3s2 3p6 3d10 4p1 1s2 2s2 2p6 3s2 3p6 3d10 4s2 1s2 2s2 2p6 3s2 3p6 3d10 4s1 1s2 2s2 2p6 3s2 3p6 4s10 4p2 8. ¿Qué electrones de la corteza de átomo de bromo (Br) influyen más notablemente en sus propiedades químicas?, número atómico 35: a. b. c. d. Los del nivel 2 Los del subnivel 3d Los del orbital 1s Los del nivel 4 9. ¿Qué tienen en común las configuraciones electrónicas de los átomos de Li, Na, K y Rb?: a. b. c. d. Que poseen un solo electrón en su capa o nivel más externo Que poseen el mismo número de capas o niveles ocupados por electrones Que tienen completo el subnivel s más externo Sus configuraciones electrónicas son muy diferentes y no tienen nada en común 10. ¿Qué tienen en común las configuraciones electrónicas de los átomos de Ca, Cr, Fe, Cu y Zn? Señala las afirmaciones correctas: a. b. c. d. Todos tienen el mismo número de capas o niveles ocupados por electrones Tienen el mismo número de orbitales ocupados por electrones Todos tienen el mismo número de electrones en su nivel más externo Tienen pocos electrones en su nivel más externo


