secuencia de adnc que transcribe un arnm que codifica la
Anuncio

19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS C12N 15/82 (2006.01) C12N 9/02 (2006.01) C12N 5/10 (2006.01) G01N 33/50 (2006.01) A01H 5/00 (2006.01) ESPAÑA 12 11 Número de publicación: 2 270 617 51 Int. Cl.: TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99952734 .4 86 Fecha de presentación : 20.10.1999 87 Número de publicación de la solicitud: 1123406 87 Fecha de publicación de la solicitud: 16.08.2001 54 Título: Secuencia de ADNc que transcribe un ARNm que codifica la oxidasa terminal asociada a la biosíntesis de carotenoides y utilizaciones. 30 Prioridad: 20.10.1998 FR 98 13283 73 Titular/es: Universite Joseph Fourier 621, avenue Centrale, Boîte Postale 53 38041 Grenoble Cédex 9, FR 45 Fecha de publicación de la mención BOPI: 01.04.2007 72 Inventor/es: Carol, Pierre; Kuntz, Marcel y Mache, Régis 45 Fecha de la publicación del folleto de la patente: 74 Agente: Curell Suñol, Marcelino ES 2 270 617 T3 01.04.2007 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art. 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. Pº de la Castellana, 75 – 28071 Madrid ES 2 270 617 T3 DESCRIPCIÓN Secuencias de ADNc que transcribe un ARNm que codifica la oxidasa terminal asociada a la biosíntesis de carotenoides y utilizaciones. 5 10 La invención se refiere a una secuencia de ADN (ácido desoxirribonucleico) descrita por la SEC. ID nº: 1, que transcribe un ARNm (ácido desoxirribonucleico mensajero), codificando él mismo la enzima OTBC (oxidasa terminal asociada a la biosíntesis de carotenoides) descrita por la SEC. ID nº: 2, así como a los vectores de transformación de células, de plantas o de fragmentos de plantas, y al procedimiento para modificar la producción de carotenoides en una planta. Los carotenoides son pigmentos lipófilos sintetizados en las plantas, los hongos y las bacterias. En los tejidos fotosintéticos, los carotenoides tienen una función de pigmento accesoria de absorción de la luz y sobre todo de fotoprotección contra los radicales libres, tales como el oxígeno singlete. 15 20 En las plantas y determinados microorganismos, la vía sintética de los carotenoides produce carotenos, xantofilas y sus derivados. Estos compuestos son sintetizados a partir del fitoeno que está modificado mediante reacciones de deshidrogenación sucesivas para producir fitoflueno, zeta-caroteno, neurosporeno después del licopeno. El licopeno se acumula en determinados casos dando por ejemplo el pigmento rojo del tomate, o más generalmente se encuentra en forma modificada por ciclación, para formar el alfa- o beta-caroteno. Estos carotenoides ciclados son los precursores de la vitamina A, y pueden acumularse o producir, mediante reacciones de oxidación, las xantofilas, que son pigmentos amarillos, rosas, naranjas o rojos. 30 Las etapas de deshidrogenación sucesivas del fitoeno están catalizadas de la mayor parte de los microorganismos por una enzima única denominada fitoeno desaturasa CRTI. En las plantas y las cianobacterias, parece que existen dos enzimas. La primera, denominada fitoeno desaturasa (PDS), cataliza la conversión del fitoeno en fitoflueno después en zeta-caroteno. La segunda, denominada zeta-caroteno desaturasa (ZDS), cataliza la conversión de zeta-caroteno en neurosporeno después en licopeno. Cada una de estas reacciones de deshidrogenación necesita la transferencia de dos electrones y dos protones del sustrato hacia un receptor. Estas reacciones de deshidrogenación necesitan por consiguiente enzimas, llamadas estructurales, y cofactores, que son intermedios en las reacciones de oxidoreducción. 35 Los inventores de la presente invención han descubierto un nuevo gen que codifica una enzima denominada OTBC (Oxidasa Terminal asociada a la Biosíntesis de Carotenoides), implicada en la biosíntesis de carotenoides. Parece que esta enzima esté situada en las membranas de los cloroplastos y sea indispensable para el buen funcionamiento de la PDS. 25 Un primer objeto según la invención se refiere por consiguiente a una secuencia de ADN que comprende por lo menos una región codificadora constituida por: 40 45 - la secuencia nucleotídica representada por SEC. ID nº: 1, que transcribe un ARNm, este ARNm codifica la enzima OTBC (Oxidasa Terminal asociada a la Biosíntesis de Carotenoides) descrita por la SEC. ID nº: 2, o su complementaria - cualquier secuencia nucleotídica modificada que presenta, con relación a la SEC. ID nº: 1, una o modificaciones seleccionadas de entre las adiciones, las supresiones y las sustituciones de nucleótidos, presentando esta secuencia modificada con la SEC. ID nº: 1 por lo menos el 70% de identidad y transcribiendo un ARNm codificando el mismo la OTBC descrita por la SEC. ID nº: 2, o codificando una proteína modificada de dicha OTBC, poseyendo dicha proteína modificada una actividad enzimática equivalente a la de la OTBC representada por la SEC. ID nº: 2 o su complementaria. 50 En particular, la invención se refiere a las secuencias que codifican la OTBC del tomate, identificada por la SEC. ID nº: 3, y del pimiento, identificada por la SEC. ID nº: 4, respectivamente, y cualquier secuencia derivada obtenida por modificación de estas secuencias. 55 60 El gen que codifica la OTBC es una doble hélice de ADN, que comprende intrones y exones. La SEC. ID nº: 1 es la cadena complementaria (sin los intrones) o ADNc, que corresponde a la cadena de ADN que transcribe el ARNm que codifica la OTBC. Por actividad enzimática equivalente, se entiende que la enzima, aunque puede ser modificada estructuralmente en alguna de sus partes, no obstante es capaz de modificar su sustrato. Su actividad es sensiblemente la misma de la de la enzima natural. Se comprenderá que esta enzima no puede ser modificada a nivel de su zona activa. De este hecho, cualquier modificación aportada a la secuencia nativa por adición, supresión o sustitución de uno o varios aminoácidos, se entiende que engendra una actividad enzimática equivalente en la medida en que la actividad de la proteína natural no está afectada por estas modificaciones. 65 Por ADN, se puede entender ADN complementario (a ADNc), es decir la copia del ARNm en forma de ADN gracias a la acción de una transcriptasa inversa. La ADNc no comprende los intrones de las secuencias de ADN. 2 ES 2 270 617 T3 5 10 15 Se entiende por “capaz de aparearse” en la presente invención, el hecho de que en las condiciones de hidratación dadas, se emparejan las secuencias nucleotídicas complementarias. El experto en la materia conoce bien, según las condiciones de hibridación utilizadas, cuál es el porcentaje de identidad que las secuencias deben presentar para que pueda realizarse un apareamiento o una hibridación. Las condiciones de severidad para obtener un apareamiento de las secuencias vecinas son por ejemplo una hibridación en el 50% de formamida a 35ºC. Por lo que se refiere a las condiciones de hibridación, se referirá especialmente al artículo “Molecular Cloning, a laboratory manual, segunda edición, Sambrook, Fritch y Maniatis, 1989. Cold Spring Harbor Laboratory Press. Cold Spring Harbor, Nueva York, USA”. Se entiende por “secuencia nucleotídica modificada” en la presente invención, cualquier secuencia nucleotídica que presenta con la secuencia de referencia un grado de identidad inferior al 100%. En una forma de realización preferida según la invención, las secuencias, nucleotídicas modificadas según la presente invención presentan por lo menos el 80% de identidad con la secuencia nucleotídica representada por la SEC. ID nº: 1, o su secuencia complementaria. Se entiende por “identidad de nucleótido”, la comparación, cuando las dos cadenas están alineadas, de la secuencia de nucleótidos idénticos presentados en las dos cadenas. De este hecho se obtiene, volviendo al número de nucleótidos totales, el porcentaje de nucleótidos idénticos, es decir la identidad del nucleótido. 20 Un segundo objeto según la invención se refiere a un ARNm transcrito a partir de la secuencia de ADN según la definición del primer objetivo, o a partir de su complementario. 25 Por “ARNm de cadena complementaria”, se entiende una secuencia de ARN que es complementaria de una secuencia de bases de un ARNm correspondiente, complementaria en el sentido en que cada base (o la mayoría de bases) en la secuencia complementaria (lisándose en el sentido de 3’ hacia 5’) es susceptible de emparejarse con la base correspondiente (G con C, A con U) en la secuencia de ARNm lisándose en el sentido de 5’ hacia 3’. 30 Un tercer objeto según la invención se refiere a una proteína que posee la actividad de la enzima OTDC descrita por la SEC. ID nº: 2, y codificada por una secuencia de ADN tal como la definida anteriormente. 35 Un cuarto objeto según la invención consiste en un ADN recombinado que comprende una secuencia de ADN definida en el primer objeto según la invención, estando dicha secuencia insertada en una secuencia heteróloga, transcribiéndose dichas secuencias completa o totalmente en una secuencia de ARNm que codifica toda o parte de la enzima OTBC, poseyendo esta última una actividad enzimática equivalente a la enzima OTBC de la planta. Por “secuencia heteróloga” se entiende, según la presente invención, cualquier secuencia que pueda ser cortada por enzimas, y que se sirva de este hecho para insertar otras secuencias que presentan diversas actividades. 40 45 50 55 60 65 Ventajosamente, el ADN recombinado definido anteriormente comprende los elementos necesarios para controlar la expresión de la secuencia insertada, especialmente una secuencia promotora y una secuencia de terminación de la trascripción de dichas secuencias. Un quinto objeto según la invención se refiere a un vector de transformación de plantas, adaptado para aumentar la biosíntesis de carotenoides, que comprende toda o parte de la secuencia nucleotídica SEC. ID nº: 1 como se define en el primer objeto según la invención, que codifica toda o parte de una enzima involucrada en la síntesis de los carotenoides, representada por la SEC. ID nº: 2, precedida por un origen de replicación de la transcripción de las plantas, de manera que el vector pueda generar el ARNm en las células de las plantas. La invención puede utilizarse pues para modificar la síntesis de los carotenoides, por ejemplo aumentar o disminuir, es decir interrumpir, la producción de colores asociados a la deshidrogenación del fitoeno. Por ejemplo, la inhibición del color rojo en frutas tales como los tomates, por transformación con un vector que comprende una secuencia complementaria, dado un fruto de un color atractivo próximo al amarillo, como el de determinados pimientos. Existen ya tomates amarillos de esta especie, pero la presente invención proporciona un medio de transferir el color característico en la descendencia, sin que sea necesario un programa de reproducción prolongado y pueda por ello engendrar la alteración de otras características de la planta. El aumento de la síntesis de carotenoides, por transformación con un vector que comprende una secuencia transcrita, puede permitir producir tomates de color más rojo, lo que puede parecer más apetecible al consumidor. La invención puede servir igualmente para introducir un color rojo en el interior de una planta, además de en el fruto. El aumento de la síntesis de los carotenoides en una planta puede efectuarse insertando una o varias copias funcionales del gen del ADN complementario, o el gen completo, bajo el control de un promotor funcional en las células de las plantas. Los vectores de transformación de las plantas para disminuir o interrumpir la síntesis de los carotenoides, es decir los vectores complementarios, pueden ser muy cortos. En una forma de realización preferida, se seleccionará secuencias de bases homólogas que posean una longitud de por lo menos 10 bases. No existe límite superior teórico para la secuencia de bases, puede ser tan larga como el ARNm producido por la planta. En una forma de realización muy preferida, se utilizarán sin embargo secuencias de longitud comprendida entre 100 y 1.000 bases. 3 ES 2 270 617 T3 5 10 15 20 25 30 35 Se sabe que las plantas mutantes en las que el gen OTBC es inactivo presentan un aspecto veteado, las plantas son verdes y blancas. Se propone una aplicación de la estrategia de cadena complementaria, que está orientada a eliminar la producción de ARNm y por consiguiente la proteína OTBC, que estaría orientada a producir plantas con follaje veteado como por ejemplo plantas ornamentales, del tipo Nicotiana o Petunia o cualquier otra planta ornamental, que se preste a la transformación genética y que podría recibir una construcción complementaria con el fin de impedir la producción de la proteína OTBC. Los productos de recombinación del ADN pueden ser preparados utilizando técnicas normalizadas. Por ejemplo, la secuencia de ADN que debe transcribirse puede obtenerse tratando un vector que contiene dicha secuencia con enzimas de restricción para cortar el segmento apropiado. La secuencia de ADN de transcripción puede asimismo ser engendrada ciclando y ligando oligonucleótidos sintéticos o utilizando oligonucleótidos sintéticos en una PCR (“Polymerase Chain Reaction”) para engendrar secuencias de restricción en cada extremo. La secuencia de ADN se clona entonces en el interior de un vector que contiene una secuencia promotora de iniciación y una secuencia de terminación. Si se desea obtener una secuencia de ADN complementario, la clonación se efectuará de manera que la secuencia de ADN cortada esté invertida con relación a su orientación en la cadena de la que se ha cortado. En un producto de recombinación que expresa un ARN complementario, la cadena que era inicialmente la cadena matriz se convierte en la cadena codificante, y viceversa. El producto de recombinación transcribirá de este hecho un ARNm cuya secuencia de bases es complementaria de toda o parte de la secuencia del ARNm de la enzima. De este hecho, las dos cadenas de ARN son complementarias no solamente en sus secuencias de bases sino igualmente en su orientación (5’ hacia 3’). En un producto de recombinación que expresa un ARN transcrito, la matriz y sus cadenas transcritas conservan la orientación del gen inicial de la planta. Los productos de recombinación que expresan el ARN transcrito transcriben un ARNm que presenta una secuencia de bases que es homóloga en su totalidad o en parte con la secuencia del ARNm. En los productos de recombinación que expresan la enzima fuincional, la zona codificante completa del gen está religada a las secuencias de control de transcripción susceptibles de expresarse en la planta. Por ejemplo, los productos de recombinación según la presente invención pueden ser preparados como se describe a continuación. Un vector adaptado que contiene la secuencia de bases deseada para la transcripción, tal como especialmente un clon del ADN complementario de OTBC, se trata con enzimas de restricción para cortar la secuencia. Se clona a continuación el ADN obtenido de este modo, en una orientación inversa si se desea, en un segundo vector que contiene la secuencia promotora deseada y la secuencia de terminación deseada. Entre los promotores adaptados, se puede citar el promotor denominado 35S del virus del CaMV, a título de ejemplo de promotor considerado como constitutivo, el promotor del gen de la poligalacturonasa del tomate (véase Bird et al., 1998, Plant Molecular Biology, 11:651-662) como ejemplo de promotor implicado en la regulación de los frutos; o incluso el promotor del gen de la pequeña subunidad de la ribulosa bis-fosfato carboxilasa, como ejemplo de promotor expresado en los tejidos verdes. Las secuencias de terminación comprenden el terminador NOS del gen de nopalina sintetasa. 40 45 50 Puede ser interesante modificar la actividad enzimática de la planta solamente durante el desarrollo y/o la maduración de los frutos. La utilización de un promotor constitutivo tenderá a modificar la tasa y la actividad de las enzimas en todas las partes de la planta transformada, mientras que la utilización de un promotor específico en un tejido controlará de manera más selectiva la expresión del gen y modificará la actividad, por ejemplo la coloración de los frutos. De este hecho, poniendo en práctica la invención, por ejemplo en los pimientos, será conveniente utilizar un promotor que permitirá la expresión específica en el curso del desarrollo y/o la maduración de los frutos. Por último, el ARN transcrito o complementario será entonces producido solamente en los órganos de la planta donde se desea que tenga una acción. Entre los promotores específicos del desarrollo o de la maduración de los frutos que pueden ser utilizados, se puede citar el promotor de estimulación de la poligalacturonasa (solicitud de patente internacional publicada con el número WO-A-92/08798), el promotor E8 (Dieckman y Fiscer, 1998, EMBO, 7:3315-3320) y el promotor específico de frutos 2A11 (Pear et al., 1989, Plant Molecular Biology, 13:639-651). Un sexto objeto según la invención se refiere a una célula de planta transformada mediante un vector definido en el quinto objeto según la invención. 55 60 65 El experto en la técnica de la ingeniería genética vegetal conoce bien actualmente las diferencias técnicas de la obtención de plantas genéticamente modificadas. Se sabe que la pared vegetal constituye una barrera mecánica natural especialmente eficaz a la penetración de cualquier material extraño en la célula y, en especial, a la del ADN. Las diferentes técnicas específicas de introducción del ADN en la célula vegetal son por ejemplo la utilización de la bacteria Agrobacterium tumefaciens, la electroporación de protoplastos, la microinyección del ADN desnudo, la utilización del disparador de partículas o biolística o la transformación de protoplastos. A fin de poder seleccionar las células transformadas de manera efectiva, se introduce, además del gen que codifica el carácter que se investiga, un gen marcador. Se seleccionará preferentemente un gen que comunique una resistencia a un antibiótico. Las células se seleccionan a continuación para el cultivo en el medio que contiene este antibiótico. Sólo las células que poseen el gen con resistencia podrán multiplicarse. La presencia del gen de interés puede comprobarse igualmente mediante la hibridación con el ADN complementario del ADN introducido. 4 ES 2 270 617 T3 5 10 15 20 La producción de recombinación según la invención se transfiere al interior de una célula de la planta diana. La célula de la planta diana puede ser una parte de una planta completa o puede ser una célula aislada o parte de un tejido que puede ser regenerado en el interior de una planta completa. La célula de una planta diana puede seleccionarse de entre cualquier especie de planta monocotiledónea o dicotiledónea. Las plantas adaptadas que comprenden cualquier planta con frutos, tales como especialmente los tomates, los mangos, los melocotones, las manzanas, las peras, las fresas, los plátanos, los melones, los pimientos, los pimientos dulces, el pimiento de España, las plantas con hojas, flores o cualquier otro órgano en los que se desee modificar el contenido en carotenoides. Los productos de recombinación según la invención pueden ser utilizados para transformar cualquier planta, utilizando cualquier técnica adaptada para transformar plantas según la invención. Las células de las plantas monocotiledóneas y dicotiledóneas pueden ser transformadas de diferentes maneras conocidas por el experto en la materia. En la mayor parte de los casos, las células de estas plantas, particularmente cuando son células de plantas dicotiledóneas, pueden ponerse en cultivo para generar una planta completa que se reproduce a continuación engendrando generaciones sucesivas de plantas modificadas genéticamente. Puede utilizarse cualquier procedimiento adaptado para la transformación de las plantas. Por ejemplo, plantas dicotiledóneas, tales como el tomate y el melón, pueden ser transformadas utilizando el plásmido Ti Agrobacterium. Dichas plantas transformadas pueden reproducirse por cruzamiento, o por cultivo de la célula o del tejido. Un séptimo objeto según la invención se refiere a una planta, o fragmento de la planta, especialmente fruto, grano, pétalo, hoja, que comprenda células definidas según el sexto objeto de la invención. Las plantas o fragmentos de plantas, genéticamente modificadas según la invención con un vector que comprende una secuencia transcrita, especialmente para aumentar la producción de carotenoides, comprenden una tasa elevada en precursor de la vitamina A con relación a la tasa normal producida por la planta. 25 30 35 40 45 50 55 Los carotenoides, además de su función en el color de la planta, ejercen igualmente una función de protección de las plantas contra los daños que pueden producir una elevada intensidad luminosa. De este hecho, las plantas, que contienen por modificación genética una tasa muy elevada de estos carotenoides, pueden presentar un gran interés para las zonas en las que se efectúa el cultivo con cambios de temperatura importantes. Las plantas modificadas genéticamente pueden presentar colores diferentes, según haya aumentado o disminuido la síntesis de carotenoides. Más especialmente, los productos de recombinación de OTBC pueden utilizarse para estimular o inhibir la producción de colores asociados a los carotenoides producidos en reacciones de desaturación, por ejemplo un rojo de licopeno, o derivados de productos como el color amarillo/naranja asociado al beta-caroteno. La estimulación de la producción de los beta-carotenos, con un producto de recombinación transcrita de sobreexpresión, puede permitir producir pimientos de color amarillo/anaranjado, o bien de un color determinado por un derivado de los beta-carotenos tal como un rojo más intenso, por el hecho de la biosíntesis de capsorrubina o de capsantina. Los pimientos obtenidos se demuestra que son más apetecibles para el consumidor. Como ejemplo de plantas genéticamente modificadas según la presente invención, se citarán más especialmente las plantas con frutos. Los frutos de estas plantas pueden ganar en atractivo para el consumidor, estimulando o intensificando en el interior un color específico. Como otras plantas que pueden ser modificadas genéticamente, se pueden citar los tubérculos tales como los rábanos, los nabos y las patatas, incluso los cereales tales como el maíz, el trigo, la cebada y el arroz. Las plantas modificadas genéticamente según la invención, pueden contener igualmente otros productos de recombinación, por ejemplo productos de recombinación que tengan otros efectos, especialmente en la maduración de los frutos. Por ejemplo, los frutos que poseen un color muy intenso, modificado según la presente invención, pueden contener igualmente productos de recombinación, ya sea los que inhiben la producción de determinadas enzimas tales como la poligalacturonasa y la peptinaesterasa, ya sea los que interfieren con la producción de etileno. Los frutos que contienen estos dos tipos de productos de recombinación pueden engendrarse, ya sea mediante transformaciones sucesivas, ya sea cruzando dos variedades que contienen cada una uno de los productos de recombinación, seleccionando a continuación de entre la descendencia los que contienen los dos productos de recombinación. El octavo objeto de la invención se refiere a un procedimiento para modificar la producción de carotenoides en una planta, ya sea aumentando la producción de carotenoides, o disminuyendo o inhibiendo la producción de carotenoides por la planta, en relación con el contenido normal de carotenoides producidos por la planta, comprendiendo dicho procedimiento la transformación de células de dichas plantas que deben transformarse con un vector definido en el quinto objeto según la invención. 60 Un noveno objeto según la invención se refiere a un procedimiento para producir carotenoides en una célula de la planta, o eucariota u procariota, comprendiendo dicho procedimiento la transformación de las células de dichas plantas, de las células eucariotas o procariotas que deben transformarse con un vector definido en el quinto objeto según la invención. 65 Los beta-carotenos, producidos por un organismo eucariota o procariota que expresa un producto de recombinación que codifica la enzima OTBC, pueden ser extraídos para ser utilizados como colorante, antioxidante o precursor de la vitamina A. 5 ES 2 270 617 T3 5 Por último, la invención se refiere también a un procedimiento para la selección del compuesto que presenta un herbicida característico según el cual se pone en contacto dicho agente con células o membranas de las células, especialmente células de la invención, y se observa una disminución del consumo de oxígeno por las membranas de dichas células, ligadas a la inhibición de la oxidasa terminal asociada a la biosíntesis de carotenoides. Las técnicas apropiadas para efectuar esta observación se ilustran especialmente en el ejemplo 6. La figura 1 presenta la secuencia de ADNc y la secuencia de aminoácidos correspondiente a la OTBC. El péptido Nterminal del transcrito potencial del cloroplasto está subrayado. El punto probable de escisión está indicado mediante un asterisco (*). Los triángulos blancos indican la posición de los intrones. 10 La figura 2 muestra la comparación entre la proteína OTBC y la proteína AOX del grano de soja. (+) indica los aminoácidos similares. Los aminoácidos encuadrados forman parte de los dominios previstos en la hélice de la transmembrana. Los motivos de enlace del hierro están subrayados. 15 20 La figura 3 presenta la alineación de las secuencias en los aminoácidos para el tomate (T), el pimiento dulce (P) y Arabidopsis (A) y la secuencia de consenso. En esta secuencia de consenso, los aminoácidos conservados están indicados en letras mayúsculas y los aminoácidos relativamente conservados están indicados en letras minúsculas. La figura 4 representa el consumo de oxígeno en las membranas celulares de E. coli para las células testigo transformadas por un vector de clonación de la invención y para la células que expresan el producto del gen “IMMUTANS” (plastid terminal oxidase). Ejemplo 1 25 Detalle de la clonación del locus que codifica la proteína OTBC 1 - Aislamiento del mutante 30 35 Se ha provocado la mutación mediante la utilización de un transposón introducido en el genoma de la planta Arabidopsis thaliana cultivar landsberg-erecta. Esta técnica se describe ampliamente en un artículo (Long D., Martin, M., Sundberg, E., Swinburne, J., Puangsomlee P. y Coupland, G. (1993) The maize transposable element system Ac/Ds as a mutagen in Arabidopsis: Identification of an albino mutation induced by Ds insertion. Pro. Natl. Science USA, 10, 10370-10374) y ha sido puesta en práctica por otros en el laboratorio de George Coupland en el John Innes Centre for Plant Science, Colney, Norwich, NR47UH, Nordwich, Gran Bretaña. La transposición del elemento Disociador (Ds) móvil utilizado aquí ha sido desencadenada por la producción de la proteína transposasa (o transposasa del elemento promotor, Ac). 40 45 Entre la descendencia de una planta que ha sufrido la transposición del elemento Ds, se han identificado varias plantas en el aspecto mutante albino, diferentes de la silvestre por ausencia de pigmentación verde (clorofila). Se ha identificado asimismo plantas de aspecto silvestre pero que transmiten la mutación a su descendencia. Estas plantas están identificadas como heterozigotos, llevando la mutación en un solo cromosoma. Las plantas homozigóticas tienen un fenotipo mutante y llevan la mutación en los dos cromosomas homólogos. 2 - Ensayo de unión de la mutación al elemento móvil Ds 50 55 Esta experiencia ha sido realizada con el fin de probar que la mutación observada está producida por la inserción del elemento Ds en un gen necesario para el buen funcionamiento de la planta y de su aspecto silvestre. El elemento móvil, o transposón, Ds, está construido de manera que lleva un gen resistente al antibiótico higromicina (descrito en las referencias anteriores). Se ha hecho brotar la descendencia de 35 plantas heterozigóticas que llevan la mutación albina sobre un medio gelatinoso que contiene una dosis letal de higromicina, todas las plantas que llevan la mutación son asimismo resistentes a la higromicina. Se concluye que la mutación está ligada al gen resistente que lleva el transposón. Se ha aislado una parte del ADN de la planta resistente al antibiótico higromicina, yuxtaponiendo el transposón. Esto se ha hecho según el método IPCR o PCR inversa descrito en las referencias anteriores. 60 Mediante el experimento conocido como “transferencia Southern” se ha resaltado que las líneas que llevan la mutación presentan una alteración del ADN genómico. Esta alteración se pone de manifiesto cuando se utiliza como “sonda” la fracción del ADN aislada yuxtaponiendo el transposón. 65 3 - Aislamiento del gen Utilizando un método de cribado del banco genómico de ADN, se ha aislado un clon que contiene un fragmento del ADN genómico que puede contener la versión silvestre inalterada del gen interrumpido en el mutante. 6 ES 2 270 617 T3 Se ha construido el banco de ADN cribado. Se describe en la publicación de Whitelam, G. C., Johnson, E., Peng, J., Carol, P., Anderson, M. L., Cowl, J. S. y Harberd, N. P. (1993) Phytochrome A null mutants of Arabidopsis display a wild-type prenotar sin hite lignito. The Planta Cell 5, 757-768. 5 10 Se ha determinado la secuencia total de un fragmento de restricción obtenido por digestión ofimática del clon del ADN genómico por la enzima EcoR I. La secuencia obtenida comprende 3.000 pares de bases. Entre estas 3.000 pares de bases, se encuentra una parte idéntica a la secuencia del fragmento límite aislado previamente, confirmando la identidad entre el ADN aislado y el gen interrumpido por el transposón. 4 - Aislamiento y caracterización de la secuencia codificadora Se ha utilizado un banco de ADNc, que es un banco comercial suministrado por CLONTECH Laboratories, Inc. Se trata de un banco de ADNc construido a partir de extractos de ARNm de Arabidopsis thaliana, transformados en ADNc, clonados a continuación en el vector plasmídico pGAD10. 15 A partir de este banco de datos de ADNc, y según las técnicas habituales, utilizando el gen identificado anteriormente como sonda, se ha aislado varios clones que contienen un ADNc de un tamaño de aproximadamente 1.400 pares de bases. 20 Se ha determinado la secuencia total del ADNc y demuestra que ésta está comprendida en su totalidad en el fragmento de ADN genómico identificado anteriormente. Se ha colocado la parte codificadora (o exones) y la parte no codificadora (intrones) del gen en la secuencia del gen. El gen lleva 9 exones y 8 intrones. La inserción del transposón Ds está identificada al principio del segundo exón e interrumpe por lo tanto la parte codificadora del gen. 25 La secuencia del ADNc presenta un codón de partida potencial seguido de un marco de lectura abierto de 350 aminoácidos, que codifica una proteína potencial de 39 kDa denominada OTBC. Una investigación de la homología utilizando el programa blastp [(Altshul et al. (1997), Gapped BLAST and PSI-BLAST: a new generation of protein database search programs Nucleics Acids Res. 25, 3389-3402] ha puesto de manifiesto una homología débil pero significativa con los polipéptidos que pertenecen a la familia de las proteínas oxidasa alternativa o terminal oxidasa de mitocondrias (AOX). No se ha encontrado ninguna otra homología significativa. La homología comienza en el aminoácido 111 y presenta 29% de identidad (45% de similitud) con la oxidasa de soja. A pesar de la débil identidad con la proteína AOX, una investigación por ordenador de las estructuras secundarias y de los dominios potenciales de la significación biológica ha puesto de manifiesto una similitud estructural entre la proteína OTBC y AOX. Los dominios en hélice de transmembrana encontrados en AOX están situados en posiciones similares sobre la secuencia peptídica de OTBC, lo que sugiere una localización membranosa de OTBC y asimismo una configuración similar a la de AOX en la membrana. Además, un motivo de enlace del hierro se encuentra conservado entre OTBC y AOX. La alineación de las secuencias entre las proteínas OTBC y AOX muestra una inserción de 19 aminoácidos en la proteína OTBC que corresponde a una parte de los exones 7 y 8. 30 35 40 45 La secuencia N-terminal de la proteína OTBC presenta las características de un péptido de señal del cloroplasto, que es rico en leucina, arginina y serina/treonina. Un análisis por ordenador del potencial péptido de señal (programa informático psort, Nakai y Kanehisa, 1992) ha sugerido una diana posible de OTBC a nivel de los compartimentos de los tilacoides del cloroplasto. 5 - Identificación de la mutación El aspecto del mutante es próximo al de un mutante ya descrito en la bibliografía: el mutante “immutans”, Wetzel C. M., Jiang C-Z., Meehan L. J., Voytas D. L., Rodermel S. R. (1994) Nuclear-organelle interactions: the immutans variegation mutant of Arabidopsis is autonomous and impaired in carotenoid biosíntesis, Plant Journal 6, 181-175. 50 Se ha cruzado el mutante “immutans” (alelo moteado, de la referencia anterior) con el que se ha aislado según la invención. La descendencia del cruzamiento es de aspecto mutante, que es un resultado alcanzado si las dos mutaciones afectan al mismo gen. Se ha podido afirmar pues que el gen identificado corresponde a la versión silvestre del locus IMMUTANS y el mutante obtenido lleva una versión interrumpida del gen cuyo producto es entonces inactivo. 55 El primer objeto de la presente invención se distingue por consiguiente del mutante anterior, porque codifica una proteína que presenta una actividad ofimática idéntica o equivalente a la de la OTBC, aunque el producto codificado por “immutans” no tiene actividad. 60 Ejemplo 2 Construcción de un vector de la invención por introducción del ADNc que codifica la OTBC del pimiento en un vector de expresión de plantas 65 El vector pBI121 (comercializado por Clontech Laboratories, Inc.) es un vector adaptado a esta construcción. Conlleva una zona T-ADN que la bacteria Agrobacterium tumefaciens puede transferir en el genoma de las plantas. Esta zona T-ADN conlleva, entre otros, un promotor constitutivo (el promotor denominado 35S del virus CaMV), el 7 ES 2 270 617 T3 gen GUS seguido del terminador NOS (del gen de nopalina sintetasa). El gen GUS que no presenta ningún interés para la invención, se sustituye por un ADNc que codifica la OTBC. Este ADNc se dispondrá por consiguiente bajo el control del promotor 35S y del terminador NOS. 5 Cualquier otro promotor constitutivo o no (en este último caso, deberá ser específico del órgano del que se desea modificar las propiedades) y cualquier otro terminador son igualmente utilizables. Un ADNc que codifica la OTBC ha sido subclonado originalmente en la secuencia de restricción Notl del plásmido bacteriano pBluescript KS: de este modo se han flanqueado las secuencias de los cortes BamHI en 5’ y SacI en 3’. 10 Este ADNc es escindido del plásmido pBluescript KS por las enzimas de restricción BamHI y SacI. Este fragmento BamHI-SacI se inserta en el vector pBI121 cortado por estas enzimas: la secuencia BamHI se encuentra en 3’ del promotor 35S y en 5’ del gen GUS, la secuencia SacI se encuentra en 3’ del gen GUS y en 5’ del terminador NOS. 15 Después de la ligadura, se seleccionan los derivados del vector pBI121 en el que el ADNc que codifica la OTBC (es decir sin intrón) ha sustituido al gen GUS. Ejemplo 3 20 Transformación de una célula vegetal para obtener una célula transformada de la invención El vector de transformación de la planta derivado de pBI121 obtenido en el ejemplo 2 se introduce en la cepa LBA4404 de Agrobacterium por electroporación. La cepa recombinante se selecciona en presencia de 50 µg/ml de kanamicina. 25 Esta cepa transformada de Agrobacterium se utiliza para la transformación de células de plantas, por ejemplo de tabaco. 30 35 40 La técnica utilizada con este fin y que puede ser sustituida por cualquier otra técnica de transformación, es la de la infección de discos foliares de plantas de tabaco cultivados in vitro. Las células transformadas de plantas se seleccionan en presencia de kanamicina. El antibiótico cefotaxima elimina Agrobacterium. Los discos foliares se cultivan en medio de cultivo vegetal en presencia de hormonas vegetales (auxina y citoquininas) que favorecen el crecimiento de callos. Los callos resultantes del crecimiento de las células transformadas se utilizan para la regeneración de plantas completas por las técnicas clásicas. Por ejemplo, los callos son transferidos al medio de cultivo vegetal en presencia de citoquinina para provocar la formación de brotes. Estos se cortan a continuación y se transfieren al medio de cultivo vegetal sin hormona a fin de regenerar las raíces. Los antibióticos kanamicina (para seleccionar el crecimiento de los tejidos transformados) y cefotaxima (para eliminar completamente Agrobacterium) se mantienen durante todas las fases del cultivo. Las plantas transformadas se ponen en el cultivo de forma estéril en presencia de kanamicina y cefotaxima a continuación se transfieren a la tierra y se cultivan en un invernadero hasta la cosecha de las semillas. La presencia del transgén se ha confirmado por hibridación del ADN genómico de estas plantas con una sonda específica resultante del vector de transformación utilizado. Ejemplo 4 45 Clonación y caracterización de ADNc de frutos de pimiento y de tomate correspondientes a la enzima oxidasa terminal asociada a la biosíntesis de carotenoides (OTBC) 50 55 Se ha utilizado el fragmento de ADNc de “immutans” de Arabidopsis que codifica el péptido OTBC maduro como sonda para investigar un banco de ADNc de pimiento verde o rojo en condiciones no severas. Todos los clones positivos que se han analizado, parece que se derivan del mismo gen, como lo sugieren las secuencias idénticas observadas en la zona no traducida en 3’. La secuencia de ADN del clon completo está presente en la lista de secuencias bajo el indicador SEC. ID nº: 3. La secuencia deducida en aminoácidos se presenta en la lista de secuencias con el indicador SEC. ID nº: 4. El ADNc de pimiento se ha utilizado a continuación para aislar el ADNc correspondiente a partir de un banco de ADNc de tomate rojo (SEC. ID nº: 5). La figura 3 presenta la comparación entre la secuencia deducida en aminoácidos citada anteriormente y las secuencias de la OTBC de pimiento y de Arabidopsis. 60 Los péptidos de señal utilizados para el reconocimiento de los plástidos han puesto de manifiesto una similitud de secuencia, a excepción de la zona N-terminal y de la zona cerca del punto de escisión supuesto (ATR/Q-AT). Los polipéptidos de OTBC maduro comparten por lo tanto una fuerte similitud de secuencia, lo que significa que presentan las mismas propiedades. 65 Una alineación de las secuencias de la OTBC ha puesto de manifiesto además la presencia de dos dominios de transmembrana potenciales conservados, separados por un segmento hidrófilo muy conservado. El dominio N-terminal es esencialmente hidrófilo y contiene un segmento largo de aminoácidos poco conservados. El dominio C-terminal es también principalmente hidrófilo y contiene un motivo (EAEH) conservado que concuerda con un supuesto punto de 8 ES 2 270 617 T3 fijación del hierro (ExxH). Además, la zona contiene 6 restos de cisteína conservados en la OTBC, mientras que el resto del polipéptido está desprovisto de restos de cisteína. Algunos de estos restos de cisteína pueden estar implicados en la dimerización covalente de la proteína. 5 Ejemplo 5 Expresión de los genes de la OTBC en el curso de la maduración de la fruta en el pimiento y el tomate 10 15 20 A fin de definir el mecanismo de expresión de los genes de la OTBC, se ha extraído el ARN total del fruto en diferentes fases de maduración. El mecanismo de expresión ha sido determinado por transcriptasa inversa del ARN completo, seguido de una reacción de polimerización en cadena (RT-PCR). El gen de la OTBC se expresa en el transcurso del desarrollo y de la maduración del fruto para el pimiento. Además, existe un mecanismo de expresión similar al de los genes que codifican las carotenoide-desaturasas, es decir la fitoeno-desaturasa y la zeta-caroteno-desaturasa. Se observa un aumento de la tasa de transcripción entre la fase verde no madura y la fase verde madura (fruto de tamaño adulto), seguido de otro aumento entre la fase verde madura y la fase de degradación (signos visibles precoces de cambio de color). La tasa de transcripción permanece a continuación bastante constante (con una ligera disminución en el transcurso de la etapa de enrojecimiento). El gen de la OTBC se expresa asimismo durante el desarrollo y la maduración del fruto en el tomate. 25 30 35 En el tomate, presenta también un mecanismo de expresión similar al de los genes que codifican las carotenoidedesaturasas (fitoeno-desaturasa y zeta-caroteno-desaturasa). Se observa un aumento de la tasa de transcripción entre la fase verde no madura y la fase verde madura (fruto de tamaño adulto), seguido de otro aumento más fuerte entre la fase verde madura y la fase de degradación. Cuando la huella de la proteína de los frutos del pimiento y del tomate se ha buscado, utilizando anticuerpos dirigidos contra la OTBC, este polipéptido se ha encontrado en diferentes fases de desarrollo del fruto. Estos ensayos han puesto en evidencia un aumento de la tasa de la proteína OTBC, desde la fase verde madura hasta la fase de degradación. Esta tasa de proteína ha quedado elevada en el transcurso de la maduración del fruto. Estos resultados demuestran que los genes de la OTBC se expresan y que la proteína OTBC está presente en el fruto. De manera análoga a las enzimas estructurales que intervienen en la desaturación de los carotenoides, el gen de la OTBC se induce y las proteínas se acumulan en el transcurso de la maduración cuando aumenta la biosíntesis de los carotenoides. 40 Los resultados expuestos en la descripción evidencian que la OTBC es un elemento del sistema de la biosíntesis de los carotenoides. 45 Se puede considerar la utilización de la proteína OTBC para modificar la biosíntesis de los carotenoides, especialmente en los tejidos o las células vegetales o en las bacterias que presentan un sistema de biosíntesis de carotenoides poco eficaz o ineficaz. La OTBC podría ser producida al mismo tiempo que las enzimas estructurales de la biosíntesis de los carotenoides para aumentar la eficacia de la producción de carotenoides. Ejemplo 6 Propiedades catalíticas de la OTBC analizadas después de su expresión en E. coli 50 Se ha insertado un producto de síntesis constituido por la región codificadora del polipéptido maduro OTBC de Arabidopsis en un vector de expresión procariota (tal como pQE31, comercializado como QIAGEN, entendiéndose que cualquier otro vector conduciría a resultados idénticos). 55 60 La región codificadora destinada a ser insertada en el vector de expresión puede ser obtenida por escisión con ayuda de enzimas de restricción que intervienen junto a los codones correspondientes al punto de escisión del péptido de señal. Alternativamente, puede efectuarse una ampliación para PCR de la región codificadora. Los oligonucleótidos siguientes se utilizarán con ventaja para la ampliación de la secuencia de la OTBC de Arabidopsis: 5’-GCAACGATTTTGCAAGACG-3’ y 5’-TTAACTTGTAATGGATTTCTTGAG-3’ 65 También pueden emplearse otros productos de ensamblado que conllevan la región codificadora para la OTBC en otras especies (como el pimiento o el tomate). 9 ES 2 270 617 T3 5 10 15 20 25 30 35 40 45 50 55 60 Estos plásmidos pueden ser introducidos en las células de E. coli según las técnicas clásicas. A fin de obtener la proteína recombinante en E. coli, se cultivan las células en las condiciones siguientes: 10 ml de un precultivo de toda la noche en un medio enriquecido se depositan en 300 ml de medio M9 (Na2 HPO4 34 mM, KH2 PO4 22 mM, NH4 Cl 18 mM, NaCl 8,5 mM, MgSO4 1 mM, CaCl2 0,1 mM, tiamina 1 mM) que contiene 0,2% de glicerol y el aporte en antibiótico necesario para interrumpir el crecimiento de las células que han perdido el plásmido. El desarrollo de bacterias se continúa a 37ºC en agitación intensa hasta la fase de desarrollo semiexponencial, preferentemente hasta la lectura de una densidad óptica de 0,3 a 600 nm. Tras la producción de este gen híbrido para el inductor IPTG y la adición de FeSO4 a 1 mg/l, el cultivo se mantiene a 25ºC en agitación intensa durante 3 horas. Las células se recogen a continuación por centrifugación a 4ºC, se lavan con MgCl2 10 mM, sacarosa 0,75 M, Tris-HCl 20 mM, a pH 7,5, y de nuevo se centrifugan. Las células se ponen a continuación en suspensión en sacarosa 0,75 M, Tris-HCl 20 mM, a pH 7,5, y se lisan por adición de lisozima (0,2 mg/ml) y EDTA (25 mM) a 30ºC durante 30 minutos, después se someten a un choque osmótico por adición de dos volúmenes de agua, después se tratan con ultrasonidos a 0ºC. Una centrifugación normal en una centrifugadora de velocidad lenta permite eliminar las células no lisadas y los residuos. Una centrifugación a gran velocidad (por ejemplo en un rotor 50Ti de Beckman a 40.000 revoluciones/min) a 4ºC conduce a la obtención de una membrana que se pone en suspensión en sacarosa 0,75 M, Tris-HCl 20 mM, a pH 7,5, y se mantiene a 4ºC. Para probar la actividad ofimática de la OTBC, se mide el consumo de oxígeno por las membranas resultantes con ayuda de un electrodo de oxígeno normal y se expresa en nmoles de 02 consumidos por minuto y por gramo de proteína. Como muestra la Figura 4, la adición de NADH provoca el consumo de oxígeno a la vez en la membrana testigo (transformada por el vector de clonación) y en la membrana que contiene la OTBC. Este consumo de oxígeno aumenta cuando se añade platoquinona 0,2 mM. La adición de KCN inhibe fuertemente el consumo de oxígeno en las membranas testigo. En las membranas que contienen OTBC, se observa un consumo de oxígeno resistente a cianuro elevado. Esto refleja la actividad de oxidorreductasa platoquinol: oxígeno de OTBC, cuya actividad puede ser inhibida por adición de galato de n-propilo (nPG) 0,5 mM. La adición de nPG (0,5 mM) a la membrana testigo antes de KCN no produce el efecto que indica que el compuesto no interfiere con el flujo normal de electrones en las membranas de E. coli (Figura 4). Esta prueba puede utilizarse para estudiar el poder inhibidor de un compuesto sobre la actividad de la OTBC. Así un inhibidor puede ser controlado cuando no hay efecto sobre la cadena respiratoria endógena de E. coli, en particular sobre el complejo I de la cadena que oxida a NADH. No obstante, si se da este caso, NADH puede ser sustituido por el succinato como donante de electrones sin pasar por el complejo I. Cualquier inhibidor de actividad de la OTBC puede probarse en plantas apropiadas, mediante riego del suelo, adición de un medio de cultivo y colocación directa en las hojas, frente a la inhibición de la biosíntesis de los carotenoides que lleva consigo un blanqueamiento y por lo tanto encontrar una aplicación como herbicida. El ensayo descrito puede modificarse para realizar un reconocimiento a gran escala de los inhibidores de la actividad de la OTBC, y su aplicación como herbicida. En este caso, la medición del consumo de oxígeno con ayuda de un electrodo de oxígeno será preferentemente sustituida por otro método de medición. La actividad de oxidasa de OTBC puede determinarse midiendo el consumo de NADH en el transcurso de la reacción, por ejemplo, por electrofotometría, midiendo la absorbancia a 340 nm. El consumo de NADH y la producción de NAD en el transcurso del ensayo debe llevar consigo una disminución de la absorbancia a 340 nm. Alternativamente, puede utilizarse cualquier coloración específica de NAD o de NADH para controlar los cambios de NAD o de NADH durante el ensayo. Si se utiliza el succinato como donante de electrones, en el ensayo, la actividad respiratoria de las membranas bacterianas conducirá a la oxidación del succinato en fumarato. A continuación la actividad de la OTBC podrá prolongarse en presencia de KCN, midiendo las concentraciones en succinato y fumarato que evolucionan en el transcurso el ensayo. Según otra posibilidad, puede utilizarse un donante artificial de electrones. El meto-sulfato de feazina (PMS) es un ejemplo. Puede oxidarse mediante la succinato deshidrogenasa de las membranas bacterianas; es incoloro en estado reducido y es de color amarillo en estado oxidado. Las muestras de membrana bacteriana que contienen la OTBC van a oxidar el PMS en presencia de KCN. Un inhibidor de actividad de OTBC impedirá la aparición del color amarillo debido a la oxidación del PMS. Esta prueba de puesta en práctica sencilla puede realizarse en las cajas multipocillos que permiten realizar un seguimiento en masa de las moléculas susceptibles de inhibir la actividad de la OTBC. 65 10 ES 2 270 617 T3 REIVINDICACIONES 1. Secuencia de ADN que comprende por lo menos una región codificadora constituida por: 5 10 - la secuencia nucleotídica representada por la SEC. ID nº: 1, que transcribe un ARNm, codificando este ARNm la enzima OTBC (Oxidasa Terminal asociada a la Biosíntesis de Carotenoides) descrita por la SEC. ID nº: 2, o su complementaria. - cualquier secuencia nucleotídica modificada: que presenta, con relación a la SEC. ID nº: 1, una o más modificaciones seleccionadas de entre las adiciones, las supresiones y las sustituciones de nucleótidos, 15 que presenta con la SEC. ID nº: 1 por lo menos 70% de identidad, y que transcribe un ARNm que codifica él mismo la OTBC descrita por la SEC. ID nº: 2, o una proteína modificada de dicha OTBC, presentando una actividad ofimática equivalente a la de la OTBC descrita por la SEC. ID nº: 2 o su complementaria. 20 25 2. Secuencia según la reivindicación 1, caracterizada porque comprende por lo menos una región codificadora constituida por cualquier secuencia nucleotídica modificada: que presenta, con relación a la SEC. ID nº: 1, una o más modificaciones seleccionadas de entre las adiciones, las supresiones y las sustituciones de nucleótidos, que presenta con la SEC. ID nº: 1 por lo menos 80% de identidad, 30 35 y que transcribe un ARNm que codifica él mismo la OTBC descrita por la SEC. ID nº: 2, o una proteína modificada de dicho OTBC, presentando una actividad ofimática equivalente a la de la OTBC descrita por la SEC. ID nº: 2 o su complementaria. 3. Secuencia según la reivindicación 1, caracterizada porque comprende por lo menos una región codificadora constituida por una secuencia nucleotídica que transcribe un ARNm que codifica una proteína descrita por la SEC ID nº: 4. 4. Secuencia según cualquiera de las reivindicaciones 1 a 3, caracterizada porque dicha secuencia nucleotídica se selecciona de entre la SEC ID nº: 3 y la SEC ID nº: 5. 40 5. ARNm transcrito a partir de una secuencia según la reivindicación 1, o a partir de su complementaria. 6. Proteína que presenta una actinidad ofimática, Oxidasa Terminal asociada a la Biosíntesis de Carotenoides, codificada por una secuencia según cualquiera de las reivindicaciones 1 a 4. 45 50 55 60 7. Proteína según la reivindicación 6, caracterizada porque se selecciona de entre SEC ID nº: 2, SEC ID nº: 4 y la secuencia codificada por la SEC ID nº: 5. 8. ADN recombinante caracterizado porque comprende una secuencia de ADN según cualquiera de las reivindicaciones 1 a 4, estando insertada dicha secuencia en una secuencia heteróloga, transcribiendo dichas secuencias toda o parte de una secuencia de ARNm que codifica toda o parte de la enzima OTBC, presentando esta última una actividad ofimática equivalente a la enzima OTBC de la planta. 9. ADN recombinante según la reivindicación 8, caracterizado porque comprende los elementos necesarios para controlar la expresión de la secuencia nucleotídica insertada, especialmente una secuencia promotora y una secuencia de terminación de la transcripción. 10. Vector de transformación de plantas, adaptado para aumentar la biosíntesis de los carotenoides, que comprende toda o parte de la secuencia nucleotídica de SEC. ID nº: 1 según la reivindicación 1, que codifica toda o parte de una enzima involucrada en la síntesis de los carotenoides, descrita por la SEC. ID nº: 2, precedida por un origen de replicación de la transcripción de las plantas, de manera que el vector pueda generar el ARNm en las células de las plantas. 11. Célula de planta transformada por un vector según la reivindicación 10. 65 12. Planta o fragmento de planta, especialmente fruto, semilla, pétalo, hoja, que comprende las células según la reivindicación 11. 11 ES 2 270 617 T3 13. Procedimiento para modificar la producción de carotenoides en una planta, o bien aumentando la producción de carotenoides, o bien disminuyendo o inhibiendo la producción de carotenoides por la planta, en relación con el contenido normal de carotenoides producidos por la planta, comprendiendo dicho procedimiento la transformación de las células de dichas plantas que deben transformarse según la reivindicación 10. 5 14. Procedimiento para producir carotenoides en una célula de la planta, o eucariota u procariota, comprendiendo dicho procedimiento la transformación de las células de dichas plantas, de las células eucariotas o procariotas que deben transformarse con un vector según la reivindicación 10. 10 15. Procedimiento para la selección de componentes que comprende un carácter herbicida, según el cual se pone en contacto dicho agente con las células o las membranas de las células de la reivindicación 11, y se observa una disminución del consumo de oxígeno por las membranas de dichas células, ligada a la inhibición de la oxidasa terminal asociada a la biosíntesis de los carotenoides. 15 20 25 30 35 40 45 50 55 60 65 12 ES 2 270 617 T3 13 ES 2 270 617 T3 14 ES 2 270 617 T3 15 ES 2 270 617 T3 16 ES 2 270 617 T3 17 ES 2 270 617 T3 LISTA DE SECUENCIAS 5 <110> UNIVERSITÉ JOSEPH FOURIER <120> Secuencia de ADNc que transcribe un ARNm que codifica la oxidasa terminal asociada a la biosíntesis de carotenoides y utilizaciones 10 <130> OTBC <140> <141> 15 <150> FR9813283 <151> 1998-10-20 20 <160> 5 <170> Patentln Ver. 2.1 25 <210> 1 <211> 1396 <212> ADN <213> Arabidopsis thaliana 30 <400> 1 35 40 45 50 55 60 65 <210> 2 <211> 351 <212> PRT <213> Arabidopsis thaliana 1 ES 2 270 617 T3 <400> 2 5 10 15 20 25 30 35 40 45 50 55 60 65 2 ES 2 270 617 T3 5 10 15 20 25 30 35 40 <210> 3 <211> 1387 <212> ADN <213> pimiento <400> 3 45 50 55 60 65 3 ES 2 270 617 T3 5 10 15 20 25 <210> 4 <211> 357 <212> PRT <213> pimiento <400> 4 30 35 40 45 50 55 60 65 4 ES 2 270 617 T3 5 10 15 20 25 30 35 40 45 50 55 60 <210> 5 <211> 1284 <212> ADN <213> tomate 65 5 ES 2 270 617 T3 <400> 5 5 10 15 20 25 30 35 40 45 50 55 60 65 6



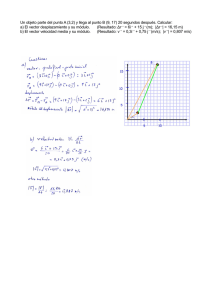


![1 Si v = [ 36 -12 ] , w = [ 9 -3 ] , y S = 1wl. Indique cuáles opciones](http://s2.studylib.es/store/data/004950498_1-7f0b4c506a631255d680bd90dfa0a3e5-300x300.png)