Tesis Claudio Escobar - Repositorio Académico
Anuncio

UNIVERSIDAD DE CHILE
FACULTAD DE CIENCIAS FÍSICAS Y MATEMÁTICAS
DEPARTAMENTO DE INGENIERÍA QUÍMICA Y
BIOTECNOLOGÍA
ESTUDIO DE LA REDUCCIÓN DE AZUFRE ELEMENTAL Y PRODUCCIÓN DE
SULFURO DE HIDRÓGENO EN BIOREACTORES ANAERÓBICOS
TESIS PARA OPTAR AL GRADO DE DOCTOR EN CIENCIAS DE LA INGENIERÍA
MENCIÓN QUÍMICA
CLAUDIO MANUEL ESCOBAR ANTOINE
PROFESOR GUÍA:
LEANDRO HERRERA ZEPPELIN
PROFESOR CO-GUÍA:
TOMÁS VARGAS VALERO
MIEMBROS DE LA COMISIÓN:
JOSÉ HERNÁNDEZ PAVEZ
MARÍA ELENA LIENQUEO CONTRERAS
GONZALO RUIZ FILIPPI
SANTIAGO DE CHILE
OCTUBRE 2009
RESUMEN
En el presente trabajo de tesis se estudió la reducción de azufre elemental y la producción de
sulfuro de hidrógeno en dos diferentes tipos de bioreactores: reactor agitado mecánicamente y
reactor gaslift. La importancia de este estudio radica en la comprensión de los distintos factores
que se ven involucrados en este tipo de sistema bacteriano, con la finalidad de lograr un futuro
desarrollo tecnológico de estos bioreactores para su aplicación industrial.
Tanto el reactor agitado mecánicamente como el reactor gaslift, fueron inoculados con cultivos
de Desulfovibrio desulfuricans. La temperatura de los reactores se controló automáticamente en
30ºC y el pH se mantuvo constante automáticamente a 7,0 ± 0,2, mediante inyección de CO2.
Ambos reactores fueron operados en modalidad batch para las fases líquida y sólida, y en forma
continua para la fase gas (H2, H2S(g), H2O(vap), CO2(g)). Como sustrato energético se utilizó H2
y como fuente carbono se utilizó CO2.
Los resultados experimentales mostraron que la principal limitante de la velocidad de reacción es
la disponibilidad de superficie activa de las partículas de azufre. Esta va disminuyendo a medida
que se recubre con biofilm, compuesto tanto por bacterias como por sustancias poliméricas
extracelulares. La presencia de bacterias adheridas a la superficie de las partículas de azufre pudo
ser detectada mediante microfotografías tomadas con SEM. Por otra parte, utilizando la técnica
XPS se determinó que las sustancias poliméricas extracelulares estaban constituidas
aproximadamente por 73% de proteínas y 27% de polisacáridos.
Se pudo comprobar que no hay limitación por transferencia de masa gas líquido del hidrógeno.
Tampoco se evidenciaron problemas por inhibición por producto (ácido sulfhídrico). Sólo se
presentaron problemas de desorción del ácido sulfhídrico para una velocidad de gas igual a
5,1·10-4 m3N·m-2·s-1, en el reactor agitado mecánicamente.
En los experimentos realizados en el reactor gaslift se obtuvo una tasa promedio de formación de
H2S(g) de 65,6 ± 7,0 mg H2S·(g S)-1·d-1 (687 ± 71 mg H2S·(m2 S)-1·d-1), para un rango de v/v/m
comprendido entre 0,17 y 0,93. Mientras que en el reactor agitado se obtuvo una tasa promedio
de formación de H2S(g) de 50,7 ± 2,7 mg H2S·(g S)-1·d-1 (513 ± 38 mg H2S·(m2 S)-1·d-1), para un
rango de v/v/m comprendido entre 0,22 y 2,97. De esta manera es más conveniente el empleo del
reactor gaslift que el reactor agitado mecánicamente, ya que se logra un patrón de mezclado
aceptable, una buena suspensión de azufre y mayores velocidades de formación de producto para
menores consumos de potencia.
Mediante el estudio de intermediarios de la reacción, fue posible detectar tiosulfato y otro
compuesto más, que podría corresponder a un polisulfuro del tipo [Sn-1(0)S(2-)]2-.
Mediante el desarrollo de un modelo fenomenológico que describió la bioreducción de azufre
elemental, se determinaron los parámetros cinéticos de la reacción en el reactor agitado
mecánicamente: µmax (velocidad máxima de crecimiento específico celular) = 5,1·10-3 h-1;
kS1(constante de afinidad al aceptor terminal de electrones) = 8,7·10-3 M; kA (constante cinética
de adherencia) = 1·10-1 h-1; kd (constante cinética de desorción) = 6,5·10-5 h-1; kS (coeficiente
cinético para la reacción en la superficie) = 6,5·10-1 m·h-1.
ii
AGRADECIMIENTOS
Una vez finalizada esta etapa, quisiera agradecer sinceramente a las siguientes personas.
A mis estimados profesores Leandro Herrera y José Hernández por guiarme de manera brillante
en la realización de mis estudios de Doctorado.
A mis profesores de comisión por mejorar este trabajo y por el tiempo dedicado: Tomás Vargas,
María Elena Lienqueo y Gonzalo Ruiz.
A Loreto Bravo, por su valiosa ayuda durante todo el trabajo experimental de esta Tesis.
A Blanca Escobar, Jorge Castillo, Andrés Ibáñez y Boris Chornik, por toda la colaboración y el
soporte brindado en la realización de diversos experimentos.
A todos los integrantes del Laboratorio de Catálisis y del Laboratorio de Polímeros por toda la
ayuda prestada y por su grata compañía: Paulo Araya, Francisco Gracia, Sergio Quinteros,
Francisco Díaz, Gonzalo Águila, Patricio Baeza, Juan Benavides, Teresa Velilla y Lorena
Guajardo.
A don Manuel, don Juan y Juan Luis, por toda su colaboración y buena disposición.
A todos los nuevos amigos que conocí en mi paso por el DIQBT: Gina Madariaga, Irene Román,
Loreto Bravo, Érika Jorquera, Luis Cáceres, Carolina Urmeneta, Kimlin Fong, Patricia Contreras,
María Luz Farah, Felipe Díaz y a todos los que se me quedaron en el tintero.
A Gonzalo Rund por sus valiosos y desinteresados aportes al mejoramiento de esta obra.
A toda mi familia por su constante apoyo y cariño, especialmente a mis padres Fernando Escobar
e Ivonne Antoine y a mis hermanos Gonzalo y Andrés Escobar.
Quiero brindar un especial agradecimiento al amor de mi vida, Carmen Saavedra, por su apoyo,
por su amor y por inspirarme a ser cada día mejor. A su familia por todo el cariño que me han
entregado
A la radio Futuro y sus programas de Rock, por hacer más placenteras las jornadas nocturnas de
trabajo en el laboratorio.
Al CEIQBT por los pies de cueca y esquinazos diechiocheros.
Finalmente deseo agradecer a CONICYT por el financiamiento de mis estudios de Doctorado.
iii
ÍNDICE DE CONTENIDOS
Contenido
Página
RESUMEN………………………………………………………………………………………...ii
AGRADECIMIENTOS…………………………………………………………………………..iii
NOMENCLATURA………………………………………………………………………………xi
CAPÍTULO 1. INTRODUCCIÓN………………………………………………………………...1
1.1
Microorganismos reductores de azufre............................................................................ 1
1.1.1
Cinética de las bacterias reductoras de azufre ......................................................... 2
1.2
Mecanismo de reacción ................................................................................................... 5
1.3
Adherencia bacteriana en las partículas de azufre........................................................... 7
1.4
Biodiversidad microbiana en bioreactores ...................................................................... 8
1.5
HIPÓTESIS ..................................................................................................................... 8
1.6
OBJETIVOS.................................................................................................................... 8
1.6.1
Objetivo General ..................................................................................................... 9
1.6.2
Objetivos Específicos .............................................................................................. 9
CAPÍTULO 2. ANTECEDENTES GENERALES………………………………………………10
2.1
Detección de Microorganismos ..................................................................................... 10
2.1.1
Análisis de resultados de T-RFLP ......................................................................... 10
2.1.1.1 Análisis de biodiversidad .................................................................................. 10
2.1.1.1.1 Diversidad alfa............................................................................................. 10
2.1.1.1.2 Diversidad beta ............................................................................................ 11
2.2
CRECIMIENTO BACTERIANO ................................................................................. 13
2.3
AZUFRE ELEMENTAL............................................................................................... 15
2.4
EQUILIBRIOS QUÍMICOS ......................................................................................... 16
2.4.1
Equilibrios de ionización del Ácido sulfhídrico .................................................... 16
2.4.2
Equilibrio líquido-gas del Ácido sulfhídrico ......................................................... 17
2.4.3
Equilibrios de ionización del dióxido de carbono y bicarbonato .......................... 17
2.4.4
Equilibrio gas-líquido del dióxido de carbono ...................................................... 18
2.4.5
Equilibrio gas-líquido del Hidrógeno .................................................................... 18
2.5
TRANSFERENCIA DE MASA GAS-LÍQUIDO......................................................... 18
2.6
REACTOR GASLIFT ................................................................................................... 20
CAPÍTULO 3. MATERIALES Y MÉTODOS…………………………………………………..24
3.1
SISTEMAS EXPERIMENTALES ............................................................................... 24
3.1.1
Sistema experimental reactor agitado mecánicamente.......................................... 24
3.1.1.1 Análisis de muestras .......................................................................................... 25
3.1.2
Sistema experimental reactor gaslift ..................................................................... 26
3.1.2.1 Análisis de muestras .......................................................................................... 27
3.2
BACTERIAS Y MEDIO DE CULTIVO ...................................................................... 27
3.3
DETERMINACIÓN
DE
PROPIEDADES
DE
TRANSFERENCIA
E
HIDRODINÁMICAS DE LOS REACTORES......................................................................... 28
3.4
DETERMINACIONES ANALÍTICAS ........................................................................ 30
3.4.1
Determinación de la concentración de Sulfuro total ............................................. 30
3.4.2
Determinación de sulfato, tetrationato, sulfito, metabisulfito y tiosulfato ............ 30
3.4.3
Determinación de la concentración de células suspendidas .................................. 31
3.4.4
Determinación de la concentración de azufre suspendido..................................... 31
iv
3.4.5
Determinación potencial zeta de las partículas de azufre...................................... 31
3.4.6
Determinación distribución de tamaños de partículas de azufre ........................... 32
3.4.7
Determinación patrón de difracción de rayos X de las partículas de azufre ......... 33
3.4.8
Análisis de adherencia bacteriana.......................................................................... 34
3.4.9
Análisis superficial de las partículas de azufre...................................................... 34
3.4.10
Detección de microorganismos mediante análisis de T-RFLP.............................. 35
3.5
COMPONENTES DEL SISTEMA EXPERIMENTAL ............................................... 36
3.5.1
Descripción de componentes ................................................................................. 36
3.5.2
Instrumentación y control...................................................................................... 39
3.5.3
Aparatos e Instrumentos ........................................................................................ 39
3.5.4
Conexiones sistemas experimentales..................................................................... 40
3.6
MODELACIÓN DINÁMICA....................................................................................... 40
CAPÍTULO 4. RESULTADOS Y DISCUSIÓN………………………………………………...41
4.1
PROPIEDADES DE TRANSFERENCIA DE MASA DEL REACTOR AGITADO
MECÁNICAMENTE ................................................................................................................ 41
4.2
ESTUDIO CINÉTICO DE LA REDUCCIÓN DE AZUFRE MEDIADA POR
BACTERIAS EN REACTOR AGITADO MECÁNICAMENTE............................................ 42
4.3
DISEÑO Y CONSTRUCCIÓN DE REACTOR GASLIFT. ........................................ 53
4.4
CARACTERIZACIÓN HIDRODINÁMICA Y DE TRANSFERENCIA DE MASA
DEL REACTOR GASLIFT. ..................................................................................................... 54
4.5
ESTUDIO CINÉTICO DE LA REDUCCIÓN DE AZUFRE MEDIADA POR
BACTERIAS EN REACTOR GASLIFT.................................................................................. 62
4.6
COMPARACIÓN DE REACTORES ........................................................................... 65
4.7
ESTUDIO DE ADHERENCIA BACTERIANA Y ANÁLISIS SUPERFICIAL DE
PARTÍCULAS DE AZUFRE.................................................................................................... 69
4.8
ESTUDIO DE BIODIVERSIDAD BACTERIANA..................................................... 83
4.9
ESTUDIO DE INTERMEDIARIOS DE LA REACCIÓN........................................... 89
4.10 MODELACIÓN MATEMÁTICA DEL REACTOR AGITADO ................................ 92
CAPÍTULO 5. CONCLUSIONES……………………………………………………………...102
CAPÍTULO 6. RECOMENDACIONES………………………………………………………..104
REFERENCIAS………………………………………………………………………………...105
APÉNDICES……………………………………………………………………………………113
APÉNDICE A.
Determinación velocidad de agitación reactor agitado mecánicamente…...114
APÉNDICE B.
Resazurina como indicador de anaerobiosis……………………………….115
APÉNDICE C.
Procedimiento T–RFLP……………………………………………………116
APÉNDICE D.
Fotografías del montaje experimental……………………………………..120
APÉNDICE E.
Programa desarrollado para la integración de las ecuaciones del modelo y el
ajuste de parámetros…………………………………………………………………………….122
APÉNDICE F.
Publicaciones generadas durante esta investigación……………………….128
v
ÍNDICE DE FIGURAS
Página
Figura 1. Variación de la energía libre de Gibbs con la temperatura para la reacción de reducción
de azufre elemental con hidrógeno en condiciones fisiológicas. ............................................ 5
Figura 2. Curva típica de crecimiento celular (Fuente: Doran, 1998)........................................... 14
Figura 3. Estructuras resonantes del anillo S8 ............................................................................... 15
Figura 4. Descripción reactor gaslift de flujo inverso y sus dimensiones. .................................... 20
Figura 5. Distribución detallada de equipos, conexiones y sistemas de control y adquisición de
datos del sistema experimental del reactor agitado mecánicamente. CV controlador de
válvula solenoide; CT controlador de temperatura; TT transmisor de temperatura; TpH
transmisor de pH; TEh transmisor de Eh; A/D convertidor análogo/digital de señales........ 24
Figura 6. Distribución detallada de equipos, conexiones y sistemas de control y adquisición de
datos del sistema experimental del reactor gaslift. La nomenclatura es la misma empleada en
la Figura anterior. .................................................................................................................. 26
Figura 7. Dimensiones del reactor gaslift...................................................................................... 37
Figura 8. a) Vista de la base del reactor. b) Corte transversal de la base del reactor ................... 38
Figura 9. Velocidad de formación de H2S(g) para UG = 2,1·10-3 m3N·m-2·s-1. La flecha 1 indica
que 18 g de azufre fueron agregados al reactor..................................................................... 43
Figura 10. Velocidad de formación de H2S considerando el aporte de sulfuro total en el reactor.
UG = 2,1·10-3 m3N·m-2·s-1. ..................................................................................................... 44
Figura 11.
Diámetro promedio estimado de partículas de azufre en el reactor agitado
mecánicamente. UG = 2,1·10-3 m3N·m-2·s-1. .......................................................................... 45
Figura 12. Velocidad de formación de H2S(g) para 5,1·10-4, 1,4·10-3 y 2,1·10-3 m3N·m-2·s-1. La
flecha 1 indica que se agregaron al reactor 400 mg de extracto de levadura. La flecha 2
indica que se agregaron al reactor 16 g de azufre.................................................................. 46
Figura 13. Concentración de sulfuro total en el reactor para 5,1·10-4, 1,4·10-3 y 2,1·10-3 m3N·m-2·s1
. La flecha roja indica que se agregaron al reactor 16 g de azufre. ...................................... 47
Figura 14. Concentración de células suspendidas en el reactor. Las flechas 1, 3 y 4 indican que se
agregaron 100 mL de medio sin extracto de levadura al reactor. La flecha 5 indica que se
agregaron 400 mg de extracto de levadura al reactor. Las flechas 2 y 6 indican que se
agregaron al reactor 18 y 16 g de azufre, respectivamente. .................................................. 49
vi
Figura 15. Potencial de óxido reducción del reactor. La flecha 1 indica que se interrumpió el flujo
de hidrógeno y se cerró el reactor con 2 psig de este gas. La flecha 2 indica que se reinició el
flujo continuo de hidrógeno. Las flechas 3 y 5 indican que se agregaron al reactor 18 y 16 g
de azufre, respectivamente. La flecha 4 indica que se agregaron al reactor 400 mg de
extracto de levadura............................................................................................................... 50
Figura 16. Velocidad de formación de H2S(g) expresado por volumen de reacción para todo el
período de experimento en el reactor agitado mecánicamente.............................................. 51
Figura 17. Velocidad de formación de H2S(g) expresado por masa total de azufre para todo el
período de experimento en el reactor agitado mecánicamente.............................................. 51
Figura 18. Velocidad de formación de H2S(g) expresado por superficie total de azufre para todo
el período de experimento en el reactor agitado mecánicamente.......................................... 52
Figura 19. Variación de (kLa)H2 con UGR ...................................................................................... 55
Figura 20. Variación del Hold-up gaseoso local descendente con la profundidad del reactor, para
distintos valores de UGR......................................................................................................... 56
Figura 21. Variación del Hold-up gaseoso ascendente, descendente, global y la diferencia entre
hold-up ascendente y descendente, para distintos valores de UGR. ....................................... 57
Figura 22. Variación de la velocidad del líquido con UGR. Los valores corresponden al promedio
de 30 determinaciones. .......................................................................................................... 59
Figura 23. Tasa de formación de H2S(g) y concentración de azufre en función de la velocidad
superficial del gas en la zona ascendente. ............................................................................. 62
Figura 24. Velocidad de formación de H2S(g) en función de la masa y de la superficie total del
azufre suspendido en el reactor ............................................................................................. 64
Figura 25. Concentración de sulfuro total en función de la velocidad superficial del gas en la
zona ascendente. .................................................................................................................... 65
Figura 26. Velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG) en
función de kLa........................................................................................................................ 66
Figura 27. Velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG) en
función de v/v/m.................................................................................................................... 67
Figura 28. Velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG) en
función de la potencia suministrada. ..................................................................................... 69
Figura 29. Adherencia bacteriana en partículas de azufre en el reactor agitado mecánicamente. La
foto fue tomada el día 8,5. Mag. = 6,50 KX.......................................................................... 70
vii
Figura 30. Microfotografía de una partícula de azufre en ausencia de bacterias. Mag. = 5,00 KX.
............................................................................................................................................... 71
Figura 31. Microfotografía de una partícula de azufre en el reactor agitado mecánicamente. La
foto fue tomada el día 8,5. Mag. = 15,00 KX........................................................................ 72
Figura 32. Difractograma de partículas de azufre. En azul: azufre antes de la reacción. En rojo:
azufre después de 25 días de reacción................................................................................... 73
Figura 33. Potencial zeta de las partículas de azufre para diferentes valores de pH. En rojo:
azufre antes de la reacción. En azul: azufre después de 25 días de reacción. Se indica el
punto isoeléctrico para ambas muestras. ............................................................................... 74
Figura 34. Potencial zeta de partículas de azufre provenientes del reactor gaslift para diferentes
valores de pH. En rojo: azufre en tiempo cero. En azul: azufre después de 6 días de reacción.
Se indica el punto isoeléctrico para ambas muestras............................................................. 75
Figura 35. Microfotografía de partículas de azufre en ausencia de bacterias. Mag. = 500 X. ...... 76
Figura 36. Microfotografía de partículas de azufre en ausencia de bacterias. Mag. = 1,00 KX. .. 76
Figura 37. Microfotografía de partículas de azufre después de 35 minutos del inicio del flujo de
H2. Mag. = 500 X................................................................................................................... 77
Figura 38. Microfotografía de partículas de azufre después de 35 minutos del inicio del flujo de
H2. Mag. = 5,00 KX............................................................................................................... 77
Figura 39. Microfotografía de partículas de azufre después de 35 minutos del inicio del flujo de
H2. Mag. = 5,00 KX............................................................................................................... 78
Figura 40. Microfotografía de partículas de azufre después de 2,1 días del inicio del flujo de H2.
Mag. = 5,00 KX..................................................................................................................... 78
Figura 41. Microfotografía de partículas de azufre después de 2,9 días del inicio del flujo de H2.
Mag. = 5,00 KX..................................................................................................................... 79
Figura 42. Microfotografía de partículas de azufre después de 7,5 días del inicio del flujo de H2.
Mag. = 5,00 KX..................................................................................................................... 79
Figura 43. Espectro XPS de partículas de azufre después de 7,5 días del inicio del flujo de H2. . 81
Figura 44. Espectro XPS del carbón 1s de la muestra de partículas de azufre después de 7,5 días
del inicio del flujo de H2........................................................................................................ 81
Figura 45. Espectro XPS del azufre 2p de la muestra de partículas de azufre después de 7,5 días
del inicio del flujo de H2........................................................................................................ 82
Figura 46. Electroferograma Muestra 1......................................................................................... 84
Figura 47. Electroferograma Muestra 2......................................................................................... 85
viii
Figura 48. Electroferograma Muestra 3......................................................................................... 85
Figura 49. Dendrograma obtenido con análisis de clusters para las tres muestras........................ 88
Figura 50. Gráfico de PCA para las muestras del reactor gaslift. ................................................. 89
Figura 51. Cromatograma muestra reactor gaslift. ........................................................................ 90
Figura 52. Resultado de la modelación y datos experimentales para la biomasa suspendida....... 99
Figura 53. Resultado de la modelación y datos experimentales para el radio promedio de las
partículas de azufre.............................................................................................................. 100
Figura 54. Resultado de la modelación de la evolución de la biomasa adherida. ....................... 101
Figura 55. Esquema propuesto de sistema experimental para estudiar reducción de azufre sin
contacto con bacterias.......................................................................................................... 104
Figura A 1. Formación de compuestos reducidos de la resazurina. ............................................ 115
Figura A 2. Etapas involucradas en el desarrollo de T-RFLP (Fuente: Morales G, 2006). ........ 116
ix
ÍNDICE DE TABLAS
Página
Tabla 1. Velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG)................ 3
Tabla 2. Características principales de los alótropos cicloocta-S.................................................. 16
Tabla 3. Características geométricas del reactor gaslift. ............................................................... 37
Tabla 4. Coeficientes combinados de transferencia de masa para hidrógeno para distintas UG. .. 41
Tabla 5. Velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG) obtenidas
en el reactor agitado mecánicamente..................................................................................... 52
Tabla 6. Resultados εGTD y ajuste exponencial.............................................................................. 56
Tabla 7. Porcentaje de azufre suspendido desde el fondo del reactor gaslift para distintas UGR. 63
Tabla 8. Índices de biodiversidad para 3 muestras del reactor gaslift........................................... 87
Tabla 9. Coeficientes de similitud de Sørensen para las tres muestras del reactor gaslift. ........... 87
Tabla 10. Tiempos de retención de estándares y sus respectivos intervalos de confianza,
utilizados en estudio de intermediarios de la reacción. ......................................................... 90
Tabla 11. Parámetros óptimos del modelo matemático............................................................... 100
Tabla A 1. Concentraciones de los reactivos utilizados en PCR................................................. 118
Tabla A 2. Concentraciones de los reactivos utilizados en la digestión...................................... 119
x
NOMENCLATURA
Símbolo
AD
Ad
aL
AR
B
C L 0O
2
C L*
CLO2
CLO2*
D
d
d0
db
DD
de
di
Di
DL
DP
DR
Fr
Ga
h
h
hB
hbr
hd
HH2
HL
hS
I0
Ii
K
k11
k12
k31
k32
K5
KB
ki
Descripción
Sección transversal de la zona descendente del reactor gaslift
Área de libre flujo de la zona ascendente del reactor gaslift
Área interfacial por unidad de volumen de líquido.
Sección transversal de la zona ascendente del reactor gaslift
Razón hB diámetro zona ascendente (B = hB/ DR)
Concentración inicial de oxígeno en fase líquida
Concentración de equilibrio en el líquido para un gas poco soluble
Concentración de oxígeno en la fase líquida
Concentración de saturación de oxígeno en la fase líquida
Coeficiente de dispersión axial
Longitud paleta de agitación (impeller)
Diámetro orificio difusor de gases
Diámetro de burbuja de gas
Diámetro zona descendente reactor gaslift
Diámetro equivalente reactor
Diámetro de partícula
Diámetro interno del reactor
Coeficiente de difusión
Diámetro promedio de partículas
Diámetro zona ascendente reactor gaslift
Número de Froude (Fr = UGR/(g·DR)0.5)
Número de Galileo (Ga = g·ρL2·DR3/µL2)
Altura dispersión gas-líquido
Constante de Planck (6,62·10-34 J s)
Separación desde la base del reactor gaslift hasta la base del tubo deflector
Altura del nivel de líquido de un bioreactor
Altura tubo deflector:
Constante de Henry para el equilibrio gas – líquido de H2
Altura líquido
Distancia entre el tope del tubo deflector y la altura de líquido
Intensidad de la luz incidida a la muestra
Intensidad de la luz transmitida a través de la muestra
Coeficiente óptico de la celda y de forma de partícula
Constante cinética de la reacción directa de la disociación de H2S(ac)
Constante cinética de la reacción inversa de la disociación de H2S(ac)
Constante cinética de la reacción directa de la hidratación-disociación de CO2(ac)
Constante cinética de la reacción inversa de la hidratación-disociación de CO2(ac)
Constante ajustada por Merchuk et al
Coeficiente de pérdida friccional en el fondo del reactor gaslift
Coeficiente de absorbancia de la partícula di
xi
Ki
kL
k La
KS
KT
n
n
N
n4
Ni
NP
P
P0
p1
p2
PG
pi
QG0
R
Re0
[S]
Sh
T
tb
tC
tD
tR
TX
UG
UGR
ULD
ULR
VG
VL
VLD
VLR
vt
X
Xi
Y
YX S 2−
Constantes de afinidad respecto a diferentes sustratos Si
Coeficiente de transferencia de masa local de la fase líquida
Coeficiente combinado de transferencia de masa gas-líquido
Constante de afinidad respecto al sustrato o constante de saturación
Coeficiente de pérdida friccional superior del reactor gaslift
Número de orificios del distribuidor
Flujo de moles de gas a la entrada del reactor
Velocidad de agitación
Constante ajustada por Merchuk et al
Número de partículas di
Número de potencia
Potencia
Potencia consumida sin aireación
Presión en la base del reactor
Presión de cabeza del reactor
Potencia consumida con aireación
Abundancia relativa de la especie i
Caudal de gas por orificio del distribuidor
Resistencia al flujo en la zona descendente del reactor gaslift (R = Ad/ AR)
Número de Reynolds en el orificio difusor de gases
Concentración sustrato limitante
Número de Sherwood (Sh = kLa·DR 2/DL)
Razón hS diámetro zona ascendente (T=(hS/DR)+1)
Tiempo promedio de residencia de una burbuja dentro de un bioreactor
Tiempo de circulación del líquido
Tiempo del líquido en la zona descendente del reactor gaslift
Tiempo del líquido en la zona ascendente del reactor gaslift
Tasa de decaimiento celular
Velocidad superficial de gas
Velocidad superficial de gas en la zona ascendente del reactor gaslift
Velocidad superficial del líquido en la zona descendente del reactor gaslift
Velocidad superficial del líquido en la zona ascendente en el reactor gaslift
Flujo de gas
Volumen de la fase líquida
Velocidad lineal del líquido en la zona descendente del reactor gaslift
Velocidad lineal del líquido en la zona ascendente del reactor gaslift
Velocidad terminal de las burbujas de gas en la fase líquida
Concentración células suspendidas
Fracción relativa de partículas di
Razón separador de gas (hS + DR)/Di
Coeficiente de rendimiento celular respecto del tetrasulfuro
YX
Coeficiente de rendimiento celular respecto del hidrógeno
4
H2
Y X CO2
−
VL
Coeficiente de rendimiento celular respecto del dióxido de carbono
Velocidad de circulación del líquido
xii
LETRAS GRIEGAS
Símbolo
Φ
σ
ρG
εGD
εGLD
εGR
εGTD
ρL
ρS
µeff
µmax
ν
νL
Descripción
Función trabajo
Tensión superficial del líquido
Densidad del gas
Hold-up gaseoso zona descendente del reactor gaslift
Hold-up local descendente del reactor gaslift
Hold-up gaseoso zona ascendente del reactor gaslift
Hold-up total descendente del reactor gaslift
Densidad del líquido
Densidad del sólido
Viscosidad efectiva de la suspensión
Velocidad de crecimiento específico celular máxima
Frecuencia de la radiación
Viscosidad cinemática del líquido
xiii
CAPÍTULO 1. INTRODUCCIÓN
Durante el siglo pasado, el flujo de azufre desde la corteza terrestre y su consecuente
acumulación en la biosfera se incrementó notoriamente debido a actividades antropogénicas,
principalmente la quema de combustibles fósiles y los procesos de fundición de minerales
sulfurados. Una de las formas de minimizar este impacto ambiental de la minería es transformar
el azufre emitido a formas de más fácil manejo y disposición, como el azufre elemental.
La creciente demanda por productos de azufre más reactivo, es decir de menor estado de
oxidación, hacen más interesante reducir el azufre elemental a su forma química más reducida, el
sulfuro. El sulfuro de hidrógeno se utiliza en operaciones metalúrgicas para la recuperación y
remoción de metales de las aguas de lixiviación (Jong y Parry, 2003). Se utiliza también en la
remoción de metales y arsénico de aguas residuales de los drenajes ácidos de minas y de
efluentes industriales (Luptakova y Kusnierova, 2005). Pero sin lugar a dudas, es en la minería
nacional del cobre en donde tiene importantes proyecciones, ya que es precursor del sulfuro ácido
de sodio (NaHS), reactivo utilizado como depresor de flotación de molibdenita. Dada la gran
importancia que tiene la minería en nuestro país, es de suma relevancia el desarrollo de
tecnologías que produzcan el sulfuro de hidrógeno a nivel nacional, ya que significaría una
importante reducción de emisiones de azufre y de costos en su importación. Este compuesto
puede ser producido in situ por reducción catalítica de azufre elemental a elevadas condiciones de
presión y temperatura (Drum et al, 1982). Una opción menos peligrosa y menos costosa que la
reducción catalítica para producir sulfuro de hidrógeno es su producción in situ mediante la
reducción biológica de sulfato presente en aguas residuales y efluentes mineros. Sin embargo, el
consumo del donador de electrones constituye una limitante económica (Herrera et al, 1997).
Una alternativa a la reducción biológica de sulfato es la bioreducción de azufre elemental.
Mediante esta vía, se reduce en un 75% el consumo de electrones con respecto a la bioreducción
de sulfato. Como se trataría de una producción in situ de H2S y posteriormente de NaSH, se
reducirían los riesgos de transporte asociados a este tipo de sustancias.
1.1
Microorganismos reductores de azufre
Muchos microorganismos son capaces de utilizar una variedad de compuestos orgánicos e
inorgánicos como aceptores terminales de electrones en el proceso de respiración anaeróbica.
Dentro de estos aceptores de electrones, los compuestos de azufre (sulfato, sulfito, tiosulfato,
sulfóxidos orgánicos y azufre elemental) juegan un importante rol en el ciclo biogeoquímico del
azufre. La bioreducción de estos compuestos de azufre genera ácido sulfhídrico como producto
metabólico (Cypionka y Pfenning, 1986), el que es excretado fuera de las células debido a la
naturaleza no asimilatoria del proceso.
La habilidad de reducir azufre elemental de manera no asimilatoria usando H2 o sustratos
orgánicos (lactato, acetato, piruvato, etanol) como dadores de electrones es común entre bacterias
y arqueas. La mayoría de estos microorganismos son hipertermofílicos y pertenecen al dominio
de las arqueas. Las reductoras de azufre mesofílicas y termofílicas, sobre todo del dominio
bacteriano, se han aislado de sedimentos marinas anóxicos, de sedimentos de agua dulce, del
rumen de los bovinos, y de afloramientos de aguas termales.
1
Dentro de las arqueas y las bacterias reductoras de azufre, los miembros de los géneros
Acidianus, Stygiolobus, Thermoproteus, Pyrobaculum, Igneococcus, Pyrodictium, Wolinella,
Desulfuromonas, Ammonifex, y Desulfurobacterium pueden generar ATP mediante respiración
litotrófica de azufre. En cambio, miembros de los géneros de arqueas Desulfurococcus,
Staphylothermus, Hyperthermus, Thermococcus, y Pyrococcus y de los géneros bacterianos
Thermotoga, Thermosipho, y Fervidobacterium sólo desproporcionan azufre. También se ha
encontrado que algunas arqueas metanogénicas son capaces de producir H2S a partir de azufre
elemental, especialmente termofílicas e hipertermofílicas de los géneros Methanopyrus,
Methanobacterium, Methanothermus, y Methanococcus. Dentro de las bacterias reductoras de
sulfato (BRS), los géneros que se ha encontrado que son capaces de reducir azufre elemental son
Desulfovibrio, Desulfuromonas y Desulfurobacterium (Hedderich et al, 1999).
Starkey (1937), reportó por primera vez la reducción bacteriana de azufre elemental con
generación de ácido sulfhídrico. En 1976, Pfennig y Biebl publicaron la primera descripción
genérica de bacterias reductoras de azufre con metabolismo no asimilatorio. En 1977, los mismos
autores encontraron que ciertas bacterias reductoras de sulfato crecían con azufre como aceptor
de electrones. En el mismo año, Wolfe y Pfenning describieron que la bacteria Sulfospirillum
podía crecer mediante la oxidación anaeróbica de hidrógeno y la reducción de azufre elemental.
Desde entonces, la bioreducción de azufre elemental ha sido intensamente estudiada. La mayor
parte de estas investigaciones se han abocado al estudio de bacterias termofílicas e
hipertermofílicos, probablemente debido a que esta forma de azufre se encuentra naturalmente
relacionada a ambientes de altas temperaturas (volcanes, aguas hidrotermales, etc). Sólo en el
último tiempo, se ha puesto énfasis en los microorganismos mesofílicos.
1.1.1
Cinética de las bacterias reductoras de azufre
El crecimiento de las bacterias reductoras de azufre, clásicamente se ha modelado de acuerdo a
una cinética tipo Monod de desarrollo celular.
Utilizando microorganismos mesofílicos se han obtenido velocidades de reducción de azufre
elemental más elevadas que aquellas obtenidas con microorganismos termófilos e
hipertermofílicos. Por ejemplo, Segerer et al (1985), trabajando con Sulfolobus sp a 82ºC,
reportaron una velocidad de formación de H2S de 4,5 mg H2S·(g S)-1·d-1 y Takai et al (2003),
trabajando con Balnearium lithotrophicum a 70ºC, obtuvieron una velocidad de formación de
H2S de 1,08 mg H2S. Mientras que Azabou et al (2007), trabajando con Desulfomicrobium sp a
37ºC, reportaron una velocidad de formación de H2S de 42,5 mg H2S·(g S)-1·d-1 y Böttcher et al
(2001), trabajando con Desulfocapsa thiozymogenes a 28ºC, obtuvieron una velocidad de
formación de H2S de 38,5 mg H2S·(g S)-1·d-1. Estos auspiciosos resultados hacen muy atractivo el
estudio cinético de bacterias mesofílicas reductoras de azufre como una alternativa para la
producción de H2S.
En la Tabla 1, se presentan velocidades de formación de H2S reportadas por distintos autores
tanto para bacterias mesofílicas como termofílicas. Por tratarse de una reacción heterogénea en la
que participa un sólido, la velocidad de formación de H2S(g) debería ser expresada también por
área superficial. Sin embargo, los distintos autores han omitido el área superficial de las
partículas de azufre.
2
Tabla 1. Velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG).
Autor
Stetter & Gaag (1983)
Belkin et al (1985)
Takai et al (2005)
Nakagawa et al (2005)
Caccavo et al (1994)
Takai et al (2003)
Azabou et al (2007)
VHG (mg H2S·(g S)-1·d-1)
Temperatura (ºC)
32,5
23,8
23,2
2,12
29,1
1,08
42,5
N.I.: no informado
65
77
50
32
35
70
37
pH
6,5
7,5
5,2
6,0
N.I.
5,4
7,0
Fuente de
electrones
H2
acetato
H2
H2
acetato
H2
lactato
Los estudios cinéticos de bioreducción de azufre elemental reportados en la literatura, sólo
informan velocidades instantáneas, y no expresiones cinéticas completas. Por otra parte hay
insuficiente información acerca de las limitantes cinéticas y tampoco se ha abordado en
profundidad el efecto de la superficie activa de las partículas de azufre sobre la cinética de la
reacción.
Las fuentes de energía más utilizadas por las bacterias reductoras de azufre incluyen hidrógeno,
piruvato, lactato y acetato. Herrera et al (1997) encontraron que la utilización de hidrógeno como
fuente de energía en el proceso de bioreducción de sulfato, era económicamente más conveniente
que la utilización de lactato.
Van Houten (1994 y 1997), logró reducir sulfato hasta ácido sulfhídrico empleando CO2 como
fuente de carbono celular y H2 como fuente de energía. Estos antecedentes demuestran la
factibilidad de utilizar bacterias reductoras autótrofas para la reducción de compuestos de azufre.
Sáez (2001) obtuvo una velocidad de reducción de sulfato promedio de 3000 (ppm/d), utilizando
Desulfovibrio desulfuricans (bacteria reportada como heterótrofa) en medio autotrófico
enriquecido con extracto de levadura. Estos resultados demuestran que es factible utilizar esta
bacteria en condiciones autotróficas. En el presente trabajo también se empleará esta bacteria, con
hidrógeno como fuente de energía y bicarbonato como fuente de carbono celular (en equilibrio
con el dióxido de carbono). Se utilizará azufre elemental como aceptor terminal de electrones.
El hidrógeno puede producirse por diferentes vías: electrólisis, fotobioproducción, a partir de gas
natural, por pirólisis de biomasa y por gasificación de carbón, entre otras. Díaz (2007) comparó
diferentes alternativas y concluyó que la generación de hidrógeno mediante la gasificación de
carbón es la opción más económica en la actualidad. Una planta modelo de reducción de azufre
elemental debería contar con una unidad generadora de hidrógeno, de manera de contar con un
suministro seguro de este gas. De esta manera se evita la construcción de grandes contenedores
de H2.
El hidrógeno se suministra en forma gaseosa al reactor. Debido a la baja solubilidad de este gas,
la reacción podría estar limitada por transferencia de masa gas-líquido. Por otra parte, el producto
de reacción, ácido sulfhídrico, es un inhibidor para las bacterias (Reis et al, 1992; Okabe et al,
1992 y 1995), de modo que la transferencia de este compuesto desde su forma acuosa a su forma
3
gaseosa es un requisito de diseño del reactor. Por lo tanto se debe diseñar un reactor para obtener
una tasa de transferencia de masa gas/líquido tan alta como para que la cinética no esté limitada
por la disponibilidad del gas H2 disuelto en fase acuosa y que la remoción del ácido sulfhídrico
sea tan eficaz como para mantenerlo bajo el umbral de inhibición. Dentro de este contexto, un
reactor conocido de alta transferencia de masa es el reactor gaslift (Siegel y Merchuk, 1987;
Bello et al, 1985a y 1985b). Por otra parte se ha encontrado que este reactor posee un buen grado
de mezcla (Bello et al, 1984; Merchuk et al, 1998), bajos efectos de cizalle y un buen grado de
contacto entre las fases. Estas características hacen muy atractivo el uso de este reactor para
aplicaciones bioquímicas y biotecnológicas.
Los reactores gas-líquido-sólido utilizados en la industria pueden ser divididos en dos grandes
grupos: uno en donde los sólidos están fijos o empacados y otro en donde los sólidos están
suspendidos. Generalmente, el primer tipo de reactores se utiliza para reacciones con catalizador
o reacciones en las que una de las 3 fases es un inerte y el segundo tipo de reactores se utiliza
para reacciones en las que las 3 fases reaccionan (Shah, 1979). Los reactores más comunes del
segundo grupo son el reactor agitado gas-líquido- sólido suspendido, el reactor no agitado gaslíquido- sólido suspendido y el reactor no agitado de tres fases de lecho fluidizado con flujo
ascendente en cocorriente.
La cinética de reducción se estudiará en dos reactores de tres fases (gas, líquido y sólido
suspendido): uno agitado mecánicamente y otro con agitación neumática y patrón hidrodinámico
de tipo gaslift de tubos concéntricos. De aquí en adelante, al primer reactor se le denominará
reactor agitado mecánicamente y al segundo se le denominará reactor gaslift. Ambos reactores
operarán en modalidad batch para las fases líquida y sólida, y en continuo para la fase gas, salvo
en una experiencia inicial en donde se operarán las tres fases en modalidad batch.
La estequiometría de la reducción de azufre elemental para bacterias (X) que utilizan hidrógeno
como fuente de energía, se expresa mediante la siguiente ecuación:
Ecuación 1:
X
H 2 (ac ) + S →
H 2 S (ac ) ∆G 0 = −46,2 kJ / reacción
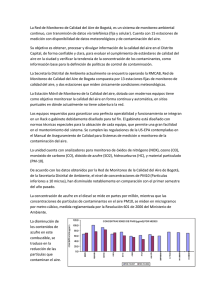
Esta reacción es espontánea. La energía libre que se genera en condiciones fisiológicas (25 ppm
de H2S y pH 7) y su evolución con la temperatura se muestra en Figura 1
4
-35.0
∆ G (kJ/reacción)
0
25
50
75 100 125 150 175 200
-40.0
-45.0
-50.0
-55.0
Temperatura (ºC)
Figura 1. Variación de la energía libre de Gibbs con la temperatura para la reacción de reducción de azufre
elemental con hidrógeno en condiciones fisiológicas.
La energía libre requerida por bacterias anaeróbicas para sintetizar un mol de ATP a partir de
ADP y fosfato en condiciones fisiológicas es 43,9 kJ/mol (Thauer et al, 1977). Estos
requerimientos energéticos pueden ser satisfechos con la energía libre disponible a partir de la
reacción de reducción de azufre elemental, tal como se aprecia en la Figura 1.
1.2
Mecanismo de reacción
En solución acuosa y en presencia de algún agente nucleófilo (CN-, SCN-, HS-, OH-, I-, C2H5S-,
entre otros), el azufre elemental experimenta ruptura del enlace S-S por ataque nucleofílico. Entre
los nucléofilos, el ion HS- es uno de los que presenta mayor tiofilicidad, es decir mayor
reactividad frente al enlace S-S (Pryor, 1962).
La primera etapa del mecanismo de la reacción corresponde a la apertura del anillo S8 mediante
un ataque nucleofilico del ion HS-. Esta etapa es la que demanda más energía ya que la estructura
corona del anillo S8 está altamente estabilizada por resonancia. En esta reacción se forman un
tipo de compuestos llamados polisulfuros (Bartlett et al, 1958; Hartler et al, 1967):
Ecuación 2:
HS − + n S 8 → S n S 2− + H +
8
Los iones polisulfuros de largo n, (Sn2-), pueden ser representados por la formula [Sn-1(0)S(2-)]2-, lo
que significa que de los n átomos, (n-1) son átomos de azufre-polisulfuros en estado de oxidación
cero y un átomo es sulfuro-polisulfuro en estado de oxidación -II.
El polisulfuro formado en el ataque nucleofílico da origen a polisulfuros más pequeños que a su
vez atacan a anillos S8 que no han reaccionado (Hartler et al, 1967).
5
S n S 2− + S 8 → S n +8 S 2 −
Ecuación 3:
La presencia de polisulfuros puede acelerar el rompimiento de las cadenas largas de azufre
formadas inicialmente (Hartler et al, 1967):
Ecuación 4:
S n +8 S 2− + S q S 2− → S m S 2− + S p S 2−
m+ p = n+ q +8
Blumentals et al (1990), trabajando con Pyrococcus furiosus, encontraron que estos polisulfuros
también se producen en la bioreducción de azufre elemental (no sólo en el proceso abiótico de
reducción) y actúan como aceptores terminales de electrones en la cadena respiratoria de estos
microorganismos. Dietrich y Klimmek (2002), trabajando con Wolinella succinogenes, también
llegaron a la misma conclusión. Sin embargo, no se tiene información acerca de que polisulfuro
en particular es utilizado como aceptor de electrones por las bacterias reductoras de azufre, ni de
la distribución de estos compuestos en el medio de reacción.
En su forma más general, los polisulfuros pueden ser representados por la fórmula X-Sn-X en
donde n está entre 1 y 10 y X puede ser H, Cl, Br u otro grupo terminal orgánico o inorgánico. A
este tipo de compuestos se les suele llamar también sulfanos cuando poseen hidrógeno como
grupo terminal. A los polisulfuros con grupo terminal constituido por átomos de azufre y oxígeno
se les denomina politionatos.
Schippers et al (1996, 1999) detectaron diferentes politionatos (tetrationato, titrionato, entre
otros) como intermediarios de la oxidación de sulfuro a azufre elemental, además de polisulfuros
del tipo Sn2-. Para la reacción de reducción de azufre elemental no se cuenta con información
acerca de la existencia de politionatos como intermediarios.
En ausencia de un dador de electrones, el azufre puede experimentar una reacción de
desproporción que conduce a la formación de productos con estados de oxidación +VI y –II. La
reacción es la siguiente:
Ecuación 5:
4 S 0 + 4 H 2 O → SO42− + 3HS − + 5H +
∆G o ' = +10,2 kJ / mol S 0 ( pH = 7)
Esta reacción es espontánea cuando se remueve el HS-. Este puede ser oxidado por MnO2 o por
FeOOH presentes en los sedimentos marinos, en donde se encuentran ciertas bacterias
anaeróbicas capaces de desproporcionar azufre a temperatura ambiente (Böttcher et al, 2001 y
2005; Thamdrup et al, 1993; Frederiksen y Finster, 2003).
Se ha encontrado que el sulfito es un intermediario esencial de la reacción de desproporción
(Thamdrup et al, 1993; Frederiksen y Finster, 2003) y que la enzima sulfito reductasa jugaría un
importante rol en este proceso (Frederiksen y Finster, 2003).
6
1.3
Adherencia bacteriana en las partículas de azufre
Microorganismos de diversas especies son capaces de adherirse a superficies de distinta
naturaleza, formando lo que se conoce como biofilm. La función y apariencia de biofilms en
distintos ambientes puede ser diferente, sin embargo todos los biofilms se forman de acuerdo a
una secuencia básica que incluye (i) la formación de un film acondicionador de compuestos
macromoleculares adsorbidos; (ii) el transporte de microorganismos hacia la superficie; (iii) la
atracción de los microorganismos hacia la superficie a través de fuerzas van der Waals
generándose una adherencia reversible; (iv) la adherencia irreversible de los microorganismos a
través de la producción de sustancias poliméricas extracelulares (extracellular polymeric
substances, EPS); (v) desprendimiento de algunas células adheridas y acumulación de
microorganismos en el biofilm. En la tercera etapa los microorganismos pueden ser removidos
fácilmente de la superficie, mientras que en la cuarta etapa se genera un enlace permanente a la
superficie.
El empleo de soportes sólidos, en este caso el azufre, puede dar lugar a adherencia bacteriana. La
posibilidad de que ocurra este fenómeno ofrece una excelente ventaja en reactores continuos
(pues reduce la tasa de lavado de células). Para el diseño del reactor de este estudio puede tener
dos efectos contrapuestos; es posible que crezca un gran número de bacterias asociadas
directamente a las partículas de azufre, aumentando y facilitando su biodisponibilidad o, puede
resultar que el biofilm termine por ocluir el azufre en sus sitios de reacción impidiendo la
generación de azufre en fase acuosa, deteniendo así la reacción.
La adherencia en partículas de azufre ha sido estudiaba con bacterias que utilizan el azufre
elemental como fuente de electrones. Bryant et al (1984) demostraron que para diferentes
especies de Thiobacillus, la adherencia en partículas de azufre elemental se generaba a través de
la interacción entre glicocalix bacteriano y la superficie del azufre. Laishley et al (1986)
demostraron que la tasa de oxidación de S0 por Thiobacillus albertis era función del área
superficial y de la microestructura de los cristales de azufre. Shrihari et al (1993) demostraron
que una vez que la bacteria Thiobacillus ferrooxidans se adhiere a las partículas de azufre,
comienza a oxidarlo generando tiosulfato y sulfito, los que sirven como sustrato para las bacterias
que permanecen suspendidas. Takakuwa et al. (Citado por Franz et al, 2007) encontraron que
grupos tiol estaban probablemente involucrados en el proceso de adherencia de Acidithiobacillus
thiooxidans en partículas de azufre elemental. En otros estudios, Ohmura et al (citado por Franz
et al, 2007) y Ramírez et al (citado en Franz et al, 2007) encontraron evidencia de una proteína en
la membrana externa de Acidithiobacillus ferrooxidans que está probablemente involucrada en la
adherencia célula – azufre.
Tal como puede apreciarse, se ha alcanzado un vasto conocimiento acerca de los mecanismos de
adherencia en partículas de azufre elemental por parte de bacterias que oxidan azufre. Sin
embargo, poco se sabe acerca de la adherencia de bacterias reductoras de azufre en partículas de
este sustrato.
En cuanto a las EPS, se puede mencionar que están involucradas en la adherencia de las células a
superficies naturales o artificiales, en donde juegan un importante rol factores como fuerzas
electrostáticas, cargas superficiales, hidrofobicidad de la superficie y disponibilidad de cationes.
7
Las EPS están compuestas por polisacáridos, proteínas, lípidos, ácidos nucleicos, ácidos
urónicos. Esta composición está influenciada por el sustrato a adherirse (Gehrke, 1998) y cada
componente tiene propiedades adherentes diferentes. Por ejemplo, se ha reportado que los ácidos
urónicos excretados por cepas de P. fuorescens tienen propiedades de activación de superficies,
previniendo la adherencia de estas cepas en las superficies (Pringle et al, citado por GómezSuárez et al, 2002). Este efecto también fue reportado para ácidos urónicos excretados por P.
aeruginosa (Gómez-Suárez et al, 2002).
Por otra parte se ha reportado que los polisacáridos (Costerton et al; Azeredo et al.; Azeredo y
Oliveira; citados por Gómez-Suárez et al, 2002) y las proteínas (Danielsson et al, citado por
Gómez-Suárez et al, 2002; Dûfrene et al, 1996), favorecen la adherencia bacteriana.
Hasta el momento, se han ignorado completamente los mecanismos y las propiedades de
adherencia de bacterias reductoras de azufre en la literatura especializada. Es primordial contar
con información precisa de este fenómeno para lograr su optimización, sea en términos de
favorecerla o de impedirla según sea el caso.
1.4
Biodiversidad microbiana en bioreactores
Los bioreactores que procesan subproductos o desechos de otros procesos, no requieren trabajar
en condiciones operacionales estériles. Bajo estas condiciones se favorece la formación de
cultivos mixtos de bacterias, antes que cepas puras. En este contexto, es primordial indagar
acerca de la existencia de especialización de algunas bacterias por adherirse a las partículas de
azufre. También resulta de medular importancia saber si la biodiversidad bacteriana evoluciona
frente a alguna variación del medio y si esta evolución toma un sentido tal que potencie o
disminuya la reacción de bioreducción de azufre elemental, de tal manera que se asegure una
operación acorde con los requisitos de diseño.
Con el desarrollo de técnicas de biología molecular y análisis filogenéticos, se han desarrollado
metodologías que dan la posibilidad de determinar la diversidad genética de microorganismos
presentes en comunidades complejas. Dentro de estas metodologías destaca el procedimiento de
T-RFLP (Terminal Restriction Fragment Lenght Polymorphims).
1.5
HIPÓTESIS
En este trabajo de Tesis se pretende probar que es posible producir sulfuro de hidrógeno a partir
de azufre elemental en bioreactores anaeróbicos autotróficas a 30ºC.
1.6
OBJETIVOS
Para probar la hipótesis se plantean los siguientes objetivos:
8
1.6.1
Objetivo General
Estudiar la cinética de reducción de azufre elemental a 30ºC para producir sulfuro de hidrógeno
en un bioreactor agitado mecánicamente y en un bioreactor gaslift, operados en condiciones
anaeróbicas.
1.6.2
Objetivos Específicos
Establecer y cuantificar las variables operacionales críticas del sistema.
Estudiar la adherencia bacteriana en las partículas de azufre y caracterizar estas partículas durante
el transcurso de la reacción.
Estudiar la biodiversidad bacteriana asociada al proceso de bioreducción de azufre elemental.
Identificar posibles intermediarios de la reacción.
Comparar los distintos tipos de bioreactores seleccionados.
Determinar los parámetros cinéticos que describen la bioreducción de azufre elemental en el
reactor agitado mecánicamente, mediante el desarrollo de un modelo dinámico fenomenológico.
9
CAPÍTULO 2. ANTECEDENTES GENERALES
2.1
Detección de Microorganismos
Para detectar y monitorear microorganismos, se han desarrollado diversas técnicas basadas en la
obtención del DNA. Dentro de éstas se encuentra el análisis de T-RFLP (Terminal Restriction
Fragment Lenght Polymorfism) en el cual el DNA es sometido a cortes con enzimas de
restricción, generando patrones únicos dependiendo del organismo del cual proviene el DNA
permitiendo de esta manera su identificación.
La molécula 16S rDNA es parte estructural del ribosoma, está presente en todos los seres vivos y
cumple un rol primordial en la formación de proteínas, específicamente sirve de lugar de unión
del RNA mensajero. Las moléculas de rDNA bacteriano de gran tamaño (16S y 23S) contienen
varias regiones que son secuencias muy bien conservadas, las que son útiles para determinar la
cercanía genealógica entre dos organismos, pero al mismo tiempo presentan suficiente
variabilidad como para ser excelentes cronómetros filogenéticos. Es por ello que las técnicas
asociadas a las secuencias 16S rDNA, han sido ampliamente utilizadas en estudios de
biodiversidad microbiana. Actualmente se ha logrado una alta caracterización de la secuencia 16S
rDNA y se han establecido métodos estándar basados en dicha secuencia tanto para la
identificación de filotipos (tipo bacteriano particular) como para análisis filogenéticos.
2.1.1
Análisis de resultados de T-RFLP
A partir de los perfiles de T-RFLP se puede analizar:
i. La diversidad de filotipos en cada muestra, dado que cada una corresponde a una comunidad
biológica integrada por un determinado número de filotipos, y cada uno de estos filotipos
tiene una cierta importancia.
ii. La dinámica de los filotipos durante la operación del sistema, mediante el análisis conjunto de
todas las muestras y su respectiva diversidad de filotipos en función del tiempo.
2.1.1.1 Análisis de biodiversidad
El análisis de biodiversidad se puede realizar en tres niveles diferentes: dentro de comunidades
(diversidad alfa), entre comunidades (diversidad beta), o para un conjunto de comunidades
(diversidad gamma).
2.1.1.1.1 Diversidad alfa
La gran mayoría de los métodos propuestos para evaluar la diversidad de especies se refieren a la
diversidad dentro de las comunidades. Para diferenciar los distintos métodos en función de las
variables biológicas que miden, se dividen en dos grandes grupos (Moreno, 2001):
10
i. Métodos basados en la cuantificación del número de especies presentes (riqueza específica)
ii. Métodos basados en la estructura de la comunidad, es decir, la distribución proporcional del
valor de importancia de cada especie (abundancia relativa de los individuos, su biomasa,
cobertura, productividad, etc)
La riqueza específica es la forma más sencilla de medir la biodiversidad, ya que se basa
únicamente en el número de especies presentes, sin tomar en cuenta el valor de importancia de las
mismas. Hay varios índices que miden la riqueza específica, siendo el más sencillo el índice de
riqueza de especies (S). Este índice corresponde al número total de especies de la comunidad.
Los métodos que describen la estructura pueden ser modelos paramétricos, modelos no
paramétricos e índices de abundancia proporcional. Estos últimos pueden a su vez clasificarse
según se basen en la dominancia o en la equidad de la comunidad.
Los índices de dominancia toman en cuenta la representatividad de las especies con mayor valor
de importancia sin evaluar la contribución del resto de las especies. Por el contrario, los índices
de equidad toman en cuenta el valor de importancia de cada especie (Moreno, 2001).
Los índices más reconocidos sobre diversidad se basan principalmente en el concepto de equidad.
Uno de ellos es el índice de Shannon – Wiener (Ecuación 6), que expresa la uniformidad de los
valores de importancia a través de todas las especies de la muestra. Adquiere valores entre cero,
cuando hay una sola especie, y el logaritmo de S, cuando todas las especies están representadas
por el mismo número de individuos
H = −∑ pi ln( pi )
Ecuación 6:
Donde:
pi
: abundancia relativa de la especie i
Otro índice de equidad importante es el índice de Pielou (Ecuación 7). Mide la proporción de la
diversidad observada con relación a la máxima diversidad esperada. Su valor va de 0 a 1, de
forma que 1 corresponde a situaciones donde todas las especies son igualmente abundantes.
J=
Ecuación 7:
H
H max
Donde:
Hmax : ln(S)
2.1.1.1.2 Diversidad beta
La diversidad beta es el grado de reemplazo de especies o cambio biótico a través de gradientes
ambientales. A diferencia de las diversidades alfa y gamma que pueden ser medidas fácilmente
en función del número de especies, la medición de la diversidad beta es de una dimensión
11
diferente porque está basada en proporciones o diferencias. Estas proporciones pueden evaluarse
con base en índices o coeficientes de similitud, de disimilitud o de distancia entre las muestras a
partir de datos cualitativos (presencia-ausencia de especies) o cuantitativos (abundancia
proporcional de cada especie medida como número de individuos, biomasa, densidad, cobertura,
etc.), o bien con índices de diversidad beta propiamente dichos.
Los índices de similitud/disimilitud expresan el grado en el que dos muestras son semejantes por
las especies presentes en ellas, por lo que son una medida inversa de la diversidad beta, que se
refiere al cambio de especies entre dos muestras. Sin embargo, a partir de un valor de similitud
(s) se puede calcular fácilmente la disimilitud (d) entre las muestras: d=1-s. Estos índices pueden
obtenerse con base en datos cualitativos o cuantitativos directamente o a través de métodos de
ordenación o clasificación de las comunidades.
Dentro de los índices de similitud cualitativos destaca el coeficiente de similitud de Sørensen
(Ecuación 8), que relaciona el número de especies en común con la media aritmética de las
especies en ambas comunidades.
IS =
Ecuación 8:
2·c
a+b
Donde:
a
b
c
: número de especies presentes en la muestra A
: número de especies presentes en la muestra B
: número de especies compartidas por ambas muestras
El intervalo de valores para este índice va de 0 cuando no hay especies compartidas entre ambos
sitios, hasta 1 cuando los dos sitios tienen la misma composición de especies (Moreno, 2001).
El análisis multivariado aprovecha las relaciones (proporciones o diferencias) entre las variables
para buscar patrones o estructuras en los datos. Para realizarlo existen métodos como los de
ordenamiento de objetos (donde se logra la reducción de dimensiones entre las variables o entre
objetos a una o pocas dimensiones), y el análisis de agrupamiento donde los objetos se clasifican
en categorías jerárquicas sobre la base de matrices de similitud de los mismos.
El método de ordenamiento más frecuentemente utilizado para la medición de la diversidad beta
es el análisis de componentes principales (PCA). Éste consiste en reducir las dimensiones de un
conjunto numeroso de variables observadas sin perder información. Las nuevas variables
obtenidas a partir de las variables originales reciben el nombre de factores o componentes. Éstos
son una combinación lineal de variables y permiten identificar las dimensiones subyacentes a una
matriz de correlaciones. Los objetos son representados en un espacio gráfico en el cual los ejes
constituyen gradientes de combinaciones de variables.
El PCA se efectúa para extraer la mayor varianza de las variables originales, considerando tanto
lo que éstas comparten como lo específico en ellas, a fin de reproducir todos los aspectos
observables en las variables. Se trata de reproducir con menos dimensiones la matriz de
correlación entre variables (Vivanco, 1999).
12
El análisis de agrupamiento (clusters) se utiliza para definir grupos homogéneos de objetos y
estudiar la estructura natural de éstos. Tiene como objetivo formar grupos de muestras que sean
similares entre sí y diferentes a los elementos de otros grupos.
Para formar los grupos uno de los métodos más usados es el de agrupamiento jerárquico divisivo.
Éste comienza con todos los elementos en un solo grupo y en sucesivas divisiones se van
formando grupos cada vez más pequeños; estos pasos sucesivos se representan en un gráfico
denominado dendrograma. Para realizarlo es necesario medir el grado de similitud entre las
muestras, ya sea mediante los índices de asociación o las distancias. Los primeros se utilizan en
general para datos cualitativos de ausencia-presencia, codificados con los estados 0 y 1,
respectivamente. Las medidas de distancia miden el grado de disimilitud: cuanto más parecidas
son dos muestras menor será su distancia. La medida más común es la distancia euclidiana
(Moreno, 2001):
D.E. =
Ecuación 9:
∑ (X
ij
− X ik )
Donde:
Xij : valor de la especie i para la muestra j
Xik : valor de la especie i para la muestra k
2.2
CRECIMIENTO BACTERIANO
La base conceptual de la modelación del crecimiento bacteriano en sistemas biológicos fue
propuesta por Jacques Monod (1942). Su modelo caracteriza a la cinética de un cultivo batch
considerando que las funciones celulares son realizadas por unidades fisiológicamente
estructuradas.
Su postulado experimental considera que µ es una función hiperbólica de la concentración del
sustrato limitante. Esta función llamada ecuación de Monod, es homóloga a la de MichaelisMenten:
µ = µ max ⋅
Ecuación 10:
[S ]
K S + [S ]
Donde:
µmax : velocidad de crecimiento específico celular máxima
KS : constante de afinidad respecto al sustrato o constante de saturación
[S] : concentración sustrato limitante
A concentraciones elevadas de sustrato, la velocidad de reacción se aproxima a un valor
constante independiente de la concentración de sustrato, µmax. En este intervalo de concentración,
la reacción es de orden cero con respecto al sustrato. Por otra parte, a concentraciones bajas de
sustrato existe una dependencia aproximadamente lineal de la velocidad de reacción respecto del
13
sustrato. En este intervalo de concentración, la reacción es esencialmente de primer orden con
respecto al sustrato (Doran, 1998).
En algunas ocasiones puede ocurrir que diferentes nutrientes pueden limitar el crecimiento. En
este caso la expresión matemática es el producto de varias expresiones de tipo Monod:
[S i ]
i =1 K i + [S i ]
n
µ = µ max ∏
Ecuación 11:
Donde:
Ki
: constantes de afinidad respecto a diferentes sustratos Si
En un cultivo discontinuo se presentan varias fases de crecimiento celular. En la Figura 2 se
muestra una curva típica de crecimiento.
Figura 2. Curva típica de crecimiento celular (Fuente: Doran, 1998)
Durante la fase de adaptación o latencia, la velocidad específica de crecimiento, µ, es cero o muy
cercana a cero, ya que las células se están adaptando al nuevo ambiente. En la fase de aceleración
comienza el crecimiento, alcanzando su máxima velocidad en la fase de crecimiento. Cuando los
nutrientes en el medio de cultivo se han consumido o se acumulan los productos inhibidores, el
crecimiento disminuye y las células comienzan la fase de desaceleración o deceleración.
Después se alcanza la fase estacionaria, en la que no se produce crecimiento. Finalmente algunos
cultivos presentan una fase de muerte cuando las células pierden viabilidad o son destruidas por
rotura (Doran, 1998).
La velocidad específica de crecimiento de las células durante las fases de crecimiento y
desaceleración de un cultivo discontinuo, a menudo se ve primordialmente afectada por un único
sustrato.
14
Otro parámetro cinético importante es el coeficiente de rendimiento celular respecto del sustrato
(también conocido como yield). Este parámetro expresa la razón entre el crecimiento bacteriano y
la disminución del sustrato consumido.
2.3
AZUFRE ELEMENTAL
El azufre en su estado de oxidación elemental tiene una configuración electrónica [Ne] 3s23p4. Es
soluble en CS2 (35,5g / 100g a 25 ºC) y prácticamente insoluble en agua (5 µg/L a 25 ºC). Su
primera energía de ionización es 999,6 kJ·mol-1, su afinidad electrónica es -200 kJ/mol y su
electronegatividad (escala de Pauling) es 2,58. Tiene los mismos electrones de valencia que el
oxígeno, por lo tanto las moléculas S2 y S3 tienen propiedades químicas y físicas análogas a las
del oxígeno molecular y el ozono, respectivamente. Sin embargo, la forma más estable de azufre
es S8 y no S2. Por ende, la química de ambos átomos (S y O) difiere en que el azufre tiene una
pronunciada tendencia a concatenarse.
Existen muchos alótropos del azufre presentes en las distintas fases. Estos pueden presentarse
como anillos, cadenas o ambos (Meyer, 1976).
Se ha demostrado mediante cálculos teóricos y consideraciones termodinámicas, que todas las
moléculas Sn con 6 < n < 12 existen como anillos en todas las fases. Todos los anillos conocidos
son de color amarillo y poseen un espectro de absorción comprendido entre 250 y 300 nm.
Exceptuando al S3, los anillos son más estables que las cadenas, debido probablemente a los
efectos de la resonancia. En la Figura 3 se muestran las estructuras resonantes del anillo S8. El
azufre puede expandir su octeto, debido a su habilidad de utilizar orbitales d (Cilento, 1960).
Figura 3. Estructuras resonantes del anillo S8
En el estado sólido, existen los siguientes alótropos de azufre: S5, S6, S7, S8, S9, S10, S11, S12, S18 y
S20. En condiciones estándar de temperatura y presión, la forma más estable de azufre es el αazufre ortorrómbico, que consta de moléculas ciclooocta- S (S8). A 93,5 ºC este alótropo de
azufre se convierte en β-azufre monoclínico (S8). Otro alótropo cicloocta- S importante es el γazufre triclínico. Tanto el β-azufre como el γ-azufre se revierten a la forma α-azufre a
temperatura ambiente (Meyer, 1976). Los alótropos ciclooocta- S poseen una estructura corona.
En la Tabla 2 se resumen las propiedades más relevantes de estos 3 alótropos.
15
Tabla 2. Características principales de los alótropos cicloocta-S
Molécula
α-S8
β-S8
γ-S8
Nº
moléculas
en celda
unitaria
16
6
4
a (Å
Å)
b (Å
Å)
c (Å
Å)
Densidad
(g/mL)
Punto
Fusión
(ºC)
10,4646
10,778
8,442
12,8660
10,844
13,025
24,4860
10,924
9,356
2,069
1,94
2,19
112,8
133
20
Nota: a, b y c se refieren a las constantes de la celda unitaria
También existen alótropos poliméricos de azufre, dentro de los que destacan el azufre plástico,
azufre laminar, azufre fibroso y supersublimado. Estos alótropos están formados por largas
hélices de azufre y son mezclas metaestables de alótropos cicloocta-S y otras formas. A
temperatura ambiente este tipo de compuestos alotrópicos de azufre tienden a transformarse en la
forma estable α-S8.
2.4
EQUILIBRIOS QUÍMICOS
En la presente sección se presentan los distintos equilibrios químicos en solución acuosa de las
especies más relevantes involucradas en el sistema experimental. Si no se indica otra cosa, las
constantes de equilibrio están referidas a 25ºC de temperatura, 1 atm de presión y a fuerza iónica
nula.
2.4.1
Equilibrios de ionización del Ácido sulfhídrico
El H2S(ac) (producto metabólico) está en equilibrio con el ión HS-. A continuación se presentan los
equilibrios de ionización del H2S(ac) y sus especies disueltas:
Ecuación 12:
Ecuación 13:
K a1
H 2 S ←→
HS − + H +
K a1 =
Ka 2
HS − ←
→ S 2− + H +
[ ][
]
k11
H + HS −
=
= 1,0 ⋅ 10 −7
[H 2 S ]
k12
K a2 =
[H ][S ] = 1,2·10
[HS ]
+
2−
−13
−
El pKa de la segunda disociación del ácido sulfhídrico es muy grande, por lo tanto a pH neutro
existirán las especies H2S(ac) y HS-.
16
2.4.2
Equilibrio líquido-gas del Ácido sulfhídrico
El H2S(ac) también está en equilibrio con su fase gaseosa. La constante de reparto entre ambas
fases es la constante de Henry (HH2S).
Ecuación 14:
2.4.3
2S
H 2 S ( ac ) ←H
→ H 2 S(g)
H
H H 2S =
[H S ] = 0,4404 mol
[H S ]
2
(g)
2
( ac )
gas
/ mol ac (30º C )
Equilibrios de ionización del dióxido de carbono y bicarbonato
El CO2(ac) proviene tanto de CO2(g) que se alimenta al reactor para control de pH, como del
equilibrio de ionización del ión HCO3- presente en el medio de cultivo como fuente de carbono.
En ausencia del CO2(ac) proveniente del control de pH, el ión bicarbonato se comporta como un
anfolito:
Ka 2
HCO3− ←
→ CO32− + H +
Ecuación 15:
Ecuación 16:
Kb 2
HCO3− + H 2 O ←
→ H 2 CO3 + OH −
K a2 =
[H ][CO ] = 5,6·10
[HCO ]
+
2−
3
−11
−
3
K b2 =
[H 2 CO3 ][OH − ]
[HCO ]
−
3
= 5,88 ⋅ 10 −11
El ácido carbónico formado sufre la siguiente transformación:
Ecuación 17:
K=
K
H 2 CO3 ←→
CO2 ( ac ) + H 2 O
[CO ] = 385
2 ( ac )
[H 2 CO3 ]
El CO2(ac) proveniente del CO2(g) ingresado al reactor, se hidrata para generar ácido carbónico
de acuerdo a la reacción inversa de la Ecuación 17, por lo tanto altera el equilibrio del
bicarbonato existente en el reactor. El ácido carbónico se disocia de acuerdo a la siguiente
ecuación:
Ecuación 18:
−
3
H 2 CO3 ←→
HCO + H
K a1
+
K a1
[HCO ][H ] = 1,7 ⋅10
=
−
3
+
[H 2 CO3 ]
−4
A su vez el bicarbonato se disocia de acuerdo a la Ecuación 15. Sin embargo, la constante de
equilibrio es muy pequeña, por lo tanto en condiciones de neutralidad puede despreciarse la
concentración del ión carbonato.
17
De acuerdo a la constante de equilibrio de la Ecuación 17, la concentración de ácido carbónico es
muy pequeña comparada con la de anhídrido carbónico. Por esta razón suele escribirse la
hidratación del CO2(ac) conjuntamente con la primera disociación del ácido carbónico:
Ecuación 19:
−
3
CO2 ( ac ) + H 2 O ←→ HCO + H
K
+
[ ][
[
]
k 31
H + HCO3−
K a1 ' =
=
= 4,44 ⋅ 10 −7
k 32
CO2 ( ac )
]
En síntesis, la incorporación de CO2(ac) por una fuente externa al reactor provoca una alteración
del equilibrio del bicarbonato.
2.4.4
Equilibrio gas-líquido del dióxido de carbono
Ecuación 20:
co 2
CO2 ( g ) ←
→ CO2 ( ac )
H
H CO2 =
[CO2 ac ]
[CO ] = 0,7435 mol
ac
/ mol g (30º C )
2g
2.4.5
Equilibrio gas-líquido del Hidrógeno
El H2(ac) proviene del H2(g) que se alimenta al reactor como fuente de energía. El equilibrio
entre ambas fases se presenta a continuación:
Ecuación 21:
H2
H 2( g ) ←
→ H 2( ac )
H H2 =
H
[H 2 ac ] = 0,0190 mol
[H ]
ac
/ mol g (30º C )
2g
2.5
TRANSFERENCIA DE MASA GAS-LÍQUIDO
La transferencia de masa del dador de electrones (H2) desde la fase gaseosa hasta los sitios de
reacción celular ocurre en varias etapas con diversas resistencias al transporte. Lo mismo ocurre
con la transferencia del producto del metabolismo celular (H2S(ac)) desde los sitios de reacción
celular hasta la fase gaseosa.
Las distintas resistencias al transporte dependen de las propiedades reológicas del medio de
cultivo, el tamaño de las burbujas de gas, coalescencia, dispersión, potencia de mezclado, tamaño
celular, entre otros.
Tal como se mencionó existen varias resistencias para la transferencia de masa. Sin embargo, en
las condiciones de operación típica de los bioreactores, la resistencia al transporte está dada por la
película de líquido que rodea a las burbujas.
18
La velocidad de transferencia de masa se expresa de la siguiente forma:
(
dC L
= k L ⋅ a L ⋅ C L∗ − C L
dt
Ecuación 22:
)
Donde:
CL* : concentración de equilibrio en el líquido para un gas poco soluble
kL : coeficiente de transferencia de masa local de la fase líquida
aL : área interfacial por unidad de volumen de líquido.
Parte fundamental del diseño de bioreactores es conocer adecuadamente el producto kL·aL o kLa
(coeficiente combinado de transferencia de masa gas líquido). Este coeficiente es influenciado
por la geometría y tipo de bioreactor, las propiedades de los fluidos y las condiciones de
operación (temperatura, presión). La fuerza motriz (CL* - CL) puede incrementarse aumentando la
concentración de saturación de la fase gas en el líquido (CL*).
La determinación experimental clásica del coeficiente kLa se basa en la integración de la
Ecuación 22 y se determina para el oxígeno empleando electrodos específicos. Para otros gases se
relacionan los coeficientes combinados con las difusividades de los gases, tal como se verá más
adelante (Sección 3.3).
En forma teórica se deben estimar por separado kL y aL.
El coeficiente de transferencia de masa local puede estimarse mediante la siguiente relación
(Bailley, 1986):
Sh =
Ecuación 23:
kL ⋅ db
DL
Donde:
Sh
db
DL
: número de Sherwood
: diámetro de burbuja
: coeficiente de difusión
El área interfacial por unidad de volumen puede estimarse para el caso de burbujas de volumen
constante mediante la siguiente relación (Treybal, 1980):
n ⋅ QGO ⋅ t b ⋅ 6
a L =
VL ⋅ d b
Ecuación 24:
Donde:
VL
n
: volumen de la fase líquida
: número de orificios del distribuidor
19
QG0
tb
hbr
vt
2.6
: caudal de gas por orificio del distribuidor
: tiempo promedio de residencia de una burbuja dentro del bioreactor (tb= hbr/vt)
: altura del nivel de líquido del bioreactor
: velocidad terminal de las burbujas de gas en la fase líquida
REACTOR GASLIFT
El gaslift es un reactor de al menos dos fases, con una gran diferencia de densidad entre ellas
como gas-líquido o gas-suspensión, donde la potencia de agitación proviene del mismo gas
(agitación neumática). Este tipo de reactor posee un deflector que lo divide en dos zonas
conectadas hidráulicamente en el fondo y en la parte superior. Sólo en una de estas zonas se
suministra gas, denominándose a ésta zona de ascenso. Al volumen de gas capturado en un
volumen particular dentro del reactor se le denomina Hold-up gaseoso, expresado como
porcentaje (o fracción) del volumen total. El mayor Hold-up gaseoso de la zona con suministro
de gas (ascendente) respecto de aquella sin suministro (descendente) provoca una diferencia de la
densidad media del fluido entre ambas zonas, induciéndose de esta manera una circulación del
líquido con un patrón cíclico definido, con dirección hacia arriba en la zona de ascenso (menor
densidad media: mayor Hold-up) y hacia abajo en la zona de descenso (Chisti et al, 1988).
El rector gaslift puede contar con dos cilindros concéntricos, que permiten dos posibles arreglos
para el flujo, según sea la forma de suministro de gas (Figura 4). En uno el gas suministrado
ingresa por la región cilíndrica interior. En el otro, el gas suministrado ingresa por la región
anular, produciéndose un flujo inverso al anterior. El primero de estos arreglos se conoce como
gaslift de flujo normal y el segundo como gaslift de flujo inverso.
hS
hB
GAS
Figura 4. Descripción reactor gaslift de flujo inverso y sus dimensiones.
20
La separación desde la base del reactor hasta la base del tubo deflector (hB), la separación de la
altura del líquido en el reactor hasta el tope del tubo deflector (hS), la relación de áreas de ascenso
(AR) y descenso (AD) y la relación altura diámetro, constituyen los parámetros geométricos más
importantes para el diseño del reactor gaslift. Estos parámetros afectan notablemente las
propiedades hidrodinámicas y de transferencia de los reactores gaslift (Bello et al, 1984; Bello et
al, 1985a; Bello et al, 1985b; Chisti et al, 1988; Merchuk et al, 1994; Gavrilescu y Tudose, 1996
y 1998; Gouveia et al, 2003).
Mediante un balance de energía y asumiendo continuidad del flujo del líquido entre la zona
descendente y ascendente, Chisti et al (1988) obtuvieron la siguiente expresión para la velocidad
superficial del líquido ascendente (ULR) en el reactor gaslift:
Ecuación 25:
U LR
2· g ·h·(ε GR − ε GD )
=
2
AR
1
KT
+
K
·
·
B
2
(1 − ε )2
AD (1 − ε GD )
GR
0.5
Donde:
h
εGR
εGD
KT
KB
: altura dispersión gas-líquido
: Hold-up gaseoso zona ascendente
: Hold-up gaseoso zona descendente
: coeficiente de pérdida friccional superior del reactor gaslift
: coeficiente de pérdida friccional en el fondo del reactor gaslift
Gavrilescu y Tudose (1998) determinaron las siguientes correlaciones entre los parámetros
geométricos y las propiedades de transferencia de masa e hidrodinámicas de un reactor gaslift de
tubos concéntricos:
Ecuación 26:
Ecuación 27:
Ecuación 28:
Ecuación 29:
Sh = 1,204·106 Ga0,01 Fr0,90 B-0,1 T-0,18 Y-1,70 R-0,18
ULR = 1,57 Fr0,42 B0,84 Y0,33 R0,63 (νL / DR)0,01
εGR = 8·10-3 Ga0,21 Fr0,82 B-0,19 Y-0,43 T-0,10 R-0,17
εGD = 2,35·10-3 Ga0,20 Fr0,74 B0,41 Y-1,14 T-0,54 R-0,24
Donde:
Ad
B
Di
: área de libre flujo de la zona ascendente
: razón hB diámetro zona ascendente (B = hB/ DR)
: diámetro interno del reactor
21
DR
Fr
Ga
R
Sh
T
νL
Y
: diámetro zona ascendente
: número de Froude (Fr = UGR/(g·DR)0.5)
: número de Galileo (Ga = g·ρL2·DR3/µL2)
: resistencia al flujo en la zona descendente (R = Ad/ AR)
: número de Sherwood (Sh = kLa·DR 2/DL)
: razón hS diámetro zona ascendente (T=(hS/DR)+1)
: viscosidad cinemática del líquido
: razón separador de gas (hS + DR)/Di
El rango donde se obtuvieron estas correlaciones fue 0,5 < B < 3,8; 1 < T < 3,8; 9·106 < Ga <
3·109; 5·10-3 < Fr < 110·10-3; AD/AR ≥ 1; 0,333 < Y < 1,267; 0,1< R < 0,9; UGR ≤ 1,1·10-1 m/s.
Gouveia et al (2003), a su vez determinaron las siguientes correlaciones:
Ecuación 30:
Sh = 7,16·106 Fr1,121 B0,201 T0,410
Ecuación 31:
ULR = 0,178 Fr0,297 B-0,004 T0,095
El rango de estas correlaciones es 0,25 < B < 0,45; 1 < T < 1,4; AD/AR = 0,63; 1,6·10-2 < UGR <
4,0·10-2 m/s.
Cabe señalar que Merchuk et al (1994), encontraron correlaciones del mismo tipo para el número
de Sherwood y para el hold up en la zona ascendente y descendente.
Un aspecto importante que se debe considerar para el diseño de un reactor gaslift, es el difusor de
gases.
Para una amplia variedad de gases y líquidos el diámetro de burbuja (dB) se puede determinar
según la siguiente expresión (Treybal, 1980):
Ecuación 32:
72 ⋅ ρ L
d B = 2
π ⋅ g ⋅ (ρ L − ρG )
1/ 5
⋅ QG 0
Donde:
ρG
ρL
: densidad del gas
: densidad del líquido
En donde tiene que cumplirse lo siguiente:
QG 0
Ecuación 33:
22
20 ⋅ (σ ⋅ d 0 )5
>
2
3
( g ⋅ ∆ρ ) ⋅ ρ L
1/ 6
0, 4
Re0 < 2100
Ecuación 34:
Donde:
d0 : diámetro orificio difusor de gases
σ
: tensión superficial del líquido
Re0 : número de Reynolds en el orificio difusor de gases
El número de orificios del difusor de gases se determina utilizando la Ecuación 32 y sabiendo que
los orificios deben estar separadas al menos 3·dB (Treybal, 1980). Esto último se recomienda para
que las burbujas de orificios adyacentes no interfieran entre sí.
23
CAPÍTULO 3. MATERIALES Y MÉTODOS
3.1
SISTEMAS EXPERIMENTALES
Inicialmente se trabajó en un reactor agitado mecánicamente. El primer experimento se llevó a
cabo operando el reactor en modalidad batch para las tres fases del sistema. Los restantes
experimentos del reactor agitado mecánicamente se llevaron a cabo operándolo en forma
continua para la fase gas y en modalidad batch para las fases líquida y sólida. Posteriormente se
estudió la cinética de reducción en un reactor gaslift. Este reactor fue operado en forma continua
para la fase gas y en modalidad batch para las fases líquida y sólida.
3.1.1
Sistema experimental reactor agitado mecánicamente
La distribución detallada de los componentes del sistema experimental, conexiones,
instrumentación y control, se muestra en la Figura 5.
Figura 5. Distribución detallada de equipos, conexiones y sistemas de control y adquisición de datos del
sistema experimental del reactor agitado mecánicamente. CV controlador de válvula solenoide; CT
controlador de temperatura; TT transmisor de temperatura; TpH transmisor de pH; TEh transmisor de Eh;
A/D convertidor análogo/digital de señales.
El sistema estaba compuesto por un bioreactor no estéril, con difusor de gases, agitado
mecánicamente. El volumen de la fase líquida estuvo comprendido en un rango entre 1 y 1,15
24
litros. La temperatura del reactor se controló automáticamente en 30ºC, temperatura que Okabe y
Characklis (1992) recomiendan para un cultivo de Desulfovibrio desulfuricans. El reactor fue
operado en modalidad batch para las fases líquida y sólida, y en forma continua para la fase gas
(H2, H2S(g), H2O(vap)). El potencial de óxido-reducción (Eh) fue registrado con un electrodo de
Eh conectado a un medidor de voltaje. El pH óptimo para el crecimiento de Desulfovibrio
desulfuricans es 7,0 (Reis et al, 1992), pero el pH del reactor aumenta a medida que se reduce
azufre elemental. Por lo tanto el pH se mantuvo constante automáticamente a 7,0 ± 0,2, mediante
inyección de CO2.
Para inocular el reactor, previamente se incubó un cultivo bacteriano resuspendido a partir de
pellets de bacterias mantenidos en frío. Esta incubación se llevó a cabo a 30ºC durante 15 días.
El reactor, con 1 litro de medio, fue inoculado con 100 mL de cultivo bacteriano. Luego se le
agregó al reactor azufre elemental en la forma de azufre flor cristalino (diámetro promedio de
partículas de 30,7 µm, determinado experimentalmente de acuerdo a sección 3.4.6) y fue cerrado
a una presión de 2 psig de hidrógeno. Después de 2 días, el reactor fue operado con flujo
continuo de hidrógeno, manteniéndose a una presión igual a 1,5 psig. Este procedimiento se
realizó tanto para la experiencia con concentración inicial de azufre de 5% (p/v) como para la
experiencia con 4% (p/v).
El dador de electrones se suministró en fase gaseosa como H2. Tanto el flujo de este gas como el
de CO2 se monitorearon con rotámetros, previamente calibrados con un flujómetro de película
ascendente. Estos gases fueron burbujeados al reactor a través del difusor de gases,
transfiriéndose al seno del líquido según las propiedades de transferencia del reactor y de las
solubilidades de los gases.
La cinética de reducción de azufre elemental se estudió en condiciones de flujo continuo de H2.
Para ver el transcurso de la reacción se determinó la velocidad de formación de sulfuro de
hidrógeno, capturando el H2S generado en el reactor, durante 15 minutos, en trampas de 1 litro de
solución de NaOH 0,1 N. En cada determinación de velocidad de formación de sulfuro de
hidrógeno se emplearon soluciones frescas de NaOH 0,1. En los períodos de tiempo en que no se
realizó esta determinación, el H2S se atrapó en trampas de 1 litro de solución de NaOH 0,5 N.
Una trampa de CuSO4 fue usada como indicador de la saturación de estas últimas trampas.
Considerando el H2S atrapado en los dos tipos de trampas de NaOH y el sulfuro total presente en
el reactor, se calculó el consumo de azufre elemental.
Se empleó una agitación de 250 RPM, suficiente para lograr la suspensión completa de las
partículas de azufre. El procedimiento para determinar este valor se detalla en el APÉNDICE A.
3.1.1.1 Análisis de muestras
Se tomaron muestras del reactor periódicamente para la determinación de la concentración de
sulfuro y recuento directo de bacterias.
También se tomaron muestras del reactor para realizar los siguientes análisis a las partículas de
azufre: determinación del potencial zeta, determinación del patrón de difracción de rayos X y
estudio de adherencia bacteriana.
25
De cada trampa de NaOH 0,1 N empleada en la determinación cinética, se tomó una muestra para
la determinación de la concentración de sulfuro.
3.1.2
Sistema experimental reactor gaslift
La distribución detallada de los componentes del sistema experimental, conexiones,
instrumentación y control, se muestra en la Figura 6.
Figura 6. Distribución detallada de equipos, conexiones y sistemas de control y adquisición de datos del
sistema experimental del reactor gaslift. La nomenclatura es la misma empleada en la Figura anterior.
Este sistema experimental es similar al del reactor agitado mecánicamente, sólo que en este caso
se utilizó un reactor gaslift y la agitación fue de tipo neumática. El pH se registró en la zona
comprendida entre el tubo deflector y el nivel del líquido. El volumen de la fase líquida fue de
5,7 litros.
El cultivo bacteriano utilizado en este reactor provino del reactor agitado utilizado anteriormente.
Una vez que se concluyeron los experimentos con ese reactor, se centrifugó su contenido a 300
RPM durante 5 minutos para separar las partículas de azufre. El sobrenadante fue sometido a
26
centrifugación a 8000 RPM durante 15 minutos, obteniéndose de esta manera un pellet de
bacterias. Para inocular el reactor gaslift se resuspendió el pellet con medio de cultivo fresco.
Al reactor gaslift, con 5,55 litros de medio de cultivo, se le agregó azufre elemental en la forma
de azufre flor cristalino (diámetro promedio de partículas de 30,7 µm). Después de 1 día, se
inoculó el reactor con 150 mL de cultivo bacteriano y fue cerrado a una presión de 2 psig de
hidrógeno. Después de 10 días, fue operado con flujo continuo de hidrógeno para distintas UGR,
manteniéndose la presión en aproximadamente 1 psig.
Se agregaron 228 gramos al reactor, pero la cantidad de azufre suspendido dependió de cada UGR
empleada. De esta manera, aumentó la concentración de azufre suspendido cada vez que se
aumentó la UGR. Las partículas de azufre que no lograban ser suspendidas, permanecían en el
fondo del reactor.
La fuente de electrones se suministró en fase gas como H2. Tanto el flujo de este gas como el de
CO2 se monitorearon con rotámetros, previamente calibrados con un flujómetro de película
ascendente. Estos gases fueron burbujeados al reactor a través del difusor de gases,
transfiriéndose al seno del líquido según las propiedades de transferencia del reactor y de las
solubilidades de los gases
Las determinaciones cinéticas se realizaron de modo similar a como se realizaron en el reactor
agitado mecánicamente. Las trampas fueron de las mismas concentraciones, pero con volúmenes
de 850 mL.
3.1.2.1 Análisis de muestras
Se tomaron muestras del reactor periódicamente para la determinación de la concentración de
sulfuro, azufre suspendido y recuento directo de bacterias. Con la finalidad de determinar
intermediarios de la reacción se tomaron muestras puntuales para análisis de sulfato (SO42-),
tetrationato (S4O62-), sulfito (SO32-), metabisulfito (S2O52-) y tiosulfato (S2O32-).
También se tomaron muestras del reactor para realizar los siguientes análisis a las partículas de
azufre: determinación del potencial zeta, determinación de la distribución de tamaños, análisis de
adherencia bacteriana y análisis superficial de las partículas de azufre.
De cada trampa de NaOH 0,1 N empleada en la determinación cinética, se tomó una muestra para
la determinación de la concentración de sulfuro.
Por último, se tomaron muestras del reactor para estudiar la diversidad bacteriana presente en el
sistema.
3.2
BACTERIAS Y MEDIO DE CULTIVO
Para el desarrollo de los experimentos se usó un cultivo autóctono formado a partir de una cepa
original de Desulfovibrio desulfuricans en medio autotrófico enriquecido con extracto de
levadura. Se usó hidrógeno y azufre elemental como fuente de energía y aceptor de electrones,
respectivamente.
27
Se utilizó un medio de cultivo constituido por (por litro de agua destilada): 0,2 g KH2PO4; 0,3 g
NH4Cl; 3,0 g MgCl2·6H2O; 0,5 g KCl; 0,15 g CaCl2·2H2O; 1·10-3 g Resazurina; 1,0 g extracto de
levadura; 2,5 g NaHCO3 (fuente de carbono en equilibrio con CO2); 1 mL de solución de
oligoelementos (Widdel et al, 1983); 10 mL de solución de vitamina de Wolfe (Atlas, 1997) y
1mL de una solución que contiene 3 mg de Na2SeO3·5H2O en un litro de NaOH 0,01M.
La anaerobiosis en ambos reactores fue alcanzada mediante la desgasificación del oxígeno
presente en el medio de cultivo, empleando hidrógeno gaseoso. Como indicador de anaerobiosis
se utilizó el reactivo Resazurina (7-hidroxi-3H-fenoxazina-3-ona-10-óxido) además del electrodo
de Eh. En el APÉNDICE B se detalla el papel de la resazurina como indicador de anaerobiosis.
3.3
DETERMINACIÓN
DE
PROPIEDADES
HIDRODINÁMICAS DE LOS REACTORES
DE
TRANSFERENCIA
E
La determinación del coeficiente combinado de transferencia de masa gas-líquido (kLa) para
ambos tipos de reactores, se realizó empleando el método dinámico (Dunn y Einsele, 1975). Se
midió la concentración del oxígeno disuelto en experiencias de absorción y desorción en fase
acuosa, mediante el empleo de un electrodo polarográfico y un sistema de adquisición de datos.
Se utilizó aire como fuente de oxígeno y nitrógeno gaseoso como desorbedor de aquel.
Un balance de masa de O2 disuelto en el sistema conduce a la siguiente relación:
Ecuación 35:
dC LO
2
dt
(
= (k L a )O2 · C LO2 − C LO2
∗
)
Donde:
CLO2
CLO2*
(kLa)O2
: concentración de oxígeno en la fase líquida
: concentración de saturación de oxígeno en la fase líquida
: coeficiente combinado de transferencia de masa gas-líquido para oxígeno
De la respuesta transiente de absorción y de la integración de la Ecuación 35, es posible
determinar kLa a partir de la siguiente expresión:
Ecuación 36:
C LO2 = C LO2 + (C L 0O2 − C LO2 )e (− k L a ·t )
∗
∗
Donde:
C L 0O
: concentración inicial de oxígeno en fase líquida
2
Los valores de kLa para hidrógeno y sulfuro de hidrógeno se calcularon usando los coeficientes
de difusión y el valor de (kLa)O2 determinado experimentalmente. De acuerdo a la teoría de
renovación y a la teoría de penetración (Miller, 1983; Moo-Young y Blanch, 1981), existe una
relación entre kLa para dos gases a las mismas condiciones del reactor. Esta relación está dada
por la siguiente expresión:
28
(k L a )H
Ecuación 37:
2
= (k L a )O2
DH 2
DO2
Esta determinación se llevó a cabo en un sistema de dos fases (medio y aire) y tres fases (medio,
aire y azufre flor). No hubo bacterias presentes en el reactor.
El Hold-up gaseoso global, ascendente (εGR) y descendente (εGD) en el reactor gaslift, fueron
determinados utilizando el método de expansión de volumen, sin bacterias ni partículas de azufre.
Se midió el Hold-up local descendente (εGLD) a diferentes profundidades del reactor, para obtener
una relación entre ambas variables para cada valor de UGR. Una vez conocida esta función, se
calculó el Hold-up total descendente (εGTD) mediante la siguiente expresión:
ε GTD
Ecuación 38:
h2
1
=
ε GLD (h)dh
h2 − h1 h∫1
El tiempo de circulación (tC) fue medido utilizando una esfera de polietileno de alta densidad
(densidad = 1 g·mL-1) inmersa en el líquido, sin bacterias ni partículas de azufre. Similarmente, el
tiempo que la esfera demora en la zona de ascenso (tR) y el tiempo que tarda en la zona
descendente (tD), fueron determinados mediante este método.
−
La velocidad de circulación del líquido ( VL ) fue calculada de acuerdo a la Ecuación 39 (Gouveia
et al, 2003):
−
VL =
Ecuación 39:
2hd + hB + hS
tC
Donde:
hd
: altura del tubo deflector
Las velocidades lineales del líquido ascendente (VLR) y descendente (VLD), se calcularon de
acuerdo a las siguientes expresiones (Lu y Hwang, 1995):
Ecuación 40:
V LR =
hd
tR
Ecuación 41:
V LD =
hd
tD
Las velocidades superficiales del líquido de ascenso (ULR) y de descenso (ULD) se calcularon
según las siguientes expresiones:
ULR = VLR (1 - εGR)
Ecuación 42:
29
ULD = VLD (1 - εGD)
Ecuación 43:
3.4
3.4.1
DETERMINACIONES ANALÍTICAS
Determinación de la concentración de Sulfuro total
La determinación de la concentración de sulfuro total (expresado como mg·L-1 de S) se llevó a
cabo mediante el método estándar del azul de metileno (Clesceri et al, 1998a) en un
espectrofotómetro Hatch.
Este método se basa en la reacción de las distintas especies de sulfuro en solución acuosa
(H2S(ac), HS- y S2-) con N,N-dimetil p-fenilenediamina y dicromato de potasio en medio ácido
para formar azul de metileno. El sulfuro total involucra la suma de las distintas especies de
sulfuro y se expresa en mg·L-1 de S.
Procedimiento:
Ajustar el método Nº 690 en el espectrofotómetro.
Diluir la muestra en matraz aforado de 50 mL o 100 mL.
Agregar 25 mL de la muestra diluida a una celda de vidrio. Utilizar otra celda “blanco” con
25 mL de agua destilada.
Agregar a cada celda 1 mL del reactivo sulfide 1® y 1 mL de reactivo sulfide 2®. Agitar.
Colocar la celda con el blanco en el espectrofotómetro, ajustar en cero y luego colocar la
celda con la muestra diluida. Multiplicar el resultado leído por la dilución realizada.
El método Nº 690 trae incorporado una curva de calibración, en consecuencia los valores de
absorbancia son convertidos automáticamente por el espectrofotómetro, a valores de
concentración de sulfuro. El límite de linealidad de este método es 0,600 ppm.
La precisión del método fue determinada por el fabricante utilizando soluciones estándar de
0,250 ppm de concentración de sulfuro y reactivos sulfide 1® y sulfide 2®. La desviación
estándar obtenida fue de ± 0,003 ppm (± 1,2%).
Conocido el pH de la muestra y las constantes de acidez, se puede determinar la concentración de
las distintas especies de sulfuro presentes (H2S(ac), HS- y S2-). En el caso de los bioreactores, el
pH del medio era 7,0, por lo tanto el 50% del sulfuro estaba como H2S(ac) y el otro 50% estaba
como HS-.
3.4.2
Determinación de sulfato, tetrationato, sulfito, metabisulfito y tiosulfato
Todos estos analitos se determinaron por cromatografía líquida de alta resolución (HPLC)
empleando columna de intercambio iónico. Se utilizó un cromatógrafo con detector de lámpara
de arreglo de diodos a una longitud de onda de 215 nm.
30
Los tiempos de retención se determinaron utilizando soluciones estándares de cada compuesto.
Se empleó una fase móvil constituida por una mezcla de NaHCO3 4 mM y Na2CO3 1,5 mM (pH
= 9,5), a un flujo de 1,2 mL/min.
Procedimiento:
Los tubos centrífuga, la jeringa de toma de muestra y el matraz de aforo se purgan con N2
para evitar contaminación con O2.
Se centrifuga la muestra a 8000 RPM durante 20 minutos para separar la bacterias y las
partículas de azufre.
Del sobrenadante se toma una alícuota de 300 – 500 µL y se diluye a 10 mL con fase móvil
en matraz de aforo de ese volumen.
Se inyecta en el cromatógrafo un volumen de 20 µL de la solución anterior.
Preparación fase móvil:
Se calienta H2O desionizada a 40ºC durante 30 minutos.
Se pesan las cantidades necesarias de bicarbonato y carbonato y se disuelven en el H2O
desionizada.
Se desgasifica esta solución mediante bombeo al vacío.
Se nitrogena la solución anterior durante 20 minutos.
3.4.3
Determinación de la concentración de células suspendidas
La concentración de células suspendidas se determinó por recuento directo, empleando una
cámara de recuento y un microscopio óptico convencional. Sólo se contabilizaron aquellas
bacterias que se encontraban suspendidas en la muestra y no aquellas que se encontraban
adheridas a las partículas de azufre.
3.4.4
Determinación de la concentración de azufre suspendido
La determinación de la concentración de azufre suspendido se llevó a cabo filtrando una muestra
de 20 mL a través de un filtro de microfibra de vidrio de 1,5 µm y secando el sólido a 105 ºC
hasta obtener peso constante, de acuerdo a método estándar de sólidos suspendidos (Clesceri et
al, 1998b). Se asumió que los sólidos suspendidos del reactor son esencialmente partículas de
azufre.
3.4.5
Determinación potencial zeta de las partículas de azufre
El potencial zeta de las partículas de azufre fue determinado a diferentes valores de pH, mediante
migración electroforética en un medidor de potencial zeta. Se utilizó un microscopio óptico
convencional con aumento 6x para observar las partículas dentro de la celda electroforética.
31
La interfase entre la capa difusa y la capa de Stern, en el modelo de la doble capa, corresponde al
potencial zeta. Este potencial puede ser medido de una manera muy simple, mientras que la carga
de la superficie y su potencial no pueden medirse (Hiemenz y Rajagopalan, 1997). Para efectos
prácticos la medida de potencial zeta es una buena aproximación del potencial superficial.
En presencia de un campo eléctrico, las partículas cargadas migran hacia el electrodo de carga
contraria. La velocidad con la que se desplazan las partículas depende de la magnitud de la carga
que posean y el sentido del desplazamiento depende de la polaridad que posean. Dependiendo del
pH y de las características superficiales de las partículas, éstas tendrán un valor determinado de
potencial zeta, ya sea negativo o positivo. Se denomina punto isoeléctrico al valor de pH en
donde las partículas tienen un valor de potencial zeta igual a cero.
Procedimiento:
Se filtra la muestra a través de un filtro de nitrato de celulosa de 0,45 µm.
Se seca el sólido a 40ºC durante 48 horas.
Se agregan 30 mg de sólidos secos a un vaso de precipitado con 300 mL de una solución de
KCl 1·10-3 M.
Se agita esta mezcla mediante placa agitadora hasta obtener una suspensión uniforme.
Se bombea la suspensión hacia la celda electroforética y se mantiene en recirculación por un
tiempo.
Se detiene el bombeo y una vez que las partículas de azufre están detenidas se les somete a
una diferencia de potencial de 300 V.
Se mide directamente el potencial zeta cada vez que las partículas pasan por una cuadrícula
visible con el microscopio. Se mide el potencial zeta a diferentes valores de pH, acidificando
el medio con HCl o alcalinizándolo con KOH. Para cada valor de pH se realizan tres
determinaciones con diferentes partículas.
Con los resultados se construye una curva potencial zeta – pH. Se ajusta una curva sigmoidea
y se determina el punto isoeléctrico.
Se repite 2 veces más el procedimiento desde el punto 3 en adelante, de tal manera de
asegurar la reproducibilidad.
3.4.6
Determinación distribución de tamaños de partículas de azufre
La distribución de tamaños de partículas de azufre se determinó mediante el método de
transmisión óptica. En este método se combina la ecuación de sedimentación de Stokes con la
relación entre la absorbancia y la concentración de partículas.
El método consiste en la medición del grado de sedimentación de las partículas a través de la
medición de la luz transmitida. La velocidad de sedimentación dependerá del tamaño de las
partículas. Una fuente de luz se sitúa en un plano de medición y la intensidad de la luz
transmitida es medida por un detector localizado en el lado opuesto. La relación entre
absorbancia y tamaño y número de partículas está dada por la siguiente expresión:
log
Ecuación 44:
32
n
I0
= K ·∑ k i · N i ·d i2
Ii
i =1
Donde:
I0
Ii
K
ki
Ni
di
: intensidad de la luz incidida a la muestra
: intensidad de la luz transmitida a través de la muestra
: coeficiente óptico de la celda y de forma de partícula
: coeficiente de absorbancia de la partícula di
: número de partículas di
: diámetro de partícula
La muestra es dispersada en una solución soporte en la que no sea soluble, no forme
aglomerados, no altere sus propiedades físico-químicas y cuyo índice de refracción debe ser
diferente al del sólido problema. En el presente estudio se seleccionó como medio dispersante al
etilenglicol.
Procedimiento:
Se filtra la muestra a través de un filtro de nitrato de celulosa de 0,45 µm.
Se seca el sólido a 40ºC durante 48 horas.
Las partículas secas se dispersan en etilenglicol
La dispersión resultante se sonica durante 20 minutos para evitar aglomeración de partículas.
Se dejan sedimentar las partículas de la dispersión de etilenglicol dentro del analizador.
Se registra automáticamente la luz transmitida en el plano de medición, durante la
sedimentación.
Una vez conocida la distribución de tamaños se calculó el tamaño promedio de partículas de
acuerdo a la siguiente expresión (Leva, 1960):
DP =
Ecuación 45:
1
Xi
∑
i =1 d i
n
Donde:
DP
Xi
3.4.7
: diámetro promedio de partículas
: fracción relativa de partículas di
Determinación patrón de difracción de rayos X de las partículas de azufre
El patrón de difracción de rayos X se determinó mediante incidencia de rayos X provenientes de
la radiación Cu Kα (1,5406 Å), en un difractómetro de rayos X. Este análisis se encargó al
Laboratorio de Cristalografía de la Facultad de Ciencias Físicas y Matemáticas de la Universidad
de Chile.
La difracción de rayos X es una técnica no destructiva de análisis que proporciona información
acerca de las fases cristalinas presentes en la muestra analizada.
Procedimiento:
33
Se filtra la muestra a través de un filtro de nitrato de celulosa de 0,45 µm.
Se seca el sólido a 40ºC durante 48 horas
Se envía muestra seca al Laboratorio de Cristalografía.
Se llena el portamuestra del difractómetro con muestra sólida
Se inciden rayos X sobre la muestra sólida y se obtiene el difractograma respectivo.
3.4.8
Análisis de adherencia bacteriana
El análisis de adherencia bacteriana fue llevado a cado mediante microscopía electrónica de
barrido (SEM) y fue encargado al Laboratorio de Física Experimental de la Facultad de Física de
la Pontificia Universidad Católica de Chile. Conjuntamente con la técnica SEM se determinó la
composición química elemental de la superficie de las partículas de azufre mediante
microanálisis por energía dispersiva (EDS).
Las etapas previas al SEM, es decir la deshidratación con alcohol, el secado de punto crítico y el
sombreado de las muestras, se encargaron al Laboratorio de Reproducción y Desarrollo de la
Facultad de Ciencias Biológicas de la Pontificia Universidad Católica de Chile. El secado de
punto crítico se llevó a cabo utilizando CO2, de acuerdo al procedimiento descrito por Porter et al
(1982). El sombreado se realizó con oro y paladio.
Procedimiento:
Se descarta el medio líquido de la muestra.
Se lava el sólido con agua destilada 10 veces para eliminar las bacterias mas bien depositadas
que adheridas.
Las bacterias adheridas se preservan con glutaraldehido al 6 %.
Se envía la muestra preservada al Laboratorio de Reproducción y Desarrollo, en donde se
deshidratan con alcohol y posteriormente son secadas con CO2 en su punto crítico.
Se sombrean las muestras con oro y paladio.
Se analizan las muestras mediante SEM en el Laboratorio de Física Experimental.
3.4.9
Análisis superficial de las partículas de azufre
El análisis superficial de las partículas de azufre se llevó a cabo mediante espectroscopía
fotoeléctrica de rayos X (XPS), utilizando rayos X provenientes de la radiación Al Kα (1486,6
eV). Este análisis se encargó al Laboratorio de Superficies de la Facultad de Ciencias Físicas y
Matemáticas de la Universidad de Chile.
XPS es una técnica espectroscópica que se basa en el efecto fotoeléctrico. La energía incidente
utilizada corresponde a rayos X monocromáticos. Esta energía es absorbida por los átomos
constituyentes de la muestra, produciéndose ionización de éstos y la emisión de electrones de
capas internas de su configuración electrónica. La energía cinética y el número de los electrones
fotoemitidos son detectados en un analizador de energía de electrones.
La diferencia de energía entre los átomos ionizados y neutros, corresponde a la energía de enlace
del electrón. Esta energía se toma como una medida directa de la energía requerida para remover
34
el electrón desde su nivel inicial hasta el nivel de vacío. En sólidos, esta energía se mide con
respecto al nivel Fermi del sólido en vez del nivel de vacío. Los átomos de mayor estado de
oxidación exhiben mayores energías de enlace, debido a interacciones electrostáticas entre el
electrón fotoemitido y el ion. La energía de enlace exacta de un electrón depende también del
ambiente químico y físico. En consecuencia mediante XPS se puede discriminar entre diferentes
estados de oxidación y ambientes químicos.
La energía de enlace se determina de acuerdo a la siguiente expresión:
Ecuación 46:
E ENLACE = hν − ECINÉTICA − Φ
Donde:
h
ν
Φ
: constante de Planck (6,62·10-34 J s)
: frecuencia de la radiación
: función trabajo
Esta técnica espectroscópica es superficial, ya que se emiten electrones ubicados a una
profundidad de 1 a 10 nm de la superficie del material a analizar. Se requieren condiciones de
ultra alto vacío para permitir analizar los electrones fotoemitidos sin la interferencia de las
colisiones de la fase gas.
Procedimiento:
Se filtra la muestra a través de un filtro de nitrato de celulosa de 0,45 µm.
Se seca el sólido a 40ºC durante 48 horas
Se envía muestra seca al Laboratorio de Superficies.
Se llena el portamuestra con muestra sólida
Se somete la cámara a condiciones de ultra alto vacío (~10-9 torr)
Se inciden rayos X sobre la muestra sólida y se obtiene el espectro respectivo
3.4.10 Detección de microorganismos mediante análisis de T-RFLP
Este análisis fue desarrollado por la profesora Blanca Escobar en el laboratorio de
Biohidrometalurgia del Departamento de Ingeniería Química y Biotecnología, de la Facultad de
Ciencias Físicas y Matemáticas de la Universidad de Chile.
El procedimiento consiste, a grandes rasgos, en extraer el DNA de la muestra, amplificarlo
utilizando un partidor marcado con fluorescencia para el gen 16S rDNA y posteriormente digerir
el ADN amplificado con una enzima de restricción específica.
El procedimiento detallado se puede ver en el APÉNDICE A.
35
3.5
3.5.1
COMPONENTES DEL SISTEMA EXPERIMENTAL
Descripción de componentes
1. Reactor agitado mecánicamente: este reactor era un recipiente cilíndrico de acrílico de
9,8·10-2 m de diámetro y 1,9·10-1 m de altura, con una capacidad aproximada de 1,3 litros. El
sello lo proporcionaba una tapa de acrílico y una empaquetadura de goma fijadas al reactor
mediante 12 pernos y 24 golillas. La tapa de acrílico, con 7 perforaciones, permitía la
utilización de éstas como puertos de conexión para la toma de muestra, para la entrada y
salida de gas y para los diversos instrumentos utilizados en el control y monitoreo del reactor
(termocupla, calefactor, electrodos de pH y Eh), tal como se muestra en la Figura B 3,
apéndice B.
2. Reactor gaslift: consistió en dos tubos concéntricos de acrílico, con ascenso del gas por su
espacio anular. Fue construido de acuerdo a los criterios y requisitos de diseño expuestos en
los resultados. Las características geométricas de este reactor se presentan en la Figura 7 y en
la Tabla 3.
36
16.80cm
1.00cm
1.00cm
11.13cm
34.99cm
9.93cm
7.62cm
7.02cm
50.50cm
38.15cm
22.07cm
17.90cm
4.00cm
1.00cm
1.00cm
16.86cm
Figura 7. Dimensiones del reactor gaslift.
Tabla 3. Características geométricas del reactor gaslift.
Parámetros Geométricos
Altura Reactor: Htot (cm)
Altura tubo deflector: hd (cm)
AR (cm2)
AD (cm2)
hB (cm)
hS (cm)
Dimensiones
92,5
53,5
38,7
38,7
3,8
13
37
3. Sistema de agitación mecánica reactor agitado mecánicamente: estaba constituido por una
barra magnética de 60 mm de largo y 9,4 mm de diámetro y una placa agitadora Variomag,
Electronicrüber, Compact HP1, con control manual de velocidad.
4. Distribuidor de gases reactor agitado mecánicamente: consistió en difusor de gases de
piedra porosa localizado inmediatamente sobre la barra agitadora magnética.
5. Distribuidor de gases reactor gaslift: el gas se distribuyó a través de 10 perforaciones
circulares (determinadas de acuerdo a los criterios expuestos en los resultados) de 0,7 mm de
diámetro ubicadas equidistantes entre sí. El gas se alimentó a través de un canal de sección
cuadrada de 0,4 cm ubicado en la base del reactor, según se muestra en la Figura 8.
Figura 8. a) Vista de la base del reactor. b) Corte transversal de la base del reactor
6. Sistema de trampas de retención de H2S(g): Las trampas de NaOH y de CuSO4 estaban
constituidas por botellas de vidrio templado Schott Duran con tapa de plástico de alta
resistencia, sello a presión y dos tubos conectores de vidrio.
38
7. Sistema de agitación de trampas: se empleó agitación mecánica utilizando barras
magnéticas como las utilizadas en la agitación del bioreactor agitado mecánicamente, con una
placa agitadora Nuova II Stir Sybron Termolyne.
3.5.2
Instrumentación y control
La instrumentación y control de los dos sistemas experimentales se realizó utilizando los
siguientes equipos:
1. Las señales de la variable pH se capturaron en un sistema de adquisición de datos consistente
en un convertidor analógico digital, marca Measuring Computing Co, modelo PMD 120 8LS,
el que operó con el software InstaCal y Tracer DAQ. El sistema de control de pH se basó en
un controlador micro PLC marca Array Electronic Co, modelo AF-20MR-D, operado con
software Quick II.
2. Sistema Autoparamétrico de Control de temperatura, marca Self Tune Plus.
3. Termocupla de Fe-Constantan tipo J, marca Veto, con blindaje de acero inoxidable.
4. Electrodo de combinación de pH, marca Hanna Instruments, modelo ML 1030
5. Electrodo de potencial de óxido reducción, marca Hanna Instruments, modelo HI 3230.
6. Registrador de pH, marca Cole Palmer, Chemcadet
7. Registrador de Eh, marca Cole Palmer, Chemcadet
8. Manómetro Bourdon, marca Veto de 8 psi.
9. Válvula solenoide, marca Nacom Industries Co, modelo M442C2AFR-HT.
10. Calefactor resistivo de Acuario de 100 W de potencia, con vaina de vidrio, de 13 cm de largo
y 1 cm de diámetro.
11. Flujómetro de película ascendente, modelo Optiflow 730, marca Humonics.
3.5.3
Aparatos e Instrumentos
1. Espectrofotómetro UV visible, marca Hach modelo DR/2000.
2. Celdas de vidrio de 2 cm de paso óptico.
3. Microscopio óptico Galen III, Cambridge Instrument, con binocular 10x y lentes 4x, 10x, 40x
y 100 x.
4. Cámara de recuento, marca Brand, modelo Neubauer Improved.
39
5. Balanza analítica, marca Metler H33-AR
6. Medidor potencial zeta, Zeta Meter, modelo 3.0
7. Analizador automático de distribución de tamaño de partículas, marca Horiba, modelo capa
300
8. Cromatógrafo para HPLC, marca Hitachi, con detector de arreglo de diodos marca Hitachi
modelo L-3000 y bomba Hitachi modelo L-6200.
9. Columna de intercambio iónico, marca Transgenomic, modelo ICSep – ANSC de 4,6 mm x
250 mm.
10. Filtros de microfibra de vidrio de 1,5 µm, marca Whatman 934 AH
11. Filtros de nitrato de celulosa de 0,45 µm, marca Sartorius AG
12. Tubos centrífuga
13. Rotámetro Gilmont Instruments, modelo F1200 con esfera de acero inoxidable.
14. Rotámetro Cole Palmer modelo FM 082-03 con esfera de acero inoxidable.
3.5.4
Conexiones sistemas experimentales
Las conexiones se realizaron utilizando mangueras Masterflex, tipos Tygon y C-flex números 13,
16 y 17; resistentes a medios ácidos y no permeables a los gases empleados.
En el Apéndice B se muestran 3 fotografías correspondientes al sistema experimental y al
montaje general del sistema, junto con los principales componentes así como también con el
sistema de control e instrumentación utilizados en este trabajo experimental.
3.6
MODELACIÓN DINÁMICA
La optimización de parámetros se realizó utilizando métodos de Gauss – Newton, considerando
como función objetivo a la suma de las diferencias cuadráticas entre los datos experimentales y
aquellos determinados en la integración del sistema de ecuaciones que describieron
adecuadamente el sistema reaccionante del reactor agitado mecánicamente (Sección 4.10).
La resolución simultánea de las ecuaciones diferenciales consideradas en el modelo se llevó a
cabo utilizando la función ODE del programa orientado a matemáticas Matlab® .
La bondad de ajuste de los resultados entregados por el modelo se determinó mediante prueba
estadística de Chi cuadrado (χ2).
40
CAPÍTULO 4. RESULTADOS Y DISCUSIÓN
En el presente capítulo se estudia la cinética de reducción de azufre mediada por bacterias en un
reactor agitado mecánicamente y en un reactor gaslift. Con estos resultados se comparan ambos
reactores, con la finalidad de encontrar el mejor diseño.
Tal como se estableció anteriormente, existen parámetros geométricos que afectan notablemente
las propiedades hidrodinámicas y de transferencia de los reactores gaslift. Por lo tanto, se diseña
el reactor de acuerdo a criterios de diseño considerando estos parámetros geométricos.
Previo a realizar los experimentos de determinación de cinéticas, es necesario conocer las
propiedades de transferencia de masa de ambas reactores y las propiedades hidrodinámicas del
reactor gaslift.
4.1
PROPIEDADES DE TRANSFERENCIA DE MASA DEL REACTOR AGITADO
MECÁNICAMENTE
Antes de realizar los experimentos de cinética de producción de H2S(g), es necesario conocer las
propiedades de transferencia de masa del reactor agitado mecánicamente, representadas por el
coeficiente combinado de transferencia de masa, kLa.
Esta determinación se realizó empleando oxígeno y nitrógeno para distintas velocidades
superficiales de gas (UG), tal como se detalla en la sección 3.3. La Ug será expresada en todo el
presente trabajo en m3N·m-2·s-1, en donde la letra N significa condiciones normales de
temperatura y presión (0ºC, 1 atm). Los resultados de las mediciones de (kLa)H2 para sistemas de
dos fases (gas, líquido) y tres fases (gas, líquido, sólido) se muestran en la Tabla 4.
Tabla 4. Coeficientes combinados de transferencia de masa para hidrógeno para distintas UG.
UG (m3N·m-2·s-1)
5,1·10-4
8,5·10-4
2,1·10-3
3,7·10-3
6,8·10-3
kLa (sistema de dos fases) (s-1) kLa (sistema de tres fases) (s-1)
5,6·10-3
N.D.
-3
6,7·10
7,0·10-3
9,3·10-3
8,2·10-3
-2
1,6·10
1,7·10-2
2,9·10-2
N.D.
N.D.: no determinado
A partir de la tabla anterior, se observa un progresivo aumento de kLa en función de UG, tanto
para el sistema de dos fases como para el de tres fases. La relación obtenida experimentalmente
es concordante con la teoría, en el sentido que al aumentar UG aumenta la cantidad de gas
entrante y con ello la cantidad de burbujas transfiriendo reactante gaseoso al medio, por lo que si
bien el coeficiente de transferencia de masa local (kL) no cambia, el cambio de área de burbujas
produce el aumento del coeficiente combinado, kLa. Naturalmente, se trabajó en el régimen de
burbujas, en donde el aumento de UG no llegó a cambiar el régimen de burbujas.
41
También es posible constatar que no hay diferencias significativas entre los valores de (kLa)H2
para el sistema de dos fases y tres fases. Se sabe que la incorporación de partículas sólidas a la
fase líquida conduce a un incremento de µeff, lo que trae consigo una disminución del área
interfacial, por lo que sería esperable una disminución de kLa al pasar a un sistema de tres fases.
Sin embargo, Joosten et al (1977) encontraron en un reactor agitado mecánicamente de tres fases
que las partículas de tamaño ≤ 250 µm no afectan significativamente el kLa, cuando la viscosidad
aparente de la suspensión no es mayor a cuatro veces la del líquido. En este caso las partículas de
azufre son bastante menores que 250 µm, por lo que es razonable que no haya mayores
diferencias entre ambos sistemas estudiados.
La determinación de kLa fue llevada a cabo sin la presencia de bacterias, pese a que autores como
Galaction et al, (2004) encontraron que la concentración celular aumenta la viscosidad del medio.
Esto provoca dos efectos sobre el coeficiente de transferencia de masa: la reducción de la
turbulencia y la perturbación del equilibrio dispersión - coalescencia de las burbujas. Estos
efectos fueron observados para un rango de concentraciones de biomasa comprendidos entre 30,5
y 120,5 g·L-1 en base seca. En el presente estudio la concentración máxima celular alcanzada fue
de 2,68·108 cel·mL-1 (ver sección 4.5). Este valor corresponde a 5,4·10-2 g·L-1 en base seca,
asumiendo que un gramo de biomasa contiene 1012 células y que una célula tiene un 80% de
humedad (Bailey y Ollis, 1986). Esta concentración es considerablemente menor que aquellas
empleadas por Galaction et al, por lo tanto en este trabajo se asume que la determinación de kLa
no es afectada por la bacterias. Por otra parte, según Bailey y Ollis (1986), el efecto de la biomasa
es despreciable sobre la viscosidad del medio para concentraciones celulares menores a 1·109
cel·mL-1.
4.2
ESTUDIO CINÉTICO DE LA REDUCCIÓN DE AZUFRE MEDIADA POR
BACTERIAS EN REACTOR AGITADO MECÁNICAMENTE.
Para ratificar la estequiometría de la reacción y para evaluar el efecto del burbujeo del hidrógeno,
se realizaron 2 experiencias en condiciones batch para las 3 fases (gas, líquido y sólido) en el
reactor agitado mecánicamente. Estos experimentos sólo duraron 5 horas, para evitar problemas
inhibitorios asociados a la acumulación de ácido sulfhídrico. Se midió la presión inicial y final de
H2, y la concentración inicial y final de sulfuro total (H2S (ac) + HS-, expresados como S) en el
reactor. Se obtuvieron velocidades de formación de sulfuro de hidrógeno (medidos en fase
acuosa) de 183 y 154 mg H2S·L-1·d-1. A partir de la diferencia de presión se determinó el
consumo de H2, siendo igual a 1,17·10-3 moles de H2 en ambos casos. Los moles de ácido
sulfhídrico formados fueron 1,21·10-3 y 1,08·10-3, para el primer y segundo experimento, con lo
que se obtuvieron cuocientes H2/H2S iguales a 0,97 y 1,08, respectivamente. De esta forma se
ratificó la estequiometría planteada en la Ecuación 1.
Los siguientes experimentos realizados en el reactor agitado mecánicamente se llevaron a cabo en
forma continua para la fase gas y en modalidad batch para las fases líquida y sólida. Se realizaron
3 experimentos de corta duración (24 horas) con la finalidad de optimizar las condiciones de
operación del reactor, en lo que a flujo de hidrógeno se refiere. La concentración de azufre inicial
fue de 5% (p/v). La reacción fue estudiada para tres velocidades superficiales de gas (2,1·10-3,
3,7·10-3 y 6,8·10-3 m3N·m-2·s-1), en tres diferentes experimentos. En los tres casos se obtuvo una
velocidad de formación de sulfuro de hidrógeno de 2,3 g H2S·L-1·d-1. Para la menor UG se obtuvo
42
esta velocidad de formación al cabo de 14 horas, mientras que para las otras UG se obtuvo luego
de 2 horas de reacción. En los tres experimentos el Eh permaneció constante con un valor en
torno a los -300 mV vs Ag/AgCl.
Las velocidades de formación de sulfuro de hidrógeno obtenidas en condiciones de flujo de H2
son notoriamente superiores a aquellas obtenidas sin flujo de este gas. En este último caso el área
de transferencia de masa gas líquido está dada sólo por la sección transversal del reactor,
mientras que en condiciones de flujo el área de transferencia es mayor, ya que está dado por las
burbujas de gas.
Considerando los resultados anteriores, se estimó que una velocidad superficial de gas (UG) de
2,1·10-3 m3N·m-2·s-1 era una velocidad adecuada para realizar un experimento de mayor duración.
Posteriormente se realizó un experimento de mayor duración (21 días), con una concentración
inicial de azufre de 4% (p/v). Los resultados de los primeros 10 días de experimento se muestran
en la Figura 9. Por tiempo cero se considera al comienzo del flujo continuo de hidrógeno.
Velocidad de formación H 2S (g) (mg·L-1·d-1)
2500
2000
1500
1000
500
1
0
0
1
2
3
4
5
6
7
8
9
10
Tiempo (días)
Figura 9. Velocidad de formación de H2S(g) para UG = 2,1·10-3 m3N·m-2·s-1. La flecha 1 indica que 18 g de
azufre fueron agregados al reactor.
Se observa un aumento gradual de la tasa de formación de H2S(g) con el transcurso del tiempo,
hasta alcanzar un valor máximo de 1,8 g H2S·L-1·d-1 en el día 2,5. Este valor se mantuvo hasta el
día 4,5. Después de transcurridos 5,4 días, disminuyó a 1,5 g H2S·L-1·d-1. Entre los días 7,5 y
9,13, la tasa de formación de H2S(g) disminuyó progresivamente. En ese último día, se agregaron
18 gramos de azufre al reactor (Figura 9, flecha 1), alcanzándose una concentración de azufre de
4,7% (p/v). Al cabo de 3 horas, se recuperó la velocidad de formación de H2S(g) alcanzando un
valor de 2,1 g H2S·L-1·d-1. Estos resultados sugieren que existe una limitación por la edad de las
43
partículas de azufre, es decir que la reacción estaría limitada por la propia disponibilidad del
azufre.
Entre los días 2,5 y 4,5, la concentración de sulfuro total en el reactor fue de 4,73 ± 0,12 mg·L-1
S. Después fue disminuyendo progresivamente hasta alcanzar un mínimo de 2,24 mg·L-1 S.
Después del día 9,13 cuando se agregó más azufre al reactor, la concentración de sulfuro total
aumentó a 7,15 mg·L-1 S; evidenciándose una tendencia similar a aquella obtenida para la
velocidad de formación de H2S(g).
Si se considera el aporte del sulfuro total en el reactor a la cinética de formación de H2S, este
representa un incremento muy marginal frente al H2S(g) atrapado en las trampas, tal como puede
visualizarse en la Figura 10. De esta manera queda en evidencia que el H2S atrapado en las
trampas es una muy buena medida de la cinética de formación de producto, siempre que haya una
buena desorción de ácido sulfhídrico.
-1
-1
Velocidad de formación H2S (mg·L ·d )
2500
2000
1500
1000
500
H2S (g)
H2S (ac) + HS- + H2S(g)
0
0
1
2
3
4
5
6
7
8
9
10
Tiempo (días)
Figura 10. Velocidad de formación de H2S considerando el aporte de sulfuro total en el reactor. UG =
2,1·10-3 m3N·m-2·s-1.
Realizando balances de masa del azufre remanente en el reactor y considerando el tamaño
promedio inicial de partículas (30,7 µm), se calculó la variación en el tiempo del diámetro
promedio de las partículas de azufre en el reactor (asumiendo que todas las partículas disminuyen
uniformemente su tamaño). En la Figura 11 se presentan los resultados para los primeros días del
experimento, antes de la adición de 18 gramos de azufre. Tal como puede apreciarse, desde el
comienzo del experimento se observa una disminución progresiva del diámetro promedio de
partículas en función del tiempo. Esta tasa se ve incrementada al cumplirse el primer día de
experimento. La tasa de disminución permanece prácticamente constante hasta el día 7. Desde
ese día hasta los 7 días y medio, la tasa es prácticamente nula. Luego, a partir del día 8, se
44
observa que el diámetro de partículas disminuye levemente, para finalmente permanecer
constante.
Hartler et al. (1967) encontraron que la reacción de disolución de azufre por reacción con
polisulfuros y el ion HS- es una reacción no catalítica con disminución de tamaño de partículas.
De acuerdo con Levenspiel (2002), este tipo de reacciones debería conducir a una disminución
del tamaño de partículas hasta su desaparición total. Sin embargo, en el experimento realizado en
esta oportunidad no se presentó dicha situación, ya que al cabo de los primeros nueve días de
experimento, la velocidad de formación de H2S(g) disminuyó drásticamente, mientras que el
tamaño promedio de las partículas sólo alcanzó a disminuir en un 9,8% (27,7 µm) con respecto al
tamaño inicial. Además cabe señalar que a contar del día 8, el diámetro promedio de partículas
permaneció constante, en cambio la velocidad de formación de H2S(g) continuó descendiendo.
De esta manera el descenso en la velocidad de formación de H2S(g) indicado en la Figura 9, no
parece deberse a la caída intrínseca de las partículas de azufre inherente a su agotamiento. En la
reducción de azufre en presencia de bacterias existe algún otro tipo de mecanismo distinto a
aquellos descritos para la reducción abiótica de azufre.
Diámetro promedio de partículas
(micrómetros)
31.0
30.0
29.0
28.0
27.0
26.0
25.0
0
1
2
3
4
5
6
7
8
9
Tiempo (días)
Figura 11. Diámetro promedio estimado de partículas de azufre en el reactor agitado mecánicamente. UG
= 2,1·10-3 m3N·m-2·s-1.
La evolución de la velocidad de formación de H2S(g) de los restantes días del experimento se
muestra en la Figura 12. En esta etapa del experimento se hicieron sucesivos cambios de UG. Por
otra parte, en la Figura 13 se presenta la evolución de la concentración de sulfuro total en el
reactor para el mismo período de tiempo.
45
2.2x10
2200
2.0x10
2000
1.8x10
-3
-3
-3
-2
1.6x10
-1
1800
UG(m N·m ·s )
1600
-3
1.4x10
3
Velocidad de producción de H2S (g) (mg/L/d)
-3
2400
1400
-3
1.2x10
1200
-3
1.0x10
1000
-4
8.0x10
800
-4
6.0x10
600
1
-4
2
4.0x10
400
9
10
11
12
13
14
15
16
17
18
19
20
21
Tiempo (días)
Figura 12. Velocidad de formación de H2S(g) para 5,1·10-4, 1,4·10-3 y 2,1·10-3 m3N·m-2·s-1. La flecha 1
indica que se agregaron al reactor 400 mg de extracto de levadura. La flecha 2 indica que se agregaron al
reactor 16 g de azufre.
Después de 12,2 días de operación, se disminuyó la velocidad superficial de gas a 1,4·10-3
m3N·m-2·s-1. Sin embargo, no se observaron cambios en la velocidad de formación de H2S(g) y la
concentración de sulfuro total permaneció constante en 7,64 ± 0,42 mg·L-1 S (ver Figura 13). En
el día 14, la UG fue disminuida a 5,1·10-4 m3N·m-2·s-1. Entre ese día y el día 15,3, la tasa de
formación de H2S(g) disminuyó de 2,04 a 1,42 g H2S·L-1·d-1 y la concentración de sulfuro total
aumentó de 9,93 a 20,85 mg·L-1 S (ver Figura 13), por lo que una posible inhibición por producto
de H2S(ac) podría haber ocurrido. Dado que el reactor estaba a pH = 7, las concentraciones recién
mencionadas equivalen a 5,27 y 11,07 mg·L-1 de H2S(ac), respectivamente. Se dejan expresadas
como concentración de ácido sulfhídrico, H2S(ac), ya que ésta es la especie reportada como
inhibitoria. Sin embargo, las concentraciones detectadas de ácido sulfhídrico en el reactor son
muy inferiores a las reportadas como inhibitorias en la literatura. Okabe et al (1992), trabajando a
pH = 7 reportaron que la inhibición comienza a una concentración de sulfuro total de 150 mg·L-1
S (equivalente a 80 mg·L-1 de H2S(ac)) y a una concentración de sulfuro total de 500 mg·L-1 S
(equivalente a 266 mg·L-1 de H2S(ac)) se produce un 50% de inhibición de utilización de lactato
(utilizado en ese estudio como fuente de carbono y energía). Reis et al (1992), trabajando a pH
6,6 y 6,2, reportaron inhibición total de reducción de sulfato para una concentración de 547 mg·L1
de H2S(ac). Okabe et al (1995), trabajando a pH = 7, encontraron que el rendimiento celular
decae a la mitad para una concentración de sulfuro total de 250 mg·L-1 S, lo que equivale a una
concentración de 133 mg·L-1 de H2S(ac). En consecuencia, se descarta que la disminución de la
velocidad de formación de H2S(g) sea debido a inhibición bacteriana por ácido sulfhídrico. Lo
que sí queda en evidencia, es una mala transferencia del H2S de la fase acuosa a la fase gaseosa
para una UG de 1·10-4 m3N·m-2·s-1.
46
-3
2.2x10
30.0
28.0
-3
2.0x10
26.0
-3
1.8x10
22.0
-3
1.6x10
-2
20.0
-1
24.0
UG(m N·m ·s )
-3
18.0
1.4x10
16.0
3
S)
-1
Concentración sulfuro total reactor (mg·L
32.0
-3
1.2x10
14.0
-3
12.0
1.0x10
10.0
-4
8.0x10
8.0
6.0
-4
6.0x10
4.0
-4
4.0x10
2.0
9
10
11
12
13
14
15
16
17
18
19
20
21
Tiempo (días)
Figura 13. Concentración de sulfuro total en el reactor para 5,1·10-4, 1,4·10-3 y 2,1·10-3 m3N·m-2·s-1. La
flecha roja indica que se agregaron al reactor 16 g de azufre.
A partir del día 15,3, tanto la concentración total de sulfuro como la velocidad de formación de
H2S(g) comenzaron a disminuir progresivamente. En el día 17,2 la UG fue aumentada a 1,4·10-3
m3N·m-2·s-1. Sin embargo, ambos parámetros continuaron disminuyendo. En el día 18, se
agregaron 400 mg de extracto de levadura al reactor (Figura 12, flecha 1), produciéndose un
ligero aumento en la velocidad de formación de H2S(g), pero no así en la concentración de
células suspendidas. Sin embargo, este efecto fue breve, ya que la velocidad de formación de
H2S(g) disminuyó nuevamente hasta alcanzar un mínimo el día 19,3. En ese momento se
agregaron 16 gramos de azufre al reactor (Figura 12, flecha 2), obteniéndose una concentración
de azufre de 4,7% (p/v). La velocidad de formación de H2S(g) alcanzó nuevamente un valor de
2,1 g H2S·L-1·d-1 pasadas 7,5 horas después de que se agregara esta nueva cantidad de azufre.
Conocido el valor de (kLa)H2 y asumiendo que la saturación de hidrógeno en el seno de la
solución es de un 70%, se puede calcular la tasa de transferencia de hidrógeno. Para UG = 2,1·10-3
m3N·m-2·s-1, ésta corresponde a 0,17 mol H2·L-1·d-1, por lo que sería esperable una máxima
velocidad de formación de H2S(g) de 5,8 g H2S·L-1·d-1. Sin embargo, sólo se obtiene una máxima
velocidad de formación de H2S(g) de 2,1 g H2S·L-1·d-1. Esto indica que no hay limitación por
transferencia de masa gas líquido de hidrógeno para UG mayores que 5,1·10-4 m3N·m-2·s-1. De
esta manera queda en evidencia que la edad de las partículas de azufre es la limitante más
importante de la velocidad de reacción para el rango de UG comprendido entre 1,4·10-3 y 6,8·10-3
m3N·m-2·s-1.
Al agregar extracto de levadura al reactor, se obtuvo un aumento en la velocidad de formación de
H2S(g). Un amino ácido común que está presente en el extracto de levadura es la cisteína.
Blumentals et al (1990) encontraron que este amino ácido es un nucleófilo que abre el anillo de
47
azufre, aumentando así la tasa de disolución del azufre. Belkin et al (1985) encontraron que la
presencia de extracto de levadura aumentaba la tasa de formación de sulfuros, con una
concentración óptima de extracto de levadura de 1 g·L-1. Estos resultados sugieren que el reactor
necesita un suministro permanente de extracto de levadura que asegure la mejor dispersión del
azufre.
Para descartar que el aumento en la velocidad de formación de H2S(g), no haya sido debido sólo
a la incorporación de azufre contenido tanto en la cisteína como en la metionina (también
presente en el extracto de levadura), se determinó el aporte de azufre. Por cada 100 gramos de
extracto de levadura hay 2 gramos de azufre, por lo que al agregar 400 mg de extracto de
levadura se incorporaron 8 mg de azufre al reactor que sólo explicarían una producción de 8,5 mg
de H2S durante las 6 horas que se detectó el aumento de la velocidad de formación de H2S(g), en
circunstancias que durante ese tiempo se produjeron 70 mg de H2S. Estos resultados reafirman el
postulado de un ataque nucleofílico por parte del azufre de la cisteína al azufre elemental presente
en el reactor.
En la Figura 14 se observa la evolución de la concentración de células suspendidas en el reactor a
lo largo de todo el experimento. En los días 3,0, 5,3 y 7,0, se agregaron 100 mL de medio de
cultivo sin extracto de levadura al reactor. No se observaron cambios en la velocidad de
formación de H2S(g) ni en la concentración celular, en los días 3,0 y 5,3. 10 horas después de que
se agregaran los últimos 100 mL de medio, la concentración celular aumentó de 7,70·106 a
1,1·107 cel/mL. En los días 13,5 y 16,4, se agregaron 100 mL de medio sin extracto de levadura
al reactor. La velocidad de formación de H2S(g) no sufrió cambios, mientras que la concentración
celular aumentó de 2,0·106 a 4,0·106 cel/mL después de 10 horas de la primera adición de medio,
y aumentó de 4,7·106 a 6,5·106 cel/mL 5 horas después de la última adición. Considerando estos
resultados, se concluye que las bacterias necesitan una renovación del medio de cultivo del orden
de dos días y medio, después de que se han aclimatado a las condiciones del reactor.
48
Concentración de células suspendidas
(cel/mL)
1.4E+07
1.2E+07
1.0E+07
8.0E+06
6.0E+06
4.0E+06
1
4
2.0E+06
5
2
3
6
0.0E+00
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22
Tiempo (días)
Figura 14. Concentración de células suspendidas en el reactor. Las flechas 1, 3 y 4 indican que se
agregaron 100 mL de medio sin extracto de levadura al reactor. La flecha 5 indica que se agregaron 400
mg de extracto de levadura al reactor. Las flechas 2 y 6 indican que se agregaron al reactor 18 y 16 g de
azufre, respectivamente.
En la Figura 15 se muestra la evolución del potencial de óxido reducción (Eh) del reactor a lo
largo de todo el experimento. En el día 7,55 (Flecha 1, Figura 15) se detuvo el flujo de hidrógeno
al reactor, con el objetivo de estudiar su efecto. Las condiciones reductoras empeoraron
rápidamente, reflejadas en un aumento del Eh desde -500 a -366 mV vs Ag/AgCl. Esta alteración
no tuvo mayor efecto en la tasa de reducción de azufre, ya que se encontraba disminuyendo antes
de este cambio y después continuó con la misma tendencia. Las bacterias suspendidas si se vieron
afectadas, ya que disminuyeron drásticamente su concentración desde 1,20·107 a 4,90·106 cel/mL
(Figura 14). Esto demuestra la sensibilidad de las bacterias reductoras de azufre frente a cambios
que pueda experimentar el potencial de óxido reducción. Una vez que se reinició el flujo de
hidrógeno, el Eh se recuperó rápidamente (flecha 2, Figura 15), indicando con ello que el
hidrógeno es fundamental en la mantención de las condiciones reductoras. Fitz y Cypionka
(1989), estudiando la reacción de tiosulfato a sulfito y sulfuro mediada por Desulfovibrio
desulfuricans, encontraron que el Eh disminuyó desde -240 a -420 mV en condiciones de baja
concentración de hidrógeno hasta condiciones de saturación de éste. En el presente estudio puede
haber sucedido algo semejante, ya que el Eh del reactor disminuye progresivamente en función
del tiempo de exposición al H2(g). En torno a los días 17 y 18 se obtiene un mínimo de Eh igual a
-515 mV vs Ag/AgCl, valor que se mantiene hasta el momento de la incorporación de extracto de
levadura, en donde inevitablemente ingresa oxígeno al sistema (flecha 4, Figura 15). Este valor
de Eh podría indicar condiciones de saturación de hidrógeno.
49
Cuando se agregó azufre elemental al reactor (flechas 3 y 5, Figura 15) se produjo un aumento
indeseado del Eh, debido a la inevitable incorporación de oxígeno al medio. Sin embargo, esta
alteración fue de carácter leve, sin que se presentaran problemas tanto en la concentración de
células suspendidas como en la velocidad de formación de H2S (g).
-300
0
2
4
6
8
10
12
14
16
18
20
22
24
26
-325
2
Eh (mV vs Ag/AgCl)
-350
-375
-400
-425
5
-450
-475
-500
3
-525
4
1
-550
Tiempo (días)
Figura 15. Potencial de óxido reducción del reactor. La flecha 1 indica que se interrumpió el flujo de
hidrógeno y se cerró el reactor con 2 psig de este gas. La flecha 2 indica que se reinició el flujo continuo
de hidrógeno. Las flechas 3 y 5 indican que se agregaron al reactor 18 y 16 g de azufre, respectivamente.
La flecha 4 indica que se agregaron al reactor 400 mg de extracto de levadura.
Durante los primeros 10 días de experimento, el Eh disminuyó desde -350 a -500 mV vs
Ag/AgCl y la concentración celular alcanzó un máximo de 1,2·107 cel/mL. Estos resultados
indican que se alcanzaron condiciones reductoras favorables para la respiración y crecimiento
celulares, de esta manera la velocidad de la reacción no estaría limitada por estas variables.
Los resultados experimentales muestran que la principal limitante de la velocidad de
bioreducción del azufre está dada por la propia disponibilidad de éste. Este hecho fue evidente en
los días 9,13 y 19,3, cuando se agregó azufre al reactor e inmediatamente aumentó la velocidad
de formación de H2S(g).
Un aumento de la concentración inicial de azufre provocó un aumento proporcional de la
velocidad de formación de H2S(g). Para UG mayores que 5,1·10-4 m3N·m-2·s-1, la velocidad de
hidrógeno no tuvo efecto en la velocidad de formación de H2S(g). Para un rango de
concentración de azufre de 4 a 5% (p/v), y para un rango de UG de 1,4·10-3 a 6,8·10-3 m3N·m-2·s-1,
se encontró que la velocidad de reacción (expresada en función del volumen de reacción) es de
primer orden con respecto al azufre (r = 0,995).
Se obtuvo una velocidad de formación de H2S(g) máxima de 2,1 g H2S·L-1·d-1durante un período
significativo de tiempo, para UG de 2,1·10-3 Nm3·m-2·s-1 y concentración inicial de azufre de 4,7%
(p/v). Por tratarse de una reacción heterogénea, es necesario conocer también la evolución de la
50
Velocidad de formación H2S (g) (mg L-1 d-1)
velocidad de formación de H2S(g) expresada en función de la masa y superficie de azufre. Estas
se presentan en las siguientes figuras, junto a la velocidad de formación de H2S(g) expresada en
función del volumen de reacción para todo el período de experimentación.
2500
2000
1500
1000
500
0
0
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15 16 17 18 19 20 21
Tiempo (días)
Figura 16. Velocidad de formación de H2S(g) expresado por volumen de reacción para todo el período de
Velocidad de formación H2S (g) (mg g-1 d-1)
experimento en el reactor agitado mecánicamente.
70
60
50
40
30
20
10
0
0
1
2
3
4
5
6
7
8
9
10 11 12 13 14 15 16 17 18 19 20 21
Tiempo (días)
Figura 17. Velocidad de formación de H2S(g) expresado por masa total de azufre para todo el período de
experimento en el reactor agitado mecánicamente.
51
Velocidad de formación H2S (g) (mg m-2 d-1)
600
500
400
300
200
100
0
0
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15 16 17 18 19 20 21
Tiempo (días)
Figura 18. Velocidad de formación de H2S(g) expresado por superficie total de azufre para todo el período
de experimento en el reactor agitado mecánicamente.
Al observar las últimas 3 figuras, se puede afirmar que la evolución de la velocidad de formación
de H2S(g) no tiene mayor diferencia si es expresada por volumen de reacción, masa o superficie
total de azufre. La única diferencia entre la Figura 16 por una parte, y la Figura 17 y Figura 18
por otra parte, se presenta después de que se son agregados 18 gramos de azufre al reactor (día
9,13). Cuando la cinética de formación de producto es expresada por masa y superficie de azufre,
el valor máximo obtenido después de esta incorporación de azufre es similar al obtenido entre el
día 3 y 5, mientras que para el caso de cinética expresada por volumen de reacción se obtiene un
valor mayor que el obtenido entre el día 3 y 5. Esto se debe a que al expresarlo en volumen, no se
corrige la variación en concentración que se produce al incorporar los 18 gramos de azufre.
Los resultados de las velocidades de formación de H2S(g) expresados en mg H2S·(g S)-1·d-1 con
sus respectivos intervalos de confianza se presentan en la Tabla 5. Al comparar estos resultados
con aquellos encontrados en la literatura (ver Tabla 1), queda de manifiesto que las tasas de
reducción de azufre obtenidas en este estudio son notablemente superiores a todas las reportadas,
con la excepción de las obtenidas por Azabou et al (2007), la que se encuentra dentro del orden
de las aquí reportadas.
Tabla 5. Velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG) obtenidas en el
reactor agitado mecánicamente
UG (m3N·m-2·s-1)
5,1·10-4
1,4·10-3
2,1·10-3
3,7·10-3
6,8·10-3
VHG (mg H2S·(g S)-1·d-1)
45,4 ± 4,0
53,0 ± 3,6
51,2 ± 1,7
52,0 ± 3,8
52,0 ± 4,1
52
4.3
DISEÑO Y CONSTRUCCIÓN DE REACTOR GASLIFT.
Como base de comparación entre el reactor agitado y el reactor gaslift en construcción, se
consideró la velocidad superficial de gas utilizada en el reactor agitado de 2,1·10-3 m3N·m-2·s-1 (la
que se utilizó la mayor parte del tiempo), equivalente a 0,94 v/v/m (volumen de gas por volumen
de reactor por minuto). Considerando esta última relación para el reactor gaslift, se obtiene un
flujo gaseoso de 9,5·10-5 m3/s, equivalente a una velocidad superficial de gas de la zona
ascendente (UGR) de 2,5·10-2 m3N·m-2·s-1, para un diámetro interno de tubo deflector de 7,02 cm
(tubo deflector seleccionado para la construcción del reactor gaslift).
Se planteó como requisito de diseño, un valor de kLa(H2) del mismo orden que el obtenido en el
reactor agitado para la misma v/v/m. De acuerdo a los resultados experimentales con valores de
kLa(H2) de ese orden no habría limitación por transferencia de masa gas líquido.
La velocidad de circulación del líquido debe ser lo suficientemente elevada para asegurar un buen
grado de mezcla (Bello et al, 1984; Chisti et al, 1988) y la suspensión de las bacterias. Vera
(1995) encontró que operando un reactor gaslift a una velocidad de circulación del líquido de
1,2·10-1 m/s, logró la suspensión de bacterias reductoras de sulfato. De acuerdo a la Ecuación 25,
para satisfacer este requisito de diseño se debe maximizar la diferencia (εGR - εGD) y minimizar el
cuociente AR/AD. Por otra parte, Bello et al (1985a y 1985b) encontraron que el kLa aumenta con
este cuociente, por lo tanto se requiere un cuociente AR/AD que optimice kLa y la velocidad de
circulación del líquido. De acuerdo a la literatura disponible, se optó como criterio de diseño una
relación AR/AD igual a 1 (Bello et al, 1984; Bello et al 1985a y 1985b; Chisti et al, 1988) y por
una relación altura diámetro tubo externo igual a 7.
Los parámetros geométricos del reactor determinados utilizando las correlaciones encontradas en
la literatura fueron hB, hS, hd y el número de orificios del difusor de gas. Los resultados se
resumen en la Tabla 3, y se estimaron de acuerdo a los criterios expuestos a continuación:
Según la Ecuación 25, ULR aumenta al disminuir los coeficientes de pérdida friccional tanto en el
fondo como en la parte superior del reactor. Estos coeficientes se minimizan al aumentar hB y hS,
ya que de esa manera hay menos resistencia al paso del líquido. Sin embargo, existen efectos
contrapuestos de hB sobre kLa en las correlaciones descritas por la Ecuación 26 y por la Ecuación
30, por lo que se tomó un valor intermedio de B igual a 0,5, para satisfacer los requisitos de kLa
de diseño. Con este valor de B no se menoscaba la velocidad superficial del líquido, ya que su
efecto según la ecuación 27 es positivo, mientras que según la Ecuación 31 es negativo, pero
despreciable. Según la Ecuación 28 y la Ecuación 29, un valor bajo de B mantendrá una alta
diferencia de Hold-up, lo que permitirá una alta velocidad del líquido, y el límite inferior a la que
fueron obtenidas estas correlaciones es 0,5. Por lo tanto se diseñó el reactor con B = 0,5, lo que
significó un valor de hB igual a 3,8 cm.
Según la Ecuación 28 y la Ecuación 29, un alto valor de T genera una gran diferencia de Hold-up
entre la zona ascendente y descendente, efecto deseable para obtener una buena circulación del
líquido. También genera efectos positivos sobre kLa y ULR, según la Ecuación 30 y la Ecuación
31, respectivamente. Sin embargo, no genera efectos positivos sobre kLa, según la Ecuación 26,
por lo que un valor de T intermedio igual a 2,8 satisface los requerimientos. Se obtuvo así un
valor de hS igual a 13 cm.
53
Las burbujas pasan a través de orificios de diámetro 0,7 mm, distribuidos en un anillo ubicado en
el punto medio entre la pared interior del reactor y la pared externa del tubo deflector, que
conforma un espacio de 0,2827 metros (ver Figura 8). Tomando como referencia este último
valor y utilizando la Ecuación 32, la Ecuación 33 y el requisito 3·dB, se calculó la cantidad de
orificios mediante iteración, obteniéndose un total de 10 orificios. Se obtuvo un valor de Re0 de
350 y uno de QG0 igual a 9,5·10-6 m3/s, valores que satisfacen las condiciones impuestas en la
Ecuación 33 y en la Ecuación 34, para validar el empleo de la Ecuación 32.
4.4
CARACTERIZACIÓN HIDRODINÁMICA Y DE TRANSFERENCIA DE MASA
DEL REACTOR GASLIFT.
Dado que el diseño se basó en correlaciones empíricas y modelos, es necesario realizar una
caracterización del reactor para ratificar que se cumplen los requisitos de diseño y conocer las
características hidrodinámicas del sistema.
Los resultados de las mediciones de (kLa)H2 en función de la velocidad superficial de gas
ascendente (UGR) para el reactor gaslift en un sistema de dos fases, se muestran en la Figura 19.
Los resultados expuestos en la figura corresponden a aquellos medidos en la zona superior del
reactor.
También se determinó kLa en la base y en el punto medio del tubo deflector, siempre en la zona
ascendente del reactor. Sin embargo la variación obtenida con respeto a la medición hecha en la
zona superior del reactor es poco significativa en ambos casos (-0,4 % para la base y -1,1% para
la medición realizada en el punto medio del tubo deflector). Por lo tanto se toma como valor
representativo de kLa del reactor a aquel medido en la zona superior del reactor. No se midió kLa
en la zona descendente, porque en esta zona el hold-up del gas y el grado de mezcla son menores
que en el resto del reactor (Hwang y Lu, 1997).
La determinación de kLa usando la Ecuación 36, requiere que el sistema esté perfectamente
agitado. Esta condición se cumple si (kLa·tC)-1 es mayor que 1 (Merchuk, 2003). En el presente
estudio se cumple para todos los casos determinados. Para reactores altos con mayores tC, no se
cumple esta condición y es necesario utilizar modelos más complejos para calcular kLa a partir de
los datos experimentales. Dentro de estos modelos destacan los propuestos por Merchuk et al
(1992) y Hwang y Lu (1997).
54
0,040
0,035
kLa (s-1)
0,030
0,025
0,020
0,015
0,010
0,005
0,000
0,000
0,010
0,020
3
0,030
-2
0,040
-1
UGR (m N·m ·s )
Figura 19. Variación de (kLa)H2 con UGR
El kLa aumenta con UGR, tal como en el caso del reactor agitado mecánicamente, por las mismas
razones expuestas anteriormente.
Los resultados experimentales concuerdan en orden de magnitud con muchos trabajos reportados
en la literatura para reactores Gaslift (Gavrilescu y Tudose, 1998; Tobajas et al, 1999; Freitas y
Teixeira, 2001). Los resultados experimentales obtenidos (en un rango de UGR comprendidos
entre 6,0·10-3 y 3,6·10-2 m3N·m-2·s-1) se correlacionan según kLa = a UGRb por:
Ecuación 47:
kLa = 1,05 · UGR 1,02
R2 = 0,991
La Figura 20 muestra la relación del Hold-up gaseoso local descendente con la profundidad del
reactor. Se observa un descenso del Hold-up con la profundidad, más rápido del que se esperaría
por simple compresión hidrostática del gas, debido probablemente a que no todas las burbujas
que ingresan al tubo deflector, la abandonan. También es posible observar que el hold-up
aumenta con UGR para todas las profundidades estudiadas, ya que al aumentar UGR aumenta la
cantidad de gas entrante y con ello la cantidad de burbujas.
55
0,08
Ug r= 0 ,0 11 m/ s
0,07
Ug r= 0 ,0 16 m/s
Ug r = 0 ,0 2 0 m/s
Ug r = 0 ,0 2 4 m/s
0,06
Hold-up (fracción)
Ug r = 0 ,0 3 2 m/s
Ug r = 0 ,0 3 6 m/s
0,05
0,04
0,03
0,02
0,01
0
15
25
35
45
55
65
75
85
Profundidad reactor (cm)
Figura 20. Variación del Hold-up gaseoso local descendente con la profundidad del reactor, para distintos
valores de UGR.
El descenso de Hold-up observado en la Figura 20, corresponde a un decaimiento exponencial,
para todas las UGR estudiadas, salvo para la velocidad menor. Este comportamiento concuerda
plenamente con otros trabajos encontrados en la literatura (Herrera, 1982; Couvert et al, 1999).
Conocida esta función, se calculó el Hold-up total descendente, utilizando la Ecuación 38 . En la
Tabla 6 se resumen los parámetros del ajuste exponencial, el coeficiente R2 y el εGTD para cada
valor de UGR estudiado. Los parámetros están referidos a una ecuación del tipo Ae-Bh, en donde h
es la profundidad y e es la función exponencial. En el caso de la menor UGR se utilizó un valor
promedio para estimar el εGTD, ya que no se obtuvo una significativa relación en este caso. No fue
posible medir hold-up a profundidades menores a 20 cm, debido a la turbulencia imperante en esa
zona.
Tabla 6. Resultados εGTD y ajuste exponencial.
UGR (m3N·m-2·s-1)
A
B (cm-1)
R2
εGTD (fracción)
1,1·10-2
1,6·10-2
2,0·10-2
2,4·10-2
3,2·10-2
3,6·10-2
--------0,080
0,114
0,117
0,121
0,106
-------0,029
0,029
0,028
0,021
0,015
------0,896
0,962
0,835
0,993
0,995
0,009
0,028
0,036
0,042
0,056
0,061
56
El εGTD corresponde entonces al Hold-up característico de la zona de descenso, expresado
simplemente como εGD. Los resultados experimentales obtenidos (en un rango de UGR
comprendidos entre 1,6·10-2 y 3,6·10-2 m3N·m-2·s-1) se correlacionan según εGD = a UGRb por:
εGD = 1,46 · UGR0,99
Ecuación 48:
R2 = 0,929
Los resultados obtenidos son muy similares a los encontrados por Couvert et al (1999), quienes
obtuvieron valores de 1,4 y 1 para los coeficientes a y b, respectivamente, para un rango de UGR
entre 5,0·10-3 y 5,7·10-2 m3N·m-2·s-1.
En la Figura 21 se muestran los resultados de la variación del Hold-up ascendente, descendente y
global con UGR. También se muestra la variación que experimenta la diferencia entre hold-up
ascendente y descendente con UGR.
0.09
0.08
Hold-up (fracción)
Ho ld -up as cend ent e
0.07
Ho ld -up d es cend ent e
Diferencia Ho ld -up
0.06
0.05
0.04
0.03
0.02
0.01
0.00
0.000
0.010
0.020
3
0.030
-2
0.040
-1
UGR (m N·m ·s )
Figura 21. Variación del Hold-up gaseoso ascendente, descendente, global y la diferencia entre hold-up
ascendente y descendente, para distintos valores de UGR.
El Hold-up gaseoso ascendente puede correlacionarse con una expresión similar a la descrita para
el descendente. En este caso es válida para valores de UGR comprendidos entre 1,1·10-2 y 3,6·10-2
m3N·m-2·s-1, y corresponde a la siguiente función:
Ecuación 49:
εGR = 1,37 · UGR0,86
R2 = 0,992
Nuevamente se encontró una buena concordancia con los resultados de Couvert et al (1999),
quienes encontraron una expresión similar con valores de 1,37 y 0,92 para los coeficientes a y b,
respectivamente. Korpijarvi et al (1999) encontraron la misma función, con valores de 0,55 y
0,65 para los coeficientes a y b, respectivamente.
57
Se encontró la siguiente función entre εGD y εGR:
Ecuación 50:
εGD = 1,019 εGR – 0,016
R2 = 0,991
La relación encontrada es diferente a aquella encontrada por Bello et al. para gaslift de tubos
concéntricos (1985b), y ampliamente utilizada en trabajos posteriores: εGD = 0,89 εGR. Sin
embargo, esta última relación fue obtenida para reactores gaslift con cuocientes AD/AR entre 0,11
y 0,69, en circunstancias que en el presente trabajo se utilizó un reactor con cuociente AD/AR
igual 1.
El Hold-up global se correlaciona con una expresión similar a las descritas para Hold-up
ascendente y descendente. La correlación encontrada es la siguiente:
Ecuación 51:
εG = 3,70 · UGR1,25
R2 = 0,991
Couvert et al (1999), encontraron una expresión similar con valores de 1,81 y 1,03 para los
coeficientes a y b, respectivamente. Es interesante destacar la similitud encontrada entre el
trabajo de Couvert et al y el realizado en esta oportunidad, a pesar del hecho de haber trabajado
con gaslift de distinta geometría, ya que esa publicación se basó en un Airlift rectangular.
Gavrilescu y Tudose (1998), encontraron valores de 1,89 y 1,20 para los coeficientes a y b,
respectivamente.
La diferencia de hold up ascendente y descendente (εGR - εGD) permaneció prácticamente
constante en torno a 0,014, para valores de UGR superiores a 1,0·10-2 m3N·m-2·s-1, pero con una
leve tendencia a aumentar para UGR superiores a 3,1·10-2 m3N·m-2·s-1.
Para UGR ≥ 1,6·10-2 m3N·m-2·s-1, se observó que algunas burbujas de gas quedaban atrapadas en la
zona descendente.
−
La Figura 22 muestra la variación de la velocidad de circulación del líquido ( VL ), de ascenso
(VLR) y descenso (VLD), al variar la velocidad superficial del gas. Se observa un aumento inicial
de las 3 velocidades hasta UGR ≈ 1,6·10-2 m3N·m-2·s-1, para luego alcanzar un plateau entre
1,6·10-2 y 2,1·10-2 m3N·m-2·s-1 de UGR.
58
0,25
-1
VL (m·s )
0,20
0,15
0,10
Velocidad ascenso
Velocidad de circulación
Velocidad de descenso
0,05
0,00
0,000
0,005
0,010
0,015
3
-2
0,020
0,025
-1
UGR (Nm ·m · s )
Figura 22. Variación de la velocidad del líquido con UGR. Los valores corresponden al promedio de 30
determinaciones.
Este comportamiento es concordante con los resultados mostrados en la Figura 21, ya que la
diferencia (εGR - εGD) es la fuerza motriz que permite la circulación del líquido, y si ésta
permanece constante, también permanecerá constante la velocidad del líquido, hecho que sucede
a partir de UGR mayor a 1,6·10-2 m3N·m-2·s-1. Estos hechos son también concordantes con la
observación de algunas burbujas que entran en el tubo deflector, y que permanecen retenidas allí.
Tanto VL como VLR, se ajustan adecuadamente al siguiente modelo:
VL
Ecuación 52:
V L max
=
U GR
k + U GR
−
Para VL , se obtuvo VL max = 0,22 m/s y k = 1,9·10-3 m/s (R2 = 0,997). Para VLR, se obtuvo VLR max
= 0,24 m/s y k = 2,8·10-3 m/s (R2 = 0,999) Couvert et al (1999), encontraron una tendencia
similar a la reportada en este trabajo, con VL max = 0,25 m/s y k = 2,0·10-3 m/s. Benthum et al
(1999) y Heijnen et al (1997) también reportaron similar tendencia, con valores de VL cercanos a
los encontrados en esta ocasión.
La evolución de la velocidad del líquido y del hold-up gaseoso observada en este trabajo, es
similar a la descrita para los regímenes I y II de los regímenes de recirculación de burbujas en
reactores gaslift (van Benthum et al, 1999; Heijnen et al 1997). En el régimen I, para velocidades
de gas muy bajas, no hay burbujas de gas presentes en la zona de descenso, ya que la velocidad
del líquido en esa zona es menor que la velocidad de deslizamiento promedio de las burbujas de
gas en el líquido. El hold-up gaseoso en la zona de ascenso aumenta, mientras que en la zona
descendente permanece con un valor igual a cero, por lo tanto la fuerza motriz para la
59
circulación, (εGR - εGD), aumenta y VLD aumenta con UGR. En el régimen II, VLD es igual a la
velocidad de deslizamiento de las burbujas de gas, lo que conduce a que burbujas de gas
permanezcan estacionarias en la zona descendente: la velocidad de las burbujas relativa al reactor
es cero. La diferencia (εGR - εGD) es mayor a cero, pero permanece constante, ya que εGR y εGD
aumentan a la misma tasa con el aumento de UGR. Por lo tanto, VLD permanece constante cuando
UGR es aumentado. En el régimen III, VLD aumenta con UGR y luego toma valores más altos que
la velocidad de deslizamiento. Las burbujas de gas recirculan junto con el líquido desde la zona
descendente hacia la zona ascendente. εGR aumenta más rápido que εGD.
Merchuk et al (1998), distingue entre un régimen de flujo homogéneo o régimen de flujo
uniforme de burbuja, un régimen de flujo de transición y un régimen de flujo heterogéneo. El
régimen homogéneo es equivalente a los regímenes I y II, y los regímenes de transición y
heterogéneo son en su conjunto equivalentes al régimen III.
La observación de burbujas atrapadas en la zona descendente, la diferencia de hold-up gaseoso y
la velocidad del líquido constante para UGR > 1,6·10-2 m3N·m-2·s-1, confirma la existencia de un
régimen de flujo II en el reactor gaslift para UGR mayores a este valor. Sin embargo, para valores
de UGR > 3,1·10-2 m3N·m-2·s-1, podría el reactor estar entrando a régimen III, de acuerdo a los
resultados de la diferencia de hold-up.
La presencia de sólidos conduce a un aumento significativo de la viscosidad efectiva de la
suspensión (µeff), y una mayor µeff aumenta la fricción de las paredes, por ende, se disminuye la
velocidad del líquido. Por otra parte, los sólidos suspendidos disminuyen la fuerza motriz para la
circulación del líquido, al cambiar las densidades medias en las zonas ascendente y descendente
del reactor gaslift (Heijnen et al, 1997). Sin embargo, diferentes autores (Miyahara y Kawate,
1992; Lu y Hwang, 1995; Schlötelburg et al, 1999) encontraron que el aumento de la
concentración de sólidos, para un rango de concentraciones de sólidos semejante a la utilizada en
el presente trabajo, no conduce a cambios significativos de la velocidad del líquido. Schlötelburg
et al (1999), encontraron una relación que correlaciona VL con UGR, con la viscosidad aparente y
con el hold-up sólido. Los exponentes de la viscosidad aparente y el hold-up sólido, indican que
su influencia sobre VL es más bien moderada. Por estas razones es que se llevaron a cabo las
determinaciones del hold-up gaseoso y de la velocidad del líquido sin la presencia de bacterias y
de partículas de azufre.
El rompimiento de las burbujas de gas causado por la fase sólida, podría conducir a un aumento
del hold-up gaseoso. Sin embargo, para las partículas de azufre utilizadas en el presente estudio
de bioreducción (tamaño promedio de partículas de 30,7 µm) este fenómeno es poco probable, ya
que Henriksen y Ostergaard (1974) encontraron un diámetro de partícula mínimo para el
rompimiento de las burbujas de gas en agua igual a 8,5·10-3 m. Por otra parte, para partículas
pequeñas, la coalescencia de burbujas puede conducir a una menor área interfacial gas-líquido y
una subsiguiente reducción del hold-up gaseoso. Sin embargo, esta influencia ha sido detectada
para una concentración de sólidos mayor que la empleada en el presente estudio (Miyahara y
Kawate, 1992; Schlötelburg et al, 1999). Además en el presente estudio, no se detectaron
diferencias significativas entre (kLa)H2 para sistemas de dos fases y tres fases, lo que indica que
las partículas de azufre utilizadas no provocarían coalescencia de burbujas.
De acuerdo a lo expuesto recientemente, la caracterización hidrodinámica y de transferencia de
masa gas-líquido del reactor gaslift realizada para un sistema de dos fases es también satisfactoria
60
para un sistema de tres fases. Además, ya se ratificó este comportamiento para el reactor agitado
mecánicamente.
Para determinar el grado de mezcla del reactor fue necesario determinar el coeficiente de
dispersión axial y el módulo de dispersión. Merchuk et al (1998), trabajando con un reactor
gaslift de tubos concéntricos, encontraron una correlación para determinar el coeficiente de
dispersión axial (D) en este tipo de reactores:
U
D = K 5 ·d e · GR
εG
Ecuación 53:
n4
Donde:
K5
de
n4
: constante ajustada por Merchuk et al
: diámetro equivalente
: constante ajustada por Merchuk et al
Las constantes K5 y n4 tienen un valor de 0,89 y 1,18, respectivamente (Merchuk et al, 1998), y
corresponden a valores promedios de distintos tipos de difusores de gas empleados por los
autores. Se encontró una baja variabilidad de los valores encontrados para K5 y n4 para los
distintos tipos de difusores, por lo que el empleo de valores promedio es una buena estimación.
El diámetro equivalente (de) viene dado por la siguiente expresión:
de =
Ecuación 54:
DR + DD
2
El reactor utilizado por Merchuk et al tenía un de igual a 0,060 m y un cuociente AR/AD igual a
1,01, mientras que el reactor gaslift del presente estudio tenía un de igual a 0,0702 m y un
cuociente AR/AD igual a 1. Las similitudes entre ambos reactores, avalan el empleo de la
Ecuación 53.
Para UGR entre 1,6·10-2 y 2,1·10-2 m3N·m-2·s-1, el coeficiente de dispersión axial fue de 4,1·10-2
m2·s-1. Este valor corresponde a un módulo de dispersión de 0,17, lo que representa una gran
dispersión (Levenspiel, 2002). Esto implica que el patrón de mezclado de este reactor se asemeja
más a un reactor perfectamente agitado que a uno de tipo pistón. Mediante los fundamentos y
criterios de diseño del reactor gaslift, es posible diseñar los parámetros geométricos de este
reactor, de tal manera de maximizar la velocidad de circulación del líquido.
Pese a que Merchuk et al (1998) estudiaron el patrón de mezcla en un reactor gaslift de dos fases,
la expresión que encontraron puede ser utilizada en el presente reactor, ya que la presencia de
partículas de azufre no altera significativamente la hidrodinámica de un reactor de dos fases.
Para el mismo rango de UGR, se calculó el número de Reynold (Re) considerando la velocidad de
circulación del líquido. Se obtuvieron valores comprendidos entre 1,4·104 y 1,8·104, lo que
indica condiciones de turbulencia. Estos resultados reafirman el buen grado de mezcla logrado en
el reactor gaslift.
61
4.5
ESTUDIO CINÉTICO DE LA REDUCCIÓN DE AZUFRE MEDIADA POR
BACTERIAS EN REACTOR GASLIFT
La cinética de bioreducción del azufre elemental fue estudiada durante 7 días y medio en el
reactor gaslift. Se trabajó por menos tiempo que en el reactor agitado, para evitar problemas de
disminución de la velocidad de reacción como los detectados en ese reactor. Durante estos 7 días
y medio se trabajó con 6 velocidades superficiales de gas diferentes, partiendo con 4,2·10-3 y
terminando con 2,3·10-2 m3N·m-2·s-1. Se utilizó azufre elemental en polvo igual al utilizado en el
experimento del reactor agitado mecánicamente, es decir azufre ortorrómbico α-S8 de tamaño
promedio de partículas de 30,7 µm.
22
20
1600
18
1400
16
1200
14
1000
12
10
800
8
600
6
400
200
0.000
-1
1800
Concentración de azufre (g·L )
-1
-1
Tasa de formación de H2S (mg·L ·d )
En la Figura 23 se presentan los valores promedios y los respectivos intervalos de confianza de la
tasa de formación de H2S(g) y de la concentración de azufre suspendido para cada una de las UGR
empleadas.
4
0.005
0.010
0.015
3
-2
0.020
2
0.025
-1
UGR(m N·m ·s )
Figura 23. Tasa de formación de H2S(g) y concentración de azufre en función de la velocidad superficial
del gas en la zona ascendente.
Para el rango de UGR comprendido entre 4,2·10-3 y 1,3·10-2 m3N·m-2·s-1, la velocidad de
formación de H2S(g) no experimentó ningún cambio significativo. La concentración de azufre
suspendido aumentó con la velocidad superficial del gas hasta 7,1·10-3 m3N·m-2·s-1. Para UGR
entre 7,1·10-3 y 1,3·10-2 m3N·m-2·s-1, la concentración de azufre permaneció constante. Para UGR ≥
1,7·10-2 m3N·m-2·s-1, aumentó tanto la tasa de formación de H2S(g), como la concentración de
azufre.
El comportamiento que experimenta la concentración de azufre al aumentarse la UGR para los 4
primeros valores, es similar a aquel obtenido para la velocidad de circulación del líquido en
función de UGR: un aumento inicial para luego alcanzar un plateau. Sin embargo, a partir de una
UGR igual a 1,7·10-2 m3N·m-2·s-1 comienza a aumentar la concentración de azufre suspendido. No
62
se cuenta con información acerca de la evolución de la velocidad de circulación del líquido para
UGR mayores que 2,1·10-2 m3N·m-2·s-1, pero sí se sabe que la diferencia de hold-up entre la zona
ascendente y descendente deja de ser constante y presenta un leve aumento para UGR mayores
que 3,1·10-2 m3N·m-2·s-1, lo que estaría indicando un aumento de la velocidad de circulación del
líquido. Esto trae como consecuencia un aumento del azufre suspendido, ya que la velocidad de
circulación del líquido es la fuerza impulsora que mantiene a las partículas en suspensión. El
líquido que circula por el loop formado dentro del reactor va suspendiendo partículas de azufre
que se encuentran en el fondo del reactor.
En la Tabla 7, se presenta el porcentaje de azufre que se logra suspender desde el fondo del
reactor gaslift para las concentraciones de azufre determinadas. Tal como se mencionó
anteriormente la máxima velocidad de circulación que se logró medir fue de 2,0·10-1 m/s, valor
insuficiente para suspender todo el azufre. Después del cuarto punto se registra un aumento del
porcentaje de azufre suspendido hasta alcanzar un 54,5%, debido probablemente a un aumento de
la velocidad de circulación del líquido. Sin embargo, no se pudo alcanzar mayor suspensión de
azufre, debido a que se estaba trabajando a caudales muy altos de hidrógeno lo que hacía muy
inestable e insegura la operación del reactor.
Tabla 7. Porcentaje de azufre suspendido desde el fondo del reactor gaslift para distintas UGR.
UGR (m3N·m-2·s-1)
0,004
0,007
0,010
0,013
0,017
0,023
Concentración azufre (g/L)
4,18
7,44
7,49
7,98
15,72
20,38
% Azufre suspendido
10,6
19,0
19,3
20,7
41,3
54,5
Tal como se vio en la Figura 23, un aumento de la concentración de azufre trae como
consecuencia un incremento de la velocidad de formación de H2S(g) expresada en función del
volumen de reacción. Para corregir esto y visualizar la evolución efectiva de la velocidad de
formación de H2S(g), es necesario expresarla en función de la masa o superficie disponible de
azufre.
Realizando balances de masa del azufre remanente en el reactor y considerando el tamaño
promedio inicial de partículas (30,7 µm), se calculó la variación en el tiempo del diámetro
promedio de las partículas de azufre en el reactor (asumiendo que todas las partículas disminuyen
uniformemente su tamaño). Con este valor y conociendo la masa de azufre suspendido, se calculó
la superficie disponible de las partículas de azufre suspendidas. En la siguiente figura, se puede
ver la velocidad de formación de H2S(g) en función de la masa y de la superficie total del azufre
suspendido en el reactor.
63
1000
70
900
60
800
50
700
40
600
30
500
20
-2
-1
80
Velocidad de formación de H2S (mg·m ·d )
1100
-1
-1
Velocidad de formación de H2S (mg·g ·d )
90
400
10
0
0.000
0.005
0.010
0.015
3
-2
300
0.025
0.020
-1
UGR(m N·m ·s )
Figura 24. Velocidad de formación de H2S(g) en función de la masa y de la superficie total del azufre
suspendido en el reactor
Al observar la figura, se aprecia que los primeros cinco puntos están en un rango acotado de
valores, mientras que el último punto se escapa claramente. Este último punto se obtuvo en
condiciones de alta inestabilidad del reactor en que no se pudieron tomar muchas muestras (N =
3), haciendo muy incierta esta medida.
Para el rango de UGR comprendido entre 4,2·10-3 y 2,3·10-2 m3N·m-2·s-1, se encontró que la tasa de
formación de H2S(g) expresada en volumen de reacción, aumentó linealmente con la
concentración de azufre suspendido (r = 0,964), de manera similar a lo obtenido en el reactor
agitado mecánicamente. Para este mismo rango de UGR, se encontró la siguiente expresión
cinética general: ([S0] se refiere a la concentración de azufre activo expresado en mol·L-1)
Ecuación 55:
[ ]
rH 2 S = 5,87 ⋅ 10 −2 d −1 ⋅ S 0
0.93
La reacción fue de primer orden con respecto al azufre, con un coeficiente de correlación de
pearson (r) de 0,927. El término de concentración de hidrógeno aparece implícito en la constante
cinética, ya que se asume que está en exceso.
En la Figura 25 se presentan los valores promedios y los intervalos de confianza de la
concentración de sulfuro total en el reactor para cada una de las UGR empleadas. Su
comportamiento es similar al obtenido para la concentración de azufre y para la tasa de formación
de H2S(g), ya que permanece constante para un rango de UGR comprendido entre 4,2·10-3 y
1,0·10-2 m3N·m-2·s-1, y aumenta para UGR > 1,3·10-2 m3N·m-2·s-1.
64
-1
Concentración de sulfuro total (mg·L S)
14.00
12.00
10.00
8.00
6.00
4.00
2.00
0.00
0.000
0.005
0.010
0.015
0.020
0.025
UGR (m3N·m-2·s-1)
Figura 25. Concentración de sulfuro total en función de la velocidad superficial del gas en la zona
ascendente.
Las concentraciones de sulfuro detectadas en este reactor son bastante más bajas que aquellas
reportadas como inhibitorias para bacterias reductoras (Okabe et al, 1992 y 1995; Reis et al,
1992), de acuerdo a lo discutido en la sección 4.2. Por lo tanto, hay una adecuada desorción del
H2S(ac) con las velocidades superficiales de gas empleadas.
Durante los 7,5 días de experimento, la concentración celular aumentó de 1,98·108 cel·mL-1 a
2,68·108 cel·mL-1.
Conocido el valor de (kLa)H2 y asumiendo que la saturación de hidrógeno en el seno de la
solución es de un 70%, se puede calcular la tasa de transferencia de hidrógeno. Para UGR =
2,3·10-2 m3N·m-2·s-1, ésta corresponde a 0,46 mol H2·L-1·d-1, por lo que sería esperable una
máxima velocidad de formación de H2S(g) de 15,5 g H2S·L-1·d-1. Sin embargo, sólo se obtiene
una velocidad de formación de H2S(g) de 1,6 g H2S·L-1·d-1. Esto indica que no hay limitación por
transferencia de masa de hidrógeno.
En los experimentos realizados en el reactor gaslift se obtuvo una tasa promedio de formación de
H2S(g) de 65,6 ± 7,0 mg H2S·(g S)-1·d-1 (687 ± 71 mg H2S·(m2 S)-1·d-1), para un rango de UGR
comprendido entre 4,2·10-3 y 2,3·10-2 m3N·m-2·s-1.
4.6
COMPARACIÓN DE REACTORES
En la Figura 26 se comparan los resultados de las velocidades de formación de H2S(g) por gramo
de azufre suspendido (VHG) en función del kLa, con sus respectivos intervalos de confianza, para
los dos reactores utilizados en este estudio. El rango de kLa utilizado en ambos casos es similar,
65
salvo el primer punto del reactor gaslift, por lo que no se considera este punto en este gráfico ni
en los siguientes. Las VHG obtenidas en el reactor agitado mecánicamente son prácticamente
independientes del kLa, para valores mayores a 5,6·10-3 s-1. En el reactor gaslift también se
obtiene una independencia de kLa hasta un valor de 2,2·10-2 s-1. A partir de este valor, se obtiene
un considerable aumento de VHG, pero atribuido a aspectos hidrodinámicos relacionados con la
velocidad de circulación del líquido más que a transferencia de masa, de acuerdo a lo explicado
anteriormente. Tal como se evidenció durante el trabajo experimental en ambos reactores, no hay
limitación por transferencia de masa gas líquido.
VHG (mg H2S·(g·S)-1·d-1)
120.0
Reacto r Gaslift
100.0
Reacto r A gitado M ecánicamente
80.0
60.0
40.0
20.0
0.0
0.000 0.005 0.010 0.015 0.020 0.025 0.030 0.035
kL a (s-1)
Figura 26. Velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG) en función de kLa.
Para comparar reactores de diferentes dimensiones se suele emplear la expresión v/v/m o
volumen de gas por volumen de reactor por minuto. Mediante esta expresión se corrige el caudal
de entrada de gas con el volumen del reactor. En la siguiente figura se comparan las VHG
obtenidas por cada reactor en función de v/v/m. El comportamiento observado es muy similar al
de la figura anterior. En ambas figuras, se aprecia que los primeros puntos en ambos reactores
están en un rango acotado de valores, mientras que el último punto del reactor gaslift se escapa
claramente. Tal como se discutió previamente, este último punto se obtuvo en condiciones de alta
inestabilidad del reactor en que no se pudieron tomar muchas muestras (N = 3), haciendo muy
incierta esta medida.
66
VHG (mg H2S·(g·S)-1·d-1)
120.0
100.0
80.0
60.0
40.0
20.0
Reacto r Gaslift
Reacto r A gitado M ecánicamente
0.0
0.0
0.5
1.0
1.5
2.0
v/v/m
2.5
3.0
3.5
Figura 27. Velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG) en función de
v/v/m.
Una característica importante de los reactores que permite compararlos es la potencia de
agitación. La potencia suministrada al reactor gaslift se calculó asumiendo una expansión
isotérmica del gas de entrada (hidrógeno), tal como se resume en la siguiente expresión:
p
P = n·R·T ·ln 1
p2
Ecuación 56:
Donde:
P
n
p1
p2
: potencia
: flujo de moles de gas a la entrada del reactor
: presión en la base del reactor
: presión de cabeza del reactor
Para el reactor agitado mecánicamente se calculó el cuociente entre la potencia consumida con
aireación y aquella consumida sin aireación, de acuerdo a la Ecuación 57 (Hughmark, 1980):
Ecuación 57:
V
PG
= 0,1· G
P0
N ·VL
Donde:
PG
P0
VG
VL
: potencia consumida con aireación
: potencia consumida sin aireación
: flujo de gas
: volumen fase líquida
67
−0 , 25
N 2 ·d 4
·
2/3
g ·H L ·V L
−0 , 20
N
d
HL
: velocidad de agitación
: longitud paleta de agitación (impeller)
: altura líquido
Una vez calculado el cuociente anterior, se calculó P0 utilizando el diagrama de Martin (Nagata,
1975). Este diagrama presenta diversas curvas de correlación entre el número de potencia (NP) y
el número de Reynolds (Re). Cada una de estas curvas representa un distinto tipo de impeller.
Conocida la velocidad de agitación, se determinó el número de Reynols, de acuerdo a la siguiente
expresión:
Re =
Ecuación 58:
d 2 · N ·ρ
µ
Donde:
ρ
µ
N
d
: densidad del líquido
: viscosidad dinámica del líquido
: velocidad de agitación
: longitud paleta de agitación (impeller)
Considerando que la velocidad de agitación en el reactor de agitación fue de 250 RPM y que la
longitud de la barra magnética utilizada como impeller era de 6 cm, el Re alcanzado bajo las
condiciones experimentales fue de 1,8·104; siendo del mismo orden de magnitud que el obtenido
para el reactor agitado mecánicamente. Con este valor se interpoló el valor de NP utilizando la
curva correspondiente al impeller más parecido a la barra magnética en el diagrama de Martin. El
valor de NP fue de 4·10-5. P0 se determinó de acuerdo a la siguiente ecuación:
NP =
Ecuación 59:
P0
ρ · N 3 ·d 5
Con el valor interpolado de NP se obtuvo un valor de P0 igual a 0,072 W, equivalente a una
potencia por unidad de volumen de 65 W/m3. En la Figura 28 se comparan los resultados de las
velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG) en función de la
potencia suministrada, con sus respectivos intervalos de confianza, para los dos reactores
utilizados en este estudio. Se observa claramente que la potencia suministrada al reactor gaslift es
notoriamente menor que aquella suministrada al reactor agitado mecánicamente. Por lo tanto
desde un punto de vista de potencia suministrada, es claramente conveniente el empleo del
reactor gaslift, ya que se logra un patrón de mezclado aceptable, una buena suspensión de azufre
y mayores VHG con menores consumos de potencia.
68
VHG (mg H2S·(g·S)-1·d-1)
120.0
100.0
80.0
60.0
40.0
Reacto r Gaslift
Reacto r A gitado M ecánicamente
20.0
0.0
0
50
100
150
200
Potencia suministrada (W/m 3)
250
Figura 28. Velocidades de formación de H2S(g) por gramo de azufre suspendido (VHG) en función de la
potencia suministrada.
En los experimentos realizados en el reactor gaslift se obtuvo una tasa promedio de formación de
H2S(g) de 65,6 ± 7,0 mg H2S·(g S)-1·d-1 (687 ± 71 mg H2S·(m2 S)-1·d-1), para un rango de v/v/m
comprendido entre 0,17 y 0,93. Mientras que en el reactor agitado se obtuvo una tasa promedio
de formación de H2S(g) de 50,7 ± 2,7 mg H2S·(g S)-1·d-1 (513 ± 38 mg H2S·(m2 S)-1·d-1), para un
rango de v/v/m comprendido entre 0,22 y 2,97. La velocidad promedio de formación de H2S(g)
obtenida con el reactor gaslift es un 30% superior a aquella obtenida con el reactor agitado. Esta
diferencia puede deberse a que en la zona de ascenso del reactor gaslift, las burbujas de gas
podrían flotar preferentemente las partículas de tamaño más pequeño dentro de la distribución de
tamaños de las partículas de azufre presente en el reactor.
4.7
ESTUDIO DE ADHERENCIA BACTERIANA Y ANÁLISIS SUPERFICIAL DE
PARTÍCULAS DE AZUFRE
Con el propósito de indagar con mayor profundidad las causas de la disminución de la velocidad
de formación de H2S(g) detectada en el reactor agitado, se tomaron y analizaron microfotografías
de partículas de azufre. En el día 8,5, cuando ya era evidente la disminución de la velocidad de
formación de H2S(g) se tomó una muestra para realizar un análisis microscópico mediante la
técnica SEM. Mediante las microfotografías obtenidas, se constató la existencia de adherencia
bacteriana en la superficie de las partículas de azufre. Las bacterias adheridas pueden ser
apreciadas en la Figura 29. Al comparar esta microfotografía con otra tomada a partículas de
azufre sometidas a las mismas condiciones experimentales, pero sin la presencia de bacterias
(Figura 30), se deduce que la formación de biofilm sólo tiene lugar en presencia de bacterias.
Además queda de manifiesto que la superficie inicial de las partículas de azufre es prácticamente
lisa y libre de imperfecciones. Un análisis de EDS realizado con la microfotografía mostrada en
la Figura 30 indica que sólo había azufre.
69
Se ha encontrado que cultivos puros y mixtos de bacterias reductoras de sulfato cultivadas en
laboratorio a menudo se adhieren a superficies (Nielsen, 1987). También se ha encontrado que
pueden formar biofilms en materiales inertes de transporte bajo condiciones de flujo turbulento
(van Houten el al, 1994; Hulshoff, 2004; Visser at al, 1993). Por otra parte, Espejo y Romero
(1987) estudiaron crecimiento de Thiobacillus ferrooxidans en partículas de azufre elemental. Sin
embargo, en el presente trabajo se reporta adherencia bacteriana en azufre elemental por parte de
otro grupo diferente de bacterias: bacterias reductoras de azufre. El fenómeno descrito puede
tener dos efectos contrapuestos en el diseño del reactor de este estudio; es posible que crezca un
gran número de bacterias asociadas directamente a las partículas de azufre, aumentando y
facilitando su biodisponibilidad o, puede resultar que se termine por ocluir el azufre en sus sitios
de reacción, impidiendo la generación de azufre en fase acuosa, deteniendo así la reacción. La
sostenida disminución de la velocidad de formación de H2S(g) obtenida a partir del día 4,5 de
experimentación, indica que se está frente a la segunda alternativa.
Figura 29. Adherencia bacteriana en partículas de azufre en el reactor agitado mecánicamente. La foto fue
tomada el día 8,5. Mag. = 6,50 KX.
70
Figura 30. Microfotografía de una partícula de azufre en ausencia de bacterias. Mag. = 5,00 KX.
En la Figura 31 se muestra otra microfotografía de partículas de azufre del día 8,5. Se observa
claramente que además de bacterias existen sustancias adheridas al azufre, las que ocupan la
mayor cantidad de la superficie. Se realizó un análisis de EDS con la imagen mostrada en esta
figura. Los elementos más abundantes en la superficie analizada fueron carbono, oxígeno y
azufre, con abundancias atómicas de 58,3%, 28,5% y 3,11%, respectivamente. La razón de
abundancias atómicas entre carbono y oxígeno es mayor a 2, lo que indica que las sustancias
adheridas a las partículas de azufre son de origen orgánico ya que las sustancias inorgánicas
poseen una razón de abundancias entre carbono y oxígeno menor a 1. Estas sustancias orgánicas
detectadas pueden corresponder al film acondicionador de compuestos macromoleculares
adsorbidos de un biofilm bacteriano.
71
Figura 31. Microfotografía de una partícula de azufre en el reactor agitado mecánicamente. La foto fue
tomada el día 8,5. Mag. = 15,00 KX.
De acuerdo a las microfotografías tomadas, no se detectó formación de biofilm compuesto de
multicapas, sino más bien una monocapa. De haberse formado un biofilm compuesto de
multicapas, las bacterias adheridas a las partículas de azufre podrían haber generado limitaciones
de tipo difusionales tanto al acceso al azufre por parte de las bacterias de las capas superiores,
como al acceso al hidrógeno por parte de las bacterias en las capas inferiores. Por otra parte,
cuando se agregaron nuevas partículas de azufre, quedó disponible más área superficial para
adherencia, lo que hubiese provocado una disminución de las bacterias suspendidas, lo que
claramente no ocurrió (Figura 14, flechas 2 y 6). Esto significa que la adherencia no es un
requisito necesario para llevar a cabo la bioreducción del azufre, ya que un aumento de la tasa de
formación de H2S(g) se produjo inmediatamente después de que nueva superficie de azufre fuera
agregada al reactor. Por lo tanto, limitaciones difusionales de esta naturaleza no parecen ser los
fenómenos que expliquen la limitación por disponibilidad de azufre detectada anteriormente.
Paralelamente a los análisis de microscopía electrónica, se hizo un análisis de rayos-X a una
muestra de azufre sin reaccionar y a otra muestra de azufre reaccionado. Esta última muestra fue
tomada 25 días después de la última adición de azufre al reactor (Flecha 2 en la Figura 12). Los
resultados se muestran en la Figura 32.
72
Figura 32. Difractograma de partículas de azufre. En azul: azufre antes de la reacción. En rojo: azufre
después de 25 días de reacción.
Tal como puede apreciarse, no se obtuvieron diferencias entre los patrones de difracción de
rayos-X para ambas muestras. En ambos casos estos patrones corresponden al azufre
ortorrómbico α-S8 con densidad igual a 2,070 g/cm3 y con celda unitaria: a = 10,45, b = 12,84 y
c = 24,46.
De manera complementaria a los análisis anteriores, se determinó el punto isoeléctrico para las
mismas dos muestras de azufre. Esta determinación se hizo a través de mediciones de potencial
zeta para diferentes valores de pH. Los resultados se muestran en la Figura 33. Se observa que
hay diferencias significativas entre ambas muestras, ya que el punto isoeléctrico de las partículas
de azufre sin reaccionar fue de 3,92, mientras que el de las partículas de azufre reaccionado fue
de 4,70. Esto significa que se registran alteraciones de la carga superficial de las partículas de
azufre después de 25 días de reacción. Esto puede deberse al aumento de la coordinación de las
partículas de azufre durante el transcurso de la reacción o a la adsorción de compuestos con
distinta carga superficial. Esta segunda opción estaría en concordancia con la formación de
biofilm detectada mediante SEM, lo que significa que la limitación de disponibilidad de azufre
detectada se debe a fenómenos superficiales de las partículas de azufre.
Costa et al (2002), encontraron que el aumento del punto isoeléctrico de partículas de pigmentos
con aditivos en comparación con partículas de pigmentos sin aditivos, era proporcional al
porcentaje de cubrimiento de aditivo adsorbido en dichas partículas. En el presente estudio puede
haber sucedido algo similar con las partículas de azufre y la formación de biofilm. De esta
manera la medición de potencial zeta podría ser un indicador de la formación de biofilm.
73
25
20
15
Potencial Zeta (mV)
10
4.70
5
0
-5
3.92
-10
-15
-20
-25
-30
-35
2.0
2.5
3.0
3.5
4.0
4.5
5.0
5.5
6.0
6.5
7.0
pH
Figura 33. Potencial zeta de las partículas de azufre para diferentes valores de pH. En rojo: azufre antes de
la reacción. En azul: azufre después de 25 días de reacción. Se indica el punto isoeléctrico para ambas
muestras.
Con la finalidad de estudiar la evolución de las características superficiales de las partículas de
azufre, se realizaron determinaciones de potencial zeta de partículas tomadas del reactor gaslift.
Se analizaron partículas de azufre al comienzo del experimento (El inicio del flujo de H2 fue
considerado como tiempo cero) y después de 6 días de experimentación (6 días). Los resultados
se muestran en la Figura 34. Se observa que hay diferencias significativas entre ambas muestras,
ya que el punto isoeléctrico de las partículas de azufre en tiempo cero fue de 3,96, mientras que el
de las partículas de azufre de 6 días fue de 4,77. Este comportamiento es similar al encontrado en
el reactor agitado mecánicamente. Es importante señalar que se tomaron varias muestras durante
el transcurso de la reacción en el reactor gaslift, pero al compararlas con las partículas antes de
reacción sólo algunas muestras presentaban cambios significativos del punto isoeléctrico.
74
30
Potencial Zeta (mV)
20
10
4,77
0
3,96
-10
-20
-30
2.5
3.0
3.5
4.0
4.5
5.0
5.5
6.0
6.5
7.0
pH
Figura 34. Potencial zeta de partículas de azufre provenientes del reactor gaslift para diferentes valores de
pH. En rojo: azufre en tiempo cero. En azul: azufre después de 6 días de reacción. Se indica el punto
isoeléctrico para ambas muestras.
Durante el transcurso del experimento en el reactor gaslift, se tomó una serie de microfotografías
a las bacterias adheridas en las partículas de azufre, con el objetivo de captar la evolución del
fenómeno de adherencia. En la Figura 35 y en la Figura 36 se muestran dos vistas de las
partículas de azufre en ausencia de bacterias. En la Figura 37 se muestra una microfotografía de
las partículas de azufre correspondiente a 35 minutos después del inicio del flujo de H2. Esta
microfotografía fue tomada con el mismo aumento que la microfotografía de la Figura 35. Al
comparar ambas microfotografías, se aprecia que sobre algunas partículas de azufre de la muestra
de 35 minutos (círculos rojos), hay algún tipo de sustancia. En la Figura 38 y en la Figura 39, se
presentan microfotografías con mayor aumento de la misma muestra, en donde se aprecia
claramente la adherencia de bacterias.
En la Figura 42 ya no se aprecian bacterias adheridas, sino más bien un entramado adherido a las
partículas de azufre. Visualmente, este entramado presenta características típicas de las EPS. Esto
significa que se está frente a una adherencia irreversible. Los resultados obtenidos por EDS para
la última microfotografía son C = 68,32% O = 6,42% S = 25,26%. La razón C/O es mucho mayor
a la esperada para compuestos de carbono inorgánico, por lo que es razonable esperar que se trate
de compuestos orgánicos.
75
Figura 35. Microfotografía de partículas de azufre en ausencia de bacterias. Mag. = 500 X.
Figura 36. Microfotografía de partículas de azufre en ausencia de bacterias. Mag. = 1,00 KX.
76
Figura 37. Microfotografía de partículas de azufre después de 35 minutos del inicio del flujo de H2. Mag. =
500 X
Figura 38. Microfotografía de partículas de azufre después de 35 minutos del inicio del flujo de H2. Mag. =
5,00 KX
77
Figura 39. Microfotografía de partículas de azufre después de 35 minutos del inicio del flujo de H2. Mag. =
5,00 KX
Figura 40. Microfotografía de partículas de azufre después de 2,1 días del inicio del flujo de H2. Mag. =
5,00 KX
78
Figura 41. Microfotografía de partículas de azufre después de 2,9 días del inicio del flujo de H2. Mag. =
5,00 KX
Figura 42. Microfotografía de partículas de azufre después de 7,5 días del inicio del flujo de H2. Mag. =
5,00 KX
79
Según se discutió anteriormente, la formación de biofilm en las partículas suspendidas de azufre
sería la causa de la disminución de la velocidad de formación de H2S (g) en el reactor agitado
mecánicamente. En las partículas de azufre suspendidas en el reactor gaslift también se detectó la
formación de biofilm, pero no así disminución de la velocidad de la reacción. Esta diferencia
puede deberse a una menor cantidad de partículas de azufre con formación de biofilm en el
reactor gaslift en comparación con las partículas de azufre presentes en el reactor agitado. Esto se
puede corroborar analizando la Figura 37, en donde se observa claramente que sólo una pequeña
cantidad de partículas presenta formación de biofilm. Los resultados obtenidos para las
mediciones de potencial zeta de las partículas de azufre del reactor gaslift también estarían
indicando que no todas las partículas tendrían desarrollo de biofilm.
La formación de biofilm sólo en una pequeña fracción de las partículas de azufre del reactor
gaslift, puede deberse a una menor cantidad de tiempo de reacción en comparación con el reactor
agitado mecánicamente y al hecho de que no todas las partículas estaban suspendidas a la vez,
existiendo la posibilidad de una renovación de partículas desde el fondo del reactor.
La adherencia a sustratos hidrofóbicos como el azufre, es más lenta que en sustratos hidrofílicos.
Esto permite tener un margen mayor de tiempo para observar los fenómenos asociados a la
adherencia bacteriana. Por esta razón se tomaron microfotografías de partículas de azufre de
muestras obtenidas durante todo el transcurso del experimento en el reactor gaslift.
A la muestra del día 7,5 se le realizó un análisis de XPS, con el objetivo de indagar acerca de la
naturaleza del biofilm, en particular de la composición de las EPS generadas por las bacterias.
Las energías de enlace de los elementos detectados fueron determinadas usando la posición del
carbono 1s a 284,8 eV (grafito) como referencia. El espectro obtenido se muestra en la Figura 43.
Los elementos detectados fueron carbono, nitrógeno, oxígeno y azufre. Cada uno de los espectros
de estos elementos está constituido de diferentes curvas gaussianas que representan distintos
grupos funcionales. Para lograr el mejor ajuste de combinaciones lineales de curvas gaussianas se
utilizó el criterio de χ2. La señal del C1s puede ser descompuesta en dos espectros con picos en
285,9 eV y 288,5 eV (χ2 = 0,63), con áreas relativas de 76,86% y 23,14%, respectivamente. Chan
et al (2002), estudiando EPS producidos por bacterias reductoras de sulfato en acero dulce,
detectaron el pico de 285,9 eV y lo atribuyeron a un carbono enlazado a oxígeno o nitrógeno, C(O, N) (enlace simple). Gómez-Suárez et al (2002), estudiando EPS producidos por Pseudomonas
aeruginosa en vidrio, también detectaron el mismo pico y también lo atribuyeron a un carbono
enlazado a oxígeno o nitrógeno. Por otra parte, el segundo pico de carbono detectado, fue
atribuido a un enlace doble de carbono-oxígeno (C=O) o a un carbono con enlaces simples a dos
átomos de oxígeno (O-C-O), tanto por Chan et al (2002) como por Gómez-Suárez et al (2002).
En la Figura 44 se muestra el espectro XPS del C1s.
80
Figura 43. Espectro XPS de partículas de azufre después de 7,5 días del inicio del flujo de H2.
Figura 44. Espectro XPS del carbón 1s de la muestra de partículas de azufre después de 7,5 días del inicio
del flujo de H2.
81
El azufre 2p presenta dos líneas espectrales: 2p3/2 y 2p1/2. De acuerdo a la expresión 2·n+1, la
primera tiene una multiplicidad de espín igual a 4 y la segunda igual a 2. Esto significa que las
señales 2p3/2 deben estar en una proporción 2:1 con respecto a las señales 2p1/2. Por esta razón se
prefiere determinar los compuestos de azufre con las señales de 2p3/2. Los picos de las señales de
las dos posibles configuraciones siempre se encuentran separadas a 1,18 eV. El espectro de alta
resolución del azufre de la muestra de partículas de azufre se muestra en la Figura 45. Se observa
que la señal del azufre pudo ser descompuesta en 6 curvas, de las cuales 3 corresponden a señales
2p3/2: 161,5 eV, 162,7 eV y 164,1 eV (χ2 = 0,94), con áreas relativas de 28,46%, 25,57% y
12,64%, respectivamente. Las otras 3 curvas corresponde a las señales 2p1/2 respectivas: 162,7
eV, 163,9 eV y 165,3 eV, con áreas relativas de 14,23%, 12,78% y 6,32%, respectivamente.
Moulder et al (citado por Chan et al, 2002), atribuyeron el pico de azufre 2p3/2 de 162,7 eV al
aminoácido metionina. Mientras que Kelemen et al (1990) atribuyeron el mismo pico al
aminoácido cisteína. Ambos aminoácidos son constituyentes de las proteínas. El pico de 164,1
eV fue atribuido al azufre elemental por Brion (1980). El bajo porcentaje de azufre elemental es
concordante con lo observado en la Figura 42, en donde se aprecia que gran parte de la superficie
de azufre está cubierta con EPS.
Figura 45. Espectro XPS del azufre 2p de la muestra de partículas de azufre después de 7,5 días del inicio
del flujo de H2.
El nitrógeno presentó un pico para una energía de enlace de 399,5 eV. Chan et al (2002) también
detectaron este pico y fue atribuido a aminas o amidas desprotonadas.
Chan et al (2002), detectaron además un pico de carbono 1s para una energía de enlace 284,2 eV,
correspondiente a un carbono enlazado a carbono o hidrógeno (C-(C, H)). Gómez-Suárez et al
(2002), detectaron los 3 picos de carbono 1s detectados por Chan et al (2002), además de un pico
82
situado a una energía de enlace de 289,1 eV. Este pico fue atribuido por los autores a un carbono
del grupo carboxilo, O=C-OH. Chan et al (2002), consideraron que las EPS estaban constituidas
primordialmente por proteínas (Pr), polisacáridos (PS) y compuestos análogos a hidrocarburos
(HC); mientras que Gómez-Suárez et al (2002), consideraron que estaban constituidas por estos
componentes y por ácidos urónicos (UA).
La presencia de ácidos urónicos se detecta a través del pico del carbono del grupo carboxilo
(Gómez-Suárez et al, 2002). Por otra parte, la presencia de los HC es detectada exclusivamente a
través del pico de carbono enlazado a carbono o hidrógeno (Chan et al, 2002). En la presente
Tesis, no se detectaron los picos de carbono correspondientes a carbono enlazado a carbono o
hidrógeno (C-(C,H) y carbono del grupo carboxilo (O=C-OH). Por lo tanto, sólo fue posible
detectar proteínas y polisacáridos.
La fracción de proteínas se determina a partir de la razón N/C y asumiendo que las proteínas
tienen un contenido de nitrógeno de 28% (Gómez-Suárez et al, 2002). De esta forma, las EPS
detectadas están constituidas aproximadamente por 73% de proteínas y 27% de polisacáridos.
Gómez-Suárez et al (2002), encontraron que las EPS estaban constituidas por 2,7% de ácidos
urónicos, 1,2% de compuestos análogos a hidrocarburos, 67,7% de proteínas y 28,4% de
polisacáridos. Por otra parte, Chan et al (2002), encontraron que las EPS estaban constituidas por
60% de proteínas, 37% de polisacáridos y 3% de compuestos análogos a hidrocarburos.
El alto contenido de proteínas detectado también se evidencia mediante la detección de
aminoácidos como la cisteína y/o metionina detectados con la señal del azufre 2p3/2 y mediante la
detección de la señal de aminas y amidas en la señal de nitrógeno.
Al comparar la fracción de proteínas de las EPS detectadas por los autores antes mencionados y
la encontrada en la presente Tesis, se puede concluir que mientras más hidrofóbica es la
superficie del sustrato, mayor es el porcentaje de proteínas. En este caso sucede algo similar a lo
enunciado por Gehrke (1998), en cuanto a que la composición de las EPS está influenciada por el
sustrato a adherirse, ya que la hidrofobicidad del azufre estimula la producción de EPS más
hidrofóbicas. Esta característica de las EPS se las confiere una mayor proporción de proteínas.
En la adherencia bacteriana reportada en esta oportunidad, la componente hidrofóbica de la
energía libre de Gibbs de adherencia parece ser la más relevante. Por otra parte, Dûfrene et al.
(1996), encontraron que la adherencia de Azospirillum brasilense a sustratos hidrofílicos e
hidrofóbicos ocurría sólo después de la producción de EPS y lo correlacionaron con un
incremento del contenido de proteínas de las EPS en el transcurso del tiempo. DeFlaun et al.
(1990), reportaron un aumento similar en la adherencia de Pseudomonas fluorescens asociado
con altos contenidos de proteínas de las EPS.
4.8
ESTUDIO DE BIODIVERSIDAD BACTERIANA
Para llevar a cabo este estudio, se realizó un análisis de T-RFLP a una muestra tomada al
comienzo del experimento de bioreducción de azufre elemental (tiempo cero) y otra al final
(después de 7,5 días), en el reactor gaslift. A estas muestras se les denominó Muestra 1 y Muestra
2, respectivamente. De la Muestra 2 se separó el azufre mediante centrifugación, para realizar un
ensayo de T-RFLP (Muestra 3) y así obtener el perfil de T-RFLP de las bacterias adheridas.
83
En la Figura 46, en la Figura 47 y en la Figura 48 se muestran los electroferogramas obtenidos
con la enzima de restricción HAE III para las Muestras 1, 2 y 3, respectivamente. Sólo se
consideraron los fragmentos de pares de bases con una abundancia relativa mayor a 1%,
considerándose como ruido a aquellos fragmentos con abundancias menores a este porcentaje.
6,0
Abundancia relativa (%)
5,0
229
4,0
247
177
52
3,0
2,0
1,0
0,0
40
80
120
160
200
240
280
320
360
Tamaño fragmentos (pb)
Figura 46. Electroferograma Muestra 1.
84
400
440
6,0
Abundancia relativa (%)
5,0
193
4,0
306
120
261
150
366
3,0
2,0
1,0
0,0
40
80
120
160
200
240
280
320
360
400
440
Tamaño fragmentos (pb)
Figura 47. Electroferograma Muestra 2.
6,0
193
Abundancia relativa (%)
5,0
4,0
296
120
156
3,0
2,0
1,0
0,0
40
80
120
160
200
240
280
320
360
Tamaño fragmentos (pb)
Figura 48. Electroferograma Muestra 3.
85
400
440
En las 3 figuras se observa gran cantidad de diferentes tamaños de fragmentos, lo que demuestra
la existencia de un cultivo mixto en el reactor de reducción biológica de azufre. Originalmente en
el laboratorio se contaba con una cepa pura de Desulfovibrio desulfuricans. Esta se ha utilizado
en diversos bioreactores anaeróbicos a lo largo del tiempo, por lo que es esperable que junto a
esta cepa se hayan desarrollado otras especies de bacterias adaptadas a condiciones anaeróbicas.
La riqueza específica es 46, 35 y 32, para las muestras 1, 2 y 3, respectivamente.
Con respecto a los perfiles de T-RFLP, se encontró que al comienzo del experimento los filotipos
más abundantes (abundancia relativa > 3,0%) correspondieron a los fragmentos de 52 pb, 177 pb,
229 pb y 247 pb. Al final del experimento (muestra 2) no se detectaron los filotipos
correspondientes a los fragmentos de 52 pb, 177 pb y 229 pb (abundancia relativa < 1,0%),
mientras que el fragmento de 247 disminuyó su abundancia relativa de 3,0% a 1,9%. En esta
muestra los filotipos más abundantes correspondieron a los fragmentos de 120 pb, 150 pb, 193
pb, 261 pb, 296 pb, 306 pb y 366 pb (abundancia relativa > 3%). Los fragmentos de 120 pb, 193
pb, 296 pb y 366 pb no se detectaron en la muestra 1, mientras que los fragmentos de 150 pb, 261
pb y 306 pb estaban presentes en la muestra 1 con abundancias relativas de 2,9%, 1,3% y 1,4%,
respectivamente. Los filotipos más abundantes de la muestra 3 (abundancia relativa > 3%)
correspondieron a los fragmentos de 120 pb, 124 pb, 156 pb, 193 pb, y 296 pb. Los fragmentos
de 124 pb y 156 pb no se detectaron en la muestra 2. De los filotipos más abundantes de la
muestra 2, aquellos correspondientes a los fragmentos de 50 pb y 306 pb, no fueron detectados en
la muestra 3.
Considerando los resultados obtenidos, queda en evidencia que se produjeron cambios en la
distribución de los fragmentos durante el transcurso de la reacción. Estos cambios pueden
producirse como consecuencia de variaciones que hayan experimentado variables fisicoquímicas
del medio, tales como el potencial de óxido-reducción y la fuerza iónica. Anteriormente, en el
reactor agitado mecánicamente, se detectó una sostenida disminución de esta variable durante el
transcurso de la reacción (Sección 4.2), por lo que algunos filotipos pueden verse favorecidos en
desmedro de otros, bajo estas nuevas condiciones.
Debido a la poca precisión, propia de las bases de datos filogenéticas consultadas en la
asignación de filotipos, no es posible utilizar la técnica de T-RFLP como una técnica de
identificación, sino más bien permite detectar cambios en la composición y distribución de
filotipos en las muestras analizadas. Para determinar con precisión los filotipos bacterianos es
necesario clonar y secuenciar el gen 16S rDNA. De esta manera se obtienen genotecas que se
comparan con los fragmentos obtenidos. No obstante lo anterior al comparar con la base de datos,
se encontró que el fragmento 229 podría corresponder a Desulfotomaculum alkaliphilum, el 193 a
alguna especie de Clostridium y el 199 a Desulfovibrio desulfuricans, todas especies reconocidas
como reductoras de azufre.
Al utilizar la enzima de restricción Msp1 para las mismas muestras, también fue posible
encontrar posibles filotipos de Desulfovibrio desulfuricans y algunas especies de Clostridium,
Desulfotomaculum y Thermotoga. Las especies del género Thermotoga desproporcionan azufre,
pero no lo utilizan como aceptor terminal de electrones en su respiración. El fragmento
correspondiente a este filotipo sólo se detectó en la Muestra 1. Al comienzo del experimento las
condiciones eran menos reductoras que al final, lo que podría explicar la presencia de especies
fermentativas especializadas en desarrollarse en ambientes carentes de dadores de electrones.
86
Los resultados obtenidos con ambas enzimas de restricción, muestran una alta coincidencia en la
detección de los filotipos reductores de azufre. Sin embargo, los resultados son sólo una
estimación, debido a las razones anteriormente señaladas.
Los fragmentos menos abundantes pueden corresponder a filotipos que no tengan relación con la
bioreducción de azufre elemental y que se encuentren en estado de latencia en el medio.
La diversidad alfa también fue estimada mediante el índice de Shannon. Este índice se determinó
a partir de los electroferogramas obtenidos con la enzima de restricción HAE III para las 3
muestras. También se determinó la biodiversidad máxima y el índice de Pielou. Estos resultados
se resumen en la Tabla 8. Los altos valores del índice de Pielou obtenidos indican que las 3
muestras analizadas presentan una alta biodiversidad.
Tabla 8. Índices de biodiversidad para 3 muestras del reactor gaslift.
Índice de Shannon
Diversidad máxima
Índice de Pielou
Muestra 1 (M1)
3,21
3,83
0,84
Muestra 2 (M2)
2,92
3,56
0,82
Muestra 3 (M3)
3,17
3,69
0,86
El Índice de Pielou no presentó diferencias significativas entre las muestras. Mientras que el
Índice de Shannon presentó diferencias significativas entre las muestras 1 y 2 (t = 2,135; p =
0,018) y no presentó diferencias significativas entre las muestras 2 y 3. Las diferencias
encontradas entre las muestras 1 y 2 mediante el Índice de Shannon, corroboran las observaciones
planteadas anteriormente, referentes a cambios en la distribución de los fragmentos de los pares
de bases de los perfiles de T-RFLP.
La diversidad beta se determinó mediante el coeficiente de similitud de Sørensen, a partir de una
matriz de ausencia/presencia de los fragmentos encontrados con el método T-RFLP. Los
resultados se muestran en la Tabla 9.
Tabla 9. Coeficientes de similitud de Sørensen para las tres muestras del reactor gaslift.
IS M1 - M3
0,385
IS M1 – M2
0,395
IS M2 - M3
0,507
De acuerdo a los resultados presentados en la Tabla anterior, se deduce que la similitud entre las
muestras 1 y 3 es comparable a aquella encontrada para las muestras 1 y 2, y que la similitud
entre las muestras 2 y 3 es significativamente mayor que las otras dos. Entre las muestras 1 y 2
comparten 16 fragmentos, entre las muestras 2 y 3 comparten 17 y entre las muestras 1 y 3
comparten 15. Los fragmentos con una abundancia superior al 1%, presentes en las tres muestras
son 7.
La mayor similitud encontrada entre las muestras 2 y 3, corrobora los resultados encontrados con
el índice de Shannon, en donde se encontró que la biodiversidad entre ambas muestras no
presentó diferencias estadísticamente significativas. La mayor similitud también es concordante
con el hecho de que ambas muestras provienen de la misma matriz. A partir de estos resultados se
87
puede afirmar que no existe una diferenciación estadísticamente significativa entre las bacterias
adheridas y aquellas que permanecen suspendidas.
La diversidad beta también fue determinada mediante dos pruebas estadísticas de análisis
multivariado: un análisis de componentes principales (PCA) y un análisis jerárquico aglomerativo
(clusters). En ambos casos se utilizó como variables la abundancia relativa de los fragmentos de
pares de bases.
En la Figura 49 se muestra el dendograma obtenido con el análisis de clusters para las tres
muestras analizadas.
2.4
Distancia
2
1.6
1.2
0.8
0.4
0
Muestra 1
Muestra 2
Muestra 3
Figura 49. Dendrograma obtenido con análisis de clusters para las tres muestras.
Los resultados presentados en el dendrograma indican un agrupamiento similar al encontrado con
el coeficiente de similitud: una mayor similitud entre las muestras 2 y 3. Sin embargo, el grado de
similitud entre estas dos muestras expresado en distancia euclidiana, es relativamente bajo.
En la Figura 50 se muestra el gráfico del análisis de componentes principales para las muestras 1,
2 y 3.
88
Componente 2
0.9
0.6 Muestra 3
0.3
Muestra 1
0
-0.3
-0.6
Muestra 2
-0.9
-0.7
-0.5
-0.3
-0.1
0.1
0.3
0.5
0.7
0.9
Componente 1
Figura 50. Gráfico de PCA para las muestras del reactor gaslift.
Los resultados presentados en la Figura 50 indican que la muestra 1 aparece claramente
distanciada de las muestras 2 y 3. Estas a su vez, se encuentran más agrupadas, pero a una
distancia considerable, lo que confirma los resultados obtenidos por los análisis anteriores.
Los dos primeros componentes explican el 80,5% de la varianza total (componente 1: 52,6% de
la varianza; componente 2: 27,9% de la varianza). Los fragmentos 75 pb, 114 pb, 120 pb, 145 pb,
177 pb, 193 pb, 229 pb, 292 pb, 353 pb y 366 pb estaban altamente relacionados con el
componente 1. Mientras que los fragmentos 124 pb, 156 pb, 296 pb y 306 pb estaban altamente
relacionados con el componente 2.
Resultados similares a los encontrados con la enzima de restricción HAE III, fueron obtenidos al
utilizar la enzima de restricción Msp1.
A la luz de los resultados obtenidos empleando la técnica de T-RFLP, se puede afirmar que en el
reactor gaslift de bioreducción de azufre elemental existe un cultivo mixto de bacterias que
experimenta cambios en la distribución de sus poblaciones, favoreciéndose las de mayor
adaptabilidad a las condiciones imperantes en el reactor. Estos cambios poblacionales pueden
deberse a variaciones de las propiedades fisicoquímicas del medio, como el potencial de óxido
reducción o la fuerza iónica. No existe una diferenciación estadísticamente significativa entre las
bacterias adheridas y aquellas que permanecen suspendidas.
4.9
ESTUDIO DE INTERMEDIARIOS DE LA REACCIÓN
Se estudió la presencia de posibles intermediarios de la reacción, mediante la determinación de
las especies sulfato, tetrationato, sulfito, metabisulfito y tiosulfato en el reactor gaslift. Con el
objetivo de descartar posibles interferencias de la matriz, se analizó también sulfuro, cloruro y
bicarbonato.
89
Se utilizó un rango de concentraciones comprendido entre 25 y 200 ppm para todos los analitos
estudiados. El límite de detección instrumental determinado según procedimiento descrito por
Skoog y Leary (1994), fue de 2 ppm. Los tiempos de retención para cada compuesto se presentan
en la Tabla 10. No se registraron señales para cloruro y bicarbonato, pese a que ambos presentan
absorción en la región UV.
Tabla 10. Tiempos de retención de estándares y sus respectivos intervalos de confianza, utilizados en
estudio de intermediarios de la reacción.
2-
Tiempo (min)
S4O6
15,68 ±
0,08
SO326,06 ± 0,04
SO426,07 ± 0,09
S2O3214,71 ±
0,42
S2O526,63 ± 0,11
HS2,46 ±
0,01
Nota: se presenta la especie más abundante bajo las condiciones de pH de la fase móvil (pH = 9,5)
En la Figura 51 se muestra el cromatograma correspondiente a una muestra tomada del reactor
gaslift. Se realizó otra determinación de intermediarios con resultados similares. La señal del
primer compuesto eluido fue mucho más intensa, pero para fines comparativos sólo se muestra
una parte de su señal.
Figura 51. Cromatograma muestra reactor gaslift.
90
En el cromatograma anterior se observan 3 picos nítidos en 2,45, en 5,73 y en 14,47 minutos, con
áreas de 11865379, 163274 y 734197, respectivamente. Al comparar con los tiempos de
retención de los estándares (Tabla 10), se deduce que el primero de los compuestos en eluir
corresponde al sulfuro. Este se encuentra en una proporción notablemente mayor que los otros
dos compuestos detectados, lo que es concordante con el hecho de que el sulfuro es el producto
final de la reacción estudiada.
El compuesto que eluye a los 14,47 minutos se encuentra dentro del intervalo de confianza del
tiempo de retención del tiosulfato, por lo que se trataría de este compuesto. El tiosulfato puede
provenir de la oxidación de polisulfuros en presencia de Fe(III) (Schippers y Sand, 1999):
Ecuación 60:
n−2
2+
+
H 2 S n + 6 Fe 3+ + 3H 2 O → H 2 S 2 O3 +
·S 8 + 6 Fe + 6 H
8
Sin embargo, en el medio de cultivo (en la solución de oligoelementos) sólo hay presente Fe(II) y
no Fe(III), por lo que parece poco plausible la reacción anterior.
El tiosulfato también podría provenir de la reacción entre el ión HS- y el tetrationato (Klimmek et
al, 1991):
Ecuación 61:
n·S 4 O6
2−
+ (n + 1)·HS − → 2n·S 2 O3
2−
+ S n +1
2−
+ (n + 1)·H +
El tetrationato no fue detectado en este estudio, pero debido a la presencia de tiosulfato se infiere
que podría producirse este politionato y reaccionar muy rápido, o permanecer en condiciones
muy bajas, indetectables con el método empleado en esta oportunidad.
El tiempo de retención del otro compuesto detectado (5,73 minutos) no coincide con ninguno de
los estándares. Se encuentra cerca del intervalo de confianza del tiempo de retención del sulfato,
sin embargo la señal del estándar del sulfato siempre se presentó con un pico hacia abajo de la
línea base. En consecuencia se trataría de un compuesto diferente a los analizados.
En el presente estudio no se detectó sulfato, lo que indicaría que no tiene lugar una reacción de
desproporción de azufre paralelamente a la reacción de reducción del mismo. Esto es concordante
con el hecho de que no se detectaron filotipos asociados a la desproporción de azufre al final del
experimento. También existe la posibilidad de que se hubiese formado sulfato, pero que éste se
haya reducido rápidamente a sulfuro, o bien que haya precipitado ante la presencia de calcio del
medio de cultivo. Sin embargo, las condiciones reductoras imperantes en el reactor hacen muy
improbable la formación de sulfato.
Durante el transcurso de la reacción, en los dos tipos de reactores empleados, siempre se detectó
un alza de pH, la que se contrarrestaba automáticamente mediante inyección de CO2. Esta alza es
similar a la que se produce al utilizar sulfato como aceptor terminal de electrones. Se ha
establecido que el transporte activo de sulfato es el causante de la alcalinización del medio, ya
que este transporte se lleva a cabo en simporte con dos protones (Cypionka, 1989; Warthmann y
Cypionka, 1990). El hecho de que también suceda esta alcalinización al utilizar azufre elemental,
91
hace suponer que existiría un mecanismo similar de transporte con alguna especie aniónica de
azufre, por ejemplo un polisulfuro.
El compuesto detectado en el tiempo de retención de 5,73 minutos podría corresponder a un
polisulfuro del tipo [Sn-1(0)S(2-)]2-, ya que estos compuestos también presentan absorción en esta
zona de la región UV (Giggenbach, 1972). Sin embargo, los espectros individuales de los
diferentes polisulfuros no han podido obtenerse.
Teder (1969) modeló numéricamente los espectros, asumiendo la coexistencia de combinaciones
de diferentes polisulfuros con cadenas de átomos de azufre entre 2 y 5. Schwarzenbach y Fischer
(1960) también dedujeron una distribución completa de polisulfuros. Giggenbach (1972) estudió
la evolución de las bandas de absorción en el espectro electrónico en un amplio rango de pH
alcalino y concluyó que el polisulfuro más grande era el pentasulfuro. Para extraer las constantes
termodinámicas, él asumió que sólo el tetra y el pentasulfuro eran importantes en un amplio
intervalo de condiciones experimentales.
Debido a la rápida reacción de desproporción de los polisulfuros (Ecuación 62), a su alta
reactividad, a su inestabilidad termodinámica y a la carencia de estándares de los mismos, ha
sido muy difícil desarrollar un método de cuantificación de polisulfuros individuales.
2 S n2− ↔ S n2−−1 + S n2+−1
Ecuación 62:
Sólo recientemente, Kamyshny et al (2006) lograron desarrollar un método para la determinación
de miembros individuales de familias de polisulfuros inorgánicos en muestras reales. Este método
consiste en la detección de dimetilpolisulfuros en HPLC-UV, generados a partir de la reacción
entre metil trifluorometanosulfonato y los polisulfuros inorgánicos.
4.10 MODELACIÓN MATEMÁTICA DEL REACTOR AGITADO
Una vez finalizado el estudio experimental, se recolectó toda la información necesaria para
plantear el conjunto de ecuaciones que describen la reducción anaeróbica y autotrófica de azufre
elemental mediada por bacterias. Con esta información se desarrolló el correspondiente modelo
matemático dinámico.
Para llevar a cabo el modelamiento, se consideró un bioreactor CSTR de mezcla perfecta,
operando en las mismas condiciones del reactor agitado mecánicamente descrito en las secciones
anteriores.
El desarrollo del modelo consistió en el planteamiento de los balances de masas para todos los
componentes presentes en la fase líquida y fase gas del sistema, además del crecimiento celular.
Para este último caso se consideró una cinética de crecimiento celular clásica de tipo Monod.
La optimización de parámetros se llevó a cabo considerando los resultados experimentales de los
primeros 8 días de experimento del reactor agitado mecánicamente, ya que posterior a ese tiempo
se agregó nuevas partículas de azufre.
92
Hipótesis del modelo:
El modelo fue desarrollado considerando las siguientes hipótesis:
•
•
•
•
•
•
•
•
•
•
•
•
•
El bioreactor agitado mecánicamente es de mezcla perfecta y opera a temperatura constante
(30°C) y pH = 7.
Existe una relación bien definida entre los rendimientos celulares de la fuente de carbono, el
producto metabólico y el aceptor y el donador de electrones (Sáez, 2001). Además se asume
que estos rendimientos celulares son constantes.
La desorción de H2S es lo suficientemente eficiente como para no considerar la inhibición por
este producto.
El consumo de sustrato para mantenimiento está incorporado en el coeficiente de rendimiento
celular.
La resistencia a la transferencia a través de la película de líquido en torno a las burbujas de
gas es la resistencia más importante. Esta resistencia se describe adecuadamente por el
coeficiente combinado de transferencia de masa gas líquido, kLa.
Se puede despreciar la concentración de H2S(g) en el reactor considerando que es atrapado en
su totalidad en las trampas de NaOH.
Las concentraciones de CO2(g) y H2(g) se consideran constantes, ya que para el período
considerado no se cambió el flujo de gas.
La fuerza iónica del sistema estudiado es pequeña, por lo que no afecta los equilibrios de
ionización. De esta manera no es necesario corregir las constantes cinéticas reportadas en la
literatura a fuerza iónica nula
Existen dos grandes grupos de bacterias; aquellas que están suspendidas y las que están
adheridas.
La velocidad máxima de crecimiento específico celular y el rendimiento no se ven afectados
por la adherencia.
El mecanismo de adherencia es de tipo Langmuir: a) la velocidad de adherencia es
proporcional a la superficie desocupada y a la concentración de bacterias suspendidas; b) la
velocidad de desorción es proporcional a la concentración de bacterias adheridas (Fehrmann,
1989)
En una primera etapa de formación de biofilm, la acumulación de microorganismos en la
superficie corresponde a la suma de los procesos de adherencia (Ra), crecimiento y desorción
(Rd). Se considera que la adherencia es reversible y que las bacterias adheridas replican hacia
la superficie (Fehrmann, 1989)
Una vez que el biofilm alcanza saturación, se considera que está en estado estacionario y las
bacterias irreversiblemente adheridas replican hacia la solución.
Balances de masa:
Crecimiento celular: Se considera que el crecimiento celular, tanto de las bacterias adheridas
como de las suspendidas, procede de acuerdo a una relación tipo Monod con un sustrato limitante
(Bailley, 1986). Según los antecedentes de la literatura (Schauder y Kröger, 1993), un aceptor de
electrones probable es el tetrasulfuro (S42-):
93
µ = µ MAX ⋅
Ecuación 63:
[S ]
+ [S ]
2−
4
K S1
2−
4
Donde:
KS1 : constante de afinidad respecto de tetrasulfuro (M)
Los paréntesis cuadrados indican concentraciones molares.
Velocidad de adherencia (Ra): las bacterias se adhieren en la superficie disponible hasta
alcanzar saturación:
Ecuación 64:
Ra = k A ⋅ ([X S ] + ( X SAT − [ X A ]) ⋅ σ )
Donde:
kA
[XS]
XSAT
[XA]
σ
: constante cinética de adherencia (h-1)
: concentración de bacterias suspendidas (células/L)
: número máximo de sitios de adherencia (células/m2)
: concentración de bacterias adheridas (células/m2)
: cuociente superficie disponible/volumen líquido del reactor (m2/L)
Velocidad de remoción (Rd): paralelamente al proceso de adherencia se produce desorción de
bacterias:
Rd = k d ⋅ [ X A ] ⋅ σ
Ecuación 65:
Donde:
kd
: constante cinética de desorción (h-1)
Cuociente superficie disponible/volumen (σ): depende del radio de las partículas de azufre (r):
Ecuación 66:
σ=
4 ⋅ π ⋅ r 2 ⋅ Número de partículas
volumen reactor
Radio partículas de azufre: la variación del radio de una partícula de azufre se estimó
considerando que la cantidad de sustancia reactante es proporcional a la superficie disponible del
núcleo sin reaccionar (Levenspiel, 2002).
[
]
b ⋅ HS − ⋅ k S
dr
=−
dt
ρB
Ecuación 67:
Donde:
94
: coeficiente cinético para la reacción en la superficie (m·h-1)
: densidad molar azufre (64,7 mol·L-1)
: coeficiente estequiométrico del azufre en la Ecuación 2
kS
ρB
b
Bacterias suspendidas: se encuentran suspendidas en la fase acuosa del reactor. La siguiente
ecuación representa el balance de masa respectivo:
d [X S ]
= µ ⋅ [ X S ] − (Ra − Rd )
dt
Ecuación 68:
Bacterias adheridas: se adhieren a la superficie de las partículas de azufre. La siguiente
ecuación representa el balance de masa respectivo:
d [ X A ] (Ra − Rd )
=
+ µ ⋅ [X A ]
dt
σ
Ecuación 69:
Tetrasulfuro: se considera que este ion es el aceptor terminal de electrones. La siguiente
ecuación representa el balance de masa respectivo:
[ ]
µ ([X S ] + [X A ]⋅ σ )
d S 42 −
=−
+ HS − ⋅ k S ⋅ σ ⋅1000
dt
YX
Ecuación 70:
[
]
S 42 −
Donde:
YX
S 42 −
: Coeficiente de rendimiento celular respecto del tetrasulfuro (células/mol S42-).
Hidrógeno disuelto: el hidrógeno disuelto proviene de la fase gas, desde donde se transfiere
mediante el difusor de gases. La siguiente ecuación representa el balance de masa respectivo:
d [H 2 ]ac
µ ([X S ] + [X A ] ⋅ σ )
= (k L a )H 2 ⋅ [H 2 ]g ⋅ H H 2 − [H 2 ]ac −
dt
YX
(
Ecuación 71:
)
H2
Donde:
YX
H2
= 1/3· Y X
S 42 −
(kLa)H2 : coeficiente combinado de transferencia de masa gas líquido para H2 (h-1)
HH2 : constante de Henry para el equilibrio gas – líquido de H2 (molac/molgas)
95
Ion sulfuro ácido: este ion proviene de su equilibrio de ionización con el ácido sulfhídrico. La
siguiente ecuación representa el balance de masa respectivo:
[
]
[
][ ] [
]
d HS −
= k11 ⋅ [H 2 S ] − k12 ⋅ HS − ⋅ H + − HS − ⋅ k S ⋅ σ ⋅ 1000
dt
Ecuación 72:
Donde:
k11
k12
: constante cinética de la reacción directa de la disociación del ácido
sulfhídrico (29,88·106 h-1).
: constante cinética de la reacción inversa de la disociación del ácido sulfhídrico
(2,7·1014 M-1 h-1).
Ácido sulfhídrico: el ácido sulfhídrico corresponde al producto metabólico de las bacterias. La
producción de este compuesto está relacionada directamente con el rendimiento celular respecto
del tetrasulfuro. La siguiente ecuación representa el balance de masa respectivo:
Ecuación 73:
d [H 2 S ]ac
= k12 ⋅ HS − ⋅ H + − k11 ⋅ [H 2 S ] − (k L a )H 2 S
dt
[
][ ]
[H 2 S ]g
⋅ [H 2 S ]ac −
H H 2S
4 ⋅ µ ([ X S ] + [ X A ] ⋅ σ )
+
YX
S 2−
4
Donde:
(kLa)H2S : coeficiente combinado de transferencia de masa gas líquido para H2S (h-1)
HH2S : constante de Henry para el equilibrio gas – líquido de H2S (molgas/molac)
Dióxido de carbono acuoso: proviene de la fase gas desde donde se transfiere mediante el
difusor de gases en el control de pH. Además, está en equilibrio con el bicarbonato presente en el
medio de cultivo. Considerando constante el rendimiento de biomasa formada por mol de dióxido
de carbono consumido, se obtiene el siguiente balance de masa:
Ecuación 74:
d [CO2 ]ac
µ ([X S ] + [X A ] ⋅ σ )
= k 32 ⋅ HCO3− ⋅ H + − k 31 ⋅ [CO2 ]ac + (k L a )CO2 ⋅ H CO2 ⋅ [CO2 ]g − [CO2 ]ac −
dt
YX
[
(
][ ]
)
CO2
Donde:
(kLa)CO2 : coeficiente combinado de transferencia de masa gas líquido para CO2 (h-1)
Y X CO2 = 10,78· Y X S 2 −
4
HH2S
k31
: constante de Henry para el equilibrio gas – líquido de CO2 (molac/molgas)
: constante cinética de la reacción directa de la disociación del dióxido de
carbono (30,6 h-1).
96
k32
: constante cinética de la reacción inversa de la disociación del dióxido de
carbono (72·106 M-1 h-1).
Ion Bicarbonato: este ion está presente en el medio de cultivo y está en equilibrio con el dióxido
de carbono. Para el pH de operación, la concentración de carbonato es despreciable, por lo que no
se considera como especie en equilibrio del ion bicarbonato. La siguiente ecuación representa el
balance de masa respectivo:
[
d HCO3−
Ecuación 75:
dt
]
ac
[
][ ]
= k 31 ⋅ [CO2 ]ac − k 32 ⋅ HCO3− ⋅ H +
Protones: se consumen durante la reducción del azufre elemental y están en equilibrio con el
ácido sulfhídrico y con el ion sulfuro ácido. La siguiente ecuación representa el balance de masa
respectivo:
Ecuación 76:
[ ]
([X S ] + [X A ]⋅ σ )
d H+
= k11 ⋅ [H 2 S ] − k12 ⋅ HS − ⋅ H + − k 32 ⋅ HCO 3− ⋅ H + + k 31 ⋅ [CO 2 ]ac − µ
+ HS − ⋅ k S ⋅ σ ⋅1000
dt
YX
[
][ ]
[
][ ]
[
]
H+
Donde:
YX
H
+
: Coeficiente de rendimiento celular respecto de los protones (cél/mol H+).
Transferencia de masa gas-líquido y condiciones iniciales
Los coeficientes combinados de transferencia de masa de las especies involucradas se
determinaron de acuerdo a la Ecuación 37, y utilizando el valor obtenido experimentalmente para
oxígeno como referencia. En este contexto, se utilizaron valores de kLa para hidrógeno, ácido
sulfhídrico y anhídrido de carbono de 33,48 h-1, 9,84 h-1 y 12,06 h-1, respectivamente. Los valores
utilizados de la constante de Henry (a 30ºC) para H2, CO2 y H2S fueron 0,019 (molac/molgas),
0,7435 (molac/molgas) y 0,4404 (molgas/molac), respectivamente.
El bioreactor se operó a 30°C, pH neutro y una presión de 1,5 psig durante 8 días. El H2 fue
alimentado continuamente a una velocidad superficial de gas (UG) de 2,1·10-3 m3N·m-2·s-1. El
control de pH fue mediante inyección de CO2, en una relación 1:10 con respecto a la inyección de
H2. La inyección de CO2 no fue continua, ya que dependía del alza de pH. Si se corrige esta
alimentación por el intervalo de inyección de CO2 para obtener una alimentación continua de
ambos gases, se obtiene una mezcla de H2 y CO2 en una relación volumétrica de 97% v/v y 3%
v/v, respectivamente. Considerando la presión de vapor del agua para las condiciones de
operación (0,042 atm), se calcularon las concentraciones de los gases involucrados en el sistema.
La concentración de H2(g) fue de 0,0414 M y la de CO2(g) fue de 0,0013 M. De acuerdo a las
hipótesis del modelo se consideró que la concentración de H2S(g) fue cero.
97
Para establecer las condiciones iniciales del modelo se utilizaron las observaciones
experimentales para la biomasa suspendida, ión sulfuro ácido, ácido sulfhídrico, bicarbonato y
radio promedio de las partículas de azufre. Para las restantes especies químicas se consideraron
condiciones de equilibrio. La concentración inicial de biomasa suspendida fue de 4,0·109 cel/L, la
concentración inicial de bicarbonato fue de 2,98·10-2 M, la del ácido sulfhídrico y la del ion
sulfuro ácido fue de 5,88·10-5 M (calculada a partir de la medición de sulfuro total). La
concentración inicial de CO2(ac) se estimó considerando equilibrio con el HCO3-, en 6,70·10-3 M.
Se consideró que la concentración inicial de bacterias adheridas era cero. La concentración inicial
de H2(ac) se estimó a partir de su concentración en fase gas para las condiciones de operación y
considerando una saturación del 70% (Sáez, 2001), resultando 5,51·10-4 M. La concentración
inicial de tetrasulfuro se estimó en 5,0·10-7 M. El radio promedio inicial de las partículas de
azufre fue de 15,35 µm y el número inicial de partículas fue de 1,28·109.
De acuerdo a las dimensiones de una bacteria se calculó que 592 bacterias cubrirían
completamente toda la superficie de una partícula de azufre. Sin embargo, tal como se apreció en
las microfotografías, sólo una parte de la superficie se cubre de bacterias (aproximadamente el
32% del total de la superficie), ya que hay una gran cantidad de superficie ocupada por EPS. De
este modo se consideró un número máximo de 192 bacterias por partícula, por lo que XSAT se
estimó en 6,5·1010 cel/m2.
A partir de los datos experimentales se determinó que el coeficiente de rendimiento celular
respecto de azufre elemental fue de 1,58·1012 cel·(mol S0)-1. Dado que no se determinó
tetrasulfuro, el coeficiente de rendimiento de esta especie se estimó considerando su relación
estequiométrica con el azufre elemental. De este modo el coeficiente de rendimiento celular
respecto del tetrasulfuro fue de 4,74·1012 cel·(mol S42-)-1.
Estimación de parámetros:
Los parámetros a optimizar en el modelo son:
1.
2.
3.
4.
5.
Velocidad máxima de crecimiento específico celular, µmax.
Constante de afinidad al aceptor terminal de electrones, kS1.
Constante cinética de adherencia, kA.
Constante cinética de desorción, kd.
Coeficiente cinético para la reacción en la superficie, kS
Resultados:
Se pudo ajustar adecuadamente el modelo para la concentración de bacterias suspendidas y para
el radio promedio de partículas de azufre. No fue posible lograr lo mismo para la concentración
del ion sulfuro ácido. El ajuste de parámetros arrojó un valor mínimo de la función objetivo de
0,729, considerando sólo las dos primeras variables mencionadas.
En la siguiente figura se muestran los resultados del modelo contrastados con los datos
experimentales para bacterias suspendidas. La bondad de ajuste del modelo se determinó
mediante test de χ2. La discrepancia entre los valores experimentales y simulados fue
98
estadísticamente poco significativa, ya que se obtuvo un valor de χ2 de 1,42·10-5 (p = 0,997; gl =
9). Esto significa que el modelo desarrollado verificó adecuadamente un buen ajuste para una
función de velocidad específica de crecimiento celular de tipo Monod con un sustrato limitante.
Concentración de células suspendidas
(cel/L)
1.4E+10
1.2E+10
Modelo
1.0E+10
Datos experimentales
8.0E+09
6.0E+09
4.0E+09
2.0E+09
0.0E+00
0
25
50
75
100
125
150
175
200
225
Tiempo (horas)
Figura 52. Resultado de la modelación y datos experimentales para la biomasa suspendida
En la siguiente figura se muestran los resultados del modelo contrastados con los datos
experimentales para bacterias suspendidas y radio promedio de partículas de azufre. La bondad
de ajuste del modelo se determinó mediante test de χ2. La discrepancia entre los valores
experimentales y simulados fue estadísticamente poco significativa, ya que se obtuvo un valor de
χ2 de 49,59 (p = 1,00; gl = 121).
99
Radio prom edio de partículas (m )
1.60E-05
1.55E-05
1.50E-05
1.45E-05
1.40E-05
1.35E-05
Modelo
Datos experimentales
1.30E-05
1.25E-05
1.20E-05
0
25
50
75
100
125
150
175
200
Tiempo (horas)
Figura 53. Resultado de la modelación y datos experimentales para el radio promedio de las partículas de
azufre.
En la siguiente tabla se presentan los resultados de la optimización:
Tabla 11. Parámetros óptimos del modelo matemático.
-1
µmax (h )
5,1·10-3
kS1 (M)
8,7·10-3
kA (h-1)
1·10-1
kd (h-1)
6.5·10-5
kS (m·h-1)
6,5·10-1
El valor de µmax obtenido en el presente trabajo es comparable con µmax obtenido por Zavarzina et
al (2000), pese a que esos autores trabajaron con bacterias heterótrofas termofílicas.
En la siguiente figura se presentan los resultados de la simulación de la concentración de
bacterias adheridas. La curva obtenida corresponde a una isoterma de tipo Langmuir, tal como
era de esperarse. De acuerdo a la figura, al cabo de unas 25 horas se alcanzan valores cercanos a
XSAT, siendo muy rápida la adherencia en las primeras horas.
En este estudio no se midió la concentración de bacterias adheridas. Sin embargo, se puede
comparar esta simulación con resultados experimentales obtenidos por otros autores. Por
ejemplo, Solari et al (1992) encontraron curvas similares trabajando con Thiobacillus
ferrooxidans en pirita y calcopirita, minerales con puntos isoeléctricos parecidos a los de las
partículas de azufre. Es evidente que la adherencia depende del pH, de la agitación, de la
hidrofobicidad y la carga superficial tanto de las bacterias como del sustrato de adherencia, por lo
que la comparación es sólo para establecer el orden de magnitud.
100
Bacterias adheridas (cel/m 2)
8.0E+10
7.0E+10
6.0E+10
5.0E+10
4.0E+10
3.0E+10
2.0E+10
1.0E+10
0.0E+00
0
25
50
75
100
125
150
175
200
225
Tiempo (horas)
Figura 54. Resultado de la modelación de la evolución de la biomasa adherida.
El hecho de que se alcancen valores en torno a XSAT, no significa que esté toda la superficie
cubierta, ya que además de las propias bacterias habría formación posterior de EPS o compuestos
orgánicos, tal como se pudo apreciar en las microfotografías. De acuerdo a la hipótesis
desarrollada en secciones anteriores, el desarrollo del biofilm en su conjunto, esto es bacterias y
EPS más un posible aumento de coordinación de las partículas de azufre serían los causantes de
la disminución de la velocidad de la reacción.
El modelo desarrollado no contempla la formación de EPS, por lo que sería importante
desarrollar como trabajo futuro un modelo fenomenológico que incorpore la formación de
sustancias poliméricas extracelulares en las partículas de azufre.
101
CAPÍTULO 5. CONCLUSIONES
Los resultados obtenidos demuestran la factibilidad de llevar a cabo la reducción de azufre
elemental en un reactor agitado mecánicamente y en un reactor gaslift utilizando bacterias
mesofílicas reductoras de azufre. Mediante el control adecuado de las variables pH, temperatura y
Eh se propiciaron las condiciones ideales para el desarrollo de las bacterias reductoras de azufre
utilizadas en la presente Tesis.
Los resultados experimentales mostraron que la principal limitante de la velocidad de reacción es
la disponibilidad de superficie activa de las partículas de azufre. Esta se va disminuyendo a
medida que se recubre con biofilm, compuesto tanto por bacterias como por sustancias
poliméricas extracelulares. La presencia de bacterias adheridas a la superficie de las partículas de
azufre pudo ser detectada mediante microfotografías tomadas con SEM. Por otra parte, utilizando
la técnica XPS, fue posible determinar la composición química de las sustancias poliméricas
extracelulares.
Para los dos reactores estudiados se encontró que la reacción es de primer orden con respecto al
azufre y el hidrógeno no tiene mayor efecto sobre ésta. En el caso del reactor agitado
mecánicamente esto es válido para el rango de velocidad supercial de gas comprendido entre
1,4·10-3 y 6,8·10-3 m3N·m-2·s-1. Para el reactor gaslift esto es válido para un rango de UGR
comprendido entre 4,2·10-3 y 2,3·10-2 m3N·m-2·s-1.
Se pudo comprobar que no hay limitación por transferencia de masa gas líquido del hidrógeno.
Tampoco se evidenciaron problemas por inhibición por producto (ácido sulfhídrico). Sólo se
presentaron problemas de desorción del ácido sulfhídrico para una velocidad de gas igual a
5,1·10-4 m3N·m-2·s-1, en el reactor agitado mecánicamente.
Se pudo constatar que una de las variables críticas del reactor gaslift es la velocidad de
circulación del líquido, ya que de ella depende el grado de mezcla y la adecuada suspensión de
las partículas de azufre. Mediante los fundamentos y criterios de diseño del reactor gaslift, es
posible diseñar los parámetros geométricos de este reactor, de tal manera de maximizar la
velocidad de circulación del líquido.
A la luz de los resultados obtenidos empleando la técnica de T-RFLP, se puede afirmar que en el
reactor gaslift de bioreducción de azufre elemental existe un cultivo mixto de bacterias que
experimenta cambios en la distribución de sus poblaciones, favoreciéndose las de mayor
adaptabilidad a las condiciones imperantes en el reactor. Estos cambios poblacionales pueden
deberse a variaciones de las propiedades fisicoquímicas del medio, como el potencial de óxido
reducción o la fuerza iónica. No existe una diferenciación estadísticamente significativa entre las
bacterias adheridas y aquellas que permanecen suspendidas.
Mediante el estudio de intermediarios de la reacción, fue posible detectar tiosulfato. Este
compuesto podría provenir de la reacción entre el ión HS- y el tetrationato. También fue posible
detectar otro compuesto más, cuyo tiempo de retención no coincidió con ninguno de los
102
estándares empleados. Este compuesto podría corresponder a un polisulfuro del tipo [Sn-1(0)S(2-)]2-,
ya que estos compuestos también presentan absorción en esta zona de la región UV.
Se constató que para llevar a cabo el proceso de bioreducción de azufre elemental es más
conveniente el empleo del reactor gaslift que el reactor agitado mecánicamente, ya que se logra
un patrón de mezclado aceptable, una buena suspensión de azufre y mayores velocidades de
formación de producto para menores consumos de potencia.
Mediante el desarrollo de un modelo fenomenológico que describió la bioreducción de azufre
elemental, se determinaron los parámetros cinéticos de la reacción en el reactor agitado
mecánicamente. Se pudo ajustar adecuadamente el modelo para la concentración de bacterias
suspendidas y para el radio promedio de partículas de azufre. No fue posible lograr lo mismo para
la concentración del ion sulfuro ácido.
Una vez realizadas todas las actividades propuestas, es posible concluir que el objetivo general
propuesto fue cumplido, ya que fue posible llevar a cabo la bioreducción de azufre elemental en
un reactor agitado mecánicamente y en un reactor gaslift. Los objetivos específicos propuestos
fueron logrados satisfactoriamente, ya que se lograron identificar las variables críticas del sistema
y las etapas limitantes de la velocidad de la reacción, se logró estudiar la adherencia bacteriana,
se pudieron identificar posibles intermediarios de la reacción y fue posible determinar parámetros
cinéticos mediante el desarrollo de un modelo fenomenológico. La hipótesis postulada fue
probada satisfactoriamente, gracias a los resultados obtenidos. En resumen se ha conseguido
avanzar en el estado del arte de la investigación de la bioreducción de azufre elemental.
103
CAPÍTULO 6. RECOMENDACIONES
Como trabajo futuro queda propuesto investigar el mecanismo de la disolución de azufre
elemental y la formación de polisulfuros del tipo [Sn-1(0)S(2-)]2-, en presencia del ión sulfuro ácido,
mediante el empleo de métodos de reciente desarrollo como el propuesto por Kamyshny et al
(2006). Una vez estudiado esto, se podría dilucidar cuál polisulfuro es el aceptor terminal de
electrones en la bioreducción de azufre elemental. Este estudio también daría pie para investigar
el transporte activo del aceptor de electrones a través de las células bacterianas y su rol en la
alcalinización del medio durante la reacción de reducción de azufre.
También se propone estudiar la cinética de la reacción en un sistema compuesto por dos reactores
conectados en serie con recirculación interna, pero sin contacto bacteria-sólido. Este sistema
debería tener un reactor agitado con el azufre suspendido y un bioreactor con las bacterias
suspendidas, ambos con medio de cultivo. Las conexiones hidráulicas entre ambos reactores
deben estar provistas de filtros, para que no se contacten las bacterias con las partículas de azufre.
Así se evitaría la adherencia bacteriana y el consiguiente agotamiento prematuro de superficie
reactiva de las partículas de azufre. Tanto el aceptor de electrones (pj el ion tetrasulfuro) como el
agente nucleofílico (HS-), podrían traspasar sin problemas los filtros. De esta manera se asegura
la respiración celular y la reacción de rompimiento de anillos S8. En la siguiente figura se
presenta el esquema propuesto:
Figura 55. Esquema propuesto de sistema experimental para estudiar reducción de azufre sin contacto con
bacterias.
Por último se propone incorporar el desarrollo de un modelo fenomenológico que incorpore la
formación de sustancias poliméricas extracelulares en las partículas de azufre.
104
REFERENCIAS
ATLAS, R. M. 1997. Handbook of microbiological media. New York, CRC Press.
AZABOU S., MECHICHI T., PATEL B., SAYADI S. 2007. Isolation and characterization of a
mesophilic heavy-metals-tolerant sulfate-reducing bacterium Desulfomicrobium sp. from an
enrichment culture using phosphogypsum as a sulfate source. Journal of Hazardous Materials.
140: 264–270.
BAILLEY, James E. y Ollis, David F. 1986. Biochemical Engineering Fundamentals. 2ª ed. New
York: McGraw-Hill, 984p.
BELKIN S., WIRSEN C., JANNASCH H.W. 1985. Biological and abiological sulfur reduction
at high Temperatures. Applied and Environmental Microbiology. 49(5): 1057-1061.
BELLO R. A., ROBINSON C. W., YOUNG M. M. 1984. Liquid Circulation and Mixing
Characteristics of Airlift Contactors. The Canadian Journal of Chemical Engineering. 62(5): 573
– 577.
BELLO R. A., ROBINSON C. W., YOUNG M. M. 1985a. Prediction of The Volumetric Mass
Transfer Coefficient in Pneumatic Contactors. Chemical Engineering Science. 40(1): 53 – 58.
BELLO R. A., ROBINSON C. W., YOUNG M. M. 1985b. Gas holdup and overall volumetric
oxygen transfer coefficient in airlift contactors. Biotechnology and Bioengineering. 27: 369–381.
BELYAKOVA E.V., ROZANOVA E.P., BORZENKOV I.A., TOUROVA T.P., PUSHEVA
M.A., LYSENKO A.M., KOLGANOVA T.V. 2006. The New Facultatively
Chemolithoautotrophic, Moderately Halophilic, Sulfate-Reducing Bacterium Desulfovermiculus
Halophilus gen. nov., sp. nov., Isolated from an Oil Field. Microbiology. 75: 161-171.
van BENTHUM W.A.J., van der LANS R.G.J.M, van LOOSDRECHT M.C.M, HEIJNEN J.J.
1999. Buble recirculation regimes in an internal-loop airlift reactor. Chem. Eng. Sci. 54: 3995 –
4006
BIEBL, H. y PFENNIG, N. 1977. Growth of Sulfate-Reducing Bacteria with Sulfur as Electron
Acceptor. Archives of Microbiology. 112: 115-117.
BLUMENTALS I.I., ITOH M., OLSON G.J., KELLY R.M. 1990. Role of Polysulfides in
Reduction of Elemental Sulfur by the Hyperthermophilic Archaebacterium Pyrococcus furiosus.
Applied and Environmental Microbiology. 56: 1255 –1262.
BÖTTCHER M. E, THAMDRUP B., GEHRE M., THEUNE, A. 2005. 34S/32S and 18O/16O
Fractionation During Sulfur Disproportionation by Desulfobulbus propionicus. Geomicrobiology
Journal. 22: 219–226.
105
BÖTTCHER M. E, THAMDRUP B., VENNEMANN T. W. 2001. Oxygen and sulfur isotope
fractionation during anaerobic bacterial disproportionation of elemental sulfur. Geochimica et
Cosmochimica Acta. 65: 1601-1609.
BRION D. 1980. Etude par spectroscopie de photoelectrons de la degradation superficielle de
FeS2, CuFeS2, ZnS et PbS a láie et dans léau. Appl. Surf. Sci. 5(2): 133 – 152.
CACCAVO F., LONERGAN D. J., LOVLEY D.R, DAVIS M, STOLZ J.F, MCINERNEY M.J.
1994. Geobacter sulfurreducens sp. nov., a Hydrogen- and Acetate- Oxidizing Dissimilatory
Metal-Reducing Microorganism. Applied and Environmental Microbiology. 60: 3752–3759.
CHAN K, XU L, FANG H. 2002. Anaerobic Electrochemical Corrosion of Mild Steel en the
Presence of Extracellular Polymeric Substances Produced by a Culture Enriched in SulfateReducing Bacteria. Environmental Science & Technology. 36(8): 1720 – 1727.
CHISTI M.Y., HALARD B., MOO-YOUNG M. Liquid Circulation in Airlift Reactors. 1988.
Chemical Engineering Science. 43(3): 451 – 457.
CILENTO, G. 1960. The expansion of the sulfur outer shell. Chems. Revs. 60: 147 – 167.
CLESCERI L.S, GREENBERG A., EATON A.D. 1998a. Standard methods for the examination
of water and wastewater. Method 4500-S2- D. 20th ed. Washington. American Public Health
Association.
CLESCERI L.S, GREENBERG A, EATON A.D. 1998b. Standard methods for the examination
of water and wastewater. Method 2540 D. 20th ed. Washington. American Public Health
Association.
COSTA A.L, BEZZI G., LA TORRETTA T.M.G., VERNA S. 2002. New process for the
preparation of pigment-coated phosphors on the base of electroacoustic characterization. Journal
of the European Ceramic Society. 22: 1667 – 1672.
COUVERT A, ROUSTAN M., CHATELLIER P. 1999. Two-phase hydrodynamics study of a
rectangular airlift loop reactor with an internal baffle. Chemical Engineering Science. 54: 5245 –
5252.
CYPIONKA H. 1989. Characterization of sulfate transport in Desulfovibrio desulfuricans. Arch.
Microbiol. 152: 237 – 243.
CYPIONKA H, PFENNIG, N. 1986. Growth yields of Desulfotomaculum orientis with hydrogen
in chemostat culture. Arch. Microbiol. 143: 396 – 399.
DÍAZ Alvarado, Felipe Andrés. 2007. Gasificación de carbón en Chile para producción de
hidrógeno y electricidad en plantas de ciclo combinado. Tesis (Magíster en Ciencias de la
Ingeniería mención Química e Ingeniero Civil en Biotecnología). Santiago, Chile. Universidad
de Chile, Facultad de Ciencias y Físicas Matemáticas, 169 h.
DORAN, Pauline M. 1995. Bioprocess Engineering Principles. London: Academic Press, 439p.
106
DÛFRENE, Y. F.y ROUXHET, P. G. 1996. X-ray photoelectron spectroscopy analysis of the
surface composition of Azospirillum brasilense in relation with growth conditions. Colloids Surf
B: Biointerfaces. 7: 271-279.
DUNN, I.J y EINSELE, A L. 1975. Oxygen transfer coefficients by the dynamic method. Journal
Appl. Chem. Biotechnology. 25: 707-720.
FEHRMANN Herrgutt, Alexis Marisol. 1989. Estudio experimental del cultivo continuo de
Thiobacillus ferrooxidans: comportamiento dinámico de la biomasa adherida. Tesis (Ingeniero
Civil Químico). Santiago, Chile. Universidad de Chile, Facultad de Ciencias y Físicas
Matemáticas, 237 h.
FRANZ B, LICHTENBERG H, HORMES J, MODROW H, DAHL C, PRANGE A. 2007.
Utilization of solid ‘elemental’ sulfur by the phototrophic purple sulfur bacterium
Allochromatium vinosum: a sulfur K-edge X-ray absorption spectroscopy study. Microbiology.
153: 1268 – 1274.
FREDERIKSEN, T. y FINSTER, K. 2003. Sulfite-oxide-reductase is involved in the oxidation of
sulfite in Desulfocapsa sulfoexigens during disproportionation of thiosulfate and elemental sulfur.
Biodegradation. 14: 189-198.
FREITAS, C y TEIXEIRA, A. 2001. Oxygen mass transfer in a high solids loading three-phase
internal-loop airlift reactor. Chem. Eng. Journal. 84: 57–61.
GALACTION A.I, CASCAVAL D, ONISCU C, TURNEA M. 2004. Prediction of oxygen mass
transfer coefficients in stirred bioreactors for bacteria, yeasts and fungus broths. Biochemical
Engineering Journal. 20: 85–94.
GAVRILESCU, M. y TUDOSE, R.Z. 1996. Effects of downcomer-to-riser cross sectional area
ratio on operation behaviour of external-loop-airlift bioreactors. Bioprocess and Biosystems
Engineering. 15(2): 77 – 85.
GAVRILESCU, M. y TUDOSE, R.Z. 1998a. Concentric-tube Airlift Bioreactors, Part I: Effects
of Geometry on gas Holdup. Bioprocess Engineering. 19: 37 – 44.
GAVRILESCU, M. y TUDOSE, R.Z. 1998b. Concentric-tube Airlift Bioreactors, Part II: Effects
of Geometry on liquid circulation. Bioprocess Engineering. 19: 103 – 109.
GAVRILESCU, M. y TUDOSE, R.Z. 1998c. Concentric-tube Airlift Bioreactors, Part III: Effects
of Geometry on mass transfer. Bioprocess Engineering. 19: 175 – 178.
GEHRKE T, TELEGDI J, THIERRY D, SAND W. 1998. Importance of Extracellular Polymeric
Substances from Thiobacillus ferrooxidans for Bioleaching. Applied and Environmental
Microbiology. 64(7): 2743–2747.
GIGGENBACH, W. 1972. Optical spectra and equilibrium distribution of polysulfide ions in
aqueous solution at 20ºC. Inorganic Chemistry. 11: 1201 – 1207.
107
GÓMEZ-SUÁREZ C, PASMA J, VAN DER BORDEN A, WINGENDER J, FLEMMING H,
BUSSCHER H, van DER MEI H. 2002. Influence of extracellular polymeric substances on
deposition and redeposition of Pseudomonas aeruginosa to surfaces. Microbiology. 148: 1161–
1169.
GOUVEIA E.R., HOKKA C.O., BADINO-Jr A.C. 2003. The effects of geometry and operational
conditions on gas Holdup, Liquid Circulation and Mass Transfer in an Airlift reactor. Brazilian
Journal of Chemical Engineering. 20(4): 363 – 374.
HARTLER N, LIBERT J, TEDER A. 1967. Rate of sulfur dissolution in aqueous sodium sulfide.
I&EC Process Design and Development. 6(4): 398 – 406.
HEDDERICH R, KLIMMEK O, KRÖGER A, DIRMEIER R, KELLER M, STETTER KO.
1999. Anaerobic respiration with elemental sulfur and with disulfides. FEMS Microbiology
Reviews. 22: 353 – 381.
HEIJNEN J.J, Hols J., van der LANS R.G.J.M., van LEEUWEN H.L.J.M., MULDER A.,
WELTEVREDE R. 1997. A simple hydrodynamic model for the liquid circulation velocity in a
full-scale two and three-phase internal airlift reactor operating in the gas recirculation regime.
Chem. Eng. Sci. 52(15): 3995 – 4006.
HERRERA L, HERNÁNDEZ J, BRAVO L, ROMO L, VERA L. 1997. Biological process for
sulfate and metals abatement from mine effluents. Environ. Toxicol. Water Qual. 12:101-107.
HERRERA Zeppelin, Albert Leandro. 1982. The Production and Kinetics of Trichoderma Reesei
Cellulase. Tesis de Ph.D. University of Wales.
HIEMENZ, P.C y RAJAGOPALAN, R. 1997. Principles of Colloid and Surface Chemistry. 3ª
ed. New York: Ed Marcel Dekker, 650p.
van HOUTEN R, HULSHOFF L, LETTINGA G. 1994. Biological Sulphate Reduction Using
Gas-Lift Reactors Fed with Hydrogen and Carbon Dioxide as Energy and Carbon Source.
Biotechnology and Bioengineering. 44: 586-594.
HUGHMARK G. 1980. Power Requirements and Interfacial Area in Gas-Liquid Turbine
Agitated Systems. Ind. Eng. Chem. Process Des. Dev. 19(4): 638 – 641.
HULSHOFF L.W, CASTRO S.I., LENS P.N.L., LETTINGA G. 2004. Anaerobic sludge
granulation. Water Res. 38: 1376–1389.
HWANG, S.J y LU, W.J. 1997. Gas-liquid mass transfer in an internal loop airlift reactor with
low density particles. Chemical Engineering Science. 52(5): 853 – 857.
KAMYSHNY A Jr, EKELTCHIK I, GUN J, LEV O. 2006. Method for the determination of
inorganic polysulfide distribution in Aquatic Systems. Anal. Chem. 78(8): 2631 – 2639.
KELEMEN S.R., GEORGE G.N., GORBATY M.L. 1990. Direct determination and
quantification of sulphur forms in heavy petroleum and coals: 1. The X-ray photoelectron
spectroscopy (XPS) approach. Fuel. 69(8): 939 – 944.
108
KLIMMEK O, KRÖGER A, STEUDEL R, HOLDT G. 1991. Growth of Wolinella succinogenes
with polysulphide as terminal acceptor of phosphorylative electron transport. Arch. Microbiol.
155: 177 – 182.
KLIMMEK O, KREIS V, KLEIN C, SIMON J, WITTERSHAGEN A, KRÖGER A. 1998. The
function of the periplasmic Sud protein in polysulfide respiration of Wolinella succinogenes. Eur.
J. Biochem. 255: 263- 269.
KORPIJARVI J., OINAS P, REUNANEN J. 1999. Hydrodynamics and mass transfer in an airlift
reactor. Chem. Eng. Sci. 54: 2255 – 2262.
LEVA, Max. 1960. Fluidization. New York: McGraw-Hill, 327p.
LEVENSPIEL, Octave. 2002. Ingeniería de las reacciones químicas. México: Editorial Reverté,
638p.
LU, W.J. y HWANG, S.J. 1995. Liquid velocity and gas holdup in three-phase internal loop
airlift reactors with low-density particles. Chemical Engineering Science. 50(8): 1301 – 1310.
MERCHUK J.C, OSEMBERG G., SIEGEL M., SHACHAM M. 1992. A Method for Evaluation
of Mass Transfer Coefficients in the Different Regions of Air Lift Reactors. Chemical
Engineering Science. 47: 3517 – 3523.
MERCHUK J.C, LADWA N, CAMERON A, BULMER M, PICKETT A. 1994. ConcentricTube Airlift Reactors: Effects of Geometrical Design and Performance. AIChE. 40(7): 1105 –
1117.
MERCHUK J.C, CONTRERAS A, GARCÍA F, MOLINA. 1998. Studies of mixing in a
concentric tube airlift bioreactor with different spargers. Chemical Engineering Science. 53(4):
709 – 719.
MERCHUK J.C. 2003. Arlift Bioreactors: Review of Recent Advances. The Canadian Journal of
Chemical Engineering. 81: 324 – 337.
MEYER, B. 1976. Elemental Sulfur. Chemical Reviews. 76(3): 367-388.
MILLER, D. 1983. Interfacial area, bubble coalescence and mass transfer in bubble column
reactors. AICHE. 29(2): 312-319.
MOGENSEN G.L, KJELDSEN K.U, INGVORSEN K. 2005. Desulfovibrio aerotolerans sp.
nov., an oxygen tolerant sulphate reducing bacterium isolated from activated sludge. Anaerobe.
11: 339 – 349.
MOO-YOUNG, M. y BLANCH, H. 1981. Design of biochemical reactors: mass transfer criteria
for simple and complex systems. Adv. Biochem. Eng. 19: 1-69.
MORALES Darker, Gabriela Andrea. 2006. Estimación de la biodiversidad bacteriana presente
en procesos de biolixiviación mediante análisis del DNA. Tesis (Ingeniero Civil Químico e
109
Ingeniero Civil en Biotecnología). Santiago, Chile. Universidad de Chile, Facultad de Ciencias y
Físicas Matemáticas, 98 h.
MORENO, Claudia E. 2001. Métodos para medir la Biodiversidad. En: Manuales y Tesis SEA.
Zaragoza, Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo, Volumen 1.
NAGATA, Shinji. 1975. Mixing principles and applications. New York: John Wiley & Sons,
458p.
NAKAGAWA S, INAGAKI F, TAKAI K, HORIKOSHI K, SAKO Y. 2005. Thioreductor
micantisoli gen. nov., sp. nov., a novel mesophilic, sulfur-reducing chemolithoautotroph within
the -Proteobacteria isolated from hydrothermal sediments in the Mid-Okinawa Trough.
International Journal of Systematic Evolutionary Microbiology. 55: 599-605.
NIELSEN, P.H. 1987. Biofilm dynamics and kinetics during high-rate sulfate reduction under
anaerobic conditions. Applied and Environmental Microbiology. 53: 27-32.
OKABE, S y CHARACKLIS, W.G. 1992. Effects of temperature and phosphorus concentration
on microbial sulfate reduction by Desulfovibrio desulfuricans. Biotechnology and
Bioengineering. 39: 1031-1042.
OKABE S, NIELSEN P, CHARAKLIS W. 1992. Factors affecting microbial sulfate reduction by
Desulfivibrio desulfuricans in continuous cultures: limiting nutrients and sulfide concentration.
Biotechnology and Bioengineering. 40: 725-734.
OKABE S, NIELSEN P, JONES W.L, CHARAKLIS W. 1995. Sulfide product inhibition of
Desulfivibrio desulfuricans in batch and continuous cultures. Water Research. 29: 571 – 578.
PFENNIG, N y BIEBL, H. 1976. Desulfuromonas acetoxidans gen. nov. and sp. nov., a New
Anaerobic Sulfur-Reducing, Acetate-Oxidizing Bacterium. Archives of Microbiology. 110: 3 -12.
PORTER K.R, KELLEY D, ANDREWS P.M. 1972. The preparation of cultured cells and solft
tissues for scanning electron microscopy. Proceedings of The Fifth Annual Stereoscan
Colloquium. p 1-19.
PRYOR, William A. 1962. Mechanisms of sulfur reactions. New York: McGraw-Hill, 241p.
REIS M. A. M., ALMEIDA J. S, LEMOS P.C, LARRONDO M. J. T. 1992. Effect oh hydrogen
sulfide on growth of sulfate-reducing bacteria. Biotechnology and Bioengineering. 40: 593-600.
SÁEZ Navarrete, César Antonio. 2001. Modelación dinámica fenomenológica de un bioreactor
continuo de reducción de sulfato. Tesis (Doctor en Ciencias de la Ingeniería mención Química).
Santiago, Chile. Universidad de Chile, Facultad de Ciencias y Físicas Matemáticas, 130 h.
SCHWARZENBACH, G y FISCHER, A. 1960. Die acidität der sulfane und die
zusammensetzung wässeriger polysulfidlösungen. Helv Chim Acta. 43: 1365 – 1390.
SCHAUDER R y KRÖGER A. 1993. Bacterial sulphur respiration. Arch. Microbiol. 159: 491497.
110
SEGERER A, STETTER K.O, KLINK F. 1985. Two contrary modes of chemolithotrophy in the
same archaebacterium. Nature. 313: 787 – 789.
SHAH, Yatish T. 1979. Gas-Liquid-Solid reactor design. 1ª ed. New York: McGraw-Hill, 370p.
SHRIHARI, BHAVARAJU S.R, MODAK J.M, KUMAR R, GANDHI K.S. 1993. Dissolution of
Sulphur Particles by Thiobacillus ferrooxidans: Substrate for Unattached Cells. Biotechnology
and Bioengineering. 41: 612-616.
SIEGEL M.H y MERCHUK J.C. 1987. Mass transfer in a rectangular airlift reactors: Effects of
geometry and gas recirculation. Biotechnology and Bioengineering. 32: 1128-1137.
SKOOG, Douglas A. y LEARY, James J. 1994. Análisis Instrumental. 4ª ed. Madrid: McGrawHill, 935p.
SOLARI J, HUERTA G, ESCOBAR B, VARGAS T y BADILLA-OHLBAUM R. 1992. Rol de
las propiedades hidrofóbicas y electrocinéticas del Thiobacillus ferrooxidans en la adherencia a
superficies minerales. Minerales. 46(195): 41-47.
STARKEY, R. L. 1937. Formation of sulfide by some sulfur bacteria. J. Bacterial. 33: 545-571.
STETTER, K y GAAG G. 1983. Reduction of molecular sulphur by methanogenic bacteria.
Nature. 305: 309 – 311.
TAKAI K, HIRAYAMA H, NAKAGAWA T, SUZUKI Y, NEALSON K.H, HORIKOSHI K.
2005. Lebetimonas acidiphila gen. nov., sp. nov., a novel thermophilic, acidophilic, hydrogenoxidizing chemolithoautotroph within the ‘Epsilonproteobacteria’, isolated from a deep-sea
hydrothermal fumarole in the Mariana Arc. International Journal of Systematic Evolutionary
Microbiology. 55: 183-189.
TAKAI K, NAKAGAWA S, SAKO Y, HORIKOSHI K. 2003. Balnearium lithotrophicum gen.
nov., sp. nov., a novel thermophilic, strictly anaerobic, hydrogenoxidizing chemolithoautotroph
isolated from a black smoker chimney in the Suiyo Seamount hydrothermal system. International
Journal of Systematic Evolutionary Microbiology. 53: 1947-1954.
TEDER, A. 1969. The spectra of aqueous polysulfide solutions. Part II: the effect of alkalinity
and stoichiometric composition at equilibrium. Arkiv För Kemi. 31: 173 – 198.
THABET O.B, FARDEAU M.L, JOULIAN C, THOMAS P, HAMDI M, GARCIA J.L,
OLLIVIER B. 2004. Clostridium tunisiense sp. nov., a new proteolytic, sulfur-reducing
bacterium isolated from an olive mill wastewater contaminated by phosphogypse. Anaerobe. 10:
185 –190.
THAMDRUP B, FINSTER K, HANSEN J.W, BAK F. 1993. Bacterial Disproportionation of
elemental sulfur coupled to chemical reduction of iron or manganese. Applied and Environmental
Microbiology. 59:101-108.
111
TOBAJAS M., GARCÍA-CALVO E., SIEGEL M.H., APITZ S.E. 1999. Hydrodynamics and
mass transfer prediction in a three-phase Airlift reactor for marine sediment biotreatment. Chem.
Eng. Sci. 54: 5347 – 5354.
TREYBAL, Robert Ewald. 1980. Operaciones de transferencia de masa. 2ª ed. México: McGrawHill, 858p.
TWIGG, R.S. 1945. Oxidation-reduction aspects of resazurin. Nature. 155: 401 – 402.
VERA Cavada, Loreto Soledad. 1995. Bioreactor Gaslift de sulfato reducción anaeróbica
autotrófica. Tesis (Ingeniero Civil Químico). Santiago, Chile. Universidad de Chile, Facultad de
Ciencias y Físicas Matemáticas, 117 h.
VISSER A, ALPHENAAR P.A, GAO Y, van ROSSUM G, LETTINGA G. 1993. Granulation
and immobilization of methanogenic and sulphate-reducing bacteria in high rate anaerobic
reactors. Applied and Environmental Microbiology. 40: 575-581.
VIVANCO, Manuel. 1999. Análisis estadístico multivariable: teoría y práctica. 1ª ed. Santiago,
Comité de Publicaciones Científicas, Universidad de Chile: Universitaria, 234p.
WARTHMANN R, CYPIONKA H. 1990. Sulfate transport in Desulfobulbus propionicus and
Desulfococcus multivorans. Arch. Microbiology. 154: 144 – 149.
WIDDEL F, KOHRING G.W., MAYER F. 1983. Studies on dissimilatory sulfate-reducing
bacteria that decompose fatty acids. lI. Characterization of the filamentous gliding Desulfonema
limicola gen. nov. sp. nov. and Desulfonema magnum sp. nov. Arch. Microbiol. 134: 286-294.
WOLFE, R.S y PFENNIG, N. 1977. Reduction of Sulfur by Spirillum 5175 and Syntrophism
with Chlorobium. Applied and Environmental Microbiology. 33: 427 – 433.
ZAVARZINA D.G., ZHILINA T.N., TOUROVA T.P., KUZNETSOV B.B, KOSTRIKINA
N.A., BONCH-OSMOLOVSKAYA E.A. 2000. Thermanaerovibrio velox sp. nov., a new
anaerobic, thermophilic, organotrophic bacterium that reduces elemental sulfur, and emended
description of the genus Thermanaerovibrio. International Journal of Systematic and
Evolutionary Microbiology. 50: 1287-1295.
112
APÉNDICES
113
APÉNDICE A. Determinación velocidad de agitación reactor agitado
mecánicamente
La velocidad de agitación crítica (Nf) para suspender las partículas de azufre se determinó de
acuerdo a la siguiente expresión (Nagata, 1975):
Ecuación A 1
N f = K ·Di
−2 / 3
·d p
1/ 3
ρ − ρL
· s
ρL
2/3
µ
·
ρL
−1 / 9
Vp'
·
Vp
0.7
Donde:
K
dp
µ
ρL
ρS
Vp
Vp `
: constante de proporcionalidad
: diámetro de partícula (mm)
: viscosidad (cp)
: densidad del líquido (g/mL)
: densidad del sólido (g/mL)
: volumen verdadero de las partículas
: volumen bulk de las partículas
Considerando una constante K igual a 160 (Nagata, 1975), se determinó que Nf tenía un valor
igual a 254 RPM. Sin embargo, este valor se corrigió para la cantidad de azufre presente según
procedimiento descrito por Nagata (1975), resultando un valor de 219 RPM. Para asegurar la
suspensión completa se agitó el reactor a una velocidad igual a 250 RPM.
114
APÉNDICE B. Resazurina como indicador de anaerobiosis.
La resazurina es una oxazona de color azul en soluciones acuosas oxigenadas. Sometido a
condiciones reductoras, la resazurina cambia de color desde azul a rosado y después a incoloro,
cuando el oxígeno es limitante en el medio (Twigg, 1945). La primera etapa de reducción se debe
a la pérdida de un átomo de oxígeno débilmente enlazado al nitrógeno del núcleo de la
fenoxazina. Esta etapa de reducción es irreversible y el compuesto formado corresponde a la
resorufina (7-hidroxi-3H-fenoxazina-3-ona). La segunda etapa de reducción es reversible, y en
ella tiene lugar la transformación de resorufina a dihidro-resorufina (10H-fenoxazina-3,7-diol),
compuesto incoloro que por oxidación puede pasar de nuevo a resorufina (Figura A 1). La
reducción de la resorufina (color rosado) a dihidro-resorufina (incoloro) tiene lugar cuando el Eh
adquiere un valor menor o igual a -100 mV (Twigg, 1945). Es esta última reacción la que se
utiliza como indicador de anaerobiosis, por lo que la ausencia de color del indicador indica un
resultado positivo de anaerobiosis.
O
N
-
+
N
+
2H 2e-
-[O]
O
O
OH
O
O
OH
Resorufina (rosado)
Resazurina (azul)
H
N
HO
O
OH
Dihidro - resorufina (incoloro)
Figura A 1. Formación de compuestos reducidos de la resazurina.
115
APÉNDICE C. Procedimiento T–RFLP
En la Figura A 2 se muestran las diferentes etapas de la técnica T-RFLP. En primer lugar se
extrae el DNA, para luego realizar un PCR con Primers no marcados simple usando distintos
volúmenes de DNA con el objeto de determinar la cantidad óptima a usar en los PCR con Primers
marcado. Después se hace el PCR marcado por triplicado y se mezcla el producto obtenido, para
tener una cantidad adecuada de DNA para las etapas siguientes y minimizar errores. Se purifican
los productos de PCR, para eliminar primers marcados y otro tipo de material que pueda interferir
posteriormente. Luego se cuantifica la concentración de DNA, para digerir los productos de PCR
con las respectivas enzimas de restricción y finalmente se realiza la electroforesis. Las distintas
electroforesis mostradas permiten verificar el correcto funcionamiento de cada etapa.
Figura A 2. Etapas involucradas en el desarrollo de T-RFLP (Fuente: Morales G, 2006).
116
Extracción de DNA
Para la extracción de DNA de las muestras 1 y 2, se utilizó el Kit de extracción UltraClean Soil
DNA Isolation Kit de MoBIO Labs.
Para la extracción de DNA de la muestra de azufre se utilizó el Kit de extracción de DNA Kit
PowerMaxSoil DNA Isolation Kit de MoBio Labs.
Ambos Kit constan de las soluciones S1, S2, S3, S4, S5, PowerBead e IRS (Inhibitor Removal
Solution). Traen también filtros spin.
El protocolo de extracción es el siguiente:
1. A los tubos con 2 mL de solución PowerBead se le agrega la cantidad de muestra necesaria que
contenga entre 0,25 y 1 gramo de biomasa.
2. Revolver suavemente
3. Revisar la solución S1. Si esta solución ha precipitado, calentarla hasta 60ºC hasta que se
disuelva, antes de ocuparla.
4. Agregar 60 µL de solución S1 y agitar (Vortex 3 a 4 segundos).
5. Agregar 200 µL de solución IRS. Se requiere sólo si el DNA se utilizará para PCR. (Vortex 3 a
4 segundos).
6. Asegurar los tubos en Vortex. Calentar a 70ºC por 5 minutos y después agitarlos en el Vortex
por 3 a 5 segundos. Repetir una vez.
7. Asegurarse que los tubos de 2 mL roten libremente en la centrífuga sin restregarse. Centrifugar
los tubos a 13000 RPM por 30 segundos.
8. Transferir el sobrenadante a un tubo microcentrífugo limpio.
9. Agregar 250 µL de solución S2 y agitar en Vortex por 5 segundos. Incubar a 4ºC por 5
minutos.
10. Centrifugar los tubos por 1 minuto a 13000 RPM.
11. Transferir el volumen completo de sobrenadante a un tubo microcentrífugo limpio, evitando
transferir el pellet.
12. Agregar 1 mL de solución S3 al sobrenadante y agitar en vortex por 5 segundos.
13. Cargar aproximadamente 700 µL a un filtro spin y centrifugar a 10000 x g por un minuto.
Descartar el filtrado, y agregar el resto del sobrenadante al filtro spin y centrifugar a 10000 x g
117
por un minuto. Repetir hasta que todo el sobrenadante haya pasado por el filtro. NOTA: un total
de 3 cargas para cada muestra procesada es requerida.
14. Agregar 300 µL de solución S4 y centrifugar a 30 segundos por 10000 x g.
15. Descartar el filtrado.
16. Centrifugar de nuevo por 1 minuto.
17. Colocar cuidadosamente el filtro spin en un nuevo tubo limpio. Evitar salpicar la solución S4
en el filtro spin.
18. Agregar 50 µL de solución S5 al centro de la membrana blanca del filtro.
19. Centrifugar por 30 segundos.
20. Descartar el filtro spin. El DNA en el tubo está listo para ser aplicado. Se recomienda guardar
el DNA congelado (-20ºC). La solución S5 no contiene EDTA.
Amplificación del 16S rDNA mediante PCR
Las condiciones que se usan para la realización del PCR con primers marcados o no marcados
son las mismas y se entregan a continuación. Las concentraciones de los reactivos se muestran en
la Tabla A 1. El volumen final de la reacción es 25 µL.
Tabla A 1. Concentraciones de los reactivos utilizados en PCR.
Reactivo
Partidor forward
Partidor reverse
Nucleótidos
Buffer Taq
MgCl2
Taq Polimerasa
Concentración final
0,5 µM
0,5 µM
200 µM
1X
2 mM
2,5 U
La cantidad de DNA genómico a utilizar para el PCR marcado se determina realizando tres
reacciones simultáneas de PCR con distintas diluciones de DNA en el volumen final de reacción.
Purificación y cuantificación de DNA
La purificación de los productos de la reacción de PCR con primers marcados se lleva a cabo
mediante el kit comercial QIAquick Gel Extraction Kit Protocol, de Qiagen, siguiendo el
protocolo descrito por el fabricante.
La cuantificación se realiza mediante espectrofotometría con luz ultravioleta a una longitud de
onda de 260 nm.
118
Digestión de productos de PCR y electroforesis capilar
La digestión se realiza en un volumen final de reacción de 20 µL. Las concentraciones de los
reactivos se detallan en la Tabla A 2. En esta etapa se utilizan dos enzimas de restricción (MspI y
Hae III), en dos digestiones separadas.
Tabla A 2. Concentraciones de los reactivos utilizados en la digestión.
Reactivo
Producto PCR purificado
MspI (Hpa II) / Hae III
Buffer MspI (Hpa II) / Buffer Hae III
Concentración final
18 ng/µL
15 U
1X
Para asegurar una reacción completa, la digestión se realiza a 37ºC durante 3 horas.
La electroforesis capilar es realizada por la empresa Genética y Tecnología limitada.
La concentración mínima de DNA a enviar es de 10 ng/µL y el volumen mínimo es 5 µL.
Procesamiento de resultados de electroforesis capilar
Los pasos a realizar en esta etapa son los siguientes:
1. Redondear largos de TRF: se redondea a un número entero los largos entregados por la
electroforesis capilar.
2. Se eliminan los largos extremos: se considera el rango de largos entre 35 y 490 pb, por la
capacidad de resolución que posee el estándar de tamaño molecular que se usa en la corrida
electroforética (GeneScan-500 Size Standard).
3. Revisión de largos: si al redondear se obtienen dos picos con largos iguales, se transforman en
1, con intensidad igual a la suma de las intensidades de ambos picos.
4. Cálculo porcentaje de presencia de cada pico (altura relativa): se realiza el cálculo para cada
uno de los picos que se encuentran en la muestra, mediante la siguiente ecuación:
Ecuación A 2
Altura relativa picoi =
Altura picoi
n
∑ Altura pico
⋅ 100 %
i
5. Estimación de la diversidad bacteriana: se comparan los largos obtenidos experimentalmente
con los obtenidos a partir de un T-RFLP virtual (usando la misma combinación primer-enzima
que en el T-RFLP real), y se asigna la bacteria correspondiente al largo encontrado.
119
APÉNDICE D. Fotografías del montaje experimental
Figura B 1. Montaje experimental
120
Figura B 2. Montaje experimental
Figura B 3. Montaje experimental
121
APÉNDICE E. Programa desarrollado para la integración de las ecuaciones
del modelo y el ajuste de parámetros
Archivo modelo2.m:
function [dx]=modelo2(t,x)
umax=0.0051; %(1/h)
ks1=0.0087; % M
kA= 0.1; % (1/h)
kd= 0.000065; % (1/h)
kS= 0.65; % (m/h)
yxs4=4.74e12; %bacterias/mol
% ctes cineticas de equilibrios de ionizacion
k32=72e6;%(1/(h*M)) constante cinetica inversa CO2 (ac)
k31=30.6;%(1/h) constante cinetica directa CO2 (ac)
k11=29.88e6; %(1/h) constante cinetica directa H2S
k12=2.7e14; %(1/(h*M)) constante cinetica inversa H2S
%coeficiente combinado (1/h)
klaco2 = 12.06;
klah2 = 33.48;
klah2s = 9.84;
% cte Henry
Hco2 = 0.7435; %cte Henry CO2 (conc. sat, molar fase ac/ conc. molar fase gas)
Hh2 = 0.019; %cte Henry H2 (conc. sat, molar fase ac/ conc. molar fase gas)
Hh2s = 0.4404; %cte Henry H2S (conc. sat, molar fase gas/ conc. molar fase ac)
%Gases en el sistema (M)
h2g = 0.0414;
co2g = 0.0013;
h2sg = 0;
%Otras constantes
rho= 64.7; % densidad molar azufre (mol/L)
N= 1.28e9; % numero inicial de particulas de azufre
Xsat= 6.5e10; % (bacterias/m2)
t0=0;
tf=200.7;
ux=umax*x(7)/(ks1+x(7));
sigma= 4*pi*(x(3)^2)*N/1.075;
Ra=kA*(x(1)+(Xsat-x(5))*sigma);
Rd=kd*x(5)*sigma;
dx(1)= x(1)*ux+Rd; %biomasa suspendida
dx(2)= -k12*x(2)*1e-7-x(2)*kS*sigma*1000 +k11*x(6); %HSdx(3)= -3*x(2)*kS/rho; %radio particulas azufre
dx(4)= klah2*(Hh2*h2g-x(4))-3*ux*(x(1)+x(5)*sigma)/yxs4; %hidrogeno acuoso
dx(5)= ux*x(5)+(Ra-Rd)/sigma; %biomasa adherida
dx(6)= k12*x(2)*1e-7-k11*x(6)-klah2s*(x(6)-h2sg/Hh2s)+4*ux*(x(1)+x(5)*sigma)/yxs4; %H2S
dx(7)= -ux*(x(1)+x(5)*sigma)/yxs4 +x(2)*kS*sigma*1000; %tetrasulfuro
dx(8)= k31*x(9)-k32*x(8)*1e-7;%HCO3-
122
dx(9)= klaco2*(Hco2*co2g-x(9))+k32*x(8)*1e-7-k31*x(9)-ux*(x(1)+x(5)*sigma)/(10.78*yxs4); %CO2
dx=[dx(1) dx(2) dx(3) dx(4) dx(5) dx(6) dx(7) dx(8) dx(9)]';
Archivo Programa2.m:
clc
clear
x0=[4.0e9 5.88e-5 15.35e-6 5.51e-4 0 5.88e-5 5e-7 2.98e-2 6.70e-3];
load 'Datos_exp.txt';
z=Datos_exp(:,:);
nptos=size(z,1);
md3=max(Datos_exp(:,3));
md2=max(Datos_exp(:,2));
md4=max(Datos_exp(:,4));
tpo=z(:,1); bio=z(:,2); sul=z(:,3); azu=z(:,4);
%calculo de los valores teoricos (integrados) para cada tiempo experimental
y=x0; %valores iniciales x=(xo,so)
teo(1,:)=y;
for i=2:nptos
delta=(tpo(i)-tpo(i-1))/2;
for p=1:2
iniciar=tpo(i-1)+(p-1)*delta;
finalizar=tpo(i-1)+p*delta;
[t,x]=ode23tb('modelo2',[iniciar finalizar],y);
tam=size(x);
ifin=tam(1);
y=x(ifin,:);
end
tr(i,1)=tpo(i); tr(i,2)=x(ifin,4); tr(i,3)=x(ifin,5);tr(i,4)=x(ifin,6);tr(i,5)=x(ifin,7);tr(i,6)=x(ifin,8);tr(i,7)=x(ifin,9);
tr(1,2)=x0(4);tr(1,3)=x0(5);tr(1,4)=x0(6);tr(1,5)=x0(7);tr(1,6)=x0(8);tr(1,7)=x0(9);
if bio(i)~=-1
teo(i,1)=x(ifin,1);
end
if sul(i)~=-1
teo(i,2)=x(ifin,2);
end
if azu(i)~=-1
teo(i,3)=x(ifin,3);
end
y=x(ifin,:);
end
% "teo" es una matriz teo(x,s) que guarda el valor teorico de x y s para
% cada tiempo experimental
%Determinacion de los residuos
ib=1; is=1; ia=1;
bteo=teo(:,1);steo=teo(:,2);ateo=teo(:,3);
conta=1;
for i=1:nptos,
if bio(i)==-1
sdq(i)=((sul(i)-steo(i))/md3).^2;
sd(is)=sul(i);st(is)=steo(i);ts(is)=tpo(i);is=is+1;
123
else
if sul(i)==-1
sdq(i)=((bio(i)-bteo(i))/md2).^2;
bd(ib)=bio(i);bt(ib)=bteo(i);tb(ib)=tpo(i);ib=ib+1;
else
sdq(i)=((azu(i)-ateo(i))/md4).^2;
ad(ia)=azu(i);at(ia)=ateo(i);ta(ia)=tpo(i);ia=ia+1;
sdq(nptos+conta)=((sul(i)-steo(i))/md3).^2;conta=conta+1;
sd(is)=sul(i);st(is)=steo(i);ts(is)=tpo(i);is=is+1;
sdq(nptos+conta)=((bio(i)-bteo(i))/md2).^2;conta=conta+1;
bd(ib)=bio(i);bt(ib)=bteo(i);tb(ib)=tpo(i);ib=ib+1;
end
end
end
minimo=0;
final=nptos+conta-1;
for i=1:final,
minimo=minimo+sdq(i);
end
minimo
it=1;
for i=1:nptos,
if sul(i)~=-1
sdd(it)=sul(i);stt(it)=steo(i);tss(it)=tpo(i);it=it+1;
end
end
%grafica de resultados
clf;
subplot(3,3,1);
plot (tb, bt,'r*-', tb, bd, 'bo');
xlabel('Tiempo(hr)');ylabel('biomasa (cel/L)');
subplot(3,3,2);
plot (tss, stt, 'r*-', tss, sdd,'bo');
xlabel('Tiempo(hr)');ylabel('HS- (mol/L)');
subplot(3,3,3);
plot (tpo, ateo, 'r*-', tpo, azu,'bo');
xlabel('Tiempo(hr)');ylabel('tamaño azufre (m)');
subplot(3,3,4);
plot (tr(1:nptos,1), tr(1:nptos,2),'r*-');
xlabel('Tiempo(hr)');ylabel('Conc de H2 (mol/L)');
subplot(3,3,5);
plot (tr(1:nptos,1), tr(1:nptos,3),'r*-');
xlabel('Tiempo(hr)');ylabel('biomasa adherida (cel/m2)');
subplot(3,3,6);
plot (tr(1:nptos,1), tr(1:nptos,4),'r*-');
xlabel('Tiempo(hr)');ylabel('Conc H2S (mol/L)');
subplot(3,3,7);
plot (tr(1:nptos,1), tr(1:nptos,5),'r*-');
xlabel('Tiempo(hr)');ylabel('Conc de S4-2 (mol/L)');
subplot(3,3,8);
plot (tr(1:nptos,1), tr(1:nptos,6),'r*-');
xlabel('Tiempo(hr)');ylabel('Conc de HCO3- (mol/L)');
subplot(3,3,9);
plot (tr(1:nptos,1), tr(1:nptos,7),'r*-');
124
xlabel('Tiempo(hr)');ylabel('Conc de CO2 (mol/L)');
Archivo Datos_exp.txt:
Tiempo (horas)
bacterias (cel/L)
HS- (M)
radio partículas (m)
0
4.00E+09
5.88E-05
1.54E-05
0.35
-1
-1
1.53E-05
1.1
-1
-1
1.53E-05
1.35
-1
-1
1.53E-05
2.1
-1
-1
1.53E-05
2.35
-1
6.07E-05
1.53E-05
2.8
-1
-1
1.53E-05
3.1
-1
-1
1.53E-05
3.35
-1
6.58E-05
1.53E-05
4.1
-1
-1
1.53E-05
4.35
-1
8.67E-05
1.53E-05
7.68
-1
-1
1.53E-05
7.93
-1
6.37E-05
1.53E-05
1.53E-05
8.1
-1
-1
10.18
-1
-1
1.53E-05
10.43
-1
8.05E-05
1.53E-05
1.53E-05
10.6
-1
-1
13.18
-1
-1
1.53E-05
13.43
-1
8.16E-05
1.53E-05
23.37
-1
-1
1.53E-05
23.62
4.40E+09
9.14E-05
1.53E-05
24.43
-1
-1
1.52E-05
24.48
-1
-1
1.52E-05
24.73
-1
9.92E-05
1.52E-05
1.52E-05
25.7
-1
-1
25.95
-1
9.41E-05
1.52E-05
26.7
-1
-1
1.52E-05
26.95
-1
8.95E-05
1.52E-05
27.27
-1
-1
1.52E-05
27.7
-1
-1
1.52E-05
27.95
-1
1.09E-04
1.52E-05
29.73
-1
-1
1.52E-05
29.98
-1
9.77E-05
1.52E-05
1.52E-05
30.1
-1
-1
31.73
-1
-1
1.52E-05
31.98
-1
1.17E-04
1.52E-05
32.27
-1
-1
1.52E-05
35.43
-1
-1
1.52E-05
35.47
-1
-1
1.52E-05
35.72
-1
1.04E-04
1.52E-05
37.38
-1
-1
1.52E-05
37.63
-1
8.28E-05
1.52E-05
37.78
-1
-1
1.51E-05
47.18
-1
-1
1.51E-05
47.27
-1
-1
1.51E-05
47.52
4.60E+09
6.76E-05
1.51E-05
48.32
-1
-1
1.51E-05
48.57
-1
7.73E-05
1.51E-05
125
49.85
-1
-1
51.02
-1
-1
1.50E-05
1.50E-05
51.27
-1
1.07E-04
1.50E-05
52.5
-1
-1
1.50E-05
53.5
-1
-1
1.50E-05
53.75
-1
1.18E-04
1.50E-05
55.37
-1
-1
1.50E-05
59.05
-1
-1
1.50E-05
59.75
-1
-1
1.50E-05
60
5.70E+09
7.42E-05
1.50E-05
61.18
-1
-1
1.49E-05
69.3
-1
-1
1.49E-05
69.55
5.15E+09
-1
1.49E-05
70.77
-1
-1
1.48E-05
71.52
-1
-1
1.48E-05
72.85
-1
-1
1.48E-05
72.9
-1
-1
1.48E-05
73.87
-1
-1
1.48E-05
74.12
-1
7.72E-05
1.48E-05
75.6
-1
-1
1.48E-05
77.68
-1
-1
1.48E-05
77.77
-1
-1
1.48E-05
78.02
-1
-1
1.48E-05
80.32
-1
-1
1.48E-05
82.73
-1
-1
1.47E-05
84.12
-1
-1
1.47E-05
84.37
-1
6.77E-05
1.47E-05
84.97
-1
-1
1.47E-05
95.35
-1
-1
1.46E-05
95.88
-1
-1
1.46E-05
96.13
-1
-1
1.46E-05
97.1
-1
-1
1.46E-05
97.77
-1
-1
1.46E-05
98.65
-1
-1
1.46E-05
98.9
5.14E+09
7.67E-05
1.46E-05
99.6
-1
-1
1.46E-05
102.1
-1
-1
1.45E-05
104.1
-1
-1
1.45E-05
107.08
-1
-1
1.45E-05
107.33
-1
-1
1.45E-05
126.85
-1
-1
1.45E-05
127.3
-1
-1
1.44E-05
128.83
-1
-1
1.44E-05
129.08
-1
-1
1.44E-05
129.6
-1
-1
1.44E-05
131.6
-1
-1
1.44E-05
131.85
4.70E+09
5.78E-05
1.44E-05
132.77
-1
-1
1.43E-05
147.07
-1
-1
1.42E-05
147.18
-1
-1
1.42E-05
147.43
7.70E+09
5.94E-05
1.42E-05
150.45
-1
-1
1.42E-05
150.7
-1
-1
1.42E-05
126
150.88
-1
-1
1.42E-05
153.17
-1
-1
1.42E-05
168.1
-1
-1
1.40E-05
168.27
-1
-1
1.40E-05
168.52
-1
6.13E-05
1.40E-05
169.53
-1
-1
1.40E-05
171.5
-1
-1
1.40E-05
171.75
-1
-1
1.40E-05
174.33
-1
-1
1.40E-05
174.58
-1
-1
1.40E-05
178
-1
-1
1.40E-05
178.02
-1
-1
1.39E-05
178.05
-1
-1
1.39E-05
178.3
-1
-1
1.39E-05
179.2
-1
-1
1.39E-05
179.45
-1
-1
1.39E-05
180.2
-1
-1
1.39E-05
180.45
1.10E+10
6.25E-05
1.39E-05
181.27
-1
-1
1.39E-05
200.4
-1
-1
1.39E-05
200.65
1.20E+10
-1
1.39E-05
127
APÉNDICE F. Publicaciones generadas durante esta investigación.
Artículos en Revistas
Escobar C, Bravo L, Hernández J, Herrera L. 2007. Hydrogen sulfide production from elemental
sulfur by Desulfovibrio desulfuricans in an anaerobic bioreactor. Biotechnology and
Bioengineering. 98(3): 569 – 577.
Presentaciones en Congresos
Escobar C, Bravo L, Hernández J, Herrera L. Modelo hidrodinámico para la predicción de la
velocidad del líquido y del hold-up gaseoso en un reactor airlift de cilindros concéntricos. XVI
Congreso Chileno de Ingeniería Química. 2005.
Escobar C, Bravo L, Hernández J, Herrera L. Diseño y caracterización hidrodinámica de un
reactor airlift. XXI Congreso Interamericano de Ingeniería Química y VIII Congreso Peruano de
Ingeniería Química. 2005.
128

![A↔ B (-rA) = 0.04CA-0.01CR, [=] mol*L](http://s2.studylib.es/store/data/005357341_1-6e8dd554fb791e1c2c9f555a9c29f5b3-300x300.png)